JP2023520249A - 非経口タンパク質溶液中の可視粒子形成の防止方法 - Google Patents
非経口タンパク質溶液中の可視粒子形成の防止方法 Download PDFInfo
- Publication number
- JP2023520249A JP2023520249A JP2022569025A JP2022569025A JP2023520249A JP 2023520249 A JP2023520249 A JP 2023520249A JP 2022569025 A JP2022569025 A JP 2022569025A JP 2022569025 A JP2022569025 A JP 2022569025A JP 2023520249 A JP2023520249 A JP 2023520249A
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- antibodies
- human
- protein
- parenteral
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
- C07K16/248—IL-6
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Dermatology (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
界面活性剤は、タンパク質凝集をもたらす可能性がある界面応力から不安定なタンパク質を保護するので、タンパク質製剤における重要な添加物である。モノクローナル抗体(mAb)などのタンパク質は非経口で投与され、そのような製剤における使用が認められている界面活性剤の選択肢は限られている。非経口の抗体調製物における使用が認められている界面活性剤には、ポリソルベート(PS20、PS80)およびポロキサマー188が含まれる(Kishore RS. Part II: Challenges with Excipients - Polysorbate Degradation and Quality, in Challenges in Protein Product Development. AAPS Advances in the Pharmaceutical Sciences Series 38. Warne N and Mahler HC eds. Springer 2018, Switzerland. pp. 25-62(非特許文献1)を参照)。しかし、ポリソルベート(PS20およびPS80)は、酸化分解または酵素・加水分解によって製品の保存期間中に劣化することがある。特に後者では分解産物として遊離脂肪酸(FFA)が生じ、これは、溶液中に沈殿し、その後肉眼不可視もしくは可視の粒子を形成することがある(Tarik A Khan et. al., Protein-Polydimethylsiloxane Particles in Liquid Vial Monoclonal Antibody Formulations Containing Poloxamer 188; J. Pharmaceutical Sciences, published online March 16, 2020(非特許文献2))。
界面活性剤の分解、とりわけポリソルベート(PS20および/またはPS80)の分解により、遊離脂肪酸(FFA)からなる可視粒子が形成されることは、バイオ医薬品業界において大きな課題であり、このため治療用抗体の非経口調製物といった非経口タンパク質製剤において、界面活性剤の選択肢が限定されている。ポリソルベートの分解による可視粒子の形成ひいてはFFAの放出を、様々な手段によって低減あるいは排除することは、非経口医薬品の品質を公証の保存期間維持するための鍵である。
PS80, Montanox 80 PPI(SEPPIC)
PS80, HX2(NOF)
(a)アミノ酸残基26~32(L1)、50~52(L2)、91~96(L3)、26~32(H1)、53~55(H2)、および96~101(H3)に生じる超可変ループ((Chothia and Lesk, J. Mol. Biol. 196:901-917(1987));
(b)アミノ酸残基24~34(L1)、50~56(L2)、89~97(L3)、31~35b(H1)、50~65(H2)、および95~102(H3)に生じるCDR(Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD(1991));ならびに
(c)アミノ酸残基27c~36(L1)、46~55(L2)、89~96(L3)、30~35b(H1)、47~58(H2)、および93~101(H3)に生じる抗原接触(antigen contact)(MacCallum et al. J. Mol. Biol. 262: 732-745(1996))である。
ある特定の態様では、本明細書で提供される抗体はキメラ抗体である。特定のキメラ抗体は、例えば、米国特許第4816567号、およびMorrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855(1984)に記載されている。一例として、キメラ抗体は、非ヒト可変領域(例えば、マウス、ラット、ハムスター、ウサギまたは非ヒト霊長類(サルなど)由来の可変領域)とヒト定常領域とを含む。さらなる例として、キメラ抗体は、クラスまたはサブクラスが親抗体のものから変更されている「クラススイッチ」抗体である。キメラ抗体には、その抗原結合断片も含まれる。
ある特定の態様では、本明細書で提供される抗体はヒト抗体である。ヒト抗体は、当技術分野において既知の様々な技術を用いて生成することができる。ヒト抗体は、van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74(2001) およびLonberg, Curr. Opin. Immunol. 20:450-459(2008)に一般的に記載されている。
ある特定の態様では、本書で提供される抗体は、当技術分野で公知であり容易に入手可能なさらなる非タンパク質性部分を含むように、さらに改変され得る。抗体の誘導体化に適した部分には水溶性ポリマーが含まれるが、これに限定されない。水溶性ポリマーの非限定的な例には、ポリエチレングリコール(PEG)、エチレングリコール/プロピレングリコールのコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニルアルコール、ポリビニルピロリドン、ポリ-1,3-ジオキソラン、ポリ-1,3,6-トリオキサン、エチレン/無水マレイン酸コポリマー、ポリアミノ酸(ホモポリマーまたはランダムコポリマーのいずれか)、およびデキストランまたはポリ(n-ビニルピロリドン)ポリエチレングリコール、プロピレングリコールホモポリマー、プロピレンeオキシド/エチレンオキシドコポリマー、ポリオキシエチル化ポリオール(例えばグリセロール)、ポリビニルアルコール、ならびにこれらの混合物が含まれる(ただし、これらに限定されない)。ポリエチレングリコールプロピオンアルデヒドは水中での安定性のために製造上の利点を有し得る。該ポリマーは、任意の分子量であってよく、分枝状でも非分枝状でもよい。抗体に結合するポリマーの数は変化してもよく、複数のポリマーが結合する場合、それらは同じ分子でも異なる分子でもよい。一般的に、誘導体化に使用されるポリマーの数および/または種類は、改善されるべき抗体の特定の特性または機能、その抗体誘導体が限定条件の下での治療に使用されるかどうかなどを含むがこれらに限定されない考慮事項に基づいて、決定することができる。
本発明はまた、細胞傷害性剤、化学療法剤、薬物、成長阻害剤、毒素(例えば、タンパク質毒素、細菌、真菌、植物、もしくは動物起源の酵素活性毒素、またはそれらの断片)、または放射性同位体などの一または複数の治療剤にコンジュゲート(化学的に結合)された本書の抗体を含む、イムノコンジュゲートを提供する。
ある特定の態様では、本明細書で提供される抗体は、多重特異性抗体、例えば、二重特異性抗体である。「多重特異性抗体」は、少なくとも2つの異なる部位、すなわち、異なる抗原上の異なるエピトープまたは同じ抗原上の異なるエピトープに対して結合特異性を有するモノクローナル抗体である。ある特定の態様では、多重特異性抗体は3つ以上の結合特異性を有する。多重特異性抗体は、完全長抗体または抗体断片として調製することができる。
抗体は、例えば米国特許第4816567号に記載されているような組換え方法および組成物を用いて製造することができる。これらの方法のために、抗体をコードする一または複数の単離された核酸が提供される。
試験用抗体製剤
抗体トシリズマブは中外製薬株式会社より提供された。以下の水性抗体製剤が(pH6.0にて)調製された。
トシリズマブ180mg/mL、
L-ヒスチジン/ L-ヒスチジン塩酸塩一水和物20mmol/L、
L-アルギニン/ L-アルギニン塩酸塩100mmol/L、
L-メチオニン30mmol/L、
PS80(NOFまたはSEPPIC社製のいずれか)0.2mg/mL。
試験用抗体製剤を、プランジャストッパー付きの1mL刺し込み針式ガラスシリンジに充填した。そのようなガラスシリンジは、例えばNuova Ompi社製(シリンジ:長さ1.0mL、ホウケイ酸ガラス製シリンジ、タイプ1、刺し込み針:27G×1/2インチカニューレ);)、大協精工社製プランジャストッパー付き(RSH 6.75F RSV D 777-7 RB2-40;)により提供される。
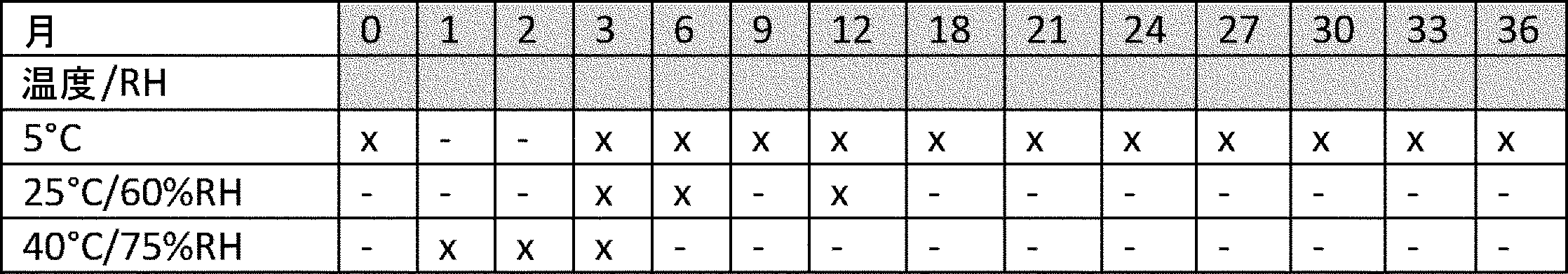
各試験用抗体製剤の安定性試験、保存条件、検査時点を表1に示す。試料は、光から保護され水平に保存された。
外観検査:
可視粒子の検査は、欧州薬局方6.0(章2.9.20. 「Particulate contamination:visible particles」)に従って実施した。
可視粒子の同定は、フーリエ変換赤外分光法(FT-IR)を用いて、粒子の単離後に実施した。
1.プランジャロッドをゆっくりと引き、シリンジのプランジャストッパーを外した。
2.可視粒子を含む溶液をシリンジから採り、清浄なペトリ皿に載せた。
3.キーエンス社製電子顕微鏡VHX-2000で粒子の写真を撮影した。
4.可視粒子をニッケルフィルタに載せた。
5.フィルタ上の粒子を冷水で洗浄した。
6.電子顕微鏡(3.と同じモデル)を用いて粒子の写真を撮影した。
25℃、40℃でそれぞれ12ヵ月、3ヵ月保存した後も、SEPPIC試料とNOF試料には可視粒子が実質的に存在しなかった。5℃での保存の場合、SEPPIC試料では24ヵ月で可視粒子が多く観察され、保存期間が24ヵ月を越えて長くなると、試料中の可視粒子数は顕著に増加した。FT-IRを用いた粒子の同定を24ヵ月、30ヵ月、36ヵ月で行い、粒子の性質が遊離脂肪酸として同定された。一方、NOF試料は、開始時から36ヵ月まで実質的に可視粒子を含まないままであった。観察された可視粒子の概要を表2に示す。
[本発明1001]
タンパク質を、薬学的に許容される添加物、例えば、バッファー、抗酸化剤を含む安定剤、およびPS80(98)などとともに含む、安定な水性組成物。
[本発明1002]
PS80(98)が、0.01~1%(w/v)、または0.01~0.06%(w/v)、または0.02~0.05%(w/v)、または約0.02%(w/v)の濃度で存在する、本発明1001の組成物。
[本発明1003]
前記タンパク質が抗体である、本発明1001または1002の組成物。
[本発明1004]
前記抗体が、INNトシリズマブを有する抗体である、本発明1003の組成物。
[本発明1005]
医薬の製造のための、PS80(98)の使用。
[本発明1006]
前記医薬が非経口タンパク質調製物を含む、本発明1005の使用。
[本発明1007]
前記タンパク質が抗体である、本発明1006の使用。
[本発明1008]
前記抗体が、INNトシリズマブを有する抗体である、本発明1007の使用。
[本発明1009]
前記医薬が、30ヵ月まで、または36ヵ月まで安定なままであることをさらに特徴とする、本発明1005~1008のいずれかの使用。
[本発明1010]
非経口タンパク質調製物中に可視粒子が形成されることを防ぐための、PS80(98)の使用。
[本発明1011]
実質的に本明細書に記載される、新規の組成物、方法、および使用。
Claims (11)
- タンパク質を、薬学的に許容される添加物、例えば、バッファー、抗酸化剤を含む安定剤、およびPS80(98)などとともに含む、安定な水性組成物。
- PS80(98)が、0.01~1%(w/v)、または0.01~0.06%(w/v)、または0.02~0.05%(w/v)、または約0.02%(w/v)の濃度で存在する、請求項1に記載の組成物。
- 前記タンパク質が抗体である、請求項1または2に記載の組成物。
- 前記抗体が、INNトシリズマブを有する抗体である、請求項3に記載の組成物。
- 医薬の製造のための、PS80(98)の使用。
- 前記医薬が非経口タンパク質調製物を含む、請求項5に記載の使用。
- 前記タンパク質が抗体である、請求項6に記載の使用。
- 前記抗体が、INNトシリズマブを有する抗体である、請求項7に記載の使用。
- 前記医薬が、30ヵ月まで、または36ヵ月まで安定なままであることをさらに特徴とする、請求項5~8のいずれか一項に記載の使用。
- 非経口タンパク質調製物中に可視粒子が形成されることを防ぐための、PS80(98)の使用。
- 実質的に本明細書に記載される、新規の組成物、方法、および使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP20174854.8 | 2020-05-15 | ||
| EP20174854 | 2020-05-15 | ||
| PCT/EP2021/062579 WO2021228917A1 (en) | 2020-05-15 | 2021-05-12 | Prevention of visible particle formation in parenteral protein solutions |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2023520249A true JP2023520249A (ja) | 2023-05-16 |
Family
ID=70861202
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022569025A Pending JP2023520249A (ja) | 2020-05-15 | 2021-05-12 | 非経口タンパク質溶液中の可視粒子形成の防止方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20230167172A1 (ja) |
| EP (1) | EP4149421A1 (ja) |
| JP (1) | JP2023520249A (ja) |
| CN (1) | CN115605184A (ja) |
| WO (1) | WO2021228917A1 (ja) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019023564A1 (en) * | 2017-07-27 | 2019-01-31 | Alexion Pharmaceutical, Inc. | ANTI-C5 ANTIBODY FORMULATIONS WITH HIGH CONCENTRATION |
| US20190300615A1 (en) * | 2018-04-02 | 2019-10-03 | Mycenax Biotech Inc. | Antibody-containing aqueous formulation and use thereof |
| WO2020088346A1 (en) * | 2018-10-31 | 2020-05-07 | Mycenax Biotech Inc. | Aqueous pharmaceutical formulations |
| WO2020264300A1 (en) * | 2019-06-28 | 2020-12-30 | Genentech, Inc. | Composition and methods for stabilizing liquid protein formulations |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5959177A (en) | 1989-10-27 | 1999-09-28 | The Scripps Research Institute | Transgenic plants expressing assembled secretory antibodies |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| AU668349B2 (en) | 1991-04-25 | 1996-05-02 | Chugai Seiyaku Kabushiki Kaisha | Reconstituted human antibody against human interleukin 6 receptor |
| DE69233254T2 (de) | 1991-06-14 | 2004-09-16 | Genentech, Inc., South San Francisco | Humanisierter Heregulin Antikörper |
| JP3951062B2 (ja) | 1991-09-19 | 2007-08-01 | ジェネンテック・インコーポレーテッド | 少なくとも遊離のチオールとして存在するシステインを有する抗体フラグメントの大腸菌での発現、2官能性F(ab’)2抗体の産生のための使用 |
| EP0752248B1 (en) | 1992-11-13 | 2000-09-27 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| US5789199A (en) | 1994-11-03 | 1998-08-04 | Genentech, Inc. | Process for bacterial production of polypeptides |
| US5840523A (en) | 1995-03-01 | 1998-11-24 | Genetech, Inc. | Methods and compositions for secretion of heterologous polypeptides |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| ATE299938T1 (de) | 1997-05-02 | 2005-08-15 | Genentech Inc | Ein verfahren zur herstellung multispezifischer antikörper die heteromultimere und gemeinsame komponenten besitzen |
| US6040498A (en) | 1998-08-11 | 2000-03-21 | North Caroline State University | Genetically engineered duckweed |
| US6610833B1 (en) | 1997-11-24 | 2003-08-26 | The Institute For Human Genetics And Biochemistry | Monoclonal human natural antibodies |
| ATE531812T1 (de) | 1997-12-05 | 2011-11-15 | Scripps Research Inst | Humanisierung von nager-antikörpern |
| US7125978B1 (en) | 1999-10-04 | 2006-10-24 | Medicago Inc. | Promoter for regulating expression of foreign genes |
| DE60022369T2 (de) | 1999-10-04 | 2006-05-18 | Medicago Inc., Sainte Foy | Verfahren zur regulation der transkription von fremden genen in gegenwart von stickstoff |
| PL357939A1 (en) | 2000-04-11 | 2004-08-09 | Genentech, Inc. | Multivalent antibodies and uses therefor |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| IL155977A0 (en) | 2000-11-30 | 2003-12-23 | Medarex Inc | Transgenic transchromosomal rodents for making human antibodies |
| MXPA06011199A (es) | 2004-03-31 | 2007-04-16 | Genentech Inc | Anticuerpos anti-tgf-beta humanizados. |
| US20080044455A1 (en) | 2006-08-21 | 2008-02-21 | Chaim Welczer | Tonsillitus Treatment |
| WO2008027236A2 (en) | 2006-08-30 | 2008-03-06 | Genentech, Inc. | Multispecific antibodies |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| US8242247B2 (en) | 2007-12-21 | 2012-08-14 | Hoffmann-La Roche Inc. | Bivalent, bispecific antibodies |
| US9266967B2 (en) | 2007-12-21 | 2016-02-23 | Hoffmann-La Roche, Inc. | Bivalent, bispecific antibodies |
| AU2009204501B2 (en) | 2008-01-07 | 2015-02-12 | Amgen Inc. | Method for making antibody Fc-heterodimeric molecules using electrostatic steering effects |
| PE20120591A1 (es) | 2009-04-02 | 2012-05-23 | Roche Glycart Ag | Anticuerpos multiespecificos que comprenden anticuerpos de longitud completa y fragmentos fab de cadena sencilla |
| EP2417156B1 (en) | 2009-04-07 | 2015-02-11 | Roche Glycart AG | Trivalent, bispecific antibodies |
| CA2761233A1 (en) | 2009-05-27 | 2010-12-02 | F. Hoffmann-La Roche Ag | Tri- or tetraspecific antibodies |
| US9676845B2 (en) | 2009-06-16 | 2017-06-13 | Hoffmann-La Roche, Inc. | Bispecific antigen binding proteins |
| AU2010296018B2 (en) | 2009-09-16 | 2016-05-05 | Genentech, Inc. | Coiled coil and/or tether containing protein complexes and uses thereof |
| KR101721301B1 (ko) | 2011-08-23 | 2017-03-29 | 로슈 글리카트 아게 | 이중특이적 항원 결합 분자 |
| CN114702594B (zh) | 2013-12-20 | 2025-05-09 | 豪夫迈·罗氏有限公司 | 双重特异性抗体 |
| UA117289C2 (uk) | 2014-04-02 | 2018-07-10 | Ф. Хоффманн-Ля Рош Аг | Мультиспецифічне антитіло |
| JP6744292B2 (ja) | 2014-07-29 | 2020-08-19 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性抗体 |
| CN116063543A (zh) | 2015-04-24 | 2023-05-05 | 豪夫迈·罗氏有限公司 | 多特异性抗原结合蛋白 |
| KR102546471B1 (ko) * | 2016-09-27 | 2023-06-21 | 프레제니우스 카비 도이치란트 게엠베하 | 액상의 약학 조성물 |
| WO2019060062A1 (en) * | 2017-09-19 | 2019-03-28 | Regeneron Pharmaceuticals Inc. | METHODS OF REDUCING PARTICLE FORMATION AND COMPOSITIONS FORMED THEREFROM |
-
2021
- 2021-05-12 JP JP2022569025A patent/JP2023520249A/ja active Pending
- 2021-05-12 WO PCT/EP2021/062579 patent/WO2021228917A1/en not_active Ceased
- 2021-05-12 EP EP21725503.3A patent/EP4149421A1/en not_active Withdrawn
- 2021-05-12 CN CN202180035080.2A patent/CN115605184A/zh active Pending
-
2022
- 2022-11-10 US US18/054,244 patent/US20230167172A1/en not_active Abandoned
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019023564A1 (en) * | 2017-07-27 | 2019-01-31 | Alexion Pharmaceutical, Inc. | ANTI-C5 ANTIBODY FORMULATIONS WITH HIGH CONCENTRATION |
| US20190300615A1 (en) * | 2018-04-02 | 2019-10-03 | Mycenax Biotech Inc. | Antibody-containing aqueous formulation and use thereof |
| WO2020088346A1 (en) * | 2018-10-31 | 2020-05-07 | Mycenax Biotech Inc. | Aqueous pharmaceutical formulations |
| WO2020264300A1 (en) * | 2019-06-28 | 2020-12-30 | Genentech, Inc. | Composition and methods for stabilizing liquid protein formulations |
Non-Patent Citations (2)
| Title |
|---|
| ALEXANDRA C. BRAUN ET AL.: ""Predicting critical micelle concentration and micelle molecularweight of polysorbate 80 using comp", EUROPEANJOURNAL OF PHARMACEUTICS AND BIOPHARMACEUTICS, vol. 94, JPN6023020646, August 2015 (2015-08-01), pages 559 - 568, ISSN: 0005240893 * |
| DDS DRUG DELIVERY SYSTEMS ポリソルベート80 のウェブアーカイブ, JPN6023020647, 14 February 2020 (2020-02-14), ISSN: 0005240892 * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20230167172A1 (en) | 2023-06-01 |
| CN115605184A (zh) | 2023-01-13 |
| EP4149421A1 (en) | 2023-03-22 |
| WO2021228917A1 (en) | 2021-11-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230279109A1 (en) | Anti-tim3 antibodies and methods of use | |
| US20220275076A1 (en) | Anti-myostatin antibodies and methods of use | |
| KR102030891B1 (ko) | 항-재기드1 항체 및 사용 방법 | |
| RU2742606C2 (ru) | Антитела к с5 и способы их применения | |
| US20160207995A1 (en) | Anti-il-4 antibodies and bispecific antibodies and uses thereof | |
| CN103261230A (zh) | 抗pcsk9抗体及使用方法 | |
| US20250241852A1 (en) | Prevention of visible particle formation in aqueous protein solutions | |
| US12297270B2 (en) | Bispecific antigen-binding molecules and methods of use | |
| KR20140116490A (ko) | 항-lrp5 항체 및 사용 방법 | |
| KR20150063565A (ko) | Her3의 베타-헤어핀 및 her4의 베타-헤어핀에 결합하는 항-her3/her4 항원 결합 단백질 | |
| KR20150064205A (ko) | Her3의 베타-헤어핀에 결합하는 her3 항원 결합 단백질 | |
| JP2023520249A (ja) | 非経口タンパク質溶液中の可視粒子形成の防止方法 | |
| JP2023532764A (ja) | 治療用タンパク質製剤の安定剤としての代替界面活性剤 | |
| HK40079577A (en) | Prevention of visible particle formation in parenteral protein solutions | |
| US20230233684A1 (en) | Use of chelators for the prevention of visible particle formation in parenteral protein solutions | |
| WO2022255440A1 (en) | Anti-ddr2 antibodies and uses thereof | |
| HK40076320A (en) | Prevention of visible particle formation in aqueous protein solutions | |
| TW202517673A (zh) | 與C3bBb結合之抗體 | |
| HK40066457A (zh) | 两种以上抗-c5抗体的组合与使用方法 | |
| HK1186480A (en) | Anti-pcsk9 antibodies and methods of use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230320 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230320 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20230320 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230524 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230821 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20240118 |