JP2020117536A - 新規な葉酸代謝拮抗薬の組み合わせ療法 - Google Patents
新規な葉酸代謝拮抗薬の組み合わせ療法 Download PDFInfo
- Publication number
- JP2020117536A JP2020117536A JP2020072098A JP2020072098A JP2020117536A JP 2020117536 A JP2020117536 A JP 2020117536A JP 2020072098 A JP2020072098 A JP 2020072098A JP 2020072098 A JP2020072098 A JP 2020072098A JP 2020117536 A JP2020117536 A JP 2020117536A
- Authority
- JP
- Japan
- Prior art keywords
- drug
- antifolate
- methylmalonic acid
- mammal
- combination
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000004052 folic acid antagonist Substances 0.000 title claims abstract description 107
- 230000003432 anti-folate effect Effects 0.000 title claims abstract description 76
- 229940127074 antifolate Drugs 0.000 title claims abstract description 76
- 238000002648 combination therapy Methods 0.000 title abstract description 6
- ZIYVHBGGAOATLY-UHFFFAOYSA-N methylmalonic acid Chemical compound OC(=O)C(C)C(O)=O ZIYVHBGGAOATLY-UHFFFAOYSA-N 0.000 claims abstract description 88
- 238000000034 method Methods 0.000 claims abstract description 57
- 241000124008 Mammalia Species 0.000 claims abstract description 47
- 239000003795 chemical substances by application Substances 0.000 claims abstract description 14
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 claims description 152
- 239000003814 drug Substances 0.000 claims description 137
- 229940079593 drug Drugs 0.000 claims description 134
- 239000011724 folic acid Substances 0.000 claims description 93
- 235000019152 folic acid Nutrition 0.000 claims description 93
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 claims description 58
- 229960000304 folic acid Drugs 0.000 claims description 58
- 230000000340 anti-metabolite Effects 0.000 claims description 42
- 229940100197 antimetabolite Drugs 0.000 claims description 42
- 239000002256 antimetabolite Substances 0.000 claims description 42
- 229940014144 folate Drugs 0.000 claims description 34
- 229940110282 alimta Drugs 0.000 claims description 32
- 231100000419 toxicity Toxicity 0.000 claims description 30
- 230000001988 toxicity Effects 0.000 claims description 30
- 230000004614 tumor growth Effects 0.000 claims description 25
- VLTRZXGMWDSKGL-UHFFFAOYSA-M perchlorate Inorganic materials [O-]Cl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-M 0.000 claims description 18
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 claims description 18
- 238000004519 manufacturing process Methods 0.000 claims description 14
- 239000011230 binding agent Substances 0.000 claims description 13
- 150000002148 esters Chemical class 0.000 claims description 12
- 230000002401 inhibitory effect Effects 0.000 claims description 12
- 150000003839 salts Chemical class 0.000 claims description 11
- BYLXFSREGROOBJ-UVKKECPRSA-K cobalt(3+) [(2R,3S,4R,5S)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2R)-1-[3-[(2R,3R,4Z,7S,9Z,12S,13S,14Z,17S,18S,19R)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2,7,12,17-tetrahydro-1H-corrin-21-id-3-yl]propanoylamino]propan-2-yl] phosphate chloride Chemical compound [Cl-].[Co+3].C[C@H](CNC(=O)CC[C@]1(C)[C@@H](CC(N)=O)C2[N-]\C1=C(C)/C1=N/C(=C\C3=N\C(=C(C)/C4=N[C@]2(C)[C@@](C)(CC(N)=O)[C@@H]4CCC(N)=O)\[C@@](C)(CC(N)=O)[C@@H]3CCC(N)=O)/C(C)(C)[C@@H]1CCC(N)=O)OP([O-])(=O)O[C@@H]1[C@@H](CO)O[C@@H]([C@@H]1O)n1cnc2cc(C)c(C)cc12 BYLXFSREGROOBJ-UVKKECPRSA-K 0.000 claims description 10
- ZNOVTXRBGFNYRX-OLZOCXBDSA-N (2s)-2-[[4-[[(6r)-2-amino-5-methyl-4-oxo-1,6,7,8-tetrahydropteridin-6-yl]methylamino]benzoyl]amino]pentanedioic acid Chemical compound C([C@H]1N(C=2C(=O)NC(N)=NC=2NC1)C)NC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 ZNOVTXRBGFNYRX-OLZOCXBDSA-N 0.000 claims description 9
- 231100001225 mammalian toxicity Toxicity 0.000 claims description 7
- -1 azidocobalamin Chemical compound 0.000 claims description 6
- 238000002360 preparation method Methods 0.000 claims description 5
- ASARMUCNOOHMLO-WLORSUFZSA-L cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2s)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@H](C)OP([O-])(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O ASARMUCNOOHMLO-WLORSUFZSA-L 0.000 claims 4
- NYDXNILOWQXUOF-GXKRWWSZSA-L pemetrexed disodium Chemical group [Na+].[Na+].C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 NYDXNILOWQXUOF-GXKRWWSZSA-L 0.000 claims 3
- FDJOLVPMNUYSCM-WZHZPDAFSA-L cobalt(3+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+3].N#[C-].N([C@@H]([C@]1(C)[N-]\C([C@H]([C@@]1(CC(N)=O)C)CCC(N)=O)=C(\C)/C1=N/C([C@H]([C@@]1(CC(N)=O)C)CCC(N)=O)=C\C1=N\C([C@H](C1(C)C)CCC(N)=O)=C/1C)[C@@H]2CC(N)=O)=C\1[C@]2(C)CCC(=O)NC[C@@H](C)OP([O-])(=O)O[C@H]1[C@@H](O)[C@@H](N2C3=CC(C)=C(C)C=C3N=C2)O[C@@H]1CO FDJOLVPMNUYSCM-WZHZPDAFSA-L 0.000 description 54
- 229930003779 Vitamin B12 Natural products 0.000 description 40
- 235000019163 vitamin B12 Nutrition 0.000 description 40
- 239000011715 vitamin B12 Substances 0.000 description 40
- WBXPDJSOTKVWSJ-ZDUSSCGKSA-N pemetrexed Chemical compound C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 WBXPDJSOTKVWSJ-ZDUSSCGKSA-N 0.000 description 30
- 238000011282 treatment Methods 0.000 description 22
- 206010028980 Neoplasm Diseases 0.000 description 17
- 241001465754 Metazoa Species 0.000 description 12
- 230000000694 effects Effects 0.000 description 11
- 208000010201 Exanthema Diseases 0.000 description 10
- 201000005884 exanthem Diseases 0.000 description 10
- 206010037844 rash Diseases 0.000 description 10
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 231100000331 toxic Toxicity 0.000 description 9
- 230000002588 toxic effect Effects 0.000 description 9
- 238000010255 intramuscular injection Methods 0.000 description 8
- 239000007927 intramuscular injection Substances 0.000 description 8
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 229940088594 vitamin Drugs 0.000 description 7
- 229930003231 vitamin Natural products 0.000 description 7
- 235000013343 vitamin Nutrition 0.000 description 7
- 239000011782 vitamin Substances 0.000 description 7
- 206010006187 Breast cancer Diseases 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- 108010022394 Threonine synthase Proteins 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 230000000259 anti-tumor effect Effects 0.000 description 6
- 150000001875 compounds Chemical class 0.000 description 6
- 238000011161 development Methods 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 231100000046 skin rash Toxicity 0.000 description 6
- ZUQBAQVRAURMCL-DOMZBBRYSA-N (2s)-2-[[4-[2-[(6r)-2-amino-4-oxo-5,6,7,8-tetrahydro-1h-pyrido[2,3-d]pyrimidin-6-yl]ethyl]benzoyl]amino]pentanedioic acid Chemical compound C([C@@H]1CC=2C(=O)N=C(NC=2NC1)N)CC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 ZUQBAQVRAURMCL-DOMZBBRYSA-N 0.000 description 5
- VVIAGPKUTFNRDU-OLZOCXBDSA-N (2s)-2-[[4-[[(6r)-2-amino-5-formyl-4-oxo-1,6,7,8-tetrahydropteridin-6-yl]methylamino]benzoyl]amino]pentanedioic acid Chemical compound C([C@H]1N(C=O)C=2C(=O)N=C(NC=2NC1)N)NC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-OLZOCXBDSA-N 0.000 description 5
- 208000026310 Breast neoplasm Diseases 0.000 description 5
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 5
- 201000011510 cancer Diseases 0.000 description 5
- 235000005911 diet Nutrition 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 229950000909 lometrexol Drugs 0.000 description 5
- 229960000485 methotrexate Drugs 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 4
- 101001039269 Rattus norvegicus Glycine N-methyltransferase Proteins 0.000 description 4
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 4
- IVTVGDXNLFLDRM-HNNXBMFYSA-N Tomudex Chemical compound C=1C=C2NC(C)=NC(=O)C2=CC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)S1 IVTVGDXNLFLDRM-HNNXBMFYSA-N 0.000 description 4
- 230000002411 adverse Effects 0.000 description 4
- 239000005557 antagonist Substances 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 238000002512 chemotherapy Methods 0.000 description 4
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 4
- 229960004316 cisplatin Drugs 0.000 description 4
- 230000001472 cytotoxic effect Effects 0.000 description 4
- 230000037213 diet Effects 0.000 description 4
- 102000004419 dihydrofolate reductase Human genes 0.000 description 4
- 231100000252 nontoxic Toxicity 0.000 description 4
- LXNHXLLTXMVWPM-UHFFFAOYSA-N pyridoxine Chemical compound CC1=NC=C(CO)C(CO)=C1O LXNHXLLTXMVWPM-UHFFFAOYSA-N 0.000 description 4
- 229960004432 raltitrexed Drugs 0.000 description 4
- 210000002700 urine Anatomy 0.000 description 4
- 150000003722 vitamin derivatives Chemical class 0.000 description 4
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101000606741 Homo sapiens Phosphoribosylglycinamide formyltransferase Proteins 0.000 description 3
- 206010028116 Mucosal inflammation Diseases 0.000 description 3
- 201000010927 Mucositis Diseases 0.000 description 3
- 241000699660 Mus musculus Species 0.000 description 3
- 206010033733 Papule Diseases 0.000 description 3
- 102100039654 Phosphoribosylglycinamide formyltransferase Human genes 0.000 description 3
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 3
- 201000008275 breast carcinoma Diseases 0.000 description 3
- 239000003651 drinking water Substances 0.000 description 3
- 235000020188 drinking water Nutrition 0.000 description 3
- 229960002949 fluorouracil Drugs 0.000 description 3
- 230000002489 hematologic effect Effects 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 208000004235 neutropenia Diseases 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 238000011580 nude mouse model Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000013589 supplement Substances 0.000 description 3
- 230000009469 supplementation Effects 0.000 description 3
- 206010043554 thrombocytopenia Diseases 0.000 description 3
- 208000002670 vitamin B12 deficiency Diseases 0.000 description 3
- 229940082632 vitamin b12 and folic acid Drugs 0.000 description 3
- 230000004580 weight loss Effects 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- 206010012735 Diarrhoea Diseases 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 208000030453 Drug-Related Side Effects and Adverse reaction Diseases 0.000 description 2
- 206010015150 Erythema Diseases 0.000 description 2
- 208000012766 Growth delay Diseases 0.000 description 2
- 206010025421 Macule Diseases 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- 102000005497 Thymidylate Synthase Human genes 0.000 description 2
- 206010070863 Toxicity to various agents Diseases 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 229940041181 antineoplastic drug Drugs 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 230000000973 chemotherapeutic effect Effects 0.000 description 2
- 238000011284 combination treatment Methods 0.000 description 2
- RMRCNWBMXRMIRW-BYFNXCQMSA-M cyanocobalamin Chemical compound N#C[Co+]N([C@]1([H])[C@H](CC(N)=O)[C@]\2(CCC(=O)NC[C@H](C)OP(O)(=O)OC3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)C)C/2=C(C)\C([C@H](C/2(C)C)CCC(N)=O)=N\C\2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O RMRCNWBMXRMIRW-BYFNXCQMSA-M 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 231100000321 erythema Toxicity 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 206010016256 fatigue Diseases 0.000 description 2
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 2
- 231100000226 haematotoxicity Toxicity 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 238000011275 oncology therapy Methods 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- RADKZDMFGJYCBB-UHFFFAOYSA-N pyridoxal hydrochloride Natural products CC1=NC=C(CO)C(C=O)=C1O RADKZDMFGJYCBB-UHFFFAOYSA-N 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 231100000004 severe toxicity Toxicity 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical class OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- JZRWCGZRTZMZEH-UHFFFAOYSA-N thiamine Chemical compound CC1=C(CCO)SC=[N+]1CC1=CN=C(C)N=C1N JZRWCGZRTZMZEH-UHFFFAOYSA-N 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 239000003734 thymidylate synthase inhibitor Substances 0.000 description 2
- 238000011269 treatment regimen Methods 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 230000002485 urinary effect Effects 0.000 description 2
- 235000019158 vitamin B6 Nutrition 0.000 description 2
- 239000011726 vitamin B6 Substances 0.000 description 2
- 229940011671 vitamin b6 Drugs 0.000 description 2
- 235000019195 vitamin supplement Nutrition 0.000 description 2
- MSTNYGQPCMXVAQ-RYUDHWBXSA-N (6S)-5,6,7,8-tetrahydrofolic acid Chemical class C([C@H]1CNC=2N=C(NC(=O)C=2N1)N)NC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 MSTNYGQPCMXVAQ-RYUDHWBXSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- KDOPAZIWBAHVJB-UHFFFAOYSA-N 5h-pyrrolo[3,2-d]pyrimidine Chemical compound C1=NC=C2NC=CC2=N1 KDOPAZIWBAHVJB-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- JJTNLWSCFYERCK-UHFFFAOYSA-N 7h-pyrrolo[2,3-d]pyrimidine Chemical compound N1=CN=C2NC=CC2=C1 JJTNLWSCFYERCK-UHFFFAOYSA-N 0.000 description 1
- 206010065553 Bone marrow failure Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 206010052358 Colorectal cancer metastatic Diseases 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- 206010012455 Dermatitis exfoliative Diseases 0.000 description 1
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 1
- 208000030814 Eating disease Diseases 0.000 description 1
- 208000019454 Feeding and Eating disease Diseases 0.000 description 1
- 206010016880 Folate deficiency Diseases 0.000 description 1
- OBQMLSFOUZUIOB-UHFFFAOYSA-N Glycinamide ribonucleotide Natural products NCC(=O)NC1OC(COP(O)(O)=O)C(O)C1O OBQMLSFOUZUIOB-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000003251 Pruritus Diseases 0.000 description 1
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 1
- 102000004357 Transferases Human genes 0.000 description 1
- 108090000992 Transferases Proteins 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 229930003270 Vitamin B Natural products 0.000 description 1
- 150000008065 acid anhydrides Chemical class 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 210000001099 axilla Anatomy 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000009104 chemotherapy regimen Methods 0.000 description 1
- 235000019365 chlortetracycline Nutrition 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- FDJOLVPMNUYSCM-UVKKECPRSA-L cobalt(3+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2,7, Chemical compound [Co+3].N#[C-].C1([C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP([O-])(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)[N-]\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O FDJOLVPMNUYSCM-UVKKECPRSA-L 0.000 description 1
- 230000001149 cognitive effect Effects 0.000 description 1
- 235000000639 cyanocobalamin Nutrition 0.000 description 1
- 239000011666 cyanocobalamin Substances 0.000 description 1
- 229960002104 cyanocobalamin Drugs 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 108020001096 dihydrofolate reductase Proteins 0.000 description 1
- OZRNSSUDZOLUSN-LBPRGKRZSA-N dihydrofolic acid Chemical compound N=1C=2C(=O)NC(N)=NC=2NCC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OZRNSSUDZOLUSN-LBPRGKRZSA-N 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- NYDXNILOWQXUOF-UHFFFAOYSA-L disodium;2-[[4-[2-(2-amino-4-oxo-1,7-dihydropyrrolo[2,3-d]pyrimidin-5-yl)ethyl]benzoyl]amino]pentanedioate Chemical class [Na+].[Na+].C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)NC(CCC([O-])=O)C([O-])=O)C=C1 NYDXNILOWQXUOF-UHFFFAOYSA-L 0.000 description 1
- 235000014632 disordered eating Nutrition 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000002359 drug metabolite Substances 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 208000004526 exfoliative dermatitis Diseases 0.000 description 1
- 238000002875 fluorescence polarization Methods 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 230000003325 follicular Effects 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 230000009760 functional impairment Effects 0.000 description 1
- 238000004817 gas chromatography Methods 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- OBQMLSFOUZUIOB-SHUUEZRQSA-N glycineamide ribonucleotide Chemical compound NCC(=O)N[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O OBQMLSFOUZUIOB-SHUUEZRQSA-N 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 1
- 238000013415 human tumor xenograft model Methods 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 238000011283 initial treatment period Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 231100001106 life-threatening toxicity Toxicity 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000010197 meta-analysis Methods 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 208000022084 motor paralysis Diseases 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 159000000018 pyrido[2,3-d]pyrimidines Chemical class 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000011916 stereoselective reduction Methods 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 230000003319 supportive effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 235000019157 thiamine Nutrition 0.000 description 1
- 239000011721 thiamine Substances 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 229940045999 vitamin b 12 Drugs 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
- A61K31/525—Isoalloxazines, e.g. riboflavins, vitamin B2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7135—Compounds containing heavy metals
- A61K31/714—Cobalamins, e.g. cyanocobalamin, i.e. vitamin B12
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Nutrition Science (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Detergent Compositions (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
一般的に、非特許文献1を参照)。例えば、安全で最大限の投与を可能とするべく、支持
処置が通常用いられる。例えば、デキサメタゾン(dexamethone)等のステロイドは、葉
酸代謝拮抗薬によって引き起こされる皮膚発疹の生成を防止するのに使用することができ
る(非特許文献1, 197頁)。
アミノプテリンが、約50年前に最初に臨床的な活性を実証された。メトトレキセートが
その直後に開発され、このものは今日、悪性疾患(例えば、リンパ腫、乳癌および頭頚癌
)のための有効な化学療法レジメの標準的な成分である(非特許文献2−4参照)。葉酸
代謝拮抗薬は、チミジンまたはプリンの生合成経路における1つまたは複数の重要な葉酸
要求酵素、特にチミジル酸シンターゼ(「TS」)、ジヒドロ葉酸レダクターゼ(「DH
FR」)およびグリシンアミドリボヌクレオチドトランスフェラーゼ(「GARFT」)
)を、これらの酵素の結合部位について還元型葉酸と競争することによって抑制する。(
非特許文献5−6参照)。いくつかの葉酸代謝拮抗薬が、現在開発中である。チミジエル
酸シンターゼ抑制(「TSI」)性質を有する葉酸代謝拮抗薬の例としては、5−フルオ
ロウラシルおよびトムデックス(Tomudex、登録商標)を含む。ジヒドロ葉酸レダクター
ゼ抑制(「DHFRI」)性質を有する葉酸代謝拮抗薬の例としては、メトトレキセート
(登録商標)である。グリシンアミドリボヌクレオチドホルミルトランスフェラーゼ抑制
(「GAFRTI」)性質を有する葉酸代謝拮抗薬の例としては、ロメトレキソール(Lo
metrexol)である。これらの葉酸代謝拮抗薬の多数が、1つ以上の生合成経路を抑制する
。例えば、ロメトレキソールはジヒドロ葉酸レダクターゼのインヒビターでもあり、そし
てペメトレキセート(pemetrexed)二ナトリウム塩(このものは、アリムタ(Alimta, 登
録商標)、イーライリリー社製、indianapolis, IN)は、チミジエル酸シンターゼ、ジヒ
ドロ葉酸レダクターゼおよびグリシンアミドリボヌクレオチドホルミルトランスフェラー
ゼ抑制を実証されている。
性が、ある患者にとっては実質的な毒性と関連し得ることである。加えて、1クラスとし
ての葉酸代謝拮抗薬は、胃腸管の毒性を有する散発性の激しい骨髄抑制(mylosuppressio
n)と関連し、これはまれではあるが、高い死亡率の危険を有する。これらの毒性を制御
するのは無力なために、いくつかの葉酸代謝拮抗薬の臨床的な開発が放棄され、そして他
のもの(例えば、ロメトレキソールおよびラルチトレックスド)の臨床的な開発を複雑に
している(非特許文献7−9参照)。
、特許文献1を参照のこと。葉酸は、ホモシステインレベルをよる低下させることが分か
っている(例えば、非特許文献10−11参照)。また、ホモシステインレベルはGAR
FTインヒビターの使用に関連した細胞毒性事象の前兆であることも分かっている。例え
ば、米国特許第5,217,74号を参照。しかしながら、この処置を用いた場合でさえも、GA
RFTインヒビターおよび1クラスとしての葉酸代謝拮抗薬の細胞毒性活性は、医薬とし
ての葉酸代謝拮抗薬の開発において重要な関心がある。細胞毒性活性をより低下させる能
力は、これらの薬物の使用において重要な利点となろう。
ある毒性影響(例えば、死亡)および非血液学的な事象(例えば、皮膚発疹および疲労)
をメチルマロン酸低下薬の存在によって有意に軽減することができ、治療学的な効力に有
害な影響を及ぼさないことを見出した。従って、本発明はメチルマロン酸低下薬を用いた
処置を与えている宿主に投与することによって、葉酸代謝拮抗薬の治療学的な有用性を改
善する方法を提供する。我々は、メチルマロン酸レベルの上昇は葉酸代謝拮抗薬を与えて
いる患者における毒性事象の前兆であって、そしてメチルマロン酸を増大させる処置(例
えば、ビタミンB12を用いた処置)が従来の葉酸代謝拮抗薬に関連した死亡率、非血液
学的な事象(例えば、皮膚の発疹)および疲労事象を低下させることを見出した。
与に関連した毒性事象を相乗的に低下させることを見出した。葉酸をビタミン12と組み
合わせて用いた心血管疾患の治療および予防が知られているが、葉酸代謝拮抗薬の投与に
関連した毒性を処置するための該組み合わせの使用はこれまで知られていなかった。
て、該方法は有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬と組み合わせて投与す
ることを含む。
、有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬と組み合わせて投与することを含
む。
る方法に関するものであって、該方法は該哺乳動物に有効な量の該葉酸代謝拮抗薬をメチ
ルマロン酸低下薬と組み合わせて投与することを含む。
該方法は該哺乳動物に有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬と組み合わせ
て投与することを含む。
あって、該方法は有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬およびFBP結合
薬と組み合わせて投与することを含む。好ましいFBP結合薬は、葉酸である。
る方法に関するものであって、該方法は該哺乳動物に有効な量の該葉酸代謝拮抗薬をメチ
ルマロン酸低下薬およびFBP結合薬と組み合わせて投与することを含む。好ましいFB
P結合薬は、葉酸である。
該方法は該哺乳動物に有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬およびFBP
結合薬と組み合わせて投与することを含む。好ましいFBP結合薬は、葉酸である。
物の製造において、メチルマロン酸低下薬を単独で、またはFBP結合薬と組み合わせて
使用することに関する。
物の製造におけるメチルマロン酸低下薬の使用に関するものであって、該薬物は葉酸代謝
拮抗薬と組み合わせて投与する。
物の製造におけるメチルマロン酸低下薬の使用に関するものであって、該薬物は葉酸代謝
拮抗薬およびFBP結合薬と組み合わせて投与する。
薬物の製造におけるメチルマロン酸低下薬の使用に関するものであって、該方法は該メチ
ルマロン酸低下薬を葉酸代謝拮抗薬と組み合わせて投与することを含む。
めの組み合わせ製剤として、メチルマロン酸低下薬、葉酸代謝拮抗薬および場合によりF
BP結合薬を含有する製品に関する。
、該葉酸代謝拮抗薬の毒性を低下させるという発見に関する。
寛解し、停止し、制限し、遅らせもしくは逆転させるか、または腫瘍の増殖を減少させる
ことを意味する。
果を得ることができる量を意味する。例えば、腫瘍の増殖を低下させようと努力する際に
投与する葉酸代謝拮抗薬の有効な量は、腫瘍の増殖を低下させるのに必要とされる量であ
る。
味する。該事象としては、好中球減少、血小板減少、毒物死、疲労、摂食障害、悪心、皮
膚発疹、感染、下痢、粘膜炎および貧血症を含むが、これらに限定されない。葉酸代謝拮
抗薬を与えている患者が経験する毒性の種類に関する更なる説明は、通常、Antifolate D
rugs in Cancer Therapyを参照のこと。毒性は、毒物死、疲労、好中球減少、血小板減少
および粘膜炎を意味することが好ましい。
膚発疹または疲労の発生を意味する。
性を低下させるのに十分なレベルのメチルマロン酸低下薬および場合により葉酸が存在す
るようないずれかの順序で、メチルマロン酸低下薬、葉酸代謝拮抗薬、および場合により
葉酸を投与することを意味する。該化合物の投与は、単一の組成物としてもしくは2つの
別々の組成物として同時にすることができたり、あるいは第2および/または第3の薬物
を投与するときに、最初に投与した薬物の有効な量が患者の体内に存在するように別々の
組成物として逐次的に投与することができる。葉酸代謝拮抗薬を最初に哺乳動物に投与し
、続いてメチルマロン酸低下薬を用いて処理することができる。別法として、哺乳動物は
、葉酸代謝拮抗薬をメチルマロン酸低下薬と同時に投与することができる。哺乳動物はメ
チルマロン酸低下薬を用いて予め処理し、次いで葉酸代謝拮抗薬を用いて処理することが
好ましい。葉酸をメチルマロン酸低下薬に加えて投与する場合には、該葉酸を、メチルマ
ロン酸低下薬または葉酸代謝拮抗薬のいずれかの投与前、投与後、または同時でのいずれ
の時に投与することができる。哺乳動物はメチルマロン酸低下薬を用いて予め処理し、次
いで葉酸を用いて処理し、続いて該葉酸代謝拮抗性化合物を用いて処理することが好まし
い。
還元型葉酸と競争することによって、チミジンまたはプリン生合成経路における少なくと
も1つの重要な葉酸要求酵素(例えば、チミジル酸シンターゼ(「TS」)、ジヒドロ葉
酸レダクターゼ(「DHFR」)またはグリシンアミドリボヌクレオチドホルミルトラン
スフェラーゼ(「GARFT」)が好ましい)を抑制する化学的な化合物を意味する。葉
酸代謝拮抗薬の好ましい例としては、5−フルオロウラシル(グラクソ(Glaxo)製);
トムデックス(Tomudex、登録商標)(ゼネカ(Zeneca)製);メトトレキセート(登録
商標)(レデルレ(Lederle)製));ロメトレキソール(Lometrexol)(登録商標)(
ツラリカ(Tularik)製);ピリド[2,3−d]ピリミジン誘導体(このものは、テイラ
ーらによる米国特許第4,684,653号、4,833,145号、4,902,796号、4,871,743号および4,88
2,334号に記載されている);誘導体(アキモト(Akimoto)らによる米国特許第4,997,83
8号に記載されている);チミジル酸シンターゼインヒビター(このものは、EPO出願
番号239,362において知られる)を含む。ペメトレキセート(pemetrexed)ナトリウム(
ALIMTA)(イーライリリー社製)が最も好ましい。
ク酸の構造異性体を意味する。
基質を意味する。該基質の好ましい例は、ビタミンB12である。従って、メチルマロン
酸およびそのための基質を測定する方法については、例えば以下の文献を参照のこと。Ma
tchar D.B., Feussner J.R., Millington D.S.らによる Isotope dilution assay for ur
inary methylmalonic acid in the diagnosis of vitamin B12 deficiency. A prospecti
ve clinical evaluation. Ann Intern Med 987; 106: 707-710; Norman E.J., Morrison
J.A.によるScreening elderly populations for cobalamin (vitamin B12) deficiency u
sing the urinary methylmalonic acid assay by gas chromatography mass spectrometr
y. Am. J. Med. 1993, 94, 589-594; Norman E.J.によるGas Chromatography mass spect
rometry screening of urinary methylmalonic acid: early detection of vitamin B12
(cobalamin) deficiency to prevent permanent neurologic disability. GC/MS News 19
84, 12, 120-129; Martin D.C., Francis J., Protetch J., Huff F.J.による Time depe
ndency of cognitive recovery with cobalamin replacement: report of a pilot study
. JAGS 1992, 40, 168-172; Norman E.J., Cronin C.による Cobalamin deficiency. Neu
rol 1996, 47, 310-311; Rasmussen K., Moelby I., Jensen M.K.による Studies on met
hylmalonic acid in humans; Savage D.G., Lindenbaum J., Stabler S.P., Allen R.H.
による Sensitivity of methylmalonic acid and total homocysteine determination fo
r diagnosing cobalamin and folate deficiency. Am. J. Med. 1994, 96, 239-246。
ドロオキソコバラミン、シアノ−10−クロロコバラミン、アココバラミン過塩素酸塩、
アコ−10−クロロコバラミン過塩素酸塩、アジドコバラミン、クロロコバラミンおよび
コバラミン)を意味する。該用語は、ビタミンB12、コバラミンおよびクロロコバラミ
ンを意味することが好ましい。
製剤)の形態であったり、飲用水に加えた水溶液としてであったり、または水溶性の非経
口製剤として与えるであろう。該メチルマロン酸低下薬は筋肉内注射製剤として投与され
ることが好ましい。該製剤は当該分野で知られており、このものは商業的に入手すること
ができる。
とを認めるであろう。例えば、コバラミンをメチルマロン酸低下薬として使用する場合に
は、コバラミンの用量は毎日1回を1ヶ月間から9週間毎に1回を1年間にわたって約0
.2μg〜約3000μgの範囲であってよい。コバラミンは、約24時間毎〜約168
0時間毎に投与される約500μg〜約1500μgの筋肉内注射として服用されること
が好ましい。葉酸代謝拮抗薬を用いた処置を開始し、葉酸代謝拮抗薬の投与を止めるまで
続けることに関係なく、葉酸代謝拮抗薬の投与の約1〜約3週間前に最初に約1000μ
gを筋肉内注射で投与し、約24時間毎〜約1680時間毎に繰り返すことが好ましい。
葉酸代謝拮抗薬の第1投与の約1週間〜約3週間前に約1000μgを筋肉内注射で投与
し、該葉酸代謝拮抗薬の投与を止めるまで、6週間毎〜12週間毎(約9週間毎が好まし
い)に繰り返すことが最も好ましい。しかしながら、メチルマロン酸低下薬の量は実際に
は、関連する状況(このものは、処置する病気、投与の選択経路、投与する実際の薬物、
個々の患者の年齢、体重および応答、患者の症状の激しさを含む)に照らして医師によっ
て決定されることを理解されるであろう。従って、該上記の用量範囲は本発明の範囲を限
定することを意図するものではない。例えば、上記の範囲より低い用量レベルがより適当
であったり、一方で他の場合には更に大きな用量をいずれの有害な副作用を生じることな
く、使用することができる。
する。このものは、例えば葉酸である(6R)−5−メチル−5,6,7,8−テトラヒドロ
葉酸および(6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生
理学的に許容し得る塩もしくはエステルを含む。この後者の化合物は、J. Am. Chem. Soc
. 74, 4215 (1952)に開示されているロイコボリン(Leucovorin)の(6R)−異性体であ
る。該テトラヒドロ葉酸化合物の両方は、6−位で異常な立体配置を有する。それらは、
それぞれの(6S)異性体と比較して葉酸結合タンパク質と結合する際に10〜20倍以上
有効である(Ratnamらによる Folate and Antifolate Transport in Mammalian Cells Sy
mposium, Mar. 21-22, 1991, Bethesda, MD.を参照)。これらの化合物は通常、対応する
デヒドロ前駆体からの非立体選択的な還元反応、続いてクロマトグラフィー法または酵素
による方法により分離することによって、ジアステレオマーである天然の(6S)体を有す
る混合物として製造する。例えば、PCT特許出願公開番号WO880844 (また、Derwent
Abstract 88-368464/5) およびカナダ国特許第1093554号を参照。例えば、Dietary Refer
ence Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B , Pa
ntothenic Acid, Biotin, and Choline (2000), 8 Folate, 196-305頁を参照。
マグネシウム塩(カルシウム塩であることが好ましい)を意味する。「生理学的に許容し
得るエステル」とは、哺乳動物に投与後に容易に加水分解されて、対応するFBP結合薬
の遊離酸(例えば、C1〜C4アルキルエステル、混合酸無水物など)を与えるエステル
を意味する。
系中で親酸に変換される生理学的に許容し得る塩またはエステルの形態であり得る。該用
量は通常、ビタミンサプリメントの形態で、すなわち経口投与される錠剤であったり(例
えば、除放性製剤であることが好ましい)、飲用水に加えた水溶液としてであったり、水
溶性の非経口製剤(例えば、静脈内製剤)などとして与える。
投与する。約1時間〜約24時間での適当な量のFBP結合薬を用いた前処置は通常、該
葉酸代謝拮抗薬を投与する前に葉酸代謝拮抗薬と結合するタンパク質と実質的に結合させ
たり、遮断させるのに十分である。FBP結合薬の1回投与(これは、葉酸の経口投与が
好ましい)は葉酸結合性タンパク質をロードするのに十分であるが、該FBP結合薬の複
数回服用を活性薬物による処置の数週間前に使用し、葉酸結合性タンパク質が十分に結合
することを確実にしてそれら前処置から得られる利点を最大限とすることができる。
〜約5mgが最も好ましい)を、メチルマロン酸低下薬の投与の約1〜約3週間後で且つ
ある量の葉酸代謝拮抗薬の非経口投与の約1〜約24時間前に、哺乳動物に経口投与する
。しかしながら、実際に投与するメチルマロン酸低下薬の量は、関連する状況(例えば、
処置する病気、投与の選択経路、投与する実際の薬物、個々の患者の年齢、体重および反
応、並びに患者の症状の激しさを含む)に照らして医師によって決定されるであろう。従
って、上記の用量の範囲は本発明の範囲を限定することを意図するものではない。ある場
合には、上記の範囲の下限よりも低い用量レベルがより適当であり、一方で他の場合には
、より一層の多量をいずれの有害な副作用を引き起こさずに使用することができる。
ことを意味する。
(方法)
メチルマロン酸低下薬の単独、または葉酸との組み合わせがヒト腫瘍異種移植片モデル
に及ぼす効果を評価するために、ヒトMX−1乳癌腫を有する雌性ヌードマウスを、AL
IMTAを単独でまたは生理学的を越えた用量の葉酸またはビタミンB12(コバラミン
)と一緒に用いて処置した。
。ドナーの腫瘍から得られるヒトMX−1腫瘍細胞(5×106)を、約8〜10週齢の
雌性ヌードマウスの大腿に皮下移植した。腫瘍細胞の移植の7日後に開始し、該動物をA
LIMTA(100mg/kgまたは150mg/kg)を用いて、7日〜11日目およ
び14日〜18日目に毎日1回腹腔内注射のみによるか、あるいは同じスケジュールでの
腹腔内注射による葉酸(6mg/kgまたは60mg/kg)および/またはビタミンB
12(165mg/kg)を用いて腹腔内投与によって、同じスケジュールで処置した。
た。腫瘍の大きさの測定と同時期に、体重の測定によって、毒性を追跡した。腫瘍増殖の
遅延は、処置腫瘍とコントロール腫瘍が1000mm3に達するまでの差異(単位は日数
)とした。
でALIMTAを用いた処置について応答性であり、17日および21日の腫瘍増殖の遅
延を得た。ALIMTAと同じスケジュールで、6mg/kgおよび60mg/kgの2
つの用量で、葉酸を該動物に単独で投与して、それぞれ7日および12日の腫瘍増殖の遅
延を得た。用量が165mg/kgでビタミンB12を単独で投与することにより、12
日の腫瘍増殖の遅延を得た。
レジメとして投与した。葉酸(6mg/kg)とALIMTAと一緒に投与することによ
り、ALIMTA単独での使用から生じる腫瘍増殖の遅延は変わらなかった。ALIMT
Aの用量がそれぞれ100mg/kgおよび150mg/kgの場合に、高用量(60m
g/kg)の葉酸を各用量のALIMTAと一緒に加えることにより、腫瘍増殖の遅延を
22日および23日と少し増大させた。ALIMTAおよびビタミン(B12)(165
mg/kg)の処置による腫瘍増殖の遅延は、ALIMTAの用量がそれぞれ100mg
/kgおよび150mg/kgでは、22日および24日であった。
減少パターンは処置レジメによって影響を受けた。7日目〜11日目および14日目〜1
8日目の処置期間中は体重が増加し、2日間間隔を置くことによって体重は回復した。A
LIMTAが原因の体重の減少は用量に依存するが、総計で小さいものであった(3%)
。葉酸を6mg/kgまたは60mg/kgで単独の場合には体重の減少は生じず、実際
に葉酸で処置した動物はコントロール動物よりも実験期間中、体重を維持したり、増加し
ていた。ALIMTA(100mg/kg)および葉酸(60mg/kg)を用いて処置
した動物は、実験期間中、体重が増加した(約20%)。
ALIMTA(100mg/kg)をビタミンB12と一緒に用いて処置した動物は体重
が増加したが、一方でALIMTA(150mg/kg)をビタミンB12と一緒に用い
て処置した動物は実験期間中、体重を維持した。
ンB12の投与は、ヌードマウスのヒトMX−1乳癌癌腫異種移植片腫瘍におけるALI
MTAの抗腫瘍活性を変化させず、そして動物の体重測定によって決まるALIMTAの
毒性を増大させなかった。
通常使用される標準的な試験において示され、該葉酸代謝拮抗薬そのものの抗腫瘍活性お
よび毒性効果を測定することができる。それらの1試験においては、2mm×2mmの腫
瘍断片をマウスの腋部分にトロカールにより挿入することによって、マウスを乳腺癌腫の
C3H菌株に予防摂取する。メチルマロン酸低下薬の単独または葉酸との組み合わせの投
与時期は変えることができる。10動物を各々の用量レベルで用いる。副尺カリパスを用
いて腫瘍増殖の長さおよび幅を測定することによって、10日目に腫瘍活性を評価する(
1日目は葉酸代謝拮抗薬の第1投与である)。該活性は、腫瘍増殖の抑制パーセントとし
て表す。
い食事を維持した感染マウスに、葉酸代謝拮抗薬を投与する場合には、非常に低用量では
中位の抗腫瘍活性を示すが、非常に低用量では激しい毒性をも引き起こす(これは、マウ
スの死として測定される)。
の2週間維持する。次いで、0.003%のビタミンB12(重量比/容量比)を筋肉内
注射によって処置し、そして場合により0.0003%の葉酸(重量比/容量比)を含有
する飲用水を該動物に与える間に、ビタミンB12および場合により葉酸を投与する。こ
の濃度は、1日当たりの体表の平方メートルにつきビタミンB12および場合により葉酸
の約1.75mgと翻訳(translate)される。上記の結果が示す通り、示したレベルの
ビタミンB12を葉酸代謝拮抗薬を与えている被験者の食事に加えることにより、低用量
で優れた抗腫瘍活性が得られ、毒性効果はほとんどまたは全くなかった。
り葉酸なしの食事を維持された腫瘍を有するマウスの場合には、該葉酸代謝拮抗薬の毒性
は非常に高く、1mg/kg/日では大部分のマウスが致死し、非毒性薬物用量ではより
低い腫瘍活性が観察される。非常に低用量のビタミンB12は、薬物毒性をいくらか逆転
し、抗腫瘍活性を改善する。より多い用量のビタミンB12は、葉酸代謝拮抗薬の毒性を
一層より有意に低下させる。該マウスをビタミンB12を用いて前処置し、次いで葉酸代
謝拮抗薬を投与する前に葉酸を投与することにより、毒性の著しい低下が見られ、葉酸代
謝拮抗薬の毒性をほとんど完全に除く。従って、ビタミンB12を葉酸代謝拮抗薬と組み
合わせた使用は薬物の毒性を低下させ、抗腫瘍活性に有害な影響を及ぼさない。ビタミン
B12と葉酸との一緒の使用は、薬物毒性を相乗的に低下させる。
胞学的に癌の診断を確認する。葉酸代謝拮抗薬をビタミンB12と組み合わせて投与する
。ビタミンB12は、葉酸代謝拮抗薬を用いた処置の1〜3週間前に、1000μgを筋
肉内注射として投与する。1000μgのビタミンB12の筋肉内注射を、患者が療法を
中断するまで約9週間毎に行なう。該葉酸代謝拮抗薬を速い静脈内注射によって2週間の
期間にわたって4回の服用で投与し、続いて非療法を2週間行う。投与は、いずれの2週
間の期間内の1、4、8および11日目に行なう。患者は、5mg/m2/服用での最初
の療法期間を有し、そして最初の期間中に観察される毒性効果に応じて、それらの続く期
間を同じ用量としたり、6mg/m2にまで増大させたり、あるいは4mg/m2にまで
減少させることができる。
を与えている患者に与えたビタミンB12が、ALIMTAが原因の副作用を有効に低下
させることを確認した。ALIMTA投与の1週間〜2週間前に、ヒト被験者から尿を集
め、血液を採取した。ビタミン代謝物レベル、メチルマロン酸およびホモシステインを測
定する。血中ホモシステインレベルは、蛍光分極イムノアッセイキット(アボット社(Ab
bot laboratories)製)によって測定する。メチルマロン酸レベルは、24時間尿収集キ
ット(バイオラボメディカルユニット(Biolab Medical Unit)(United Kingdom compan
y)から入手可能)を用いた尿レベルによって測定する。加えて、尿および血液を、AL
IMTAの投与1週間前に(葉酸の補充の少なくとも5日後でビタミンB12の補充の少
なくとも1週間後)、および周期毎の4日前まで集めることができる。
1.葉酸
葉酸は、以下の選択肢の1つとして与える。選択肢1〜選択肢3の順序で好ましい。
1.葉酸の350〜600μg。
2.選択肢1を使用できない場合には、350μg〜600μgの範囲の葉酸を含有す
るマルチビタミンが許容され得る。
3.選択肢1または選択肢2のいずれも使用できない場合には、350μg〜1000
μg用量の葉酸が許容され得る。
独で用いた処置の約1〜約3週間前に葉酸の毎日の経口投与を開始し、研究療法を中断す
るまで毎日続けるべきである。
ビタミンB12を得て、1000μgを筋肉内注射として投与する。ビタミンB12の
注射は、ALIMTAを用いた処置の約1〜3週間前に投与しなければならず、そのこと
は患者が研究療法を中断するまで約9週間毎に繰り返すべきである。
ンの第1投与の約1〜3週間前に毎日の経口投与を開始すべきである。ビタミンB12(
1000μg)の注射は、ALIMTAの第1投与の約1〜3週間前に筋肉内投与しなけ
ればならず、そしてこのことは患者が研究療法を中断するまで約9週間毎に繰り返すべき
である。
1服用の直前レベル、およびb)被験薬の第2服用の直前レベル(すなわち、補充の完全
な周期後)と比較する。ベースラインから補充された患者における最初の7個までの治療
周期を与えたある毒性の羅患率を、補充されていない初期の患者(n=246)において
観察された羅疾患率(ファーバー(Farber)らによる)と比較する。
ることができる。
比較するデータは以下の通りである:
1)患者数と、ベースラインから補充された患者のベースライン個体群の統計学的デー
タ;
2)第1の服用前、第2の服用前および研究している癌の種類に応じた各治療サイクル
前のホモシステインレベルおよびメチルマロン酸レベルと、ベースラインレベル;
3)これらの十分に補充された患者におけるグレード3と4の血液学的な毒性;
4)これらの十分に補充された患者におけるグレード3と4の非血液学的な毒性。
く知られる。疲労および皮膚発疹のグレードの例を以下に示す。
疲労のグレード
神経運動
0) なしまたは変化なし
1) 主観的な脱力感;客観的な知見なし
2) 機能の有意な障害がない、中位の客観的な脱力感
3) 機能の障害を有する、客観的な脱力感
4) 運動麻痺
皮膚
0) なしまたは変化なし
1) 無症候性である散らばった黄斑、丘疹の皮疹または紅斑
2) かゆみ症を伴う無症候性の散らばった黄斑、丘疹の皮疹もしくは紅斑、または他
の関連する皮疹の症状
3) 全身症候性の黄斑、丘疹または小胞の皮疹
4) 剥脱性の皮膚炎または潰瘍性の皮膚炎
社(Zenith Gold Line, Centrum, Folvite)またはインカナダアポ−ホリック社(in Can
ada Apo-Folic)から得ることができる。シアノコバラミンは、これらの研究においてメ
チルマロン酸低下薬として使用される。
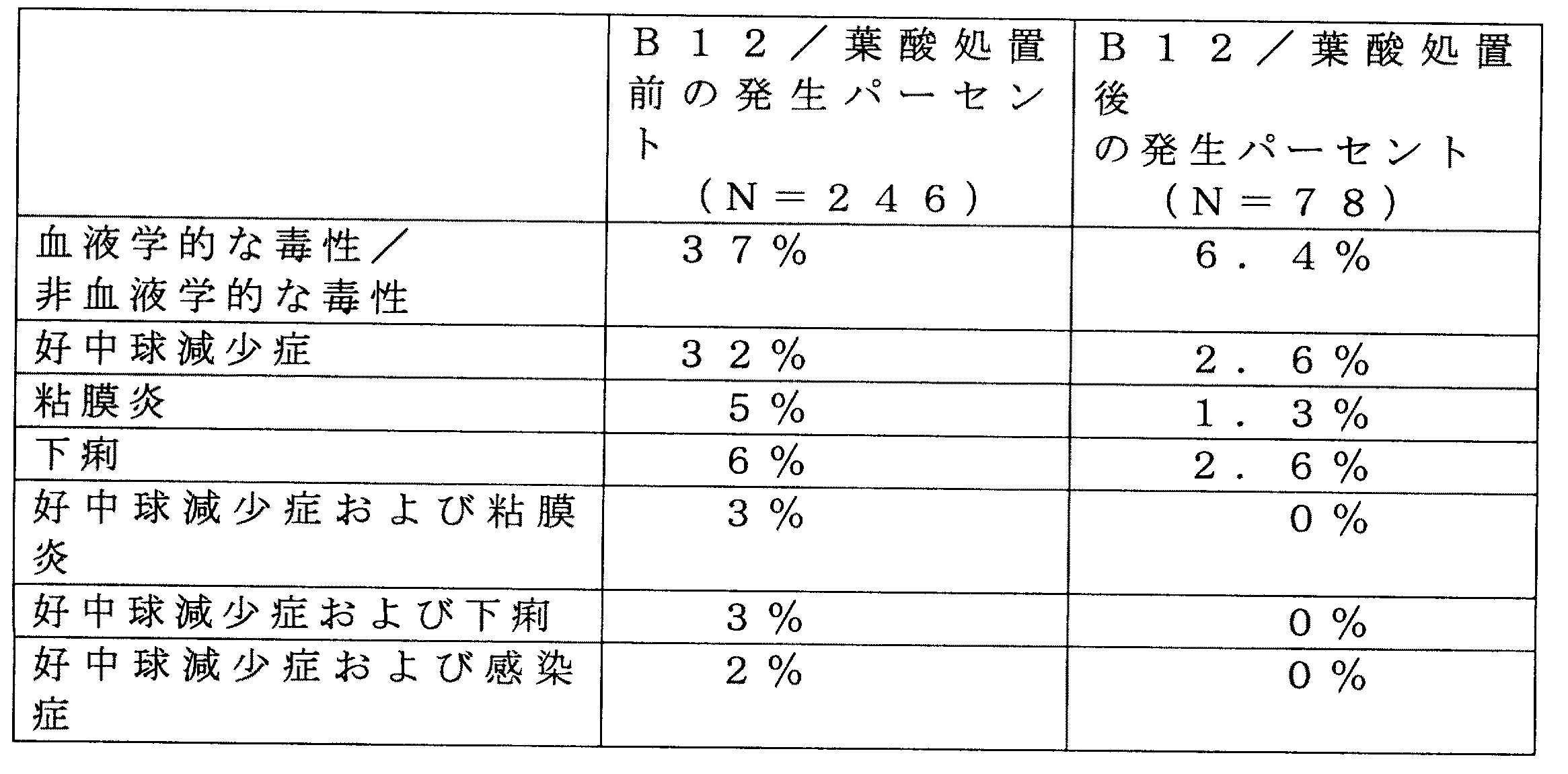
薬物関連死亡全体の4%、グレード3/4の好中球減少症の50%、グレード4の血小板
減少症の7%、およびグレード3/4の下痢および粘膜炎の10%を示す。ALIMTA
で補充したビタミンB12は、薬物関連の毒性において中位の効果を示し、薬物関連の死
を3%にまで低下させ、且つ激しい毒性を約25%だけ低下させた。ビタミンB12およ
び葉酸とALIMTAとの組み合わせは、処置した480以上において、薬物関連の死を
<1%にまで低下させた。ビタミンB12と葉酸との組み合わせは、薬物に関連するグレ
ード3/4の毒性事象を低下させた。このことを、表1に示す。
表1
れらのうちの17患者は上記の通り、ALIMTAを与えているが、ビタミンB12また
は葉酸を与えなかった。残りの患者は、上記の通り、ビタミンB12、葉酸およびALI
MTAを与えた。組合わせ処置を与えた患者において、45のうちの8が化学療法に応答
した。該組み合わせ療法を与えていないが、ALIMTAを用いた処置だけを与えた患者
においては、17のうちの1だけが応答した。
れらのうちの17患者は上記の通り、ALIMTAを与えているが、ビタミンB12また
は葉酸を与えなかった。残りの患者は、上記の通り、ビタミンB12、葉酸およびALI
MTAを与えた。組合わせ処置を与えた患者において、45のうちの8が化学療法に応答
した。該組み合わせ療法を与えていないが、ALIMTAを用いた処置だけを与えた患者
においては、17のうちの1だけが応答した。
本発明は以下の態様を含み得る。
[1]
必要のある哺乳動物に葉酸代謝拮抗薬を投与する方法であって、有効な量の該葉酸代謝
拮抗薬をメチルマロン酸低下薬と組み合わせて投与することを含む方法。
[2]
哺乳動物に葉酸代謝拮抗薬を投与することに関連した毒性を低下させる方法であって、
該哺乳動物に有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬と組み合わせて投与す
ることを含む方法。
[3]
哺乳動物における腫瘍の増殖を抑制する方法であって、有効な量の該葉酸代謝拮抗薬を
メチルマロン酸低下薬と組み合わせて投与することを含む方法。
[4]
必要のある哺乳動物に葉酸代謝拮抗薬を投与する方法であって、有効な量の該葉酸代謝
拮抗薬をメチルマロン酸低下薬およびFBP結合薬と組み合わせて投与することを含む方
法。
[5]
哺乳動物ヘ葉酸代謝拮抗薬を投与することに関連した毒性を低下させる方法であって、
有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬およびFBP結合薬と組み合わせて
投与することを含む方法。
[6]
哺乳動物における腫瘍増殖を抑制する方法であって、該哺乳動物に有効な量の葉酸代謝
拮抗薬をメチルマロン酸低下薬およびFBP結合薬と組み合わせて投与することを含む方
法。
[7]
メチルマロン酸低下薬は、ヒドロオキソコバラミン、シアノ−10−クロロコバラミン
、アココバラミン過塩素酸塩、アコ−10−クロロコバラミン過塩素酸塩、アジドコバラ
ミン、クロロコバラミンおよびコバラミンからなる群から選ばれる、請求項1〜6のいず
れかに記載の方法。
[8]
FBP結合薬は、葉酸、(6R)−5−メチル−5,6,7,8−テトラヒドロ葉酸および(
6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生理学的に許容
し得る塩もしくはエステルからなる群から選ばれる、請求項4〜6のいずれかに記載の方
法。
[9]
葉酸代謝拮抗薬はALIMTAである、請求項1〜8のいずれかに記載の方法。
[10]
哺乳動物はメチルマロン酸低下薬を用いて予め処理する、請求項1〜9のいずれかに記
載の方法。
[11]
葉酸代謝拮抗薬に関連した哺乳動物の毒性を低下させるのに有用な薬物の製造における
メチルマロン酸低下薬の使用であって、該薬物を葉酸代謝拮抗薬と組み合わせて投与する
使用。
[12]
葉酸代謝拮抗薬に関連した哺乳動物の毒性を低下させるのに有用な薬物の製造における
メチルマロン酸低下薬の使用であって、該薬物を葉酸代謝拮抗薬およびFBP結合薬と組
み合わせて投与する使用。
[13]
メチルマロン酸低下薬は、ヒドロオキソコバラミン、シアノ−10−クロロコバラミン
、アココバラミン過塩素酸塩、アコ−10−クロロコバラミン過塩素酸塩、アジドコバラ
ミン、クロロコバラミンおよびコバラミンからなる群から選ばれる、請求項11または1
2のいずれかに記載の使用。
[14]
FBP結合薬は、葉酸、(6R)−5−メチル−5,6,7,8−テトラヒドロ葉酸および(
6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生理学的に許容
し得る塩もしくはエステルからなる群から選ばれる、請求項11〜13のいずれかに記載
の使用。
[15]
葉酸代謝拮抗薬はAIMTAである、請求項11〜14のいずれかに記載の使用。
[16]
哺乳動物はメチルマロン酸低下薬を用いて予め処理する、請求項11〜15のいずれか
に記載の使用。
[17]
葉酸代謝拮抗薬の投与に関連した哺乳動物の毒性を抑制するための薬物の製造における
メチルマロン酸低下薬の使用であって、該メチルマロン酸低下薬を該葉酸代謝拮抗薬と組
み合わせて投与する使用。
[18]
哺乳動物における腫瘍増殖を抑制する方法において使用するための薬物の製造における
メチルマロン酸低下薬の使用であって、該方法はメチルマロン酸低下薬を葉酸代謝拮抗薬
と組み合わせて投与することを含む使用。
[19]
FBP結合薬を該メチルマロン酸低下薬および葉酸代謝拮抗薬とも組み合わせて投与す
る、請求項17または18のいずれかに記載の使用。
[20]
メチルマロン酸低下薬、葉酸代謝拮抗薬、および場合によりFBP結合薬を、互いに同
時に、別々に、または逐次的に投与する、請求項17〜19のいずれかに記載の使用。
[21]
メチルマロン酸低下薬は、ヒドロオキソコバラミン、シアノ−10−クロロコバラミン
、アココバラミン過塩素酸塩、アコ−10−クロロコバラミン過塩素酸塩、アジドコバラ
ミン、クロロコバラミンおよびコバラミンからなる群から選ばれる、請求項17〜20の
いずれかに記載の使用。
[22]
FBP結合薬は、葉酸、(6R)−5−メチル−5,6,7,8−テトラヒドロ葉酸および(
6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生理学的に許容
し得る塩もしくはエステルからなる群から選ばれる、請求項19〜21のいずれかに記載
の使用。
[23]
葉酸代謝拮抗薬はALIMTAである、請求項17〜22のいずれかに記載の使用。
[24]
哺乳動物をメチルマロン酸低下薬で予め処理する、請求項17〜23のいずれかに記載
の使用。
[25]
腫瘍の増殖を抑制する際に同時に、別々にまたは逐次的に使用するための組み合わせ製
剤としての、メチルマロン酸低下薬、葉酸代謝拮抗薬および場合によりFBP結合薬を含
有する製品。
[26]
メチルマロン酸低下薬は、ヒドロオキソコバラミン、シアノ−10−クロロコバラミン
、アココバラミン過塩素酸塩、アコ−10−クロロコバラミン過塩素酸塩、アジドコバラ
ミン、クロロコバラミンおよびコバラミンからなる群から選ばれる、請求項25に記載の
製品。
[27]
葉酸代謝拮抗薬はALIMTAである、請求項25または26のいずれかに記載の製品
。
[28]
FBP結合薬は、葉酸、(6R)−5−メチル−5,6,7,8−テトラヒドロ葉酸および(
6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生理学的に許容
し得る塩もしくはエステルからなる群から選ばれる、請求項25〜27のいずれかに記載
の製品。
Claims (28)
- 必要のある哺乳動物に葉酸代謝拮抗薬を投与する方法であって、有効な量の該葉酸代謝
拮抗薬をメチルマロン酸低下薬と組み合わせて投与することを含む方法。 - 哺乳動物に葉酸代謝拮抗薬を投与することに関連した毒性を低下させる方法であって、
該哺乳動物に有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬と組み合わせて投与す
ることを含む方法。 - 哺乳動物における腫瘍の増殖を抑制する方法であって、有効な量の該葉酸代謝拮抗薬を
メチルマロン酸低下薬と組み合わせて投与することを含む方法。 - 必要のある哺乳動物に葉酸代謝拮抗薬を投与する方法であって、有効な量の該葉酸代謝
拮抗薬をメチルマロン酸低下薬およびFBP結合薬と組み合わせて投与することを含む方
法。 - 哺乳動物ヘ葉酸代謝拮抗薬を投与することに関連した毒性を低下させる方法であって、
有効な量の該葉酸代謝拮抗薬をメチルマロン酸低下薬およびFBP結合薬と組み合わせて
投与することを含む方法。 - 哺乳動物における腫瘍増殖を抑制する方法であって、該哺乳動物に有効な量の葉酸代謝
拮抗薬をメチルマロン酸低下薬およびFBP結合薬と組み合わせて投与することを含む方
法。 - メチルマロン酸低下薬は、ヒドロオキソコバラミン、シアノ−10−クロロコバラミン
、アココバラミン過塩素酸塩、アコ−10−クロロコバラミン過塩素酸塩、アジドコバラ
ミン、クロロコバラミンおよびコバラミンからなる群から選ばれる、請求項1〜6のいず
れかに記載の方法。 - FBP結合薬は、葉酸、(6R)−5−メチル−5,6,7,8−テトラヒドロ葉酸および(
6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生理学的に許容
し得る塩もしくはエステルからなる群から選ばれる、請求項4〜6のいずれかに記載の方
法。 - 葉酸代謝拮抗薬はALIMTAである、請求項1〜8のいずれかに記載の方法。
- 哺乳動物はメチルマロン酸低下薬を用いて予め処理する、請求項1〜9のいずれかに記
載の方法。 - 葉酸代謝拮抗薬に関連した哺乳動物の毒性を低下させるのに有用な薬物の製造における
メチルマロン酸低下薬の使用であって、該薬物を葉酸代謝拮抗薬と組み合わせて投与する
使用。 - 葉酸代謝拮抗薬に関連した哺乳動物の毒性を低下させるのに有用な薬物の製造における
メチルマロン酸低下薬の使用であって、該薬物を葉酸代謝拮抗薬およびFBP結合薬と組
み合わせて投与する使用。 - メチルマロン酸低下薬は、ヒドロオキソコバラミン、シアノ−10−クロロコバラミン
、アココバラミン過塩素酸塩、アコ−10−クロロコバラミン過塩素酸塩、アジドコバラ
ミン、クロロコバラミンおよびコバラミンからなる群から選ばれる、請求項11または1
2のいずれかに記載の使用。 - FBP結合薬は、葉酸、(6R)−5−メチル−5,6,7,8−テトラヒドロ葉酸および(
6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生理学的に許容
し得る塩もしくはエステルからなる群から選ばれる、請求項11〜13のいずれかに記載
の使用。 - 葉酸代謝拮抗薬はAIMTAである、請求項11〜14のいずれかに記載の使用。
- 哺乳動物はメチルマロン酸低下薬を用いて予め処理する、請求項11〜15のいずれか
に記載の使用。 - 葉酸代謝拮抗薬の投与に関連した哺乳動物の毒性を抑制するための薬物の製造における
メチルマロン酸低下薬の使用であって、該メチルマロン酸低下薬を該葉酸代謝拮抗薬と組
み合わせて投与する使用。 - 哺乳動物における腫瘍増殖を抑制する方法において使用するための薬物の製造における
メチルマロン酸低下薬の使用であって、該方法はメチルマロン酸低下薬を葉酸代謝拮抗薬
と組み合わせて投与することを含む使用。 - FBP結合薬を該メチルマロン酸低下薬および葉酸代謝拮抗薬とも組み合わせて投与す
る、請求項17または18のいずれかに記載の使用。 - メチルマロン酸低下薬、葉酸代謝拮抗薬、および場合によりFBP結合薬を、互いに同
時に、別々に、または逐次的に投与する、請求項17〜19のいずれかに記載の使用。 - メチルマロン酸低下薬は、ヒドロオキソコバラミン、シアノ−10−クロロコバラミン
、アココバラミン過塩素酸塩、アコ−10−クロロコバラミン過塩素酸塩、アジドコバラ
ミン、クロロコバラミンおよびコバラミンからなる群から選ばれる、請求項17〜20の
いずれかに記載の使用。 - FBP結合薬は、葉酸、(6R)−5−メチル−5,6,7,8−テトラヒドロ葉酸および(
6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生理学的に許容
し得る塩もしくはエステルからなる群から選ばれる、請求項19〜21のいずれかに記載
の使用。 - 葉酸代謝拮抗薬はALIMTAである、請求項17〜22のいずれかに記載の使用。
- 哺乳動物をメチルマロン酸低下薬で予め処理する、請求項17〜23のいずれかに記載
の使用。 - 腫瘍の増殖を抑制する際に同時に、別々にまたは逐次的に使用するための組み合わせ製
剤としての、メチルマロン酸低下薬、葉酸代謝拮抗薬および場合によりFBP結合薬を含
有する製品。 - メチルマロン酸低下薬は、ヒドロオキソコバラミン、シアノ−10−クロロコバラミン
、アココバラミン過塩素酸塩、アコ−10−クロロコバラミン過塩素酸塩、アジドコバラ
ミン、クロロコバラミンおよびコバラミンからなる群から選ばれる、請求項25に記載の
製品。 - 葉酸代謝拮抗薬はALIMTAである、請求項25または26のいずれかに記載の製品
。 - FBP結合薬は、葉酸、(6R)−5−メチル−5,6,7,8−テトラヒドロ葉酸および(
6R)−5−ホルミル−5,6,7,8−テトラヒドロ葉酸、またはそれらの生理学的に許容
し得る塩もしくはエステルからなる群から選ばれる、請求項25〜27のいずれかに記載
の製品。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US21531000P | 2000-06-30 | 2000-06-30 | |
| US60/215,310 | 2000-06-30 | ||
| US23585900P | 2000-09-27 | 2000-09-27 | |
| US60/235,859 | 2000-09-27 | ||
| US28444801P | 2001-04-18 | 2001-04-18 | |
| US60/284,448 | 2001-04-18 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018156677A Division JP2018197265A (ja) | 2000-06-30 | 2018-08-23 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2020117536A true JP2020117536A (ja) | 2020-08-06 |
Family
ID=27396105
Family Applications (7)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002506715A Expired - Lifetime JP5102928B2 (ja) | 2000-06-30 | 2001-06-15 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2012144570A Expired - Lifetime JP5469706B2 (ja) | 2000-06-30 | 2012-06-27 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2013213276A Withdrawn JP2014005304A (ja) | 2000-06-30 | 2013-10-11 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2015087012A Withdrawn JP2015178501A (ja) | 2000-06-30 | 2015-04-21 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2016192173A Withdrawn JP2017019852A (ja) | 2000-06-30 | 2016-09-29 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2018156677A Withdrawn JP2018197265A (ja) | 2000-06-30 | 2018-08-23 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2020072098A Pending JP2020117536A (ja) | 2000-06-30 | 2020-04-14 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
Family Applications Before (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002506715A Expired - Lifetime JP5102928B2 (ja) | 2000-06-30 | 2001-06-15 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2012144570A Expired - Lifetime JP5469706B2 (ja) | 2000-06-30 | 2012-06-27 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2013213276A Withdrawn JP2014005304A (ja) | 2000-06-30 | 2013-10-11 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2015087012A Withdrawn JP2015178501A (ja) | 2000-06-30 | 2015-04-21 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2016192173A Withdrawn JP2017019852A (ja) | 2000-06-30 | 2016-09-29 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
| JP2018156677A Withdrawn JP2018197265A (ja) | 2000-06-30 | 2018-08-23 | 新規な葉酸代謝拮抗薬の組み合わせ療法 |
Country Status (11)
| Country | Link |
|---|---|
| US (4) | US7053065B2 (ja) |
| EP (1) | EP1313508B1 (ja) |
| JP (7) | JP5102928B2 (ja) |
| AT (1) | ATE359823T1 (ja) |
| AU (1) | AU2001269688A1 (ja) |
| CY (1) | CY1107649T1 (ja) |
| DE (1) | DE60127970T2 (ja) |
| DK (1) | DK1313508T5 (ja) |
| ES (1) | ES2284660T3 (ja) |
| PT (1) | PT1313508E (ja) |
| WO (1) | WO2002002093A2 (ja) |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE60127970T2 (de) * | 2000-06-30 | 2007-12-20 | Eli Lilly And Co., Indianapolis | Zusammensetzung, welche ein antifolate und ein methylmalonsäuresenkendes mittel enthält |
| WO2006114115A1 (de) | 2005-04-26 | 2006-11-02 | Trion Pharma Gmbh | Kombination von antikörpern mit glukokortikoiden zur behandlung von krebs |
| AU2007204410A1 (en) * | 2006-01-12 | 2007-07-19 | Novartis Ag | Combination of mTOR inhibitor and antipolate compound |
| WO2010021843A1 (en) * | 2008-08-20 | 2010-02-25 | Eli Lilly And Company | Use of antifolates in patients with detectable levels of tff-1 for the cancer treatment |
| WO2010138955A2 (en) | 2009-05-29 | 2010-12-02 | University Of Florida Research Foundation, Inc. | Methods and compositions for treating neoplasia |
| WO2012088282A1 (en) | 2010-12-21 | 2012-06-28 | Nektar Therapeutics | Multi-arm polymeric prodrug conjugates of pemetrexed-based compounds |
| EP2854768B2 (en) | 2012-05-30 | 2025-06-18 | Fresenius Kabi Oncology Limited | Pharmaceutical compositions of pemetrexed |
| SG11201609981RA (en) * | 2014-06-04 | 2016-12-29 | Thomas Helledays Stiftelse För Medicinsk Forskning | Mth1 inhibitors for treatment of inflammatory and autoimmune conditions |
| WO2016187413A1 (en) | 2015-05-21 | 2016-11-24 | Musculoskeletal Transplant Foundation | Modified demineralized cortical bone fibers |
| AU2016298439B2 (en) * | 2015-07-30 | 2018-11-08 | Expression Pathology, Inc. | Quantifying FR-alpha and GART proteins for optimal cancer therapy |
| HUE069668T2 (hu) * | 2015-12-07 | 2025-04-28 | General Oncology Inc | Kombináció a metasztatikus rák hatékony kezelésére betegeknél |
| EP4052729A1 (en) | 2016-08-12 | 2022-09-07 | L.E.A.F Holdings Group LLC | Alpha and gamma-d polyglutamated antifolates and uses thereof |
| WO2018031968A1 (en) | 2016-08-12 | 2018-02-15 | L.E.A.F. Holdings Group Llc | Alpha and gamma-d polyglutamated antifolates and uses thereof |
| US11584733B2 (en) | 2017-01-09 | 2023-02-21 | Shuttle Pharmaceuticals, Inc. | Selective histone deacetylase inhibitors for the treatment of human disease |
| ES2914123T3 (es) | 2017-01-09 | 2022-06-07 | Shuttle Pharmaceuticals Inc | Inhibidores selectivos de la histona desacetilasa para el tratamiento de una enfermedad humana |
| ES2983284T3 (es) | 2018-01-09 | 2024-10-22 | Shuttle Pharmaceuticals Inc | Inhibidores selectivos de histona deacetilasa para el tratamiento de enfermedades humanas |
| WO2019157133A1 (en) | 2018-02-07 | 2019-08-15 | L.E.A.F. Holdings Group Llc | Alpha polyglutamated raltitrexed and uses thereof |
| WO2019157129A1 (en) | 2018-02-07 | 2019-08-15 | L.E.A.F. Holdings Group Llc | Alpha polyglutamated pralatrexate and uses thereof |
| CA3090384A1 (en) | 2018-02-07 | 2019-08-15 | L.E.A.F. Holdings Group Llc | Alpha polyglutamated aminopterin and uses thereof |
| WO2019157138A1 (en) | 2018-02-07 | 2019-08-15 | L.E.A.F. Holdings Group Llc | Alpha polyglutamated pemetrexed and uses thereof |
| US12220431B2 (en) | 2018-02-07 | 2025-02-11 | L.E.A.F. Holdings Group Llc | Gamma polyglutamated antifolates and uses thereof |
| CN111936146A (zh) | 2018-02-07 | 2020-11-13 | L.E.A.F.控股集团公司 | α聚谷氨酸化四氢叶酸及其用途 |
| CN111867593A (zh) | 2018-02-07 | 2020-10-30 | L.E.A.F.控股集团公司 | α聚谷氨酸化抗叶酸剂及其用途 |
| EP3749318A4 (en) | 2018-02-07 | 2022-07-06 | L.E.A.F Holdings Group LLC | GAMMA-POLYGLUTAMATED RALTITREXED AND ITS USES |
| JP7490239B2 (ja) | 2018-02-07 | 2024-05-27 | エル.イー.エー.エフ. ホールディングス グループ エルエルシー | ガンマポリグルタミン酸化ペメトレキセドおよびその使用 |
| EP3749312A4 (en) | 2018-02-07 | 2022-02-23 | L.E.A.F Holdings Group LLC | ALPHA-POLYGLUTAMATED LOMETREXOLE AND USES THEREOF |
| WO2019157125A1 (en) | 2018-02-07 | 2019-08-15 | L.E.A.F. Holdings Group Llc | Alpha polyglutamated methotrexate and uses thereof |
| JP7462950B2 (ja) | 2018-02-14 | 2024-04-08 | エル.イー.エー.エフ. ホールディングス グループ エルエルシー | ガンマポリグルタミン酸化メトトレキセートおよびその使用 |
| US12048767B2 (en) | 2018-02-14 | 2024-07-30 | L.E.A.F. Holdings Group Llc | Gamma polyglutamated pralatrexate and uses thereof |
| EP3752157A4 (en) | 2018-02-14 | 2022-07-06 | L.E.A.F Holdings Group LLC | GAMMA-POLYGLUTAMATED LOMETREXOLE AND USES THEREOF |
| EP3755335A4 (en) | 2018-02-14 | 2022-06-22 | L.E.A.F Holdings Group LLC | GAMMA POLYGLUTAMIC TETRAHYDROFOLATES AND THEIR USES |
| US12350271B2 (en) | 2018-02-14 | 2025-07-08 | L.E.A.F. Holdings Group Llc | Gamma polyglutamated aminopterin and uses thereof |
| WO2023177894A1 (en) | 2022-03-18 | 2023-09-21 | Ideaya Biosciences, Inc. | Combination therapy comprising a mat2a inhibitor and an antimetabolite agent |
| WO2025247952A1 (en) * | 2024-05-30 | 2025-12-04 | Université De Fribourg | Inhibition of cyanide overproduction for the therapy of down syndrome and nonketotic hyperglycinemia |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US216350A (en) * | 1879-06-10 | Improvement in car-replacers | ||
| US225030A (en) * | 1880-03-02 | Rotary engine | ||
| US2920015A (en) * | 1957-08-27 | 1960-01-05 | Armour & Co | Long-acting vitamin b12 |
| CH605550A5 (ja) * | 1972-06-08 | 1978-09-29 | Research Corp | |
| US5563126A (en) * | 1986-11-20 | 1996-10-08 | Metabolite Laboratories | Method for treatment and prevention of deficiencies of vitamins B12, folic acid, and B6 |
| JP2962755B2 (ja) * | 1989-02-28 | 1999-10-12 | 帝人株式会社 | 新規ビタミンb▲下1▼▲下2▼誘導体、その製造方法並びにその用途 |
| US5405839A (en) * | 1989-02-28 | 1995-04-11 | Teijin Limited | Vitamin B12 derivative, preparation process thereof, and use thereof |
| KR0162654B1 (ko) * | 1989-12-11 | 1998-11-16 | 알렌 제이. 시니스갤리 | N-(피롤로[2,3-d]피리미딘-3-일아크릴)-글루타민산 유도체 |
| DK0505640T4 (da) * | 1991-03-29 | 2002-12-16 | Lilly Co Eli | Forbedret terapeutisk metode |
| JPH05163160A (ja) * | 1991-12-13 | 1993-06-29 | Snow Brand Milk Prod Co Ltd | 免疫低下に伴う感染症の予防及び治療用栄養剤 |
| US6207651B1 (en) | 1996-08-02 | 2001-03-27 | Metabolite Laboratories | Method for treatment and prevention of deficiencies of vitamins B12, folic acid, and B6 |
| ATE225799T1 (de) | 1994-04-08 | 2002-10-15 | Receptagen Corp | Rezeptor modulierendes mitteln und entsprechendes verfahren |
| AU3972195A (en) * | 1994-10-12 | 1996-05-06 | Research & Diagnostics Systems, Inc. | Reticulocyte assay control |
| DE60127970T2 (de) * | 2000-06-30 | 2007-12-20 | Eli Lilly And Co., Indianapolis | Zusammensetzung, welche ein antifolate und ein methylmalonsäuresenkendes mittel enthält |
| US20040005311A1 (en) * | 2001-07-20 | 2004-01-08 | Pitman Bradford D. | Dietary supplement compositions |
-
2001
- 2001-06-15 DE DE60127970T patent/DE60127970T2/de not_active Expired - Lifetime
- 2001-06-15 DK DK01948214.0T patent/DK1313508T5/da active
- 2001-06-15 AT AT01948214T patent/ATE359823T1/de active
- 2001-06-15 JP JP2002506715A patent/JP5102928B2/ja not_active Expired - Lifetime
- 2001-06-15 PT PT01948214T patent/PT1313508E/pt unknown
- 2001-06-15 EP EP01948214A patent/EP1313508B1/en not_active Expired - Lifetime
- 2001-06-15 AU AU2001269688A patent/AU2001269688A1/en not_active Abandoned
- 2001-06-15 WO PCT/US2001/014860 patent/WO2002002093A2/en not_active Ceased
- 2001-06-15 US US10/297,821 patent/US7053065B2/en not_active Expired - Lifetime
- 2001-06-15 ES ES01948214T patent/ES2284660T3/es not_active Expired - Lifetime
-
2005
- 2005-11-29 US US11/288,807 patent/US20060079480A1/en not_active Abandoned
-
2007
- 2007-06-07 CY CY20071100756T patent/CY1107649T1/el unknown
- 2007-07-11 US US11/776,329 patent/US7772209B2/en not_active Expired - Fee Related
-
2010
- 2010-04-28 US US12/768,920 patent/US20100210583A1/en not_active Abandoned
-
2012
- 2012-06-27 JP JP2012144570A patent/JP5469706B2/ja not_active Expired - Lifetime
-
2013
- 2013-10-11 JP JP2013213276A patent/JP2014005304A/ja not_active Withdrawn
-
2015
- 2015-04-21 JP JP2015087012A patent/JP2015178501A/ja not_active Withdrawn
-
2016
- 2016-09-29 JP JP2016192173A patent/JP2017019852A/ja not_active Withdrawn
-
2018
- 2018-08-23 JP JP2018156677A patent/JP2018197265A/ja not_active Withdrawn
-
2020
- 2020-04-14 JP JP2020072098A patent/JP2020117536A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| ATE359823T1 (de) | 2007-05-15 |
| DK1313508T3 (da) | 2007-08-06 |
| JP2018197265A (ja) | 2018-12-13 |
| EP1313508A2 (en) | 2003-05-28 |
| JP2017019852A (ja) | 2017-01-26 |
| EP1313508B1 (en) | 2007-04-18 |
| JP5102928B2 (ja) | 2012-12-19 |
| WO2002002093A2 (en) | 2002-01-10 |
| DK1313508T5 (da) | 2017-03-20 |
| US20030212038A1 (en) | 2003-11-13 |
| US20060079480A1 (en) | 2006-04-13 |
| DE60127970D1 (de) | 2007-05-31 |
| US20100210583A1 (en) | 2010-08-19 |
| CY1107649T1 (el) | 2013-04-18 |
| PT1313508E (pt) | 2007-06-21 |
| JP2012180381A (ja) | 2012-09-20 |
| US7772209B2 (en) | 2010-08-10 |
| US7053065B2 (en) | 2006-05-30 |
| JP2015178501A (ja) | 2015-10-08 |
| JP2004501964A (ja) | 2004-01-22 |
| AU2001269688A1 (en) | 2002-01-14 |
| JP2014005304A (ja) | 2014-01-16 |
| US20080032948A1 (en) | 2008-02-07 |
| ES2284660T3 (es) | 2007-11-16 |
| WO2002002093A3 (en) | 2003-02-06 |
| JP5469706B2 (ja) | 2014-04-16 |
| DE60127970T2 (de) | 2007-12-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2020117536A (ja) | 新規な葉酸代謝拮抗薬の組み合わせ療法 | |
| CA2450777C (en) | Use of c-src inhibitors alone or in combination with sti571 for the treatment of leukaemia | |
| van den Bogaert et al. | Pemetrexed maintenance therapy in patients with malignant pleural mesothelioma | |
| DE60202278T2 (de) | Aktivierung natürlicher killerzellen durch adenosin-a3-rezeptoragonisten | |
| de Rouw et al. | Mechanisms, management and prevention of pemetrexed-related toxicity | |
| JP2002528507A (ja) | 神経疾患および病態心理学的疾患の治療および予防用の組成物 | |
| TWI233359B (en) | Pharmaceutical composition for treating neoplasm | |
| EP2034978A1 (en) | Organic compounds | |
| Davis et al. | Pharmacology of therapeutic agents in photomedicine | |
| US5217974A (en) | Method for treating gar-transformylase tumors in mammals and reducing mammalian toxicity | |
| Lennard et al. | The effect of folate supplements on 6-mercaptopurine remission maintenance therapy in childhood leukaemia | |
| Nobile et al. | Phase II study with high-dose N5–10-methyltetrahydrofolate and 5-fluorouracil in advanced colorectal cancer | |
| DE DK et al. | ZUSAMMENSETZUNG, WELCHE EIN ANTIFOLATE UND EIN METHYLMALONSÄURESENKENDES MITTEL ENTHÄLT COMPOSITION COMPRENANT UN ANTIFOLATE ET UN AGENT REDUCTEUR D’ACIDE METHYLMALONIQUE | |
| EP0505640B2 (en) | Improved therapeutic method | |
| HK1146804A (en) | Use of c-src inhibitors alone or in combination with sti571 for the treatment of leukaemia |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200511 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200511 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210511 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210810 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20211130 |