JP2019512210A - Egfl6特異的モノクローナル抗体及びそれらの使用方法 - Google Patents
Egfl6特異的モノクローナル抗体及びそれらの使用方法 Download PDFInfo
- Publication number
- JP2019512210A JP2019512210A JP2018540833A JP2018540833A JP2019512210A JP 2019512210 A JP2019512210 A JP 2019512210A JP 2018540833 A JP2018540833 A JP 2018540833A JP 2018540833 A JP2018540833 A JP 2018540833A JP 2019512210 A JP2019512210 A JP 2019512210A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- cdr
- domain
- antibody
- cancer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6843—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1136—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against growth factors, growth regulators, cytokines, lymphokines or hormones
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57449—Specifically defined cancers of ovaries
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6854—Immunoglobulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/475—Assays involving growth factors
- G01N2333/485—Epidermal growth factor [EGF] (urogastrone)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Zoology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- General Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Epidemiology (AREA)
- Endocrinology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Plant Pathology (AREA)
- Hospice & Palliative Care (AREA)
- Oncology (AREA)
Abstract
Description
1.発明の分野
本発明は、一般的には癌生物学の分野に関する。より具体的には、癌の治療及び検出のためのEGFL6を標的とするモノクローナル抗体に関する。
ヒト上皮増殖因子(EGF)様ドメイン6(EGFL6)は、腫瘍及び胎児組織中で最初に発見され、EGF反復スーパーファミリーのメンバーである。EGFL6は、4つと半分のEGF様反復ドメイン、2つのN結合グリコシル化部位、1つのインテグリン関連モチーフ(RGD)、チロシンリン酸化部位、及びMAMドメインを有する分泌タンパク質として同定された(Yeung et al.,1999)。研究は、EGFL6の高発現が、卵巣癌及び肺癌のような特定の癌タイプにおける腫瘍組織と関連していることを示し、健康な成人組織中で見られる発現は限られていた(Buckanovich et al.,2007、Chim et al.,2011、及びOberauer et al.,2010)。しかしながら、EGFL6陽性癌の治療のための試薬及び療法の必要性が残っている。
EGFL6は、創傷治癒に関与するEGF反復スーパーファミリーのメンバーである。しかしながら、高いEGFL6は、卵巣癌及び肺癌のような、様々な癌細胞タイプにおいても見出された。本明細書における研究は、EGFL6活性の阻害が腫瘍組織において癌細胞増殖及び血管新生を阻害するのに効果的であることを示す。また、ここで提供されるEGFL6結合抗体は、EGFL6活性及び癌細胞増殖を阻害するのに効果的であることが見出された。よって、実施形態の抗体は、癌を治療及び血管新生を阻害するための新たな効果的な方法を提供する。
特定の実施形態では、EGFL6タンパク質の少なくとも一部分に結合し、EGFL6シグナル伝達及び癌細胞増殖を阻害する、抗体またはその断片が考慮される。本明細書で使用されるとき、「抗体」という用語は、IgG、IgM、IgA、IgD、IgE、及び遺伝的に修飾されたIgGのような、いずれかの免疫学的結合剤、ならびに抗原結合活性を保持する抗体CDRドメインを含むポリペプチドを広く指すことが意図される。抗体は、キメラ抗体、親和性成熟抗体、ポリクロナール抗体、モノクローナル抗体、ヒト化抗体、ヒト抗体、または抗原結合抗体断片または天然もしくは合成配位子からなる群から選択され得る。好ましくは、抗EGFL6抗体は、モノクローナル抗体またはヒト化抗体である。
本実施形態の特定の態様を使用して、EGFL6シグナル伝達に関連した疾患または障害を予防または治療することができる。EGFL6のシグナル伝達は、いずれかの適切な薬物により低減され、癌細胞増殖が防止され得る。好ましくは、こうした物質は、抗EGFL6抗体であろう。
阻害抗体を含有する治療組成物の臨床適用が行われる場合、一般的には、意図される適用に適した薬学的または治療組成物を調製するのが有益であろう。特定の実施形態では、薬学的組成物は、例えば、少なくとも約0.1%の活性化合物を含み得る。他の実施形態では、活性化合物は、単位の重量の約2%〜約75%、または、例えば、約25%〜約60%、及びその中で誘導可能ないずれかの範囲を含み得る。
特定の実施形態では、本実施形態の組成物及び方法は、第2のまたは追加の療法と組み合わせた、癌細胞増殖におけるその活性を阻害するEGFL6に対する抗体または抗体断片を含む。こうした療法は、EGFL6媒介性細胞増殖に関連したいずれかの疾患の治療において適用することができる。例えば、疾患は、癌であり得る。
本実施形態に従って多種多様な化学療法剤が使用され得る。「化学療法」という用語は、癌を治療するための薬物の使用を指す。「化学療法剤」は、癌の治療において投与される化合物または組成物を示すのに使用される。これらの薬剤または薬物は、細胞内でのそれらの活性モード、例えば、それらが細胞周期に影響を及ぼすか、及びどのステージで影響を及ぼすかにより分類される。あるいは、薬剤は、DNAに直接架橋、DNAにインターカレート、または核酸合成に影響を及ぼすことにより染色体及び有糸分裂異常を誘発するその能力に基づいて特徴付けられ得る。
DNA損傷を引き起こし、広く使用されている他の因子は、γ線、X線、及び/または腫瘍細胞への放射性同位体の特異的送達として一般的に知られているものを含む。マイクロ波、プロトンビーム照射(米国特許第5,760,395及び4,870,287号)、及びUV照射のような、DNA損傷因子の他の形態も考慮される。これらの因子の全ては、広範囲のDNA損傷、DNA前駆体、DNA複製及び修復、ならびに染色体の組立て及び維持に影響を及ぼす可能性が最も高い。X線の線量範囲は、長期間(3〜4週間)にわたる50〜200レントゲンの1日線量から、2000〜6000レントゲンの単回線量までに及ぶ。放射性同位体の線量範囲は、広く変動し、同位体の半減期、放出される放射線の強度及びタイプ、ならびに新生細胞による取込みに依存する。
当業者であれば、実施形態の方法と組み合わせて、またはこれらと共に、追加の免疫療法が使用され得ることを理解するであろう。癌治療の文脈において、免疫療法剤は、一般的には、癌細胞を標的化して破壊するための免疫エフェクター細胞及び分子の使用に依存する。リツキシマブ(RITUXAN(登録商標))はこうした例である。免疫エフェクターは、例えば、腫瘍細胞の表面上のいくつかのマーカーに特異的な抗体であり得る。抗体単独では、療法のエフェクターとして作用し得るか、または細胞死滅に実際に影響を及ぼすように他の細胞を動員し得る。抗体はまた、薬物または毒素(化学療法剤、放射性核種、リシンA鎖、コレラ毒素、百日咳毒素、等)と複合され、標的化剤として作用し得る。あるいは、エフェクターは、腫瘍細胞標的と直接または間接のいずれかで相互作用する表面分子を有するリンパ球であり得る。様々なエフェクター細胞は、細胞毒性T細胞及びNK細胞を含む
癌を有する人々の約60%は、予防的、診断的または病期分類、根治、及び姑息手術を含む、何らかのタイプの外科手術を受けるであろう。根治手術は、癌性組織の全部または一部が物理的に除去、摘出、及び/または破壊される切除術を含み、本実施形態の治療、化学療法、放射線療法、ホルモン療法、遺伝子療法、免疫療法、及び/または代替療法のような、他の療法と共に使用され得る。腫瘍切除術とは、腫瘍の少なくとも一部の物理的な除去を指す。腫瘍切除術に加えて、外科手術による治療は、レーザー手術、凍結手術、電気手術、及び微視的制御手術(モース手術)を含む。
処置の治療有効性を向上させるために本実施形態の特定の態様と組み合わせて他の薬剤が使用され得ることが考慮されている。これらの追加の薬剤としては、細胞表面受容体及びGAP結合の上方調節に影響を及ぼす薬剤、細胞増殖抑制剤及び分化剤、細胞接着の阻害剤、過剰増殖細胞のアポトーシス誘発因子に対する感受性を増加させる薬剤、または他の生物学的薬剤が挙げられる。GAP結合の数を増やすことによる細胞間シグナル伝達の増加は、隣接する過剰増殖細胞集団に対する抗過剰増殖効果を増加させるであろう。他の実施形態では、細胞増殖抑制剤または分化剤は、治療の抗過剰増殖有効性を向上させるために本実施形態の特定の態様と組み合わせて使用することができる。細胞接着の阻害剤は、本実施形態の有効性を向上させると考えられる。細胞接着阻害剤の例としては、局所接着キナーゼ(FAK)阻害剤及びロバスタチンがある。抗体c225のような、過剰増殖細胞のアポトーシスに対する感受性を増加させる他の薬剤を、治療有効性を向上させるために本実施形態の特定の態様と組み合わせて使用することができることは、さらに考慮されている。
実施形態の様々な態様では、キットは、治療薬及び/または他の治療及び送達剤を含有すると想定される。いくつかの実施形態では、本実施形態は、実施形態の療法を調製及び/または投与するためのキットについて考慮する。キットは、本実施形態の薬学的組成物のうちのいずれかを含有する1つ以上の封止されたバイアルを含み得る。キットは、例えば、少なくとも1つのEGFL6抗体ならびに実施形態の成分を調製、配合、及び/もしくは投与するか、または本発明の方法の1つ以上のステップを行うための試薬を含み得る。いくつかの実施形態では、キットは、エッペンドルフチューブ、アッセイプレート、シリンジ、ボトル、またはチューブのような、キットの成分と反応しない容器である、適切な容器も含み得る。容器は、プラスチックまたはガラスのような殺菌可能な材料から作製され得る。
本発明の好ましい実施形態を示すために下記の実施例が含まれる。下記の実施例において開示される技法は、発明者により本発明の実施において十分に機能することが見出された技法を表し、よってその実施に好ましいモードを構成するものとみなすことができることが、当業者により理解されるべきである。しかしながら、当業者であれば、本開示に照らして、開示される具体的な実施形態において、本発明の精神及び範囲から逸脱することなく、多くの変更を行い、依然として同様または類似の結果を得ることができることを理解すべきである。
EGFL6(Genebankアクセッション#Q8IUX8)タンパク質を使用して、RevMAb Biosciences USA,Inc.でニュージーランドウサギを免疫化した。抗EGFL6血清の力価を、EGFL6タンパク質を96ウェルプレート(max−sorbプレート、Nunc)にコーティングすることによる結合についてのELISAにおける血清の一連の希釈により決定し、ホースラディッシュペルオキシダーゼ(HRP)及びTMB基質と複合された抗ウサギ抗体で検出した。2〜3回の追加の免疫化後、力価は>106に到達し、末梢血試料を、蛍光補助細胞選別(FACS)装置(BD FACSAria(商標)III、BD Biosciences)を使用して、調製されたばかりの末梢血単核細胞(PBMC)からのB細胞(CD45+CD5−CD19+)単離のために、免疫化ウサギから回収した。単離B細胞を単一B細胞として播種し、7〜10日間培養した。培養上清をEGFL6結合について分析した。陽性ウェルからの細胞を溶解し、トータルRNAを単離し、スーパースクリプト逆転写酵素II(Invitrogen)を製造業者の指示に従って使用してcDNAを合成した。重鎖及び軽鎖の両方からの抗体可変領域のDNA配列を、設計されたプライマーのセットを使用してポリメラーゼ連鎖反応(PCR)により増幅し、配列決定した。DNA及びアミノ酸配列の両方を下のセクションV.に挙げる。抗EGFL6モノクローナル抗体のCDRを、IMGTプログラムを使用して同定し、表1及び2に挙げる。
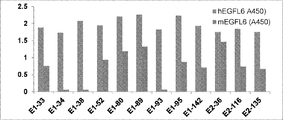
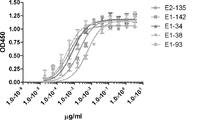
モノクローナル抗体によるEGFL6の結合を、B細胞培養物から回収された上清を使用するELISAによりまずスクリーニングした(図2)。ELISA滴定を使用して、モノクローナル抗体のパネルのEGFL6抗原に対する結合親和性を決定した(図3)。モノクローナル抗体のパネルの結合定数(KD及び/またはEC50)を、Prism GraphPadプログラムで4パラメータ曲線フィッティングを使用して推定した。Biacore分析について、全ての実験を25℃、45μl/分の流量で行った。抗ヒトIgGFc抗体(ThermoFisher製、酢酸緩衝液中で各々50μg/ml、pH5.0)を、製造業者からの指示に基づくアミンカップリング手順を使用して、カルボキシメチルデキストランセンサーチップ(CM5)上に固定した。試験される精製ウサギ/ヒトキメラ抗体を、0.5%P20、HBS−EP緩衝液中5μg/mlの濃度で希釈し、500〜1000RUに到達するようにFC2に注入した。FC1を参照細胞として使用した。特異的なシグナルは、FC2対FC1で得られるシグナルの相違に対応する。分析物(組換えヒトEGFL6、SDS−PAGEゲル上の見かけ分子量60kDa)を、90秒間、0.5%P20、HBS−EP緩衝液中での一連の濃度希釈(100、50、25、12.5、6.25、及び3.13、1.56nM)で注入した。これらの濃度は、0.5%P20、HBS−EP中のストック溶液から調製した。分析物の解離フェーズを、30分間にわたりモニタリングした。ランニング緩衝液も、二重参照として同じ条件下で注入した。各ランニングサイクル後、両方のフローセルを、20〜45μlのグリシン−HCl緩衝液pH1.5を注入することにより再生成した。EGFL6に対する結合KDを、各EGFL6モノクローナル抗体についてのkオフ/kオン速度により計算した(表3)。
細胞株及び培養:ヒト上皮性卵巣癌細胞株、SKOV3ip1及びA2780ip2を、記載されるように維持した(Sood,A.K.et al.Molecular determinants of ovarian cancer plasticity.American Journal of Pathology 158,1279−1288,2001)。ヒト不死化臍帯内皮細胞(RF24)を、補充物(ピルビン酸ナトリウム、非必須アミノ酸、MEMビタミン、及びグルタミン、Life Technologies)を含むMEM培地において増殖させた。マウス卵巣内皮細胞(MOEC)の誘導及び特徴分析については、以前に記載されている(Langley,R.R.et al.Tissue−specific microvascular endothelial cell lines from H−2K(b)−tsA58 mice for studies of angiogenesis and metastasis.Cancer Research 63,2971−2976,2003)。細胞培養物を、95%湿度を含む5%CO2インキュベーター中、37℃で維持した。インビボ注入のために、細胞をトリプシン処理し、1,200rpmで5分間4℃で遠心分離し、PBSで2回洗浄し、無血清ハンクス平衡塩溶液(Life Technologies,Grand Island,NY,USA)中で再構成した。(トリパンブルー色素排除により決定される)95%超の生存率を有する単細胞懸濁液のみを、インビボ腹腔内注入に使用した。
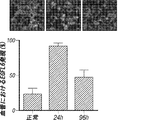
5個の正常卵巣、5個の創傷組織試料、及び10個の侵襲性上皮性卵巣腫瘍を入手し、陰性及び陽性免疫選別を行った。マイクロアレイ分析を実施する前に、内皮細胞について全ての試料の純度を、内皮細胞マーカーP1H12及びフォンウィレブランド因子を使用して確立した(図4A)。免疫染色は、免疫精製技法が、全ての試料において>95%の内皮細胞純度をもたらしたことを明らかにした。データの分析は、375個の遺伝子が、正常及び創傷内皮細胞と比較して、卵巣腫瘍内皮細胞において上方調節されたことを明らかにした(図4B)。とりわけ、EGFL6は、正常及び創傷内皮細胞と比較して、腫瘍内皮細胞において最も高い分化発現を示した(図4B)。卵巣患者試料におけるEGFL6、VEGF、及びCD31の発現を決定した(図4C)。この結果をさらに検証するために、内皮細胞を正常卵巣、卵巣腫瘍、及び創傷治癒組織から単離し、EGFL6の発現を、PCRを使用して決定した。EGFL6は、主に、正常または創傷内皮細胞と比較して、腫瘍内皮細胞においてのみ過剰発現した(図4D)。腫瘍内皮細胞におけるEGFL6上方調節も示された。EGFL6は、内皮細胞及び試験される卵巣癌細胞のほとんどにおいて発現した。腫瘍血管新生におけるEGFL6の役割を示すために、RF24細胞をsiEGFL6で処理し、これは対照細胞と比較して72時間でのタンパク質レベルにおいて80%超のノックダウンをもたらした。EGFL6 siRNA処理細胞は、対照siRNA処理細胞と比較して、顕著に少ない遊走及びチューブ形成を示し、血管新生におけるEGFL6の重要性を示した。
創傷治癒におけるEGFL6の役割は、ヒト皮膚微小血管内皮細胞(HDMEC)を使用して、形成された創傷を使用して説明された。創傷治癒に対する効果を、下記の手順を使用して行った。1日目に、SKOV3ip1細胞をヌードマウスに注入し、2日目に、創傷を腫瘍保有マウスの背中に形成した(2cm×2cm)。動物をランダムに2つのグループ(n=10)に分け、一方に対照抗体を投与し、他方のグループのマウスをEGFL6抗体で処理した。抗体処理を3日目に開始し、週1回行った(5mg/kg)。創傷(面積=長さ×幅)を、2週間にわたり創傷治癒の完了までモニタリングした。EGFL6抗体は、インビボ研究において創傷治癒を使用して試験される場合、創傷治癒を妨げなかった(図9C)。
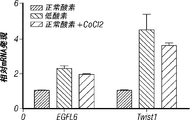
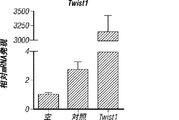
EGFL6が低酸素条件下で内皮細胞の増加した生存率をもたらすことを確立するために、EGFL6を、EGFL6 siRNAを使用して低酸素状態で低酸素RF24細胞においてサイレンシングし、細胞死を調査した。図6Aに示されるように、細胞のほぼ50%は、正常酸素と比較して低酸素で5日後も生存した。これとは対照的に、低酸素におけるEGFL6遺伝子サイレンシングは、低酸素及び正常酸素条件下の未処理細胞と比較して75%の細胞死をもたらした(図6H)。マウスの後肢の大腿動脈を摘出することにより、マウスにおいて後肢虚血を形成し、これは後肢への血液及び酸素供給の遮断をもたらした(図6I)。図6J〜6Kに示されるように、虚血マウスは、MVD(血管)の顕著な低減及び内皮細胞におけるEGFL6発現の増加を示した。RF24細胞の遊走(図12C)及びチューブ形成(図12D)は、EGFL6での処理後に増加した。
遺伝子サイレンシングにおけるEGFL6の治療有効性を、2つの同所性卵巣癌腫瘍モデル、SKOV3ip1及びOVCAR5を使用して研究した。雌無胸腺ヌードマウス(NCr−nu)は、NCI−Frederick Cancer Research and Development Center(Frederick,MD)から購入し、全てのマウス研究は、施設内動物実験委員会により承認された。マウスは、American Association for Accreditation of Laboratory Animal Care及びUS Public Health Service Policy on Human Care and Use of Laboratory Animalsにより記載されるガイドラインに従って飼育された。腫瘍細胞注入について、SKOV3ip1細胞(1×106)を腹腔内(i.p)経路を通して注入した。抗体処理グループについて、精製モノクローナル抗体を、5週間にわたり週1回5mg/kg体重で投与した。犠死時、マウス及び腫瘍重量、腫瘍の数及び分布を記録した。解剖を行った個人には処理グループ割り当てがわからないようにした。組織検体を、ホルマリン、OCT(Miles,Inc.,Elkhart,IN)、または液体窒素中での急速凍結のいずれかで固定した。
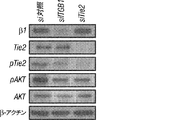
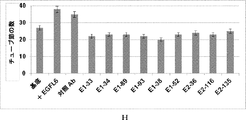
EGFL6遮断がその血管新生媒介性機能に影響を及ぼすであろうことを示すために、EGFL6機能的遮断抗体を開発し、血管新生に対するその活性について試験した。ヒト及びマウスEGFL6に結合したいくつかのEGFL6抗体クローンを同等の親和性でスクリーニングした。2つの抗体(93及び135)は、全ての結合親和性及びインビトロ活性基準を満たし、さらなる研究を実施するのに選択された。図8Bに示されるように、内皮細胞のEGFL6組換えタンパク質での処理は、リン酸化Tie2及びAKTタンパク質の両方の発現を増加させた。これとは対照的に、EGFL6遮断抗体93及び135は、両方のリン酸化タンパク質の発現の低減をもたらした。図8D〜Eに示されるように、内皮細胞のEGFL6組換えタンパク質での処理は、これらの細胞における遊走及びチューブ形成を向上させた。しかしながら、チューブ形成及び遊走の両方のEGFL6媒介性機能効果は、EGFL6遮断抗体により顕著に低減された。
上で報告されたEGFL6のインビトロ活性は、EGFL6機能の遮断が、腫瘍血管を損傷する能力を向上させ、これにより抗腫瘍有効性を増加させるであろうことを示した。これを試験するために、EGFL6の活性を遮断し、血管新生及び腫瘍増殖及び血管新生を阻害するEGFL6の能力について調査した。
抗EGFL6抗体の可変DNA配列を下に示す。
Claims (55)
- 単離モノクローナル抗体であって、前記抗体が、EGFL6に特異的に結合し、
(I)
(a)第1のVHCDRが配列番号4と同一であることと、
(b)第2のVHCDRが配列番号5と同一であることと、
(c)第3のVHCDRが配列番号6と同一であることと、
(d)第1のVLCDRが配列番号76と同一であることと、
(e)第2のVLCDRが配列番号77と同一であることと、
(f)第3のVLCDRが配列番号78と同一であること、
(II)
(a)第1のVHCDRが配列番号10と同一であることと、
(b)第2のVHCDRが配列番号11と同一であることと、
(c)第3のVHCDRが配列番号12と同一であることと、
(d)第1のVLCDRが配列番号82と同一であることと、
(e)第2のVLCDRが配列番号83と同一であることと、
(f)第3のVLCDRが配列番号84と同一であること、
(III)
(a)第1のVHCDRが配列番号16と同一であることと、
(b)第2のVHCDRが配列番号17と同一であることと、
(c)第3のVHCDRが配列番号18と同一であることと、
(d)第1のVLCDRが配列番号88と同一であることと、
(e)第2のVLCDRが配列番号77と同一であることと、
(f)第3のVLCDRが配列番号89と同一であること、
(IV)
(a)第1のVHCDRが配列番号22と同一であることと、
(b)第2のVHCDRが配列番号23と同一であることと、
(c)第3のVHCDRが配列番号24と同一であることと、
(d)第1のVLCDRが配列番号93と同一であることと、
(e)第2のVLCDRが配列番号94と同一であることと、
(f)第3のVLCDRが配列番号95と同一であること、
(V)
(a)第1のVHCDRが配列番号28と同一であることと、
(b)第2のVHCDRが配列番号29と同一であることと、
(c)第3のVHCDRが配列番号30と同一であることと、
(d)第1のVLCDRが配列番号99と同一であることと、
(e)第2のVLCDRが配列番号100と同一であることと、
(f)第3のVLCDRが配列番号101と同一であること、
(VI)
(a)第1のVHCDRが配列番号34と同一であることと、
(b)第2のVHCDRが配列番号35と同一であることと、
(c)第3のVHCDRが配列番号36と同一であることと、
(d)第1のVLCDRが配列番号104と同一であることと、
(e)第2のVLCDRが配列番号100と同一であることと、
(f)第3のVLCDRが配列番号105と同一であること、
(VII)
(a)第1のVHCDRが配列番号40と同一であることと、
(b)第2のVHCDRが配列番号41と同一であることと、
(c)第3のVHCDRが配列番号42と同一であることと、
(d)第1のVLCDRが配列番号108と同一であることと、
(e)第2のVLCDRが配列番号77と同一であることと、
(f)第3のVLCDRが配列番号109と同一であること、
(VIII)
(a)第1のVHCDRが配列番号46と同一であることと、
(b)第2のVHCDRが配列番号47と同一であることと、
(c)第3のVHCDRが配列番号48と同一であることと、
(d)第1のVLCDRが配列番号113と同一であることと、
(e)第2のVLCDRが配列番号83と同一であることと、
(f)第3のVLCDRが配列番号114と同一であること、
(IX)
(a)第1のVHCDRが配列番号52と同一であることと、
(b)第2のVHCDRが配列番号53と同一であることと、
(c)第3のVHCDRが配列番号54と同一であることと、
(d)第1のVLCDRが配列番号117と同一であることと、
(e)第2のVLCDRが配列番号83と同一であることと、
(f)第3のVLCDRが配列番号119と同一であること、
(X)
(a)第1のVHCDRが配列番号58と同一であることと、
(b)第2のVHCDRが配列番号59と同一であることと、
(c)第3のVHCDRが配列番号60と同一であることと、
(d)第1のVLCDRが配列番号121と同一であることと、
(e)第2のVLCDRが配列番号100と同一であることと、
(f)第3のVLCDRが配列番号122と同一であること、
(XI)
(a)第1のVHCDRが配列番号64と同一であることと、
(b)第2のVHCDRが配列番号65と同一であることと、
(c)第3のVHCDRが配列番号66と同一であることと、
(d)第1のVLCDRが配列番号126と同一であることと、
(e)第2のVLCDRが配列番号127と同一であることと、
(f)第3のVLCDRが配列番号128と同一であること、または
(XII)
(a)第1のVHCDRが配列番号70と同一であることと、
(b)第2のVHCDRが配列番号71と同一であることと、
(c)第3のVHCDRが配列番号72と同一であることと、
(d)第1のVLCDRが配列番号131と同一であることと、
(e)第2のVLCDRが配列番号100と同一であることと、
(f)第3のVLCDRが配列番号132と同一であること
を含む、単離抗体。 - (a)第1のVHCDRが配列番号4と同一であることと、
(b)第2のVHCDRが配列番号5と同一であることと、
(c)第3のVHCDRが配列番号6と同一であることと、
(d)第1のVLCDRが配列番号76と同一であることと、
(e)第2のVLCDRが配列番号77と同一であることと、
(f)第3のVLCDRが配列番号78と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号10と同一であることと、
(b)第2のVHCDRが配列番号11と同一であることと、
(c)第3のVHCDRが配列番号12と同一であることと、
(d)第1のVLCDRが配列番号82と同一であることと、
(e)第2のVLCDRが配列番号83と同一であることと、
(f)第3のVLCDRが配列番号84と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号16と同一であることと、
(b)第2のVHCDRが配列番号17と同一であることと、
(c)第3のVHCDRが配列番号18と同一であることと、
(d)第1のVLCDRが配列番号88と同一であることと、
(e)第2のVLCDRが配列番号77と同一であることと、
(f)第3のVLCDRが配列番号89と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号22と同一であることと、
(b)第2のVHCDRが配列番号23と同一であることと、
(c)第3のVHCDRが配列番号24と同一であることと、
(d)第1のVLCDRが配列番号93と同一であることと、
(e)第2のVLCDRが配列番号94と同一であることと、
(f)第3のVLCDRが配列番号95と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号28と同一であることと、
(b)第2のVHCDRが配列番号29と同一であることと、
(c)第3のVHCDRが配列番号30と同一であることと、
(d)第1のVLCDRが配列番号99と同一であることと、
(e)第2のVLCDRが配列番号100と同一であることと、
(f)第3のVLCDRが配列番号101と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号34と同一であることと、
(b)第2のVHCDRが配列番号35と同一であることと、
(c)第3のVHCDRが配列番号36と同一であることと、
(d)第1のVLCDRが配列番号104と同一であることと、
(e)第2のVLCDRが配列番号100と同一であることと、
(f)第3のVLCDRが配列番号105と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号40と同一であることと、
(b)第2のVHCDRが配列番号41と同一であることと、
(c)第3のVHCDRが配列番号42と同一であることと、
(d)第1のVLCDRが配列番号108と同一であることと、
(e)第2のVLCDRが配列番号77と同一であることと、
(f)第3のVLCDRが配列番号109と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号46と同一であることと、
(b)第2のVHCDRが配列番号47と同一であることと、
(c)第3のVHCDRが配列番号48と同一であることと、
(d)第1のVLCDRが配列番号113と同一であることと、
(e)第2のVLCDRが配列番号83と同一であることと、
(f)第3のVLCDRが配列番号114と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号52と同一であることと、
(b)第2のVHCDRが配列番号53と同一であることと、
(c)第3のVHCDRが配列番号54と同一であることと、
(d)第1のVLCDRが配列番号117と同一であることと、
(e)第2のVLCDRが配列番号83と同一であることと、
(f)第3のVLCDRが配列番号119と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号58と同一であることと、
(b)第2のVHCDRが配列番号59と同一であることと、
(c)第3のVHCDRが配列番号60と同一であることと、
(d)第1のVLCDRが配列番号121と同一であることと、
(e)第2のVLCDRが配列番号100と同一であることと、
(f)第3のVLCDRが配列番号122と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号64と同一であることと、
(b)第2のVHCDRが配列番号65と同一であることと、
(c)第3のVHCDRが配列番号66と同一であることと、
(d)第1のVLCDRが配列番号126と同一であることと、
(e)第2のVLCDRが配列番号127と同一であることと、
(f)第3のVLCDRが配列番号128と同一であること
を含む、請求項1に記載の単離抗体。 - (a)第1のVHCDRが配列番号70と同一であることと、
(b)第2のVHCDRが配列番号71と同一であることと、
(c)第3のVHCDRが配列番号72と同一であることと、
(d)第1のVLCDRが配列番号131と同一であることと、
(e)第2のVLCDRが配列番号100と同一であることと、
(f)第3のVLCDRが配列番号132と同一であること
を含む、請求項1に記載の単離抗体。 - (i)E1−33(配列番号157)のVHドメインもしくはE1−33mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE1−33(配列番号158)のVLドメインもしくはE1−33mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(ii)E1−34(配列番号159)のVHドメインもしくはE1−34mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE1−34(配列番号160)のVLドメインもしくはE1−34mAのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(iii)E1−80(配列番号161)のVHドメインもしくはE1−80mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE1−80(配列番号162)のVLドメインもしくはE1−80mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(iv)E1−89(配列番号163)のVHドメインもしくはE1−89mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE1−89(配列番号164)のVLドメインもしくはE1−80mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(v)E2−93(配列番号165)のVHドメインもしくはE2−93mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE2−93(配列番号166)のVLドメインもしくはE2−93mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(vi)E1−38(配列番号167)のVHドメインもしくはE1−38mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE1−38(配列番号168)のVLドメインもしくはE1−38mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(vii)E1−52(配列番号169)のVHドメインもしくはE1−52mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE1−52(配列番号170)のVLドメインもしくはE1−52mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(viii)E2−36(配列番号171)のVHドメインもしくはE2−36mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE2−36(配列番号172)のVLドメインもしくはE2−36mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(ix)E1−95(配列番号173)のVHドメインもしくはE1−95mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE1−95(配列番号174)のVLドメインもしくはE1−95mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(x)E2−116(配列番号175)のVHドメインもしくはE2−116mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE2−116(配列番号176)のVLドメインもしくはE2−116mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、
(xi)E2−135(配列番号177)のVHドメインもしくはE2−135mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE2−135(配列番号178)のVLドメインもしくはE2−135mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン、または
(xii)E1−142(配列番号179)のVHドメインもしくはE1−142mABのヒト化VHドメインと少なくとも約80%同一のVHドメイン、及びE1−142(配列番号180)のVLドメインもしくはE1−142mABのヒト化VLドメインと少なくとも約80%同一のVLドメイン
を含む、請求項1に記載の抗体。 - E1−33(配列番号157)のVHドメインと同一のVHドメインと、E1−33(配列番号158)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E1−34(配列番号159)のVHドメインと同一のVHドメインと、E1−34(配列番号160)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E1−80(配列番号161)のVHドメインと同一のVHドメインと、E1−80(配列番号162)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E1−89(配列番号163)のVHドメインと同一のVHドメインと、E1−89(配列番号164)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E2−93(配列番号165)のVHドメインと同一のVHドメインと、E2−93(配列番号166)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E1−38(配列番号167)のVHドメインと同一のVHドメインと、E1−38(配列番号168)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E1−52(配列番号169)のVHドメインと同一のVHドメインと、E1−52(配列番号170)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E2−36(配列番号171)のVHドメインと同一のVHドメインと、E2−36(配列番号172)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E1−95(配列番号173)のVHドメインと同一のVHドメインと、E1−95(配列番号174)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E2−116(配列番号175)のVHドメインと同一のVHドメインと、E2−116(配列番号176)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E2−135(配列番号177)のVHドメインと同一のVHドメインと、E2−135(配列番号178)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E1−142(配列番号179)のVHドメインと同一のVHドメインと、E1−142(配列番号180)のVLドメインと同一のVLドメインと、を含む、請求項14に記載の抗体。
- E1−33、E1−34、E1−80、E1−89、E2−93、E1−38、E1−52、E2−36、E1−95、E2−116、E2−135、またはE1−142抗体である、請求項14に記載の抗体。
- 組換え体である、請求項1〜27のいずれか一項に記載の抗体。
- IgG、IgM、IgA、またはこれらの抗原結合断片である、請求項1に記載の抗体。
- Fab’、F(ab’)2、F(ab’)3、一価scFv、二価scFv、または単一ドメイン抗体である、請求項1〜27のいずれか一項に記載の抗体。
- ヒト抗体、ヒト化抗体、または脱免疫化抗体である、請求項1〜13のいずれか一項に記載の抗体。
- イメージング剤、化学療法剤、毒素、または放射性核種と複合されている、請求項1〜27のいずれか一項に記載の抗体。
- 毒素と複合されている、請求項32に記載の抗体。
- 前記毒素が、アウリスタチンである、請求項33に記載の抗体。
- 前記毒素が、モノメチルアウリスタチンE(MMAE)である、請求項33に記載の抗体。
- 薬学的に許容される担体中に請求項1〜27のいずれか一項に記載の抗体を含む、組成物。
- 請求項1〜27のいずれか一項に記載の抗体をコードする核酸配列を含む、単離ポリヌクレオチド分子。
- E1−33(配列番号4、5、及び6)のVHドメインのCDR1〜3、
E1−34(配列番号10、11、及び12)のVHドメインのCDR1〜3、
E1−80(配列番号16、17、及び18)のVHドメインのCDR1〜3、
E1−89(配列番号22、23、及び24)のVHドメインのCDR1〜3、
E2−93(配列番号28、29、及び30)のVHドメインのCDR1〜3、
E1−38(配列番号34、35、及び36)のVHドメインのCDR1〜3、
E1−52(配列番号40、41、及び42)のVHドメインのCDR1〜3、
E2−36(配列番号46、47、及び48)のVHドメインのCDR1〜3、
E1−95(配列番号52、53、及び54)のVHドメインのCDR1〜3、
E2−116(配列番号58、59、及び60)のVHドメインのCDR1〜3、
E2−135(配列番号64、65、及び66)のVHドメインのCDR1〜3、または
E1−142(配列番号70、71、及び72)のVHドメインのCDR1〜3
を含む抗体VHドメインを含む、組換えポリペプチド。 - E1−33(配列番号76、77、及び78)のVLドメインのCDR1〜3、
E1−34(配列番号82、83、及び84)のVLドメインのCDR1〜3、
E1−80(配列番号88、77、及び89)のVLドメインのCDR1〜3、
E1−89(配列番号93、94、及び95)のVLドメインのCDR1〜3、
E2−93(配列番号99、100、及び101)のVLドメインのCDR1〜3、
E1−38(配列番号104、100、及び105)のVLドメインのCDR1〜3、
E1−52(配列番号108、77、及び109)のVLドメインのCDR1〜3、
E2−36(配列番号113、83、及び114)のVLドメインのCDR1〜3、
E1−95(配列番号117、83、及び118)のVLドメインのCDR1〜3、
E2−116(配列番号121、100、及び122)のVLドメインのCDR1〜3、
E2−135(配列番号126、127、及び128)のVLドメインのCDR1〜3、または
E1−142(配列番号131、100、及び132)のVLドメインのCDR1〜3
を含む抗体VLドメインを含む、組換えポリペプチド。 - 請求項38または39に記載のポリペプチドをコードする核酸配列を含む、単離ポリヌクレオチド分子。
- 請求項1〜27のいずれか一項に記載の抗体または請求項38または39に記載の組換えポリペプチドをコードする1つ以上のポリヌクレオチド分子を含む、宿主細胞。
- 哺乳動物細胞、酵母細胞、細菌細胞、繊毛虫細胞、または昆虫細胞である、請求項41に記載の宿主細胞。
- (a)細胞中で、請求項1〜27のいずれか一項に記載の抗体のVL及びVH鎖をコードする1つ以上のポリヌクレオチド分子を発現させる段階と、
(b)前記細胞から前記抗体を精製する段階と
を含む、抗体の製造方法。 - 有効量の請求項1〜27のいずれか一項に記載の抗体を対象に投与する段階を含む、癌を有する対象を治療するための方法。
- 前記癌が、乳癌、肺癌、頭頸部癌、前立腺癌、食道癌、気管癌、皮膚癌、脳癌、肝臓癌、膀胱癌、胃癌、膵臓癌、卵巣癌、子宮癌、子宮頸癌、精巣癌、結腸癌、直腸癌、または皮膚癌である、請求項44に記載の方法。
- 前記癌が、上皮癌である、請求項44に記載の方法。
- 前記癌が、結腸直腸腺癌、肺腺癌、肺扁平上皮癌、乳癌、肝細胞癌、卵巣癌、淡明細胞型腎細胞癌、肺癌、または腎臓癌である、請求項44に記載の方法。
- 前記抗体が、薬学的に許容される組成物中にある、請求項44に記載の方法。
- 前記抗体が、全身投与される、請求項44に記載の方法。
- 前記抗体が、静脈内、皮内、腫瘍内、筋肉内、腹腔内、皮下、または局所投与される、請求項44に記載の方法。
- 前記対象に少なくとも第2の抗癌療法を施す段階をさらに含む、請求項44に記載の方法。
- 前記第2の抗癌療法が、外科療法、化学療法、放射線療法、凍結療法、ホルモン療法、免疫療法、またはサイトカイン療法である、請求項51に記載の方法。
- 対象からの試料中の対照と比較して高いEGFL6の存在について試験する段階を含む、対象における癌を検出するための方法であって、
前記試験する段階が、前記試料を請求項14〜27または32のいずれか一項に記載の抗体と接触させることを含む、方法。 - インビトロ方法としてさらに定義される、請求項53に記載の方法。
- (a)E1−33(配列番号4)、E1−34(配列番号10)、E1−80(配列番号16)、E1−89(配列番号22)、E2−93(配列番号28)、E1−38(配列番号34)、E1−52(配列番号40)、E2−36(配列番号46)、E1−95(配列番号52)、E2−116(配列番号58)、E2−135(配列番号64)、またはE1−142(配列番号70)のVHCDR1と少なくとも80%同一の第1のVHCDRと、
(b)E1−33(配列番号5)、E1−34(配列番号11)、E1−80(配列番号17)、E1−89(配列番号23)、E2−93(配列番号29)、E1−38(配列番号35)、E1−52(配列番号41)、E2−36(配列番号47)、E1−95(配列番号53)、E2−116(配列番号59)、E2−135(配列番号65)、またはE1−142(配列番号71)のVHCDR2と少なくとも80%同一の第2のVHCDRと、
(c)E1−33(配列番号6)、E1−34(配列番号12)、E1−80(配列番号18)、E1−89(配列番号24)、E2−93(配列番号30)、E1−38(配列番号36)、E1−52(配列番号42)、E2−36(配列番号48)、E1−95(配列番号54)、E2−116(配列番号60)、E2−135(配列番号66)、またはE1−142(配列番号72)のVHCDR3と少なくとも80%同一の第3のVHCDRと、
(d)E1−33(配列番号76)、E1−34(配列番号82)、E1−80(配列番号88)、E1−89(配列番号93)、E2−93(配列番号99)、E1−38(配列番号104)、E1−52(配列番号108)、E2−36(配列番号113)、E1−95(配列番号117)、E2−116(配列番号121)、E2−135(配列番号126)、またはE1−142(配列番号131)のVLCDR1と少なくとも80%同一の第1のVLCDRと、
(e)E1−33(配列番号77)、E1−34(配列番号83)、E1−80(配列番号77)、E1−89(配列番号94)、E2−93(配列番号100)、E1−38(配列番号100)、E1−52(配列番号77)、E2−36(配列番号83)、E1−95(配列番号83)、E2−116(配列番号100)、E2−135(配列番号127)、またはE1−142(配列番号100)のVLCDR2と少なくとも80%同一の第2のVLCDRと、
(f)E1−33(配列番号78)、E1−34(配列番号84)、E1−80(配列番号89)、E1−89(配列番号95)、E2−93(配列番号101)、E1−38(配列番号105)、E1−52(配列番号109)、E2−36(配列番号114)、E1−95(配列番号118)、E2−116(配列番号122)、E2−135(配列番号128)、またはE1−142(配列番号132)のVLCDR3と少なくとも80%同一の第3のVLCDRと
を含む、単離抗体。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021139610A JP7358426B2 (ja) | 2016-02-05 | 2021-08-30 | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
| JP2023106822A JP2023130411A (ja) | 2016-02-05 | 2023-06-29 | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662291987P | 2016-02-05 | 2016-02-05 | |
| US62/291,987 | 2016-02-05 | ||
| PCT/US2017/016659 WO2017136807A1 (en) | 2016-02-05 | 2017-02-06 | Egfl6 specific monoclonal antibodies and methods of their use |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021139610A Division JP7358426B2 (ja) | 2016-02-05 | 2021-08-30 | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2019512210A true JP2019512210A (ja) | 2019-05-16 |
| JP2019512210A5 JP2019512210A5 (ja) | 2020-03-12 |
Family
ID=59501106
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018540833A Pending JP2019512210A (ja) | 2016-02-05 | 2017-02-06 | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
| JP2021139610A Active JP7358426B2 (ja) | 2016-02-05 | 2021-08-30 | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
| JP2023106822A Pending JP2023130411A (ja) | 2016-02-05 | 2023-06-29 | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021139610A Active JP7358426B2 (ja) | 2016-02-05 | 2021-08-30 | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
| JP2023106822A Pending JP2023130411A (ja) | 2016-02-05 | 2023-06-29 | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US10875912B2 (ja) |
| EP (1) | EP3411070A4 (ja) |
| JP (3) | JP2019512210A (ja) |
| KR (1) | KR20180105704A (ja) |
| CN (2) | CN109562163B (ja) |
| AU (1) | AU2017214685B2 (ja) |
| BR (1) | BR112018015826A2 (ja) |
| CA (1) | CA3012696A1 (ja) |
| MX (1) | MX2018009499A (ja) |
| SG (1) | SG11201806622PA (ja) |
| WO (1) | WO2017136807A1 (ja) |
| ZA (1) | ZA201805051B (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2018009499A (es) * | 2016-02-05 | 2019-05-06 | Univ Texas | Anticuerpos monoclonales especificos de egfl6 y metodos de su uso. |
| WO2019062871A1 (en) * | 2017-10-01 | 2019-04-04 | Taipei Medical University | ANTI-DOMAIN ANTI-DOMESTIC ANTIBODIES WITH MULTIPLE EGF 6 (EGFL6) AND THEIR APPLICATIONS IN THE DIAGNOSIS AND TREATMENT OF CANCER |
| EP3902830A1 (en) * | 2018-12-30 | 2021-11-03 | F. Hoffmann-La Roche AG | Anti-rabbit cd19 antibodies and methods of use |
| CN110951733A (zh) * | 2019-11-27 | 2020-04-03 | 山西医科大学 | 一种靶向抑制食管癌EGFL6基因表达的siRNA及构建的表达载体和应用 |
| CN116381251A (zh) * | 2023-03-13 | 2023-07-04 | 广州鹏翔生物技术有限公司 | 一种肿瘤标志物诊断试剂盒及其诊断方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014150720A1 (en) * | 2013-03-15 | 2014-09-25 | The Regents Of The University Of Michigan | Compositions and methods relating to inhibiting cancer cell growth and/or proliferation |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1211315A1 (en) | 1994-07-29 | 2002-06-05 | Innogenetics N.V. | Recombinant vectors for producing HCV envelope proteins |
| US20030036508A1 (en) | 1997-11-22 | 2003-02-20 | John Ford | EGF motif protein, EGFL6 materials and methods |
| US20040059098A1 (en) | 2000-10-13 | 2004-03-25 | Tang Y. Tom | Egf motif protein, egfl6 materials and methods |
| EP2471937A3 (en) | 2005-11-24 | 2013-04-24 | The Research Foundation for Microbial Diseases of Osaka University | Recombinant polyvalent vaccine |
| AR059851A1 (es) | 2006-03-16 | 2008-04-30 | Genentech Inc | Anticuerpos de la egfl7 y metodos de uso |
| CA3020290A1 (en) * | 2008-06-25 | 2009-12-30 | Esbatech, An Alcon Biomedical Research Unit Llc | Stable and soluble antibodies inhibiting vegf |
| US8501197B2 (en) * | 2010-04-30 | 2013-08-06 | The Research Foundation for The State of New York | Compositions and methods for stimulating immune response against Moraxella catarrhalis |
| SG10201504605RA (en) | 2011-09-23 | 2015-07-30 | Technophage Investigação E Desenvolvimento Em Biotecnologia Sa | Anti-Tumor Necrosis Factor-Alpha Agents And Uses Thereof |
| EP3004168A4 (en) | 2013-05-24 | 2017-03-01 | Board of Regents, The University of Texas System | Chimeric antigen receptor-targeting monoclonal antibodies |
| MX2018009499A (es) * | 2016-02-05 | 2019-05-06 | Univ Texas | Anticuerpos monoclonales especificos de egfl6 y metodos de su uso. |
-
2017
- 2017-02-06 MX MX2018009499A patent/MX2018009499A/es unknown
- 2017-02-06 BR BR112018015826A patent/BR112018015826A2/pt unknown
- 2017-02-06 US US16/075,711 patent/US10875912B2/en active Active
- 2017-02-06 KR KR1020187024950A patent/KR20180105704A/ko unknown
- 2017-02-06 WO PCT/US2017/016659 patent/WO2017136807A1/en active Application Filing
- 2017-02-06 CN CN201780015519.9A patent/CN109562163B/zh active Active
- 2017-02-06 CN CN202110985801.8A patent/CN113912717B/zh active Active
- 2017-02-06 AU AU2017214685A patent/AU2017214685B2/en active Active
- 2017-02-06 EP EP17748334.4A patent/EP3411070A4/en active Pending
- 2017-02-06 SG SG11201806622PA patent/SG11201806622PA/en unknown
- 2017-02-06 JP JP2018540833A patent/JP2019512210A/ja active Pending
- 2017-02-06 CA CA3012696A patent/CA3012696A1/en active Pending
-
2018
- 2018-07-26 ZA ZA2018/05051A patent/ZA201805051B/en unknown
-
2020
- 2020-11-12 US US17/096,280 patent/US20210130450A1/en active Pending
-
2021
- 2021-08-30 JP JP2021139610A patent/JP7358426B2/ja active Active
-
2023
- 2023-06-29 JP JP2023106822A patent/JP2023130411A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014150720A1 (en) * | 2013-03-15 | 2014-09-25 | The Regents Of The University Of Michigan | Compositions and methods relating to inhibiting cancer cell growth and/or proliferation |
Also Published As
| Publication number | Publication date |
|---|---|
| CN113912717B (zh) | 2024-05-03 |
| WO2017136807A1 (en) | 2017-08-10 |
| EP3411070A1 (en) | 2018-12-12 |
| CN109562163A (zh) | 2019-04-02 |
| CN113912717A (zh) | 2022-01-11 |
| BR112018015826A2 (pt) | 2019-01-02 |
| KR20180105704A (ko) | 2018-09-28 |
| EP3411070A4 (en) | 2019-11-27 |
| US10875912B2 (en) | 2020-12-29 |
| JP7358426B2 (ja) | 2023-10-10 |
| RU2018131611A (ru) | 2020-03-05 |
| CN109562163B (zh) | 2022-04-08 |
| AU2017214685A1 (en) | 2018-08-09 |
| SG11201806622PA (en) | 2018-09-27 |
| JP2023130411A (ja) | 2023-09-20 |
| AU2017214685B2 (en) | 2024-03-07 |
| ZA201805051B (en) | 2023-05-31 |
| MX2018009499A (es) | 2019-05-06 |
| CA3012696A1 (en) | 2017-08-10 |
| JP2022008309A (ja) | 2022-01-13 |
| RU2018131611A3 (ja) | 2020-05-19 |
| US20190031751A1 (en) | 2019-01-31 |
| US20210130450A1 (en) | 2021-05-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11174320B2 (en) | HER3 specific monoclonal antibodies for diagnostic and therapeutic use | |
| JP7358426B2 (ja) | Egfl6特異的モノクローナル抗体及びそれらの使用方法 | |
| RU2624049C2 (ru) | Фармацевтическая композиция для лечения и профилактики злокачественной опухоли | |
| JP2017534251A (ja) | Agr2およびその受容体c4.4aに対する遮断モノクローナル抗体 | |
| US20220119545A1 (en) | Cdcp1-targeted therapies | |
| BR112021009366A2 (pt) | proteína de fusão e uso da mesma | |
| WO2012065161A2 (en) | Antibodies to tumor endothelial marker 8 | |
| US11512141B2 (en) | Fibrinogen-like protein 2 (FGL2) monoclonal antibodies and their use in cancer detection and treatment | |
| US10729781B2 (en) | LGR4 specific monoclonal antibodies and methods of their use | |
| CA2888345C (en) | Jam-c antibodies and methods for treatment of cancer | |
| RU2779902C2 (ru) | Egfl6-специфические моноклональные антитела и способы их применения | |
| BR112014020816B1 (pt) | Anticorpos monoclonais anti-sez6, conjugado anticorpo-fármaco e composições farmacêuticas |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180824 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200203 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200203 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210126 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210303 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210602 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210802 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20211101 |