JP2017524924A - 異常増殖などのサンプル若しくは組織のタイプ若しくは性質を分析し、特徴付け、及び/又は診断するためのラマン分光法システム、装置及び方法 - Google Patents
異常増殖などのサンプル若しくは組織のタイプ若しくは性質を分析し、特徴付け、及び/又は診断するためのラマン分光法システム、装置及び方法 Download PDFInfo
- Publication number
- JP2017524924A JP2017524924A JP2016575728A JP2016575728A JP2017524924A JP 2017524924 A JP2017524924 A JP 2017524924A JP 2016575728 A JP2016575728 A JP 2016575728A JP 2016575728 A JP2016575728 A JP 2016575728A JP 2017524924 A JP2017524924 A JP 2017524924A
- Authority
- JP
- Japan
- Prior art keywords
- raman
- tissue
- illumination
- spectrum
- probe
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/65—Raman scattering
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B1/00—Instruments for performing medical examinations of the interior of cavities or tubes of the body by visual or photographical inspection, e.g. endoscopes; Illuminating arrangements therefor
- A61B1/012—Instruments for performing medical examinations of the interior of cavities or tubes of the body by visual or photographical inspection, e.g. endoscopes; Illuminating arrangements therefor characterised by internal passages or accessories therefor
- A61B1/018—Instruments for performing medical examinations of the interior of cavities or tubes of the body by visual or photographical inspection, e.g. endoscopes; Illuminating arrangements therefor characterised by internal passages or accessories therefor for receiving instruments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0075—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence by spectroscopy, i.e. measuring spectra, e.g. Raman spectroscopy, infrared absorption spectroscopy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0082—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence adapted for particular medical purposes
- A61B5/0084—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence adapted for particular medical purposes for introduction into the body, e.g. by catheters
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01J—MEASUREMENT OF INTENSITY, VELOCITY, SPECTRAL CONTENT, POLARISATION, PHASE OR PULSE CHARACTERISTICS OF INFRARED, VISIBLE OR ULTRAVIOLET LIGHT; COLORIMETRY; RADIATION PYROMETRY
- G01J3/00—Spectrometry; Spectrophotometry; Monochromators; Measuring colours
- G01J3/02—Details
- G01J3/0205—Optical elements not provided otherwise, e.g. optical manifolds, diffusers, windows
- G01J3/0218—Optical elements not provided otherwise, e.g. optical manifolds, diffusers, windows using optical fibers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01J—MEASUREMENT OF INTENSITY, VELOCITY, SPECTRAL CONTENT, POLARISATION, PHASE OR PULSE CHARACTERISTICS OF INFRARED, VISIBLE OR ULTRAVIOLET LIGHT; COLORIMETRY; RADIATION PYROMETRY
- G01J3/00—Spectrometry; Spectrophotometry; Monochromators; Measuring colours
- G01J3/28—Investigating the spectrum
- G01J3/44—Raman spectrometry; Scattering spectrometry ; Fluorescence spectrometry
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/25—Colour; Spectral properties, i.e. comparison of effect of material on the light at two or more different wavelengths or wavelength bands
- G01N21/27—Colour; Spectral properties, i.e. comparison of effect of material on the light at two or more different wavelengths or wavelength bands using photo-electric detection ; circuits for computing concentration
- G01N21/274—Calibration, base line adjustment, drift correction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B2560/00—Constructional details of operational features of apparatus; Accessories for medical measuring apparatus
- A61B2560/02—Operational features
- A61B2560/0223—Operational features of calibration, e.g. protocols for calibrating sensors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01J—MEASUREMENT OF INTENSITY, VELOCITY, SPECTRAL CONTENT, POLARISATION, PHASE OR PULSE CHARACTERISTICS OF INFRARED, VISIBLE OR ULTRAVIOLET LIGHT; COLORIMETRY; RADIATION PYROMETRY
- G01J3/00—Spectrometry; Spectrophotometry; Monochromators; Measuring colours
- G01J3/12—Generating the spectrum; Monochromators
- G01J2003/1226—Interference filters
- G01J2003/123—Indexed discrete filters
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/06—Illumination; Optics
- G01N2201/061—Sources
- G01N2201/06113—Coherent sources; lasers
- G01N2201/0612—Laser diodes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/08—Optical fibres; light guides
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/12—Circuits of general importance; Signal processing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/12—Circuits of general importance; Signal processing
- G01N2201/129—Using chemometrical methods
Landscapes
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Pathology (AREA)
- General Health & Medical Sciences (AREA)
- Surgery (AREA)
- Engineering & Computer Science (AREA)
- General Physics & Mathematics (AREA)
- Public Health (AREA)
- Biophysics (AREA)
- Medical Informatics (AREA)
- Animal Behavior & Ethology (AREA)
- Heart & Thoracic Surgery (AREA)
- Biomedical Technology (AREA)
- Veterinary Medicine (AREA)
- Molecular Biology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- Optics & Photonics (AREA)
- Radiology & Medical Imaging (AREA)
- Mathematical Physics (AREA)
- Theoretical Computer Science (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Endoscopes (AREA)
Abstract
Description
本発明の態様は、異常な又は明らかに異常な増殖(例えば癌として)といった、励起エネルギー(例えば、コリメートイルミネーション)が向けられるサンプル又は組織のタイプ又は性質の高精度同定のためのラマン分光システム及び方法に関する。特に、ただし排他的ではないが、本発明の態様により、胃腸成長などの異常組織の生体内及び生体外でのリアルタイム高精度診断が可能になる。
内視鏡などの低侵襲技術を用いて、新生物胃腸成長などの組織の性質を正確かつ迅速に特徴づけ、同定することが非常に望ましい。例えば、結腸直腸癌(CRC)は、後期に発見されたときには死亡率の高い一般的な疾患である。結腸ポリープの同定及び根絶は、結腸直腸死亡率及び罹患率を低下させるために最も重要な手段の1つである。悪性形質転換のリスクがほとんど又はまったくない過形成性ポリープと顕著な悪性潜伏期を伴う腺腫との区別は、従来の大腸内視鏡検査技術を用いた臨床的課題として残っている。
本発明に係る実施形態の目的は、例えば本質的に身体の任意の部分における癌などとしての異常成長といった組織のタイプ及び/又は性質を特徴付け、同定し及び/又は診断するための従来技術及び現在の内視鏡技術に関連する問題の少なくともいくつかを克服することである。さらに別の目的は、内視鏡検査(例えば大腸内視鏡検査などの胃腸内視鏡検査)中に生体内でポリープ及び前癌などの異常組織のタイプ又は性質を迅速に特徴付け、同定し及び/又は診断するためのラマン分光法に基づく高精度システム及び方法を提供することである。
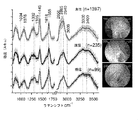
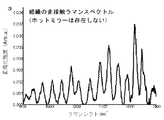
(i)FP範囲内の組織ラマン信号を圧倒する強力な自己蛍光を呈する場合のある組織(例えば、胃、肺、結腸、肝臓)について、HW範囲は依然として診断情報を伴う強力な組織ラマンピークを含むことができる。
(ii)FP及びHW範囲は、補完生体分子情報(例えば、タンパク質、脂質、DNA及び水)を含むため、組織の特徴付け及び診断を改善することができる。
(iii)結合が異なれば異なるスペクトル範囲で振動するので、2つの異なるスペクトル範囲(FP及びHW)を使用すると、単一スキャンで得られる生体分子情報が増加する。
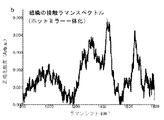
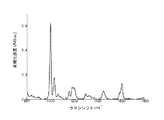
ラマン分光法は、非弾性光散乱の基本原理に基づくユニークな光学的振動技術を表す。入射レーザ光が分子の偏光変化を誘発すると、入射光子のわずかな割合(108の〜1)が、サンプル中の分子の特定のラマン活性振動モードに対応する周波数シフトにより非弾性的に散乱される。異なる分子及び異なる結合が異なる周波数で振動する。したがって、ラマン分光法は、組織中のタンパク質、脂質及びデオキシリボ核酸(DNA)、水などの多数の細胞間及び/又は細胞内成分から多数の特定の生体分子情報を得ることができる。
・v(C−C)タンパク質に関連する853cm-1、
・フェニルアラニンのvs(C−C)環揺らぎに関連する1004cm-1、
・脂質のv(C−C)に関連する1078cm-1、
・タンパク質のアミドIIIv(C−N)及びδ(N−H)に関連する1265cm-1、
・タンパク質のCH3CH2ねじれ及び揺れに関連する1302cm-1、
・タンパク質及び脂質のδ(CH2)変形に関連する1445cm-1、
・タンパク質のアミドIv(C=O)に関連する1655cm-1、及び
・脂質のv(C=O)に関連する1745cm-1。
HW領域には、次のような強いラマンピークも見られる:
・脂質の対称及び非対称CH2伸縮に関連する2850及び2885cm-1、
・タンパク質のCH3伸縮に関連する2940cm-1、
・水OH伸縮振動の広いラマンバンドに関連する3100〜3600cm-1の領域における3400cm-1。
・新規外れ値検出スキームを、オンラインフレームワークの高レベルのモデル固有フィードバックツールとして機能するようにHotellingのT2及びQ−残存統計と結合された主成分(PCA)に基づいて導入する。HotellingのT2及びQ−残差は、モデルフィット内外の情報を提供する2つの独立したパラメータである。
・取得されたスペクトル品質(すなわち、プローブ−組織接触モード、プローブ処理変動、白色光干渉、青色光干渉、交絡因子など)を制御するための指標としてHotellingのT2及びQ−残差パラメータを使用して、聴覚フィードバックをオンラインラマン診断システムに統合し、臨床医のためにリアルタイム分光スクリーニング及びプローブ取扱のアドバイスを容易にする。
・スペクトルがさらなる分析のために確認された場合には、これらを生体内癌診断の確率モデルに送る。このソフトウェアは、多数の患者のスペクトルデータベースに基づいて、部分最小二乗弁別解析(PLS−DA)、PCA線形判別分析(LDA)、アリコロニー最適化(ACO)−LDA、分類及び回帰ツリー(CART)、サポートベクターマシン(SVM)、アダプティブブースティング(AdaBoost)などを含めた、予めレンダリングされた多変量統計モデル間で即座に切り替えることができる。
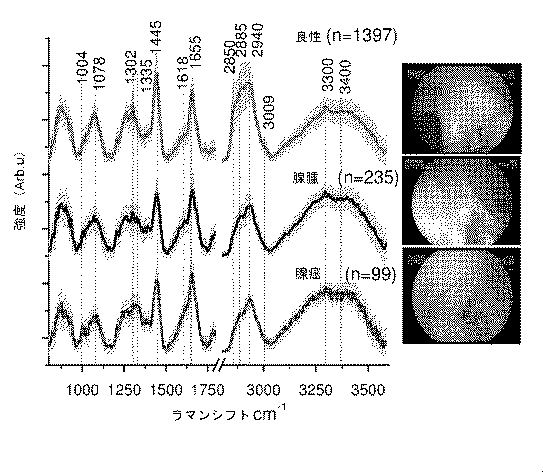
(i)良性(正常及び過形成性ポリープ)
(ii)低悪性度及び高悪性度の腺腫(管状、尿細管性、絨毛状)
(iii)腺癌。
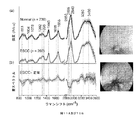
・v(C−C)タンパク質に関連する853cm-1、
・フェニルアラニンのvs(C−C)環揺らぎに関連する1004cm-1、
・脂質のv(C−C)に関連する1078cm-1、
・タンパク質のアミドIIIv(C−N)及びδ(N−H)に関連する1265cm-1、
・脂質のCH2ねじれ及び揺れに関連する1302cm-1、
・タンパク質及び脂質のδ(CH2)変形に関連する1445cm-1、
・ポルフィリンのv(C=C)に関連する1618cm-1、
・タンパク質のアミドIv(C=O)に関連する1655cm-1、
・脂質のv(C=O)に関連する1745cm-1。
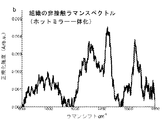
HW領域には、次のような強いラマンピークも見られる:
・それぞれ脂質の対称及び非対称CH2伸縮に関連する2850及び2885cm-1、
・タンパク質のCH3伸縮に関連する2940cm-1、
・タンパク質の非対称=CH伸縮に関連する3009cm-1、
・アミドA(タンパク質のNH伸縮)に関連する〜約3300cm-1、並びに
・組織の細胞外及び細胞外空間におけるOH−結合の局所構造及び相互作用に直接関係するOH伸縮振動に関連するOHの広いラマンバンド〜3200及び〜3400cm-1。
(i)直腸ポリープ切除術又はEMRのための小さな高リスク腺腫の同定を含む予防的介入アプローチ。本質的にリスクが明らかに低い過形成性ポリープ又は扁平な疑わしい病変をその場に残し、それにより医療費を効率的に削減することができる可能性がある。
(ii)光ファイバー共焦点ラマン分光法を使用して、結腸直腸腺癌の存在を高精度で効率的に確認又は拒絶することもできる。
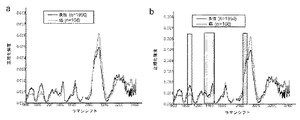
・v(C−C)タンパク質に関連する853cm-1、
・フェニルアラニンの環揺らぎに関連する1004cm-1、
・脂質のv(C−C)に関連する1078cm-1、
・タンパク質のアミドIIIv(C−N)及びδ(N−H)に関連する1265cm-1、
・脂質のCH2ねじれ及び揺れに関連する1302cm-1、
・タンパク質及び核酸のCH3CH2ねじれに関連する1335cm-1、
・タンパク質及び脂質のδ(CH2)変形に関連する1445cm-1、
・ポルフィリンのv(C=C)に関連する1618cm-1、
・タンパク質のアミドIv(C=O)に関連する1655cm-1、及び
・リン脂質のv(C=O)に関連する1745cm-1。
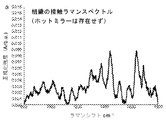
HW領域18〜24においても、次のように強いラマンピークが観察される:
・脂質の対称及び非対称CH2伸縮に関連する2580及び2885cm-1、
・タンパク質のCH3伸縮に関連する2940cm-1、
・アミドA(タンパク質のNH伸縮)に関連する約3300cm-1、及び
・食道組織の細胞内及び細胞外空間におけるOH−結合の局所コンホメーション及び相互作用に関連する水の広範なラマンバンド(〜3250及び〜3400cm-1でピークに達するOH伸縮振動)。
1.予測性能を改善する;
2.モデルの複雑さを軽減する;及び
3.変数/特徴の重要性などの基礎的な分光プロセスへの洞察を得る。
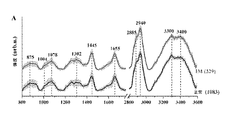
・構造タンパク質及びコラーゲンのグリコーゲン(CCH)変形芳香族及び(C−C)伸縮に関連する〜854cm-1、
・プロリン、バリン及びグリコーゲンのv(C−C)伸縮に関連する〜937cm-1、
・フェニルアラニンの(C−C)環揺らぎに関連する〜1001cm-1、
・リン脂質及び核酸に関連する〜約1095cm-1、
・アミドIIIに関連する〜1253cm-1、
・脂質/タンパク質(コラーゲン)のCH3CH2ねじれ態様に関連する〜約1313cm-1、
・タンパク質及び脂質のCH2屈曲態様に関連する〜約1445cm-1、
・タンパク質のアミドIバンド−(C=O)伸縮態様に関連する〜1654cm-1、
・タンパク質−CH3伸縮に関連する〜2946cm-1、及び
・水−(OH)伸縮に関連する〜約3400cm-1。
・v(C−C)タンパク質に関連する936cm-1、
・フェニルアラニンのvs(C−C)環揺らぎに関連する1004cm-1、
・脂質のv(C−C)に関連する1078cm-1、
・タンパク質のアミドIIIv(C−N)及びδ(N−H)に関連する1265cm-1、
・タンパク質のCH2のねじれ及び揺れに関連する1302cm-1、
・タンパク質及び脂質のδ(CH2)変形に関連する1445cm-1、
・ポルフィリンのv(C=C)に関連する1618cm-1、
・タンパク質のアミドIv(C=O)に関連する1655cm-1、
・脂質のv(C=O)に関連する1745cm-1、
・タンパク質−CH3伸縮に関連する〜2946cm-1、及び
・水−(OH)伸縮に関連する〜3400cm-1。
・v(C−C)タンパク質に関連する875cm-1、
・フェニルアラニンのνs(C−C)環揺らぎに関連する1004cm-1、
・脂質のv(C−C)に関連する1078cm-1、
・脂質のCH2のねじれ及び揺れに関連する1302cm-1、
・タンパク質及び脂質のδ(CH2)変形に関連する1445cm-1、
・タンパク質のアミドIv(C=O)に関連する1655cm-1。
さらに、HW領域の強いラマンピークも観察される:
・脂質の対称及び非対称CH2伸縮に関連する2885cm-1、
・タンパク質のCH3伸縮に関連する2940cm-1、
・アミドA(タンパク質のNH伸縮)に関連する3300cm-1、
・組織の細胞外及び細胞外空間におけるOH結合の局所コンホメーション及び相互作用に関連する水の広範なラマンバンド(〜約3400cm-1にピークを有するOH伸縮振動)。
・従来のWLR/NBI/AFI内視鏡撮像は、前癌(すなわち異形成)が疑われる大きなバレットセグメントの確定していない外観を示す遠位食道で実施される。
・その後、広帯域共焦点ラマン内視鏡技術を疑わしい組織セグメント内の客観的に標的となる生検に適用する。
・共焦点ラマン分類は、「正常」(病理又は胃炎の欠如)、「低リスク」(腸−異形性)及び「高リスク」(異形成/癌)に定義される。
・共焦点ラマンプローブは遠位食道の組織に対して配置され、診断はFP及びHW領域から抽出された補完情報に基づいてリアルタイムで与えられる。
・共焦点ラマン内視鏡技術は、後に生検される高リスク組織部位を標的とする。
・v(C−C)タンパク質に関連する853cm-1、
・フェニルアラニンのvs(C−C)環揺らぎに関連する1004cm-1、
・脂質のv(C−C)に関連する1078cm-1、
・タンパク質のアミドIIIv(C−N)及びδ(N−H)に関連する1265cm-1、
・タンパク質のCH3CH2ねじれ及び揺れに関連する1302cm-1、
・タンパク質及び脂質のδ(CH2)変形に関連する1445cm-1、
・タンパク質のアミドIv(C=O)に関連する1655cm-1、及び
・脂質のv(C=O)に関連する1745cm-1。
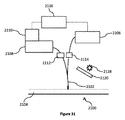
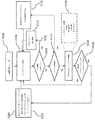
102 近赤外(NIR)ダイオードレーザ
104 ハイスループット反射イメージング分光器
105 細長シャフト
106 NIR最適化電荷結合素子(CCD)カメラ
108 プローブ
110 光ファイバー
112 バンドパスフィルタ
114 ロングパスフィルタ
124 マイクロコントローラシステム
2100 システム
2102 プローブ
2104 組織
2106 NIRレーザ
2108 スペクトログラフ
2110 CCD
2112 エッジロングパスフィルタ
2114 バンドパスフィルタ
2116 PC
2118 イルミネーション源
2120 ホットミラーローパスフィルタ
2304 サンプル
Claims (19)
- ラマン分光装置であって、
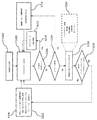
イルミネーションを組織に向けるように構成された第1のイルミネーション源と、
該組織によって散乱されたイルミネーションからフィンガープリント(FP)及び高波数(HW)ラマンスペクトルを同時に検出するように構成されたラマン分光器と、
FP及びHW波長範囲における検出ラマンスペクトルの離散スペクトルサブインターバルを分析して一方又は両方の波長範囲において1以上の基準マーカーとの一致を同定するための、少なくとも1個の処理ユニット及び該少なくとも1個の処理ユニットによって実行可能なプログラム命令を保存するメモリを含むコンピュータ化制御及び分析モジュールと
を備えるラマン分光装置。 - 前記ラマン分光器が単一の広帯域回折格子を有する、請求項1に記載の装置。
- 前記第1イルミネーション源が励起エネルギーを生成して前記組織に適用するためのコリメートイルミネーション源を備え、前記装置がコリメートイルミネーションを該組織に送り、かつ、検出されたラマンスペクトルを該組織から前記ラマン分光器に戻すためのプローブをさらに備える、請求項2に記載の装置。
- 1以上の基準マーカーが、検出されたラマンスペクトルにおいて特定のピークを含む、請求項3に記載の装置。
- 前記コンピュータ化制御及び分析モジュールが、一致に基づいて異常成長を診断するための少なくとも1個の処理ユニットによって実行可能なプログラム命令を含む、請求項3に記載の装置。
- 前記プローブが共焦点光ファイバープローブを備える、請求項3に記載の装置。
- 前記プローブが保持される器具チャネルを有する細長いシャフトを有する内視鏡をさらに備える、請求項6に記載の装置。
- 前記コンピュータ化制御及び分析モジュールが、コリメートイルミネーションの出力を動的に調節するための少なくとも1個の処理ユニットによって実行可能なプログラム命令を含む、請求項3に記載の装置。
- 前記コンピュータ化制御及び分析モジュールが、コリメートイルミネーションに組織がさらされる時間を動的に調節するための少なくとも1個の処理ユニットによって実行可能なプログラム命令を含む、請求項3に記載の装置。
- 少なくとも1の較正基準に対してプローブ又はラマン装置全体を標準化するように構成された較正装置をさらに備える、請求項3に記載の装置。
- 追加のイルミネーションを組織に出力するように構成された追加のイルミネーション源と、
前記第1イルミネーション源によるイルミネーション出力と追加のイルミネーション源による追加のイルミネーション出力との間のイルミネーション干渉を補うように構成されたホットミラーフィルタと
をさらに備える、請求項3に記載の装置。 - ラマン分光法装置によって実行される方法であって、
第1イルミネーション源によるイルミネーション出力を組織に向け;
該組織によって散乱されたイルミネーションからのプローブフィンガープリント(FP)及び高波数(HW)ラマンスペクトルを同時に検出し;及び
該検出されたラマンスペクトルにおける離散スペクトルサブインターバルをFP波長範囲及びHW波長範囲の両方において分析して、一方又は両方の波長範囲内において1以上の基準マーカーとの一致を同定すること
を含む方法。 - 前記FP及びHWラマンスペクトルを同時に検出することが、単一広帯域回折格子を使用してFP及びHW波長範囲の両方においてイルミネーションを回折させることを含む、請求項12に記載の方法。
- 前記一致に基づいて異常成長の性質を診断することをさらに含む、請求項12に記載の方法。
- 前記1以上の基準マーカーが検出されたラマンスペクトルにおける特定のピークである、請求項12に記載の方法。
- イルミネーションの出力を動的に調節することをさらに含む、請求項12に記載の方法。
- 前記組織が前記イルミネーションにさらされる時間を動的に調節することをさらに含む、請求項12に記載の方法。
- 前記組織をイルミネーションにさらす前に、少なくとも1つの較正基準に対してプローブ又はラマン装置全体を標準化するように較正又は標準化手順を実行することをさらに含む、請求項12に記載の方法。
- 前記第1イルミネーション源によるイルミネーション出力を組織に向けつつ追加のイルミネーション源を使用して該組織に追加のイルミネーションを向け;
ホットミラーフィルタを使用して該第1イルミネーション源によるイルミネーション出力と該追加のイルミネーション源による該追加のイルミネーション出力との間のイルミネーション干渉を補うこと
をさらに含む、請求項12に記載の方法。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB201411803A GB201411803D0 (en) | 2014-07-02 | 2014-07-02 | The method and system for the use of Raman spectroscopy in the diagnosis of the nature of an abnormal growth |
| GB201411820A GB201411820D0 (en) | 2014-07-02 | 2014-07-02 | The method and system for the use of raman spectroscopy in the diagnosis of the nature of an abnormal growth |
| GB1411803.8 | 2014-07-02 | ||
| GB1411800.4 | 2014-07-02 | ||
| GB1411820.2 | 2014-07-02 | ||
| GB201411800A GB201411800D0 (en) | 2014-07-02 | 2014-07-02 | The method and system for the use of Raman spectroscopy in the diagnosis of an abnormal growth |
| PCT/SG2015/050195 WO2016003371A1 (en) | 2014-07-02 | 2015-07-02 | Raman spectroscopy system, apparatus, and method for analyzing, characterizing, and/or diagnosing a type or nature of a sample or a tissue such as an abnormal growth |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017524924A true JP2017524924A (ja) | 2017-08-31 |
| JP6768529B2 JP6768529B2 (ja) | 2020-10-14 |
Family
ID=55019739
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016575728A Active JP6768529B2 (ja) | 2014-07-02 | 2015-07-02 | 異常増殖などのサンプル若しくは組織のタイプ若しくは性質を分析し、特徴付け、及び/又は診断するためのラマン分光法システム、装置及び方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20170138860A1 (ja) |
| EP (1) | EP3164046B1 (ja) |
| JP (1) | JP6768529B2 (ja) |
| KR (1) | KR102409070B1 (ja) |
| CN (1) | CN106793917B (ja) |
| AU (1) | AU2015284810B2 (ja) |
| ES (1) | ES2847230T3 (ja) |
| SG (1) | SG11201702715UA (ja) |
| WO (1) | WO2016003371A1 (ja) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019073733A1 (ja) * | 2017-10-12 | 2019-04-18 | 富士フイルム株式会社 | 画像作成装置、画像作成方法、画像作成プログラム |
| KR20200134405A (ko) * | 2019-05-22 | 2020-12-02 | 주식회사 나노바이오라이프 | 신속진단키트의 다중 바이오마커 검출 방법 및 이를 이용하는 멀티모달 스캐너 |
| JP2021511108A (ja) * | 2018-01-17 | 2021-05-06 | オーディーエス メディカル インコーポレイテッドODS Medical Inc. | がん検出を目的としたリアルタイムラマン分光法のためのシステムおよび方法 |
| JP2024528161A (ja) * | 2021-08-06 | 2024-07-26 | 華東師範大学 | 光ファイバーラマン光度計及びその構築方法と応用 |
| US20240426757A1 (en) * | 2023-06-26 | 2024-12-26 | Mariposa Technology, Inc. | Spectroscopic Methods and Systems for the Qualitative and Quantitative Analysis of Samples |
| WO2025005160A1 (ja) * | 2023-06-30 | 2025-01-02 | ソニー・オリンパスメディカルソリューションズ株式会社 | 医療用制御装置及び医療用観察システム |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014036470A1 (en) | 2012-08-31 | 2014-03-06 | Sloan-Kettering Institute For Cancer Research | Particles, methods and uses thereof |
| AU2014218867B2 (en) | 2013-02-20 | 2018-11-08 | Sloan-Kettering Institute For Cancer Research | Wide field raman imaging apparatus and associated methods |
| US10912947B2 (en) | 2014-03-04 | 2021-02-09 | Memorial Sloan Kettering Cancer Center | Systems and methods for treatment of disease via application of mechanical force by controlled rotation of nanoparticles inside cells |
| WO2016018896A1 (en) | 2014-07-28 | 2016-02-04 | Memorial Sloan Kettering Cancer Center | Metal(loid) chalcogen nanoparticles as universal binders for medical isotopes |
| WO2017004301A1 (en) | 2015-07-01 | 2017-01-05 | Memorial Sloan Kettering Cancer Center | Anisotropic particles, methods and uses thereof |
| CN105997000B (zh) * | 2016-05-30 | 2023-04-14 | 福建师范大学 | 一种基于纤维内窥镜的拉曼光谱检测装置及其实现方法 |
| WO2018072807A1 (de) * | 2016-09-27 | 2018-04-26 | Siemens Aktiengesellschaft | Vorrichtung und verfahren zur feststellung pathologischer implikationen |
| GB201621912D0 (en) * | 2016-12-21 | 2017-02-01 | Dublin Inst Of Tech And Trinity College Dublin | A method of using raman spectroscopy for identification of low grade cervical cytology cases likely to progress to high grade / cancer |
| CN107132208B (zh) * | 2017-04-10 | 2018-11-30 | 苏州贝康医疗器械有限公司 | 一种基于拉曼光谱测量的细胞培养液质量检测方法 |
| FR3065285B1 (fr) * | 2017-04-14 | 2019-07-05 | Commissariat A L'energie Atomique Et Aux Energies Alternatives | Procede d’acquisition d’un spectre |
| CN109507166A (zh) * | 2017-09-15 | 2019-03-22 | Ravr有限公司 | 一种双通道微型拉曼光谱仪 |
| WO2019094341A1 (en) * | 2017-11-10 | 2019-05-16 | Clinicai, Inc. | System, composition and method for the detection of spectral biomarkers of a condition and patterns from stool samples |
| FR3078620A1 (fr) * | 2018-03-09 | 2019-09-13 | Institut Georges Lopez | Dispositif de quantification du taux de lipides et/ou de proteines dans le tissu hepatique |
| CN108398418B (zh) * | 2018-03-16 | 2020-12-04 | 华东理工大学 | 一种内参比表面增强拉曼测试试纸、制备方法与应用 |
| WO2019195737A1 (en) * | 2018-04-06 | 2019-10-10 | Braskem America, Inc. | Raman spectroscopy and machine learning for quality control |
| CN110208244B (zh) * | 2019-06-18 | 2020-07-28 | 华南理工大学 | 一种基于拉曼光谱测试果蔬组织中细胞水平水分含量和分布的方法 |
| US11815462B2 (en) | 2019-06-20 | 2023-11-14 | National Research Council Of Canada | Broadband Raman excitation spectroscopy with structured excitation profiles |
| JP6788298B1 (ja) * | 2019-12-17 | 2020-11-25 | 日本分光株式会社 | 蛍光観察機能を備えるラマン顕微装置 |
| CN111189817B (zh) * | 2020-01-09 | 2021-09-03 | 中国原子能科学研究院 | 激光诱导击穿光谱真假信号分辨数据分析方法 |
| EP4096505A1 (en) * | 2020-01-29 | 2022-12-07 | King's College London | Raman spectroscopy method and system |
| CN111256819B (zh) * | 2020-02-20 | 2022-09-09 | 苏州沓来软件科技有限公司 | 一种光谱仪器的降噪方法 |
| GB202004010D0 (en) * | 2020-03-19 | 2020-05-06 | Res & Innovation Uk | Detection of water content in tissue |
| GB2601789A (en) * | 2020-12-10 | 2022-06-15 | Creo Medical Ltd | Raman spectroscopy probe, Raman spectroscopy apparatus including the Raman spectroscopy probe and elongate assembly |
| WO2022139465A1 (ko) * | 2020-12-22 | 2022-06-30 | 두에이아이(주) | 인공지능 라만 분석 기법을 이용한 췌장암 조기진단 방법 |
| KR102298680B1 (ko) * | 2021-02-26 | 2021-09-07 | (주)메디띵스 | 협대역 확산 반사 분광법을 이용한 혼탁매질에서의 수분 및 지질 함량 정량화 방법 |
| JP2024524430A (ja) * | 2021-07-01 | 2024-07-05 | ベーリンガー インゲルハイム フェトメディカ ゲーエムベーハー | 光学系を較正する方法 |
| US20250003880A1 (en) * | 2021-09-25 | 2025-01-02 | Tornado Spectral Systems Inc. | Raman spectroscopy of chemical processes with spectral blocking filters |
| US20250120582A1 (en) * | 2022-01-21 | 2025-04-17 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Cancer diagnosis method and systems using second harmonic generation measurements |
| WO2023249962A1 (en) * | 2022-06-20 | 2023-12-28 | Vanderbilt University | Non-contact clinical raman spectroscopy guided probe and applications of same |
| CN115308189A (zh) * | 2022-07-18 | 2022-11-08 | 上海理工大学 | 生物样本预测方法、装置和存储介质 |
| CN116385344A (zh) * | 2022-12-30 | 2023-07-04 | 山东大学 | 一种基于拉曼光谱的手持式宫颈癌图像检测方法及系统 |
| CN120086746B (zh) * | 2025-04-30 | 2025-08-15 | 广东惠丰达电气设备有限公司 | 一种基于光谱吸收原理的gis故障气体分类识别系统及方法 |
| CN120778697B (zh) * | 2025-09-10 | 2025-11-18 | 国检测试控股集团(安徽)拓维检测服务有限公司 | 一种原子荧光光谱法快速检测废水污染物的方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007090044A (ja) * | 2005-08-31 | 2007-04-12 | Olympus Corp | 光イメージング装置 |
| US20110295062A1 (en) * | 2008-12-11 | 2011-12-01 | Fundacio Clinic Per A La Recerca Biomedica Fcrb | Equipment for infrared vision of anatomical structures and signal processing methods thereof |
| WO2014007759A1 (en) * | 2012-07-02 | 2014-01-09 | National University Of Singapore | Methods related to real-time cancer diagnostics at endoscopy utilizing fiber-optic raman spectroscopy |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7697576B2 (en) * | 2004-05-05 | 2010-04-13 | Chem Image Corporation | Cytological analysis by raman spectroscopic imaging |
| US20120057145A1 (en) * | 2008-08-18 | 2012-03-08 | Tunnell James W | Systems and methods for diagnosis of epithelial lesions |
| US8300220B2 (en) * | 2009-02-25 | 2012-10-30 | Vanderbilt University | Device and method for non-invasively evaluating a target of interest of a living subject |
| WO2011088580A1 (en) * | 2010-01-22 | 2011-07-28 | British Columbia Cancer Agency Branch | Apparatus and methods for characterization of lung tissue by raman spectroscopy |
| GB201302886D0 (en) * | 2013-02-19 | 2013-04-03 | Univ Singapore | Diagnostic instrument and method |
-
2015
- 2015-07-02 JP JP2016575728A patent/JP6768529B2/ja active Active
- 2015-07-02 US US15/322,874 patent/US20170138860A1/en not_active Abandoned
- 2015-07-02 ES ES15814823T patent/ES2847230T3/es active Active
- 2015-07-02 AU AU2015284810A patent/AU2015284810B2/en active Active
- 2015-07-02 SG SG11201702715UA patent/SG11201702715UA/en unknown
- 2015-07-02 EP EP15814823.9A patent/EP3164046B1/en active Active
- 2015-07-02 KR KR1020177002888A patent/KR102409070B1/ko active Active
- 2015-07-02 WO PCT/SG2015/050195 patent/WO2016003371A1/en not_active Ceased
- 2015-07-02 CN CN201580046151.3A patent/CN106793917B/zh active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007090044A (ja) * | 2005-08-31 | 2007-04-12 | Olympus Corp | 光イメージング装置 |
| US20110295062A1 (en) * | 2008-12-11 | 2011-12-01 | Fundacio Clinic Per A La Recerca Biomedica Fcrb | Equipment for infrared vision of anatomical structures and signal processing methods thereof |
| WO2014007759A1 (en) * | 2012-07-02 | 2014-01-09 | National University Of Singapore | Methods related to real-time cancer diagnostics at endoscopy utilizing fiber-optic raman spectroscopy |
Non-Patent Citations (2)
| Title |
|---|
| BERGHOLT, MS ET AL: ""DEVELOPMENT OF A MULTIPLEXING FINGERPRINT AND HIGH WAVENUMBER RAMAN SPECTROSCOPY TECHNIQUE FOR REAL", JOURNAL OF BIOMEDICAL OPTICS, vol. 18, no. 3, JPN6019021537, 28 February 2013 (2013-02-28), pages 030502, ISSN: 0004251953 * |
| DURAIPANDIAN, S ET AL: ""SIMULTANEOUS FINGERPRINT AND HIGH-WAVENUMBER CONFOCAL RAMAN SPECTROSCOPY ENHANCES EARLY DETECTION O", ANALYTICAL CHEMISTRY, vol. 84, no. 14, JPN6019021536, 20 July 2012 (2012-07-20), pages 5913 - 5919, ISSN: 0004251952 * |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019073733A1 (ja) * | 2017-10-12 | 2019-04-18 | 富士フイルム株式会社 | 画像作成装置、画像作成方法、画像作成プログラム |
| JPWO2019073733A1 (ja) * | 2017-10-12 | 2020-10-22 | 富士フイルム株式会社 | 画像作成装置、画像作成方法、画像作成プログラム |
| JP2021511108A (ja) * | 2018-01-17 | 2021-05-06 | オーディーエス メディカル インコーポレイテッドODS Medical Inc. | がん検出を目的としたリアルタイムラマン分光法のためのシステムおよび方法 |
| JP7257009B2 (ja) | 2018-01-17 | 2023-04-13 | オーディーエス メディカル インコーポレイテッド | がん検出を目的としたリアルタイムラマン分光法のためのシステムおよび方法 |
| KR20200134405A (ko) * | 2019-05-22 | 2020-12-02 | 주식회사 나노바이오라이프 | 신속진단키트의 다중 바이오마커 검출 방법 및 이를 이용하는 멀티모달 스캐너 |
| KR102251968B1 (ko) * | 2019-05-22 | 2021-05-17 | 주식회사 나노바이오라이프 | 신속진단키트의 다중 바이오마커 검출 방법 및 이를 이용하는 멀티모달 스캐너 |
| JP2024528161A (ja) * | 2021-08-06 | 2024-07-26 | 華東師範大学 | 光ファイバーラマン光度計及びその構築方法と応用 |
| US20240426757A1 (en) * | 2023-06-26 | 2024-12-26 | Mariposa Technology, Inc. | Spectroscopic Methods and Systems for the Qualitative and Quantitative Analysis of Samples |
| WO2025005160A1 (ja) * | 2023-06-30 | 2025-01-02 | ソニー・オリンパスメディカルソリューションズ株式会社 | 医療用制御装置及び医療用観察システム |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2016003371A1 (en) | 2016-01-07 |
| EP3164046A1 (en) | 2017-05-10 |
| KR102409070B1 (ko) | 2022-06-16 |
| US20170138860A1 (en) | 2017-05-18 |
| AU2015284810B2 (en) | 2020-03-12 |
| EP3164046A4 (en) | 2018-04-25 |
| SG11201702715UA (en) | 2017-04-27 |
| KR20170039168A (ko) | 2017-04-10 |
| EP3164046B1 (en) | 2020-10-28 |
| JP6768529B2 (ja) | 2020-10-14 |
| AU2015284810A1 (en) | 2017-02-16 |
| CN106793917B (zh) | 2019-04-30 |
| ES2847230T3 (es) | 2021-08-02 |
| CN106793917A (zh) | 2017-05-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6768529B2 (ja) | 異常増殖などのサンプル若しくは組織のタイプ若しくは性質を分析し、特徴付け、及び/又は診断するためのラマン分光法システム、装置及び方法 | |
| Nogueira et al. | Evaluation of wavelength ranges and tissue depth probed by diffuse reflectance spectroscopy for colorectal cancer detection | |
| Duraipandian et al. | Real-time Raman spectroscopy for in vivo, online gastric cancer diagnosis during clinical endoscopic examination | |
| Yoon et al. | A clinically translatable hyperspectral endoscopy (HySE) system for imaging the gastrointestinal tract | |
| JP6230077B2 (ja) | 光ファイバーラマン分光法を利用する内視鏡検査でのリアルタイム癌診断に関連する方法 | |
| Lu et al. | Detection of head and neck cancer in surgical specimens using quantitative hyperspectral imaging | |
| US8326404B2 (en) | Multimodal detection of tissue abnormalities based on raman and background fluorescence spectroscopy | |
| Bergholt et al. | Combining near-infrared-excited autofluorescence and Raman spectroscopy improves in vivo diagnosis of gastric cancer | |
| Wang et al. | Simultaneous fingerprint and high-wavenumber fiber-optic Raman spectroscopy improves in vivo diagnosis of esophageal squamous cell carcinoma at endoscopy | |
| US8532750B2 (en) | Process and device for detection of precancer tissues with infrared spectroscopy | |
| CN102740762A (zh) | 由拉曼光谱法表征肺组织的设备和方法 | |
| WO1999037204A1 (en) | Fluorescence imaging endoscope | |
| CN1870929A (zh) | 自动内窥镜检查装置、诊断方法及其使用 | |
| WO2012039679A2 (en) | System for near-infrared autofluorescence measurement of a subject, and method thereof | |
| Lin et al. | Shifted-excitation Raman difference spectroscopy for improving in vivo detection of nasopharyngeal carcinoma | |
| Vališ et al. | Automated classification pipeline for real-time in vivo examination of colorectal tissue using Raman spectroscopy | |
| Haugen et al. | Biochemical detection of pediatric eosinophilic esophagitis using high wavenumber Raman endoscopy and stimulated Raman microscopy | |
| Park et al. | Artificial intelligence-based gastric cancer detection in the gastric submucosal dissection method via hyperspectral imaging | |
| Ralbovsky et al. | Raman Spectroscopy and Advanced Statistics for Cancer Diagnostics | |
| BERGHOLT | REAL-TIME FIBER OPTIC RAMAN SPECTROSCOPY FOR EARLY DIAGNOSIS OF PRECANCER AND CANCER IN VIVO IN THE UPPER GASTROINTESTINAL TRACT | |
| JIANHUA | Near-infrared raman spectroscopy for early detection of cervical precancer | |
| Almond et al. | The Prospects for Real‐Time Raman Spectroscopy for Oesophageal Neoplasia | |
| Hutchings | Advancing the clinical application of Raman spectroscopic diagnosis of oesophageal pre-malignancies | |
| Kan | Multimodal optical spectroscopy and imaging for improving cancer detection in the head and neck at endoscopy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170123 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180606 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190611 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190911 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191111 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200414 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200709 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20200825 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20200923 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6768529 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |