定義
以下の用語は、特に指示がない限り、以下の意味を有する。未定義の用語はいずれも、その技術分野で認識される意味を有する。
「アルキル」は、1〜10個の炭素原子、例えば、1〜6個の炭素原子、または1〜5個、または1〜4個または1〜3個の炭素原子を有する一価飽和脂肪族ヒドロカルビル基を指す。本用語は、例えば、直鎖及び分岐鎖ヒドロカルビル基、例えば、メチル(CH3−)、エチル(CH3CH2−)、n−プロピル(CH3CH2CH2−)、イソプロピル((CH3)2CH−)、n−ブチル(CH3CH2CH2CH2−)、イソブチル((CH3)2CHCH2−)、sec−ブチル((CH3)(CH3CH2)CH−)、t−ブチル((CH3)3C−)、n−ペンチル(CH3CH2CH2CH2CH2−)、及びネオペンチル((CH3)3CCH2−)を含む。
用語「置換アルキル」は、本明細書に定義されるとおり、アルキル鎖(C1炭素原子を除く)中の1個以上の炭素原子が、任意で、ヘテロ原子、例えば、−O−、−N−、−S−、−S(O)n−(nが、0〜2である)、−NR−(Rが、水素またはアルキルである)で置換されるアルキル基を指し、アルコキシ、置換アルコキシ、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アシル、アシルアミノ、アシルオキシ、アミノ、アミノアシル、アミノアシルオキシ、オキシアミノアシル、アジド、シアノ、ハロゲン、ヒドロキシル、オキソ、チオケト、カルボキシル、カルボキシルアルキル、チオアリールオキシ、チオヘテロアリールオキシ、チオヘテロシクロオキシ、チオール、チオアルコキシ、置換チオアルコキシ、アリール、アリールオキシ、ヘテロアリール、ヘテロアリールオキシ、ヘテロシクリル、ヘテロシクロオキシ、ヒドロキシアミノ、アルコキシアミノ、ニトロ、−SO−アルキル、−SO−アリール、−SO−ヘテロアリール、−SO2−アルキル、−SO2−アリール、−SO2−ヘテロアリール、及び−NRaRb(R’及びR’’が、同じ、または異なってよく、水素、任意で、置換アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロアリール及びヘテロサイクリックから選択される)からなる群から選択される1〜5個の置換基を有するヘテロ原子で置換されるアルキル基を指す。
「アルキレン」は、好ましくは、1〜6個の炭素原子、さらに好ましくは、1〜3個の炭素原子を有する二価脂肪族ヒドロカルビル基を指し、当該炭素原子が、直鎖または分岐鎖のいずれかであり、任意で、−O−、−NR10−、−NR10C(O)−、−C(O)NR10−などから選択される1個以上の基で中断されている。本用語は、例えば、メチレン(−CH2)、エチレン(−CH2CH2−)、n−プロピレン(−CH2CH2CH2−)、イソ−プロピレン(−CH2CH(CH3)−)、(−C(CH3)2CH2CH2−)、(−C(CH3)2CH2C(O)−)、(−C(CH3)2CH2C(O)NH−)、(−CH(CH3)CH2−)などを含む。
「置換アルキレン」は、以下の「置換」の定義に炭素について記載したとおり、置換基で置換された1〜3個の水素を有するアルキレン基を指す。
用語「アルカン」は、本明細書に定義されるとおり、アルキル基及びアルキレン基を指す。
用語「アルキルアミノアルキル」、「アルキルアミノアルケニル」及び「アルキルアミノアルキニル」は、基、R’NHR’’−を指し、R’は、本明細書に定義されるとおり、アルキル基であり、R’’は、本明細書に定義されるとおり、アルキレン、アルケニレンまたはアルケニレン基である。
用語「アルカリール」または「アラルキル」は、基、−アルキレン−アリール及び置換アルキレン−アリールを指し、アルキレン、置換アルキレン及びアリールは、本明細書に定義されている。
「アルコキシ」は、基、−O−アルキルを指し、アルキルは、本明細書に定義されるとおりである。アルコキシとしては、例えば、メトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、t−ブトキシ、sec−ブトキシ、n−ペントキシなどが挙げられる。用語「アルコキシ」は、また、基、アルケニル−O−、シクロアルキル−O−、シクロアルケニル−O−、及びアルキニル−O−を指し、アルケニル、シクロアルキル、シクロアルケニル、及びアルキニルは、本明細書に定義されるとおりである。
用語「置換アルコキシ」は、基、置換アルキル−O−、置換アルケニル−O−、置換シクロアルキル−O−、置換シクロアルケニル−O−、及び置換アルキニル−O−を指し、置換アルキル、置換アルケニル、置換シクロアルキル、置換シクロアルケニル及び置換アルキニルは、本明細書に定義されるとおりである。
用語「アルコキシアミノ」は、基、−NH−アルコキシを指し、アルコキシは、本明細書に定義されるとおりである。
用語「ハロアルコキシ」は、基、アルキル−O−を指し、アルキル基上の1個以上の水素原子が、ハロ基で置換され、基、例えば、トリフルオロメトキシなどを含む。
用語「ハロアルキル」は、上記に記載したとおり、置換アルキル基を指し、アルキル基上の1個以上の水素原子が、ハロ基で置換されている。かかる基の例としては、フルオロアルキル基、例えば、トリフルオロメチル、ジフルオロメチル、トリフルオロエチルなどが挙げられるが、これらに限定されない。
用語「アルキルアルコキシ」は、基、−アルキレン−O−アルキル、アルキレン−O−置換アルキル、置換アルキレン−O−アルキル、及び置換アルキレン−O−置換アルキルを指し、アルキル、置換アルキル、アルキレン及び置換アルキレンは、本明細書に定義されるとおりである。
用語「アルキルチオアルコキシ」は、基、−アルキレン−S−アルキル、アルキレン−S−置換アルキル、置換アルキレン−S−アルキル及び置換アルキレン−S−置換アルキルを指し、アルキル、置換アルキル、アルキレン及び置換アルキレンは、本明細書に定義されるとおりである。
「アルケニル」は、2〜6個の炭素原子、好ましくは、2〜4個の炭素原子を有し、二重結合不飽和の少なくとも1個、好ましくは、1〜2個の部位を有する直鎖または分岐鎖ヒドロカルビル基を指す。本用語は、例えば、ビ−ビニル、アリル、及びブト−3−エン−1−イルを含む。本用語には、シス及びトランス異性体、またはこれらの異性体の混合物が含まれる。
用語「置換アルケニル」は、本明細書に定義されるとおり、アルコキシ、置換アルコキシ、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アシル、アシルアミノ、アシルオキシ、アミノ、置換アミノ、アミノアシル、アミノアシルオキシ、オキシアミノアシル、アジド、シアノ、ハロゲン、ヒドロキシル、オキソ、チオケト、カルボキシル、カルボキシルアルキル、チオアリールオキシ、チオヘテロアリールオキシ、チオヘテロシクロオキシ、チオール、チオアルコキシ、置換チオアルコキシ、アリール、アリールオキシ、ヘテロアリール、ヘテロアリールオキシ、ヘテロシクリル、ヘテロシクロオキシ、ヒドロキシアミノ、アルコキシアミノ、ニトロ、−SO−アルキル、−SO−置換アルキル、−SO−アリール、−SO−ヘテロアリール、−SO2−アルキル、−SO2−置換アルキル、−SO2−アリール及び−SO2−ヘテロアリールから選択される1〜5個の置換基、または1〜3個の置換基を有するアルケニル基を指す。
「アルキニル」は、2〜6個の炭素原子、好ましくは、2〜3個の炭素原子を有し、三重結合不飽和の少なくとも1個、好ましくは、1〜2個の部位を有する直鎖または分岐鎖一価ヒドロカルビル基を指す。かかるアルキニル基の例としては、アセチレニル(−C≡CH)、及びプロパルギル(−CH2C≡CH)が挙げられる。
用語「置換アルキニル」は、本明細書に定義されるとおり、アルコキシ、置換アルコキシ、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アシル、アシルアミノ、アシルオキシ、アミノ、置換アミノ、アミノアシル、アミノアシルオキシ、オキシアミノアシル、アジド、シアノ、ハロゲン、ヒドロキシル、オキソ、チオケト、カルボキシル、カルボキシルアルキル、チオアリールオキシ、チオヘテロアリールオキシ、チオヘテロシクロオキシ、チオール、チオアルコキシ、置換チオアルコキシ、アリール、アリールオキシ、ヘテロアリール、ヘテロアリールオキシ、ヘテロシクリル、ヘテロシクロオキシ、ヒドロキシアミノ、アルコキシアミノ、ニトロ、−SO−アルキル、−SO−置換アルキル、−SO−アリール、−SO−ヘテロアリール、−SO2−アルキル、−SO2−置換アルキル、−SO2−アリール、及び−SO2−ヘテロアリールから選択される1〜5個の置換基、または1〜3個の置換基、を有するアルキニル基を指す。
「アルキニルオキシ」は、基、−O−アルキニルを指し、アルキニルは、本明細書に定義されるとおりである。アルキニルオキシとしては、例えば、エチニルオキシ、プロピニルオキシなどが挙げられる。
「アシル」は、基、H−C(O)−、アルキル−C(O)−、置換アルキル−C(O)−、アルケニル−C(O)−、置換アルケニル−C(O)−、アルキニル−C(O)−、置換アルキニル−C(O)−、シクロアルキル−C(O)−、置換シクロアルキル−C(O)−、シクロアルケニル−C(O)−、置換シクロアルケニル−C(O)−、アリール−C(O)−、置換アリール−C(O)−、ヘテロアリール−C(O)−、置換ヘテロアリール−C(O)−、ヘテロシクリル−C(O)−、及び置換ヘテロシクリル−C(O)−を指し、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。例えば、アシルとしては、「アセチル」基CH3C(O)−が挙げられる。
「アシルアミノ」は、基、−NR20C(O)アルキル、−NR20C(O)置換アルキル、NR20C(O)シクロアルキル、−NR20C(O)置換シクロアルキル、−NR20C(O)シクロアルケニル、−NR20C(O)置換シクロアルケニル、−NR20C(O)アルケニル、−NR20C(O)置換アルケニル、−NR20C(O)アルキニル、−NR20C(O)置換アルキニル、−NR20C(O)アリール、−NR20C(O)置換アリール、−NR20C(O)ヘテロアリール、−NR20C(O)置換ヘテロアリール、−NR20C(O)ヘテロサイクリック、及び−NR20C(O)置換ヘテロサイクリックを指し、R20が、水素またはアルキルであり、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。
「アミノカルボニル」または用語「アミノアシル」は、基、−C(O)NR21R22を指し、R21及びR22が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アリール、置換アリール、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックからなる群から独立して選択され、R21及びR22が、任意で、窒素に結合し、窒素とともに結合され、ヘテロサイクリックまたは置換ヘテロサイクリック基を形成し、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。
「アミノカルボニルアミノ」は、基、−NR21C(O)NR22R23を指し、R21、R22、及びR23が、水素、アルキル、アリールまたはシクロアルキルから独立して選択される、または、2個のR基が結合され、ヘテロシクリル基を形成する。
用語「アルコキシカルボニルアミノ」は、基、−NRC(O)ORを指し、各Rが、独立して、水素、アルキル、置換アルキル、アリール、ヘテロアリール、またはヘテロシクリルであり、アルキル、置換アルキル、アリール、ヘテロアリール、及びヘテロシクリルは、本明細書に定義されるとおりである。
用語「アシルオキシ」は、基、アルキル−C(O)O−、置換アルキル−C(O)O−、シクロアルキル−C(O)O−、置換シクロアルキル−C(O)O−、アリール−C(O)O−、ヘテロアリール−C(O)O−、及びヘテロシクリル−C(O)O−を指し、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アリール、ヘテロアリール、及びヘテロシクリルは、本明細書に定義されるとおりである。
「アミノスルホニル」は、基、−SO2NR21R22を指し、R21及びR22が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アリール、置換アリール、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、置換ヘテロサイクリックからなる群から独立して選択され、R21及びR22が、任意で、窒素に結合し、窒素とともに結合され、ヘテロサイクリックまたは置換ヘテロサイクリック基を形成し、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。
「スルホニルアミノ」は、基、−NR21SO2R22を指し、R21及びR22が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アリール、置換アリール、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックからなる群から独立して選択され、R21及びR22が、任意で、原子に結合し、原子とともに結合され、ヘテロサイクリックまたは置換ヘテロサイクリック基を形成し、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。
「アリール」または「Ar」は、単環(例えば、フェニル基中に存在する)または多縮合環(かかる芳香族環系の例としては、ナフチル、アントリル及びインダニルが挙げられる)を有する環系を有する6〜18個の炭素原子の一価芳香族炭素環式基を指し、縮合環は、結合点が、芳香族環の原子を介しているという条件で、芳香族としてよい、または芳香族でなくてもよい。本用語は、例えば、フェニル及びナフチルを含む。アリール置換基の定義によって特に束縛されない限り、かかるアリール基は、任意で、アシルオキシ、ヒドロキシ、チオール、アシル、アルキル、アルコキシ、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、置換アルキル、置換アルコキシ、置換アルケニル、置換アルキニル、置換シクロアルキル、置換シクロアルケニル、アミノ、置換アミノ、アミノアシル、アシルアミノ、アルカリール、アリール、アリールオキシ、アジド、カルボキシル、カルボキシルアルキル、シアノ、ハロゲン、ニトロ、ヘテロアリール、ヘテロアリールオキシ、ヘテロシクリル、ヘテロシクロオキシ、アミノアシルオキシ、オキシアシルアミノ、チオアルコキシ、置換チオアルコキシ、チオアリールオキシ、チオヘテロアリールオキシ、−SO−アルキル、−SO−置換アルキル、−SO−アリール、−SO−ヘテロアリール、−SO2−アルキル、−SO2−置換アルキル、−SO2−アリール、−SO2−ヘテロアリール及びトリハロメチルから選択される1〜5個の置換基、または1〜3個の置換基で置換することができる。
「アリールオキシ」は、基、−O−アリールを指し、アリールは、本明細書に定義されるとおりであり、例えば、フェノキシ、ナフトキシなどを含み、任意で、また、本明細書に定義されるとおり、置換アリール基を含む。
「アミノ」は、基、−NH2を指す。
用語「置換アミノ」は、基、−NRRを指し、少なくとも1個のRが、水素ではないという条件で、各Rが、水素、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、シクロアルケニル、置換シクロアルケニル、アルキニル、置換アルキニル、アリール、ヘテロアリール、及びヘテロシクリルからなる群から独立して選択される。
用語「アジド」は、基、−N3を指す。
「カルボキシル」、「カルボキシ」または「カルボキシレート」は、−CO2Hまたはこれらの塩を指す。
「カルボキシルエステル」または「カルボキシエステル」または用語「カルボキシアルキル」または「カルボキシルアルキル」は、基、−C(O)O−アルキル、−C(O)O−置換アルキル、−C(O)O−アルケニル、−C(O)O−置換アルケニル、−C(O)O−アルキニル、−C(O)O−置換アルキニル、−C(O)O−アリール、−C(O)O−置換アリール、−C(O)O−シクロアルキル、−C(O)O−置換シクロアルキル、−C(O)O−シクロアルケニル、−C(O)O−置換シクロアルケニル、−C(O)O−ヘテロアリール、−C(O)O−置換ヘテロアリール、−C(O)O−ヘテロサイクリック、及び−C(O)O−置換ヘテロサイクリックを指し、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。
「(カルボキシルエステル)オキシ」または「カーボネート」は、基、−O−C(O)O−アルキル、−O−C(O)O−置換アルキル、−O−C(O)O−アルケニル、−O−C(O)O−置換アルケニル、−O−C(O)O−アルキニル、−O−C(O)O−置換アルキニル、−O−C(O)O−アリール、−O−C(O)O−置換アリール、−O−C(O)O−シクロアルキル、−O−C(O)O−置換シクロアルキル、−O−C(O)O−シクロアルケニル、−O−C(O)O−置換シクロアルケニル、−O−C(O)O−ヘテロアリール、−O−C(O)O−置換ヘテロアリール、−O−C(O)O−ヘテロサイクリック、及び−O−C(O)O−置換ヘテロサイクリックを指し、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。
「シアノ」または「ニトリル」は、基、−CNを指す。
「シクロアルキル」は、縮合、橋かけ、及びスピロ環系を含む単一または複数の環状環を有する3〜10個の炭素原子の環状アルキル基を指す。好適なシクロアルキル基の例としては、例えば、アダマンチル、シクロプロピル、シクロブチル、シクロペンチル、シクロオクチルなどが挙げられる。かかるシクロアルキル基としては、例えば、単環構造、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロオクチルなど、または多環構造、例えば、アダマンタニルなどが挙げられる。
用語「置換シクロアルキル」は、アルキル、置換アルキル、アルコキシ、置換アルコキシ、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アシル、アシルアミノ、アシルオキシ、アミノ、置換アミノ、アミノアシル、アミノアシルオキシ、オキシアミノアシル、アジド、シアノ、ハロゲン、ヒドロキシル、オキソ、チオケト、カルボキシル、カルボキシルアルキル、チオアリールオキシ、チオヘテロアリールオキシ、チオヘテロシクロオキシ、チオール、チオアルコキシ、置換チオアルコキシ、アリール、アリールオキシ、ヘテロアリール、ヘテロアリールオキシ、ヘテロシクリル、ヘテロシクロオキシ、ヒドロキシアミノ、アルコキシアミノ、ニトロ、−SO−アルキル、−SO−置換アルキル、−SO−アリール、−SO−ヘテロアリール、−SO2−アルキル、−SO2−置換アルキル、−SO2−アリール及び−SO2−ヘテロアリールから選択される1〜5個の置換基、または1〜3個の置換基を有するシクロアルキル基を指す。
「シクロアルケニル」は、単一環または複数環を有する、少なくとも1つの二重結合、好ましくは、1〜2つの二重結合を有する3〜10個の炭素原子の非芳香族環状アルキル基を指す。
用語「置換シクロアルケニル」は、アルコキシ、置換アルコキシ、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アシル、アシルアミノ、アシルオキシ、アミノ、置換アミノ、アミノアシル、アミノアシルオキシ、オキシアミノアシル、アジド、シアノ、ハロゲン、ヒドロキシル、ケト、チオケト、カルボキシル、カルボキシルアルキル、チオアリールオキシ、チオヘテロアリールオキシ、チオヘテロシクロオキシ、チオール、チオアルコキシ、置換チオアルコキシ、アリール、アリールオキシ、ヘテロアリール、ヘテロアリールオキシ、ヘテロシクリル、ヘテロシクロオキシ、ヒドロキシアミノ、アルコキシアミノ、ニトロ、−SO−アルキル、−SO−置換アルキル、−SO−アリール、−SO−ヘテロアリール、−SO2−アルキル、−SO2−置換アルキル、−SO2−アリール及び−SO2−ヘテロアリールから選択される1〜5個の置換基、または1〜3個の置換基を有するシクロアルケニル基を指す。
「シクロアルキニル」は、単一環または複数環を有し、少なくとも1つの三重結合を有する5〜10個の炭素原子の非芳香族シクロアルキル基を指す。
「シクロアルコキシ」は、−O−シクロアルキルを指す。
「シクロアルケニルオキシ」は、−O−シクロアルケニルを指す。
「ハロ」または「ハロゲン」は、フルオロ、クロロ、ブロモ、及びヨードを指す。
「ヒドロキシ」または「ヒドロキシル」は、基、−OHを指す。
「ヘテロアリール」は、1〜15個の炭素原子、例えば、1〜10個の炭素原子の芳香族基を指し、環内に酸素、窒素、及び硫黄からなる群から選択される1〜10個のヘテロ原子を有する。かかるヘテロアリール基は、単環(例えば、ピリジニル、イミダゾリルまたはフリル)または環系(例えば、インドリジニル、キノリニル、ベンゾフラン、ベンゾイミダゾリルまたはベンゾチエニルなどの基中)中の多縮合環を有することができ、結合点が、芳香族環の原子を介しているという条件で、環系内の少なくとも1つの環が、芳香族であり、環系内の少なくとも1つの環が、芳香族である。特定の実施形態では、ヘテロアリール基の窒素及び/または硫黄環原子(単数及び複数)が、任意で、酸化され、N−オキシド(N→O)、スルフィニル、またはスルホニル部分がもたらされる。本用語は、例えば、ピリジニル、ピロリル、インドリル、チオフェニル、及びフラニルを含む。ヘテロアリール置換基の定義によって特に束縛されない限り、かかるヘテロアリール基は、任意で、アシルオキシ、ヒドロキシ、チオール、アシル、アルキル、アルコキシ、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、置換アルキル、置換アルコキシ、置換アルケニル、置換アルキニル、置換シクロアルキル、置換シクロアルケニル、アミノ、置換アミノ、アミノアシル、アシルアミノ、アルカリール、アリール、アリールオキシ、アジド、カルボキシル、カルボキシルアルキル、シアノ、ハロゲン、ニトロ、ヘテロアリール、ヘテロアリールオキシ、ヘテロシクリル、ヘテロシクロオキシ、アミノアシルオキシ、オキシアシルアミノ、チオアルコキシ、置換チオアルコキシ、チオアリールオキシ、チオヘテロアリールオキシ、−SO−アルキル、−SO−置換アルキル、−SO−アリール、−SO−ヘテロアリール、−SO2−アルキル、−SO2−置換アルキル、−SO2−アリール及び−SO2−ヘテロアリール、及びトリハロメチルから選択される1〜5個の置換基、または1〜3個の置換基で置換することができる。
用語「ヘテロアラルキル」は、基、−アルキレン−ヘテロアリールを指し、アルキレン及びヘテロアリールは、本明細書に定義されている。本用語は、例えば、ピリジルメチル、ピリジルエチル、インドリルメチルなどを含む。
「ヘテロアリールオキシ」は、−O−ヘテロアリールを指す。
「複素環」、「ヘテロサイクリック」、「ヘテロシクロアルキル」、及び「ヘテロシクリル」は、縮合、橋かけ、及びスピロ環系を含む単環または多縮合環を有し、1〜10個のヘテロ原子を含む3〜20個の環原子を有する飽和または不飽和基を指す。これらの環原子は、窒素、硫黄、または酸素からなる群から選択され、縮合環系では、結合点が、非芳香族環を介しているという条件で、1個以上の環は、シクロアルキル、アリール、またはヘテロアリールとすることができる。特定の実施形態では、ヘテロサイクリック基の窒素及び/または硫黄原子(単数及び複数)が、任意で、酸化され、N−オキシド、−S(O)−、または−SO2−部分がもたらされる。
複素環及びヘテロアリールの例としては、アゼチジン、ピロール、イミダゾール、ピラゾール、ピリジン、ピラジン、ピリミジン、ピリダジン、インドリジン、イソインドール、インドール、ジヒドロインドール、インダゾール、プリン、キノリジン、イソキノリン、キノリン、フタラジン、ナフチルピリジン、キノキサリン、キナゾリン、シンノリン、プテリジン、カルバゾール、カルボリン、フェナントリジン、アクリジン、フェナントロリン、イソチアゾール、フェナジン、イソキサゾール、フェノキサジン、フェノチアジン、イミダゾリジン、イミダゾリン、ピペリジン、ピペラジン、インドリン、フタルイミド、1,2,3,4−テトラヒドロイソキノリン、4,5,6,7−テトラヒドロベンゾ[b]チオフェン、チアゾール、チアゾリジン、チオフェン、ベンゾ[b]チオフェン、モルホリニル、チオモルホリニル(チアモルホリニルとも称される)、1,1−ジオキソチオモルホリニル、ピペリジニル、ピロリジン、テトラヒドロフラニルなどが挙げられるが、これらに限定されない。
ヘテロサイクリック置換基の定義によって特に束縛されない限り、かかるヘテロサイクリック基は、任意で、アルコキシ、置換アルコキシ、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アシル、アシルアミノ、アシルオキシ、アミノ、置換アミノ、アミノアシル、アミノアシルオキシ、オキシアミノアシル、アジド、シアノ、ハロゲン、ヒドロキシル、オキソ、チオケト、カルボキシル、カルボキシルアルキル、チオアリールオキシ、チオヘテロアリールオキシ、チオヘテロシクロオキシ、チオール、チオアルコキシ、置換チオアルコキシ、アリール、アリールオキシ、ヘテロアリール、ヘテロアリールオキシ、ヘテロシクリル、ヘテロシクロオキシ、ヒドロキシアミノ、アルコキシアミノ、ニトロ、−SO−アルキル、−SO−置換アルキル、−SO−アリール、−SO−ヘテロアリール、−SO2−アルキル、−SO2−置換アルキル、−SO2−アリール、−SO2−ヘテロアリール、及び縮合複素環から選択される1〜5個、または1〜3個の置換基で置換することができる。
「ヘテロシクリルオキシ」は、基、−O−ヘテロシクリルを指す。
用語「ヘテロシクリルチオ」は、基、ヘテロサイクリック−S−を指す。
用語「ヘテロサイクレン」は、本明細書に定義されるとおり、複素環から形成されるジラジカル基を指す。
用語「ヒドロキシアミノ」は、基、−NHOHを指す。
「ニトロ」は、基、−NO2を指す。
「オキソ」は、原子(=O)を指す。
「スルホニル」は、基、SO2−アルキル、SO2−置換アルキル、SO2−アルケニル、SO2−置換アルケニル、SO2−シクロアルキル、SO2−置換cylcoアルキル、SO2−シクロアルケニル、SO2−置換cylcoアルケニル、SO2−アリール、SO2−置換アリール、SO2−ヘテロアリール、SO2−置換ヘテロアリール、SO2−ヘテロサイクリック、及びSO2−置換ヘテロサイクリックを指し、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。スルホニルとしては、例えば、メチル−SO2−、フェニル−SO2−、及び4−メチルフェニル−SO2−が挙げられる。
「スルホニルオキシ」は、基、−OSO2−アルキル、OSO2−置換アルキル、OSO2−アルケニル、OSO2−置換アルケニル、OSO2−シクロアルキル、OSO2−置換cylcoアルキル、OSO2−シクロアルケニル、OSO2−置換シクロアルケニル、OSO2−アリール、OSO2−置換アリール、OSO2−ヘテロアリール、OSO2−置換ヘテロアリール、OSO2−ヘテロサイクリック、及びOSO2置換ヘテロサイクリックを指し、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、シクロアルキル、置換シクロアルキル、シクロアルケニル、置換シクロアルケニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、ヘテロサイクリック、及び置換ヘテロサイクリックは、本明細書に定義されるとおりである。
用語「アミノカルボニルオキシ」は、基、−OC(O)NRRを指し、各Rが、独立して、水素、アルキル、置換アルキル、アリール、ヘテロアリール、またはヘテロサイクリックであり、アルキル、置換アルキル、アリール、ヘテロアリール及びヘテロサイクリックは、本明細書に定義されるとおりである。
「チオール」は、基、−SHを指す。
「チオキソ」または用語「チオケト」は、原子(=S)を指す。
「アルキルチオ」または用語「チオアルコキシ」は、基、−S−アルキルを指し、アルキルは、本明細書に定義されるとおりである。特定の実施形態では、硫黄を酸化させ、−S(O)−としてよい。スルホキシドは、1つ以上の立体異性体として存在してよい。
用語「置換チオアルコキシ」は、基、−S−置換アルキルを指す。
用語「チオアリールオキシ」は、基、アリール−S−を指し、アリール基は、本明細書に定義されるとおりであり、また、本明細書に定義されるとおり、任意で置換アリール基を含む。
用語「チオヘテロアリールオキシ」は、基、ヘテロアリール−S−を指し、ヘテロアリール基は、本明細書に定義されるとおりであり、また、本明細書に定義されるとおり、任意で置換アリール基を含む。
用語「チオヘテロシクロオキシ」は、基、ヘテロシクリル−S−を指し、ヘテロシクリル基は、本明細書に定義されるとおりであり、また、本明細書に定義されるとおり、任意で置換ヘテロシクリル基を含む。
本明細書の開示に加えて、用語「置換」は、また、特定の基または遊離基を修飾するために用いられる場合、特定の基または遊離基の1個以上の水素原子それぞれが、互いに独立し、以下に定義されるとおり、同じ、または異なる置換基で置換することができる。
本明細書の個々の用語に関して開示された基に加えて、特定の基または遊離基中の飽和炭素原子の1個以上の水素(単一炭素の2個の水素のいずれかを=O、=NR70、=N−OR70、=N2または=Sで置換することができる)を置換するための置換基は、特に指示がない限り、−R60、ハロ、=O、−OR70、−SR70、−NR80R80、トリハロメチル、−CN、−OCN、−SCN、−NO、−NO2、=N2、−N3、−SO2R70、−SO2O−M+、−SO2OR70、−OSO2R70、−OSO2O−M+、−OSO2OR70、−P(O)(O−)2(M+)2、−P(O)(OR70)O−M+、−P(O)(OR70)2、−C(O)R70、−C(S)R70、−C(NR70)R70、−C(O)O−M+、−C(O)OR70、−C(S)OR70、−C(O)NR80R80、−C(NR70)NR80R80、−OC(O)R70、−OC(S)R70、−OC(O)O−M+、−OC(O)OR70、−OC(S)OR70、−NR70C(O)R70、−NR70C(S)R70、−NR70CO2 −M+、−NR70CO2R70、−NR70C(S)OR70、−NR70C(O)NR80R80、−NR70C(NR70)R70及び−NR70C(NR70)NR80R80であり、R60が、任意で、置換アルキル、シクロアルキル、ヘテロアルキル、ヘテロシクロアルキルアルキル、シクロアルキルアルキル、アリール、アリールアルキル、ヘテロアリール及びヘテロアリールアルキルからなる群から選択され、各R70が、独立して水素またはR60である;各R80が、独立してR70または代わりに、2個のR80’であり、それらが結合する窒素原子とともに取られ、5−、6−または7−員環ヘテロシクロアルキルを形成し、ヘテロシクロアルキルが、任意で、1〜4個の同じ、または異なる追加のO、N及びSからなる群から選択されるヘテロ原子を含んでよく、ヘテロ原子Nのヘテロシクロアルキルが、−HまたはC1−C3アルキル置換を有してよい;及び各M+が、正味の単一正電荷を有する対立イオンである。各M+は、独立して、例えば、アルカリイオン、例えば、K+、Na+、Li+;アンモニウムイオン、例えば、+N(R60)4;またはアルカリ土類イオン、例えば、[Ca2+]0.5、[Mg2+]0.5、または[Ba2+]0.5(下付きの0.5は、かかる二価アルカリ土類イオンの対立イオンの一方が、本発明の化合物のイオン化形態とすることができ、他方が、典型的対立イオン、例えば、クロリドとすることができる、または本明細書に開示された2個のイオン化化合物が、かかる二価アルカリ土類イオンの対立イオンとして役割を果たすことができる、または本発明の二重イオン化化合物が、かかる二価アルカリ土類イオンの対立イオンとして役割を果たすことができることを意味する)。特定の例として、−NR80R80が、−NH2、−NH−アルキル、N−ピロリジニル、N−ピペラジニル、4N−メチル−ピペラジン−1−イル及びN−モルホリニルを含むことを意味する。
本明細書の開示に加えて、「置換」アルケン、アルキン、アリール及びヘテロアリール基中の不飽和炭素原子での水素の置換基は、特に指示がない限り、−R60、ハロ、−O−M+、−OR70、−SR70、−S−M+、−NR80R80、トリハロメチル、−CF3、−CN、−OCN、−SCN、−NO、−NO2、−N3、−SO2R70、−SO3 −M+、−SO3R70、−OSO2R70、−OSO3 −M+、−OSO3R70、−PO3 −2(M+)2、−P(O)(OR70)O−M+、−P(O)(OR70)2、−C(O)R70、−C(S)R70、−C(NR70)R70、−CO2 −M+、−CO2R70、−C(S)OR70、−C(O)NR80R80、−C(NR70)NR80R80、−OC(O)R70、−OC(S)R70、−OCO2 −M+、−OCO2R70、−OC(S)OR70、−NR70C(O)R70、−NR70C(S)R70、−NR70CO2 −M+、−NR70CO2R70、−NR70C(S)OR70、−NR70C(O)NR80R80、−NR70C(NR70)R70及び−NR70C(NR70)NR80R80であり、R60、R70、R80及びM+が、置換アルケンまたはアルキンの場合、置換基が、−O−M+、−OR70、−SR70、または−S−M+ではないという条件で、前記に定義されたとおりである。
本明細書の個々の用語に関して開示された基に加えて、「置換」ヘテロアルキル及びシクロヘテロアルキル基中の窒素原子での水素の置換基は、特に指示がない限り、−R60、−O−M+、−OR70、−SR70、−S−M+、−NR80R80、トリハロメチル、−CF3、−CN、−NO、−NO2、−S(O)2R70、−S(O)2O−M+、−S(O)2OR70、−OS(O)2R70、−OS(O)2O−M+、−OS(O)2OR70、−P(O)(O−)2(M+)2、−P(O)(OR70)O−M+、−P(O)(OR70)(OR70)、−C(O)R70、−C(S)R70、−C(NR70)R70、−C(O)OR70、−C(S)OR70、−C(O)NR80R80、−C(NR70)NR80R80、−OC(O)R70、−OC(S)R70、−OC(O)OR70、−OC(S)OR70、−NR70C(O)R70、−NR70C(S)R70、−NR70C(O)OR70、−NR70C(S)OR70、−NR70C(O)NR80R80、−NR70C(NR70)R70及び−NR70C(NR70)NR80R80であり、R60、R70、R80及びM+が、前記に定義されたとおりである。
本明細書の開示に加えて、特定の実施形態では、置換される基が、1、2、3、または4個の置換基、1、2、または3個の置換基、1または2個の置換基、または1個の置換基を有する。
前記で定義された全置換基では、置換基をさらに置換基で定義することによってそれ自体に達するポリマー(例えば、置換基として置換アリール基を有する置換アリールが、置換アリール基で、それ自体に置換される、置換アリール基によってさらに置換される、など)が、本明細書に含まれることを意図しないと理解される。かかる場合では、かかる置換の最大数が、3である。例えば、本明細書で検討される置換アリール基の連続置換は、特に、置換アリール−(置換アリール)−置換アリールに限定される。
特に指示がない限り、本明細書で明示的に定義されない置換基の名称は、官能基の末端部分、続いて結合点に向かって隣接した官能基に名をつけることによって、つけられる。例えば、置換基「アリールアルキルオキシカルボニル」は、基、(アリール)−(アルキル)−O−C(O)−を指す。
1個以上の置換基を含有する本明細書に開示される基のいずれかに関して、言うまでもなく、かかる基は、立体配置的に実行不可能である、及び/または合成的に実行不可能である置換または置換パターンのいずれも含有しないと理解される。また、対象の化合物は、これらの化合物の置換により生じる全立体化学的異性体を含む。
用語「製剤的に許容可能な塩」は、患者、例えば、哺乳動物への投与に許容可能である塩を意味する(所与の投与計画に許容可能な哺乳動物の安全性を有する対立イオンを有する塩)。かかる塩は、製剤的に許容可能な無機または有機塩基及び製剤的に許容可能な無機または有機酸から誘導することができる。「製剤的に許容可能な塩」は、化合物の製剤的に許容可能な塩を指し、当該塩は、当技術分野でよく知られているさまざまな有機及び無機対立イオンから誘導され、例にすぎないが、ナトリウム、カリウム、カルシウム、マグネシウム、アンモニウム、テトラアルキルアンモニウムなどを含む;分子が塩基性官能基を含有する場合、有機または無機酸の塩、例えば、塩酸塩、臭化水素酸塩、蟻酸塩、酒石酸塩、ベシル酸塩、メシル酸塩、酢酸塩、マレイン酸塩、蓚酸塩などである。
用語「これらの塩」は、酸のプロトンが、カチオン、例えば、金属カチオンまたは有機カチオンなどによって置換される場合に形成される化合物を意味する。これに当てはまる場合、当該塩は、製剤的に許容可能な塩であり、これは、患者への投与を意図しない中間化合物の塩では必要とされない。例えば、本化合物の塩は、当該化合物が、無機または有機酸によってプロトン化され、塩の陰イオン成分としての無機または有機酸の共役塩基とともにカチオンを形成する塩を含む。
「溶媒和物」は、溶質の分子またはイオンと溶媒分子の組み合わせによって形成される複合物を指す。溶媒は、有機化合物、無機化合物、または両者の混合物とすることができる。溶媒のいくつかの例としては、メタノール、N,N−ジメチルホルムアミド、テトラヒドロフラン、ジメチルスルホキシド、及び水が挙げられるが、これらに限定されない。溶媒が水である場合、形成される溶媒和物は、水和物である。
「立体異性体」及び「立体異性体」は、同じ原子結合性を有するが、空間に異なる原子配置を有する化合物を指す。立体異性体は、シス−トランス異性体、E及びZ異性体、光学異性体、及びジアステレオマーを含む。
「互変異性体」は、原子の電子結合及び/またはプロトンの位置だけが異なる分子の別の形態を指し、例えば、エノール−ケト及びイミン−エナミン互変異性体、または−N=C(H)−NH−環原子配置を含有するヘテロアリール基の互変異性体形態、例えば、ピラゾール、イミダゾール、ベンゾイミダゾール、トリアゾール、及びテトラゾールである。当業者であれば、他の互変異性体の環原子配置が可能であると認識する。
用語「またはこれらの塩もしくは溶媒和物もしくは立体異性体」は、塩、溶媒和物及び立体異性体の全ての順序の交換、例えば、対象の化合物の立体異性体の製剤的に許容可能な塩の溶媒和物を含むことを意図すると理解される。
「薬剤的に有効な量」及び「治療的に有効な量」は、特定の障害もしくは疾患または1つ以上のその症状を治療する、及び/または疾患または障害の発症を予防するのに十分な化合物の量を指す。腫瘍形成性増殖障害に関して、薬剤的にまたは治療的に有効な量は、特に、腫瘍を縮小させる、または腫瘍の成長速度を減少させるのに十分な量を含む。
「患者」は、ヒト及び非ヒト被験者、特に哺乳動物の被験者を指す。
用語「治療する」または「治療」は、本明細書に用いる場合、患者、例えば、哺乳動物(特にヒト)の疾患または医学的状態を治療すること、またはこれの治療を意味し、(a)疾患または医学的状態が生じることを予防すること、例えば、被験者の予防的治療;(b)疾患または医学的状態を改善すること、例えば、患者の疾患または医学的状態を除去することまたは後退させること;(c)例えば、患者の疾患または医学的状態の発症を遅らせること、または抑えることによって、疾患または医学的状態を抑制すること;または(d)患者の疾患または医学的状態の症状を軽減することを含む。
用語「ポリペプチド」、「ペプチド」、及び「タンパク質」は、本明細書に交換可能で用いられ、任意の長さのアミノ酸のポリマー形態を指す。特に指示がない限り、「ポリペプチド」、「ペプチド」、及び「タンパク質」は、遺伝子的にコード化されたアミノ酸及びコード化されていないアミノ酸、化学的に、または生化学的に修飾された、または誘導体化されたアミノ酸、及び修飾されたペプチド主鎖を有するポリペプチドを含むことができる。本用語は、融合タンパク質を含み、これらに限定されないが、異種アミノ酸配列との融合タンパク質、異種及び同種リーダー配列との融合、少なくとも1つのN−末端メチオニン残基(例えば、遺伝子組み換え細菌性宿主細胞中での生成を促進するため)を含有するタンパク質;免疫学的に標識を付けられたタンパク質などを含む。
「天然アミノ酸配列」または「親アミノ酸配列」は、本明細書に交換可能で用いられ、修飾アミノ酸残基を含む修飾前のポリペプチドのアミノ酸配列を指す。
用語「アミノ酸類似体」、「非天然アミノ酸」、などは、交換可能で用いてよく、一般に天然タンパク質にみられる1個以上のアミノ酸と構造及び/または全体形状がほぼ同じであるアミノ酸−様化合物を含む(例えば、AlaまたはA、CysまたはC、AspまたはD、GluまたはE、PheまたはF、GlyまたはG、HisまたはH、IleまたはI、LysまたはK、LeuまたはL、MetまたはM、AsnまたはN、ProまたはP、GlnまたはQ、ArgまたはR、SerまたはS、ThrまたはT、ValまたはV、TrpまたはW、TyrまたはY)。アミノ酸類似体は、また、修飾された側鎖または主鎖を有する天然アミノ酸を含む。アミノ酸類似体は、また、アミノ酸類似体の天然D体、ならびにL体と同じ立体化学を有するアミノ酸類似体を含む。いくつかの例では、アミノ酸類似体が、1個以上の天然アミノ酸の主鎖構造、及び/または側鎖構造を共有し、差(単数及び複数)は、分子中の1個以上の修飾された基である。かかる修飾は、関連原子(例えば、S)の原子(例えば、N)の置換、基(例えば、メチル、またはヒドロキシルなど)または原子(例えば、ClまたはBrなど)の付加、基の欠失、共有結合(二重結合などの単結合)の置換など、またはこれらの組み合わせを含んでよいが、これらに限定されない。例えば、アミノ酸類似体は、α−ヒドロキシ酸、及びα−アミノ酸などを含んでよい。
単糖、二糖、オリゴ糖、及び多糖の、モノマー単位及び/またはポリマーを意味するために用語「炭水化物」などを用いてよい。低分子炭水化物、例えば、単糖、二糖を意味するために用語、糖を用いてよい。用語「炭水化物誘導体」は、対象の炭水化物の1個以上の官能基が、置換されている(任意の好適な置換基によって置換されている)、修飾されている(任意の好適な化学を用いて、別の基に変換されている)または、ない(例えば、Hによって除去されている、または置換されている)化合物を含む。さまざまな炭水化物及び炭水化物誘導体があり、対象の化合物及びコンジュゲートに用いるために適合させてよい。
用語「抗体」は、最も広い意味に用いられ、単クローン性抗体(完全長単クローン性抗体を含む)、多クローン性抗体、及び多重特異性抗体(例えば、二重特異性抗体)、ヒト化抗体、単鎖抗体、キメラ抗体、抗体フラグメント(例えば、Fabフラグメント)などを含む。抗体は、標的抗原を結合することができる。(Janeway,C.,Travers,P.,Walport,M.,Shlomchik (2001) Immuno Biology,5th Ed.,Garland Publishing,New York)。標的抗原は、1つ以上の結合部位を有することができ、この部位はエピトープとも呼ばれ、抗体の1つ以上の可変領域によって形成される相補性決定領域(CDR)によって認識される。
用語「天然抗体」は、抗体の重鎖及び軽鎖が、多細胞生物の免疫系によって生成され、一組にされている抗体を指す。脾臓、リンパ節、骨髄及び血清が、天然抗体を生成する組織の例である。例えば、抗原で免疫性を与えた第1の動物から分離された抗体生成細胞によって生成される抗体が、天然抗体である。
用語「ヒト化抗体」または「ヒト化免疫グロブリン」は、ヒト抗体に由来する対応する位置のアミノ酸で置換されている1個以上のアミノ酸(例えば、フレームワーク領域、不変領域またはCDR中)を含有する非ヒト(例えば、マウスまたはウサギ)抗体を指す。一般に、ヒト化抗体は、同じ抗体の非ヒト化バージョンと比べて、ヒト宿主中の免疫反応が低下する。例えば、CDR−グラフティング(EP239,400;PCT公開WO91/09967;米国特許第5,225,539号;5,530,101号;及び5,585,089号)、ベニアリングまたはリサーフェイシング(EP592,106;EP519,596;Padlan,Molecular Immunology 28(4/5):489−498(1991);Studnicka et al.,Protein Engineering7(6):805−814(1994);Roguska.et al.,PNAS 91:969−973(1994))、及び鎖シャッフリング(米国特許第5,565,332号)を含む当技術分野で知られているさまざまな技術を用いて、抗体をヒト化することができる特定の実施形態では、特定の位置のフレームワーク残基を特定するための抗原結合及び配列比較に重要なフレームワーク残基を特定するために、フレームワーク置換が、CDR及びフレームワーク残基の相互作用のモデリングによって特定される(例えば、米国特許第5,585,089号;Riechmann et al.,Nature 332:323(1988)を参照)。さらに、本発明に用いるために検討されたヒト化抗体の方法が、米国特許第5,750,078号;5,502,167号;5,705,154号;5,770,403号;5,698,417号;5,693,493号;5,558,864号;4,935,496号;及び4,816,567号、及びPCT公開WO98/45331及びWO98/45332に記載されている。特定の実施形態では、米国特許第20040086979号及び米国特許第20050033031号に記載された方法に従って、対象のウサギ抗体をヒト化してよい。したがって、当技術分野でよく知られている方法を用いて、前記に記載された抗体をヒト化してよい。
用語「キメラ抗体」は、通常、異なる種に属する抗体可変及び不変領域遺伝子から遺伝子工学によって、軽鎖及び重鎖遺伝子が形成されている抗体を指す。例えば、マウス単クローン性抗体からの遺伝子の可変セグメントをヒト不変セグメント、例えば、ガンマ1及びガンマ3に結合してよい。治療用キメラ抗体の例は、マウス抗体からの可変または抗原−結合ドメイン及びヒト抗体からの不変またはエフェクタードメインからなるハイブリッドタンパク質であり、他の哺乳動物種からのドメインを用いてよい。
免疫グロブリンポリペプチド免疫グロブリン軽または重鎖可変領域は、3つの超可変領域によって中断されるフレームワーク領域(FR)からなり、また、「相補性決定領域」または「CDR」と称される。フレームワーク領域及びCDRの範囲が定義されている(“Sequences of Proteins of Immunological Interest,”E.Kabat et al.,U.S.Department of Health and Human Services,1991を参照)。抗体のフレームワーク領域は、構成要素である軽鎖及び重鎖が結合されたフレームワーク領域であり、CDRの位置を決め、CDRを整列する役割を果たす。CDRは、基本的に抗原のエピトープへの結合を担う。
本開示全体を通して、免疫グロブリン重鎖及び免疫グロブリン軽鎖中の残基のナンバリングは、Kabat et al.,Sequences of Proteins of Immunological Interest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,Md.(1991)に記載のとおりであり、参照により本明細書に明確に組み入れられる。
「親Igポリペプチド」は、本明細書に記載したとおり、アルデヒド標識の不変領域を欠くアミノ酸配列を含むポリペプチドである。親ポリペプチドは、天然配列の不変領域を含んでよい、または、既存のアミノ酸配列修飾(例えば、付加、欠失及び/または置換)を有する不変領域を含んでよい。
Igポリペプチドの文脈では、用語「不変領域」は、当技術分野でよく理解され、Ig重鎖、またはIg軽鎖のC−末端領域を指す。Ig重鎖不変領域は、CH1、CH2、及びCH3ドメイン(及び、重鎖がμまたはε重鎖であるCH4ドメイン)を含む。天然Ig重鎖では、CH1、CH2、CH3(及び、存在する場合、CH4)ドメインが、(C−末端へ)重鎖可変(VH)領域の直後に始まり、それぞれ、長さが約100アミノ酸〜約130アミノ酸である。天然Ig軽鎖では、不変領域が、(C−末端へ)軽鎖可変(VL)領域の直後に始まり、長さが約100アミノ酸〜120アミノ酸である。
本明細書に用いる場合、用語「CDR」または「相補性決定領域」は、重鎖及び軽鎖ポリペプチドの可変領域内にみられる非接触抗原の結合部位を意味することを意図する。CDRは、Kabat et al.,J.Biol.Chem.252:6609−6616(1977);Kabat et al.,U.S.Dept.of Health and Human Services,“Sequences of proteins of immunological interest”(1991);Chothia et al.,J.Mol.Biol.196:901−917(1987);及びMacCallum et al.,J.Mol.Biol.262:732−745(1996)に記載されており、定義は、互いに比較される場合、アミノ酸残基のオーバーラッピングまたはサブセットを含む。それにもかかわらず、抗体またはグラフト抗体またはこれらの変異体のCDRを指す定義のいずれかの適用では、本明細書で定義され、用いられるとおりの用語の範囲内であることを意図する。前記に記載した参照のそれぞれによって定義されるとおりのCDRを包含するアミノ酸残基は、比較として以下の表1に記載されている。
ポリペプチド、ペプチドまたはタンパク質のアミノ酸配列に関して用いられるとおり、「遺伝子的にコード化可能な」は、アミノ酸配列が、アミノ酸配列をコードする核酸の転写及び翻訳によって生成することができるアミノ酸残基からなることを意味し、転写及び/または翻訳は、細胞中または無細胞のin vitro転写/翻訳系で生じさせてよい。
用語「制御配列」は、特定の発現系発現、例えば、哺乳動物細胞、細菌性細胞、無細胞合成などで、作動可能に結合されたコード配列の発現を促進するDNA配列を指す。原核生物系に好適な制御配列は、例えば、プロモーター、任意でオペレーター配列、及びリボソーム結合部位を含む。真核細胞系では、プロモ−ター、ポリアデニル化シグナル、及びエンハンサーを用いてよい。
核酸がもう1つの核酸配列と機能的関係に置かれている場合、核酸は、「作動可能に結合」されている。例えば、プレ配列または分泌リーダーのDNAは、ポリペプチドの分泌に関与するプレタンパク質として発現する場合、ポリペプチドのDNAに作動可能に結合される;プロモーターまたはエンハンサーは、配列の転写に影響を及ぼす場合、コード配列に作動可能に結合される;またはリボソーム結合部位は、翻訳の開始を促進するように位置する場合、コード配列に作動可能に結合される。一般に、「作動可能に結合」は、結合されるDNA配列が、隣接しており、分泌リーダーの場合、隣接し、リーディングフレーム中にあることを意味する。リゲーションによって、または増幅反応によって、結合が実現される。従来の実施に従って、結合配列に合成オリゴヌクレオチドアダプターまたはリンカーを用いてよい。
用語「発現カセット」は、本明細書に用いる場合は、核酸に挿入することができる(例えば、対象の構成体にリゲーションと適合する制限部位を使用するによって、または、対象の構成体または宿主細胞ゲノムへの相同組み換えによって)核酸のセグメント、通常、DNAのセグメントを指す。一般に、核酸セグメントは、対象のポリペプチドをコードするポリヌクレオチドを含み、カセット及び制限部位は、転写及び翻訳のための好適なリーディングフレームにカセットを挿入するのを促進するように設計される。発現カセットは、また、宿主細胞中の対象のポリペプチドをコードするポリヌクレオチドの発現を促進するエレメントを含むことができる。これらのエレメントは、プロモ−ター、最小プロモ−ター、エンハンサー、応答エレメント、ターミネーター配列、ポリアデニル化配列、などを含んでよいが、これらに限定されない。
本明細書に用いる場合、用語「分離した」は、対象の化合物が、天然に生じる環境とは異なる環境にあることを示すことを意味する。「分離した」とは、化合物が、対象の化合物のために実質的に富化されている試料内にあること、および/または、化合物が、対象の化合物が部分的にまたは実質的に精製されている試料内にあることを含むことを意味する。
本明細書に用いる場合、用語「実質的に精製した」は、その天然の環境から除去されており、天然に関係している他の成分が、少なくとも60%含まれない、少なくとも75%含まれない、少なくとも80%含まれない、少なくとも85%含まれない、少なくとも90%含まれない、少なくとも95%含まれない、少なくとも98%含まれない、または98%以上含まれない化合物を指す。
用語「生理学的条件」は、生きている細胞と適合する条件、例えば、生きている細胞と適合する主として温度、pH、塩分濃度などの水溶液条件を包含することを意味する。
「反応パートナー」は、反応生成物を生成するために、特に別の反応パートナーと反応する分子または分子部分を意味する。例示的な反応パートナーとしては、スルファターゼモチーフのシステインまたはセリン及びホルミルグリシン生成酵素(FGE)が挙げられ、FGEは、反応して、モチーフ中のシステインまたはセリンの代わりにホルミルグリシン(FGly)を含有する変換アルデヒドタグの反応生成物を形成する。他の例示的な反応パートナーとしては、変換アルデヒドタグのfGly残基のアルデヒド(例えば、反応性アルデヒド基)及び「アルデヒド反応性反応パートナー」が挙げられる。これは、アルデヒド反応性基及び対象の部分を含み、反応して、修飾されたfGly残基を介して修飾ポリペプチドに共役される対象の部分を有する修飾されたアルデヒド標識ポリペプチドの反応生成物を形成する。
「N−末端」は、非−N−末端アミノ酸残基中のアミン基が、通常、ポリペプチドの共有結合主鎖の部分を形成する無アミン基を有するポリペプチドの末端アミノ酸残基を指す。
「C−末端」は、非−C−末端アミノ酸残基中のカルボキシル基が、通常、ポリペプチドの共有結合主鎖の部分を形成する無カルボキシル基を有するポリペプチドの末端アミノ酸残基を指す。
「内部部位」は、ポリペプチドのポリペプチドまたはアミノ酸配列に関して用いられるとおり、N−末端またはC−末端ではないポリペプチドの領域を意味する。
さらに本発明を記載する前に、本発明は、記載した特定の実施形態に限定されず、例えば、言うまでもなく、変えることができるものと理解しなければならない。さらに、本発明の範囲は、添付したクレームだけによって限定されるため、本明細書に用いられる専門用語は、特定の実施形態だけを記載する目的のためにあり、限定することを意図しないものと理解しなければならない。
値の範囲が提供される場合、その範囲の上限値と下限値の間の各中間値、文脈が明白に記載をしない限り、下限値の単位の10分の1まで、及びその示した範囲内の他の示した値または中間値が、本発明内に包含されるものとすると理解される。これより狭い範囲の上限値及び下限値は、独立してより狭い範囲に含んでよく、これも、示した範囲内の明確に除外したいずれかの境界値に従う限り、本発明内に包含される。示した範囲が境界値の一方または両方を含む場合、含まれる境界値のいずれかまたは両方を除外する範囲も本発明に含まれる。
明確さのために、個々の実施形態の文脈に記載される本発明の特定の特徴は、単一の実施形態と組み合わせて、提供してよいと理解される。反対に、簡潔のために、単一の実施形態の文脈に記載される本発明のさまざまな特徴は、別個にまたは好適な副組み合わせで、提供してよい。本発明に関係する実施形態の全組み合わせは、明確に本発明に包含され、かかる組み合わせが、例えば、化合物が安定した化合物(すなわち、生成し、分離し、特徴づけ、及び生物活性を試験することができる化合物)であるという構成要件を含む程度まで、あたかも組み合わせのそれぞれ及びすべてが、個々に及び明示的に開示されるように本明細書に開示される。また、さまざまな実施形態及びその要素(例えば、かかる変化を示す実施形態に記載された化学基の要素)の全副組み合わせも明確に本発明に包含され、あたかもかかる副組み合わせのそれぞれ及びすべてが、本明細書に個々に及び明示的に開示されるように本明細書に開示される。
特に定義しない限り、本明細書に用いられる全専門用語及び科学用語は、本発明が関係する当業者によって一般的に理解される意味と同じである。本発明の実施または試験では、本明細書に記載したものとほぼ同じまたは等しい任意の方法及び材料を用いることもできるが、ここに好適な方法及び材料を記載する。本明細書に記載した全出版物は、出版物が記載されているところに関係して、方法及び/または材料を開示及び記載するために参照により本明細書に組み込まれる。
本明細書及び添付したクレームに用いる場合、文脈が明らかに別段の指示をしない限り、単数形「a」、「an」及び「the」は複数の指示物を含むことを明記しなければならない。さらに、クレームを記載して、任意の要素を除外してよいことを示す。こうして、本明細書は、先行詞として、クレームの要素の列挙、または「否定的な」限定の使用と関連して、「単独で」、「唯一の」などのような除外用語を用いることを意図している。
明確さのために、個々の実施形態の文脈に記載される本発明の特定の特徴は、単一の実施形態と組み合わせて、提供してよいと理解される。反対に、簡潔のために、単一の実施形態の文脈に記載される本発明のさまざまな特徴は、別個にまたは好適な副組み合わせで、提供してよい。
本明細書に記載した出版物は、本出願の出願日の前に開示されたものだけが提供される。本明細書には、本発明が、以前の発明によってかかる出版物に先行する権利がないと容認するものとして解釈されるものはない。さらに、提供された出版物の日付は、別々に確認する必要があると思われる実際の出版物の日付と異なるものとしてよい。
詳細説明
本開示は、抗HER2抗体−メイタンシンコンジュゲート構造を提供する。本開示は、また、かかるコンジュゲートの生成方法、ならびにその使用方法を包含する。以下のセクションに、それぞれの実施形態が、さらに詳細に記載される。
コンジュゲート
本開示は、コンジュゲートを提供する。「コンジュゲート」は、第2の部分と安定して結合している第1の部分を意味する。「安定して結合した」は、標準条件下で別の部分または構造に結合している部分を意味する。特定の実施形態では、第1の部分及び第2の部分が、互いに1つ以上の共有結合によって結合されている。
特定の実施形態では、コンジュゲートが、第2の部分に共役されたポリペプチドを含むポリペプチドコンジュゲートである。特定の実施形態では、ポリペプチドに共役される部分は、対象のさまざまな部分のいずれかとすることができ、例えば、これらに限定されないが、検出可能標識、薬剤、水溶性ポリマー、または膜または表面へのポリペプチドの固定化のための部分である。ポリペプチドのいずれかの所望の部位で対象の部分をポリペプチドに共役することができる。このため、本開示は、例えば、ポリペプチドのC−末端の部位、またはこれの近くの部位で共役される部分を有する修飾ポリペプチドを提供する。他の例としては、ポリペプチドのN−末端の部位、またはこれの近くの部位で共役される部分を有する修飾ポリペプチドが挙げられる。また、この例としては、ポリペプチドのC−末端及びN−末端の間の位置で(例えば、ポリペプチドの内部部位で)共役される部分を有する修飾ポリペプチドが挙げられる。前記の組み合わせも可能であり、修飾ポリペプチドが2つ以上の部分に共役される。
本開示の実施形態では、ポリペプチドが、1つ以上の部分、例えば、2つの部分、3つの部分、4つの部分、5つの部分、6つの部分、7つの部分、8つの部分、9つの部分、または10以上の部分に共役されているコンジュゲートを含む。当該部分は、ポリペプチド中の1つ以上の部位でポリペプチドに共役させてよい。例えば、1つ以上の部分をポリペプチドの単一アミノ酸残基に共役させてよい。いくつかの場合では、1つの部分が、ポリペプチドのアミノ酸残基に共役されている。他の実施形態では、2つの部分をポリペプチドの同じアミノ酸残基に共役させてよい。他の実施形態では、第1の部分が、ポリペプチドの第1のアミノ酸残基に共役されており、第2の部分が、ポリペプチドの第2のアミノ酸残基に共役されている。また、前記の組み合わせが、可能であり、例えば、ポリペプチドが、第1のアミノ酸残基で第1の部分に共役されており、第2のアミノ酸残基で2つの他の部分に共役されている。また、他の組み合わせが、可能であり、例えば、これらに限定されないが、第1のアミノ酸残基で第1及び第2の部分に共役され、第2のアミノ酸残基で第3及び第4の部分に共役されたポリペプチドなどである。
1つ以上の部分に共役されているポリペプチドの1つ以上のアミノ酸残基は、天然アミノ酸、非天然アミノ酸、またはこれらの組み合わせとしてよい。例えば、コンジュゲートは、ポリペプチドの天然アミノ酸残基に共役された部分を含んでよい。他の例では、コンジュゲートは、ポリペプチドの非天然アミノ酸残基に共役された部分を含んでよい。前記に記載したとおり、単一天然または非天然アミノ酸残基で、1つ以上の部分をポリペプチドに共役させてよい。本明細書に記載したとおり、ポリペプチド中の1つ以上の天然または非天然アミノ酸残基を部分または部分に共役させてよい。例えば、ポリペプチド中の2つ(以上)のアミノ酸残基(例えば、天然または非天然アミノ酸残基)それぞれを1つまたは2つの部分に共役してよく、その結果、ポリペプチド中の複数の部位が修飾される。
本明細書に記載したとおり、ポリペプチドを1つ以上の部分に共役させてよい。特定の実施形態では、対象の部分が、化学成分、例えば、薬剤または検出可能標識である。例えば、薬剤を、ポリペプチドに共役させてよく、または他の実施形態では、検出可能標識をポリペプチドに共役させてよい。このため、例えば、本開示の実施形態としては、ポリペプチド及び薬剤のコンジュゲート;ポリペプチド及び検出可能標識のコンジュゲート;2つ以上の薬剤及びポリペプチドのコンジュゲート;2つ以上の検出可能標識及びポリペプチドのコンジュゲートなどが挙げられるが、これらに限定されない。
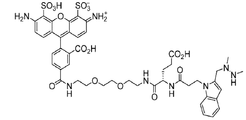
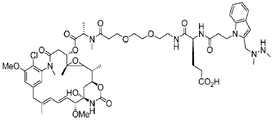
特定の実施形態では、ポリペプチド及び対象の部分が、カップリング部分を介して共役される。例えば、ポリペプチド及び対象の部分それぞれをカップリング部分に結合(例えば、共有結合)させてよく、この結果、ポリペプチド及び対象の部分がともにカップリング部分を介して、間接的に結合される。いくつかの場合では、カップリング部分が、ヒドラジニル−ピロロ化合物またはヒドラジニル−ピロロ化合物の誘導体を含む。例えば、ヒドラジニル−ピロロカップリング部分(例えば、ヒドラジノ−イソ−ピクテ−スペングラー(HIPS)カップリング部分)を介して、ポリペプチドに対象の部分をカップリングする一般的スキームが、以下の一般的反応スキームに示されている。
前記の反応スキームでは、R’’’は、ポリペプチドに共役されている対象の部分としてよい。本明細書に記載したとおり、部分は、さまざまな部分のいずれか、例えば、これらに限定されないが、化学成分、例えば、検出可能標識、または薬剤(例えば、マイタンシノイド)とすることができる。R’及びR’’それぞれは、独立して、任意の所望の置換基、例えば、これらに限定されないが、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルとしてよい。Q10、Q20、Q30及びQ40は、CR11、NR12、N、OまたはSとしてよく、Q10、Q20、Q30及びQ40の1つは、任意であり、R11及びR12は、任意の所望の置換基としてよい。
特定の実施形態では、ポリペプチドを対象の部分に共役させてよく、ポリペプチドは、対象の部分への共役前に修飾される。ポリペプチドの修飾では、対象の部分への共役に好適な1つ以上の反応性基を含有する修飾ポリペプチドを生成させてよい。いくつかの場合では、1つ以上のアミノ酸残基でポリペプチドを修飾し、対象の部分(例えば、前記に記載したとおり、カップリング部分を含む部分、例えば、ヒドラジニル−ピロロカップリング部分)への共役に好適な1つ以上の反応性基をもたらしてよい。例えば、反応性アルデヒド基(例えば、反応性アルデヒド)を含むようにポリペプチドを修飾してよい。反応性アルデヒドが、「アルデヒドタグ」または「ald−タグ」中に含まれてよく、このタグは、本明細書に用いる場合、ホルミルグリシン生成酵素(FGE)の作用によって変換され、2−ホルミルグリシン残基(本明細書では「FGly」と称する)を含有するスルファターゼモチーフ(例えば、L(C/S)TPSR)から誘導されるアミノ酸配列を指す。また、FGEによって生成されるFGly残基は、「ホルミルグリシン」と称してよい。別様に示すと、用語「アルデヒドタグ」は、「変換された」スルファターゼモチーフ(すなわち、システインまたはセリン残基が、FGE、例えば、L(FGly)TPSRの作用によってFGlyに変換されるスルファターゼモチーフ)を含むアミノ酸配列を指すように本明細書に用いられる。変換されたスルファターゼモチーフは、「未変換」スルファターゼモチーフ(すなわち、システインまたはセリン残基が、FGEによってFGlyに変換されないが、変換することができるスルファターゼモチーフ、例えば、配列:L(C/S)TPSRを有する未変換スルファターゼモチーフ)を含むアミノ酸配列から誘導してよい。「変換」は、スルファターゼモチーフでのホルミルグリシン生成酵素(FGE)の作用の文脈で用いられる場合、スルファターゼモチーフ中のシステインまたはセリン残基のホルミルグリシン(FGly)残基(例えば、CysからFGlyへ、またはSerからFGlyへ)への生化学的修飾を指す。さらに、アルデヒドタグ及び部位特異的タンパク質修飾でのアルデヒドタグの使用の態様が、米国特許第7,985,783号及び米国特許第8,729,232号に記載されており、これらの各開示は参照により本明細書に組み込まれる。
いくつかの場合では、化合物(例えば、前記に記載したとおり、ヒドラジニル−ピロロカップリング部分を含有する化合物)とFGlyの反応によって、FGly残基を含有する修飾ポリペプチドを対象の部分に共役させてよい。例えば、反応パートナーを含有する薬剤とFGly含有ポリペプチドを、当該薬剤を当該ポリペプチドに共役させるのに好適な条件下で、接触させてよい。いくつかの例では、反応パートナーを含有する薬剤は、前記に記載したとおり、ヒドラジニル−ピロロカップリング部分を含んでよい。
特定の実施形態では、本開示のコンジュゲートが、少なくとも1つの修飾アミノ酸残基を有するポリペプチド(例えば、抗体、例えば、抗HER2抗体)を含む。前記に記載したとおり、ヒドラジニル−ピロロ部分を含有する薬剤に、ポリペプチドの修飾アミノ酸残基を結合させてよい。特定の実施形態では、ポリペプチド(例えば、抗HER2抗体)の修飾アミノ酸残基は、前記に記載したとおり、FGly残基に変換されるシステインまたはセリン残基から誘導してよい。特定の実施形態では、FGly残基が、前記に記載したとおり、ヒドラジニル−ピロロ部分を含有する薬剤に共役され、薬剤がヒドラジニル−ピロロ部分を介してポリペプチドに共役されている本開示のコンジュゲートがもたらされる。本明細書に用いる場合、用語FGly’は、対象の部分(例えば、薬剤、例えば、マイタンシノイド)に結合されているポリペプチド(例えば、抗HER2抗体)の修飾アミノ酸残基を指す。
特定の実施形態では、コンジュゲートが、式(I)の少なくとも1つの修飾アミノ酸残基を含む。
式中、
Q
1が、CまたはNであり、Q
1が、Nである場合、Y
1は、ない;
Y
1が、水素、ハロゲン、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される;
R
1が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される;
R
2及びR
3それぞれが、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから独立して選択される、またはR
2及びR
3が、任意で、環状結合し、5または6員環ヘテロシクリルを形成する;
Lが、−(T
1−Z
1)
a−(T
2−Z
2)
b−(T
3−Z
3)
c−(T
4−Z
4)
d−を含むリンカーであり、式中、a、b、c及びdそれぞれが、独立して0または1であり、a、b、c及びdの合計が、1〜4である;
T
1、T
2、T
3及びT
4それぞれが、(C
1−C
12)アルキル、置換(C
1−C
12)アルキル、(EDA)
w、(PEG)
n、(AA)
p、−(CR
13OH)
h−、ピペリジン−4−アミノ(4AP)、アセタール基、ヒドラジン、及びエステルから独立して選択され、式中、EDAが、エチレンジアミン部分であり、PEGが、ポリエチレングリコールまたは修飾ポリエチレングリコールであり、AAが、アミノ酸残基であり、式中、wが、1〜20の整数であり、nが、1〜30の整数であり、pが、1〜20の整数であり、hが、1〜12の整数である;
Z
1、Z
2、Z
3及びZ
4それぞれが、共有結合、−CO−、−NR
15−、−NR
15(CH
2)
q−、−NR
15(C
6H
4)−、−CONR
15−、−NR
15CO−、−C(O)O−、−OC(O)−、−O−、−S−、−S(O)−、−SO
2−、−SO
2NR
15−、−NR
15SO
2−及び−P(O)OH−からなる群から独立して選択され、式中、qが、1〜6の整数である;
各R
13が、水素、アルキル、置換アルキル、アリール、及び置換アリールから独立して選択される;
各R
15が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、カルボキシル、カルボキシルエステル、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから独立して選択される;
W
1が、マイタンシノイドである;及び
W
2が、抗HER2抗体である。
特定の実施形態では、Q1が、CまたはNであり、Q1が、Nである場合、Y1は、ない。特定の実施形態では、Q1が、Cである。特定の実施形態では、Q1が、Nであり、Y1が、ない。
特定の実施形態では、Y1が、水素、ハロゲン、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される。特定の実施形態では、Y1が、水素である。特定の実施形態では、Y1が、ハロゲン、例えば、F、Cl、BrまたはIである。特定の実施形態では、Y1が、アルキルまたは置換アルキル、例えば、C1−6アルキルまたはC1−6置換アルキル、またはC1−4アルキルまたはC1−4置換アルキル、またはC1−3アルキルまたはC1−3置換アルキルである。特定の実施形態では、Y1が、アルケニルまたは置換アルケニル、例えば、C2−6アルケニルまたはC2−6置換アルケニル、またはC2−4アルケニルまたはC2−4置換アルケニル、またはC2−3アルケニルまたはC2−3置換アルケニルである。特定の実施形態では、Y1が、アルキニルまたは置換アルキニルである。特定の実施形態では、Y1が、アルコキシまたは置換アルコキシである。特定の実施形態では、Y1が、アミノまたは置換アミノである。特定の実施形態では、Y1が、カルボキシルまたはカルボキシルエステルである。特定の実施形態では、Y1が、アシルまたはアシルオキシである。特定の実施形態では、Y1が、アシルアミノまたはアミノアシルである。特定の実施形態では、Y1が、アルキルアミドまたは置換アルキルアミドである。特定の実施形態では、Y1が、スルホニルである。特定の実施形態では、Y1が、チオアルコキシまたは置換チオアルコキシである。特定の実施形態では、Y1が、アリールもしくは置換アリール、例えば、C5−8アリールもしくはC5−8置換アリール、例えば、C5アリールもしくはC5置換アリール、またはC6アリールもしくはC6置換アリールである。特定の実施形態では、Y1が、ヘテロアリールもしくは置換ヘテロアリール、例えば、C5−8ヘテロアリールもしくはC5−8置換ヘテロアリール、例えば、C5ヘテロ
アリールもしくはC5置換ヘテロアリール、またはC6ヘテロアリールもしくはC6置換ヘテロアリールである。特定の実施形態では、Y1が、シクロアルキルもしくは置換シクロアルキル、例えば、C3−8シクロアルキルもしくはC3−8置換シクロアルキル、例えば、C3−6シクロアルキルもしくはC3−6置換シクロアルキル、またはC3−5シクロアルキルもしくはC3−5置換シクロアルキルである。特定の実施形態では、Y1が、ヘテロシクリルもしくは置換ヘテロシクリル、例えば、C3−8ヘテロシクリルもしくはC3−8置換ヘテロシクリル、例えば、C3−6ヘテロシクリルもしくはC3−6置換ヘテロシクリル、またはC3−5ヘテロシクリルもしくはC3−5置換ヘテロシクリルである。
特定の実施形態では、R1が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される。特定の実施形態では、R1が、水素である。特定の実施形態では、R1が、アルキルもしくは置換アルキル、例えば、C1−6アルキルもしくはC1−6置換アルキル、またはC1−4アルキルもしくはC1−4置換アルキル、またはC1−3アルキルもしくはC1−3置換アルキルである。特定の実施形態では、R1が、アルケニルもしくは置換アルケニル、例えば、C2−6アルケニルもしくはC2−6置換アルケニル、またはC2−4アルケニルもしくはC2−4置換アルケニル、またはC2−3アルケニルもしくはC2−3置換アルケニルである。特定の実施形態では、R1が、アルキニルもしくは置換アルキニル、例えば、C2−6アルケニルもしくはC2−6置換アルケニル、またはC2−4アルケニルもしくはC2−4置換アルケニル、またはC2−3アルケニルもしくはC2−3置換アルケニルである。特定の実施形態では、R1が、アリールもしくは置換アリール、例えば、C5−8アリールもしくはC5−8置換アリール、例えば、C5アリールもしくはC5置換アリール、またはC6アリールもしくはC6置換アリールである。特定の実施形態では、R1が、ヘテロアリールもしくは置換ヘテロアリール、例えば、C5−8ヘテロアリールもしくはC5−8置換ヘテロアリール、例えば、C5ヘテロアリールもしくはC5置換ヘテロアリール、またはC6ヘテロアリールもしくはC6置換ヘテロアリールである。特定の実施形態では、R1が、シクロアルキルもしくは置換シクロアルキル、例えば、C3−8シクロアルキルもしくはC3−8置換シクロアルキル、例えば、C3−6シクロアルキルもしくはC3−6置換シクロアルキル、またはC3−5シクロアルキルもしくはC3−5置換シクロアルキルである。特定の実施形態では、R1が、ヘテロシクリルもしくは置換ヘテロシクリル、例えば、C3−8ヘテロシクリルもしくはC3−8置換ヘテロシクリル、例えば、C3−6ヘテロシクリルもしくはC3−6置換ヘテロシクリル、またはC3−5ヘテロシクリルもしくはC3−5置換ヘテロシク
リルである。
特定の実施形態では、R2及びR3それぞれが、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから独立して選択される、またはR2及びR3が、任意で、環状結合し、5または6員環ヘテロシクリルを形成する。
特定の実施形態では、R2が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される。特定の実施形態では、R2が、水素である。特定の実施形態では、R2が、アルキルもしくは置換アルキル、例えば、C1−6アルキルもしくはC1−6置換アルキル、またはC1−4アルキルもしくはC1−4置換アルキル、またはC1−3アルキルもしくはC1−3置換アルキルである。特定の実施形態では、R2が、アルケニルもしくは置換アルケニル、例えば、C2−6アルケニルもしくはC2−6置換アルケニル、またはC2−4アルケニルもしくはC2−4置換アルケニル、またはC2−3アルケニルもしくはC2−3置換アルケニルである。特定の実施形態では、R2が、アルキニルまたは置換アルキニルである。特定の実施形態では、R2が、アルコキシまたは置換アルコキシである。特定の実施形態では、R2が、アミノまたは置換アミノである。特定の実施形態では、R2が、カルボキシルまたはカルボキシルエステルである。特定の実施形態では、R2が、アシルまたはアシルオキシである。特定の実施形態では、R2が、アシルアミノまたはアミノアシルである。特定の実施形態では、R2が、アルキルアミドまたは置換アルキルアミドである。特定の実施形態では、R2が、スルホニルである。特定の実施形態では、R2が、チオアルコキシまたは置換チオアルコキシである。特定の実施形態では、R2が、アリールもしくは置換アリール、例えば、C5−8アリールもしくはC5−8置換アリール、例えば、C5アリールもしくはC5置換アリール、またはC6アリールもしくはC6置換アリールである。特定の実施形態では、R2が、ヘテロアリールもしくは置換ヘテロアリール、例えば、C5−8ヘテロアリールもしくはC5−8置換ヘテロアリール、例えば、C5ヘテロアリールもしくはC5置換ヘテロアリール、またはC6ヘテロアリールもしく
はC6置換ヘテロアリールである。特定の実施形態では、R2が、シクロアルキルもしくは置換シクロアルキル、例えば、C3−8シクロアルキルもしくはC3−8置換シクロアルキル、例えば、C3−6シクロアルキルもしくはC3−6置換シクロアルキル、またはC3−5シクロアルキルもしくはC3−5置換シクロアルキルである。特定の実施形態では、R2が、ヘテロシクリルもしくは置換ヘテロシクリル、例えば、C3−6ヘテロシクリルもしくはC3−6置換ヘテロシクリル、またはC3−5ヘテロシクリルもしくはC3−5置換ヘテロシクリルである。
特定の実施形態では、R3が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される。特定の実施形態では、R3が、水素である。特定の実施形態では、R3が、アルキルもしくは置換アルキル、例えば、C1−6アルキルもしくはC1−6置換アルキル、またはC1−4アルキルもしくはC1−4置換アルキル、またはC1−3アルキルもしくはC1−3置換アルキルである。特定の実施形態では、R3が、アルケニルもしくは置換アルケニル、例えば、C2−6アルケニルもしくはC2−6置換アルケニル、またはC2−4アルケニルもしくはC2−4置換アルケニル、またはC2−3アルケニルもしくはC2−3置換アルケニルである。特定の実施形態では、R3が、アルキニルまたは置換アルキニルである。特定の実施形態では、R3が、アルコキシまたは置換アルコキシである。特定の実施形態では、R3が、アミノまたは置換アミノである。特定の実施形態では、R3が、カルボキシルまたはカルボキシルエステルである。特定の実施形態では、R3が、アシルまたはアシルオキシである。特定の実施形態では、R3が、アシルアミノまたはアミノアシルである。特定の実施形態では、R3が、アルキルアミドまたは置換アルキルアミドである。特定の実施形態では、R3が、スルホニルである。特定の実施形態では、R3が、チオアルコキシまたは置換チオアルコキシである。特定の実施形態では、R3が、アリールもしくは置換アリール、例えば、C5−8アリールもしくはC5−8置換アリール、例えば、C5アリールもしくはC5置換アリール、またはC6アリールもしくはC6置換アリールである。特定の実施形態では、R3が、ヘテロアリールもしくは置換ヘテロアリール、例えば、C5−8ヘテロアリールもしくはC5−8置換ヘテロアリール、例えば、C5ヘテロアリールもしくはC5置換ヘテロアリール、またはC6ヘテロアリールもしく
はC6置換ヘテロアリールである。特定の実施形態では、R3が、シクロアルキルもしくは置換シクロアルキル、例えば、C3−8シクロアルキルもしくはC3−8置換シクロアルキル、例えば、C3−6シクロアルキルもしくはC3−6置換シクロアルキル、またはC3−5シクロアルキルもしくはC3−5置換シクロアルキルである。特定の実施形態では、R3が、ヘテロシクリルもしくは置換ヘテロシクリル、例えば、C3−8ヘテロシクリルもしくはC3−8置換ヘテロシクリル、例えば、C3−6ヘテロシクリルもしくはC3−6置換ヘテロシクリル、またはC3−5ヘテロシクリルもしくはC3−5置換ヘテロシクリルである。
特定の実施形態では、R2及びR3が、任意で、環状結合し、5または6−員環ヘテロシクリルを形成する。特定の実施形態では、R2及びR3が、環状結合し、5または6−員環ヘテロシクリルを形成する。特定の実施形態では、R2及びR3が、環状結合し、5−員環ヘテロシクリルを形成する。特定の実施形態では、R2及びR3が、環状結合し、6−員環ヘテロシクリルを形成する。
特定の実施形態では、式(I)の化合物が、リンカー、Lを含む。リンカーを用いて、カップリング部分を1つ以上の対象の部分及び/または1つ以上のポリペプチドに結合させてよい。いくつかの実施形態では、リンカーが、カップリング部分をポリペプチドまたは化学成分のいずれかに結合させる。リンカーを好適な位置でカップリング部分(例えば、本明細書に記載したとおり)に結合(例えば、共有結合)させてよい。
特定の実施形態では、Lが、カップリング部分をW1に結合させ、この結果、カップリング部分が、リンカーLを介して間接的にW1に結合される。
対象のコンジュゲート及び化合物に任意の好適なリンカーを用いてよい。特定の実施形態では、Lが、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシルアミノ、アルキルアミド、置換アルキルアミド、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される基を含む。特定の実施形態では、Lが、アルキルまたは置換アルキル基を含む。特定の実施形態では、Lが、アルケニルまたは置換アルケニル基を含む。特定の実施形態では、Lが、アルキニルまたは置換アルキニル基を含む。特定の実施形態では、Lが、アルコキシまたは置換アルコキシ基を含む。特定の実施形態では、Lが、アミノまたは置換アミノ基を含む。特定の実施形態では、Lが、カルボキシルまたはカルボキシルエステル基を含む。特定の実施形態では、Lが、アシルアミノ基を含む。特定の実施形態では、Lが、アルキルアミドまたは置換アルキルアミド基を含む。特定の実施形態では、Lが、アリールまたは置換アリール基を含む。特定の実施形態では、Lが、ヘテロアリールまたは置換ヘテロアリール基を含む。特定の実施形態では、Lが、シクロアルキルまたは置換シクロアルキル基を含む。特定の実施形態では、Lが、ヘテロシクリルまたは置換ヘテロシクリル基を含む。
特定の実施形態では、Lが、ポリマーを含む。例えば、ポリマーは、ポリエチレングリコール、メトキシポリエチレングリコール、ポリエチレングリコールホモポリマー、ポリプロピレングリコールホモポリマー、エチレングリコールのプロピレングリコールとのコポリマー(例えば、ホモポリマー及びコポリマーが、置換されていない、または1つの末端でアルキル基で置換されている)、ポリビニルアルコール、ポリビニルエチルエーテル、ポリビニルピロリドン、これらの組み合わせなどを含むポリアルキレングリコール及びこれらの誘導体を含んでよい。特定の実施形態では、ポリマーが、ポリアルキレングリコールである。特定の実施形態では、ポリマーが、ポリエチレングリコールである。以下にさらに詳細に記載したコンジュゲート及び化合物に示したとおり、他のリンカーも可能である。
いくつかの実施形態では、Lが、式−(L1)a−(L2)b−(L3)c−(L4)d−によって記載されたリンカーであり、式中、L1、L2、L3及びL4それぞれが、独立してリンカー単位であり、a、b、c及びdそれぞれが、独立して、0または1であり、a、b、c及びdの合計が、1〜4である。
特定の実施形態では、a、b、c及びdの合計が、1である。特定の実施形態では、a、b、c及びdの合計が、2である。特定の実施形態では、a、b、c及びdの合計が、3である。特定の実施形態では、a、b、c及びdの合計が、4である。特定の実施形態では、a、b、c及びdそれぞれが、1である。特定の実施形態では、a、b及びcそれぞれが、1であり、dが、0である。特定の実施形態では、a及びbそれぞれが、1であり、c及びdが、0である。特定の実施形態では、aが、1であり、b、c及びdが、0である。
特定の実施形態では、L1が、ヒドラジニル−ピロロ部分(例えば、前記の式(I)に示したとおり)に結合される。特定の実施形態では、L2が、存在する場合、W1に結合される。特定の実施形態では、L3が、存在する場合、W1に結合される。特定の実施形態では、L4が、存在する場合、W1に結合される。
対象のリンカーに任意の好適なリンカー単位を用いてよい。対象のリンカー単位としては、ポリマー、例えば、ポリエチレングリコール、ポリエチレン及びポリアクリレート、アミノ酸残基(単数及び複数)、炭水化物ベースポリマーまたは炭水化物残基及びこれらの誘導体、ポリヌクレオチド、アルキル基、アリール基、ヘテロサイクリック基、これらの組み合わせ、及びこれらの置換バージョンの単位が挙げられるが、これらに限定されない。いくつかの実施形態では、L1、L2、L3及びL4(存在する場合)のそれぞれが、ポリエチレングリコール、修飾されたポリエチレングリコール、アミノ酸残基、アルキル基、置換アルキル、アリール基、置換アリール基、及びジアミン(例えば、アルキレンジアミンを含む結合基)から独立して選択される1つ以上の基を含む。
いくつかの実施形態では、L1(存在する場合)が、ポリエチレングリコール、修飾されたポリエチレングリコール、アミノ酸残基、アルキル基、置換アルキル、アリール基、置換アリール基、またはジアミンを含む。いくつかの実施形態では、L1が、ポリエチレングリコールを含む。いくつかの実施形態では、L1が、修飾されたポリエチレングリコールを含む。いくつかの実施形態では、L1が、アミノ酸残基を含む。いくつかの実施形態では、L1が、アルキル基または置換アルキルを含む。いくつかの実施形態では、L1が、アリール基または置換アリール基を含む。いくつかの実施形態では、L1が、ジアミン(例えば、アルキレンジアミンを含む結合基)を含む。
いくつかの実施形態では、L2(存在する場合)が、ポリエチレングリコール、修飾されたポリエチレングリコール、アミノ酸残基、アルキル基、置換アルキル、アリール基、置換アリール基、またはジアミンを含む。いくつかの実施形態では、L2が、ポリエチレングリコールを含む。いくつかの実施形態では、L2が、修飾されたポリエチレングリコールを含む。いくつかの実施形態では、L2が、アミノ酸残基を含む。いくつかの実施形態では、L2が、アルキル基または置換アルキルを含む。いくつかの実施形態では、L2が、アリール基または置換アリール基を含む。いくつかの実施形態では、L2が、ジアミン(例えば、アルキレンジアミンを含む結合基)を含む。
いくつかの実施形態では、L3(存在する場合)が、ポリエチレングリコール、修飾されたポリエチレングリコール、アミノ酸残基、アルキル基、置換アルキル、アリール基、置換アリール基、またはジアミンを含む。いくつかの実施形態では、L3が、ポリエチレングリコールを含む。いくつかの実施形態では、L3が、修飾されたポリエチレングリコールを含む。いくつかの実施形態では、L3が、アミノ酸残基を含む。いくつかの実施形態では、L3が、アルキル基または置換アルキルを含む。いくつかの実施形態では、L3が、アリール基または置換アリール基を含む。いくつかの実施形態では、L3が、ジアミン(例えば、アルキレンジアミンを含む結合基)を含む。
いくつかの実施形態では、L4(存在する場合)が、ポリエチレングリコール、修飾されたポリエチレングリコール、アミノ酸残基、アルキル基、置換アルキル、アリール基、置換アリール基、またはジアミンから独立して選択される基を含む。いくつかの実施形態では、L4が、ポリエチレングリコールを含む。いくつかの実施形態では、L4が、修飾されたポリエチレングリコールを含む。いくつかの実施形態では、L4が、アミノ酸残基を含む。いくつかの実施形態では、L4が、アルキル基または置換アルキルを含む。いくつかの実施形態では、L4が、アリール基または置換アリール基を含む。いくつかの実施形態では、L4が、ジアミン(例えば、アルキレンジアミンを含む結合基)を含む。
いくつかの実施形態では、Lが、−(L1)a−(L2)b−(L3)c−(L4)d−を含むリンカーであり、式中、
−(L1)a−が、−(T1−Z1)a−である;
−(L2)b−が、−(T2−Z2)b−である;
−(L3)c−が、−(T3−Z3)c−である;及び
−(L4)d−が、−(T4−Z4)d−であり、
式中、T1、T2、T3及びT4が、存在する場合、テザー基である;
Z1、Z2、Z3及びZ4が、存在する場合、共有結合または結合官能基である;及び
a、b、c及びdそれぞれが、独立して0または1であり、a、b、c及びdの合計が、1〜4である。
前記に記載したとおり、特定の実施形態では、L1が、ヒドラジニル−ピロロ部分(例えば、前記の式(I)に示したとおり)に結合される。したがって、特定の実施形態では、T1が、ヒドラジニル−ピロロ部分(例えば、前記の式(I)に示したとおり)に結合される。特定の実施形態では、Z1が、W1に結合される。特定の実施形態では、L2が、存在する場合、W1に結合される。したがって、特定の実施形態では、T2が、存在する場合、W1に結合される、またはZ2が、存在する場合、W1に結合される。特定の実施形態では、L3が、存在する場合、W1に結合される。したがって、特定の実施形態では、T3が、存在する場合、W1に結合される、またはZ3が、存在する場合、W1に結合される。特定の実施形態では、L4が、存在する場合、W1に結合される。したがって、特定の実施形態では、T4が、存在する場合、W1に結合される、またはZ4が、存在する場合、W1に結合される。
テザー基、T1、T2、T3及びT4に関して、対象のリンカーに任意の好適なテザー基を用いてよい。いくつかの実施形態では、T1、T2、T3及びT4それぞれが、(C1−C12)アルキル、置換(C1−C12)アルキル、(EDA)w、(PEG)n、(AA)p、−(CR13OH)h−、ピペリジン−4−アミノ(4AP)、アセタール基、ヒドラジン、及びエステルから独立して選択される1つ以上の基を含み、式中、wが、1〜20の整数であり、nが、1〜30の整数であり、pが、1〜20の整数であり、hが、1〜12の整数である。
特定の実施形態では、a、b、c及びdの合計が、2であり、T
1−Z
1、T
2−Z
2、T
3−Z
3、またはT
4−Z
4の1つが、(PEG)
n−COである場合、nが、6ではない。例えば、いくつかの例では、リンカーが、以下の構造を有してよい。
式中、nが、6ではない。
特定の実施形態では、a、b、c及びdの合計が、2であり、T
1−Z
1、T
2−Z
2、T
3−Z
3、またはT
4−Z
4の1つが、(C
1−C
12)アルキル−NR
11である場合、(C
1−C
12)アルキルが、C
5−アルキルではない。例えば、いくつかの例では、リンカーが、以下の構造を有してよい。
式中、gが、4ではない。
特定の実施形態では、テザー基(例えば、T
1、T
2、T
3及び/またはT
4)が、エチレンジアミン(EDA)部分、例えば、EDA含有テザーを含む。特定の実施形態では、(EDA)
wが、1つ以上のEDA部分を含み、例えば、式中、wが、1〜50の整数であり、例えば、1〜40、1〜30、1〜20、1〜12または1〜6の整数、例えば、1、2、3、4、5または6である)。任意で、1つ以上の好適な位置で、任意の好適な置換基、例えば、アルキル、置換アルキル、アシル、置換アシル、アリールまたは置換アリールで結合エチレンジアミン(EDA)部分を置換してよい。特定の実施形態では、EDA部分が、以下の構造によって記載されている。
式中、yが、1〜6の整数であり、rが、0または1であり、各R
12が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから独立して選択される。特定の実施形態では、yが、1、2、3、4、5または6である。特定の実施形態では、yが、1であり、rが、0である。特定の実施形態では、yが、1であり、rが、1である。特定の実施形態では、yが、2であり、rが、0である。特定の実施形態では、yが、2であり、rが、1である。特定の実施形態では、各R
12が、水素、アルキル、置換アルキル、アリール、及び置換アリールから独立して選択される。特定の実施形態では、EDAの2つの隣接したR
12基のいずれかが、環状結合して、例えば、ピペラジニル環を形成してよい。特定の実施形態では、yが、1であり、2つの隣接したR
12基が、アルキル基であり、環状結合して、ピペラジニル環を形成する。特定の実施形態では、yが、1であり、隣接したR
12基が、水素、アルキル(例えば、メチル)及び置換アルキル(例えば、低級アルキル−OH、例えば、エチル−OHまたはプロピル−OH)から選択される。
特定の実施形態では、テザー基が、ピペリジン−4−アミノ(4AP)部分(また、本明細書では、4−アミノ−ピペリジン、4APと称される)を含む。4AP部分は、任意で、1つ以上の好適な位置で、任意の好適な置換基、例えば、アルキル、置換アルキル、ポリエチレングリコール部分、アシル、置換アシル、アリールまたは置換アリールで置換してよい。特定の実施形態では、4AP部分が、以下の構造によって記載されている。
式中、R
12が、水素、アルキル、置換アルキル、ポリエチレングリコール部分(例えば、ポリエチレングリコールまたは修飾されたポリエチレングリコール)、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される。特定の実施形態では、R
12が、ポリエチレングリコール部分である。特定の実施形態では、R
12が、カルボキシ修飾されたポリエチレングリコールである。特定の実施形態では、R
12が、以下の構造によって示してよい式:(PEG)
kによって記載されるポリエチレングリコール部分を含む。
式中、kが、1〜20の整数であり、例えば、1〜18、または1〜16、または1〜14、または1〜12、または1〜10、または1〜8、または1〜6、または1〜4の整数、または1もしくは2、例えば、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19または20である。いくつかの例では、kが、2である。特定の実施形態では、R
17が、OH、COOH、またはCOORから選択され、式中、Rが、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される。特定の実施形態では、R
17が、COOHである。
特定の実施形態では、テザー基(例えば、T
1、T
2、T
3及び/またはT
4)が、(PEG)
nであり、式中、(PEG)
nが、ポリエチレングリコールまたは修飾されたポリエチレングリコール結合単位である。特定の実施形態では、(PEG)
nが、以下の構造によって記載されている。
式中、nが、1〜50の整数であり、例えば、1〜40、1〜30、1〜20、1〜12または1〜6の整数、例えば、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19または20である。いくつかの例では、nが、3である。いくつかの例では、nが、6である。いくつかの例では、nが、12である。
特定の実施形態では、テザー基(例えば、T1、T2、T3及び/またはT4)が、(AA)pを含み、式中、AAが、アミノ酸残基である。任意の好適なアミノ酸を用いてよい。対象のアミノ酸としては、L−及びD−アミノ酸、天然アミノ酸、例えば、20一次α−アミノ酸及びβ−アラニン、非−天然アミノ酸(例えば、アミノ酸類似体)、例えば、非−天然α−アミノ酸または非−天然β−アミノ酸などのいずれかが挙げられるが、これらに限定されない。特定の実施形態では、pが、1である。特定の実施形態では、pが、1〜50の整数であり、例えば、1〜40、1〜30、1〜20、1〜12または1〜6の整数、例えば、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19または20である。
特定の実施形態では、テザー基(例えば、T1、T2、T3及び/またはT4)が、式−(CR13OH)h−によって記載される部分を含み、式中、hが、0であり、またはnが、1〜50の整数であり、例えば、1〜40、1〜30、1〜20、1〜12または1〜6の整数、例えば、1、2、3、4、5、6、7、8、9、10、11または12である。特定の実施形態では、R13が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから選択される。特定の実施形態では、R13が、水素である。特定の実施形態では、R13が、アルキルもしくは置換アルキル、例えば、C1−6アルキルもしくはC1−6置換アルキル、またはC1−4アルキルもしくはC1−4置換アルキル、またはC1−3アルキルもしくはC1−3置換アルキルである。特定の実施形態では、R13が、アルケニルもしくは置換アルケニル、例えば、C2−6アルケニルもしくはC2−6置換アルケニル、またはC2−4アルケニルもしくはC2−4置換アルケニル、またはC2−3アルケニルもしくはC2−3置換アルケニルである。特定の実施形態では、R13が、アルキニルまたは置換アルキニルである。特定の実施形態では、R13が、アルコキシまたは置換アルコキシである。特定の実施形態では、R13が、アミノまたは置換アミノである。特定の実施形態では、R13が、カルボキシルまたはカルボキシルエステルである。特定の実施形態では、R13が、アシルまたはアシルオキシである。特定の実施形態では、R13が、アシルアミノまたはアミノアシルである。特定の実施形態では、R13が、アルキルアミドまたは置換アルキルアミドである。特定の実施形態では、R13が、スルホニルである。特定の実施形態では、R13が、チオアルコキシまたは置換チオアルコキシである。特定の実施形態では、R13が、アリールもしくは置換アリール、例えば、C5−8アリー
ルもしくはC5−8置換アリール、例えば、C5アリールもしくはC5置換アリール、またはC6アリールもしくはC6置換アリールである。特定の実施形態では、R13が、ヘテロアリールもしくは置換ヘテロアリール、例えば、C5−8ヘテロアリールもしくはC5−8置換ヘテロアリール、例えば、C5ヘテロアリールもしくはC5置換ヘテロアリール、またはC6ヘテロアリールもしくはC6置換ヘテロアリールである。特定の実施形態では、R13が、シクロアルキルもしくは置換シクロアルキル、例えば、C3−8シクロアルキルもしくはC3−8置換シクロアルキル、例えば、C3−6シクロアルキルもしくはC3−6置換シクロアルキル、またはC3−5シクロアルキルもしくはC3−5置換シクロアルキルである。特定の実施形態では、R13が、ヘテロシクリルもしくは置換ヘテロシクリル、例えば、C3−8ヘテロシクリルもしくはC3−8置換ヘテロシクリル、例えば、C3−6ヘテロシクリルもしくはC3−6置換ヘテロシクリル、またはC3−5ヘテロシクリルもしくはC3−5置換ヘテロシクリルである。
特定の実施形態では、R13が、水素、アルキル、置換アルキル、アリール、及び置換アリールから選択される。これらの実施形態では、アルキル、置換アルキル、アリール、及び置換アリールが、R13について前記に記載したとおりである。
Z1、Z2、Z3及びZ4に関して、対象のリンカーに任意の好適な結合官能基を用いてよい。結合官能基の対象としては、アミノ、カルボニル、アミド、オキシカルボニル、カルボキシ、スルホニル、スルホキシド、スルホニルアミノ、アミノスルホニル、チオ、オキシ、ホスホ、ホスホラミデート、チオホスホラミデートなどが挙げられるが、これらに限定されない。いくつかの実施形態では、Z1、Z2、Z3及びZ4それぞれが、独立して共有結合、−CO−、−NR15−、−NR15(CH2)q−、−NR15(C6H4)−、−CONR15−、−NR15CO−、−C(O)O−、−OC(O)−、−O−、−S−、−S(O)−、−SO2−、−SO2NR15−、−NR15SO2−及び−P(O)OH−であり、式中、qが、1〜6の整数である。特定の実施形態では、qが、1〜6(例えば、1、2、3、4、5または6)の整数である。
いくつかの実施形態では、各R15が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから独立して選択される。特定の実施形態では、R15が、水素である。特定の実施形態では、R15が、アルキルもしくは置換アルキル、例えば、C1−6アルキルもしくはC1−6置換アルキル、またはC1−4アルキルもしくはC1−4置換アルキル、またはC1−3アルキルもしくはC1−3置換アルキルである。特定の実施形態では、R15が、アルケニルもしくは置換アルケニル、例えば、C2−6アルケニルもしくはC2−6置換アルケニル、またはC2−4アルケニルもしくはC2−4置換アルケニル、またはC2−3アルケニルもしくはC2−3置換アルケニルである。特定の実施形態では、R15が、アルキニルまたは置換アルキニルである。特定の実施形態では、R15が、アルコキシまたは置換アルコキシである。特定の実施形態では、R15が、アミノまたは置換アミノである。特定の実施形態では、R15が、カルボキシルまたはカルボキシルエステルである。特定の実施形態では、R15が、アシルまたはアシルオキシである。特定の実施形態では、R15が、アシルアミノまたはアミノアシルである。特定の実施形態では、R15が、アルキルアミドまたは置換アルキルアミドである。特定の実施形態では、R15が、スルホニルである。特定の実施形態では、R15が、チオアルコキシまたは置換チオアルコキシである。特定の実施形態では、R15が、アリールもしくは置換アリール、例えば、C5−8アリールもしくはC5−8置換アリール、例えば、C5アリールもしくはC5置換アリール、またはC6アリールもしくはC6置換アリールである。特定の実施形態では、R15が、ヘテロアリールもしくは置換ヘテロアリール、例えば、C5−8ヘテロアリールもしくはC5−8置換ヘテロアリール、例えば、C5ヘテロアリールもしくはC5置換ヘ
テロアリール、またはC6ヘテロアリールもしくはC6置換ヘテロアリールである。特定の実施形態では、R15が、シクロアルキルもしくは置換シクロアルキル、例えば、C3−8シクロアルキルもしくはC3−8置換シクロアルキル、例えば、C3−6シクロアルキルもしくはC3−6置換シクロアルキル、またはC3−5シクロアルキルもしくはC3−5置換シクロアルキルである。特定の実施形態では、R15が、ヘテロシクリルもしくは置換ヘテロシクリル、例えば、C3−8ヘテロシクリルもしくはC3−8置換ヘテロシクリル、例えば、C3−6ヘテロシクリルもしくはC3−6置換ヘテロシクリル、またはC3−5ヘテロシクリルもしくはC3−5置換ヘテロシクリルである。
特定の実施形態では、各R15が、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、カルボキシル、カルボキシルエステル、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルから独立して選択される。これらの実施形態では、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、カルボキシル、カルボキシルエステル、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリル置換基が、R15について前記に記載したとおりである。
いくつかの実施形態では、対象のリンカー中で、
T
1が、(C
1−C
12)アルキル及び置換(C
1−C
12)アルキルから選択される;
T
2、T
3及びT
4それぞれが、(C
1−C
12)アルキル、置換(C
1−C
12)アルキル、(EDA)
w、(PEG)
n、(AA)
p、−(CR
13OH)
h−、ピペリジン−4−アミノ(4AP)、アセタール基、ヒドラジン、及びエステルから独立して選択される;及び、
Z
1、Z
2、Z
3及びZ
4それぞれが、共有結合、−CO−、−NR
15−、−NR
15(CH
2)
q−、−NR
15(C
6H
4)−、−CONR
15−、−NR
15CO−、−C(O)O−、−OC(O)−、−O−、−S−、−S(O)−、−SO
2−、−SO
2NR
15−、−NR
15SO
2−及び−P(O)OH−からなる群から独立して選択され、式中、qが、1〜6の整数である;
式中、
(PEG)
nが、
であり、nが、1〜30の整数である;
EDAが、以下の構造:
を有するエチレンジアミン部分であり、
式中、yが、1〜6の整数であり、rが、0または1である;
ピペリジン−4−アミノが、
である;
AAが、アミノ酸残基であり、式中、pが、1〜20の整数である;及び、
各R
11及びR
12が、水素、アルキル、置換アルキル、アリール及び置換アリールから独立して選択され、式中、任意の2つの隣接したR
12基が、環状結合して、ピペラジニル環を形成する;及び、
R
13が、水素、アルキル、置換アルキル、アリール、及び置換アリールから選択される。
特定の実施形態では、T
1、T
2、T
3及びT
4及びZ
1、Z
2、Z
3及びZ
4が、以下の表、例えば、以下の表の1つの列から選択される。
特定の実施形態では、Lが、−(L1)a−(L2)b−(L3)c−(L4)d−を含むリンカーであり、式中、−(L1)a−が、−(T1−Z1)a−である;−(L2)b−が、−(T2−Z2)b−である;−(L3)c−が、−(T3−Z3)c−である;及び−(L4)d−が、−(T4−Z4)d−である。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が、−NR15−であり、T3が、(PEG)nであり、Z3が、−CO−であり、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(EDA)wであり、Z2が、−CO−であり、T3が、(CR13OH)hであり、Z3が、−CONR15−であり、T4が、(C1−C12)アルキルであり、Z4が、−CO−である。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が、−NR15−であり、T3が、(C1−C12)アルキルであり、Z3が、−CO−であり、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、(PEG)nであり、Z2が、−CO−であり、T3が存在せず、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が存在せず、T3が存在せず、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、(PEG)nであり、Z2が、−NR15−であり、T3が存在せず、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が、−NR15−であり、T3が、(PEG)nであり、Z3が、−NR15−であり、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(EDA)wであり、Z2が、−CO−であり、T3が存在せず、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、(C1−C12)アルキルであり、Z2が、−NR15−であり、T3が存在せず、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、(PEG)nであり、Z2が、−CO−であり、T3が、(EDA)wであり、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(EDA)wであり、Z2が存在せず、T3が存在せず、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、(PEG)nであり、Z2が、−CO−であり、T3が、(AA)pであり、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(EDA)wであり、Z2が、−CO−であり、T3が、(CR13OH)hであり、Z3が、−CO−であり、T4が、(AA)pであり、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が、−NR15−であり、T3が、(C1−C12)アルキルであり、Z3が、−CO−であり、T4が、(AA)pであり、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が、−NR15−であり、T3が、(PEG)nであり、Z3が、−CO−であり、T4が、(AA)pであり、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が、−NR11−であり、T3が、(PEG)nであり、Z3が、−SO2−であり、T4が、(AA)pであり、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(EDA)wであり、Z2が、−CO−であり、T3が、(CR13OH)hであり、Z3が、−CONR15−であり、T4が、(PEG)nであり、Z4が、−CO−である。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(CR13OH)hであり、Z2が、−CO−であり、T3が存在せず、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、置換(C1−C12)アルキルであり、Z2が、−NR15−であり、T3が、(PEG)nであり、Z3が、−CO−であり、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−SO2−であり、T2が、(C1−C12)アルキルであり、Z2が、−CO−であり、T3が存在せず、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、(C1−C12)アルキルであり、Z2が存在せず、T3が、(CR13OH)hであり、Z3が、−CONR15−であり、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が、−NR15−であり、T3が、(PEG)nであり、Z3が、−CO−であり、T4が、(AA)pであり、Z4が、−NR15−である。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(AA)pであり、Z2が、−NR15−であり、T3が、(PEG)nであり、Z3が、−P(O)OH−であり、T4が、(AA)pであり、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(EDA)wであり、Z2が存在せず、T3が、(AA)pであり、Z3が存在せず、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(EDA)wであり、Z2が、−CO−であり、T3が、(CR13OH)hであり、Z3が、−CONR15−であり、T4が、(C1−C12)アルキルであり、Z4が、−CO(AA)p−である。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、(C1−C12)アルキルであり、Z2が、−NR15−であり、T3が存在せず、Z3が、−CO−であり、T4が存在せず、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CONR15−であり、T2が、(C1−C12)アルキルであり、Z2が、−NR15−であり、T3が存在せず、Z3が、−CO−であり、T4が、(C1−C12)アルキルであり、Z4が、−NR15−である。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、(EDA)wであり、Z2が、−CO−であり、T3が、(CR13OH)hであり、Z3が、−CONR15−であり、T4が、(PEG)nであり、Z4が、−CO(AA)p−である。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、4APであり、Z2が、−CO−であり、T3が、(C1−C12)アルキルであり、Z3が、−CO−であり、T4が、(AA)pであり、Z4が存在しない。
特定の実施形態では、T1が、(C1−C12)アルキルであり、Z1が、−CO−であり、T2が、4APであり、Z2が、−CO−であり、T3が、(C1−C12)アルキルであり、Z3が、−CO−であり、T4が存在せず、Z4が存在しない。
特定の実施形態では、リンカーが、以下の構造のうちの1つによって記載される。
前記記載のリンカー構造の特定の実施形態では、各fが、独立して、0または1〜12の整数である;各yが、独立して、0または1〜20の整数である;各nが、独立して、0または1〜30の整数である;各pが、独立して、0または1〜20の整数である;各hが、独立して、0または1〜12の整数である;各Rが、独立して、水素、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルである;及び各R’が、独立して、H、アミノ酸の側鎖、アルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アルコキシ、置換アルコキシ、アミノ、置換アミノ、カルボキシル、カルボキシルエステル、アシル、アシルオキシ、アシルアミノ、アミノアシル、アルキルアミド、置換アルキルアミド、スルホニル、チオアルコキシ、置換チオアルコキシ、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、シクロアルキル、置換シクロアルキル、ヘテロシクリル、及び置換ヘテロシクリルである。前記記載のリンカー構造の特定の実施形態では、各fが、独立して、0、1、2、3、4、5または6である;各yが、独立して、0、1、2、3、4、5または6である;各nが、独立して、0、1、2、3、4、5または6である;各pが、独立して、0、1、2、3、4、5または6である;及び各hが、独立して、0、1、2、3、4、5または6である。前記記載のリンカー構造の特定の実施形態では、各Rが、独立して、H、メチルまたは−(CH2)m−OHであり、式中、mが、1、2、3または4(例えば、2)である。
特定の実施形態では、W1が、マイタンシノイドである。以下のセクションに、マイタンシノイドが、さらに詳細に記載される。
特定の実施形態では、W2が、抗HER2抗体である。以下のセクションに、抗HER2抗体が、さらに詳細に記載される。
対象の化合物及びコンジュゲートに用いるのに、前記の構造に記載した化学成分、リンカー及びカップリング部分のいずれかを適合させてよい。
さらに、ヒドラジニル−インドール化合物及びコンジュゲートの生成方法に関する開示が、2013年3月11日に出願された米国特許出願第13/794,159号にみられ、本出願の開示は参照として本明細書に全体が組み込まれる。
抗HER2抗体
前記に記載したとおり、対象のコンジュゲートが、置換基W2として2−ホルミルグリシン(FGly)残基を含むように修飾された抗HER2抗体を含むことができる。本明細書に用いる場合、アミノ酸を、その標準名称、その3文字の標準略名及び/またはその1文字の標準略名で呼んでよい。例えば、アラニンまたはAlaまたはA;システインまたはCysまたはC;アスパラギン酸またはAspまたはD;グルタミン酸またはGluまたはE;フェニルアラニンまたはPheまたはF;グリシンまたはGlyまたはG;ヒスチジンまたはHisまたはH;イソロイシンまたはIleまたはI;リジンまたはLysまたはK;ロイシンまたはLeuまたはL;メチオニンまたはMetまたはM;アスパラギンまたはAsnまたはN;プロリンまたはProまたはP;グルタミンまたはGlnまたはQ;アルギニンまたはArgまたはR;セリンまたはSerまたはS;トレオニンまたはThrまたはT;バリンまたはValまたはV;トリプトファンまたはTrpまたはW;及びチロシンまたはTyrまたはYである。
いくつかの場合では、好適な抗HER2抗体が、HER2のドメインI内のエピトープ、例えば、図4に示されたHER2アミノ酸配列のアミノ酸23〜217内のエピトープを結合する。いくつかの場合では、好適な抗HER2抗体が、HER2のドメインII内のエピトープ、例えば、図4に示されたHER2アミノ酸配列のアミノ酸218〜341内のエピトープを結合する。いくつかの場合では、好適な抗HER2抗体が、HER2のドメインIII内のエピトープ、例えば、図4に示されたHER2アミノ酸配列のアミノ酸342〜510内のエピトープを結合する。いくつかの場合では、好適な抗HER2抗体が、HER2のドメインIV内のエピトープ、例えば、図4に示されたHER2アミノ酸配列のアミノ酸511〜636内のエピトープを結合する。
いくつかの場合では、好適な抗HER2抗体が、図4に示されたとおり、配列番号://のアミノ酸529〜625内のエピトープを結合する。いくつかの場合では、好適な抗HER2抗体が、図4に示されたとおり、配列番号://のアミノ酸561〜625内のエピトープを結合する。
いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、第2の抗HER2抗体を有するHER2内のエピトープへの結合と競合する、及び/または、第2の抗HER2抗体として、HER2内の同じエピトープを結合する。いくつかの場合では、第2の抗HER2抗体を有するHER2内のエピトープへの結合と競合する抗HER2抗体が、また、第2の抗HER2抗体としてエピトープに結合する。いくつかの場合では、第2の抗HER2抗体を有するHER2内のエピトープへの結合と競合する抗HER2抗体が、第2の抗HER2抗体によって結合されたエピトープ内でオーバーラッピングしているエピトープに結合する。
対象のコンジュゲートに用いるのに好適な抗HER2抗体が、いくつかの場合では、HER2を過剰発現するヒト腫瘍細胞の増殖を抑制し、当該抑制は、in vitro、in vivo、またはin vitro及びin vivoの両者で生じる。例えば、いくつかの場合では、対象のコンジュゲートに用いるのに好適な抗HER2抗体が、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、または80%以上、例えば、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約98%、少なくとも約99%、または100%、HER2を過剰発現するヒト腫瘍細胞の増殖を抑制する。
いくつかの場合では、対象のコンジュゲートに用いるのに好適な抗HER2抗体が、HER2のHER3及び/または他のEGFR受容体への二量体化を抑制する。いくつかの場合では、対象のコンジュゲートに用いるのに好適な抗HER2抗体が、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、または80%以上、例えば、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約98%、少なくとも約99%、または100%、HER2のHER3及び/または他のEGFR受容体への二量体化を抑制する。
4D5
いくつかの場合では、好適な抗HER2抗体が、図4に示されたとおり、配列番号://のアミノ酸511〜636内のエピトープを結合する。いくつかの場合では、好適な抗HER2抗体が、図4に示されたとおり、配列番号://のアミノ酸529〜625内のエピトープを結合する。いくつかの場合では、好適な抗HER2抗体が、図4に示されたとおり、配列番号://のアミノ酸561〜625内のエピトープを結合する。
いくつかの場合では、好適な抗HER2抗体が、DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)から選択される重鎖相補性決定領域(CDR)を含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)から選択される軽鎖CDRを含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、VH CDR DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)を含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、VL CDR RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)を含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、VH CDR DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)及びVL CDR RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)を含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、VH CDR DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、VL CDR RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、VH CDR DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)及びVL CDR RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://)を含む抗HER2 VH領域中に存在するVH CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)を含む抗HER2 VL領域中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://)中に存在するVH CDR及びDIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、VHアミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://)を含む。いくつかの場合では、好適な抗HER2抗体が、VLアミノ酸配列DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)を含む。いくつかの場合では、好適な抗HER2抗体が、VHアミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://);及びVLアミノ酸配列DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖不変領域が、FGly残基を含むように修飾されているVHアミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://)を含む。いくつかの場合では、好適な抗HER2抗体が、軽鎖不変領域が、FGly残基を含むように修飾されているVLアミノ酸配列DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)を含む。
ヒト化2C4
いくつかの場合では、好適な抗HER2抗体が、HER2のドメインII内のエピトープ、例えば、図4に示されたアミノ酸配列のアミノ酸218〜341内のエピトープを結合する。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)から選択される重鎖相補性決定領域(CDR)を含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)から選択される軽鎖CDRを含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む;及び軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む;及び軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMD(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYRYT(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMD(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む;及び軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYRYT(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含む抗HER2 VH領域中に存在するVH CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含む抗HER2 VL領域中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含む抗HER2 VH領域中に存在するVH CDRを含む;及び以下のアミノ酸配列:DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含む抗HER2 VL領域中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、アミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含むVH領域を含む。いくつかの場合では、好適な抗HER2抗体が、アミノ酸配列DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含むVL領域を含む。いくつかの場合では、好適な抗HER2抗体が、アミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含むVH領域を含む;及びアミノ酸配列DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含むVL領域を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖不変領域が、FGly残基を含むように修飾されているアミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含むVH領域を含む。いくつかの場合では、好適な抗HER2抗体が、軽鎖不変領域が、FGly残基を含むように修飾されているアミノ酸配列DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含むVL領域を含む。
Symphogen抗HER2
いくつかの場合では、好適な抗HER2抗体が、GFTFSSYG(配列番号://)、GFNIKDIF(配列番号://)、GYTFTNYW(配列番号://)、GYTFTDYY(配列番号://)、GYTFTDYS(配列番号://)、GYTFTSHW(配列番号://)、GYTFTGYW(配列番号://)、GYTFTSYW(配列番号://)、及びGYSFTDYN(配列番号://)から選択されるVH CDR1;及び/またはISGGGSYT(配列番号://)、IDPANDNP(配列番号://)、IHPSDSDV(配列番号://)、INPNNGGT(配列番号://)、INTATGEP(配列番号://)、INPSNGGT(配列番号://)、ILPGSGST(配列番号://)、IHPNSGSI(配列番号://)、ILPGGYT(配列番号://)、及びIDPYNGGT(配列番号://)から選択されるVH CDR2;及び/またはCARKGNYGNYGKLAYW(配列番号://)、CAGGPAYFDYW(配列番号://)、CAKSYYDSAMDYW(配列番号://)、CVPGGLRSYFDYW(配列番号://)、CTAWAYEPYFDYW(配列番号://)、CARAYYDFSWFVYW(配列番号://)、CARWGDGSFAYW(配列番号://)、CAGYGNGPMDYW(配列番号://)、CARGSSGYPYYFDYW(配列番号://)、及びCARGAGYALDYW(配列番号://)から選択されるVH CDR1を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、ENIYSN(配列番号://)、QDVIAA(配列番号://)、KSVTTSGYSY(配列番号://)、QDVSAA(配列番号://)、QDVFTA(配列番号://)、QDISNY(配列番号://)、QNVGTA(配列番号://)、SSVSY(配列番号://)、及びQDVGTA(配列番号://)から選択されるVL CDR1;及び/またはAAT、WAS、VAS、SAS、IS、STS、RTS、及びLTSから選択されるVL CDR2;及び/またはCQHFWGTPWTF(配列番号://)、CQQHYSTPWTF(配列番号://)、CHHSRELPWTF(配列番号://)、CQQHYTTPPTF(配列番号://)、CQQHFGIPWTF(配列番号://)、CQQGNTLPLTF(配列番号://)、CQQYRSYPFTF(配列番号://)、CQQYHNYPLTF(配列番号://)、CQQYSSYPYMYTF(配列番号://)、及びCQQWSSTPYTF(配列番号://)から選択されるVL CDR3を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、下記のとおり、VH CDR1、CDR2、及びCDR3配列を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GFTFSSYG(配列番号://)、ISGGGSYT(配列番号://)、及びCARKGNYGNYGKLAYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GFNIKDIF(配列番号://)、IDPANDNP(配列番号://)、及びCAGGPAYFDYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GYTFTNYW(配列番号://)、IHPSDSDV(配列番号://)、及びCAKSYYDSAMDYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GYTFTDYY(配列番号://)、INPNNGGT(配列番号://)、及びCVPGGLRSYFDYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GYTFTDYS(配列番号://)、INTATGEP(配列番号://)、及びCTAWAYEPYFDYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GYTFTSHW(配列番号://)、INPSNGGT(配列番号://)、及びCARAYYDFSWFVYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GYTFTGYW(配列番号://)、ILPGSGST(配列番号://)、及びCARWGDGSFAYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GYTFTSYW(配列番号://)、IHPNSGSI(配列番号://)、及びCAGYGNGPMDYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GYTFTNYW(配列番号://)、ILPGGYT(配列番号://)、及びCARGSSGYPYYFDYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR配列GYSFTDYN(配列番号://)、IDPYNGGT(配列番号://)、CARGAGYALDYW(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。前記の実施形態のいずれかでは、抗体をヒト化することができる。
いくつかの場合では、好適な抗HER2抗体が、下記のとおり、VL CDR1、CDR2、及びCDR3配列を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列ENIYSN(配列番号://)、AAT、及びCQHFWGTPWTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列QDVIAA(配列番号://)、WAS、及びCQQHYSTPWTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列KSVTTSGYSY(配列番号://)、VAS、及びCHHSRELPWTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列QDVSAA(配列番号://)、WAS、及びCQQHYTTPPTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列QDVFTA(配列番号://)、SAS、及びCQQHFGIPWTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列QDISNY(配列番号://)、IS、及びCQQGNTLPLTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列QNVGTA(配列番号://)、STS、及びCQQYRSYPFTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列SSVSY(配列番号://)、RTS、及びCQQYHNYPLTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列QDVGTA(配列番号://)、WAS、及びCQQYSSYPYMYTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VL CDR配列SSVSY(配列番号://)、LTS、及びCQQWSSTPYTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。前記の実施形態のいずれかでは、抗体をヒト化することができる。
いくつかの場合では、好適な抗HER2抗体が、下記のとおり、VH CDR1、CDR2、及びCDR3配列を含み、VL CDR1、CDR2、及びCDR3配列を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GFTFSSYG(配列番号://)、ISGGGSYT(配列番号://)、及びCARKGNYGNYGKLAYW(配列番号://)を含み、VL CDR ENIYSN(配列番号://)、AAT、及びCQHFWGTPWTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GFNIKDIF(配列番号://)、IDPANDNP(配列番号://)、及びCAGGPAYFDYW(配列番号://)を含み、VL CDR QDVIAA(配列番号://)、WAS、及びCQQHYSTPWTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GYTFTNYW(配列番号://)、IHPSDSDV(配列番号://)、及びCAKSYYDSAMDYW(配列番号://)を含み、VL CDR KSVTTSGYSY(配列番号://)、VAS、及びCHHSRELPWTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GYTFTDYY(配列番号://)、INPNNGGT(配列番号://)、及びCVPGGLRSYFDYW(配列番号://)を含み、VL CDR QDVSAA(配列番号://)、WAS、及びCQQHYTTPPTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GYTFTDYS(配列番号://)、INTATGEP(配列番号://)、及びCTAWAYEPYFDYW(配列番号://)を含み、VL CDR QDVFTA(配列番号://)、SAS、及びCQQHFGIPWTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GYTFTSHW(配列番号://)、INPSNGGT(配列番号://)、及びCARAYYDFSWFVYW(配列番号://)を含み、VL CDR QDISNY(配列番号://)、IS、及びCQQGNTLPLTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GYTFTGYW(配列番号://)、ILPGSGST(配列番号://)、及びCARWGDGSFAYW(配列番号://)を含み、VL CDR QNVGTA(配列番号://)、STS、及びCQQYRSYPFTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GYTFTSYW(配列番号://)、IHPNSGSI(配列番号://)、及びCAGYGNGPMDYW(配列番号://)を含み、VL CDR SSVSY(配列番号://)、RTS、及びCQQYHNYPLTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GYTFTNYW(配列番号://)、ILPGGYT(配列番号://)、及びCARGSSGYPYYFDYW(配列番号://)を含み、VL CDR QDVGTA(配列番号://)、WAS、及びCQQYSSYPYMYTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。いくつかの場合では、好適な抗HER2抗体が、VH CDR GYSFTDYN(配列番号://)、IDPYNGGT(配列番号://)、CARGAGYALDYW(配列番号://)を含み、VL CDR SSVSY(配列番号://)、LTS、及びCQQWSSTPYTF(配列番号://)を含む抗体を有するHER2ポリペプチド中のエピトープへの結合と競合する。前記の実施形態のいずれかでは、抗体をヒト化することができる。
Alper BioTech 2HE
いくつかの場合では、好適な抗HER2抗体が、HER2ポリペプチドのドメインII内のエピトープ、例えば、図4に示したHER2アミノ酸配列のアミノ酸LVTYNTDTFE内、アミノ酸SMPNPEGRYT内、またはアミノ酸YNYLSTDVGS内のエピトープを結合する。いくつかの場合では、好適な抗HER2抗体が、HER2ポリペプチドのドメインIII内のエピトープ、例えば、図4に示したHER2アミノ酸配列のアミノ酸ETLEEITGYL内、アミノ酸YISAWPDSLP内、またはアミノ酸YSLTLQGLGI内のエピトープを結合する。いくつかの場合では、好適な抗HER2抗体が、HER2ポリペプチドのドメインIV内のエピトープ、例えば、図4に示したHER2アミノ酸配列のアミノ酸PREYVNARHC内、アミノ酸ADQCVACAHY内、またはアミノ酸PSGVKPDLSY内のエピトープを結合する。
いくつかの場合では、好適な抗HER2抗体が、GFSLTSYV(VH CDR1;配列番号://)、IWTGGGT(VH CDR2;配列番号://)、及びASLSYDGFDYW(VH CDR3;配列番号://)から選択される重鎖相補性決定領域(CDR)を含む抗体を有するHER2エピトープへの結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、SSVSY(VL CDR1;配列番号://)、DTS(VL CDR2)、及びQQWSSNPLT(VL CDR3;配列番号://)から選択される軽鎖CDRを含む抗体を有するHER2エピトープへの結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、VH CDR GFSLTSYV(VH CDR1;配列番号://)、IWTGGGT(VH CDR2;配列番号://)、及びASLSYDGFDYW(VH CDR3;配列番号://)を含む抗体を有するHER2エピトープへの結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、VL CDR SSVSY(VL CDR1;配列番号://)、DTS(VL CDR2)、及びQQWSSNPLT(VL CDR3;配列番号://)を含む抗体を有するHER2エピトープへの結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、VH CDR GFSLTSYV(VH CDR1;配列番号://)、IWTGGGT(VH CDR2;配列番号://)、及びASLSYDGFDYW(VH CDR3;配列番号://)を含み、VL CDR SSVSY(VL CDR1;配列番号://)、DTS(VL CDR2)、及びQQWSSNPLT(VL CDR3;配列番号://)を含む抗体を有するHER2エピトープへの結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、VH CDR GFSLTSYV(VH CDR1;配列番号://)、IWTGGGT(VH CDR2;配列番号://)、及びASLSYDGFDYW(VH CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、VL CDR SSVSY(VL CDR1;配列番号://)、DTS(VL CDR2)、及びQQWSSNPLT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、VH CDR GFSLTSYV(VH CDR1;配列番号://)、IWTGGGT(VH CDR2;配列番号://)、及びASLSYDGFDYW(VH CDR3;配列番号://)を含み、VL CDR SSVSY(VL CDR1;配列番号://)、DTS(VL CDR2)、及びQQWSSNPLT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
いくつかの場合では、好適な抗HER2抗体が、以下のVHアミノ酸配列:GPGLAAPSQSLSITCTVSGFSLTSYVISWVRQPPGKGLEWLGVIWTGGGTNYNSALKSRLSISKDNSKSQVSLKMNSLQTDDTARYYCASLSYDGFDYWGQGTTVT(配列番号://)中に存在するVH CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、以下のVLアミノ酸配列:ILMTQSPAIMSASPGEKVTMTCSASSSVSYMHWYQQKSGTSPKRWIYDTSKLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLEIK(配列番号://)中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、好適な抗HER2抗体が、以下のVHアミノ酸配列:GPGLAAPSQSLSITCTVSGFSLTSYVISWVRQPPGKGLEWLGVIWTGGGTNYNSALKSRLSISKDNSKSQVSLKMNSLQTDDTARYYCASLSYDGFDYWGQGTTVT(配列番号://)中に存在するVH CDRを含み、以下のVLアミノ酸配列:ILMTQSPAIMSASPGEKVTMTCSASSSVSYMHWYQQKSGTSPKRWIYDTSKLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLEIK(配列番号://)中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。
修飾された不変領域配列
前記に記載したとおり、抗HER2抗体のアミノ酸配列が、in vivo(例えば、細胞中のaldタグを含有するタンパク質の翻訳時)またはin vitro(例えば、無細胞系でaldタグを含有するタンパク質をFGEと接触させることによって)のいずれかで、ホルミルグリシン生成酵素(FGE)の作用によって、2−ホルミルグリシン(FGly)残基に変換(酸化)することができるセリンまたはシステイン残基を含有するスルファターゼモチーフを含むように修飾される。また、本明細書では、かかるスルファターゼモチーフをFGE−修飾部位と称してよい。
スルファターゼモチーフ
アルデヒドタグの最小のスルファターゼモチーフは、通常、5または6のアミノ酸残基の長さであり、通常、6のアミノ酸残基の長さのみである。Igポリペプチド中にもたらされるスルファターゼモチーフは、少なくとも5または6のアミノ酸残基であり、例えば、16、15、14、13、12、11、10、9、8または7未満のアミノ酸残基の長さのスルファターゼモチーフと定義されるように、5〜16、6〜16、5〜15、6〜15、5〜14、6〜14、5〜13、6〜13、5〜12、6〜12、5〜11、6〜11、5〜10、6〜10、5〜9、6〜9、5〜8、または6〜8のアミノ酸残基の長さとすることができる。
特定の実施形態では、対象のポリペプチドが、天然アミノ酸配列と比較して、1つ以上のアミノ酸残基、例えば、2以上の、または3以上の、または4以上の、または5以上の、または6以上の、または7以上の、または8以上の、または9以上の、または10以上の、または11以上の、または12以上の、または13以上の、または14以上の、または15以上の、または16以上の、または17以上の、または18以上の、または19以上の、または20以上のアミノ酸残基が、挿入され、除去され、置換(置換され)たポリペプチドを含み、ポリペプチド中のスルファターゼモチーフの配列が提供される。特定の実施形態では、ポリペプチドが、ポリペプチドの天然アミノ酸配列と比較して、アミノ酸配列の20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3または2未満のアミノ酸残基の修飾(挿入、付加、欠失、及び/または置換/置き換え)を含む。式中、ポリペプチド由来のアミノ酸配列(例えば、抗HER2抗体)が、所望のスルファターゼモチーフの1つ以上の残基を含有する場合、例えば、天然アミノ酸残基をフランキングするアミノ酸残基の部位特定修飾(挿入、付加、欠失、置換/置き換え)によって残基の修飾の総数を減らし、所望のスルファターゼモチーフの配列をもたらすことができる。特定の実施形態では、挿入、除去、置換(置き換え)、または付加(例えば、N−末端またはC−末端に)されるアミノ酸残基の数を最小化するように、標的抗HER2ポリペプチドの天然アミノ酸配列の修飾の範囲が、最小化される。標的抗HER2ポリペプチドのアミノ酸配列修飾の範囲の最小化では、かかる修飾が抗HER2機能及び/または構造に与える可能性がある影響を最小化してよい。
特定の対象のアルデヒドタグが、少なくとも最小のスルファターゼモチーフ(また、「コンセンサススルファターゼモチーフ」と称される)を含むアルデヒドタグであることを留意すべきであり、より長いアルデヒドタグが、本開示によって検討され、包含され、本開示の組成物及び方法に用いることができると容易に理解される。このため、アルデヒドタグは、5または6の残基の最小のスルファターゼモチーフを含むことができる、または、より長くすることができ、追加のアミノ酸残基によってモチーフのN−末端及び/またはC−末端側でフランキングすることができる最小のスルファターゼモチーフを含むことができる。例えば、5または6のアミノ酸残基のアルデヒドタグが、検討され、ならびに、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20以上のアミノ酸残基のより長いアミノ酸配列が、検討される。
アルデヒドタグが、Ig重鎖のC−末端に、またはC−末端の近くに存在することができる;例えば、アルデヒドタグが、天然野生型Ig重鎖のC−末端の1、2、3、4、5、6、7、8、9、または10のアミノ酸内に存在することができる。アルデヒドタグが、Ig重鎖のCH1ドメイン内に存在することができる。アルデヒドタグが、Ig重鎖のCH2ドメイン内に存在することができる。アルデヒドタグが、Ig重鎖のCH3ドメイン内に存在することができる。アルデヒドタグが、Ig軽鎖不変領域中に、例えば、カッパ軽鎖不変領域またはラムダ軽鎖不変領域中に存在することができる。
特定の実施形態では、用いられるスルファターゼモチーフを以下の式によって記載してよい。
X1Z10X2Z20X3Z30 (I’)
式中、
Z10が、システインまたはセリン(また、(C/S)によって示すことができる)である;
Z20が、プロリンまたはアラニン残基(また、(P/A)によって示すことができる)のいずれかである;
Z30が、塩基性アミノ酸(例えば、アルギニン(R)であり、リジン(K)またはヒスチジン(H)、例えば、リジンとしてよい)、または脂肪族アミノ酸(アラニン(A)、グリシン(G)、ロイシン(L)、バリン(V)、イソロイシン(I)、またはプロリン(P)、例えば、A、G、L、V、またはIである;
X1が、存在する、または存在しない。存在する場合、スルファターゼモチーフが、標的ポリペプチドのN−末端にある場合、X1が存在するという条件で、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、L、M、V、SまたはT、例えば、L、M、SまたはVとすることができる;及び
X2及びX3は、独立して、通常、脂肪族アミノ酸、極性非荷電アミノ酸、または硫黄を含有するアミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、S、T、A、V、GまたはC、例えば、S、T、A、VまたはGであるが、任意のアミノ酸とすることができる。
抗HER2重鎖及び/または軽鎖のアミノ酸配列は、少なくとも5の式X1Z10X2Z20X3Z30のアミノ酸の配列がもらされるように修飾することができ、式中、
Z10が、システインまたはセリンである;
Z20が、プロリンまたはアラニン残基である;
Z30が、脂肪族アミノ酸または塩基性アミノ酸である;
X1が、存在するまたは存在しない。存在する場合、異種スルファターゼモチーフが、ポリペプチドのN−末端にある場合、X1が、存在するという条件で、任意のアミノ酸である;
X2及びX3それぞれが、独立して、任意のアミノ酸であり、
配列は、Ig不変領域の溶媒接触可能ループ領域内にある、または隣接しており、配列は、Ig重鎖のC−末端にない。
スルファターゼモチーフは、一般に、選択されるFGE、例えば、アルデヒドの標識を付けたポリペプチドが、発現する宿主細胞中に存在するFGE、または無細胞in vitro方法でアルデヒドの標識を付けたポリペプチドと接触されるFGEによって、変換することができるように選択される。
例えば、FGEが、真核生物FGE(例えば、ヒトFGEを含む哺乳動物FGE、)である場合、スルファターゼモチーフは、以下の式のものとすることができる。
X1CX2PX3Z30 (I’’)
式中、
X1が、存在してよい、または存在しなくてよい。存在する場合、スルファターゼモチーフが、標的ポリペプチドのN−末端にある場合、X1が存在するという条件で、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、L、M、SまたはVとすることができる;
X2及びX3は、独立して、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、S、T、A、V、G、またはC、例えば、S、T、A、VまたはGとすることができる;及び
Z30が、塩基性アミノ酸(例えば、アルギニン(R)であり、リジン(K)またはヒスチジン(H)、例えば、リジンとしてよい)、または脂肪族アミノ酸(アラニン(A)、グリシン(G)、ロイシン(L)、バリン(V)、イソロイシン(I)、またはプロリン(P)、例えば、A、G、L、V、またはIである。
スルファターゼモチーフの特定の例が、LCTPSR(配列番号:17)、MCTPSR(配列番号://)、VCTPSR(配列番号://)、LCSPSR(配列番号://)、LCAPSR(配列番号://)、LCVPSR(配列番号://)、LCGPSR(配列番号://)、ICTPAR(配列番号://)、LCTPSK(配列番号://)、MCTPSK(配列番号://)、VCTPSK(配列番号://)、LCSPSK(配列番号://)、LCAPSK(配列番号://)、LCVPSK(配列番号://)、LCGPSK(配列番号://)、LCTPSA(配列番号://)、ICTPAA(配列番号://)、MCTPSA(配列番号://)、VCTPSA(配列番号://)、LCSPSA(配列番号://)、LCAPSA(配列番号://)、LCVPSA(配列番号://)、及びLCGPSA(配列番号://)を含む。
FGlyを含有する配列
修飾された抗HER2重鎖及び/または軽鎖上のFGEの作用により、スルファターゼモチーフ中のセリンまたはシステインが、FGlyに修飾される。このため、FGlyを含有するスルファターゼモチーフは、以下の式のものとすることができ、
X1(FGly)X2Z20X3Z30 (I’’’)
式中、
FGlyが、ホルミルグリシン残基である;
Z20が、プロリンまたはアラニン残基(また、(P/A)によってによって示すことができる)のいずれかである;
Z30が、塩基性アミノ酸(例えば、アルギニン(R)であり、リジン(K)またはヒスチジン(H)、通常、リジンとしてよい)、または脂肪族アミノ酸(アラニン(A)、グリシン(G)、ロイシン(L)、バリン(V)、イソロイシン(I)、またはプロリン(P)、例えば、A、G、L、V、またはIである;
X1が、存在してよい、または存在しなくてよい。存在する場合、スルファターゼモチーフが、標的ポリペプチドのN−末端にある場合、X1が存在するという条件で、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、L、M、V、SまたはT、例えば、L、M、またはVとすることができる;及び
X2及びX3は、独立して、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、S、T、A、V、G、またはC、例えば、S、T、A、VまたはGとすることができる。
前記に記載したとおり、FGly残基を含有する修飾ポリペプチドを、薬剤(例えば、前記に記載したとおり、ヒドラジニル−ピロロカップリング部分を含有する薬剤)とFGlyの反応によって、薬剤(例えば、マイタンシノイド)に共役させ、FGly’を含有するスルファターゼモチーフを生成してよい。本明細書に用いる場合、用語FGly’は、薬剤、例えば、マイタンシノイド(例えば、式(I)の修飾アミノ酸残基)に結合されるスルファターゼモチーフの修飾アミノ酸残基を指す。このため、FGly’を含有するスルファターゼモチーフは、以下の式のものとすることができ、
X1(FGly’)X2Z20X3Z30 (II)
式中、
FGly’が、式(I)の修飾アミノ酸残基である;
Z20が、プロリンまたはアラニン残基(また、(P/A)によって示すことができる)のいずれかである;
Z30が、塩基性アミノ酸(例えば、アルギニン(R)であり、リジン(K)またはヒスチジン(H)、通常、リジンとしてよい)、または脂肪族アミノ酸(アラニン(A)、グリシン(G)、ロイシン(L)、バリン(V)、イソロイシン(I)、またはプロリン(P)、例えば、A、G、L、V、またはIである;
X1が、存在してよい、または存在しなくてよい。存在する場合、スルファターゼモチーフが、標的ポリペプチドのN−末端にある場合、X1が存在するという条件で、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、L、M、V、SまたはT、例えば、L、M、またはVとすることができる;及び
X2及びX3は、独立して、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、S、T、A、V、G、またはC、例えば、S、T、A、VまたはGとすることができる。
特定の実施形態では、式(I)の修飾アミノ酸残基が、抗HER2抗体の重鎖不変領域のC−末端に位置する。いくつかの例では、重鎖不変領域が、式(II)の配列を含む:
X1(FGly’)X2Z20X3Z30 (II)
式中、
FGly’が、式(I)の修飾アミノ酸残基である;
Z20が、プロリンまたはアラニン残基(また、(P/A)によって示すことができる)のいずれかである;
Z30が、塩基性アミノ酸(例えば、アルギニン(R)であり、リジン(K)またはヒスチジン(H)、通常、リジンとしてよい)、または脂肪族アミノ酸(アラニン(A)、グリシン(G)、ロイシン(L)、バリン(V)、イソロイシン(I)、またはプロリン(P)、例えば、A、G、L、V、またはIである;
X1が、存在してよい、または存在しなくてよい。存在する場合、スルファターゼモチーフが、標的ポリペプチドのN−末端にある場合、X1が存在するという条件で、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、L、M、V、SまたはT、例えば、L、M、またはVとすることができる;
X2及びX3は、独立して、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、S、T、A、V、G、またはC、例えば、S、T、A、VまたはGとすることができる;及び
配列が、アミノ酸配列QKSLSLSPGSへのC−末端であり、配列が、天然野生型重Ig鎖不変領域中に存在しない1、2、3、4、5、または5〜10のアミノ酸を含んでよい。
特定の実施形態では、重鎖不変領域が、例えば、天然SLSLSPGK(配列番号://)配列の代わりに、Ig重鎖のC−末端で、配列SLSLSPGSL(FGly’)TPSRGSを含む。
特定の実施形態では、式(I)の修飾アミノ酸残基が、抗HER2抗体の軽鎖不変領域に位置する。特定の実施形態では、軽鎖不変領域が、式(II)の配列を含む:
X1(FGly’)X2Z20X3Z30 (II)
式中、
FGly’が、式(I)の修飾アミノ酸残基である;
Z20が、プロリンまたはアラニン残基(また、(P/A)によって示すことができる)のいずれかである;
Z30が、塩基性アミノ酸(例えば、アルギニン(R)であり、リジン(K)またはヒスチジン(H)、通常、リジンとしてよい)、または脂肪族アミノ酸(アラニン(A)、グリシン(G)、ロイシン(L)、バリン(V)、イソロイシン(I)、またはプロリン(P)、例えば、A、G、L、V、またはIである;
X1が、存在してよい、または存在しなくてよい。存在する場合、スルファターゼモチーフが、標的ポリペプチドのN−末端にある場合、X1が存在するという条件で、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、L、M、V、SまたはT、例えば、L、M、またはVとすることができる;
X2及びX3は、独立して、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、S、T、A、V、G、またはC、例えば、S、T、A、VまたはGとすることができる;及び
配列が、アミノ酸配列KVDNAL(配列番号://)へのC−末端である、及び/またはアミノ酸配列QSGNSQ(配列番号://)へのN−末端である。
特定の実施形態では、軽鎖不変領域が、配列KVDNAL(FGly’)TPSRQSGNSQ(配列番号://)を含む。
特定の実施形態では、式(I)の修飾アミノ酸残基が、抗HER2抗体の重鎖CH1領域に位置する。特定の実施形態では、重鎖CH1領域が、式(II)の配列を含む。
X1(FGly’)X2Z20X3Z30 (II)
式中、
FGly’が、式(I)の修飾アミノ酸残基である;
Z20が、プロリンまたはアラニン残基(また、(P/A)によって示すことができる)のいずれかである;
Z30が、塩基性アミノ酸(例えば、アルギニン(R)であり、リジン(K)またはヒスチジン(H)、通常、リジンとしてよい)、または脂肪族アミノ酸(アラニン(A)、グリシン(G)、ロイシン(L)、バリン(V)、イソロイシン(I)、またはプロリン(P)、例えば、A、G、L、V、またはIである;
X1が、存在してよい、または存在しなくてよい。存在する場合、スルファターゼモチーフが、標的ポリペプチドのN−末端にある場合、X1が存在するという条件で、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、L、M、V、SまたはT、例えば、L、M、またはVとすることができる;
X2及びX3は、独立して、任意のアミノ酸、例えば、脂肪族アミノ酸、硫黄を含有するアミノ酸、または極性非荷電アミノ酸(すなわち、芳香族アミノ酸または荷電アミノ酸以外)、例えば、S、T、A、V、G、またはC、例えば、S、T、A、VまたはGとすることができる;及び
配列が、アミノ酸配列SWNSGA(配列番号://)へのC−末端である、及び/またはアミノ酸配列GVHTFP(配列番号://)へのN−末端である。
特定の実施形態では、重鎖CH1領域が、配列SWNSGAL(FGly’)TPSRGVHTFP(配列番号://)を含む。
修飾の部位
前記に記載したとおり、抗HER2抗体のアミノ酸配列が、in vivo(例えば、細胞中のaldタグを含有するタンパク質の翻訳時)またはin vitro(例えば、無細胞系でaldタグを含有するタンパク質をFGEと接触させることによって)のいずれかで、FGEの作用によって、FGly残基に変換(酸化)することができるセリンまたはシステイン残基を含有するスルファターゼモチーフを含むように修飾される。抗HER2ポリペプチドが、用いられ、少なくともIg不変領域、例えば、Ig重鎖不変領域(例えば、少なくともCH1ドメイン;少なくともCH1及びCH2ドメイン;CH1、CH2、及びCH3ドメイン;またはCH1、CH2、CH3、及びCH4ドメイン)、またはIg軽鎖不変領域を含む本開示のコンジュゲートが生成される。かかるIgポリペプチドは、本明細書では、「標的Igポリペプチド」または「標的抗HER2抗体」または「標的抗HER2 Igポリペプチド」と称される。
スルファターゼモチーフが、導入される抗HER2抗体の部位は、任意の好適な部位とすることができる。前記に記載したとおり、いくつかの例では、挿入、除去、置換(置き換え)、及び/または付加(例えば、N−末端またはC−末端に)されるアミノ酸残基の数を最小化するように、標的抗HER2ポリペプチドの天然アミノ酸配列の修飾の範囲が、最小化される。標的抗HER2ポリペプチドのアミノ酸配列修飾の範囲の最小化では、かかる修飾が抗HER2機能及び/または構造に与える可能性がある影響を最小化してよい。
抗HER2抗体重鎖不変領域は、任意の重鎖イソタイプのIg不変領域、非天然Ig重鎖不変領域(コンセンサスIg重鎖不変領域を含む)を含むことができる。Ig不変領域は、Ig不変領域の溶媒接触可能ループ領域中に存在する、またはこの領域に隣接して存在するアルデヒドタグを含むように修飾することができる。Ig不変領域は、前記に記載したとおり、スルファターゼモチーフのアミノ酸配列が生成されるように、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、または16アミノ酸、または16以上のアミノ酸の挿入及び/または置換によって、修飾することができる。
いくつかの場合では、アルデヒド標識抗HER2抗体が、アルデヒド標識Ig重鎖不変領域(例えば、少なくともCH1ドメイン;少なくともCH1及びCH2ドメイン;CH1、CH2、及びCH3ドメイン;またはCH1、CH2、CH3、及びCH4ドメイン)を含む。アルデヒド標識Ig重鎖不変領域は、FGlyが修飾されたIgポリペプチドが生成されるようにFGEによって修飾することができる少なくとも1つのスルファターゼモチーフを含むように修飾されたIgA、IgM、IgD、IgE、IgG1、IgG2、IgG3、もしくはIgG4イソタイプ重鎖の重鎖不変領域配列、またはこれらのアロタイプ変異体、例えば、ヒト重鎖不変領域配列もしくはマウス重鎖不変領域配列、ハイブリッド重鎖不変領域、合成的重鎖不変領域、またはコンセンサス重鎖不変領域配列などを含むことができる。Ig重鎖のアロタイプ変異体は、当技術分野で知られている。例えば、Jefferis及びLefranc(2009)MAbs1:4を参照。
いくつかの場合では、アルデヒド標識抗HER2抗体が、アルデヒド標識Ig軽鎖不変領域を含む。アルデヒド標識Ig軽鎖不変領域は、FGlyが修飾された抗HER2抗体ポリペプチドが生成されるようにFGEによって修飾することができる少なくとも1つのスルファターゼモチーフを含むように修飾されたカッパ軽鎖、ラムダ軽鎖の不変領域配列、例えば、ヒトカッパもしくはラムダ軽鎖不変領域、ハイブリッド軽鎖不変領域、合成的軽鎖不変領域、またはコンセンサス軽鎖不変領域配列などを含むことができる。例示的な不変領域は、ヒトガンマ1及びガンマ3領域を含む。スルファターゼモチーフを除いて、修飾された不変領域は、野生型アミノ酸配列を有してよい、または野生型アミノ酸配列と少なくとも70%同一(例えば、少なくとも80%、少なくとも90%または少なくとも95%同一)であるアミノ酸配列を有してよい。
いくつかの実施形態では、スルファターゼモチーフが、Igポリペプチド重鎖のC−末端以外の位置にある、またはこの位置に加えて存在する。前記に記載したとおり、分離したアルデヒド標識抗HER2ポリペプチドは、スルファターゼモチーフが、抗HER2ポリペプチド重鎖不変領域の表面接触可能ループ領域中にある、または、この領域に隣接しており、前記に記載したとおり、スルファターゼモチーフを含むように修飾された重鎖不変領域を含むことができる。
いくつかの例では、標的抗HER2免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸122−127;2)アミノ酸137−143;3)アミノ酸155−158;4)アミノ酸163−170;5)アミノ酸163−183;6)アミノ酸179−183;7)アミノ酸190−192;8)アミノ酸200−202;9)アミノ酸199−202;10)アミノ酸208−212;11)アミノ酸220−241;12)アミノ酸247−251;13)アミノ酸257−261;14)アミノ酸269−277;15)アミノ酸271−277;16)アミノ酸284−285;17)アミノ酸284−292;18)アミノ酸289−291;19)アミノ酸299−303;20)アミノ酸309−313;21)アミノ酸320−322;22)アミノ酸329−335;23)アミノ酸341−349;24)アミノ酸342−348;25)アミノ酸356−365;26)アミノ酸377−381;27)アミノ酸388−394;28)アミノ酸398−407;29)アミノ酸433−451;及び30)アミノ酸446−451の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、図17Bに示したとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。
いくつかの例では、標的抗HER2免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(ヒトIgG1不変領域;図17Bに示した配列に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。
IgG1重鎖の例示的な表面接触可能ループ領域が、図17A及び17Bに示したとおり、1)ASTKGP(配列番号://);2)KSTSGGT(配列番号://);3)PEPV(配列番号://);4)NSGALTSG(配列番号://);5)NSGALTSGVHTFPAVLQSSGL(配列番号://);6)QSSGL(配列番号://);7)VTV;8)QTY;9)TQTY(配列番号://);10)HKPSN(配列番号://);11)EPKSCDKTHTCPPCPAPELLGG(配列番号://);12)FPPKP(配列番号://);13)ISRTP(配列番号://);14)DVSHEDPEV(配列番号://);15)SHEDPEV(配列番号://);16)DG;17)DGVEVHNAK(配列番号://);18)HNA;19)QYNST(配列番号://);20)VLTVL(配列番号://);21)GKE;22)NKALPAP(配列番号://);23)SKAKGQPRE(配列番号://);24)KAKGQPR(配列番号://);25)PPSRKELTKN(配列番号://);26)YPSDI(配列番号://);27)NGQPENN(配列番号://);28)TPPVLDSDGS(配列番号://);29)HEALHNHYTQKSLSLSPGK(配列番号://);及び30)SLSPGK(配列番号://)を含む。
いくつかの例では、標的免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸13−24;3)アミノ酸33−37;4)アミノ酸43−54;5)アミノ酸58−63;6)アミノ酸69−71;7)アミノ酸78−80;8)87−89;9)アミノ酸95−96;10)114−118;11)122−126;12)134−136;13)144−152;14)159−167;15)175−176;16)184−188;17)195−197;18)204−210;19)216−224;20)231−233;21)237−241;22)252−256;23)263−269;24)273−282;25)アミノ酸299−302の1つ以上に対応するIgG2重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(ヒトIgG2;図17Bにも示した)に示されたアミノ酸配列のナンバリングに基づいている。
IgG2重鎖の例示的な表面接触可能ループ領域が、図17Bに示したとおり、1)ASTKGP(配列番号://);2)PCSRSTSESTAA(配列番号://);3)FPEPV(配列番号://);4)SGALTSGVHTFP(配列番号://);5)QSSGLY(配列番号://);6)VTV;7)TQT;8)HKP;9)DK;10)VAGPS(配列番号://);11)FPPKP(配列番号://);12)RTP;13)DVSHEDPEV(配列番号://);14)DGVEVHNAK(配列番号://);15)FN;16)VLTVV(配列番号://);17)GKE;18)NKGLPAP(配列番号://);19)SKTKGQPRE(配列番号://);20)PPS;21)MTKNQ(配列番号://);22)YPSDI(配列番号://);23)NGQPENN(配列番号://);24)TPPMLDSDGS(配列番号://);25)GNVF(配列番号://);及び26)HEALHNHYTQKSLSLSPGK(配列番号://)を含む。
いくつかの例では、標的免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸13−22;3)アミノ酸33−37;4)アミノ酸43−61;5)アミノ酸71;6)アミノ酸78−80;7)87−91;8)アミノ酸97−106;9)111−115;10)147−167;11)173−177;16)185−187;13)195−203;14)210−218;15)226−227;16)238−239;17)246−248;18)255−261;19)267−275;20)282−291;21)アミノ酸303−307;22)アミノ酸313−320;23)アミノ酸324−333;24)アミノ酸350−352;25)アミノ酸359−365;及び26)アミノ酸372−377の1つ以上に対応するIgG3重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(ヒトIgG3;図17Bにも示した)に示されたアミノ酸配列のナンバリングに基づいている。
IgG3重鎖の例示的な表面接触可能ループ領域が、図17Bに示したとおり、1)ASTKGP(配列番号://);2)PCSRSTSGGT(配列番号://);3)FPEPV(配列番号://);4)SGALTSGVHTFPAVLQSSG(配列番号://);5)V;6)TQT;7)HKPSN(配列番号://);8)RVELKTPLGD(配列番号://);9)CPRCPKP(配列番号://);10)PKSCDTPPPCPRCPAPELLGG(配列番号://);11)FPPKP(配列番号://);12)RTP;13)DVSHEDPEV(配列番号://);14)DGVEVHNAK(配列番号://);15)YN;16)VL;17)GKE;18)NKALPAP(配列番号://);19)SKTKGQPRE(配列番号://);20)PPSREEMTKN(配列番号://);21)YPSDI(配列番号://);22)SSGQPENN(配列番号://);23)TPPMLDSDGS(配列番号://);24)GNI;25)HEALHNR(配列番号://);及び26)SLSPGK(配列番号://)を含む。
いくつかの例では、標的免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−5;2)アミノ酸12−23;3)アミノ酸32−36;4)アミノ酸42−53;5)アミノ酸57−62;6)アミノ酸68−70;7)アミノ酸77−79;8)アミノ酸86−88;9)アミノ酸94−95;10)アミノ酸101−102;11)アミノ酸108−118;12)アミノ酸122−126;13)アミノ酸134−136;14)アミノ酸144−152;15)アミノ酸159−167;16)アミノ酸175−176;17)アミノ酸185−186;18)アミノ酸196−198;19)アミノ酸205−211;20)アミノ酸217−226;21)アミノ酸232−241;22)アミノ酸253−257;23)アミノ酸264−265;24)269−270;25)アミノ酸274−283;26)アミノ酸300−303;27)アミノ酸399−417の1つ以上に対応するIgG4重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(ヒトIgG4;図17Bにも示した)に示されたアミノ酸配列のナンバリングに基づいている。
IgG4重鎖の例示的な表面接触可能ループ領域が、図17Bに示したとおり、1)STKGP(配列番号://);2)PCSRSTSESTAA(配列番号://);3)FPEPV(配列番号://);4)SGALTSGVHTFP(配列番号://);5)QSSGLY(配列番号://);6)VTV;7)TKT;8)HKP;9)DK;10)YG;11)CPAPEFLGGPS(配列番号://);12)FPPKP(配列番号://);13)RTP;14)DVSQEDPEV(配列番号://);15)DGVEVHNAK(配列番号://);16)FN;17)VL;18)GKE;19)NKGLPSS(配列番号://);20)SKAKGQPREP(配列番号://);21)PPSQEEMTKN(配列番号://);22)YPSDI(配列番号://);23)NG;24)NN;25)TPPVLDSDGS(配列番号://);26)GNVF(配列番号://);及び27)HEALHNHYTQKSLSLSLGK(配列番号://)を含む。
いくつかの例では、標的免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、:1)アミノ酸1−13;2)アミノ酸17−21;3)アミノ酸28−32;4)アミノ酸44−54;5)アミノ酸60−66;6)アミノ酸73−76;7)アミノ酸80−82;8)アミノ酸90−91;9)アミノ酸123−125;10)アミノ酸130−133;11)アミノ酸138−142;12)アミノ酸151−158;13)アミノ酸165−174;14)アミノ酸181−184;15)アミノ酸192−195;16)アミノ酸199;17)アミノ酸209−210;18)アミノ酸222−245;19)アミノ酸252−256;20)アミノ酸266−276;21)アミノ酸293−294;22)アミノ酸301−304;23)アミノ酸317−320;24)アミノ酸329−353の1つ以上に対応するIgA重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(ヒトIgA;図17Bにも示した)に示されたアミノ酸配列のナンバリングに基づいている。
IgA重鎖の例示的な表面接触可能ループ領域が、図17Bに示したとおり、1)ASPTSPKVFPLSL(配列番号://);2)QPDGN(配列番号://);3)VQGFFPQEPL(配列番号://);4)SGQGVTARNFP(配列番号://);5)SGDLYTT(配列番号://);6)PATQ(配列番号://);7)GKS;8)YT;9)CHP;10)HRPA(配列番号://);11)LLGSE(配列番号://);12)GLRDASGV(配列番号://);13)SSGKSAVQGP(配列番号://);14)GCYS(配列番号://);15)CAEP(配列番号://);16)PE;17)SGNTFRPEVHLLPPPSEELALNEL(配列番号://);18)ARGFS(配列番号://);19)QGSQELPREKY(配列番号://);20)AV;21)AAED(配列番号://);22)HEAL(配列番号://);及び23)IDRLAGKPTHVNVSVVMAEVDGTCY(配列番号://)を含む。
スルファターゼモチーフは、Ig重鎖のかかる修飾部位のこれらの1つ以上のアミノ酸配列内に、またはこの配列に隣接して提供することができる。例えば、これらの修飾部位に隣接して及びこれらの修飾部位へのN−末端及び/またはこれらの修飾部位に隣接して及びこれらの修飾部位へのC−末端にスルファターゼモチーフをもたらすように、これらの1つ以上のアミノ酸配列で、Ig重鎖ポリペプチドを修飾(例えば、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む)することができる。代わりに、または加えて、Ig重鎖修飾部位の任意の2つの残基の間にスルファターゼモチーフをもたらすように、これらの1つ以上のアミノ酸配列で、Ig重鎖ポリペプチドを修飾(例えば、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む)することができる。いくつかの実施形態では、2つのモチーフを含むようにIg重鎖ポリペプチドを修飾してよく、これは、互いに隣接してよい、または1、2、3、4つ以上(例えば、約1〜約25、約25〜約50、または約50〜約100、これ以上)のアミノ酸によって分離してよい。代わりに、または加えて、天然アミノ酸配列が、スルファターゼモチーフ配列の1つ以上のアミノ酸残基を提供する場合、修飾部位でスルファターゼモチーフをもたらすように、Ig重鎖ポリペプチドアミノ酸配列の修飾部位の選択したアミノ酸残基を修飾(例えば、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む)することができる。
このため、スルファターゼモチーフがもたらされるように、表面接触可能ループ領域のアミノ酸配列を修飾することができ、修飾は、挿入、欠失、及び/または置換を含むことができる。例えば、修飾が、CH1ドメイン中にある場合、表面接触可能ループ領域が、アミノ酸配列NSGALTSG(配列番号://)を有することができ、アルデヒド標識配列は、例えば、NSGALCTPSRG(配列番号://)とすることができ、例えば、NSGALTSG(配列番号://)配列の「TS」残基が、「CTPSR」(配列番号://)で置換される場合には、その結果、スルファターゼモチーフが、配列LCTPSR(配列番号://)を有する。もう1つの例として、修飾が、CH2ドメイン中にある場合、表面接触可能ループ領域が、アミノ酸配列NKALPAP(配列番号://)を有することができ、アルデヒド標識配列は、例えば、NLCTPSRAP(配列番号://)とすることができ、例えば、NKALPAP(配列番号://)配列の「KAL」残基が、「LCTPSR」(配列番号://)で置換される場合には、その結果、スルファターゼモチーフが、配列LCTPSR(配列番号://)を有する。もう1つの例として、修飾が、CH2/CH3ドメイン中にある場合、表面接触可能ループ領域が、アミノ酸配列KAKGQPR(配列番号://)を有することができ、アルデヒド標識配列は、例えば、KAKGLCTPSR(配列番号://)とすることができ、例えば、KAKGQPR(配列番号://)配列の「GQP」残基が、「LCTPS」(配列番号://)で置換される場合には、その結果、スルファターゼモチーフが、配列LCTPSR(配列番号://)を有する。
前記に記載したとおり、分離したアルデヒド標識抗HER2 Igポリペプチドは、スルファターゼモチーフが、Igポリペプチド軽鎖不変領域の表面接触可能ループ領域中にある、または、この領域に隣接しており、前記に記載したとおり、スルファターゼモチーフを含むように修飾された軽鎖不変領域を含むことができる。軽鎖不変領域の表面接触可能ループ領域の例示例が、図17A及び17Cに示されている。
いくつかの例では、標的免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸130−135;2)アミノ酸141−143;3)アミノ酸150;4)アミノ酸162−166;5)アミノ酸163−166;6)アミノ酸173−180;7)アミノ酸186−194;8)アミノ酸211−212;9)アミノ酸220−225;10)アミノ酸233−236の1つ以上に対応するIg軽鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、図17Cに示したとおり、ヒトカッパ軽鎖のアミノ酸ナンバングに基づいている。いくつかの例では、標的免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIg軽鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(ヒトカッパ軽鎖;図17Cに示したアミノ酸配列)に基づいている。
Ig軽鎖の例示的な表面接触可能ループ領域(例えば、ヒトカッパ軽鎖)が、図17A及び17Cに示したとおり、1)RTVAAP(配列番号://);2)PPS;3)Gly(例えば、図17Cに示したヒトカッパ軽鎖配列の位置150のGlyを参照);4)YPREA(配列番号://);5)PREA(配列番号://);6)DNALQSGN(配列番号://);7)TEQDSKDST(配列番号://);8)HK;9)HQGLSS(配列番号://);及び10)RGEC(配列番号://)を含む。
Igラムダ軽鎖の例示的な表面接触可能ループ領域が、図17Cに示したとおり、QPKAAP(配列番号://)、PPS、NK、DFYPGAV(配列番号://)、DSSPVKAG(配列番号://)、TTP、SN、HKS、EG、及びAPTECS(配列番号://)を含む。
いくつかの例では、標的免疫グロブリンが、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸121−22;4)アミノ酸31−37;5)アミノ酸44−51;6)アミノ酸55−57;7)アミノ酸61−62;8)アミノ酸81−83;9)アミノ酸91−92;10)アミノ酸102−105の1つ以上に対応するラットIg軽鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号:10(図17Cに示した配列)に示されたとおり、ラット軽鎖のアミノ酸ナンバリングに基づいている。
いくつかの場合では、スルファターゼモチーフが、抗HER2重鎖不変領域のCH1領域に導入される。いくつかの場合では、スルファターゼモチーフが、抗HER2重鎖のC−末端に、またはC−末端の近く(例えば、1〜10のアミノ酸内)に導入される。いくつかの場合では、スルファターゼモチーフが、軽鎖不変領域に導入される。
いくつかの場合では、スルファターゼモチーフが、抗HER2重鎖不変領域のCH1領域、例えば、図6Aに示したアミノ酸配列のアミノ酸121−219内に導入される。例えば、いくつかの場合では、スルファターゼモチーフが、アミノ酸配列:ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVE(配列番号://)に導入される。例えば、これらの実施形態のいくつかでは、アミノ酸配列GALTSGVH(配列番号://)が、GALCTPSRGVH(配列番号://)に修飾され、スルファターゼモチーフが、LCTPSR(配列番号://)である。1つの非限定実施形態では、抗HER2抗体が、スルファターゼモチーフを含む重鎖不変領域を含み、重鎖不変領域が、図6Cに示したアミノ酸配列を含み、例えば、重鎖不変領域が、図6Cに示したアミノ酸配列のアミノ酸121−453を含む。
いくつかの場合では、スルファターゼモチーフが、抗HER2重鎖のC−末端に、またはC−末端の近くに導入され、例えば、スルファターゼモチーフが、抗HER2重鎖のC−末端の1アミノ酸、2アミノ酸(aa)、3aa、4aa、5aa、6aa、7aa、8aa、9aa、または10aa内に導入される。1つの非限定例として、抗HER2重鎖のC−末端リジン残基は、アミノ酸配列SLCTPSRGS(配列番号://)で置換することができる。1つの非限定実施形態では、抗HER2抗体が、スルファターゼモチーフを含む重鎖不変領域を含み、重鎖不変領域が、図6Dに示したアミノ酸配列を含み、例えば、重鎖不変領域が、図6Dに示したアミノ酸配列のアミノ酸121−458を含む。
いくつかの場合では、スルファターゼモチーフが、抗HER2抗体の軽鎖の不変領域に導入される。1つの非限定例として、いくつかの場合では、スルファターゼモチーフが、抗HER2抗体の軽鎖の不変領域に導入され、スルファターゼモチーフが、KVDNAL(配列番号://)へのC−末端である、及び/または、QSGNSQ(配列番号://)へのN−末端である。例えば、いくつかの場合では、スルファターゼモチーフが、LCTPSR(配列番号://)であり、抗HER2軽鎖が、アミノ酸配列KVDNALLCTPSRQSGNSQ(配列番号://)を含む。1つの非限定例として、抗HER2軽鎖が、図6Eに示したとおり、アミノ酸配列を含むスルファターゼモチーフを含み、例えば、軽鎖不変領域が、図6Eに示したアミノ酸配列のアミノ酸108−219を含む。
例示的な抗HER2抗体
いくつかの場合では、好適な抗HER2抗体が、DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)から選択される重鎖CDRを含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)から選択される軽鎖CDRを含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸122−127;2)アミノ酸137−143;3)アミノ酸155−158;4)アミノ酸163−170;5)アミノ酸163−183;6)アミノ酸179−183;7)アミノ酸190−192;8)アミノ酸200−202;9)アミノ酸199−202;10)アミノ酸208−212;11)アミノ酸220−241;12)アミノ酸247−251;13)アミノ酸257−261;14)アミノ酸269−277;15)アミノ酸271−277;16)アミノ酸284−285;17)アミノ酸284−292;18)アミノ酸289−291;19)アミノ酸299−303;20)アミノ酸309−313;21)アミノ酸320−322;22)アミノ酸329−335;23)アミノ酸341−349;24)アミノ酸342−348;25)アミノ酸356−365;26)アミノ酸377−381;27)アミノ酸388−394;28)アミノ酸398−407;29)アミノ酸433−451;及び30)アミノ酸446−451の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、図17Bに示したとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、VH CDR DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)を含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、VL CDR RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)を含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、VH CDR DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)及びVL CDR RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)を含む抗体を有するHER2エピトープ(例えば、HER2のドメインIV内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸511〜636内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸529〜625内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸561〜625内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、VH CDR DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、VL CDR RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、VH CDR DTYIH(VH CDR1;配列番号://)、RIYPTNGYTRYADSVKG(VH CDR2;配列番号://)、及びWGGDGFYAMDV(VH CDR3;配列番号://)及びVL CDR RASQDVNTAVA(VL CDR1;配列番号://)、SASFLES(VL CDR2;配列番号://)、及びQQHYTTPPT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://)を含む抗HER2 VH領域中に存在するVH CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)を含む抗HER2 VL領域中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://)中に存在するVH CDR及びDIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、VHアミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://)を含む。いくつかの場合では、好適な抗HER2抗体が、VLアミノ酸配列DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)を含む。いくつかの場合では、好適な抗HER2抗体が、VHアミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDVWGQGTLVTVSS(配列番号://);及びVLアミノ酸配列DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLESGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT(配列番号://)を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。
いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列を含む重鎖を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列を含む重鎖を含む。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列を含む軽鎖を含む。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列を含む重鎖を含み、図6Eに示したアミノ酸配列を含む軽鎖を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列を含む重鎖を含み、図6Eに示したアミノ酸配列を含む軽鎖を含む。
さらに例示的な抗HER2抗体
いくつかの場合では、好適な抗HER2抗体が、GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)から選択される重鎖相補性決定領域(CDR)を含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)から選択される軽鎖CDRを含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む;及び軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む抗体を有するHER2中のエピトープ(例えば、HER2のドメインII内のエピトープ;例えば、図4に示したHER2アミノ酸配列のアミノ酸218〜341内のエピトープ)への結合と競合する。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMX、式中、Xが、DまたはSである(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む;及び軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYX1X2X3、式中、X1が、RまたはLであり、X2が、YまたはEであり、X3が、TまたはSである(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMD(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYRYT(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖CDR GFTFTDYTMD(VH CDR1;配列番号://);DVNPNSGGSIYNQRFKG(VH CDR2;配列番号://);及びNLGPSFYFDY(VH CDR3;配列番号://)を含む;及び軽鎖CDR KASQDVSIGVA(VL CDR1;配列番号://);SASYRYT(VL CDR2;配列番号://);及びQQYYIYPYT(VL CDR3;配列番号://)を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含む抗HER2 VH領域中に存在するVH CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含む抗HER2 VL領域中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、以下のアミノ酸配列:EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含む抗HER2 VH領域中に存在するVH CDRを含む;及び以下のアミノ酸配列:DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含む抗HER2 VL領域中に存在するVL CDRを含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、アミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含むVH領域を含む。いくつかの場合では、好適な抗HER2抗体が、アミノ酸配列DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含むVL領域を含む。いくつかの場合では、好適な抗HER2抗体が、アミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含むVH領域を含む;及びアミノ酸配列DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含むVL領域を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
いくつかの場合では、好適な抗HER2抗体が、重鎖不変領域が、FGly残基を含むように修飾されているアミノ酸配列EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSS(配列番号://)を含むVH領域を含む。いくつかの場合では、好適な抗HER2抗体が、軽鎖不変領域が、FGly残基を含むように修飾されているアミノ酸配列DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIK(配列番号://)を含むVL領域を含む。いくつかの場合では、抗HER2抗体が、ヒト化される。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む。特定の実施形態では、スルファターゼモチーフが、1)アミノ酸1−6;2)アミノ酸16−22;3)アミノ酸34−47;4)アミノ酸42−49;5)アミノ酸42−62;6)アミノ酸34−37;7)アミノ酸69−71;8)アミノ酸79−81;9)アミノ酸78−81;10)アミノ酸87−91;11)アミノ酸100−121;12)アミノ酸127−131;13)アミノ酸137−141;14)アミノ酸149−157;15)アミノ酸151−157;16)アミノ酸164−165;17)アミノ酸164−172;18)アミノ酸169−171;19)アミノ酸179−183;20)アミノ酸189−193;21)アミノ酸200−202;22)アミノ酸209−215;23)アミノ酸221−229;24)アミノ酸22−228;25)アミノ酸236−245;26)アミノ酸217−261;27)アミノ酸268−274;28)アミノ酸278−287;29)アミノ酸313−331;及び30)アミノ酸324−331の1つ以上に対応するIgG1重鎖不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Bに示したヒトIgG1不変領域)に示されたとおり、ヒトIgG1のアミノ酸ナンバリングに基づいている。いくつかの場合では、抗HER2抗体が、図6Cに示したアミノ酸配列のアミノ酸121−453に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの場合では、抗HER2抗体が、図6Dに示したアミノ酸配列のアミノ酸121−458に示されたとおり、重鎖不変領域アミノ酸配列を含む。いくつかの例では、抗HER2抗体が、前記に記載したとおり、スルファターゼモチーフを含むように修飾され、修飾が、1つ以上のアミノ酸残基の挿入、欠失、及び/または置換を含む;例えば、スルファターゼモチーフが、:1)アミノ酸1−6;2)アミノ酸12−14;3)アミノ酸21;4)アミノ酸33−37;5)アミノ酸34−37;6)アミノ酸44−51;7)アミノ酸57−65;8)アミノ酸83−83;9)アミノ酸91−96;10)アミノ酸104−107の1つ以上に対応するIgカッパ不変領域の領域内にある、または、この領域に隣接している;アミノ酸ナンバリングは、配列番号://(図17Cに示したヒトカッパ軽鎖;アミノ酸配列)に基づいている。いくつかの場合では、抗HER2抗体が、図6Eに示したアミノ酸配列のアミノ酸108−219に示されたとおり、軽鎖不変領域アミノ酸配列を含む。
ポリペプチドへの共役のための薬剤
本開示は、薬剤−ポリペプチドコンジュゲートを提供する。薬剤の例としては、小分子薬剤、例えば、癌化学療法薬が挙げられる。例えば、ポリペプチドが、腫瘍細胞への特異性を有する抗体(またはこれらのフラグメント)である場合、本明細書に記載したとおり、その後、癌化学療法薬、例えば、微小管に影響を及ぼす薬剤に共役することができる修飾されたアミノ酸を含むように抗体を修飾することができる。特定の実施形態では、薬剤が、抗増殖活性を有する微小管に影響を及ぼす薬剤、例えば、マイタンシノイドである。特定の実施形態では、薬剤が、以下の構造を有するマイタンシノイドである。
式中、
が、マイタンシノイド及びリンカー、式(I)中のL間の結合点を示す。「結合点」は、マイタンシノイドのN及びリンカー、式(I)中のL間の結合を示す記号を意味する。例えば、式(I)中のW
1が、マイタンシノイド、例えば、マイタンシノイド及びリンカー、L間の結合点を示す前記構造のマイタンシノイドである。
特定の実施形態では、L1が、ヒドラジニル−ピロロ部分(例えば、前記の式(I)に示したとおり)に結合される。特定の実施形態では、L2が、存在する場合、W1(マイタンシノイド)に結合される。特定の実施形態では、L3が、存在する場合、W1(マイタンシノイド)に結合される。特定の実施形態では、L4が、存在する場合、W1(マイタンシノイド)に結合される。
前記に記載したとおり、特定の実施形態では、L1が、ヒドラジニル−ピロロ部分(例えば、前記の式(I)に示したとおり)に結合される。したがって、特定の実施形態では、T1が、ヒドラジニル−ピロロ部分(例えば、前記の式(I)に示したとおり)に結合される。特定の実施形態では、Z1が、W1(マイタンシノイド)に結合される。特定の実施形態では、L2が、存在する場合、W1(マイタンシノイド)に結合される。したがって、特定の実施形態では、T2が、存在する場合、W1(マイタンシノイド)に結合される、またはZ2が、存在する場合、W1(マイタンシノイド)に結合される。特定の実施形態では、L3が、存在する場合、W1(マイタンシノイド)に結合される。したがって、特定の実施形態では、T3が、存在する場合、W1(マイタンシノイド)に結合される、またはZ3が、存在する場合、W1(マイタンシノイド)に結合される。特定の実施形態では、L4が、存在する場合、W1(マイタンシノイド)に結合される。したがって、特定の実施形態では、T4が、存在する場合、W1(マイタンシノイド)に結合される、またはZ4が、存在する場合、W1(マイタンシノイド)に結合される。
本開示の実施形態では、ポリペプチド(例えば、抗HER2抗体)が、1つ以上の薬剤部分(例えば、マイタンシノイド)、例えば、2つの薬剤部分、3つの薬剤部分、4つの薬剤部分、5つの薬剤部分、6つの薬剤部分、7つの薬剤部分、8つの薬剤部分、9つの薬剤部分、または10以上の薬剤部分に共役されているコンジュゲートを含む。当該薬剤部分は、本明細書に記載したとおり、ポリペプチド中の1つ以上の部位でポリペプチドに共役させてよい。特定の実施形態では、コンジュゲートが、0.1〜10、または0.5〜10、または1〜10、例えば、1〜9、または1〜8、または1〜7、または1〜6、または1〜5、または1〜4、または1〜3、または1〜2の範囲の平均薬物抗体比(DAR)(モル比)を有する。特定の実施形態では、コンジュゲートが、平均DAR1〜2、例えば、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9または2を有する。特定の実施形態では、コンジュゲートが、1.7の平均DARを有する。特定の実施形態では、コンジュゲートが、平均DAR3〜4、例えば、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9または4を有する。特定の実施形態では、コンジュゲートが、3.4の平均DARを有する。平均は、算術平均を意味する。
配合物
本開示のコンジュゲート(抗体コンジュゲートを含む)は、さまざまな異なる方法で配合することができる。一般に、コンジュゲートが、ポリペプチド−薬剤コンジュゲートである場合、コンジュゲートは、ポリペプチドに共役された薬剤、治療される状態、及び用いられる投与経路と適合する方法で配合される。
コンジュゲート(例えば、ポリペプチド−薬剤コンジュゲート)は、任意の好適な形態で、例えば、製剤的に許容可能な塩の形態で提供することができ、任意の好適な投与経路、例えば、経口、局所または非経口投与のために配合することができる。コンジュゲートが、注入可能な液体(例えば、これらの実施形態では、それらが静脈内に、または組織に直接、投与される)として提供される場合、コンジュゲートは、使用準備済剤形として、または再構成可能貯蔵安定粉末もしくは製剤的に許容可能なキャリア及び賦形剤からなる液体として提供することができる。
コンジュゲートの配合方法は、容易に利用できる方法から適合させることができる。例えば、コンジュゲートは、治療的に有効量のコンジュゲート及び製剤的に許容可能なキャリア(例えば、生理食塩水)を含む医薬組成物中に提供することができる。医薬組成物が、任意で、他の添加剤(例えば、緩衝剤、安定剤、防腐剤など)を含んでよい。いくつかの実施形態では、配合物が、哺乳動物への投与に好適であり、例えば、ヒトへの投与に好適な配合物である。
治療方法
本開示のポリペプチド−薬剤コンジュゲートは、親薬剤(すなわち、ポリペプチドへの共役前の薬剤)の投与による治療に適している被験者の状態または疾患の治療に用いられる。「治療」は、少なくとも、宿主を苦しめる状態に関連した症状の改善が実現することを意味し、改善は、広い意味で、少なくとも、パラメーターの大きさ、例えば、治療される状態に関連した症状が減少することを指すように用いられる。したがって、治療が、また、病理的状態、または少なくともそれに関連した症状が、完全に抑制され、例えば、発症が防止され、または停止され、例えば、中断され、その結果、宿主が、状態、または少なくとも状態を特徴づける症状にもはや苦しまない状況を含む。このため、治療が、(i)予防、すなわち、臨床的症状が発現しないようにすること、例えば、有害な状態に疾患が進行するのを防止することを含む臨床的症状の発現のリスクを低下させること;(ii)抑制、すなわち、臨床的症状が発現する、またはさらに発現するのを阻止すること、例えば、活動性疾患を軽減することまたは完全に抑制すること;及び/または(iii)緩和、すなわち、臨床的症状を後退させることを含む。
癌の文脈では、用語「治療する」が、固体腫瘍の成長を低下させること、癌細胞の複製を抑制すること、全体の腫瘍負担を低下させること及び癌に関連した1つ以上の症状を改善することのいずれか、または全てを含む。
治療される被験者は、治療が必要な者とすることができ、治療される宿主が、親薬剤を用いた治療に適している者である。したがって、さまざまな被験者が、本明細書に開示されるポリペプチド−薬剤コンジュゲートを用いた治療に適している可能性がある。一般に、かかる被験者が、「哺乳動物」であり、対象となるヒトを含む。他の被験者としては、ペット(例えば、イヌ及びネコ)、家畜(例えば、ウシ、ブタ、ヤギ、ウマ、など)、げっ歯類動物(例えば、マウス、モルモット、及びラット、例えば、疾患の動物モデル)、ならびに非ヒト霊長動物(例えば、チンパンジー、及びサル)を挙げることができる。
投与されるポリペプチド−薬剤コンジュゲートの量は、最初に、親薬剤の用量及び/または投与計画のガイダンスに基づいて決定することができる。一般に、ポリペプチド−薬剤コンジュゲートは、標的デリバリー及び/または結合薬剤の血清半減期の向上をもたらし、このため、投与計画で用量の減少または投与の減少の少なくとも1つをもたらすことができる。このため、ポリペプチド−薬剤コンジュゲートは、本開示のポリペプチド−薬剤コンジュゲート中に共役される前の親薬剤と比較して、投与計画で用量の減少及び/または投与の減少をもたらすことができる。
さらに、前記に記載したとおり、ポリペプチド−薬剤コンジュゲートが、薬剤デリバリーのストイキオメトリーの制御をもたらすことができるため、ポリペプチド−薬剤コンジュゲートの投与量は、1ポリペプチド−薬剤コンジュゲート主剤当たりに提供される薬剤分子の数に基づいて計算することができる。
いくつかの実施形態では、ポリペプチド−薬剤コンジュゲートの複数の用量が投与される。ポリペプチド−薬剤コンジュゲートの投与の頻度は、さまざまな因子、例えば、症状の重症度、被験者の状態、などのいずれかに応じて変えることができる。例えば、いくつかの実施形態では、ポリペプチド−薬剤コンジュゲートが、1ヶ月当たり1回、1ヶ月当たり2回、1ヶ月当たり3回、隔週(qow)、1週間当たり1回(qw)、1週間当たり2回(biw)、1週間当たり3回(tiw)、1週間当たり4回、1週間当たり5回、1週間当たり6回、隔日(qod)、毎日(qd)、1日当たり2回(qid)、または1日当たり3回(tid)、投与される。
癌の治療方法
本開示は、癌を有する個体に癌化学療法薬を送達する方法を提供する。本方法は、癌腫、肉腫、白血病、及びリンパ腫を含む幅広い癌を治療するのに有用である。
対象の方法を用いて治療することができる癌腫としては、食道癌、肝細胞癌、基底細胞癌(皮膚癌の形態)、扁平細胞癌(さまざまな組織)、膀胱癌、(移行細胞癌(膀胱の悪性新生物)を含む)、気管支原生癌、結腸癌、大腸癌、胃癌、肺癌(肺の小細胞癌及び非−小細胞癌を含む)、副腎皮質癌、甲状腺癌、膵臓癌、乳癌、卵巣癌、前立腺癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭腺癌、嚢胞腺癌、髄様癌、腎細胞癌、in situの腺管癌または胆管癌、絨毛膜癌、セミノーマ、胎生性癌、ウィルムス腫瘍、子宮頸癌、子宮癌、精巣癌、骨原性癌腫、上皮癌腫、及び鼻咽頭癌などが挙げられるが、これらに限定されない。
対象の方法を用いて治療することができる肉腫としては、繊維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、脊椎腫、骨原性肉腫、骨肉腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、悪性滑膜、中皮腫、ユーイング腫瘍、平滑筋肉腫、横絞筋肉腫、及び他の軟部組織肉腫が挙げられるが、これらに限定されない。
対象の方法を用いて治療することができる他の固体腫瘍としては、グリオーマ、星状細胞腫、髄芽腫、頭蓋咽頭腫、脳室上皮腫、松果体腫、血管芽腫、聴神経鞘腫、乏突起細胞腫、髄膜腫(menangioma)、黒色腫、神経細胞腫、及び網膜芽腫が挙げられるが、これらに限定されない。
対象の方法を用いて治療することができる白血病としては、a)慢性脊髄増殖性症候群(多能性造血幹細胞の腫瘍性障害);b)急性骨髄性白血病(分化能が制限された多能性造血幹細胞または造血細胞の腫瘍性転化;c)慢性リンパ性白血病(CLL;免疫学的に未成熟で機能的に能力のない小リンパ球のクローン増殖)(B−細胞CLL、T−細胞CLL前リンパ球性白血病、及び有毛細胞白血病を含む);及びd)急性リンパ芽球性白血病(リンパ芽球の蓄積によって特徴づけられる)が挙げられるが、これらに限定されない。対象の方法を用いて治療することができるリンパ腫としては、B−細胞リンパ腫(例えば、バーキットリンパ腫);ホジキンリンパ腫;非ホジキンB細胞リンパ腫;などが挙げられるが、これらに限定されない。
以下の実施例は、本発明の実施方法及び使用方法の包括的な開示及び説明を当業者に提供するために記載され、発明者が、発明と考えるものの範囲を制限することを意図せず、以下の実験が、実施した全実験または唯一の実験であることを示すことも意図しない。用いられる数(例えば、量、温度など)に関して正確さを確保するために努力がなされてきたが、いくつかの実験誤差および偏差の責任を負わなければならない。特に指示がないかぎり、部は重量部であり、分子量は重量平均分子量であり、温度は摂氏度であり、圧力は大気圧または近大気圧である。平均は、算術平均を意味する。例えば、bp、塩基対(単数及び複数);kb、キロベース(単数及び複数);pl、ピコリットル(単数及び複数);sまたはsec、秒(単数及び複数);min、分(単数及び複数);hまたはhr、時間(単数及び複数);aa、アミノ酸(単数及び複数);kb、キロベース(単数及び複数);bp、塩基対(単数及び複数);nt、ヌクレオチド(単数及び複数);i.m.、筋肉内の(筋肉内で);i.p.、腹腔内の(腹腔内で);s.c.、皮下の(皮下で);などの標準略語を用いてよい。
一般的合成方法
開示された化合物を合成するのに有用な一般に公知の化学合成的スキーム及び条件を提供するための多くの一般的文献が、利用可能である(例えば、Smith and March,March’s Advanced Organic Chemistry:Reactions,Mechanisms,and Structure,Fifth Edition,Wiley−Interscience,2001;またはVogel,A Textbook of Practical Organic Chemistry,Including Qualitative Organic Analysis,Fourth Edition,New York:Longman,1978を参照)。
本明細書に記載したとおりの化合物は、クロマトグラフィー、例えば、HPLC、分取薄層クロマトグラフィー、フラッシュカラムクロマトグラフィー及びイオン交換クロマトグラフィーを含む当技術分野で知られている任意の精製プロトコールによって精製することができる。順相及び逆相ならびにイオン樹脂を含む任意の好適な固定相を用いることができる。特定の実施形態では、開示された化合物が、シリカゲル及び/またはアルミナクロマトグラフィーによって精製される。例えば、Introduction to Modern Liquid Chromatography,2nd Edition,ed.L.R.Snyder and J.J.Kirkland,John Wiley and Sons,1979;及びThin Layer Chromatography,ed E.Stahl,Springer−Verlag,New York,1969を参照。
対象の化合物の調製のためのプロセスのいずれかの間に、関係する分子のいずれかの感受性基または反応性基を保護することが必要である、及び/または好ましい可能性がある。これは、例えば、J.F.W.McOmie.「Protective Groups in Organic Chemistry」,Plenum Press,London and New York 1973,in T.W.Greene and P.G.M.Wuts,「Protective Groups in Organic Synthesis」,Third edition,Wiley,New York 1999,in 「The Peptides」;Volume 3(editors:E.Gross and J.Meienhofer),Academic Press,London and New York 1981,in「Methoden der organischen Chemie」,Houben−Weyl,4th edition,Vol.15/l,Georg Thieme Verlag,Stuttgart 1974,in H.−D.Jakubke and H.Jescheit,「Aminosauren,Peptide,Proteine」,Verlag Chemie,Weinheim,Deerfield Beach,and Basel 1982,and/or in Jochen Lehmann,「Chemie der Kohlenhydrate:Monosaccharide and Derivate」,Georg Thieme Verlag,Stuttgart 1974の標準作業に記載されたとおり、従来の保護基の手段によって実現してよい。保護基は、当技術分野で公知の方法を用いて、好適な次の工程で除去してよい。
対象の化合物は、市販されている出発物質及び/または従来の合成方法によって調製された出発物質を用いて、さまざまな異なる合成経路によって、合成することができる。本明細書に開示された化合物を合成するのに用いることができる合成経路のさまざまな例が、以下のスキームに記載されている。
実施例1
部位特異的に共役される抗体−薬剤コンジュゲート(ADC)を生成するために実験が実施された。部位特異的ADC生成には、タンパク質配列へのホルミルグリシン(FGly)、非天然アミノ酸の組込みが含まれる。FGlyを組み込むために(図1)、短いコンセンサス配列、CXPXR(Xが、セリン、トレオニン、アラニン、またはグリシンである)が、標準分子生物学クローニング技術を用いて、抗体重鎖または軽鎖の保存領域中の所望の位置に挿入された。この「標識を付けられた」構成体は、同時翻訳でタグ内のシステインをFGly残基に変換し、アルデヒド官能基(また、本明細書では、アルデヒドタグと称される)を生成するホルミルグリシン生成酵素(FGE)を同時発現する細胞中に遺伝子組換えで生成された。アルデヒド官能基は、原生物共役のための化学的ハンドルとしての役割を果たした。FGlyにペイロード(例えば、薬剤、例えば、サイトトキシン)を結合し、その結果、サイトトキシンペイロード及び抗体間に安定した共有結合C−C結合を形成するため、ヒドラジノ−イソ−ピクテ−スペングラー(HIPS)リゲーションが、用いられた。このC−C結合は、循環及びFcRn再利用中にADCによって現れる生理的に関係のある変化、例えば、プロテアーゼ、低pH、及び還元剤に対して安定していると予測された。アルデヒドタグを有する抗体は、さまざまな位置に生成してよい。軽鎖中の1つの部位及び重鎖中の7つの部位にアルデヒドタグを挿入する作用を試験するために実験を実施した。HIPSリンカーを介したメイタンシンペイロードへの共役によって生成され、得られた3つのADCで生物物理学及び機能的特性解析を実施した。結合部位を調節することには、抗体有効性及びPKへの有意な効果があった。
実験方法
一般
マウス抗−メイタンシン抗体を生成し、試験所内で確認した。Life Technologies(Grand Island、NY)からウサギ抗−AF488抗体を購入した。Jackson Immunoresearch(West Grove、PA)からヤギ抗−ヒトIgG−特異的抗体及びヤギ抗−ヒトFab−特異的抗体、及びロバ抗−ウサギ、ヤギ抗−マウスIgGサブクラスI−特異的、及びヤギ抗−ヒトFc−特異的HRP−コンジュゲートを購入した。
標識を付けられた抗体のクローニング、発現、及び精製
標準分子生物学技術を用いて、軽鎖及び重鎖コンセンサス領域中のさまざまな点にアルデヒドタグ配列を挿入した。小規模生成では、ヒトFGE発現構成体で、CHO−S細胞をトランスフェクトし、抗体の過渡的生成にFGEを過剰発現している細胞のプールを用いた。大規模生成では、ヒトFGEを過剰発現しているクローン細胞株(GPEx)を生成するために、GPEx technology(Catalent,Inc.、Somerset、NJ)を用いた。その後、抗体を発現している細胞の大量で安定したプールを生成するためにFGEクローンを用いた。タンパク質Aクロマトグラフィー(MabSelect、GE Healthcare Life Sciences、Pittsburgh、PA)を用いて、条件付き培地から抗体を精製した。精製した抗体を急速冷凍し、さらに使用するまで−80℃で、保存した。
バイオコンジュゲーション、精製、及びHPLC分析
72時間、37℃で、50mMクエン酸ナトリウム、0.85%DMA及び0.085%Triton X−100を含有する50mM NaCl pH5.5中で、アルデヒド標識抗体(15mg/mL)をHIPS−Glu−PEG2−メイタンシン(薬剤と抗体が等量の8モル)に共役させた。タンジェント流ろ過を用いて、遊離型薬剤を除去した。移動相A:1.0M硫酸アンモニウム、25mMリン酸ナトリウムpH7.0、及び移動相B:25%イソプロパノール、18.75mMリン酸ナトリウムpH7.0で、分取スケール疎水性相互作用クロマトグラフィー(HIC;GE Healthcare 17−5195−01)を用いて、非共役抗体を除去した。非共役物質を溶離させるために33%Bの無勾配を用い、続いて、単共役及び二共役種を溶離させるために41〜95%Bの直線勾配を用いた。最終生成物のDARを測定するために、移動相A:1.5M硫酸アンモニウム、25mMリン酸ナトリウムpH7.0、及び移動相B:25%イソプロパノール、18.75mMリン酸ナトリウムpH7.0で、分析用HIC(Tosoh#14947)によってADCを検討した。凝集を測定するために、300mM NaCl、25mMリン酸ナトリウムpH6.8の移動相で、分析用サイズ排除クロマトグラフィー(SEC;Tosoh#08541)を用いて、試料を分析した。
in vitro安定性
約1pmol(ペイロード)/mLで、ラット血しょうに抗体−発蛍光団及び抗体−薬剤コンジュゲートを加えた。試料を採取し、使用するまで−80℃で、保存した。指示された時間、5%CO2下で、37℃で、アリコットを置き、その後、抗−メイタンシン及び抗−Fabシグナルを評価するためにELISAによって分析した。分析のための第1のステップとして、分析対象物質濃度が、アッセイのリニアレンジ内(20〜40ng/mL)であることを確実にするために1%ウシ血清アルブミン中への分析対象物質の連続希釈を実施した。一度、好適な希釈を測定してから、インキュベーターから試料を除去し、試験した。共役の参照開始値として新鮮解凍アリコットを用いた。時点間での比較が可能になるように1つのプレート上で、全分析対象物質をともに測定した。抗−ヒトFab−特定の抗体で被覆したプレート上で分析対象物質を捕捉した。その後、ペイロードを、抗−AF488または抗−メイタンシン抗体のいずれかで、検出し、続いて、HRP−共役二次抗体で検出した;全抗体を、直接共役された抗−ヒトFc−特異的抗体で、検出した。TMB基質で結合二次抗体を視覚化した。H2SO4で比色反応を停止させ、プレートリーダーを用いて、450nmで、吸光度を測定した。Excelでデータ分析を実施した。4連で、各試料を分析し、平均値を用いた。抗体共役の尺度として、抗−メイタンシンシグナルと抗−Fabシグナルとの比を用いた。
in vitro細胞傷害性
ATCCからHER2−陽性乳癌細胞株、NCI−N87を入手し、10%ウシ胎児血清(Invitrogen、Grand Island、NY)及びGlutamax(Invitrogen)を補ったRPMI−1640培地(Cellgro、Manassas、VA)中に維持した。平板培養前の24時間、対数期成長を確実にするために細胞を通過させた。平板培養の日に、10IUペニシリン及び10μg/mLストレプトマイシンを補った90μL正常成長培地(Cellgro)中の96−ウェルプレート上に5000細胞/ウェルを播種した。10μLの希釈した分析対象物質と、さまざまな濃度で、細胞を処置し、37℃で、5%CO2の雰囲気中で、プレートをインキュベートした。6日後、100μL/ウェルの細胞Titer−Glo試薬(Promega、Madison、WI)を添加し、モレキュラーデバイスSpectraMax M5プレートリーダーを用いて、発光を測定した。IC50計算を含むデータ分析のためにGraphPad Prismソフトウエアを用いた。
異種移植試験
50%Matrigel中の1x107NCI−N87腫瘍細胞をメスC.B−17 SCIDマウスの尾の付け根に接種した。腫瘍が、平均112mm3に達した場合、動物に単一5mg/kg用量のADC、トラスツズマブ抗体(標識を付けられていない)、またはビヒクルだけを与えた。1週間に2回、体重及び腫瘍サイズについて動物をモニターした。以下の式を用いて、腫瘍容積を計算した。
腫瘍容積(mm3)=(w2xl)/2
式中、w=腫瘍幅、及びl=腫瘍長
4つの群のマウスの腫瘍成長速度曲線を平均することによって腫瘍倍加時間を得た。その後、以下の式を用いて、log10細胞殺傷を推定した。
log10細胞殺傷=(治療群TTE−対照群TTE)/(3.32x腫瘍倍加時間)
PK分析
単一5mg/kgボーラスの抗体コンジュゲートをオスBALB/cマウスの静脈内に投与した。投与後、1時間、8時間及び20時間、及び2、4、6、8、10、14、21、及び28日に、時点ごとに3匹の動物の血しょうを採集した。1週間ごとに2回以上、単一の動物を採取しなかった。−80℃で、血しょう試料を保存し、ELISAによって全抗体及び全ADCの濃度を定量化した。前者について、抗−ヒトIgG−特異的抗体で、コンジュゲートを捕捉し、HRP−共役抗−Fc−特異的抗体でコンジュゲートを検出した。後者について、抗−ヒトFab−特異的抗体で、コンジュゲートを捕捉し、マウス抗−メイタンシン一次抗体で、コンジュゲートを検出し、続いて、HRP−共役抗−マウスIgG−サブクラス1−特異的二次抗体で、コンジュゲートを検出した。Ultra TMB One−Step ELISA基質(Thermo Fisher、Waltham、MA)を用いて、結合二次抗体を検出した。硫酸で反応をクエンチ後、SoftMax Proソフトウエアを備えたモレキュラーデバイスSpectra Max M5プレートリーダーで、450nmで、吸光度を取ることによってシグナルを読んだ。GraphPad Prismソフトウエアを用いて、データを分析した。以下の式によるY値(1/Y
2によって加重した)の平均の非線形回帰によって、経時的に測定した濃度を2−コンパートメントモデルにフィットさせた。
得られた指数的減弱定数(τβ)を用いて、t1/2を計算した。
熱蛍光
FcRN
NHS−LC−Biotin(Pierce、#21336)を用いて、製造者の指示書に従って、FcRn(Sino Biologicals、#CT009−H08H)をビオチン化した。「キネティックバッファー」:20mMホスフェート、150mM NaCl、0.02%Tween−20、0.05%ナトリウムアジド、0.1mg/mLウシ血清アルブミン中でFcRnアッセイのための全希釈及び結合ステップを行った。バッファーは、別段の記載を除いてpH6.0であった。黒色96ウェルプレート中で、10分間、200μLのキネティックバッファー中で、SAバイオセンサー(ForteBio、#1305291)を事前に水和反応させた。その後、チップをForteBio Octet Redバイオセンサーに入れ、1分間、ベースラインシグナルを設定した。その後、1.5μg/mLビオチン化FcRn中にチップを置き、320秒間、捕捉した。さらに2回の1分間、ベースラインステップ後、5分間、IgG(100nM)を結合させた。最後に、pH7.3のキネティックバッファーを含有するウェルにチップを移動し、5分間、解離をモニターした。
免疫原性
iTope(商標)を用いて、タグを含有する領域にまたがるオーバーラッピング9merで、標識配列及び非標識配列の分析を実施し、34ヒトMHCクラスII対立遺伝子のそれぞれに対して試験した。ポテンシャル「フィット」及びMHCクラスII分子による相互作用に基づいて各9merにスコアを付与した。ソフトウエアによって計算したペプチドスコアは、0〜1の間にある。高平均結合スコア(iTope(商標)スコアリング機能で>0.55)を得たペプチドを強調した。MHCクラスII結合ペプチドの≧50%(すなわち、34対立遺伝子のうち17を越える)では、高結合親和性(スコア>0.6)がみられ、かかるペプチドを「乱雑高親和性」と定義した。スコア>0.55である対立遺伝子のMHCクラスII結合ペプチド結合≧50%を「乱雑中等度親和性」と定義した。また、配列を用いて、以前に特定されたT細胞エピトープとの同一性または高配列相同性を確認するために、BLASTサーチによってTCED(商標)(T細胞エピトープデータベース)に照会した。
HIPS−Glu−PEG2−メイタンシンの合成
(S)−5−(3−(tert−ブトキシ)−3−オキソプロピル)−1−(9H−フルオレン−9−イル)−3,6−ジオキソ−2,10,13−トリオキサ−4,7−ジアザヘキサデカン−16−オイック酸(3)の調製
スターラーバーを含有する20mLガラスシンチレーションバイアルにアミン2(710.3mg、4.0mmol)、及びNa2CO3(637.9mg、6.0mmol)を添加した。水(10.0mL)を添加し、20℃で、5分間、溶液を撹拌し透明で無色の溶液が得られた。分離20mLガラスシンチレーションバイアルにペンタフルオロフェニルエステル1(1185.7mg、2.0mmol)を添加し、10.0mLの1,4−ジオキサン中に溶解した。前記の調製した溶液に滴下添加され、透明で無色の溶液を得ているバイアルを1分間、ボルテックスさせ、白色沈殿物が得られた。20℃で、4時間、反応物を撹拌し、70mLの水に添加し、1MのHClの滴下添加によってpH3まで酸性にし、2x50mLのEtOAcで抽出し、Na2SO4上で乾燥させた。有機フラクションを濾過し、蒸発させ、溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって精製した。高真空下で、精製した生成物を乾燥させ、粘着性で吸湿性の白色固体として1137.3mg(97%)の化合物3が得られた。
(S)−7−アミノ−2,2−ジメチル−4,8−ジオキソ−3,12,15−トリオキサ−9−アザオクタデカン−18−オイック酸(4)の調製
アミン化合物3(2638.7mg、4.513mmol)をDMF(8.92mL)中のピペリジン(2.23mL、22.57mmol)溶液(20%v/vピペリジン)中に溶解し、20℃で、1時間、撹拌した。白色沈殿物が形成された。反応物を濾過し、透明で淡黄色の溶液が得られた。溶液を蒸発させ、溶離液として0〜100%CH
3CN−H
2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって精製した。高真空下で、分離した生成物を乾燥させ、透明で粘性の油として813.1mg(50%)の化合物4が得られた。
(S)−7−(3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパンアミド)−2,2−ジメチル−4,8−ジオキソ−3,12,15−トリオキサ−9−アザオクタデカン−18−オイック酸(6)の調製
乾燥させたスターラーバーを含有する乾燥させた20mLガラスシンチレーションバイアルにアミン化合物4(582.4mg、1.607mmol)を添加した。無水DMF(5mL)及び(i−Pr)
2NEt、(0.84mL、4.82mmol)を添加し、20℃で、5分間、溶液を撹拌し、透明で非常に淡黄色の溶液が得られた。少量ずつ、5分以上で、エステル5(1253.7mg、1.930mmol)を添加し、20℃で、2時間、反応物を撹拌した。溶離液として0〜100%CH
3CN−H
2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって、さらにワークアップなしで、反応混合物を精製した。高真空下で、精製した生成物を乾燥させ、白色フィルムとして406.3mg(49%)の化合物6が得られた。
2−(((tert−ブチルジメチルシリル)オキシ)メチル)−1H−インドール(8)
オーブン乾燥フラスコに、インドール−2−メタノール,7,(1.581g,10.74mmol),TBSCl(1.789g、11.87mmol)、及びイミダゾール(2.197g、32.27mmol)を装填し、この混合物をCH2Cl2(40mL、無水)中に懸濁させた。16時間後、オレンジ色残基に反応混合物を濃縮した。粗混合物をEt2O(50mL)中に溶かし、水性AcOH(5%v/v、3x50mL)及びブライン(25mL)で洗浄した。混合有機層をNa2SO4上で乾燥させ、濃縮し、さらに精製しないで用いられた結晶質固体として、2.789g(99%)の化合物8が得られた。
1H NMR (500 MHz, CDCl3) δ 8.29 (s, 1H), 7.57 (d, J = 7.7 Hz, 1H), 7.37 (dd, J = 8.1, 0.6 Hz, 1H), 7.19 − 7.14 (m, 1H), 7.12 − 7.07 (m, 1H), 6.32 (d, J = 1.0 Hz, 1H), 4.89 (s, 2H), 0.95 (s, 9H), 0.12 (s, 6H).13C NMR (101 MHz, CDCl3) δ 138.3, 136.0, 128.6, 121.7, 120.5, 119.8, 110.9, 99.0, 59.4, 26.1, 18.5, −5.2.C15H24NOSi[M+H]+のHRMS(ESI)計算値:262.1627;実測値:262.1625.
メチル3−(2−(((tert−ブチルジメチルシリル)オキシ)メチル)−1H−インドール−1−イル)プロパノエート(10)
CH3CN(25mL)中のインドール8(2.789g、10.67mmol)の溶液にメチルアクリレート、9、(4.80mL、53.3mmol)を添加し、続いて、1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン(800μL,5.35mmol)を添加し、得られた混合物を還流させた。18時間後、溶液を冷却し、シリカゲルクロマトグラフィー(9:1ヘキサン:EtOAc)によって精製されたオレンジ色油に濃縮し、無色油として3.543g(96%)の化合物10が生成された。
1H NMR (400 MHz, CDCl3) δ 7.58 (d, J = 7.8 Hz, 1H), 7.34 (d, J = 8.2 Hz, 1H), 7.23 − 7.18 (m, 1H), 7.12 − 7.07(m, 1H), 6.38 (s, 1H), 4.84 (s, 2H), 4.54 − 4.49 (m, 2H), 2.89 − 2.84 (m, 2H), 0.91 (s, 9H), 0.10 (s, 6H).13C NMR (101 MHz, CDCl3) δ 172.0, 138.5, 137.1, 127.7, 122.0, 121.0, 119.8, 109.3, 101.8, 58.2, 51.9, 39.5, 34.6, 26.0, 18.4, −5.2.C19H30NO3Si[M+H]+のHRMS(ESI)計算値:348.1995;実測値:348.1996.
メチル3−(2−(ヒドロキシメチル)−1H−インドール−1−イル)プロパノエート(11)
THF(20mL)中の化合物10(1.283g、3.692mmol)の溶液に、0℃で、THF(3.90mL、3.90mmol)中のテトラブチルアンモニウムフルオリドの1.0M溶液を添加した。15分後、Et2O(20mL)で反応混合物を希釈し、NaHCO3(飽和水溶性、3x20mL)で洗浄し、薄緑色油に濃縮した。シリカゲルクロマトグラフィー(2:1ヘキサン:EtOAc)によって油を精製し、白色結晶質固体として822mg(95%)の化合物11が生成された。
1H NMR (500 MHz, CDCl3) δ 7.60 (d, J = 7.8 Hz, 1H), 7.34 (dd, J = 8.2, 0.4 Hz, 1H), 7.27 − 7.23 (m, 1H), 7.16 − 7.11 (m, 1H), 6.44 (s, 1H), 4.77 (s, 2H), 4.49 (t, J = 7.3 Hz, 2H), 3.66 (s, 3H), 2.87 (t, J = 7.3 Hz, 2H), 2.64 (s, 1H).13C NMR (126 MHz, CDCl3) δ 172.3, 138.5, 137.0, 127.6, 122.2, 121.1, 119.9, 109.3, 102.3, 57.1, 52.0, 39.1, 34.3.C13H15NNaO3[M+Na]+のHRMS(ESI)計算値:256.0950;実測値:256.0946.
メチル3−(2−ホルミル−1H−インドール−1−イル)プロパノエート(12)
デス−マーチンペルヨージナン(5.195g、12.25mmol)をCH2Cl2(20mL)及びピリジン(2.70mL、33.5mmol)の混合物中に懸濁させた。5分後、CH2Cl2(10mL)中のメチル3−(2−(ヒドロキシメチル)−1H−インドール−1−イル)プロパノエート(化合物11;2.611g、11.19mmol)の溶液に得られた白色懸濁液を移し、赤茶色懸濁液が得られた。1時間後、チオ硫酸ナトリウム(10%水溶液、5mL)及びNaHCO3(飽和水溶液、5mL)で反応物をクエンチした。水性層をCH2Cl2(3x20mL)で抽出し;混合抽出物をNa2SO4上で乾燥させ、濾過し、茶色油に濃縮した。シリカゲルクロマトグラフィー(ヘキサン中の5〜50%EtOAc)による精製の結果、無色油として2.165g(84%)の化合物12が生成された。
1H NMR (400 MHz, CDCl3) δ 9.87 (s, 1H), 7.73 (dt, J = 8.1, 1.0 Hz, 1H), 7.51 (dd, J = 8.6, 0.9 Hz, 1H), 7.45 − 7.40 (m, 1H), 7.29 (d, J = 0.9 Hz, 1H), 7.18 (ddd, J = 8.0, 6.9, 1.0 Hz, 1H), 4.84 (t, J = 7.2 Hz, 2H), 3.62 (s, 3H), 2.83 (t, J = 7.2 Hz, 2H).13C NMR (101 MHz, CDCl3) δ 182.52, 171.75, 140.12, 135.10, 127.20, 126.39, 123.46, 121.18, 118.55, 110.62, 51.83, 40.56, 34.97.C13H13NO3Na[M+Na]+のHRMS(ESI)計算値:254.0793;実測値:254.0786.
3−(2−ホルミル−1H−インドール−1−イル)プロパンオイック酸(13)
ジオキサン(100mL)中に溶解したインドール12(2.369g、10.24mmol)の溶液に、LiOH(4M水溶液、7.68mL、30.73mmol)を添加した。濃白色沈殿物が、数時間の間に次第に形成された。21時間後、HCl(1M水溶液、30mL)を滴下添加し、pH=4の溶液が得られた。溶液を濃縮し、得られた薄茶色油をEtOAc(50mL)中に溶解し、水(2x50mL)及びブライン(20mL)で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、オレンジ色固体に濃縮した。シリカゲルクロマトグラフィー(0.1%酢酸とヘキサン中の10〜50%EtOAc)による精製の結果、淡黄色固体として1.994g(84%)の化合物13が生成された。
1H NMR (400 MHz, CDCl3) δ 9.89 (s, 1H), 7.76 (dt, J = 8.1, 0.9 Hz, 1H), 7.53 (dd, J = 8.6, 0.9 Hz, 1H), 7.48 − 7.43 (m, 1H), 7.33 (d, J = 0.8 Hz, 1H), 7.21 (ddd, J = 8.0, 6.9, 1.0 Hz, 1H), 4.85 (t, J = 7.2 Hz, 2H), 2.91 (t, J = 7.2 Hz, 2H).13C NMR (101 MHz, CDCl3) δ 182.65, 176.96, 140.12, 135.02, 127.33, 126.42, 123.53, 121.27, 118.76, 110.55, 40.19, 34.82.C12H10NO3[M−H]−のHRMS(ESI)計算値:216.0666;実測値:216.0665.
3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパンオイック酸(15)
1,2−ジクロロエタン(無水、25mL)中の化合物13(1.193g、5.492mmol)及び(9H−フルオレン−9−イル)メチル1,2−ジメチルヒドラジンカルボキシレート、14、(2.147g、7.604mmol)の溶液に、ナトリウムトリアセトキシボロヒドリド(1.273g、6.006mmol)を添加した。2時間、得られた黄色懸濁液を撹拌し、その後、NaHCO3(飽和水溶液、10mL)でクエンチし、続いて、HCl(1M水溶液)を添加し、pH4にした。有機層を分離し、水性層をCH2Cl2(5x10mL)で抽出した。プールした有機抽出物をNa2SO4上で乾燥させ、濾過し、オレンジ色油に濃縮した。C18シリカゲルクロマトグラフィー(水中の20〜90%CH3CN)による精製の結果、蝋様ピンク色固体として1.656g(62%)の化合物15が生成された。
1H NMR (400 MHz, CDCl3) δ 7.76 (d, J = 7.4 Hz, 2H), 7.70 − 7.47 (br m, 3H), 7.42 − 7.16 (br m, 6H), 7.12 − 7.05 (m, 1H), 6.37 (s, 0.6H), 6.05 (s, 0.4H), 4.75 − 4.30 (br m, 4H), 4.23 (m, 1H), 4.10 (br s, 1H), 3.55 (br d, 1H), 3.11 − 2.69 (m, 5H), 2.57 (br s, 2H), 2.09 (br s, 1H).13C NMR (101 MHz, CDCl3) δ 174.90, 155.65, 143.81, 141.42, 136.98, 134.64, 127.75, 127.48, 127.12, 124.92, 122.00, 120.73, 120.01, 119.75, 109.19, 103.74, 67.33, 66.80, 51.39, 47.30, 39.58, 39.32, 35.23, 32.10.C29H30N3O4[M+H]+のHRMS(ESI)計算値:484.2236;実測値:484.2222.
(9H−フルオレン−9−イル)メチル1,2−ジメチル−2−((1−(3−オキソ−3−(ペルフルオロフェノキシ)プロピル)−1H−インドール−2−イル)メチル)ヒドラジン−1−カルボキシレート(5)
乾燥させたスターラーバーを含有する乾燥させた100mLの2首丸底フラスコに化合物15(5.006g、10.4mmol)を添加した。シリンジによって無水EtOAc、40mLを添加し、20℃で、5分間、溶液を撹拌し、透明で薄い黄色〜緑色の溶液が得られた。氷水浴中で溶液を0℃に冷却し、3mLの無水EtOAc中のペンタフルオロフェノール(2098.8mg、11.4mmol)を滴下添加した。0℃で、5分間、溶液を撹拌した。シリンジによってゆっくりと7mLの無水EtOAc中のDCC(2348.0mg、11.4mmol)を滴下添加した。0℃で、5分間、溶液を撹拌し、その後、水浴から除去し、20℃に温めた。2時間、反応物を撹拌し、0℃に冷却し、濾過し、透明で薄い黄色〜緑色の溶液が得られた。溶液を50mLのEtOAcで希釈し、2x25mLのH2O、1x25mLの5MのNaClで洗浄し、Na2SO4上で乾燥させた。溶液を濾過し、蒸発させ、高真空下で、乾燥させ、緑色〜白色固体として、6552.5mg(97%)の化合物5が得られた。
1H NMR (400 MHz, CDCl
3) δ 780 (d, J = 7.2 Hz, 2H), 7.58 (m, 3H), 7.45−7.22 (m, 6H), 7.14 (dd(appt. t), J = 7.4 Hz, 1H), 6.42 & 6.10 (2 br s, 1H), 4.74 (dd(appt. t), J = 5.4 Hz, 2H), 3.65−3.18 (br, 3H), 3.08 & 2.65 (2 br s, 3H), 2.88 (s, 3H).
(9H−フルオレン−9−イル)メチル1,2−ジメチルヒドラジン−1−カルボキシレート(14)
MeNHNHMe・2HCl,化合物16、(5.0g、37.6mmol)をMeCN(80mL)中に溶解した。Et3N(22mL、158mmol)を添加し、濾過によって形成された沈殿物を除去した。MeNHNHMeの残りの溶液に、2.5時間以上、−20℃で、FmocCl(0.49g、18.9mmol、0.5当量)の溶液を滴下添加した。その後、反応混合物をEtOAcで希釈し、H2O、ブラインで洗浄し、Na2SO4上で乾燥させ、in vacuoで濃縮した。シリカ(ヘキサン/EtOAc=3:2)上でフラッシュクロマトグラフィーによって残留物を精製し、3.6g(34%)の化合物14が得られた。
1H NMR (400 MHz, CDCl
3) δ7.75−7.37 (m, 8H), 4.48 (br s, 2H), 4.27 (t, J = 6.0 Hz, 1H), 3.05 (s, 3H), 2.55 (br s, 3H).
マイタンシノール3−(2S,15R)−19−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−15−(2−(t−ブトキシカルボニル)エチル)−2,3−ジメチル−4,14,17−トリオキソ−7,10−ジオキサ−3,13,16−トリアザノナデカノエート(18)
HATU(0.277g、0.729mmol)を添加しながら、室温で、3.0mLのDMF中のマイタンシノール3−(S)−α−N−メチルアミノプロピオネート(化合物17)(0.426g、0.655mmol)、カルボン酸6(0.597g、0.721mmol)、及び(i−Pr)2NEt(0.35mL、2.00mmol)の溶液を撹拌した。2.5時間、反応混合物を撹拌し、ロータリー蒸発によって濃縮した。0〜10%MeOH−CH2Cl2勾配を用いて、シリカゲル上でフラッシュクロマトグラフィーによって生成物を分離した。生成物を含有するフラクションを混合し、濃縮し、0〜100%CH3CN−H2O勾配を用いて、C18上で再度、フラッシュクロマトグラフィーにかけ、白色固体として0.721g(75%)のマイタンシノイド18が生成された。
C75H95ClN8O17[M+Na]+のMS(ESI)計算値:1458.7;実測値:1481.8.
マイタンシノール3−(2S,15R)−19−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−15−(2−(カルボキシ)エチル)−2,3−ジメチル−4,14,17−トリオキソ−7,10−ジオキサ−3,13,16−トリアザノナデカノエート(19)
CH2Cl2(0.378mL、0.378mmol)中のSnCl4の1.0M溶液を滴下添加しながら、0℃で、1.0mLの無水CH2Cl2中のマイタンシノイド18(110.5mg、0.08mmol)の溶液を撹拌した。黄色沈殿物が形成された。溶離液として0〜100%CH3CN−H20勾配を用いて、C18上でフラッシュクロマトグラフィーによって、さらにワークアップなしで、反応混合物を精製し、白色フィルムとして65.6mg(62%)のマイタンシノイド19が得られた。
C73H91ClN8O18[M−H]−のMS(ESI)計算値:1401.6 実測値1401.1.
マイタンシノール3−(2S,15R)−19−(2−(2−(1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−15−(2−(カルボキシ)エチル)−2,3−ジメチル−4,14,17−トリオキソ−7,10−ジオキサ−3,13,16−トリアザノナデカノエート(20)
マイタンシノイド19(64.5mg、0.05mmol)を添加しながら、室温で、453.6mLのDMA中のピペリジン(90.7μL、0.92mmol)の溶液を撹拌した。20分間、反応混合物を撹拌した。溶離液として0〜100%CH3CN−H20勾配を用いて、C18上でフラッシュクロマトグラフィーによって、さらにワークアップなしで、反応混合物を精製し、白色フィルムとして49.1mg(90%)のマイタンシノイド20が得られた。
C58H82ClN8O16[M+H]+のMS(ESI)計算値:1181.6 実測値1181.3.
結果及び考察
抗体タグ−配置ライブラリーの開発及び最初のスクリーニング
重鎖及び軽鎖不変領域内の露出した比較的非構造化部分を特定するために、ヒトIgG1結晶構造を調査した。最小に天然IgG構造を混乱させるが、共役に接触可能のままである位置にタグを挿入した。アルデヒドタグ配置のために8つの部位を選択した。一度、重鎖または軽鎖のいずれかに各タグを組み入れ、その結果、各抗体が、2つのアルデヒド基を含む。軽鎖中の1つの内部部位及び重鎖中の7つの部位を選択した:CH1中の3つ、CH2中の2つ、CH3中の1つ、及びC−末端の1つ(図2、上部)。N−末端からC−末端への順序に従って、アルファベット順にこれらの部位に名前を付けた(すなわち、タグA〜G)。軽鎖タグを「LC」と示した。プロトタイプヒトIgG1重鎖及びカッパ軽鎖の不変領域に選択されたタグ部位をクローンした。コンセンサス配列内でCysのFGlyへの有効な変換を確実にするために、ヒトFGEを過剰発現している細胞の大量プール中に過渡的にタンパク質を生成した。タンパク質Aを用いて、抗体を精製し、PBS中に保存した。
in silico分析によって免疫原性についてアルデヒド標識抗体を試験するために実験を実施した。公知のMHCクラスIIペプチド結合モチーフ(iTope(商標))及び事前に特定された免疫原性配列(TCED(商標))の両者を組み入れたソフトウエアを用いて、高及び中等度親和性を有する多くのMHCコンテクストで乱雑に結合する可能性があるペプチドを特定した。この分析に基づいて、免疫原性である可能性があるペプチドを生成するためにタグBを決定した。次に、タグ配置の抗体安定性への作用を扱うために、サイズ排除クロマトグラフィー(SEC)によって凝集を分析した。標識を付けられた抗体のうち6つが、凝集なし〜極めて凝集が少ないを示した(表2)。CH2及びCH3ドメイン中のタグD及びFを含有する2つの抗体が、それぞれ、有意な凝集を示した。
抗体トラスツズマブ及びサイトトキシンペイロードメイタンシンが含まれた部位特異的ADCを生成するために実験を実施した。LC、タグC、またはタグG位置にアルデヒドタグでトラスツズマブを発現させ、抗体ドメイン全体に分散した共役部位を示した。これらのタグ配置は、よい抗体力価を示し、凝集が少なく、容易に共役し、クロマトグラフ分析、ならびに生物物理学及び機能試験によって測定したとおり、挙動のよいADCを生成した。また、実験の対照薬として用いるために、従来のリジン化学によりSMCC−DMにトラスツズマブを共役することによって、ADC(αHER2−DM1)を生成した。
細胞傷害性ペイロードの安定したADCを生成したアルデヒド標識αHER2抗体上の3つの異なる位置への部位特異的共役
ヒトホルミルグリシン−生成酵素(FGE)を過剰発現する細胞の大量プール中に、軽鎖(LC)、CH1ドメイン(タグC)のいずれか、または重鎖C−末端(CT、タグG)にアルデヒドタグを含有するように修飾されたトラスツズマブ抗体を生成した。LC、CH1、またはCTそれぞれで標識を付けられた抗体のために165、546、及び660mg/LのUTiterを入手した。CysからfGlyへの変換有効性に関して、質量分析法によって測定したとおり、LC、CH1、及びCTそれぞれでの86%、92%、及び98%変換を得た。37℃で、50mMクエン酸ナトリウム、0.85%DMA及び0.085%Triton X−100を含有する50mM NaCl pH5.5中のHIPS−Glu−PEG2−メイタンシンでfGly標識抗体を処置することによって共役反応を実施し、分析用疎水性相互作用クロマトグラフィー(HIC)によって反応の進行を追跡した。完了時に、タンジェント流ろ過によって過剰ペイロードを除去し、分取HICによって非共役抗体を除去した。これらの反応により、CH1及びCTタグ部位で、HIPSリンカーペイロードのfGlyへの>90%共役有効性を示し、LCタグ部位で、75%共役有効性を示した。最終生成物のHIC分析が、図3に示されている。コンジュゲートのSEC分析では、最小凝集を示した(図7)。SECによって、指示された位置で標識を付けられた非共役及びHIPS−Glu−PEG2−メイタンシン共役ADCを分析した。全凝集は、すべての場合で≦5%であった。
抗体構造へのタグ組込みの作用を評価するために、熱蛍光によってこれらの抗体の熱安定性を検討した。非標識配列ならびにLC、CH1、またはCT位置に標識を付けられた抗体を含む試験したαHER2抗体(範囲67.6〜68℃)の間では、Tm1(最も低く観察された熱転移)で検出可能な差はなかった(表3)。
CT標識抗体のHIPS−Glu−PEG2−メイタンシンとの共役では、Tm1で軽微な作用があり、非標識抗体と比べて1度だけ融解温度が減少した。次に、表面プラスモン共鳴分析によってタグ配置及びペイロード共役のFcRn結合への作用を測定した。FcRnが、抗体薬物動態学で重要な役割を演じる可能性があり、pH6.0での会合及びpH7.3での解離の両者が抗体の循環半減期と関係しており、後者の値は、前者より大きな影響を有する。両パラメーターを測定した(表4)。
対照には、非標識αHER2及びαHER2−DM1が含まれた。pH6.0でのFcRn KDでアルデヒドタグ配置またはペイロード共役の作用がみられなかった。逆に、pH7.3での解離は、5秒後に結合を残した抗体のパーセントで差を示した。トラスツズマブの抗体の保持が、最小量であり、アルデヒドタグの包含物が、わずかに保持を増加させたが、有意でなかった。抗体の共役が、pH7.3での解離に影響を及ぼし、アルデヒド標識ADCの受けた影響は、αHER2−DM1と比べて少なかった。後者のコンジュゲートの保持は、他の測定した全分析対象物質と有意な差があった。これらの傾向は、抗体へのアルデヒドタグの挿入が、FcRn結合を有意に調節せず、アルデヒド−媒介部位特異的ADC生成により、非特異的に共役されたαHER2−DM1と比べて、野生型抗体とほぼ同じであるFcRn解離特性を有するADCが生成されたことを示した。
さらにLC、CH1、及びCTタグの免疫原性プロファイルを検討するために、ex vivoヒトT−細胞アッセイ(EpiScreen(商標))を実施し、HLAアロタイプの世界母集団を表している50人の健康なドナーからの白血球とこれらの構成体の非共役バージョン及びADCバージョンの両者をインキュベートした。増殖及びIL−2サイトカイン分泌を評価することによって、T−細胞反応を測定した。この機能的測定によると、LC−、CH1−、及びCT−標識抗体の非共役バージョン及びADCバージョンは、免疫原性が低かった(表5)。分析対象物質は、陽性対照(比較的免疫原性であり、臨床的免疫原性データが利用できる単クローン性抗体のヒト化A33)によって誘発された試料では、22%で増殖したのと比べて、ドナー白血球の2〜10%だけでT−細胞増殖を誘発した。
異なる抗体主鎖であるが、同じ3つのタグ配置を用いた実験の平行セットでは、血しょう中で37℃で、アルデヒド標識HIPSコンジュゲートの安定性を試験した。発蛍光団(Alexa Fluor 488、AF488)またはサイトトキシンペイロード(メイタンシン)のいずれかに結合されたHIPS−Glu−PEG2リンカーを保持している抗体を試験した。リンカーへのペイロード結合の差(例えば、エステル対アリールアミド結合、図8A及び8Bを参照)がどれくらい安定性に影響を及ぼすかを測定するために実験を実施した。結果は、HIPS化学が、高く安定していることを示した。AF488コンジュゲートでは、タグ配置にかかわらず、12dで、37℃で、ラット血しょう中で、ペイロードシグナルの損失はみられなかった(図9A)。しかし、この安定性は、完全にメイタンシンコンジュゲートに移らず、経時的にペイロードシグナルのいくつかの損失を示した(図9B)。ペイロード損失の量は、タグ配置に応じて異なっていた、CT部位が、最も大きな安定性を示し、続いて、CH1及びLC部位が安定性を示した。AF488及びメイタンシンコンジュゲート間の安定性の差は、リンカーのPEG2部分にペイロードを結合する異なる結合に関係する可能性がある(図8A及び8B)。AF488は、安定したアリールアミド結合によってPEG2に結合され、一方、メイタンシンペイロードを結合したエステル結合は、高pHで化学的に不安定であった。したがって、3つのADCの安定性にみられた差は、3つの結合部位でpH作用を含む別々の局所環境を反映している可能性がある。
in vitro及びin vivoで、腫瘍標的に対して強力な活性を示したLC−、CH1−、及びCT−標識ADC
有効性を測定するために、in vitroで、HER2を過剰発現している細胞株、NCI−N87に対して、ADCを試験した。対照薬として遊離型メイタンシンを用いた。3つのαHER2 HIPS−Glu−PEG2−メイタンシンADCコンジュゲートの全てが、pM活性を示し、遊離型メイタンシンと同等であった(図10)。IC50測定値は、これらの分析対象物質の間で有意な差がなかった。逆に、イソタイプ対照CT標識コンジュゲートが、本質的に活性を示さなかった。
SCIDマウスのNCI−N87異種移植モデルを用いて、LC−、CH1−、及びCT−標識αHER2 ADCのin vivo有効性を評価した。陰性対照として、トラスツズマブだけ及びイソタイプ対照CT−標識HIPS−Glu−PEG2−メイタンシンADCを用い、対照薬としてαHER2−DM1(DAR3.4)が含まれた。試験の開始時に、単一5mg/kg用量として全化合物を投与した。トラスツズマブまたはイソタイプ対照ADCのいずれかで処置したマウスでは、腫瘍が、成長し続け、一方、単一用量のαHER2−標的ADCが、治療した動物で、約30日間で腫瘍成長を停止するのに十分であった(図11A)。腫瘍が、結局、再び成長し始めた場合、腫瘍サイズは、LC−またはCT−標識ADCで処置した動物と比べて、CH1−標識ADCまたはαHER2−DM1のいずれかで処置した動物の方が大きかった。この作用を調査するために、さまざまな治療により投与した腫瘍について、log
10細胞殺傷を測定した(表6)。結果は、CH1−標識ADCによる処置の方が、他のADCによる治療と比べて、腫瘍細胞の殺傷が少なかったを示した。CT−標識ADCが、最も高いlog
10細胞殺傷が得られ、最も有効なコンジュゲートであると思われた。この力価の増大は、CT−標識ADCで処置した動物に有意な生存優位性があると解釈された(図11B)。
別々の薬物動態学を示した抗体上の異なる位置にペイロードを保持しているADC
ADCのPKプロファイルを評価するために実験を実施した。マウスに、5mg/kgのLC−、CH1−、またはCT−標識ADC、または対照薬としてトラスツズマブもしくはαHER2−DM1を投与した。マウスから血しょうを採集し、総ADC及び総抗体濃度を定量するためにELISAによって分析した。総ADCを測定するために、分析対象物質を抗−ヒトFab−特異的抗体で捕捉し、抗−メイタンシン抗体で検出した。総抗体を測定するために、分析対象物質を抗−ヒトIgG−特異的抗体で捕捉し、抗−ヒトFc−特異的抗体で検出した。半減期を測定するために、非線形回帰によって、経時的に測定した濃度を2−コンパートメントモデルにフィットさせた(表7)。各アルデヒド標識ADCの総抗体半減期は、トラスツズマブと同じ、またはトラスツズマブより長く、アルデヒドタグ挿入及びHIPS共役が、抗体の塩基性PK特性を変化させなかったことを示している。逆に、αHER2−DM1コンジュゲートの総抗体半減期の方が有意に短く、非−特異的共役化学(過剰共役された種となる)が、PKに陰性作用があったことを示している。また、共役された抗体(総ADC)半減期を測定し、CT−標識ADCでは、担腫瘍マウスに最も大きな生存利益を与え、また、総ADC半減期が最長であったことを示した。αHER2−DM1、及びCH1−及びLC−標識ADCのコンジュゲート半減期の方が、CT−標識コンジュゲートより短かった。これらの数は、共役部位が、ADC半減期を制御するのに重要な役割を演じたことを示した。全ての場合で、アルデヒド標識コンジュゲートが循環中で安定しており、総ADCと総抗体濃度とのパーセント曲線下面積比が、76〜81%の範囲であった(図12)。αHER2−DM1コンジュゲートの比は、72%であった。
ADC構造−活性関係性マッピング
実験を実施し、細胞傷害性ペイロードの抗体重鎖及び軽鎖への部位特異的コンジュゲートに、HIPS化学で結合されたアルデヒドタグを用いることができることを示した。実験には、内部、ならびにN−またはC−末端部位での共役配置を変化させることが含まれ、SAR空間を検討すること及びADC構造を最適化することに関して柔軟性を許容した。このアプローチにより、PKが改善し、従来のコンジュゲートと比べて薬剤負荷の低下による同等の有効性、または向上した有効性を有するADCを生成した。アルデヒド標識ADCは、また、PK実験で試験した総ADCと総抗体濃度との高い曲線下面積比によって示したとおり、in vivoで非常に安定していた。この観察された安定性は、HIPS化学によるものと思われ、抗体及びペイロード間のC−C結合が得られた。
別々の抗体ドメイン中に共役部位を有する3つのアルデヒド標識ADCを試験し、CT−標識ADCの方が、CH1−及びLC−標識ADCと比べて、PK及びin vivo有効性が優れていることが観察された。3つのタグ位置で観察されたADC安定性の差は、リンカー/ペイロードを抗体に結合するHIPS化学ではなく、PEG2リンカーにメイタンシンを結合するエステル結合の作用による可能性がある。エステル結合は、高pHで開裂しやすい可能性がある;そのため、LC、CH1、及びCT位置で共役されたメイタンシンの安定性の差は、これらの部位の局所pH作用の変化を反映している可能性がある。例えば、1)安定したアリールアミド結合によってPEG2に結合されたAF488コンジュゲートが、タグ配置にかかわらず、in vitro安定性アッセイで、ペイロードの損失がないことを示したこと;及び2)最も安定した共役部位、CTタグが、最も露出した溶媒であると予測され、このため、これは、局所タンパク質の影響を受けたpH作用より、周囲溶媒のpHを受けやすいと思われることが、観察された。
実施例2
リンカー部分で変化させた抗HER2 ADCを生成した。メイタンシンペイロードへのヒドラジニル−イソ−ピクテ−スペングラー(HIPS)リゲーションを用いて、共役されたアルデヒド標識抗HER2タンパク質を用いて、ADCを生成した。得られたADCは、均質であり、疎水性相互作用クロマトグラフィー(HIC)によって評価したとおり、明確な薬物抗体比(DAR)がみられた。リンカーデザインの差が、単一及び複数用量の有効性異種移植試験で、これらのコンジュゲートの有効性に影響を及ぼした。
化学修飾のため、タンパク質を部位特異的に機能化させるためにアルデヒドタグを用いた。遺伝子的にコードされたタグには、ホルミルグリシン−生成酵素(FGE)によって特異的に認識されたペンタペプチド配列(CXPXR)が含まれた。細胞中のタンパク質発現の間、配列中のシステイン残基が、FGEによって認識され、翻訳と共役してホルミルグリシンに酸化された。リゲーションのための原生物化学的ハンドルとして、得られたアルデヒドを用いた。2−((1、2−ジメチルヒドラジニル)メチル)−1H−インドール末端のリンカーが、イソ−ピクテ−スペングラー反応によってアルデヒドと反応し、アザカルボリンを形成し、抗体及びペイロードを結合する安定したC−C結合が得られた。
メイタンシンを含有する薬剤−リンカー構成体の構造
一般的合成スキーム
リンカー組成物を変化させる作用を検討するために、アルデヒド標識αHER2抗体のC−末端に共有結合した5つの異なるメイタンシンコンジュゲートを調製した。ADCは、前記の化合物101〜105の構造に示したとおり、そのリンカー組成物に関して変化した。溶解度を助ける官能基が含まれた。リンカー構成体101、102、103、及び104が、PEG2スペーサーを含有し、リンカー105にC3スペーサーを用いた。リンカーは、反応性2−((1,2−ジメチルヒドラジニル)メチル)インドール(HIPS)(101,102,103,及び105)または2−((1,2−ジメチルヒドラジニル)メチル)ピロロ[2,3−b]ピリジン(AzaHIPS)(104)のいずれかの末端にあった。リンカーには、陰性荷電側鎖または中性側鎖のいずれかを有するアミノ酸が含まれた。リンカーの代表的な合成が、前記の一般的合成スキーム、スキーム6に示されている。当該例では、リンカー101を示し、ペンタフルオロフェニルエステル109にペグ化され保護されたアミノ酸を結合した。その後、HATUを用いて、N−デアセチルメイタンシンに生成物、110、を結合し、続いて、tert−ブチルエステルを加水分解し、ピペリジンでFmoc−保護基を除去した。
37℃で、50mMクエン酸ナトリウム、0.85%DMA及び0.085%Triton X−100を含有する50mM NaCl pH5.5中の8〜10等量のリンカー−メイタンシンで抗体を処置することによって、薬剤/リンカーのC−末端標識αHER2抗体への共役を実施し、分析用疎水性相互作用クロマトグラフィー(HIC)によって反応の進行を観察した。完了時に、タンジェント流ろ過によって過剰ペイロードを除去し、分取HICによって非共役抗体を除去した。これらの反応では、>90%共役有効性であった。精製後,ADCは、疎水性相互作用クロマトグラフィーによって測定したとおり、平均薬物抗体比(DAR)1.7を含有した(データは示していない)。調製物は、サイズ排除クロマトグラフィーによって評価したとおり、≧95%モノマーであった(データは示していない)。
抗−ペイロードと抗−Fcシグナルとの比を比較するELISAベースの方法を用いることによって、14日間、37℃で、血しょう中のHIPS−連結ADCの安定性を測定した。群として、コンジュゲートが、高程度の安定性を示し、差はわずかにすぎなかった(表8を参照)。HER2を過剰発現している細胞株、NCI−N87に対して、ADCのin vitro細胞傷害性を試験した。全ADCに、ピコモル活性があり(図13)、IC50値が、遊離型メイタンシンで処置後に観察された値とほぼ同じ、または、この値より優れていた。
6日間アッセイで、in vitro細胞傷害性の標的として、HER2を過剰発現するNCI−N87細胞を用いた。陽性対照として、遊離型メイタンシンが含まれ、特異性を示すために陰性対照としてイソタイプ対照ADCを用いた。下記のとおり、IC50値(遊離型薬剤の場合を除いて抗体濃度を反映している)を測定した:遊離型メイタンシン、250pM;リンカー101、170pM;リンカー102、160pM;リンカー103、110pM;リンカー104、96pM;リンカー105、120pM;イソタイプ対照ADCは測定できなかった。図13を参照。
SCIDマウスのマウスNCI−N87異種移植モデルを用いて、ADCのin vivo有効性を評価した。試験の開始時に、単一5mg/kg用量として化合物を投与した。腫瘍成長が阻止され、いくつかの腫瘍では、αHER2 ADCによる処置後のサイズが減少したが(図14A)、イソタイプ対照ADCによる処置後のサイズは減少しなかった(リンカー101を用いて、共役された)。結局、腫瘍が、全動物で再成長し始め、処置に用いられたADCに応じて、いくつかの群では、他より早かった。投与後60〜70日まで、αHER2 ADCで処置した群間に平均腫瘍容積の差はなかった;特異的に、平均腫瘍容積が、第60日に249〜487の範囲であった(図14A)。さまざまな処置で投与された腫瘍のlog10細胞殺傷を測定した(表9)。結果は、リンカー101及び104に共役されたADCによる処置の方が、他のADCによる処置と比べて多くの腫瘍細胞を殺傷したことを示した。これらの2つのリンカーは、リゲーション中に形成されたアザカルボリン中の窒素基によって互いに異なっていた。この力価の増大の結果、リンカー101または104に共役されたADCで処置した動物に有意な生存優位性がみられた(図14B)。リンカー101及び104と比べて、リンカー105の有効性が低下し、それはグルタミン酸部分を共有していた。この一連のリンカーの結果は、この文脈では、C3スペーサーが含まれるとPEG2スペーサーと比べて力価が低下することを示した。異なるアミノ酸を組み入れた他の2つのリンカーでは、有効性が変化していた。リンカー102が、中間のlog10細胞殺傷値(試験全体を通じて殺傷された細胞を反映している)を示したが、試験の最初の10日に最も高いin vivo有効性があり、他の処置より腫瘍容積の減少が大きかった(図14A)。リンカー103が、in vivo有効性が最も低く、また、その結果、IC50値が110pMであってもin vitroで、NCI−N87標的細胞の不完全殺傷となった。全ADCが、優れた耐容性を示し、処置後40日までに、>15%の体重損失を示した動物はいなかった(図15)。第0日に、単一5mg/kgボーラスのADCをマウスに投与し、最初の5日間は毎日、その後は、2週間ごとに体重をモニターした(図15)。HIPS化学を用いて、リンカー−メイタンシンペイロードに共役された5mg/kgのαHER2 ADCでSCIDマウスを処置したが、体重に影響を及ぼさなかった。
NCI−N87細胞をCB.17 SCIDマウス(8/群)の尾の付け根にインプラントした。腫瘍が約113mm
3に達したとき,動物にリンカー101〜105に共役された単一5mg/kg用量のαHER2リンカー、またはリンカー101に共役された同用量のイソタイプ対照抗体を与えた。図14Aは、1週間に2回、モニターした腫瘍成長のグラフを示す。図14Bは、生存曲線のグラフを示し、試験したタグ配置間の有効性の差を示す。腫瘍が800mm
3に達した場合、または試験の第112日に、どちらが最初になっても、動物を安楽死させた。
複数用量の有効性試験に2つのリンカーを用いた。腫瘍成長、log10細胞殺傷、及び生存によって測定したとおり、その全力価のために、リンカー101を用いた。最も早い初期腫瘍減少を示したため、リンカー102を用い、複数用量セッティングで、有効性の増大という結果となった可能性がある。複数用量試験では、SCIDマウスのNCI−N87腫瘍を用いた。4週間、1週間に1回、動物に投与した(5mg/kg)。実験に2つの群を用い、腫瘍の平均容積が、180または400mm3のいずれかに達した場合、投与を開始した。リンカー101及び102の両者で生成されたαHER2 ADCが、より小さな腫瘍に対する活性が高く(図16A)、その結果、腫瘍対照とほぼ同じレベルであった。より大きな腫瘍に対しては、リンカー102で生成したαHER2 ADCの方が、大きな有効性を示し、その結果、リンカー101で生成したADCと比べて、腫瘍抑制のレベルが大きかった(図16B)。第42日に、処置した/対照の腫瘍容積が、リンカー101及び102でそれぞれ、0.39及び0.26であった。
前記に記載したとおり、異なるリンカーを保持するC−末端−共役αHER2 ADCのパネルが生成され、リンカー中の構造変化により、NCI−N87腫瘍モデルに対して、in vitro及びin vivoの両者で、ADC力価に有意な差が生じることが観察された。
実験方法
バイオコンジュゲーション、精製、及びHPLC分析
72時間、37℃で、50mMクエン酸ナトリウム、0.85%DMA及び0.085%Triton X−100を含有する50mM NaCl pH5.5中で、アルデヒド標識抗体(15mg/mL)をメイタンシンを含有する薬剤リンカー(薬剤と抗体が等量の8モル)に共役させた。タンジェント流ろ過を用いて、遊離型薬剤を除去した。移動相A:1.0M硫酸アンモニウム、25mMリン酸ナトリウムpH7.0、及び移動相B:25%イソプロパノール、18.75mMリン酸ナトリウムpH7.0で、分取スケール疎水性相互作用クロマトグラフィー(HIC;GE Healthcare 17−5195−01)を用いて、非共役抗体を除去した。非共役物質を溶離させるために33%Bの無勾配を用い、続いて、単共役及び二共役種を溶離させるために41〜95%Bの直線勾配を用いた。最終生成物のDARを測定するために、移動相A:1.5M硫酸アンモニウム、25mMリン酸ナトリウムpH7.0、及び移動相B:25%イソプロパノール、18.75mMリン酸ナトリウムpH7.0で、分析用HIC(Tosoh #14947)によってADCを検討した。凝集を測定するために、300mM NaCl、25mMリン酸ナトリウムpH6.8の移動相で、分析用サイズ排除クロマトグラフィー(SEC;Tosoh# 08541)を用いて、試料を分析した。
in vitro安定性
約1pmol(ペイロード)/mLで、ラット血しょうにADCを添加した。試料を採取し、使用するまで−80℃で、保存した。指示された時間、5%CO2下で、37℃で、アリコットを置き、その後、抗−メイタンシン及び抗−Fabシグナルを評価するためにELISAによって分析した。共役の参照開始値として新鮮解凍アリコットを用いた。時点間での比較が可能になるように1つのプレート上で、全分析対象物質をともに測定した。最初に、ブロッキングバッファー中で、分析対象物質を20ng/mL(アッセイのリニアレンジ内)に希釈した。その後、抗−ヒトFab−特定の抗体で被覆したプレート上で分析対象物質を捕捉した。次に、ペイロードを、抗−メイタンシン抗体で検出し、続いて、HRP−共役二次抗体で検出した;全抗体を、直接共役された抗−ヒトFc−特異的抗体で検出した。TMB基質で結合二次抗体を視覚化した。H2SO4で比色反応を停止させ、モレキュラーデバイスSpectraMax M5プレートリーダーを用いて、450nmで、吸光度を測定した。Excelでデータ分析を実施した。4連で、各試料を分析し、平均値を用いた。抗体共役の尺度として、抗−メイタンシンシグナルと抗−Fabシグナルとの比を用いた。
in vitro細胞傷害性
ATCCからHER2−陽性乳癌細胞株、NCI−N87を入手し、10%ウシ胎児血清(Invitrogen)及びGlutamax(Invitrogen)を補ったRPMI−1640培地(Cellgro)中に維持した。平板培養前の24時間、対数期成長を確実にするために細胞を通過させた。平板培養の日に、10IUペニシリン及び10μg/mLストレプトマイシンを補った90μL正常成長培地(Cellgro)中の96−ウェルプレート上に5000細胞/ウェルを播種した。10μLの希釈した分析対象物質と、さまざまな濃度で、細胞を処置し、37℃で、5%CO2の雰囲気中で、プレートをインキュベートした。6日後、100μL/ウェルの細胞Titer−Glo試薬(Promega)を添加し、モレキュラーデバイスSpectraMax M5プレートリーダーを用いて、発光を測定した。IC50計算を含むデータ分析のためにGraphPad Prismソフトウエアを用いた。
異種移植試験
50%Matrigel中の1x107NCI−N87腫瘍細胞をメスC.B−17 SCIDマウスの尾の付け根に接種した。腫瘍が、平均112mm3に達した場合、動物に単一5mg/kg用量のADC、トラスツズマブ抗体(標識を付けられていない)、またはビヒクルだけを与えた。1週間に2回、体重及び腫瘍サイズについて動物をモニターした。以下の式を用いて、腫瘍容積を計算した。
腫瘍容積(mm3)=(w2xl)/2
式中、w=腫瘍幅、及びl=腫瘍長
4つの群のマウスの腫瘍成長速度曲線を平均することによって腫瘍倍加時間を得た。その後、以下の式を用いて、log
10細胞殺傷を推定した。
log
10細胞殺傷=(治療群TTE−対照群TTE)/(3.32x腫瘍倍加時間)
合成方法
(S)−5−(3−(tert−ブトキシ)−3−オキソプロピル)−1−(9H−フルオレン−9−イル)−3,6−ジオキソ−2,10,13−トリオキサ−4,7−ジアザヘキサデカン−16−オイック酸(110)の調製
スターラーバーを含有する20mLガラスシンチレーションバイアルにアミン109(710.3mg、4.0mmol)、及びNa2CO3(637.9mg、6.0mmol)を添加した。水(10.0mL)を添加し、20℃で、5分間、溶液を撹拌し、透明で無色の溶液が得られた。分離20mLガラスシンチレーションバイアルにペンタフルオロフェニルエステル108(1185.7mg、2.0mmol)を添加し、10.0mLの1,4−ジオキサン中に溶解した。前記の調製した溶液に滴下添加され、透明で無色の溶液を得ているバイアルを1分間、ボルテックスさせ、白色沈殿物が得られた。20℃で、4時間、反応物を撹拌し、70mLの水に添加し、1MのHClの滴下添加によってpH3まで酸性にし、2x50mLのEtOAcで抽出し、Na2SO4上で乾燥させた。有機フラクションを濾過し、蒸発させ、溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって精製した。高真空下で、精製した生成物を乾燥させ、粘着性で吸湿性の白色固体として1137.3mg(97%)の化合物110が得られた。
(S)−7−アミノ−2,2−ジメチル−4,8−ジオキソ−3,12,15−トリオキサ−9−アザオクタデカン−18−オイック酸(111)の調製
化合物110(2638.7mg、4.513mmol)をDMF(8.92mL)中のピペリジン(2.23mL、22.57mmol)溶液(20%v/vピペリジン)中に溶解し、20℃で、1時間、撹拌した。白色沈殿物が形成された。反応物を濾過し、透明で淡黄色の溶液が得られた。溶液を蒸発させ、溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって精製した。高真空下で、分離した生成物を乾燥させ、透明で粘性の油として813.1mg(50%)の化合物111が得られた。
(S)−7−(3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパンアミド)−2,2−ジメチル−4,8−ジオキソ−3,12,15−トリオキサ−9−アザオクタデカン−18−オイック酸(113)の調製
乾燥させたスターラーバーを含有する乾燥させた20mLガラスシンチレーションバイアルに化合物111(582.4mg、1.607mmol)を添加した。無水DMF(5mL)及び(i−Pr)2NEt、(0.84mL、4.82mmol)を添加し、20℃で、5分間、溶液を撹拌し、透明で非常に淡黄色の溶液が得られた。少量ずつ、5分以上で、エステル112(1253.7mg、1.930mmol)を添加し、20℃で、2時間、反応物を撹拌した。溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって、さらにワークアップなしで、反応混合物を精製した。高真空下で、精製した生成物を乾燥させ、白色フィルムとして406.3mg(49%)の化合物113が得られた。
1H NMR (400 MHz, CDCl
3) δ 7.78 (d,J = 6.8 Hz, 2H), 7.62 (m, 2H), 7.54 (d, J = 7.6 Hz, 1H), 7.42 (m, 1H), 7.41 (dd (app. t), J = 7.4 Hz, 2H), 7.32 (m, 2H), 7.23 (m, 1H), 7.10 (dd (app. t), J = 7.4 Hz, 1H), 7.06 (m, 1H), 4.76 (m, 1H), 4.70−4.42 (m, 4H), 4.26 (m, 1H), 4.03 (m, 2H), 3.80 (m, 1H), 3.75 (m, 1H), 3.70−3.42 (m, 9H), 3.37(m, 1H), 2.81 (s, 3H), 2.70−2.48 (m, 5H), 2.25−1.80 (m, 4H), 1.42 (s, 9H).
2−(((tert−ブチルジメチルシリル)オキシ)メチル)−1H−インドール(115)
オーブン乾燥フラスコに、インドール−2−メタノール,114,(1.581g,10.74mmol),TBSCl(1.789g、11.87mmol)、及びイミダゾール(2.197g、32.27mmol)を装填し、この混合物をCH2Cl2(40mL、無水)中に懸濁させた。16時間後、オレンジ色残基に反応混合物を濃縮した。粗混合物をEt2O(50mL)中に溶かし、水性AcOH(5%v/v、3x50mL)及びブライン(25mL)で洗浄した。混合有機層をNa2SO4上で乾燥させ、濃縮し、さらに精製しないで用いられた結晶質固体として、2.789g(99%)の化合物115が得られた。
1H NMR (500 MHz, CDCl3) δ 8.29 (s, 1H), 7.57 (d, J = 7.7 Hz, 1H), 7.37 (dd, J = 8.1, 0.6 Hz, 1H), 7.19 − 7.14 (m, 1H), 7.12 − 7.07 (m, 1H), 6.32 (d, J = 1.0 Hz, 1H), 4.89 (s, 2H), 0.95 (s, 9H), 0.12 (s, 6H).13C NMR (101 MHz, CDCl3) δ 138.3, 136.0, 128.6, 121.7, 120.5, 119.8, 110.9, 99.0, 59.4, 26.1, 18.5, −5.2.C15H24NOSi[M+H]+のHRMS(ESI)計算値:262.1627;実測値:262.1625.
メチル3−(2−(((tert−ブチルジメチルシリル)オキシ)メチル)−1H−インドール−1−イル)プロパノエート(117)
CH3CN(25mL)中のインドール115(2.789g、10.67mmol)の溶液にメチルアクリレート、116、(4.80mL、53.3mmol)を添加し、続いて、1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン(800μL,5.35mmol)を添加し、得られた混合物を還流させた。18時間後、溶液を冷却し、シリカゲルクロマトグラフィー(9:1ヘキサン:EtOAc)によって精製されたオレンジ色油に濃縮し、無色油として3.543g(96%)の化合物117が生成された。
1H−NMR (400 MHz, CDCl3) δ 7.58 (d, J = 7.8 Hz, 1H), 7.34 (d, J = 8.2 Hz, 1H), 7.23 − 7.18 (m, 1H), 7.12 − 7.07(m, 1H), 6.38 (s, 1H), 4.84 (s, 2H), 4.54 − 4.49 (m, 2H), 2.89 − 2.84 (m, 2H), 0.91 (s, 9H), 0.10 (s, 6H).13C−NMR (101 MHz, CDCl3) δ 172.0, 138.5, 137.1, 127.7, 122.0, 121.0, 119.8, 109.3, 101.8, 58.2, 51.9, 39.5, 34.6, 26.0, 18.4, −5.2.C19H30NO3Si[M+H]+のHRMS(ESI)計算値:348.1995;実測値:348.1996.
メチル3−(2−(ヒドロキシメチル)−1H−インドール−1−イル)プロパノエート(118)
THF(20mL)中の化合物117(1.283g、3.692mmol)の溶液に、0℃で、THF(3.90mL、3.90mmol)中のテトラブチルアンモニウムフルオリドの1.0M溶液を添加した。15分後、Et2O(20mL)で反応混合物を希釈し、NaHCO3(飽和水溶性、3x20mL)で洗浄し、薄緑色油に濃縮した。シリカゲルクロマトグラフィー(2:1ヘキサン:EtOAc)によって油を精製し、白色結晶質固体として822mg(95%)の化合物118が生成された。
1H NMR (500 MHz, CDCl3) δ 7.60 (d, J = 7.8 Hz, 1H), 7.34 (dd, J = 8.2, 0.4 Hz, 1H), 7.27 − 7.23 (m, 1H), 7.16 − 7.11 (m, 1H), 6.44 (s, 1H), 4.77 (s, 2H), 4.49 (t, J = 7.3 Hz, 2H), 3.66 (s, 3H), 2.87 (t, J = 7.3 Hz, 2H), 2.64 (s, 1H).13C NMR (126 MHz, CDCl3) δ 172.3, 138.5, 137.0, 127.6, 122.2, 121.1, 119.9, 109.3, 102.3, 57.1, 52.0, 39.1, 34.3.C13H15NNaO3[M+Na]+のHRMS(ESI)計算値:256.0950;実測値:256.0946.
メチル3−(2−ホルミル−1H−インドール−1−イル)プロパノエート(119)
デス−マーチンペルヨージナン(5.195g、12.25mmol)をCH2Cl2(20mL)及びピリジン(2.70mL、33.5mmol)の混合物中に懸濁させた。5分後、CH2Cl2(10mL)中のメチル3−(2−(ヒドロキシメチル)−1H−インドール−1−イル)プロパノエート(化合物118;2.611g、11.19mmol)の溶液に得られた白色懸濁液を移し、赤茶色懸濁液が得られた。1時間後、チオ硫酸ナトリウム(10%水溶液、5mL)及びNaHCO3(飽和水溶液、5mL)で反応物をクエンチした。水性層をCH2Cl2(3x20mL)で抽出し;混合抽出物をNa2SO4上で乾燥させ、濾過し、茶色油に濃縮した。シリカゲルクロマトグラフィー(ヘキサン中の5〜50%EtOAc)による精製の結果、無色油として2.165g(84%)の化合物119が生成された。
1H NMR (400 MHz, CDCl3) δ 9.87 (s, 1H), 7.73 (dt, J = 8.1, 1.0 Hz, 1H), 7.51 (dd, J = 8.6, 0.9 Hz, 1H), 7.45 − 7.40 (m, 1H), 7.29 (d, J = 0.9 Hz, 1H), 7.18 (ddd, J = 8.0, 6.9, 1.0 Hz, 1H), 4.84 (t, J = 7.2 Hz, 2H), 3.62 (s, 3H), 2.83 (t, J = 7.2 Hz, 2H).13C NMR (101 MHz, CDCl3) δ 182.52, 171.75, 140.12, 135.10, 127.20, 126.39, 123.46, 121.18, 118.55, 110.62, 51.83, 40.56, 34.97.C13H13NO3Na[M+Na]+のHRMS(ESI)計算値:254.0793;実測値:254.0786.
3−(2−ホルミル−1H−インドール−1−イル)プロパンオイック酸(120)
ジオキサン(100mL)中に溶解したインドール119(2.369g、10.24mmol)の溶液に、LiOH(4M水溶液、7.68mL、30.73mmol)を添加した。濃白色沈殿物が、数時間の間に次第に形成された。21時間後、HCl(1M水溶液、30mL)を滴下添加し、pH=4の溶液が得られた。溶液を濃縮し、得られた薄茶色油をEtOAc(50mL)中に溶解し、水(2x50mL)及びブライン(20mL)で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、オレンジ色固体に濃縮した。シリカゲルクロマトグラフィー(0.1%酢酸とヘキサン中の10〜50%EtOAc)による精製の結果、淡黄色固体として1.994g(84%)の化合物120が生成された。
1H NMR (400 MHz, CDCl3) δ 9.89 (s, 1H), 7.76 (dt, J = 8.1, 0.9 Hz, 1H), 7.53 (dd, J = 8.6, 0.9 Hz, 1H), 7.48 − 7.43 (m, 1H), 7.33 (d, J = 0.8 Hz, 1H), 7.21 (ddd, J = 8.0, 6.9, 1.0 Hz, 1H), 4.85 (t, J = 7.2 Hz, 2H), 2.91 (t, J = 7.2 Hz, 2H).13C NMR (101 MHz, CDCl3) δ 182.65, 176.96, 140.12, 135.02, 127.33, 126.42, 123.53, 121.27, 118.76, 110.55, 40.19, 34.82.C12H10NO3[M−H]−のHRMS(ESI)計算値:216.0666;実測値:216.0665.
3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパンオイック酸(122)
1,2−ジクロロエタン(無水、25mL)中の120(1.193g、5.492mmol)及び(9H−フルオレン−9−イル)メチル1,2−ジメチルヒドラジンカルボキシレート、121、(2.147g、7.604mmol)の溶液に、ナトリウムトリアセトキシボロヒドリド(1.273g、6.006mmol)を添加した。2時間、得られた黄色懸濁液を撹拌し、その後、NaHCO3(飽和水溶液、10mL)でクエンチし、続いて、HCl(1M水溶液)を添加し、pH4にした。有機層を分離し、水性層をCH2Cl2(5x10mL)で抽出した。プールした有機抽出物をNa2SO4上で乾燥させ、濾過し、オレンジ色油に濃縮した。C18シリカゲルクロマトグラフィー(水中の20〜90%CH3CN)による精製の結果、蝋様ピンク色固体として1.656g(62%)の化合物122が生成された。
1H NMR (400 MHz, CDCl3) δ 7.76 (d, J = 7.4 Hz, 2H), 7.70 − 7.47 (br m, 3H), 7.42 − 7.16 (br m, 6H), 7.12 − 7.05 (m, 1H), 6.37 (s, 0.6H), 6.05 (s, 0.4H), 4.75 − 4.30 (br m, 4H), 4.23 (m, 1H), 4.10 (br s, 1H), 3.55 (br d, 1H), 3.11 − 2.69 (m, 5H), 2.57 (br s, 2H), 2.09 (br s, 1H).13C NMR (101 MHz, CDCl3) δ 174.90, 155.65, 143.81, 141.42, 136.98, 134.64, 127.75, 127.48, 127.12, 124.92, 122.00, 120.73, 120.01, 119.75, 109.19, 103.74, 67.33, 66.80, 51.39, 47.30, 39.58, 39.32, 35.23, 32.10.C29H30N3O4[M+H]+のHRMS(ESI)計算値:484.2236;実測値:484.2222.
(9H−フルオレン−9−イル)メチル1,2−ジメチル−2−((1−(3−オキソ−3−(ペルフルオロフェノキシ)プロピル)−1H−インドール−2−イル)メチル)ヒドラジン−1−カルボキシレート(112)
乾燥させたスターラーバーを含有する乾燥させた100mLの2首丸底フラスコに化合物122(5.006g、10.4mmol)を添加した。シリンジによって無水EtOAc、40mLを添加し、20℃で、5分間、溶液を撹拌し、透明で薄い黄色〜緑色の溶液が得られた。氷水浴中で溶液を0℃に冷却し、3mLの無水EtOAc中のペンタフルオロフェノール(2098.8mg、11.4mmol)を滴下添加した。0℃で、5分間、溶液を撹拌した。シリンジによってゆっくりと7mLの無水EtOAc中のDCC(2348.0mg、11.4mmol)を滴下添加した。0℃で、5分間、溶液を撹拌し、その後、水浴から除去し、20℃に温めた。2時間、反応物を撹拌し、0℃に冷却し、濾過し、透明で薄い黄色〜緑色の溶液が得られた。溶液を50mLのEtOAcで希釈し、2x25mLのH2O、1x25mLの5MのNaClで洗浄し、Na2SO4上で乾燥させた。溶液を濾過し、蒸発させ、高真空下で、乾燥させ、緑色〜白色固体として、6552.5mg(97%)の化合物112が得られた。
1H NMR (400 MHz, CDCl
3) δ 780 (d, J = 7.2 Hz, 2H), 7.58 (m, 3H), 7.45−7.22 (m, 6H), 7.14 (dd(appt. t), J = 7.4 Hz, 1H), 6.42 & 6.10 (2 br s, 1H), 4.74 (dd(appt. t), J = 5.4 Hz, 2H), 3.65−3.18 (br, 3H), 3.08 & 2.65 (2 br s, 3H), 2.88 (s, 3H).
(9H−フルオレン−9−イル)メチル1,2−ジメチルヒドラジン−1−カルボキシレート(121)
MeNHNHMe・2HCl,化合物123、(5.0g、37.6mmol)をMeCN(80mL)中に溶解した。Et3N(22mL、158mmol)を添加し、濾過によって形成された沈殿物を除去した。MeNHNHMeの残りの溶液に、2.5時間以上、−20℃で、FmocCl(0.49g、18.9mmol、0.5当量)の溶液を滴下添加した。その後、反応混合物をEtOAcで希釈し、H2O、ブラインで洗浄し、Na2SO4上で乾燥させ、in vacuoで濃縮した。シリカ(ヘキサン/EtOAc=3:2)上でフラッシュクロマトグラフィーによって残留物を精製し、3.6g(34%)の化合物121が得られた。
1H NMR (400 MHz, CDCl
3) δ7.75−7.37 (m, 8H), 4.48 (br s, 2H), 4.27 (t, J = 6.0 Hz, 1H), 3.05 (s, 3H), 2.55 (br s, 3H).
マイタンシノール3−(2S,15R)−19−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−15−(2−(t−ブトキシカルボニル)エチル)−2,3−ジメチル−4,14,17−トリオキソ−7,10−ジオキサ−3,13,16−トリアザノナデカノエート(125)
HATU(0.277g、0.729mmol)を添加しながら、室温で、3.0mLのDMF中のマイタンシノール3−(S)−α−N−メチルアミノプロピオネート(化合物124)(0.426g、0.655mmol)、カルボン酸113(0.597g、0.721mmol)、及び(i−Pr)2NEt(0.35mL、2.00mmol)の溶液を撹拌した。2.5時間、反応混合物を撹拌し、ロータリー蒸発によって濃縮した。0〜10%MeOH−CH2Cl2勾配を用いて、シリカゲル上でフラッシュクロマトグラフィーによって生成物を分離した。生成物を含有するフラクションを混合し、濃縮し、0〜100%CH3CN−H2O勾配を用いて、C18上で再度、フラッシュクロマトグラフィーにかけ、白色固体として0.721g(75%)のマイタンシノイド125が生成された。
C75H95ClN8O17[M+Na]+のMS(ESI)計算値:1458.7;実測値:1481.8.
マイタンシノール3−(2S,15R)−19−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−15−(2−(カルボキシ)エチル)−2,3−ジメチル−4,14,17−トリオキソ−7,10−ジオキサ−3,13,16−トリアザノナデカノエート(126)
CH2Cl2(0.378mL、0.378mmol)中のSnCl4の1.0M溶液を滴下添加しながら、0℃で、1.0mLの無水CH2Cl2中のマイタンシノイド125(110.5mg、0.08mmol)の溶液を撹拌した。黄色沈殿物が形成された。溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって、さらにワークアップなしで、反応混合物を精製し、白色フィルムとして65.6mg(62%)のマイタンシノイド126が得られた。
C73H91ClN8O18[M−H]−のMS(ESI)計算値:1401.6;実測値:1401.1.
マイタンシノール3−(2S,15R)−19−(2−(2−(1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−15−(2−(カルボキシ)エチル)−2,3−ジメチル−4,14,17−トリオキソ−7,10−ジオキサ−3,13,16−トリアザノナデカノエート(101)
マイタンシノイド126(64.5mg、0.05mmol)を添加しながら、室温で、453.6mLのDMA中のピペリジン(90.7μL、0.92mmol)の溶液を撹拌した。20分間、反応混合物を撹拌した。溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって、さらにワークアップなしで、反応混合物を精製し、白色フィルムとして49.1mg(90%)のリンカー101が得られた。
C
58H
82ClN
8O
16[M+H]
+のMS(ESI)計算値:1181.6実測値1181.3.
(2S,15S)−1−(((14S,16S,32S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−15−(3−(2−((1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパンアミド)−2,3−ジメチル−1,4,14−トリオキソ−7,10−ジオキサ−3,13−ジアザヘプタデカン−17−オイック酸(102)
0.7mL(7.09mmol)のピペリジンを添加しながら、室温で、3.0mLのDMF中の0.492g(0.35mmol)の化合物127の溶液を撹拌した。1時間、反応混合物を撹拌し、溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上で直接フラッシュクロマトグラフィーによって生成物を分離し、薄黄色固体として0.335g(81%)のリンカー102が得られた。
C
57H
79ClN
8O
16[M+H]
+のMS−ESI(m/z)計算値:1167.5;実測値:1167.0;[M+Na]
+:1189.5,実測値1189.0.
(14S,16S,32S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル(2S,15S)−19−(2−((1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−2,3−ジメチル−4,14,17−トリオキソ−15−(4−(ホスホノオキシ)ベンジル)−7,10−ジオキサ−3,13,16−トリアザノナデカノエート(103)
0.141g(0.1mmol)の化合物128を添加しながら、室温で、0.8mLのDMA中の0.2mL(2.0mmol)のピペリジンの溶液を撹拌した。20分間、反応混合物を撹拌し、溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上で直接フラッシュクロマトグラフィーによって生成物を分離し、白色フィルムとして0.108g(90%)のリンカー103が得られた。
C
62H
84ClN
8O
18P[M−H]
−のMS−ESI(m/z)計算値:1293.5;実測値:1293.1.
(+/−)−3−((2S,3R)−4−((2−(3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパンアミド)エチル)アミノ)−2,3−ビス((tert−ブチルジメチルシリル)オキシ)−4−オキソブタンアミド)プロパンオイック酸(130)の合成
室温で、1時間、5mLのDMA中の0.206g(0.3mmol)のインドール112、0.236g(0.5mmol)の化合物129、及び0.134g(1.6mmol)のNaHCO3の溶液を撹拌した。反応混合物を水に注入し、EtOAcで抽出した。有機層をブラインで洗浄し、Na2SO4上で乾燥させ、デカントした。ロータリー蒸発によって溶媒を除去し、0〜100%CH3CN−H2O勾配を用いて、C−18上で残基を精製し、白色固体として0.23gのカルボン酸130(76%)が得られた。
C
50H
72N
6O
9Si
2[M+H]
+のMS−ESI(m/z)計算値:957.5;実測値:957.0;[M+Na]+:979.5,実測値979.5.
(14S,16S,32S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル(2S,9R,10S)−18−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−9,10−ビス((tert−ブチルジメチルシリル)オキシ)−2,3−ジメチル−4,8,11,16−テトラオキソ−3,7,12,15−テトラアザオクタデカノエート(131)の合成
室温で、3時間、0.5mLのDMA中の0.129g(0.1mmol)のカルボン酸130及び0.096g(0.1mmol)のN−デアセチルメイタンシン124、0.052g(0.1mmol)のHATU、及び0.036mL(0.3mmol)のヒューニッヒ塩基の溶液を撹拌した。溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上で直接フラッシュクロマトグラフィーによって生成物を分離した。分離物の分析では、<90%の純度を示した。シリカゲル上で0〜10%MeOH−CH2Cl2勾配を用いて、材料を第2のフラッシュクロマトグラフィーにかけ、白色固体として0.103g(48%)の化合物131が得られた。
C
82H
114ClN
9O
17Si
2[M+Na]+のMS−ESI(m/z)計算値:1610.8,実測値1610.7.
(14S,16S,32S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル(2S,9R,10S)−18−(2−((1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)−9,10−ジヒドロキシ−2,3−ジメチル−4,8,11,16−テトラオキソ−3,7,12,15−テトラアザオクタデカノエート(106)
THF中の0.225mL(0.23mmol)の1.0MのTBAF溶液を添加しながら、0℃で、0.6mLのTHF中の0.102g(0.06mmol)の化合物131の溶液を撹拌した。35分後、溶離液として0〜75%CH3CN−H2O勾配を用いて、C18上で直接フラッシュクロマトグラフィーによって反応混合物を分離し、オフホワイトの固体として0.045g(60%)のリンカー106が得られた。
C
55H
76ClN
9O
15[M+H]
+のMS−ESI(m/z)計算値:1138.5;実測値:1138.3;[M+Na]+:1160.5,実測値1160.5.
(S)−5−((4−(((S)−1−(((14S,16S,32S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−1−オキソプロパン−2−イル)(メチル)アミノ)−4−オキソブチル)アミノ)−4−(3−(2−((1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパンアミド)−5−オキソペンタンオイック酸(105)
0.049g(0.04mmol)の化合物132を添加しながら、室温で、0.4mLのDMA中の0.1mL(1.0mmol)のピペリジンの溶液を撹拌した。20分間、反応混合物を撹拌し、溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上で直接フラッシュクロマトグラフィーによって生成物を分離し、白色フィルムとして0.040g(99%)のリンカー105が得られた。
C
55H
75ClN
8O
14[M+H]
+のMS−ESI(m/z)計算値:1107.5;実測値:1107.3;[M+Na]+:1129.5,実測値1129.4.
1−(tert−ブチル)2−エチル2−ヒドロキシ−2,3−ジヒドロ−1H−ピロロ[2,3−b]ピリジン−1,2−ジカルボキシレート(134)
マグネチックスターラーを備えた2Lの3つ首フラスコ中に、(3−メチル−ピリジン−2−イル)−カルバミン酸tert−ブチルエステル(化合物133;60g、288mmol、1.0当量)及びTHF(900mL)を入れ、窒素雰囲気下で維持した。−78℃以下の温度に維持しながら、t−BuLi(600mL、1.3M、777mmol、2.7当量)を滴下添加した。1時間、−45℃で、撹拌後、乾燥テトラヒドロフラン(50mL)中のジエチルオキサレート(126.5g、865mmol、3.0当量)の−80℃の温度で維持した溶液に、このために入手したリチウム化誘導体を添加した。2時間、反応培地を−50℃に温め、その後、室温に温め、一晩、撹拌した。水を添加し、混合物をEAで抽出し、Na2SO4上で乾燥させ、濃縮し、シリカ(PE/EA=40:1−2:1)上でフラッシュクロマトグラフィーによって精製し、黄色油として、化合物134(19.3g、22%)が生成された。
1H NMR (400 MHz, CDCl3) δ 8.24 (d, J = 4.4 Hz, 1H), 7.39 (d, J = 7.6 Hz, 1H), 6.87 (t, J = 6.0 Hz, 1H), 4.57 (br s, 1H), 4.25−4.23 (m, 2H), 3.35 (d, J = 17.2 Hz, 1H), 3.14 (d, J = 17.2 Hz, 1H), 1.49 (s, 9H), 1.23 (t, J = 6.8 Hz, 3H).
エチル1H−ピロロ[2,3−b]ピリジン−2−カルボキシレート(135)
50℃で、2時間、HCl(50mL、6N)の溶液中の化合物134(9.7g、31.4mmol、1当量)の混合物を撹拌し、室温で、一晩、撹拌した。固体K2CO3でpH13に反応混合物を調節し、EAで抽出した。有機相を硫酸ナトリウム上で乾燥させ、濾過し、減圧下で蒸発させ、化合物135(6.0g、100%)が得られた。
1H NMR (400 MHz, DMSO) δ 11.12 (br s, 1H), 8.59 (d, J = 4.8 Hz, 1H), 8.05 (dd, J = 8.0, 1.6 Hz, 1H), 7.19 (s, 1H), 7.18−7.15 (m, 1H), 4.46 (q, J = 6.8 Hz, 2H), 1.44 (t, J = 6.8 Hz, 3H).
(1H−ピロロ[2,3−b]ピリジン−2−イル)メタノール(136)
0℃で、N2下で、THF(200mL)中のエステル135(9g、47.3mmol、1.0当量)の溶液にLiAIH4(3.0g、78.9mmol、1.5当量)をゆっくりと添加し、1時間、室温に温めた。懸濁液を水でクエンチし、濾過によって白色沈殿物を除去した。濾液をNa2SO4上で乾燥させ、濃縮した。シリカ(PE/EA=9:1)上でフラッシュクロマトグラフィーによって残留物を精製し、わずかに黄色の固体として、化合物136(6.5g、93%)が得られた。
1H NMR (400 MHz, DMSO−d6) δ 11.47 (s, 1H), 8.10 (dd, J = 6.4, 1.2 Hz, 1H), 7.82 (d, J = 7.6 Hz, 1H), 6.97 (dd, J = 7.6, 4.8 Hz, 1H), 6.27 (s, 1H), 5.23 (t, J = 5.2 Hz, 1H), 4.57 (d, J = 5.6 Hz, 2H).
2−(((tert−ブチルジメチルシリル)オキシ)メチル)−1H−ピロロ[2,3−b]ピリジン(137)
オーブン乾燥フラスコに、化合物136(7.5g、50.6mmol、1.0当量)、TBSCl(8.4g、55.7mmol、1.1当量)、及びイミダゾール(10.3g、152.0mmol、3.0当量)を装填し、この混合物をCH2Cl2(100mL)中に懸濁させた。16時間後、オレンジ色残基に反応混合物を濃縮した。粗混合物をEt2O(50mL)中に溶かし、ブライン(25mL)で洗浄した。有機層を濃縮し、結晶質固体(化合物137;11.8g、89%)が得られ、さらに精製しないで用いた。
1H NMR (400 MHz, CDCl3) δ 9.56 (br s, 1H), 8.25 (s, 1H), 7.84 (d, J = 8.0 Hz, 1H), 7.04 (dd, J = 7.6, 4.4 Hz, 1H), 6.27 (s, 1H), 4.90 (s, 2H), 0.93 (s, 9H), 0.11 (s, 6H).
メチル3−(2−(((tert−ブチルジメチルシリル)オキシ)メチル)−1H−ピロロ[2,3−b]ピリジン−1−イル)プロパノエート(138)
アセトニトリル(120mL)中のアザインドール137(11.5g、43.9mmol、1.0当量)の溶液にメチルアクリレート(18.9g、220mmol、5.0当量)を添加し、続いて、1、8−ジアザビシクロ[5.4.0]−ウンデカ−7−エン(DBU、335μL、22mmol、0.50当量)を添加し、18時間、得られた混合物を還流させた。溶液を冷却し、オレンジ色油に濃縮し、シリカ(PE/EA=9:1)上でフラッシュクロマトグラフィーによって精製し、化合物138(15g、98%)として無色油が生成された。
1H NMR (400 MHz, CDCl3) δ 8.28 (d, J = 3.6 Hz, 1H), 7.83 (dd, J = 8.0, 0.8 Hz, 1H), 7.03 (dd, J = 7.6, 4.8 Hz, 1H), 6.33 (s, 1H), 4.87 (s, 2H), 4.62 (t, J = 7.2 Hz, 2H), 3.66 (s, 3H), 2.98 (t, J = 7.2 Hz, 2H), 0.91 (s, 9H), 0.10 (s, 6H).
メチル3−(2−(ヒドロキシメチル)−1H−ピロロ[2,3−b]ピリジン−1−イル)プロパノエート(139)
0℃で、THF(150mL)中の化合物138(15g、43.1mmol、1.0当量)の溶液に、テトラブチルアンモニウムフルオリド(THF中の1.0M、45.6mL、45.6mmol、1.06当量)を添加した。15分後、反応混合物をジエチルエーテル(100mL)で希釈し、水性NaHCO3で洗浄し、油残留物に濃縮し、シリカ(PE/EA=4:1)上でフラッシュカラムクロマトグラフィーによって精製し、白色固体(8g、80%)として化合物139が生成された。
LC−MS:235(M+1).1H NMR (400 MHz, CDCl3) δ 8.28 (dd, J = 4.8,1.6 Hz, 1H), 7.84 (dd, J = 8.0, 1.2 Hz, 1H), 7.05 (dd, J = 7.8, 4.4 Hz, 1H), 6.40 (s, 1H), 4.85 (s, 2H), 4.61 (t, J = 6.8 Hz, 2H), 3.63 (s, 3H), 3.10 (t, J = 6.8 Hz, 2H), 3.03 (br s, 1H).
メチル3−(2−ホルミル−1H−ピロロ[2,3−b]ピリジン−1−イル)プロパノエート(140)
20mLのCH2Cl2中の1.171g(5.0mmol)の化合物139の溶液を滴下添加しながら、室温で、40mLのCH2Cl2中の2.335g(5.5mmol)のデス−マーチンペルヨージナン及び1.21mL(15.0mmol)のピリジンの溶液を撹拌した。1時間、反応混合物を撹拌し、Na2S2O3の20mLの10%水溶液及びNaHCO3の20mLの1.2M水溶液の混合物でクエンチした。層を分離し、水性層をCH2Cl2で抽出した。有機層を混合し、Na2SO4上で乾燥させ、濾過した。ロータリー蒸発によって溶媒を除去し、溶離液として30%EtOAc−ヘキサンを用いて、シリカゲル上でフラッシュクロマトグラフィーによって生成物を分離し、薄黄色の油として1.005g(87%)の化合物140が得られた。
(9H−フルオレン−9−イル)メチル2−((1−(3−メトキシ−3−オキソプロピル)−1H−ピロロ[2,3−b]ピリジン−2−イル)メチル)−1,2−ジメチルヒドラジン−1−カルボキシレート(141)
室温で、3.0mLのDCE中の0.129g(0.56mmol)のアルデヒド140の溶液に0.228g(0.81mmol)のヒドラジン121を添加し、続いて、0.129g(0.60mmol)のNaB(OAc)3Hを少量ずつ添加した。24時間、反応混合物を撹拌し、10mLのH2Oの添加によりクエンチした。混合物をCH2Cl2で抽出した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮した。溶離液として0〜100%CH3CN:H2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって生成物を分離し、0.197g(73%)の化合物141が得られた。
3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−ピロロ[2,3−b]ピリジン−1−イル)プロパンオイック酸(142)
LiOHの0.51mLの1.0M水溶液を滴下添加しながら、0℃で、1.54mLのTHF中の269.7mg(0.50mmol)の化合物141の溶液を撹拌した。1時間、反応混合物を撹拌し、溶離液として0〜100%CH
3CN:H
2O勾配を用いて、C18上で直接クロマトグラフィーによって生成物を分離し、白色フィルムとして124.5mg(50%)の化合物142が得られた。
18−(tert−ブチル)1−((1
4S,1
6S,3
2R,3
3R,2R,4S,10E,12E,14R)−8
6−クロロ−1
4−ヒドロキシ−8
5,14−ジメトキシ−3
3,2,7,10−テトラメチル−1
2,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)(2S,15S)−15−(3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−ピロロ[2,3−b]ピリジン−1−イル)プロパンアミド)−2,3−ジメチル−4,14−ジオキソ−7,10−ジオキサ−3,13−ジアザオクタデカンジオエート(144)
0.2mLの無水DMF中の64.1mg(0.06mmol)の化合物143の溶液を滴下添加しながら、室温で、0.3mLの無水DMF中の69.4mg(1.3mmol)のPyAOP及び0.65mL(3.7mmol)のジイソプロピルエチルアミンの溶液を撹拌した。2時間後、溶離液として0〜100%CH
3CN:H
20勾配を用いて、C18上で直接クロマトグラフィーによって生成物を分離し、白色フィルムとして133.2mg(74%)の化合物144が得られた。
(2S,15S)−15−(3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−ピロロ[2,3−b]ピリジン−1−イル)プロパンアミド)−1−(((1
4S,1
6S,3
3S,2R,4S,10E,12E,14R)−8
6−クロロ−1
4−ヒドロキシ−8
5,14−ジメトキシ−3
3,2,7,10−テトラメチル−1
2,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−2,3−ジメチル−1,4,14−トリオキソ−7,10−ジオキサ−3,13−ジアザオクタデカン−18−オイック酸(146)
CH
2Cl
2中のSnCl
4の0.456mL(0.46mmol)の1.0M溶液を滴下添加しながら、0.133g(0.09mmol)の化合物145の溶液を1.0mLの無水CH
2Cl
2中に溶解し、0℃で、撹拌した。黄色沈殿物が形成された。N
2下で、1時間、反応混合物を撹拌した。溶離液として0〜100%CH
3CN:H
2O勾配を用いて、C18上で直接クロマトグラフィーによって生成物を分離し、白色固体として0.112g(87%)の化合物146が得られた。
(2S,15S)−1−(((14S,16S,32S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−15−(3−(2−((1,2−ジメチルヒドラジニル)メチル)−1H−ピロロ[2,3−b]ピリジン−1−イル)プロパンアミド)−2,3−ジメチル−1,4,14−トリオキソ−7,10−ジオキサ−3,13−ジアザオクタデカン−18−オイック酸(104)
0.048g(0.04mmol)の化合物147を添加しながら、室温で、0.4mLのDMA中の0.1mL(1.0mmol)のピペリジンの溶液を撹拌した。20分間、反応混合物を撹拌し、溶離液として0〜100%CH3CN−H2O勾配を用いて、C18上で直接フラッシュクロマトグラフィーによって生成物を分離し、白色フィルムとして0.034g(85%)のリンカー104が得られた。
C
57H
80ClN
9O
16[M+H]
+のMS−ESI(m/z)計算値:1182.6;実測値:1182.5;[M+Na]+:1204.5,実測値1204.5.
2−(tert−ブチルジメチルシリルオキシ)エタンアミン(149)
乾燥DCM(1L)中の2−アミノエタノール(50g、0.82モル)、トリエチルアミン(124g、1.23モル)、及びDMAP(2g)の撹拌溶液にTBSCl(135g、0.9016モル)を添加した。一晩、室温で、反応混合物を撹拌し、水性NH4Clでクエンチした。混合物をDCM(3x)で抽出した。混合有機層を水で洗浄し、MgSO4上で乾燥させた。減圧下で、溶媒を除去し残留物が得られ、フラッシュカラムクロマトグラフィーによって精製し、30.5g(22%)の化合物149が得られた。
1H NMR (400 MHz, CDCl3) δ 3.6 (t, J=5.5 Hz, 2H), 2.74 (t, J=5.5 Hz, 2H), 1.36 (brs, 1H), 0.87 (s, 9H), 0.04 (s, 6H).
ベンジル3−((2−((tert−ブチルジメチルシリル)オキシ)エチル)アミノ)プロパノエート(151)
0℃で、メタノール(25mL)及びTHF(25mL)中のリチウムクロリド(20mg)及び2−(tert−ブチルジメチルシリルオキシ)エタンアミン(1.0g、5.71mmol)の撹拌溶液に、10分間以上、アクリレート150(1.0g、6.28mmol)を滴下添加した。反応混合物を次第に室温に温め、室温で、一晩、撹拌した。減圧下で、反応混合物を濃縮し、乾燥状態にし、EtOAc(250mL)、及びブライン(200mL)で抽出した。有機層を無水硫酸ナトリウム上で乾燥させ、減圧下で蒸発させ、乾燥状態にした。フラッシュカラムクロマトグラフィー(pet.エーテル:EtOAc=5:1〜0:1)によって残留物を精製し、化合物151(0.7g、37%)が得られた。
ベンジル3−(2−ブロモ−N−(2−((tert−ブチルジメチルシリル)オキシ)エチル)アセトアミド)プロパノエート(153)
窒素下で、0℃で、THF(20mL)中の化合物151(0.7g、2.07mmol)の溶液に、Et3N(1.2当量、0.25g、2.49mmol)及びブロミド152(1.2当量、0.5g、2.49mmol)を添加した。0℃で、1時間、撹拌後、得られた混合物をEtOAc(10mL)で希釈し、濾過した。EtOAcで固体を洗浄し、濾液を濃縮し、in vacuoで乾燥させ、粗ブロモアセチルアミド153が生成され、フラッシュカラムクロマトグラフィー(石油エーテル:EtOAc=10:1〜5:1)によって精製し、純粋化合物153(0.3g、31%)が得られた。
MS+:459[M+H]+.
ベンジル10−(2−((tert−ブチルジメチルシリル)オキシ)エチル)−2,2,3,3−テトラメチル−9−オキソ−4−オキサ−7,10−ジアザ−3−シラトリデカン−13−オエート(154)
0℃で、窒素下で、THF(350mL)中の化合物153(36.8g、80.3mmol、1.0当量)の溶液に、Et3N(16.3g、160.7mmol、2当量)及び2−(tert−ブチルジメチルシリルオキシ)エタンアミン(28.1g、160.7mmol、2当量)を添加した。室温で、一晩、撹拌後、得られた混合物をEtOAc(100mL)で希釈し、濾過した。EtOAcで固体を洗浄し、濾液を濃縮し、in vacuoで乾燥させ、粗アミンが生成され、フラッシュカラムクロマトグラフィー(pet.エーテル:EtOAc=3:1)によって精製し、化合物154(27g、60%)が得られた。
ベンジル7−(((ベンジルオキシ)カルボニル)グリシル)−10−(2−((tert−ブチルジメチルシリル)オキシ)エチル)−2,2,3,3−テトラメチル−9−オキソ−4−オキサ−7,10−ジアザ−3−シラトリデカン−13−オエート(156)
0℃で、DCM(20mL)中のCbz−グリシン(2.5g、12mmol)及びEDCI(2.5g、13mmol)HOBT(1.75g、13mmol)の溶液に、iPr2NEt(4.2g、32.5mmol)を添加した。0℃で、30分間、混合物を撹拌した。溶液にアミン154(6g、11mmol)を滴下添加した。室温で、一晩、混合物を撹拌し、蒸発させ、乾燥状態にし、DCM中に懸濁させた。混合物を濾過し、濾液を水及びブラインで洗浄し、硫酸ナトリウム上で乾燥させ、濃縮した。フラッシュカラムクロマトグラフィーによって残留物を精製し、化合物156(3.01g、38%)が得られた。
10−(2−((tert−ブチルジメチルシリル)オキシ)エチル)−7−グリシル−2,2,3,3−テトラメチル−9−オキソ−4−オキサ−7,10−ジアザ−3−シラトリデカン−13−オイック酸(157)
H2(50psi)下で、室温で、一晩、Parrシェーカー中で、EtOAc(50mL)中の化合物156(1.9g、2.55mmol)及びPd/C(500mg)の混合物を撹拌した。Celiteのパッドを介して混合物を濾過し、濃縮し、化合物157(730mg、55%)が得られた。
7−((3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパノイル)グリシル)−10−(2−((tert−ブチルジメチルシリル)オキシ)エチル)−2,2,3,3−テトラメチル−9−オキソ−4−オキサ−7,10−ジアザ−3−シラトリデカン−13−オイック酸(158)の合成
0.120g(1.4mmol)のNaHCO3を添加しながら、室温で、5.0mLのDMA中の0.220g(0.3mmol)のインドール112及び0.264g(0.5mmol)のペプトイド157の溶液を撹拌した。6時間後、反応混合物を水で希釈し、EtOAcで抽出した。有機層をNa2SO4上で乾燥させ、デカントした。ロータリー蒸発によって溶媒を除去した。0〜100%CH3CN:H2O勾配を用いて、C18上でフラッシュクロマトグラフィーによって生成物を分離し、白色固体として0.184g(55%)のカルボン酸158が得られた。
1H NMR (400 MHz, CDCl
3) δ 7.80 (d, J = 6.8 Hz, 2H), 7.62 (m, 2H), 7.55 (d, J = 7.6 Hz, 1H), 7.41 (dd(app. t), J = 7.4 Hz, 2H), 7.30 (m, 4H), 7.22 (m, 1H), 7.10 (m, 1H), 4.72−4.30(m, 5H), 4.29−4.08 (m, 3H), 3.95−3.66 (m, 7H), 3.62−3.41 (m, 5H), 2.86 (m, 4H), 2.63 (m, 6H), 2.11(m, 1H), 0.90 (m, 18H), 0.60 (m, 12H).
(14S,16S,32S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル(S)−7−((3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパノイル)グリシル)−10−(2−((tert−ブチルジメチルシリル)オキシ)エチル)−2,2,3,3,14,15−ヘキサメチル−9,13−ジオキソ−4−オキサ−7,10,14−トリアザ−3−シラヘキサデカン−16−オエート(159)の合成
室温で、3時間、0.8mLのDMA中の0.180g(0.2mmol)カルボン酸158及び0.123gのN−デアシルメイタンシン124(0.2mmol)、0.072g(0.2mmol)のHATU、及び0.051mL(0.4mmol)のヒューニッヒ塩基の溶液を撹拌した。0〜100%CH3CN−H2O勾配を用いて、C18上で直接フラッシュクロマトグラフィーによって生成物を分離し、白色固体として0.235g(80%)の化合物159が得られた。
C
84H
118ClN
9O
17Si
2[M+Na]+のMS−ESI(m/z)計算値:1638.8,実測値1638.8.
(14S,16S,32S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イルN−(3−(2−(2−(3−(2−((1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパンアミド)−N−(2−ヒドロキシエチル)アセトアミド)−N−(2−ヒドロキシエチル)アセトアミド)プロパノイル)−N−メチル−L−アラニネート(107)の合成
10分間、0.5mLのTHF中の0.114g(0.07mmol)の化合物159の溶液を、窒素で分散させた。THF(0.30mL、0.3mmol)中の1.0M TBAFの溶液を添加し、1時間、反応混合物を撹拌した。0〜100%CH3CN−H2O勾配を用いて、C18上で直接クロマトグラフィーによって生成物を分離し、オフホワイトの固体として、0.0417g(51%)のリンカー107が得られた。
C57H80ClN9O15[M+H]+のMS−ESI(m/z)計算値:1166.6;実測値:1166.4;[M+Na]+:1188.5,実測値1188.4.
実施例3
以下に示したスキーム25に従って、ピペリジン−4−アミノ(4AP)基を含有するリンカーを合成した。
(9H−フルオレン−9−イル)メチル4−オキソピペリジン−1−カルボキシレート(200)の合成
マグネチックスターラーバーを含有する100mL丸底フラスコに、ピペリジン−4−オン塩酸塩一水和物(1.53g、10mmol)、Fmocクロリド(2.58g、10mmol)、炭酸ナトリウム(3.18g、30mmol)、ジオキサン(20mL)、及び水(2mL)を添加した。室温で、1時間、反応混合物を撹拌した。混合物をEtOAc(100mL)で希釈し、水(1x100mL)で抽出した。有機層をNa2SO4上で乾燥させ、濾過し、減圧下で、濃縮した。in vacuoで、得られた物質を乾燥させ、白色固体(3.05g、95%収率)として化合物200が生成された。
1H NMR (CDCl3) δ 7.78 (d, 2H, J = 7.6), 7.59 (d, 2H, J = 7.2), 7.43 (t, 2H, J = 7.2), 7.37 (t, 2H, J = 7.2), 4.60 (d, 2H, J = 6.0), 4.28 (t, 2H, J = 6.0), 3.72 (br, 2H), 3.63 (br, 2H), 2.39 (br, 2H), 2.28 (br, 2H).
C20H20NO3のMS(ESI)m/z:[M+H]+計算値322.4;実測値322.2.
(9H−フルオレン−9−イル)メチル4−((2−(2−(3−(tert−ブトキシ)−3−オキソプロポキシ)エトキシ)エチル)アミノ)ピペリジン−1−カルボキシレート(201)の合成
マグネチックスターラーバーを含有する乾燥させたシンチレーションバイアルに、ピペリジノン200(642mg、2.0mmol)、H2N−PEG2−CO2t−Bu(560mg、2.4mmol)、4Åモレキュラーシーブ(活性化粉末、500mg)、及び1,2−ジクロロエタン(5mL)を添加した。1時間、室温で、混合物を撹拌した。反応混合物に、ナトリウムトリアセトキシボロヒドリド(845mg、4.0mmol)を添加した。5日間、室温で、混合物を撹拌した。得られた混合物を、EtOAcで希釈した。有機層を飽和NaHCO3(1x50mL)、及びブライン(1x50mL)で洗浄し、Na2SO4上で乾燥させ、濾過し、減圧下で濃縮し、油として化合物201が生成され、さらに精製しないで持ち越された。
13−(1−(((9H−フルオレン−9−イル)メトキシ)カルボニル)ピペリジン−4−イル)−2,2−ジメチル−4,14−ジオキソ−3,7,10−トリオキサ−13−アザヘプタデカン−17−オイック酸(202)の合成
マグネチックスターラーバーを含有する乾燥させたシンチレーションバイアルに、前のステップからのN−Fmoc−ピペリジン−4−アミノ−PEG2−CO2t−Bu(201)、無水コハク酸(270mg、2.7mmol)、及びジクロロメタン(5mL)を添加した。18時間、室温で、混合物を撹拌した。反応混合物をEtOAc及び飽和NaHCO3に分割した。水性層をEtOAc(3x)で抽出した。HCl(1M)で、pH約3まで水性層を酸性にした。水性層をDCM(3x)で抽出した。混合有機層をNa2SO4上で乾燥させ、濾過し、減圧下で、濃縮した。反応混合物をC18フラッシュクロマトグラフィー(0.1%酢酸を含む溶離液10〜100%MeCN/水)によって精製した。減圧下で、生成物を含有するフラクションを濃縮し、その後、トルエン(3x50mL)と共沸し、残留酢酸を除去し、白色固体として、534mg(42%、2つのステップ)の化合物202が得られた。
1H NMR (DMSO−d6) δ 11.96 (br, 1H), 7.89 (d, 2H, J = 7.2), 7.63 (d, 2H, J = 7.2), 7.42 (t, 2H, J = 7.2), 7.34 (t, 2H, J = 7.2), 4.25−4.55 (m, 3H), 3.70−4.35 (m, 3H), 3.59 (t, 2H, J = 6.0), 3.39 (m, 5H), 3.35 (m, 3H), 3.21 (br, 1H), 2.79 (br, 2H), 2.57 (m, 2H), 2.42 (q, 4H, J = 6.0), 1.49 (br, 3H), 1.37 (s, 9H).
C35H47N2O9のMS(ESI)m/z:[M+H]+計算値639.3;実測値639.2.
(2S)−1−(((14S,16S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−2,3−ジメチル−1,4,7−トリオキソ−8−(ピペリジン−4−イル)−11,14−ジオキサ−3,8−ジアザヘプタデカン−17−オイック酸(203)の合成
2mLのDMF中のエステル202(227mg、0.356mmol)、ジイソプロピルエチルアミン(174μL、1.065mmol)、N−デアセチルメイタンシン124(231mg、0.355mmol)の溶液に、PyAOP(185mg、0.355mmol)を添加した。30分間、溶液を撹拌した。反応混合物にピペリジン(0.5mL)を添加し、さらに20分間、撹拌した。0〜100%アセトニトリル:水の勾配を用いて、C18逆相クロマトグラフィーによって粗反応混合物を精製し、203.2mg(55%、2つのステップ)の化合物203が得られた。
17−(tert−ブチル)1−((14S,16S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)(2S)−8−(1−(3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパノイル)ピペリジン−4−イル)−2,3−ジメチル−4,7−ジオキソ−11,14−ジオキサ−3,8−ジアザヘプタデカンジオエート(204)の合成
30分間、1mLのDMF中のピペリジン203(203.2mg、0.194mmol)、エステル5(126.5mg、0.194mmol)、2,4,6−トリメチルピリジン(77μL、0.582mmol)、HOAT(26.4mg、0.194mmol)の溶液を撹拌した。0〜100%アセトニトリル:0.1%ギ酸を含む水の勾配を用いて、C18逆相クロマトグラフィーによって粗反応物を精製し、280.5mg(97%収率)の化合物204が得られた。
C81H106ClN8O18のMS(ESI)m/z:[M+H]+計算値1513.7;実測値1514.0.
(2S)−8−(1−(3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパノイル)ピペリジン−4−イル)−1−(((14S,16S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−2,3−ジメチル−1,4,7−トリオキソ−11,14−ジオキサ−3,8−ジアザヘプタデカン−17−オイック酸(205)の合成
500μL無水DCM中の化合物204(108mg、0.0714mmol)の溶液に、DCM中の357μLの1Mの溶液SnCl4を添加した。1時間、異質混合物を撹拌し、その後、0〜100%アセトニトリル:0.1%ギ酸を含む水の勾配を用いて、C18逆相クロマトグラフィーによって精製し、78.4mg(75%収率)の化合物205が得られた。
C77H96ClN8O18のMS(ESI)m/z:[M−H]−計算値1455.7;実測値1455.9.
実施例4
以下に示したスキーム26に従って、ピペリジン−4−アミノ(4AP)基を含有するリンカーを合成した。
tert−ブチル4−オキソピペリジン−1−カルボキシレート(210)の合成
マグネチックスターラーバーを含有する100mL丸底フラスコに、ピペリジン−4−オン塩酸塩水和物(1.53g、10mmol)、ジ−tert−ブチルジカーボネート(2.39g、11mmol)、炭酸ナトリウム(1.22g、11.5mmol)、ジオキサン(10mL)、及び水(1mL)を添加した。室温で、1時間、反応混合物を撹拌した。混合物を水(100mL)で希釈し、EtOAc(3x100mL)で抽出した。ブラインで混合した有機層を洗浄し、Na2SO4上で乾燥させ、減圧下で濾過および濃縮した。in vacuoで、得られた物質を乾燥させ、白色固体として1.74g(87%)の化合物210が生成された。
1H NMR (CDCl3) δ 3.73 (t, 4H, J = 6.0), 2.46 (t, 4H, J = 6.0), 1.51 (s, 9H).
C10H18NO3のMS(ESI)m/z:[M+H]+計算値200.3;実測値200.2.
tert−ブチル4−((2−(2−(3−(tert−ブトキシ)−3−オキソプロポキシ)エトキシ)エチル)アミノ)ピペリジン−1−カルボキシレート(211)の合成
マグネチックスターラーバーを含有する乾燥させたシンチレーションバイアルに、tert−ブチル4−オキソピペリジン−1−カルボキシレート(399mg、2mmol)、H2N−PEG2−COOt−Bu(550mg、2.4mmol)、4Åモレキュラーシーブ(活性化粉末、200mg)、及び1,2−ジクロロエタン(5mL)を添加した。1時間、室温で、混合物を撹拌した。反応混合物に、ナトリウムトリアセトキシボロヒドリド(845mg、4mmol)を添加した。3日間、室温で、混合物を撹拌した。得られた混合物をEtOAc及び飽和水性NaHCO3に分割した。有機層をブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、減圧下で濃縮し、粘性油として850mgの化合物211が得られた。
C21H41N2O6のMS(ESI)m/z:[M+H]+計算値417.3;実測値417.2.
13−(1−(tert−ブトキシカルボニル)ピペリジン−4−イル)−2,2−ジメチル−4,14−ジオキソ−3,7,10−トリオキサ−13−アザヘプタデカン−17−オイック酸(212)の合成
マグネチックスターラーバーを含有する乾燥させたシンチレーションバイアルに、tert−ブチル4−((2−(2−(3−(tert−ブトキシ)−3−オキソプロポキシ)エトキシ)エチル)アミノ)ピペリジン−1−カルボキシレート211(220mg、0.5mmol)、無水コハク酸(55mg、0.55mmol)、4−(ジメチルアミノ)ピリジン(5mg、0.04mmol)、及びジクロロメタン(3mL)を添加した。24時間、室温で、混合物を撹拌した。フラッシュクロマトグラフィー(溶離液50〜100%EtOAc/ヘキサン)によって、反応混合物を部分的に精製し、透明油として117mgの化合物212が生成され、さらに特性付けしないで持ち越された。
C25H45N2O9のMS(ESI)m/z:[M+H]+計算値517.6;実測値517.5.
17−(tert−ブチル)1−((14S,16S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)(2S)−8−(1−(tert−ブトキシカルボニル)ピペリジン−4−イル)−2,3−ジメチル−4,7−ジオキソ−11,14−ジオキサ−3,8−ジアザヘプタデカンジオエート(213)の合成
マグネチックスターラーバーを含有する乾燥させたシンチレーションバイアルに、13−(1−(tert−ブトキシカルボニル)ピペリジン−4−イル)−2,2−ジメチル−4,14−ジオキソ−3,7,10−トリオキサ−13−アザヘプタデカン−17−オイック酸212(55mg、0.1mmol)、N−デアシルメイタンシン124(65mg、0.1mmol)、HATU(43mg、0.11mmol)、DMF(1mL)、及びジクロロメタン(0.5mL)を添加した。8時間、室温で、混合物を撹拌した。C18フラッシュクロマトグラフィー(溶離液5〜100%MeCN/水)によって、反応混合物を直接精製し、白色フィルムとして18mg(16%)の化合物213が得られた。
C57H87ClN5O17のMS(ESI)m/z:[M+H]+計算値1148.6;実測値1148.7.
(2S)−1−(((14S,16S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−2,3−ジメチル−1,4,7−トリオキソ−8−(ピペリジン−4−イル)−11,14−ジオキサ−3,8−ジアザヘプタデカン−17−オイック酸(214)の合成
マグネチックスターラーバーを含有する乾燥させたシンチレーションバイアルに、マイタンシノイド213(31mg、0.027mmol)及びジクロロメタン(1mL)を添加した。溶液を0℃に冷却し、スズ(IV)テトラクロリド(ジクロロメタン中の1.0M溶液、0.3mL、0.3mmol)を添加した。1時間、0℃で、反応混合物を撹拌した。C18フラッシュクロマトグラフィー(溶離液5〜100%MeCN/水)によって、反応混合物を直接精製し、白色固体(16mg、60%収率)として16mg(60%)の化合物214が生成された。
C48H71ClN5O15のMS(ESI)m/z:[M+H]+計算値992.5;実測値992.6.
(2S)−8−(1−(3−(2−((2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパノイル)ピペリジン−4−イル)−1−(((14S,16S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−2,3−ジメチル−1,4,7−トリオキソ−11,14−ジオキサ−3,8−ジアザヘプタデカン−17−オイック酸(215)の合成
マグネチックスターラーバーを含有する乾燥させたシンチレーションバイアルに、マイタンシノイド214(16mg、0.016mmol)、(9H−フルオレン−9−イル)メチル1,2−ジメチル−2−((1−(3−オキソ−3−(ペルフルオロフェノキシ)プロピル)−1H−インドール−2−イル)メチル)ヒドラジン−1−カルボキシレート(5)(13mg、0.02mmol)、DIPEA(8μL、0.05mmol)、及びDMF(1mL)を添加した。18時間、室温で溶液を撹拌した。C18フラッシュクロマトグラフィー(溶離液5〜100%MeCN/水)によって、反応混合物を直接精製し、白色固体として18mg(77%)の化合物215が生成された。
C77H98ClN8O18のMS(ESI)m/z:[M+H]+計算値1457.7;実測値1457.9.
(2S)−1−(((14S,16S,33S,2R,4S,10E,12E,14R)−86−クロロ−14−ヒドロキシ−85,14−ジメトキシ−33,2,7,10−テトラメチル−12,6−ジオキソ−7−アザ−1(6,4)−オキサジンアナ−3(2,3)−オキシラナ−8(1,3)−ベンゼナシクロテトラデカファン−10,12−ジエン−4−イル)オキシ)−8−(1−(3−(2−((1,2−ジメチルヒドラジニル)メチル)−1H−インドール−1−イル)プロパノイル)ピペリジン−4−イル)−2,3−ジメチル−1,4,7−トリオキソ−11,14−ジオキサ−3,8−ジアザヘプタデカン−17−オイック酸(216)の合成
マグネチックスターラーバーを含有する乾燥させたシンチレーションバイアルに、マイタンシノイド215(18mg、0.012mmol)、ピペリジン(20μL、0.02mmol)、及びDMF(1mL)を添加した。20分間、室温で溶液を撹拌した。C18フラッシュクロマトグラフィー(溶離液1〜60%MeCN/水)によって反応混合物を直接精製し、白色固体として、15mg(98%)の化合物216(本明細書では、HIPS−4AP−メイタンシンまたはHIPS−4−アミノ−ピペリジン−メイタンシンとも称される)が生成された。
C62H88ClN8O16のMS(ESI)m/z:[M+H]+計算値1235.6;実測値1236.0.
実施例5
バイオコンジュゲーション、精製、及びHPLC分析
方法:
72時間、37℃で、50mMクエン酸ナトリウム、0.85%DMAを含有する50mM NaCl pH5.5中で、C−末端アルデヒド標識αHER2抗体(15mg/mL)をHIPS−4AP−メイタンシン(実施例4を参照)(薬剤と抗体が等量の8モル)に共役させた。移動相A:1.0M硫酸アンモニウム、25mMリン酸ナトリウムpH7.0、及び移動相B:25%イソプロパノール、18.75mMリン酸ナトリウムpH7.0で、分取スケール疎水性相互作用クロマトグラフィー(HIC;GE Healthcare 17−5195−01)を用いて、非共役抗体を除去した。非共役物質を溶離させるために33%Bの無勾配を用い、続いて、単共役及び二共役種を溶離させるために41〜95%Bの直線勾配を用いた。最終生成物のDARを測定するために、移動相A:1.5M硫酸アンモニウム、25mMリン酸ナトリウムpH7.0、及び移動相B:25%イソプロパノール、18.75mMリン酸ナトリウムpH7.0で、分析用HIC(Tosoh#14947)によって、抗体−薬剤コンジュゲート(ADC)を検討した。凝集を測定するために、300mM NaCl、25mMリン酸ナトリウムpH6.8の移動相で、分析用サイズ排除クロマトグラフィー(SEC;Tosoh#08541)を用いて、試料を分析した。
結果:
重鎖C−末端(CT)にアルデヒドタグを含有するように修飾されたαHER2抗体を、前記に記載したとおり、HIPS−4APリンカーに結合されたメイタンシンペイロードに共役させた。完了時に、分取HICによって非共役抗体を除去し、タンジェント流ろ過によってバッファー交換中に残りの遊離型薬剤を除去した。これらの反応は、収率が高く、≧84%共役有効性及び>50%総収率であった。得られたADCの薬物抗体比(DAR)が、1.6〜1.9であり、モノマーが優位であった。図18〜21は、HIC及び逆相PLRPクロマトグラフィーによって測定したとおり、粗反応物及び精製したADCの例からのDARを示し、SECによって測定したとおり、モノマー結合性を示す。
図18は、HIPS−4APリンカー(実施例4を参照)に結合されたメイタンシンペイロードに共役された重鎖C−末端(CT)標識αHER2抗体の例の疎水性相互作用クロマトグラフィー(HIC)分析のグラフを示す。粗生成物薬物抗体比(DAR)を測定し、HICによって1.64であった。
図19は、HIPS−4APリンカー(実施例4を参照)に結合されたメイタンシンペイロードに共役された重鎖C−末端(CT)標識αHER2抗体の例の疎水性相互作用クロマトグラフィー(HIC)分析のグラフを示す。最終生成物薬物抗体比(DAR)を測定し、HICによって1.86であった。
図20は、HIPS−4APリンカー(実施例4を参照)に結合されたメイタンシンペイロードに共役された重鎖C−末端(CT)標識αHER2抗体の例のポリマー逆相(PLRP)クロマトグラフィー分析のグラフを示す。最終生成物薬物抗体比(DAR)を測定し、PLRPによって1.84であった。
図21は、HIPS−4APリンカー(実施例4を参照)に結合されたメイタンシンペイロードに共役された重鎖C−末端(CT)標識αHER2抗体の例の分析用サイズ排除クロマトグラフィー(SEC)分析のグラフを示す。分析用SECでは、最終生成物が、98.5%モノマーを示した。
in vitro安定性
方法:
40μg/mLで、ラット血しょうに、抗体−薬剤コンジュゲートを加えた。試料を採取し、使用するまで−80℃で、保存した。指示された時間、5%CO2下で、37℃で、アリコットを置き、その後、抗−メイタンシン及び抗−Fcシグナルを評価するためにELISAによって分析した。共役の参照開始値として新鮮解凍アリコットを用いた。アッセイ(20〜40ng/mL)のリニアレンジ内となるように、ブロッキングバッファー(カゼインバッファー、Thermo Fisher)中で、試料を希釈した。時点間での比較が可能になるように1つのプレート上で、全分析対象物質をともに測定した。上部4列上に抗−ヒトFab−特異的抗体(抗−メイタンシンリードアウトのため)で被覆し、下部4列上に抗−ヒトIgG−特異的抗体(抗−Fcリードアウトのため)で被覆したプレート上で、分析対象物質を捕捉した。その後、ペイロードを、抗−メイタンシン抗体(試験所内で生成され、確認された)で検出し、続いて、HRP−共役二次抗体で検出した;全抗体を、直接共役された抗−ヒトFc−特異的抗体で、検出した。Ultra TMB One−Step ELISA基質(Thermo Fisher)で、結合二次抗体を視覚化した。H2SO4で比色反応を停止させ、モレキュラーデバイスSpectraMax M5プレートリーダーを用いて、450nmで、吸光度を測定した。Excelでデータ分析を実施した。4連で、各試料を分析し、平均値を用いた。抗体共役の尺度として、抗−メイタンシンシグナルと抗−Fcシグナルとの比を用いた。
結果:
CTで、HIPS−4AP−メイタンシンに共役されたαHER2 ADCの安定性を試験した。7日間に、血しょう中で、37℃で、脱共役の証拠が観察されず、同じ条件下で14日後に、ペイロードの最小(5%)の損失だけが観察された(図22)。
in vitro細胞傷害性
方法:
ATCCからHER2−陽性胃癌細胞株、NCI−N87を入手し、10%ウシ胎児血清(Invitrogen)及びGlutamax(Invitrogen)を補ったRPMI−1640培地(Cellgro)中に維持した。平板培養前の24時間、対数期成長を確実にするために細胞を通過させた。平板培養の日に、10IUペニシリン及び10μg/mLストレプトマイシンを補った90μL正常成長培地(Cellgro)中の96−ウェルプレート上に5000細胞/ウェルを播種した。10μLの希釈した分析対象物質(HIPS−4AP−メイタンシン及びメイタンシンに共役されたαHER2 ADC)と、さまざまな濃度で、細胞を処理し、37℃で、5%CO2の雰囲気中で、プレートをインキュベートした。6日後、100μL/ウェルの細胞Titer−Glo試薬(Promega)を添加し、モレキュラーデバイスSpectraMax M5プレートリーダーを用いて、発光を測定した。データ分析のためにGraphPad Prismソフトウエアを用いた。
結果:
αHER2 CT HIPS−4AP−メイタンシンが、遊離型メイタンシンと比べて、in vitroで、NCI−N87細胞に対してきわめて強力な活性を示した(図23)。ADC及び遊離型薬剤それぞれのIC50濃度が、0.032及び0.35nMであった。
直接ELISA HER2抗原結合
方法:
PBS中の1μg/mLのヒトHER2−His(Sino Biological)で、一晩、4℃で、Maxisorp96−ウェルプレート(Nunc)を被覆した。カゼインバッファー(ThermoFisher)で、プレートをブロックし、その後、200ng/mLで開始する11−ステップ連続の2倍希釈液中で、αHER2野生型抗体及びADCを培養した。室温で、2時間、振り混ぜながら、プレートをインキュベートした。PBS 0.1% Tween−20中で洗浄後、ロバ抗−ヒトFc−γ−特異的ホースラディッシュペルオキシダーゼ(HRP)−共役二次抗体で、結合分析対象物質を検出した。Ultra TMB(Pierce)で、シグナルを視覚化し、2NH2SO4でクエンチした。モレキュラーデバイスSpectraMax M5プレートリーダーを用いて、450nmで、吸光度を測定し、GraphPad Prismを用いて、データを分析した。
結果:
図24に示したとおり、アルデヒドタグ配置またはHIPS−4AP−メイタンシン共役の作用が、抗原結合上に観察されなかった。野生型及び4AP共役抗体それぞれのこれらのデータから計算されたEC50濃度は、6.0及び5.3ng/mLであった。
異種移植試験
方法:
4.5x106NCI−N87腫瘍細胞をオスBALB/cヌードマウスの尾の付け根に接種した。腫瘍が平均269mm3に達したときに処置が開始され、その時、動物の静脈内にCT−標識αHER2 HIPS−4AP−メイタンシン(3または6mg/kg)またはCT−標識イソタイプ対照HIPS−4AP−メイタンシンコンジュゲート(6mg/kg)を投与した。4週間、1週間に1回、投与を進めた。1週間に2回、体重及び腫瘍サイズについて動物をモニターした。腫瘍が1500mm3に達したときに、動物を安楽死させた。
結果:
処置の18日後、αHER2 ADCが投与された動物の全腫瘍が、薬剤に反応した(図25)。6mg/kgで投与された動物で、成長の最も大きな減少が、観察され、腫瘍成長抑制比が25%(T/C)であった。イソタイプ対照ADCが投与された動物は、ビヒクルで処置された対照(95%T/C比)とほぼ同じ腫瘍成長を示した。
特定の実施形態を参照して本発明を記載すると同時に、本発明の趣旨及び範囲から逸脱することなく、さまざまな変更を実施してよく、均等物を置き換えることができると当業者は理解しなければならない。また、特定の状況、材料、物質の組成物、工程、工程ステップ(単数及び複数)が、本発明の目的、趣旨及び範囲に適合するように多くの変更を実施してよい。かかる全変更は、本明細書に添付したクレームの範囲内であることを意図する。