JP2017520520A - 非小細胞肺がんを治療するための抗b7−h1および抗ctla−4抗体 - Google Patents
非小細胞肺がんを治療するための抗b7−h1および抗ctla−4抗体 Download PDFInfo
- Publication number
- JP2017520520A JP2017520520A JP2016567088A JP2016567088A JP2017520520A JP 2017520520 A JP2017520520 A JP 2017520520A JP 2016567088 A JP2016567088 A JP 2016567088A JP 2016567088 A JP2016567088 A JP 2016567088A JP 2017520520 A JP2017520520 A JP 2017520520A
- Authority
- JP
- Japan
- Prior art keywords
- antigen
- binding fragment
- tremelimumab
- patient
- medi4736
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/58—Medicinal preparations containing antigens or antibodies raising an immune response against a target which is not the antigen used for immunisation
- A61K2039/585—Medicinal preparations containing antigens or antibodies raising an immune response against a target which is not the antigen used for immunisation wherein the target is cancer
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Oncology (AREA)
- Endocrinology (AREA)
- Biomedical Technology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Description
本願は、2014年5月13日に出願された米国仮特許出願第61/992,658号明細書、2015年1月21日に出願された米国仮特許出願第62/105,992号明細書、および2015年2月10日に出願された米国仮特許出願第62/114,336号明細書の優先権および利益を主張するものである。これら出願各々の内容全体は、参照により本明細書中に援用される。
(a)被験者
本試験における被験者は、18歳以上であり、かつ、固形癌効果判定基準(RECIST)ガイドラインv1.1(その全体が参照により本明細書に援用される)に従うと、少なくとも1つの測定可能な病変を伴う組織学的または細胞学的に確認された非小細胞肺がん(NSCLC;扁平上皮および非扁平上皮)を有することが求められる。
試験は、MEDI4736およびトレメリムマブの組み合わせに関する非盲検第1b相試験である(図1)。コホートにおける主要な試験基準を図11に示す。試験では、用量漸増段階および用量拡大段階において約36名の被験者を、また免疫療法を受けていないコホートおよび免疫療法で前治療されたコホートの各々において最低20名の被験者を登録することになる。最大耐容量(MTD)またはプロトコルで規定された最高用量(用量漸増段階中に免疫療法を受けていないコホートにおいて決定されたMTDを超えない場合で各薬剤に対する)は、用量漸増段階の一部としての免疫療法で前治療されたコホート内の登録された被験者における開始用量として役立つことになる。免疫療法で前治療されたコホートにおける用量探索は、免疫療法を受けていないコホートにおける用量拡大段階と並行して行うことになる。
免疫療法を受けていないコホート
試験の用量漸増段階では、MEDI4736およびトレメリムマブを、免疫療法を受けていない被験者3〜6名の連続コホートに最初に投与することになり、ここで各被験者は、トレメリムマブをQ4Wに6用量および12週毎(Q12W)に3用量受け(すなわち、トレメリムマブは用量6から4週目に用量7を投与し、用量7から12週目に用量8を投与する)、また13用量のMEDI4736を全部で1年間Q4WにIV注入を介して受ける(図2)。各コホートには、標準の3+3設計および改良されたゾーンに基づく設計に従い、最低で被験者3名を登録することになる。第1のコホート(コホート1)内の被験者は、用量が3mg/kgのMED4736および1mg/kgのトレメリムマブを受けることになる。第1の用量コホート内で≧2の用量制限毒性(DLT)が認められる場合、開始用量は図1のように漸減することになる。所与の用量コホートにおいてDLTを経験する被験者が6名から
である場合、用量漸増が継続することになる。
MTDまたはプロトコルで規定された最高用量(用量漸増段階中に免疫療法を受けていないコホートにおいて決定されたMTDを超えない場合での各薬剤に対する)(図1を参照)は、用量漸増段階の一部としての免疫療法で前治療されたコホート内に登録された被験者における開始用量として役立つことになる。3+3設計を用いる免疫療法で前治療されたコホートにおける用量探索は、免疫療法を受けていないコホートにおける用量拡大段階と並行して行うことになる。免疫療法で前治療されたコホートにおける用量拡大段階は、MTDまたはプロトコルで規定された最高用量(MTDを超えない場合での各薬剤に対する)が用量漸増段階中の免疫療法で前治療された被験者において決定されると、開始し得る。MTDを超えない中間ゾーンに基づく1つもしくは複数のコホートからの単回もしくは複数回の追加的用量は、用量拡大段階からの免疫療法で前治療されたコホートにおけるPKおよび薬力学、安全性および有効性パラメータの評価に基づき、用量拡大段階で評価することができる。
免疫療法を受けていないコホートおよび免疫療法で前治療されたコホートという2つの用量拡大コホートを用いることになる(図1を参照)。MTDまたはプロトコルで規定された最高用量(用量漸増段階中に同定されたMTDを超えない場合での各薬剤に対する)は、用量拡大段階での両コホートに対して用いることになる。さらに、MTDを超えない1つもしくは複数の中間ゾーンに基づくコホートからの単回もしくは複数回の用量は、安全性、PK、薬力学、バイオマーカー、および応答を含む新たな被験者データ、ならびに進行中の試験から提示されるデータに基づいて、用量拡大段階での免疫療法で前治療されたコホートおよび免疫療法を受けていないコホートにおける単回もしくは複数回の追加的用量として含めることができる。
被験者は、試験の用量漸増段階または用量拡大段階のいずれかで治療することになる。試験の用量漸増段階および用量拡大段階では、トレメリムマブは、4週毎(Q4W)に6用量、その後に12週毎(Q12W)に3用量投与することになり、ここで用量7は用量6の4週間後に投与され、用量8は用量7の12週間後に投与される。MEDI4736は、Q4Wに13用量投与することになる。両薬剤は、全部で1年間、IV注入を介して投与することになる(図2)。
血清中のMEDI4736およびトレメリムマブ濃度の測定は、有効な免疫測定法を用いて実施することになる。
標的病変の評価においては、完全寛解は、すべての標的病変の消失と定義する。任意の病理学的リンパ節(標的か非標的かを問わない)は、短軸が<10mmに減少している必要がある(標的リンパ節が存在する場合、合計が「0」でない場合がある)。
非標的病変の評価においては、完全寛解(CR)は、すべての非標的病変の消失と定義する。すべてのリンパ節は、短軸が<10mmである必要がある。
新たな病変の出現は、RECISTガイドラインv1.1に従い、PDと考えられる。免疫療法に伴って認められている固有の応答動態を考慮すると、新たな病変は真の疾患進行を表さない場合がある。急激な臨床的悪化の不在下では、被験者は、MEDI4736およびトレメリムマブを用いる治療を受け続けてもよい。
CR、PR、およびPDの確認は、初回記録日から4週以降にわたる反復的な継続的評価によって必要とされる。標的病変、非標的病変、および新たな病変の評価に基づく総合効果の評価については、下の表1のように判定する。
(a)登録および追跡調査
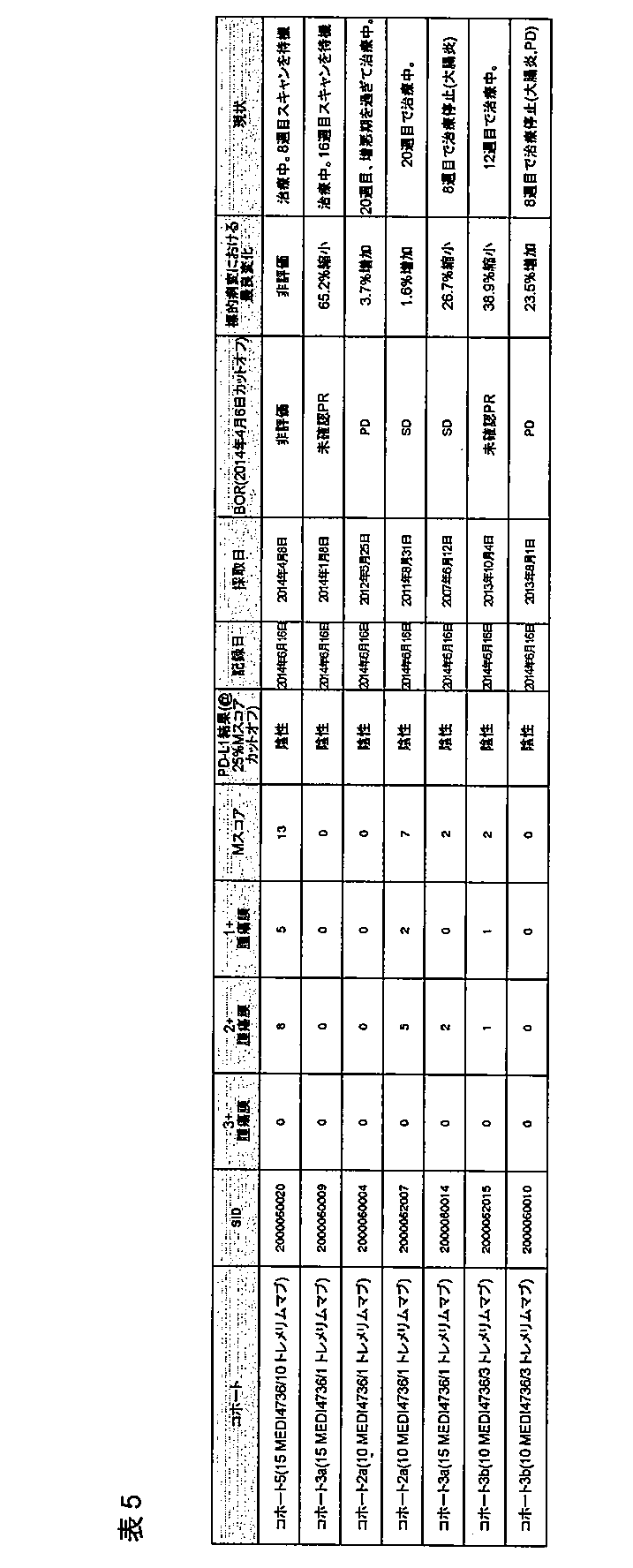
被験者3名ずつを、コホート1a(1mg/kgのトレメリムマブおよび3mg/kgのMEDI4736)、コホート2a(1mg/kgのトレメリムマブおよび10mg/kgのMEDI4736)、コホート3a(1mg/kgのトレメリムマブおよび15mg/kgのMEDI4736)、およびコホート3b(3mg/kgのトレメリムマブおよび10mg/kgのMEDI4736)に入れて、被験者12名を治療した。コホート1aの被験者2名(被験者1名は両薬剤の2回投与後に同意の上中止した)は約115日の追跡調査を完了し;コホート2aの被験者は約56日の追跡調査を完了し;またコホート3aおよび3bの被験者は28日の追跡調査を完了した(図12)。
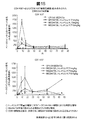
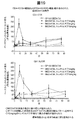
3mg/kgおよび10mg/kgでのMEDI4736の(1mg/kgのトレメリムマブを組み合わせた)投与から得られた薬物動態学的データを図4に示す。MEDI4736の投与から得られた各PKパラメータを図8に示す。初回投与からのこの初期データでは、3mg/kgのMEDI4736を受けた被験者における平均Cmaxは67.36μg/mlであった。3mg/kgのMEDI4736を受けた被験者における平均AUCτは625.3μg/mL*日であった。3mg/kgのMEDI4736を受けた被験者における平均Ctroughは8.85μg/mlであった。10mg/kgのMEDI4736を受けた被験者における平均Cmaxは266.7μg/mlであった。10mg/kgのMEDI4736を受けた被験者における平均AUCτは2860μg/mL*日であった。10mg/kgのMEDI4736を受けた被験者における平均Ctroughは35.65μg/mlであった。MEDI4736は、非線形PKを示す、AUCにおける用量比例性を超える増加を示した。図4を参照のこと。
3mg/kgおよび10mg/kgのMEDI4736ならびに1mg/kgのトレメリムマブの投与から得られたsPD−L1データを、図6(絶対濃度)、図7および図8(抑制、ベースラインの%)に示す。MEDI4736の投与後、被験者6名中5名で完全なsPD−L1抑制が認められた。被験者1名では、約65%のsPD−L1抑制がMEDI4736の2回目の投与で認められた。
被験者12名中10名が治療中に発生した有害反応(TEAE)を報告した。最も高頻度に報告されたTEAEが、疲労(41.7%;被験者5名)、アミラーゼ増加(25.0%;被験者3名)、そう痒および上気道感染(16.7%;各々被験者2名)であった。用量制限毒性を経験した被験者はなかった。TEAEを経験した被験者10名中9名が、重症度がグレード1または2の事象を有した。被験者1名(コホート2a)が、グレード3のアスパラギン酸アミノトランスフェラーゼ(AST)の増加およびアラニンアミノトランスフェラーゼ(ALT)の増加および致死性(グレード5)重症筋無力症を経験した。被験者12名中2名が、治療下で出現した重篤な有害事象(SAE)を経験した。被験者2名が、TEAEが原因で治療を中断した。図13は関連有害事象を示す。
阻害性PD−L1およびCTLA−4経路は、T細胞活性化の制御における主要な役割を果たす。MEDI4736(M)は、PD−L1のPD−1およびCD−80への結合を遮断するヒトIgG1モノクローナル抗体である。トレメリムマブ(T)は、CTLA−4を標的とするヒトIgG2モノクローナル抗体である。MEDI4736およびトレメリムマブの双方は、単剤として安全性特性および有望な臨床活性を促進することを示している。つまり、それらが免疫抑制に寄与する明らかな相互作用を遮断することから、MEDI4736+トレメリムマブの併用療法は、進行型非小細胞肺がんを有する患者(pts)において、いずれかの薬剤単独と比べて抗腫瘍活性の増強を提供し得る。
被験者3名ずつを、コホート1a(1mg/kgのトレメリムマブおよび3mg/kgのMEDI4736)、コホート2a(1mg/kgのトレメリムマブおよび10mg/kgのMEDI4736)、コホート3a(1mg/kgのトレメリムマブおよび15mg/kgのMEDI4736)、およびコホート3b(3mg/kgのトレメリムマブおよび10mg/kgのMEDI4736)に入れて、被験者12名を治療した。コホート1aの被験者2名(被験者1名は両薬剤の2回投与後に同意の上中止した)は約115日の追跡調査を完了し;コホート2aの被験者は約56日の追跡調査を完了し;またコホート3aおよび3bの被験者は28日の追跡調査を完了した。
配列番号1 MEDI4736 VL
配列番号2 MEDI4736 VH
配列番号3−MEDI4736 VH CDR1
RYWMS
配列番号4−MEDI4736 VH CDR2
NIKQDGSEKYYVDSVKG
配列番号5−MEDI4736 VH CDR3
EGGWFGELAFDY
配列番号6−MEDI4736 VL CDR1
RASQRVSSSYLA
配列番号7−MEDI4736 VL CDR2
DASSRAT
配列番号8−MEDI4736 VL CDR3
QQYGSLPWT
配列番号9 トレメリムマブVL
配列番号10 トレメリムマブVH
配列番号11−トレメリムマブVH CDR1
GFTFSSYGMH
配列番号12−トレメリムマブVH CDR2
VIWYDGSNKYYADSV
配列番号13−トレメリムマブVH CDR3
TAVYYCARDPRGATLYYYYYGMDV
配列番号14−トレメリムマブVL CDR1
RASQSINSYLD
配列番号15−トレメリムマブVL CDR2
AASSLQS
配列番号16−トレメリムマブVL CDR3
QQYYSTPFT
Claims (101)
- ヒト患者における非小細胞肺がん(NSCLC)を治療する方法であって、1mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、3mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、15mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、20mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、15mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、15mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、20mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、20mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、3mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、3mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、1mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるNSCLCを治療する方法であって、1mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- 前記MEDI4736が4週毎に投与される、請求項1〜15のいずれか一項に記載の方法。
- 前記MEDI4736が49週間、4週毎に投与される、請求項16に記載の方法。
- 全部で13用量のMEDI4736が投与される、請求項17に記載の方法。
- ヒト患者におけるNSCLCを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含み、ここで前記MEDI4736は2週毎に投与される、方法。
- ヒト患者におけるNSCLCを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含み、ここで前記MEDI4736は2週毎に投与される、方法。
- ヒト患者におけるNSCLCを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含み、ここで前記MEDI4736は2週毎に投与される、方法。
- ヒト患者におけるNSCLCを治療する方法であって、MEDI4736またはその抗原結合断片およびトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含み、ここで前記投与により腫瘍応答がもたらされる、方法。
- 前記投与により、前記MEDI4736もしくはその抗原結合断片または前記トレメリムマブもしくはその抗原結合断片のいずれかの単独投与と比べて増強された腫瘍応答がもたらされる、請求項22に記載の方法。
- 前記腫瘍応答が、2、4、6、8、または10週毎に検出され得る、請求項22または23に記載の方法。
- 前記腫瘍応答が8週毎に検出され得る、請求項22または23に記載の方法。
- 前記腫瘍応答が33週毎に検出され得る、請求項22または23に記載の方法。
- 前記腫瘍応答が50週毎に検出され得る、請求項22または23に記載の方法。
- ヒト患者におけるNSCLCを治療する方法であって、MEDI4736またはその抗原結合断片およびトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含み、ここで前記投与により進行のない生存が増加する、方法。
- 前記投与により、前記MEDI4736もしくはその抗原結合断片または前記トレメリムマブもしくはその抗原結合断片のいずれかの単独投与と比べて進行のない生存の増加がもたらされる、請求項28に記載の方法。
- ヒト患者におけるNSCLCを治療する方法であって、MEDI4736またはその抗原結合断片およびトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含み、ここで前記投与により全生存が増加する、方法。
- 前記投与により、前記MEDI4736もしくはその抗原結合断片または前記トレメリムマブもしくはその抗原結合断片のいずれかの単独投与と比べて全生存の増加がもたらされる、請求項30に記載の方法。
- 前記投与により腫瘍応答がもたらされる、請求項1〜31のいずれか一項に記載の方法。
- 前記投与により、前記MEDI4736もしくはその抗原結合断片または前記トレメリムマブもしくはその抗原結合断片のいずれかの単独投与と比べて増強された腫瘍応答がもたらされる、請求項32に記載の方法。
- 前記腫瘍応答が8週毎に検出され得る、請求項32または33に記載の方法。
- 前記腫瘍応答が33週毎に検出され得る、請求項32または33に記載の方法。
- 前記投与により進行のない生存が増加する、請求項1〜35のいずれか一項に記載の方法。
- 前記投与により、前記MEDI4736もしくはその抗原結合断片または前記トレメリムマブもしくはその抗原結合断片のいずれかの単独投与と比べて進行のない生存の増加がもたらされる、請求項36に記載の方法。
- 前記投与により全生存が増加する、請求項1〜37のいずれか一項に記載の方法。
- 前記投与により、前記MEDI4736もしくはその抗原結合断片または前記トレメリムマブもしくはその抗原結合断片のいずれかの単独投与と比べて全生存の増加がもたらされる、請求項38に記載の方法。
- MEDI4736またはその抗原結合断片の前記投与が約4週毎に反復される、請求項32〜39のいずれか一項に記載の方法。
- トレメリムマブまたはその抗原結合断片の前記投与が約4週毎に反復される、請求項1〜40のいずれか一項に記載の方法。
- トレメリムマブまたはその抗原結合断片の前記投与が約12週毎に反復される、請求項1〜40のいずれか一項に記載の方法。
- トレメリムマブまたはその抗原結合断片の前記投与が、7回投与に対して約4週毎、次に12週毎に投与される、請求項1〜40のいずれか一項に記載の方法。
- 前記投与により可溶性PD−L1が低下する、請求項1〜43のいずれか一項に記載の方法。
- 可溶性PD−L1が少なくとも65%低下する、請求項44に記載の方法。
- 可溶性PD−L1が少なくとも80%低下する、請求項45に記載の方法。
- 可溶性PD−L1が少なくとも90%低下する、請求項46に記載の方法。
- 可溶性PD−L1が少なくとも95%低下する、請求項47に記載の方法。
- 可溶性PD−L1が少なくとも99%低下する、請求項48に記載の方法。
- 前記固形腫瘍が少なくとも1つの化学療法剤に対して難治性である、請求項1〜49のいずれか一項に記載の方法。
- 前記化学療法剤が、ベムラフェニブ、エルロチニブ、アファチニブ、セツキシマブ、カルボプラチン、ベバシズマブ、エルロチニブ、ゲフィチニブ、またはペメトレキセドである、請求項50に記載の方法。
- 前記患者が、米国東海岸がん臨床試験グループ(ECOG)の0〜1のパフォーマンスステータスを有する、請求項1〜51のいずれか一項に記載の方法。
- 前記患者が、MEDI4736またはその抗原結合断片およびトレメリムマブまたはその抗原結合断片の前記投与前に免疫療法を受けていない、請求項1〜52のいずれか一項に記載の方法。
- 前記患者が、MEDI4736またはその抗原結合断片およびトレメリムマブまたはその抗原結合断片の前記投与前に免疫療法を受けている、請求項1〜53のいずれか一項に記載の方法。
- MEDI4736またはその抗原結合断片の前記投与が静脈内注入によるものである、請求項1〜54のいずれか一項に記載の方法。
- トレメリムマブまたはその抗原結合断片の前記投与が静脈内注入によるものである、請求項1〜55のいずれか一項に記載の方法。
- 前記MEDI4736またはその抗原結合断片がMEDI4736であり、かつ前記トレメリムマブまたはその抗原結合断片がトレメリムマブである、請求項1〜56のいずれか一項に記載の方法。
- 前記投与により、腫瘍サイズがベースラインに対して少なくとも約10%縮小する、請求項1〜57のいずれか一項に記載の方法。
- 前記投与により、腫瘍サイズがベースラインに対して少なくとも約25%または50%縮小する、請求項1〜58のいずれか一項に記載の方法。
- 前記ヒト患者が限局的に進行型の切除不能または転移性NSCLCを有する、請求項1〜59のいずれか一項に記載の方法。
- 前記NSCLCが扁平上皮または非扁平上皮である、請求項1〜60のいずれか一項に記載の方法。
- 前記NSCLCがKRAS突然変異またはEGFR突然変異を含む、請求項1〜61のいずれか一項に記載の方法。
- 前記NSCLCがPD−L1陽性である、請求項1〜62のいずれか一項に記載の方法。
- 前記NSCLCがPD−L1陰性である、請求項1〜62のいずれか一項に記載の方法。
- MEDI4736またはその抗原結合断片およびトレメリムマブまたはその抗原結合断片を、PD−L1-またはPD−L1+NSCLCを有するものとして同定された患者に投与するステップを含む、治療方法。
- 1mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 3mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 10mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 15mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 10mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 20mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 15mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 15mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 20mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 20mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 10mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 3mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 3mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 1mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 1mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、請求項65に記載の方法。
- 前記MEDI4736またはその抗原結合断片が2週毎に投与される、請求項65〜80のいずれか一項に記載の方法。
- 前記MEDI4736またはその抗原結合断片が4週毎に投与される、請求項65〜80のいずれか一項に記載の方法。
- ヒト患者におけるがんを治療する方法であって、1mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、3mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、15mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、20mg/kgのMEDI4736またはその抗原結合断片および1mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、15mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、15mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、20mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、20mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、10mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、3mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、3mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、1mg/kgのMEDI4736またはその抗原結合断片および3mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- ヒト患者におけるがんを治療する方法であって、1mg/kgのMEDI4736またはその抗原結合断片および10mg/kgのトレメリムマブまたはその抗原結合断片を前記患者に投与するステップを含む、方法。
- 前記MEDI4736が4週毎に投与される、請求項83〜97のいずれか一項に記載の方法。
- 前記MEDI4736が49週間、4週毎に投与される、請求項98に記載の方法。
- 全部で13用量のMEDI4736が投与される、請求項99に記載の方法。
- がんが、前立腺がん、乳がん、トリプルネガティブ乳がん、大腸がん、肺がん、NSCLC、頭頚部がん、メラノーマ、胃がん、膵がん、卵巣がん、腎細胞がん、および肝がんから選択される、請求項83〜97のいずれか一項に記載の方法。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461992658P | 2014-05-13 | 2014-05-13 | |
| US61/992,658 | 2014-05-13 | ||
| US201562105992P | 2015-01-21 | 2015-01-21 | |
| US62/105,992 | 2015-01-21 | ||
| US201562114336P | 2015-02-10 | 2015-02-10 | |
| US62/114,336 | 2015-02-10 | ||
| PCT/EP2015/060523 WO2015173267A1 (en) | 2014-05-13 | 2015-05-12 | Anti-b7-h1 and anti-ctla-4 antibodies for treating non-small cell lung cancer |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020004032A Division JP2020090509A (ja) | 2014-05-13 | 2020-01-15 | 非小細胞肺がんを治療するための抗b7−h1および抗ctla−4抗体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017520520A true JP2017520520A (ja) | 2017-07-27 |
| JP6648038B2 JP6648038B2 (ja) | 2020-02-14 |
Family
ID=53175516
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016567088A Active JP6648038B2 (ja) | 2014-05-13 | 2015-05-12 | 非小細胞肺がんを治療するための抗b7−h1および抗ctla−4抗体 |
| JP2020004032A Pending JP2020090509A (ja) | 2014-05-13 | 2020-01-15 | 非小細胞肺がんを治療するための抗b7−h1および抗ctla−4抗体 |
| JP2021037883A Pending JP2021098734A (ja) | 2014-05-13 | 2021-03-10 | 非小細胞肺がんを治療するための抗b7−h1および抗ctla−4抗体 |
| JP2023009115A Active JP7519477B2 (ja) | 2014-05-13 | 2023-01-25 | 非小細胞肺がんを治療するための抗b7-h1および抗ctla-4抗体 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020004032A Pending JP2020090509A (ja) | 2014-05-13 | 2020-01-15 | 非小細胞肺がんを治療するための抗b7−h1および抗ctla−4抗体 |
| JP2021037883A Pending JP2021098734A (ja) | 2014-05-13 | 2021-03-10 | 非小細胞肺がんを治療するための抗b7−h1および抗ctla−4抗体 |
| JP2023009115A Active JP7519477B2 (ja) | 2014-05-13 | 2023-01-25 | 非小細胞肺がんを治療するための抗b7-h1および抗ctla-4抗体 |
Country Status (27)
| Country | Link |
|---|---|
| US (3) | US10232040B2 (ja) |
| EP (2) | EP3142751B1 (ja) |
| JP (4) | JP6648038B2 (ja) |
| KR (4) | KR20220162844A (ja) |
| CN (2) | CN113230398B (ja) |
| AU (4) | AU2015260962B2 (ja) |
| BR (1) | BR122023025321A2 (ja) |
| CA (1) | CA2947471A1 (ja) |
| CY (1) | CY1122642T1 (ja) |
| DK (1) | DK3142751T3 (ja) |
| ES (1) | ES2749098T3 (ja) |
| GB (1) | GB2531094A (ja) |
| HR (1) | HRP20191449T1 (ja) |
| HU (1) | HUE045965T2 (ja) |
| IL (2) | IL248528B (ja) |
| LT (1) | LT3142751T (ja) |
| ME (1) | ME03493B (ja) |
| MX (1) | MX373019B (ja) |
| PL (1) | PL3142751T3 (ja) |
| PT (1) | PT3142751T (ja) |
| RS (1) | RS59134B1 (ja) |
| RU (1) | RU2702332C2 (ja) |
| SG (2) | SG10201810108PA (ja) |
| SI (1) | SI3142751T1 (ja) |
| SM (1) | SMT201900544T1 (ja) |
| TW (3) | TW202123967A (ja) |
| WO (1) | WO2015173267A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US12139763B2 (en) | 2016-05-17 | 2024-11-12 | Genecentric Therapeutics, Inc. | Methods for subtyping of lung adenocarcinoma |
| US12139765B2 (en) | 2016-05-17 | 2024-11-12 | Genecentric Therapeutics, Inc. | Methods for subtyping of lung squamous cell carcinoma |
Families Citing this family (46)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210143932A (ko) * | 2013-09-11 | 2021-11-29 | 메디뮨 리미티드 | 종양 치료용 항-b7-h1 항체 |
| GB201403775D0 (en) | 2014-03-04 | 2014-04-16 | Kymab Ltd | Antibodies, uses & methods |
| SMT201900544T1 (it) * | 2014-05-13 | 2019-11-13 | Medimmune Ltd | Anticorpi anti-b7-h1 e anti-ctla-4 per trattare il cancro del polmone non a piccole cellule |
| GB2535256A (en) * | 2014-08-28 | 2016-08-17 | Medimmune Ltd | Combination therapy for PD-L1 negative tumors |
| WO2016030455A1 (en) * | 2014-08-28 | 2016-03-03 | Medimmune Limited | Anti-b7-h1 and anti-ctla-4 antibodies for treating non-small lung cancer |
| WO2016149201A2 (en) | 2015-03-13 | 2016-09-22 | Cytomx Therapeutics, Inc. | Anti-pdl1 antibodies, activatable anti-pdl1 antibodies, and methods of use thereof |
| WO2017165742A1 (en) | 2016-03-24 | 2017-09-28 | Millennium Pharmaceuticals, Inc. | Methods of treating gastrointestinal immune-related adverse events in anti-ctla4 anti-pd-1 combination treatments |
| WO2017165778A1 (en) | 2016-03-24 | 2017-09-28 | Millennium Pharmaceuticals, Inc. | Methods of treating gastrointestinal immune-related adverse events in immune oncology treatments |
| EP3448428A4 (en) * | 2016-04-25 | 2019-11-27 | Medimmune, LLC | COMPOSITIONS WITH CO FORMULATION OF ANTI-PD-L1 AND ANTI-CTLA-4 ANTIBODIES |
| US9567399B1 (en) | 2016-06-20 | 2017-02-14 | Kymab Limited | Antibodies and immunocytokines |
| JP7461741B2 (ja) | 2016-06-20 | 2024-04-04 | カイマブ・リミテッド | 抗pd-l1およびil-2サイトカイン |
| WO2018029474A2 (en) | 2016-08-09 | 2018-02-15 | Kymab Limited | Anti-icos antibodies |
| JP7198752B2 (ja) | 2016-08-09 | 2023-01-04 | カイマブ・リミテッド | 抗icos抗体 |
| KR20230011473A (ko) | 2016-09-06 | 2023-01-20 | 메이오 파운데이션 포 메디칼 에쥬케이션 앤드 리써치 | Pd-l1 발현 암의 치료 방법 |
| EP3534947A1 (en) | 2016-11-03 | 2019-09-11 | Kymab Limited | Antibodies, combinations comprising antibodies, biomarkers, uses & methods |
| WO2018089780A1 (en) * | 2016-11-11 | 2018-05-17 | Medimmune, Llc | Anti-pd-l1 and anti-ctla-4 antibodies for treating non-small cell lung cancer |
| WO2018098352A2 (en) | 2016-11-22 | 2018-05-31 | Jun Oishi | Targeting kras induced immune checkpoint expression |
| US11040027B2 (en) | 2017-01-17 | 2021-06-22 | Heparegenix Gmbh | Protein kinase inhibitors for promoting liver regeneration or reducing or preventing hepatocyte death |
| IL320916A (en) * | 2017-02-16 | 2025-07-01 | Medimmune Llc | Bladder cancer treatment with anti-PD-L1 antibody |
| CN110914302A (zh) | 2017-06-01 | 2020-03-24 | 赛托姆克斯治疗学股份有限公司 | 可活化抗pdl1抗体及其使用方法 |
| GB201709808D0 (en) | 2017-06-20 | 2017-08-02 | Kymab Ltd | Antibodies |
| US11629189B2 (en) | 2017-12-19 | 2023-04-18 | Kymab Limited | Bispecific antibody for ICOS and PD-L1 |
| GB201721338D0 (en) | 2017-12-19 | 2018-01-31 | Kymab Ltd | Anti-icos Antibodies |
| AU2018412532B2 (en) * | 2018-03-08 | 2025-05-08 | Astrazeneca Ab | Compositions and methods for treating late stage lung cancer |
| WO2021024020A1 (en) | 2019-08-06 | 2021-02-11 | Astellas Pharma Inc. | Combination therapy involving antibodies against claudin 18.2 and immune checkpoint inhibitors for treatment of cancer |
| JP7487558B2 (ja) | 2020-05-25 | 2024-05-21 | 船井電機株式会社 | 面光源装置および表示装置 |
| KR20230035576A (ko) | 2020-07-07 | 2023-03-14 | 비온테크 에스이 | Hpv 양성 암 치료용 rna |
| WO2022135667A1 (en) | 2020-12-21 | 2022-06-30 | BioNTech SE | Therapeutic rna for treating cancer |
| WO2022135666A1 (en) | 2020-12-21 | 2022-06-30 | BioNTech SE | Treatment schedule for cytokine proteins |
| TW202245808A (zh) | 2020-12-21 | 2022-12-01 | 德商拜恩迪克公司 | 用於治療癌症之治療性rna |
| TW202304506A (zh) | 2021-03-25 | 2023-02-01 | 日商安斯泰來製藥公司 | 涉及抗claudin 18.2抗體的組合治療以治療癌症 |
| WO2022243378A1 (en) | 2021-05-18 | 2022-11-24 | Kymab Limited | Uses of anti-icos antibodies |
| GB202107994D0 (en) | 2021-06-04 | 2021-07-21 | Kymab Ltd | Treatment of cancer |
| AU2022312698A1 (en) | 2021-07-13 | 2024-01-25 | BioNTech SE | Multispecific binding agents against cd40 and cd137 in combination therapy for cancer |
| WO2023051926A1 (en) | 2021-09-30 | 2023-04-06 | BioNTech SE | Treatment involving non-immunogenic rna for antigen vaccination and pd-1 axis binding antagonists |
| TW202333802A (zh) | 2021-10-11 | 2023-09-01 | 德商拜恩迪克公司 | 用於肺癌之治療性rna(二) |
| MX2024004429A (es) * | 2021-10-29 | 2024-05-06 | Oncoc4 Inc | Regimenes de dosificacion del anticuerpo anti-ctla-4. |
| WO2023083439A1 (en) | 2021-11-09 | 2023-05-19 | BioNTech SE | Tlr7 agonist and combinations for cancer treatment |
| US20250340641A1 (en) | 2022-05-18 | 2025-11-06 | Kymab Limited | Uses of anti-icos antibodies |
| AU2023401158A1 (en) | 2022-12-01 | 2025-05-29 | BioNTech SE | Multispecific antibody against cd40 and cd137 in combination therapy with anti-pd1 ab and chemotherapy |
| CN120418289A (zh) | 2022-12-14 | 2025-08-01 | 安斯泰来制药欧洲有限公司 | 结合cldn18.2和cd3的双特异性结合剂与免疫检查点抑制剂的联合疗法 |
| CN120813375A (zh) | 2023-01-30 | 2025-10-17 | 凯玛布有限公司 | 抗体 |
| WO2025056180A1 (en) | 2023-09-15 | 2025-03-20 | BioNTech SE | Methods of treatment using agents binding to epcam and cd137 in combination with pd-1 axis binding antagonists |
| WO2025121445A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and agents stabilizing or increasing expression of cldn18.2 |
| WO2025120867A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and anti-vegfr2 antibodies |
| WO2025120866A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and agents stabilizing or increasing expression of cldn18.2 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013173223A1 (en) * | 2012-05-15 | 2013-11-21 | Bristol-Myers Squibb Company | Cancer immunotherapy by disrupting pd-1/pd-l1 signaling |
| WO2014066834A1 (en) * | 2012-10-26 | 2014-05-01 | The University Of Chicago | Synergistic combination of immunologic inhibitors for the treatment of cancer |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7109003B2 (en) | 1998-12-23 | 2006-09-19 | Abgenix, Inc. | Methods for expressing and recovering human monoclonal antibodies to CTLA-4 |
| EE05627B1 (et) | 1998-12-23 | 2013-02-15 | Pfizer Inc. | CTLA-4 vastased inimese monoklonaalsed antikehad |
| US7158164B2 (en) | 2003-08-29 | 2007-01-02 | Fuji Photo Film Co., Ltd. | Thermal development method and apparatus |
| AU2011203119C1 (en) | 2005-05-09 | 2018-06-14 | E. R. Squibb & Sons, L.L.C. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| KR101607288B1 (ko) * | 2005-07-01 | 2016-04-05 | 이. 알. 스퀴부 앤드 선즈, 엘.엘.씨. | 예정 사멸 리간드 1 (피디-엘1)에 대한 인간 모노클로날 항체 |
| EP2007423A2 (en) * | 2006-04-05 | 2008-12-31 | Pfizer Products Incorporated | Ctla4 antibody combination therapy |
| US20100055111A1 (en) * | 2007-02-14 | 2010-03-04 | Med. College Of Georgia Research Institute, Inc. | Indoleamine 2,3-dioxygenase, pd-1/pd-l pathways, and ctla4 pathways in the activation of regulatory t cells |
| CN104961829B (zh) | 2009-11-24 | 2018-08-21 | 米迪缪尼有限公司 | 针对b7-h1的靶向结合剂 |
| CN102000947B (zh) * | 2010-10-14 | 2012-06-06 | 沈阳飞机工业(集团)有限公司 | 两半轴瓦的铣切加工方法 |
| HUE044038T2 (hu) | 2010-11-05 | 2019-09-30 | Novartis Ag | Spondilitisz ankilopoetika kezelési eljárásai anti-IL-17 alkalmazásával |
| CN101975831B (zh) * | 2010-11-25 | 2012-09-05 | 中国检验检疫科学研究院 | 高效液相色谱法测定化妆品中苯酚磺酸锌的方法 |
| US8609625B2 (en) * | 2011-06-24 | 2013-12-17 | Taipei Veterans General Hospital | Method for enhancing immune response in the treatment of infectious and malignant diseases |
| US9863935B2 (en) * | 2012-05-08 | 2018-01-09 | H. Lee Moffitt Cancer And Research Institute, Inc. | Predictive biomarkers for CTLA-4 blockade therapy and for PD-1 blockade therapy |
| WO2013172926A1 (en) * | 2012-05-14 | 2013-11-21 | Yale University | Immune biomarkers and assays predictive of clinical response to immunotherapy for cancer |
| US9107960B2 (en) * | 2012-12-13 | 2015-08-18 | Immunimedics, Inc. | Antibody-SN-38 immunoconjugates with a CL2A linker |
| EP3563836A1 (en) * | 2013-03-01 | 2019-11-06 | Astex Pharmaceuticals, Inc. | Drug combinations |
| SMT201900544T1 (it) * | 2014-05-13 | 2019-11-13 | Medimmune Ltd | Anticorpi anti-b7-h1 e anti-ctla-4 per trattare il cancro del polmone non a piccole cellule |
| WO2016030455A1 (en) * | 2014-08-28 | 2016-03-03 | Medimmune Limited | Anti-b7-h1 and anti-ctla-4 antibodies for treating non-small lung cancer |
| CN112778418B (zh) * | 2014-11-10 | 2025-04-22 | 免疫医疗有限公司 | 对cd73具有特异性的结合分子及其用途 |
| KR20250004095A (ko) * | 2015-04-17 | 2025-01-07 | 브리스톨-마이어스 스큅 컴퍼니 | 항-pd-1 항체 및 또 다른 항체의 조합물을 포함하는 조성물 |
| US20160347848A1 (en) * | 2015-05-28 | 2016-12-01 | Medimmune Limited | Therapeutic combinations and methods for treating neoplasia |
| EP3448428A4 (en) * | 2016-04-25 | 2019-11-27 | Medimmune, LLC | COMPOSITIONS WITH CO FORMULATION OF ANTI-PD-L1 AND ANTI-CTLA-4 ANTIBODIES |
| IL320916A (en) * | 2017-02-16 | 2025-07-01 | Medimmune Llc | Bladder cancer treatment with anti-PD-L1 antibody |
| US12042527B2 (en) * | 2019-01-08 | 2024-07-23 | Modernatx, Inc. | Use of mRNAs encoding OX40L, IL-23 and IL-36gamma in combination with immune checkpoint blockade for treating particular cancers |
-
2015
- 2015-05-12 SM SM20190544T patent/SMT201900544T1/it unknown
- 2015-05-12 SG SG10201810108PA patent/SG10201810108PA/en unknown
- 2015-05-12 KR KR1020227040764A patent/KR20220162844A/ko not_active Ceased
- 2015-05-12 HR HRP20191449 patent/HRP20191449T1/hr unknown
- 2015-05-12 ME MEP-2019-231A patent/ME03493B/me unknown
- 2015-05-12 DK DK15722195.3T patent/DK3142751T3/da active
- 2015-05-12 US US14/710,101 patent/US10232040B2/en active Active
- 2015-05-12 LT LTEP15722195.3T patent/LT3142751T/lt unknown
- 2015-05-12 GB GB1508097.1A patent/GB2531094A/en not_active Withdrawn
- 2015-05-12 RS RS20191070A patent/RS59134B1/sr unknown
- 2015-05-12 BR BR122023025321-3A patent/BR122023025321A2/pt not_active Application Discontinuation
- 2015-05-12 PL PL15722195T patent/PL3142751T3/pl unknown
- 2015-05-12 SG SG11201609285SA patent/SG11201609285SA/en unknown
- 2015-05-12 KR KR1020167031692A patent/KR102333658B1/ko active Active
- 2015-05-12 CN CN202110380316.8A patent/CN113230398B/zh active Active
- 2015-05-12 KR KR1020237040802A patent/KR20230165876A/ko not_active Ceased
- 2015-05-12 KR KR1020217038830A patent/KR20210149870A/ko not_active Ceased
- 2015-05-12 EP EP15722195.3A patent/EP3142751B1/en active Active
- 2015-05-12 CA CA2947471A patent/CA2947471A1/en active Pending
- 2015-05-12 JP JP2016567088A patent/JP6648038B2/ja active Active
- 2015-05-12 MX MX2016014189A patent/MX373019B/es active IP Right Grant
- 2015-05-12 PT PT157221953T patent/PT3142751T/pt unknown
- 2015-05-12 RU RU2016148645A patent/RU2702332C2/ru active
- 2015-05-12 HU HUE15722195A patent/HUE045965T2/hu unknown
- 2015-05-12 SI SI201530857T patent/SI3142751T1/sl unknown
- 2015-05-12 EP EP19190351.7A patent/EP3603748A1/en active Pending
- 2015-05-12 AU AU2015260962A patent/AU2015260962B2/en active Active
- 2015-05-12 CN CN201580024117.6A patent/CN106456756B/zh active Active
- 2015-05-12 ES ES15722195T patent/ES2749098T3/es active Active
- 2015-05-12 WO PCT/EP2015/060523 patent/WO2015173267A1/en not_active Ceased
- 2015-05-13 TW TW109134952A patent/TW202123967A/zh unknown
- 2015-05-13 TW TW104115327A patent/TWI707692B/zh active
- 2015-05-13 TW TW110144264A patent/TWI780994B/zh active
-
2016
- 2016-10-26 IL IL248528A patent/IL248528B/en active IP Right Grant
-
2019
- 2019-01-24 US US16/256,022 patent/US11446377B2/en active Active
- 2019-10-03 CY CY20191101034T patent/CY1122642T1/el unknown
-
2020
- 2020-01-15 JP JP2020004032A patent/JP2020090509A/ja active Pending
- 2020-08-04 IL IL276481A patent/IL276481B/en unknown
- 2020-09-10 AU AU2020230309A patent/AU2020230309B2/en active Active
-
2021
- 2021-03-10 JP JP2021037883A patent/JP2021098734A/ja active Pending
-
2022
- 2022-08-09 US US17/818,546 patent/US20230115328A1/en active Pending
-
2023
- 2023-01-25 JP JP2023009115A patent/JP7519477B2/ja active Active
- 2023-07-04 AU AU2023204286A patent/AU2023204286B2/en active Active
-
2025
- 2025-04-24 AU AU2025202908A patent/AU2025202908A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013173223A1 (en) * | 2012-05-15 | 2013-11-21 | Bristol-Myers Squibb Company | Cancer immunotherapy by disrupting pd-1/pd-l1 signaling |
| WO2014066834A1 (en) * | 2012-10-26 | 2014-05-01 | The University Of Chicago | Synergistic combination of immunologic inhibitors for the treatment of cancer |
Non-Patent Citations (2)
| Title |
|---|
| ONCOIMMUNOLOGY, vol. 3:2, JPN6019004899, January 2014 (2014-01-01), pages 27297, ISSN: 0003977801 * |
| TRANSLATIONAL LUNG CANCER RESEARCH, vol. 3, no. 1, JPN6019004900, January 2014 (2014-01-01), pages 53 - 63, ISSN: 0003977802 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US12139763B2 (en) | 2016-05-17 | 2024-11-12 | Genecentric Therapeutics, Inc. | Methods for subtyping of lung adenocarcinoma |
| US12139765B2 (en) | 2016-05-17 | 2024-11-12 | Genecentric Therapeutics, Inc. | Methods for subtyping of lung squamous cell carcinoma |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7519477B2 (ja) | 非小細胞肺がんを治療するための抗b7-h1および抗ctla-4抗体 | |
| KR20240134249A (ko) | 결장직장암을 갖는 환자의 치료에서의 항-pd-1 항체의 용도 | |
| US20190256603A1 (en) | Anti-pd-l1 and anti-ctla-4 antibodies for treating non-small cell lung cancer | |
| RU2806210C2 (ru) | Антитела к b7-h1 и к ctla-4 для лечения немелкоклеточного рака легкого | |
| US20240092934A1 (en) | Assessment of ceacam1 expression on tumor infiltrating lymphocytes | |
| US20230365691A1 (en) | Use of anti-pd-1 antibody in treatment of nasopharyngeal carcinoma | |
| HK40013014A (en) | Anti-b7-h1 and anti-ctla-4 antibodies for treating non-small cell lung cancer | |
| TW202515612A (zh) | 使用薩西土珠單抗戈維特坎及抗pd—1抗體或其抗原結合片段治療非小細胞肺癌 | |
| HK1235023B (en) | Anti-b7-h1 and anti-ctla-4 antibodies for treating non-small cell lung cancer | |
| HK1235023A1 (en) | Anti-b7-h1 and anti-ctla-4 antibodies for treating non-small cell lung cancer | |
| BR112016026197B1 (pt) | Uso de medi4736 e tremelimumab |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180420 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190219 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190513 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190816 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20191218 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20200115 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6648038 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |