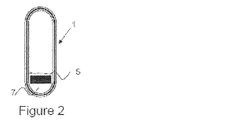JP2017014257A - 剤形 - Google Patents
剤形 Download PDFInfo
- Publication number
- JP2017014257A JP2017014257A JP2016159825A JP2016159825A JP2017014257A JP 2017014257 A JP2017014257 A JP 2017014257A JP 2016159825 A JP2016159825 A JP 2016159825A JP 2016159825 A JP2016159825 A JP 2016159825A JP 2017014257 A JP2017014257 A JP 2017014257A
- Authority
- JP
- Japan
- Prior art keywords
- dosage form
- capsule
- weight agent
- form according
- capsules
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/0065—Forms with gastric retention, e.g. floating on gastric juice, adhering to gastric mucosa, expanding to prevent passage through the pylorus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/05—Phenols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/216—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acids having aromatic rings, e.g. benactizyne, clofibrate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
- A61K31/4045—Indole-alkylamines; Amides thereof, e.g. serotonin, melatonin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4808—Preparations in capsules, e.g. of gelatin, of chocolate characterised by the form of the capsule or the structure of the filling; Capsules containing small tablets; Capsules with outer layer for immediate drug release
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/485—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4891—Coated capsules; Multilayered drug free capsule shells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5036—Polysaccharides, e.g. gums, alginate; Cyclodextrin
- A61K9/5042—Cellulose; Cellulose derivatives, e.g. phthalate or acetate succinate esters of hydroxypropyl methylcellulose
- A61K9/5047—Cellulose ethers containing no ester groups, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
- A61M31/002—Devices for releasing a drug at a continuous and controlled rate for a prolonged period of time
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Inorganic Chemistry (AREA)
- Hematology (AREA)
- Heart & Thoracic Surgery (AREA)
- Biomedical Technology (AREA)
- Anesthesiology (AREA)
- Emergency Medicine (AREA)
- Medicinal Preparation (AREA)
Abstract
Description
サイズ00elカプセルは、典型的には、直径約8.5mmおよび接合後の長さ約25.3mmを有する。
サイズ0カプセルは、典型的には、直径約7.6mmおよび接合後の長さ約21.7mmを有する。
サイズ1カプセルは、典型的には、直径約6.9mmおよび接合後の長さ約19.4mmを有する。
サイズ2カプセルは、典型的には、直径約6.3mmおよび接合後の長さ約18.0mmを有する。
サイズ3カプセルは、典型的には、直径約5.8mmおよび接合後の長さ約15.9mmを有する。
サイズ4カプセルは、典型的には、直径約5.3mmおよび接合後の長さ約14.3mmを有する。
サイズ5カプセルは、典型的には、直径約4.9mmおよび接合後の長さ約11.1mmを有する。
重量剤の重量は10〜500mgの範囲であり、より具体的には10〜400mgであり、さらにより具体的には100〜350mgの間であり、より具体的には50〜250mgである。
説明のために中空カプセルに言及する場合、重量剤はカプセル壁形成剤と混合してカプセルの部分を形成してもよいし;または、カプセル壁にコーティングとして適用されてもよい。あるいは、重量剤はカプセルの充填剤の一部を形成してもよい。
充填剤の一部として、重量剤は、小錠剤、ミニタブ(minitab)、顆粒剤、粒子剤、スラッグ剤またはビーズの形態をとってもよく、またはこれらの1個以上を含んでいてもよい。上述したとおり、重量剤は、上述した方法で胃液に浮遊するために剤形が偏るように、剤形の一方の端のみに含有されるべきである。そのようなものとして、小錠剤、顆粒剤、粒子剤、丸剤(slug)またはビーズ等をカプセルの一端に固定し、この位置から実質的に動かないようにできる。
特定の態様としては、サイズ#2カプセルは、サイズ#00カプセルの内側に適合し、カプセル中カプセル剤形を提供しうる。この方法で、#00カプセルには、まだ重量剤を入れ、重量剤が該#00カプセルの一端から実質的に離れるのを妨げるのに十分な充填量がある。しかし、当業者は、外部カプセルが容易に嚥下でき、さらに、幽門括約筋に対するその大きさのために胃に保持され;複数カプセル間の容積は、重量剤を入れ、実質的にこの容積内で実質的に移動が妨げられるのに十分大きい限り、他の内部および外部カプセルの組合せが可能であることを理解するであろう。
本発明に有用な原薬は、温血哺乳動物、ヒトおよび霊長類;ペットまたは家畜、例えば、ネコ、イヌ、ヒツジ、ヤギ、ウシ、ウマおよびブタ;実験動物、例えば、マウス、ラットおよびモルモット;動物園および野生動物;などを含む動物において、局所または全身効果を奏するあらゆる生理学的または薬理学的物質を含む。
原薬は、無機および有機化合物を含み、限定はなく、末梢神経、アドレナリン受容体、コリン作動性受容体、骨格筋、心血管系、平滑筋、血液循環系、神経部位(synoptic sites)、神経効果器接合部、内分泌およびホルモン系、免疫学的系、生殖器系、骨格系、消化器および排泄系、ヒスタミン系および中枢神経系に作用する物質を含む。
本発明において有用な原薬の特定群は、例えば、いくつかの活性な核酸またはアミノ酸およびその誘導体、ペプチドミメティック物質、抗潰瘍剤、タンパク質、酵素、酵素阻害剤、ホルモン、ポリヌクレオチド、核タンパク質、多糖、糖タンパク質、リポタンパク質、ペプチド、ポリペプチド、ステロイド類、催眠剤および鎮静剤、精神賦活剤、精神安定剤、抗精神剤、抗痙攣剤、抗てんかん剤、抗鬱剤、筋肉弛緩剤、抗パーキンソン剤、抗片頭痛剤、鎮痛剤、免疫抑制剤、抗炎症剤、抗ヒスタミン剤、局所麻酔剤、筋肉収縮剤、抗菌剤、抗マラリア剤、抗ウイルス剤、抗生物質、抗肥満剤、抗糖尿病性剤、避妊薬を含むホルモン剤、交感神経様作用剤、生理学的効果を発揮することのできるポリペプチドおよびタンパク質、利尿剤、脂質制御剤、抗アンドロゲン剤、駆虫剤、新生物、抗新生物、抗高血糖剤、低血糖剤、栄養剤および補助剤、成長補助剤、脂肪、眼科用剤、抗腸炎剤、電解質および診断剤である。
本発明は、特にヘリコバクターピロリに対する原薬、例えば、ミノサイクリンにより例示される抗生物質の投与に有用であり、それはヘリコバクターピロリ菌が存在するところである、胃の内壁と胃保護粘膜の間に浸透でき、ヘリコバクターピロリ菌を完全にまたは処置集団における処置後の再発が最少である程度に根絶する結果をもたらす。本発明により、胃における活性薬剤の存在時間が増加することにより、該菌における活性薬剤の送達時間が増加する。本発明により提供された増加した効率性および処置の有効性により、単一の活性薬剤、好ましくはミノサイクリンを有する剤形で、多くの対象における胃障害の処置が可能となる。従って、ヘリコバクターピロリ菌の除去のための複雑な処置レジメン、例えば、PPIを2種の抗生物質と組み合わせるような3剤レジメンを用いる必要性を避けられる。
原薬は、種々の形態であり得、非荷電分子、分子複合体の成分、または非炎症性の薬理学的に許容される塩である。また、体内pH、酵素等により容易に加水分解される薬剤の単純な誘導体(例えば、エーテル、エステル、アミド等)も用いられる。それらの薬学的に許容される純粋な異性体も用いられうる。
原薬の粒子の大きさは、好ましくは、50ミクロン、より好ましくは10ミクロン、さらにより具体的には、1ミクロンより小さいことである。望ましい粒子の大きさを得るための原薬の調製は、当業者の知識の範囲内であり、当業者に知られた範囲のミクロンまたはサブミクロン粒子の大きさを提供するあらゆる知られた技術を用いて達成される。
本発明において用語「即時放出」は、その分野に認識されている意味を有する。コーティングは、例えば米国薬局方において提示されているように即時放出固体経口剤形として、崩壊および/または溶解の必要性に合うのであれば、即時放出で作用すると考えられる。
即時放出コーティングの溶解特性は、好ましくはパドル法装置番号2.USP 26/NF 21 (「71 1 溶解」)記載の公定試験方法および装置を用いて、好ましくは、約75%が、60分間以内に、緩衝溶液において、37℃の温度で、パドル速度50rpmで溶解し、その試験方法は溶解要求に合致していることを調査者がわかり、およびこの文献は、参照として組み込まれる。
追加の賦形剤は、即時放出および/または持続放出コーティングにおいて全体特性、例えば機械的安定性などを促進するために用いられる。これらの賦形剤は、典型的には、柔軟性を改善するための可塑剤、希釈剤または増量剤、結合剤または接着剤;崩壊剤(disintegrants)または崩壊剤(disintegrating agents)、抗接着剤、流動促進剤または滑剤および種々の他のアジュバント、例えば着色剤および香味剤を含む。
適切な希釈剤は、薬学的に許容される不活性増量剤、例えば、微結晶セルロース、ラクトース、二塩基性リン酸カルシウム、単糖、および/または前述の混合物の混合物を含む。希釈剤の例は、微結晶セルロース、例えばAvicel PH 12、Avicel PH l0lおよびAvicel PH102;ラクトース、例えば、ラクトース一水和物、ラクトース無水物およびPharmatose DCL 21;二塩基性リン酸カルシウム、例えばEmcompress;マンニトール;デンプン;ソルビトール;フルクトース;スクロース;およびグルコースを含む。希釈剤は、好ましくは原薬-含有コーティングの0.1重量%〜90重量%の用量で、より具体的には50重量%の用量で含む。
適切な結合剤は、ポリエチレングリコール、例えばPEG 6000;セトステアリルアルコール;セチルアルコール;ポリオキシエチレンアルキルエーテル;ポリオキシエチレンヒマシ油誘導体;ポリオキシエチレンソルビタン脂肪酸エステル;ステアリン酸ポリオキシエチレン;ポロキサマー;蝋、アルギン酸およびそれらの塩類;HPC;HPMC;メチルセルロース;マルトデキストリンおよびデキストリン;ポビドン;増粘剤;デンプンおよび加工デンプン類を含む。結合剤は、好ましくは、原薬-含有コーティングの2〜10重量%、より具体的には5重量%で用いられる。
適切な崩壊剤は、デンプングリコール酸ナトリウム、例えば、Explotab(RTM)、クロスポビドン、例えばKollidon CL、ポリプラスドンXL、カルボキシメチルセルロースナトリウム、クロスカルメロースナトリウム、例えば、AcDiSolおよびデンプンを含む。崩壊剤は、好ましくは、原薬-含有コーティングの2〜10重量%、より具体的には5重量%で用いられる。
用語「放出速度制御剤」は、慣例の即時放出製剤では可能でなかった治療効果を得るため、期間または位置の観点で、成分の放出速度を制御するあらゆる薬剤を含み、それには、親水性ポリマー、疎水性ポリマーまたはそれらの混合物、またはそれらのコポリマー、またはこれらのポリマーおよびコポリマーの混合物を含む。
放出速度制御剤は、好ましくは、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、ポリ(エチレンオキシド)、エチルセルロースまたはそれらの組合せであり、好ましくは原薬-含有コーティングの10〜90重量%で用いられる。
本発明において用いられるためのHPMCの好ましい型は、Methocel(Dow Chemical Co.)の商標で販売されているものである。適切なMethocelsは、Kグレード、例えばMethocel Kl 5M、Methocel Kl00M、Methocel Kl00LVおよびMethocel K4Mを含む。他の適切なMethocelsは、E、FおよびJグレードを含む。
ポリ(エチレンオキシド)としては、商標Sentry Polyox(Union Carbide Corp.)または等価体として販売されているものが挙げられる。適切なPolyoxsは、Polyox WSRグレード、例えば、Polyox WSR Coagulant、Polyox WSR-301、Polyox WSR-303、Polyox WSR N-12K、Polyox WSR N-60K、Polyox WSR-1105、Polyox WSR-205およびPolyox WSR N-3000を含む。
本発明の使用のためのエチルセルロースは、商標Ethocel(Dow Chemical Co.)または等価体、例えばSurelease (Colorcon)で販売されているものが挙げられる。
ポリエチレンオキシドグレードは、好ましくは平均分子量約100,000〜7,000,000、より好ましくは900,000〜7,000,000である。特に適切なものはPolyox WSR Coagulantであり、これは分子量5,000,000を有する。本発明のエチルセルロースグレードは、好ましくは、約3〜110cps、より好ましくは7〜100cpsの粘度を有する。
原薬-含有コーティングは、剤形の外部表面に直接適用されうる。しかし、本発明においては、原薬-含有コーティングを適用する前に、プレコーティングを施してもよい。プレコーティングは、剤形の物理的安定性を増加させるために適用される。カプセル形態の剤形の場合、プレコーティングは、カプセルに強度を与え、密封し、充填空間からの成分の漏出を妨げ、またはカプセルを胃の内容物から保護するために加えられる。
腸溶性コーティングは、当該分野で知られている。腸溶性コーティングは、pHが5より大きい水性媒体には溶解するが、pHが約5以下の水性媒体には溶解しないフィルム形成ポリマーを含む。腸溶性ポリマーの例には、セルロース誘導体、アクリル性コポリマー、マレインコポリマー、ポリビニル誘導体、セラックなどを含む。
特定のセルロース誘導体の例には、例えば、ヒドロキシプロピルメチルセルロースアセテートスクシネート、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシメチルエチルセルロースフタレート、セルロースアセテートフタレート、セルロースアセテートスクシネート、セルロースアセテートマリエート、セルロースベンゾエートフタレート、セルロースプロピオネートフタレート、メチルセルロースフタレート、カルボキシメチルエチルセルロース、エチルヒドロキシエチルセルロースフタレートなどを含む。その中では、ヒドロキシプロピルメチルセルロースアセテートスクシネート、ヒドロキシプロピルメチルセルロースフタレートおよびカルボキシメチルエチルセルロースが、好ましい。さらに、ヒドロキシプロピルメチルセルロースアセテートスクシネートが好ましい。
マレインコポリマーの特定の例は、例えば、ビニルアセテート-マレイン酸無水物コポリマー、スチレン-マレイン酸無水物コポリマー、スチレン-マレイン酸モノエステルコポリマー、ビニルメチルエーテル-マレイン酸無水物コポリマー、エチレン-マレイン酸無水物コポリマー、ビニルブチルエーテル-マレイン酸無水物コポリマー、アクリロニトリル-メチルアクリレート-マレイン酸無水物コポリマー、ブチルアクリレート-スチレン-マレイン酸無水物コポリマーなどがある。
プレコーティングは、追加として、原薬-含有コーティングと関連したいかなる賦形剤またはアジュバントを、いかなる用量で含有してもよい。
剤形がカプセルとして提供されるとき、腸溶性または部分的にまたは完全に不溶性のプレコーティングを使用する代わりに、カプセル自体が腸溶性または部分的または完全に不溶性の特性を与えられうる。換言すると、カプセルそれ自体が不浸透性、実質的に不溶性または胃腸管分泌に抵抗性を有することになる。腸溶性または不溶性の特性を有するカプセルは、当該分野に知られている。カプセル、例えば、ゼラチンカプセルは、ゼラチンのアミノ酸鎖を架橋することにより、カプセル壁の溶解性を減ずるためのホルムアルデヒドまたはグルタルアルデヒドで処置することにより、不溶性特性を形成できる。あるいは、カプセル壁素材が、完全にまたは部分的に腸溶性特性を有する素材で形成されていることである。腸溶性カプセルの調製においては、上述した腸溶性コーティングの調製に有用ないかなるカプセル形成材または腸溶性材をも用いることができる。
原薬-含有コーティングは、トップコーティングでオーバーコーティングしうる。トップコーティングは、美的効果を達成するため(例えば、魅力的な色または心地よい味)または情報効果、例えば、コーティングは患者が正しい医薬を特定するための視覚的な指示として働く。また、トップコーティングは、用量に関連した情報を上書きするため、または、機能的な効果、例えば嚥下の容易性のための滑らかなコーティングのような取り扱い効果を発揮しうるか、または安定化効果、例えば保存における湿度または光に対するバリアとなりうる。
コーティング層の重量は、剤形の総重量に基づき約3%〜約95%でありうる。
コーティングは、薬学的技術においてコーティングに慣用されている技術により適用される。
本発明の特定の態様としては、本発明の剤形は、フィルムコーティング技術を用いてコーティングされうる。フィルムコーティング技術は、電気メッキ、パンコーティングまたは流動床乾燥コーティングを含む。側方通気型のコーティング用平皿におけるフィルムコーティングが、本発明の好ましいコーティング方法である。
フィルムコーティングは、有機-溶媒に基づいたまたは水に基づいた溶液からの剤形への薄いフィルムの堆積である。フィルムコーティングは、上述したポリマーおよび他の賦形剤またはアジュバントの溶液または懸濁液でありうる。コーティング分散体の調製に用いられる溶媒は、フィルムコーティング薬学的剤形において知られるいかなるものであってもよく、水、エタノール、メタノール、プロパン-2-オール、アセトン、酢酸エチル、酢酸、グリコール、ジクロロメタン、ジメチルホルムアミド、ジメチルスルホキシド、クロロホルム、トルエン、塩化メチレン、ベンゼン、エトキシ酢酸エチル、エチレングリコールモノアセテート、エチルラクテート、モノ酢酸エチル、メチルエチルケトンおよびそれらの組合せを含む。上述した溶媒の中では、用いる溶媒は、それぞれのコーティング層の特性に応じて選択でき、適切にそれらを混合して用いることができる。
フィルムコーティング製剤の主成分は、ポリマー、可塑剤、着色剤、および溶媒を含むがこれに限定されない。理想的には、ポリマーは、広い範囲の溶媒系に可溶性であり、良好な機械的安定性でコーティングを生成する。適切なポリマーは、セルロースエーテル、特にヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、メチルセルロース、カルボキシメチルセルロースナトリウム、およびアクリル体、例えば、メタクリレートまたはメチルメタクリレートコポリマーを含むがこれに限定されない。ある態様においては、コーティング溶液に用いられるポリマーは、カルボキシメチルセルロースナトリウムである。ある態様においては、コーティング溶液において用いられるポリマーはアルギン酸ナトリウムである。ある態様においては、コーティング溶液において用いられるポリマーは、カルボキシメチルセルロースナトリウムおよびアルギン酸ナトリウムの混合物である。
適切なコーティング工程には、Remington:The Science and Practice of Pharmacy、Lippincott Williams & Wilkins、21st ed.(2005) (「Remington's」)に記載されたコーティングパンおよび流動床装置を含む。ある態様としては、コーティング溶液がスプレーコーティング技術を用いてカプセルに適用される。Remington'sに記載されているように、フィルムコーティングに、非空気または空気スプレーコーティング技術を用いることができる。スプレーコーティング技術を用いることにより、カプセル表面に配置するコーティング溶液の細かい霧状液滴が可能となる。これらの技術は、カプセルが互いに接着することなく、カプセルの均一な被覆を保証するので市販製品に理想的である。
ある態様においては、側方通気型のコーティング用平皿は、スプレーコーティング技術により、コーティング溶液の適用に用いられる。適切な側方通気型のコーティング用平皿は、the Accela-Cota (Thomas Engineering、Hoffman Estates、Ill.)、the Fast Coater
(O'Hara Manufacturing Ltd.、Toronto Canada)、the Hi-Coater (Vector Corp.、Marion、Iowa)、the Driacoater (Driam Metallprodukt、GmbH、Eriskirch、Germany)、およびthe Pro Coater (Glatt Air Techniques、Ramsey、N.J.)を含む。
充填は、薬学的用途のための充填カプセルとして当業者に知られた手段で行われる。例えば、カプセルは、空のカプセルに重量剤、内部カプセルまたは他の充填されるべき物質を加えるためのドーサター(dosator)を装着した、間欠的または連続的なカプセル充填機を用いて充填される。カプセル充填装置の例は、ボローニャのIMA社のthe Zanazi 40およびボローニャのMG2社のMGモデルFuturaレベル02がある。本発明の剤形のカプセル中カプセル形態は、手動機械Zuma150型または300型およびParke-Davis/Capsugel型を用いて実現できる。
密封手段に用いられる密封剤は、本体およびキャップを滑らかにするカプセル表面を作ることのできる物質である。密封剤の例は、例えば、水-可溶性ポリマー、水-不溶性ポリマー、低pH-可溶性ポリマー、腸溶性ポリマー、サッカライド、低分子量電解質などがある。
密封剤として用いる水-可溶性ポリマーとしては、中間層として用いられる水溶性ポリマーが用いられる。水-可溶性ポリマーの例としては、例えば、水-可溶性多糖エーテル、例えばメチルセルロース、ヒドロキシプロピルセルロースまたはヒドロキシプロピルメチルセルロース;水-可溶性ポリビニル誘導体、例えば、ポリビニルピロリドンまたはポリビニルアルコール;多糖、例えば、プルラン;ポリエチレングリコール;などがある。
密封剤として単糖および低分子量電解質を用いる場合、中間層として用いることのできるサッカライドおよび低分子量電解質が存在してもよい。サッカライドの例は、例えば、モノサッカライド、例えば、グルコース、ジサッカライド、例えば、スクロースなどがあり、および低分子量電解質は、例えば、無機塩類、例えば塩化ナトリウムなどがある。
上述の密封剤は、単独でまたはそれらの混合物として用いることができる。
[本発明1001]
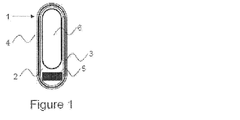
一端が他端より重いように加重された、2つの対面する末端を有する概ね円筒形状を有し、胃液中で浮遊性である、細長い剤形。
[本発明1002]
水性液体に置くと、相対的に重い端が液体内で概ね下向きに、相対的に軽い端が概ね上向きに液の表面から外に出て、液体に浮かぶように水性液体で自己配向性である剤形である、本発明1001の剤形。
[本発明1003]
最長の長さが少なくとも12mmの長さを有する、本発明1001または本発明1002の剤形。
[本発明1004]
中空カプセルの形態である、本発明1001〜1003のいずれかの剤形。
[本発明1005]
中空カプセルが充填容積を含み、その中に、該充填容積の一端に維持される重量剤を含み、該重量剤が維持されている端を他端より重くする、本発明1004の剤形。
[本発明1006]
重量剤が錠剤の形態である本発明1005の剤形。
[本発明1007]
重量剤が硫酸バリウム、二塩基性リン酸カルシウム、酸化鉄、鉄、二酸化チタン、高密度炭酸カルシウムおよびリン酸カルシウムからなる群から選択される成分を含む、本発明1005または本発明1006の剤形。
[本発明1008]
中空カプセルよりも小さい第二のカプセルが中空カプセルの充填容積に配置され、第二のカプセルの寸法が、重量剤を入れ、それを中空カプセルの一端に保つ空間を中空カプセルの充填容積に残す、本発明1005ないし1007のいずれかの剤形。
[本発明1009]
重量剤の周りに形成された蝋状物質の詰め物による手段により重量剤が中空カプセルの一端に保持される、本発明1005ないし1007のいずれかの剤形。
[本発明1010]
蝋状物質が、それが固化したときに重量剤を中空カプセルの一端に保持するように重量剤の周りに注ぐことができる低融点を有する物質である、本発明1009の剤形。
[本発明1011]
蝋状物質がマクロゴールまたは天然もしくは半合成脂質蝋である、本発明1009または本発明1010の剤形。
[本発明1012]
蝋が37℃より高い融点を有する親油性低HLB蝋である、本発明1009ないし本発明1011のいずれかの剤形。
[本発明1013]
剤形が原薬を含むコーティング物質でコーティングされている、本発明1001〜1012のいずれかの剤形。
直径5.75mmを有する硫酸バリウム100mg錠剤を、まず硫酸バリウムをProsolv(シリカ状微結晶セルロース)と混合し、続いてステアリン酸マグネシウムを加えることにより調製する。最後に混合物を5.75mm直径押し機を用いて打錠する。
続いて、1個のカプセルにつき1個の硫酸バリウム錠剤を、サイズ1ゼラチンカプセルに入れ、サイズ1ゼラチンカプセルを閉じる前にサイズ3ゼラチンカプセルを加える。続いてサイズ1カプセルを、60℃で、ゼラチンの水溶液(20&W/W)を用いてQuali-密封装置で密封する(約5mgのゼラチン乾燥物質を適用する)。
側方通気型パンコーターで、オイドラギットRS30D、クエン酸トリエチル(TEC)およびタルクを含有する水溶液の第1層が充填サイズ1カプセルに適用する。カプセルに適用される乾燥物質は、オイドラギットR30D16.8mg、TEC3.3mgおよびタルク8.4mgである。この層により、カプセルは24時間まで水密性となる。
続いて第2層を、サイズ1カプセルにつきロピニロールHCl 75mgを得るのに十分な、ロピニロール塩酸塩の水溶液をスプレーすることにより適用する。
オイドラギットRS30D(懸濁液として) 23.91%
オイドラギットRL30D(懸濁液として) 5.98%
TEC 1.79%
タルク 4.48%
ロピニロールHCl 8.54%
純水 QS100%
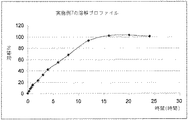
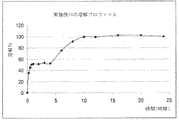
実施例1のカプセルを、USP溶解装置2において100rpmで、酢酸塩緩衝液900ml(pH4.5)において試験する。
溶解プロファイルを図4に示す。
実施例1の剤形は、24時間より長く浮遊性である。
実施例1のカプセルを、さらに重量22.5mgのポリマー層でコーティングする。
実施例1のカプセルにスプレーされる溶液は、以下の組成を有する:
オイドラギットRS30D(懸濁液として) 31.38%
オイドラギットRL30D(懸濁液として) 7.84%
TEC 2.35%
タルク 5.88%
純水 QS100%
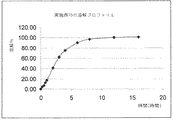
実施例3のカプセルを、USP溶解装置2において100rpmで、酢酸塩緩衝液900ml(pH4.5)において試験する。
溶解プロファイルを図5に示す。
実施例3のカプセルは24時間より長く浮遊性である。
実施例1のカプセルを、さらに重量43mgのポリマー層でコーティングする。
実施例1のカプセルにスプレーされる溶液は、以下の組成を有する:
オイドラギットRS30D(懸濁液として) 31.38%
オイドラギットRL30D(懸濁液として) 7.84%
TEC 2.35%
タルク 5.88%
純水 QS100%
実施例5のカプセルを、USP溶解装置2において100rpmで、酢酸塩緩衝液900 ml(pH 4.5)において試験する。
溶解プロファイルを図6に示す。
実施例5のカプセルは24時間より長く浮遊性である。
直径5.75mmを有する硫酸バリウム100mg錠剤を、上の実施例1に記載した方法で調製する。続いて、1つのカプセルにつき1つの硫酸バリウム錠剤を、サイズ1ゼラチンカプセルに入れる。サイズ1ゼラチンカプセルを閉じる前にサイズ3ゼラチンカプセルを加える。続いてサイズ1カプセルを、60℃でゼラチンの水溶液(20&W/W)を用いてQuali-密封装置で密封する(約5mgのゼラチン乾燥物質を適用する)。
側方通気型パンコーターで、オイドラギットRS30D、クエン酸トリエチル(TEC)およびタルクを含有する水溶液の第1層を充填サイズ1カプセルに適用する。カプセルに適用される乾燥物質は、オイドラギットR30D16.8mg、TEC3.3mgおよびタルク8.4mgである。この層により、カプセルは24時間まで水密性となる。
続いて第2相を、サイズ1カプセルにつきフェノフィブラート145mgを得るのに十分な、フェノフィブラートの水溶液をスプレーすることにより適用する。
フェノフィブラートの水溶液の組成は、以下のとおりである:
オイドラギットRS30D(懸濁液として) 23.91%
オイドラギットRL30D(懸濁液として) 5.98%
TEC 1.79%
タルク 4.48%
Vit E TPGS 0.9%
フェノフィブラート 16.8%
純水 QS100%
実施例7のカプセルを、USP溶解装置2において100rpmで、1%SLS溶液900ml(pH4.5)において試験する。
溶解プロファイルを図7に示す。
実施例7のカプセルは、24時間より長く浮遊性である。
直径5.75mmを有する硫酸バリウム100mg錠剤を、上の実施例1に実質的に記載した方法で調製する。続いて、1つのカプセルにつき1つの硫酸バリウム錠剤を、サイズ1ゼラチンカプセルに入れ、サイズ1ゼラチンカプセルを閉じる前に、冷やす前に、溶解水素化ヒマシ油を硫酸バリウム錠剤に注ぐ。
続いてサイズ1カプセルを、60℃でゼラチンの水溶液(20&W/W)を用いてQuali-密封装置で密封する(約5mgのゼラチン乾燥物質を適用する)。
側方通気型パンコーターで、オイドラギットRS30D、クエン酸トリエチル(TEC)およびタルクを含有する水溶液の第1層を充填サイズ1カプセルに適用する。カプセルに適用される乾燥物質は、オイドラギットR30D16.8mg、TEC3.3mgおよびタルク8.4mgである。この層により、カプセルは24時間まで水密性となる。
続いて第2層を、サイズ1カプセルにつきロピニロールHCl75mgを得るのに十分な、ロピニロール塩酸塩の水溶液をスプレーすることにより適用する。
ロピニロールHClの水溶液の組成は、以下のとおりである:
オイドラギットRS30D(懸濁液として) 23.91%
オイドラギットRL30D(懸濁液として) 5.98%
TEC 1.79%
タルク 4.48%
ロピニロールHCl 8.54%
純水 QS100%
実施例9のカプセルを、SP溶解装置2において100rpmで、酢酸塩緩衝液900ml(pH4.5)において試験する。
溶解プロファイルを図8に示す。
実施例8のカプセルは、24時間より長く浮遊性である。
実施例3のカプセルを、ロピニロールHCl 50mgを適用するため、さらにロピニロールHCl溶液でコーティングする。
ロピニロールHCl溶液の製剤は以下のとおりである:
ロピニロールHCl 12%
オパドライII 12%
純水 QS100%
実施例11のカプセルを、USP溶解装置2において100rpmで、酢酸塩緩衝液900ml(pH4.5)において試験する。
溶解プロファイルを図9に示す。
実施例11のカプセルは、24時間より長く浮遊性である。
(二重パルス放出カプセル)
実施例1の側方通気型パンコーターカプセルを、さらに水性/エタノール性溶液(85%アルコールV/V)で、ヒドロキシプロピル(25%)およびヒドロキシメチルプロピル(4%)セルロース分散体でコーティングする。その後、水性/エタノール性溶液(85%エタノールV/V)中のロピニロールHCl(15%)分散体を75mg重量のロピニロールHCl/カプセルが得られるまでスプレーする。
実施例13のカプセルを、USP溶解装置2において100rpmで、酢酸塩緩衝液900ml(pH4.5)において試験する。
実施例13のカプセルは、24時間より長く浮遊性である。
直径5.75mmを有する硫酸バリウム100mg錠剤を、まず硫酸バリウムをProsolv(シリカ状微結晶セルロース)と混合し、続いてステアリン酸マグネシウムを加えることにより調製する。最後に混合物を5.75mm直径押し機を用いて打錠する。
続いて、1つのカプセルにつき1つの硫酸バリウム錠剤を、サイズ1ゼラチンカプセルに入れ、サイズ1ゼラチンカプセルを閉じる前にサイズ3ゼラチンカプセルを加える。続いてサイズ1カプセルを、60℃でゼラチンの水溶液(20&W/W)を用いてQuali-密封装置で密封する(約5mgのゼラチン乾燥物質を適用する)。
側方通気型パンコーターで、オイドラギットRS30D、クエン酸トリエチル(TEC)およびタルクを含有する水溶液の第1層を充填サイズ1カプセルに適用する。カプセルに適用される乾燥物質は、オイドラギットR30D16.8mg、TEC3.3mgおよびタルク8.4mgである。この層により、カプセルは24時間まで水密性となる。
続いて第2相を、サイズ1カプセルにつきイロペリドン24mgを得るのに十分な、ロピニロール塩酸塩の水溶液をスプレーすることにより適用する。
オイドラギットRS30D(懸濁液として) 23.91%
オイドラギットRS30D(懸濁液として) 5.98%
TEC 1.79%
タルク 4.48%
フマル酸 6.32%
イロペリドン 6.32%
純水 QS100%
オイドラギットRS30D(懸濁液として) 31.38%
オイドラギットRL30D(懸濁液として) 7.84%
TEC 2.35%
タルク 5.88%
純水 QS100%
実施例15のカプセルを、USP溶解装置2において100rpmで、クエン酸緩衝液900ml(pH4.5)において試験する。
溶解プロファイルを図11に示す。
実施例15の発明は、24時間より長い間、浮遊性である。
Claims (13)
- 一端が他端より重いように加重された、一般的に2つの対面する末端を有する円筒形状を有し、胃液中で浮遊性である、細長い投与形態。
- 水性液体に置くと、相対的に重い端が一般に液体内で下に向きに、相対的に軽い端が上向きに液の表面から外に出て、液体に浮かぶように水性液体で自己配向性である投与形態である、請求項1に記載の投与形態。
- 最長の長さが少なくとも12mmの長さを有する、請求項1または請求項2に記載の投与形態。
- 中空カプセルの形態である、請求項1〜3のいずれかに記載の投与形態。
- 中空カプセルが充填容積を含み、その中に、該充填容積の一端に維持される重量剤を含み、該重量剤が維持されている端を他端より重くする、請求項4に記載の投与形態。
- 重量剤が錠剤の形態である請求項5に記載の投与形態。
- 重量剤が硫酸バリウム、二塩基性リン酸カルシウム、酸化鉄、鉄、二酸化チタン、高密度炭酸カルシウムおよびリン酸カルシウムからなる群から選択される成分を含む、請求項5または請求項6に記載の投与形態。
- 中空カプセルよりも小さい第二のカプセルが中空カプセルの充填容積に配置され、第二のカプセルの寸法が、重量剤を入れ、それを中空カプセルの一端に保つ空間を中空カプセルの充填容積に残す、請求項5ないし7のいずれかに記載の投与形態。
- 重量剤の周りに形成された蝋状物質の詰め物による手段により重量剤が中空カプセルの一端に保持される、請求項5ないし7のいずれかに記載の投与形態。
- 蝋状物質が固化したときに重量剤を中空カプセルの一端に保持するように重量剤の周りに注ぐことができる低融点を有する物質である、請求項9に記載の投与形態。
- 蝋状物質がマクロゴールまたは天然または半合成脂質蝋である、請求項9または請求項10に記載の投与形態。
- 蝋が37℃より高い融点を有する親油性低HLB蝋である、請求項9ないし請求項11のいずれかに記載の投与形態。
- 投与形態が原体を含むコーティング物質でコーティングされている、請求項1〜12のいずれかに記載の投与形態。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB1011271.2 | 2010-07-05 | ||
| GBGB1011271.2A GB201011271D0 (en) | 2010-07-05 | 2010-07-05 | Dosage Form |
| GB1018917.3 | 2010-11-09 | ||
| GBGB1018917.3A GB201018917D0 (en) | 2010-11-09 | 2010-11-09 | Dosage form |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013517345A Division JP6019019B2 (ja) | 2010-07-05 | 2011-07-04 | 剤形 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017014257A true JP2017014257A (ja) | 2017-01-19 |
| JP6360525B2 JP6360525B2 (ja) | 2018-07-18 |
Family
ID=45440785
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013517345A Active JP6019019B2 (ja) | 2010-07-05 | 2011-07-04 | 剤形 |
| JP2016159825A Active JP6360525B2 (ja) | 2010-07-05 | 2016-08-17 | 剤形 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013517345A Active JP6019019B2 (ja) | 2010-07-05 | 2011-07-04 | 剤形 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US9314430B2 (ja) |
| EP (1) | EP2590633B1 (ja) |
| JP (2) | JP6019019B2 (ja) |
| CN (2) | CN103037850A (ja) |
| AU (1) | AU2011275881B2 (ja) |
| CA (1) | CA2803064C (ja) |
| ES (1) | ES2651743T3 (ja) |
| WO (1) | WO2012004231A1 (ja) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2590633B1 (en) * | 2010-07-05 | 2017-10-11 | Jagotec AG | Dosage form |
| CN103637999B (zh) * | 2013-12-12 | 2014-12-03 | 南通联亚药业有限公司 | 一种多层固体药物剂型 |
| EP3943076A3 (en) * | 2014-12-17 | 2022-04-13 | Empros Pharma AB | A modified release composition of orlistat and acarbose for the treatment of obesity and related metabolic disorders |
| US9907325B2 (en) | 2015-03-06 | 2018-03-06 | Kraft Foods Group Brands Llc | Encapsulated weighting agents for beverage emulsions |
| CN104706613B (zh) * | 2015-03-20 | 2018-01-16 | 华侨大学 | 一种胃漂浮空心缓释片的制备方法 |
| JP2018154807A (ja) * | 2017-03-08 | 2018-10-04 | 株式会社ダイセル | セルロース混合エステルとその成形体 |
| IL270449B2 (en) * | 2017-05-17 | 2025-02-01 | Massachusetts Inst Technology | Self-healing systems, methods, and related components |
| US11541015B2 (en) | 2017-05-17 | 2023-01-03 | Massachusetts Institute Of Technology | Self-righting systems, methods, and related components |
| CA3100710A1 (en) | 2018-05-17 | 2019-11-21 | Massachusetts Institute Of Technology | Systems for electrical stimulation |
| CN113993560B (zh) | 2019-02-01 | 2024-05-07 | 麻省理工学院 | 用于液体注射的系统和方法 |
| EP3968980A1 (en) | 2019-05-14 | 2022-03-23 | Clexio Biosciences Ltd. | Treatment of nocturnal symptoms and morning akinesia in subjects with parkinson's disease |
| US11541216B2 (en) | 2019-11-21 | 2023-01-03 | Massachusetts Institute Of Technology | Methods for manufacturing tissue interfacing components |
| WO2021176360A1 (en) * | 2020-03-02 | 2021-09-10 | Craft Health Pte Ltd | Oral dosage forms for extended drug release |
| WO2022195476A1 (en) | 2021-03-15 | 2022-09-22 | Clexio Biosciences Ltd. | Gastroretentive devices for assessment of intragastric conditions |
| WO2024061971A1 (en) | 2022-09-21 | 2024-03-28 | Wista Laboratories Ltd. | Novel formulations and vehicles |
| JP2025536556A (ja) | 2022-10-25 | 2025-11-07 | ヴェラダーミクス インコーポレイテッド | 放出調節ミノキシジル用組成物および使用方法 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5512411B2 (ja) * | 1974-03-12 | 1980-04-02 | ||
| JPS6322014A (ja) * | 1986-03-07 | 1988-01-29 | Shionogi & Co Ltd | 胃内浮遊性持続型カプセル剤 |
| JP2001514211A (ja) * | 1997-09-04 | 2001-09-11 | アール、ピー、シャーラー コーポレイション | 放出を制御されるカプセル、該カプセルを有する微生物の培養および検出用テストキット |
| WO2005048947A2 (en) * | 2003-11-18 | 2005-06-02 | John Cooker | Oral delivery system and method for making same |
| WO2010020098A1 (zh) * | 2008-08-18 | 2010-02-25 | 北京天衡药物研究院 | 胃滞留药物释出系统及其制备方法和用途 |
| JP6019019B2 (ja) * | 2010-07-05 | 2016-11-02 | ヤゴテック アーゲー | 剤形 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4055178A (en) * | 1976-03-10 | 1977-10-25 | Harrigan Roy Major | Drug delivery device for preventing contact of undissolved drug with the stomach lining |
| US5417682A (en) * | 1991-01-30 | 1995-05-23 | Alza Corporation | Device for administering active agent to biological environment |
| US5198229A (en) * | 1991-06-05 | 1993-03-30 | Alza Corporation | Self-retaining gastrointestinal delivery device |
| US6488962B1 (en) * | 2000-06-20 | 2002-12-03 | Depomed, Inc. | Tablet shapes to enhance gastric retention of swellable controlled-release oral dosage forms |
| US20030194428A1 (en) | 2002-04-10 | 2003-10-16 | Miller Frederick H. | Process for encapsulating multi-phase, multi-compartment capsules |
| WO2004056336A2 (en) * | 2002-12-20 | 2004-07-08 | Ranbaxy Laboratories Limited | Controlled release, multiple unit drug delivery systems |
| US8563491B2 (en) * | 2005-03-04 | 2013-10-22 | The Procter & Gamble Company | Methods of cleansing skin and rinse-off or wipe-off compositions therefor |
| KR101861307B1 (ko) * | 2011-10-13 | 2018-07-06 | 한미약품 주식회사 | 정제를 포함하는 경질 캡슐 복합 제형 |
-
2011
- 2011-07-04 EP EP11729628.5A patent/EP2590633B1/en active Active
- 2011-07-04 AU AU2011275881A patent/AU2011275881B2/en active Active
- 2011-07-04 CN CN2011800331206A patent/CN103037850A/zh active Pending
- 2011-07-04 US US13/704,760 patent/US9314430B2/en active Active
- 2011-07-04 CA CA2803064A patent/CA2803064C/en active Active
- 2011-07-04 JP JP2013517345A patent/JP6019019B2/ja active Active
- 2011-07-04 WO PCT/EP2011/061257 patent/WO2012004231A1/en not_active Ceased
- 2011-07-04 CN CN201610191491.1A patent/CN105726460A/zh active Pending
- 2011-07-04 ES ES11729628.5T patent/ES2651743T3/es active Active
-
2016
- 2016-03-17 US US15/072,938 patent/US10076500B2/en active Active
- 2016-08-17 JP JP2016159825A patent/JP6360525B2/ja active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5512411B2 (ja) * | 1974-03-12 | 1980-04-02 | ||
| JPS6322014A (ja) * | 1986-03-07 | 1988-01-29 | Shionogi & Co Ltd | 胃内浮遊性持続型カプセル剤 |
| JP2001514211A (ja) * | 1997-09-04 | 2001-09-11 | アール、ピー、シャーラー コーポレイション | 放出を制御されるカプセル、該カプセルを有する微生物の培養および検出用テストキット |
| WO2005048947A2 (en) * | 2003-11-18 | 2005-06-02 | John Cooker | Oral delivery system and method for making same |
| WO2010020098A1 (zh) * | 2008-08-18 | 2010-02-25 | 北京天衡药物研究院 | 胃滞留药物释出系统及其制备方法和用途 |
| JP6019019B2 (ja) * | 2010-07-05 | 2016-11-02 | ヤゴテック アーゲー | 剤形 |
Also Published As
| Publication number | Publication date |
|---|---|
| US10076500B2 (en) | 2018-09-18 |
| CN103037850A (zh) | 2013-04-10 |
| CA2803064A1 (en) | 2012-01-12 |
| AU2011275881A1 (en) | 2013-02-07 |
| CA2803064C (en) | 2017-12-19 |
| AU2011275881B2 (en) | 2014-11-06 |
| EP2590633A1 (en) | 2013-05-15 |
| US9314430B2 (en) | 2016-04-19 |
| JP6360525B2 (ja) | 2018-07-18 |
| US20160263045A1 (en) | 2016-09-15 |
| JP6019019B2 (ja) | 2016-11-02 |
| CN105726460A (zh) | 2016-07-06 |
| US20130108695A1 (en) | 2013-05-02 |
| EP2590633B1 (en) | 2017-10-11 |
| WO2012004231A1 (en) | 2012-01-12 |
| JP2013530200A (ja) | 2013-07-25 |
| ES2651743T3 (es) | 2018-01-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6360525B2 (ja) | 剤形 | |
| JP2013530200A5 (ja) | ||
| JP3955320B2 (ja) | バンド付き持続放出活性剤投与形 | |
| KR100618234B1 (ko) | 다공성 입자를 포함하는 제형 | |
| AU736951C (en) | Biphasic controlled release delivery system for high solubility pharmaceuticals and method | |
| KR101660927B1 (ko) | 약염기성 약물 및 유기산을 포함하는 약물 전달 시스템 | |
| US20160038411A1 (en) | Pulsatile gastric retentive dosage forms | |
| EP0671167A1 (en) | Pharmaceutical preparation controlled to release medicinal active ingredient at targeted site in intestinal tract | |
| EP1455751A1 (en) | Zero-order sustained released dosage forms and method of making the same | |
| JP2001527023A (ja) | 胃で保持するのに適合した長期放出性活性剤剤形 | |
| EP2510923A1 (en) | Coating composition, solid preparation coated therewith, and method for preparing solid preparation | |
| WO1994004135A1 (fr) | Preparation administree par voie orale et destinee a etre liberee dans le tube digestif inferieur | |
| KR20110130441A (ko) | 고형 제제 | |
| TWI441659B (zh) | Oral administration | |
| JPS63101332A (ja) | 経口投与用徐放性製剤 | |
| KR20120006983A (ko) | 고형 제제 | |
| HK1186095A (en) | Dosage form | |
| HK1186095B (en) | Dosage form | |
| KR100428273B1 (ko) | 약물전달의지연된활성화및완전한약물방출기능을갖는삼투장치 | |
| JP5386149B2 (ja) | 経口投与剤 | |
| CN118019524A (zh) | 地屈孕酮缓释药物组合物 | |
| WO2007010846A1 (ja) | 胃内滞留製剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170719 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171018 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A132 Effective date: 20171220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180316 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180607 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180622 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6360525 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |