JP2015505359A - 乳がん検出のための吸収紙及びその使用 - Google Patents
乳がん検出のための吸収紙及びその使用 Download PDFInfo
- Publication number
- JP2015505359A JP2015505359A JP2014538957A JP2014538957A JP2015505359A JP 2015505359 A JP2015505359 A JP 2015505359A JP 2014538957 A JP2014538957 A JP 2014538957A JP 2014538957 A JP2014538957 A JP 2014538957A JP 2015505359 A JP2015505359 A JP 2015505359A
- Authority
- JP
- Japan
- Prior art keywords
- absorbent paper
- nipple aspirate
- cells
- sample
- aspirate fluid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000002250 absorbent Substances 0.000 title claims abstract description 153
- 230000002745 absorbent Effects 0.000 title claims abstract description 153
- 206010006187 Breast cancer Diseases 0.000 title claims description 89
- 208000026310 Breast neoplasm Diseases 0.000 title claims description 89
- 238000001514 detection method Methods 0.000 title description 3
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 129
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 129
- 238000000034 method Methods 0.000 claims abstract description 127
- 210000000481 breast Anatomy 0.000 claims abstract description 100
- 239000012472 biological sample Substances 0.000 claims abstract description 9
- 239000000523 sample Substances 0.000 claims description 142
- 210000000019 nipple aspirate fluid Anatomy 0.000 claims description 107
- 238000012545 processing Methods 0.000 claims description 61
- 238000004590 computer program Methods 0.000 claims description 55
- 210000002445 nipple Anatomy 0.000 claims description 55
- 238000005070 sampling Methods 0.000 claims description 35
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 claims description 31
- 229920002678 cellulose Polymers 0.000 claims description 29
- 239000000020 Nitrocellulose Substances 0.000 claims description 28
- 229920001220 nitrocellulos Polymers 0.000 claims description 28
- 239000002923 metal particle Substances 0.000 claims description 24
- 238000003860 storage Methods 0.000 claims description 21
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 claims description 20
- 238000004458 analytical method Methods 0.000 claims description 18
- 229910052751 metal Inorganic materials 0.000 claims description 17
- 239000002184 metal Substances 0.000 claims description 16
- 238000010186 staining Methods 0.000 claims description 13
- 239000000725 suspension Substances 0.000 claims description 12
- 238000005406 washing Methods 0.000 claims description 12
- 239000000203 mixture Substances 0.000 claims description 11
- 230000036541 health Effects 0.000 claims description 10
- 238000003745 diagnosis Methods 0.000 claims description 7
- 238000011269 treatment regimen Methods 0.000 claims description 7
- 239000012530 fluid Substances 0.000 abstract description 57
- 239000012528 membrane Substances 0.000 abstract description 43
- 206010028980 Neoplasm Diseases 0.000 abstract description 9
- 201000011510 cancer Diseases 0.000 abstract description 9
- 238000011161 development Methods 0.000 abstract description 6
- 102000003886 Glycoproteins Human genes 0.000 abstract description 3
- 108090000288 Glycoproteins Proteins 0.000 abstract description 3
- 102400000050 Oxytocin Human genes 0.000 abstract description 2
- XNOPRXBHLZRZKH-UHFFFAOYSA-N Oxytocin Natural products N1C(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CC(C)C)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C(C(C)CC)NC(=O)C1CC1=CC=C(O)C=C1 XNOPRXBHLZRZKH-UHFFFAOYSA-N 0.000 abstract description 2
- 101800000989 Oxytocin Proteins 0.000 abstract description 2
- 230000001413 cellular effect Effects 0.000 abstract description 2
- 239000002773 nucleotide Substances 0.000 abstract description 2
- 125000003729 nucleotide group Chemical group 0.000 abstract description 2
- XNOPRXBHLZRZKH-DSZYJQQASA-N oxytocin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@H](N)C(=O)N1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)NCC(N)=O)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 XNOPRXBHLZRZKH-DSZYJQQASA-N 0.000 abstract description 2
- 229960001723 oxytocin Drugs 0.000 abstract description 2
- 102000004196 processed proteins & peptides Human genes 0.000 abstract description 2
- 108090000765 processed proteins & peptides Proteins 0.000 abstract description 2
- 208000030270 breast disease Diseases 0.000 abstract 2
- 210000004027 cell Anatomy 0.000 description 123
- 239000002609 medium Substances 0.000 description 21
- 238000012360 testing method Methods 0.000 description 16
- 239000010408 film Substances 0.000 description 13
- 239000000463 material Substances 0.000 description 13
- 239000007790 solid phase Substances 0.000 description 13
- 238000011156 evaluation Methods 0.000 description 10
- 229910052737 gold Inorganic materials 0.000 description 10
- 239000010931 gold Substances 0.000 description 10
- 239000002245 particle Substances 0.000 description 10
- 239000003550 marker Substances 0.000 description 9
- 230000008569 process Effects 0.000 description 8
- 229910052709 silver Inorganic materials 0.000 description 8
- 239000004332 silver Substances 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 238000011282 treatment Methods 0.000 description 8
- 210000004883 areola Anatomy 0.000 description 7
- 239000011159 matrix material Substances 0.000 description 7
- 102000016943 Muramidase Human genes 0.000 description 6
- 108010014251 Muramidase Proteins 0.000 description 6
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 6
- 230000018109 developmental process Effects 0.000 description 6
- 239000011521 glass Substances 0.000 description 6
- 150000002736 metal compounds Chemical class 0.000 description 6
- 230000003287 optical effect Effects 0.000 description 6
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 5
- 239000011324 bead Substances 0.000 description 5
- 230000034994 death Effects 0.000 description 5
- 231100000517 death Toxicity 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 238000003365 immunocytochemistry Methods 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 235000010335 lysozyme Nutrition 0.000 description 5
- 238000000386 microscopy Methods 0.000 description 5
- 239000007853 buffer solution Substances 0.000 description 4
- 239000000084 colloidal system Substances 0.000 description 4
- 238000007796 conventional method Methods 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 238000000684 flow cytometry Methods 0.000 description 4
- 229960000274 lysozyme Drugs 0.000 description 4
- 239000004325 lysozyme Substances 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- 230000000007 visual effect Effects 0.000 description 4
- 238000003556 assay Methods 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 238000005520 cutting process Methods 0.000 description 3
- 230000002380 cytological effect Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 3
- 210000002919 epithelial cell Anatomy 0.000 description 3
- 235000014413 iron hydroxide Nutrition 0.000 description 3
- NCNCGGDMXMBVIA-UHFFFAOYSA-L iron(ii) hydroxide Chemical compound [OH-].[OH-].[Fe+2] NCNCGGDMXMBVIA-UHFFFAOYSA-L 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 229910052697 platinum Inorganic materials 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 238000012502 risk assessment Methods 0.000 description 3
- 230000009870 specific binding Effects 0.000 description 3
- 229920001621 AMOLED Polymers 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 239000005749 Copper compound Substances 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 108010006464 Hemolysin Proteins Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 2
- 206010033372 Pain and discomfort Diseases 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 239000003463 adsorbent Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 230000000845 anti-microbial effect Effects 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- TZCXTZWJZNENPQ-UHFFFAOYSA-L barium sulfate Chemical compound [Ba+2].[O-]S([O-])(=O)=O TZCXTZWJZNENPQ-UHFFFAOYSA-L 0.000 description 2
- 230000004888 barrier function Effects 0.000 description 2
- 230000027455 binding Effects 0.000 description 2
- 210000001124 body fluid Anatomy 0.000 description 2
- 239000010839 body fluid Substances 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000012501 chromatography medium Substances 0.000 description 2
- 238000004140 cleaning Methods 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 238000004883 computer application Methods 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 150000001880 copper compounds Chemical class 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- -1 filter Substances 0.000 description 2
- 239000003228 hemolysin Substances 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 239000004973 liquid crystal related substance Substances 0.000 description 2
- 238000007726 management method Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000011817 metal compound particle Substances 0.000 description 2
- 229910021645 metal ion Inorganic materials 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- 239000011859 microparticle Substances 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 230000035935 pregnancy Effects 0.000 description 2
- 238000009597 pregnancy test Methods 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- JKFYKCYQEWQPTM-UHFFFAOYSA-N 2-azaniumyl-2-(4-fluorophenyl)acetate Chemical compound OC(=O)C(N)C1=CC=C(F)C=C1 JKFYKCYQEWQPTM-UHFFFAOYSA-N 0.000 description 1
- RBTBFTRPCNLSDE-UHFFFAOYSA-N 3,7-bis(dimethylamino)phenothiazin-5-ium Chemical compound C1=CC(N(C)C)=CC2=[S+]C3=CC(N(C)C)=CC=C3N=C21 RBTBFTRPCNLSDE-UHFFFAOYSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 108700020463 BRCA1 Proteins 0.000 description 1
- 102000036365 BRCA1 Human genes 0.000 description 1
- 101150072950 BRCA1 gene Proteins 0.000 description 1
- 102000052609 BRCA2 Human genes 0.000 description 1
- 108700020462 BRCA2 Proteins 0.000 description 1
- 101150008921 Brca2 gene Proteins 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- CXRFDZFCGOPDTD-UHFFFAOYSA-M Cetrimide Chemical compound [Br-].CCCCCCCCCCCCCC[N+](C)(C)C CXRFDZFCGOPDTD-UHFFFAOYSA-M 0.000 description 1
- 108050006400 Cyclin Proteins 0.000 description 1
- 102000016736 Cyclin Human genes 0.000 description 1
- 101710087047 Cytoskeleton-associated protein 4 Proteins 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 229920002683 Glycosaminoglycan Polymers 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 206010039101 Rhinorrhoea Diseases 0.000 description 1
- 229910021612 Silver iodide Inorganic materials 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 102100027881 Tumor protein 63 Human genes 0.000 description 1
- 101710140697 Tumor protein 63 Proteins 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- XHCLAFWTIXFWPH-UHFFFAOYSA-N [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] XHCLAFWTIXFWPH-UHFFFAOYSA-N 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000012062 aqueous buffer Substances 0.000 description 1
- 238000013475 authorization Methods 0.000 description 1
- 102000023732 binding proteins Human genes 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 210000003756 cervix mucus Anatomy 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- VQWFNAGFNGABOH-UHFFFAOYSA-K chromium(iii) hydroxide Chemical compound [OH-].[OH-].[OH-].[Cr+3] VQWFNAGFNGABOH-UHFFFAOYSA-K 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 230000000093 cytochemical effect Effects 0.000 description 1
- 238000013500 data storage Methods 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000000326 densiometry Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 208000023965 endometrium neoplasm Diseases 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 210000004251 human milk Anatomy 0.000 description 1
- 235000020256 human milk Nutrition 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 238000003126 immunogold labeling Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 201000004933 in situ carcinoma Diseases 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 238000009607 mammography Methods 0.000 description 1
- IPJKJLXEVHOKSE-UHFFFAOYSA-L manganese dihydroxide Chemical compound [OH-].[OH-].[Mn+2] IPJKJLXEVHOKSE-UHFFFAOYSA-L 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 230000009247 menarche Effects 0.000 description 1
- 230000009245 menopause Effects 0.000 description 1
- 229960000907 methylthioninium chloride Drugs 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 229940051921 muramidase Drugs 0.000 description 1
- 208000010753 nasal discharge Diseases 0.000 description 1
- 230000001254 nonsecretory effect Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- QHGUCRYDKWKLMG-UHFFFAOYSA-N octopamine Chemical compound NCC(O)C1=CC=C(O)C=C1 QHGUCRYDKWKLMG-UHFFFAOYSA-N 0.000 description 1
- 229960001576 octopamine Drugs 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000012207 quantitative assay Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 208000017443 reproductive system disease Diseases 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000010979 ruby Substances 0.000 description 1
- 229910001750 ruby Inorganic materials 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 210000002374 sebum Anatomy 0.000 description 1
- 210000000582 semen Anatomy 0.000 description 1
- 238000011896 sensitive detection Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- ADZWSOLPGZMUMY-UHFFFAOYSA-M silver bromide Chemical compound [Ag]Br ADZWSOLPGZMUMY-UHFFFAOYSA-M 0.000 description 1
- 229940045105 silver iodide Drugs 0.000 description 1
- 239000010454 slate Substances 0.000 description 1
- 238000012306 spectroscopic technique Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- QXKXDIKCIPXUPL-UHFFFAOYSA-N sulfanylidenemercury Chemical compound [Hg]=S QXKXDIKCIPXUPL-UHFFFAOYSA-N 0.000 description 1
- 210000004243 sweat Anatomy 0.000 description 1
- 210000001138 tear Anatomy 0.000 description 1
- WZWYJBNHTWCXIM-UHFFFAOYSA-N tenoxicam Chemical compound O=C1C=2SC=CC=2S(=O)(=O)N(C)C1=C(O)NC1=CC=CC=N1 WZWYJBNHTWCXIM-UHFFFAOYSA-N 0.000 description 1
- 229960002871 tenoxicam Drugs 0.000 description 1
- XPDICGYEJXYUDW-UHFFFAOYSA-N tetraarsenic tetrasulfide Chemical compound S1[As]2S[As]3[As]1S[As]2S3 XPDICGYEJXYUDW-UHFFFAOYSA-N 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 210000000779 thoracic wall Anatomy 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 229910001935 vanadium oxide Inorganic materials 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57415—Specifically defined cancers of breast
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B10/00—Instruments for taking body samples for diagnostic purposes; Other methods or instruments for diagnosis, e.g. for vaccination diagnosis, sex determination or ovulation-period determination; Throat striking implements
- A61B10/0041—Detection of breast cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B10/00—Instruments for taking body samples for diagnostic purposes; Other methods or instruments for diagnosis, e.g. for vaccination diagnosis, sex determination or ovulation-period determination; Throat striking implements
- A61B10/0045—Devices for taking samples of body liquids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
- C12Q1/06—Quantitative determination
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6803—General methods of protein analysis not limited to specific proteins or families of proteins
- G01N33/6827—Total protein determination, e.g. albumin in urine
- G01N33/683—Total protein determination, e.g. albumin in urine involving metal ions
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6803—General methods of protein analysis not limited to specific proteins or families of proteins
- G01N33/6827—Total protein determination, e.g. albumin in urine
- G01N33/683—Total protein determination, e.g. albumin in urine involving metal ions
- G01N33/6836—Silver staining
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- General Health & Medical Sciences (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Analytical Chemistry (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Cell Biology (AREA)
- General Physics & Mathematics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medical Informatics (AREA)
- Heart & Thoracic Surgery (AREA)
- Surgery (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Computational Biology (AREA)
- Organic Chemistry (AREA)
- Hospice & Palliative Care (AREA)
- Zoology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Wood Science & Technology (AREA)
- Toxicology (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Abstract
Description
本出願は、2011年10月24日に出願された米国仮出願第61/550,855号の利益を主張し、該仮出願は、参照により本明細書に組み込まれる。
各個別の刊行物、特許、又は特許出願が具体的かつ個別に参照により組み込まれることがまるで示されているのと同程度に、本明細書で言及される全ての刊行物、特許、及び特許出願が本明細書に参照により組み込まれる。
いくつかの実施形態では、本明細書に記載される方法、システム、及びソフトウェアは、デジタル処理デバイス又はその使用を含む。さらなる実施形態では、デジタル処理デバイスは、デバイスの機能を実行する1つ以上のハードウェアの中央処理デバイス(CPU)を含む。さらに別の実施形態では、デジタル処理デバイスは、実行可能な命令を実行するように構成されたオペレーティングシステムをさらに含む。いくつかの実施形態では、デジタル処理デバイスは、コンピュータネットワークに随意に接続される。さらなる実施形態では、デジタル処理デバイスは、World Wide Webにアクセスするように、Internetに随意に接続される。さらに別の実施形態では、デジタル処理デバイスは、クラウドコンピューティングインフラストラクチャに随意に接続される。他の実施形態では、デジタル処理デバイスは、イントラネットに随意に接続される。他の実施形態では、デジタル処理デバイスは、データ記憶装置に随意に接続される。
いくつかの実施形態では、本明細書に開示される方法、システム、及びソフトウェアは、随意にネットワーク接続されたデジタル処理デバイスのオペレーティングシステムによって実行可能な命令を含むプログラムで符号化された1つ以上のコンピュータ可読記憶媒体を含む。さらなる実施形態では、コンピュータ可読記憶媒体は、デジタル処理デバイスの有形(tangible)の構成要素である。さらに別の実施形態では、コンピュータ可読記憶媒体は、デジタル処理デバイスから随意に取り外し可能である。いくつかの実施形態では、コンピュータ可読記憶媒体は、非限定的な例として、CD−ROM、DVD、フラッシュメモリデバイス、固体メモリ、磁気ディスクドライブ、磁気テープドライブ、光学ディスクドライブ、クラウドコンピューティングシステム及びサービス等を含む。いくつかの場合において、プログラム及び命令は、永久に、実質的に永久に、半永久的に、又は非一時に媒体において符号化される。
いくつかの実施形態では、本明細書に開示される方法、システム、及びソフトウェアは、少なくとも1つのコンピュータプログラム、又はその使用を含む。コンピュータプログラムは、デジタル処理デバイスのCPUで実行可能であり、かつ指定されたタスクを実行するために書かれた命令のシーケンスを含む。本明細書で提供される開示に照らすと、当業者は、コンピュータプログラムが様々な言語の様々なバージョンで書かれてもよいことを認識する。いくつかの実施形態では、コンピュータプログラムは、命令の1つのシーケンスを含む。いくつかの実施形態では、コンピュータプログラムは、命令の複数のシーケンスを含む。いくつかの実施形態では、コンピュータプログラムは、1つの場所から提供される。他の実施形態では、コンピュータプログラムは、複数の場所から提供される。様々な実施形態では、コンピュータプログラムは、1つ以上のソフトウェアモジュールを含む。様々な実施形態では、コンピュータプログラムは、1つ以上のウェブアプリケーション、1つ以上のモバイルアプリケーション、1つ以上のスタンドアロンアプリケーション、1つ以上のウェブブラウザのプラグイン、拡張、アドイン、又はアドオン、又はそれらの組み合わせの一部又は全部を含む。
いくつかの実施形態では、コンピュータプログラムは、ウェブアプリケーションを含む。本明細書で提供される開示に照らすと、当業者は、ウェブアプリケーションが、様々な実施形態では、1つ以上のソフトウェアフレームワーク及び1つ以上のデータベースシステムを利用することを認識する。いくつかの実施形態では、ウェブアプリケーションは、Microsoft(登録商標)の.NET又はRuby on Rails(RoRの)などのソフトウェアフレームワーク上に作成される。いくつかの実施形態では、ウェブアプリケーションは、非限定的な例として、リレーショナル、非リレーショナル、オブジェクト指向、連想、及びXMLデータベースシステムを含む1つ以上のデータベースシステムを利用する。さらなる実施形態では、適切なリレーショナルデータベースシステムは、非限定的な例として、Microsoft(登録商標)のSQLサーバ、mySQL(登録商標)、及びOracle(登録商標)を含む。当業者はまた、ウェブアプリケーションが、様々な実施形態では、1つ以上の言語の1つ以上のバージョンで書かれていることを認識する。ウェブアプリケーションは、1つ以上のマークアップ言語、プレゼンテーション定義言語、クライアント側のスクリプト言語、サーバ側のコーディング言語、データベースクエリ言語、又はそれらの組み合わせで書かれてもよいことを認識する。いくつかの実施形態では、ウェブアプリケーションは、Hypertext Markup Language(HTML)、Extensible Hypertext Markup Language(XHTML)、又はeXtensible Markup Language(XML)などのマークアップ言語で、ある程度書き込まれる。いくつかの実施形態では、ウェブアプリケーションは、Cascading Style Sheets(CSS)などのプレゼンテーション定義言語で、ある程度書き込まれる。いくつかの実施形態では、ウェブアプリケーションは、Asynchronous Javascript及びXML(AJAX)、フラッシュ(登録商標)のActionscript、Javascript、又はSilverlight(登録商標)などのクライアント側のスクリプト言語で、ある程度書き込まれる。いくつかの実施形態では、ウェブアプリケーションは、Active Server Pages(ASP)、ColdFusion(登録商標)、Perl、Java(商標)、JavaServer Pages(JSP)、Hypertext Preprocessor(PHP)、Python(商標)、Ruby、Tcl、Smalltalk、WebDNA(登録商標)、又はGroovyなどのサーバ側のコーディング言語で、ある程度書き込まれる。いくつかの実施形態では、ウェブアプリケーションは、Structured Query Language(SQL)などのデータベースクエリ言語で、ある程度に書き込まれる。いくつかの実施形態では、ウェブアプリケーションは、IBM(登録商標)のLotus Domino(登録商標)などのエンタープライズサーバ製品を統合する。アーティストが情報及びメディアファイルをアップロードすることを可能にするアーティストのためのキャリア開発ネットワークを提供するためのウェブアプリケーションは、いくつかの実施形態では、メディアプレーヤ要素を含む。様々なさらなる実施形態では、メディアプレーヤ要素は、非限定的な例として、Adobe(登録商標)のFlash(登録商標)、HTML5、Apple(登録商標)のQuickTime(登録商標)、Microsoft(登録商標)のSilverlight(登録商標)Java(商標)、及びUnity(登録商標)を含む多くの適切なマルチメディア技術のうちの1つ以上を利用する。
いくつかの実施形態では、コンピュータプログラムは、携帯デジタル処理デバイスに提供されるモバイルアプリケーションを含む。いくつかの実施形態では、モバイルアプリケーションは、モバイルデジタル処理デバイスが製造される時に、モバイルデジタル処理デバイスに提供される。他の実施形態では、モバイルアプリケーションは、本明細書に記載のコンピュータネットワークを介してモバイルデジタル処理デバイスに提供される。
いくつかの実施形態では、コンピュータプログラムは、スタンドアロンアプリケーションを含む。該スタンドアロンアプリケーションは、独立したコンピュータプロセスとして実行されるプログラムであり、既存のプロセスへのアドオンではなく、例えばプラグインではない。当業者は、スタンドアロンアプリケーションがしばしばコンパイルされることを認識する。コンパイラは、プログラミング言語で書かれたソースコードをアセンブリ言語又はマシンコードなどのバイナリオブジェクトコードに変換するコンピュータプログラムである。適切なコンパイルされたプログラミング言語は、非限定的な例として、C、C++、Objective−C、COBOL、Delphi Eiffel、Java(商標)、Lisp、Python(商標)、Visual Basic、及びVB.NET、又はそれらの組み合わせを含む。コンパイルは、少なくとも部分的に、実行可能なプログラムを作成するためにしばしば実行される。いくつかの実施形態では、コンピュータプログラムは、1つ以上の実行可能なコンパイルされたアプリケーションを含む。
本明細書中に開示される方法、システム、及びソフトウェアは、様々な実施形態では、ソフトウェア、サーバ、及び/又はデータベースモジュール、又はその使用を含む。本明細書で提供される開示に鑑みると、ソフトウェアモジュールは、当技術分野に周知のマシン、ソフトウェア、及び言語を使用して、当業者に周知の技術によって作成される。本明細書に開示されたソフトウェアモジュールは、多数のやり方で実装される。様々な実施形態では、ソフトウェアモジュールは、ファイル、コードのセクション、プログラミングオブジェクト、プログラミング構造、又はそれらの組み合わせを含む。さらなる様々な実施形態では、ソフトウェアモジュールは、複数のファイル、コードの複数のセクション、複数のプログラミングオブジェクト、複数のプログラミング構造、又はそれらの組み合わせを含む。様々な実施形態では、1つ以上のソフトウェアモジュールは、非限定的な例として、ウェブアプリケーション、モバイルアプリケーション、及びスタンドアロンアプリケーションを含む。いくつかの実施形態では、ソフトウェアモジュールは、1つのコンピュータプログラム又はアプリケーションである。他の実施形態では、ソフトウェアモジュールは、1つより多いコンピュータプログラム又はアプリケーションである。いくつかの実施形態では、ソフトウェアモジュールは、1つのマシン上でホストされる。他の実施形態では、ソフトウェアモジュールは、1つより多いマシン上でホストされる。さらなる実施形態では、ソフトウェアモジュールは、クラウドコンピューティングプラットフォーム上でホストされる。いくつかの実施形態では、ソフトウェアモジュールは、1つの場所において1つ以上のマシン上でホストされる。他の実施形態では、ソフトウェアモジュールは、1つより多い場所において1つ以上のマシン上でホストされる。
いくつかの実施形態では、本明細書に開示される方法、システム、及びソフトウェアは、1つ以上のデータベース、又はそれらの使用を含む。本明細書で提供される開示に鑑みると、当業者は、多くのデータベースがメタゲノムの情報、(メタゲノムプロファイルを含む)、メタトランスクリプトーム(metatranscriptome)の情報(メタトランスクリプトームプロファイルを含む)、及びマルチプレックスのプロファイルの記憶及び読み出しに適していることを認識する。様々な実施形態では、適切なデータベースは、非限定的な例として、リレーショナルデータベース、非リレーショナルデータベース、オブジェクト指向データベース、オブジェクトデータベース、エンティティ関係モデルデータベース、連想データベース、及びXMLデータベースを含む。いくつかの実施形態では、データベースは、インターネットベースである。さらなる実施形態では、データベースは、ウェブベースである。さらに別の実施形態では、データベースは、クラウドコンピューティングベースである。他の実施形態では、データベースは、1つ以上のローカル記憶デバイスベースである。
<実施例>
(実施例1:乳頭吸引液の評価)
(略語)
簡単に説明すると、風袋を量ったニトロセルロースフィルタを各乳頭(各乳房ごとに1つ)に単に接触させることによって、乳管液を採取するために風袋を量ったニトロセルロースフィルタを使用した。次に、風袋を量った試料採取ユニットとともにMASCT(商標)デバイスを用いて乳房流体試料を吸引した。下記の染色技術を用いてタンパク質について、ニトロセルロースフィルタの両方のセットを試験した。乳頭吸引液標本を含むフィルタを洗浄することにより採取した細胞に、細胞診を施行した。
MASCT(商標)デバイスを使用するときにニトロセルロースフィルタ上のタンパク質の存在によって判定されるように、試験の主要エンドポイントは、乳管液を生成する、試験を完了した女性の割合だった。
これらの3人の被験者から得られたフィルタに対して行われたタンパク質試験に関して、乳頭洗浄フィルタ試料上のいずれもタンパク質の存在を示さなかった。MASCT(商標)デバイスからのすべてのフィルタは、タンパク質が装置フィルタ上で検出されたことを示した。
MASCT(商標)デバイスは、以前、510(k)制御経路(regulatory pathway)を介して(via)市販の許可が与えられていた。MASCT(商標)デバイスへの改造を試験するためにこの臨床研究を設計した。MASCT(商標)デバイスの改造は、有効性及び使いやすさ、ならびに以前は非分泌者であると考えられた女性を含む女性からの乳頭吸引液中のタンパク質を検出する能力を高めるようになされた。乳房の健康管理において助となる乳頭吸引液の臨床的有用性は、流体を採取し、液体の存在を測定する現在の方法論によって、ここ50年間、妨げられてきた。実際には、現在の技術を使用して、すべての女性の50%までは、非分泌者、すなわち、彼女らは、乳頭吸引液(NAF)を生成しないと判断される。
必要な場合には、各患者は、研究へのさらなる参加に先立って、尿妊娠検査を受けた。妊娠検査陽性は、参加から被写体を除外する。すべての包含及び除外基準は、被験者の適格性を確保するためにレビューされた。適格性が立証された後、固有の被験者識別番号が割り当てられた。
以下の人口統計的及び病歴を各被験者から取得した:年齢及び人種;家族の病歴、特に母親や姉妹;乳がん、良性乳房状態、及び生殖疾患(例えば、卵巣がん又は子宮内膜腫瘍)を含む個人の病歴;併用薬;初潮の年齢;最初の妊娠時の年齢;最初の出産時の年齢;閉経の年齢;及び身長と体重。
被験者を臥位に置いた。両乳房の乳頭及び周囲の乳輪領域をアルコールで洗浄して、過剰皮脂、化粧品又は上皮破片を除去した。アルコールが蒸発した後、暖かい湿った圧定布を10〜15分間、両方の乳房の上に置いた。圧定布を取り除き、被験者を着座位置に置いた。アルコールを用いて乳頭区域を拭いて、存在していた乳管プラグ(ductal plug)を取り除いた。
フィルタ材料を取り扱うすべての者は、フィルタ汚染のリスクを最小限に抑えるために、手袋及び保護マスクを着用しなければならない。
各被験者の使用に先立って、CIDEX(登録商標)などの抗菌剤溶液を用いてMASCT(商標)デバイスを徹底的に洗浄した。装置は、極端な温度にさらされず、また加圧滅菌器で処理されなかった。装置の材料の劣化又は負圧を誘発する障害ついて装置を定期的に検査した。いずれかの状態が観察された場合には、ユニットを交換した。
(MASCT(商標)と乳頭タッチ処置)
a.1つのフィルタディスクアセンブリには「左」、第2のフィルタディスクアセンブリには「右」とラベルを付す。
b.素手でフィルタには手を触れないように注意しながら、必要に応じて鉗子を使用して各アセンブリの重さを量り、記録する。
c.搾乳器デバイスに1つのアセンブリに挿入する。
d.胸壁から開始して、約1分間、乳頭−乳輪合成物(complex)に徐々に移動する手による自己乳房マッサージ行うように被験者に指示する。
e.次いで、搾乳器デバイスが医師又は看護師によって60〜90秒間作動している間、被験者は、両手で自分の乳房を圧搾する。
f.フィルタディスクアセンブリを取り外し、流体採取のためにMASCT(商標)のフィルタディスクの重さを量る。
g.CIDEX(登録商標)などの抗菌剤溶液を使用して、試料採取漏斗の表面を拭き、採取バイアルをすすぐ。
h.第2の乳房について、工程c、d、e、f及びgを繰り返す。
i.タンパク質及び/又は細胞診評価のその後の評価のために冷蔵庫にフィルタディスクに保管する。各フィルタディスクアセンブリのための梱包容器に、採取した被験者のID番号及び日付で適宜ラベルを付さなければならない。
被験者は診療所に残り、吸引後30分間の装置による副作用について観察される。その時点において、進行する(evolving)又は未解決の副作用がない場合には、被験者は解放される。治験責任医師の裁量で、この観察期間の終了時に副作用を経験する被験者は、副作用が解決されるか又はフォローアップの手配がなされるまで試験場所に残る。
本明細書に記載されるプロトコルに従ってこの研究におけるすべての被験者を研究した。
以下の結果は、この研究で使用された個々のフィルタの試験の際に得られた。
対照の乳頭洗浄フィルタの試料はいずれも、タンパク質の存在を示さなかった。
(搾乳器の結果)
死亡又は重篤な有害事象はなかった。
18〜65歳の31人の女性の研究では、本開示の方法は、タンパク質を分析するために使用され、タンパク質は、31人すべての女性から検出され(1人の女性は、1つの乳房のみでタンパク質が検出された)、97%の臨床的有用性を与えた。従来技術に対するこの改善は、がんの予防対策を設けることができるとき、早期の前がん変化を有する女性を特定するのにこの試験を有用にする。
研究の主な目的は、MASCT(商標)デバイスを用いたときに得られるすべてのニトロセルロースフィルタ上のタンパク質の存在によって判定されるように達成された。細胞の存在及びタイプについて乳頭吸引液を細胞診的に評価する副次的な目的が達成された。すべての試料は、細胞物質について成功裏に分析された。
この実施例は、実施例1に記載した試料から得られた細胞の特定及び評価するための従来の細胞学的技術の使用を記載する。濾紙上の試料の採取に続いて、フィルタは、任意の適切な緩衝洗浄溶液(例えばリン酸緩衝生理食塩水)を用いて洗浄して細胞を採取する。流体をさらに処理し、例えば、改造された細胞診バイアルにおける遠心分離によって細胞を採取することができる。次いで、清浄なガラス顕微鏡スライドの中央領域に、処理された試料を移動し、試料上にカバースリップをスライドさせて、スライドの表面に沿ってカバースリップを広げる。スライドを空気乾燥させることができ、次いで、例えば無水アルコール中にスライドを固定し、メチレンブルー、ヘマトキシリン(hematoxyln)及びエオシン、又は他の適切な染色剤などの標準的な細胞染色剤で染色する。
Claims (60)
- 個体からの乳頭吸引液(NAF)試料を分析するためのシステムであって、
a.前記乳頭吸引液試料を吸収するための吸収紙であって、ミクロセルロース、混合セルロースエステル紙又はニトロセルロースを含み、乳頭を覆うようなサイズを有する吸収紙と、
b.前記乳頭吸引液試料の総タンパク質を可視化し、前記乳頭吸引液試料の細胞の数を計数し、又はそれらの組み合わせのための顕微鏡と
を備えたシステム。 - 前記吸収紙は、直径が約1.0〜約3.0インチであり、厚さが約0.01〜約0.1インチである、請求項1に記載のシステム。
- 前記乳頭吸引液試料の総タンパク質を判定するためのコロイド状の金属染色剤をさらに備えた、請求項1に記載のシステム。
- 前記コロイド状の金属は、コロイド状の金又はコロイド状の銀である、請求項3に記載のシステム。
- 実行可能な命令を実行するように構成された随意にネットワーク接続されたコンピュータ処理デバイスと、
コンピュータプログラムであって、前記乳頭吸引液試料の総タンパク質の含有量、前記乳頭吸引液試料の細胞の数、又はそれらの組み合わせを分析するためのモデル又はアルゴリズムを適用するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールを含むコンピュータプログラムと
をさらに備えた、請求項1に記載のシステム。 - 前記コンピュータプログラムは、前記個体の治療レジメンを指定するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項5に記載のシステム。
- 前記コンピュータプログラムは、フォトマイクログラムのデータベース内にフォトマイクログラムを記憶するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項5に記載のシステム。
- 前記コンピュータプログラムは、分析のデータベース内に分析を記憶するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項5に記載のシステム。
- 前記コンピュータプログラムは、前記乳頭吸引液試料の総タンパク質の含有量又は細胞の数と標準とを比較するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項5に記載のシステム。
- 前記コンピュータプログラムは、医療提供者又は前記個体に分析を伝達するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項5に記載のシステム。
- 前記コンピュータプログラムは、医療提供者又は前記個体に診断を伝達するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項5に記載のシステム。
- 前記コンピュータプログラムは、分析を含むレポートを生成するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項5に記載のシステム。
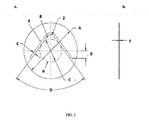
- 前記吸収紙は、図1に示す装置である、請求項1に記載のシステム。
- アプリケーションを作成するために、コンピュータ処理デバイスによって実行可能な命令を含むコンピュータプログラムで符号化された非一時的なコンピュータ可読記憶媒体であって、
前記アプリケーションは、
(a)乳頭を覆うようなサイズを有する吸収紙上に吸収される乳頭吸引液試料の総タンパク質の含有量及び/又は細胞の数を分析するためのモデル又はアルゴリズムを適用するように構成されたソフトウェアモジュールと、
(b)個体の治療レジメンを指定するように構成されたソフトウェアモジュールと
を含む、記憶媒体。 - 前記吸収紙は、直径が約1.0〜約3.0インチであり、厚さが約0.01〜約0.1インチである、請求項14に記載の記憶媒体。
- 前記モデル又はアルゴリズムは、前記乳頭吸引液試料の総タンパク質の含有量及び/又は前記乳頭吸引液試料の細胞の数と標準とを比較することを含む、請求項14に記載の記憶媒体。
- 前記アプリケーションは、コンピュータメモリにフォトマイクログラフのデータベースをさらに含む、請求項14に記載の記憶媒体。
- 前記アプリケーションは、コンピュータメモリに分析のデータベースをさらに含む、請求項14に記載の記憶媒体。
- 前記アプリケーションは、分析を含むレポートを生成するように構成されたソフトウェアモジュールをさらに含む、請求項14に記載の記憶媒体。
- 前記吸収紙は、図1に示す装置である、請求項14に記載の記憶媒体。
- 乳頭を覆うようなサイズを有する吸収紙であって、ミクロセルロース、混合セルロースエステル紙又はニトロセルロースを含む吸収紙。
- 図1に示す吸収紙を含む、請求項21に記載の吸収紙。
- 前記吸収紙は、混合セルロースエステル紙を含む、請求項21に記載の吸収紙。
- 前記吸収紙は、直径が約1.0〜約3.0インチであり、厚さが約0.01〜約0.1インチである、請求項21に記載の吸収紙。
- 前記紙は、図1に示すようなL字型の要素4を含む、請求項21に記載の吸収紙。
- 個体において乳がんを発症するリスクを特定する方法であって、
前記方法は、
a)吸収紙上に吸収された乳頭吸引液試料中のタンパク質の総量及び/又は細胞の数を検出する工程であって、前記吸収紙は、ミクロセルロース、混合セルロースエステル紙又はニトロセルロースを含む、工程と、
b)前記乳頭吸引液試料のタンパク質の総量及び/又は細胞の数に基づいて、乳がんを発症するリスクを特定する工程と
を含む方法。 - 前記吸収紙は、図1に示す装置である、請求項26に記載の方法。
- 前記吸収紙は、直径が約1.0〜約3.0インチであり、厚さが約0.01〜約0.1インチである、請求項26に記載の方法。
- 前記試料がタンパク質を含み、かつ無細胞である場合には、前記個体は、乳がんを発症するリスクが低いのもであるとして特定される、請求項26に記載の方法。
- 前記試料が約1pg〜約500pgのタンパク質を含み、かつ無細胞である場合には、前記個体は、乳がんのリスクが低いのもであるとして特定される、請求項26に記載の方法。
- 前記試料が少なくとも約300ngのタンパク質及び2つ以上の細胞を含む場合には、前記個体は、乳がんのさらなる評価が必要であると特定され、又は乳がんリスクが中又は高いとして診断される、請求項30に記載の方法。
- 前記試料が約300ngのタンパク質〜約2μgのタンパク質及び2つ以上の細胞を含む場合には、前記個体は、乳がんのさらなる評価が必要であると特定され、又は乳がんリスクが中又は高いとして診断される、請求項30に記載の方法。
- 前記試料が約300ngのタンパク質〜約2μgのタンパク質及び2つ〜5つの細胞を含む場合には、前記個体は、乳がんのさらなる評価が必要であると特定され、又は乳がんリスクが中又は高いとして診断される、請求項30に記載の方法。
- 前記個体は、乳頭吸引液の古典的な非分泌者又は古典的な分泌者として診断される、請求項26に記載の方法。
- 乳頭吸引液試料中の細胞を検出する工程は、前記吸収紙を洗浄し、流出物を採取し、前記流出物中の細胞を計数する工程を含む、請求項26に記載の方法。
- 前記吸収紙は、前記タンパク質の総量が判定される前に洗浄される、請求項35に記載の方法。
- 前記タンパク質の総量は、金属粒子の懸濁液で前記吸収紙を染色することによって検出される、請求項26に記載の方法。
- 前記金属粒子の懸濁液は、コロイド状の金又はコロイド状の銀である、請求項37に記載の方法。
- 前記細胞の数は、顕微鏡を使用して検出される、請求項26に記載の方法。
- 前記乳頭吸引液は、乳房組織のマッサージ、及び患者の乳器から生体試料を採取するための試料採取装置を用いる吸引に続いて、吸収紙上に採取される、請求項26に記載の方法。
- 乳頭吸引液(NAF)と、乳頭を覆うようなサイズを有する吸収紙とを含む組成物であって、前記吸収紙は、ミクロセルロース、混合セルロースエステル紙又はニトロセルロースを含む、組成物。
- 図1に示すような吸収紙を含む、請求項41に記載の組成物。
- 前記吸収紙は、混合セルロースエステル紙を含む、請求項26に記載の組成物。
- 前記吸収紙は、直径が約1.0〜約3.0インチであり、厚さが約0.01〜約0.1インチである、請求項26に記載の組成物。
- 個体からの乳頭吸引液(NAF)試料を分析するためのシステムであって、
a.前記乳頭吸引液試料を吸収するための吸収紙であって、ミクロセルロース、混合セルロースエステル紙又はニトロセルロースを含み、乳頭を覆うようなサイズを有する吸収紙と、
b.搾乳器デバイスと
を備えた、システム。 - 前記吸収紙は、直径が約1.0〜約3.0インチであり、厚さが約0.01〜約0.1インチである、請求項45に記載のシステム。
- 前記搾乳器デバイスは、MASCT(商標)デバイスである、請求項45に記載のシステム。
- 個体からの乳頭吸引液(NAF)試料を分析するためのシステムであって、
a.前記乳頭吸引液試料を吸収するための吸収紙であって、ミクロセルロース、混合セルロースエステル紙又はニトロセルロースを含み、乳頭を覆うようなサイズを有する吸収紙と、
b.前記乳頭吸引液試料の総タンパク質を判定するためのコロイド状の金属染色剤と
を備えた、システム。 - 前記吸収紙は、直径が約1.0〜約3.0インチであり、厚さが約0.01〜約0.1インチである、請求項48に記載のシステム。
- 前記乳頭吸引液試料の総タンパク質を可視化し、前記乳頭吸引液試料の細胞の数を計数し、又はそれらの組み合わせのための顕微鏡をさらに備えた、請求項48に記載のシステム。
- 前記コロイド状の金属は、コロイド状の金又はコロイド状の銀である、請求項48に記載のシステム。
- 実行可能な命令を実行するように構成された随意にネットワーク接続されたコンピュータ処理デバイスと、
コンピュータプログラムであって、前記乳頭吸引液試料の総タンパク質の含有量、前記乳頭吸引液試料の細胞の数、又はそれらの組み合わせを分析するためのモデル又はアルゴリズムを適用するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールを含むコンピュータプログラムと
をさらに備えた、請求項48に記載のシステム。 - 前記コンピュータプログラムは、前記個体の治療レジメンを指定するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項52に記載のシステム。
- 前記コンピュータプログラムは、フォトマイクログラムのデータベース内にフォトマイクログラムを記憶するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項52に記載のシステム。
- 前記コンピュータプログラムは、分析のデータベース内に分析を記憶するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項52に記載のシステム。
- 前記コンピュータプログラムは、前記乳頭吸引液試料の総タンパク質の含有量又は細胞の数と標準とを比較するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項52に記載のシステム。
- 前記コンピュータプログラムは、医療提供者又は前記個体に分析を伝達するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求52に記載のシステム。
- 前記コンピュータプログラムは、医療提供者又は前記個体に診断を伝達するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項52に記載のシステム。
- 前記コンピュータプログラムは、分析を含むレポートを生成するために、前記コンピュータ処理デバイスによって実行されるソフトウェアモジュールをさらに含む、請求項52に記載のシステム。
- 前記吸収紙は、図1に示す装置である、請求項48に記載のシステム。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161550855P | 2011-10-24 | 2011-10-24 | |
| US61/550,855 | 2011-10-24 | ||
| PCT/US2012/061733 WO2013063147A1 (en) | 2011-10-24 | 2012-10-24 | Absorbent paper and use thereof for breast cancer detection |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015505359A true JP2015505359A (ja) | 2015-02-19 |
| JP2015505359A5 JP2015505359A5 (ja) | 2015-12-17 |
Family
ID=48168446
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014538957A Pending JP2015505359A (ja) | 2011-10-24 | 2012-10-24 | 乳がん検出のための吸収紙及びその使用 |
Country Status (6)
| Country | Link |
|---|---|
| US (3) | US20130130310A1 (ja) |
| EP (1) | EP2771686A4 (ja) |
| JP (1) | JP2015505359A (ja) |
| CN (1) | CN104040339A (ja) |
| CA (1) | CA2853343A1 (ja) |
| WO (1) | WO2013063147A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20130130310A1 (en) * | 2011-10-24 | 2013-05-23 | Atossa Genetics, Inc. | Absorbent paper and use thereof for breast cancer detection |
| US20170145515A1 (en) * | 2014-06-04 | 2017-05-25 | Atossa Genetics Inc. | Molecular mammography |
| TWI588261B (zh) | 2014-09-02 | 2017-06-21 | 國立成功大學 | 聚合酶鏈鎖反應之儀器與方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH09149890A (ja) * | 1995-09-27 | 1997-06-10 | Hisamitsu Pharmaceut Co Inc | 検査用貼付剤およびその検出装置並びに検査方法 |
| JP2004524060A (ja) * | 2000-11-13 | 2004-08-12 | アトッサ ヘルスケア,インコーポレイティド | 癌を含む胸部疾患を評価するために乳房分泌流体サンプルを採集、操作および処理する方法ならびに装置 |
| JP2006519591A (ja) * | 2003-01-15 | 2006-08-31 | ロゼッタ インファーマティクス エルエルシー | 乳癌患者の診断および予後 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3786801A (en) * | 1969-02-24 | 1974-01-22 | Diagnostic Inc | Method and apparatus for aiding in the detection of breast cancer |
| GB8415998D0 (en) | 1984-06-22 | 1984-07-25 | Janssen Pharmaceutica Nv | Staining method |
| JPS6294170A (ja) * | 1985-10-21 | 1987-04-30 | ピジヨン株式会社 | 搾乳器 |
| US5340746A (en) | 1993-01-08 | 1994-08-23 | Minnesota Mining And Manufacturing Company | Composite reactive articles for the determination of cyanide |
| US5798266A (en) * | 1996-08-27 | 1998-08-25 | K-Quay Enterprises, Llc | Methods and kits for obtaining and assaying mammary fluid samples for breast diseases, including cancer |
| AU1820100A (en) | 1998-11-13 | 2000-06-05 | Pro Duct Health, Inc. | Devices and methods to identify ductal orifices during nipple aspiration |
| WO2001085023A2 (en) | 2000-05-10 | 2001-11-15 | Cytyc Health Corporation | Method for differentiating breast ducts for cancer risk status |
| US20020013539A1 (en) * | 2000-07-28 | 2002-01-31 | David Hung | Methods and devices for diagnosis of precancer and cancer in breast milk ducts |
| US6866994B2 (en) | 2001-05-30 | 2005-03-15 | Neomatrix, Llc | Noninvasive intraductal fluid diagnostic screen |
| AU2002348297A1 (en) * | 2001-11-20 | 2003-06-10 | Proteex, Inc. | Proteonomic methods for diagnosis and monitoring of breast cancer |
| US7128887B2 (en) | 2003-05-29 | 2006-10-31 | Specialty Minerals (Michigan) Inc. | Platy precipitated calcium carbonate synthesis method |
| EP1796723B1 (en) | 2004-10-07 | 2012-11-14 | National Institute of Immunology | Method of diagnosing cancer by detecting the expression of spag9 or the presence of anti-spag9 antibodies |
| EP1827216A4 (en) * | 2004-12-08 | 2010-10-27 | Paul C Wang | DEVICE FOR THE NON-SURGICAL CORRECTION OF BONED INCEPTED CHICKEN CHALK AND / OR COLLECTION OF BREAST CHOCOLATE ASPIRATE LIQUID |
| EP1907857A4 (en) * | 2005-05-26 | 2009-08-05 | Univ Johns Hopkins | BIOMARKER FOR BREAST CANCER |
| WO2008141318A1 (en) | 2007-05-14 | 2008-11-20 | Dr. Susan Love Research Foundation | Device for determining risk of developing breast cancer and method thereof |
| US20110151580A1 (en) * | 2007-11-06 | 2011-06-23 | University Health Network | Method for the detection of breast cancer by determining alcam and/or bcam levels in a patient |
| US20140255954A1 (en) | 2011-10-24 | 2014-09-11 | Atossa Genetics, Inc. | Method of breast cancer detection |
| US20130130310A1 (en) | 2011-10-24 | 2013-05-23 | Atossa Genetics, Inc. | Absorbent paper and use thereof for breast cancer detection |
-
2012
- 2012-10-24 US US13/659,832 patent/US20130130310A1/en not_active Abandoned
- 2012-10-24 WO PCT/US2012/061733 patent/WO2013063147A1/en active Application Filing
- 2012-10-24 EP EP12843852.0A patent/EP2771686A4/en not_active Withdrawn
- 2012-10-24 JP JP2014538957A patent/JP2015505359A/ja active Pending
- 2012-10-24 CN CN201280064266.1A patent/CN104040339A/zh active Pending
- 2012-10-24 CA CA2853343A patent/CA2853343A1/en not_active Abandoned
- 2012-10-24 US US14/352,461 patent/US9052318B2/en not_active Expired - Fee Related
-
2015
- 2015-05-14 US US14/712,846 patent/US20150323537A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH09149890A (ja) * | 1995-09-27 | 1997-06-10 | Hisamitsu Pharmaceut Co Inc | 検査用貼付剤およびその検出装置並びに検査方法 |
| JP2004524060A (ja) * | 2000-11-13 | 2004-08-12 | アトッサ ヘルスケア,インコーポレイティド | 癌を含む胸部疾患を評価するために乳房分泌流体サンプルを採集、操作および処理する方法ならびに装置 |
| JP2006519591A (ja) * | 2003-01-15 | 2006-08-31 | ロゼッタ インファーマティクス エルエルシー | 乳癌患者の診断および予後 |
Non-Patent Citations (1)
| Title |
|---|
| KING E B ET AL.: "CELLULAR COMPOSITION OF THE NIPPLE ASPIRATE SPECIMEN OF BREAST FLUID I. THE BENIGN CELLS", AMERICAN JOURNAL OF CLINICAL PATHOLOGY, vol. 64, no. 6, JPN6016032380, 1 January 1975 (1975-01-01), pages 728 - 745, XP001056678, ISSN: 0003384914 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2853343A1 (en) | 2013-05-02 |
| US20130130310A1 (en) | 2013-05-23 |
| US20140287430A1 (en) | 2014-09-25 |
| EP2771686A4 (en) | 2015-03-18 |
| US9052318B2 (en) | 2015-06-09 |
| EP2771686A1 (en) | 2014-09-03 |
| WO2013063147A1 (en) | 2013-05-02 |
| US20150323537A1 (en) | 2015-11-12 |
| CN104040339A (zh) | 2014-09-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Palkovicova et al. | Maternal amalgam dental fillings as the source of mercury exposure in developing fetus and newborn | |
| Holtkötter et al. | Forensic differentiation between peripheral and menstrual blood in cases of alleged sexual assault—validating an immunochromatographic multiplex assay for simultaneous detection of human hemoglobin and D-dimer | |
| Olms et al. | Clinical comparison of liquid-based and conventional cytology of oral brush biopsies: a randomized controlled trial | |
| Rodrigues-Peres et al. | Aluminum concentrations in central and peripheral areas of malignant breast lesions do not differ from those in normal breast tissues | |
| US20150323537A1 (en) | Absorbent paper and use thereof for breast cancer detection | |
| Spugnini et al. | Filling the gap between histology and cytology: Description of an innovative technology (Cytomatrix) to increase the diagnostic effectiveness of fine needle aspirates data | |
| Edwards et al. | Cadmium levels in a North Carolina cohort: identifying risk factors for elevated levels during pregnancy | |
| Ambrosini-Spaltro et al. | PD-L1 expression in head and neck carcinoma by combined positive score: a comparison among preoperative biopsy, tumor resection, and lymph node metastasis | |
| WO2022194033A1 (zh) | 一种弥漫大b细胞淋巴瘤的外周血tcr标志物及其检测试剂盒和应用 | |
| JP2015501429A (ja) | 乳癌検出の方法 | |
| JP2022523110A (ja) | バイオマーカー分析に基づいて将来の皮膚傾向を視覚化するためのシステムおよび方法 | |
| Zhao et al. | Effects of an Omaha system-based continuing nursing program on nutritional status in patients undergoing peritoneal dialysis: a randomized controlled trial | |
| Zhang et al. | Clinical implications of SPRR1A expression in diffuse large B-cell lymphomas: a prospective, observational study | |
| Jung et al. | Non-Invasive nasal discharge fluid and other body fluid biomarkers in alzheimer’s disease | |
| Nemes-Baran et al. | Quantification of microglial contact and engulfment of oligodendrocyte progenitor cells in the rodent brain | |
| JP2015505359A5 (ja) | ||
| Foschini et al. | Non-diagnostic | |
| Archer et al. | Relationship between prenatal lead exposure and infant blood lead levels | |
| El Sokkary et al. | Prevalence of P16 Immunohistochemistry Positive Staining and Its Correlation to Clinical and Radiological Staging of Squamous Cell Carcinoma of the Cervix | |
| JP2017015711A (ja) | 血液分析方法及び血液検査キット | |
| EP4004932A2 (en) | Systems and methods for using biomarker analysis for personalized skincare | |
| Abdulkareem et al. | Pathological services in sub-Saharan Africa, a barrier to effective cancer care | |
| JP2017012129A (ja) | 血液分析方法及び血液検査キット | |
| Wojtyła et al. | New challenges for cervical cancer | |
| Nordhoff et al. | Semen analysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151023 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20151023 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20160819 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160824 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20170315 |