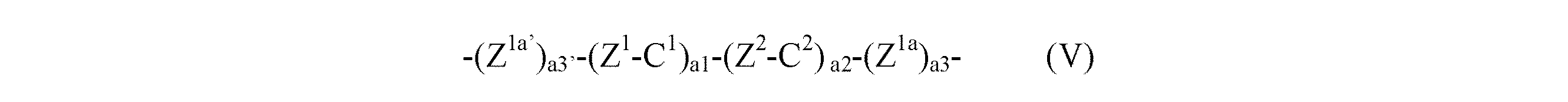JP2015232136A - 側方置換した光整列材料 - Google Patents
側方置換した光整列材料 Download PDFInfo
- Publication number
- JP2015232136A JP2015232136A JP2015145493A JP2015145493A JP2015232136A JP 2015232136 A JP2015232136 A JP 2015232136A JP 2015145493 A JP2015145493 A JP 2015145493A JP 2015145493 A JP2015145493 A JP 2015145493A JP 2015232136 A JP2015232136 A JP 2015232136A
- Authority
- JP
- Japan
- Prior art keywords
- alkylene
- compound
- substituted
- formula
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 0 Cc1c(*c(cc2)c(*)cc2N)ccc(N)c1 Chemical compound Cc1c(*c(cc2)c(*)cc2N)ccc(N)c1 0.000 description 2
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/06—Polycondensates having nitrogen-containing heterocyclic rings in the main chain of the macromolecule
- C08G73/10—Polyimides; Polyester-imides; Polyamide-imides; Polyamide acids or similar polyimide precursors
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/06—Polycondensates having nitrogen-containing heterocyclic rings in the main chain of the macromolecule
- C08G73/10—Polyimides; Polyester-imides; Polyamide-imides; Polyamide acids or similar polyimide precursors
- C08G73/1075—Partially aromatic polyimides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/06—Polycondensates having nitrogen-containing heterocyclic rings in the main chain of the macromolecule
- C08G73/10—Polyimides; Polyester-imides; Polyamide-imides; Polyamide acids or similar polyimide precursors
- C08G73/1075—Partially aromatic polyimides
- C08G73/1078—Partially aromatic polyimides wholly aromatic in the diamino moiety
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L79/00—Compositions of macromolecular compounds obtained by reactions forming in the main chain of the macromolecule a linkage containing nitrogen with or without oxygen or carbon only, not provided for in groups C08L61/00 - C08L77/00
- C08L79/04—Polycondensates having nitrogen-containing heterocyclic rings in the main chain; Polyhydrazides; Polyamide acids or similar polyimide precursors
- C08L79/08—Polyimides; Polyester-imides; Polyamide-imides; Polyamide acids or similar polyimide precursors
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/52—Liquid crystal materials characterised by components which are not liquid crystals, e.g. additives with special physical aspect: solvents, solid particles
- C09K19/54—Additives having no specific mesophase characterised by their chemical composition
- C09K19/56—Aligning agents
-
- G—PHYSICS
- G02—OPTICS
- G02F—OPTICAL DEVICES OR ARRANGEMENTS FOR THE CONTROL OF LIGHT BY MODIFICATION OF THE OPTICAL PROPERTIES OF THE MEDIA OF THE ELEMENTS INVOLVED THEREIN; NON-LINEAR OPTICS; FREQUENCY-CHANGING OF LIGHT; OPTICAL LOGIC ELEMENTS; OPTICAL ANALOGUE/DIGITAL CONVERTERS
- G02F1/00—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics
- G02F1/01—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour
- G02F1/13—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour based on liquid crystals, e.g. single liquid crystal display cells
- G02F1/133—Constructional arrangements; Operation of liquid crystal cells; Circuit arrangements
- G02F1/1333—Constructional arrangements; Manufacturing methods
- G02F1/1337—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers
- G02F1/133711—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers by organic films, e.g. polymeric films
- G02F1/133723—Polyimide, polyamide-imide
-
- G—PHYSICS
- G02—OPTICS
- G02F—OPTICAL DEVICES OR ARRANGEMENTS FOR THE CONTROL OF LIGHT BY MODIFICATION OF THE OPTICAL PROPERTIES OF THE MEDIA OF THE ELEMENTS INVOLVED THEREIN; NON-LINEAR OPTICS; FREQUENCY-CHANGING OF LIGHT; OPTICAL LOGIC ELEMENTS; OPTICAL ANALOGUE/DIGITAL CONVERTERS
- G02F1/00—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics
- G02F1/01—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour
- G02F1/13—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour based on liquid crystals, e.g. single liquid crystal display cells
- G02F1/133—Constructional arrangements; Operation of liquid crystal cells; Circuit arrangements
- G02F1/1333—Constructional arrangements; Manufacturing methods
- G02F1/1337—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers
- G02F1/13378—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers by treatment of the surface, e.g. embossing, rubbing or light irradiation
- G02F1/133788—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers by treatment of the surface, e.g. embossing, rubbing or light irradiation by light irradiation, e.g. linearly polarised light photo-polymerisation
Landscapes
- Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Crystallography & Structural Chemistry (AREA)
- Nonlinear Science (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Mathematical Physics (AREA)
- General Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Macromolecular Compounds Obtained By Forming Nitrogen-Containing Linkages In General (AREA)
- Liquid Crystal (AREA)
- Liquid Crystal Substances (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Other Resins Obtained By Reactions Not Involving Carbon-To-Carbon Unsaturated Bonds (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
Abstract
Description
[式中、
A及びBは、相互に独立に、5若しくは6個の原子の単環式環、5若しくは6個の原子の2個の隣接単環式環、8、9若しくは10個の原子の二環式環系、又は13若しくは14個の原子の三環式環系から選択される、非置換又は置換の炭素環式又は複素環式の芳香族基又は脂環式基を表し;
好ましくはAは、5若しくは6個の原子の単環式環、5若しくは6個の原子の2個の隣接単環式環、8、9若しくは10個の原子の二環式環系、又は13若しくは14個の原子の三環式環系から選択される、非置換又は置換の炭素環式又は複素環式の芳香族基を表し;そしてBは、5若しくは6個の原子の単環式環、5若しくは6個の原子の2個の隣接単環式環、8、9若しくは10個の原子の二環式環系、又は13若しくは14個の原子の三環式環系から選択される、非置換又は置換の炭素環式又は複素環式の芳香族基又は脂環式基を表し;
Zは、架橋基を表し、
R1は、ハロゲン、C1−C16アルコキシ、C1−C16アルキル、ニトロ又はニトリルを、好ましくはメトキシ、フッ素、塩素又はニトリルを、そして更に好ましくはフッ素を表し、
R2及びR3は、相互に独立に、水素、ハロゲン又はニトリル;非置換又はハロゲン置換C1−C12アルキル(ここで、1個以上のC原子、CH−又はCH2−基は、連結基により置換されていてもよい)であり;好ましくはR2及びR3は、水素、ニトリル又はフッ素であり、そして更に好ましくはR2及びR3は、水素及び/又はニトリルであり、そして最も好ましくはR2及びR3は、水素である]により表される側方置換部分を有するポリマーを含む、光整列材料。
で示される基、−NR2−、−NR2−CO−、−CO−NR2−、−NR2−CO−O−、−O−CO−NR2−、−NR2−CO−NR2−、−CH=CH−、−C≡C−、−O−CO−O−、−Si(CH3)2−O−Si(CH3)2−;並びに非置換又は置換のシクロヘキシレン、及び非置換又は置換のフェニレンから選択されるが、ここで、R2は、水素又はC1−C6アルキルを表し;特に水素又はメチルを表すが、ただし、連結基の酸素原子は、相互に直接結合することはなく;好ましいのは、単結合、−O−、−O(CO)−、−S−、−(CO)O−又は下記式:
で示される基、−NR2−であり;更に好ましいのは、単結合、−O−、−O(CO)−又は−(CO)O−である。
[式中、
B及びZは、上記の意味及び優先傾向を有しており、
R1は、ハロゲン、C1−C16アルコキシ、C1−C16アルキル、ニトロ又はニトリルを表し、好ましくはメトキシ、フッ素、塩素又はニトリルを表し、そして更に好ましくはフッ素を表し、
Uは、水素、又は直鎖若しくは分岐の、非置換の、若しくは少なくとも1回ハロゲン、ニトリル、エーテル、エステル、シロキサン、アミド若しくはアミンで置換されているC1−C16アルキル基(好ましくは末端位で置換されている)を表し;特に末端置換されているC1−C12アルキル基、更にはC1−C6アルキル基を表し、そしてここで、1個以上のC原子、CH−又はCH2−基は、相互に独立に、置換されていないか、又は上記の意味及び優先傾向内の連結基により置換されており;特にC原子、CH−又はCH2−基は、−NH−、−NCH3−、−NH−CO−、−CO−NH−、−NH−CO−O−、−O−CO−NH−、−NH−CONH−、−NCH3−、−NCH3−CO−、−CO−NCH3−、−NCH3−CO−O−、−O−CO−NCH3−、−NCH3−CONCH3−、−O−、−CO−、−CO−O−、−O−CO−、−CH=CH−、−C≡C−、−O−CO−O−、又は非置換若しくは置換のシクロヘキシレン若しくはフェニレンにより置換されており;
好ましくはUは、水素又はQ1−(C1−C16アルキル)、好ましくはQ1−(C1−C12アルキル)であり、そして最も好ましくはQ1−(C1−C6アルキル)(非置換であるか、又はハロゲン、ニトリル、エーテル、エステル、アミド若しくはアミンにより;好ましくはフッ素若しくはニトリルで、特に1、2、3、4、5、6、7、8、9若しくは10個、更には1、2、3、4、5、6若しくは7個、そしてとりわけ1、2、3若しくは5個のフッ素原子で置換されている)であり;そしてここで、Q1−(C1−C16アルキル)の1個以上のC原子、CH−又はCH2−基は、相互に独立に、置換されていないか、又は上記の意味及び優先傾向内の連結基により置換されており;特に1個のC原子、CH−又はCH2−基が、−NH−、−NCH3−、−NH−CO−、−CO−NH−、−NH−CO−O−、−O−CO−NH−、−NH−CONH−、−NCH3−、−NCH3−CO−、−CO−NCH3−、−NCH3−CO−O−、−NCH3−CO−O−、−O−CO−NCH3−、−NCH3−CONCH3−、−O−、−CO−、−CO−O−、−O−CO−、−CH=CH−、−C≡C−、−O−CO−O−、又は非置換若しくは置換のシクロヘキシレン若しくはフェニレンにより置換されており;そしてここで、
Q1は、単結合又は−NH−、−NCH3−、−NH−CO−、−CO−NH−、−NH−CO−O−、−O−CO−NH−、−NH−CONH−、−O−、−CO−、−COO−、−OCO−、−S−、−CS−、−SCS−、−SCO−、−CH=CH−、−C≡C−若しくは−O−CO−O−を表し、好ましくはQ1は、−O−、−CO−、−COO−、−OCO−又は単結合を、更に好ましくは−O−又は単結合を表し;
好ましくはQ1−(C1−C6アルキル)のフッ素置換基は、アルキル基の末端位で、B環への連結部の反対側であり、更に好ましくは置換(C1−C6アルキル)は、−CF3、−CF2H、−CH2F、−CF2CF3、−CF2CHF2、−CF2CH2F、−CFHCF3、−CFHCHF2、−CFHCH2F、−CF2CH3、−CFHCHF2、−(CF2)2CF3、−(CF2)2CHF2、−(CF2)2CH2F、−(CF2)2CH3、−(CF2)3CHF2、−(CF2)3CH2F、−(CF2)3CF3、−CF(CF3)2又は−CF2(CHF)CF3であり、そして最も好ましくは式:−CF2H、−CF2H、−CH2F、−CF3、−CF2CF3、−CF2CHF2のものであり;そして特に最も好ましくは式:−CF3、−CH2F、−CF2CF3のものであり、特に−CF3であり;
更に好ましくはUは、水素、−CF3、−CF2H、−CH2F、−Q1−(C1−C6アルキレン)−CF3、−Q1−(C1−C6アルキレン)−CF2H、−Q1−(C1−C6アルキレン)−CH2F、−Q1−(C1−C6アルキレン)−CF2CF3、−Q1−(C1−C6アルキレン)−CF2CHF2、−Q1−(C1−C6アルキレン)−CF2CH2F、−Q1−(C1−C6アルキレン)−CFHCF3、−Q1−(C1−C6アルキレン)−CFHCHF2、−Q1−(C1−C6アルキレン)−CFHCH2F、−Q1−(C1−C6アルキレン)−CF2CH3、−Q1−(C1−C6アルキレン)−CFHCHF2、−Q1−(C1−C6アルキレン)−(CF2)2CF3、−Q1−(C1−C6アルキレン)−(CF2)2CHF2、−Q1−(C1−C6アルキレン)−(CF2)2CH2F、−Q1−(C1−C6アルキレン)−(CF2)2CH3、−Q1−(C1−C6アルキレン)−(CF2)3CHF2、−Q1−(C1−C6アルキレン)−(CF2)3CH2F、−Q1−(C1−C6アルキレン)−(CF2)3CF3、−Q1−(C1−C6アルキレン)−CF(CF3)2、−Q1−(C1−C6アルキレン)−CF2(CHF)CF3であり、そしてここで、1個以上のC原子、CH−又はCH2−基は、相互に独立に、置換されていないか、又は上記の意味及び優先傾向内の連結基により置換されており;特に1個のC原子、CH−又はCH2−基が、−NH−、−NCH3−、−NH−CO−、−CO−NH−、−NH−CO−O−、−O−CO−NH−、−NH−CONH−、−NCH3−、−NCH3−CO−、−CO−NCH3−、−NCH3−CO−O−、−O−CO−NCH3−、−NCH3−CONCH3−、−O−、−CO−、−CO−O−、−O−CO−、−CH=CH−、−C≡C−、−O−CO−O−、又は非置換若しくは置換のシクロヘキシレン若しくはフェニレンにより置換されており;そしてここで、
−Q1−は、上記の意味及び優先傾向を有しており、
R2及びR3は、それぞれ相互に独立に、水素、フッ素、塩素、ニトリル、非置換又はフッ素置換C1−C12アルキルであり、そしてここで、1個以上のC原子、CH−又はCH2−基は、連結基により置換されていてもよく;好ましくは水素、ニトリル又はFであり、そして更に好ましくは水素であり;
Xは、フェニレン、特に1,4−フェニレンのような二価芳香族基であるか;あるいはXは、−CH2−、−CO−、−CS−、−O(CO)−、−(CO)O−、−NH(CO)−、−(CO)NH−、−OCF2−、((C1−C6アルキル)−N)CO−、好ましくは((CH3)N)CO−、又は−S(CS)−、−O(CS)−、−S(CO)−であり、好ましくは−O(CO)−である]により表される、少なくとも1個の側方置換部分を有する、ポリマーを含む光整列材料である。
[式中、
X、Z及びUは、上記の意味及び優先傾向を有しており、
R1は、ハロゲン、C1−C6アルコキシ、C1−C16アルキル、ニトロ又はニトリルを表し、好ましくはメトキシ、塩素、フッ素又はニトリルを表し、そして更に好ましくはフッ素、又はメトキシを表し;
R1’及びR1”は、相互に独立に、水素、フッ素、C1−C6アルコキシ、ニトリル及び/又は塩素あるいはUの意味を有しており;好ましくは水素、メトキシ、フッ素又は塩素であり、そして更に好ましくは水素又はフッ素である]により表される、少なくとも1個の側方置換部分を有する、ポリマーを含む光整列材料である。
[式中、
Bは、非置換又は置換のベンゼン、フェニレン、ピリジン、トリアジン、ピリミジン、ビフェニレン、ナフタレン、フェナントレン、トリフェニレン、テトラリン、好ましくはフェニレン、又は脂環式基(シクロプロパン、シクロブタン、シクロペンタン、シクロペンテン、シクロヘキサン、シクロヘキセン、シクロヘキサジエン、デカリン、テトラヒドロフラン、ジオキサン、ピロリジン、ピペリジン及びステロイド骨格からから選択される)、好ましくはシクロヘキサン若しくはステロイド骨格を表し、好ましくはシクロヘキサン又はステロイド骨格であり;好ましくはBは、ベンゼン、フェニレン、ビフェニレン又はナフタレンであり、そして更に好ましくはBは、非置換又は置換のフェニレンであり;
R1は、ハロゲン、C1−C16アルコキシ、C1−C16アルキル、ニトロ又はニトリルを、好ましくはメトキシ、フッ素、塩素又はニトリルを、そして更に好ましくはフッ素、塩素又はメトキシを表し、
R2及びR3は、水素及び/又はニトリル、好ましくは水素であり、
Xは、フェニレン、特に1,4−フェニレンのような二価芳香族基であるか;あるいはXは、−CH2−、−CO−、−CS−、−O(CO)−、−(CO)O−、−NH(CO)−、−(CO)NH−、−OCF2−、((C1−C6アルキル)−N)CO−、−(C1−C16アルキレン)(CO)O−、−(C1−C16アルキレン)O(CO)−、−(CO)O(C1−C16アルキレン)−、−O(CO)(C1−C16アルキレン)−、−O(C1−C16アルキレン)−、−(C1−C16アルキレン)O−、((CH3)N)CO−、又は−S(CS)−、−O(CS)−、−S(CO)−であり、好ましくは1,4−フェニレン、−O(CS)−、−S(CO)−、−CS−、−CO−又は−O(CO)−であり、そして更に好ましくは−CO−又は−O(CO)−又は1,4−フェニレンであり;
Zは、−COO−、−OCO−、−OCF2−、−CF2O−、−(C1−C16アルキレン)(CO)O−、−(C1−C16アルキレン)O(CO)−、−(CO)O(C1−C16アルキレン)−、−O(CO)(C1−C16アルキレン)−、−O(C1−C16アルキレン)−、−(C1−C16アルキレン)O−、−CON(CH3)−、−(CH3)NCO−、−CONH−、−NHCO−、−OCH2−、−CH2O−、又は単結合を、好ましくは−COO−、−OCO−、−OCH2−、−OCF2−、−CF2O−、−CH2O−、又は単結合を、特に−OCO−、−OCH2−又は単結合を表し、
Uは、水素、−CF3、−CF2H、−CH2F、−Q1−(C1−C6アルキレン)−CF3、−Q1−(C1−C6アルキレン)−CF2H、−Q1−(C1−C6アルキレン)−CH2F、−Q1−(C1−C6アルキレン)−CF2CF3、−Q1−(C1−C6アルキレン)−CF2CHF2、−Q1−(C1−C6アルキレン)−CF2CH2F、−Q1−(C1−C6アルキレン)−CFHCF3、−Q1−(C1−C6アルキレン)−CFHCHF2、−Q1−(C1−C6アルキレン)−CFHCH2F、−Q1−(C1−C6アルキレン)−CF2CH3、−Q1−(C1−C6アルキレン)−CFHCHF2、−Q1−(C1−C6アルキレン)−(CF2)2CF3、−Q1−(C1−C6アルキレン)−(CF2)2CHF2、−Q1−(C1−C6アルキレン)−(CF2)2CH2F、−Q1−(C1−C6アルキレン)−(CF2)2CH3、−Q1−(C1−C6アルキレン)−(CF2)3CHF2、−Q1−(C1−C6アルキレン)−(CF2)3CH2F、−Q1−(C1−C6アルキレン)−(CF2)3CF3、−Q1−(C1−C6アルキレン)−CF(CF3)2、−Q1−(C1−C6アルキレン)−CF2(CHF)CF3であり、そしてここで、1個以上のC原子、CH−又はCH2−基は、相互に独立に、置換されていないか、又は上記の意味及び優先傾向内の連結基により置換されており;特に1個のC原子、CH−又はCH2−基が、−NH−、−NCH3−、−NH−CO−、−CO−NH−、−NH−CO−O−、−O−CO−NH−、−NH−CONH−、−NCH3−、−NCH3−CO−、−CO−NCH3−、−NCH3−CO−O−、−O−CO−NCH3−、−NCH3−CONCH3−、−O−、−CO−、−CO−O−、−O−CO−、−CH=CH−、−C≡C−、−O−CO−O−、又は非置換若しくは置換のシクロヘキシレン若しくはフェニレンにより置換されており;そしてここで、
Q1は、単結合又は−NH−、−NCH3−、−NH−CO−、−CO−NH−、−NH−CO−O−、−O−CO−NH−、−NH−CONH−、−O−、−CO−、−COO−、−OCO−、−S−、−CS−、−SCS−、−SCO−、−CH=CH−、−C≡C−若しくは−O−CO−O−を表し、好ましくはQ1は、−O−、−CO−、−COO−、−OCO−又は単結合、更に好ましくは−O−又は単結合であり;
Dは、非置換又は置換の脂肪族、芳香族又は脂環式重合性基を、好ましくは1〜40個の炭素原子を有するジアミン基を表し、更に好ましくはDは、芳香族重合性基であり、最も好ましくは芳香族重合性ジアミン基であり;
y及びzは、それぞれ相互に独立に、1、2、3又は4、好ましくは1又は2であり;更に好ましくはyは、2であり、かつzは、1であるか;又はzは、2であり、かつyは、1であり;そして更になお好ましくはy及びzは、1であり;
wは、1、2、3、4であり、そして好ましくは1又は2であり、更に好ましくはwは、1であり;
更に最も好ましくはwは、1であり、そしてyは2であり、かつzは、1であり;そしてzは、2であり、かつyは、1であるか;あるいは更に最も好ましくはwは、1であり、そしてy及びzは、1であり;特に最も好ましくはwは、1であり、そしてyは、2であり、かつzは1であり;そしてzは、2であり、かつyは、1であり;
S1及びS2は、それぞれ相互に独立に、単結合又はスペーサー単位を表し、そしてこの単位は、環状、直鎖又は分岐の置換又は非置換のC1−C24アルキレン、好ましくはC1−C12アルキレン、更に好ましくはC1−C6アルキレン、例えば、メチレン、エチレン、直鎖又は分岐のプロピレン、ブチレン、ペンチレン又はヘキシレンであり、ここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよく;ここで、この連結基は、好ましくは単結合、−O−、−O(CO)−、−S−、−(CO)O−、−C≡C−、又は下記式:
で示される基、−NR2−であり、そして更に好ましくは単結合、−O−、−O(CO)−又は−(CO)O−であり、そして最も好ましくは−O−であり;そしてここで、C1−C24アルキレンの置換基は、好ましくは少なくとも1個のC1−C6アルキル、好ましくはメチルであるか;かつ/あるいはこの単位は、式(V):
(式中、
C1、C2は、それぞれ独立に、脂環式又は芳香族の非置換又は置換の炭素環式又は複素環式基を表し、好ましくはC1及びC2は、S1及び/又はS2基が長い分子軸を持つように、Z1、Z2、Z1a及び/又はZ1a’を介して反対位置で結合しており、そして
Z1、Z2、Z1a、Z1a’は、それぞれ独立に、上記の意味及び優先傾向内の架橋基を表し、そして
a1、a3’、a2、a3は、それぞれ独立に、a1+a3’+a2+a3≦6、好ましくはa3及び/又はa3’が1であり、かつa1+a2≦4であるように、0〜3の整数を表す)で示される非芳香族、芳香族、非置換又は置換の炭素環式又は複素環式基であり、
最も好ましいS1及びS2は、それぞれ相互に独立に、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレン、そして更に別にC4−C12アルキレンを表し;そしてここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよく;ここで、この連結基は、好ましくは単結合、−O−、−O(CO)−、−S−、−(CO)O−、−C≡C−、又は下記式:
で示される基、−NR2−であり、そして更に好ましくは単結合、−O−、−O(CO)−又は−(CO)O−であり、そして最も好ましくは−O−であり;特に最も好ましくはS1及びS2は、一緒に単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレン、そして更に別にC4−C12アルキレンである]により表される化合物である。
[式中、
Dは、非置換又は置換の、脂肪族、芳香族又は脂環式の重合性基を、好ましくは1〜40個の炭素原子を有するジアミン基を表し、更に好ましくはDは、芳香族重合性基、最も好ましくは芳香族重合性ジアミン基であり;
w、y及びz、並びにS1及びS2、並びにUは、上記の意味及び優先傾向を有しており;
Rは、水素又はハロゲン、C1−C16アルコキシ、C1−C16アルキル、ニトロ又はニトリルであり、好ましくはメトキシ、フッ素、塩素又はニトリルであり、そして更に好ましくはフッ素、塩素又はメトキシであり、
R1’、R1”及びR1’’’は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味を有するが;ただし、少なくとも1個のR、R1’、R1”又はR1’’’は、水素ではなく;
好ましくはR1’、R1”及びR1’’’は、水素であり、かつRは、フッ素又はメトキシであり;
更に好ましいR1”及びR1’’’は、水素であり、かつRは、フッ素又は塩素であり、かつR1’は、フッ素又は塩素であるか、あるいはR1’は、フッ素であり、かつRは、水素であるか;あるいは
更に好ましいR1”及びR1’は、水素であり、かつR及びR1’’’は、フッ素であり;
Zは、上記の意味及び優先傾向を有する架橋基を表す]で示される化合物であり;特に最も好ましいのは、y、z及びwが、1であり、そしてS1が、ブチレン、ペンチレン又はヘキシレンを表し、そしてS2が、式(IV)の特に最も好ましい化合物と同じ意味及び優先傾向を有する、式(IVa)の化合物である。
Dは、1〜40個の炭素原子を有する、非置換又は置換の、脂肪族、芳香族又は脂環式のジアミン基を表し、更に好ましくはDは、芳香族重合性基であり;
Dは、好ましくは式(VI):
[式中、
R4、R5は、それぞれ相互に独立に、水素原子又はC1−C6アルキルを表し;
Sp1、Sp2は、それぞれ相互に独立に、非置換又は置換の直鎖又は分岐のC1−C24アルキレンを表し、そしてここで、1個以上の−CH2−基は、相互に独立に連結基により置換されていてもよく、そして
k1、k2は、それぞれ独立に0又は1、好ましくは0であり;そして
X4、X5は、それぞれ独立に、−O−、−S−、−NH−、−N(CH3)−、−CH(OH)−、−CO−、−CH2(CO)−、−SO−、−CH2(SO)−、−SO2−、−CH2(SO2)−、−COO−、−OCO−、−OCO−O−、−S−CO−、−CO−S−、−SOO−、−OSO−、−SOS−、−CH2−CH2−、−OCH2−、−CH2O−、−CH=CH−、若しくは−C≡C−又は単結合を、好ましくは単結合を表し;そして
t1、t2は、それぞれ独立に、0又は1の値を有する整数であり;そして
C4、C5は、それぞれ独立に、側鎖Tを有していてもよい、非芳香族、芳香族の、置換又は非置換の、炭素環式又は複素環式基を、好ましくは非置換又は置換フェニレンを表し、そして
Z4及びZ5は、相互に独立に、単結合、又は置換若しくは非置換の直鎖若しくは分岐のC1−C24アルキレン基を表し、そしてここで、1個以上のC原子、CH−又はCH2−基は、相互に独立に、非芳香族、芳香族の、非置換若しくは置換の、炭素環式若しくは複素環式基;及び/又はヘテロ原子及び/又は−O−、−CO−、−COO−、−OCO−、−OCF2−、−CF2O−、−CON(CH3)−、−(CH3)NCO−、−CONH−、−NHCO−、−CO−S−、−S−CO−、−CS−S−、−SOO−、−OSO−、−CH2(SO2)−、−CH2−CH2−、−OCH2−、−CH2O−、−CH=CH−、−C≡C−、−CH=CH−COO−、−OCO−CH=CH−により置換されていてもよく;好ましくは、Z4は、単結合であり、そしてZ5は、非置換又は置換の直鎖又は分岐のC1−C14アルキレン基、C1−C6アルキレンを表し、そしてここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、酸素又は窒素原子により置換されていてもよく、かつ/あるいは1個以上の炭素−炭素単結合は、炭素−炭素二重結合又は炭素−炭素三重結合により置換されており;そして
a4、a5は、相互に独立に、a4+a5≦4であるように、0、1、2又は3であり、好ましくはa4及びa5は、相互に独立に、0又は1であり、そして更に好ましくはa4又はa5の少なくとも一方は、1であり、そして最も好ましくはa4及びa5は、1である]から選択され;そしてここで、
Dは、少なくとも1個のスペーサー基:S2及び/又はS1に少なくとも1回結合しているか;かつ/あるいは少なくとも1個のSp1、Sp2、C4、C5、Z4及び/又はZ5を介して結合しており、そしてここで、k1、k2、a4及びa5の少なくとも1個は、0ではない。
[式中、
「−」は、C4及びC5の上記の式(VI)の化合物の隣接基に接続する結合を意味し;そして
Lは、水素、−CH3、−COCH3、−OCH3、ニトロ、ニトリル、ハロゲン、−CH2=CH−、−CH2=C(CH3)−、−CH2=CH−(CO)O−、−CH2=CH−O−、−NR5R6、−CH2=C(CH3)−(CO)O−、−CH2=C(CH3)−O−であり;そしてここで、
R5、R6は、それぞれ相互に独立に、水素原子又はC1−C6アルキルを表し;
Tは、置換又は非置換の直鎖又は分岐のC1−C24アルキレン基を表し、そしてここで、1個以上のC原子、CH−又はCH2−基は、相互に独立に、非芳香族、芳香族の、非置換若しくは置換の、炭素環式若しくは複素環式基、及び/又はヘテロ原子、及び/又は架橋基により置換されていてもよく、好ましくはTは、水素であり;
mは、0〜2の整数であり;好ましくは1又は0であり;そして更に好ましくは0であり;
u1は、0〜4の整数であり、好ましくは0であるが、ただし、m+u1≦4であり;そして
u2は、0〜3の整数であり、好ましくは0であるが、ただし、m+u2≦3であり;そして
u3は、0〜2の整数であり、好ましくは0であるが、ただし、m+u3≦2である]を意味する。
ジアミン基Dは更に、2個のアミノ基を持たない、以下に列挙されるアミノ化合物からのラジカルから選択されるが、これらは少なくとも1個の更に別のアミノ基との誘導体と見なされる:アニリン、4−アミノ−2,3,5,6−テトラフルオロ安息香酸、4−アミノ−3,5−ジヨード安息香酸、4−アミノ−3−メチル安息香酸、4−アミノ−2−クロロ安息香酸、4−アミノサリチル酸、4−アミノ安息香酸、4−アミノフタル酸、1−(4−アミノフェニル)エタノール、4−アミノベンジルアルコール、4−アミノ−3−メトキシ安息香酸、4−アミノフェニルエチルカルビノール、4−アミノ−3−ニトリル安息香酸、4−アミノ−3,5−ジニトロ安息香酸、4−アミノ−3,5−ジクロロ安息香酸、4−アミノ−3−ヒドロキシ安息香酸、4−アミノベンジルアルコール塩酸塩、4−アミノ安息香酸塩酸塩、パラローズアニリン塩基、4−アミノ−5−クロロ−2−メトキシ安息香酸、4−(ヘキサフルオロ−2−ヒドロキシイソプロピル)アニリン、ピペラジン−p−アミノベンゾアート、4−アミノ−3,5−ジブロモ安息香酸、イソニコチン酸ヒドラジドp−アミノサリチル酸塩、4−アミノ−3,5−ジヨードサリチル酸、4−アミノ−2−メトキシ安息香酸、2−[2−(4−アミノフェニル)−2−ヒドロキシ−1−(ヒドロキシメチル)エチル]イソインドリン−1,3−ジオン、4−アミノ−2−ニトロ安息香酸、2−(4−アミノフェニル)−3,3,3−トリフルオロ−2−ヒドロキシプロパン酸エチル、2−(4−アミノ−3−メチルフェニル)−3,3,3−トリフルオロ−2−ヒドロキシプロパン酸エチル、2−(4−アミノ−3−メトキシフェニル)−3,3,3−トリフルオロ−2−ヒドロキシプロパン酸エチル、4−アミノナフタレン−1,8−ジカルボン酸、4−アミノ−3−クロロ−5−メチル安息香酸、4−アミノ−2,6−ジメチル安息香酸、4−アミノ−3−フルオロ安息香酸、4−アミノ−5−ブロモ−2−メトキシベンゼンカルボン酸、3,3’−トリジン−5−スルホン酸、又はこれらの誘導体(重ねてただし、2個のアミノ基を持たない列挙される化合物は、少なくとも1個の更に別のアミノ基との誘導体と見なされる)。
から選択され、そして更に特に好ましいのは、下記式:
[式中、
L、L1、L2及びL3は、相互に独立に、水素、−CH3、−COCH3、−OCH3、ニトロ、ニトリル、ハロゲン、CH2=CH−、CH2=C(CH3)−、CH2=CH−(CO)O−、CH2=CH−O−、−NR5R6、CH2=C(CH3)−(CO)O−又はCH2=C(CH3)−O−であり、好ましくは水素であり、
T、T1、T2及びT3は、相互に独立に、単結合又は置換若しくは非置換の直鎖若しくは分岐のC1−C24アルキレン基であり、ここで、1個以上のC原子、CH−又はCH2−基は、相互に独立に、非芳香族、芳香族の、非置換若しくは置換の炭素環式若しくは複素環式基、及び/又はヘテロ原子及び/又は連結基により置換されていてもよく;
「−」は、単結合であり、
qは、1又は2の整数であり;そして
q1、q2及びq3は、相互に独立に、0〜2の整数であり;好ましくは1又は2であり;
mは、1又は2の整数であり、
m1、m2及びm3は、相互に独立に、0〜2の整数であり;好ましくは1又は2であり;
u3、u3’及びu3”は、相互に独立に、0〜2の整数であり;
R5、R6及びZ5は、上記のとおりであり;好ましくはZ5は、非置換又は置換の直鎖又は分岐のC1−C14アルキレン基、C1−C6アルキレンであり、ここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、酸素又は窒素原子により置換されていてもよく;更に好ましいZ5は、メチレン、エチレン、プロピレン、2,2−ジメチル−プロピレン、ブチレン、ペンチレン、ヘキシレン、2(−O−C1−C6アルキレン)メチレン若しくは2(−(CO)O−C1−C6アルキレン)メチレン又はそのモノ−若しくはビ−ラジカルであるが;ただし、
Dは、少なくとも1個の基:S1又はS2に、単結合「−」を介して、又は側鎖:T、T1、T2又はT3を介して;又はZ5基を介して、少なくとも1回結合しており;また、
u3+q、又はu3+mは、≦4であり;
u3+q1、及び/又はu3’+q2、及び/又はu3+m1、及び/又はu3’+m2、及び/又はu3”+q3、及び/又はu3”+m3は、≦4であり;
q1+q2、及びm1+m2、及びq1+q2+q3、及びm1+m2+m3は、≧1である]で示される。
から選択され、更に好ましいのは、下記式:
[式中、
「−」は、DからS1又はS2への結合を意味し、かつ単結合を表し;そして
Lは、−CH3、−COCH3、−OCH3、ニトロ、ニトリル、ハロゲン、CH2=CH−、CH2=C(CH3)−、CH2=CH−(CO)O−、CH2=CH−O−、−NR5R6、CH2=C(CH3)−(CO)O−又はCH2=C(CH3)−O−であり、ここで、
R5、R6は、それぞれ相互に独立に、水素又はC1−C6アルキル、好ましくは水素を表し;
u3は、0〜2の整数、好ましくは0である]で示される、本発明のジアミン化合物である。
[式中、アルキレンは、好ましくは式(IV)の化合物中のS1又はS2又はXに少なくとも1回結合しているC1−C24アルキレンである]
[式中、X9、X10、X11及び/又はフェニレンは、式(IV)の化合物中のS1又はS2又はXに少なくとも1回結合しており、そしてここで、
X4、X6、X7、X8、X9、X10及びX11は、相互に独立に、架橋基又は単結合である];又は以下に与えられる化合物の群:
[式中、X5は、上記の意味を有しており、そしてX17は、CH2、O、NHであり、そしてこの基は、式(IV)の化合物中のS1又はS2又はXにアリール基で結合している]から選択される式(XIV)、及び(XV):
[式中、
R9、R10、R11は、相互に独立に上記の意味を有しており、そしてR9及びR10は、C1−C30アルキル、そして好ましくはメチルであり、そしてR11は、2−メチルヘプタンであり、そしてyが1であるならば、nは0であり、そしてnが1であるならば、yは0であり、そしてy1は、単結合又は二重結合であり、そしてX18は、カルボニル又は単結合又はNHであり、そして
X17は、CH2、O、NHであり、そして
この基は、式(IV)の化合物中のS1又はS2又はXに結合している]で示されるジアミン類に関する。
[式中、R3は、上記と同じ意味及び優先傾向を有しており、そしてa、b及びcは、相互に独立に、1、2又は3であり、そしてcは、1〜20の整数である]で示される基、例えば、下記式:
[式中、X13は、メチレン、エチレン、プロピレン又はブチレンであり、そしてR3は、同じ意味を有しており、そして好ましくはメチル、エチル又はプロピルである]で示される基である、ジアミン基D(XV)である。
[式中、R9及びR10は、相互に独立に、水素、ハロゲン、ヒドロキシル、炭素環式又は複素環式の非芳香族基、あるいはC1−C30アルキル(分岐の、直鎖の、置換の、非置換の、中断されていない、又は上記のように中断されている、そして好ましくは連結基により中断されている、そして更に好ましくは炭素環式又は複素環式の非芳香族基(シクロヘキシレン又はC17−C40脂環式基など)により中断されている)であり、そして
このシクロヘキシル基は、式(IV)の化合物中のS1又はS2又はXに結合している]で示されるジアミン基D(VIII)である。
[式中、
X14は、架橋基又は単結合であり、そして好ましくは−COO−、−CONH−、単結合、−O−、−S−、メチレン、エチレン、プロピレンであり、R9及びR10は、相互に独立に、水素、ハロゲン、ヒドロキシル、炭素環式若しくは複素環式の非芳香族基又はC1−C30アルキルであり;
好ましくはX14は、単結合、又はCF3、OCF3、Fで置換若しくは非置換の、メチレン、エチレン、プロピレン、ブチレン若しくはペンチレンであり、そしてR9及びR10は、ハロゲン又は置換若しくは非置換の、メチレン、エチレン、プロピレンであり、そして
少なくとも1個のシクロヘキシル基は、式(IV)の化合物中のS1又はS2又はXに結合している]である。
[式中、R11、R12、R13及びR14は、相互に独立に、水素、ハロゲン、ヒドロキシル、炭素環式若しくは複素環式の非芳香族基又はC1−C30アルキルであり、好ましくはC1−C30アルキルは、メチル、エチル、プロピル、ブチル、ペンチル若しくはヘキシル、1,1’−シクロヘキシル、4−(C1−C30アルキル)−シクロヘキシル、3,4”−ビス[4’−(C1−C30アルキル)−1,1’−ビ(シクロヘキシル)−4−イル]、1,1’−ビ(シクロヘキシル)−4−イル、2−ピリジン、ピロリジン−2,5−ジオンであって、非置換であるか、又はCF3、OCF3、F、ベンジル、ペンチル、安息香酸エステル、4−(フェノキシカルボニル)、カルボン酸、−SO3H、−PO3H、−OR15により置換されており、そしてここで、R15は、C1−C30アルキル、好ましくは−C12H25、非置換又は置換のベンジルであり、そしてこのフェニル基は、式(IV)の化合物中のS1又はS2又はXに結合しており、好ましくは(X-1)の2個のNH2基は、フェニレン環のメタ又はパラ位にある]であり、(X-1)の更に別の好ましい構造は、下記式:
[式中、R11は、上記の意味及び優先傾向を有しており、
X15及びX16は、相互に独立に、単結合又はC1−C30アルキル、好ましくはC1−C6アルキル、−COO−及び−CONH−、−COO(C1−C6アルキレン)−、−CONH(C1−C6アルキレン)−であり、そして
少なくとも1個のフェニル基は、式(IV)の化合物中のS1又はS2又はXに結合している]で示される。
[式中、X6は、上記の意味及び優先傾向を有しており、そして好ましくは、例えば、−O−、−S−又は置換若しくは非置換のC1−C6アルキレン、−O−(CH2CH2O)n−、−O−(C1−C12アルキル)n−O−、−S−(C1−C12アルキル)n−S−、トリアジン、1,3,5−トリアジナン−2,4,6−トリオン、1,1’−シクロヘキシレン、NR5((C1−C6アルキル)nNR6)、−(ピペリジン)n1−(C1−C6アルキル)n−(ピペリジン)n(ここで、nは、1〜6の整数であり、そしてn1は、0〜6の整数である)であり、そして
R11、R12、R13及びR14は、相互に独立に、上記の意味及び優先傾向を有しており、そして
少なくとも1個のフェニル基又はX6は、式(IV)の化合物中のS1又はS2又はXに結合している]で示される。
[式中、R11及びR12は、相互に独立に、上記と同じ意味を有しており、そして好ましくは、水素、C1−C6アルキル、ヒドロキシ、又は4−(C1−C30アルキル)−シクロヘキシル又は3,4”−ビス[4’−(C1−C30アルキル)−1,1’−ビ(シクロヘキシル)−4−イル]であり、そして
少なくとも1個のフェニル基又はX6は、式(IV)の化合物中のS1又はS2又はXに結合している]で示される。
[式中、nは、相互に独立に、0又は1であり、そしてR3、R11、R12、X14及びX17は、上記と同じ意味及び優先傾向を有しており、そして少なくとも1個のフェニル基又はシクロヘキシル基又はX17は、式(IV)の化合物中のS1又はS2又はXに結合している]に与えられる、ジアミン基D(XI)であり、そして
更に好ましいのは、ジアミン基(XI):
4,4’−ジアミノジフェニル、4,4’−ジアミノジフェニル−3,3’−ジメトキシ、4,4’−ジアミノジフェニル−3,3’−ジメチル、4,4’−ジアミノジフェニル−3,3’−ジヒドロキシ、4,4’−ジアミノジフェニルメタン、4,4’−ジアミノジフェニルスルフィド、4,4’−ジアミノジフェニルスルホン、4,4’−ジアミノジフェニルカルボニル、4,4’−ジアミノジフェニル−オキソメチレン、4,4’−ジアミノジフェニル−ビス(トリフルオロメチル)−メチレン、4,4’−ジアミノジフェニル−ビス(トリフルオロメチル)メチレン−3,3’−ジメトキシ又は4,4’−ジアミノジフェニル−ビス(トリフルオロメチル)メチレン−3,3’−ジヒドロキシ、4,4’−ジアミノジフェニルエーテル、4,4’−(p−フェニレンイソプロピリデン)ビスアニリン、2,2−ビス[4−(4−アミノフェノキシ)フェニル]−ヘキサフルオロプロパン、2,2’−ビス[4−(4−アミノ−2−トリフルオロメチル−フェノキシ)フェニル]ヘキサフルオロプロパン、4,4’−ジアミノ−2,2’−ビス(トリフルオロメチル)−ビフェニル、4,4’−ビス[4−アミノ−2−トリフルオロメチル−フェノキシ]−オクタフルオロビフェニルである。
R11及びR12は、相互に独立に、好ましくは水素、メチル、エチル、プロピル、ブチル、ペンチル又はヘキシルであり;
好ましくはX10は、−SO−、−SO2−、−O−、−N(CH3)−、−C(CH3)2−、−C(CF3)2−、1,1’−シクロヘキシル、4−(C1−C30アルキル)−シクロヘキシル、3,4”−ビス[4’−(C1−C30アルキル)−1,1’−ビ(シクロヘキシル)−4−イル]又は1,1’−ビ(シクロヘキシル)−4−イルであり、そしてX9及びX11は、同一であって、かつメチレン、エチレン、プロピレン、ブチレン、ペンチレン、ヘキシレン又は−O−であり;そして
nは、0〜3の整数、好ましくは0又は1であり;そして
nが0であるばならば、X9及びX11は、同一であって、かつメチレン、エチレン、プロピレン、ブチレン、ペンチレン、ヘキシレン、−O−、−S−、−C(CH3)2−、−C(CF3)2−である。
[式中、nは、0又は1であり、そしてX7及びX8、X9及びX10又はX11は、上記の意味及び優先傾向を有しており、そして少なくとも1個のフェニル基又はX9又はX10は、式(IV)の化合物中のS1又はS2又はXに結合している]で示される。
に与えられる化合物、及び更には、1−コレステリル−オキシ−2,4−ジアミノ−ベンゼン、1−コレスタニルオキシ−2,4−ジアミノベンゼン、コレステリルオキシ(3,5−ジアミノ−ベンゾイル)、コレスタニルオキシ(3,5−ジアミノベンゾイル)である。
[式中、
S1、S2、Z、U、y及びzは、化合物(IV)について与えられた上記の意味及び優先傾向を有しており;そしてR、R1’、R1”は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素の意味を有するが、ただし、少なくとも1個のR、R1’又はR1”は、水素ではなく;好ましくは、R及びR1’は、化合物(IVa)について与えられた上記の意味及び優先傾向を有しており;R1”は、化合物(IVa)中のR1”及びR1’’’について与えられた上記の意味及び優先傾向を有する]で示される化合物である。
[式中、
S1、S2、Z、U、y及びzは、相互に独立に、化合物(IV)について与えられた意味及び優先傾向を有しており;そしてR1”、R1’’’は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味、並びに化合物(IVa)について与えられた優先傾向を有するが、ただし、少なくとも1個のR1”又はR1’’’は、水素ではない];
[式中、
S1、S2、Z、U、y及びzは、相互に独立に、化合物(IV)について与えられた意味及び優先傾向を有しており;そしてR1”、R1’’’は、化合物(IVa)について与えられた上記の意味及び優先傾向を有しており、そして好ましくは、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味、好ましくは水素の意味を有する];
[式中、
S1、S2、y、z、Z及びUは、(IV)について記載された上記の意味、そして好ましくは(XVIIa)、(XVIIb)、(XVIIc)、(XVIId)、(XVIIf)について以下に記載される意味を有しており、そして
R1’、R1”は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味、好ましくは水素の意味を有する]。
[式中、U、S2、S1、Z、y及びzは、上記の意味、そして好ましくは(XVIII)又は(XIX)について以下に記載される意味を有しており;そして
R、R1’、R1”は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味を有するが、ただし、少なくとも1個のR1’又はR1”は、水素ではなく;そして
X6は、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C6アルキレンである]で示される化合物;又は式(XIX):
[式中、U、S2、S1、Z、y及びzは、上記の意味、そして好ましくは(XVIII)又は(XIX)について以下に記載される意味を有しており;そして
R、R1’、R1”は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味を有するが、ただし、少なくとも1個のR、R1’、R1”は、水素ではなく;そして
X6は、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C6アルキレンである]で示される化合物である。
[式中、
S1、S2、R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有しており;そして
y及びzは、それぞれ相互に独立に、1、2、3又は4、好ましくは1又は2であり;更に好ましくはyは2であり、かつzは1であるか;又はzは2であり、かつyは1であり;そして更に好ましくはy及びzは1であるか;あるいは
R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有しており;そして
S1及びS2は、それぞれ相互に独立に、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレン、そして更に別にC4−C12アルキレンを表し;そしてここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよく、そしてここで、この連結基は、好ましくは単結合、−O−、−O(CO)−、−S−、−(CO)O−、−C≡C−、又は下記式:
で示される基、−NR2−であり、そして更に好ましくは単結合、−O−、−O(CO)−又は−(CO)O−であり、そして最も好ましくは−O−であり;特に最も好ましくはS1及びS2は、一緒に単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレン、そして更に別にC4−C12アルキレンである]で示される化合物であり、更には
好ましくは最も好ましいのは、式(XVIIb)又は(XVIIc):
[式中、
S1、S2、y、z、R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有する]で示される化合物であり、そして
更に好ましくは最も好ましいのは、式(XVIId)及び(XVIIe):
[式中、
S1、S2、R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有しており;そして
y及びzは、それぞれ相互に独立に、1、2、3又は4、好ましくは1又は2であり;更に好ましくはyは2であり、かつzは1であるか;又はzは2であり、かつyは1であり;そして更に好ましくはy及びzは1であり;
最も好ましいS1及びS2は、それぞれ相互に独立に、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレン、そして更に特にC4−C12アルキレンを表し;そしてここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよく、そしてここで、この連結基は、好ましくは単結合、−O−、−O(CO)−、−S−、−(CO)O−、−C≡C−、又は下記式:
で示される基、−NR2−であり、そして更に好ましくは単結合、−O−、−O(CO)−又は−(CO)O−であり、そして最も好ましくは−O−であり;特に最も好ましくはS1及びS2は、一緒に単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレン、そして更に別にC4−C12アルキレンである]で示される化合物であるか、又は
更に、好ましくは最も好ましいのは、(XVIIf):
[式中、
R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有しており;そして
最も好ましいS2は、それぞれ相互に独立に、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレンを表し;そしてここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよく、そしてここで、この連結基は、好ましくは単結合、−O−、−O(CO)−、−S−、−(CO)O−、−C≡C−、又は下記式:
で示される基、−NR2−であり、そして更に好ましくは単結合、−O−、−O(CO)−又は−(CO)O−であり、そして最も好ましくは−O−であり;特に最も好ましくはS1及びS2は、一緒に単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレン、そして更に特にC4−C12アルキレンである]で示される化合物であるか、又は
更に、特に好ましく最も好ましいのは、式(XVIII)又は(XIX):
で示される化合物であり、そして
好ましくは化合物(XIX)は、式(XVIIIa)の化合物であり、そして化合物(XVIII)は、式(XIXa)、(XVIIIa)又は(XVIIIb):
[式中、R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有しており;そして
S1及びS2は、それぞれ相互に独立に、単結合又はスペーサー単位を表し、そしてこの単位は、環状、直鎖又は分岐の置換又は非置換のC1−C24アルキレン、好ましくはC1−C12アルキレン、更に好ましくはC1−C6アルキレン、例えば、メチレン、エチレン、直鎖又は分岐のプロピレン、ブチレン、ペンチレン又はヘキシレンであり、ここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよく、ここで、この連結基は、好ましくは単結合、−O−、−O(CO)−、−S−、−(CO)O−、−C≡C−、又は下記式:
で示される基、−NR2−であり、そして更に好ましくは単結合、−O−、−O(CO)−又は−(CO)O−であり、そして最も好ましくは−O−であり;そしてここで、置換基は、好ましくは少なくとも1個のC1−C6アルキル、好ましくはメチルであり;かつ/あるいはS1及びS2は、式(V):
(式中、
C1、C2は、それぞれ独立に、脂環式又は芳香族の非置換又は置換の炭素環式又は複素環式基を表し、好ましくはC1及びC2は、S1及び/又はS2基が長い分子軸を持つように、架橋基Z1、Z2、Z1a及び/又はZ1a’を介して反対位置で結合しており、そして
Z1、Z2、Z1a、Z1a’は、それぞれ独立に、上記の意味及び優先傾向内の架橋基を表し、そして
a1、a3’、a2、a3は、それぞれ独立に、a1+a3’+a2+a3≦6、好ましくはa3及び/又はa3’が1であり、かつa1+a2≦4であるように、0〜3の整数を表す)で示される非芳香族、芳香族、非置換又は置換の炭素環式又は複素環式基を表し、
最も好ましいS1及びS2は、それぞれ相互に独立に、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレン、特にC1−C2アルキレン、そして更に特にC4−C12アルキレンを表し;そしてここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよく;ここで、この連結基は、好ましくは単結合、−O−、−O(CO)−、−S−、−(CO)O−、−C≡C−、又は下記式:
で示される基、−NR2−であり、そして更に好ましくは単結合、−O−、−O(CO)−又は−(CO)O−であり、そして最も好ましくは−O−であり;特に最も好ましくはS1及びS2は、一緒に単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレン、好ましくはC1−C6アルキレンであり;そして
y及びzは、それぞれ相互に独立に、1、2、3又は4、好ましくは1又は2であり;更に好ましくはyは2であり、かつzは1であるか;又はzは2であり、かつyは1であり;そして更に好ましくはy及びzは1であり;
X6は、好ましくは単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C6アルキレン、好ましくは直鎖又は分岐のプロピレン、ブチレン、ペンチレン又はヘキシレンであり、そしてこれらは、側鎖と1回又は2回結合しており、特にここで、プロピレンが、2位で1回又は2,2’位で2回結合しており、そしてブチレンが、2位及び/又は3位で1回又は2回結合している]で示される化合物である。
[(XX)、(XXI)、(XXII)、(XXIII)、(XXIV)、(XXV)、(XXVa)中、
U、Zは、相互に独立に、上記の意味及び優先傾向を有しており、そして
R1’、R1”及びR1’’’は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素の意味を有しており、好ましくはR1’、R1”は、水素であり、そしてR1’’’は、水素、メトキシ、フッ素、ニトリル及び/又は塩素である]、
[式中、
U、Zは、相互に独立に、上記の意味及び優先傾向を有しており、そしてZは、好ましくは−OCO−、−OCH2−又は単結合であり、
更に別の好ましい実施態様では、Zは、−OCH2−又は単結合であり、そして
R1”及びR1’’’は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素の意味を有するが、ただし、少なくとも1個のR1”又はR1’’’は、水素ではない]。
1,4,5,8−ナフタレンテトラカルボン酸二無水物、
2,3,6,7−ナフタレンテトラカルボン酸二無水物、
3,3’,4,4’−ジメチルジフェニルシランテトラカルボン酸二無水物、
3,3’,4,4’−テトラフェニルシランテトラカルボン酸二無水物、1,2,3,4−フランテトラカルボン酸二無水物、
4,4’−ビス(3,4−ジカルボキシフェノキシ)ジフェニルスルフィド二無水物、4,4’−ビス(3,4−ジカルボキシフェノキシ)ジフェニルスルホン二無水物、4,4’−ビス(3,4−ジカルボキシフェノキシ)ジフェニルプロパン二無水物、3,3’,4,4’−ビフェニルテトラゾリルカルボン酸二無水物、エチレングリコールビス(トリメリット酸)二無水物、4,4’−(1,4−フェニレン)ビス(フタル酸)二無水物、4,4’−(1,3−フェニレン)ビス(フタル酸)二無水物、
4,4’−(ヘキサフルオロイソプロピリデン)ジフタル酸二無水物、4−tert−ブチル−6−(2,5−ジオキソテトラヒドロ−3−フラニル)−2−ベンゾフラン−1,3−ジオン、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−3a,4,5,9b−テトラヒドロナフト[1,2−c]フラン−1,3−ジオン、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−5−メチル−3a,4,5,9b−テトラヒドロナフト[1,2−c]フラン−1,3−ジオン、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−6−メチルヘキサヒドロ−2−ベンゾフラン−1,3−ジオン、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−7−メチル−3a,4,5,7b−テトラヒドロ−2−ベンゾフラン−1,3−ジオン、
6−(2,5−ジオキソテトラヒドロ−3−フラニル)−4−メチルヘキサヒドロ−2−ベンゾフラン−1,3−ジオン、
9−イソプロピルオクタヒドロ−4,8−エテノフロ[3’,4’:3,4]シクロブタ[1,2−f][2]ベンゾフラン−1,3,5,7−テトロン、
1,2,5,6−シクロオクタンテトラカルボン酸二無水物、
オクタヒドロ−4,8−エテノフロ[3’,4’:3,4]シクロブタ[1,2−f][2]ベンゾフラン−1,3,5,7−テトロン、
オクタヒドロ[3’,4’:3,4]シクロブタ[1,2−f][2]ベンゾフラン−1,3,5,7−テトロン、
テトラヒドロ−3,3’−ビフラン−2,2’,5,5’−テトロン、
4,4’−オキシジ(1,4−フェニレン)ビス(フタル酸)二無水物、及び4,4’−メチレンジ(1,4−フェニレン)ビス(フタル酸)二無水物である。
ピロメリット酸二無水物、
3,3’,4,4’−ベンゾフェノンテトラカルボン酸二無水物、
4,4’−オキシジフタル酸二無水物、
3,3’,4,4’−ジフェニレンスルホンテトラカルボン酸二無水物、
1,4,5,8−ナフタレンテトラカルボン酸二無水物、
2,3,6,7−ナフタレンテトラカルボン酸二無水物、
3,3’,4,4’−ジメチルジフェニルシランテトラカルボン酸二無水物、
3,3’,4,4’−テトラフェニルシランテトラカルボン酸二無水物、
1,2,3,4−フランテトラカルボン酸二無水物、
4,4’−ビス(3,4−ジカルボキシフェノキシ)ジフェニルスルフィド二無水物、
4,4’−ビス(3,4−ジカルボキシフェノキシ)ジフェニルスルホン二無水物、
4,4’−ビス(3,4−ジカルボキシフェノキシ)ジフェニルプロパン二無水物、
3,3’,4,4’−ビフェニルテトラカルボン酸二無水物、
エチレングリコールビス(トリメリット酸)二無水物、
4,4’−(1,4−フェニレン)ビス(フタル酸)二無水物、
4,4’−(1,3−フェニレン)ビス(フタル酸)二無水物、
4,4’−(ヘキサフルオロイソプロピリデン)ジフタル酸二無水物、
4,4’−オキシジ(1,4−フェニレン)ビス(フタル酸)二無水物、
4,4’−メチレンジ(1,4−フェニレン)ビス(フタル酸)二無水物、
4−tert−ブチル−6−(2,5−ジオキソテトラヒドロ−3−フラニル)−2−ベンゾフラン−1,3−ジオンなどである。
1,2,3,4−シクロブタンテトラカルボン酸二無水物、
1,2,3,4−シクロペンタンテトラカルボン酸二無水物、
2,3,5−トリカルボキシシクロペンチル酢酸二無水物、
テトラヒドロ−4,8−メタノフロ[3,4−d]オキセピン−1,3,5,7−テトロン、
3−(カルボキシメチル)−1,2,4−シクロペンタントリカルボン酸1,4:2,3−二無水物、
ヘキサヒドロフロ[3’,4’:4,5]シクロペンタ[1,2−c]ピラン−1,3,4,6−テトロン、
5−(2,5−ジオキソテトラヒドロフラン−3−イル)−3−メチル−3−シクロヘキセン−1,2−ジカルボン酸二無水物、
ピロメリット酸二無水物、
4−(2,5−ジオキソテトラヒドロフラン−3−イル)テトラヒドロナフタレン−1,2−ジカルボン酸二無水物、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−5−メチル−3a,4,5,9b−テトラヒドロナフト[1,2−c]フラン−1,3−ジオン、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−3a,4,5,9b−テトラヒドロナフト[1,2−c]フラン−1,3−ジオン、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−7−メチル−3a,4,5,7a−テトラヒドロ−2−ベンゾフラン−1,3−ジオン、
4−tert−ブチル−6−(2,5−ジオキソテトラヒドロ−3−フラニル)−2−ベンゾフラン−1,3−ジオン、
4,4’−(ヘキサフルオロイソプロピリデン)ジフタル酸二無水物、及び
ビシクロ[2.2.2]オクタ−7−エン−2,3,5,6−テトラカルボン酸二無水物から選択される。
1,2,3,4−シクロブタンテトラカルボン酸二無水物、
1,2,3,4−シクロペンタンテトラカルボン酸二無水物、
2,3,5−トリカルボキシシクロペンチル酢酸二無水物、エキソ−2,3,5−トリカルボキシシクロペンチル酢酸二無水物、少なくとも90%のエキソ−2,3,5−トリカルボキシシクロペンチル酢酸二無水物を含有する混合物、テトラヒドロ−4,8−メタノフロ[3,4−d]オキセピン−1,3,5,7−テトロン、
3−(カルボキシメチル)−1,2,4−シクロペンタントリカルボン酸1,4:2,3−二無水物、
ヘキサヒドロフロ[3’,4’:4,5]シクロペンタ[1,2−c]ピラン−1,3,4,6−テトロン、
5−(2,5−ジオキソテトラヒドロフラン−3−イル)−3−メチル−3−シクロヘキセン−1,2−ジカルボン酸二無水物、
ピロメリット酸二無水物、4−(2,5−ジオキソテトラヒドロフラン−3−イル)テトラヒドロナフタレン−1,2−ジカルボン酸二無水物、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−5−メチル−3a,4,5,9b−テトラヒドロナフト[1,2−c]フラン−1,3−ジオン、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−3a,4,5,9b−テトラヒドロナフト[1,2−c]フラン−1,3−ジオン、
5−(2,5−ジオキソテトラヒドロ−3−フラニル)−7−メチル−3a,4,5,7a−テトラヒドロ−2−ベンゾフラン−1,3−ジオン、
4−tert−ブチル−6−(2,5−ジオキソテトラヒドロ−3−フラニル)−2−ベンゾフラン−1,3−ジオン、
4,4’−(ヘキサフルオロイソプロピリデン)ジフタル酸二無水物、及び
ビシクロ[2.2.2]オクタ−7−エン−2,3,5,6−テトラカルボン酸二無水物から選択される。
− 場合により少なくとも2種の異なるテトラカルボン酸二無水物及び上記された所定の優先傾向内の化合物(I)(ここで、重合性基は、アミンである);及び/又は
− 場合により少なくとも2種の異なる上記された所定の優先傾向内の化合物(I)(ここで、好ましくは重合性基は、アミン、好ましくは2個のアミン基である);
− 場合により上記された所定の優先傾向内の化合物(I)(ここで、重合性基は、アミンである)、及び式(I)の側鎖に結合していない少なくとも1種の更に別の本発明のジアミン。好ましくは側鎖(I)への結合の代わりに、このジアミンは、この潜在的連結位置が水素で飽和されている。
− 場合により上記の溶媒、及び/又は
− 場合により後述の添加剤。
− 少なくとも2種の異なるテトラカルボン酸二無水物及び上記された所定の優先傾向内の化合物(I)(ここで、重合性基は、アミンである);及び/又は
− 少なくとも2種の異なる上記された所定の優先傾向内の化合物(I)(ここで、好ましくは重合性基は、アミン、好ましくは2個のアミン基である);
− 上記された所定の優先傾向内の化合物(I)(ここで、重合性基は、アミンである)、及び式(I)の側鎖に結合していない少なくとも1種の更に別の本発明のジアミン。好ましくは側鎖(I)への結合の代わりに、このジアミンは、この潜在的連結位置が水素で飽和されている。
− 垂直に整列しているポリマー層の製造方法;
− ポリマー層のマルチドメイン垂直アラインメントの製造方法;
− 光軸が傾斜したポリマー層の製造方法。
質量分析EI=EI(電子衝撃)
1H NMR=1H核磁気共鳴分光法
DMSOd6=ジメチルスルホキシド重水素化
300MHz=300メガヘルツ
M+=カチオンの分子量
m=多重項
d=二重項
dd=ダブル二重項
t=三重項
s=一重項
q=四重項
br=ブロード
HCl=塩化水素
NaOH=水酸化ナトリウム
NMP=N−メチル−2−ピロリドン
THF=テトラヒドロフラン
プレチルト=液晶のチルト
6−ヒドロキシヘキシル−3,5−ジニトロベンゾアート及び2−(2,4−ジニトロフェニル)エタノールは、WO 2007/071091 A1(引用例として本明細書に取り込まれる)の79及び92ページに記載される製造法により調製する。
化合物(1): 2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンゾニトリルの調製
4−ヨード−1,1,1−トリフルオロブタン464.5g(1.95mol)、4−ニトリル−3−フルオロフェノール267.6g(1.95mol)及び炭酸カリウム539.5g(3.90mol)をNMP 3Lに溶解する。この混合物を一晩80℃に加熱する。溶液を室温まで冷却して、反応混合物を酢酸エチル及び水で抽出する。有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過して減圧下で濃縮することにより、化合物(1)503gを得る。
化合物(2): 2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸の調製
化合物(1)61.8g(250.0mmol)、硫酸150mL、酢酸600mL及び塩酸400mLを2日間加熱還流する。この混合物を冷却して、水2.5Lに注ぎ入れる。固体を濾過して、水で洗浄する。この固体を真空下で乾燥することにより、化合物(2)53.4gを得る。
化合物(3): 2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−ホルミルフェニルの調製
化合物(2)5.0g(18.7mmol)、4−ヒドロキシベンズアルデヒド2.29g(18.78mmol)、4−ジメチルアミノピリジン0.23g(1.88mmol)をジクロロメタン25mLに溶解する。ジシクロヘキシルカルボジイミド(DCC)3.88g(18.78mmol)を0℃で加える。この溶液を0℃で1時間撹拌して、室温で一晩撹拌させておく。室温で22時間後、反応混合物をジクロロメタンと水とに分液する。有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過して減圧下で濃縮することにより、化合物(3)6.92gを得る。
化合物(4): (2E)−3−(4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エン酸の調製
化合物(3)6.92g(18.68mmol)及びマロン酸3.32g(31.93mmol)をピリジン15mLに溶解する。ピロリジン0.78mL(9.39mmol)をこの懸濁液に加えて、これを90℃でアルゴン下2.5時間反応させる。次にこの黄色の溶液を氷上に注ぐ。25% HCl溶液でこの溶液を注意深くpH=1〜2まで酸性にして、15分間撹拌する。生成物を濾別して、室温で真空下乾燥することにより、化合物(4)7.75gを得る。
化合物(5): 2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−{(1E)−3−[2−(2,4−ジニトロフェニル)エトキシ]−3−オキソプロパ−1−エニル}フェニルの調製
2−(2,4−ジニトロフェニル)エタノール2.50g(11.8mmol)、化合物(4)4.86g(11.8mmol)、4−ジメチルアミノピリジン144mg(1.2mmol)をジクロロメタン30mLに溶解する。N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド塩酸塩(EDC塩酸塩)2.48g(13.0mmol)を0℃で加える。この溶液を0℃で1時間撹拌し、室温で一晩撹拌させておく。室温で22時間後、反応混合物をジクロロメタンと水とに分液する。有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過して減圧下で濃縮する。トルエン:酢酸エチル(95:5)を溶離液として用いて残渣を200gシリカゲルのクロマトグラフィーに付し、酢酸エチル:ヘキサン混合物から結晶化することにより、化合物(5)5.08g(71%)が無色の結晶として生成する。
化合物(6): 2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−{(1E)−3−[2−(2,4−ジアミノフェニル)エトキシ]−3−オキソプロパ−1−エニル}フェニルの調製
化合物(5)5.8g(8.38mmol)をN,N−ジメチルホルムアミド54mL及び水6mLの混合物に溶解する。塩化第二鉄六水和物13.9g(51.4mmol)を加える。亜鉛粉末5.60g(85.7mmol)を少量ずつ60分以内に加える。この混合物を2時間反応させる。反応混合物を酢酸エチルと水とに分液して、濾過する。有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過して減圧下で濃縮する。トルエン:酢酸エチル(1:3)を溶離液として用いて残渣を200gシリカゲルで濾過し、酢酸エチル:ヘキサン混合物から結晶化することにより、化合物(6)3.30gが無色の結晶として生成する。
化合物(7): 3−メトキシ−4−(ペンチルオキシ)安息香酸の調製
ブロモペンタン16.57g(109.7mmol)、バニリン酸メチル20g(109.7mmol)及び炭酸カリウム30.30g(219mmol)をNMP 200mLに溶解する。この混合物を一晩80℃に加熱する。1N NaOH溶液100mL(100mmol)を上記混合物に加えた。反応が終了するまで、この懸濁液を還流温度で30分間加熱する。この反応混合物を室温で冷却させて、冷水に注ぎ入れる。25% HCl溶液でこの溶液を注意深く酸性にして、15分間撹拌する。生成物を濾別し、水で洗浄して室温で真空下一晩乾燥することにより、化合物(7)23.90g(97%)を白色の固体として得る。
化合物(8): 2,3−ジフルオロ−4−(ペンチルオキシ)安息香酸の調製
2,3−ジフルオロ−4−ヒドロキシ安息香酸19.09g(109.7mmol)を硫酸2滴を加えたメタノール500mL中で22時間還流する。溶媒を真空下で留去する。残渣にブロモペンタン16.57g(109.7mmol)、炭酸カリウム30.30g(219mmol)及びNMP 200mLを加える。この混合物を一晩80℃に加熱する。1N NaOH溶液100mL(100mmol)を上記混合物に加えた。反応が終了するまで、この懸濁液を還流温度で30分間加熱する。反応混合物を室温で冷却させて、冷水に注ぎ入れる。25% HCl溶液でこの溶液を注意深く酸性にして、15分間撹拌する。生成物を濾別し、水で洗浄して室温で真空下一晩乾燥することにより、化合物(8)25.72g(96%)を白色の固体として得る。
化合物(9): 3−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸の調製
3−フルオロ−4−ヒドロキシ安息香酸4.37g(28.00mmol)を硫酸2滴を加えたメタノール100mL中で22時間還流する。溶媒を真空下で留去する。残渣に4−ヨード−1,1,1−トリフルオロブタン6.66g(28.00mmol)、炭酸カリウム11.84g(85.00mmol)及びNMP 50mLを加える。この混合物を一晩80℃に加熱する。1N NaOH溶液40mL(40mmol)を上記混合物に加えた。反応が終了するまで、この懸濁液を還流温度で30分間加熱する。反応混合物を室温で冷却させて、冷水に注ぎ入れる。25% HCl溶液でこの溶液を注意深く酸性にして、15分間撹拌する。生成物を濾別し、水で洗浄して室温で真空下一晩乾燥することにより、化合物(9)5.91g(79%)を白色の固体として得る。
3−メトキシ−4−(ペンチルオキシ)安息香酸4−ホルミルフェニル(3A)
2,3−ジフルオロ−4−(ペンチルオキシ)安息香酸4−ホルミルフェニル(3B)
3−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−ホルミルフェニル(3C)
(2E)−3−(4−{[3−メトキシ−4−(ペンチルオキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エン酸(4A)
(2E)−3−(4−{[2,3−ジフルオロ−4−(ペンチルオキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エン酸(4B)
(2E)−3−(4−{[3−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エン酸(4C)
3−メトキシ−4−(ペンチルオキシ)安息香酸4−[(1E)−3−({6−[(3,5−ジニトロベンゾイル)オキシ]ヘキシル}オキシ)−3−オキソプロパ−1−エニル]フェニル(5A)
2,3−ジフルオロ−4−(ペンチルオキシ)安息香酸4−[(1E)−3−({6−[(3,5−ジニトロベンゾイル)オキシ]ヘキシル}オキシ)−3−オキソプロパ−1−エニル]フェニル(5B)
3−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−{(1E)−3−[2−(2,4−ジニトロフェニル)エトキシ]−3−オキソプロパ−1−エニル}フェニル(5C)
化合物(12)は、化合物(6)についての実施例6に記載される製造法により調製するが、ただし、化合物(5)は、化合物(5B)に置き換える。
化合物(10)は、化合物(6)についての実施例6に記載される製造法により調製するが、ただし、化合物(5)は、化合物(5C)に置き換える。
2,3,5−トリカルボキシシクロペンチル酢酸1,2:3,4−二無水物0.820g(3.66mmol)を、NMP 6.56mL中の化合物(6)2.000g(3.66mmol)の溶液に加える。次に0℃で2時間撹拌を行う。続いてこの混合物を室温で21時間反応させる。このポリマー混合物をTHF 18mLで希釈し、水800mL中に沈殿させることにより、室温で真空下で乾燥後、ポリアミド酸(1)2.76gが白色の粉末の形で生成する:[η]=0.21dL/g
実施例10と同様に、2,3,5−トリカルボキシシクロペンチル酢酸1,2:3,4−二無水物と共にポリアミド酸の調製のために以下のジアミンを使用する。
化合物(10)を使用して、ポリアミド酸(2)が白色の粉末として生成する;[η]=0.22dL/g
化合物(11)を使用して、ポリアミド酸(7)が白色の粉末として生成する;[η]=0.26dL/g
化合物(12)を使用して、ポリアミド酸(8)が白色の粉末として生成する;[η]=0.27dL/g
実施例10と同様に、1,2,3,4−シクロブタンテトラカルボン酸二無水物と共にポリアミド酸の調製のために以下のジアミンを使用する。
化合物(6)を使用して、ポリアミド酸(5)が白色の粉末として生成する;[η]=0.28dL/g
化合物(10)を使用して、ポリアミド酸(6)が白色の粉末として生成する;[η]=0.29dL/g
化合物(11)を使用して、ポリアミド酸(3)が白色の粉末として生成する;[η]=0.33dL/g
化合物(12)を使用して、ポリアミド酸(4)が白色の粉末として生成する;[η]=0.40dL/g
実施例10と同様に、化合物(6)と共にポリアミド酸の調製のために以下のテトラカルボン酸二無水物混合物を使用する。
1,2,3,4−シクロブタンテトラカルボン酸二無水物及び2,3,5−トリカルボキシシクロペンチル酢酸1,2:3,4−二無水物の混合物25:75(モル比)を使用して、ポリアミド酸(9)が白色の粉末として生成する;[η]=0.31dL/g
重合工程B(ポリイミドの生成)
上記実施例12で得られるポリアミド酸(3)0.50gを1−メチル−2−ピロリドン(NMP)3mLに溶解する。ここにピリジン0.28g(3.57mmol、4当量)及び無水酢酸364mg(3.57mmol、4当量)を加え、80℃で2時間脱水及び閉環反応を行う。このポリマー混合物をNMP 1.5mlで希釈し、ジエチルエーテル100ml中に沈殿させ、濾過により収集する。このポリマーをTHF(10ml)から水200ml中に再沈殿させることにより、室温で真空下乾燥後、ポリイミド(1)0.45gが生成する;[η]=0.31dL/g、イミド化率ID=100%
ポリアミド酸(3)を無水酢酸1.2当量及びピリジンと共に使用して、ポリイミド(2)が白色の粉末として生成する;[η]=0.33dL/g、ID=35%
液晶が光反応性ポリアミド酸(1)により整列する、液晶セルを調製する。
固体ポリアミド酸(1)を溶媒N−メチル−2−ピロリドン(NMP)中に混合して、固体ポリアミド酸(1)が溶解するまで充分に撹拌し、第2の溶媒ブチルセルロース(BC)を加え、最終溶液が得られるまで全組成物を充分に撹拌することによって、ポリアミド酸(1)の4%溶液を調製する。N−メチル−2−ピロリドンとブチルセルロースとの溶媒比は、1:1である。上記ポリマー溶液を2枚のITOコーティングガラス基板上に1200rpmのスピン速度で30秒間スピンコーティングする。スピンコーティング後、基板を、130℃で5分間の仮焼成及び200℃の温度で40分間の後焼成からなる焼成処理に付す。生じる層の厚さは70nm前後である。
別の液晶セルは、ポリアミド酸(1)の代わりに異なる方向に側方置換を有するポリアミド酸(2)を使用し、かつ1250rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、88.40°である。
別の液晶セルは、ポリアミド酸(3)を使用し、かつ1600rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、88.96°である。
別の液晶セルは、ポリアミド酸(4)を使用し、かつ1750rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、88.34°である。このことは、整列層コーティング工程後の液晶セル加工条件の変更がないまま、プレチルトは、ポリマー上の様々な側方置換によって調節できることを示している。
4,4’−ジニトロ−1,1’−ビフェニル−2,2’−ジメタノールの調製:
4,4’−ジニトロ−1,1’−ビフェニル−2,2’−ジカルボン酸3.6g(10.83mmol)をテトラヒドロフラン25mlに溶解して、1時間の間に滴下によりテトラヒドロフラン中のボラン−テトラヒドロフラン複合体1.0M溶液65ml(65.02mmol)に加える。25℃で19時間後、水50mlを注意深く加える。1時間後、1N HCl溶液10mlでこの溶液をpH=1〜2まで酸性にして、30分間撹拌させる。次にこの反応混合物を酢酸エチルと水とに分液する;有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過してロータリーエバポレーターにより濃縮する。残渣である白色の粉末としての4,4’−ジニトロ−1,1’−ビフェニル−2,2’−ジメタノール4.2gを、更に精製することなく使用する。
2−(2,4−ジニトロフェニル)プロパン−1,3−ジオールの調製:
2,4−ジニトロトルエン20g(106.5mmol)をNMP 280mLに可溶化する。この褐色の溶液に、パラホルムアルデヒド7.6g(255.6mmol)を加える。この懸濁液に、カリウムテトラブトキシド597mg(5.32mmol)を加える。生じる溶液をRTで一晩撹拌する。この混合物を氷200mL上に注ぎ、HCl 25% 2mLで中和する。次にこの反応混合物を酢酸エチルと水とに分液する;有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過してロータリーエバポレーターにより濃縮する。ヘプタン150mLを加えることにより、この溶液をRTで沈殿させる。生成物を濾過して真空下RTで乾燥する。生成物16.15gは、わずかに黄色の生成物として単離する。
化合物(21): 2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−((1E)−3−{[2’−({[(2E)−3−(4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エノイル]オキシ}メチル)−4,4’−ジニトロ−1,1’−ビフェニル−2−イル]メトキシ}−3−オキソプロパ−1−エニル)フェニルの調製
4,4’−ジニトロ−1,1’−ビフェニル−2,2’−ジメタノール8.48g(27.9mmol)、化合物(5)23.0g(55.7mmol)、4−ジメチルアミノピリジン170mg(1.4mmol)をジクロロメタン100mLに溶解する。N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド塩酸塩(EDC塩酸塩)8.64g(55.7mmol)を0℃で加える。この溶液を0℃で1時間撹拌して、室温で一晩撹拌させておく。室温で22時間後、反応混合物をジクロロメタンと水とに分液する。有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過して減圧下で濃縮する。トルエン:酢酸エチル(95:5)を溶離液として用いて残渣を200gシリカゲルのクロマトグラフィーに付し、酢酸エチル:ヘキサン混合物から結晶化することにより、化合物(21)21g(71%)が無色の結晶として生成した。
化合物(22): 4−(4,4,4−トリフルオロブトキシ)−2−フルオロ安息香酸4−[(1E)−3−(2−(2,4−ジニトロフェニル)−3−{[(2E)−3−(4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エノイル]オキシ}プロポキシ)−3−オキソプロパ−1−エニル]フェニルの調製:
2−(2,4−ジニトロフェニル)プロパン−1,3−ジオール6.75g(27.9mmol)、化合物(5)23.0g(55.7mmol)、4−ジメチルアミノピリジン170mg(1.4mmol)をジクロロメタン100mLに溶解する。N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド塩酸塩(EDC塩酸塩)8.64g(55.7mmol)を0℃で加える。この溶液を0℃で1時間撹拌して、室温で一晩撹拌させておく。室温で22時間後、反応混合物をジクロロメタンと水とに分液する。有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過して減圧下で濃縮する。トルエン:酢酸エチル(95:5)を溶離液として用いて残渣を200gシリカゲルのクロマトグラフィーに付し、酢酸エチル:ヘキサン混合物から結晶化することにより、化合物(22)21.3g(74%)が無色の結晶として生成した。
化合物(23): 2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−((1E)−3−{[4,4’−ジアミノ−2’−({[(2E)−3−(4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エノイル]オキシ}メチル)−1,1’−ビフェニル−2−イル]メトキシ}−3−オキソプロパ−1−エニル)フェニルの調製
化合物(21)9.15g(8.38mmol)をN,N−ジメチルホルムアミド54mL及び水6mLの混合物に溶解する。塩化第二鉄六水和物13.9g(51.4mmol)を加える。亜鉛粉末5.60g(85.7mmol)を少量ずつ60分以内に加える。この混合物を2時間反応させる。反応混合物を酢酸エチルと水とに分液して濾過する。有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過して減圧下で濃縮する。トルエン:酢酸エチル(1:3)を溶離液として用いて残渣を200gシリカゲルで濾過し、酢酸エチル:ヘキサン混合物から結晶化することにより、化合物(23)6.05gが無色の結晶として生成した。
化合物(24): 4−(4,4,4−トリフルオロブトキシ)−2−フルオロ安息香酸4−[(1E)−3−(2−(2,4−ジアミノフェニル)−3−{[(2E)−3−(4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エノイル]オキシ}プロポキシ)−3−オキソプロパ−1−エニル]フェニルの調製
化合物(22)8.63g(8.38mmol)をN,N−ジメチルホルムアミド54mL及び水6mLの混合物に溶解する。塩化第二鉄六水和物13.9g(51.4mmol)を加える。亜鉛粉末5.60g(85.7mmol)を少量ずつ60分以内に加える。この混合物を2時間反応させる。反応混合物を酢酸エチルと水とに分液して濾過する。有機相を水で繰り返し洗浄し、硫酸ナトリウムで乾燥し、濾過して減圧下で濃縮する。トルエン:酢酸エチル(1:3)を溶離液として用いて残渣を200gシリカゲルで濾過し、酢酸エチル:ヘキサン混合物から結晶化することにより、化合物(24)6.50gが無色の結晶として生成した。
2,3,5−トリカルボキシシクロペンチル酢酸1,2:3,4−二無水物0.277g(1.24mmol)をNMP 3.51mL中の化合物(24)1.20g(1.24mmol)の溶液に加える。次に0℃で2時間撹拌を行う。次いでこの混合物を室温で21時間反応させる。このポリマー混合物をTHF 25mLで希釈し、水800mL中に沈殿させることにより、室温で真空下乾燥後に、ポリアミド酸(25)1.1gが白色の粉末の形で生成する:[η]=0.19dL/g
実施例25と同様に、2,3,5−トリカルボキシシクロペンチル酢酸1,2:3,4−二無水物と共にポリアミド酸の調製のために以下のジアミンを使用する。
化合物(23)を使用して、ポリアミド酸(26)が白色の粉末として生成する;[η]=0.48dL/g
別の液晶セルは、ポリアミド酸(25)を使用し、かつ1500rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、88.05°であった。
3−メトキシ−4−(4,4,4−トリフルオロブトキシ)安息香酸、化合物(28)の調製
この化合物は、化合物(7)についての実施例7に記載される製造法により調製するが、ただし、ブロモペンタンは、4−ヨード−1,1,1−トリフルオロブタンに置き換える。
3−メトキシ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−ホルミルフェニル、化合物(29)の調製
この化合物は、化合物(3)についての実施例3に記載される製造法により調製するが、ただし、化合物(2)は、化合物(28)に置き換える。
(2E)−3−(4−{[3−メトキシ−4−(4,4,4−トリフルオロブトキシ)ベンゾイル]オキシ}フェニル)プロパ−2−エン酸、化合物(30)の調製
この化合物は、化合物(4)についての実施例4に記載される製造法により調製するが、ただし、化合物(3)は、化合物(29)に置き換える。
3−メトキシ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−[(1E)−3−({6−[(3,5−ジニトロベンゾイル)オキシ]ヘキシル}オキシ)−3−オキソプロパ−1−エニル]フェニル、化合物(31)の調製
この化合物は、化合物(5B)についての実施例5に記載される製造法により調製するが、ただし、化合物(4B)は、化合物(30)に置き換える。
3−メトキシ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−[(1E)−3−({6−[(3,5−ジアミノベンゾイル)オキシ]ヘキシル}オキシ)−3−オキソプロパ−1−エニル]フェニル、化合物(32)の調製
この化合物は、化合物(6)についての実施例6に記載される製造法により調製するが、ただし、化合物(5B)は、化合物(31)に置き換える。
3,4−ビス[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]安息香酸、化合物(33)の調製
この化合物は、化合物(7)についての実施例7に記載される製造法により調製するが、ただし、ブロモペンタンは、5−ヨード−1,1,1,2,2−ペンタフルオロペンタンに置き換え、そしてバニリン酸メチルは、3,4−ジヒドロキシ安息香酸エチルに置き換える。
3,4−ビス[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]安息香酸4−ホルミルフェニル、化合物(34)の調製
この化合物は、化合物(3)についての実施例3に記載される製造法により調製するが、ただし、化合物(2)は、化合物(33)に置き換える。
(2E)−3−[4−({3,4−ビス[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]ベンゾイル}オキシ)フェニル]プロパ−2−エン酸、化合物(35)の調製
この化合物は、化合物(4)についての実施例4に記載される製造法により調製するが、ただし、化合物(3)は、化合物(34)に置き換える。
3,4−ビス[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]安息香酸4−{(1E)−3−[2−(2,4−ジニトロフェニル)エトキシ]−3−オキソプロパ−1−エニル}フェニル、化合物(36)の調製
この化合物は、化合物(5)についての実施例5に記載される製造法により調製するが、ただし、化合物(4)は、化合物(35)に置き換える。
3,4−ビス[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]安息香酸4−{(1E)−3−[2−(2,4−ジアミノフェニル)エトキシ]−3−オキソプロパ−1−エニル}フェニル、化合物(37)の調製
この化合物は、化合物(6)についての実施例6に記載される製造法により調製するが、ただし、化合物(5)は、化合物(36)に置き換える。
2−フルオロ−4−[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]ベンゾニトリル、化合物(38)の調製
この化合物は、化合物(1)についての実施例1に記載される製造法により調製するが、ただし、4−ヨード−1,1,1−トリフルオロブタンは、5−ヨード−1,1,1,2,2−ペンタフルオロペンタンに置き換える。
2−フルオロ−4−[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]安息香酸、化合物(39)の調製
この化合物は、化合物(2)についての実施例2に記載される製造法により調製するが、ただし、化合物(1)は、化合物(38)に置き換える。
2−フルオロ−4−[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]安息香酸4−ホルミルフェニル、化合物(40)の調製
この化合物は、化合物(3)についての実施例3に記載される製造法により調製するが、ただし、化合物(2)は、化合物(39)に置き換える。
(2E)−3−[4−({2−フルオロ−4−[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]ベンゾイル}オキシ)フェニル]プロパ−2−エン酸、化合物(41)の調製
この化合物は、化合物(4)についての実施例4に記載される製造法により調製するが、ただし、化合物(3)は、化合物(40)に置き換える。
2−フルオロ−4−[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]安息香酸4−{(1E)−3−[2−(2,4−ジニトロフェニル)エトキシ]−3−オキソプロパ−1−エニル}フェニル、化合物(42)の調製
この化合物は、化合物(5)についての実施例5に記載される製造法により調製するが、ただし、化合物(4)は、化合物(41)に置き換える。
2−フルオロ−4−[(4,4,5,5,5−ペンタフルオロペンチル)オキシ]安息香酸4−{(1E)−3−[2−(2,4−ジアミノフェニル)エトキシ]−3−オキソプロパ−1−エニル}フェニル、化合物(43)の調製
この化合物は、化合物(6)についての実施例6に記載される製造法により調製するが、ただし、化合物(5)は、化合物(42)に置き換える。
2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸メチル、化合物(44)の調製
2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸3.0g(11.3mmol)を、硫酸2滴を加えたメタノール40mL中で22時間還流する。真空下で溶媒を留去する。粗生成物は、更に精製することなく使用する。
[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)フェニル]メタノール、化合物(45)の調製
THF 40mL中の化合物(44)3.13g(11.2mmol)を0℃に冷却する。この溶液に、LiAlH4THF溶液8.8mLを加える。3時間後、溶液は、HCl 1N 20mLの添加によりクエンチする。生成物をAcOEtで抽出し、水200mLで洗浄する。有機相を硫酸ナトリウムで乾燥して、真空下で溶媒を留去することにより、化合物(45)2.32gを橙色の油状物として得る。
1−(ブロモメチル)−2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンゼン、化合物(46)の調製
化合物(45)2.00g(7.93mmol)及びCBr4 3.42g(10.31mmol)をTHF 20mLに溶解する。この溶液に、トリフェニルホスフィン2.70g(10.31mmol)を加える。1時間後、この混合物をシリカゲル栓で濾過して、AcOEt/ヘキサン(1/1)の混合物により溶出する。過剰の溶媒を真空下で除去することにより、化合物(46)2.28gを無色の油状物として得る。
4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンジル]オキシ}ベンズアルデヒド、化合物(47)の調製
化合物(46)0.66g(2.09mmol)、K2CO3 0.32g(2.30mmol)及び4−ヒドロキシベンズアルデヒド0.25g(2.30mmol)をNMP 10mL中で混合する。この混合物を1時間65℃に加熱する。この溶液をHCl 0.1N 100mLに注ぎ入れる。固体を濾過して真空下で乾燥することにより、化合物(47)を得る。
(2E)−3−(4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンジル]オキシ}フェニル)プロパ−2−エン酸、化合物(48)の調製
この化合物は、化合物(4)についての実施例4に記載される製造法により調製するが、ただし、化合物(3)は、化合物(47)に置き換える。
(2E)−3−(4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンジル]オキシ}フェニル)プロパ−2−エン酸2−(2,4−ジニトロフェニル)エチル、化合物(49)の調製
この化合物は、化合物(5)についての実施例5に記載される製造法により調製するが、ただし、化合物(4)は、化合物(48)に置き換える。
(2E)−3−(4−{[2−フルオロ−4−(4,4,4−トリフルオロブトキシ)ベンジル]オキシ}フェニル)プロパ−2−エン酸2−(2,4−ジアミノフェニル)エチル、化合物(50)の調製
この化合物は、化合物(6)についての実施例6に記載される製造法により調製するが、ただし、化合物(5)は、化合物(49)に置き換える。
1,2−ジフルオロ−3−(4,4,4−トリフルオロブトキシ)ベンゼン、化合物(51)の調製
この化合物は、化合物(1)についての実施例1に記載される製造法により調製するが、ただし、3−フルオロ−4−ヒドロキシベンゾニトリルは、2,3−ジフルオロフェノールに置き換える。
2,3−ジフルオロ−4−(4,4,4−トリフルオロブトキシ)フェニルボロン酸、化合物(52)の調製
化合物(51)5.0g(20.8mmol)をTHF 58mLに溶解して−78℃に冷却する。この溶液に、ヘキサン中のBuLiの溶液7.71mL(20.8mmol)を滴下により加える。3時間後、THF 20mL中のホウ酸トリメチル2.84mL(24.98mmol)の混合物を前記溶液に加える。添加後、溶液を室温で一晩撹拌する。この混合物は、HCl 1N 20mLの添加によりクエンチする。生じる乳濁液は、濃HCl 10mLの添加により処理する。この混合物を2時間撹拌する。有機相を酢酸エチルで抽出し、水で洗浄し、硫酸ナトリウムで乾燥する。過剰の溶媒を真空下で除去することにより、化合物(52)5.3gを褐色の固体として得る。
2’,3’−ジフルオロ−4’−(4,4,4−トリフルオロブトキシ)−1,1’−ビフェニル−4−カルバルデヒド、化合物(53)の調製
化合物(52)5.3g(18.66mmol)、4−ブロモベンズアルデヒド3.4g(18366mmol)及びテトラキス(トリフェニルホスフィン)パラジウム862mg(0.74mmol)をトルエン90mL中で混合する。この混合物を脱気して、アルゴンでパージする。反応液を50℃に加熱して、Na2CO32M 90mLをゆっくり加える。反応液を90℃に加熱して2日間撹拌する。室温に冷却後、この混合物をHCl 25% 50mLでクエンチする。有機相を酢酸エチルで抽出して、硫酸ナトリウムで乾燥する。過剰の溶媒を真空下で除去する。生成物(53)は、トルエン/AcOEt(98/2)の混合物でのシリカゲルのフラッシュクロマトグラフィーにより精製する。
(2E)−3−[2’,3’−ジフルオロ−4’−(4,4,4−トリフルオロブトキシ)−1,1’−ビフェニル−4−イル]プロパ−2−エン酸、化合物(54)の調製
この化合物は、化合物(4)についての実施例4に記載される製造法により調製するが、ただし、化合物(3)は、化合物(53)に置き換える。
(2E)−3−[2’,3’−ジフルオロ−4’−(4,4,4−トリフルオロブトキシ)−1,1’−ビフェニル−4−イル]プロパ−2−エン酸2−(2,4−ジニトロフェニル)エチル、化合物(55)の調製
この化合物は、化合物(5)についての実施例5に記載される製造法により調製するが、ただし、化合物(4)は、化合物(54)に置き換える。
(2E)−3−[2’,3’−ジフルオロ−4’−(4,4,4−トリフルオロブトキシ)−1,1’−ビフェニル−4−イル]プロパ−2−エン酸2−(2,4−ジアミノフェニル)エチル、化合物(56)の調製
この化合物は、化合物(6)についての実施例6に記載される製造法により調製するが、ただし、化合物(5)は、化合物(55)に置き換える。
2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−{(1E)−3−[(3,5−ジニトロベンジル)オキシ]−3−オキソプロパ−1−エニル}フェニル、化合物(57)の調製
この化合物は、化合物(5)についての実施例5に記載される製造法により調製するが、ただし、化合物2,4−ジニトロフェニルエタノールは、3,5−ジニトロベンジルアルコールに置き換える。
2−フルオロ−4−(4,4,4−トリフルオロブトキシ)安息香酸4−{(1E)−3−[(3,5−ジアミノベンジル)オキシ]−3−オキソプロパ−1−エニル}フェニル、化合物(58)の調製
この化合物は、化合物(6)についての実施例6に記載される製造法により調製するが、ただし、化合物(5)は、化合物(57)に置き換える。
実施例10と同様に、2,3,5−トリカルボキシシクロペンチル酢酸1,2:3,4−二無水物と共にポリアミド酸の調製のために以下のジアミンを使用する。
化合物(37)を使用して、ポリアミド酸(60)が白色の粉末として生成する;[η]=0.24dL/g
化合物(43)を使用して、ポリアミド酸(61)が白色の粉末として生成する;[η]=0.28dL/g
化合物(50)を使用して、ポリアミド酸(62)が白色の粉末として生成する;[η]=0.25dL/g
化合物(56)を使用して、ポリアミド酸(63)が白色の粉末として生成する;[η]=0.21dL/g
化合物(58)を使用して、ポリアミド酸(64)が白色の粉末として生成する;[η]=0.32dL/g
実施例10と同様に、1,2,3,4−シクロブタンテトラカルボン酸二無水物と共にポリアミド酸の調製のために以下のジアミンを使用する。
化合物(32)を使用して、ポリアミド酸(59)が白色の粉末として生成する;[η]=0.38dL/g
実施例10と同様に、1,2,3,4−シクロブタンテトラカルボン酸二無水物と共にポリアミド酸の調製のために以下のジアミンの混合物を使用する。
1,2,3,4−シクロブタンテトラカルボン酸二無水物、並びに化合物(6)及び4−(4,4,4−トリフルオロブトキシ)安息香酸4−{(1E)−3−[2−(2,4−ジアミノフェニル)エトキシ]−3−オキソプロパ−1−エニル}フェニルの50:50(モル比)の混合物を使用して、ポリアミド酸(65)が白色の粉末として生成する;[η]=0.64dL/g
1H NMR 300MHz DMSO d6:
12.51 (s, 2H), 10.19 (s, 1H), 9.59 (s, 1H), 8.08-7.61 (m, 6H), 7.43-6.94 (m, 7H), 6.65-6.59 (m, 1H), 4.30 (s, 2H), 4.16 (s, 2H), 3.83-3.58 (m, 4H), 2.95 (s, 2H), 2.39 (m, 2H), 1.96 (m, 2H).
別の液晶セルは、ポリアミド酸(25)を使用し、かつ1200rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、88.15°である。
別の液晶セルは、ポリアミド酸(26)を使用し、かつ1400rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、88.60°である。
別の液晶セルは、ポリアミド酸(59)を使用し、かつ1600rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、89.33°である。
別の液晶セルは、ポリアミド酸(60)を使用し、かつ1900rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、87.44°である。
別の液晶セルは、ポリアミド酸(61)を使用し、かつ1800rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、88.52°である。
別の液晶セルは、ポリアミド酸(62)を使用し、かつ1200rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、77.2°である。
別の液晶セルは、ポリアミド酸(63)を使用し、かつ1200rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、89.61°である。
別の液晶セルは、ポリアミド酸(64)を使用し、かつ1600rpmのスピン速度を30秒間用いることを除いて、実施例15に記載されるのと同じ方法で調製する。実施例15と同じ方法でプレチルトを測定すると、87.84°である。
Claims (16)
- 側鎖に少なくとも1個の式(I):
[式中、
A及びBは、相互に独立に、5若しくは6個の原子の単環式環、5若しくは6個の原子の2個の隣接単環式環、8、9若しくは10個の原子の二環式環系、又は13若しくは14個の原子の三環式環系から選択される、非置換又は置換の炭素環式又は複素環式の芳香族基又は脂環式基を表し;
Zは、架橋基を表し、
R1は、ハロゲン、C1−C16アルコキシ、C1−C16アルキル、ニトロ又はニトリルを、好ましくはメトキシ、フッ素、塩素又はニトリルを表し、
R2及びR3は、相互に独立に、水素、ハロゲン又はニトリル;非置換又はハロゲン置換C1−C12アルキル(ここで、1個以上のC原子、CH−又はCH2−基は、連結基により置換されていてもよい)であり;好ましくはR2及びR3は、H、ニトリル又はフッ素である]により表される側方置換部分を有するポリマーを含む、光整列材料。 - 式(I):
[式中、
A及びBは、相互に独立に、5若しくは6個の原子の単環式環、5若しくは6個の原子の2個の隣接単環式環、8、9若しくは10個の原子の二環式環系、又は13若しくは14個の原子の三環式環系から選択される、非置換又は置換の炭素環式又は複素環式の芳香族基又は脂環式基を表し;
Zは、架橋基を表し、
R1は、ハロゲン、C1−C16アルコキシ、C1−C16アルキル、ニトロ又はニトリルを、好ましくはメトキシ、フッ素、塩素又はニトリルを表し、
R2及びR3は、相互に独立に、水素、ハロゲン又はニトリル;非置換又はハロゲン置換C1−C12アルキル(ここで、1個以上のC原子、CH−又はCH2−基は、連結基により置換されていてもよい)であり;好ましくはR2及びR3は、H、ニトリル又はフッ素である]により表される少なくとも1個の側方置換部分、及び重合性基を含む、化合物。 - 式(IV):
[式中、
Bは、非置換又は置換のベンゼン、フェニレン、ピリジン、トリアジン、ピリミジン、ビフェニレン、ナフタレン、フェナントレン、トリフェニレン、テトラリンを表し、
R1は、ハロゲン、C1−C16アルコキシ、C1−C16アルキル、ニトロ又はニトリルを表し、
R2及びR3は、水素及び/又はニトリルであり、
Xは、二価芳香族基であるか;あるいはXは、−CH2−、−CO−、−CS−、−O(CO)−、−(CO)O−、−NH(CO)−、−(CO)NH−、−OCF2−、((C1−C6アルキル)−N)CO−、−(C1−C16アルキレン)(CO)O−、−(C1−C16アルキレン)O(CO)−、−(CO)O(C1−C16アルキレン)−、−O(CO)(C1−C16アルキレン)−、−O(C1−C16アルキレン)−、−(C1−C16アルキレン)O−、((CH3)N)CO−、又は−S(CS)−、−O(CS)−、−S(CO)−であり、好ましくは1,4−フェニレン、−O(CS)−、−S(CO)−、−CS−、−CO−又は−O(CO)−であり、そして更に好ましくは−CO−又は−O(CO)−又は1,4−フェニレンであり;
Zは、−COO−、−OCO−、−OCF2−、−CF2O−、−(C1−C16アルキレン)(CO)O−、−(C1−C16アルキレン)O(CO)−、−(CO)O(C1−C16アルキレン)−、−O(CO)(C1−C16アルキレン)−、−O(C1−C16アルキレン)−、−(C1−C16アルキレン)O−、−CON(CH3)−、−(CH3)NCO−、−CONH−、−NHCO−、−OCH2−、−CH2O−、又は単結合を表し、
Uは、水素、−CF3、−CF2H、−CH2F、−Q1−(C1−C6アルキレン)−CF3、−Q1−(C1−C6アルキレン)−CF2H、−Q1−(C1−C6アルキレン)−CH2F、−Q1−(C1−C6アルキレン)−CF2CF3、−Q1−(C1−C6アルキレン)−CF2CHF2、−Q1−(C1−C6アルキレン)−CF2CH2F、−Q1−(C1−C6アルキレン)−CFHCF3、−Q1−(C1−C6アルキレン)−CFHCHF2、−Q1−(C1−C6アルキレン)−CFHCH2F、−Q1−(C1−C6アルキレン)−CF2CH3、−Q1−(C1−C6アルキレン)−CFHCHF2、−Q1−(C1−C6アルキレン)−(CF2)2CF3、−Q1−(C1−C6アルキレン)−(CF2)2CHF2、−Q1−(C1−C6アルキレン)−(CF2)2CH2F、−Q1−(C1−C6アルキレン)−(CF2)2CH3、−Q1−(C1−C6アルキレン)−(CF2)3CHF2、−Q1−(C1−C6アルキレン)−(CF2)3CH2F、−Q1−(C1−C6アルキレン)−(CF2)3CF3、−Q1−(C1−C6アルキレン)−CF(CF3)2、−Q1−(C1−C6アルキレン)−CF2(CHF)CF3であり、そしてここで、1個以上のC原子、CH−又はCH2−基は、相互に独立に、置換されていないか、又は連結基により置換されており、そしてここで、
Q1は、単結合又は−NH−、−NCH3−、−NH−CO−、−CO−NH−、−NH−CO−O−、−O−CO−NH−、−NH−CONH−、−O−、−CO−、−COO−、−OCO−、−S−、−CS−、−SCS−、−SCO−、−CH=CH−、−C≡C−若しくは−O−CO−O−を表し、好ましくはQ1は、−O−、−CO−、−COO−、−OCO−又は単結合を表し、
Dは、非置換又は置換の脂肪族、芳香族又は脂環式重合性基を、好ましくは1〜40個の炭素原子を有するジアミン基を表し、
y及びzは、それぞれ相互に独立に、1、2、3又は4、好ましくは1又は2であり;
wは、1、2、3、4であり、そして好ましくは1又は2であり、
S1及びS2は、それぞれ相互に独立に、単結合又はスペーサー単位を表し、そしてこの単位は、環状、直鎖又は分岐の置換又は非置換のC1−C24アルキレンであり、ここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよいか;かつ/あるいはこの単位は、式(V):
(式中、
C1、C2は、それぞれ独立に、脂環式又は芳香族の非置換又は置換の炭素環式又は複素環式基を表し、好ましくはC1及びC2は、S1及び/又はS2基が長い分子軸を持つように、Z1、Z2、Z1a及び/又はZ1a’を介して反対位置で結合しており、そして
Z1、Z2、Z1a、Z1a’は、それぞれ独立に、架橋基を表し、そして
a1、a3’、a2、a3は、それぞれ独立に、a1+a3’+a2+a3≦6、好ましくはa3及び/又はa3’が1であり、かつa1+a2≦4であるように、0〜3の整数を表す)で示される非芳香族、芳香族、非置換又は置換の炭素環式又は複素環式基である]により表される、請求項2に記載の化合物。 - 式(XVI):
[式中、
S1、S2、Z、U、y及びzは、請求項3に記載された上記の意味及び優先傾向を有しており;そしてR、R1’、R1”は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味を有するが、ただし、少なくとも1個のR、R1’又はR1”は、水素ではない]、又は式(XVIII):
[式中、U、R、R1’及びR1”、S2、S1、Z、y及びzは、(XVI)について上記の意味を有しており;そしてX6は、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C6アルキレンである]、又は式(XIX):
[式中、U、R、R1’、R1”、S2、S1、Z、y及びzは、(XVI)について上記の意味を有する]により表される、請求項2に記載の化合物。 - 式(XVIIa)、(XVIIb)、(XVIIc)、(XVIIf)、(XVIII)又は(XIX):
[式中、
S1、S2、Z、U、y及びzは、請求項3に記載された上記の意味及び優先傾向を有しており;そしてR1、R1’、R1”は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味を有するが、ただし、少なくとも1個のR、R1’又はR1”は、水素ではなく;そして
S1及びS2は、それぞれ相互に独立に、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C12アルキレンを表し;そしてここで、1個以上の、好ましくは隣接していない、C原子、CH−又はCH2−基は、少なくとも1個の連結基により置換されていてもよい]又は式(XVIIb)若しくは(XVIIc):
[式中、
S1、S2、y、z、R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有する]又は式(XVIIf):
[式中、
S1、S2、R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有する]又は式(XVIII)若しくは(XIX):
[式中、
S1、S2、y、z、R1、R1’、R1”、Z及びUは、上記の意味及び優先傾向を有しており、そしてX6は、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C6アルキレンである]により表される、少なくとも1個の側方置換部分を含む、請求項2に記載の化合物。 - 式(XX)、(XXI)、(XXII)、(XXIII)、(XXIV)、(XXV)、(XXVa)若しくは(XXVb)により表される少なくとも1個の側方置換部分を含む、請求項2に記載の化合物、及び/又は側鎖に式(XX)、(XXI)、(XXII)、(XXIII)、(XXIV)、(XXV)、(XXVa)若しくは(XXVb)により表される少なくとも1個の側方置換部分を有するポリマーを含む、光整列材料:
[(XX)、(XXI)、(XXII)、(XXIII)、(XXIV)、(XXV)、(XXVa)中、
U、Zは、請求項3に記載された意味を有しており、そして
R1’、R1”及びR1’’’は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素の意味を有する]、
[式中、
U、Zは、請求項3に記載された意味を有しており、そして
R1”及びR1’’’は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素の意味を有するが、ただし、少なくとも1個のR1”又はR1’’’は、水素ではない]。 - 式(XXVc)、(XXVd)、(XXVe)、(XXVf)、(XXVg)、(XXVIII)、(XIX)により表される少なくとも1個の側方置換部分を含む、請求項2に記載の化合物、及び/又は側鎖に式(XXVc)、(XXVd)、(XXVe)、(XXVf)、(XXVg)、(XXVIII)、(XIX)により表される少なくとも1個の側方置換部分を有するポリマーを含む、請求項1に記載の光整列材料:
[式中、
S1、S2、Z、U、y及びzは、相互に独立に、請求項3に記載された意味及び優先傾向を有しており;そしてR1”、R1’’’は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味を有するが、ただし、少なくとも1個のR1”又はR1’’’は、水素ではない];
[式中、
S1、S2、Z、U、y及びzは、相互に独立に、請求項3に記載された意味及び優先傾向を有しており;そしてR1”、R1’’’は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味、好ましくは水素の意味を有する];
[式中、
S1、S2、y、z、Z及びUは、請求項3に記載された上記の意味を有しており、そして
R1’、R1”は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味、好ましくは水素の意味を有する];及び
[式中、
S1、S2、y、z、Z及びUは、請求項3に記載された上記の意味を有しており、そして
R、R1’、R1”は、相互に独立に、水素、メトキシ、フッ素、ニトリル及び/又は塩素あるいはUの意味を有するが、ただし、少なくとも1個のR、R1’、R1”は、水素ではなく;そしてここで、
X6は、単結合又は直鎖若しくは分岐の置換若しくは非置換のC1−C6アルキレンである]。 - 請求項2に記載の化合物を接触させることを含む、請求項1に記載のポリマーの製造方法。
- 請求項8に記載の方法により入手できる、請求項1に記載のポリマー、好ましくはホモ−及び/又はコポリマー。
- 請求項1に記載されるか、若しくは請求項9により得られるか、若しくは請求項8により製造される、側鎖に式(I)により表される少なくとも1個の側方置換部分を有するポリマー、及び/又は請求項2に記載の少なくとも1種の化合物を含む、組成物、特にブレンド及び/又は配合物。
- ポリマー層、特に配向層の製造のための、請求項1に記載の光整列材料の、あるいは請求項1、9に記載されるか、又は請求項8において製造される、側鎖に式(I)により表される少なくとも1個の側方置換部分を有するポリマーの使用。
- ポリマー層、特に配向層の製造方法であって、請求項1に記載の光整列材料、又は請求項9により得られるか、若しくは請求項8により製造されるポリマー、又は請求項10に記載の組成物を支持体に適用し、そしてこれをアライニング光で処理することを含む方法。
- 請求項1に記載の、側鎖に式(I)により表される少なくとも1個の側方置換部分を有する少なくとも1種の光整列材料を含むか、又は請求項9により得られるか、若しくは請求項8により製造される少なくとも1種のポリマーを含む、ポリマー層、特に配向層、あるいは請求項12により製造されるポリマー層。
- 光学及び電気光学的非構造化又は構造化構成要素、好ましくは液晶ディスプレイセル、多層及びハイブリッド層素子の製造のための、請求項13に記載の、若しくは請求項12により製造されるポリマー層の、又は請求項1に記載の光整列材料の使用。
- 請求項13に記載の、若しくは請求項12により製造される少なくとも1種のポリマー層を含むか、又は請求項1に記載の少なくとも1種の光整列材料を含む、光学及び電気光学的非構造化又は構造化構成要素、好ましくは液晶ディスプレイセル、多層及びハイブリッド層素子。
- 請求項13に記載の、若しくは請求項12により製造される少なくとも1種のポリマー層を含むか、又は請求項1に記載の少なくとも1種の光整列材料を含む、液晶ディスプレイセルである、請求項14に記載の電気光学的非構造化又は構造化構成要素。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP10001443 | 2010-02-12 | ||
| EP10001443.0 | 2010-02-12 | ||
| EP10161466.7 | 2010-04-29 | ||
| EP10161466 | 2010-04-29 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012552373A Division JP5852016B2 (ja) | 2010-02-12 | 2011-02-09 | 側方置換した光整列材料 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015232136A true JP2015232136A (ja) | 2015-12-24 |
| JP6046219B2 JP6046219B2 (ja) | 2016-12-14 |
Family
ID=43951759
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012552373A Active JP5852016B2 (ja) | 2010-02-12 | 2011-02-09 | 側方置換した光整列材料 |
| JP2015145493A Active JP6046219B2 (ja) | 2010-02-12 | 2015-07-23 | 側方置換した光整列材料 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012552373A Active JP5852016B2 (ja) | 2010-02-12 | 2011-02-09 | 側方置換した光整列材料 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20120316317A1 (ja) |
| EP (1) | EP2534191B1 (ja) |
| JP (2) | JP5852016B2 (ja) |
| KR (1) | KR101898431B1 (ja) |
| CN (3) | CN102753605A (ja) |
| BR (1) | BR112012020244A2 (ja) |
| TW (1) | TWI591096B (ja) |
| WO (1) | WO2011098461A1 (ja) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102858849B (zh) * | 2010-04-23 | 2014-07-09 | 罗利克有限公司 | 光配向材料 |
| US9334366B2 (en) | 2011-10-03 | 2016-05-10 | Rolic Ag | Photoaligning materials |
| BR112014007924A2 (pt) * | 2011-10-03 | 2017-04-11 | Rolic Ag | materiais de foto alinhamento |
| JP6330662B2 (ja) * | 2012-08-21 | 2018-05-30 | 日産化学工業株式会社 | 液晶配向剤、液晶配向膜及び液晶表示素子 |
| KR101960827B1 (ko) * | 2013-05-03 | 2019-03-22 | 삼성디스플레이 주식회사 | 액정 조성물, 액정 표시 장치 및 액정 표시 장치 제조 방법 |
| SG11201601034PA (en) | 2013-08-19 | 2016-03-30 | Rolic Ag | Photo-alignable object |
| KR102284231B1 (ko) * | 2014-02-19 | 2021-08-04 | 롤리크 아게 | 액정 정렬 조성물, 액정 정렬 필름 및 액정 디스플레이 소자 |
| EP3246307B1 (en) | 2015-01-13 | 2019-11-27 | Nissan Chemical Corporation | Method for producing diamine precursor compound |
| KR102629649B1 (ko) | 2015-03-31 | 2024-01-29 | 롤리크 아게 | 광정렬 조성물 |
| CN105785612B (zh) * | 2016-05-13 | 2020-05-29 | 深圳市华星光电技术有限公司 | Psva液晶面板的制作方法 |
| CN109477930A (zh) | 2016-07-29 | 2019-03-15 | 罗利克技术有限公司 | 在液晶聚合物材料上产生取向的方法 |
| CN120040306A (zh) * | 2019-03-29 | 2025-05-27 | 日产化学株式会社 | 二胺 |
| KR20220038353A (ko) | 2019-07-24 | 2022-03-28 | 롤릭 테크놀로지스 아게 | 광-정렬성 포지티브 c-플레이트 리타더 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001517719A (ja) * | 1997-09-25 | 2001-10-09 | ロリク アーゲー | 光架橋可能なポリイミド |
| JP2003520878A (ja) * | 2000-01-24 | 2003-07-08 | ロリク アーゲー | 側鎖の光架橋性基を有する光活性ポリイミド、ポリアミド酸又はエステル |
| WO2008145225A2 (en) * | 2007-05-25 | 2008-12-04 | Rolic Ag | Photocrosslinkable materials comprising alicyclic group |
| JP2009520702A (ja) * | 2005-12-23 | 2009-05-28 | ロリク アーゲー | 光架橋性材料 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA1341010C (en) * | 1986-06-30 | 2000-05-30 | Minnesota Mining And Manufacturing Company | Compounds useful in preparing fluorine-containing chiral smectic liquid crystals |
| US4886619A (en) * | 1986-06-30 | 1989-12-12 | Minnesota Mining And Manufacturing Company | Fluorine-containing chiral smectic liquid crystals |
| US5082587A (en) * | 1988-09-23 | 1992-01-21 | Janulis Eugene P | Achiral fluorine-containing liquid crystals |
| JPH02115145A (ja) * | 1988-10-26 | 1990-04-27 | Canon Inc | 液晶性化合物、それを含有する液晶組成物および液晶素子 |
| KR100465445B1 (ko) * | 2001-07-31 | 2005-01-13 | 삼성전자주식회사 | 액정배향막용 광배향재 |
| AU2003218476A1 (en) * | 2002-05-31 | 2003-12-19 | Elsicon, Inc. | Hybrid polymer materials for liquid crystal alignment layers |
| EP1801097A1 (en) * | 2005-12-23 | 2007-06-27 | Rolic AG | Photocrosslinkable materials |
| EP1860094A1 (en) * | 2006-05-23 | 2007-11-28 | Rolic AG | Photocrosslinkable materials |
| KR101330911B1 (ko) | 2006-01-30 | 2013-11-18 | 제이에스알 가부시끼가이샤 | 액정 배향제, 배향막 및 액정 표시 소자 |
| EP1975687A1 (en) * | 2007-03-29 | 2008-10-01 | Rolic AG | Method of uniform and defect free liquid crystal aligning layers |
| WO2008135131A1 (en) * | 2007-05-02 | 2008-11-13 | Rolic Ag | Thermally stable alignment materials |
| WO2009080147A1 (en) * | 2007-12-21 | 2009-07-02 | Rolic Ag | Functionalized photoreactive compounds |
| KR101484250B1 (ko) | 2008-05-21 | 2015-01-19 | 삼성디스플레이 주식회사 | 광배향재, 이를 이용하여 형성한 배향막을 갖는 표시 기판및 그 표시 기판의 제조 방법 |
| CN102056882B (zh) * | 2008-06-09 | 2014-07-09 | Jnc株式会社 | 具有环己烷环的5环液晶化合物、液晶组成物以及液晶显示元件 |
-
2011
- 2011-01-31 TW TW100103544A patent/TWI591096B/zh active
- 2011-02-09 CN CN2011800089537A patent/CN102753605A/zh active Pending
- 2011-02-09 US US13/578,056 patent/US20120316317A1/en not_active Abandoned
- 2011-02-09 KR KR1020127023808A patent/KR101898431B1/ko active Active
- 2011-02-09 EP EP11702460.4A patent/EP2534191B1/en not_active Not-in-force
- 2011-02-09 CN CN201710276755.8A patent/CN106873249B/zh active Active
- 2011-02-09 WO PCT/EP2011/051845 patent/WO2011098461A1/en not_active Ceased
- 2011-02-09 JP JP2012552373A patent/JP5852016B2/ja active Active
- 2011-02-09 BR BR112012020244A patent/BR112012020244A2/pt not_active Application Discontinuation
- 2011-02-09 CN CN201710276753.9A patent/CN107011924B/zh active Active
-
2015
- 2015-07-23 JP JP2015145493A patent/JP6046219B2/ja active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001517719A (ja) * | 1997-09-25 | 2001-10-09 | ロリク アーゲー | 光架橋可能なポリイミド |
| JP2003520878A (ja) * | 2000-01-24 | 2003-07-08 | ロリク アーゲー | 側鎖の光架橋性基を有する光活性ポリイミド、ポリアミド酸又はエステル |
| JP2009520702A (ja) * | 2005-12-23 | 2009-05-28 | ロリク アーゲー | 光架橋性材料 |
| WO2008145225A2 (en) * | 2007-05-25 | 2008-12-04 | Rolic Ag | Photocrosslinkable materials comprising alicyclic group |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20120125541A (ko) | 2012-11-15 |
| CN107011924B (zh) | 2021-06-01 |
| KR101898431B1 (ko) | 2018-09-14 |
| WO2011098461A1 (en) | 2011-08-18 |
| TWI591096B (zh) | 2017-07-11 |
| JP2013519744A (ja) | 2013-05-30 |
| TW201141911A (en) | 2011-12-01 |
| CN106873249B (zh) | 2018-09-14 |
| BR112012020244A2 (pt) | 2016-04-26 |
| CN106873249A (zh) | 2017-06-20 |
| EP2534191A1 (en) | 2012-12-19 |
| JP6046219B2 (ja) | 2016-12-14 |
| US20120316317A1 (en) | 2012-12-13 |
| JP5852016B2 (ja) | 2016-02-03 |
| CN102753605A (zh) | 2012-10-24 |
| CN107011924A (zh) | 2017-08-04 |
| EP2534191B1 (en) | 2020-04-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6046219B2 (ja) | 側方置換した光整列材料 | |
| KR102020755B1 (ko) | 광배향 재료 | |
| JP5856147B2 (ja) | 光配向材料 | |
| JP6525590B2 (ja) | 光反応性化合物 | |
| WO2021060270A1 (ja) | 液晶配向剤、液晶配向膜、及び液晶表示素子 | |
| HK1239829A1 (en) | Photoaligning material with lateral substitution | |
| HK1239829A (en) | Photoaligning material with lateral substitution | |
| HK1238279A (zh) | 具有侧取代的光配向材料 | |
| HK1238279A1 (en) | Photoaligning material with lateral substitution | |
| HK1239829B (zh) | 具有侧取代的光配向材料 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20160729 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160809 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161020 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20161108 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20161116 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6046219 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |