JP2014523398A - 抗−インテグリンを用いた抗血管新生療法を改良するための方法及び組成物 - Google Patents
抗−インテグリンを用いた抗血管新生療法を改良するための方法及び組成物 Download PDFInfo
- Publication number
- JP2014523398A JP2014523398A JP2014501258A JP2014501258A JP2014523398A JP 2014523398 A JP2014523398 A JP 2014523398A JP 2014501258 A JP2014501258 A JP 2014501258A JP 2014501258 A JP2014501258 A JP 2014501258A JP 2014523398 A JP2014523398 A JP 2014523398A
- Authority
- JP
- Japan
- Prior art keywords
- integrin
- beta
- antibody
- agent
- tumor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2839—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the integrin superfamily
- C07K16/2842—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the integrin superfamily against integrin beta1-subunit-containing molecules, e.g. CD29, CD49
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
- C12N2740/15043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Pharmacology & Pharmacy (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Description
本出願は、2011年3月23日に出願された米国仮出願第61/466791号の利益を主張するものであり、その全開示を参照により本願明細書に援用する。
なし
本出願は、EFS−WebによりASCII形式で提出された配列表を含み、その全開示を参照により本願明細書に援用する。2012年1月31日に作成されたこのASCIIの複製は、「479−100配列表.txt」と名付けられ、5287バイトのサイズがある。
本発明の特定の態様についての背景的情報を下記に記載する。これらは、詳細な説明において言及されるが、必ずしも詳細に記載されない技術的特徴に関連し得る。すなわち、本発明に用いられる個々の部材又は方法は、以下に記載の文献においてより詳細に記載され得る。これらの文献は、請求項に記載される本発明の特定の態様を実施又は使用するための更なる助言を当業者に提供する。以下の記載は、本願のあらゆる請求項について重要な情報であること、又は、下記の文献の先行技術の効果に関する自白として解釈されるべきではない。
Park et al.(米国特許第7,618,627号、2009年11月17日発行、“Method of increasing radiation sensitivity by inhibition of beta−one integrin”)は、腫瘍細胞のアポトーシスを増加させるためのイオン照射と組み合わせて、抗−ベータ1インテグリン抗体AIIB2を用いた。
Theodore Yednock(米国特許第6,033,665号(2000年))“Compositions and methods for modulating leukocyte adhesion to brain endothelial cells.”。これは、臨床用にFDA承認された抗−インテグリン治療薬(複数の硬化症の治療用のアルファ−4−ベータ−1に対するTysabri(登録商標)、Elan Pharmaceuticals, Inc.)を生じさせた最初の特許の1つである。
Friess et al.(米国特許出願公開第0050385 A1号(2008年))は、共に血管新生に関連する増殖因子を標的とする、抗−VEGF抗体及び抗−HER2抗体による組み合わせ治療を提案した。
Senger et al.(米国特許第6,596,276号(2003年))は、VEGFを介する血管新生の下流にあるエフェクターを標的とする、アルファ−1及び/又はアルファ−2インテグリンサブユニットに対する阻害抗体の投与を提案した。
Bissell et al.(米国特許第5,846,536号(1998年)及び米国特許第6,123,941号(2000年))は、有効量の、ベータ1インテグリン機能−遮断抗体、又は、かかる治療を必要とする組織のベータ1受容体に対するインテグリンの機能のペプチド阻害剤を投与することによって、組織中の悪性の表現型を逆転させる方法を開示する。
本願明細書に記載されるのは、1)血管の新たな成長又はリモデリング(すなわち、血管新生)と、2)直接的な接着性の相互作用(すなわち、吸収)による既存の血管の使用とによる腫瘍の血管新生という2つの作用機序が認められる、腫瘍及び転移腫瘍、を治療するための改良した方法及び組成物である。生物システム中の両作用機序を組み合わせて阻害することによって、腫瘍及び転移腫瘍は、十分な血液供給を取り除くことができ、腫瘍細胞の死を含む腫瘍細胞の成長停止及び可能ならば退行を生じさせることができる。この方法は、血管新生が疾患、特に癌のプロセスにおいて寄与する因子となる、科学研究及び医療において様々な用途を有する。別の実施形態では、組織の修復又は交換のための血管新生の増強を、血管新生及び接着性の血管吸収の両方を同時に又は連続的に促進することによって達成することができる。
Holash et al.(1999; Science 284: 1994−1998 “essel co−option, regression and growth in tumors mediated by angiopoietins and VEGF”)は、腫瘍のサブセットが既存の宿主の血管を吸収することによって初めに成長することを、ラット神経膠腫モデルにおいて実証した。この吸収された宿主の脈管構造は、やがてVEGF及び血管新生の上方制御を示した。脳転移腫瘍についての発明者の研究は、血管吸収又は既存の血管の使用が、実験用の脳転移腫瘍の確立の初期における腫瘍細胞による、及び疾患の初期を示すヒト臨床用試料中において用いられる、血管の主要な形態であることを示した。この発見は、ミクロコロニー形成前のデノボ血管新生の要件を除外する。CNS実質は、内皮及び癌細胞の接着及び生存に必要である非血管性の間質の基底膜要素を大きく欠いている。そのため、血管吸収は、そうでなければ神経網で広く用いられていない、非神経系の癌細胞の悪性の増殖に関係する物質を供給する。転移性腫瘍細胞による増殖は、インビトロで、基底膜の基層に対する接着により大きく促進され、MEKを阻害することによって減衰される。組織培養における実験と一致して、インビボでのコロニー形成の初期段階中、微小転移の圧倒的多数は、既存の脳血管のVBMと直接的に接触することが見出され、これらの細胞の多くは増殖していた。このように、血管基底膜(VBM)は、脳における腫瘍細胞増殖のための活性物質とし示唆される。VBMは接着及び悪性細胞の浸入を促進し、血管新生のあらゆる兆候の前の腫瘍増殖に十分であった。
血管の血管基底膜にチアする腫瘍細胞の接着は、ベータ−1インテグリンにより仲介されることが見出されている。腫瘍細胞におけるベータ−1インテグリンサブユニットの遮断又は喪失は、血管基底膜に対する接着を妨げ、ビボでの転移腫瘍の確立及び増殖を減衰させた。脳における転移中の接着及び浸入における脈管構造のための転移性癌細胞の要件は、膵島の発達中のVBMについての要件により類似したものとしてよい。島細胞はVBMに適合するためのベータ1インテグリンを用い、この相互作用は増殖及び内分泌機能に必要となる。Nikolova et al.は、この基底膜の微小環境を、「血管ニッチ(vascular niche)」と称した(Nikolova et al., 2006; Dev Cell 10: 397−405; “the vascular basement membrane: a niche for insulin gene expression and beta cell proliferation”)。同様に、血管の壁細胞は、血管に対する適切な接着及び血管安定性を維持するために、ベータ1インテグリンサブユニットを必要とする。同様に、その後、癌細胞は、脳の転移中に必須の機能を求めて、脳のVBMをハイジャックすると思われる。興味深いことに、限局性の安定確立されたCNSメラノーマ転移において血管新生を阻害することにより、血管吸収による増殖への転換が生じる。これは、治療的活用のための生物標的を表し得る腫瘍細胞による血管に使用するための連続体を与える。
接着性の血管吸収及び血管新生を制御する薬剤は、一緒に又は処方時間のインターバルの後に連続的に投与してよい。一緒に投与される場合、これらは許容可能な生体適合性の送達のプラットフォームにより送達してよい。代わりに、薬剤は互いに直接的に融合されてよい。加えて、複数の血管新生の及び/又は接着性の血管吸収を制御する薬剤が、同時又は連続的のいずれかで投与されてよい。最後に、いかなる実施形態も、照射、化学療法、及び/又は血管透過性を増大させる薬剤等のアジュバンド療法と組み合わせてよい。
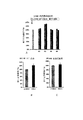
高速増殖の癌の確立及び抗血管新生治療後における別の一般的な細胞ストレスである、低酸素が、患者の多形膠芽細胞腫(GBM)の試料におけるベータ1の高発現に関係することを示す。この作用機序を直接的に確認するために、我々は、神経膠腫細胞を6〜48時間、1%酸素に曝して、微小環境の低酸素刺激を行った。我々は、インビトロで神経膠腫細胞においてベータ1インテグリン発現に大きな増加を観察した。これは、迅速で可逆の細胞の応答であり、乳癌及び結腸直腸癌細胞においても実証された。抗−血管新生治療がインビボで増殖中の腫瘍においてベータ1の発現を急激に増加させることを証明するために、我々は、最後にベバシツマブ治療を行った日のうちに採取したマウス由来の神経膠腫を染色した。コントロールと比較して特記すべきベータ1の増加が、治療された腫瘍、特に、低酸素の腫瘍コアにおいて観察された(図2)。
インビトロでの腫瘍細胞におけるベータ1の発現の更なる増加が、腫瘍細胞の増殖そのものの中で観察された。U87MG神経膠腫細胞において、インビトロでの細胞コンフルエントとベータ1のレベルとの間には負の相関がある(図3)。加えて、U87MG神経膠腫細胞において、増殖マーカーであるKi−67は、FACSによる実験の通り、ベータ1の発現と正の相関がある。これは、他の研究者が乳癌細胞において観察した結果と一致している。第一に、我々は、一次性GBM由来のヒトの外科的試料中の血管新生の血管におけるベータ1インテグリンの発現において相当な減少を視覚的に観察した(図4)。このベータ1インテグリンの発現の増加は、上記の通り、神経膠腫細胞において観察された細胞の増殖へのベータ1の集合に関連すると考えられる。このように、血管の浸入及び増殖に加えて、ベータ1インテグリンは、腫瘍細胞の増殖、低酸素及びIR青の生存シグナリング、及び血管新生のプロセス中の血管内皮細胞に、密接に関係すると思われる。これらの複数の特徴は、ベータ1インテグリンを、直接的に腫瘍の増殖を阻害することができる、また、抗−血管新生薬への耐性の発達を減衰させる抗−血管新生薬を用いた併用療法として、非常に魅力的な標的とする。
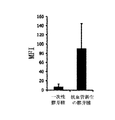
ベータ1インテグリンがベバシツマブ耐性に関与し得るという仮説を実証するために、我々は、ベバシツマブ治療の前、及び獲得したベバシツマブ耐性の発達後に採取した、一対の患者のGBMの試料において、ベータ1インテグリンに対する免疫蛍光化学を用いた。未治療の試料と比較して、ベバシツマブ後のGBM組織において、12対中9対で明らかな増加が見られた(75%、図5)。
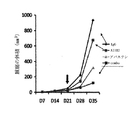
レンチウイルス粒子中のインテグリンベータ1shRNAは、Santa Cruz Biotechnology,Inc.,カタログ番号sc−35675から購入した。4つの異なるshRNA配列の混合物を与えた。この試薬は、ベバシツマブ治療に不成功であった患者に由来する、SF8106−Ax1及びSF7796−Ax3(それぞれ、BRG3及びBRG2として知られている)細胞株を形質転換するために用いられる。我々は、レンチウイルスベクターを用いてベータ1及びベータ3インテグリンの安定ノックダウン細胞株を作製した。我々は、BRG3細胞において、一週間後に、GFPベクターコントロール細胞株又はベータ3ノックダウン細胞株のいずれかと比較して、70%のベータ1のノックダウンと、それに相当する60%の細胞増殖の減少を実証した(図8)。これらの細胞をより詳細に研究するために、我々は、90%超のベータ1がノックダウンされたBRG3ノックダウン細胞株を単離して、接着性、細胞伸展、細胞移動、及び細胞増殖を含む腫瘍細胞の病原力の増加を示す機能を評価した。これらのノックダウン細胞株は、ベクターコントロール細胞株と比較して、4つの機能全てにおいて相当に損なわれた。
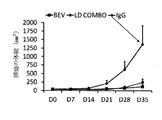
臨床的に意義のあるモードのベータ1阻害を伴う上記結果を証明するために、我々は、よく特性評価されたAIIB2阻害性のラットモノクローナル抗−ベータ1インテグリン抗体をインビトロでの阻害実験で用いた。アイソタイプがマッチしたIgGをコントロールとして用いた。ベバシツマブ耐性神経膠腫細胞株は、10μg/mLで、接着性(データ未公表)及び移動(動的な映像分析、未公表)の低減を含むベータ1のノックダウンとしての同様な機能の阻害を示した。細胞増殖に対する効果は、アポトーシス/細胞死(アネキシンV)又は増殖(Ki−67抗原)のいずれかについての免疫蛍光染色を用いて実証された。染色後、細胞をフローサイトメトリー/蛍光励起セルソーティング(FACS)によりソートした。この分析は、AIIB2で治療されたGBM細胞におけるKi−67における相当な減少を示したが、アネキシンVの免疫反応性に関して全く効果を示さず、細胞分裂停止の効果と一致した(データ未公表)。
スフェロイドの培養物中の腫瘍細胞の増殖が、幹様表現型の代替物となり、低酸素及び酸性のpH等のストレス要因により促進/富化され得る。標準的な神経膠腫細胞株(U87MG)及びBRG3ベバシツマブ耐性細胞株の両方におけるベータ1のノックダウンは、スフェロイドの形成を相当に悪化させる(データ未公表)。AIIB2は、48時間の低酸素により誘導されたU87MG神経膠腫細胞のスフェロイド増殖をも阻害した。
抗血管新生治療の効果のインビトロのモデルとして、我々は、増殖フェーズにある一次性GBM細胞を、低酸素で2時間、その後酸素正常で2日間曝した。低酸素は、ベバシツマブ等の抗−血管新生治療のインビトロでの代替物として用いた。2日の回復期間のAIIB2抗体の追加により、低酸素又はAIIB2治療のみのいずれかの場合と比較して、腫瘍細胞の増殖の更なる低減が生じた(図12)。このように、ベータ1インテグリンと抗血管新生薬との組み合わせは、治療効果の相乗効果を予見させる。
上記特定の記載は、本発明の例示説明を意味し、添付の請求項に記述の同等の本発明の範囲により定義される本発明の範囲を限定すると解されるべきではない。この明細書に記載されるあらゆる特許又は文献は、明示的に説明されないが、当業者により理解されうる、本発明の特定の実施形態を実施する際に有用な方法及び材料の詳細を説明することを目的とする。かかる特許又は文献は、それぞれが具体的に個別に本願明細書に参照され含まれる場合と同様に、言及される方法又は材料を記載する及び実施可能とする目的で必要に応じて、参照により本願明細書に援用される。
Claims (28)
- 血管内皮増殖因子(VEGF)の阻害剤である第一薬剤と、
ベータ−1インテグリンの結合を遮断する第二薬剤と、
の組み合わせを含み、
ここで、前記組み合わせは、腫瘍細胞の増殖を、前記第一薬剤又は前記第二薬剤のいずれか別々の場合よりも大きい程度まで腫瘍細胞の増殖を阻害する、
腫瘍細胞の増殖を阻害するための薬学的組成物。 - 前記VEGFの阻害剤はVEGFに結合する抗体である、請求項1に記載の組成物。
- 前記抗体はヒト化マウス抗体である、請求項2に記載の組成物。
- 前記第二薬剤はベータ−1インテグリンに対して結合するポリペプチドである、請求項1、2、又は3に記載の組成物。
- 前記ポリペプチドは、あらゆるアルファサブユニットに関連するベータ−1インテグリンに対して結合し、腫瘍細胞の細胞外基質に対する結合を阻害する、請求項4に記載の組成物。
- 前記ポリペプチドはベータ−1インテグリンに特異的な抗体である、請求項4に記載の組成物。
- 前記ベータ−1インテグリンに特異的な抗体は、キメラ、一本鎖、又はヒト化抗体である、請求項6に記載の組成物。
- 前記抗体はAIIB2、BIE11又はAIIB若しくはBIE11に由来するヒト化抗体である、請求項7に記載の組成物。
- 前記第一薬剤及び前記第二薬剤は、VEGFを認識する1つの結合部位、及びベータ1インテグリンを認識する1つの結合部位を有する2価抗体により提供される、請求項1に記載の組成物。
- 腫瘍を有する被験者に対して、
抗血管新生薬である第一薬剤と;ベータ−1インテグリンにより仲介される腫瘍細胞の結合を遮断する第二薬剤と
の組み合わせを投与するステップを含み、
ここで、腫瘍細胞の増殖は、前記第一薬剤又は前記第二薬剤のいずれか単独の場合よりも大きい程度で阻害される、
腫瘍細胞の増殖を阻害する方法。 - 前記抗血管新生薬はVEGFに結合する抗体である、請求項10に記載の方法。
- 前記抗血管新生薬は、ヒト化マウスモノクローナル抗体及び完全ヒト化抗体からなる群から選択される、請求項10に記載の方法。
- 前記第二薬剤はベータ−1インテグリンに結合するポリペプチドである、請求項10に記載の方法。
- 前記ポリペプチドは、あらゆるアルファサブユニットに関連するベータ−1インテグリンに対して結合する、請求項13に記載の方法。
- 前記ポリペプチドはベータ−1インテグリンに特異的な抗体である、請求項13に記載の方法。
- 前記抗体は、キメラ、一本鎖、又はヒト化抗体である、請求項15に記載の方法。
- 前記抗体はAIIB2、BIE11又はそのヒト化誘導体である、請求項15に記載の方法。
- 前記腫瘍は、神経膠芽腫、大腸、肺、肝臓、腎臓、結腸、メラノーマ、及びリンパ腫からなる群から選択される、請求項10に記載の方法。
- 腫瘍をベータ−1インテグリンの結合の阻害剤と接触させるステップを含む、神経上皮組織の腫瘍を治療する方法。
- 前記阻害剤はあらゆるアルファサブユニットに関連するベータ−1インテグリンに対して結合する抗体である、請求項19に記載の方法。
- 腫瘍を有する被験者に対して、
VEGFに対して結合する第一薬剤と;ベータ−1インテグリンにより仲介される腫瘍細胞の結合を遮断する第二薬剤と
の組み合わせを投与するステップを含み、
ここで、前記第一薬剤又は前記第二薬剤の1つ又は両方はラベル化されている、
腫瘍をイメージングする方法。 - 前記第二薬剤は、キメラ、一本鎖、又はベータ−1インテグリンに対して結合するヒト化抗体である、請求項21に記載の方法。
- 前記腫瘍は、神経膠芽腫、大腸、肺、腎臓、肝臓、卵巣、及び乳房からなる群から選択される、請求項21に記載の方法。
- 前記細胞にベータ−1インテグリンをコード化する遺伝子の発現を妨げる拡散コンストラクトを送達するステップを含む、腫瘍細胞の増殖を阻害する方法。
- 前記コンストラクトは、ベータ−1インテグリンmRNAに対して結合して、ベータ−1インテグリン遺伝子発現を発現停止するshRNAをコード化するレンチウイルスベクターである、請求項24に記載の方法。
- 被験者に抗−インテグリン薬剤を投与するステップを含み、前記被験者は抗−VEGF抗体による治療に失敗している、
腫瘍を有する被験者を治療する方法。 - (a)腫瘍内、切除による空洞内、又は硬膜下に配置するためのカテーテルと;
(b)前記カテーテルを通して、対流強化送達法(CED)装置により、臨床的に意義のある用量及び速度で、投与するために製剤化された、阻害性の抗−ベータ1インテグリン組成物と
を含む、再発性の多形膠芽細胞腫(GBM)を有する被験者を治療するためのキット。 - 腫瘍を有する被験者に対して、
抗血管新生薬である低用量の第一薬剤と;ベータ−1インテグリンにより仲介される腫瘍細胞の結合を遮断する第二薬剤と、
の組み合わせを投与するステップを含み、
ここで腫瘍細胞の増殖は、より高い用量の第一薬剤により生じる量と同じ量まで阻害される、
腫瘍細胞の増殖を抑制する方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161466791P | 2011-03-23 | 2011-03-23 | |
| US61/466,791 | 2011-03-23 | ||
| PCT/US2012/030204 WO2012129448A1 (en) | 2011-03-23 | 2012-03-22 | Methods and compositions for improving antiangiogenic therapy with anti-integrins |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014523398A true JP2014523398A (ja) | 2014-09-11 |
| JP2014523398A5 JP2014523398A5 (ja) | 2015-05-07 |
Family
ID=46879749
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014501258A Pending JP2014523398A (ja) | 2011-03-23 | 2012-03-22 | 抗−インテグリンを用いた抗血管新生療法を改良するための方法及び組成物 |
Country Status (9)
| Country | Link |
|---|---|
| US (3) | US20140079637A1 (ja) |
| EP (1) | EP2688585B1 (ja) |
| JP (1) | JP2014523398A (ja) |
| KR (1) | KR20140030153A (ja) |
| CN (1) | CN103561761A (ja) |
| AU (1) | AU2012230809B2 (ja) |
| CA (1) | CA2830908C (ja) |
| ES (1) | ES2699532T3 (ja) |
| WO (1) | WO2012129448A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022519342A (ja) * | 2019-01-10 | 2022-03-23 | エスジー メディカル インコーポレイテッド | 抗ベータ1インテグリンヒト化抗体及びこれを含む癌治療用薬学組成物 |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20140030153A (ko) * | 2011-03-23 | 2014-03-11 | 더 리젠츠 오브 더 유니버시티 오브 캘리포니아 | 항-인테그린을 사용하여 항혈관 형성 요법을 개선하기 위한 방법 및 조성물 |
| EP3530284B1 (en) | 2012-12-26 | 2023-10-25 | OncoSynergy, Inc. | Anti-integrin beta1 antibody compositions and methods of use thereof |
| EP3067698A1 (en) | 2015-03-11 | 2016-09-14 | Institut d'Investigació Biomèdica de Bellvitge (IDIBELL) | Pd-ecgf as biomarker of cancer |
| EP3067369A1 (en) | 2015-03-11 | 2016-09-14 | Institut d'Investigació Biomèdica de Bellvitge (IDIBELL) | Methods and compositions for the treatment of anti-angiogenic resistant cancer |
| IL298067A (en) | 2015-08-25 | 2023-01-01 | Histide Ag | Compounds for inducing tissue formation and uses thereof |
| WO2017046229A1 (en) * | 2015-09-17 | 2017-03-23 | Histide Ag | Pharmaceutical association of growth factor receptor agonist and adhesion protein inhibitor for converting a neoplastic cell into a non-neoplastic cell and uses thereof |
| AU2016323407A1 (en) * | 2015-09-17 | 2018-04-19 | Histide Ag | Pharmaceutical association of growth factor receptor agonist and adhesion protein inhibitor for converting a neoplastic cell into a non-neoplastic cell and uses thereof |
| AU2016323408A1 (en) * | 2015-09-17 | 2018-04-19 | Histide Ag | Pharmaceutical association of growth factor receptor agonist and adhesion protein inhibitor for converting a neoplastic cell into a non-neoplastic cell and uses thereof |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002514605A (ja) * | 1998-05-08 | 2002-05-21 | ザ レジェンツ オブ ザ ユニヴァースティ オブ カリフォルニア | 血管形成を検出および阻害する方法 |
| WO2005117976A2 (en) * | 2004-06-03 | 2005-12-15 | The Regent Of The University Of California | Method of increasing radiation sensitivity by inhibition of beta one integrin |
| JP2007210968A (ja) * | 2006-02-10 | 2007-08-23 | Keio Gijuku | 神経幹細胞の増殖抑制剤 |
| WO2009009114A2 (en) * | 2007-07-12 | 2009-01-15 | Oncomed Pharmaceuticals, Inc. | Compositions and methods for treating and diagnosing cancer |
| US20090124976A1 (en) * | 2007-11-14 | 2009-05-14 | Stephan Mittermeyer | Drug supply system for ced (convection-enhanced delivery) catheter infusions |
| JP2009536921A (ja) * | 2006-03-21 | 2009-10-22 | ジェネンテック・インコーポレーテッド | アルファ5ベータ1アンタゴニストを含むコンビナトリアル療法 |
| US20100048677A1 (en) * | 2008-08-20 | 2010-02-25 | Mitchell W Beau | Regulation of Integrin Surface Expression |
| WO2010072741A1 (en) * | 2008-12-23 | 2010-07-01 | Astrazeneca Ab | TARGETED BINDING AGENTS DIRECTED TO α5β1 AND USES THEREFOR |
| WO2010111254A1 (en) * | 2009-03-25 | 2010-09-30 | Genentech, Inc. | Novel anti-alpha5beta1 antibodies and uses thereof |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5272263A (en) * | 1989-04-28 | 1993-12-21 | Biogen, Inc. | DNA sequences encoding vascular cell adhesion molecules (VCAMS) |
| US6033665A (en) | 1989-09-27 | 2000-03-07 | Elan Pharmaceuticals, Inc. | Compositions and methods for modulating leukocyte adhesion to brain endothelial cells |
| US6165467A (en) | 1991-07-20 | 2000-12-26 | Yoshihide Hagiwara | Stabilized human monoclonal antibody preparation |
| US5840300A (en) | 1995-09-11 | 1998-11-24 | Trustees Of The University Of Pennsylvania | Methods and compositions comprising single chain recombinant antibodies |
| US5846536A (en) * | 1996-10-04 | 1998-12-08 | The Regents Of The University Of California | Restoration of normal phenotype in cancer cells |
| US6596276B1 (en) | 1997-09-30 | 2003-07-22 | Beth Israel Deaconess Medical Center | Method for inhibiting tumor angiogenesis in a living subject |
| WO2000042012A1 (en) | 1999-01-13 | 2000-07-20 | Bayer Corporation | φ-CARBOXYARYL SUBSTITUTED DIPHENYL UREAS AS RAF KINASE INHIBITORS |
| IL144144A0 (en) | 1999-01-13 | 2002-05-23 | Bayer Ag | Omega-carboxy aryl substituted diphenyl ureas as p38 kinase inhibitors |
| US7928239B2 (en) | 1999-01-13 | 2011-04-19 | Bayer Healthcare Llc | Inhibition of RAF kinase using quinolyl, isoquinolyl or pyridyl ureas |
| US6949245B1 (en) | 1999-06-25 | 2005-09-27 | Genentech, Inc. | Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies |
| US6716410B1 (en) | 1999-10-26 | 2004-04-06 | The Regents Of The University Of California | Reagents and methods for diagnosing, imaging and treating atherosclerotic disease |
| JP3789066B2 (ja) | 1999-12-08 | 2006-06-21 | 三菱電機株式会社 | 液晶表示装置 |
| US8725620B2 (en) | 2000-07-10 | 2014-05-13 | Nobuyoshi Morimoto | System and method for negotiating improved terms for products and services being purchased through the internet |
| US6995162B2 (en) | 2001-01-12 | 2006-02-07 | Amgen Inc. | Substituted alkylamine derivatives and methods of use |
| US6878714B2 (en) | 2001-01-12 | 2005-04-12 | Amgen Inc. | Substituted alkylamine derivatives and methods of use |
| US20030143191A1 (en) * | 2001-05-25 | 2003-07-31 | Adam Bell | Chemokine beta-1 fusion proteins |
| JP4351043B2 (ja) | 2001-07-09 | 2009-10-28 | エラン ファーマシューティカルズ,インコーポレイテッド | アミロイド毒性の阻害方法 |
| JP2005526008A (ja) | 2001-12-04 | 2005-09-02 | オニックス ファーマシューティカルズ,インコーポレイティド | 癌を処置するためのraf−mek−erk経路インヒビター |
| US8637553B2 (en) | 2003-07-23 | 2014-01-28 | Bayer Healthcare Llc | Fluoro substituted omega-carboxyaryl diphenyl urea for the treatment and prevention of diseases and conditions |
| US7435823B2 (en) | 2004-01-23 | 2008-10-14 | Amgen Inc. | Compounds and methods of use |
| JP2008546805A (ja) | 2005-06-23 | 2008-12-25 | メディミューン,エルエルシー | 最適な凝集および断片化プロフィールを有する抗体製剤 |
| AR059066A1 (es) | 2006-01-27 | 2008-03-12 | Amgen Inc | Combinaciones del inhibidor de la angiopoyetina -2 (ang2) y el inhibidor del factor de crecimiento endotelial vascular (vegf) |
| CN101448858B (zh) * | 2006-03-21 | 2013-06-12 | 健泰科生物技术公司 | 牵涉α5β1拮抗剂的联合疗法 |
| WO2008031064A1 (en) * | 2006-09-07 | 2008-03-13 | University Of South Florida | Hyd1 peptides as anti-cancer agents |
| WO2009018226A2 (en) * | 2007-07-27 | 2009-02-05 | Facet Biotech Corporation | Pharmaceutical combinations comprising a tyrosine kinase inhibitor and an antibody against integrin alpha 1 beta 5 (cd49e) |
| KR20140030153A (ko) * | 2011-03-23 | 2014-03-11 | 더 리젠츠 오브 더 유니버시티 오브 캘리포니아 | 항-인테그린을 사용하여 항혈관 형성 요법을 개선하기 위한 방법 및 조성물 |
| EP3530284B1 (en) * | 2012-12-26 | 2023-10-25 | OncoSynergy, Inc. | Anti-integrin beta1 antibody compositions and methods of use thereof |
-
2012
- 2012-03-22 KR KR1020137027236A patent/KR20140030153A/ko not_active Ceased
- 2012-03-22 CA CA2830908A patent/CA2830908C/en active Active
- 2012-03-22 US US14/006,669 patent/US20140079637A1/en not_active Abandoned
- 2012-03-22 JP JP2014501258A patent/JP2014523398A/ja active Pending
- 2012-03-22 AU AU2012230809A patent/AU2012230809B2/en active Active
- 2012-03-22 CN CN201280024596.8A patent/CN103561761A/zh active Pending
- 2012-03-22 WO PCT/US2012/030204 patent/WO2012129448A1/en active Application Filing
- 2012-03-22 EP EP12760157.3A patent/EP2688585B1/en active Active
- 2012-03-22 ES ES12760157T patent/ES2699532T3/es active Active
-
2018
- 2018-01-12 US US15/869,970 patent/US11185585B2/en active Active
-
2021
- 2021-10-27 US US17/512,500 patent/US20220111045A1/en not_active Abandoned
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002514605A (ja) * | 1998-05-08 | 2002-05-21 | ザ レジェンツ オブ ザ ユニヴァースティ オブ カリフォルニア | 血管形成を検出および阻害する方法 |
| WO2005117976A2 (en) * | 2004-06-03 | 2005-12-15 | The Regent Of The University Of California | Method of increasing radiation sensitivity by inhibition of beta one integrin |
| JP2007210968A (ja) * | 2006-02-10 | 2007-08-23 | Keio Gijuku | 神経幹細胞の増殖抑制剤 |
| JP2009536921A (ja) * | 2006-03-21 | 2009-10-22 | ジェネンテック・インコーポレーテッド | アルファ5ベータ1アンタゴニストを含むコンビナトリアル療法 |
| WO2009009114A2 (en) * | 2007-07-12 | 2009-01-15 | Oncomed Pharmaceuticals, Inc. | Compositions and methods for treating and diagnosing cancer |
| US20090124976A1 (en) * | 2007-11-14 | 2009-05-14 | Stephan Mittermeyer | Drug supply system for ced (convection-enhanced delivery) catheter infusions |
| US20100048677A1 (en) * | 2008-08-20 | 2010-02-25 | Mitchell W Beau | Regulation of Integrin Surface Expression |
| WO2010072741A1 (en) * | 2008-12-23 | 2010-07-01 | Astrazeneca Ab | TARGETED BINDING AGENTS DIRECTED TO α5β1 AND USES THEREFOR |
| WO2010111254A1 (en) * | 2009-03-25 | 2010-09-30 | Genentech, Inc. | Novel anti-alpha5beta1 antibodies and uses thereof |
Non-Patent Citations (4)
| Title |
|---|
| CANCER RESEARCH, vol. 66(3), (2006 Feb), JPN6016003742, pages 1526 - 1535, ISSN: 0003249314 * |
| INT J CANCER., VOL.76, 1998, P.63-72, JPN6016038954, ISSN: 0003416211 * |
| 日本臨床, vol. Vol.68, No.10 (2010), JPN6016003740, pages 1825 - 1829, ISSN: 0003249313 * |
| 松下晃ら: "膵癌においてNeuropilin‐1はintegrin beta 1との関連し,その増殖,生存,浸潤に関与する", 日本癌学会学術総会記事, vol. Vol.67th (2008.09.30), JPN6016003737, pages 195, ISSN: 0003249312 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022519342A (ja) * | 2019-01-10 | 2022-03-23 | エスジー メディカル インコーポレイテッド | 抗ベータ1インテグリンヒト化抗体及びこれを含む癌治療用薬学組成物 |
| JP7222104B2 (ja) | 2019-01-10 | 2023-02-14 | エスジー メディカル インコーポレイテッド | 抗ベータ1インテグリンヒト化抗体及びこれを含む癌治療用薬学組成物 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20140079637A1 (en) | 2014-03-20 |
| KR20140030153A (ko) | 2014-03-11 |
| US20180236073A1 (en) | 2018-08-23 |
| CA2830908A1 (en) | 2012-09-27 |
| AU2012230809A1 (en) | 2013-10-10 |
| WO2012129448A1 (en) | 2012-09-27 |
| US20220111045A1 (en) | 2022-04-14 |
| EP2688585A1 (en) | 2014-01-29 |
| CN103561761A (zh) | 2014-02-05 |
| AU2012230809B2 (en) | 2017-06-29 |
| ES2699532T3 (es) | 2019-02-11 |
| EP2688585A4 (en) | 2015-05-06 |
| US11185585B2 (en) | 2021-11-30 |
| EP2688585B1 (en) | 2018-09-05 |
| CA2830908C (en) | 2019-09-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220111045A1 (en) | Methods and Compositions for Improving Antiangiogenic Therapy with Anti-Integrins | |
| US20240018257A1 (en) | Antibodies specific to human poliovirus receptor (pvr) | |
| JP7540994B2 (ja) | 高親和性のアイソフォーム選択的TGFβ1阻害剤、およびその使用 | |
| JP7011574B2 (ja) | Flt3及びcd3に対する抗体構築物 | |
| CN102596998B (zh) | 血管增殖病症的治疗 | |
| KR102608028B1 (ko) | 인간 원형질막 소포 관련 단백질 pv-1에 특이적으로 결합하는 단일클론항체 및 이의 제조방법과 용도 | |
| US10106601B2 (en) | Inhibition of PLGF to treat philadelphia chromosome positive leukemia | |
| US20090017011A1 (en) | Modulation of vegf-c/vegfr-3 interactions in the treatment of rheumatoid arthritis | |
| CN115873110A (zh) | 抑制scube2,一种新颖vegfr2辅助受体,抑制肿瘤血管发生 | |
| US20120189635A1 (en) | Methods for Treating or Preventing Malaria by Administering an Antibody that Specifically Binds Angiopoietin-2 (Ang-2) | |
| US20200330591A1 (en) | Treatment | |
| KR102207221B1 (ko) | 도펠-타겟팅 분자를 이용한 병리학적 신생혈관 생성을 억제하는 방법 | |
| WO2023105528A1 (en) | Antibodies specific to ceacam1 | |
| TW202430214A (zh) | Cd47阻斷劑及抗bcma/抗cd3雙特異性抗體之組合療法 | |
| JP2025517336A (ja) | 転移性去勢抵抗性前立腺癌を二重特異性抗psma×抗CD3抗体を単独で、又は抗PD-1抗体と組み合わせて治療する方法 | |
| JP2021504492A (ja) | 癌治療のための組成物および方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150320 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150320 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160209 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160509 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161011 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170111 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170410 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20171003 |