JP2010533869A - 標的分子を検出するためのマイクロ流体装置、方法及びシステム - Google Patents
標的分子を検出するためのマイクロ流体装置、方法及びシステム Download PDFInfo
- Publication number
- JP2010533869A JP2010533869A JP2010517146A JP2010517146A JP2010533869A JP 2010533869 A JP2010533869 A JP 2010533869A JP 2010517146 A JP2010517146 A JP 2010517146A JP 2010517146 A JP2010517146 A JP 2010517146A JP 2010533869 A JP2010533869 A JP 2010533869A
- Authority
- JP
- Japan
- Prior art keywords
- channel
- target
- protein
- polynucleotide
- flow
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54393—Improving reaction conditions or stability, e.g. by coating or irradiation of surface, by reduction of non-specific binding, by promotion of specific binding
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J19/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J19/0046—Sequential or parallel reactions, e.g. for the synthesis of polypeptides or polynucleotides; Apparatus and devices for combinatorial chemistry or for making molecular arrays
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502746—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means for controlling flow resistance, e.g. flow controllers, baffles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502753—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by bulk separation arrangements on lab-on-a-chip devices, e.g. for filtration or centrifugation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
- G01N33/582—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances with fluorescent label
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2219/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J2219/00274—Sequential or parallel reactions; Apparatus and devices for combinatorial chemistry or for making arrays; Chemical library technology
- B01J2219/00277—Apparatus
- B01J2219/0054—Means for coding or tagging the apparatus or the reagents
- B01J2219/00547—Bar codes
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2219/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J2219/00274—Sequential or parallel reactions; Apparatus and devices for combinatorial chemistry or for making arrays; Chemical library technology
- B01J2219/00583—Features relative to the processes being carried out
- B01J2219/00596—Solid-phase processes
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2219/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J2219/00274—Sequential or parallel reactions; Apparatus and devices for combinatorial chemistry or for making arrays; Chemical library technology
- B01J2219/00583—Features relative to the processes being carried out
- B01J2219/00603—Making arrays on substantially continuous surfaces
- B01J2219/00605—Making arrays on substantially continuous surfaces the compounds being directly bound or immobilised to solid supports
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2219/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J2219/00274—Sequential or parallel reactions; Apparatus and devices for combinatorial chemistry or for making arrays; Chemical library technology
- B01J2219/00583—Features relative to the processes being carried out
- B01J2219/00603—Making arrays on substantially continuous surfaces
- B01J2219/00605—Making arrays on substantially continuous surfaces the compounds being directly bound or immobilised to solid supports
- B01J2219/00614—Delimitation of the attachment areas
- B01J2219/00621—Delimitation of the attachment areas by physical means, e.g. trenches, raised areas
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2219/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J2219/00274—Sequential or parallel reactions; Apparatus and devices for combinatorial chemistry or for making arrays; Chemical library technology
- B01J2219/00718—Type of compounds synthesised
- B01J2219/0072—Organic compounds
- B01J2219/00722—Nucleotides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2219/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J2219/00274—Sequential or parallel reactions; Apparatus and devices for combinatorial chemistry or for making arrays; Chemical library technology
- B01J2219/00718—Type of compounds synthesised
- B01J2219/0072—Organic compounds
- B01J2219/00725—Peptides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2219/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J2219/00274—Sequential or parallel reactions; Apparatus and devices for combinatorial chemistry or for making arrays; Chemical library technology
- B01J2219/00718—Type of compounds synthesised
- B01J2219/0072—Organic compounds
- B01J2219/0074—Biological products
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0636—Integrated biosensor, microarrays
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0864—Configuration of multiple channels and/or chambers in a single devices comprising only one inlet and multiple receiving wells, e.g. for separation, splitting
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0867—Multiple inlets and one sample wells, e.g. mixing, dilution
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0487—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure fluid pressure, pneumatics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/08—Regulating or influencing the flow resistance
- B01L2400/084—Passive control of flow resistance
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5025—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures for parallel transport of multiple samples
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502715—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by interfacing components, e.g. fluidic, electrical, optical or mechanical interfaces
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2458/00—Labels used in chemical analysis of biological material
- G01N2458/10—Oligonucleotides as tagging agents for labelling antibodies
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Cell Biology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Organic Chemistry (AREA)
- Dispersion Chemistry (AREA)
- Clinical Laboratory Science (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Analysing Materials By The Use Of Radiation (AREA)
- Automatic Analysis And Handling Materials Therefor (AREA)
Abstract
Description
ハイブリダイゼーション速度Lrは:
Lr=kagfr
によって与えられ、kaは反応速度定数であり、gfrは表面に結合された捕捉剤の平均密度である。
Lm=cube root[(UD2)/(lwh2)]
によって与えられ、Uは流動速度であり、Dは拡散定数であり、l、w及びhは、それぞれ長さ、幅及び高さである。Da>>1(≧10)のとき、反応が拡散速度よりも速く起こっていることから、過程は拡散律速である。Da<<1(≦0.1)のとき、拡散速度は反応速度に比較して速く、過程は親和性律速である。いくつかの実施形態において、幅広いチャンネル(16)は、Da≧10であるように設計されることができ、狭いチャンネル(14)は、適切な長さ、幅及び高さのパラメータを上記の式に入力することによってDa≦0.1であるように設計されることができる。圧力は、適切な流速を得るために調節されることができる。
Da1:Da2=Lm2:Lm1=cube root(U2l1w1/U1l2w2)
であり、Lm1=幅広いチャンネルにおける物質輸送速度であり、Lm2=狭いチャンネルにおける物質輸送速度である。
Da1:Da2=cube root(w1/5w2)
と簡略化されることが可能である。
(原文“The flow of a liquid in a region over time t is characterized by a velocity vector field u a pressure p and a density ρ. For laminar, incompressible and viscous fluids the velocity is constant. The flow is described by the Navier-Stokes partial differential equation system
The bulk concentration C of a solute in a given solution is described by the Convection-Diffusion equation of the form
The association and the dissociation from the capture site are described by the rate coefficients k, the analyte concentration C and the density of free binding sites (Θmax-Θt) on the surface, using an ordinary differential equation of the form,
(非特許文献8)
いくつかの実施形態において、ツィンマーマン節からの数式は、親和性律速過程vs拡散律速過程と関係がある流速を決定するために、使用することができる。特に、ツィンマーマンの数式を組み込むシミュレーション、検体濃度の1pM及び抗体結合親和性のK〜10^9、及びフィーチャー・サイズの1500mm^2を使用し、0.5mm/sよりも速い流速は、親和性律速と考えられる一方、0.005mm/s付近の流速は、拡散律速と考えられる。さらに具体的には、0.05mm/sの流速は、拡散律速過程の始まりと考えられる。結果として、10倍-100倍の流速の相違は、拡散律速型と親和性律速型との間で識別される。
血漿分離のための装置が本開示に従って以下のように製造される。制御弁及び流体チャンネルは、PDMSにおいて加工される。装置は次に、DNAマイクロアレイ・ガラス・スライドに接着される。
統合分離DEAL装置が製造され、図9の概略図において示されるように使用される。
血液の処理及び低容量の血液における迅速な血漿分離;及びDEAL技術を使用したたんぱく質の検出及び量子化を実施する統合マイクロ流体チップが、製造され使用された。
模範的な分離分析手順は、以下のように実施された。DNAアレイでスポッティングされたガラス・スライドを含む血液分離マイクロ流体血液チップが、最初に3つの異なるヒトのサイトカイン捕捉抗体でコードされ、オンチップDEALアレイを形成する。ヒトのサイトカインでスパイクされた(spiked)羊の血液サンプルが、次に、装置に送り込まれた。アレイ上に流された分離された血漿、及びかくサイトカイン標的が、異なるアレイ・スポット上で捕捉された。
DEAL技術と統合マイクロ流体工学との互換性は、迅速な血液分離及び信頼度の高いたんぱく質パネルの測定を産出した。実験手順は、以下に詳しく述べられている。
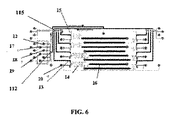
IBBCの加工は、2層のソフトリソグラフィーの方法で達成された。代表的なチップ設計は、図7に示されている。制御層(赤)のシリコンマスターは、スピンコート(spin-coated)のSU8 2010ネガ型フォトレジスト・フィルム(厚さ〜20マイクロメートル)を露出することによって加工される。成形の前に、そのマスターは、トリメチルクロロシラン(TMCS)蒸気ボックスにおいて20分間シラン化された。GE RTV 615 PDMSプレポリマーのA部分及びB部分(5:1)が準備され、均質化され、そして制御層マスターに加えられた。15分間ガス抜きをした後、PDMSは80℃で50分間保存された。次に、凝固したPDMSチップは、マスターから切り取られ、アクセス穴は23ゲージのステンレス・スチール穴で開けられた。
マイクロ・チャンネルでガイドされる流れパターン形成の方法を使用して、DEALバーコード・アレイが加工された。伝統的なインクジェット・スポッティング物質がまた、DNAオリゴマーをスポッティングするために利用され、そのマイクロ・チャンネルでガイドされた流れパターン形成の方法は、少なくとも従来のマイクロアレイよりも少なくともさらに1桁分濃厚なアレイの形成を可能にする。
DEAL技術を含むバーコードのチップは、採血された全血からの血清バイオマーカーのパネルの迅速な測定に使用された。特に、2つの例の全血の採血からの血液バイオマーカーの迅速な測定がされた‐たんぱく質でスパイクがされた新鮮な全血、新鮮な全血。実際の採血から始まるたんぱく質分析における全ての致命的な段階が、10分未満で達成された。
[例9:抗体で覆われたチャンネルにおいて分離された血漿からのたんぱく質解析(机上の例)]
PDMS装置の血液分離が直接的に平面のガラス・スライド又はポリ・エル・リジン処理されたガラス・スライドに接着されている(事前パターン形成されていない)。IL2捕捉抗体(ポリヌクレオチドに結合されていない)の0.02mg/mLの溶液が、単一の装置の中へ流され、その装置の容積を完全に充填する。
[例10:捕捉剤を有さないチャンネルにおいて分離された血漿からのたんぱく質解析(机上の例)]
血液分離PDMS装置は、平面のガラス・スライド又はポリ・エル・リジン処理されたガラス・スライド(事前にパターン形成されている)に直接的に接着される。その装置は、1xPBSでその全体の容積を完全に充填することによって備えられる。30nM組み換え型IL2でスパイクされた血液が、次に、RTで1時間その装置の中へ流され、スパイクされたIL2を含む血漿は、全血から分離され幅広いチャンネル領域に送られる。
[付録A]
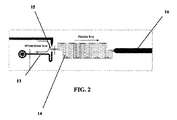
血液チップの血漿分離部分は抵抗器ネットワークとして成形されることができる(図1-15、特に図1-6において示された要素を引用する図A1参照)。
注入口圧力は、Pinとして与えられている。チャンネル(15)は5部分に分割され、各部分に抵抗が与えられている。チャンネル(15)の5個の部分の境界は以下である:
セグメント「in」:注入口と第1の狭いチャンネルとの間の部分は、抵抗Rinを有し、流速Qinに関連する。このセグメントの端部の圧力はPlとして与えられる。
狭いチャンネル1:Rp1、Qp1
狭いチャンネル2:Rp2、Qp2
狭いチャンネル3:Rp3、Qp3
狭いチャンネル4:Rp4、Qp4
狭いチャンネル5:Rp5、Qp5
幅広い血漿チャンネル(領域16)抵抗及び流速は、Rout2であり流速はQout2である。狭い血漿チャンネルと幅広い血漿チャンネルとの間の交差点(領域14と16との間の交差点)での圧力は、Poutとして与えられる。
2.Qs1 = Qp2 + Qs2
3.Qs2 = Qp3 + Qs3
4.Qs3 = Qp4 + Qs4
5.Qs4 = Qp5 + Qout1
6.Qout2 = Qp1 + Qp2 + Qp3 + Qp4 + Qp5
次に出願人は、セグメントs1、s2、s3及びs4の全てが同じ寸法を有し、従って、同じ抵抗を有することに注目する。
さらに、5個の狭い血漿チャンネルは、また、同じ寸法を有し、従って同じ抵抗を有する。
流れは抵抗器ネットワークによって成形されていることから、出願人は、オームの法則の電気に関するバージョンを代入することができる‐ΔV=IR(V=電圧、I=電流、R=抵抗)‐流体流動のバージョンでは:ΔP=QR(P=圧力、Q=流速、R=流れ抵抗)である。出願人は、概略図における全てのチャンネル及びセグメントにこの数式を適用する。従って、例えば、抵抗器Rinにおける圧力の低下は、Pin-P1=QinRinなどとして表現されることが可能である。出願人は以下の12個の数式を記す。
9.P1 − P2 = Qs1Rs
10.P2 − P3 = Qs2Rs
11.Pin − P1 = Qs3Rs
12.Pin − P1 = Qs4Rs
13.P1 − Pout2 = Qp1Rp
14.P2 − Pout2 = Qp2Rp
15.P3 − Pout2 = Qp3Rp
16.P4 − Pout2 = Qp4Rp
17.P5 − Pout2 = Qp5Rp
18.P5 = Iout1Rout1
19.Pout2 = Qout2Rout2
出願人は次に、数式8-19を以下のように記しなおす:
20.Pin = P1 + QinRin
21.P1 = P2 + Qs1Rs
22.P2 = P3 + Qs2Rs
23.P3 = P4 + Qs3Rs
24.P4 = P5 + Qs4Rs
25.P1 = Pout2 + Qp1Rp
26.P2 = Pout2 + Qp2Rp
27.P3 = Pout2 + Qp3Rp
28.P4 = Pout2 + Qp4Rp
29.P5 = Pout2 + Qp5Rp
数式29の数式24への代入は、数式31を与える。数式31は、次に、数式23に代入され数式32を取得する。この方式で数式22、21及び20への連続的な代入を続け、以下の数式の列が得られる:
30.P5 = Pout2 + Qp5Rp
31.P4 = Pout2 + Qp5Rp + Qs4Rs
32.P3 = Pout2 + Qp5Rp + Qs4Rs + Qs3Rs
33.P2 = Pout2 + Qp5Rp + Qs4Rs + Qs3Rs + Qs2Rs
34.P1 = Pout2 + Qp5Rp + Qs4Rs + Qs3Rs + Qs2Rs + Qs1Rs
35.Pin = Pout2 + Qp5Rp + Qs4Rs + Qs3Rs + Qs2Rs + Qs1Rs + QinRin
似た方法において、数式42を得るために数式5を数式4に代入することができる。数式42は、次に、数式43を得るために数式3に代入することができ、また、数式44及び45を得るためにも似た代入がされる。
37.Qs3 = Qp4 + Qp5 + Qout1
38.Qs2 = Qp3+Qp4 + Qp5 + Qout1
39.Qs1 = Qp2 + Qp3 + Qp4 + Qp5 +Qout1
40.Qin = Qp1 + Qp2 + Qp3 + Qp4 + Qp5 + Qout1
数式6を数式45に代入し、以下の関係が得られる:
41.Qin = Qout2 + Qout1
以下の代入が、次にできる。数式36は、数式31-35におけるQs4に代入できる。数式37は、数式32-35におけるQs3に代入できる。数式37は、数式32-35におけるQs3に代入できる。代入:38を33-35;39を34-35;40を35;にできる。そうすることにおいて、以下の数式が得られる。
43.P4 = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs
44.P3 = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs
45.P2 = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 + Qp5 + Qout1)Rs
46.P1 = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 + Qp5 + Qout1)Rs + (Qp2 + Qp3 + Qp4 + Qp5 + Qout1)Rs
47.Pin = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 +Qp5 + Qout1)Rs + (Qp2+Qp3 + Qp4 + Qp5 + Qout1)Rs + QinRin
数式18を42にP5の値で代入し、数式28をP4の値で43に代入し、P3、P2、P1についても同様にし、以下の数式が得られる:
48.Qout1Rout1 = Pout2 + Qp5Rp
49.Pout2 + Qp4Rp = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs
50.Pout2 + Qp3Rp = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs
51.Pout2 + Qp3Rp = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 + Qp5 + Qout1)Rs
52.Pout2 + Qp3Rp = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 + Qp5 + Qout1)Rs + (Qp2 + Qp3 + Qp4 + Qp5 + Qout1)Rs
53.Pin = Pout2 + Qp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 + Qp5 + Qout1)Rs + (Qp2 + Qp3 + Qp4 + Qp5 + Qout1)Rs + (Qp1 + Qp2 + Qp3 + Qp4 + Qp5 + Qout1)Rin
変数Pout2が数式49-52の両側をキャンセルし、以下数式55-58を与える。さらに、数式19を数式48及び53に代入し、簡略化した後に以下の数式が得られる:
54.Qout1Rout1 = Qout2Rout2 + Qp5Rp
55.Qp4Rp = Qp5Rp + (Qp5 + Qout1)Rs
56.Qp3Rp = Rp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs
57.Qp2Rp = Rp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 + Qp5 + Qout1)Rs
58.Qp1Rp = Rp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 + Qp5 + Qout1)Rs + (Qp2 + Qp3 + Qp4 + Qp5 + Qout1)Rs
59.Pin = Qout2Rout2 + Rp5Rp + (Qp5 + Qout1)Rs + (Qp4 + Qp5 + Qout1)Rs + (Qp3 + Qp4 + Qp5 + Qout1)Rs + (Qp2 + Qp3 + Qp4 + Qp5 + Qout1)Rs + (Qp1 + Qp2 + Qp3 + Qp4 + Qp5 + Qout1)Rin
数式6を数式48及び53にQout2で代入し、簡略化及び再配置した後に以下の数式60及び65が得られる。さらに、数式55-58を再配置し、以下の数式61-64が得られる。
61.0 = Qout1(Rs) + Qp5(Rp + Rs) − Qp4(Rp)
62.0 = Qout1(2Rs) + Qp5(Rp + 2Rs) + Qp4(Rs) −Qp3(Rp)
63.0 = Qout1(3Rs) + Qp5(Rp + 3Rs) + Qp4(2Rp) +Qp3(Rs) − Qp2(Rp)
64.0 = Qout1(4Rs) + Qp5(Rp + 4Rs) + Qp4(3Rp) + Qp3(2Rs) + Qp2(Rs) − Qp1(Rp)
65.Pin = Rp5(Rp + 4Rs + Rin + Rout2) Qout1(4Rs + Rin) + Qp4(3Rs + Rin + Rout2) + Qp3(2Rs + Rin + Rout2) + Rp2(Rs + Rin + Rout2) + Qp1(Rin + Rout2)
数式60-65は、マトリクス表記法の形式で再表記できる。
R =
[Rout1 -Rp-Rout2 -Rout2 -Rout2 -Rout2 -Rout2]
[Rs Rp + Rs -Rp 0 0 0]
[2Rs Rp + 2Rs Rs -Rp 0 0]
[3Rs Rp + 3Rs 2Rs Rs -Rp 0]
[4Rs Rp + 4Rs 3Rs 2Rs Rs -Rp]
[4Rs+Rin Rp+4Rs+Rin+Rout2 3Rs+Rin+Rout2 2Rs+Rin+Rout2 Rs+Rin+Rout2 Rin+Rout2]
[Qout1] [0]
[Qp5] [0]
Q = [Qp4] P = [0]
[Qp3] [0]
[Qp2] [0]
[Qp1] [0]
上記のマトリクスRにおける各抵抗の値Rは、関連するチャンネルの寸法によって、以下の数式に従って決定され:
これは、流速Qout1、Qp5、Qp4、Qp3、Qp2、Qp1を与える。これらの値は、数式1-6に代入でき、Qs1、Qs2、Qs3、Qs4、及びQout2が得られる。プログラムは、次に、狭い血漿チャンネルの各々とその下流側のチャンネル15セグメントとの比を求め、以下のようになる:
73.Qp1:Qs1
74.Qp2:Qs2
75.Qp3:Qs3
76.Qp4:Qs4
77.Qp5:Qout1
プログラムは、全血からの血漿の収率を、幅広い血漿チャンネルの流速Qout2をチャンネル13から出て行く全血の流速で割り、その値を100で掛けることによって以下のように計算できる:
78.%収率=(Qout2/Qout1)x100
プログラムは、また、如何なるチャンネルの中を移動する流体の速度(v)も、そのチャンネルの流速(Q)をそのチャンネルの断面積(A)で割ることによって、以下のように得られる:
78.V=Q/A
狭い血漿チャンネル(領域14)によって分離された血漿は、73-77における流れ比が、>20:1である場合、細胞をほとんど有さない。
流れ比‐20:1(流れ比しきい値)
収率‐20%(>5%)
流速‐0.2mm/sec(親和性律速過程では>0.5mm/secが必要である)
流れ比は、所定しきい値の20:1を満たすが、収率が20%であるという事実は、その流れ比の割当量が、所定限度の5%収率よりも低くならずに、より適切な分離を得るように増やすことができる。流れ比を増やすために、ユーザーは、狭い血漿チャンネルの長さを増やすことができ、あるいはチャンネル(13)の幅を増やすことができる。領域(14)の長さを増やすことは、それらの抵抗を増やし、流動率及び流速(既にしきい値よりも低い)を減少させる。しかし、ユーザーは、プログラムにおいて注入口圧力Pinの値を増やすだけで、それらのチャンネルの流速をより速くすることができる。
Claims (13)
- 流体サンプルの流体成分において少なくとも1つの標的を検出するためのマイクロ流体装置であり:
該流体サンプルを該マイクロ流体装置に導入するための注入口;
該注入口に流体的に連通し、流動チャンネル抵抗を有する流動チャンネル;及び
該流動チャンネルに流体的に連通し、分析チャンネル抵抗を有し、少なくとも1つの捕捉剤又はその成分を含む分析チャンネル;
を含み、該少なくとも1つの捕捉剤又はその成分は、前記分析チャンネルに付着され、前記標的に対して結合親和性を有し、
前記流動チャンネル抵抗及び前記分析チャンネル抵抗は、前記流動チャンネルから前記分析チャンネルまでの前記流体成分の流れを制御し、
さらに、該分析チャンネル抵抗は、検出可能な標的捕捉剤結合複合体を形成するために前記標的が前記捕捉剤へ結合することを可能にし、該結合は、前記結合親和性と前記流体成分における前記標的の拡散との間の少なくとも1つによって制御される、ことを特徴とするマイクロ流体装置。 - 前記流動チャンネル抵抗及び前記分析チャンネル抵抗が、前記流動チャンネルから前記分析チャンネルまでの前記流体成分の流れを最大化するようにされている、請求項1に記載されたマイクロ流体装置。
- 前記分析チャンネルが、前記結合が前記結合親和性によって制御される第1部分及び前記結合が前記流体成分における標的分子の拡散によって制御される第2部分を含む、請求項1又は2に記載されたマイクロ流体装置。
- 前記流体が血液であり、前記流体成分が血漿である、請求項1乃至3のいずれかに記載されたマイクロ流体装置。
- 前記少なくとも1つの捕捉剤又はその成分が、前記分析チャンネルに付着された基質ポリヌクレオチドである、請求項1乃至4のいずれかに記載されたマイクロ流体装置。
- 前記少なくとも1つの捕捉剤又はその成分がさらに、
たんぱく質及び該たんぱく質に付着されたコード化ポリヌクレオチドを含むポリヌクレオチドでコードされたたんぱく質、を含み、該たんぱく質は、前記少なくとも1つの標的に特異結合し、該コード化ポリヌクレオチドは、該基質ポリヌクレオチドに特異結合されている、
ことを特徴とする、請求項5に記載されたマイクロ流体装置。 - 前記少なくとも1つの標的は、複数の標的を含み、前記少なくとも1つの捕捉剤又はその成分が:
前記分析チャンネルに付着された複数の基質ポリヌクレオチドであり、該複数の基質ポリヌクレオチドの各ポリヌクレオチドは、配列特異的であり、互いに位置的に区別可能である、複数の基質ポリヌクレオチド;
を含むことを特徴とする、請求項1乃至4のいずれかに記載されたマイクロ流体装置。 - 前記複数の捕捉剤又はその成分は、さらに、
複数のポリヌクレオチドでコードされたたんぱく質であり、各ポリヌクレオチドでコードされたたんぱく質は、たんぱく質及び該たんぱく質に付着されたコード化ポリヌクレオチドを含み、該たんぱく質は、前記複数の標的のうち所定の標的に特異結合し、該コード化ポリヌクレオチドは、前記分析チャンネルに付着された複数のポリヌクレオチドのうち配列特異的及び位置的に区別可能なポリヌクレオチドに特異結合し、各たんぱく質及びコード化ポリヌクレオチドは、互いに結合的に区別可能である、
ことを特徴とする、請求項7に記載されたマイクロ流体装置。 - 前記少なくとも1つの捕捉剤又はその成分は、複数の捕捉剤又はその成分を含み、
該複数の捕捉剤の各々は、結合的に区別可能であり、互いに位置的に区別可能であり、捕捉剤標的結合複合体における標的分子に特異結合しており、
さらに、該複数の捕捉剤は、捕捉剤標的結合複合体が、バーコードのパターンを形成する実質的に平行な線に沿って検出可能であるように、前記分析チャンネル上に配置されている、
ことを特徴とする、請求項1乃至8のいずれかに記載されたマイクロ流体装置。 - 流体サンプルの流体成分において少なくとも1つの標的を検出するためのシステムであり:
請求項5に記載されたマイクロ流体装置;及び
たんぱく質及び該たんぱく質に付着されたコード化ポリヌクレオチドを含むポリヌクレオチドでコードされたたんぱく質であり、該たんぱく質は、標的に特異結合し、該コード化ポリヌクレオチドは、前記基質ポリヌクレオチドに特異結合する、ことを特徴とする、ポリヌクレオチドでコードされたたんぱく質;
を含むシステム。 - 流体サンプルの流体成分における少なくとも1つの標的を検出するためのシステムであり:
請求項7に記載されたマイクロ流体装置;及び
複数のポリヌクレオチドでコードされたたんぱく質であり、各ポリヌクレオチドでコードされたたんぱく質は、たんぱく質及び該たんぱく質に付着されたコード化ポリヌクレオチドを含み、該たんぱく質は、前記複数の標的のうち所定の標的に特異結合し、該コード化ポリヌクレオチドは、前記分析チャンネルに付着された複数のポリヌクレオチドのうち配列特異的及び位置的に区別可能なポリヌクレオチドに特異結合し、各たんぱく質及びコード化ポリヌクレオチドは、互いに結合的に区別可能である、
ことを特徴とする、複数のポリヌクレオチドでコードされたたんぱく質;
を含むシステム。 - 流体サンプルの流体成分において少なくとも1つの標的分子を検出するための方法であり:
流動マイクロ流体チャンネルにおいて流体サンプルを提供する段階;
該流動マイクロ流体チャンネルから分析マイクロ流体チャンネルまでの流体成分の選択的な流れを制御する段階であり、該分析マイクロ流体チャンネルは、少なくとも1つの捕捉剤又はその成分、該分析チャンネルに付着された少なくとも1つの捕捉剤を有し、該少なくとも1つの捕捉剤は、前記標的分子に対する結合親和性を有する、ことを特徴とする段階;
前記分析マイクロ流体チャンネルにおいて一時的に、検出可能な標的捕捉剤結合複合体を形成するために該少なくとも1つの標的分子の該少なくとも1つの捕捉剤への結合を可能にする条件下において、前記少なくとも1つの標的分子を前記少なくとも1つの捕捉剤で接触する段階であり、該結合は、前記結合親和性又は前記流体成分における前記標的分子の拡散によって制御される、ことを特徴とする段階;及び
該検出可能な標的捕捉剤結合複合体を検出する段階;
を含む方法。 - 流体サンプルの流体成分において少なくとも1つの標的を検出するためのマイクロ流体装置であり:
該マイクロ流体装置において該流体サンプルを導入するための注入口;
該注入口と流体的に連通し、流動チャンネル抵抗を有する流動チャンネル;及び
該流動チャンネルに流体的に連通し、分析チャンネル抵抗を有する分析チャンネル;
を含み、該流動チャンネル抵抗及び該分析チャンネル抵抗は、前記流動チャンネルから前記分析チャンネルまでの前記流体成分の流れを制御するように設定され、
該分析チャンネル抵抗は、さらに、標的が前記分析チャンネルの表面上に付着することを可能にするように設定され、該付着された標的は、該標的に特異結合するラベル付きの分子を通して検出可能である、
ことを特徴とする、マイクロ流体装置。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US95966607P | 2007-07-16 | 2007-07-16 | |
| US99898107P | 2007-10-15 | 2007-10-15 | |
| PCT/US2008/070232 WO2009012340A2 (en) | 2007-07-16 | 2008-07-16 | Microfluidic devices, methods and systems for detecting target molecules |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010533869A true JP2010533869A (ja) | 2010-10-28 |
| JP2010533869A5 JP2010533869A5 (ja) | 2011-09-01 |
Family
ID=40260363
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010517148A Pending JP2010533871A (ja) | 2007-07-16 | 2008-07-16 | 標的分子を検出するためのアレイ、基板、装置、方法、及び、システム |
| JP2010517146A Pending JP2010533869A (ja) | 2007-07-16 | 2008-07-16 | 標的分子を検出するためのマイクロ流体装置、方法及びシステム |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010517148A Pending JP2010533871A (ja) | 2007-07-16 | 2008-07-16 | 標的分子を検出するためのアレイ、基板、装置、方法、及び、システム |
Country Status (6)
| Country | Link |
|---|---|
| US (5) | US20090053732A1 (ja) |
| EP (3) | EP2167633A4 (ja) |
| JP (2) | JP2010533871A (ja) |
| AU (2) | AU2008276024A1 (ja) |
| CA (2) | CA2694541A1 (ja) |
| WO (2) | WO2009012343A2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101906969B1 (ko) | 2017-09-15 | 2018-10-11 | 삼성전자주식회사 | 유전자 분석장치 및 이를 이용한 유전자 분석방법 |
| JP2020148778A (ja) * | 2014-12-03 | 2020-09-17 | アイソプレキシス コーポレイション | 細胞分泌プロファイルの分析およびスクリーニング |
Families Citing this family (123)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100022414A1 (en) | 2008-07-18 | 2010-01-28 | Raindance Technologies, Inc. | Droplet Libraries |
| GB0307428D0 (en) | 2003-03-31 | 2003-05-07 | Medical Res Council | Compartmentalised combinatorial chemistry |
| GB0307403D0 (en) | 2003-03-31 | 2003-05-07 | Medical Res Council | Selection by compartmentalised screening |
| US20060078893A1 (en) | 2004-10-12 | 2006-04-13 | Medical Research Council | Compartmentalised combinatorial chemistry by microfluidic control |
| US20050221339A1 (en) | 2004-03-31 | 2005-10-06 | Medical Research Council Harvard University | Compartmentalised screening by microfluidic control |
| US7968287B2 (en) | 2004-10-08 | 2011-06-28 | Medical Research Council Harvard University | In vitro evolution in microfluidic systems |
| AU2006335290A1 (en) | 2006-01-11 | 2007-07-19 | Raindance Technologies, Inc. | Microfluidic devices and methods of use in the formation and control of nanoreactors |
| US8492098B2 (en) | 2006-02-21 | 2013-07-23 | The Trustees Of Tufts College | Methods and arrays for target analyte detection and determination of reaction components that affect a reaction |
| US11237171B2 (en) | 2006-02-21 | 2022-02-01 | Trustees Of Tufts College | Methods and arrays for target analyte detection and determination of target analyte concentration in solution |
| EP4190448A3 (en) | 2006-05-11 | 2023-09-20 | Bio-Rad Laboratories, Inc. | Microfluidic devices |
| US9562837B2 (en) | 2006-05-11 | 2017-02-07 | Raindance Technologies, Inc. | Systems for handling microfludic droplets |
| US8394590B2 (en) * | 2006-08-02 | 2013-03-12 | California Institute Of Technology | Capture agents and related methods and systems for detecting and/or sorting targets |
| CA2659745A1 (en) * | 2006-08-02 | 2008-02-07 | California Institute Of Technology | Methods and systems for detecting and/or sorting targets |
| WO2008021123A1 (en) | 2006-08-07 | 2008-02-21 | President And Fellows Of Harvard College | Fluorocarbon emulsion stabilizing surfactants |
| WO2008097559A2 (en) | 2007-02-06 | 2008-08-14 | Brandeis University | Manipulation of fluids and reactions in microfluidic systems |
| US8592221B2 (en) | 2007-04-19 | 2013-11-26 | Brandeis University | Manipulation of fluids, fluid components and reactions in microfluidic systems |
| AU2008276024A1 (en) * | 2007-07-16 | 2009-01-22 | California Institute Of Technology | Microfluidic devices, methods and systems for detecting target molecules |
| US8380457B2 (en) | 2007-08-29 | 2013-02-19 | Canon U.S. Life Sciences, Inc. | Microfluidic devices with integrated resistive heater electrodes including systems and methods for controlling and measuring the temperatures of such heater electrodes |
| US9221056B2 (en) * | 2007-08-29 | 2015-12-29 | Canon U.S. Life Sciences, Inc. | Microfluidic devices with integrated resistive heater electrodes including systems and methods for controlling and measuring the temperatures of such heater electrodes |
| US8306773B2 (en) | 2007-08-29 | 2012-11-06 | Canon U.S. Life Sciences, Inc. | Microfluidic devices with integrated resistive heater electrodes including systems and methods for controlling and measuring the temperatures of such heater electrodes |
| WO2009029073A1 (en) * | 2007-08-30 | 2009-03-05 | The Trustees Of Tufts College | Methods for determining the concentration of an analyte in solution. |
| JP5163999B2 (ja) * | 2007-11-14 | 2013-03-13 | 国立大学法人富山大学 | 類似植物体および生薬同定用dnaマイクロアレイ |
| JP2011518553A (ja) * | 2008-04-09 | 2011-06-30 | カリフォルニア インスティチュート オブ テクノロジー | 標的を検出及び/又は分類する捕捉剤および関連する方法およびシステム |
| US8222047B2 (en) | 2008-09-23 | 2012-07-17 | Quanterix Corporation | Ultra-sensitive detection of molecules on single molecule arrays |
| US20100075862A1 (en) * | 2008-09-23 | 2010-03-25 | Quanterix Corporation | High sensitivity determination of the concentration of analyte molecules or particles in a fluid sample |
| US9128091B2 (en) * | 2008-09-26 | 2015-09-08 | The General Hospital Corporation | Capturing particles |
| CA2745636A1 (en) * | 2008-12-02 | 2010-06-10 | California Institute Of Technology | Self-powered microfluidic devices, methods and systems |
| WO2010085548A2 (en) * | 2009-01-22 | 2010-07-29 | Li-Cor, Inc. | Single molecule proteomics with dynamic probes |
| US9739771B2 (en) | 2009-02-27 | 2017-08-22 | Yale University | Physiologic sample preparation for nanosensors |
| WO2010099318A1 (en) * | 2009-02-27 | 2010-09-02 | Yale University | Physiologic sample preparation for nanosensors |
| US8528589B2 (en) | 2009-03-23 | 2013-09-10 | Raindance Technologies, Inc. | Manipulation of microfluidic droplets |
| WO2010127304A2 (en) * | 2009-05-01 | 2010-11-04 | Illumina, Inc. | Sequencing methods |
| US10520500B2 (en) | 2009-10-09 | 2019-12-31 | Abdeslam El Harrak | Labelled silica-based nanomaterial with enhanced properties and uses thereof |
| WO2013134742A2 (en) | 2012-03-08 | 2013-09-12 | Cyvek, Inc | Micro-tube particles for microfluidic assays and methods of manufacture |
| US9855735B2 (en) | 2009-11-23 | 2018-01-02 | Cyvek, Inc. | Portable microfluidic assay devices and methods of manufacture and use |
| US10022696B2 (en) | 2009-11-23 | 2018-07-17 | Cyvek, Inc. | Microfluidic assay systems employing micro-particles and methods of manufacture |
| US9759718B2 (en) | 2009-11-23 | 2017-09-12 | Cyvek, Inc. | PDMS membrane-confined nucleic acid and antibody/antigen-functionalized microlength tube capture elements, and systems employing them, and methods of their use |
| US9500645B2 (en) | 2009-11-23 | 2016-11-22 | Cyvek, Inc. | Micro-tube particles for microfluidic assays and methods of manufacture |
| US9700889B2 (en) | 2009-11-23 | 2017-07-11 | Cyvek, Inc. | Methods and systems for manufacture of microarray assay systems, conducting microfluidic assays, and monitoring and scanning to obtain microfluidic assay results |
| CN102713621B (zh) * | 2009-11-23 | 2016-10-19 | 西维克公司 | 用于施行化验的方法和设备 |
| US10065403B2 (en) | 2009-11-23 | 2018-09-04 | Cyvek, Inc. | Microfluidic assay assemblies and methods of manufacture |
| US10837883B2 (en) | 2009-12-23 | 2020-11-17 | Bio-Rad Laboratories, Inc. | Microfluidic systems and methods for reducing the exchange of molecules between droplets |
| US9366632B2 (en) | 2010-02-12 | 2016-06-14 | Raindance Technologies, Inc. | Digital analyte analysis |
| EP2534267B1 (en) | 2010-02-12 | 2018-04-11 | Raindance Technologies, Inc. | Digital analyte analysis |
| US9399797B2 (en) | 2010-02-12 | 2016-07-26 | Raindance Technologies, Inc. | Digital analyte analysis |
| US10351905B2 (en) | 2010-02-12 | 2019-07-16 | Bio-Rad Laboratories, Inc. | Digital analyte analysis |
| JP5729651B2 (ja) | 2010-02-23 | 2015-06-03 | ゴードン アトウッド,クリストファー | 生体分子及びその相互作用特性の検出方法 |
| US8415171B2 (en) * | 2010-03-01 | 2013-04-09 | Quanterix Corporation | Methods and systems for extending dynamic range in assays for the detection of molecules or particles |
| US8236574B2 (en) | 2010-03-01 | 2012-08-07 | Quanterix Corporation | Ultra-sensitive detection of molecules or particles using beads or other capture objects |
| CN103026232B (zh) | 2010-03-01 | 2015-02-04 | 匡特里克斯公司 | 扩大用于检测分子或颗粒的测定法中的动态范围的方法和系统 |
| US9678068B2 (en) * | 2010-03-01 | 2017-06-13 | Quanterix Corporation | Ultra-sensitive detection of molecules using dual detection methods |
| US8614056B2 (en) | 2010-03-24 | 2013-12-24 | The Board Of Trustees Of The Leland Stanford Junior University | Microfluidic method for measurement or detection involving cells or biomolecules |
| JP2011221009A (ja) * | 2010-03-25 | 2011-11-04 | Fujifilm Corp | 生体物質検出装置 |
| KR101152791B1 (ko) * | 2010-05-10 | 2012-06-12 | 광주과학기술원 | 쯔바이파흐-풍 효과를 이용한 세포 발열량 측정 센서 및 이의 제조방법 |
| IT1400868B1 (it) * | 2010-06-23 | 2013-07-02 | Torino Politecnico | Dispositivo microfluidico integrato per la purificazione, amplificazione e rivelazione di acidi nucleici per la diagnostica |
| US9188593B2 (en) | 2010-07-16 | 2015-11-17 | The University Of British Columbia | Methods for assaying cellular binding interactions |
| EP2622103B2 (en) | 2010-09-30 | 2022-11-16 | Bio-Rad Laboratories, Inc. | Sandwich assays in droplets |
| US9952237B2 (en) | 2011-01-28 | 2018-04-24 | Quanterix Corporation | Systems, devices, and methods for ultra-sensitive detection of molecules or particles |
| EP2673614B1 (en) | 2011-02-11 | 2018-08-01 | Raindance Technologies, Inc. | Method for forming mixed droplets |
| EP3736281A1 (en) | 2011-02-18 | 2020-11-11 | Bio-Rad Laboratories, Inc. | Compositions and methods for molecular labeling |
| CA2830533C (en) | 2011-03-22 | 2020-02-18 | Cyvek, Inc. | Microfluidic devices and methods of manufacture and use |
| US9828696B2 (en) | 2011-03-23 | 2017-11-28 | Nanohmics, Inc. | Method for assembly of analyte filter arrays using biomolecules |
| US9252175B2 (en) | 2011-03-23 | 2016-02-02 | Nanohmics, Inc. | Method for assembly of spectroscopic filter arrays using biomolecules |
| US20140302532A1 (en) | 2011-04-12 | 2014-10-09 | Quanterix Corporation | Methods of determining a treatment protocol for and/or a prognosis of a patient's recovery from a brain injury |
| DE202012013668U1 (de) | 2011-06-02 | 2019-04-18 | Raindance Technologies, Inc. | Enzymquantifizierung |
| US8841071B2 (en) | 2011-06-02 | 2014-09-23 | Raindance Technologies, Inc. | Sample multiplexing |
| US8658430B2 (en) | 2011-07-20 | 2014-02-25 | Raindance Technologies, Inc. | Manipulating droplet size |
| US11099178B2 (en) * | 2011-10-28 | 2021-08-24 | Torsten Matthias | Device and method for detecting substances present in biological or chemical samples |
| CN104204800A (zh) * | 2012-04-11 | 2014-12-10 | 美艾利尔圣地亚哥公司 | 微流体装置、系统和方法 |
| WO2013177046A1 (en) | 2012-05-21 | 2013-11-28 | Solulink, Inc. | Methods and/or use of oligonucleotide conjugates for suppressing background due to cross-hybridization |
| CN104884605B (zh) * | 2012-08-24 | 2018-05-18 | 耶鲁大学 | 用于高通量多重检测的系统、装置和方法 |
| WO2014083496A1 (en) | 2012-11-29 | 2014-06-05 | Koninklijke Philips N.V. | Cartridge for uptake and processing of a sample |
| US9386948B2 (en) | 2012-12-05 | 2016-07-12 | Theranos, Inc. | Systems, devices, and methods for bodily fluid sample transport |
| US10248765B1 (en) | 2012-12-05 | 2019-04-02 | Theranos Ip Company, Llc | Systems, devices, and methods for bodily fluid sample collection, transport, and handling |
| US9932626B2 (en) | 2013-01-15 | 2018-04-03 | Quanterix Corporation | Detection of DNA or RNA using single molecule arrays and other techniques |
| KR102060831B1 (ko) * | 2013-02-27 | 2019-12-30 | 삼성전자주식회사 | 플립 칩 패키징 방법, 그리고 상기 플립 칩 패키징 방법에 적용되는 플럭스 헤드 및 그 제조 방법 |
| DK2972353T3 (da) | 2013-03-11 | 2023-03-27 | Meso Scale Technologies Llc | Forbedrede fremgangsmåder til udførelse af multipleksanalyser |
| US20140323911A1 (en) * | 2013-03-15 | 2014-10-30 | Theranos, Inc. | Methods and devices for sample collection and sample separation |
| EP3462174B1 (en) * | 2013-03-15 | 2021-12-29 | Arizona Board of Regents on behalf of Arizona State University | Biosensor microarray compositions and methods |
| US10094762B2 (en) * | 2013-05-30 | 2018-10-09 | UNIVERSITé LAVAL | Patterned capillary device and process for fabricating thereof |
| KR101428977B1 (ko) | 2013-06-14 | 2014-08-13 | 케이맥(주) | 미세유체 분석장치 |
| US9857370B2 (en) | 2013-07-22 | 2018-01-02 | National Technology & Engineering Solutions Of Sandia, Llc | Amplification of biological targets via on-chip culture for biosensing |
| US11901041B2 (en) | 2013-10-04 | 2024-02-13 | Bio-Rad Laboratories, Inc. | Digital analysis of nucleic acid modification |
| EP3080605B1 (en) | 2013-12-11 | 2019-02-20 | The Regents of the University of California | Method for labeling dna fragments to reconstruct physical linkage and phase |
| US9944977B2 (en) | 2013-12-12 | 2018-04-17 | Raindance Technologies, Inc. | Distinguishing rare variations in a nucleic acid sequence from a sample |
| US9957554B1 (en) | 2013-12-19 | 2018-05-01 | National Technology & Engineering Solutions Of Sandia, Llc | Microfluidic platform for multiplexed detection in single cells and methods thereof |
| US11193176B2 (en) | 2013-12-31 | 2021-12-07 | Bio-Rad Laboratories, Inc. | Method for detecting and quantifying latent retroviral RNA species |
| US9995411B1 (en) | 2014-07-16 | 2018-06-12 | National Technology & Engineering Solutions Of Sandia, Llc | High-temperature, adhesive-based microvalves and uses thereof |
| US9636675B2 (en) | 2014-11-26 | 2017-05-02 | International Business Machines Corporation | Pillar array structure with uniform and high aspect ratio nanometer gaps |
| US11353448B2 (en) | 2015-02-13 | 2022-06-07 | California Institute Of Technology | Methods and compositions for quantifying metabolites and proteins from single cells |
| WO2016196691A2 (en) * | 2015-06-01 | 2016-12-08 | California Institute Of Technology | Compositions and methods for screening t cells with antigens for specific populations |
| WO2016209775A1 (en) * | 2015-06-20 | 2016-12-29 | The Regents Of The University Of California | Monocyte integrin based microfluidic assay for evaluating coronary diseases |
| US10371606B2 (en) | 2015-07-21 | 2019-08-06 | Theraos IP Company, LLC | Bodily fluid sample collection and transport |
| US10647981B1 (en) | 2015-09-08 | 2020-05-12 | Bio-Rad Laboratories, Inc. | Nucleic acid library generation methods and compositions |
| WO2017044888A1 (en) | 2015-09-09 | 2017-03-16 | Theranos, Inc. | Methods and devices for sample collection and sample separation |
| US10498171B2 (en) * | 2015-10-12 | 2019-12-03 | Avago Technologies International Sales Pte. Limited | Wireless power receiver voltage control enabling simultaneous communications to transmitter in over-voltage state |
| US10228367B2 (en) | 2015-12-01 | 2019-03-12 | ProteinSimple | Segmented multi-use automated assay cartridge |
| US11988662B2 (en) | 2015-12-07 | 2024-05-21 | Nanohmics, Inc. | Methods for detecting and quantifying gas species analytes using differential gas species diffusion |
| US10386365B2 (en) | 2015-12-07 | 2019-08-20 | Nanohmics, Inc. | Methods for detecting and quantifying analytes using ionic species diffusion |
| US10386351B2 (en) | 2015-12-07 | 2019-08-20 | Nanohmics, Inc. | Methods for detecting and quantifying analytes using gas species diffusion |
| CN109791146A (zh) | 2016-07-07 | 2019-05-21 | 范德比尔特大学 | 用于检测、捕获或去除疾病物质的流体装置 |
| US20190308190A1 (en) * | 2016-09-26 | 2019-10-10 | The Johns Hopkins University | Non-invasive cancer detection and analysis by single-molecule imaging |
| JP7348066B2 (ja) | 2016-11-11 | 2023-09-20 | アイソプレキシス コーポレイション | 単一細胞のゲノム、トランスクリプトームおよびプロテオームの同時解析のための組成物および方法 |
| WO2018098372A1 (en) | 2016-11-22 | 2018-05-31 | IsoPlexis Corporation | Systems, devices and methods for cell capture and methods of manufacture thereof |
| WO2018148700A1 (en) | 2017-02-13 | 2018-08-16 | Yale University | High-throughput single-cell polyomics |
| US10850276B2 (en) * | 2017-02-24 | 2020-12-01 | VisuGen Global LLC | Systems and methods for capture and detection of low copy targets from large sample volumes |
| WO2018156855A1 (en) * | 2017-02-24 | 2018-08-30 | VisuGen Global LLC | Systems and methods for capture and detection of low copy targets from large sample volumes |
| US11857966B1 (en) | 2017-03-15 | 2024-01-02 | Labrador Diagnostics Llc | Methods and devices for sample collection and sample separation |
| WO2018183969A1 (en) * | 2017-03-30 | 2018-10-04 | California Institute Of Technology | Barcoded rapid assay platform for efficient analysis of candidate molecules and methods of making and using the platform |
| EP3582893B1 (en) | 2017-04-20 | 2021-03-31 | Hewlett-Packard Development Company, L.P. | Microfluidic reaction system |
| JP7295092B2 (ja) | 2017-08-18 | 2023-06-20 | ノーティラス・サブシディアリー・インコーポレイテッド | 結合試薬を選択する方法 |
| ES2702432B2 (es) | 2017-08-31 | 2019-08-05 | Venegas Pedro Manuel Medina | Método y dispositivo para el análisis de ácidos nucleicos |
| WO2019075321A1 (en) | 2017-10-13 | 2019-04-18 | The Charles Stark Draper Laboratory, Inc. | MINIATURIZED DNA MICROARRAY FOR SMALL VOLUME SAMPLE PROCESSING |
| WO2019147714A1 (en) * | 2018-01-23 | 2019-08-01 | Shield Diagnostics Corp. | Microfluidic microarray devices and methods |
| CN108588284B (zh) * | 2018-05-10 | 2022-06-10 | 山东师范大学 | 基于酶催化可控自组装生物条码检测htlv-ii dna的方法 |
| CN109387641B (zh) * | 2018-12-20 | 2022-04-15 | 深圳职业技术学院 | 一种以磁性氧化铁纳米粒子为信号放大器检测天蚕素b的装置及检测方法 |
| WO2020175381A1 (ja) * | 2019-02-27 | 2020-09-03 | 京セラ株式会社 | 粒子分離計測デバイスおよび粒子分離計測装置 |
| CN110026258B (zh) * | 2019-04-26 | 2023-11-28 | 珠海市迪奇孚瑞生物科技有限公司 | 基于数字微流控芯片的检测电路、装置及dna或rna检测装置 |
| US11130994B2 (en) * | 2019-12-13 | 2021-09-28 | Autonomous Medical Devices Inc. | Automated, cloud-based, point-of-care (POC) pathogen and antibody array detection system and method |
| WO2022178253A1 (en) | 2021-02-19 | 2022-08-25 | IsoPlexis Corporation | Methods and devices for spatially resolved analysis of proteomic and genetic information |
| EP4305419A1 (en) | 2021-03-11 | 2024-01-17 | Nautilus Subsidiary, Inc. | Systems and methods for biomolecule retention |
| CN113125739B (zh) * | 2021-04-16 | 2022-07-26 | 杭州浙大迪迅生物基因工程有限公司 | 一种荧光芯片定量检测试剂盒 |
| US20220341850A1 (en) * | 2021-04-23 | 2022-10-27 | Poppy Health, Inc. | System and method for characterizing, monitoring, & detecting bioaerosol presence & movement in an indoor environment |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002236131A (ja) * | 2000-12-08 | 2002-08-23 | Minolta Co Ltd | マイクロチップ |
| WO2005090972A1 (ja) * | 2004-03-18 | 2005-09-29 | Nissui Pharmaceutical Co., Ltd. | 生物学的物質の分析キット、分析装置及び分析方法 |
| JP2006329767A (ja) * | 2005-05-25 | 2006-12-07 | Aisin Seiki Co Ltd | 試料分析装置 |
Family Cites Families (50)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6943034B1 (en) * | 1991-11-22 | 2005-09-13 | Affymetrix, Inc. | Combinatorial strategies for polymer synthesis |
| US6632436B2 (en) * | 1996-01-25 | 2003-10-14 | Genitrix Llc | Vaccine compositions and method of modulating immune responses |
| US6165739A (en) | 1996-03-13 | 2000-12-26 | Compucyte Corporation | Multiple simultaneous testing media |
| US6039897A (en) * | 1996-08-28 | 2000-03-21 | University Of Washington | Multiple patterned structures on a single substrate fabricated by elastomeric micro-molding techniques |
| US6924153B1 (en) * | 1997-03-06 | 2005-08-02 | Quidel Corporation | Quantitative lateral flow assays and devices |
| US5858801A (en) * | 1997-03-13 | 1999-01-12 | The United States Of America As Represented By The Secretary Of The Navy | Patterning antibodies on a surface |
| AU730827B2 (en) * | 1997-06-09 | 2001-03-15 | Caliper Technologies Corporation | Apparatus and methods for correcting for variable velocity in microfluidic systems |
| US20030096232A1 (en) * | 1997-12-19 | 2003-05-22 | Kris Richard M. | High throughput assay system |
| US6316193B1 (en) * | 1998-10-06 | 2001-11-13 | Origene Technologies, Inc. | Rapid-screen cDNA library panels |
| US6429027B1 (en) | 1998-12-28 | 2002-08-06 | Illumina, Inc. | Composite arrays utilizing microspheres |
| US6875619B2 (en) * | 1999-11-12 | 2005-04-05 | Motorola, Inc. | Microfluidic devices comprising biochannels |
| US20020090649A1 (en) * | 1999-12-15 | 2002-07-11 | Tony Chan | High density column and row addressable electrode arrays |
| US6699665B1 (en) | 2000-11-08 | 2004-03-02 | Surface Logix, Inc. | Multiple array system for integrating bioarrays |
| WO2002044695A1 (en) * | 2000-11-16 | 2002-06-06 | Burstein Technologies, Inc. | Methods and apparatus for detecting and quantifying lymphocytes with optical biodiscs |
| US20020100714A1 (en) * | 2001-01-31 | 2002-08-01 | Sau Lan Tang Staats | Microfluidic devices |
| US20020168640A1 (en) * | 2001-02-22 | 2002-11-14 | Min Li | Biochips comprising nucleic acid/protein conjugates |
| WO2002080647A2 (en) * | 2001-04-03 | 2002-10-17 | Surromed, Inc. | Methods and reagents for multiplexed analyte capture, surface array self-assembly, and analysis of complex biological samples |
| DE10127221A1 (de) * | 2001-05-23 | 2002-11-28 | Lifebits Ag | Träger für chemische, biochemische und biologische Substanzen |
| US7473767B2 (en) * | 2001-07-03 | 2009-01-06 | The Institute For Systems Biology | Methods for detection and quantification of analytes in complex mixtures |
| US7023007B2 (en) * | 2001-07-17 | 2006-04-04 | Caliper Life Sciences, Inc. | Methods and systems for alignment of detection optics |
| US10539561B1 (en) * | 2001-08-30 | 2020-01-21 | Customarray, Inc. | Enzyme-amplified redox microarray detection process |
| CA2468674A1 (en) * | 2001-12-05 | 2003-06-12 | University Of Washington | Microfluidic device and surface decoration process for solid phase affinity binding assays |
| US20030190689A1 (en) * | 2002-04-05 | 2003-10-09 | Cell Signaling Technology,Inc. | Molecular profiling of disease and therapeutic response using phospho-specific antibodies |
| AU2002952384A0 (en) * | 2002-10-31 | 2002-11-14 | Swinburne University Of Technology | Structures |
| JP2004354364A (ja) * | 2002-12-02 | 2004-12-16 | Nec Corp | 微粒子操作ユニット、それを搭載したチップと検出装置、ならびにタンパク質の分離、捕獲、および検出方法 |
| DE10305050A1 (de) * | 2003-02-07 | 2004-08-19 | Roche Diagnostics Gmbh | Analytisches Testelement und Verfahren für Blutuntersuchungen |
| WO2005022153A2 (en) * | 2003-02-19 | 2005-03-10 | Syntherica Corporation | Compositions and methods for screening using populations of surrogate antibodies which comprise aptamers |
| US7452678B2 (en) * | 2003-06-24 | 2008-11-18 | Bristol-Myers Squibb Company | Identification of biomarkers for liver toxicity |
| WO2005007892A1 (en) * | 2003-07-03 | 2005-01-27 | Gentron, Llc | Methods and systems for diagnosis of non-cenral nervous system (cns) diseases in cns samples |
| US20050277125A1 (en) * | 2003-10-27 | 2005-12-15 | Massachusetts Institute Of Technology | High-density reaction chambers and methods of use |
| US7981362B2 (en) * | 2003-11-04 | 2011-07-19 | Meso Scale Technologies, Llc | Modular assay plates, reader systems and methods for test measurements |
| EP1682261B1 (en) * | 2003-11-12 | 2012-08-15 | BIO-RAD Haifa Ltd. | Method for carrying out multiple binding reactions in an array format |
| KR20070004725A (ko) * | 2004-02-20 | 2007-01-09 | 더 리전츠 오브 더 유니버시티 오브 캘리포니아 | 타액 mRNA 프로파일링, 생물 마커 및 관련 방법 및부품 키트 |
| CN1296492C (zh) | 2004-11-18 | 2007-01-24 | 博奥生物有限公司 | 一种基于生物芯片检测能结合特异序列的核酸结合蛋白的方法 |
| EP1838880A2 (en) * | 2005-01-21 | 2007-10-03 | Third Wave Technologies, Inc. | Methods and compositions for increased dynamic range detection of nucleic acid molecules |
| GB0508983D0 (en) * | 2005-05-03 | 2005-06-08 | Oxford Gene Tech Ip Ltd | Cell analyser |
| WO2006124340A2 (en) * | 2005-05-06 | 2006-11-23 | The Regents Of California University | Microfluidic system for identifying or sizing individual particles passing through a channel |
| US20060263818A1 (en) * | 2005-05-23 | 2006-11-23 | Axel Scherer | High throughput multi-antigen microfluidic fluorescence immunoassays |
| WO2007011622A2 (en) * | 2005-07-18 | 2007-01-25 | U.S. Genomics, Inc. | Microfluidic methods and apparatuses for sample preparation and analysis |
| US20080220982A1 (en) | 2005-07-26 | 2008-09-11 | Vu Tania Q | Nanoparticle Probes for Capture, Sorting and Placement of Targets |
| US20070074972A1 (en) * | 2005-09-13 | 2007-04-05 | Fluidigm Corporation | Microfluidic assay devices and methods |
| US7776553B2 (en) | 2005-09-16 | 2010-08-17 | Presidents And Fellows Of Harvard College | Screening assays and methods |
| US20070122819A1 (en) * | 2005-11-25 | 2007-05-31 | Industrial Technology Research Institute | Analyte assay structure in microfluidic chip for quantitative analysis and method for using the same |
| CA3179247A1 (en) | 2005-12-21 | 2007-07-05 | Meso Scale Technologies, Llc | Assay modules having assay reagents and methods of making and using same |
| JP2009525756A (ja) * | 2006-02-07 | 2009-07-16 | ウェファージェン, インコーポレイテッド | 温度制御された培養プレート |
| CA2659745A1 (en) | 2006-08-02 | 2008-02-07 | California Institute Of Technology | Methods and systems for detecting and/or sorting targets |
| US7863035B2 (en) * | 2007-02-15 | 2011-01-04 | Osmetech Technology Inc. | Fluidics devices |
| AU2008276024A1 (en) * | 2007-07-16 | 2009-01-22 | California Institute Of Technology | Microfluidic devices, methods and systems for detecting target molecules |
| CN104884605B (zh) | 2012-08-24 | 2018-05-18 | 耶鲁大学 | 用于高通量多重检测的系统、装置和方法 |
| US9824870B1 (en) * | 2014-04-29 | 2017-11-21 | The United States Of America As Represented By The Administrator Of Nasa | Portable medical diagnosis instrument |
-
2008
- 2008-07-16 AU AU2008276024A patent/AU2008276024A1/en not_active Abandoned
- 2008-07-16 US US12/174,598 patent/US20090053732A1/en not_active Abandoned
- 2008-07-16 US US12/174,601 patent/US20090036324A1/en not_active Abandoned
- 2008-07-16 EP EP08781923.1A patent/EP2167633A4/en not_active Withdrawn
- 2008-07-16 CA CA2694541A patent/CA2694541A1/en not_active Abandoned
- 2008-07-16 WO PCT/US2008/070236 patent/WO2009012343A2/en active Application Filing
- 2008-07-16 EP EP08796213.0A patent/EP2167634A4/en not_active Withdrawn
- 2008-07-16 EP EP19180665.2A patent/EP3628729A3/en active Pending
- 2008-07-16 AU AU2008276027A patent/AU2008276027B2/en active Active
- 2008-07-16 JP JP2010517148A patent/JP2010533871A/ja active Pending
- 2008-07-16 WO PCT/US2008/070232 patent/WO2009012340A2/en active Application Filing
- 2008-07-16 CA CA2694545A patent/CA2694545C/en active Active
- 2008-07-16 JP JP2010517146A patent/JP2010533869A/ja active Pending
-
2015
- 2015-04-23 US US14/694,340 patent/US20160011189A1/en not_active Abandoned
-
2016
- 2016-11-22 US US15/359,464 patent/US10928389B2/en active Active
-
2018
- 2018-11-14 US US16/191,207 patent/US20190195869A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002236131A (ja) * | 2000-12-08 | 2002-08-23 | Minolta Co Ltd | マイクロチップ |
| WO2005090972A1 (ja) * | 2004-03-18 | 2005-09-29 | Nissui Pharmaceutical Co., Ltd. | 生物学的物質の分析キット、分析装置及び分析方法 |
| JP2006329767A (ja) * | 2005-05-25 | 2006-12-07 | Aisin Seiki Co Ltd | 試料分析装置 |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020148778A (ja) * | 2014-12-03 | 2020-09-17 | アイソプレキシス コーポレイション | 細胞分泌プロファイルの分析およびスクリーニング |
| JP2022020708A (ja) * | 2014-12-03 | 2022-02-01 | アイソプレキシス コーポレイション | 細胞分泌プロファイルの分析およびスクリーニング |
| US11661619B2 (en) | 2014-12-03 | 2023-05-30 | IsoPlexis Corporation | Analysis and screening of cell secretion profiles |
| JP7342086B2 (ja) | 2014-12-03 | 2023-09-11 | アイソプレキシス コーポレイション | 細胞分泌プロファイルの分析およびスクリーニング |
| KR101906969B1 (ko) | 2017-09-15 | 2018-10-11 | 삼성전자주식회사 | 유전자 분석장치 및 이를 이용한 유전자 분석방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2694545C (en) | 2019-10-01 |
| US20090036324A1 (en) | 2009-02-05 |
| EP3628729A3 (en) | 2020-05-06 |
| JP2010533871A (ja) | 2010-10-28 |
| AU2008276024A1 (en) | 2009-01-22 |
| EP3628729A2 (en) | 2020-04-01 |
| EP2167633A2 (en) | 2010-03-31 |
| EP2167634A4 (en) | 2013-11-06 |
| WO2009012340A2 (en) | 2009-01-22 |
| AU2008276027A1 (en) | 2009-01-22 |
| WO2009012340A3 (en) | 2009-03-26 |
| CA2694545A1 (en) | 2009-01-22 |
| CA2694541A1 (en) | 2009-01-22 |
| EP2167633A4 (en) | 2014-12-24 |
| WO2009012343A9 (en) | 2010-02-04 |
| US10928389B2 (en) | 2021-02-23 |
| WO2009012343A2 (en) | 2009-01-22 |
| US20190195869A1 (en) | 2019-06-27 |
| AU2008276027B2 (en) | 2014-09-04 |
| US20090053732A1 (en) | 2009-02-26 |
| EP2167634A2 (en) | 2010-03-31 |
| WO2009012343A3 (en) | 2009-04-23 |
| US20170138942A1 (en) | 2017-05-18 |
| US20160011189A1 (en) | 2016-01-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2010533869A (ja) | 標的分子を検出するためのマイクロ流体装置、方法及びシステム | |
| US8124015B2 (en) | Multiplexed, microfluidic molecular assay device and assay method | |
| US8586348B2 (en) | Lateral flow microfluidic assaying device and related method | |
| JP4850061B2 (ja) | 抗原の分析装置の製造方法及び分析装置 | |
| Pinto et al. | The application of microbeads to microfluidic systems for enhanced detection and purification of biomolecules | |
| KR20110036002A (ko) | 라이브러리 요소들의 마이크로 유체 선택 | |
| WO2007033385A2 (en) | Microfluidic assay devices and methods | |
| US20080160623A1 (en) | Method and device for bioanalyte quantification by on/off kinetics of binding complexes | |
| Birtwell et al. | Multiplexed suspension array platform for high-throughput protein assays | |
| US20070224702A1 (en) | Flex Method | |
| Uddayasankar | Towards a Surface Microarray Based Multiplexed Immunoassay on a Digital Microfluidics Platform | |
| Chen et al. | A centrifugal microfluidics platform for potential application on immobilization-free bead-based immunoassays | |
| Lee et al. | Fabrication of disposable protein chip for simultaneous sample detection | |
| QINGDI | Microparticle Array on Gel Microstructure Chip for Multiplexed Biochemical Assays | |
| Tekin et al. | Microchannel-guided capture antibody patterning on beads for multiple protein detection arrays | |
| EP1996946A1 (en) | Plex method | |
| Kariuki et al. | Development of a Label-Free Protein Array Chip | |
| Kai | Protein lab-on-a-chips on polymer substrates for point-of-care testing (POCT) of cardiac biomarkers | |
| Goluch | Chip-based detection of protein cancer markers | |
| Qingdi et al. | Simultaneous detetion of protein and DNA in a microfluidic device using spatial addressable microbeads on a gel pad array | |
| Rodriguez | The development of microbead-based immunoassays: An application of the “electronic taste chip” | |
| Goluch et al. | A Microfluidic Chip for Bio-bar-code-based Detection of Proteins | |
| Ouellet et al. | Parallel microfluidic arrays for SPRi detection | |
| Liu | in the Graduate College of the |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110714 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110714 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20120920 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120925 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20121221 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130104 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130123 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131105 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140401 |