JP2010519288A - イオン導入法のためのテルビナフィン製剤 - Google Patents
イオン導入法のためのテルビナフィン製剤 Download PDFInfo
- Publication number
- JP2010519288A JP2010519288A JP2009550768A JP2009550768A JP2010519288A JP 2010519288 A JP2010519288 A JP 2010519288A JP 2009550768 A JP2009550768 A JP 2009550768A JP 2009550768 A JP2009550768 A JP 2009550768A JP 2010519288 A JP2010519288 A JP 2010519288A
- Authority
- JP
- Japan
- Prior art keywords
- terbinafine
- pharmaceutical composition
- nail
- formulation
- iontophoresis
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0002—Galenical forms characterised by the drug release technique; Application systems commanded by energy
- A61K9/0009—Galenical forms characterised by the drug release technique; Application systems commanded by energy involving or responsive to electricity, magnetism or acoustic waves; Galenical aspects of sonophoresis, iontophoresis, electroporation or electroosmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/38—Cellulose; Derivatives thereof
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Dermatology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Emergency Medicine (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
Abstract
本発明は、活性物質としてテルビナフィン化合物、水、および少なくとも一種類の水溶性または水混和性の非イオン性界面活性剤を含む薬学的組成物を提供し、ここで、該テルビナフィン化合物は、遊離塩基型、酸付加塩型、イオン型、およびそれらの組み合わせからなる群より選択される少なくとも一つの型を有し、該組成物にはアルコールが実質的に存在しない。
Description
分野
本発明は、テルビナフィン抗真菌組成物に関する。本発明はさらに、イオン導入法による送達用に製剤化されたテルビナフィン抗真菌組成物に関する。
本発明は、テルビナフィン抗真菌組成物に関する。本発明はさらに、イオン導入法による送達用に製剤化されたテルビナフィン抗真菌組成物に関する。
背景
合成アリルアミンであるテルビナフィンは、真菌感染症を処置するために一般的に用いられている。テルビナフィンは、スクアレンエポキシダーゼを阻害することによって、エルゴステロール合成を阻害し、それによって真菌の細胞壁を破壊する。
合成アリルアミンであるテルビナフィンは、真菌感染症を処置するために一般的に用いられている。テルビナフィンは、スクアレンエポキシダーゼを阻害することによって、エルゴステロール合成を阻害し、それによって真菌の細胞壁を破壊する。
当技術分野において、Novartisから販売されているラミシールなどのテルビナフィン塩酸塩の経口および局所製剤が開示されている。テルビナフィン塩酸塩の経口投与を、爪真菌症の処置において用いてもよいが、この投与経路は、肝毒性などの望ましくない副作用に関連する。テルビナフィン塩基またはテルビナフィン塩酸塩の利用可能な局所製剤は、爪真菌症の処置において有効ではない。
いくつかの活性物質を皮膚に送達するための公知の方法は、イオン導入法である。イオン導入法は、物質の電気的送達法である。
イオン導入法によって送達される物質は、好ましくは電流に対して応答するために荷電しているべきである。物質がもともと荷電していない場合、該物質を、荷電物質と混合するか、または電荷の形成を誘導する特定のpH環境などの環境条件に供することができる。活性分子の大きさ、pH、粘度、疎水性、親水性、および競合イオンなどの、しかしこれらに限定されない物質または組成物の特性は全て、イオン導入による物質の送達に影響を及ぼす。さらに、組成物の物理的状態は、イオン導入法と共に用いる場合の実行可能性および容易さに合わせて形成される必要がある。
利用可能なテルビナフィン組成物は、経口または局所投与用に製剤化されており、イオン導入法を用いる送達用に製剤化されていない。
したがって、本発明によって提供されるような、イオン導入法による有効な送達用に製剤化されているテルビナフィン製剤は有利であろう。
概要
本発明の局面には、テルビナフィンを含む抗真菌製剤が含まれる。一つの局面において、抗真菌テルビナフィン製剤は、イオン導入法による送達用に形成されてもよい。製剤は、遊離塩基型、酸付加塩型、およびイオン型の少なくとも一つもしくはそれらの組み合わせのテルビナフィン化合物、水、ならびに少なくとも一種類の水溶性または水混和性の非イオン性界面活性剤を含んでもよく、アルコールは実質的に存在しない。
本発明の局面には、テルビナフィンを含む抗真菌製剤が含まれる。一つの局面において、抗真菌テルビナフィン製剤は、イオン導入法による送達用に形成されてもよい。製剤は、遊離塩基型、酸付加塩型、およびイオン型の少なくとも一つもしくはそれらの組み合わせのテルビナフィン化合物、水、ならびに少なくとも一種類の水溶性または水混和性の非イオン性界面活性剤を含んでもよく、アルコールは実質的に存在しない。
もう一つの局面は、テルビナフィンと酢酸の製剤、またはテルビナフィンと酢酸の塩の製剤に関する。
さらなる局面は、イオン導入法による送達用に形成された抗真菌テルビナフィン製剤が含まれるか、またはこれと共に用いられてもよいイオン導入装置などの装置に関する。
さらなる局面は、真菌感染症を処置するための装置およびテルビナフィン製剤の使用に関する。
本発明の様々な特色は、下記の説明、および添付の図面を合わせて参照することによって最もよく認識されるであろう。
詳細な説明
テルビナフィンのイオン導入法による送達が爪真菌症の処置において有効であり、経口投与経路によって引き起こされる全身性副作用が起こらないことが発見された。本出願の文脈において、「イオン導入法」という用語は、電気的輸送、イオン導入、電気浸透、電気穿孔、および/またはそれらの組み合わせが含まれる、物質の任意の電気的送達法を意味する。
テルビナフィンのイオン導入法による送達が爪真菌症の処置において有効であり、経口投与経路によって引き起こされる全身性副作用が起こらないことが発見された。本出願の文脈において、「イオン導入法」という用語は、電気的輸送、イオン導入、電気浸透、電気穿孔、および/またはそれらの組み合わせが含まれる、物質の任意の電気的送達法を意味する。
製剤/組成物
本発明の局面は、テルビナフィンの組成物に関する。いくつかの局面において、組成物には、少なくとも一種類の活性物質、少なくとも一種類の溶媒、および少なくとも一種類の界面活性剤が含まれる。
本発明の局面は、テルビナフィンの組成物に関する。いくつかの局面において、組成物には、少なくとも一種類の活性物質、少なくとも一種類の溶媒、および少なくとも一種類の界面活性剤が含まれる。
活性物質は、構造式:
のN,6,6-トリメチル-N-(ナフタレン-l-イルメチル)ヘプト-2-エン-4-イン-l-アミン(テルビナフィン)、またはその任意の適した誘導体である。いくつかの局面において、活性物質テルビナフィンは、遊離塩基型、酸性塩型、もしくはイオン型の少なくとも一つ、またはそれらの組み合わせである。活性物質テルビナフィンは、シス型、トランス型、およびその任意の組み合わせ、またはラセミ型であってもよい。
のN,6,6-トリメチル-N-(ナフタレン-l-イルメチル)ヘプト-2-エン-4-イン-l-アミン(テルビナフィン)、またはその任意の適した誘導体である。いくつかの局面において、活性物質テルビナフィンは、遊離塩基型、酸性塩型、もしくはイオン型の少なくとも一つ、またはそれらの組み合わせである。活性物質テルビナフィンは、シス型、トランス型、およびその任意の組み合わせ、またはラセミ型であってもよい。
テルビナフィン塩基およびテルビナフィン塩酸塩は、水溶性、吸湿性、安定性、および親油性などにおいて、異なる化学特性を示す。テルビナフィン塩基は塩酸塩より有意に水溶性が低い。テルビナフィン塩基は吸湿性であり、これは、製剤において安定性の問題を引き起こす可能性がある。そのため、塩酸塩と比較して、塩基が含まれる処方に関する必要条件は異なる可能性がある。イオン導入法を用いてテルビナフィン塩基を含有する製剤からテルビナフィンを送達することは、テルビナフィン塩酸塩を含有する製剤からの送達と比較して差を示す可能性がある。さらに、異なる真菌に対するテルビナフィン塩基とテルビナフィン塩の抗真菌活性は、同じではないように思われる。したがって、一部の用途において、活性を最適にするためにテルビナフィン塩酸塩を実質的に含まない、テルビナフィン塩基を含む製剤、またはテルビナフィン塩基と塩との組み合わせを含む製剤を有することが望ましい場合がある。
組成物がイオン導入法による送達のためのものである局面において、該組成物は、(a)荷電活性テルビナフィン、(b)可溶化テルビナフィン、(c)非クラスタ形成テルビナフィン、(d)適した分子分散、(e)安定性、および(f)電流の影響下で処置部位へのテルビナフィン活性イオンの移動の助けとなる物理的状態の少なくとも一つまたは組み合わせを容易にするように製剤化される。
いくつかの局面において、製剤の伝導度特性を、イオン導入法用に調整してもよい。いくつかの局面において、製剤の伝導度特性を、爪へのイオン導入送達用に調整してもよく、製剤の特性および伝導度特性は、皮膚への送達の場合と爪への送達の場合で異なってもよい。いくつかの局面において、活性物質の水溶液などの伝導性媒体を製剤において用いてもよい。賦形剤が含まれるいくつかの局面において、賦形剤は、活性なテルビナフィンイオンの代わりに競合イオンの送達を低減または防止するために、非イオン性賦形剤であってもよい。別の局面において、抗真菌活性物質を爪の中に押し込むためのより高いイオン流を作製するために、非活性物質の一価イオンを製剤に含めてもよい。いくつかの局面において、テルビナフィンのイオン化の程度を改変するためにpHを改変する。
一つの局面において、テルビナフィン組成物は、イオン化テルビナフィンの有効量を含む。本明細書において用いられる「イオン化テルビナフィンの適した百分率または有効量」は、電流による爪への送達にとって少なくとも適切であろうイオンの量を指す。別の局面において、合成された組成物を、患者の処置の際にさらに処理してそれによってイオン化テルビナフィンを得てもよい。テルビナフィンのイオン化が起こりうる方法の一つの非限定的な例は、たとえば電気分解生成物の結果として、イオン導入装置による活性薬の送達の際に組成物のpHを低下させることである。そのような方法は、「インサイチューイオン化」と呼ばれうる。イオン化した化合物の量は、組成物のpHに依存する。典型的に、組成物のpHは、イオン化化合物を50%より多く含む組成物を容易にするために、化合物のpKaより低くあるべきである。本発明のテルビナフィン組成物がイオン導入による送達のためのものである局面において、該組成物のpHは、約7.1であるテルビナフィンのpKaより低くてもよい。そのため、テルビナフィン組成物のpHは約7.1もしくはそれより低いpHで製剤化されてもよく、またはより高いpHで製剤化して、処置時にpHを下げてもよい。一つの局面において、組成物をイオン導入装置および体の領域に適用する前の組成物のpHは約4.7より高く、適用時のpHは約4.7未満である。さらなる局面において、組成物は、約4を上回るpHで製剤化されて、処置時に下げられるか、この値が維持されてもよい。
製剤が局所で使用される局面において、非荷電テルビナフィン製剤を提供するように、製剤のパラメータを制御してもよい。爪におけるケラチンの陽電荷により、荷電テルビナフィン製剤は、局所的処置において望ましくない可能性がある。
いくつかの局面において、組成物はさらに、適したpH調整剤を含んでもよい。適したpH調整剤の非限定的な例には、トリエタノールアミン、水酸化ナトリウム、酢酸、乳酸、および酢酸ナトリウムが含まれる。添加されるpH調整剤の量を、それによって適した量のイオン化薬が得られる適したpHを達成するように計算してもよい。低いpHは処置される体の領域に損傷を与える可能性があることから、pHが低すぎないように注意すべきである。そのため、pHを、治療的に許容される値のパラメータおよび活性薬の最適なイオン化に従って最適化してもよい。
いくつかの局面において、組成物は緩衝剤をさらに含んでもよい。緩衝剤は、製剤のpHを一定レベルで維持しうる。一つの局面において、酢酸および酢酸ナトリウムの緩衝剤システムを用いて、製剤のpHを約pH 3から4.5のあいだで維持する。適した緩衝剤のさらなる非限定的な例には、クエン酸塩/クエン酸、クエン酸/リン酸水素ナトリウム、および酢酸ナトリウム/酢酸が含まれる。
活性物質は、任意の適した量で存在する。適した量は、最適な治療活性を提供するが、それによって毒性を生じないであろう量であってもよい。いくつかの局面において、量は、最小発育阻止濃度(MIC)を上回るテルビナフィンの量を送達するために決定される。皮膚糸状菌に対するテルビナフィン塩酸塩の最小発育阻止濃度は約0.0015μg/mlである。本発明の組成物において用いられるテルビナフィンの割合は、約0.05重量%〜約15重量%の範囲であってもよい。いくつかの局面において、組成物におけるテルビナフィンの百分率は、約0.25重量%〜約4重量%である。いくつかの局面において、テルビナフィンは、約0.1重量%〜約2重量%、または約0.5重量%〜約1重量%で存在する。一つの局面において、テルビナフィンは、約1重量%で存在する。さらなる局面において、テルビナフィンは、約0.5重量%で存在する。
一つの局面において、組成物は、少なくとも一種類の溶媒を含む。溶媒は、活性化合物を溶解する、かつ/または活性物質テルビナフィンのイオン化状態を容易にするように機能しうる。一つの局面において、溶媒は、二回脱イオン水などの、しかしこれに限定されない任意の適した純度の水である。活性物質がテルビナフィンである局面において、テルビナフィンは疎水性であり、そのためテルビナフィンの水中での溶解度は低い。
いくつかの局面において、さらなる適した溶媒が含まれてもよい。さらなる溶媒は、たとえば水におけるテルビナフィンの溶解を補助する可能性がある。適した溶媒に関する一つの基準は、溶媒がテルビナフィンを可溶化する容易さである。溶媒を選ぶ場合のさらなる考慮には、感受性を引き起こさないこと、安定性、熱および電流に対する酸化的安定性、ならびに不揮発性が含まれてもよいがこれらに限定されるわけではない。そのため、たとえテルビナフィンがメタノールおよびエタノールに対し極めて溶解性であっても、一つの局面において本発明の組成物には実質的にいかなるアルコールも含まれない。外部条件によるアルコールの蒸発によって、製剤成分の割合の変化が起こる可能性がある。アルコールの蒸発によって、テルビナフィンの沈殿も起こる可能性がある。いくつかの局面において、本発明の製剤は、アルコールの蒸発を促進するであろう条件である、高温の環境においてまたは体の罹患領域の加熱と共に用いられてもよい。製剤中のテルビナフィン塩基またはテルビナフィン塩の百分率は爪における活性薬の分布に影響を及ぼすことが、本発明者らによって見いだされている。一定の条件において、2%を上回るテルビナフィンを含む組成物のイオン導入法による送達によって、1%テルビナフィン製剤の送達より多くのテルビナフィンが爪に送達される可能性があるが、より多くの量のテルビナフィンを含有する製剤では爪床に送達されるテルビナフィンがより少ないことが観察された。製剤における極めて揮発性の溶媒は、保存条件および処置条件において蒸発する可能性があり、製剤中の活性なテルビナフィンの百分率を高めて爪床の最適な処置を妨げる可能性がある。活性薬の標的送達部位が爪床である爪真菌症などの場合、アルコール含有製剤を用いることは望ましくない可能性がある。本発明は、一つの局面において、遊離塩基型、酸付加塩型、およびイオン型の少なくとも一つまたはそれらの組み合わせのテルビナフィン化合物、水、ならびに少なくとも一種類の水溶性または水混和性の界面活性剤を含む薬学的組成物を提供し、ここで、アルコールは実質的に存在しない。さらなる局面において、本発明は、成分がエタノールと同等の沸点を有し、その結果室温で実質的に揮発性である、エタノールと同等の揮発性を有するいかなる成分も実質的に含まないテルビナフィン製剤を提供する。
一つの局面において、組成物には、少なくとも一種類の水溶性または水混和性界面活性剤が含まれる。界面活性剤は非イオン性であってもよい。界面活性剤が非イオン性である局面において、該界面活性剤は、イオン導入法による送達のために、活性なテルビナフィンイオンと競合する可能性があるイオンを実質的に産生しないであろう。界面活性剤は、テルビナフィンを乳化すること、水などの溶媒における水溶性の低いテルビナフィンの溶解を補助すること、テルビナフィンの分散を容易にすること、テルビナフィンを安定化すること、および電流下で移動することができるテルビナフィンを容易にすることを含む機能の、少なくとも一つまたはそれらの組み合わせを示してもよい。いくつかの局面において、界面活性剤はまた、組成物のゲル化を容易にする可能性がある。適した水溶性非イオン性界面活性剤の一つの非限定的な例は、ポリオキシエチレン-ポリオキシプロピレンコポリマー、たとえばポロキサマーなどの両親媒性ポリマーである。ポロキサマーはまた、組成物のゲル化を容易にする可能性がある。適した界面活性剤の別の非限定的な例には、2-(2-エトキシエトキシ)エタノール(エトキシジグリコール)、オレイン酸ポリグリセリル-10;ノノキシノール-9、オレス-20、デシルグルセス-20、ジメチコンコポリオール、ステアレス-20、セテアレス-20、ステアレス-21、イソセテス-20、オレス-20、オレス-10、ラウレス-23、ノノキシノール-10、PEG-40硬化ヒマシ油、PEG-35ヒマシ油、PEG-7グリセリルココエート;Tween 80、Span 80、ジパルミチン酸デカグリセリル、およびそれらの組み合わせが含まれる。いくつかの局面において、界面活性剤は、抗真菌特性を有してもよく、それによってテルビナフィンとの併用または相乗的な抗真菌活性が得られる可能性がある。界面活性剤は、約5重量%〜約50重量%などの、しかしこれらに限定されない任意の適した量で存在してもよい。
いくつかの局面において、製剤には、任意の適した量で少なくとも一種類の保存剤が含まれてもよい。保存剤は、約2重量%より少ない量で存在してもよい。保存剤は水溶性であってもよい。適した保存剤の非限定的な例には、メチルイソチアゾリノン、Sharonmix MTG、フェノキシエタノール、メチルパラベン、およびその誘導体が含まれる。
いくつかの局面において、製剤には、少なくとも一種類の浸透性増強剤が任意の適した量で含まれてもよい。少なくとも一種類の浸透性増強剤は、約20%未満の量で存在してもよい。浸透性増強剤は、皮膚および/または爪への活性薬の送達を補助する可能性がある。浸透性増強剤の非限定的な例には、尿素、酢酸、サリチル酸、ジメチルスルホキシド、エトキシジグリコール、イソセテス-20、ジメチルイソソルビド、およびそれらの組み合わせが含まれる。意外にも、本発明者らは、いくつかの製剤において、製剤に尿素を含めると、爪床へのテルビナフィンの送達を阻害する可能性があることを観察している。当技術分野において公知である任意の適した浸透性増強剤を用いてもよい。
いくつかの局面において、製剤には、NaCl、KCl、硫酸ナトリウム、クエン酸ナトリウム、ヨウ化ナトリウム、酢酸ナトリウム、酢酸カリウム、乳酸ナトリウム、リン酸カリウム、およびそれらの組み合わせなどの、しかしこれらに限定されない少なくとも一種類の伝導度増強剤が任意の適した量で含まれてもよい。伝導度増強剤は約5%以内の量で存在してもよい。一つの局面において、伝導度増強剤は、約1%以内の量で存在してもよい。約2%を上回る濃度の伝導度増強剤は、本発明の製剤からのテルビナフィンのイオン導入による薬物送達を阻害する可能性があることが観察されており、これは競合に起因する可能性がある。
いくつかの局面において、本発明の製剤は、約1.0 mSi/cmを上回る伝導度を有するように製剤化される。一つの局面において、本発明の製剤は、pH約4.5で約3.0〜約25.0 mSi/cmの範囲の伝導度を有する。
いくつかの局面において、製剤には、セルロース誘導体、PVA、PVP、MC、およびHPMCなどの、しかしこれらに限定されない安定化剤が含まれてもよい。
いくつかの局面において、製剤には、抗真菌剤、抗生物質、抗ウイルス剤、鎮痛剤、およびそれらの組み合わせなどの少なくとも一種類のさらなる活性物質が含まれてもよい。一つの局面において、製剤の少なくとも一種類の非テルビナフィン構成成分も同様に抗真菌特性を有してもよい。
いくつかの局面において、製剤には、真菌胞子を活性化するための胞子活性化剤が含まれてもよい。いくつかの局面において、装置の電気刺激は、胞子を活性化するように形成され、次にこれを本発明の組成物によって処置してもよい。
いくつかの局面において、製剤には、着色剤、増粘剤、抗酸化剤、乳化剤、湿潤剤、および香料などの、しかしこれらに限定されない薬剤および化粧品の技術分野において公知のさらなる賦形剤が含まれてもよい。
本発明の組成物は、液剤、ゲル剤、クリーム剤、流動体、噴霧剤、分散剤、または乳剤などの、しかしこれらに限定されない任意の適した物理的形状で製剤化されてもよい。いくつかの局面において、テルビナフィン、水、および非イオン性界面活性剤を含む製剤は、ゲル形態である。ゲル形態は、イオン導入装置による容易な取り扱いおよび容易な使用の助けとなる。いくつかの局面において、本明細書において先に記述したように、非イオン性界面活性剤はゲル化剤である。または、非イオン性界面活性剤に加えて、ゲル化剤を製剤に添加してもよい。ヒドロキシエチルセルロース、ヒドロキシメチルセルロース、メチルセルロース、キサンタンガム、グアーガム、ヒドロキシプロピルセルロース、およびそれらの組み合わせなどの、しかしこれらに限定されない任意の適したゲル化剤を用いてもよい。
一つの局面において、本発明の製剤は、イオン性および非イオン性ハイドロゲルが含まれるハイドロゲルと、任意の適した方法で混合してもよい。いくつかの局面において、適したハイドロゲルには、スルホン基および/またはカルボン酸基および/または四級アンモニウム基が含まれてもよい。
さらなる局面において、本発明は、酢酸テルビナフィンなどのテルビナフィンと酢酸との塩、またはテルビナフィンと酢酸との反応生成物から形成された任意の適した塩を提供する。本発明は、テルビナフィンと酢酸との塩を含む薬学的組成物を提供する。組成物にはさらに、少なくとも一種類の溶媒が含まれてもよい。一つの局面において、組成物は、酢酸テルビナフィン、水、および少なくとも一種類の水溶性または水混和性の非イオン性界面活性剤を含む。組成物には、さらに、テルビナフィン塩基および酢酸が含まれてもよい。組成物には、本明細書において先に記述したように任意の適した賦形剤が含まれてもよい。テルビナフィン酢酸塩および/またはその製剤を、任意の適した方法で任意の適したハイドロゲルと混合してもよい。
さらに、本発明は、テルビナフィン塩基および/またはテルビナフィン塩酸塩、および/またはテルビナフィン酸性塩、および/またはイオン化テルビナフィンなどのテルビナフィンと酢酸との任意の適した組み合わせを提供する。一つの局面において、製剤は、酢酸、水、およびテルビナフィンのみによって作出されてもよい。別の態様において、製剤にはさらに、ハイドロゲルが含まれてもよい。任意で、酢酸の特徴的な匂いを中和するための芳香剤または手段を製剤に含めてもよい。
酢酸テルビナフィン塩を、真菌感染症の処置などの任意の適した障害を処置するための薬剤を調製するために用いてもよい。一つの局面において、酢酸テルビナフィン塩は、爪真菌症の処置のためのものであってもよい。本発明者らは、酢酸テルビナフィンが含まれる製剤のイオン導入送達によって、約150μg/cm2のテルビナフィンの爪床への送達が起こることをインビトロ試験を用いて示している。類似の条件において、テルビナフィン塩基製剤によって約10μg/cm2の爪床への送達が起こり、テルビナフィン塩酸塩製剤によって約45μg/cm2の爪床への送達が起こった。テルビナフィン酢酸製剤は、テルビナフィンの別の形態より有意により多く、爪床へテルビナフィンを送達した。
酢酸塩は、任意の適した方法によって調製してもよい。一つの局面において、塩はテルビナフィンの遊離塩基を酢酸と反応させることによって調製される。酢酸を、テルビナフィンの遊離塩基に付加してもよい。酢酸の任意の適した量および濃度を用いてもよい。一つの局面において、約99重量%以内の酢酸を用いた。一つの例において、95%酢酸をテルビナフィン塩基と混合する。その後、生成物を単離してもよい。
または、酢酸塩は、酢酸をテルビナフィン塩基と反応させることによって、酢酸、テルビナフィン塩基、およびさらなる成分が含まれてもよい製剤においてインサイチューで作出されてもよく、ここで、酢酸テルビナフィンは単離されない。
さらなる方法には、酢酸のインサイチュー生成が含まれる。テルビナフィン塩基と、たとえば酢酸塩、たとえば酢酸ナトリウムまたは無水酢酸などの酢酸塩含有化合物とが含まれる製剤を調製してもよい。たとえばイオン導入装置を適用することによって電流を製剤に印加して、電流はたとえば電気分解の際にプロトンを放出することによって、酢酸の電気的生成を容易にする。次に、生成された酢酸を、テルビナフィンの遊離塩基とインサイチューで反応させて、酢酸テルビナフィンを形成してもよい。この方法は、酢酸塩の調製に限定されず、テルビナフィンの任意の適した酸性塩を作出するために用いてもよい。
酢酸テルビナフィンおよび/またはテルビナフィンと酢酸との混合物をハイドロゲルに加えてもよい。より高濃度のテルビナフィンが存在するハイドロゲル酢酸テルビナフィン製剤は、より低濃度のテルビナフィンを有する類似の製剤より多くのテルビナフィンを爪床に送達することが、インビトロ試験において観察された。たとえば、約2.67重量%テルビナフィンを有するハイドロゲル酢酸テルビナフィン製剤は、約5.5重量%テルビナフィンが含まれる製剤より実質的に少ないテルビナフィンを送達した。
装置
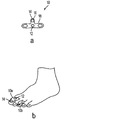
一つの局面において、本発明は、本発明のテルビナフィン組成物を含むイオン導入装置を含む、爪真菌症を処置するための装置を提供する。テルビナフィン製剤がイオン導入法による送達用である局面において、製剤を任意の適したイオン導入装置と組み合わせて用いてもよい。本明細書において用いられる「装置」および「イオン導入装置」という用語には、「イオン導入パッチ」、「電気的操作装置」、および「電気的操作パッチ」が含まれ、電気的輸送、イオン導入法、電気浸透、および電気穿孔を含む、物質の電気的送達のために用いられる任意の方法または装置を互換的に表す。装置は、薄型かつ柔軟であってもよく、または非薄型かつ/または非柔軟であってもよい、当技術分野の任意の装置であってもよい。本明細書において用いられる薄型という用語は、厚さ約5 mm未満を指す。本明細書において用いられる「柔軟な」という用語は、足指または指などの、しかしこれらに限定されない任意の体表面に対して折り畳み可能かつ/または適合可能な装置を指す。装置は、軽量装置であってもよい。一つの局面において、装置は、重量約2 g〜約10 gであってもよい。いくつかの局面において、装置はより重くてもより軽くてもよい。装置は、装置に対して一体型であってもよくまたは外部構成要素であってもよい、電池対物質または電池などの、しかしこれらに限定されない任意の適した電源によって、電力を供給されてもよい。装置は、本発明のテルビナフィン製剤を含むように製造されてもよく、または製剤をたとえばキットの一部として使用前などに個別に適用してもよい。一つの局面において、爪真菌症を処置するためのキットは、イオン導入装置および本発明のテルビナフィン組成物を特色とする。適した装置の非限定的な例は、参照により本明細書に組み入れられる米国特許出願公開第20050038375 A1号において記述されている。図1aは、本発明の製剤と共に用いるために適しており、米国特許出願公開第20050038375 A1号において記述されているイオン導入装置10の一つの非限定的な例を示す。装置10には、対電極12、活性電極14、およびフレーム18に配置された電源16が含まれ、対電極12および活性電極14は電源16に電気的に接続されている。図1bは足指に取り付けられた装置10aまたは10bを示す。
一つの局面において、本発明は、本発明のテルビナフィン組成物を含むイオン導入装置を含む、爪真菌症を処置するための装置を提供する。テルビナフィン製剤がイオン導入法による送達用である局面において、製剤を任意の適したイオン導入装置と組み合わせて用いてもよい。本明細書において用いられる「装置」および「イオン導入装置」という用語には、「イオン導入パッチ」、「電気的操作装置」、および「電気的操作パッチ」が含まれ、電気的輸送、イオン導入法、電気浸透、および電気穿孔を含む、物質の電気的送達のために用いられる任意の方法または装置を互換的に表す。装置は、薄型かつ柔軟であってもよく、または非薄型かつ/または非柔軟であってもよい、当技術分野の任意の装置であってもよい。本明細書において用いられる薄型という用語は、厚さ約5 mm未満を指す。本明細書において用いられる「柔軟な」という用語は、足指または指などの、しかしこれらに限定されない任意の体表面に対して折り畳み可能かつ/または適合可能な装置を指す。装置は、軽量装置であってもよい。一つの局面において、装置は、重量約2 g〜約10 gであってもよい。いくつかの局面において、装置はより重くてもより軽くてもよい。装置は、装置に対して一体型であってもよくまたは外部構成要素であってもよい、電池対物質または電池などの、しかしこれらに限定されない任意の適した電源によって、電力を供給されてもよい。装置は、本発明のテルビナフィン製剤を含むように製造されてもよく、または製剤をたとえばキットの一部として使用前などに個別に適用してもよい。一つの局面において、爪真菌症を処置するためのキットは、イオン導入装置および本発明のテルビナフィン組成物を特色とする。適した装置の非限定的な例は、参照により本明細書に組み入れられる米国特許出願公開第20050038375 A1号において記述されている。図1aは、本発明の製剤と共に用いるために適しており、米国特許出願公開第20050038375 A1号において記述されているイオン導入装置10の一つの非限定的な例を示す。装置10には、対電極12、活性電極14、およびフレーム18に配置された電源16が含まれ、対電極12および活性電極14は電源16に電気的に接続されている。図1bは足指に取り付けられた装置10aまたは10bを示す。
テルビナフィン、水、および界面活性剤を含む製剤がゲル形態である局面において、ゲルは、漏出の問題なしに、装置上または体の処置領域上に配置されてもよい。ゲルは、少なくとも一つの電極上など、イオン導入装置の任意の適した要素上に直接もしくは間接的に配置されてもよく、または不織性の製剤維持装置などの保持要素の上/中、もしくはハイドロゲルの上/中に配置されてもよい。テルビナフィン約10 mg未満を含む製剤を装置に適用してもよい。一つの局面において、約2 mg未満のテルビナフィンを含む製剤を、装置に適用してもよい。一つの局面において、テルビナフィン1 mg以内を含む製剤を、処置のために装置に適用してもよい。
テルビナフィンイオンは正電荷を帯びており、そのため、イオン導入装置に起因する電流が、陽極から皮膚および/または爪などの体の罹患領域への荷電テルビナフィンイオンの送達を促進するように、製剤を陽極に接触させて配置してもよい。
交流を用いる別の局面において、テルビナフィン製剤を、陽極と陰極の双方の下に配置してもよい。
装置は、テルビナフィン製剤を爪に送達するために任意の適した電流密度を提供するように形成されてもよい。装置がテルビナフィンを爪床および爪母に特異的に送達するためのものである局面において、約100μA/cm2を上回る電流密度を提供してもよい。製剤に約1%以内のテルビナフィンが含まれ、装置が爪床および爪母にテルビナフィンを送達するためのものである局面において、約400μA/cm2以上の電流密度を提供してもよい。電流密度が増加するとテルビナフィンの爪への送達が増加するが、送達されるテルビナフィンの量については、より低い電流密度とより高い電流密度のあいだとの差は明白ではなかったことが本発明者らによって見いだされた。意外にも、テルビナフィンの分布については、より低い電流密度と比較してより高い電流密度を用いる場合に明白な差が観察された。300μA/cm2を上回る電流密度では、有意により多くのテルビナフィンが製剤から爪床へと送達された。
局所的使用
本発明のテルビナフィン製剤を、真菌感染症の局所的処置のために用いてもよい。テルビナフィン製剤が局所的使用のためのものである局面において、ゲルであってもよい本明細書において先に記述した製剤を、爪および/または皮膚などの体の罹患領域に、該領域を処置するために適用してもよい。製剤を体に直接適用してもよく、または受動的パッチに含めて、次にこれを体の罹患領域に適用してもよい。当技術分野において記述される任意の適した受動的パッチを用いてもよい。
本発明のテルビナフィン製剤を、真菌感染症の局所的処置のために用いてもよい。テルビナフィン製剤が局所的使用のためのものである局面において、ゲルであってもよい本明細書において先に記述した製剤を、爪および/または皮膚などの体の罹患領域に、該領域を処置するために適用してもよい。製剤を体に直接適用してもよく、または受動的パッチに含めて、次にこれを体の罹患領域に適用してもよい。当技術分野において記述される任意の適した受動的パッチを用いてもよい。
真菌感染症の処置
一つの局面において、本発明は、本発明のテルビナフィン組成物の治療的有効量を投与する段階を含む、真菌感染症を処置する方法を提供する。本明細書において用いられる「処置」、「処置する」、および「処置している」という用語は、爪真菌症などの真菌感染症の任意の処置を包含し、これには、疾患に対して素因を有する可能性がある対象において感染症または疾患が起こることを予防する段階;感染症または疾患を阻害する、すなわちその発症を阻止する段階;および/または疾患を軽減する、すなわち疾患の後退を引き起こす段階が含まれる。疾患の軽減とは、臨床的改善、微生物学的改善、および審美的改善が含まれるがこれらに限定されるわけではない対象の状態の改善を達成することを意味する。
一つの局面において、本発明は、本発明のテルビナフィン組成物の治療的有効量を投与する段階を含む、真菌感染症を処置する方法を提供する。本明細書において用いられる「処置」、「処置する」、および「処置している」という用語は、爪真菌症などの真菌感染症の任意の処置を包含し、これには、疾患に対して素因を有する可能性がある対象において感染症または疾患が起こることを予防する段階;感染症または疾患を阻害する、すなわちその発症を阻止する段階;および/または疾患を軽減する、すなわち疾患の後退を引き起こす段階が含まれる。疾患の軽減とは、臨床的改善、微生物学的改善、および審美的改善が含まれるがこれらに限定されるわけではない対象の状態の改善を達成することを意味する。
本発明のテルビナフィン製剤は、任意の適した真菌感染症の処置において用いられてもよい。いくつかの局面において、テルビナフィン製剤は、皮膚糸状菌、カンジダ、およびカビの少なくとも一つ、ならびにそれらの組み合わせによって引き起こされる真菌感染症の処置において用いるためのものである。一つの局面において、本発明のテルビナフィン製剤は、爪真菌症を処置するためのものである。爪真菌症は、爪および周囲の皮膚の真菌感染症である。爪真菌症の最も一般的な型において、真菌は、爪板の下の爪床に侵入し、爪下皮で始まり、その後その下にある爪母の中を近位に移動する。典型的に、爪真菌症の経口処置では、感染症を処置するために爪床に活性薬を送達する。
爪真菌症などの真菌感染症は、感染した爪領域にイオン導入装置を適用することによって処置されてもよい。装置には、本明細書において先に記述したような、ゲル状または流動体状などの適した物理的状態のテルビナフィン製剤が含まれてもよい。テルビナフィン製剤は任意で、維持装置または他の薬物保持手段に含有されてもよい。製剤が装置に添付されていない局面において、製剤を、装置の電極に適用してもよく、または処置される爪の領域に直接適用してもよい。
一つの局面において、装置には、テルビナフィンイオンに対して透過性であり、かつ製剤の少なくとも一種類の他の構成物に対して実質的に非透過性である膜などの手段が含まれてもよい。そのような膜は、活性のあるテルビナフィン分子またはイオンのみが爪に接触するように形成されてもよい。該イオンと競合する可能性がある、または皮膚もしくは爪に対して有害である可能性がある他の製剤成分が爪また皮膚に接触するのを防止してもよい。適した選択的障壁膜の非限定的な例には、イオン交換膜および/または特定の孔径の膜が含まれる。
テルビナフィン組成物は、イオン導入法によって投与されてもよい。対象は、処置される感染した爪領域を装置に接触させてもよい。いくつかの局面において、装置と体の領域との接触により、装置の回路が爪で閉じられ、電流が、爪の処置のために、製剤から爪および周囲領域の上および中へのテルビナフィンイオンの送達を促進する。
装置の適用時間終了時に、該装置を体の領域から除去してもよい。適用時間は多様となりうる。いくつかの局面において、適用時間は約1時間〜約24時間またはそれと同等の時間である。同等の適用時間とは、総時間は同じで適用時間を分割できることを意味する。たとえば、装置および/または製剤を、たとえば24時間適用してもよく、これは3日間毎日8時間適用することと同等である。いくつかの局面において、適用時間は約5時間〜約24時間である。一つの局面において、組成物が終夜投与されるように、適用時間は終夜である。しかし、いくつかの局面において、適用時間はより短くても、またはより長くてもよい。任意で予め決定することができる、または所望の用量に従って決定される期間の後で、すなわち、電極が消耗するまでの時間、または十分な効果が認められるかもしくはそれ以上の改善を認めることができなくなるまでの時間の後で、装置を体の領域との接触から除去してもよい。装置を除去した後、活性薬を、たとえば爪板および爪の上層から爪母および爪床への拡散によってさらに送達してもよい。処置レジメンおよび処置回数は、このことを考慮に入れて設計してもよい。たとえば、爪の処置は、活性薬によって爪が飽和またはほぼ飽和するまで繰り返してもよく、その後、活性薬または活性薬の一部が爪床および/または爪母に分布するまで、および/または爪がこれ以上飽和またはほぼ飽和しなくなるまでの期間、待機する。薬物飽和後の待機期間は数日間または数週間であってもよい。待機期間は少なくとも約3日間またはそれより長くてもよい。飽和は、製剤から爪へ薬物が実質的にそれ以上送達されない時、または初めの送達と比較して大幅に低減された量の薬物が送達される時として定義されてもよい。
いくつかの局面において、装置を使用する前に前処置を適用することができる。前処置の非限定的な例には、洗浄剤の適用、保湿組成物の適用、爪を切ること、乾燥皮膚の除去、入浴、軟化処置、抗刺激剤の適用、浸透増強剤の適用、加熱、微小穿孔、電気刺激、薬学的活性成分を含む製剤の適用、美容上の活性成分を含む製剤の適用、またはそれらの組み合わせが含まれる。
一つの局面において、尿素およびNaClなどの塩による前処置を、感染した爪、その周囲領域、またはそれらの組み合わせに適用する。前処置には、約10重量%〜約30重量%の尿素、および約1重量%〜約10重量%のNaClが含まれてもよい。感染領域を、約20分〜約2時間の範囲であってもよい任意の適した時間、前処置してもよい。いくつかの態様において、前処置は約24時間以内であってもよい。前処置部位を閉鎖するための手段を用いてもよい。閉鎖のために適した手段には、プラスターが含まれてもよい。前処置は、電流を加えずにまたは電流を加えて適用してもよい。
いくつかの局面において、装置の適用後に体の領域に後処置を適用することができる。後処置の非限定的な例には、閉鎖用製剤の適用、洗浄剤の適用、冷却、爪用バーニッシュの適用、薬学的活性成分を含む製剤の適用、本発明のテルビナフィン製剤の局所的適用、美容上の活性成分を含む製剤の適用、またはそれらの組み合わせが含まれる。
処置は任意で、1回限りの処置であることができ、または適した時間間隔で任意の適した回数繰り返されることができる。一つの局面において、処置は、1週間に1回であるか、または約1ヶ月もしくは約3ヶ月までのあいだ、毎日もしくは1週間に数回繰り返される。いくつかの局面において、処置は、3ヶ月より長く、たとえば約1年以内であってもよい。一つの局面において、処置は、テルビナフィンによる爪の飽和を達成するために毎日であってもよい。いくつかの場合において、爪の飽和または近飽和には、約1週間から約3週間の毎日の処置を要してもよい。飽和は、一部の個体において、より少ない処置またはより多い処置の後に起こる可能性がある。さらなる処置の前に待機時間があってもよい。待機時間は、数週間の期間であってもよい。いくつかの場合において、待機期間はそれより長くても短くてもよい。待機期間の後、さらなるブースター処置を週に1回または数回行ってもよく、これは連続的または非連続的処置であってもよい。ブースター処置は、約1年以内の期間行ってもよい。本発明の使用は、真菌感染症の緩和および消失を容易にすることができる。効果の持続期間は、適用時間および頻度、用いる電流のタイプおよび量、状態の重症度、ならびに爪および爪母に送達されて存在するテルビナフィンの不活化によって影響を受けうる。処置の効果の持続期間は多様であってもよい。繰り返し使用は、処置の結果の持続および程度に対して相乗効果を有する可能性がある。
図2は、本発明による典型的な処置の概略を示す。処置領域は、本明細書において先に記述されたように前処置されてもよい(100)。次に、装置および製剤を、電流が爪および/または周囲領域へのテルビナフィンの送達を促進するように、爪および/または周囲の皮膚領域の処置領域に適用してもよい(200)。装置および/または製剤を、本明細書において先に定義した時間の後に処置領域から除去してもよい(300)。処置領域は任意で、本明細書において先に記述したように後処置によって処置されてもよい(400)。同じ装置、異なる装置、または同じ装置の異なる試料を再度適用してもよく、本明細書において先に記述したように処置を適した時間間隔で繰り返してもよい(500)。爪において薬物が飽和するまたはほぼ飽和となるまで適用を繰り返してもよい。飽和に達するための処置の平均回数を予め計算して、この回数をそれぞれの患者について用いてもよく、または各個体に応じて回数を計算してもよい。薬物が爪母および/または爪床に拡散するための期間、待機してもよい(600)。薬物が爪床に拡散するまでの平均待機時間を予め計算して、これを各患者に対して一般的に用いてもよく、または待機時間を各個体もしくは個体の一定のパラメータに従って計算してもよい。パラメータには、年齢、性別、障害の重症度、爪の抵抗性、体重、身長、および病歴が含まれてもよいがこれらに限定されるわけではない。装置および/または製剤の処置および適用を、必要に応じて繰り返してもよい(700)。
一つの局面において、処置は、家庭での使用用に形成されてもよい。他の局面において、処置は、管理された環境において行われてもよい。
ラミシールの経口投与には典型的に、250 mg錠を毎日1錠服用することが含まれることに注意されたい。本発明の製剤は、実質的に100 mg未満のテルビナフィンを体に毎日送達するように形成される。本発明の製剤は、実質的に1 mg未満のテルビナフィンを体に毎日送達することができる。一つの局面において、本発明の製剤は、テルビナフィンのMICの1000倍より多くを爪床に送達するように形成される。
テルビナフィンの爪への浸透
以下の実験1〜10は、本発明のテルビナフィン製剤が、受動的送達および電流の影響によって爪へのテルビナフィンの送達を容易にすることを確認するために行った。実験はまた、電流を用いた、本発明の製剤からのテルビナフィンの爪への改善された送達を確認するために設計した。
以下の実験1〜10は、本発明のテルビナフィン製剤が、受動的送達および電流の影響によって爪へのテルビナフィンの送達を容易にすることを確認するために行った。実験はまた、電流を用いた、本発明の製剤からのテルビナフィンの爪への改善された送達を確認するために設計した。
実験1−能動的イオン導入法を用いる本発明の局面による、テルビナフィン製剤からのテルビナフィンのインビトロ浸透実験
フランツ型セルを用いて、本発明の製剤からのテルビナフィンの爪への浸透を確認するために、インビトロ浸透実験を行った。テルビナフィン塩酸塩(1%)、Pluronic 127(20%)、および二回脱イオン水(79.0%)を含む製剤を用いた。ブタの爪を用いて、グラファイト送達電極および銀/塩化銀対電極による動力イオン導入装置を用いて、電流100μA/cm2の影響下で、テルビナフィンがMICを上回る量で爪に送達されたことが見いだされた。
フランツ型セルを用いて、本発明の製剤からのテルビナフィンの爪への浸透を確認するために、インビトロ浸透実験を行った。テルビナフィン塩酸塩(1%)、Pluronic 127(20%)、および二回脱イオン水(79.0%)を含む製剤を用いた。ブタの爪を用いて、グラファイト送達電極および銀/塩化銀対電極による動力イオン導入装置を用いて、電流100μA/cm2の影響下で、テルビナフィンがMICを上回る量で爪に送達されたことが見いだされた。
実験2−能動的イオン導入法を用いる本発明の局面による、テルビナフィン製剤からのテルビナフィンのインビトロ浸透試験
フランツ型セルを用いて、本発明の製剤からのテルビナフィンの爪への浸透を確認するために、インビトロ浸透実験を行った。テルビナフィン塩酸塩(1%)、Pluronic 127(25%)、メチルパラベン(0.3%)、Sharonmix MTG(0.1%)、および二回脱イオン水(73.6%)を含む製剤を用いた。ブタの爪を用いて、グラファイト送達電極および銀/塩化銀対電極による動力イオン導入装置を用いて、電流100μA/cm2の影響下で、テルビナフィンがMICを上回る量で爪に送達されたことが見いだされた。
フランツ型セルを用いて、本発明の製剤からのテルビナフィンの爪への浸透を確認するために、インビトロ浸透実験を行った。テルビナフィン塩酸塩(1%)、Pluronic 127(25%)、メチルパラベン(0.3%)、Sharonmix MTG(0.1%)、および二回脱イオン水(73.6%)を含む製剤を用いた。ブタの爪を用いて、グラファイト送達電極および銀/塩化銀対電極による動力イオン導入装置を用いて、電流100μA/cm2の影響下で、テルビナフィンがMICを上回る量で爪に送達されたことが見いだされた。
実験3−受動的送達(局所的適用)を用いる本発明の局面による、テルビナフィン製剤のインビトロ浸透試験
フランツ型セルを用いた本発明の製剤から爪へのテルビナフィンの受動的送達による浸透を確認するために、インビトロ浸透実験を行った。テルビナフィン塩酸塩(1%)、Pluronic 127(25%)、メチルパラベン(0.3%)、Sharonmix MTG(0.1%)、および二回脱イオン水(73.6%)を含む製剤を用いた。ブタの爪を用いて、テルビナフィンがMICを上回る量で爪に送達されたことが見いだされた。
フランツ型セルを用いた本発明の製剤から爪へのテルビナフィンの受動的送達による浸透を確認するために、インビトロ浸透実験を行った。テルビナフィン塩酸塩(1%)、Pluronic 127(25%)、メチルパラベン(0.3%)、Sharonmix MTG(0.1%)、および二回脱イオン水(73.6%)を含む製剤を用いた。ブタの爪を用いて、テルビナフィンがMICを上回る量で爪に送達されたことが見いだされた。
実験4−能動的イオン導入法と比較して局所送達を用いる、本発明のテルビナフィン製剤からのテルビナフィンのインビトロ浸透の比較
ブタの爪へのテルビナフィンのインビトロ送達を、テルビナフィン塩酸塩(1%)、Pluronic 127(25%)、メチルパラベン(0.3%)、Sharonmix MTG(0.1%)、および二回脱イオン水(73.6%)を含む製剤から、電流を加えずに受動的に、またはグラファイト送達電極および銀/塩化銀対電極による動力イオン導入装置を用いて、電流100μA/cm2の影響下で測定した。電流を用いて(能動的イオン導入法)爪に送達されるテルビナフィンの量が、受動的送達を用いて爪に送達されるテルビナフィンの量の1.5倍を上回ったことが観察された。
ブタの爪へのテルビナフィンのインビトロ送達を、テルビナフィン塩酸塩(1%)、Pluronic 127(25%)、メチルパラベン(0.3%)、Sharonmix MTG(0.1%)、および二回脱イオン水(73.6%)を含む製剤から、電流を加えずに受動的に、またはグラファイト送達電極および銀/塩化銀対電極による動力イオン導入装置を用いて、電流100μA/cm2の影響下で測定した。電流を用いて(能動的イオン導入法)爪に送達されるテルビナフィンの量が、受動的送達を用いて爪に送達されるテルビナフィンの量の1.5倍を上回ったことが観察された。
実験5−本発明のテルビナフィン製剤から爪床へのテルビナフィンの送達の決定
テルビナフィン製剤を本明細書において詳述されるように調製した。製剤をスクリーニングするためのモデルとしてブタの蹄を用いた。屠殺後数時間以内にブタの脚から組織を採取して、12ヶ月間以内の期間、蹄を凍結保存した。爪を保持するように特別に設計されたNeoflon爪アダプターによって、フランツ型拡散セルを用いてインビトロ送達試験を行った。いくつかの爪をそれぞれの試験(能動的)群または対照(受動的)群において用いた。
テルビナフィン製剤を本明細書において詳述されるように調製した。製剤をスクリーニングするためのモデルとしてブタの蹄を用いた。屠殺後数時間以内にブタの脚から組織を採取して、12ヶ月間以内の期間、蹄を凍結保存した。爪を保持するように特別に設計されたNeoflon爪アダプターによって、フランツ型拡散セルを用いてインビトロ送達試験を行った。いくつかの爪をそれぞれの試験(能動的)群または対照(受動的)群において用いた。
各送達の前に、実験用の爪を二回蒸留水(DDW)に24時間液浸して、完全に水和させた。それぞれの爪をアダプターに取り付けて、外部背側表面を薬物製剤に対して露出して、内部腹側表面を受容区画においてリン酸緩衝生理食塩液(PBS)溶液(5 ml)に接触させた。取り付けた爪を実験時に37℃でインキュベートした。500μlアリコートの製剤を、爪の露出した投与領域に適用した後、蒸発を回避するために密封した。
各能動的セルにおいて、Ag/AgCl陰極電極を受容チャンバーに挿入して、グラファイト電極をドナーチャンバーにおいて固定した。一定の直流を印加するために電源を用いた。薬物製剤をドナー区画に入れた。試料0.1 mlを特定の間隔で受容区画から引き出して、テルビナフィンの量をHPLCによって測定した。受動的実験(電流を印加しない)も同様に、能動的実験と比較するために行った。それぞれの実験の終了時、製剤をドナー区画から除去した。受容区画からPBS溶液を収集して、爪をHPLC分析のために収集した。爪を洗浄して、投与領域を小片に切断して、DDWと共に平均で16時間インキュベートした。HPLC分析の前に、テルビナフィンは爪から溶出した。
テルビナフィン製剤を爪の表面に1回限り24時間適用した。次に、製剤をドナー区画から除去して、電流を加えずにセルをさらなる120時間組み立てたままにした。試料(100μl)を受容区画(時間=0)から採取した。さらなる試料を0時間から48時間目に受容区画から採取した。実験の終了時(0時間から120時間目)、セルを分解して、受容区画(爪床)から爪およびPBS溶液をHPLC分析のために収集した。爪および受容区画の緩衝剤におけるテルビナフィンの量をHPLCによって測定した。
別の実験において、テルビナフィン製剤を爪の表面に24時間間隔で1日1回、全体で72時間適用した。24時間インキュベートした後、製剤をドナー区画から除去して爪を洗浄した。次に、「新しい」製剤をドナー区画にさらなる24時間加えた。爪を製剤と共に48時間インキュベートした後、試料(100μl)を受容区画(爪床)から採取した。次に、72時間インキュベートした後、受容区画から採取した爪、製剤、およびPBSをHPLC分析のために収集した。
実験6
爪板および爪床(受容区画)へのテルビナフィン浸透(1重量%NaClと共に製剤化した1%テルビナフィン)に及ぼす電流密度の増加の効果を、実験5において記述される方法を用いて調べた。100から500μA/cm2へと増加させた電流密度を印加して、受容区画の試料採取を48時間後および72時間後に行った。爪の試料採取を72時間後に行った。対照実験には、受動拡散セル(電流を用いない)を用いる同じ製剤の送達が含まれた。
爪板および爪床(受容区画)へのテルビナフィン浸透(1重量%NaClと共に製剤化した1%テルビナフィン)に及ぼす電流密度の増加の効果を、実験5において記述される方法を用いて調べた。100から500μA/cm2へと増加させた電流密度を印加して、受容区画の試料採取を48時間後および72時間後に行った。爪の試料採取を72時間後に行った。対照実験には、受動拡散セル(電流を用いない)を用いる同じ製剤の送達が含まれた。
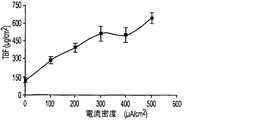
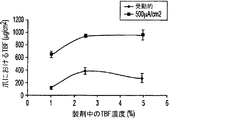
受容区画(爪床)において、テルビナフィン含有量の有意な増加が、受動群と比較して能動群(400および500μA/cm2)で記録され、図3において示されるように高い電流密度に限って薬物が爪のより深い層および爪床に浸透していることを示唆している。
爪において、図4において示されるように、受動群と比較して、テルビナフィン含有量の有意な増加がそれぞれの能動群(100、200、300、400、および500μA/cm2)のあいだで記録された。
実験7
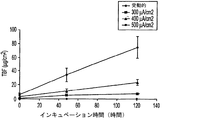
テルビナフィンの爪から爪床への拡散を薬物の1回投与後に調べた。爪を、1%テルビナフィン塩酸塩および1重量%NaClを含有する製剤と共に、電流密度300、400、または500μA/cm2において24時間インキュベートした。対照実験には、受動(電流を加えない)拡散セルを用いる同じ製剤の送達が含まれた。実験5において先に記述したように、24時間後にドナー区画から製剤を除去して、セルを電流を加えずにさらなる120時間組み立てたままとした。爪および受容区画(爪床同等物)におけるテルビナフィン含有量(μg/cm2)を図5に示す。示されているように、製剤と共に24時間インキュベートした直後では、ごく低い量のテルビナフィンが全ての試験群の受容区画において検出された。二種類の追加期間、48時間および120時間拡散させた後では、薬物含有量の増加は、400および500μA/cm2のより高い電流密度に限って記録された。受動的対照セルにおいて、テルビナフィンは、いずれの時点でも受容区画において検出されなかった。
テルビナフィンの爪から爪床への拡散を薬物の1回投与後に調べた。爪を、1%テルビナフィン塩酸塩および1重量%NaClを含有する製剤と共に、電流密度300、400、または500μA/cm2において24時間インキュベートした。対照実験には、受動(電流を加えない)拡散セルを用いる同じ製剤の送達が含まれた。実験5において先に記述したように、24時間後にドナー区画から製剤を除去して、セルを電流を加えずにさらなる120時間組み立てたままとした。爪および受容区画(爪床同等物)におけるテルビナフィン含有量(μg/cm2)を図5に示す。示されているように、製剤と共に24時間インキュベートした直後では、ごく低い量のテルビナフィンが全ての試験群の受容区画において検出された。二種類の追加期間、48時間および120時間拡散させた後では、薬物含有量の増加は、400および500μA/cm2のより高い電流密度に限って記録された。受動的対照セルにおいて、テルビナフィンは、いずれの時点でも受容区画において検出されなかった。
実験8
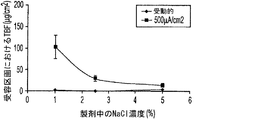
NaCl濃度の増加が1%または2.5%テルビナフィン塩酸塩の送達に及ぼす効果を調べた。一つの電流密度500μA/cm2を72時間印加した。対照として、受動群を電流を加えずに同じ条件で調べた。1%テルビナフィン塩酸塩の製剤において、NaCl濃度を1%〜2.5%または5%まで増加させても、能動群または受動群における爪および受容区画への薬物送達は増加しなかった。2.5%テルビナフィン塩酸塩を含有する製剤において、NaCl濃度を1%〜2.5%または5%まで増加させると、図6および7において示されるように、能動群における爪および受容区画への薬物送達を有意に阻害した。
NaCl濃度の増加が1%または2.5%テルビナフィン塩酸塩の送達に及ぼす効果を調べた。一つの電流密度500μA/cm2を72時間印加した。対照として、受動群を電流を加えずに同じ条件で調べた。1%テルビナフィン塩酸塩の製剤において、NaCl濃度を1%〜2.5%または5%まで増加させても、能動群または受動群における爪および受容区画への薬物送達は増加しなかった。2.5%テルビナフィン塩酸塩を含有する製剤において、NaCl濃度を1%〜2.5%または5%まで増加させると、図6および7において示されるように、能動群における爪および受容区画への薬物送達を有意に阻害した。
実験9
薬物濃度が、ブタの爪を通したテルビナフィン塩酸塩のイオン導入法による送達に及ぼす効果を調べた。異なる濃度のテルビナフィン塩酸塩(1%、2.5%、または5%)、および1%NaClを含有する異なる製剤を調製した。これらの実験において、一つの電流密度500μA/cm2を72時間印加した。対照として、電流を印加せずに受動群を同じ条件で調べた。製剤におけるテルビナフィンの濃度を1%〜2.5%または5%まで増加すると、図9において示されるように能動群の爪におけるテルビナフィン含有量が有意に増加した。受動群における増加は主に1%〜2.5%のあいだであった。爪における含有量の増加とは対照的にテルビナフィン含有量は、能動群の受容区画(爪床)において有意に減少した。受動群では、図8において示されるように受容区画におけるテルビナフィン含有量に差は記録されなかった。
薬物濃度が、ブタの爪を通したテルビナフィン塩酸塩のイオン導入法による送達に及ぼす効果を調べた。異なる濃度のテルビナフィン塩酸塩(1%、2.5%、または5%)、および1%NaClを含有する異なる製剤を調製した。これらの実験において、一つの電流密度500μA/cm2を72時間印加した。対照として、電流を印加せずに受動群を同じ条件で調べた。製剤におけるテルビナフィンの濃度を1%〜2.5%または5%まで増加すると、図9において示されるように能動群の爪におけるテルビナフィン含有量が有意に増加した。受動群における増加は主に1%〜2.5%のあいだであった。爪における含有量の増加とは対照的にテルビナフィン含有量は、能動群の受容区画(爪床)において有意に減少した。受動群では、図8において示されるように受容区画におけるテルビナフィン含有量に差は記録されなかった。
実験10
尿素が、爪板および爪床の双方におけるテルビナフィン塩酸塩の浸透を増強することができるか否かに関して調べた。ブタの爪を1%テルビナフィン、1%NaCl、20%尿素を含有する製剤と共に72時間インキュベートした。尿素を含まない同じ製剤を用いて対照実験を行った。双方の製剤を、500μA/cm2の電流密度で調べた。製剤における20%尿素の存在は、対照群と比較して受容区画における薬物の含有量を有意に減少させた。尿素を有するまたは有しない二つの群のあいだで、爪における薬物含有量に差はなかった。
尿素が、爪板および爪床の双方におけるテルビナフィン塩酸塩の浸透を増強することができるか否かに関して調べた。ブタの爪を1%テルビナフィン、1%NaCl、20%尿素を含有する製剤と共に72時間インキュベートした。尿素を含まない同じ製剤を用いて対照実験を行った。双方の製剤を、500μA/cm2の電流密度で調べた。製剤における20%尿素の存在は、対照群と比較して受容区画における薬物の含有量を有意に減少させた。尿素を有するまたは有しない二つの群のあいだで、爪における薬物含有量に差はなかった。
ここで、上記の説明と共に、本発明を非限定的に説明する以下の実施例を参照されたい。
製剤のpHは2.98であり、伝導度は1315マイクロジーメンス/cmであった。
メチルパラベンを加熱しながら水に溶解した。混合物を撹拌した後、水性混合物を0℃〜約4℃まで冷却した。Pluronic 127およびSharonmix MTGを加えて、乳化剤が完全に溶解するまで撹拌した。テルビナフィン塩酸塩を透明な液体溶液に加えて、混合物を、完全に溶解するまで冷却しながら撹拌した。得られた組成物は、pH約3.0〜約4.0を有した。テルビナフィンはこのpH範囲で正電荷を帯びている。
メチルパラベンを加熱しながら水に溶解した。混合物を撹拌した後、水性混合物を0℃〜約4℃まで冷却した。Pluronic 127およびSharonmix MTGを加えて、乳化剤が完全に溶解するまで撹拌した。次に、ノノキシノール-9、酢酸、および酢酸ナトリウムを加えて、完全に溶解するまで撹拌した。テルビナフィン塩基を透明な液体溶液に加えて、混合物を、完全に溶解するまで冷却しながら撹拌した。得られた組成物は、pH約3.0〜約4.0を有した。テルビナフィンはこのpH範囲で正電荷を帯びている。
テルビナフィン塩基を酢酸とエトキシジグリコールの混合物に溶解した。次にこの混合物を撹拌しながら水に溶解した。次に、酢酸ナトリウムを加えて、撹拌しながら溶解した。混合物を40℃まで加熱しながら撹拌した。次に、ヒドロキシエチルセルロースを透明な液体溶液に加えて、完全に溶解してゲル化するまで、混合物を冷却しながら撹拌した。ゲルを撹拌して室温まで冷却した。得られた組成物はpH約3.0〜約4.5を有した。テルビナフィンはこのpH範囲で正電荷を帯びている。
テルビナフィン塩酸塩を酢酸とオレイン酸ポリグリセリル-10の混合物に溶解した。次にこの混合物を撹拌しながら水に溶解した。その後酢酸ナトリウムを加えて、撹拌しながら溶解した。混合物を40℃まで加熱しながら撹拌した。次に、ヒドロキシエチルセルロースおよびメチルセルロースを透明な液体溶液に加えて、完全に溶解してゲル化するまで、混合物を冷却しながら撹拌した。ゲルを撹拌して室温まで冷却した。得られた組成物はpH約3.0〜約4.5を有した。テルビナフィンはこのpH範囲で正電荷を帯びている。
製剤を、イオン導入法による送達、および実験5において詳述した方法を用いて爪床への浸透に関して試験した。1回処置の後、テルビナフィンは、約74μg/cm2を上回る量で爪床に送達されることが見いだされた。
製剤を、イオン導入法による送達、および実験5において詳述した方法を用いて爪床への浸透に関して試験した。1回処置の後、テルビナフィンは、約30μg/cm2を上回る量で爪床に送達されることが見いだされた。
実施例13
実施例9からの製剤を、ハイドロゲルの上に滴下することによって、ハイドロゲルと混合した。
実施例9からの製剤を、ハイドロゲルの上に滴下することによって、ハイドロゲルと混合した。
実施例14
実施例10からの製剤を、ハイドロゲルの上に滴下することによって、ハイドロゲルと混合した。
実施例10からの製剤を、ハイドロゲルの上に滴下することによって、ハイドロゲルと混合した。
テルビナフィン塩基を酢酸と混合して、酢酸テルビナフィン溶液を形成した。
実施例16
実施例15において作出した組成物を、テルビナフィン塩基の最終濃度が5.5%となるように、ハイドロゲル上に滴下することによって、ハイドロゲルと混合した。
実施例15において作出した組成物を、テルビナフィン塩基の最終濃度が5.5%となるように、ハイドロゲル上に滴下することによって、ハイドロゲルと混合した。
本発明は、背景技術のテルビナフィン組成物における欠陥を克服し、本発明のテルビナフィン製剤は、イオン導入法による最適な送達のため、爪床への送達の改善のため、および爪真菌症の処置の改善のために、形成される。
当業者は、本発明の局面の広い技術を多様な型で実行することができることを前述の記述から認識することができる。したがって、本発明の局面を、その特定の実施例に結びつけて記述してきたが、明細書および添付の特許請求の範囲を検討することによって、当業者に他の改変が明らかとなるであろうことから、本発明の局面の真の範囲はそれに限定されるべきではない。
Claims (39)
- テルビナフィン化合物、水、および少なくとも一種類の水溶性または水混和性の非イオン性界面活性剤を含む薬学的組成物であって、該テルビナフィン化合物が、遊離塩基型、酸付加塩型、イオン型、およびそれらの組み合わせからなる群より選択される少なくとも一つの型を有し、かつアルコールが実質的に存在しない、薬学的組成物。
- 少なくとも一種類の水溶性非イオン性界面活性剤が、ポリオキシエチレン-ポリオキシプロピレンコポリマーを含む、請求項1記載の薬学的組成物。
- 活性剤がイオン型のテルビナフィンを含む、請求項1記載の薬学的組成物。
- 約0.1%テルビナフィン〜約2%テルビナフィンを含む、請求項1記載の薬学的組成物。
- 約0.5%テルビナフィン〜約1.0%テルビナフィンを含む、請求項1記載の薬学的組成物。
- ゲルである、請求項1記載の薬学的組成物。
- 真菌感染症の局所的処置のためのテルビナフィン化合物の有効量を含む、請求項1記載の薬学的組成物。
- イオン導入法による皮膚および/または爪への送達のためのテルビナフィン化合物の有効量を含む、請求項1記載の薬学的組成物。
- 爪真菌症の処置のためのテルビナフィン化合物の有効量を含む、請求項1記載の薬学的組成物。
- イオン導入装置および体の領域に対して適用する前のpHが4より大きく、かつ適用時のpHが4未満である、請求項1記載の薬学的組成物。
- 適用前のpHが約4以下である、請求項1記載の薬学的組成物。
- 約1%以下のNaClまたはKClを含む少なくとも一種類の伝導度増強剤をさらに含む、請求項1記載の薬学的組成物。
- ゲル化剤、緩衝剤、pH調整剤、浸透増強剤、保存剤、および薬学的賦形剤の少なくとも一つをさらに含む、請求項1記載の薬学的組成物。
- 製剤の伝導度が3.0 mSi/cmを上回る、請求項1記載の薬学的組成物。
- 酢酸をさらに含む、請求項1記載の薬学的組成物。
- テルビナフィン化合物約2 mg未満を含む、非経口送達のための請求項1記載の薬学的組成物。
- 請求項1記載の薬学的組成物の治療的有効量を投与する段階を含む、真菌感染症を処置する方法。
- 薬学的組成物の投与がイオン導入法による、請求項17記載の方法。
- 薬学的組成物が約1時間〜約24時間投与される、請求項18記載の方法。
- 薬学的組成物が終夜投与される、請求項18記載の方法。
- 電流密度が約300μA/cm2を上回る電流が製剤に印加される、請求項18記載の方法。
- 0.05 mgより多く100 mg未満のテルビナフィンが体に適用される、請求項18記載の方法。
- 以下の段階を含む、爪の真菌感染症を処置する方法:
爪および/または周囲領域に接触させたイオン導入送達装置を適用すること;
イオン導入送達装置に接触している抗真菌薬を爪および/または周囲領域に送達すること;
処置時間の終了時に装置を除去すること
を含む処置によって爪を処置する段階;
抗真菌薬によって爪が飽和またはほぼ飽和するまで前記処置を複数回繰り返す段階;ならびに
爪の飽和後、その後のさらなる処置の前に待機時間を経過させる段階。 - 抗真菌薬の一部が爪床に拡散する時間に応じて待機時間が決定される、請求項23記載の方法。
- 請求項1記載の薬学的組成物を含むイオン導入装置を含む、爪真菌症を処置するための装置。
- 薬学的組成物がテルビナフィン2 mg未満を含む、請求項25記載の装置。
- イオン導入装置および請求項1記載の薬学的組成物を含む、爪真菌症を処置するためのキット。
- テルビナフィン化合物を含む薬学的組成物であって、該テルビナフィン化合物が、イオン導入法による送達用に形成された遊離塩基型、酸付加塩型、イオン型、およびそれらの組み合わせからなる群より選択される少なくとも一つの型を有し、イオン導入装置および体の領域に適用する前の該組成物のpHが4より大きく、かつ適用時のpHが4未満である、薬学的組成物。
- テルビナフィン塩基およびテルビナフィンイオン、水、ならびに非イオン性界面活性剤を含む、爪真菌症を処置するための薬学的組成物。
- テルビナフィン塩酸塩が実質的に存在しない、請求項29記載の薬学的組成物。
- テルビナフィンと酢酸との塩。
- 酢酸テルビナフィンである、請求項31記載の塩。
- テルビナフィンと酢酸との反応生成物から形成された塩を含む、請求項31記載の塩。
- 遊離のテルビナフィン塩基と酢酸とを反応させることによって塩が調製される、請求項31記載の化合物を調製するための方法。
- インサイチューで酢酸を形成して、形成された酢酸をテルビナフィン塩基と反応させることによって、塩が調製される、請求項34記載の方法。
- 酢酸が電気発生によってインサイチューで調製される、請求項35記載の方法。
- 請求項31記載のテルビナフィン塩と少なくとも一種類の溶媒とを含む薬学的組成物。
- 水、酢酸、および少なくとも一種類の水溶性または水混和性の非イオン性界面活性剤を含む、請求項37記載の薬学的組成物。
- 真菌感染症を処置するための薬剤の調製における請求項31記載の化合物の使用。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US90234607P | 2007-02-21 | 2007-02-21 | |
| PCT/IL2008/000218 WO2008102349A2 (en) | 2007-02-21 | 2008-02-20 | Terbinafine formulation for iontophoresis |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010519288A true JP2010519288A (ja) | 2010-06-03 |
| JP2010519288A5 JP2010519288A5 (ja) | 2011-04-07 |
Family
ID=39590146
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009550768A Pending JP2010519288A (ja) | 2007-02-21 | 2008-02-20 | イオン導入法のためのテルビナフィン製剤 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20100168233A1 (ja) |
| EP (1) | EP2120870A2 (ja) |
| JP (1) | JP2010519288A (ja) |
| CN (1) | CN101677953A (ja) |
| WO (1) | WO2008102349A2 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101652124A (zh) | 2007-02-05 | 2010-02-17 | 亲生物有限公司 | 烯丙胺药物化合物的增加的效力 |
| ES2369101B2 (es) * | 2010-05-07 | 2012-08-02 | Universidade De Santiago De Compostela | Sistema farmacéutico acuoso para la administración de fármacos en las uñas. |
| US11793783B2 (en) | 2015-08-05 | 2023-10-24 | Cmpd Licensing, Llc | Compositions and methods for treating an infection |
| US11173163B2 (en) * | 2015-08-05 | 2021-11-16 | Cmpd Licensing, Llc | Topical antimicrobial compositions and methods of formulating the same |
| US11684567B2 (en) | 2015-08-05 | 2023-06-27 | Cmpd Licensing, Llc | Compositions and methods for treating an infection |
| WO2019135123A1 (en) * | 2018-01-02 | 2019-07-11 | Nal Pharmaceutical Group Limited | Liquid dosage form for topical application |
| IT201800003557A1 (it) * | 2018-03-14 | 2019-09-14 | Kolfarma S R L | Preparazione farmaceutica o di integratore alimentare a base di alfa-lattoalbumina |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05132419A (ja) * | 1991-05-20 | 1993-05-28 | Sandoz Ag | 医薬組成物 |
| JPH05148136A (ja) * | 1991-05-23 | 1993-06-15 | Sandoz Ag | 医薬組成物 |
| WO2005004980A1 (en) * | 2003-07-14 | 2005-01-20 | Power Paper Ltd. | Method, apparatus, and kit for onychomycosis treatment using electrokinetic transport of substances |
| WO2006103638A2 (en) * | 2005-03-31 | 2006-10-05 | Ranbaxy Laboratories Limited | Topical pharmaceutical compositions of terbinafine and processes for their preparation |
| JP2007501832A (ja) * | 2003-08-12 | 2007-02-01 | ノバルテイス・コンシユーマー・ヘルス・エス・アー | テルビナフィンおよびヒドロコルチゾンを含んでいる局所組成物 |
| JP2007534764A (ja) * | 2004-04-27 | 2007-11-29 | ニムニ、マーセル | 抗真菌薬物送達 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US238672A (en) * | 1881-03-08 | Child s-carriage top |
-
2008
- 2008-02-20 EP EP08710218A patent/EP2120870A2/en not_active Withdrawn
- 2008-02-20 US US12/528,023 patent/US20100168233A1/en not_active Abandoned
- 2008-02-20 JP JP2009550768A patent/JP2010519288A/ja active Pending
- 2008-02-20 WO PCT/IL2008/000218 patent/WO2008102349A2/en active Application Filing
- 2008-02-20 CN CN200880009192A patent/CN101677953A/zh active Pending
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05132419A (ja) * | 1991-05-20 | 1993-05-28 | Sandoz Ag | 医薬組成物 |
| JPH05148136A (ja) * | 1991-05-23 | 1993-06-15 | Sandoz Ag | 医薬組成物 |
| WO2005004980A1 (en) * | 2003-07-14 | 2005-01-20 | Power Paper Ltd. | Method, apparatus, and kit for onychomycosis treatment using electrokinetic transport of substances |
| JP2007501832A (ja) * | 2003-08-12 | 2007-02-01 | ノバルテイス・コンシユーマー・ヘルス・エス・アー | テルビナフィンおよびヒドロコルチゾンを含んでいる局所組成物 |
| JP2007534764A (ja) * | 2004-04-27 | 2007-11-29 | ニムニ、マーセル | 抗真菌薬物送達 |
| WO2006103638A2 (en) * | 2005-03-31 | 2006-10-05 | Ranbaxy Laboratories Limited | Topical pharmaceutical compositions of terbinafine and processes for their preparation |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2008102349A3 (en) | 2008-11-06 |
| EP2120870A2 (en) | 2009-11-25 |
| WO2008102349A2 (en) | 2008-08-28 |
| US20100168233A1 (en) | 2010-07-01 |
| CN101677953A (zh) | 2010-03-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7647100B2 (en) | Method, apparatus, and kit for onychomycosis treatment | |
| EP2853274B1 (en) | Compositions and methods for treating diseases of the nail | |
| EP1858503B1 (en) | Topical gels compositions | |
| US8889155B2 (en) | Gel composition for treating mycosis | |
| US20080261986A1 (en) | Pharmaceutical formulations for iontophoretic delivery of an anti-fungal drug | |
| JP2010519288A (ja) | イオン導入法のためのテルビナフィン製剤 | |
| Sachdeva et al. | Transdermal iontophoretic delivery of terbinafine hydrochloride: quantitation of drug levels in stratum corneum and underlying skin | |
| JP2009542657A (ja) | ゲルの形態でのロピニロール含有薬学的組成物、その使用 | |
| US20070053984A1 (en) | Topical gels compositions | |
| US7795309B2 (en) | Topical formulation including diclofenac, or a pharmaceutically acceptable salt thereof | |
| KR101333892B1 (ko) | 항진균 조성물 | |
| JP2007534764A (ja) | 抗真菌薬物送達 | |
| JP3981074B2 (ja) | オルニチンデカルボキシラーゼインヒビターの毛包輸送のための局所用組成物 | |
| RU2371179C2 (ru) | Чрескожное введение соединений пиперазинил-2 (3н)-бензоксазолона посредством электрофореза | |
| KR101799008B1 (ko) | 케라틴 조직의 진균감염증 치료를 위한 약제학적 조성물 | |
| JP2011503222A (ja) | イオン導入による爪疾患の処置のためのアモロルフィンの使用 | |
| EP3284484A1 (en) | Transdermal preparation containing antifungal active material | |
| US20140343159A1 (en) | Formulation of small adrenergic agonist salt forms in organic solvents | |
| US11154542B2 (en) | Nail lacquer composition containing ciclopirox | |
| WO2021249288A1 (zh) | 伏立康唑外用制剂及其制备方法 | |
| US20160175334A1 (en) | Antifungal combination therapy of tavaborole and ciclopirox | |
| US20110066134A1 (en) | Controlling Drug Transport and Current in Iontophoretic Onychomycosis Treatment | |
| US20080221212A1 (en) | Topical formulation | |
| JP2017226618A (ja) | リュープロレリンの経皮吸収型製剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110217 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110217 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130124 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130620 |