JP2008520348A - 易損性プラークの処置 - Google Patents
易損性プラークの処置 Download PDFInfo
- Publication number
- JP2008520348A JP2008520348A JP2007543076A JP2007543076A JP2008520348A JP 2008520348 A JP2008520348 A JP 2008520348A JP 2007543076 A JP2007543076 A JP 2007543076A JP 2007543076 A JP2007543076 A JP 2007543076A JP 2008520348 A JP2008520348 A JP 2008520348A
- Authority
- JP
- Japan
- Prior art keywords
- treatment agent
- vulnerable plaque
- balloon
- blood vessel
- kit
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000004204 blood vessel Anatomy 0.000 claims abstract description 56
- 150000001875 compounds Chemical class 0.000 claims abstract description 21
- 239000000203 mixture Substances 0.000 claims abstract description 17
- 239000003795 chemical substances by application Substances 0.000 claims description 70
- 238000000034 method Methods 0.000 claims description 27
- 239000003431 cross linking reagent Substances 0.000 claims description 21
- 239000003814 drug Substances 0.000 claims description 18
- 229940079593 drug Drugs 0.000 claims description 14
- 238000004132 cross linking Methods 0.000 claims description 9
- 239000000463 material Substances 0.000 claims description 9
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 claims description 8
- AZKVWQKMDGGDSV-BCMRRPTOSA-N Genipin Chemical compound COC(=O)C1=CO[C@@H](O)[C@@H]2C(CO)=CC[C@H]12 AZKVWQKMDGGDSV-BCMRRPTOSA-N 0.000 claims description 7
- 229920002684 Sepharose Polymers 0.000 claims description 7
- AZKVWQKMDGGDSV-UHFFFAOYSA-N genipin Natural products COC(=O)C1=COC(O)C2C(CO)=CCC12 AZKVWQKMDGGDSV-UHFFFAOYSA-N 0.000 claims description 7
- UWFRVQVNYNPBEF-UHFFFAOYSA-N 1-(2,4-dimethylphenyl)propan-1-one Chemical compound CCC(=O)C1=CC=C(C)C=C1C UWFRVQVNYNPBEF-UHFFFAOYSA-N 0.000 claims description 6
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 claims description 6
- 239000000126 substance Substances 0.000 claims description 6
- 239000012530 fluid Substances 0.000 claims description 5
- 230000009969 flowable effect Effects 0.000 claims description 4
- 229940124597 therapeutic agent Drugs 0.000 claims description 4
- 238000004891 communication Methods 0.000 claims description 2
- 230000000903 blocking effect Effects 0.000 claims 1
- 238000001802 infusion Methods 0.000 description 33
- 239000011162 core material Substances 0.000 description 24
- 238000002347 injection Methods 0.000 description 11
- 239000007924 injection Substances 0.000 description 11
- 210000001789 adipocyte Anatomy 0.000 description 8
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical group OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 8
- 210000004027 cell Anatomy 0.000 description 5
- 229920000295 expanded polytetrafluoroethylene Polymers 0.000 description 5
- 238000003384 imaging method Methods 0.000 description 5
- 230000017531 blood circulation Effects 0.000 description 4
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 4
- 210000004351 coronary vessel Anatomy 0.000 description 4
- 150000002632 lipids Chemical class 0.000 description 4
- 210000002540 macrophage Anatomy 0.000 description 4
- 210000001616 monocyte Anatomy 0.000 description 4
- 238000012014 optical coherence tomography Methods 0.000 description 4
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 4
- 229960004889 salicylic acid Drugs 0.000 description 4
- 230000001732 thrombotic effect Effects 0.000 description 4
- 241001631457 Cannula Species 0.000 description 3
- 239000004971 Cross linker Substances 0.000 description 3
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 3
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 3
- 210000001367 artery Anatomy 0.000 description 3
- 238000009792 diffusion process Methods 0.000 description 3
- 238000002608 intravascular ultrasound Methods 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 238000011144 upstream manufacturing Methods 0.000 description 3
- 208000037260 Atherosclerotic Plaque Diseases 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 239000004952 Polyamide Substances 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 150000001840 cholesterol esters Chemical class 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 229920001971 elastomer Polymers 0.000 description 2
- 239000000806 elastomer Substances 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 229930014626 natural product Natural products 0.000 description 2
- 229920002647 polyamide Polymers 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- AOBIOSPNXBMOAT-UHFFFAOYSA-N 2-[2-(oxiran-2-ylmethoxy)ethoxymethyl]oxirane Chemical compound C1OC1COCCOCC1CO1 AOBIOSPNXBMOAT-UHFFFAOYSA-N 0.000 description 1
- 208000004476 Acute Coronary Syndrome Diseases 0.000 description 1
- 101100098918 Arabidopsis thaliana TFCA gene Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 229920002614 Polyether block amide Polymers 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 229910021607 Silver chloride Inorganic materials 0.000 description 1
- 239000002390 adhesive tape Substances 0.000 description 1
- 210000003484 anatomy Anatomy 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- FACXGONDLDSNOE-UHFFFAOYSA-N buta-1,3-diene;styrene Chemical compound C=CC=C.C=CC1=CC=CC=C1.C=CC1=CC=CC=C1 FACXGONDLDSNOE-UHFFFAOYSA-N 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000001687 destabilization Effects 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 210000001105 femoral artery Anatomy 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 239000000834 fixative Substances 0.000 description 1
- 210000000497 foam cell Anatomy 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 238000009434 installation Methods 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- -1 polyepoxy Chemical compound 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 210000002321 radial artery Anatomy 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- HKZLPVFGJNLROG-UHFFFAOYSA-M silver monochloride Chemical compound [Cl-].[Ag+] HKZLPVFGJNLROG-UHFFFAOYSA-M 0.000 description 1
- 229920000468 styrene butadiene styrene block copolymer Polymers 0.000 description 1
- 230000002885 thrombogenetic effect Effects 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000012281 transfemoral cerebral angiography Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/11—Aldehydes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/336—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having three-membered rings, e.g. oxirane, fumagillin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/729—Agar; Agarose; Agaropectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Vascular Medicine (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Urology & Nephrology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Media Introduction/Drainage Providing Device (AREA)
- Surgical Instruments (AREA)
- Materials For Medical Uses (AREA)
Abstract
易損性プラークを含む処置部位に血管内の経内腔経路を介して処置デバイスを導入するステップ、易損性プラークの内容物の特性を修正する傾向のある特性を有する化合物を含む処置薬剤を投薬するステップを含む。易損性プラークの内容物の特性を修正することのできる特性を有する第1の処置薬剤、および異なる第2の処置薬剤を含むキット。易損性プラークの内容物の移動度を修正することのできる処置薬剤を、カテーテルを通して血管の中に投薬するのに適した形態と濃度で含む組成。
Description
本発明は経内腔治療のデバイス、構成、および方法に関する。
Thin−capped fibroatheroma(「TFCA」)すなわち易損性プラークは、動脈などの血管の内側で発現することがあるアテローム硬化性プラークに関する。通常の易損性プラークは脂質、コレステロール結晶、コレステロールエステルで満たされた芯、マクロファージ、その他の細胞を含む。芯は薄い線維性のキャップ(0.05ミリメートル(mm)から0.10mmの厚さ)を有する。この線維性のキャップは脆弱化して破裂することがある。破裂すると、管腔の血液が易損性プラークの芯からの高度に血栓形成性の物質に晒され、これが結果として血管の全体的な血栓性閉塞につながることもある。
易損性プラークの破裂する傾向が、マクロファージに由来する泡沫細胞によって大部分が合成されるマトリクス・メタロプロテナーゼ(「MMP」)の活性に関連するという証拠が増えている。特に、MMPは線維性キャップ構造の完全性の重要な供給源であるタイプIおよびIIIのコラーゲンなどの細胞外マトリクスタンパク質を分解することが見込まれる。したがって、通常ではプラーク内の単球付着の結果である慢性および/または局所性の炎症が易損性プラークの不安定化と(血栓症を経由した)急性の冠不全症候群につながることもある。
以下の方式で易損性プラークが形成されると研究者達は考えている。脂肪小滴が血管(例えば動脈)によって吸収され、これが、炎症につながるサイトカイン(タンパク質)の放出を引き起こす。サイトカインは動脈壁を粘着性にし、これが単球(免疫系細胞)を引き寄せる。単球は動脈壁の中に押し入る。いったん内部に入ると、単球はマクロファージ(細胞)へと変わり、脂肪小滴を吸収し始める。脂肪で満たされたマクロフォージは薄い被膜を備えたプラークを形成する。
光コヒーレンス・トモグラフィ(「OCT」)や血管内超音波検査法(「IVUS」)などの映像技術の進歩は易損性プラークを識別する機会を提供する。しかしながら、易損性プラークを処置する(例えば除去する、固定する、新形態にする)ための効果的な方法に関するニーズが存在する。
方法が開示される。一実施態様では、この方法は、易損性プラークを含む処置部位に血管内の経内腔経路を介して処置デバイスを導入するステップと、易損性プラークの内容物の特性を修正する傾向のある特性を有する化合物を含む処置薬剤を投薬するステップとを含む。易損性プラークの内容物の代表的な特性は移動度を含む。適切な化合物は線維性キャップの芯の中に移動(例えば拡散)して芯内物質(例えば脂質)を架橋させ、芯内物質を高度に血栓性からほぼ非血栓性へと変える架橋剤として作用することが可能な化合物を含む。
別の態様では、キットが開示される。一実施態様では、キットは易損性プラークの内容物の特性を修正することのできる特性を有する第1の処置薬剤、易損性プラークの内容物と第1の処置薬剤の架橋を加速する薬剤などの第2の処置薬剤を含む。別の実施態様では、キットは、血管を行き来するのに適したカテーテルであって外側からアクセス可能な患者の箇所から血管内の処置部位における設置に適した長さ寸法を有するカテーテルを含む。第1の処置薬剤および/または第2の処置薬剤が易損性プラークを含む処置部位にカテーテルを通して導入されて易損性プラークを修正することが可能である。
別の態様では、組成が開示される。この組成は易損性プラークの内容物の移動度を修正することのできる処置薬剤を、カテーテルを通して血管の中に投薬するのに適した形態と濃度で含む。易損性プラークの内容物の移動度を修正することのできる処置薬剤の例は架橋用薬剤を含む。
さらなる態様では、システムが述べられる。一実施態様では、システムは、易損性プラークの芯を修正する特性を有する架橋用薬剤を含む第1の流動可能な物質を収容したリザーバと、第1のリザーバ内の第1の流動可能な物質と流体連絡した管腔およびカニューレの遠端部分を通過させる開口となっている遠端部分を有するカニューレとを有するシステムを含む。
図1は冠状動脈などの血管の断面図を示している。血管100はこれを通る内腔105を形成する血管壁110を有する。血管100の内腔105の中に易損性プラーク120が形成されている。易損性プラーク120は線維性キャップ140で囲まれた芯130を有する。未変更状態の芯130は脂質、コレステロール結晶、コレステロールエステル、マクロファージ、その他の細胞を含む。未処置状態の芯内物質130は高度に血栓性であり、線維性キャップ140だけで血栓性物質の放出を阻止している。
図2は易損性プラーク120の芯内物質の修正の後の血管100を示している。一実施形態では、芯内物質を固定するための組成が易損性プラーク120の中に導入される。典型的には、芯内物質は、架橋用薬剤を易損性プラーク120内へ導入することによって固定される。或る意味では架橋用薬剤は2つ以上の分子または細胞を連結する薬剤である。一実施形態では、本願明細書に述べられる架橋用薬剤はこれらが易損性プラークの芯内物質を架橋させるような形態で導入される。或る意味では架橋用薬剤は易損性プラーク120内部で連結された脂肪細胞のネットワークを形成する。この方式では、易損性プラーク120の芯内物質は実質的に、支配的に、または全体的に不動にされ、したがって血栓形成性が下がる。図2は修正された(固定された)芯内物質230を有する易損性プラーク120を示している。
一実施形態では、易損性プラークの芯内物質を架橋させるために適した薬剤はグルタルアルデヒドである。他の適切な化合物はポリエポキシである。適切なポリエポキシの例はエチレングリコールジグリシジルエーテルである。エチレングリコールジグリシジルエーテルは日本国兵庫県龍野市にあるNagase Chemtex CorporationのDENACAL EX−810(商標)として市販入手可能である。別の実施形態では、適切な架橋用薬剤は天然化合物のゲニピンである。別の実施形態では、架橋用薬剤はCNBrで活性化したセファロースである。言及された薬剤または化合物の各々が単独または組合せで使用されることもある。
一実施形態では、架橋用薬剤は液体の形で血管の中に導入され、易損性プラークの中に拡散または移動する機会を与えられるかまたはそのようにさせられる。この方式では、易損性プラークの線維性キャップは乱されない。したがって、一実施形態では、(複数の)架橋用薬剤が易損性プラークの線維性キャップを通って拡散または移動できるように(複数の)架橋用薬剤は分子サイズである。
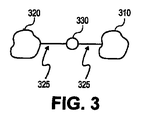
図3は架橋事象の表現を示している。図3は易損性プラークの芯内物質中に存在するであろう脂肪細胞310と脂肪細胞320を示している。この実施形態では、脂肪細胞310と脂肪細胞320は共有結合接続などによって架橋剤330に接続される。一実施形態では、架橋剤330はグルタルアルデヒド、ポリエポキシ、ゲニピン、CNBrで活性化したセファロースから選択される。理論によって束縛される意図はないが、芯内物質の脂肪細胞は化学結合に利用可能な表面アミン基を有すると考えられる。したがって、言及された架橋用薬剤のうちの1つは、様々な脂肪細胞のアミン基間に形成される共有結合325を通して脂肪細胞を架橋させる。架橋の事象は易損性プラークの中で起こるので、易損性プラークを含む血管の内腔が架橋の事象によって塞がれることはない。
上記で参照した架橋用薬剤の各々は架橋の事象を達成または誘発させることができる。処置薬剤の各々は架橋可能なモノマーまたはポリマーを随伴せずに供給されることが可能であり、したがって架橋用薬剤の全部または大部分の量は易損性プラークの芯の物質を架橋させるために利用可能である。
易損性プラークの芯内物質の固定化時間または固着化時間を上げるために、加速剤が導入されてもよい。適切な加速剤としてサリチル酸が挙げられる。サリチル酸は、特にアルカリ性のpHで投与されると、言及された架橋用薬剤の反応時間(例えば易損性プラーク組織を固定するための時間)を高めることが可能である。好ましいpH範囲は10から12のオーダーである。加速剤としてのサリチル酸の典型的な量は固着化薬剤に対して加速剤0.1パーセントから1パーセントのオーダーである。
加速剤は、架橋用薬剤の導入の前または後などのように別々に易損性プラークの中に導入されることも、または(混合物などのように)架橋用薬剤と同時に導入されることも可能である。一実施形態では、架橋用薬剤と加速剤の混合物は、導入の前の混合物の見込まれる架橋を最少限にするために血管への導入の前の現場の時間に調製されてもよい。
加速剤に加えて、追加の治療用化合物が場合によって、または追加的に易損性プラークの中に導入されてもよい。典型的には、治療用化合物は易損性プラークが成長するのを阻害する化合物を含む。例は酵素阻害剤と細胞毒性薬剤である。
一実施形態では、易損性プラークの中への導入のための処置薬剤、加速剤、いずれかの他の治療用化合物の組合せがキットとして提供される。典型的には、キットは処置薬剤(架橋用薬剤)、加速剤、別のいずれかの、場合によって使用される治療用薬剤各々の別々の量を含む。この(これらの)薬剤や加速剤は血管内への直接注入に適した形態と投薬量である。使用説明書が(複数の)処置薬剤または処置薬剤および/または加速剤の組合せの注入に提供されることになるであろう。別の実施形態では、キットは血管に処置薬剤を供給するためのカテーテル・アセンブリを含んでもよい。
図4は血管の中に処置薬剤を導入するために適したカテーテル・アセンブリの実施形態の側面図を示している。この実施形態では、カテーテル・アセンブリ400は血管などの身体の管腔の中への挿入のための遠位部分410と、カテーテル・アセンブリ400が使用中であるときに患者の外側に残るように意図された部分420を有する。カテーテル・アセンブリ400は近位部分420から遠位部分410を通して延びる主カニューレまたは管状部材425を有する。一実施形態では、主カニューレ425はカテーテル・アセンブリ400が経皮的に大腿動脈または橈骨動脈に挿入され、かつ冠状動脈(例えば左冠状動脈、左下行前動脈、右冠状動脈など)へと進められることを可能にするような長さを有する。
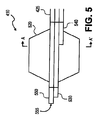
一実施形態では、カテーテル・アセンブリ400は3つのカニューレ(3つの管腔シャフト)を収容できる。図5はカテーテル・アセンブリ400の遠位部分410の拡大図を例示している。図6は図5の線A−A’を通るカテーテル・アセンブリの断面を示している。図5、図6を参照すると、3つのカニューレまたは管状部材が主カニューレ425の管腔の中に示されている。これらのカニューレはガイドワイヤ・カニューレ530、膨張カニューレ540、注入カニューレ550を含む。各々のカニューレがこれを通る管腔を有する。
図5はまた、主カニューレ425に接続されたバルーン520も示している。バルーン520は膨張した状態で示されている。バルーン520は膨張カニューレ540によって膨張させられる。膨張カニューレ540は近位部分420から主カニューレ425を通って延び、バルーン520の中で遠端終結する。一実施形態では、バルーン520はつぶれた構造から望ましくかつ制御された膨張構造へと拡張するように膨張カニューレ540によって選択的に膨張可能である。所定の圧力の程度で流体(例えば液体)を膨張カニューレ540の管腔の中に供給することによってバルーン520を選択的に膨張させることができる。同様に、バルーン520はつぶれた構造または収縮した形状に戻るように選択的に収縮可能である。
バルーン520は、限定はされないがポリオレフィン、ポリアミド、ポリエステルなどのポリマーやコポリマーを含めた様々な材料から作られる。使用される特定の材料は膨張用または拡張用流体に適合すべきであり、バルーン520の中で展開される圧力に耐えることが可能でなければならない。1つの適切な材料はPEBAX 63D(商標)、縮合重合したポリエーテルブロック重合ポリアミドなどのエラストマー系ナイロンである。
バルーン520の壁は、最適性能を達成するために重大な特性を損なわない限り、どのような厚さを有することも可能である。関連する特性は、限定はされないが高い破裂強度、低い伸展性、良好な可撓性、疲労に対する高い抵抗力、折り畳み能力、所望の関心対象領域に交差し再交差する能力、取り扱いによって引き起こされる欠陥に対する低い感受性である。限定ではないが例を挙げると、バルーン壁の適切な厚さは0.0005インチ(約0.0127mm)から0.002インチ(0.0508mm)であり、特定の仕様は検討事項の中でもとりわけバルーン520が挿入される標的の管腔の生体構造やサイズによって決まる。
上記で言及したように、カテーテル・アセンブリ400は主カニューレ425の少なくとも一部分を通して配置されたガイドワイヤ・カニューレ530もやはり含む。ガイドワイヤ・カニューレ530はガイドワイヤ(図示せず)を通してカテーテル・アセンブリ400を供給し、操作できるようにする。一実施形態では、ガイドワイヤ・カニューレ530は、カテーテル・アセンブリ400の近位部分420から遠位部分410へ主カニューレ425の長さ延びる。典型的には、通常の手順において、ガイドワイヤが最初に生理学的管腔(例えば血管)内の関心対象の領域を通って設置され、ガイド・カテーテルを通してカテーテル・アセンブリ400がワイヤ越え(OTH)方式で関心対象領域へ、またはその領域を通ってガイドワイヤ上を進められる。別の実施形態では、カテーテル・アセンブリ400は迅速交換(RX)型カテーテル・アセンブリであり、カテーテル・アセンブリ400の一部分(遠位部分)のみがガイドワイヤ上で進められる。迅速交換カテーテルでは、通常ではガイドワイヤ・カニューレ/管腔はカテーテルの遠端部から、カテーテルの近端部から遠端方向に間隔を置かれた近位ガイドワイヤ・ポートへと延びる。近位ガイドワイヤ・ポートは通常ではカテーテルの近端部から大幅な距離を置かれている。
やはり上記で述べられたように、主カニューレ425は注入カニューレ550を含む。注入カニューレ550は近位部分420からカテーテル・アセンブリ400の遠位部分410を通って延びる。この実施形態では、注入カニューレ550はバルーン520の遠位部分を越えて延び、注入または投薬ポートとなる。
注入ポート555はバルーン520に対して遠位の位置を有する。例示された実施形態では、注入ポート555はカテーテルの最遠端部である。他の実施形態(図示せず)では、注入ポート555は、カテーテル・シャフトの側壁における1つまたは複数の側方ポートである。この方式では、易損性プラークに沿った血流を塞ぐためにバルーン520が血管内で経線方向に隣接し、かつ易損性プラークの下流または上流のどちらかに置かれる。バルーン520は易損性プラークを処置(例えば修正、固定など)する手順の中で血管を塞ぐため、および血流を最少にするために使用される。図4〜6に示された実施形態では、易損性プラークに沿った流れを塞ぐためにバルーン520が易損性プラークの上流に置かれる。次いで、処置薬剤が注入ポート555を通して血管の中に導入される。
図4〜6に示された実施形態では、ガイドワイヤ・カニューレ530と膨張カニューレ540の各々がバルーン520を越えて延びている。膨張カニューレ540の管腔を通る処置薬剤の注入の間にガイドワイヤが定位置にあってもなくてもよいことは理解できるであろう。別の実施形態では、別になった注入カニューレを有するのではなくガイドワイヤ・カニューレがガイドワイヤのために使用されるとともに処置薬剤に管腔を提供するために使用されてもよい。典型的には、図4〜6に示されたアセンブリにおいて、カテーテル・アセンブリ400はガイドワイヤを使用して関心対象の領域に設置される。設置の後、ガイドワイヤが取り外され、ガイドワイヤ・カニューレ530の管腔を通して処置薬剤を供給するために処置薬剤供給源(リザーバ)がガイドワイヤ・カニューレ530の近端部に接続される。
再び図4に示された実施形態を参照すると、カテーテル・アセンブリ400の近位部分420は膨張カニューレ540の中に液体を導入するためのインデフレータ440を有する。一実施形態では、インデフレータ440は所定の圧力の程度でバルーン520を膨張させるために膨張用流体をカニューレ540の管腔の中に導入する。図4は注入カニューレ550の管腔の中に処置薬剤を導入することができるインデフレータ450もやはり示している。一実施形態では、インデフレータ450は処置薬剤の所定の量が注入カニューレ550の管腔の中、したがって処置部位に導入されることが可能になるように制御された量のインデフレータである。図4はインデフレータ450に接続されることが可能ないくつかのリザーバを例示している。リザーバ460は、例えば、グルタルアルデヒド、ポリエポキシ、天然化合物(例えばゲニピン)、または活性化セファロースなどの処置薬剤を含む。場合によって使用されるリザーバ470はサリチル酸などの加速剤を含む。場合によって使用されるリザーバ480は架橋用薬剤以外の治療用薬剤を含む。複数の薬剤が複数のリザーバから供給される一実施形態では、これらのリザーバは順々にインデフレータ450に接続される。
図4に示された実施形態では、インデフレータ440は主カニューレ425に相対して分岐して側方の位置で示されている。別の実施形態では、注入カニューレ550とインデフレータ450に類似して、インデフレータ440と膨張カニューレ540の近位部分は主カニューレ425と同軸に配置される。
図4、図5、図6に関して述べられた実施形態では、カテーテル・アセンブリ400は処置部位の近くの位置(例えば易損性プラークに近くの位置)で血管を塞ぐことを少なくとも1つの目的として有するバルーンを含む。この方式では、注入カニューレ550とポート555はバルーンの遠端部を越えて遠位に延ばされる。別の実施形態では、閉塞用バルーンなどの閉塞用機構を(例えば半径方向に隣接する)処置部位(例えば易損性プラーク)に設置することが望ましい。この実施形態では、処置薬剤はこの閉塞用機構を通して導入されるであろう。
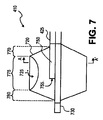
図7、図8はカテーテル・アセンブリ400の遠位部分410の代替の実施形態を示しており、バルーン内部に多孔性部分と注入ポートを有するバルーンを含む。図7は主カニューレ425に接続されたバルーン720を示している。ガイドワイヤ・カニューレ730がバルーン720の遠端部を越えて延びている。注入カニューレ750はバルーン720の内部で注入ポート755で終結している。この実施形態では、処置薬剤は注入カニューレ750の近端部に導入され、注入カニューレ750の管腔を通ってバルーンを膨張させ、それと同様に、バルーン720の多孔性部分を通って易損性プラークへと移動する。処置薬剤がバルーン720を膨張させるために使用されるので、別の膨張カニューレ/管腔は不必要である。代替の実施形態では、カテーテル・アセンブリが注入カニューレと膨張カニューレを有してもよい。
一実施形態では、バルーン720は多孔性部分725を含む。この実施形態では、バルーン720は主カニューレ425に接続された近位の裾770、中間の機能長さ775、遠位に延びるガイドワイヤ・カニューレ730に接続された遠位の裾780もやはり有する。一実施形態では、多孔性部分725はバルーン720の膨張可能部分全体よりも小さい部分を形作っている。一実施形態の多孔性部分725は、例えば、バルーン720の円周の周囲で部分的に延びるのみである。図8は図7の線A−A’を通る断面を示しており、バルーン720の円周の周囲で部分的に延びる多孔性部分725を例示している。一実施形態では、多孔性部分725はバルーン720の機能長さ(例えば中間の機能長さ775の長さ)に延び、易損性プラークの長さに応じて8ミリメートル(mm)から28mmの長さの範囲にわたる。別の実施形態では、多孔性部分725はバルーン720の円周の周囲で部分的に延びるのみであり、バルーン720の中間の機能長さ775の長さよりも少ない長さに延びる。
多孔性のバルーン、または多孔性部分を有するバルーンは膨張ポリテトラフルオロエチレン(ePTFE)から作られることもある。ePTFEの多孔性部分を有するバルーンは5ミクロン(μm)から40μmのオーダーのサイズで作られる。部分的多孔質ePTFEバルーンを形成するための1つの方式は所望の多孔性部分をスコッチテープなどの粘着テープでマスクし、バルーンの残りの部分をスチレン−ブタジエン−スチレンエラストマー、シリコーン−ポリウレタンコポリマー、ポリウレタンなどのエラストマー系ポリマーで含浸することによる。多孔性部分を有する非ePTFEバルーンを形成するための別の方式は機械的または化学的手段を介してバルーン表面に25から250マイクロメートルの範囲にわたる多数の穴を作り出すことである。
上述の実施形態では、バルーン720を膨張させるために注入カニューレ750がバルーン720の内側に処置薬剤を供給する。処置薬剤はバルーン720の多孔性部分725の孔隙を通ってバルーン720から移動する。他の構造もやはり可能であることは理解されるであろう。例えば、カテーテル・アセンブリは別になった膨張カニューレと注入カニューレを有し、膨張カニューレが第1のバルーンの中に延び、注入カニューレが第1のバルーン上に配置された第2のバルーンの中に延びることもある。この方式では、第1のバルーンが血管の少なくとも一部分を塞ぐために使用されてもよく、血管を部分的に塞ぐためや、処置薬剤を供給するために第2のバルーンが役立ってもよい。別の実施形態では、単一の注入カニューレによって2つのバルーンが使用され供給されることもある。注入カニューレは多孔性である(微細孔を有する)第1のバルーンの中に延び、処置薬剤が第1のバルーンの内側から第1のバルーンの上の第2のバルーンの内側へ移動させる。第2のバルーンは処置薬剤が第2のバルーンの内側から移動できるようにやはり多孔性の部分を有する。この構成の1つの利点は、第1の内側バルーンから来ることが見込まれる処置薬剤の考えられる圧力流からの血管に対する防護効果を第2のバルーンが提供することである。
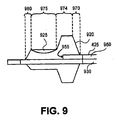
図7、図8に関して述べられた実施形態では、バルーンはその機能長さの一部分が易損性プラークの線維性キャップにあるかまたはこれに沿うように置かれる。線維性キャップに接触しないように、またはバルーンが膨張させられるときの線維性への接触圧力を最少限にするように注意が必要である。図9はカテーテル・アセンブリ400の遠位部分410の代替の実施形態を示しており、バルーンの中に多孔性部分を有し、かつ注入ポートを有するバルーンを含む。図9は主カニューレ425へ接続されたバルーン920を示している。ガイドワイヤ・カニューレ930がバルーン920の遠端部を越えて延びている。注入カニューレ950の遠端部はバルーン920の内部で注入ポート955で終結している。処置薬剤は注入カニューレ950の近端部に導入され、注入カニューレ950を通り、注入ポート955を通ってバルーン920を膨張させることが可能である。
図9に例示された実施形態では、バルーン920は主カニューレ425へ接続された近位の裾970とガイドワイヤ・カニューレ930へ接続された遠位の裾980を含む。バルーン920はまた、近位の裾970と遠位の裾980へそれぞれ接続された第1の中間機能長さ部分974と第2の中間機能長さ部分975も含む。膨張した状態では、第1の中間機能長さ部分974は第2の中間機能長さ部分975よりも大きい直径を有し、第2の中間機能長さ部分975よりも概してさらに弾性的である。第2の中間機能長さ部分975よりも大きい弾性を有する第1の中間機能長さ部分974を形成するための1つの方式は、第1の中間機能長さ部分974と第2の中間機能長さ部分975の両方を含む長さを有するバルーン920の概して非弾性の中間機能長さを形成し、次いで、第1の中間機能長さ部分974の中にエラストマーを含浸させることである。
一実施形態では、第1の中間機能長さ部分974は標的の血管の直径に膨張させられ、その一方で第2の中間機能長さ部分975は標的の血管の直径よりも小さい、好ましくは易損性プラークを有する血管の直径よりも小さい直径に膨張させられる。一実施形態では、カテーテル・アセンブリ400はバルーン920の第1の中間機能長さ部分974が易損性プラークの上流にあり、易損性プラークに接触することなく標的の血管を塞ぐように膨張させられるように設置される。
第1の中間機能長さ部分974は血流を塞ぐための構造的完全性を提供するのに適した長さ寸法を有する。典型的には、数ミリメートルのオーダーの長さで十分である。
バルーン920の第2の中間機能長さ部分975は、一実施形態では、易損性プラークの長さとほぼ同等の長さを有する。第2の中間機能長さ部分975に関する典型例の長さは8mmから28mmのオーダーである。第2の中間機能長さ部分975は、図7と図8およびそれに付随する文を参照して上述したようなバルーン720の多孔性部分725と同様の多孔性部分925を含む。多孔性部分925はバルーン920の円周の周囲に部分的に延びるのみであってもよく、第2の中間機能長さ部分975の全長に延びてもよい。注入カニューレ950を通して注入ポート955に供給される処置薬剤は第2の中間機能長さ部分975の多孔性部分925を通って移動することが可能であり、易損性プラークへと供給される。
血管の中の易損性プラークの場所を見つけるために様々な映像技術を使用することができる。そのような映像技術はOCTやIVUSなどの管腔内技術を含む。易損性プラークを有する処置部位がいったん識別されると、図4、図5、図6、または図4、図7、図8、または図4、図9に関して述べられたカテーテル・アセンブリなどのカテーテル・アセンブリが血管の中に導入される。
図10は中に易損性プラークを有する血管の断面の側面図と血管の中の処置デバイスを示している。典型的には、図4、図5、図6に関して上述したような処置デバイス400が処置部位に対して近位または易損性プラーク1060に対して近位の箇所の血管1000を塞ぐバルーン520を含む。次いで、処置薬剤がバルーン520に対して遠位の箇所で投薬ポート555を通して血管1000の中に注入される。処置薬剤は芯を修正するために易損性プラーク1060の薄い線維性キャップを通って移動または拡散する。
図11は中に易損性プラークを有する血管の断面の側面図と血管内に配置された処置デバイスの別の実施形態を示している。この実施形態では、処置デバイス400は例えば、図4、図7、図8と付随する文を参照して上述したアセンブリと同様のカテーテル・アセンブリである。処置デバイス410はバルーン720を含む。バルーン720は血管1100の中で膨張した状態で示されている。この実施形態では、バルーン720は易損性プラーク1160を含む処置部位で機能長さを伴なって位置決めされている。一実施形態では、バルーン720は(例えば4気圧未満または1気圧未満ですらある)低い圧力と制御された程度で膨張させられる。一実施形態では、バルーン720は易損性プラーク1160の内径未満であって好ましくは易損性プラーク1160に接触しない直径に膨張させられる。
この実施形態では、バルーン720はバルーン720の機能長さに沿って多孔性部分725を含む。例えば注入カニューレ755の注入ポート755はバルーン720の中に設置される。処置薬剤は注入ポート755を通して導入される。処置薬剤はバルーン720の多孔性部分を通って移動し、易損性プラーク1060の中へと移動または拡散することが可能である。
バルーン720の多孔性部分725がバルーン720の全周未満および/または機能長さ未満に延びる場合、多孔性部分を易損性プラーク1160に整列させる(位置決めする)ことが望ましい。そのような整列または位置決めのための1つの技法はカテーテル・アセンブリ400のガイドワイヤ・カニューレを通じたOCTデバイスなどの映像デバイスの設置を含む。易損性プラーク1160はこの映像デバイスで識別されることが可能であり、バルーン720の多孔性部分725が易損性プラーク1160に整列する(位置決めされる)ようにバルーン720が回され、または位置決めされる。
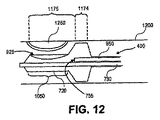
図12は中に易損性プラークを有する血管の断面の側面図と血管の中の処置デバイスを示している。典型的には、図4、図9に関して上述したような処置デバイス400が、第1の中間機能長さ部分974と第2の中間機能長さ部分975を含むバルーン920を有する。第2の中間機能長さ部分975は易損性プラークに沿って設置され、第1の中間機能長さ部分は易損性プラーク1260に近位方向で隣接して設置される。バルーン920は注入カニューレ950の注入ポート955を通して供給される処置薬剤で膨張させられる。第1の中間機能長さ弾性部分974は血管1200の内壁に接触するように、または血流を遮断するように膨張し、その一方でバルーン920の第2の中間機能長さ部分975は易損性プラーク1260に接触するかまたは損傷を与えるのに少なくとも有意に十分ではない程度まで有意に膨張しないであろう。注入ポート955を通して導入される処置薬剤はバルーン920の多孔性部分925を通って移動し、易損性プラーク1260の中へと移動または拡散することが可能である。
別の実施形態では、例えば図11や図12で述べられた実施形態による易損性プラークの中への処置薬剤の移動または拡散が助成される。典型的な助成技術は、限定はされないが電気輸送技術を含む。例えば、バルーン720の下/上の選択された周波数、振幅、デューティ・サイクル、波形を備えた圧電マイクロチップが動脈壁の検出された易損性プラークの表面の周囲で超音波周波数を発射することで易損性プラークの中への処置薬剤の拡散を容易にすることができる。易損性プラークの中への処置薬剤の拡散を容易にするための別の方式は、多孔性のバルーンの下で銀/塩化銀電極を使用するなどのイオン導入法による。処置薬剤をバルーンの外に出して易損性プラークの中へと駆動するための電位がバルーンの中に作られる。
上記の実施形態では、外部で易損性プラークの中に処置薬剤を導入するためのデバイスと技法が述べられている。処置薬剤が様々な他の手段で導入されることが可能であることは理解されるであろう。典型的には、処置薬剤は例えば針カテーテルを使用して易損性プラークの中に注射される。このケースでの懸案事項は注射で易損性プラークを破裂させることに付随すると見込まれる。そのような破裂を最少限にするための技術には、注射時にバルーンまたはステントで易損性プラークを支えるステップを含む。
前述の詳細な説明では、特定の実施形態を参照している。しかしながら、添付の特許請求の範囲のさらに広い精神と範囲から逸脱することなく様々な修正や変更がこれになされ得ることは明らかである。したがって、本明細書と図面は限定の意味ではなく具体的例示の意味に見なされるべきである。
Claims (49)
- 血管内で経内腔経路を介して易損性プラークを含む処置部位に処置デバイスを導入するステップと、
前記易損性プラークの内容物の特性を修正する特性を有する化合物を含む処置薬剤を投薬するステップとを含む方法。 - 前記易損性プラークの前記内容物の前記特性が移動度を含む請求項1に記載の方法。
- 前記化合物が前記易損性プラークの前記内容物のうちの少なくとも2つの成分を架橋させることのできる特性を有する請求項2に記載の方法。
- 前記化合物がグルタルアルデヒドを含む請求項2に記載の方法。
- 前記化合物がグルタルアルデヒドを含む請求項2に記載の方法。
- 前記ポリエポキシがエチレングリコールジグリシジルエーテルを含む請求項5に記載の方法。
- 前記化合物がゲニピンを含む請求項2に記載の方法。
- 前記化合物がCNBrで活性化したセファロースを含む請求項2に記載の方法。
- 前記処置薬剤が第1の処置薬剤を含み、前記方法が異なる第2の処置薬剤を投薬するステップをさらに含む請求項2に記載の方法。
- 前記第2の処置薬剤が前記易損性プラークの前記内容物の成分の架橋を加速する特性を有する請求項9に記載の方法。
- 投薬するステップの前に、前記処置部位に対して近位の部位で前記血管を塞ぐステップをさらに含む請求項1に記載の方法。
- 投薬するステップの前に、前記処置部位の部分で前記血管を塞ぐステップをさらに含む請求項1に記載の方法。
- 前記血管を塞ぐステップが、一部分が前記処置薬剤に対して多孔性である特性を有するバルーンを膨張させるステップを含む請求項12に記載の方法。
- 多孔性である前記バルーンの前記部分が前記バルーンの全体部分よりも小さく、前記方法がさらに、
多孔性である前記バルーンの前記部分を前記易損性プラークを含む前記血管の一部分と整列させるステップと、
前記バルーンを通して前記処置薬剤を投薬するステップとを含む請求項13に記載の方法。 - 易損性プラークの内容物の特性を修正することのできる特性を有する第1の処置薬剤と、
異なる第2の処置薬剤を含むキット。 - 前記易損性プラークの前記内容物の前記特性が移動度を含む請求項15に記載のキット。
- 前記第1の処置薬剤がグルタルアルデヒドを含む請求項16に記載のキット。
- 前記第1の処置薬剤がポリエポキシを含む請求項16に記載のキット。
- 前記ポリエポキシがエチレングリコールジグリシジルエーテルを含む請求項18に記載のキット。
- 前記第1の処置薬剤がゲニピンを含む請求項16に記載のキット。
- 前記第1の処置薬剤がCNBrで活性化したセファロースを含む請求項16に記載のキット。
- 前記第2の処置薬剤が前記易損性プラークの前記内容物の成分の架橋を加速する特性を有する請求項16に記載のキット。
- 血管を行き来するために適しており、体外でアクセス可能な患者の箇所から前記血管の中の処置部位に設置するために適した長さ寸法を有するカテーテルをさらに含む請求項15に記載のキット。
- 前記カテーテルが投薬用ポートと、前記投薬用ポートに対して近位の箇所で血管の一部分を塞ぐことのできる機構を有する請求項23に記載のキット。
- 前記カテーテルが処置部位で前記血管の一部分を塞ぐことのできる機構と、前記機構に投薬用ポートを有する請求項23に記載のキット。
- 前記機構が、前記処置薬剤に対して多孔質である特性を有する部分を含むバルーンを含む請求項25に記載のキット。
- 前記処置薬剤に対して多孔性である特性を有する前記バルーンの前記部分が全体部分よりも小さい請求項26に記載のキット。
- 易損性プラークの内容物の移動度を修正することのできる処置薬剤を、カテーテルを通して血管の中に投薬するのに適した形態と濃度で含む組成。
- 前記化合物が前記易損性プラークの前記内容物の成分を架橋させることのできる特性を有する請求項28に記載の組成。
- 前記化合物がグルタルアルデヒドを含む請求項28に記載の組成。
- 前記化合物がポリエポキシを含む請求項28に記載の組成。
- 前記ポリエポキシがエチレングリコールジグリシジルエーテルを含む請求項28に記載の組成。
- 前記化合物がゲニピンを含む請求項28に記載の組成。
- 前記化合物がCNBrで活性化したセファロースを含む請求項28に記載の組成。
- 前記処置薬剤が第1の処置薬剤であり、前記組成がさらに、異なる第2の処理薬剤を含む請求項28に記載の組成。
- 前記第2の処置薬剤が前記易損性プラークの前記内容物の成分の架橋を加速する特性を有する請求項35に記載の組成。
- 易損性プラークの芯を修正する特性を有する架橋用薬剤を含む第1の流動可能な物質を収容するリザーバと、
前記第1のリザーバ内の前記第1の流動可能な物質と流体連絡した管腔および遠端部分から外に出させる開口となっている遠端部分を有するカニューレとを含むシステム。 - 前記カニューレが血管を行き来するために適した寸法を有し、体外でアクセス可能な患者の箇所から前記血管の中の処置部位に設置するために適した長さ寸法を有する請求項37に記載のシステム。
- 前記易損性プラークの前記内容物の前記特性が移動度を含む請求項37に記載のシステム。
- 前記物質がグルタルアルデヒドを含む請求項39に記載のシステム。
- 前記物質がポリエポキシを含む請求項39に記載のシステム。
- 前記ポリエポキシがエチレングリコールジグリシジルエーテルを含む請求項41に記載のシステム。
- 前記物質がゲニピンを含む請求項39に記載のシステム。
- 前記物質がCNBrで活性化したセファロースを含む請求項39に記載のシステム。
- 前記遠端部分内に形成される開口に対して近位の箇所で前記カニューレに連結された血管の一部分を塞ぐことのできる機構をさらに含む請求項37に記載のシステム。
- 処置部位で血管の一部分を塞ぐことのできる機構であって、前記機構と前記遠端部分内に形成される前記開口が同一の広がりを有するように或る箇所で前記カニューレに連結された機構をさらに含む請求項37に記載のシステム。
- 前記機構が、前記処置薬剤に対して多孔性である特性を有する一部分を含むバルーンを含む請求項46に記載のシステム。
- 前記処置薬剤に対して多孔性である特性を有する前記バルーンの前記部分が前記バルーンの機能長さの部分を含む請求項47に記載のシステム。
- 開口が前記遠端部分の端部に形成される請求項37に記載のシステム。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/992,873 US7846147B2 (en) | 2004-11-18 | 2004-11-18 | Vulnerable plaque treatment |
| PCT/US2005/039026 WO2006055216A2 (en) | 2004-11-18 | 2005-10-28 | Vulnerable plaque treatment |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008520348A true JP2008520348A (ja) | 2008-06-19 |
| JP2008520348A5 JP2008520348A5 (ja) | 2008-12-11 |
Family
ID=36001058
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007543076A Pending JP2008520348A (ja) | 2004-11-18 | 2005-10-28 | 易損性プラークの処置 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US7846147B2 (ja) |
| EP (1) | EP1824465A2 (ja) |
| JP (1) | JP2008520348A (ja) |
| WO (1) | WO2006055216A2 (ja) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9687262B2 (en) | 2005-11-30 | 2017-06-27 | CARDINAL HEALTH SWITZERLAND 515 GmbH | Methods and devices for treating vulnerable plaque |
| US9144509B2 (en) | 2007-05-31 | 2015-09-29 | Abbott Cardiovascular Systems Inc. | Method and apparatus for delivering an agent to a kidney |
| US9364586B2 (en) | 2007-05-31 | 2016-06-14 | Abbott Cardiovascular Systems Inc. | Method and apparatus for improving delivery of an agent to a kidney |
| US9149610B2 (en) | 2007-05-31 | 2015-10-06 | Abbott Cardiovascular Systems Inc. | Method and apparatus for improving delivery of an agent to a kidney |
| US8216209B2 (en) | 2007-05-31 | 2012-07-10 | Abbott Cardiovascular Systems Inc. | Method and apparatus for delivering an agent to a kidney |
| US20110196383A1 (en) * | 2009-05-05 | 2011-08-11 | Atherolysis Medical, Inc | Atherosclerotic Plaque Dissolution Composition |
| WO2011044455A1 (en) * | 2009-10-09 | 2011-04-14 | Vatrix Medical, Inc. | In vivo chemical stabilization of vulnerable plaque |
| US9011513B2 (en) | 2012-05-09 | 2015-04-21 | Abbott Cardiovascular Systems Inc. | Catheter having hydraulic actuator |
| US20130304180A1 (en) * | 2012-05-09 | 2013-11-14 | Michael L. Green | Catheter having dual balloon hydraulic actuator |
| WO2014055514A2 (en) | 2012-10-01 | 2014-04-10 | C.R. Bard, Inc. | Balloon catheter having multiple inflation lumens and related methods |
| US10531971B2 (en) | 2013-03-12 | 2020-01-14 | Abbott Cardiovascular System Inc. | Balloon catheter having hydraulic actuator |
| US10420662B2 (en) | 2013-03-12 | 2019-09-24 | Abbott Cardiovascular Systems Inc. | Catheter having movable tubular structure and proximal stopper |
| US9283101B2 (en) | 2013-03-12 | 2016-03-15 | Abbott Cardiovascular Systems Inc. | Catheter having hydraulic actuator and locking system |
| DE102013104029A1 (de) | 2013-04-22 | 2014-10-23 | Innora Gmbh | Ballonkatheter |
| US20160175569A1 (en) * | 2014-12-22 | 2016-06-23 | Richard R. Heuser | Device for treating vascular occlusion |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001503299A (ja) * | 1996-11-05 | 2001-03-13 | チャレンジ バイオプロダクツ カンパニー,リミテッド | ジェニピンによる生物医学的材料の化学改変 |
| US20030065303A1 (en) * | 2001-09-28 | 2003-04-03 | Wellman Parris S. | Methods and devices for treating diseased blood vessels |
| JP2003521976A (ja) * | 1999-12-30 | 2003-07-22 | セント・ジュード・メディカル・インコーポレーテッド | 再狭窄を阻止する医療デバイス |
| US20040220607A1 (en) * | 2003-04-30 | 2004-11-04 | Donovan Maura G. | Method and systems for treating vulnerable plaque |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1538810A (en) * | 1976-08-10 | 1979-01-24 | Sumitomo Electric Industries | Hydrophilic porous fluorocarbon structures and process for their production |
| JP2678945B2 (ja) * | 1989-04-17 | 1997-11-19 | 有限会社ナイセム | 人工血管とその製造方法及び人工血管用基質 |
| US5213576A (en) * | 1991-06-11 | 1993-05-25 | Cordis Corporation | Therapeutic porous balloon catheter |
| JP3403233B2 (ja) * | 1994-01-20 | 2003-05-06 | テルモ株式会社 | バルーンカテーテル |
| DE69622764T2 (de) * | 1995-09-20 | 2003-04-24 | California Institute Of Technology, Pasadena | yNZEIGE VON THERMISCHEN UNSTETIGKEITEN AN GEFÄSSWÄNDEN |
| DE19610560A1 (de) * | 1996-03-18 | 1997-09-25 | Rainer Dipl Ing Kaufmann | Färbemittel, insbesondere Tinte oder Druckfarbe |
| US6624138B1 (en) * | 2001-09-27 | 2003-09-23 | Gp Medical | Drug-loaded biological material chemically treated with genipin |
| US6171787B1 (en) * | 1997-06-26 | 2001-01-09 | Abbott Laboratories | Member of the TNF family useful for treatment and diagnosis of disease |
| AU8913998A (en) * | 1997-08-28 | 1999-03-22 | Boston Scientific Corporation | System for implanting a cross-linked polysaccharide fiber and methods of formingand inserting the fiber |
| US6419659B1 (en) * | 2000-02-10 | 2002-07-16 | Medventure Technology Corp | Lipid pool aspiration arrangement for the treatment of vulnerable atherosclerosis plaque |
| US6395325B1 (en) * | 2000-05-16 | 2002-05-28 | Scimed Life Systems, Inc. | Porous membranes |
| US20030207271A1 (en) * | 2000-06-30 | 2003-11-06 | Holwitt Eric A. | Methods and compositions for biological sensors |
| US20050123583A1 (en) * | 2000-12-18 | 2005-06-09 | Hsing-Wen Sung | Medical use of reuterin |
| US7195640B2 (en) * | 2001-09-25 | 2007-03-27 | Cordis Corporation | Coated medical devices for the treatment of vulnerable plaque |
| WO2003053492A2 (en) * | 2001-11-27 | 2003-07-03 | Imetrx, Inc. | Expandable device to profile the wall of a hollow body organ |
| US20050019404A1 (en) * | 2003-06-30 | 2005-01-27 | Hsing-Wen Sung | Drug-eluting biodegradable stent |
| US7008411B1 (en) * | 2002-09-30 | 2006-03-07 | Advanced Cardiovascular Systems, Inc. | Method and apparatus for treating vulnerable plaque |
| US20040230156A1 (en) * | 2003-02-13 | 2004-11-18 | Schreck Stefan Georg | Methods and devices for in-situ crosslinking of vascular tissue |
-
2004
- 2004-11-18 US US10/992,873 patent/US7846147B2/en not_active Expired - Fee Related
-
2005
- 2005-10-28 JP JP2007543076A patent/JP2008520348A/ja active Pending
- 2005-10-28 WO PCT/US2005/039026 patent/WO2006055216A2/en active Application Filing
- 2005-10-28 EP EP05824338A patent/EP1824465A2/en not_active Withdrawn
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001503299A (ja) * | 1996-11-05 | 2001-03-13 | チャレンジ バイオプロダクツ カンパニー,リミテッド | ジェニピンによる生物医学的材料の化学改変 |
| JP2003521976A (ja) * | 1999-12-30 | 2003-07-22 | セント・ジュード・メディカル・インコーポレーテッド | 再狭窄を阻止する医療デバイス |
| US20030065303A1 (en) * | 2001-09-28 | 2003-04-03 | Wellman Parris S. | Methods and devices for treating diseased blood vessels |
| US20040220607A1 (en) * | 2003-04-30 | 2004-11-04 | Donovan Maura G. | Method and systems for treating vulnerable plaque |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1824465A2 (en) | 2007-08-29 |
| US20060106366A1 (en) | 2006-05-18 |
| US7846147B2 (en) | 2010-12-07 |
| WO2006055216A3 (en) | 2006-08-10 |
| WO2006055216A2 (en) | 2006-05-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2008520348A (ja) | 易損性プラークの処置 | |
| US6706013B1 (en) | Variable length drug delivery catheter | |
| US6547767B1 (en) | Syringe assembly for a catheter | |
| US7150738B2 (en) | Substance delivery apparatus and a method of delivering a therapeutic substance to an anatomical passageway | |
| JP4436761B2 (ja) | 薬剤放出用拡張性ポーションを備えた装置 | |
| JP4053882B2 (ja) | 注入穴を有するハイコンプライアントバルーンを備えた薬剤搬送カテーテル | |
| US9381326B2 (en) | Vascular occlusion and drug delivery devices, systems, and methods | |
| CN211584835U (zh) | 一种药物球囊导管 | |
| US20100152702A1 (en) | Method for delivering medication into an arterial wall for prevention of restenosis | |
| US20040260239A1 (en) | Catheter for tissue dilation and drug delivery | |
| US20100268191A1 (en) | Drug Delivery Catheter using Frangible Microcapsules and Delivery Method | |
| US20070270757A1 (en) | Needle array devices and methods | |
| JPH07504599A (ja) | 潤滑性カテーテル | |
| JPH037169A (ja) | 血管内薬物供給膨張カテーテル | |
| CN110548212B (zh) | 一种具有自灌注功能的双球囊导管 | |
| CN110548211B (zh) | 一种带封堵功能的药物球囊导管 | |
| CN113018660A (zh) | 一种用于介入给药的微针球囊 | |
| KR101230657B1 (ko) | 약물 전달용 필름이 제공된 풍선 카테터 | |
| US9409000B2 (en) | Balloon with fibers for treatment of blood vessels | |
| JP2004329552A (ja) | 薬液投与用カテーテル | |
| CN108553742B (zh) | 一种儿童肝移植静脉血管成形专用的非标准球囊扩张导管 | |
| CN219646516U (zh) | 一种双层球囊 | |
| JP3631777B2 (ja) | 薬剤投与カテーテル | |
| US20240216655A1 (en) | Double-balloon thrombolysis and thrombectomy device | |
| CN102553062B (zh) | 一种药物输送装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081021 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20081021 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110301 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110809 |