JP2008514376A - パーキンソン病のための経皮治療システム - Google Patents
パーキンソン病のための経皮治療システム Download PDFInfo
- Publication number
- JP2008514376A JP2008514376A JP2007534813A JP2007534813A JP2008514376A JP 2008514376 A JP2008514376 A JP 2008514376A JP 2007534813 A JP2007534813 A JP 2007534813A JP 2007534813 A JP2007534813 A JP 2007534813A JP 2008514376 A JP2008514376 A JP 2008514376A
- Authority
- JP
- Japan
- Prior art keywords
- max
- auc
- rotigotine
- parkinson
- disease
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
- A61K9/7038—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer
- A61K9/7046—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds
- A61K9/7069—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds obtained otherwise than by reactions only involving carbon to carbon unsaturated bonds, e.g. polysiloxane, polyesters, polyurethane, polyethylene oxide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/38—Heterocyclic compounds having sulfur as a ring hetero atom
- A61K31/381—Heterocyclic compounds having sulfur as a ring hetero atom having five-membered rings
Abstract
【選択図】図1
Description
発明の内容をより充分に記載するために種々の参考文献が本出願を通して引用されている。これらの参考文献は、全体で本願明細書に含まれるものとする。
発明の分野
本発明は、パーキンソン病又は下肢静止不能症候群の症状を治療又は改善するのに充分な量のロチゴチンを充分な速度で送達する皮膚貼付剤(経皮治療システム(TTS)としても知られる)に関する。
パーキンソン病は、黒質におけるドーパミン作動性ニューロンの変性によって引き起こされると考えられる。要するに、これにより、緊張性ドーパミン分泌の低下と尾状核におけるニューロン活性のドーパミン関連の変調、従って、或る脳領域におけるドーパミンの不足が生じる。神経伝達物質アセチルコリンとドーパミンから生じた平衡異常により、最終的に、疾患が関連した症状になる。通常運動系疾患とみなされるが、パーキンソン病は、現在、運動系と非運動系双方を含むより複雑な疾患であると考えられている。この衰弱性疾患は、震動、運動緩慢、硬直、運動障害、歩行障害及び言語障害を含む主要な臨床的特徴が確認される。ある患者において、これらの症状に痴呆が伴うことがある。自律神経系の関係は、起立性低血圧症、発作の潮紅、温度調節による問題、便秘、膀胱や括約筋制御の低下を生じることがある。意欲喪失やうつ病のような心理的疾患もパーキンソン病に伴うことがある。
パーキンソン病の臨床診断は、特徴的な身体的徴候、例えば、震動、骨格筋の硬直、運動緩慢、姿勢反射障害、歩行障害の存在に基づく。疾患は、発症が段階的で、遅い進行性で、臨床症状が可変であることが知られている。症状が起こる前の年齢を適合させた制御に見られるレベルより線条体のドーパミン含量が20%まで減少する証拠が示されている。
パーキンソン病の治療は、なかでも、L-ドーパによって試みられてきており、これはなおパーキンソン病の治療の標準的なものである。L-ドーパは、ドーパミンの前駆物質として血液脳関門を通過し、その後、脳においてドーパミンに変換される化合物である。L-ドーパは、パーキンソン病の症状を改善するが、重い副作用を引き起こすことがある。その上、薬剤は、治療の最初の2〜3年後にその有効性を失う傾向がある。5〜6年後には、L-ドーパ治療による患者の25%〜50%しか改善を維持しない。
上述したように、パーキンソン病の1つの治療方法は、ドーパミン受容体作用薬を含む。ドーパミン作用薬としばしば呼ばれるドーパミン受容体作用薬は、ドーパミンと構造的に異なるが、ドーパミン受容体に結合し且つドーパミンのそれに匹敵する作用の引き金となる。副作用が減少したことにより、物質が既知のドーパミン受容体サブタイプの1つ又はサブセットに選択的に結合又は相互作用する場合に有利である。現在、数種類の同定されたドーパミン受容体サブタイプがあり、D1、D2、D3受容体が最も良く確認されている。
パーキンソン病の症状を治療するために用いられてきた1つのドーパミン受容体作用薬は、ロチゴチン呼ばれる化合物である。ロチゴチンは、下記構造を有する(6S)-6-{プロピル[2-(2-チェニル)エチル]アミノ}-5,6,7,8-テトラヒドロ-1-ナフタレノール(CAS No. 99755-59-6)である。
国際出願第99/49852号に用いられるシリコーン貼付剤の薬剤含量はアクリレート貼付剤に用いられる薬剤含量より少なかったことは留意すべきである。しかしながら、このことは、公開されたPCT出願の実施例1及び2に用いられるそれぞれのポリマーシリコーン粘着剤とアクリレート粘着剤における単に薬剤放出容量の差を反映するだけである。アクリレート系はシリコーン系より薬剤を溶解することができるが、シリコーンは薬剤をより速く皮膚に放出させることができる。これらの2つの作用は相互に補償するので、国際出願第99/49852号に用いられるアクリレートとシリコーン系は、得られる薬剤血漿レベルにおいて、それ故、治療効力においてほとんど等価である。
ロチゴチンの投与によって、RLS症状が抑制及び減少することがわかる(米国特許出願公開公報第2004/0048779号、段落0012)。
このように、本発明は、パーキンソン病の症状を改善するのに有効な定常状態血漿濃度を達成する毎日投与の反復を可能にする治療用法を企図する。特に、本発明の方法は、連続ロチゴチン血漿レベルを生じ、これはパルス血漿レベルを生じる用法より有効な治療であり得る。
本発明の他の好ましい態様においては、製剤によって誘発されるロチゴチンのCmaxは、約0.20ng/mL〜約1.30ng/mL; 約0.30ng/mL〜約1.20ng/mL; 約0.14ng/mL〜約0.48ng/mL; 約0.37ng/mL〜約0.75ng/mL; 又は約0.84ng/mL〜約1.54ng/mLである。本発明の更に他の好ましい態様においては、誘発されたCmaxは、約0.31ng/mL; 約0.56ng/mL; 又は約1.19ng/mLである。
本発明の他の態様においては、ヒト患者においてパーキンソン病を治療するための方法であって、投与時に、約0.14ng/mL〜約1.54ng/mLのCmaxが得られ、AUC0-tが約3.3ng/mL*h〜約32.2ng/mL*hである、ロチゴチンを投与することを含む、前記方法が提供される。
一実施態様においては、本発明は、ヒト患者に経皮投与のための放出制御ロチゴチン製剤であって、前記ヒト患者の身体に適用される場所にかかわらず前記製剤が同じ薬物動態学的プロファイルを示す、前記製剤に関する。好適実施形態においては、患者は、パーキンソン病を罹患している。他の好ましい実施態様においては、患者は、下肢静止不能症候群を罹患している。
本発明の経皮治療システム(TTS)は、当該技術において既知である方法を用いて又は公開された米国特許出願第2003/0026830号、同第2003/0027793号及び米国特許第6,884,434号に記載されるように調製することができ、TTSの調製に関する開示は、本願明細書に全体で含まれるものとする。
実施態様においては、本発明のTTSは、1以上の層から構成されるレザバー又はマトリックス型経皮システムである。実施態様においては、更に、TTSには、裏打層及び使用前に除去されるライナ層が含まれる。
(1) その内側が好ましくはシリコン処理され且つ外側又は透明なポリエステルフィルム上に顔料層で被覆されたアルミニウムを施したポリエステルホイルからなる可撓性の裏打ち; 及び
(2) 活性成分ロチゴチン、アスコルビルパルミテート、dl-αトコフェロール、シリコーン粘着剤、ポビドン、及びメタ重亜硫酸ナトリウムを含む粘着性薬剤マトリックス層; 及び
(3) 透明なフルオロポリマー被覆ポリエステルフィルムを含む保護ライナ、ライナは適用前に除去される。
本発明の好ましいTTSは、約4〜約20mgのロチゴチン遊離塩基を含有することができる。好ましい実施態様においては、TTSは、約4.5mgのロチゴチン遊離塩基、約9mgのロチゴチン遊離塩基、約13.5mgのロチゴチン遊離塩基、又は約18mgのロチゴチン遊離塩基を含有する。他の好ましい実施態様においては、TTSは、5-25%(w/w)ロチゴチンを含有する。
本発明の好ましい実施態様においては、TTSは貼付剤の形である。貼付剤の放出表面積は、約10cm2〜約40cm2であってもよい。本発明の好ましい実施態様においては、貼付剤の放出表面積は、約10cm2、約20cm2、約30cm2又は約40cm2である。
本発明の好ましい実施態様は、以下の1つ以上: 薬学的に許容しうる担体(例えば、ポリビニルピロリドン)、重亜硫酸ナトリウム、アスコルビルパルミテート、DL-α-トコフェロール、アミン抵抗性高粘着性シリコーン粘着剤(例えば、BIO-PSA(登録商標) Q7-4301; Dow Corning)、アミン抵抗性中程度粘着性シリコーン粘着剤(例えば、BIO-PSA(登録商標) Q7-4201、Dow Corning)を含有するTTSを用いる。例えば、好ましい20cm2 貼付剤TTSは、表1に記載される量で成分を含有する。
上述の親水性ポリマーがポリビニルピロリドンである場合、ポリビニルピロリドンは不溶性粒子の形で活性物質含有マトリックス層に1.5 - 5%(w/w)の濃度で存在する。
好ましい一実施態様においては、本発明のTTSはパーキンソン病又は下肢静止不能症候群(RLS)を治療するために用いられる。本明細書に用いられる用語“治療”は、完全な治癒に至る真の原因となる治療より、パーキンソン病又はRLSの症状の治療又は改善を示すことを意味する。
A. 薬物動態
本発明の実施態様においては、製剤によって誘発されるロチゴチンのCmaxは、約0.20ng/mL〜約1.30ng/mL; 約0.30ng/mL〜約1.20ng/mL; 約0.14ng/mL〜約0.48ng/mL; 約0.37ng/mL〜約0.75ng/mL; 又は約0.84ng/mL〜約1.54ng/mLである。本発明の更に他の好ましい態様においては、誘発されたCmaxは、約0.31ng/mL; 約0.56ng/mL; 又は約1.19ng/mLである。
他の本発明の態様においては、時間“t”にわたる薬物動態学的プロファイルの誘発された曲線下の面積(“AUC0-t”)は、約4.0ng/mL*h〜約30.0ng/mL*h; 約5.0ng/mL*h〜約25.0ng/mL*h; 約3.3ng/mL*h〜約8.9ng/mL*h; 又は約15.2ng/mL*h〜約32.2ng/mL*hである。他の態様においては、誘発されたAUC0-tは、約6.1ng/mL*h; 約11.1ng/mL*h; 又は約23.7ng/mL*hである。
他の好ましい実施態様においては、TTSは、ヒトにおいてパーキンソン病を治療するための方法であって、投与時に、約0.14ng/mL〜約1.54ng/mLのCmaxを示し且つAUC0-tが約3.3ng/mL*h〜約32.2ng/mL*hであるロチゴチンを投与することを含む、前記方法に用いられる。
好ましい実施態様においては、本発明のTTSは、24時間にわたって2、4、6、又は8mgのロチゴチンを投与するために用いられる。ある種の実施態様においては、上述の用量を送達するために用いられるTTSは、適用時に、それぞれ4.5、9、13.5又は18mgのロチゴチンを含有する。
1日1回適用される場合、本発明のTTSは、持続し且つ相対的に安定なロチゴチン血漿レベルを生じる。図1-図2は、好ましい貼付剤(実施例1に記載される)の単回投与後の24時間にわたって持続し且つ相対的に安定なロチゴチン血漿レベルを示すグラフである。Chase, T.N., Drugs 55 Suppl. 1: 1 - 9 (1998); Stocchi, F. and Olanow, C.W., Neurology 62 (1 Suppl. 1): S56 - S63 (2004).
ロチゴチン血漿レベルは、複合していない血液試料又は複合した血液試料において求めた。
健康な被検者とパーキンソン病患者における本発明のTTSの毎日の適用からロチゴチンにさらされることにより、一貫した曝露プロファイルが示された。毎日の投与の反復により、安定な血漿レベルが得られた。TTSの除去後、血漿レベルは、5〜7時間の排出半減期によって低下する。
健康な被検者に本発明の好ましいTTSの単回又は多回適用した後の薬物動態パラメータ実験を表2にまとめる。
本発明の好ましい実施態様においては、TTSは、約4〜約20mgのロチゴチンを含む、ヒト患者に対する経皮投与のための放出制御ロチゴチン製剤を含有し、前記製剤により約0.14ng/mL〜約1.54ng/mLのロチゴチンの平均最大血漿濃度(Cmax)と約3.3ng/mL*h〜約32.2ng/mL*hの最後の定量化可能な濃度までの曲線下の平均面積(AUC0-t)が得られる。
本発明の好ましい実施態様においては、TTSは、約4.5〜約18mgのロチゴチンを含む、ヒト患者に対する経皮投与のための放出制御ロチゴチン製剤を含有し、前記製剤により約0.14ng/mL〜約1.54ng/mLのロチゴチンの平均最大血漿濃度(Cmax)と約3.3ng/mL*h〜約32.2ng/mL*hの最後の定量化可能な濃度までの曲線下の平均面積(AUC0-t)が得られる。
なお他の好ましい実施態様においては、TTSは、パーキンソン病に罹っているヒト患者において24時間にわたる定常状態のロチゴチン薬物動態学的プロファイルを誘発するための方法に用いられ、ここで、ロチゴチンのCmaxは、約0.14ng/mL〜約1.54ng/mLであり、AUC0-tは、約3.3ng/mL*h〜約32.2ng/mL*hであり、前記方法はロチゴチンを前記ヒト患者に投与することを含んでいる。
他の実施態様においては、本発明は、ヒト患者においてパーキンソン病を治療するための方法であって、患者にパーキンソン病の症状を改善するのに有効血漿濃度を維持することができるロチゴチン製剤を投与することを含み、Cmaxが約0.14ng/mL〜約1.54ng/mLのレベルで維持され、曲線下の平均面積(AUC0-t)が約3.3ng/mL *h〜約32.3ng/mL *hである、前記方法に関する。
更に他の実施態様においては、本発明は、ヒト患者においてパーキンソン病を治療するための方法であって、ロチゴチンを含む経皮治療システム(TTS)を適用することを含み、TTSがパーキンソン病の症状を改善するのに有効な血漿濃度を得ることができ、Cmaxが約0.14ng/mL〜約1.54ng/mLであり、曲線下の平均面積(AUC0-t)が約3.3ng/mL *h〜約32.2ng/mL *hである、前記方法に関する。
a) ヒト患者に4mg〜20mgの量のロチゴチンを含む1つ以上の経皮貼付剤を適用する段階;
b) 段階a)の1つ又は複数の貼付剤を除去すると共にヒト患者においてパーキンソン病の症状を改善するのに有効なロチゴチンの平均最大血漿濃度(Cmax)をヒト患者において生じる間隔で4mg〜20mgの量のロチゴチンを含む他の1つ又は複数の貼付剤をヒト患者に適用する段階; 及び
c) ヒト患者においてパーキンソン病の症状を改善するのに有効レベルでヒト患者においてロチゴチンのCmaxを維持するのに必要とされる段階b)を繰り返す段階
を含み、ロチゴチンのCmaxが約0.14ng/mL〜約1.54ng/mLのレベルで維持される、前記方法に関する。
本発明の他の好ましい実施態様においては、1つ又は複数の貼付剤が除去され、他の1つ又は複数の貼付剤が毎日、一日2回、毎週、一週2回、毎月又は一月2回適用される。
本発明の他の好ましい態様においては、ヒト患者におけるロチゴチンのCmaxは、約0.20ng/mL〜約1.30ng/mL; 約0.30ng/mL〜約1.20ng/mL; 約0.14ng/mL〜約0.48ng/mL; 約0.37ng/mL〜約0.75ng/mL; 又は約0.84ng/mL〜約1.54ng/mLのレベルで持続する。本発明の更に他の好ましい態様においては、誘発されたCmaxは、約0.31ng/mL; 約0.56ng/mL; 又は約1.19ng/mLである。
他の実施態様においては、本発明は、それを必要としているヒト患者において24時間にわたって定常状態のロチゴチン薬物動態学的プロファイルを誘発するための方法であって、前記ヒト患者にロチゴチンを投与することを含み、ここで、ロチゴチンのCmaxが約0.14ng/mL〜約1.54ng/mLであり、AUC0-tが約3.3ngの/mL *h〜約32.2ng/mL *hであり、前記方法により、ロチゴチンがヒト患者の身体に投与される場所にかかわらず同様のCmaxとAUC0-tが得られる、前記方法に関する。
他の実施態様においては、本発明は、ヒト患者のパーキンソン病を治療するための方法であって、パーキンソン病の症状を改善するのに有効な血漿濃度を得ることができるロチゴチン製剤を24時間にわたって患者に投与することを含み、Cmaxが約0.14ng/mL〜約1.54ng/mLであり、AUC0-tが約3.3ng/mL *h〜約32.2ng/mL *hである、前記方法に関する。
他の実施態様においては、本発明は、ロチゴチンがヒト患者の身体に投与される場所にかかわらずパーキンソン病の症状を改善するのに有効な同様の血漿濃度を示す方法に関する。
本発明の実施態様においては、単回の1日量のロチゴニンが開始されなければならず、その後、有効量まで増加分で増加されなければならない。他の実施態様においては、用量は経皮治療システム(TTS)によって投与される。更に他の実施態様においては、TTSは、一日一回適用される。実施態様においては、更に、TTSは、同時に毎日適用されなければならない。他の実施態様においては、TTSの適用部位は、毎日、例えば、右側から左側へ、上体から下の方へ移動させなければならない。
或る実施態様においては、経皮システムは、48時間毎に、好ましくは24時間毎に置き換えられる。適用部位は、薬物動態学的プロファイルに影響しない。限定されない例においては、TTSは、腹部、大腿、腰、脇腹、肩又は上腕の正面に適用する。好ましくは、TTSは毎日、例えば、右側から左側へ、上体から下の方へ移動させる。好ましくは、TTSは、同じ部位に7日毎に、10日毎に、14日毎に、17日毎に又は21日毎に2回以上適用されない。
本発明の範囲を制限せずに、以下の実施例によって本発明を示す。
本明細書の上で及び他で用いられる以下の用語及び略語は下で定義される意味を有する。
AUC0-t: ゼロから最後の定量化可能な濃度までの曲線下の面積
AUC(0-48): ゼロから投与後48時間まで曲線下の面積
AUC0-inf: ゼロから最初の24時間後の曲線下の面積(AUC0-24)を用い、AUC0-inf = AUC0-24 + 24時間/kelの血漿濃度のような無限に外挿して算出した無限までの曲線下の面積
Ctrough: 測定トラフ血漿濃度
CL: 全身クリアランス
Cmax: 最大測定血漿濃度
Cmax,τ: 用量間隔τの間の最大測定血漿濃度
Cmin: 最少測定血漿濃度
Cmin,τ: 用量間隔τの間の最小測定血漿濃度
CV: 変動係数
kel: 放出の速度定数
LLQ: 定量化の下限
std: 標準偏差
swing: (Cmax−Cmin)/(0.5*Cmax +0.5*Cmin) * 100%によって算出された血漿濃度の変動
tlag: 遅れ時間; 吸収の開始までの所要時間
tmax: Cmaxの時間
tmin: Cminの時間。
(投与部位:H =腰、S =肩、UA =上腕、T =大腿、AB =腹部、F =脇腹
試験設計及び被検者集団
単一施設の、非盲検の、単回投与の、3方向重複の臨床試験を行って、シリコーン経皮貼付剤とアクリル経皮貼付剤からロチゴチンの血中濃度と比較バイオアベイラビリティーを評価した。アクリル経皮貼付剤は、国際出願第99/49852号の教示に従って製造した。シリコーン経皮貼付剤は、米国特許出願公開公報第2003/0026830号の段落38-42、米国特許出願公開公報第2003/0027793号の段落37-41、米国特許第6,884,434号、第5-6欄、実施例2の教示に従って製造し、以下の成分が含まれた。
各々の試験期間の間にロチゴチンの分析のための血液試料を貼付剤適用前と、初回の貼付剤適用の1時間後、2時間後、4時間後、6時間後、8時間後、12時間後、15時間後、23時間後、24時間後、25時間後、26時間後、27時間後、28時間後、30時間後、32時間後、36時間後、40時間後、48時間後に採取した。
シリコーン貼付剤に対するこの臨床試験の間に測定したロチゴチン血漿濃度と薬物動態パラメータのためのデータを表3、4、5、6に示す。アクリル貼付剤に対するロチゴチン血漿濃度のためのデータを表7と表8に示す。図1及び図2は、シリコーン貼付剤の単回投与のためのロチゴチン血漿濃度の算術平均を示すグラフである。図3は、アクリル貼付剤の単回投与のためのロチゴチン血漿濃度の算術平均を示す。
次元: Cmax[ng/mL]tmax,t[h] AUC[ng/mL h]
次元: Cmax[ng/mL]tmax,t[h] AUC[ng/mL h]
試験設計及び被検者集団
単一施設の、非盲検の、多回投与の臨床試験を行って、30人の健康な男性志願者に1日1回の貼付剤投与の14日間の間のロチゴチン経皮貼付剤の薬物動態を評価した。被検者を、プラセボ貼付剤で2日間、その後14日間(即ち、13-16日間)プラセボか又はロチゴチン貼付剤で治療した。シリコーン経皮貼付剤は、米国特許出願公報第2003/0026830号の段落38-42、米国特許出願公報第2003/0027793号の段落37-41、米国特許第6,884,434号、第5-6欄、実施例2の教示に従って製造し、以下の層と成分が含まれた。
試験の間、ロチゴチンの分析のための血液試料を貼付剤投与前と最初の貼付剤投与の1時間後、2時間後、4時間後、6時間後、12時間後、24時間後、48時間後、72時間後、96時間後、120時間後、144時間後、168時間後、192時間後、216時間後、240時間後、264時間後、288時間後、312時間後、316時間後、320時間後、324時間後、336時間後、337時間後、338時間後、339時間後、340時間後、342時間後、344時間後、350時間後、360時間後、372時間後、384時間後に採取した。
健康な志願者においてロチゴチン貼付剤の投与後にロチゴチンの薬物動態を確認するために、最大血漿濃度(Cmax)と対応する時点(tmax)を用い、データを被検者で分けた。血漿濃度の各時間配列に対して台形公式を用いてAUCを算出した。AUC(312-336)は、定常状態の投与による24時間の用量間隔の範囲のAUCを示す。
この臨床試験の間に測定したロチゴチン血漿濃度と薬物動態パラメータのためのデータを表9と表10に示す。図4及び図5は、多回貼付剤投与中及びその後のロチゴチン血漿濃度の算術平均を示すグラフである。
次元: Cmax[ng/mL]; tmax,t[h]; AUC[ng/mL h]
試験設計及び被検者集団
単一施設の、非盲検の、単回投与の、無作為2方向重複の臨床試験を行って、30人の健康な男性被検者(白人、18-50歳)に2種類の異なるロチゴチン含有シリコーン貼付剤の生物学的同等性を評価した。第1シリコーン経皮貼付剤(貼付剤C)は、米国特許出願公報第2003/0026830号の段落38-42、米国特許出願公報第2003/0027793号の段落37-41、米国特許第6,884,434号、第5-6欄、実施例2の教示に従って製造し、以下の層と成分が含まれた。
試験の間、ロチゴチンの分析のための血液試料を貼付剤適用前と、最初の貼付剤適用の1時間後、2時間後、4時間後、6時間後、8時間後、10時間後、12時間後、15時間後、23時間後、24時間後、25時間後、26時間後、27時間後、28時間後、30時間後、36時間後、48時間後に採取した。試験は、36-48時間での採尿及び48時間の血液採取を除いて(通院に基づいて行った)入院状態の下で行った。
この臨床の間に測定したロチゴチン血漿濃度及び薬物動態パラメータのためのデータを表11、12、13、14、15に示す。図6及び図7は、単回貼付剤投与のためのロチゴチン血漿濃度の算術平均を示すグラフである。表15は、2つの貼付剤製剤が生物学的同等性であることを示すために統計的試験の結果をまとめたものである。
試験設計及び被検者集団
70人の被検者の皮膚に適用されるロチゴチン貼付剤の1日量による非盲検の複数部位の無作為試験を行って、貼付剤を異なる身体部位に配置する安全性、許容性、及び有効性を評価した。試験は、また、貼付剤投与ロチゴチンの心電図の影響を評価した。毎日、新しい貼付剤を、新しい皮膚部位(腹部、脇腹、上腕、肩、大腿、腰)の回転順序で配置した。シリコーン経皮貼付剤を、米国特許出願公報第2003/0026830号の段落38-42、米国特許出願公報第2003/0027793号の段落37-41、米国特許第6,884,434号、第5-6欄、実施例2の教示に従って製造し、以下の層と成分が含まれた。
試験には、10cm2、20cm2、0cm2のロチゴチン経皮パッチを貼付剤が用いられ、それぞれ4.5mg、9.0mg、13.5mgのロチゴチンに対応する。シリコーン経皮貼付剤を米国特許出願公報第2003/0026830号の段落38-42、米国特許出願公報第2003/0027793号の段落37-41の教示に従って製造し、上で開示した以下の層と成分が含まれた。18.0mg/日用量には、2×20 cm2 貼付剤が用いられた。初回量は、4.5mg/日で、18.0mg/日の最大標的用量まで4.5mg/日を毎週の増加させた。
表16に示される貼付剤投与の前と日数と時間に血液試料を集めた。
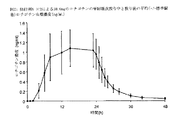
27日目と30日目の合計データを用いて6つの適用部位について平均血漿濃度と時間を図8に示す。
複合していないロチゴチンの平均血漿濃度は、6つの適用部位間で同様であった。約1ng/mLの時間0(貼付剤除去の前、Ctrough)での血漿濃度から始まって、濃度が2時間以内に0.2ng/mLだけ低下し、続いてトラフ血漿濃度のレベルまで増加した。図9は、全ての貼付剤適用部位に対する経時血漿濃度を示すグラフである。
表16は、投与日、実際の投与後の試料採取の時間及び貼付剤投与の部位によって分けられた複合していないロチゴチンの血漿濃度の記述統計の結果を示すものである。
多施設の、無作為の、二重盲検の、プラセボ制御の、2腕の同時グループの臨床試験を行って、初期段階の特発性パーキンソン病をもつ被検者におけるロチゴチン貼付剤の安全性と効力を評価した。シリコーン経皮貼付剤を、米国特許出願公報第2003/0026830号の段落38-42、米国特許出願公報第2003/0027793号の段落37-41、米国特許第6,884,434号、第5-6欄、実施例2の教示に従って製造し、以下の層と成分が含まれた。
ロチゴチン濃度の測定用血漿試料は、56人の被験者において集めた。試料の全数は、1297であった。試験中、ロチゴチンの分析用血液試料は、貼付剤適用前と、最初の貼付剤適用後の1、2、3、11、19、28週に採取した。
表19は、血漿試料におけるロチゴチン濃度の記述統計の結果を示すものである。図10は、その結果を示すグラフである。この図は、試験の維持相にわたる安定な濃度を示すグラフである。
Claims (110)
- ヒト患者においてパーキンソン病を治療するための方法であって、パーキンソン病の症状を改善するのに有効な血漿濃度を得ることができるロチゴチン製剤を患者に投与することを含み、Cmaxが約0.14ng/mL〜約1.54ng/mLであり、曲線下の平均面積(AUC0-t)が約3.3ng/mL *h〜約32.2ng/mL *hである、前記方法。
- ロチゴチンが経皮投与される、請求項1記載の方法。
- Cmaxが約0.20ng/mL〜約1.30ng/mLである、請求項1記載の方法。
- Cmaxが約0.30ng/mL〜約1.20ng/mLである、請求項1記載の方法。
- Cmaxが約0.14ng/mL〜約0.48ng/mLである、請求項1記載の方法。
- Cmaxが約0.37ng/mL〜約0.75ng/mLである、請求項1記載の方法。
- Cmaxが約0.84ng/mL〜約1.54ng/mLである、請求項1記載の方法。
- Cmaxが約0.31ng/mLである、請求項1記載の方法。
- Cmaxが約0.56ng/mLである、請求項1記載の方法。
- Cmaxが約1.19ng/mLである、請求項1記載の方法。
- AUC0-tが約4.0ng/mL *h〜約30.0ng/mL *hである、請求項1記載の方法。
- AUC0-tが約5.0ng/mL *h〜約25.0ng/mL *hである、請求項1記載の方法。
- AUC0-tが約3.3ng/mL *h〜約8.9ng/mL *hである、請求項1記載の方法。
- AUC0-tが約7ng/mL *h〜約15.2ng/mL *hである、請求項1記載の方法。
- AUC0-tが約15.2ng/mL *h〜約32.2ng/mL *hである、請求項1記載の方法。
- AUC0-tが約6.1ng/mL *hである、請求項1記載の方法。
- AUC0-tが約11.1ng/mL *hである、請求項1記載の方法。
- AUC0-tが約23.7ng/mL *hである、請求項1記載の方法。
- 前記方法によって、ロチゴチンがヒト患者の身体に投与される場所にかかわらずパーキンソン病の症状を改善するのに有効な血漿濃度が得られる、請求項1記載の方法。
- ヒト患者においてパーキンソン病を治療するための方法であって、パーキンソン病の症状を改善するのに有効な血漿濃度を維持することができるロチゴチン製剤を患者に投与することを含み、Cmaxが約0.14ng/mL〜約1.54ng/mLのレベルで維持され、曲線下の平均面積(AUC0-t)が約3.3ng/mL *h〜約32.2ng/mL *hである、前記方法。
- ロチゴチンが経皮投与される、請求項20記載の方法。
- Cmaxが約0.20ng/mL〜約1.30ng/mLである、請求項20記載の方法。
- Cmaxが約0.30ng/mL〜約1.20ng/mLである、請求項20記載の方法。
- Cmaxが約0.14ng/mL〜約0.48ng/mLである、請求項20記載の方法。
- Cmaxが約0.37ng/mL〜約0.75ng/mLである、請求項20記載の方法。
- Cmaxが約0.84ng/mL〜約1.54ng/mLである、請求項20記載の方法。
- Cmaxが約0.31ng/mLである、請求項20記載の方法。
- Cmaxが約0.56ng/mLである、請求項20記載の方法。
- Cmaxが約1.19ng/mLである、請求項20記載の方法。
- AUC0-tが約4.0ng/mL *h〜約30.0ng/mL *hである、請求項20記載の方法。
- AUC0-tが約5.0ng/mL *h〜約25.0ng/mL *hである、請求項20記載の方法。
- AUC0-tが約3.3ng/mL *h〜約8.9ng/mL *hである、請求項20記載の方法。
- AUC0-tが約7ng/mL *h〜約15.2ng/mL *hである、請求項20記載の方法。
- AUC0-tが約15.2ng/mL *h〜約32.2ng/mL *hである、請求項20記載の方法。
- AUC0-tが約6.1ng/mL *hである、請求項20記載の方法。
- AUC0-tが約11.1ng/mL *hである、請求項20記載の方法。
- AUC0-tが約23.7ng/mL *hである、請求項20記載の方法。
- 前記方法によって、ロチゴチンがヒト患者の身体に投与される場所にかかわらずパーキンソン病の症状を改善するのに有効な血漿濃度が得られる、請求項20記載の方法。
- ヒト患者においてパーキンソン病を治療するための方法であって、ロチゴチンを含む経皮治療システム(TTS)を適用することを含み、TTSがパーキンソン病の症状を改善するのに有効な血漿濃度を得ることができ、Cmaxが約0.14ng/mL〜約1.54ng/mLであり、曲線下の平均面積(AUC0-t)が約3.3ng/mL *h〜約32.2ng/mL *hである、前記方法。
- Cmaxが約0.20ng/mL〜約1.30ng/mLである、請求項39記載の方法。
- Cmaxが約0.30ng/mL〜約1.20ng/mLである、請求項39記載の方法。
- Cmaxが約0.14ng/mL〜約0.48ng/mLである、請求項39記載の方法。
- Cmaxが約0.37ng/mL〜約0.75ng/mLである、請求項39記載の方法。
- Cmaxが約0.84ng/mL〜約1.54ng/mLである、請求項39記載の方法。
- Cmaxが約0.31ng/mLである、請求項39記載の方法。
- Cmaxが約0.56ng/mLである、請求項39記載の方法。
- Cmaxが約1.19ng/mLである、請求項39記載の方法。
- AUC0-tが約4.0ng/mL *h〜約30.0ng/mL *hである、請求項39記載の方法。
- AUC0-tが約5.0ng/mL *h〜約25.0ng/mL *hである、請求項39記載の方法。
- AUC0-tが約3.3ng/mL *h〜約8.9ng/mL *hである、請求項39記載の方法。
- AUC0-tが約7ng/mL *h〜約15.2ng/mL *hである、請求項39記載の方法。
- AUC0-tが約15.2ng/mL *h〜約32.2ng/mL *hである、請求項39記載の方法。
- AUC0-tが約6.1ng/mL *hである、請求項39記載の方法。
- AUC0-tが約11.1ng/mL *hである、請求項39記載の方法。
- AUC0-tが約23.7ng/mL *hである、請求項39記載の方法。
- 前記方法によって、ロチゴチンがヒト患者の身体に投与される場所にかかわらずパーキンソン病の症状を改善するのに有効な血漿濃度が得られる、請求項39記載の方法。
- ヒト患者においてパーキンソン病を治療するための方法であって、パーキンソン病の症状を改善するのに有効な血漿濃度を得ることができるロチゴチン製剤を24時間にわたって患者に投与することを含み、Cmaxが約0.14ng/mL〜約1.54ng/mLであり、AUC0-tが約3.3ng/mL *h〜約32.2ng/mL *hである、前記方法。
- ロチゴチンが経皮投与される、請求項57記載の方法。
- Cmaxが約0.20ng/mL〜約1.30ng/mLである、請求項57記載の方法。
- Cmaxが約0.30ng/mL〜約1.20ng/mLである、請求項57記載の方法。
- Cmaxが約0.14ng/mL〜約0.48ng/mLである、請求項57記載の方法。
- Cmaxが約0.37ng/mL〜約0.75ng/mLである、請求項57記載の方法。
- Cmaxが約0.84ng/mL〜約1.54ng/mLである、請求項57記載の方法。
- Cmaxが約0.31ng/mLである、請求項57記載の方法。
- Cmaxが約0.56ng/mLである、請求項57記載の方法。
- Cmaxが約1.19ng/mLである、請求項57記載の方法。
- AUC0-tが約4.0ng/mL *h〜約30.0ng/mL *hである、請求項57記載の方法。
- AUC0-tが約5.0ng/mL *h〜約25.0ng/mL *hである、請求項57記載の方法。
- AUC0-tが約3.3ng/mL *h〜約8.9ng/mL *hである、請求項57記載の方法。
- AUC0-tが約7ng/mL *h〜約15.2ng/mL *hである、請求項57記載の方法。
- AUC0-tが約15.2ng/mL *h〜約32.2ng/mL *hである、請求項57記載の方法。
- AUC0-tが約6.1ng/mL *hである、請求項57記載の方法。
- AUC0-tが約11.1ng/mL *hである、請求項57記載の方法。
- AUC0-tが約23.7ng/mL *hである、請求項57記載の方法。
- 前記方法によって、ロチゴチンがヒト患者の身体に投与される場所にかかわらずパーキンソン病の症状を改善するのに有効な血漿濃度が得られる、請求項57記載の方法。
- ヒト患者においてパーキンソン病を治療するための方法であって、ヒト患者においてパーキンソン病の症状を改善するのに有効な血漿濃度を得る量のロチゴチン4mg〜20mgを含む1つ以上の経皮貼付剤を適用することを含み、Cmaxが約0.14ng/mL〜約1.54ng/mLのレベルで維持され、患者における曲線下の平均面積(AUC0-t)が約3.3ng/mL *h〜約32.2ng/mL *hである、前記方法。
- Cmaxが約0.20ng/mL〜約1.30ng/mLである、請求項76記載の方法。
- Cmaxが約0.30ng/mL〜約1.20ng/mLである、請求項76記載の方法。
- Cmaxが約0.14ng/mL〜約0.48ng/mLである、請求項76記載の方法。。
- Cmaxが約0.37ng/mL〜約0.75ng/mLである、請求項76記載の方法。
- Cmaxが約0.84ng/mL〜約1.54ng/mLである、請求項76記載の方法。
- Cmaxが約0.31ng/mLである、請求項76記載の方法。
- Cmaxが約0.56ng/mLである、請求項76記載の方法。
- Cmaxが約1.19ng/mLである、請求項76記載の方法。
- AUC0-tが約4.0ng/mL *h〜約30.0ng/mL *hである、請求項76記載の方法。
- AUC0-tが約5.0ng/mL *h〜約25.0ng/mL *hである、請求項76記載の方法。
- AUC0-tが約3.3ng/mL *h〜約8.9ng/mL *hである、請求項76記載の方法。
- AUC0-tが約7ng/mL *h〜約15.2ng/mL *hである、請求項76記載の方法。
- AUC0-tが約15.2ng/mL *h〜約32.2ng/mL *hである、請求項76記載の方法。
- AUC0-tが約6.1ng/mL *hである、請求項76記載の方法。
- AUC0-tが約11.1ng/mL *hである、請求項76記載の方法。
- AUC0-tが約23.7ng/mL *hである、請求項76記載の方法。
- 前記方法によって、ロチゴチンがヒト患者の身体に投与される場所にかかわれずパーキンソン病の症状を改善するのに有効な血漿濃度が得られる、請求項76記載の方法。
- ヒト患者においてパーキンソン病を治療するための方法であって、
a) 4mg〜20mgの量のロチゴチンを含む1つ以上の経皮貼付剤を患者に適用する段階;
b) 段階a)の1つ又は複数の貼付剤を除去すると共に患者においてパーキンソン病の症状を改善するのに有効な血漿濃度を得る間隔で4mg〜20mgの量のロチゴチンを含む他の1つ又は複数の貼付剤を患者に適用する段階; 及び
c) ヒト患者においてパーキンソン病の症状を改善するのに有効なレベルでCmaxを維持するのに必要とされる段階b)を繰り返す段階
を含み、Cmaxが約0.14ng/mL〜約1.54ng/mLのレベルで維持される、前記方法。 - Cmaxが約0.20ng/mL〜約1.30ng/mLである、請求項94記載の方法。
- Cmaxが約0.30ng/mL〜約1.20ng/mLである、請求項94記載の方法。
- Cmaxが約0.14ng/mL〜約0.48ng/mLである、請求項94記載の方法。
- Cmaxが約0.37ng/mL〜約0.75ng/mLである、請求項94記載の方法。
- Cmaxが約0.84ng/mL〜約1.54ng/mLである、請求項94記載の方法。
- Cmaxが約0.31ng/mLである、請求項94記載の方法。
- Cmaxが約0.56ng/mLである、請求項94記載の方法。
- Cmaxが約1.19ng/mLである、請求項94記載の方法。
- Cmaxが、ヒト患者においてパーキンソン病の症状を改善するのに有効なレベルで1日〜7日間維持される、請求項94記載の方法。
- Cmaxが、ヒト患者においてパーキンソン病の症状を改善するのに有効なレベルで1週〜6週間維持される、請求項94記載の方法。
- Cmaxが、ヒト患者においてパーキンソン病の症状を改善するのに有効なレベルで7週間維持される、請求項94記載の方法。
- Cmaxが、ヒト患者においてパーキンソン病の症状を改善するのに有効なレベルで8週間〜28週間維持される、請求項94記載の方法。
- 前記方法によって、貼付剤がヒト患者の身体に適用される場所にかかわらずパーキンソン病の症状を改善するのに有効な血漿濃度が得られる、請求項94記載の方法。
- 1つ又は複数の貼付剤が毎日取り替えられる、請求項94記載の方法。
- Cmaxが、ヒト患者においてパーキンソン病の症状を改善するのに有効なレベルで1日〜28週間維持される、請求項94記載の方法。
- ヒト患者においてパーキンソン病を治療するための方法であって、
パーキンソン病の症状を改善するのに有効な血漿濃度を得ることができるロチゴチン製剤を24時間にわたって投与することを含み、ロチゴチンがヒト患者の身体に投与される場所にかかわらず、Cmaxが約0.14ng/mL〜約1.54ng/mLであり、AUC0-tが約3.3ng/mL *h〜約32.2ng/mL *hである、前記方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US61376104P | 2004-09-29 | 2004-09-29 | |
| US61376004P | 2004-09-29 | 2004-09-29 | |
| PCT/US2005/035257 WO2006039532A2 (en) | 2004-09-29 | 2005-09-29 | Transdermal therapeutic system for parkinson’s disease |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008514376A true JP2008514376A (ja) | 2008-05-08 |
| JP2008514376A5 JP2008514376A5 (ja) | 2008-11-13 |
Family
ID=36143101
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007534813A Pending JP2008514376A (ja) | 2004-09-29 | 2005-09-29 | パーキンソン病のための経皮治療システム |
Country Status (3)
| Country | Link |
|---|---|
| EP (1) | EP1796610A4 (ja) |
| JP (1) | JP2008514376A (ja) |
| WO (1) | WO2006039532A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10045948B2 (en) | 2014-02-27 | 2018-08-14 | Medrx Co., Ltd. | Pramipexole-containing transdermal patch for treatment of neurodegenerative disease |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10361258A1 (de) | 2003-12-24 | 2005-07-28 | Schwarz Pharma Ag | Verwendung von substituierten 2-Aminotetralinen zur vorbeugenden Behandlung von Morbus Parkinson |
| DE102004014841B4 (de) | 2004-03-24 | 2006-07-06 | Schwarz Pharma Ag | Verwendung von Rotigotin zur Behandlung und Prävention des Parkinson-Plus-Syndroms |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002509878A (ja) * | 1998-03-30 | 2002-04-02 | エルティエス ローマン テラピー−ズュステーメ アーゲー | パーキンソン症候群の治療のためのd2−アゴニスト含有経皮吸収治療システムおよびその製造方法 |
| WO2002089778A2 (en) * | 2001-05-08 | 2002-11-14 | Schwarz Pharma Ag | Transdermal therapeutic system for parkinson's disease inducing high plasma levels of rotigotine |
| WO2004012730A1 (en) * | 2002-07-30 | 2004-02-12 | Schwarz Pharma Ag | Improved transdermal delivery system for the administration of rotigotine |
| WO2004012721A2 (de) * | 2002-07-30 | 2004-02-12 | Schwarz Pharma Ag | Heissschmelz-tts zur verabreichungvon rotigotin |
| JP2004520112A (ja) * | 2000-12-29 | 2004-07-08 | ナショナル スターチ アンド ケミカル インベストメント ホールディング コーポレイション | 皮膚に適用するホットメルト接着剤 |
| WO2004058247A1 (de) * | 2002-12-30 | 2004-07-15 | Schwarz-Pharma Ag | Vorrichtung zur transdermalen verabreichung von rotigotin-base |
| JP2004528359A (ja) * | 2001-05-08 | 2004-09-16 | シュバルツ ファルマ アクチェンゲゼルシャフト | パーキンソン氏病を治療するための改善された経皮吸収治療システム |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4885308A (en) * | 1984-08-13 | 1989-12-05 | Nelson Research & Development Co. | Method and compositions for treatment of parkinsonism syndrome in mammals |
| US5989586A (en) * | 1992-10-05 | 1999-11-23 | Cygnus, Inc. | Two-phase matrix for sustained release drug delivery device |
| US6024974A (en) * | 1995-01-06 | 2000-02-15 | Noven Pharmaceuticals, Inc. | Composition and methods for transdermal delivery of acid labile drugs |
-
2005
- 2005-09-29 JP JP2007534813A patent/JP2008514376A/ja active Pending
- 2005-09-29 EP EP05802679A patent/EP1796610A4/en not_active Withdrawn
- 2005-09-29 WO PCT/US2005/035257 patent/WO2006039532A2/en active Application Filing
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002509878A (ja) * | 1998-03-30 | 2002-04-02 | エルティエス ローマン テラピー−ズュステーメ アーゲー | パーキンソン症候群の治療のためのd2−アゴニスト含有経皮吸収治療システムおよびその製造方法 |
| JP2004520112A (ja) * | 2000-12-29 | 2004-07-08 | ナショナル スターチ アンド ケミカル インベストメント ホールディング コーポレイション | 皮膚に適用するホットメルト接着剤 |
| WO2002089778A2 (en) * | 2001-05-08 | 2002-11-14 | Schwarz Pharma Ag | Transdermal therapeutic system for parkinson's disease inducing high plasma levels of rotigotine |
| JP2004528359A (ja) * | 2001-05-08 | 2004-09-16 | シュバルツ ファルマ アクチェンゲゼルシャフト | パーキンソン氏病を治療するための改善された経皮吸収治療システム |
| WO2004012730A1 (en) * | 2002-07-30 | 2004-02-12 | Schwarz Pharma Ag | Improved transdermal delivery system for the administration of rotigotine |
| WO2004012721A2 (de) * | 2002-07-30 | 2004-02-12 | Schwarz Pharma Ag | Heissschmelz-tts zur verabreichungvon rotigotin |
| WO2004058247A1 (de) * | 2002-12-30 | 2004-07-15 | Schwarz-Pharma Ag | Vorrichtung zur transdermalen verabreichung von rotigotin-base |
Non-Patent Citations (2)
| Title |
|---|
| JPN6012065745; 蓮江光男ら: '腰痛症, 頸肩腕症候群および肩関節周囲炎に対する塩酸エペリゾンテープ製剤E2000の臨床評価' 医学のあゆみ 181(8), 1997, p.575-593 * |
| JPN6012065751; 五島雄一郎ら: 'Ba37142(Nicotine TTS)の臨床効果-初期用量の安全性の検討-' 臨床医薬 10(suppl-3), 1994, p.117-142 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10045948B2 (en) | 2014-02-27 | 2018-08-14 | Medrx Co., Ltd. | Pramipexole-containing transdermal patch for treatment of neurodegenerative disease |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2006039532A3 (en) | 2006-07-13 |
| EP1796610A4 (en) | 2012-12-05 |
| WO2006039532A2 (en) | 2006-04-13 |
| EP1796610A2 (en) | 2007-06-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20060263419A1 (en) | Transdermal therapeutic system for Parkinson's Disease | |
| US20060216336A1 (en) | Transdermal therapeutic system for Parkinson's Disease | |
| JP6298034B2 (ja) | 経皮吸収治療システム | |
| KR100968293B1 (ko) | 파킨슨병의 치료를 위한 개선된 경피제제 | |
| JP4316800B2 (ja) | メチルフェニデートで注意欠乏障害及び注意欠乏/活動亢進障害を治療する組成物及び方法 | |
| RU2272625C2 (ru) | Чрескожная терапевтическая система для лечения болезни паркинсона, индуцирующая высокие уровни ротиготина в плазме | |
| US20030026830A1 (en) | Transdermal therapeutic system for parkinson's disease inducing high plasma levels of rotigotine | |
| US20050220855A1 (en) | Transdermal therapeutic system | |
| NZ228467A (en) | Transdermal compositions containing deprenyl, i.e. n-methyl-n-(1-phenyl-2-propyl)-2-propinylamine | |
| AU2002310805A1 (en) | Improved transdermal therapeutic system for the treatment of Parkinson's disease | |
| US20030027793A1 (en) | Transdermal treatment of parkinson's disease | |
| JP2004512305A (ja) | ドパミン作用性疾患状態を治療するための、ドパミンアゴニストを含有する経皮治療系と経口及び/または非経口調合剤との組合せ | |
| JP2008514376A (ja) | パーキンソン病のための経皮治療システム | |
| JP6978417B2 (ja) | プラミペキソール経皮送達系及びその使用 | |
| TWI386191B (zh) | 用於嘔吐之經皮給藥方法及貼片 | |
| AU2005242160B2 (en) | Improved transdermal therapeutic system for the treatment of parkinson's disease |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080929 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080929 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111219 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120319 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120327 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120619 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121217 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130307 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130314 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130614 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130805 |