JP2007524708A - 血管新生を阻害するラクトアルブミン - Google Patents
血管新生を阻害するラクトアルブミン Download PDFInfo
- Publication number
- JP2007524708A JP2007524708A JP2007500287A JP2007500287A JP2007524708A JP 2007524708 A JP2007524708 A JP 2007524708A JP 2007500287 A JP2007500287 A JP 2007500287A JP 2007500287 A JP2007500287 A JP 2007500287A JP 2007524708 A JP2007524708 A JP 2007524708A
- Authority
- JP
- Japan
- Prior art keywords
- lactalbumin
- biologically active
- hamlet
- tumor
- complex
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 102000004407 Lactalbumin Human genes 0.000 title claims abstract description 95
- 108090000942 Lactalbumin Proteins 0.000 title claims abstract description 82
- 230000033115 angiogenesis Effects 0.000 title claims abstract description 37
- 101000946384 Homo sapiens Alpha-lactalbumin Proteins 0.000 claims abstract description 177
- 102100034668 Alpha-lactalbumin Human genes 0.000 claims abstract description 157
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 135
- 235000021241 α-lactalbumin Nutrition 0.000 claims abstract description 90
- 208000005017 glioblastoma Diseases 0.000 claims abstract description 49
- 238000011282 treatment Methods 0.000 claims abstract description 40
- 239000012634 fragment Substances 0.000 claims abstract description 39
- 201000011510 cancer Diseases 0.000 claims abstract description 30
- 230000000975 bioactive effect Effects 0.000 claims abstract description 28
- 239000003814 drug Substances 0.000 claims abstract description 22
- 238000004519 manufacturing process Methods 0.000 claims abstract description 19
- 210000004881 tumor cell Anatomy 0.000 claims abstract description 17
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims abstract description 16
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 15
- 206010005003 Bladder cancer Diseases 0.000 claims abstract description 13
- 201000005112 urinary bladder cancer Diseases 0.000 claims abstract description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 9
- 201000010099 disease Diseases 0.000 claims abstract description 8
- 201000001441 melanoma Diseases 0.000 claims abstract description 8
- 230000002062 proliferating effect Effects 0.000 claims abstract description 7
- 210000001835 viscera Anatomy 0.000 claims abstract description 7
- 229960005541 HAMLET Drugs 0.000 claims abstract 14
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 claims abstract 2
- 241000282414 Homo sapiens Species 0.000 claims description 34
- 210000004556 brain Anatomy 0.000 claims description 34
- 108090000623 proteins and genes Proteins 0.000 claims description 30
- 238000000034 method Methods 0.000 claims description 28
- 235000018102 proteins Nutrition 0.000 claims description 27
- 102000004169 proteins and genes Human genes 0.000 claims description 27
- 150000001413 amino acids Chemical class 0.000 claims description 23
- 238000002347 injection Methods 0.000 claims description 22
- 239000007924 injection Substances 0.000 claims description 22
- 241001465754 Metazoa Species 0.000 claims description 20
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 16
- 239000011575 calcium Substances 0.000 claims description 16
- 238000001727 in vivo Methods 0.000 claims description 15
- 235000014113 dietary fatty acids Nutrition 0.000 claims description 14
- 229930195729 fatty acid Natural products 0.000 claims description 14
- 239000000194 fatty acid Substances 0.000 claims description 14
- 150000004665 fatty acids Chemical class 0.000 claims description 14
- 239000000203 mixture Substances 0.000 claims description 11
- 101000946377 Bos taurus Alpha-lactalbumin Proteins 0.000 claims description 10
- 102000005701 Calcium-Binding Proteins Human genes 0.000 claims description 10
- 108010045403 Calcium-Binding Proteins Proteins 0.000 claims description 10
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 8
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims description 8
- 229910052791 calcium Inorganic materials 0.000 claims description 8
- 239000011780 sodium chloride Substances 0.000 claims description 8
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 claims description 7
- 229910001424 calcium ion Inorganic materials 0.000 claims description 7
- 230000002829 reductive effect Effects 0.000 claims description 7
- 241000282412 Homo Species 0.000 claims description 6
- 206010027476 Metastases Diseases 0.000 claims description 5
- 230000004071 biological effect Effects 0.000 claims description 5
- 235000013336 milk Nutrition 0.000 claims description 5
- 239000008267 milk Substances 0.000 claims description 5
- 210000004080 milk Anatomy 0.000 claims description 5
- 241000283690 Bos taurus Species 0.000 claims description 4
- 102220467241 Receptor tyrosine-protein kinase erbB-2_D87A_mutation Human genes 0.000 claims description 4
- 239000005018 casein Substances 0.000 claims description 4
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 claims description 4
- 235000021240 caseins Nutrition 0.000 claims description 4
- 235000020256 human milk Nutrition 0.000 claims description 4
- 210000004251 human milk Anatomy 0.000 claims description 4
- 238000004255 ion exchange chromatography Methods 0.000 claims description 4
- 210000004185 liver Anatomy 0.000 claims description 4
- 230000009401 metastasis Effects 0.000 claims description 4
- 230000035772 mutation Effects 0.000 claims description 4
- 210000003734 kidney Anatomy 0.000 claims description 3
- 230000004048 modification Effects 0.000 claims description 3
- 238000012986 modification Methods 0.000 claims description 3
- 210000002307 prostate Anatomy 0.000 claims description 3
- 206010019695 Hepatic neoplasm Diseases 0.000 claims description 2
- 238000005571 anion exchange chromatography Methods 0.000 claims description 2
- 238000005227 gel permeation chromatography Methods 0.000 claims description 2
- 208000014018 liver neoplasm Diseases 0.000 claims description 2
- 210000001672 ovary Anatomy 0.000 claims description 2
- 102200115883 rs121918076 Human genes 0.000 claims description 2
- 201000000849 skin cancer Diseases 0.000 claims description 2
- 102220468836 Albumin_D87N_mutation Human genes 0.000 claims 1
- 102000009027 Albumins Human genes 0.000 claims 1
- 108010088751 Albumins Proteins 0.000 claims 1
- 208000008839 Kidney Neoplasms Diseases 0.000 claims 1
- 206010061535 Ovarian neoplasm Diseases 0.000 claims 1
- 208000023958 prostate neoplasm Diseases 0.000 claims 1
- 210000004027 cell Anatomy 0.000 description 48
- 241000700159 Rattus Species 0.000 description 33
- 230000000694 effects Effects 0.000 description 26
- 235000001014 amino acid Nutrition 0.000 description 17
- 230000006907 apoptotic process Effects 0.000 description 17
- 238000001574 biopsy Methods 0.000 description 17
- 229940024606 amino acid Drugs 0.000 description 16
- 210000004204 blood vessel Anatomy 0.000 description 15
- 230000012010 growth Effects 0.000 description 14
- 238000000338 in vitro Methods 0.000 description 14
- 210000001519 tissue Anatomy 0.000 description 14
- 210000003932 urinary bladder Anatomy 0.000 description 14
- 208000024891 symptom Diseases 0.000 description 12
- 230000001225 therapeutic effect Effects 0.000 description 12
- 241000699670 Mus sp. Species 0.000 description 10
- 230000000699 topical effect Effects 0.000 description 10
- 230000001640 apoptogenic effect Effects 0.000 description 9
- 210000002889 endothelial cell Anatomy 0.000 description 9
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 8
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 8
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 8
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 8
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 8
- 239000006071 cream Substances 0.000 description 8
- 238000001802 infusion Methods 0.000 description 7
- 238000002689 xenotransplantation Methods 0.000 description 7
- 238000012288 TUNEL assay Methods 0.000 description 6
- 230000002491 angiogenic effect Effects 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 102000008300 Mutant Proteins Human genes 0.000 description 5
- 108010021466 Mutant Proteins Proteins 0.000 description 5
- 238000007906 compression Methods 0.000 description 5
- 230000006835 compression Effects 0.000 description 5
- 230000003111 delayed effect Effects 0.000 description 5
- 238000009826 distribution Methods 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 238000002595 magnetic resonance imaging Methods 0.000 description 5
- 230000003211 malignant effect Effects 0.000 description 5
- 206010027191 meningioma Diseases 0.000 description 5
- 230000004083 survival effect Effects 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 4
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 4
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 4
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 4
- 206010005064 Bladder papilloma Diseases 0.000 description 4
- 102400001047 Endostatin Human genes 0.000 description 4
- 108010079505 Endostatins Proteins 0.000 description 4
- 206010018338 Glioma Diseases 0.000 description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 4
- 239000005642 Oleic acid Substances 0.000 description 4
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 4
- 230000003213 activating effect Effects 0.000 description 4
- 235000004279 alanine Nutrition 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 229960001230 asparagine Drugs 0.000 description 4
- 235000009582 asparagine Nutrition 0.000 description 4
- 201000011177 bladder transitional cell papilloma Diseases 0.000 description 4
- 210000005013 brain tissue Anatomy 0.000 description 4
- 210000003855 cell nucleus Anatomy 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 239000000945 filler Substances 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 4
- 201000005202 lung cancer Diseases 0.000 description 4
- 208000020816 lung neoplasm Diseases 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- 210000004940 nucleus Anatomy 0.000 description 4
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 4
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 238000011301 standard therapy Methods 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- 238000001356 surgical procedure Methods 0.000 description 4
- 238000002054 transplantation Methods 0.000 description 4
- 208000012477 urothelial papilloma Diseases 0.000 description 4
- 208000032612 Glial tumor Diseases 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 3
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 3
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 230000029578 entry into host Effects 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 238000007917 intracranial administration Methods 0.000 description 3
- 230000003902 lesion Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 238000007491 morphometric analysis Methods 0.000 description 3
- 230000014399 negative regulation of angiogenesis Effects 0.000 description 3
- 210000001577 neostriatum Anatomy 0.000 description 3
- 238000011275 oncology therapy Methods 0.000 description 3
- 238000012346 open field test Methods 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 239000008194 pharmaceutical composition Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 102200060693 rs142232675 Human genes 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 229940100611 topical cream Drugs 0.000 description 3
- 229940100613 topical solution Drugs 0.000 description 3
- 231100000331 toxic Toxicity 0.000 description 3
- 230000002588 toxic effect Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 210000003556 vascular endothelial cell Anatomy 0.000 description 3
- 102400000068 Angiostatin Human genes 0.000 description 2
- 108010079709 Angiostatins Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 2
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- 206010022773 Intracranial pressure increased Diseases 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 230000002730 additional effect Effects 0.000 description 2
- 230000001772 anti-angiogenic effect Effects 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- FZCSTZYAHCUGEM-UHFFFAOYSA-N aspergillomarasmine B Natural products OC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=O FZCSTZYAHCUGEM-UHFFFAOYSA-N 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 238000000376 autoradiography Methods 0.000 description 2
- 230000006399 behavior Effects 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 210000001736 capillary Anatomy 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 238000004624 confocal microscopy Methods 0.000 description 2
- 238000002574 cystoscopy Methods 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 230000005059 dormancy Effects 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 210000002744 extracellular matrix Anatomy 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 238000013467 fragmentation Methods 0.000 description 2
- 238000006062 fragmentation reaction Methods 0.000 description 2
- 210000001652 frontal lobe Anatomy 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 230000006882 induction of apoptosis Effects 0.000 description 2
- 230000002601 intratumoral effect Effects 0.000 description 2
- 238000005304 joining Methods 0.000 description 2
- 230000003907 kidney function Effects 0.000 description 2
- 210000002429 large intestine Anatomy 0.000 description 2
- 231100001231 less toxic Toxicity 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 230000003908 liver function Effects 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 230000027939 micturition Effects 0.000 description 2
- 238000013425 morphometry Methods 0.000 description 2
- 230000017074 necrotic cell death Effects 0.000 description 2
- 230000004942 nuclear accumulation Effects 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 210000003800 pharynx Anatomy 0.000 description 2
- 239000002504 physiological saline solution Substances 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 231100000161 signs of toxicity Toxicity 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000000451 tissue damage Effects 0.000 description 2
- 231100000827 tissue damage Toxicity 0.000 description 2
- 230000017423 tissue regeneration Effects 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 230000002476 tumorcidal effect Effects 0.000 description 2
- 238000013042 tunel staining Methods 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- 210000005167 vascular cell Anatomy 0.000 description 2
- 230000006444 vascular growth Effects 0.000 description 2
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- USSUMSBPLJWFSZ-TUFLPTIASA-N (2s)-2-[[2-[[(2s)-1-[(2s)-1-[(2s)-2-amino-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]pyrrolidine-2-carbonyl]amino]acetyl]amino]-3-phenylpropanoic acid Chemical compound NC(N)=NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(=O)NCC(=O)N[C@@H](CC=2C=CC=CC=2)C(O)=O)CCC1 USSUMSBPLJWFSZ-TUFLPTIASA-N 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 208000031648 Body Weight Changes Diseases 0.000 description 1
- 206010006458 Bronchitis chronic Diseases 0.000 description 1
- 208000009458 Carcinoma in Situ Diseases 0.000 description 1
- 206010009696 Clumsiness Diseases 0.000 description 1
- 102000036364 Cullin Ring E3 Ligases Human genes 0.000 description 1
- 231100001074 DNA strand break Toxicity 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000003839 Human Proteins Human genes 0.000 description 1
- 108090000144 Human Proteins Proteins 0.000 description 1
- 238000010824 Kaplan-Meier survival analysis Methods 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 102100038609 Lactoperoxidase Human genes 0.000 description 1
- 108010023244 Lactoperoxidase Proteins 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 206010071289 Lower urinary tract symptoms Diseases 0.000 description 1
- 208000027007 Meningioma benign Diseases 0.000 description 1
- 208000016285 Movement disease Diseases 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 206010033799 Paralysis Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 208000004880 Polyuria Diseases 0.000 description 1
- 101710093543 Probable non-specific lipid-transfer protein Proteins 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 239000005862 Whey Substances 0.000 description 1
- 102000007544 Whey Proteins Human genes 0.000 description 1
- 108010046377 Whey Proteins Proteins 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 210000001642 activated microglia Anatomy 0.000 description 1
- 101150034884 ado1 gene Proteins 0.000 description 1
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 108010020219 apo-alpha-lactalbumin Proteins 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-L aspartate group Chemical group N[C@@H](CC(=O)[O-])C(=O)[O-] CKLJMWTZIZZHCS-REOHCLBHSA-L 0.000 description 1
- 210000001130 astrocyte Anatomy 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 210000004227 basal ganglia Anatomy 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 201000009467 benign meningioma Diseases 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 206010005084 bladder transitional cell carcinoma Diseases 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 230000036770 blood supply Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000004579 body weight change Effects 0.000 description 1
- 108010070055 bradykinin (1-5) Proteins 0.000 description 1
- 210000004958 brain cell Anatomy 0.000 description 1
- 230000003925 brain function Effects 0.000 description 1
- 230000007052 brain toxicity Effects 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- WHLPIOPUASGRQN-UHFFFAOYSA-N butyl 2-methylprop-2-enoate;methyl 2-methylprop-2-enoate Chemical compound COC(=O)C(C)=C.CCCCOC(=O)C(C)=C WHLPIOPUASGRQN-UHFFFAOYSA-N 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 108091092356 cellular DNA Proteins 0.000 description 1
- 210000003710 cerebral cortex Anatomy 0.000 description 1
- 231100000976 cerebrotoxicity Toxicity 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 208000007451 chronic bronchitis Diseases 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 230000035619 diuresis Effects 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 102000034238 globular proteins Human genes 0.000 description 1
- 108091005896 globular proteins Proteins 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 235000020251 goat milk Nutrition 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 238000007489 histopathology method Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 201000004933 in situ carcinoma Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 208000020082 intraepithelial neoplasia Diseases 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 230000000622 irritating effect Effects 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 229940057428 lactoperoxidase Drugs 0.000 description 1
- 210000003141 lower extremity Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 210000001259 mesencephalon Anatomy 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 238000002406 microsurgery Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 239000012120 mounting media Substances 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 230000007171 neuropathology Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 231100000957 no side effect Toxicity 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000027758 ovulation cycle Effects 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 231100000683 possible toxicity Toxicity 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 238000012342 propidium iodide staining Methods 0.000 description 1
- 210000004129 prosencephalon Anatomy 0.000 description 1
- 230000012846 protein folding Effects 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 102220005070 rs121912459 Human genes 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 235000020254 sheep milk Nutrition 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 210000003523 substantia nigra Anatomy 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- JGVWCANSWKRBCS-UHFFFAOYSA-N tetramethylrhodamine thiocyanate Chemical compound [Cl-].C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=C(SC#N)C=C1C(O)=O JGVWCANSWKRBCS-UHFFFAOYSA-N 0.000 description 1
- 210000001103 thalamus Anatomy 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000008467 tissue growth Effects 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 231100000820 toxicity test Toxicity 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 206010044412 transitional cell carcinoma Diseases 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 210000001635 urinary tract Anatomy 0.000 description 1
- 208000023747 urothelial carcinoma Diseases 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/38—Albumins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0034—Urogenital system, e.g. vagina, uterus, cervix, penis, scrotum, urethra, bladder; Personal lubricants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0085—Brain, e.g. brain implants; Spinal cord
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Reproductive Health (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Psychology (AREA)
- Gynecology & Obstetrics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Oncology (AREA)
- Dermatology (AREA)
- Endocrinology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicinal Preparation (AREA)
Abstract
Description
(i)シスC18:1:9又はC18:1:11脂肪酸又は類似の立体配置を有する異なった脂肪酸;及び
(ii)カルシウムイオンが放出されたα−ラクトアルブミン、又はカルシウムイオンが除去されたか又は機能性カルシウム結合部位を有していないα−ラクトアルブミンの変異体;又はこれらのいずれか一つの断片、但し、このいずれか一つの断片は、α及びβドメインの間に接点を形成するα−ラクトアルブミンの領域に相当する領域を含むものである;
を含む。
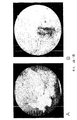
図1は、本発明による治療前後にとった、膀胱癌の内腔の写真を示す。
図2.HAMLET−ヒトGBM腫瘍異種移植片のインビトロ及びインビボにおける構造及び機能
(a)HAMLETがCa2+の脱離により、及びC18:1,9シス脂肪酸の付加により天然のα−ラクトアルブミンから形成される。図はα−ラクトアルブミンの結晶構造に基づく。
(b)HAMLETに対するGBM細胞株の感受性。LD50=6/24時間における細胞の50%を殺すに必要な濃度。(c及びd)ヒトGBM腫瘍スフェロイド(矢印のところで注射した)を、HAMLET(n=10)又はα−ラクトアルブミン(n=10)を24時間注入前に1週間定着させた。α−ラクトアルブミン(1〜4)又はHAMLET(5〜8)で処置したラットにおいて個々の腫瘍のMRIスキャンを、注入後2ヵ月実施した。(e)平均腫瘍サイズは、α−ラクトアルブミン処置群におけるよりもHAMLETの点滴注入動物において有意に小さかった(p<0.01)。(f)頭蓋内圧上昇の症状を記録し、そしてα−ラクトアルブミン対照において約2ヵ月後に生じたが、圧迫症状の発症はHAMLETの点滴注入されたラットでは遅延した(p<0.001)。
(a)脳組織切片を、HAMLET又はα−ラクトアルブミンのCED後12時間に、担癌ラットから得た。HAMLETは、TUNEL染色によって示されるように、腫瘍領域内にアポトーシス(緑の蛍光、左パネル)及び核濃縮アポトーシス腫瘍細胞核(右パネル、倍率600×)を豊富にした。HAMLET処置動物及びα−ラクトアルブミン処置群において腫瘍の周辺の健全な脳組織にアポトーシスは観察されなかった。細胞核を、細胞DNAのプロピジウムヨージド染色を用いて目に見えるようにした(赤い蛍光)。
(b)GBMスフェロイドを、インビトロでHAMLET又はα−ラクトアルブミンで処置し、アポトーシス誘導を試験した。HAMLET誘導アポトーシス(緑の蛍光)が、ヒトGBMスフェロイド全体に見られたが、良性髄膜腫由来のスフェロイドにはなかった。
(c)α−ラクトアルブミンは、GBM又は髄膜腫スフェロイドのいずれにおいてもアポトーシスを促進しなかった(倍率360×)。多染色体細胞及び核濃縮アポトーシス細胞(bの矢印)が、HAMLET処置スフェロイドにおいて見出されたが、α−ラクトアルブミン群においては見られなかった(倍率450×)。
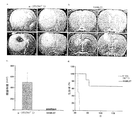
各群6動物を、HAMLET又はα−ラクトアルブミンで3時間前処置した、樹立ヒトGBMスフェロイド(各群4−5)で異種移植した。α−ラクトアルブミン前処置GBM細胞を注入された全てのラットは、大きな腫瘍を発現した(a、1〜4)。HAMLET処置スフェロイドを注入された6動物中4動物は、腫瘍発現の徴候を示さず、少なくとも210日間生存した(b、5〜8)。腫瘍をともかく発現したHAMLET群の2ラットは、有意により小さな腫瘍を示した(c、p<0.01)、そして圧迫症状の発症は遅延した(d、p<0.01)。
健全ラットの脳へ注入後の放射能標識HAMLET(2〜10×106PPM)の分布(n=3、倍率90×)を示す。文字は切片の位置、xは注入部位を示す。(a)前頭葉、(b)大脳基底核、(c)視床、及び(g)黒質。
健全ラットをHAMLET0.7mM、α−ラクトアルブミン0.7mM又はNaCl0.15M(各群n=5)で処置した。潜在的な毒性は注入後3週間で分析した。
(a)MR画像のT2強調シグナルは、注入部位に小嚢胞性病変を示したが、毒性の放射線学的徴候はなかった。
(b)注入脳半球由来の連続脳切片での組織病理は、健全な脳における毒性の証拠は示されなかったが、注入部位に隣接していくつかの組織損傷が見られた(矢印、ヘマトキシリン−エオジン染色、倍率100×及び400×)。
(c)肝機能及び腎機能の生化学マーカーは、有意な毒性効果を現さなかった(両群において、p>0.05)。
(d)体重増加は、群間で差はなかった(p>0.5)。ハッチの棒(hatched bar)は、注入前の体重値、及び塗りつぶした棒(filled bar)は、注入後3週間の値である。
(e)運動のオープンフィールド試験は影響なかった(p>0.05、ネズミ色=HAMLET、薄い灰色=α−ラクトアルブミン、白=NaCl)。
物質の製造及び患者の無作為化
母乳のドナーは、非喫煙者であり、HAMLETの製造前にHIVについてスクリーニングした。α−ラクトアルブミンは、硫酸アンモニウム沈殿に次いでフェニル・セファロース・クロマトグラフィー及びサイズ排除クロマトグラフィーによってヒトミルクホエーから精製された。ホスピタル・ミルクバンクからの余剰ミルクを未熟児に投与するための規則に従って使用した。HAMLETは、文献に記載されたようにして、オレイン酸で調節したイオン交換クロマトグラフィーで天然のα−ラクトアルブミンから生成したものである。溶離した分画を蒸留水に対して透析し、凍結乾燥し、−20℃で保存した。
新しく診断された、又は再発した膀胱の尿路上皮癌の手術待機患者を、研究に参加させるために招いた。インフォームドコンセントの後、患者に膀胱鏡検査を行って腫瘍サイズを評価し、そして内腔写真撮影(endoluminal photography)で病変を記録した。処置後、及び手術前に、膀胱鏡検査を繰り返して、腫瘍の大きさを再評価し、そして内腔写真撮影を実施した。
全ての患者は、5日間、HAMLETの膀胱内注入を毎日受けた。点滴注入の副作用は、どの患者も経験しなかった、そしてCRP、発熱又は末梢好中球数のような全身性炎症パラメーターの反応はなかった。
TUNEL陽性、アポトーシス性癌細胞が検出された。
HAMLETを、C18:1,9シス脂肪酸(Svensson et al., Proc. Natl. Acad. Sci. USA, 97:4221-4226)で、前調整処理したDEAE−トリスアクリルM(BioSepra, France)のイオン交換クロマトグラフィーによって、アポα−ラクトアルブミンから製造した。HAMLET(1mg/ml)の125I標識は、ラクトペルオキシダーゼ法(Hakansson et al., Proc. Natl. Sci. USA 92:8064-8068)によった。
Haukeland University Hospital (Bergen, Norway) で、その医学倫理委員会の許可を得て、右前頭葉及び側矢状髄膜腫のGBMから腫瘍生検を集めた。直径300μmのスフェロイドを培養し、移植に使用した(Bjerkvig et al., J. Neurosurg. 72:463-475)。神経膠腫細胞株は、ATCC・CRL・2365、D−54MG及びU−251MGであった。A549肺癌株はATCC・CCL・185であった。充分に分化したネズミ脳細胞の単個細胞浮遊液を、完全に成長したマウスの脳を解剖し、1%トリプシン(Sigma Chemicals Inc., St. Louis, MO, USA)でDMEM培地(GibcofBRL, Life Technologies Ltd. Paisley, Scotland)中で、30分間、室温にて解離し、0.24%DNase及び1%FCS(Sigma Chemicals Inc., St. Louis, MO, USA)を加え、次いで機械的破壊によって、調製した。生存率は>99%であった。
全ての実験は、国立動物研究委員会によって承認されており、科学的目的のために使用される脊椎動物の保護に関するヨーロッパ条約に従って行われた。Haukland Hospitalで飼育された、ヌードラット(Han: rnu/rnu Rowett)を、Equitisinの腹腔内注射によって麻酔し、穿孔術のために定位フレーム(David Kopf, model 900, Tujunga, CA, USA)におき、5生検スフェロイドを含有したPBS約5〜10μlを線条体に注射した。ラットを、無抵抗、不器用及び不全麻痺のような頭蓋内圧の亢進症状を発症するまで毎日モニターした。1.5テスラのSiemens Magnetom Vision装置(Erlangen, Germany)及び脳解析用フィンガーコイルを使用して、腫瘤を磁気共鳴スキャンによって定量した。約100万細胞の移植から圧迫症状までの平均時間は、約2ヵ月であって、その時点で、動物を殺処分した。
HAMLET又はα−ラクトアルブミン(0.15M・NaCl中0.7mM)を、浸透圧ミニポンプ(ADO1, Alzet Inc., Mountainview, CA, USA)に接続した26ゲージカニューレを通して投与した。腫瘍の領域には、カニューレを外す前24時間にわたって8μl/時間で注入した。125I放射能標識HAMLET(0.15M・NaCl中0.7mM、2〜10×106PPM)を記載したようにして投与した。HAMLETの分布を、全体に注入した脳半球からの連続脳切片のオートラジオグラフィーによって確認した。
脳をTissue-Tec(Sakura Finetek Inc., Torrance, CA, USA)に急速に包埋し、液体窒素で凍結した。連続軸方向10μm切片を、Reichert Jung Cryostat(Reichert, Vienna, Austria)でカットした。アポトーシスを起こした細胞をTUNELアッセイ(Roche, Basel, Switzerland)によって検出し、封入剤と共にカバーグラスをした(Vectashield, Vector Labs Inc., Burlingame, CA, USA)。細胞核をプロピジウムヨージド(Propidium iodide)(10μg/ml、30秒間)で対比染色し、Leicaスキャナーで試験した。並列切片を、ヘマトキシリン−エオジンで染色し、Entellan(Merck, Darmstadt, Germany)に封入した。凍結アーチファクトがなく、FITC(TUNEL)とTRITC(プロピジウムヨージド)に対する許容されるシグナル/ノイズ比を有する切片を特定し、各腫瘍又はスフェロイドの中心からの代表的な切片1つを形態計測解析にかけた。FITC及びTRTTC陽性核プロフィールがバックグランド上に明確に視認でき、プリントした絵から計測した。結果は、プロピジウムヨージド陽性核のパーセントのTUNEL陽性として表される。
樹立したスフェロイド(各群4〜5)を無血清培地に移し、HAMLET又はα−ラクトアルブミンと3時間インキュベートし、直ちにヌードラットの脳内に移植した。アポトーシスを分析するために、スフェロイドをDMEMに戻し、更に21時間インキュベートし、連続切片作成後、形態計測でTUNELアッセイによって試験した。細胞株を記載されたようにして培養し(Hakansson et al. 前述)、剥離し、収集し、洗浄し、そしてHAMLET又はα−ラクトアルブミンに24時間曝露した。アポトーシスを、トリパンブルー排除によって評価した細胞生存の喪失(計数細胞100当たりの死亡細胞の%)として測定し、DNA断片化を電気泳動によって検出した(Zhivotovsky et al., FEBS Lett. 351:150-154)。
HAMLET(0.7mM)、α−ラクトアルブミン(0.7mM)又はNaCl(0.15M)をラットに与え、注入後3週間分析した。腫瘤を、1.5テスラのSiemens Magnetom Vision装置(Erlangen, Germany)及び脳解析用フィンガーコイルを使用して、磁気共鳴スキャンによって定量した。組織病理を、ヘマトキシリン−エオジンを用いて上に記載したようにして検討した。肝機能及び腎機能の生化学マーカー及びCRPを定量した。体重を注入前及び注入後3週間記録した。脳機能をオープンフィールドテストで評価した。ラットを、黒い壁(20cm)で囲まれたオープンフィールド箱(100×100cm)中においた。床は、白いストライプによって25の同じ区域(20×20cm)に分けた。動物を中心の区域におき、彼らの動きを6分間、手作業で点数付けした。各運動性のカウントは、両後肢で区域の境界を横断したことで表され、方向を右又は左として記録した。実験は、盲検法で、防音室中で午前10時及び午前2時の間に行った。
群はT検定、一元配置分散分析(事後最小有意差)で比較し、生存率はカプラン・マイヤー分析によった。
GBM異種移植モデル
二つの実験モデルがインビボでGBM治療を研究するために開発された。神経膠腫細胞株はインビトロで効率的に増殖し、移植後脳内腫瘍をいつも産生する;しかし、これらの腫瘍は、インビボでは非侵襲性であり、それ故に、ヒト疾患のモデルとしては余り好適ではない。ヒトGBM生検スフェロイドは、対照的に、ヌードラットに異種移植後侵襲性増殖挙動を保持している。インビトロスフェロイド培養ステップは、再現可能な腫瘤を得るため、及び臨床症状の出現を同調させるために必須である。このモデルは、それ故、ヒトGBM疾患に関連する治療モデルを提供し、腫瘍領域への治療分子のCEDと組み合わせることができる。
実験的GBMが、ヒトGBM生検スフェロイドのヌードラット脳への異種移植によって確立された(Engebraaten et al., J. Neurosurg. 90:125-132)。異種移植片はヒトGBMの浸潤性増殖を示し(図2c)、対照ラットは、約2ヵ月後発症した(図2f)。
アポトーシス誘導を、DNA鎖切断を標識したTUNELアッセイを用いてインビボで試験した。CED完了の12時間後に得られた組織の形態計測解析は、HAMLET処置GBM細胞の33±7%が、α−ラクトアルブミン群における2±2%に比較して、TUNEL陽性であった(図3a、p<0.001)。アポトーシス効果は、通常の組織病理学によって確認され、HAMLET処置動物において典型的な核濃縮及び核凝縮を示した(図3a)。腫瘍を囲んでいる宿主の脳は、移植脳半球内へのHAMLET又はα−ラクトアルブミンのCED後アポトーシス又は壊死の証拠を示さなかった(図3a)。
GBM細胞におけるアポトーシスを誘導するHAMLETの能力を、インビトロで確認した。同じヒトのGBM由来の生検スフェロイドをインビトロでHAMLETに曝露し、アポトーシス細胞をTUNELアッセイによって同定し、同時にプロピジウムヨージド対比染色で総細胞集団を可視化した。HAMLET処置GBMスフェロイドは、スフェロイドの全体積の至るところに豊富なTUNEL染色を示した(図3b)。形態計測によって、核の93±7%(平均±SD)がアポトーシスになっていることが見出された。TUNEL陽性細胞が、0.35mM又はそれより高い濃度でGBMスフェロイドの全体積の至るところに観察され、治療研究のために選択された濃度の妥当性が確認された。組織病理によって、核濃縮及び核凝縮が、HAMLETに曝露されたGBMに観察された(図3bの矢印を参照)。
GBM生検スフェロイドを、3時間インビトロでHAMLETに曝露し、記載されているようにして、ヌードラットの脳に異種移植した。α−ラクトアルブミンで処置したスフェロイドを対照とした。腫瘍の大きさは、2ヵ月後MRIスキャンによって推定した。腫瘍は、α−ラクトアルブミン処置スフェロイドを投与された全てのラットに発症した(図4a)。腫瘍の平均的な大きさは、496(範囲286〜696)mm3であり、そしてラットは第56日から症状を発現した(図4c及びd)。この時点では、HAMLET処置スフェロイドは、検出可能な腫瘍を有しており、これらの腫瘍は、平均体積31(範囲28〜34)mm3を有し、α−ラクトアルブミン対照におけるよりも小さかった(図4b及びc)。より小さい腫瘍を有するラットは、84日後圧迫症状を発症した。残りの動物は、移植後210日の殺処分の時点で腫瘍はなく、無症候性であった(図4d、p<0.01)。
CEDによるHAMLET投与の効率を調べた。125I放射標識HAMLET(2〜10×106PPM)を線条体に挿入した針を用いてCEDによって注入し、脳全体のHAMLETの分布を、連続脳切片に対するオートラジオグラフィーによって検出した(図5)。HAMLETは、CEDの完了後12時間で、前脳から中脳までの全ての注入した半球に到達したことが示された。
HAMLETの潜在的な脳毒性を、健全なラットの線条体に入れたCED後3週間、MRI及び組織病理によって試験した。先の実験と同様に、α−ラクトアルブミン又は生理食塩水を対照とした。MRIによって、小嚢胞性病変が注入部位に見られたが、注入カニューレによって貫通された大脳皮質を含めて周辺の脳に浮腫又は組織損傷の徴候はなかった(図6aのT2強調スキャンを参照)。HAMLETと対照群の間に放射性の差はなかった。
上記実施例1に報告された試験に続いて、治療した腫瘍の生検試料を、この治療の終了時にとった。結果を、図7から9に示す。これらの図から明らかなように、内膜は失われ、血球が腫瘍の中心部全体に存在しており、このことは血管新生が阻害されたことを示している。
Claims (39)
- 動物、特にヒトの増殖性疾患の治療において使用するための、及び/又は血管新生を阻害するための薬剤の製造における、HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体の使用。
- 粘膜癌の治療において使用するための薬剤の製造における、HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体の使用。
- 粘膜癌が膀胱癌である、請求項2に記載の使用。
- 腫瘍に注入するための薬剤の製造における、HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体の使用。
- 腫瘍が内部器官の固形腫瘍である、請求項4に記載の使用。
- 内部器官が脳、肝臓、腎臓、前立腺及び卵巣から選択されたものである、請求項5に記載の使用。
- 内部器官が脳である、請求項6に記載の使用。
- 脳腫瘍がヒト膠芽細胞腫である、請求項7に記載の使用。
- 血管新生の阻害において使用するための薬剤の製造における、HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体の使用。
- 腫瘍細胞の転移を遅らせるための、請求項9に記載の使用。
- 生物活性のある複合体が、アポフォールディング状態であるα−ラクトアルブミン又はα−ラクトアルブミンの変異体、又はこれらのいずれか一方の断片、及び生物活性のある形態で複合体を安定化する補助因子を含み、但し、α−ラクトアルブミン又はその変異体のいずれかの断片が、α及びβドメインの間に接点を形成するα−ラクトアルブミンの領域に相当する領域を含む、請求項1〜10のいずれか1項に記載の使用。
- 補助因子が、シスC18:1:9又はC18:1:11脂肪酸又は類似の立体配置を有する異なった脂肪酸である、請求項11に記載の方法。
- 生物活性のある複合体が、pH4.6で沈殿したミルクのカゼイン分画からの単離によって、陰イオン交換クロマトグラフィーとゲルクロマトグラフィーの組合せによってか、又はα−ラクトアルブミンを、C18:1脂肪酸の特性を示す、ヒトミルクカゼイン由来の補助因子の存在下で、イオン交換クロマトグラフィーにかけることによってのいずれかで得られ得るHAMLETを含む、請求項1〜10のいずれか1項に記載の使用。
- α−ラクトアルブミンの生物活性のある複合体が、
(i)シスC18:1:9又はC18:1:11脂肪酸又は類似の立体配置を有する異なった脂肪酸;及び
(ii)カルシウムイオンが除去されたα−ラクトアルブミン、又はカルシウムイオンが除去されたか又は機能性カルシウム結合部位を有していないα−ラクトアルブミンの変異体;又はこれらのいずれか一つの断片(但し、いずれかの断片が、α及びβドメインの間に接点を形成するα−ラクトアルブミンの領域に相当する領域を含む);
を含む、請求項1〜10のいずれか1項に記載の使用。 - 生物活性のある複合体が、カルシウム結合部位が改変され、その結果カルシウムに対する親和性が減少しているか、又はそれがもはや機能的でない、α−ラクトアルブミンの変異体を包含する、請求項14に記載の使用。
- 変異が、ウシα−ラクトアルブミンのK79、D82、D84、D87及びD88に相当するアミノ酸の一つで変異を有する、請求項15に記載の使用。
- 改変が、D87A又はD87N変異体を有するα−ラクトアルブミンの変異体を包含するD87においてである、請求項16に記載の使用。
- 生物活性のある複合体が、α−ラクトアルブミン又はその変異体の断片を含み、その断片が天然のタンパク質のアミノ酸34〜86の全領域を包含するものである、請求項1〜10のいずれか1項に記載の使用。
- α−ラクトアルブミンが、ヒト又はウシα−ラクトアルブミン又はそれらのいずれか一方の変異体である、請求項1〜18のいずれか1項に記載の使用。
- α−ラクトアルブミンがヒトα−ラクトアルブミンである、請求項19に記載の使用。
- α−ラクトアルブミンがS70R変異を包含する変異体ウシα−ラクトアルブミンである、請求項19に記載の使用。
- HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体を患者に投与することを含む、ヒトの増殖性疾患を治療する、及び/又は血管新生を阻害する方法。
- 粘膜腫瘍を治療する方法であって、それを必要とする患者の粘膜腫瘍に、HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体を投与することを含む、上記方法。
- 粘膜腫瘍が膀胱癌である、請求項23に記載の方法。
- 生物活性のある複合体が膀胱内点滴注入によって投与される、請求項24に記載の方法。
- 生物活性のある複合体が200mgから1gの単回投与単位で投与される、請求項25に記載の方法。
- 投与単位が少なくとも5日間繰り返される、請求項26に記載の方法。
- 投与単位が連続した日々に行なわれる、請求項27に記載の方法。
- HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体を腫瘍に注入することを含む、癌を治療する方法。
- 複合体が担体として生理食塩水を更に含む組成物の形態で投与される、請求項29に記載の方法。
- 複合体が、運搬促進送達(CED)を用いて注入される、請求項29または30に記載の方法。
- 腫瘍が、脳、肝臓、腎臓、前立腺及び卵巣の腫瘍である、請求項29〜31のいずれか1項に記載の方法。
- 腫瘍が脳腫瘍である、請求項32に記載の方法。
- 腫瘍がヒト膠芽細胞腫である、請求項33に記載の方法。
- 血管新生を阻害する方法であって、それを必要とする患者に、HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体を投与することを含む、上記方法。
- 悪性皮膚腫瘍、特にメラノーマの治療において使用するための薬剤の製造における、HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体の使用。
- HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片から選択される、α−ラクトアルブミンの生物活性のある複合体を、メラノーマに適用することを含む、悪性メラノーマを治療する方法。
- HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片を含む生物活性のある複合体を腫瘍に適用することによる、インビボで、特にヒトにおける癌を治療する方法。
- インビボでのヒトの癌治療において使用するための薬剤の製造における、HAMLET若しくはその生物活性のある改変体、又はそれらのいずれかの生物活性のある断片を含む生物活性のある複合体の使用。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0404358A GB0404358D0 (en) | 2004-02-26 | 2004-02-26 | Therapeutic treatment |
| GB0404369A GB0404369D0 (en) | 2004-02-26 | 2004-02-26 | Novel therapies |
| GB0404339A GB0404339D0 (en) | 2004-02-26 | 2004-02-26 | Therapeutic treatment |
| PCT/GB2005/000685 WO2005082406A1 (en) | 2004-02-26 | 2005-02-24 | Lactalbumin for inhibiting angiogenesis |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007524708A true JP2007524708A (ja) | 2007-08-30 |
| JP2007524708A5 JP2007524708A5 (ja) | 2008-03-21 |
Family
ID=34915949
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007500287A Pending JP2007524708A (ja) | 2004-02-26 | 2005-02-24 | 血管新生を阻害するラクトアルブミン |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20080039381A1 (ja) |
| EP (1) | EP1727561A1 (ja) |
| JP (1) | JP2007524708A (ja) |
| WO (1) | WO2005082406A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0210464D0 (en) * | 2002-05-08 | 2002-06-12 | Svanborg Catharina | Therapeutic treatment |
| WO2008138348A1 (en) * | 2007-05-09 | 2008-11-20 | Nya Hamlet Pharma Ab | Preparation of complexed lactalbumin |
| US20100112702A1 (en) * | 2008-02-25 | 2010-05-06 | Klein Benjamin Y | Method designed to divert glucose away from the glycolytic pathway |
| WO2009135494A2 (en) * | 2008-05-09 | 2009-11-12 | Nya Hamlet Pharma Ab | Alpha-lactalbumin composition for the treatment of actinic keratosis |
| WO2010131237A1 (en) * | 2009-05-13 | 2010-11-18 | Agriculture And Food Development Authority (Teagasc) | A process for producing a biologically active globular protein complex |
| PL2882446T3 (pl) * | 2012-08-09 | 2018-10-31 | Hamlet Pharma Ab | Terapia profilaktyczna i nutraceutyczna |
| WO2024075003A1 (en) | 2022-10-03 | 2024-04-11 | Linnane Pharma Ab | A complex comprising a alpha-lactalbumin and a fatty acid or lipid for use in the treatment or prevention of cancer |
| GB202303177D0 (en) | 2023-03-03 | 2023-04-19 | Linnane Pharma Ab | Method of predicting response to treatment |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001524535A (ja) * | 1997-11-27 | 2001-12-04 | カタリーナ・スヴァンボルイ | 治療剤 |
| WO2003074547A2 (en) * | 2002-03-07 | 2003-09-12 | Catharina Svanborg | Biologically active complex comprising alpha-lcatalbumin or a variant thereof, and a cofactor |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2188903A (en) * | 1938-12-03 | 1940-02-06 | Dow Chemical Co | Polystyrene compositions |
| GB0210464D0 (en) * | 2002-05-08 | 2002-06-12 | Svanborg Catharina | Therapeutic treatment |
| GB0211658D0 (en) * | 2002-05-22 | 2002-07-03 | Svanborg Catharina | Novel therapies and methods of screening for therapeutic compounds |
-
2005
- 2005-02-24 US US10/590,938 patent/US20080039381A1/en not_active Abandoned
- 2005-02-24 EP EP05708451A patent/EP1727561A1/en not_active Withdrawn
- 2005-02-24 WO PCT/GB2005/000685 patent/WO2005082406A1/en active Application Filing
- 2005-02-24 JP JP2007500287A patent/JP2007524708A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001524535A (ja) * | 1997-11-27 | 2001-12-04 | カタリーナ・スヴァンボルイ | 治療剤 |
| WO2003074547A2 (en) * | 2002-03-07 | 2003-09-12 | Catharina Svanborg | Biologically active complex comprising alpha-lcatalbumin or a variant thereof, and a cofactor |
Also Published As
| Publication number | Publication date |
|---|---|
| US20080039381A1 (en) | 2008-02-14 |
| EP1727561A1 (en) | 2006-12-06 |
| WO2005082406A1 (en) | 2005-09-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2007524708A (ja) | 血管新生を阻害するラクトアルブミン | |
| CN107921062B (zh) | 组织修复和再生方法 | |
| ES2677005T3 (es) | Composición parenteral que comprende microesferas con un diámetro entre 10 y 20 micras | |
| PT1526867E (pt) | Eritropoietina em doses sub-policitémicas | |
| JP2009535328A (ja) | コンパートメント症候群の治療における使用のための抗分泌性タンパク質 | |
| JP2013216689A (ja) | 血管新生を増大させるための組成物および方法 | |
| Xing et al. | Progress in drug delivery system for fibrosis therapy | |
| WO2024193322A1 (zh) | 利培酮在治疗器官纤维化中的应用 | |
| Drixler et al. | Angiostatin inhibits pathological but not physiological retinal angiogenesis | |
| KR102015197B1 (ko) | 대상체에서의 혈관신생을 유도하기 위한 10000Da 미만의 평균 분자량을 가지는 황산덱스트란의 용도 | |
| TWI426082B (zh) | 癌症轉移的抑制 | |
| Shen et al. | High rapamycin-loaded hollow mesoporous Prussian blue nanozyme targets lesion area of spinal cord injury to recover locomotor function | |
| BR112020000115A2 (pt) | sais farmaceuticamente aceitáveis de polipeptídeos e uso dos mesmos | |
| Gong et al. | Dental pulp stem cell transplantation facilitates neuronal neuroprotection following cerebral ischemic stroke | |
| KR20200140277A (ko) | 허혈 재관류 손상 예방 및/또는 치료용 한약 조성물 | |
| JP7073486B2 (ja) | 興奮性神経毒性に関連した損傷の治療用ペプチド組成物 | |
| TWI482629B (zh) | 下泌尿道疾病治療劑及下泌尿道症狀改善劑 | |
| WO2015190989A1 (en) | The use of dextran sulfate having an average molecular weight below 10000 da for inducing angiogenisis in a subject | |
| JP2023500771A (ja) | アネキシンa5の用途 | |
| KR20220012940A (ko) | 망막병증 치료용 조성물 및 방법 | |
| CN111035766A (zh) | 红细胞和活化的血小板细胞膜作为载体在制备血栓治疗药物中的应用 | |
| US7807628B2 (en) | Therapeutic agent for dentin-pulp complex regeneration | |
| Yang et al. | Neuroprotective effects of anti-TRAIL-ICG nanoagent and its multimodal imaging evaluation in cerebral ischemia-reperfusion injury | |
| WO2007122280A1 (es) | Uso del factor de crecimiento de hígado (lgf) como regenerador tisular pleiotrópico | |
| WO2018008729A1 (ja) | 虚血性疾患の治療剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080130 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080130 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20080214 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101221 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110712 |