JP2007505905A - 疾患における免疫学的介入のための合成多糖抗原 - Google Patents
疾患における免疫学的介入のための合成多糖抗原 Download PDFInfo
- Publication number
- JP2007505905A JP2007505905A JP2006526901A JP2006526901A JP2007505905A JP 2007505905 A JP2007505905 A JP 2007505905A JP 2006526901 A JP2006526901 A JP 2006526901A JP 2006526901 A JP2006526901 A JP 2006526901A JP 2007505905 A JP2007505905 A JP 2007505905A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- formula
- cells
- compound according
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 CCCC(C)(CC)C(CCC(C(N)=O)NC([C@](C)NC([C@@](C)OC(C(*)[C@@](OC(C)(CC)CCC)OC1CO)[C@]1OC(C)C(C)CC)=O)=O)=O Chemical compound CCCC(C)(CC)C(CCC(C(N)=O)NC([C@](C)NC([C@@](C)OC(C(*)[C@@](OC(C)(CC)CCC)OC1CO)[C@]1OC(C)C(C)CC)=O)=O)=O 0.000 description 3
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/006—Heteroglycans, i.e. polysaccharides having more than one sugar residue in the main chain in either alternating or less regular sequence; Gellans; Succinoglycans; Arabinogalactans; Tragacanth or gum tragacanth or traganth from Astragalus; Gum Karaya from Sterculia urens; Gum Ghatti from Anogeissus latifolia; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/646—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the entire peptide or protein drug conjugate elicits an immune response, e.g. conjugate vaccines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K9/00—Peptides having up to 20 amino acids, containing saccharide radicals and having a fully defined sequence; Derivatives thereof
- C07K9/001—Peptides having up to 20 amino acids, containing saccharide radicals and having a fully defined sequence; Derivatives thereof the peptide sequence having less than 12 amino acids and not being part of a ring structure
- C07K9/005—Peptides having up to 20 amino acids, containing saccharide radicals and having a fully defined sequence; Derivatives thereof the peptide sequence having less than 12 amino acids and not being part of a ring structure containing within the molecule the substructure with m, n > 0 and m+n > 0, A, B, D, E being heteroatoms; X being a bond or a chain, e.g. muramylpeptides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/0006—Homoglycans, i.e. polysaccharides having a main chain consisting of one single sugar, e.g. colominic acid
- C08B37/0024—Homoglycans, i.e. polysaccharides having a main chain consisting of one single sugar, e.g. colominic acid beta-D-Glucans; (beta-1,3)-D-Glucans, e.g. paramylon, coriolan, sclerotan, pachyman, callose, scleroglucan, schizophyllan, laminaran, lentinan or curdlan; (beta-1,6)-D-Glucans, e.g. pustulan; (beta-1,4)-D-Glucans; (beta-1,3)(beta-1,4)-D-Glucans, e.g. lichenan; Derivatives thereof
- C08B37/0027—2-Acetamido-2-deoxy-beta-glucans; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/5555—Muramyl dipeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55583—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Abstract
Description
式I
で表される、直鎖で非−架橋性の免疫調整高分子化合物またはその製薬学的に入手可能な塩を提供し、
式中、
下付文字nは、ポリマー中の式Ymで表されるモノマー単位の数を意味し、2〜375の範囲の1つの整数であり;
上付文字mは、ポリマー中の式Ymで表される特定のモノマー単位の位置を意味し、左から右へ逐次的に、1〜nの連続した整数であり;
X1およびX2は、独立して、Hまたは末端基であり;
式Ymで表される各モノマー単位は独立して:
(a)YmがYnでない場合、式IIa:
式IIa
で表される基であり、または、
(b)YmがYnである場合、式IIb:
式IIb
で表される基であり、
ここで、
各R1 1、R2 1、...、Rn-1 1およびRn 1は、独立して、Hまたは低分子アルキルであり;
各R1 2、R2 2、...、Rn-1 2およびRn 2は、独立して、−OH、−NH2、アミノ酸基、または2〜10個のアミノ酸基を含むペプチドであり;ここで:
(a)各アミノ酸基は、独立して、DまたはLの立体配置を示し;
(b)各アミノ酸基は、非置換であるかまたはハロ、アルキル、ヒドロキシ、アルコキシ、フェノキシ、CF3、アミノ、アルキルアミノ、ジアルキルアミノ、−C(O)Oアルキルおよび−NO2から成る群より選択される1つ以上の基で置換されており;
(a)アミノ基は、独立して、γカルボキシル基のα位ならびにαまたはεアミノ基で結合しているか、またはそれらの組合せである、
ただし、直鎖ポリマーは以下のものではない:
(a)以下の式で示されるホモポリマー(ここでnは、75〜375):
または
(b)以下の式で示されるモノマー単位を含むホモポリマー:
(a)YmがYnでない場合、式IIIa:
式IIIa
で表される基であるか;または
(b)YmがYnである場合、式IIIb:
式IIIb
で表される基であり、
ここで、
各R1 3、R2 3、...、Rn-1 3およびRn 3が、独立して、−OHまたは−NH2であり;
各R1 4、R2 4、...、Rn-1 4およびRn 4が、独立して、−OHまたは−NH2、アミノ酸基、または2〜8個のアミノ酸基を含むペプチドであり、ここで:
(a)各アミノ酸基は、独立して、DまたはLの立体配置を示し;
(b)各アミノ酸基は、非置換であるかまたはハロ、アルキル、ヒドロキシ、アルコキシ、フェノキシ、CF3、アミノ、アルキルアミノ、ジアルキルアミノ、−C(O)Oアルキルおよび−NO2から成る群より選択される1つ以上の基で置換されており;
(c)アミノ酸基は、独立して、γカルボキシル基のα位、αまたはεアミノ基で結合しているかまたはそれらの組合せである。
(a)YmがYnでない場合、式IIIa:
式IIIa
で表される基であるか;または
(b)YmがYnである場合、式IIIb:
式IIIb
で表される基であり、
ここで、
各R1 3、R2 3、...、Rn-1 3およびRn 3が、独立して、−OHまたは−NH2であり;
各R1 4、R2 4、...、Rn-1 4およびRn 4が、独立して、−OHまたは−NH2、アミノ酸基、または2〜8個のアミノ酸基を含むペプチドであり、ここで:
(c)各アミノ酸基は、独立して、DまたはLの立体配置を示し;
(d)各アミノ酸基は、非置換であるかまたはハロ、アルキル、ヒドロキシ、アルコキシ、フェノキシ、CF3、アミノ、アルキルアミノ、ジアルキルアミノ、−C(O)Oアルキルおよび−NO2から成る群より選択される1つ以上の基で置換されており;
(e)アミノ酸基は、独立して、γカルボキシル基のα位、αまたはεアミノ基で結合しているかまたはそれらの組合せである。
(a)抹消血単核細胞または単核細胞を含む単核細胞分画を哺乳動物から単離し、
(b)in vitroにおいて、単離した抹消血単核細胞または単核細胞と、単核細胞を未熟樹状細胞へ分化させ得るサイトカインを有効量で含有する組成物とを、一定時間且つ単核細胞由来の未熟樹状細胞を十分に産生できる条件で接触させ、
(c)in vitroにおいて、単核細胞由来の未熟樹状細胞と有効量の式VIの化合物またはその製薬学的に入手可能な塩とを、一定時間且つ単核細胞由来の未熟樹状細胞が成熟するのを阻止できる条件で接触させ、
(d)単核細胞由来の未熟樹状細胞を哺乳動物に投与し、哺乳動物樹状細胞が有するT細胞のコグネイト相互作用を促進する能力を減じ、哺乳動物における炎症応答を阻止する、
を含む。
哺乳動物の樹状細胞またはその他の抗原提示細胞が成熟するのを妨げてT細胞の活性化を刺激できなくするために、式VIの化合物またはその製薬学的に入手可能な塩を有効量で哺乳動物に投与し、
それにより哺乳動物の炎症応答を抑制する、
を含む。
(a)抹消血単核細胞または単核細胞を含む単核細胞分画を哺乳動物から単離し、
(b)in vitroにおいて、単離した抹消血単核細胞または単核細胞と、単核細胞を未熟樹状細胞へ分化させ得るサイトカインを有効量で含有する組成物とを、一定時間且つ単核細胞由来の未熟樹状細胞が十分に産生される条件で接触させ、
(c)in vitroにおいて、単核細胞由来の未熟樹状細胞と有効量の式VIの化合物またはその製薬学的に入手可能な塩とを、一定時間且つ単核細胞由来の未熟樹状細胞が成熟するのを十分に阻止できる条件で接触させ、
(d)in vitroにおいて、未熟樹状細胞とナイーブT細胞とを接触させて制御性T細胞を産生し、
(e)エフェクターT細胞を抑制する制御性T細胞を哺乳動物に投与し、炎症応答を抑制する
を含む。
式VIの化合物またはその製薬学的に入手可能な塩を有効量で哺乳動物に投与し、
エフェクターT細胞を抑制し且つ炎症応答を阻止する制御性T細胞を産生する、
を含む。
化合物を哺乳動物に投与し、
Candinを哺乳動物に投与し、
Candinが惹起する遅延型過敏性皮膚外傷の阻害度を測定する、
を含み、
この際、哺乳動物の外傷寸法が、化合物を投与されていない未処理のコントロール哺乳動物の外傷寸法と比べて減少していれば、前記化合物が限局的な炎症応答の阻止に有効なことが明白である。
図面の詳細な説明
本発明の前記したまたはその他の側面、態様、特徴および利点は、添付の図面と共に記される以下の詳細な説明により詳しく理解されるが、全ての図面は単に例証するものであって本発明を制限するものではない。
本発明の以下の詳細な説明は当業者が本発明を実施する際の助けとなるよう提供されるものである。従って、当業者が本発明の精神または目的から外れることなくここに記載の態様を修飾および変化させることができ、その際、以下の詳細な説明は本発明を不当に制限するものと解釈されてはならない。
“Ac”はCH3C(O)−を意味する、
“アルキル”は、鎖中に炭素原子約1〜約20個を有する直鎖または分枝鎖であってよい脂肪族炭化水素である。好ましいアルキル基は鎖中に炭素原子を約1〜約12個含有し、より好ましくは本明細書で定義される低分子アルキルである。分枝とは、1つ以上の低分子アルキル、例えばメチル、エチルまたはプロピルが直鎖アルキル鎖に結合していることを意味する。“低分子アルキル”は、鎖中に炭素原子を約1〜約4個含有するアルキルで、直鎖または分枝鎖であってよい。
本発明の式Iの化合物は直鎖で非架橋性のポリマーであり、これには種々のホモポリマーおよびコポリマーが含まれる。このようなポリマーは例えばN−アセチルグルコサミンから化学的酵素学的に全合成して製造できる。更にその構造によって、本発明の化合物は炎症性または抗−炎症性のいずれかを示すことができる。
化合物1
式I
は、n個のYmで示される独立したモノマー単位を含む。下付き文字nはポリマー中の式Ymで表されるモノマー単位の数を示し、2〜375の範囲の1つの整数である。例えばn=2のときは2個のモノマー単位:Y1およびY2が存在する。n=3のときは3個のモノマー単位:Y1、Y2およびY3が存在する。n=375のときは375個のモノマー単位:Y1、Y2、…、Y374およびY375が存在する。
一組目:R1 1、R2 1、R3 1、…、Rn-1 1、Rn 1、
二組目:R1 2、R2 2、R3 2、…、Rn-1 2、Rn 2。
GMDP
GMDP-A
は炎症応答を誘導すると報告されている(米国特許明細書第4,395,399号参照)。同様に、高分子細菌ペプチドグリカンの購買入手可能なサンプル(Staphylococcus aureus,Sigma;Streptococcus pyogenes,Lee Laboratories)は、強力な炎症作用を示す(Staophylococcus属>Streptococcus属)。これらの物質が組成物中で不均質である間に、より小さな二糖類断片(そのうちの幾つかはペプチド架橋されている)をHPLCで精製して特徴づけたが、これも炎症性である。これらの物質の炎症能はその構造に依存すると報告されている(Tuomanen等(1993)J.Clin.Invest.92:297)。生物学的活性を有することが報告されている中で最小のペプチドグリカン断片はムラミルジペプチド(またはMDP)であり、その生物学的活性は自然界で炎症性である(Chedid(1983)Microbio.Immunol.27:723)。実際、以下に示すMDPおよびMDP−Aのモチーフは公知の炎症性化合物の一般的特徴である:
MDPモチーフ
MDP−Aモチーフ
(a)YmがYnでない場合、式IIIa:
式IIIa
で表される基であるか;または
(b)YmがYnである場合、式IIIb:
式IIIb
で表される基であり、
ここで、
各R1 3、R2 3、...、Rn-1 3およびRn 3が、独立して、−OHまたは−NH2であり;
各R1 4、R2 4、...、Rn-1 4およびRn 4が、独立して、−OHまたは−NH2、アミノ酸基、または2〜8個のアミノ酸基を含むペプチドであり、ここで:
(f)各アミノ酸基は、独立して、DまたはLの立体配置を示し;
(g)各アミノ酸基は、非置換であるかまたはハロ、アルキル、ヒドロキシ、アルコキシ、フェノキシ、CF3、アミノ、アルキルアミノ、ジアルキルアミノ、−C(O)Oアルキルおよび−NO2から成る群より選択される1つ以上の基で置換されており;
(b)アミノ酸基は、独立して、γカルボキシル基のα位、ならびにαまたはεアミノ基で結合しているかまたはそれらの組合せである。
(a)YmがYnでない場合、式IIIa:
式IIIa
で表される基;または
(b)YmがYnである場合、式IIIb:
式IIIb
で表される基、
ここで、
各R1 3、R2 3、...、Rn-1 3およびRn 3が、独立して、−OHまたは−NH2であり;
各R1 4、R2 4、...、Rn-1 4およびRn 4が、独立して、−OHまたは−NH2、アミノ酸基、または2〜8個のアミノ酸基を含むペプチドであり、ここで:
(h)各アミノ酸基は、独立して、DまたはLの立体配置を示し;
(i)各アミノ酸基は、非置換であるかまたはハロ、アルキル、ヒドロキシ、アルコキシ、フェノキシ、CF3、アミノ、アルキルアミノ、ジアルキルアミノ、−C(O)Oアルキルおよび−NO2から成る群より選択される1つ以上の基で置換されており;
(c)アミノ酸基は、独立して、γカルボキシル基のα位、ならびにαまたはεアミノ基で結合しているかまたはそれらの組合せである。
多くの細菌抗原は病原体関連微生物パターン(pathogen−associated microbial patterns、PAMP)と称される高度に保存された構造モチーフを介して免疫系に信号を送っている(Medzhitoz(2001)Nat.Rev.Immunol.135〜145)。PAMPは種々の抗原提示細胞に存在するToll様レセプター(TLR)と相互に作用してシグナルカスケードを開始し、その結果IL12およびIL6のような前−炎症性サイトカインならびに種々のケモカインが発現される(Janeway等(2002)Annu.Rev.Immunol.20:197〜216)。TLRを介した抗原提示細胞、特に樹状細胞の活性化は、成熟過程を導き、この過程は表面MHCII分子ならびにCD80およびCD86のような共−刺激分子の発現増加により特徴付けられる(Chakraborty等(2000)Clin.Immunol.94:88〜98)。このカスケードは生得的免疫系の初期防御分子を秩序立って配列しているので侵入に迅速な応答ができ、長い期間を経て獲得された適応免疫(T細胞への抗原提示を介する)へ繋ぐための基礎を形成している(Keller(2001)Immunol.Lett.78:113〜122)(図1参照)。化合物1は天然細菌細胞壁由来のペプチドグリカンを模倣したものであるが一本鎖であるので、このポリマーが、TLRを介して信号を送ることのできるPAMPを有していると考えられる。実際、天然のペプチドグリカンはTLR2のリガンドである(Schwandner等(1999)J.Biol.Chem.274:17406〜17409)。意外にも、本明細書に記載するように、式VIの化合物の代表例である化合物1は、ヒトまたはその他のげっ歯類細胞のいずれで試験してもTLR2またはその他のTLRを活性化しない。このことは、化合物1で刺激するとPBMC培養液中でIL12、IL6またはその他の前−炎症性サイトカインが発現しないことからも明らかである。更に、ヒト単核細胞誘導樹状細胞はこの化合物の刺激で成熟しない。樹状細胞が最も強力な抗原提示細胞であり、分子を多く取り込んで細胞内空砲へ集結させるにもかかわらず、化合物1で処理した後、未熟樹状細胞はその表面に存在するMHCII、CD80またはCD86による特徴的なアップレギュレーションを起こさない。
樹状細胞(DC)は、殆ど全ての器官で見出される抗原提示細胞の主要なファミリーである。樹状細胞のサブタイプは明確に定義されており、これらの細胞種がその寿命の間に幾つかのレベルの分化および成熟を通して進化することが証明されている(Jonuleit等(2001)Trends in Immunol.22:394〜400)。未熟樹状細胞は、MHCII分子を僅かしか発現せず、同様に共−刺激分子CD80およびCD86も限られた発現しか示さないことに特徴を有する。これらの表面分子の発現は、INFγのような炎症刺激に対する応答または細胞抗原との相互作用を介したTLRの活性化に対する応答において、劇的にアップレギュレートされている。機能上、抹消の未熟DCは特に抗原の捕捉および処理に精通している。成熟DCはこのような活性をダウンレギュレートし、MHCIIによる抗原提示ならびにCD80およびCD86による共−刺激を介してナイーブT細胞を刺激する能力を強くアップレギュレートする(Banchereau等(2000)Annu.Rev.Immunol.18:767〜811)。図1に要約を示す。
幾つかの研究室が行った最新の研究から、未熟樹状細胞が制御性T細胞産生に関わる重要な成分であることが証明された(Jonuleit等(2001)Trend Immunol.22:394〜400)。制御性T細胞は、抹消の寛容を維持し、自己免疫から保護し、微生物の侵入または組織損傷に対して適切な応答ができるように炎症を調整し、同時に第三者による有害な作用から宿主を保護している(Maloy等(2001)Nat.Immunol.2:816〜822)。
免疫療法として組み換えIL10を使用するという発想は広く受け入れられている(Madsen(2002)Gastroenterl.123:2140〜2144);Barnes(2001)Curr.Opin.Allergy.Clin.Immunol.1:555〜560;Bremeanu等(2001)Int.Rev.Immunol.20:301〜331;St.Clair(2000)Curr.Cir.Autoimmun.2:126〜149)。IL10が効果を有することを示す、例えば炎症性腸疾患(IBD)、クローン病、慢性関節リウマチ、自己免疫性糖尿病およびアレルギー性疾患等の動物炎症モデルが多数存在する(Madsen(2002)Gastroenterol.123:2140〜2144;Barnes(2001)Curr.Opin.Allergy Clin.Immunol.1:555〜560;Bremeanu等(2001)Int.Rev.Immunol.20:301〜331;St.Clair(2000)Curr.Dir.Autoimmun.2:126〜149)。しかし、炎症性腸疾患の治療に組み換えIL10を用いた臨床試験では雑多な結果となった。繰り返し多量投与する条件では、数例で毒性を示し、効果を発揮できなかった。制御性T細胞の活性を介して内在IL10を選択的に産生する個体免疫系を利用すれば、より好ましい免疫療法手段になると思われる。宿主の免疫系の範囲で調整して内在IL10を発現させれば、反復投与の条件またはサイトカイン毒性の問題が回避され、好ましい形で効果が得られると考えられる。更に、ある細胞群を選択的に強化すれば、強力なサイトカイン等の理想的な輸送系が確立できると考えられる。免疫細胞群の本来の性質は、体内の炎症部位への輸送能である。式VIの化合物を処理した樹状細胞を介する特別な輸送シグナルを受けた免疫細胞群は、特定部位に集積して、局部的にIL10の発現を誘導すると考えられる。このような治療的アプローチは、強力なサイトカインを全身投与した際に生じる問題を回避し、免疫メディエーターが有する元来の局部的作用をより好ましい形で擬態すると考えられる。
腹腔内膿瘍は、腹腔が結腸細菌に汚染された結果形成される。腹腔内膿瘍は一般的に外傷または外科的処置により生じるものである。細菌は様々な炎症応答を刺激し、結果、マクロファージ、多形核白血球(PMN)、リンパ球を動員し、IL1β、TNFα、TNFβ、IL17のような種々の炎症性メディエーターおよび多数のサイトカインを放出させる(Whal等(1986)J.Exp.Med.163:884〜891;Tzianabos等(2002)Curr.Opin.Micro.5:92〜95)。この応答が誘導し得る1つの結果は、フィブリン層で織編された種々の免疫細胞による侵入細菌の封入である。一度形成されると、膿瘍は抗生物質療法にかなりの耐性を示し、患者はしばしば膿瘍を取り出すために外科的処置を求める。危険を承知で予防のために抗生物質を投与しても、この処置は必ずしも好結果に至らない。制御性T細胞の活性およびIL10の発現を介して宿主の応答を調整することで膿瘍の形成を初期の段階で食い止めるという方法がより好ましい治療形態であり、危険な外科的処置に変わって一般的治療法と成り得ると考えられる。
術後癒着は、腹部の手術、婦人家系の手術、整形外科系の手術および心胸部の手術で生じる重篤な合併症である。腹腔および骨盤腔では高い罹患率を示し致命傷となることもある。症状発現前のモデルでは、IL10を外から投与することで癒着の形成が抑制された(Laan等(1999)J.Immunol.162:2347〜2352;Chung等(2002)J.Exp.Med.195:1471〜1476)。しかし、人間医学における最新治療では手術で傷ができた後に癒着が形成されるのを抑制することが求められる。その方法として術部へのジェルまたはバリア製品の導入が含まれる。これらの製品は感染速度を速め、十分な効力がなく、医療分野では使用頻度が比較的低いため、好ましい結果はあまり得られない。
化合物1が炎症刺激に対する制御性T細胞群の応答を介してその保護作用を惹起するという仮説の立場から、臨床試験で活性を測定するために特別な方法を開発する必要がある。臨床実験の初期のフェーズでは一般的に健康なボランティアを対象として安全性と用量応答性を評価するので、その内容に、特異的炎症病変の誘導または測定が含まれるとは限らない。従って、この化合物の活性を測定するには、代用物としてバイオマーカーを開発する必要がある。皮膚の遅延型過敏症(DTH)反応はこの数十年の間、人がMycobaterium tuberculosis(TB)に曝露されたかを判断するために使用されており、近年では、免疫無防備状態に対するT細胞の応答性を測定するために使用されている(Anderson等(1968)Immunology15:405〜409;Gray等(1994)Curr.Opin.Immunol.6:425〜437;Kuby等(2000)Immunology,W.H.Freeman and Co.)文献に記載される実験は、DTH応答が主にT細胞によって仲介され、炎症活性はDTH細胞によってのみナイーブ動物へ選択的に伝達されることを証明している(Elices等(1993)Clin.Exp.Rheumatol.11:s77〜s80)。本明細書に記載するようにして、式VIの化合物が有する皮膚における限局的な炎症反応を制限する能力を評価するために、モルモットのDTHモデルを開発した。DTH応答の直接測定は人間およびモルモットで容易に実施および評価できる。発赤、じんま疹および/または硬化を発見でき、皮膚表面上で容易に定量測定できる。このアッセイで炎症性T細胞の活性を惹起するために使用される抗原は、Candida albicans(Candin)由来であり、昨今では移植治療を受けた患者またはAIDに罹患している患者の免疫応答能を測定するために臨床的に使用されている。また、この抗原は一般的個体群にとってTB抗原よりも安全である。CD4+CD25+制御性T細胞がC.Albucabsに対する記憶と防御免疫とに必須の成分であることが文献に報告されたが(Montagnoli等(2002)J.Immunol.169:6298〜6308)、これらの結果は、式VIの化合物の保護作用が制御性T細胞活性に由来するものであることを更に明確にしている。
以下に記載するのは、合成多糖抗原(化合物1)のような免疫調整分子が哺乳動物において抗−炎症作用を指示および惹起するメカニズムの詳細な研究についてであり、これには制御性T細胞群の誘導も含まれる。これらの研究から以下の図式が明らかになり、図2にその要約を示している。
化合物2に代表される式Vの化合物は、TNF−αが産生される炎症応答を刺激する。化合物2は、細菌全体または細菌細胞壁抗原と同様の方法で、おそらくはTLR2を介して、免疫細胞と相互作用すると考えられる。この場合、式Vの化合物とTLR2−保持細胞との相互作用が炎症に特徴的なマーカーを刺激する。これは、場合によって、侵入した病原体を検出した後に炎症細胞が作用を開始することを示唆している。この考えは図8に要約されている。
本明細書に記載される式Iの化合物は、その構造に応じて、炎症病変を予防または治療したりあるいは炎症が人間およびその他の動物に有益な治療効果または予防効果をもたらす病状または容態に関連して炎症を誘導したりできる。従って、本発明は1つの側面として、式Iの化合物またはその製薬学的に入手可能な塩を、製薬学的または生理学的に使用可能なバッファー、キャリアー、医薬品添加物または希釈剤ならびに任意の別の治療薬と一緒に含有する、人および獣に臨床使用できる医薬品を提供する。特記すべきは、本発明の化合物が個々に投与することも、2種類以上の化合物を含む混合物として投与することも可能な点である。本発明はまた、式Iの化合物またはその製薬学的に入手可能な塩を、炎症病変あるいは炎症免疫応答が有益な病状または容態の予防用または治療用薬剤の製造に使用することを含む。そのような使用において化合物VまたはVIのいずれを使用するかは、どのような免疫応答が治療に望ましいかによって判断される。
反復単位に正および負の電荷を等しく有して平衡した電荷を示す本発明の両性イオン分子は、時間が経つにつれ、相互に凝集し且つ/または電荷−電荷引力により分子内に圧縮される。本明細書に記載の化合物1は、代表的な平衡電荷両性イオン分子であり、以下に示すように、望ましい抗−炎症活性を示す。医薬品中に含まれるこの種の分子により炎症の免疫調整活性はしだいに停滞するが、表面活性剤または分散剤、例えばポリエチレングリコール、グリセロール、スクロース等を含有させて凝集を最小に留める製造技術により最適化できる。
適切に選択された本発明の化合物を、術後癒着および細菌感染による腹腔内膿瘍を含む種々の炎症病変に対する保護作用を誘導するためまたは炎症が有益な治療効果または予防効果をもたらす様々な病状または障害に関連する炎症を誘導するためのいずれかの目的に有効な量で投与してよい。このような目的での有効量とは、本発明の抗−炎症性または炎症性化合物が、それぞれ、単独でまたは更なる投与であるいは付加的な治療用化合物と一緒に、炎症病変を阻害、改善または予防するかあるいは治療上有効な炎症応答を刺激するかのいずかを可能にする量である。投与量は約1ピコグラム/体重1キログラム〜約1ミリグラム/体重1キログラム、あるいは約1ナノグラム/体重1キログラム〜約1マイクログラム/体重1キログラムの範囲であってよい。絶対量は、治療すべき疾患または障害の性質がどんなものか、予定手術での投与か緊急手術での投与か、併用療法なのか、投与回数は何回か、年齢、身体条件、身長および体重を含む患者の個人的パラメーターがどんなものか、治療する疾患または障害の重症度はどの程度か、等の様々なファクターに依存し、更に決まりきった実験を行わなくても開業医が決定できる値である。極量で用いるのが一般的に好ましく、極量とは信頼に値する医学的判断に即した最大安全薬剤量である。本発明の医薬品を複数回投与することも検討されている。
内分泌系:(甲状腺)橋本甲状腺炎、グレーブス病、甲状腺機能亢進による甲状腺炎;I型多腺性自己免疫症候群、II型多腺性自己免疫症候群、インシュリン−依存性真性糖尿病、免疫の関与した不妊症、および自己免疫アジソン病。
結合組織疾患、例えば全身性エリテマトーデス、慢性関節リウマチ、全身性硬化症(強皮症)、強直性脊椎炎、反応性関節炎、タハツセイ筋炎/皮膚筋炎、シェーグレン症候群、混合型結合組織病、ベーチェット病、乾癬。
<実施例1>
式Iの化合物の一般的調製
式Iの化合物は、例えば式IV:
式IV
の脂質II基質を重合して製造でき、この際、R5は脂質キャリアーであり、その他の変数は本明細書に記載した通りである。好適な脂質キャリアーには例えば1つ以上の炭素を有する飽和および不飽和の炭化水素鎖が含まれる。この鎖は直鎖または分枝鎖であってよい。この炭化水素はまた置換(例えば過フッ素化)されていても非置換でもよい。この炭化水素鎖は5〜55個の炭素と1〜11個のプレニル単位を有するのが好ましく、25〜55個の炭素と5〜11個のプレニル単位を有するのが更に好ましく、40〜55個の炭素と8〜11個のプレニル単位を有するのが最も好ましい。式IVの脂質II基質は例えば国際公開WO01/79242A3、WO02/085929A1および米国特許明細書第6,461,829号に記載される方法に従って製造できる。例えば本明細書に記載される方法に従い、単官能トランスグリコシラーゼMgtAを使用するかまたは米国特許明細書第6,461,829号に記載される任意の単官能またはニ官能トランスグリコシラーゼを使用し、脂質II基質を重合することにより式Iの化合物を製造することができる。
本明細書に記載される式IVの脂質II基質分子の20mM原液を準備する。PEG8000(水中に50%で貯蔵)を水で希釈し約20%(w/w)にする。PEG溶液へpH7.0の0.5M HEPESバッファー、1M 塩化マグネシウム水溶液および脂質II基質を添加し、それぞれ終濃度を20mM、25mMおよび2mMとする。得られた溶液を混合して均質にする。Staphylococcus aureus MtgA酵素原液を約120μMで添加して反応を開始するので、酵素の終モル濃度は10μMである(約200:1=基質:酵素)。反応溶液をしっかり混合し、24hr静かに放置する。
式IVの様々な脂質II基質分子の重合速度は大して変動しない。結果的に、式IVの異なる脂質II基質分子を含む混合物が重合してコポリマーが生じる。当業者は、公知の方法を用い、異質モノマー単位の数およびそのような単位が生じる頻度の両方を変化させてコポリマーを製造できることを正しく認識している。コポリマーを調製するにあたり、原液は、全脂質II基質分子を約20mMの濃度で含むのが好ましい。
式Iの化合物の構造確認は、デキストランを標準物質とするサイズ排除クロマトグラフィーとD2O/CD3CN中での1Hnmr分光光度分析により実施される。材料をリゾチームで分解し、リゾチームによる二糖−ペプチド分解産物はES/MSで分析できる。
化合物3
化合物1
白色粉末(370mg)を水(14.5mL)に溶解することにより、化合物3の20mM原液を調製する。水へPEG8000(28.8mL、水中の50%貯蔵溶液)を添加する。この溶液へpH7の0.5Mリン酸ナトリウムバッファー(5.8mL)と1M塩化マグネシウム水溶液(3.6mL)を添加する。得られた溶液を3つのコニカルチューブへ等量に分配し、それぞれに化合物3の原液(4.8mL)を混合しながら添加する。Staphylococcus aureus MtgA酵素の原液(米国特許明細書第5,922,540号(123μM;3.9mL))を添加して重合反応を開始する。反応溶液をしっかりと混合し、24hr静かに放置する。
化合物1の構造確認はサイズ排除クロマトグラフィー、1H NMR分光法、酵素感受性および質量分析により実施される。サイズ排除クロマトグラフィー(3.2mm×30mm Pharmacia Superose6カラム、pH=7の20mMリン酸ナトリウムバッファー)は、デキストランを標準物質として約150kDのサイズ分布中点を示す(範囲は約75kD〜約375kD)。
1H NMR(400MHz、D2O)δ4.45(br s,1H)、4.32(br s,1H)、3.50(br m,13H)、2.90(m,2H)、2.26(M,2H)、1.95(s,3H)、1.89(s,3H)、1.75(m,3H)、1.62(m,3H)、1.31(m,6H)。
化合物4 化合物2
化合物4の20mM原液を調製する。PEG8000(水中の50%貯蔵溶液)を水で希釈して約20%(w/w)とする。PEG溶液へpH=7.0の0.5M HEPESバッファー、1M塩化マグネシウム水溶液および化合物4を添加し、それぞれ終濃度を20mM、25mMおよび2mMとする。得られた溶液を混合して均質化する。Staphylococcus aureus MtgA酵素原液を約120μMで添加することにより反応を開始するので、酵素の終モル濃度は10μMである(約200:1=基質:酵素)。反応溶液をしっかり混合し、24hr静かに放置する。
分析用クロマトグラフィーカラムSuperose6(3.2mm×30cm)を用いたサイズ排除クロマトグラフィー(SEC)(25μL注入;20mMリン酸ナトリウムの移動相、pH7、流速50μL/分、60分間実施(定組成))および206nmでのUV検出により化合物2を分析した。25〜270kDのデキストランを標準物質として検量に使用した。
化合物4の質量スペクトル分析:
ES/MS m/z=1264.1(M−H)、642.8[(M−2+Na)/2]、631.5[(M−2)/2]、1265.7(M+H)、807.4(グリコシルカチオン)、644.4[(M+H+Na)/2]、655.4[(M+2Na)/2]、633.5[(M+2)/2]。
ヒト末梢血単核細胞での式VIの化合物によるIL10発現の刺激
天然ペプチドグリカンおよび細菌莢膜抗原がin vitroおよびin vivoで炎症性サイトカインを刺激することが知られているので、我々は式VIの化合物(例えば化合物1)に曝露したヒト末梢血単核細胞(PBMC)から誘導されるサイトカインの概要の決定を試みた。
式VIの化合物とToll様レセプター2(TLR2)の相互作用
Toll様レセプター(Toll−like―receptors(TLR))は、体内の微生物の存在を感知することにより、侵入した病原に対する初期先天免疫に重要な役割を果たす(Akira等(2001)Nature Immunol.2:675〜680)。このレセプターは病原菌によってのみ発現される高度に保存された構造モチーフを認識し、病原体関連微生物パターン(PAMP)と称される(Medzhitov(2001)Nat.Rev.Immunol.135〜145)。PAMPには様々な細菌細胞壁成分、例えばリポポリサッカライド(LPS)、ペプチドグリカンおよびリポペプチド、ならびにフラジェリン、細菌DNAおよびウイルス二本鎖RNAが含まれる。PAMPでTLRを刺激するとシグナルカスケードが開始し、転写因子NF−κBの活性化が誘導され、NF−κBは前炎症性サイトカインおよびエフェクターサイトカインの分泌を誘導し、これが適応免疫応答を指示する(Janeway等(2002)Annu.Rev.Immunol.20:197〜216)。天然ペプチドグリカンはTLR−2を介して細胞を活性化するPAMPであるので(Iwaki等(2002)J.Biol.Chem.277:24315〜24320)、式VIの化合物(例えば化合物1)もin vitroでNF−κBを活性化できるかどうか試験した。
式VIの化合物とその他のToll様レセプター(TLR)の相互作用
化合物1とTLR2の相互作用を調べる実験と同時に、前記実施例1に記載されるのと同じNFκBレセプターアッセイ(表1)を用いて、化合物1とより広い範囲のTLRの相互作用についても試験した。結果を表2に示す。
式VIの化合物はヒト樹状細胞(DC)の成熟を刺激しない
DCは抗原提示を専門に行う細胞であり、免疫系の歩哨である(Banchereau等(2000)Annu.Rev.Immunol.18:767〜811)。DCは殆ど全ての末梢組織に未熟状態(iDC)で存在し、抗原を貪食(または封入)して処理し、特にナイーブT細胞のような免疫系に提示する(Shortman等(2002)Nat.Rev.Immunol.2:151〜161)。処理抗原という積荷と共に、樹状細胞は、血液およびリンパ液の循環を介してリンパ節、脾臓および他のリンパ組織へ移行する。この移動の間に樹状細胞は成熟し、抗原を取り込んで処理する能力を失い、抗原をその表面に提示し始める。目的の場所に到達するまでに、樹状細胞はT細胞の強力な刺激物質となり、多触手状(樹状)形状のおかげで多くのT細胞との細胞−細胞接触を進行させる(Banchereau等(2000)Annu.Rev.Immunol.18:767〜811)。
表4:化合物1またはLPSとインキュベートした後の単核細胞−由来樹状細胞のフローサイトメトリー分析
未熟ヒト樹状細胞(iDC)による式VI化合物の取り込み
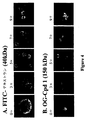
化合物1によるDC成熟の阻害は、化合物1のような分子を樹状細胞が内部処理できないためと考えられる。抗原の取り込みおよび処理(分解)はAPCの2つの基本特性である(Banchereau等(2000)Annu.Rev.Immunol.18:767〜811)。DCはその強力なエンドサイトーシス能から免疫系である意味最も強力なAPCであり、あるいはその環境を映す最も有効な実験材料である(Shortman等(2002)Nat.Rev.Immunol.2:151〜161)。iDCが、化合物1に代表される式VIの化合物のような高分子量免疫調整多糖抗原をエンドサイトーシスにより取り込むことができるかどうかを調べるために、共焦点顕微鏡を使用した取り込み試験に用いる化合物1の蛍光誘導体を調製する。この画像技術を利用することで、蛍光プローブ、例えばオレゴングリーン標識した本明細書の化合物の細胞内での存在箇所を突き止めることができる。この実験ではコントロール分子として蛍光標識(FITC)デキストランポリマーを使用する。デキストラン(40kDaの大きさ)は、エンドサイトーシスの実験に常用される高分子である(Sallusto等(1995)J.Exp.Med.182:389〜400)。デキストランは高分子量炭化水素ポリマーであるので、化合物1の有用な比較物質となる。
ヒト未熟樹状細胞(iDC)による式VIの化合物の取り込み動態
化合物1がiDCにより強力に取り込まれると考えられることから(図4)、蛍光標識した化合物1を使用し、ポリマーの取り込み動態をフローサイトメトリーで視覚化する。
LPSが誘導するiDCの成熟に対する式VIの化合物の阻害作用
表4(実施例5)に示すように、50μg/mlでLPSはiDCをmDC表現型へ変化させることができ、この変化は共−刺激マーカー(CD83およびCD86)ならびにクラスII主要組織適合複合体(MHC)マーカー(HLA−DR)の増加により特徴付けられる(Chakraborty等(2000)Clin.Immunol.94:88〜98)。次に式VIの化合物(代表例は化合物1)がiDCからmDCへの変化を阻害できるかどうか調査した。結果を表5に示す。
式VIの分子はポリクーナルなマイトジェンではなく、ヒトPBMC培養液中のリンパ球の増殖を刺激しない
マイトジェンは、DNA合成およびリンパ球の細胞分裂を非特異的に誘導する物質である。LPSはB−細胞に特異的なマイトジェンであるが(Moller等(1973)J.Infect.Dis.128:52〜56)、フィトヘマグルチニン(PHA)は特異的にT細胞の分裂を誘導する(Boldt等(1975)J.Immunol.114:1532〜1536)。ペプチドグリカンは別のT細胞マイトジェンである(Levinson等(1983)Infect.Immun.32:290〜296)。従って、式VIの化合物(代表例は化合物1)に関し、特に化合物1が完全に合成されたペプチドグリカンである場合、ヒト末梢血単核リンパ球(PBMC)を刺激して培養物を分裂させられるかどうか調査した。この実験では、放射線標識ヌクレオチド塩基の増殖細胞DNAへの取り込みにより細胞分裂を確認する。培養物の放射能の計数毎分(cpm)は細胞増殖を直接測定する方法であり、シンチレーションカウンターで測定される。
式VIの化合物は抗−CD3抗体の誘導するヒトPBMCリンパ球の増殖を抑制する
抗体(Ag)が抗原提示細胞(APC)の表面のMHCIIをナイーブT細胞に提示する時、MHC−Ag複合体とT細胞表面上のT細胞レセプター(TCR)/CD3複合体が接触する(Weiss等(1986)Annu.Rev.Immunol.4:593〜619)。これら2種類の細胞上のCD28−B7(CD80、CD86)相互作用により生じる増幅シグナルと一緒になって、前記相互作用はT細胞活性化、サイトカイン刺激および細胞分裂を誘導する(Weiss等(1986)Annu.Rev.Immunol.4:593〜619)。AgまたはAPCが存在しなくてもTリンパ球はプレートに結合させた抗−CD抗体とのインキュベーションでin vitroにおいて活性化され増殖し得る(van Lier等(1989)Immunol.68:45〜50)。抗体による活性化を模倣し、T細胞にCD3抗体を結合させると、チロシンキナーゼが活性化され、細胞内カルシウム濃度が上昇し、ジアシルグリセロールが産生され、プロテインキナーゼCが活性化される。カルシウムおよびプロテインキナーゼCのいずれも遺伝子活性化を誘導する細胞内メッセンジャーとして働く(van Lier等(1989)Immunol.68:45〜50)。図6に例示するように、抗−CD3抗体−関連T細胞増殖も、分裂細胞のDNAへの[3H]−チミジンの取り込みにより測定できる。
式VIの化合物および抗−CD3抗体で処理した後のヒトCD3+細胞のマイクロアレイ分析
マイクロアレイテクノロジーを用いてサイトカイン調整を測定することにより、図3に示すサイトカイン発現の結果を再確認し評価する。
式VIの化合物による腹腔内膿瘍形成からの保護
化合物1が、in vitroで抑制機能を示す制御性T細胞を誘導し、同時にヒトPBMCからのIL10の遅い時期の産生を誘導するので(それぞれ実施例10および実施例2)、in vivoにおいてこの合成ポリマー抗原が炎症性の膿瘍形成から動物を守ることができるかその能力を評価することにした。この疑問に取り組むためにラットの腹腔内膿瘍モデルを使用する。
式VIの化合物による術後癒着の発生率および重傷度の低減
外因性IL10は術後癒着の形成を制限することが知られている(Holschneider等(1997)J.Surg.Research70:138〜143)。更に、制御性T細胞は強力な抗−炎症活性を有し、in vivoモデルで炎症を抑制することが知られている(Maloy等(2001)Nat.Immunol.2:816〜822;Shevach(2002)Nat.Rev.Immunol.2389〜400)。制御性T細胞はその標的である炎症性T細胞からIL10の産生を惹起することも知られている(Diekman等(2002)J.Exp.Med.196:247〜253)。上記の実施例2、10、11および12で多角的に示されるように、化合物1はPBMCからのIL10の産生を刺激し、in vitroでは制御性T細胞の数および作用を増強し、in vivoでは膿瘍形成から防御する。線維素沈着を起こし膿瘍を形成する炎症応答が、癒着の形成の病理学的性質に類似するので、癒着モデルに化合物1を処理すると、同じように制御性T細胞の活性が刺激され、最終的にIL10が内部産生され、その結果、術後癒着の形成が減少するという仮説を立てた。
モルモットモデルで式VIの化合物がもたらす遅延型過敏反応に対する阻害作用
式VIの化合物(代表例は化合物1)のような免疫調整薬の安全性および有効性を臨床評価するには、手頃なバイオマーカーが必要である。安全性および投与量は一般的に健康なボランティアで決定され、その場合、特定の炎症過程を調査することはできないので、バイオマーカーは必須である。さらに、膿瘍および/または癒着はすぐに生じるわけではないので、このようなバイオマーカーは実験の後半で役に立ち、免疫調整薬を用いた治療後に非−侵入的なやり方で治療効果を格付けできる。それ故、遅延型過敏症(DTH)動物モデルを開発した(Gray等(1994)Curr.Opin.Immunol.6:425〜437)。このアッセイは、現存する免疫調整薬を用いた臨床効果試験用のバイオマーカーとして人間にも使用できる。臨床上、DTH皮膚試験は人の免疫適格性の総体的評価に非常に有用である(Gray等(1994)Curr.Opin.Immunol.6:425〜437;Kuby等(2000)Immunology、W.H.Freeman and Co)。この試験には、下記に記載するCnadinの投与が含まれ、この薬剤はAIDS患者の免疫適格性を調べるのに常用されるものである。
式VおよびVIの化合物によるヒトPBMCのTNF−αの分化誘導
式VおよびVIの化合物が、ヒト末梢血単核細胞による前−炎症性サイトカインTNF−αお産生を誘導する能力を有するかを以下のようにして調査する。
Claims (41)
- 式I:
式I
で表される、直鎖で非−架橋性の免疫調整高分子化合物であり、
式中、
下付文字nは、ポリマー中の式Ymで表されるモノマー単位の数を意味し、2〜375の範囲の1つの整数であり;
上付文字mは、ポリマー中の式Ymで表される特定のモノマー単位の位置を意味し、左から右へ逐次的に、1〜nの連続した整数であり;
X1およびX2は、独立して、Hまたは末端基であり;
式Ymで表される各モノマー単位は独立して:
(a)YmがYnでない場合、式IIa:
式IIa
で表される基であり、または
(b)YmがYnである場合、式IIb:
式IIb
で表される基であり、
ここで、
各R1 1、R2 1、...、Rn-1 1およびRn 1は、独立して、Hまたは低分子アルキルであり;
各R1 2、R2 2、...、Rn-1 2およびRn 2は、独立して、−OH、−NH2、アミノ酸基、または2〜10個のアミノ酸基を含むペプチドであり;ここで:
(j)各アミノ酸基は、独立して、DまたはLの立体配座を示し;
(k)各アミノ酸基は、非置換であるかまたはハロ、アルキル、ヒドロキシ、アルコキシ、フェノキシ、CF3、アミノ、アルキルアミノ、ジアルキルアミノ、−C(O)Oアルキルおよび−NO2から成る群より選択される1つ以上の基で置換されており;
(d)アミノ基は、独立して、γカルボキシル基のα位ならびにαまたはεアミノ基で結合しているか、またはそれらの組合せである、
ことを特徴とする、直鎖で非−架橋性の免疫調整高分子化合物、またはその製薬学的に入手可能な塩、ただし、直鎖ポリマーは以下のものではない:
(a)以下の式で示されるホモポリマー(ここでnは、75〜375):
または
(b)以下の式で示されるモノマー単位を含むホモポリマー:
- R1 1、R2 1、...、Rn-1 1およびRn 1の1つ以上がメチルであることを特徴とする、請求項1に記載の化合物。
- 各R1 1、R2 1、...、Rn-1 1およびRn 1がメチルであることを特徴とする、請求項2に記載の化合物。
- 各X1およびX2がHであることを特徴とする、請求項1から3までのいずれか1項に記載の化合物。
- nが、75〜375であることを特徴とする、請求項1から4までのいずれか1項に記載の化物。
- nが、2〜10であることを特徴とする、請求項5に記載の化合物。
- nが、2または3であることを特徴とする、請求項6に記載の化合物。
- R1 2、R2 2、...、Rn-1 2およびRn 2の1つ以上がジペプチドであることを特徴とする、請求項1から7までのいずれか1項に記載の化合物。
- 各R1 2、R2 2、...、Rn-1 2およびRn 2がジペプチドであることを特徴とする、請求項8に記載の化合物。
- R1 2、R2 2、...、Rn-1 2およびRn 2の1つ以上がトリペプチドであることを特徴とする、請求項1から7までのいずれか1項に記載の化合物。
- 各R1 2、R2 2、...、Rn-1 2およびRn 2がトリペプチドであることを特徴とする、請求項10に記載の化合物。
- R1 2、R2 2、...、Rn-1 2およびRn 2の1つ以上がテトラペプチドであることを特徴とする、請求項1から7までのいずれか1項に記載の化合物。
- 各R1 2、R2 2、...、Rn-1 2およびRn 2がテトラペプチドであることを特徴とする、請求項12に記載の化合物。
- R1 2、R2 2、...、Rn-1 2およびRn 2の1つ以上がペンタペプチドであることを特徴とする、請求項1から7までのいずれか1項に記載の化合物。
- 各R1 2、R2 2、...、Rn-1 2およびRn 2がペンタペプチドであることを特徴とする、請求項14に記載の化合物。
- 式Ymで表されるモノマー単位の1つ以上が:
(a)YmがYnでない場合、式IIIa:
式IIIa
で表される基であるか;または
(b)YmがYnである場合、式IIIb:
式IIIb
で表される基であり、
ここで、
各R1 3、R2 3、...、Rn-1 3およびRn 3が、独立して、−OHまたは−NH2であり;
各R1 4、R2 4、...、Rn-1 4およびRn 4が、独立して、−OHまたは−NH2、アミノ酸基、または2〜8個のアミノ酸基を含むペプチドであり、ここで:
(d)各アミノ酸基は、独立して、DまたはLの立体配座を示し;
(e)各アミノ酸基は、非置換であるかまたはハロ、アルキル、ヒドロキシ、アルコキシ、フェノキシ、CF3、アミノ、アルキルアミノ、ジアルキルアミノ、−C(O)Oアルキルおよび−NO2から成る群より選択される1つ以上の基で置換されており;
(f)アミノ酸基は、独立して、γカルボキシル基のα位、αまたはεアミノ基で結合しているかまたはそれらの組合せである、
ことを特徴とする、請求項1から15までのいずれか1項に記載の化合物。 - (a)式Ymで示される各モノマー単位は、Ynと異なり、式IIIaで表される基であり;且つ
(b)Ynが式IIIbで表される基であることを特徴とする、請求項16に記載の化合物。 - 前記化合物が、実質的に、純粋な形であることを特徴とする、請求項16または17に記載の化合物。
- 式Ymで表されるモノマー単位が以下の基でない:
(a)YmがYnでない場合、式IIIa:
式IIIa
で表される基;または
(b)YmがYnである場合、式IIIb:
式IIIb
で表される基、
ここで、
各R1 3、R2 3、...、Rn-1 3およびRn 3が、独立して、−OHまたは−NH2であり;
各R1 4、R2 4、...、Rn-1 4およびRn 4が、独立して、−OHまたは−NH2、アミノ酸基、または2〜8個のアミノ酸基を含むペプチドであり、ここで:
(d)各アミノ酸基は、独立して、DまたはLの立体配座を示し;
(e)各アミノ酸基は、非置換であるかまたはハロ、アルキル、ヒドロキシ、アルコキシ、フェノキシ、CF3、アミノ、アルキルアミノ、ジアルキルアミノ、−C(O)Oアルキルおよび−NO2から成る群より選択される1つ以上の基で置換されており;
(f)アミノ酸基は、独立して、γカルボキシル基のα位、αまたはεアミノ基で結合しているかまたはそれらの組合せである、
ことを特徴とする、請求項1から15までのいずれか1項に記載の化合物。 - R1 2、R2 2、...、Rn-1 2およびRn 2の1つ以上が正味荷電を有することを特徴とする、請求項1から19までのいずれか1項に記載の化合物。
- 各R1 2、R2 2、...、Rn-1 2およびRn 2が正味荷電を有することを特徴とする、請求項20に記載の化合物。
- 正味荷電が負であることを特徴とする、請求項20または21に記載の化合物。
- R1 2、R2 2、...、Rn-1 2およびRn 2の1つ以上が、中性正味荷電を有することを特徴とする、請求項1から19までのいずれか1項に記載の化合物。
- 各R1 2、R2 2、...、Rn-1 2およびRn 2が中性正味荷電を有することを特徴とする、請求項23に記載の化合物。
- 直鎖ポリマーがホモポリマーであることを特徴とする、請求項1から24までのいずれか1項に記載の化合物。
- 直鎖ポリマーが、ランダム共重合体、交互共重合体、またはブロック共重合体であることを特徴とする、請求項1から24までのいずれか1項に記載の化合物。
- 直鎖ポリマーがランダム共重合体であることを特徴とする、請求項26に記載の化合物。
- 直鎖ポリマーが、2種類のモノマー単位を含むことを特徴とする、請求項26または27に記載の化合物。
- 直鎖ポリマーが、2種類を越えるモノマー単位を含むことを特徴とする、請求項26または27に記載の化合物。
- 製薬学的に使用可能な希釈剤、医薬品添加物またはキャリアと一緒に請求項1から29までのいずれか1項に記載の化合物を含む医薬品、またはその製薬学的に入手可能な塩。
- さらに分散剤を含むこと特徴とする、請求項30に記載の医薬品。
- 分散剤が、ポリエチレングリコール、グリセロールまたはスクロースであることを特徴とする、請求項31に記載の医薬品。
- 免疫調整薬による治療が可能な疾患または障害の予防用あるいは治療用の薬剤を製造するための、請求項1から29までのいずれか1項に記載の化合物またはその製薬学的に入手可能な塩の使用。
- ワクチン補助剤を製造するための、請求項16、17または18に記載の化合物、あるいはその製薬学的に入手可能な塩の使用。
- 免疫調整薬による治療が可能な疾患または障害の予防あるいは治療のための、請求項1から29までのいずれか1項に記載の化合物またはその製薬学的に入手可能な塩の使用。
- 請求項1から29までのいずれか1項に記載の化合物の哺乳動物への有効量投与を含む、哺乳動物に免疫応答を誘起する方法。
- 前記免疫応答が炎症性であり、前記化合物が請求項16、17または18に記載の化合物であることを特徴とする、請求項36に記載の方法。
- 前記免疫応答が非−炎症性であり、前記化合物が請求項19に記載の化合物であることを特徴とする、請求項37に記載の方法。
- 請求項19に記載の化合物の哺乳動物への有効量投与を含む、予防または治療を必要とする哺乳動物の炎症性の疾患、症状または障害の予防法あるいは治療法。
- 請求項16、17または18に記載の化合物の哺乳動物への有効量投与を含む、予防または治療を必要とする哺乳動物に炎症性の免疫応答を誘起する免疫調整薬が有効な疾患、症状または障害の予防法あるいは治療法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US50378403P | 2003-09-17 | 2003-09-17 | |
| PCT/US2004/026737 WO2005035588A1 (en) | 2003-09-17 | 2004-09-15 | Synthetic polysaccharide antigens for immunological intervention in disease |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007505905A true JP2007505905A (ja) | 2007-03-15 |
| JP2007505905A5 JP2007505905A5 (ja) | 2008-11-20 |
Family
ID=34434862
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006526901A Pending JP2007505905A (ja) | 2003-09-17 | 2004-09-15 | 疾患における免疫学的介入のための合成多糖抗原 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US8129518B2 (ja) |
| EP (1) | EP1664127A1 (ja) |
| JP (1) | JP2007505905A (ja) |
| KR (1) | KR100810770B1 (ja) |
| CN (1) | CN100554279C (ja) |
| AU (1) | AU2004280329B2 (ja) |
| CA (1) | CA2538418A1 (ja) |
| HK (1) | HK1099319A1 (ja) |
| WO (1) | WO2005035588A1 (ja) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101448517A (zh) * | 2005-04-19 | 2009-06-03 | 伊莱利利公司 | 用于疾病免疫干预的单价和多价合成多糖抗原 |
| US8378064B2 (en) | 2006-05-19 | 2013-02-19 | Trustees Of Boston University | Hydrophilic polymers as medical lubricants and gels |
| US7850949B2 (en) | 2006-09-29 | 2010-12-14 | Michigan Technological University | Purification of synthetic oligomers |
| US20090124573A1 (en) | 2007-11-09 | 2009-05-14 | Sarkis Mazmanian | Immunomodulating compounds and related compositions and methods |
| FR2954703B1 (fr) * | 2009-12-28 | 2013-12-13 | Chu Nantes | Agonistes des recepteurs tlr 4 et 9 pour prevenir les complications septiques de l'immunodepression post-traumatique chez les patients hospitalises pour traumatismes severes |
| EP2555753B1 (en) | 2010-04-07 | 2018-08-01 | California Institute of Technology | Vehicle for delivering a compound to a mucous membrane and related compositions, methods and systems |
| EP2571982A4 (en) * | 2010-05-20 | 2014-01-01 | California Inst Of Techn | ANTIGEN-SPECIFIC TREGS AND CORRESPONDING COMPOSITIONS, METHODS AND SYSTEMS |
| US9243023B2 (en) | 2010-09-27 | 2016-01-26 | Michigan Technological University | Purification of synthetic oligonucleotides |
| US9180173B2 (en) * | 2013-12-09 | 2015-11-10 | Stephanie D. Neider | Methods of treating psoriasis using candida antigen |
| US10765696B2 (en) | 2015-06-10 | 2020-09-08 | City Of Hope | Compositions of and methods of treatment with zwitterionic polysaccharide |
| US11331335B2 (en) | 2015-06-10 | 2022-05-17 | California Institute Of Technology | Sepsis treatment and related compositions methods and systems |
| CN109416355A (zh) | 2016-03-30 | 2019-03-01 | 定性酶诊断有限责任两合公司 | 检测伤口微生物感染 |
| EP3295926A1 (en) | 2016-09-19 | 2018-03-21 | Institut Univ. de Ciència i Tecnologia, S.A. | Exopolysaccharide-protein complex, a method of preparing said complex and uses thereof |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4186194A (en) * | 1973-10-23 | 1980-01-29 | Agence Nationale De Valorisation De La Recherche (Anvar) | Water soluble agents effective as immunological adjuvants for stimulating, in the host the immune response to various antigens and compositions, notably vaccines containing said water soluble agents |
| WO2001079242A2 (en) * | 2000-04-18 | 2001-10-25 | Eli Lilly And Company | Process for preparing lipid ii and derivatives thereof |
| JP2002515260A (ja) * | 1998-05-15 | 2002-05-28 | アストラゼネカ アクチボラグ | ペプチドグリカン合成検出のためのシンチレーションプロキシミティーアッセイ |
| WO2002085929A1 (en) * | 2001-04-18 | 2002-10-31 | Eli Lilly And Company | Process for preparing lipid ii |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU727647A1 (ru) | 1977-11-02 | 1980-04-15 | Институт биоорганической химии им.М.М.Шемякина | Гликопептиды,обладающие противоопухолевой активностью и способ их получени |
| US5834435A (en) * | 1996-11-27 | 1998-11-10 | Slesarev; Vladimir I. | Inhibition of TNF-α pleiotropic and cytotoxic effects |
| US20010034325A1 (en) * | 2000-03-07 | 2001-10-25 | Slesarev Vladimir I. | Dietary modulators of gamma glutamyl transpeptidase |
| EP1494687A2 (en) | 2002-03-08 | 2005-01-12 | Eli Lilly And Company | Immunomodulatory polymeric antigens for treating inflammatory pathogies |
| US20040258779A1 (en) * | 2003-06-06 | 2004-12-23 | Pinegrin Boris V. | Dietary and pharmaceutical compositions for treatment of anemia, thrombocytopenia, and leukopenia |
-
2004
- 2004-09-15 CA CA002538418A patent/CA2538418A1/en not_active Abandoned
- 2004-09-15 US US10/571,486 patent/US8129518B2/en not_active Expired - Fee Related
- 2004-09-15 EP EP04781434A patent/EP1664127A1/en not_active Withdrawn
- 2004-09-15 JP JP2006526901A patent/JP2007505905A/ja active Pending
- 2004-09-15 WO PCT/US2004/026737 patent/WO2005035588A1/en active Application Filing
- 2004-09-15 CN CNB200480030122XA patent/CN100554279C/zh not_active Expired - Fee Related
- 2004-09-15 AU AU2004280329A patent/AU2004280329B2/en not_active Ceased
- 2004-09-15 KR KR1020067005302A patent/KR100810770B1/ko not_active IP Right Cessation
-
2007
- 2007-05-21 HK HK07105329A patent/HK1099319A1/xx not_active IP Right Cessation
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4186194A (en) * | 1973-10-23 | 1980-01-29 | Agence Nationale De Valorisation De La Recherche (Anvar) | Water soluble agents effective as immunological adjuvants for stimulating, in the host the immune response to various antigens and compositions, notably vaccines containing said water soluble agents |
| JP2002515260A (ja) * | 1998-05-15 | 2002-05-28 | アストラゼネカ アクチボラグ | ペプチドグリカン合成検出のためのシンチレーションプロキシミティーアッセイ |
| WO2001079242A2 (en) * | 2000-04-18 | 2001-10-25 | Eli Lilly And Company | Process for preparing lipid ii and derivatives thereof |
| WO2002085929A1 (en) * | 2001-04-18 | 2002-10-31 | Eli Lilly And Company | Process for preparing lipid ii |
Also Published As
| Publication number | Publication date |
|---|---|
| HK1099319A1 (en) | 2007-08-10 |
| US8129518B2 (en) | 2012-03-06 |
| EP1664127A1 (en) | 2006-06-07 |
| US20070041986A1 (en) | 2007-02-22 |
| AU2004280329A1 (en) | 2005-04-21 |
| KR20060057015A (ko) | 2006-05-25 |
| AU2004280329B2 (en) | 2011-03-24 |
| CN100554279C (zh) | 2009-10-28 |
| KR100810770B1 (ko) | 2008-03-07 |
| WO2005035588A1 (en) | 2005-04-21 |
| CN1867589A (zh) | 2006-11-22 |
| CA2538418A1 (en) | 2005-04-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20100310470A1 (en) | Immunomodulatory polymeric antigens for treating inflammatory pathologies | |
| ES2298353T3 (es) | Peptido wt1 modificado. | |
| Chen et al. | PLGA-nanoparticle mediated delivery of anti-OX40 monoclonal antibody enhances anti-tumor cytotoxic T cell responses | |
| Heo et al. | Polymer nanoparticles for enhanced immune response: combined delivery of tumor antigen and small interference RNA for immunosuppressive gene to dendritic cells | |
| JP2006265212A (ja) | Il−21産生誘導剤 | |
| JP2007505905A (ja) | 疾患における免疫学的介入のための合成多糖抗原 | |
| CN113677352A (zh) | T细胞修饰 | |
| AU2008202216A1 (en) | Combination therapies for immune mediated diseases | |
| Liu et al. | A novel multifunctional vaccine platform with dendritic cell-targeting and pH-responsive for cancer immunotherapy: Antigen-directed biomimetic fabrication of a cabbage-like mannatide-zinc-antigen hybrid microparticles | |
| JP2008539169A (ja) | 疾患における免疫学的介入のための一価および多価合成多糖類抗原 | |
| TW201416374A (zh) | 對於th1細胞之ly6k抗原決定位胜肽及含此之疫苗 | |
| JP2023021131A (ja) | 免疫を調節するペプチド、ポリペプチド又は細胞を作製する方法 | |
| TW202024122A (zh) | 來自koc1的胜肽及含其之疫苗 | |
| JP5717116B2 (ja) | 抗原特異的ヒトTh17細胞を調整する方法 | |
| TWI719944B (zh) | 來自cdca1的胜肽及含其之疫苗 | |
| TW201138803A (en) | ECT2 peptides and vaccines including the same | |
| AU2011203013A1 (en) | Synthetic polysaccharide antigens for immunological intervention in disease | |
| CA3104182C (en) | Immunomodulatory peptides and methods for modulating the immune system in a subject | |
| CN112402596B (zh) | 多肽组合物及疫苗 | |
| TWI761316B (zh) | 來自mphosph1之胜肽及含此之疫苗 | |
| Ramanayake et al. | Generation of molecular-targeting helix-loop-helix peptides for inhibition of the interaction between cytotoxic T-lymphocyte-associated protein 4 and B7 in the dog | |
| KR101172874B1 (ko) | HspX를 포함하는 수지상 세포의 성숙화 촉진용 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070914 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070914 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080926 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110517 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110812 Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110812 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110819 Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110819 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110908 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110915 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20111004 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20111012 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120131 |