JP2007099599A - 三フッ化窒素の製造方法および製造装置 - Google Patents
三フッ化窒素の製造方法および製造装置 Download PDFInfo
- Publication number
- JP2007099599A JP2007099599A JP2005295497A JP2005295497A JP2007099599A JP 2007099599 A JP2007099599 A JP 2007099599A JP 2005295497 A JP2005295497 A JP 2005295497A JP 2005295497 A JP2005295497 A JP 2005295497A JP 2007099599 A JP2007099599 A JP 2007099599A
- Authority
- JP
- Japan
- Prior art keywords
- gas
- nitrogen trifluoride
- reactor
- producing nitrogen
- fluorine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Landscapes
- Physical Or Chemical Processes And Apparatus (AREA)
Abstract
安全かつ収率よく連続的に製造することができる方法を提供すること。
【解決手段】本発明に係る三フッ化窒素の製造方法は、フッ素ガスとアンモニアガスとを管状反応器に供給して、希釈ガスの存在下、気相中、無触媒条件で反応させて、主として三フッ化窒素からなるガス生成物と主としてフッ化アンモニウムおよび/または酸性フッ化アンモニウムからなる固形生成物とを生成させ、前記管状反応器内部に装着されたハンマリング装置により前記管状反応器の内壁に付着した前記固形生成物を除去することを特徴とする。
【選択図】図1
Description
れに用いる装置に関する。
ーニングガス等に使用される。その製造方法としては、一般に化学法と電解法とに大別される。化学法としては、例えば、(1)溶融酸性フッ化アンモニウム中にF2ガスとNH3ガスとを吹き込む方法(特公昭55−8926号公報(特許文献1)参照)、(2)F2
ガスとNH3ガスとを直接反応させる方法(特開平2−255513号公報(特許文献2
)、特開平5−105411号公報(特許文献3)参照)、等が知られている。
.197,395(1931)(非特許文献1)参照)、Morrowらも同様に気相でNF3を収率24.3%で合成したことを報告している(J.Amer.Chem.So
c.82.5301(1960)(非特許文献2)参照)。
性に富むF2ガスを用いるため、爆発や腐食の危険があり、またこれらの反応は反応熱が
大きく、反応器内の温度が上昇し副反応や生成したNF3の分解や副反応によりN2、HF、N2F2、N2O、NH4F(フッ化アンモニウム)やNH4HF2(酸性フッ化アンモニウム)等が生成して収率が低下したり、NH4FやNH4HF2の固体分により反応器や配管
が閉塞するという問題点があった。
がら、高価なF2ガスを原料として用いるため、収率のさらなる向上が課題である。
反応器の閉塞や収率向上に対する課題がある。
スとNH3ガスとを反応させて、NF3を直接フッ素化法により、工業的に安全かつ収率よく連続的に製造することができる方法を提供することを解決課題とする。
料ガスを管状反応器に供給して反応させ、主としてNF3からなるガス生成物と主として
フッ化アンモニウムおよび/または酸性フッ化アンモニウムからなる固形生成物(固体生成物)を生成させ、前記管状反応器に装着されたハンマリング装置により前記管状反応器の内壁に付着した前記固形生成物を除去することにより、収率よく連続的にNF3を製造
することができることを見出した。
る場合、約−110Kcal/molの大きな反応熱が発生する。したがって、F2ガス
とNH3ガスとを反応させる直接フッ素化反応によりNF3を製造する場合、約−330Kcal/molの大きな反応熱が発生し、局部的に温度が高くなる。反応器内の温度が高くなると目的のNF3生成反応〔下記式(1)〕以外に副反応〔下記式(2)〕が支配的
に起こる。
2NH3 + 3F2 → N2 + 6HF (2)
本発明者らは、選択的に上記式(1)の反応を進行させるため鋭意検討を重ねた結果、固形生成物の付着による線速度の上昇、ガスの乱流、冷却効率の低下等による収率の低下も反応温度と密接に関連していることを見出した。
すなわち、本発明は以下の[1]〜[22]に示されるNF3の製造方法である。
[1]フッ素ガスとアンモニアガスとを管状反応器に供給して、希釈ガスの存在下、無触媒条件で反応させて、主として三フッ化窒素からなるガス生成物と主としてフッ化アンモニウムおよび/または酸性フッ化アンモニウムからなる固形生成物とを生成させ、前記管状反応器に装着されたハンマリング装置により前記管状反応器の内壁に付着した前記固形生成物を除去することを特徴とする三フッ化窒素の製造方法。
[3]前記管状反応器が冷却構造を有することを特徴とする上記[1]または[2]に記載の三フッ化窒素の製造方法。
る上記[1]〜[3]のいずれかに記載の三フッ化窒素の製造方法。
[5]フッ素ガスとアンモニアガスとを、モル比(フッ素ガス:アンモニアガス)が1:1〜1:2の範囲で供給することを特徴とする上記[1]〜[4]のいずれかに記載の三フッ化窒素の製造方法。
[8]前記反応後、未反応のフッ素ガスをアルカリ水溶液および/またはアルミナで処理することを特徴とする上記[1]〜[7]のいずれかに記載の三フッ化窒素の製造方法。
[11]前記フッ素ガスが、酸素および酸素含有化合物の合計含有量が0.1vol%以下ならびにテトラフルオロメタンの含有量が50volppm以下の高純度フッ素ガスであることを特徴とする上記[9]または[10]に記載の三フッ化窒素の製造方法。
物であることを特徴とする上記[11]に記載の三フッ化窒素の製造方法。
[16]フッ素ガスとアンモニアガスとを60℃以下の温度で反応させることを特徴とする上記[9]〜[15]のいずれかに記載の三フッ化窒素の製造方法。
[19]前記アンモニアガスの供給濃度が6モル%以下であることを特徴とする上記[9]〜[18]のいずれかに記載の三フッ化窒素の製造方法。
[21]反応器下部に設けられた固形分を分離、排出する前記装置が、交換可能な固体貯溜槽であることを特徴とする上記[9]〜[20]のいずれかに記載の三フッ化窒素の製造方法。
配管の閉塞等による収率の低下等の課題、問題に対して、原料ガスを管状反応器に供給して反応させ、管状反応器内壁に付着した、主としてフッ化アンモニウムおよび/または酸性フッ化アンモニウムからなる固形生成物を除去するためのハンマリング装置を具備した反応器を用いることにより、連続的かつ収率よく経済的にNF3を製造できる方法を提供
できる。
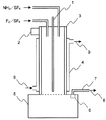
まず、本発明の三フッ化窒素の製造装置について説明する。本発明の製造装置は、フッ素ガス供給手段、アンモニアガス供給手段、ハンマリング装置を具備した反応器を有する。
び固形生成物をガス成分とを分離する手段を有することが好ましい。具体的には、上記反応器の下部に、固形分を分離、排出する装置(以下、「固体分離排出装置」という)が設置されていることが好ましい。前記固体分離排出装置は、その断面が反応器の断面より大きいことが好ましい。より具体的には、定期的に交換可能な固体貯溜槽が好ましく、槽を直列に2つを設けてロ−タリーバルブで2槽間を切り離すことができる構造や槽を2基設けて切り替えることができる構造を有することが好ましい。また、前記固体分離排出装置は、上部に目的物のNF3および希釈ガスを次工程へと導くガス排出ラインがフィルター
を介して具備されていることが好ましい。このフィルターによりガスと共に同伴される微量の固形分を除去することができる。さらに、ガス排出ラインを例えば2ライン設けて、ガス流れを定期的に切れ替え、連続的に稼働させることがより好ましい。
上記構成装置および部品のうち、フィルター以外の装置および部品の材質はSUS316が好ましい。
しくない。このため、F2ガスおよびNH3ガスは希釈して低濃度領域で反応させる必要がある。F2ガスは希釈ガスで希釈して供給ガス全量の3モル%以下で供給することが好ま
しく、NH3ガスは希釈ガスで希釈して供給ガス全量の6モル%以下で供給することが好
ましい。つまり、原料ガス(NH3ガスおよびF2ガス)が合計9モル%以下で希釈ガスが91モル%以上であることが好ましい。NH3ガス濃度が6モル%を超え、フッ素ガスが
3モル%を超えると、反応熱が大きくなるなど温度の急激な上昇、燃焼や爆発等の危険が生じるため好ましくない。前記希釈ガスとしては、窒素、ヘリウム、アルゴン、六弗化イオウ、ヘキサフルオロエタン、オクタフルオロプロパンおよび三フッ化窒素などの不活性ガスが挙げられる。これらの希釈ガスは単独でまたは2種以上を混合して使用することができる。また、これらの希釈ガスのうち、希釈ガスの比熱、蒸留工程での分離・精製等を考慮すると、六弗化硫黄、ヘキサフルオロエタンおよびオクタフルオロプロパンが好ましい。
など温度の急激な上昇、燃焼や爆発等の危険が生じるため好ましくない。また、F2ガス
に対してNH3ガスを2倍モルを超えて供給するとNH3に対するNF3の収率が低下する
ため好ましくない。
して供給する方法等が好ましい。また、反応圧力は0.05〜1.0MPaの範囲が好ましい。1.0MPaを超えると装置の耐圧を高める必要があるなど経済的に好ましくない。
、OF2およびO2F2が挙げられ、これらは単独で、または2種以上が含まれている。N
H3ガスに含まれる酸素含有化合物としては、NO、NO2、N2O、CO、CO2およびH2Oが挙げられ、これらは単独で、または2種以上が含まれている。また、F2ガスには、さらにテトラフルオロメタン(CF4)が含まれていることがあり、NH3ガスには、さらにメタン、水素、水素含有化合物や油分が含まれていることがある。上記酸素や酸素含有化合物はN2OやN2F2等の不純物を副生したり、F2ガスと反応してCF4やCOF、C
OF2、OF2等を副生する。NH3ガスに含まれるメタンはF2ガスと反応してCF4を副
生する。この副生したCF4やF2ガスに含まれるCF4は、その沸点が−128℃であり
、目的物であるNF3の沸点に近く、分離が極めて困難である等の問題がある。また、N
H3ガスに含まれる水素や水素含有化合物はF2ガスと反応してフッ化水素(HF)を生成し、これがNH3ガスと反応してNH4Fを形成するため好ましくない。NH3ガスに含ま
れる油分は、F2ガスと反応してCF4やCOF、COF2、OF2等を副生する。このように、原料ガスに含まれる微量不純物は、多くの不純物を副生するため、上記F2ガスおよ
びNH3ガスは高純度ガスであることが好ましく、不純物を極力低減する必要がある。
差を利用し、例えば、液体窒素等を用いて、−150〜−160℃の温度で低温蒸留してF2ガス中に含まれるCF4を除去することにより精製でき、同時に酸素および酸素含有化合物も除去される。精製後のF2ガス中のCF4の含有量は50volppm以下が好ましく、酸素および酸素含有化合物の合計含有量は0.1vol%以下が好ましい。
り返して油分を除去したり、蒸留精製や吸着操作等を繰り返して水素や水素含有化合物、メタン、酸素、酸素含有化合物を除去することにより精製できる。精製後のNH3ガス中
の油分の含有量は2質量ppm以下が好ましく、酸素および酸素含有化合物の合計含有量は10volppm以下が好ましい。
必要がある。このため、反応器に装着された上記ハンマリング装置を用いて固形生成物を反応器の内壁から払い落とす。
フッ化アンモニウムおよび酸性フッ化アンモニウムは他の用途に使用することができる。
一方、ガス生成物は、目的物のNF3と希釈ガスの他に、微量の未反応のF2ガス等を含有する。このため、前記固体分離排出装置の上部に設けられたフィルタ−を通過したガス生成物から、未反応のF2ガスを除去することが好ましい。未反応のF2ガスを除去する方法としては、たとえば、アルミナ(酸化アルミニウム)を用いて反応させて除去する乾式除去方法、またはアルカリ水溶液と接触させて除去する湿式除去方法が好ましく適用され、場合によっては両方法を併用してもよい。アルカリ水溶液としては水酸化ナトリウム水溶液、水酸化カリウム水溶液が好ましい。
[実施例]
以下、本発明を実施例により説明するが、本発明は、この実施例により何ら限定されるものではない。
[調製例1]
KF・1.8HF〜KF・2.5HFの組成物を約100℃で溶融塩電解し、陽極にF2を発生させて捕集し、得られた粗F2ガス中のHFを液体窒素を用いて分離・精製した後、F2ガスを液体窒素を用いて低温蒸留し、高純度フッ素ガスを得た。この高純度フッ素
ガス中に含まれる酸素および酸素含有化合物、テトラフルオロメタンを、ガスクロマトグラフィー(GC)のTCD法およびFID法、ガスクロマトグラフィー質量分析計(GC−MS)を用いて分析した結果を以下に示す。
テトラフルオロメタン 0.0016vol%
[調製例2]
KF・1.8HF〜KF・2.5HFの組成物を約100℃で溶融塩電解し、陽極にF2を発生させて捕集し、得られた粗F2ガス中のHFを液体窒素を用いて分離・精製し、フッ素ガスを得た。このフッ素ガス中に含まれる酸素および酸素含有化合物、テトラフルオロメタンを、ガスクロマトグラフィー(GC)のTCD法およびFID法、ガスクロマトグラフィー質量分析計(GC−MS)を用いて分析した結果を以下に示す。
テトラフルオロメタン 0.0138vol%
<NH3ガスの調製>
[調製例3]
工業的な製法である高圧触媒法で製造された液体アンモニアを熱交換器により蒸発させて冷却回収し、さらに蒸留精製を行なうことにより高純度アンモニアを得た。この高純度アンモニア中に含まれる酸素および酸素含有化合物、メタン、油分をガスクロマトグラフィ−(GC)のTCD法およびFID法、ガスクロマトグラフィー質量分析計(GC−MS)を用いて分析した結果を以下に示す。
メタン <0.1volppm
油分 <0.1質量ppm
[調製例4]
工業的な製法である高圧触媒法で製造された液体アンモニア中に含まれる酸素および酸素含有化合物、メタン、油分をガスクロマトグラフィ−(GC)のTCD法およびFID法、ガスクロマトグラフィー質量分析計(GC−MS)を用いて分析した結果を以下に示す。
メタン 0.0007vol%
油分 0.0007質量%
化イオウ(純度:>99.999%)59.64NL/hrとの混合ガスを、もう一方の原料ガス供給ラインから調製例3で得た高純度NH3ガス3.06NL/hrと六弗化イ
オウ(純度:>99.999%)50NL/hrとの混合ガスを、管状反応器3内にそれぞれ供給し、反応器3内でF2ガスとNH3ガスとを混合して反応させた。反応中、エアーノッカー2をタイマーによりノッカー打撃間隔30分間で作動させた。また、反応器3を冷媒により冷却しながら反応を行なった。反応開始から4時間後、反応器3内のピーク温度は16.2℃であった。
CF4 :0.0016vol%
COF2 :検出されず
COF :検出されず
OF2 :検出されず
N2O :検出されず
この結果から明らかなように、高純度フッ素ガスと高純度アンモニアガスとを用いることにより、微量不純物、特にCF4の副生を抑制でき、また、低濃度で原料ガスを供給し
、反応器内の温度を制御し、さらに固形生成物を反応器内から除去することにより目的物であるNF3を連続的に、高収率(97%以上)で得ることができた。
さらに反応を継続したところ、反応開始から48時間後の反応器3内のピーク温度は15.8℃であった。ガス排出ラインから回収したガスを上記と同様にして分析した。結果
を以下に示す。
その後、原料ガスおよび希釈ガスの供給を停止し、反応器内部および固体貯溜槽を目視により観察したところ、反応器内部には白色固形物の付着は認められず、固体貯溜槽に白色固形物(主として、フッ化アンモニウム)が堆積していた。
調製例4で得たNH3ガスを用いた以外は、実施例1と同様にして反応を行なった。反応
開始から4時間後、反応器3内のピーク温度は16.3℃であった。
CF4 :0.0145vol%
COF2 :0.0002vol%
COF :0.0001vol%
OF2 :0.0001vol%
N2O :0.0002vol%
実施例1および2を比較すると、高純度の原料ガスを使用することにより、微量不純物の副生を抑制できることがわかった。
実施例2で得た、未反応フッ素ガスと生成フッ化水素とを除去したガスを、冷却捕集し、公知の方法によりCF4の蒸留分離を試みたが、NF3中のCF4量は低減できなかった
。
2 エアーノッカー
3 管状反応器
4 ジャケット(冷媒循環式)
5 固体貯溜槽
6 フィルター
7 ガス排出ライン
8 排出ガス(主として、NF3および希釈ガス)
9 冷媒
Claims (23)
- フッ素ガスとアンモニアガスとを管状反応器に供給して、希釈ガスの存在下、無触媒条件で反応させて、主として三フッ化窒素からなるガス生成物と主としてフッ化アンモニウムおよび/または酸性フッ化アンモニウムからなる固形生成物とを生成させ、前記管状反応器に装着されたハンマリング装置により前記管状反応器の内壁に付着した前記固形生成物を除去することを特徴とする三フッ化窒素の製造方法。
- 前記ハンマリング装置がエアーノッカーであることを特徴とする請求項1に記載の三フッ化窒素の製造方法。
- 前記管状反応器が冷却構造を有することを特徴とする請求項1または2に記載の三フッ化窒素の製造方法。
- フッ素ガスとアンモニアガスとを60℃以下の温度で反応させることを特徴とする請求項1〜3のいずれかに記載の三フッ化窒素の製造方法。
- フッ素ガスとアンモニアガスとを、モル比(フッ素ガス:アンモニアガス)が1:1〜1:2の範囲で供給することを特徴とする請求項1〜4のいずれかに記載の三フッ化窒素の製造方法。
- 前記希釈ガスが、窒素、ヘリウム、アルゴン、六弗化硫黄、ヘキサフルオロエタン、オクタフルオロプロパンおよび三フッ化窒素からなる群より選ばれる少なくとも1種のガスであることを特徴とする請求項1〜5のいずれかに記載の三フッ化窒素の製造方法。
- 希釈ガスを循環使用することを特徴とする請求項1〜6のいずれかに記載の三フッ化窒素の製造方法。
- 前記反応後、未反応のフッ素ガスをアルカリ水溶液および/またはアルミナで処理することを特徴とする請求項1〜7のいずれかに記載の三フッ化窒素の製造方法。
- 長さ方向が鉛直方向となるように設置された管状反応器の上部からフッ素ガスとアンモニアガスとを供給して、希釈ガスの存在下、気相中、無触媒条件で反応させて、主として三フッ化窒素からなるガス生成物と主としてフッ化アンモニウムおよび/または酸性フッ化アンモニウムからなる固形生成物とを生成させ、前記管状反応器に装着されたハンマリング装置により前記管状反応器の内壁に付着した前記固形生成物を払い落とし、該固形生成物を反応器下部に設けられた固形分を分離、排出する装置およびフィルターにより前記ガス生成物から除去することを特徴とする三フッ化窒素の製造方法。
- 前記ハンマリング装置がエアーノッカーであることを特徴とする請求項9に記載の三フッ化窒素の製造方法。
- 前記フッ素ガスが、酸素および酸素含有化合物の合計含有量が0.1vol%以下ならびにテトラフルオロメタンの含有量が50volppm以下の高純度フッ素ガスであることを特徴とする請求項9または10に記載の三フッ化窒素の製造方法。
- 前記アンモニアガスが、酸素および酸素含有化合物の合計含有量が10volppm以下ならびに油分の含有量が2質量ppm以下の高純度アンモニアガスであることを特徴とする請求項9〜11のいずれかに記載の三フッ化窒素の製造方法。
- 前記高純度フッ素ガス中に含まれる酸素含有化合物が、NO、NO2、N2O、CO、CO2、H2O、OF2およびO2F2からなる群より選ばれる少なくとも1種の化合物である
ことを特徴とする請求項11に記載の三フッ化窒素の製造方法。 - 前記高純度アンモニアガス中に含まれる酸素含有化合物が、NO、NO2、N2O、CO、CO2およびH2Oからなる群より選ばれる少なくとも1種の化合物であることを特徴とする請求項12に記載の三フッ化窒素の製造方法。
- 前記管状反応器が冷却構造を有することを特徴とする請求項9〜14のいずれかに記載の三フッ化窒素の製造方法。
- フッ素ガスとアンモニアガスとを60℃以下の温度で反応させることを特徴とする請求項9〜15のいずれかに記載の三フッ化窒素の製造方法。
- フッ素ガスとアンモニアガスとを、モル比(フッ素ガス:アンモニアガス)が1:1〜1:2の範囲で供給することを特徴とする請求項9〜16のいずれかに記載の三フッ化窒素の製造方法。
- 前記フッ素ガスの供給濃度が3モル%以下であることを特徴とする請求項9〜17のいずれかに記載の三フッ化窒素の製造方法。
- 前記アンモニアガスの供給濃度が6モル%以下であることを特徴とする請求項9〜18のいずれかに記載の三フッ化窒素の製造方法。
- フッ素ガスとアンモニアガスとを0.05〜1.0MPaの圧力で反応させることを特徴とする請求項9〜19のいずれかに記載の三フッ化窒素の製造方法。
- 反応器下部に設けられた固形分を分離、排出する前記装置が、交換可能な固体貯溜槽であることを特徴とする請求項9〜20のいずれかに記載の三フッ化窒素の製造方法。
- 反応器下部に設けられた固形分を分離、排出する前記装置が、ロータリーバルブを備えた装置であることを特徴とする請求項9〜21のいずれかに記載の三フッ化窒素の製造方法。
- フッ素ガス供給手段、アンモニアガス供給手段、ハンマリング装置と反応温度制御手段とを具備した管状反応器、該反応器から除去された固形生成物を貯留する手段、および固形生成物とガス成分とを分離する手段を含むことを特徴とする三フッ化窒素の製造装置。
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005295497A JP2007099599A (ja) | 2005-10-07 | 2005-10-07 | 三フッ化窒素の製造方法および製造装置 |
| US12/064,927 US7820127B2 (en) | 2005-08-26 | 2006-08-25 | Method and apparatus for producing nitrogen trifluoride |
| TW095131376A TW200722370A (en) | 2005-08-26 | 2006-08-25 | Method and apparatus for producing nitrogen trifluoride |
| PCT/JP2006/316778 WO2007023968A1 (ja) | 2005-08-26 | 2006-08-25 | 三フッ化窒素の製造方法および製造装置 |
| KR1020087007173A KR100975490B1 (ko) | 2005-08-26 | 2006-08-25 | 삼불화질소의 제조 방법 및 제조 장치 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005295497A JP2007099599A (ja) | 2005-10-07 | 2005-10-07 | 三フッ化窒素の製造方法および製造装置 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007099599A true JP2007099599A (ja) | 2007-04-19 |
| JP2007099599A5 JP2007099599A5 (ja) | 2008-11-20 |
Family
ID=38026892
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005295497A Pending JP2007099599A (ja) | 2005-08-26 | 2005-10-07 | 三フッ化窒素の製造方法および製造装置 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2007099599A (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114572944A (zh) * | 2021-12-23 | 2022-06-03 | 西安近代化学研究所 | 一种三氟化氮及三氟化氮混合气体的制备方法 |
| CN116407913A (zh) * | 2023-06-12 | 2023-07-11 | 福建德尔科技股份有限公司 | 用于三氟化氮制备的汽水分离装置及制备系统 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05105411A (ja) * | 1991-10-22 | 1993-04-27 | Onoda Cement Co Ltd | 三フツ化窒素の製造方法 |
| JPH09255650A (ja) * | 1996-03-28 | 1997-09-30 | Toyo Eng Corp | 分離器内部の付着防止方法 |
| JP2001322806A (ja) * | 2000-05-12 | 2001-11-20 | Showa Denko Kk | 三フッ化窒素の製造方法及びその用途 |
-
2005
- 2005-10-07 JP JP2005295497A patent/JP2007099599A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05105411A (ja) * | 1991-10-22 | 1993-04-27 | Onoda Cement Co Ltd | 三フツ化窒素の製造方法 |
| JPH09255650A (ja) * | 1996-03-28 | 1997-09-30 | Toyo Eng Corp | 分離器内部の付着防止方法 |
| JP2001322806A (ja) * | 2000-05-12 | 2001-11-20 | Showa Denko Kk | 三フッ化窒素の製造方法及びその用途 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114572944A (zh) * | 2021-12-23 | 2022-06-03 | 西安近代化学研究所 | 一种三氟化氮及三氟化氮混合气体的制备方法 |
| CN116407913A (zh) * | 2023-06-12 | 2023-07-11 | 福建德尔科技股份有限公司 | 用于三氟化氮制备的汽水分离装置及制备系统 |
| CN116407913B (zh) * | 2023-06-12 | 2023-08-29 | 福建德尔科技股份有限公司 | 用于三氟化氮制备的汽水分离装置及制备系统 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100654286B1 (ko) | Nf3의 정제 방법 | |
| JP4828180B2 (ja) | 三フッ化窒素の製造方法 | |
| JP5013692B2 (ja) | フルオロメタンの製造方法およびその製品 | |
| US20130144081A1 (en) | Process for the preparation of isocyanates | |
| US7820127B2 (en) | Method and apparatus for producing nitrogen trifluoride | |
| JP4624905B2 (ja) | 三フッ化窒素の製造方法 | |
| JP2007099599A (ja) | 三フッ化窒素の製造方法および製造装置 | |
| US7018598B2 (en) | Process for producing nitrogen trifluoride | |
| JP2007119292A (ja) | 三フッ化窒素の製造方法および製造装置 | |
| KR100867582B1 (ko) | 삼플루오르화 질소의 제조방법 | |
| JP4624920B2 (ja) | 三フッ化窒素の製造方法 | |
| JP4508356B2 (ja) | 三フッ化窒素の製造方法及びその用途 | |
| EP3898561A1 (en) | Catalysts and integrated processes for producing trifluoroiodomethane | |
| US4102987A (en) | Process for preparing sulfuryl-fluoride and -chlorofluoride products | |
| JP2007099600A (ja) | 三フッ化窒素の製造方法 | |
| WO2005056472A1 (ja) | フッ化カルボニルの製造方法および製造装置 | |
| ZA200507484B (en) | Process for the production of nitrogen trifluoride | |
| EP0714849B1 (en) | Production process for refined hydrogen iodide | |
| JP2007084370A (ja) | 三フッ化窒素の製造方法 | |
| JP3512285B2 (ja) | 精ヨウ化水素の製造方法 | |
| CN102666451A (zh) | 生产烯丙基氯和二氯丙醇的方法 | |
| JP2007099599A5 (ja) | ||
| JP2007099600A5 (ja) | ||
| JP2022538048A (ja) | ビス(フルオロスルホニル)イミドのアルカリ塩の製造方法 | |
| GB2094278A (en) | Process for producing ammonium carbonate |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081007 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20081007 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20120203 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120321 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120724 |