JP2006518184A - 弱毒寄生虫生ワクチン - Google Patents
弱毒寄生虫生ワクチン Download PDFInfo
- Publication number
- JP2006518184A JP2006518184A JP2004537149A JP2004537149A JP2006518184A JP 2006518184 A JP2006518184 A JP 2006518184A JP 2004537149 A JP2004537149 A JP 2004537149A JP 2004537149 A JP2004537149 A JP 2004537149A JP 2006518184 A JP2006518184 A JP 2006518184A
- Authority
- JP
- Japan
- Prior art keywords
- parasite
- live attenuated
- gene
- protein
- genus
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 244000045947 parasite Species 0.000 title claims abstract description 149
- 230000002238 attenuated effect Effects 0.000 title claims abstract description 67
- 229960005486 vaccine Drugs 0.000 title claims abstract description 53
- 108700020534 tetracycline resistance-encoding transposon repressor Proteins 0.000 claims abstract description 54
- 108020001507 fusion proteins Proteins 0.000 claims abstract description 28
- 102000037865 fusion proteins Human genes 0.000 claims abstract description 28
- 238000004519 manufacturing process Methods 0.000 claims abstract description 13
- 108090000623 proteins and genes Proteins 0.000 claims description 67
- 108010000605 Ribosomal Proteins Proteins 0.000 claims description 48
- 230000001939 inductive effect Effects 0.000 claims description 37
- 239000004098 Tetracycline Substances 0.000 claims description 35
- 229960002180 tetracycline Drugs 0.000 claims description 35
- 229930101283 tetracycline Natural products 0.000 claims description 35
- 235000019364 tetracycline Nutrition 0.000 claims description 35
- 150000003522 tetracyclines Chemical class 0.000 claims description 35
- 102000009661 Repressor Proteins Human genes 0.000 claims description 22
- 208000015181 infectious disease Diseases 0.000 claims description 22
- 102000004169 proteins and genes Human genes 0.000 claims description 18
- 241000223996 Toxoplasma Species 0.000 claims description 17
- 108020004414 DNA Proteins 0.000 claims description 16
- 101150061166 tetR gene Proteins 0.000 claims description 14
- 241000223836 Babesia Species 0.000 claims description 11
- 241000223924 Eimeria Species 0.000 claims description 10
- 241001147660 Neospora Species 0.000 claims description 10
- 208000030852 Parasitic disease Diseases 0.000 claims description 10
- 241000224016 Plasmodium Species 0.000 claims description 10
- 241000223104 Trypanosoma Species 0.000 claims description 10
- 241000222722 Leishmania <genus> Species 0.000 claims description 8
- 201000008680 babesiosis Diseases 0.000 claims description 8
- 241000224482 Apicomplexa Species 0.000 claims description 7
- 241000223997 Toxoplasma gondii Species 0.000 claims description 7
- 241000223777 Theileria Species 0.000 claims description 5
- 239000003242 anti bacterial agent Substances 0.000 claims description 5
- 229940088710 antibiotic agent Drugs 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 239000012634 fragment Substances 0.000 claims description 5
- 108010034634 Repressor Proteins Proteins 0.000 claims description 4
- 230000029142 excretion Effects 0.000 claims description 4
- 230000028327 secretion Effects 0.000 claims description 4
- 241000224003 Sarcocystis Species 0.000 claims description 3
- 241000222714 Trypanosomatidae Species 0.000 claims description 3
- 230000027455 binding Effects 0.000 claims description 3
- 241001455948 Babesiidae Species 0.000 claims description 2
- 241000224483 Coccidia Species 0.000 claims description 2
- 241001490774 Cryptosporidiidae Species 0.000 claims description 2
- 241000223935 Cryptosporidium Species 0.000 claims description 2
- 241000224015 Haemosporida Species 0.000 claims description 2
- 241000223834 Piroplasmida Species 0.000 claims description 2
- 241000223929 Sarcocystidae Species 0.000 claims description 2
- 241000238631 Hexapoda Species 0.000 claims 1
- 102100026357 40S ribosomal protein S13 Human genes 0.000 description 43
- 101150066555 lacZ gene Proteins 0.000 description 36
- 238000013518 transcription Methods 0.000 description 19
- 230000035897 transcription Effects 0.000 description 19
- 238000000034 method Methods 0.000 description 18
- 108091008146 restriction endonucleases Proteins 0.000 description 18
- 102000002278 Ribosomal Proteins Human genes 0.000 description 17
- 239000013612 plasmid Substances 0.000 description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 14
- 210000003936 merozoite Anatomy 0.000 description 14
- 201000010099 disease Diseases 0.000 description 13
- 241000282412 Homo Species 0.000 description 12
- 101150024821 tetO gene Proteins 0.000 description 12
- 241000283690 Bos taurus Species 0.000 description 11
- 108091026890 Coding region Proteins 0.000 description 11
- 230000008901 benefit Effects 0.000 description 11
- 210000004027 cell Anatomy 0.000 description 11
- 238000011144 upstream manufacturing Methods 0.000 description 11
- 241001465754 Metazoa Species 0.000 description 10
- 210000000059 tachyzoite Anatomy 0.000 description 10
- 108010035563 Chloramphenicol O-acetyltransferase Proteins 0.000 description 9
- 239000005090 green fluorescent protein Substances 0.000 description 9
- 238000002744 homologous recombination Methods 0.000 description 9
- 230000006801 homologous recombination Effects 0.000 description 9
- 210000003705 ribosome Anatomy 0.000 description 9
- 230000004927 fusion Effects 0.000 description 8
- 238000003780 insertion Methods 0.000 description 8
- 230000037431 insertion Effects 0.000 description 8
- 108700009124 Transcription Initiation Site Proteins 0.000 description 7
- 241000894007 species Species 0.000 description 7
- 210000003046 sporozoite Anatomy 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 6
- 241000283086 Equidae Species 0.000 description 6
- 241000287828 Gallus gallus Species 0.000 description 6
- 238000013459 approach Methods 0.000 description 6
- 235000013330 chicken meat Nutrition 0.000 description 6
- 230000036039 immunity Effects 0.000 description 6
- 230000010354 integration Effects 0.000 description 6
- 210000004698 lymphocyte Anatomy 0.000 description 6
- 210000003250 oocyst Anatomy 0.000 description 6
- 230000001717 pathogenic effect Effects 0.000 description 6
- 239000003981 vehicle Substances 0.000 description 6
- 241000282472 Canis lupus familiaris Species 0.000 description 5
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 210000003743 erythrocyte Anatomy 0.000 description 5
- 230000006698 induction Effects 0.000 description 5
- 239000003550 marker Substances 0.000 description 5
- 239000002773 nucleotide Substances 0.000 description 5
- 125000003729 nucleotide group Chemical group 0.000 description 5
- 244000144977 poultry Species 0.000 description 5
- 235000013594 poultry meat Nutrition 0.000 description 5
- 238000002255 vaccination Methods 0.000 description 5
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 5
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 4
- 241000283073 Equus caballus Species 0.000 description 4
- 241000223105 Trypanosoma brucei Species 0.000 description 4
- 241000041386 Tyleria Species 0.000 description 4
- 239000002671 adjuvant Substances 0.000 description 4
- 208000007502 anemia Diseases 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 238000010276 construction Methods 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- 210000003527 eukaryotic cell Anatomy 0.000 description 4
- 229940031551 inactivated vaccine Drugs 0.000 description 4
- 229940124590 live attenuated vaccine Drugs 0.000 description 4
- 229940023012 live-attenuated vaccine Drugs 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 239000011859 microparticle Substances 0.000 description 4
- 238000002703 mutagenesis Methods 0.000 description 4
- 231100000350 mutagenesis Toxicity 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 150000007523 nucleic acids Chemical class 0.000 description 4
- 230000006798 recombination Effects 0.000 description 4
- 238000005215 recombination Methods 0.000 description 4
- 208000000995 spontaneous abortion Diseases 0.000 description 4
- UYYRDZGZGNYVBA-VPXCCNNISA-N (2s,3r,4s,5r,6r)-2-[2-chloro-4-[3-(3-chloro-4-hydroxyphenyl)-1,1-dioxo-2,1$l^{6}-benzoxathiol-3-yl]phenoxy]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CC=C(C2(C3=CC=CC=C3S(=O)(=O)O2)C=2C=C(Cl)C(O)=CC=2)C=C1Cl UYYRDZGZGNYVBA-VPXCCNNISA-N 0.000 description 3
- 206010000234 Abortion spontaneous Diseases 0.000 description 3
- 208000003495 Coccidiosis Diseases 0.000 description 3
- 206010061598 Immunodeficiency Diseases 0.000 description 3
- 206010023076 Isosporiasis Diseases 0.000 description 3
- 241000222712 Kinetoplastida Species 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241001147662 Neospora caninum Species 0.000 description 3
- 238000012408 PCR amplification Methods 0.000 description 3
- 241001494479 Pecora Species 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 3
- 208000001117 Theileriasis Diseases 0.000 description 3
- 206010047505 Visceral leishmaniasis Diseases 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- 108091007433 antigens Proteins 0.000 description 3
- 102000036639 antigens Human genes 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 210000000805 cytoplasm Anatomy 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 230000002779 inactivation Effects 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 210000001165 lymph node Anatomy 0.000 description 3
- 210000002706 plastid Anatomy 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000002741 site-directed mutagenesis Methods 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 210000003501 vero cell Anatomy 0.000 description 3
- 241000238876 Acari Species 0.000 description 2
- 241000501899 Apiomorpha annulata Species 0.000 description 2
- 240000005528 Arctium lappa Species 0.000 description 2
- 241001372518 Aspicilia brucei Species 0.000 description 2
- 108010045123 Blasticidin-S deaminase Proteins 0.000 description 2
- 241000282465 Canis Species 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 229920001661 Chitosan Polymers 0.000 description 2
- 108700010070 Codon Usage Proteins 0.000 description 2
- 241000255925 Diptera Species 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 2
- 108010025815 Kanamycin Kinase Proteins 0.000 description 2
- 241000222727 Leishmania donovani Species 0.000 description 2
- 238000010222 PCR analysis Methods 0.000 description 2
- 241000223960 Plasmodium falciparum Species 0.000 description 2
- 206010037660 Pyrexia Diseases 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 108020001027 Ribosomal DNA Proteins 0.000 description 2
- 108050001197 Ribosomal protein S13 Proteins 0.000 description 2
- 241000282849 Ruminantia Species 0.000 description 2
- 241000282887 Suidae Species 0.000 description 2
- 241000223776 Theileria equi Species 0.000 description 2
- 241000504303 Toxoplasma gondii RH Species 0.000 description 2
- 241000223109 Trypanosoma cruzi Species 0.000 description 2
- 102000004243 Tubulin Human genes 0.000 description 2
- 108090000704 Tubulin Proteins 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- 241000607479 Yersinia pestis Species 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 229940031567 attenuated vaccine Drugs 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 206010014599 encephalitis Diseases 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 210000003608 fece Anatomy 0.000 description 2
- 208000021760 high fever Diseases 0.000 description 2
- 229960001438 immunostimulant agent Drugs 0.000 description 2
- 239000003022 immunostimulating agent Substances 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 208000015994 miscarriage Diseases 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 2
- 229960000951 mycophenolic acid Drugs 0.000 description 2
- 230000003071 parasitic effect Effects 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 125000006850 spacer group Chemical group 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 229940075420 xanthine Drugs 0.000 description 2
- ZJBWTIUOKRAEPR-UHFFFAOYSA-N 2-amino-3,7-dihydropurin-6-one;3,7-dihydropurine-2,6-dione;3,7-dihydropurin-6-one Chemical compound O=C1NC=NC2=C1NC=N2.O=C1NC(N)=NC2=C1NC=N2.O=C1NC(=O)NC2=C1NC=N2 ZJBWTIUOKRAEPR-UHFFFAOYSA-N 0.000 description 1
- 102100033409 40S ribosomal protein S3 Human genes 0.000 description 1
- RJOXFJDOUQJOMQ-UHFFFAOYSA-N 6-sulfanylidene-3,7-dihydropurin-2-one Chemical compound S=C1NC(=O)NC2=C1NC=N2 RJOXFJDOUQJOMQ-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- 108010042708 Acetylmuramyl-Alanyl-Isoglutamine Proteins 0.000 description 1
- 208000000230 African Trypanosomiasis Diseases 0.000 description 1
- 206010001935 American trypanosomiasis Diseases 0.000 description 1
- 241001196513 Archidendron bigeminum Species 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000223846 Babesia canis Species 0.000 description 1
- 241001455947 Babesia divergens Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 101100056797 Canis lupus familiaris SAG gene Proteins 0.000 description 1
- 241001466804 Carnivora Species 0.000 description 1
- 208000024699 Chagas disease Diseases 0.000 description 1
- 206010010071 Coma Diseases 0.000 description 1
- 201000007045 Congenital toxoplasmosis Diseases 0.000 description 1
- 206010011732 Cyst Diseases 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 101150074155 DHFR gene Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 108020003215 DNA Probes Proteins 0.000 description 1
- 239000003298 DNA probe Substances 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- UPEZCKBFRMILAV-JNEQICEOSA-N Ecdysone Natural products O=C1[C@H]2[C@@](C)([C@@H]3C([C@@]4(O)[C@@](C)([C@H]([C@H]([C@@H](O)CCC(O)(C)C)C)CC4)CC3)=C1)C[C@H](O)[C@H](O)C2 UPEZCKBFRMILAV-JNEQICEOSA-N 0.000 description 1
- 241000223932 Eimeria tenella Species 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 241000224431 Entamoeba Species 0.000 description 1
- 208000004232 Enteritis Diseases 0.000 description 1
- 241000283074 Equus asinus Species 0.000 description 1
- 241001331845 Equus asinus x caballus Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241000224467 Giardia intestinalis Species 0.000 description 1
- 241000257324 Glossina <genus> Species 0.000 description 1
- 229920001503 Glucan Polymers 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 241000503811 Irus mitis Species 0.000 description 1
- 241000222697 Leishmania infantum Species 0.000 description 1
- 241000222734 Leishmania mexicana Species 0.000 description 1
- 208000004554 Leishmaniasis Diseases 0.000 description 1
- 244000089068 Melianthus major Species 0.000 description 1
- 241001314546 Microtis <orchid> Species 0.000 description 1
- 208000034486 Multi-organ failure Diseases 0.000 description 1
- 208000010718 Multiple Organ Failure Diseases 0.000 description 1
- 241001520860 Mycoplasma microti Species 0.000 description 1
- 241000397192 Myrmica divergens Species 0.000 description 1
- 108010023356 Nonmuscle Myosin Type IIA Proteins 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 101710112083 Para-Rep C1 Proteins 0.000 description 1
- 241000255129 Phlebotominae Species 0.000 description 1
- 206010037423 Pulmonary oedema Diseases 0.000 description 1
- 230000004570 RNA-binding Effects 0.000 description 1
- 102100022881 Rab proteins geranylgeranyltransferase component A 1 Human genes 0.000 description 1
- 241000722251 Rhodnius Species 0.000 description 1
- 101100532512 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) SAG1 gene Proteins 0.000 description 1
- 241000146987 Sarcocystis neurona Species 0.000 description 1
- 241001473628 Sarcocystis suihominis Species 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 108700005078 Synthetic Genes Proteins 0.000 description 1
- 241000223778 Theileria annulata Species 0.000 description 1
- 241000223779 Theileria parva Species 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- 101710119887 Trans-acting factor B Proteins 0.000 description 1
- 241001414833 Triatoma Species 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- UPEZCKBFRMILAV-UHFFFAOYSA-N alpha-Ecdysone Natural products C1C(O)C(O)CC2(C)C(CCC3(C(C(C(O)CCC(C)(C)O)C)CCC33O)C)C3=CC(=O)C21 UPEZCKBFRMILAV-UHFFFAOYSA-N 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 229940124536 anticoccidial agent Drugs 0.000 description 1
- 102000005936 beta-Galactosidase Human genes 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 101150055766 cat gene Proteins 0.000 description 1
- 239000013553 cell monolayer Substances 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000013626 chemical specie Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 239000003224 coccidiostatic agent Substances 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 208000031513 cyst Diseases 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 108020001096 dihydrofolate reductase Proteins 0.000 description 1
- OZRNSSUDZOLUSN-LBPRGKRZSA-N dihydrofolic acid Chemical compound N=1C=2C(=O)NC(N)=NC=2NCC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OZRNSSUDZOLUSN-LBPRGKRZSA-N 0.000 description 1
- 230000002222 downregulating effect Effects 0.000 description 1
- 239000003651 drinking water Substances 0.000 description 1
- 235000020188 drinking water Nutrition 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- UPEZCKBFRMILAV-JMZLNJERSA-N ecdysone Chemical compound C1[C@@H](O)[C@@H](O)C[C@]2(C)[C@@H](CC[C@@]3([C@@H]([C@@H]([C@H](O)CCC(C)(C)O)C)CC[C@]33O)C)C3=CC(=O)[C@@H]21 UPEZCKBFRMILAV-JMZLNJERSA-N 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 230000000925 erythroid effect Effects 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 229940085435 giardia lamblia Drugs 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 201000001505 hemoglobinuria Diseases 0.000 description 1
- 230000002008 hemorrhagic effect Effects 0.000 description 1
- 244000038280 herbivores Species 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 230000004727 humoral immunity Effects 0.000 description 1
- 230000007124 immune defense Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 208000000509 infertility Diseases 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 210000002490 intestinal epithelial cell Anatomy 0.000 description 1
- 244000000056 intracellular parasite Species 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 229940124735 malaria vaccine Drugs 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 208000029744 multiple organ dysfunction syndrome Diseases 0.000 description 1
- BSOQXXWZTUDTEL-ZUYCGGNHSA-N muramyl dipeptide Chemical compound OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)O[C@@H](O)[C@@H]1NC(C)=O BSOQXXWZTUDTEL-ZUYCGGNHSA-N 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 238000007857 nested PCR Methods 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 239000002353 niosome Substances 0.000 description 1
- 244000054334 omnivore Species 0.000 description 1
- 235000020912 omnivore Nutrition 0.000 description 1
- 229940126578 oral vaccine Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 208000005333 pulmonary edema Diseases 0.000 description 1
- 108010045647 puromycin N-acetyltransferase Proteins 0.000 description 1
- WKSAUQYGYAYLPV-UHFFFAOYSA-N pyrimethamine Chemical compound CCC1=NC(N)=NC(N)=C1C1=CC=C(Cl)C=C1 WKSAUQYGYAYLPV-UHFFFAOYSA-N 0.000 description 1
- 229960000611 pyrimethamine Drugs 0.000 description 1
- 108010054624 red fluorescent protein Proteins 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000036387 respiratory rate Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 108020004418 ribosomal RNA Proteins 0.000 description 1
- 108010033804 ribosomal protein S3 Proteins 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 210000001563 schizont Anatomy 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 230000037380 skin damage Effects 0.000 description 1
- 208000019116 sleep disease Diseases 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000004215 spore Anatomy 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 210000004876 tela submucosa Anatomy 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 210000003812 trophozoite Anatomy 0.000 description 1
- 230000001018 virulence Effects 0.000 description 1
- 230000009278 visceral effect Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 208000016261 weight loss Diseases 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/24—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Enterobacteriaceae (F), e.g. Citrobacter, Serratia, Proteus, Providencia, Morganella, Yersinia
- C07K14/245—Escherichia (G)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/06—Antimalarials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/14—Ectoparasiticides, e.g. scabicides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/43504—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates
- C07K14/43595—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates from coelenteratae, e.g. medusae
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/635—Externally inducible repressor mediated regulation of gene expression, e.g. tetR inducible by tetracyline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/52—Bacterial cells; Fungal cells; Protozoal cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Biophysics (AREA)
- Zoology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Veterinary Medicine (AREA)
- Biotechnology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Gastroenterology & Hepatology (AREA)
- General Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Toxicology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
挿入した制限部位を下線で示す。
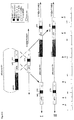
リボソーム蛋白質遺伝子S13の転写開始部位を決定するために、ベロ細胞で増殖させたToxoplasma gondii RHΔHXGPRTタキゾイトからRNAを単離した。GeneRacer(登録商標)キット(Invitrogen)を使用して全RNAから遺伝子特異的全長cDNAを得た。このキットを使用してRNAオリゴを全長mRNAの両末端にライゲーションした。オリゴdTによる逆転写を実施した後に、RNAオリゴと結合するGeneRacerプライマーを遺伝子特異的プライマーと併用してPCR増幅し、産物を得た。その後、転写開始部位(STS)を決定することができた。これはプライマーREV13A(#7,配列番号11)及びREV13B(#8,配列番号12)を使用してリボソーム蛋白質遺伝子S13について実施した。プライマー#7をGeneRacerプライマーと併用して産物を得た後にプライマー#8をネステッドPCRに使用した。PCR産物は2個の弱いバンドと1個の強いバンドの3個のバンドを示した。最高産物量を示すバンドを単離し、STSを決定し、0位とした。図3A及び3Bには開始コドンに対するSTSの位置関係も示す。
tetリプレッサーによる誘導発現を試験するために、単一tetO部位の存在下又は不在下でS13プロモーターの制御下にlacZ遺伝子から数種のレポーター構築物を作製した。まず、プラスミドS13/lacZ(最終構築物の構成と配列については図2参照)を作製した後、このプラスミドを使用して以下のようにtetO部位の配列を挿入又は置換した。
rp−L9プロモーターへのtetO挿入/置換を図3Bに示す。
tub−YFP−TR株にエレクトロポレーションした場合に単一tetオペレーターを含むS13プロモーターにより誘導されるLacZ発現の測定。
a)S13/LZ:これはS13リボソーム蛋白質遺伝子プロモーターの制御下にLacZ遺伝子を一過的にトランスフェクトしたtub−YFP−TRトランスフェクタントトキソプラズマ株である。この構築物にはtetオペレーター部位が存在しない。
a)上記S13/LZ
b)上記S13s−23/lacZ(I)(=S13s−23/lacZ)
c)S13s−23/lacZ(II):これは第1のtetオペレーターのすぐ下流に付加tetオペレーター部位をクローニングした以外はS13s−23/lacZと同一である。この構築物はS13s−23/lacZ(I)と同様の方法を使用して構築した。
Claims (20)
- 誘導性プロモーターの制御下にリボソーム蛋白質遺伝子を含むことを特徴とするアピコンプレックス(Apicomplexa)門又はトリパノソーマ(Trypanosomatidae)科の生きた弱毒寄生虫。
- 前記寄生虫がコクシジウム(Coccidia)、ピロプラズマ(Piroplasmida)又は住血胞子虫(Haemosporida)に属することを特徴とする請求項1に記載の生きた弱毒寄生虫。
- 前記寄生虫がアイメリア(Eimeridiidae)科、クリプトスポリジウム(Cryptosporidiidae)科又はサルコシスティス(Sarcocystidae)科に属することを特徴とする請求項2に記載の生きた弱毒寄生虫。
- 前記寄生虫がアイメリア(Eimeria)属、クリプトスポリジウム(Cryptosporidium)属、トキソプラズマ(Toxoplasma)属、サルコシスティス(Sarcocystis)属又はネオスポラ(Neospora)属に属することを特徴とする請求項3に記載の生きた弱毒寄生虫。
- 前記寄生虫がバベシア(Babesiidae)科又はタイレリア(Theileriidae)科に属することを特徴とする請求項2に記載の生きた弱毒寄生虫。
- 前記寄生虫がバベシア(Babesia)属又はタイレリア(Theileria)属に属することを特徴とする請求項5に記載の生きた弱毒寄生虫。
- 前記寄生虫がプラスモジウム(Plasmodium)属に属することを特徴とする請求項2に記載の生きた弱毒寄生虫。
- 前記寄生虫がトリパノソーマ(Trypanosoma)属又はリーシュマニア(Leishmania)属に属することを特徴とする請求項1に記載の生きた弱毒寄生虫。
- 前記誘導性プロモーターがオペレーター部位と前記オペレーター部位と可逆的に結合することが可能なリプレッサー蛋白質をベースとすることを特徴とする請求項1から8のいずれか一項に記載の生きた弱毒寄生虫。
- 前記誘導性プロモーターが抗生物質により誘導可能であることを特徴とする請求項1から9のいずれか一項に記載の生きた弱毒寄生虫。
- 前記誘導性プロモーターがテトラサイクリン又は無水テトラサイクリン又はその誘導体により誘導可能であることを特徴とする請求項10に記載の生きた弱毒寄生虫。
- tetRシステムを誘導性プロモーターとして使用することを特徴とする請求項11に記載の生きた弱毒寄生虫。
- 前記リボソーム蛋白質遺伝子がL9、S3、プラスチド−S9又はS13、好ましくはトキソプラズマ・ゴンジイ(Toxoplasma gondii)のL9、S3、プラスチド−S9又はS13をコードする遺伝子であることを特徴とする請求項1から12のいずれか一項に記載の生きた弱毒寄生虫。
- ワクチンで使用するための請求項1から13のいずれか一項に記載の生きた弱毒寄生虫。
- 請求項1から13のいずれか一項に記載の生きた弱毒寄生虫と医薬的に許容可能なキャリヤーを含有することを特徴とする寄生虫感染防除用ワクチン。
- アピコンプレックス門又はトリパノソーマ科の寄生虫に起因する感染の防除用ワクチンの製造における請求項1から13のいずれか一項に記載の生きた弱毒寄生虫の使用。
- 請求項1から13のいずれか一項に記載の生きた弱毒寄生虫と医薬的に許容可能なキャリヤーを混合する段階を含む請求項15に記載のワクチンの製造方法。
- tetリプレッサー蛋白質と異種蛋白質又はその一部を含むtetリプレッサー融合蛋白質をコードするDNAフラグメントであって、前記異種蛋白質又はその一部がtetリプレッサー蛋白質のN末端側に融合しており、前記融合蛋白質のモノマー形態が分子量60kD未満であり且つGPIアンカー、分泌/排泄シグナル及び膜貫通領域をもたない前記DNAフラグメント。
- 前記寄生虫がtetオペレーター部位と請求項18に記載のtetリプレッサー融合蛋白質をコードするDNAフラグメントを含むことを特徴とする請求項1から13のいずれか一項に記載の生きた弱毒寄生虫。
- 前記寄生虫が2個以上のtetオペレーター部位を含むことを特徴とする請求項19に記載の生きた弱毒寄生虫。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP02078953 | 2002-09-20 | ||
| PCT/EP2003/010696 WO2004026903A2 (en) | 2002-09-20 | 2003-09-19 | Live antenuated parasite vaccine |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006518184A true JP2006518184A (ja) | 2006-08-10 |
| JP2006518184A5 JP2006518184A5 (ja) | 2009-11-12 |
Family
ID=32011015
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004537149A Pending JP2006518184A (ja) | 2002-09-20 | 2003-09-19 | 弱毒寄生虫生ワクチン |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20050244437A1 (ja) |
| EP (1) | EP1543028A2 (ja) |
| JP (1) | JP2006518184A (ja) |
| CN (1) | CN100393866C (ja) |
| AU (1) | AU2003270274B2 (ja) |
| BR (1) | BR0313994A (ja) |
| CA (1) | CA2498604A1 (ja) |
| WO (1) | WO2004026903A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019156751A (ja) * | 2018-03-13 | 2019-09-19 | 共立製薬株式会社 | 反芻動物のネオスポラ感染症に対するワクチン製剤 |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| OA13341A (en) | 2003-12-19 | 2007-04-13 | Seattle Biomedical Res Inst | Live genetically attenuated malaria vaccine. |
| US7722860B2 (en) | 2004-12-03 | 2010-05-25 | Seattle Biomedical Research Institute | Live genetically engineered protozoan vaccine |
| ES2319242B1 (es) | 2005-12-23 | 2009-12-01 | Laboratorios Hipra, S.A. | Aislado avirulento de neospora canimum y sus usos. |
| US9265818B2 (en) * | 2007-05-04 | 2016-02-23 | The United States Of America, As Represented By The Secretary Of Agriculture | Genetically modified Babesia parasites expressing protective tick antigens and uses thereof |
| ES2326770B1 (es) | 2007-07-13 | 2010-07-26 | Universidad Complutense De Madrid | Uso de un nuevo aislado de neospora caninum para el desarrollo de pruebas de diagnostico y para la fabricacion de productos para el tratamiento y prevencion de la infenccion causada por neospora. |
| US9050281B2 (en) | 2008-05-29 | 2015-06-09 | Intervet Inc. | Coccidiosis vaccines |
| CA2743262C (en) | 2008-11-13 | 2021-11-02 | Intervet International B.V. | Eimeria vaccine for turkeys |
| BR112012000679A2 (pt) * | 2009-07-13 | 2016-11-01 | Leti Sl Lab | diagnóstico de uma doença parasitária como a leishmaniose utilizando um extrato de proteína ribossômica (epr) |
| EP2412382A1 (en) | 2010-07-29 | 2012-02-01 | University Court of the University of Edinburgh | Recombinant Trypanosoma theileri parasite |
| WO2012031076A1 (en) * | 2010-09-02 | 2012-03-08 | Ludwig Institute For Cancer Research, Ltd. | Recombinant trypanosoma cruzi cells useful as anti-cancer immune agents |
| EP2658568A1 (en) | 2010-12-29 | 2013-11-06 | Intervet International B.V. | Canine babesiosis vaccine antigen |
| AU2016347636B2 (en) | 2015-10-28 | 2021-02-18 | Universidad Complutense De Madrid | Neospora vaccine composition |
| AU2017289886A1 (en) * | 2016-06-29 | 2019-01-24 | Ramot At Tel-Aviv University Ltd. | Engineered parasites for delivering protein to the central nervous system (CNS) |
| WO2019140136A1 (en) * | 2018-01-10 | 2019-07-18 | University Of Washington | Malarial vaccination methods and regimens |
| BR112020022003A2 (pt) * | 2018-05-15 | 2021-01-26 | The Walter And Eliza Hall Institute Of Medical Research | parasita protozoário mutante isolado, vacina, métodos para vacinar um animal contra um parasita, contra uma infecção ou condição parasítica e contra toxoplasmose e para prevenir toxoplasmose em um animal, e, uso de um parasita mutante ou da vacina |
| CN109825514A (zh) * | 2019-01-24 | 2019-05-31 | 华中农业大学 | 田鼠巴贝斯虫gpi10基因及其编码的蛋白和应用 |
| CN110922491B (zh) * | 2019-12-17 | 2021-08-27 | 河南科技大学 | 一种肉孢子虫融合抗原、编码基因、间接elisa抗体检测试剂盒及其应用 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000507089A (ja) * | 1995-12-22 | 2000-06-13 | イー・アイ・デユポン・ドウ・ヌムール・アンド・カンパニー | 組換えバキュロウイルスの生産 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5756662A (en) * | 1995-03-14 | 1998-05-26 | Corixa Corporation | Compounds and methods for the detection of T. cruzi infection |
| WO1998037185A2 (en) * | 1997-02-20 | 1998-08-27 | The Board Of Regents Of The University Of Texas System | Vectors for controlled gene expression |
| US6596508B2 (en) * | 1999-03-19 | 2003-07-22 | National Research Council Of Canada | CRE-inducible expression system |
| AU767117B2 (en) * | 1999-05-04 | 2003-10-30 | David Ferguson | Anti-microbial agents, diagnostic reagents, and vaccines based on unique apicomplexan parasite components |
-
2003
- 2003-09-19 WO PCT/EP2003/010696 patent/WO2004026903A2/en active Application Filing
- 2003-09-19 CA CA002498604A patent/CA2498604A1/en not_active Abandoned
- 2003-09-19 JP JP2004537149A patent/JP2006518184A/ja active Pending
- 2003-09-19 AU AU2003270274A patent/AU2003270274B2/en not_active Ceased
- 2003-09-19 BR BR0313994-8A patent/BR0313994A/pt not_active IP Right Cessation
- 2003-09-19 EP EP03750636A patent/EP1543028A2/en not_active Withdrawn
- 2003-09-19 CN CNB038222086A patent/CN100393866C/zh not_active Expired - Fee Related
- 2003-09-19 US US10/526,731 patent/US20050244437A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000507089A (ja) * | 1995-12-22 | 2000-06-13 | イー・アイ・デユポン・ドウ・ヌムール・アンド・カンパニー | 組換えバキュロウイルスの生産 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019156751A (ja) * | 2018-03-13 | 2019-09-19 | 共立製薬株式会社 | 反芻動物のネオスポラ感染症に対するワクチン製剤 |
| JP7032965B2 (ja) | 2018-03-13 | 2022-03-09 | 共立製薬株式会社 | 反芻動物のネオスポラ感染症に対するワクチン製剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2004026903A2 (en) | 2004-04-01 |
| CN1681842A (zh) | 2005-10-12 |
| US20050244437A1 (en) | 2005-11-03 |
| BR0313994A (pt) | 2005-07-19 |
| AU2003270274A1 (en) | 2004-04-08 |
| CN100393866C (zh) | 2008-06-11 |
| AU2003270274B2 (en) | 2009-03-19 |
| WO2004026903A3 (en) | 2004-06-03 |
| CA2498604A1 (en) | 2004-04-01 |
| EP1543028A2 (en) | 2005-06-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2006518184A (ja) | 弱毒寄生虫生ワクチン | |
| Ding et al. | In ovo vaccination with the Eimeria tenella EtMIC2 gene induces protective immunity against coccidiosis | |
| Petersen et al. | Biology of toxoplasmosis | |
| US5597571A (en) | Eimeria antigenic composition which elicits antibodies against avian coccidiosis | |
| JP2009077713A (ja) | アイメリア・マキシマ(Eimeriamaxima)の配偶子母細胞由来の組換え56及び82kDa各抗原をコードする核酸及びその使用 | |
| US7722860B2 (en) | Live genetically engineered protozoan vaccine | |
| Klotz et al. | Identification of Eimeria tenella genes encoding for secretory proteins and evaluation of candidates by DNA immunisation studies in chickens | |
| Li et al. | Transgenic Eimeria mitis expressing chicken interleukin 2 stimulated higher cellular immune response in chickens compared with the wild-type parasites | |
| JP4898432B2 (ja) | 遺伝子組換え植物による抗原虫病経口ワクチン | |
| WO2000046381A1 (en) | Recombinant expression of heterologous nucleic acids in protozoa | |
| US9250239B2 (en) | Compositions and methods for detecting microbial infections | |
| US7326568B2 (en) | Recombinant expression of heterologous nucleic acids in protozoa | |
| CA2531161A1 (en) | Use of a novel eimeria gene and corresponding protein | |
| KR0152245B1 (ko) | 에이메리아 테넬라 왁찐 | |
| Soete et al. | The importance of reverse genetics in determining gene function in apicomplexan parasites | |
| WO2013113865A1 (en) | Eimeria vector vaccine for campylobacter jejuni | |
| EP2598163B1 (en) | Recombinant trypanosoma theileri parasite | |
| US9603914B2 (en) | Mutant strains of Neospora and uses thereof | |
| CN111032079A (zh) | 双重减毒肝晚期疟原虫及相关组合物和方法 | |
| US20100093062A1 (en) | Transfection system for perkinsus species | |
| Gaylets | The Apicomplexan-Specific FIKK Kinase is Crucial for Cyst Formation in Toxoplasma gondii | |
| Qu et al. | CRISPR-Cas9-based method for isolating microgametes of Eimeria tenella | |
| Kopko | Response of chickens to different immunizing strategies using a refractile body antigen of Eimeria tenella | |
| Belperron | Plasmodium falciparum SERA protein transgenics used in the study parasite immunobiology and drug resistance | |
| JP2008133200A (ja) | 鳥コクシジウム症に対するdnaワクチン |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20061222 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090324 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090617 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090624 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20090924 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20091020 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100219 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20100407 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100706 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100928 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20101005 |