JP2006010534A - コア・シェル型磁性粒子センサー - Google Patents
コア・シェル型磁性粒子センサー Download PDFInfo
- Publication number
- JP2006010534A JP2006010534A JP2004188881A JP2004188881A JP2006010534A JP 2006010534 A JP2006010534 A JP 2006010534A JP 2004188881 A JP2004188881 A JP 2004188881A JP 2004188881 A JP2004188881 A JP 2004188881A JP 2006010534 A JP2006010534 A JP 2006010534A
- Authority
- JP
- Japan
- Prior art keywords
- target substance
- plasmon resonance
- magnetic particles
- magnetic
- binding
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 239000006249 magnetic particle Substances 0.000 title claims abstract description 66
- 239000011258 core-shell material Substances 0.000 title 1
- 239000013076 target substance Substances 0.000 claims abstract description 122
- 238000001514 detection method Methods 0.000 claims abstract description 62
- 239000002184 metal Substances 0.000 claims abstract description 29
- 229910052751 metal Inorganic materials 0.000 claims abstract description 29
- 230000000737 periodic effect Effects 0.000 claims abstract description 26
- 230000005291 magnetic effect Effects 0.000 claims abstract description 22
- 239000000758 substrate Substances 0.000 claims description 31
- 230000027455 binding Effects 0.000 claims description 27
- 238000000034 method Methods 0.000 claims description 17
- 239000000463 material Substances 0.000 claims description 12
- 230000008859 change Effects 0.000 claims description 10
- 230000005284 excitation Effects 0.000 claims description 8
- 238000011002 quantification Methods 0.000 claims description 3
- 238000006243 chemical reaction Methods 0.000 abstract description 16
- 238000005259 measurement Methods 0.000 abstract description 11
- 238000009792 diffusion process Methods 0.000 abstract description 5
- 239000007788 liquid Substances 0.000 abstract description 5
- 239000000243 solution Substances 0.000 description 22
- 239000003153 chemical reaction reagent Substances 0.000 description 18
- 239000010419 fine particle Substances 0.000 description 18
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 14
- 239000000126 substance Substances 0.000 description 12
- 239000000696 magnetic material Substances 0.000 description 10
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 9
- 239000010931 gold Substances 0.000 description 9
- 239000012491 analyte Substances 0.000 description 8
- 239000010410 layer Substances 0.000 description 8
- 230000003287 optical effect Effects 0.000 description 8
- 238000001228 spectrum Methods 0.000 description 8
- 102000004877 Insulin Human genes 0.000 description 7
- 108090001061 Insulin Proteins 0.000 description 7
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 7
- 229910052737 gold Inorganic materials 0.000 description 7
- 229940125396 insulin Drugs 0.000 description 7
- 108090000623 proteins and genes Proteins 0.000 description 7
- 239000000523 sample Substances 0.000 description 7
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 6
- 230000001419 dependent effect Effects 0.000 description 6
- 230000003993 interaction Effects 0.000 description 6
- 239000002245 particle Substances 0.000 description 6
- 102000004169 proteins and genes Human genes 0.000 description 6
- 239000002131 composite material Substances 0.000 description 5
- 230000035945 sensitivity Effects 0.000 description 5
- 239000011521 glass Substances 0.000 description 4
- 230000003053 immunization Effects 0.000 description 4
- 238000002649 immunization Methods 0.000 description 4
- 230000035699 permeability Effects 0.000 description 4
- 229910045601 alloy Inorganic materials 0.000 description 3
- 239000000956 alloy Substances 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000011247 coating layer Substances 0.000 description 3
- 229910017052 cobalt Inorganic materials 0.000 description 3
- 239000010941 cobalt Substances 0.000 description 3
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 3
- 239000007850 fluorescent dye Substances 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 239000011859 microparticle Substances 0.000 description 3
- 239000011259 mixed solution Substances 0.000 description 3
- 229910052759 nickel Inorganic materials 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- KZNICNPSHKQLFF-UHFFFAOYSA-N succinimide Chemical group O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 3
- 229910000859 α-Fe Inorganic materials 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 2
- -1 antibody Proteins 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 229910001566 austenite Inorganic materials 0.000 description 2
- 239000012620 biological material Substances 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 238000011088 calibration curve Methods 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000000609 electron-beam lithography Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000003302 ferromagnetic material Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 229910044991 metal oxide Inorganic materials 0.000 description 2
- 150000004706 metal oxides Chemical class 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- GWOLZNVIRIHJHB-UHFFFAOYSA-N 11-mercaptoundecanoic acid Chemical compound OC(=O)CCCCCCCCCCS GWOLZNVIRIHJHB-UHFFFAOYSA-N 0.000 description 1
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- NIPNSKYNPDTRPC-UHFFFAOYSA-N N-[2-oxo-2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 NIPNSKYNPDTRPC-UHFFFAOYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 229910004298 SiO 2 Inorganic materials 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 238000000862 absorption spectrum Methods 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 239000012670 alkaline solution Substances 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000000975 co-precipitation Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 150000002013 dioxins Chemical class 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 231100000507 endocrine disrupting Toxicity 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 239000003344 environmental pollutant Substances 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical compound CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 230000005308 ferrimagnetism Effects 0.000 description 1
- 230000005307 ferromagnetism Effects 0.000 description 1
- 239000010408 film Substances 0.000 description 1
- 238000001215 fluorescent labelling Methods 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 230000005389 magnetism Effects 0.000 description 1
- 230000005415 magnetization Effects 0.000 description 1
- 239000002923 metal particle Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229910000889 permalloy Inorganic materials 0.000 description 1
- 150000003071 polychlorinated biphenyls Chemical class 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 239000013558 reference substance Substances 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 238000009774 resonance method Methods 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 150000003408 sphingolipids Chemical class 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54313—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being characterised by its particulate form
- G01N33/54326—Magnetic particles
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
- G01N33/54373—Apparatus specially adapted for solid-phase testing involving physiochemical end-point determination, e.g. wave-guides, FETS, gratings
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S435/00—Chemistry: molecular biology and microbiology
- Y10S435/808—Optical sensing apparatus
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S436/00—Chemistry: analytical and immunological testing
- Y10S436/805—Optical property
Abstract
【課題】 液媒体に分散させた状態で標的物質とその捕捉体とを反応させて拡散律速を抑えることで反応効率を向上させ、この反応を行なった後に、プラズモン共鳴を生じさせる周期構造を設けた検出用の素子の表面に、捕捉体で捕捉した標的物質を、簡単、かつ取扱い性よく、分散させて、高感度な測定を可能とする検出用素子と磁性粒子との組合せを提供すること。
【解決手段】 磁性体からなるコアの表面に金属層を設け、更に、金属層表面に標的物質捕捉体を保持させた磁性粒子と試料中の標的物質とを液媒体での分散状態で反応させてから、プラズモン共鳴を測定し得る周期的構造を有する素子の表面にこれを適用し、標的物質の濃度に基づくプラズモン共鳴の変化を光学的に検出して試料中の標的物質の濃度を検出する。
【選択図】 図3
【解決手段】 磁性体からなるコアの表面に金属層を設け、更に、金属層表面に標的物質捕捉体を保持させた磁性粒子と試料中の標的物質とを液媒体での分散状態で反応させてから、プラズモン共鳴を測定し得る周期的構造を有する素子の表面にこれを適用し、標的物質の濃度に基づくプラズモン共鳴の変化を光学的に検出して試料中の標的物質の濃度を検出する。
【選択図】 図3
Description
タンパク質やDNAなど検体中の標的物質と、金属に固定化された捕捉体を高効率に反応させ、標的物質の検出感度を向上させる技術を提供する。
血液中には、ガン・肝炎・糖尿病・骨粗しょう症など特定の疾患に対するマーカーが複数存在している。罹患した際には、平時より特定のタンパク質の濃度が増加する。これらを平時からモニターしておくことで、重大な病気を早期に発見することが出来るため、次世代の医療技術として期待されている。未加工で未精製のタンパク質を分析するための方法の1つは、生物学的なリガンド−アナライト相互作用を利用して特定の化合物を識別するセンサーを基本としたものである。
センサーには、蛍光標識免疫法、磁気標識免疫法、プラズモン共鳴法など幾つかの方式があるが、どの場合もリガントをセンサー表面に固定し、検体中のアナライトを高感度にかつ選択性よく選別して結合することにより夾雑物を排除し、目的とするタンパク質のみを高効率に基板表面に固定化することが共通のステップとなる。蛍光標識免疫法では、リガンド−アナライト複合体に、蛍光色素で標識した第二のリガントをさらに結合させ、蛍光色素を励起し、蛍光量を測定することでアナライトの濃度を測定する。磁気標識免疫法では、リガンド−アナライト複合体に、磁気ビーズで標識した第二のリガントをさらに結合させ、磁界の変化を検出することでアナライトの濃度を測定する。プラズモン共鳴法では、金属薄膜や金属の微粒子の上に形成されたリガンド−アナライト複合体を、金属プラズモンが界面物質の屈折率変化に高感度に反応することを利用して、アナライトの濃度を測定している。
特許文献1には、ガラス基板表面にAu微粒子を固定し、溶媒の屈折率変化や抗原抗体反応における抗原吸着の程度などを検出するプラズモン共鳴センサーが開示されている。該発明では、狭隘な場所に配置することや任意の形状の試料に対して優位であることが示されている。
特許文献2には、回折格子型SPR(サーフェスプラズモン共鳴)に微小な流路(マイクロチャンネルチップ)を組み合わせ検体や洗浄液の導入量を最小にして、測定対象物と特定物質とが結合−解離する過程を高効率で検出する装置が示されている。
非特許文献1には、フェライトを金で被覆したコア・シェル型の微粒子の作成方法、ならびに光学特性(吸光スペクトル)が示されている。
特登録3452837号
特開2004−93558
(NANO LETTERS,2004,vol.4,No.4,p719−723)
上記特許文献2では、標的物質と捕捉体を高効率に反応させる為に、検体を微小な流路中に注入し送液させることで、標的物質の濃度勾配が生じることによる拡散律速を抑制している。そして、固定化された捕捉体に捕捉された標的物質を、プラズモン共鳴の変化によりその濃度を検出している。すなわち、プラズモン共鳴を生じさせる表面に検体を接触させる際に標的物質の濃度勾配が生じることによる拡散律速を抑制するための特別な構造が必要となる。
本発明の目的は、液媒体に分散させた状態で標的物質とその捕捉体とを反応させて拡散律速を抑えることで反応効率を向上させ、この反応を行なった後に、プラズモン共鳴を生じさせる周期構造を設けた検出用の素子の表面に、捕捉体で捕捉した標的物質を、簡単、かつ取扱い性よく、分散させて、高感度な測定を可能とする検出用素子と磁性粒子との組合せを提供することにある。本発明の他の目的は、この検出用素子と磁性粒子との組合せを用いて得られる測定用試料におけるプラズモン共鳴を光学的に検出し得る検出手段を少なくとも用いた装置及び検出方法を提供することにある。
上記に挙げた課題は、以下に示す本発明によって達成することができる。
本発明の検体中の標的物質を検出するための素子は、プラズモン共鳴を利用して検体中の標的物質を検出するための素子であって、前記標的物質との結合能を有する捕捉体を保持する金属により被覆された磁性粒子を磁気的に固定し得る表面と、該表面に設けられたプラズモン共鳴を生じ得る周期構造と、を有し、前記磁性体粒子が前記基体の前記周期構造を有する表面に固定されたときに、該表面に励起光を入射することで生じたプラズモン共鳴を検出し、検出されたプラズモン共鳴の該磁性体粒子表面への前記標的物質の結合に基づく変化から該標的物質の該磁性粒子への結合量を求めるために用いるものであることを特徴とする標的物質検出用の素子である。
本発明の検体中の標的物質を検出するための装置は、前記標的物質と、前記標的物質との結合能を有する捕捉体を表面に有する、金属により被覆された磁性粒子とを結合させる手段と、前記磁性粒子を磁気的に固定し得る表面にプラズモン共鳴を生じ得る周期構造を設けた基体を有する検出用素子に、磁性粒子を固定するための手段と、前記周期構造に励起光を入射することで生じたプラズモン共鳴を光学的に検出するための検出手段と、前記検出手段で検出されたプラズモン共鳴の該磁性体粒子表面へ前記標的物質が結合している場合における変化に基づいて該標的物質の該磁性粒子への結合量を求めるための定量手段と、を有することを特徴とする標的物質検出装置である。
また、本発明の検体中の標的物質を検出する方法は、前記標的物質と、前記標的物質との結合能を有する捕捉体を表面に有する、金属により被覆された磁性粒子とを結合させる工程と、前記磁性粒子を磁気的に固定し得る表面にプラズモン共鳴を生じ得る周期構造を設けた基体を有する検出用素子に、前記標的物質が結合した磁性粒子を固定させる工程と、前記標的物質が結合した磁性粒子が固定されている周期構造に励起光を入射することで生じたプラズモン共鳴を検出し、検出されたプラズモン共鳴の該磁性体粒子表面への前記標的物質の結合による変化に基づいて前記標的物質の結合量を求める工程とを有することを特徴とする標的物質検出方法である。
本発明によると、標的物質と捕捉体を表面に有する金属により被覆された磁性粒子(金属コート微粒子)を反応させるという容易な手法により、拡散律速を抑え反応効率を向上させることができる。さらに、標的物質と充分に反応した磁性粒子を磁気的な力を利用して基板に固定化し、感度の高いプラズモン共鳴を利用することにより検出することができる。
本発明にかかるプラズモン共鳴を利用して検体中の標的物質を検出するための素子は、標的物質との結合能を有する捕捉体を金属被覆層表面に保持する磁性粒子を標的物質の検出用試薬として用いる検出方法に利用されるものであり、基体の表面にこの磁性粒子を磁気的に固定し得る表面を設け、更にこの表面にプラズモン共鳴を生じさせる周期構造としたものである。この素子には、標的物質との結合能を有する補足体を保持する金属被覆層表面を有する微粒子が好ましいものとして含まれる。
少なくとも、この検出用素子と、標的物質との結合能を有する捕捉体を表面に有する、金属により被覆された磁性粒子と、によって、前記磁性体粒子が前記基体の前記周期構造を有する表面に固定されたときに、該表面に励起光を入射することで生じたプラズモン共鳴を検出し、検出されたプラズモン共鳴の該磁性体粒子表面への前記標的物質の結合に基づく変化から該標的物質の該磁性粒子への結合量を求めるために用いる標的物質検出用のキットを構成することができる。更に、このキットは検出用素子の周期構造を有する表面に磁性体粒子を固定した状態で、この基体表面に励起光を入射することで生じたプラズモン共鳴を検出するための検出手段(必要に応じて検出されたデータの解析を行なうコンピュータなどの解析手段などを有する)を更に有することができる。
以下、図を参照しながら本発明に関わる実施形態につき述べる。ここでは本発明を完全に理解してもらうため、特定の実施形態について詳細な説明をおこなうが、本発明はここに記した内容に限定されるものではない。
まず本発明の第一の実施形態について、図1〜4を参照しながら説明する。
<1−1.標的物質検出用の試薬>
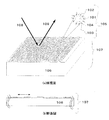
まず、標的物質検出用の試薬としての磁性粒子の構造を、図2を用いて説明する。図2は、磁性粒子を含む液体に標的物質104を添加し、一部の磁性粒子の金属層102上に固定した標的物質捕捉体103に標的物質を捕捉させ、これを検出用素子基体106に適用する段階を示している。標的物質検出用の磁性粒子は、磁性体からなるコア101を金属層102で覆った、コア・シェル構造をとっている。さらに、標的物質捕捉体103が磁性粒子表面を構成する金属層102上に固定されている。ここで、コア101の材料である磁性体としては、鉄、コバルト、ニッケル等の金属またはこれらの酸化物、合金、もしくはこれらの複合体などが用いられるが、本発明では強磁性体が好ましく、超常磁性を持つことが好ましい。一般に、強磁性体材料の粒径が数100〜数10nm以下になると低い磁界で飽和を示すにもかかわらず、ヒステリシスを示さず、残留磁化もない超常磁性を示す。そのため、コア101のサイズは前述の超常磁性特性が現れるサイズであることが望ましい。
まず、標的物質検出用の試薬としての磁性粒子の構造を、図2を用いて説明する。図2は、磁性粒子を含む液体に標的物質104を添加し、一部の磁性粒子の金属層102上に固定した標的物質捕捉体103に標的物質を捕捉させ、これを検出用素子基体106に適用する段階を示している。標的物質検出用の磁性粒子は、磁性体からなるコア101を金属層102で覆った、コア・シェル構造をとっている。さらに、標的物質捕捉体103が磁性粒子表面を構成する金属層102上に固定されている。ここで、コア101の材料である磁性体としては、鉄、コバルト、ニッケル等の金属またはこれらの酸化物、合金、もしくはこれらの複合体などが用いられるが、本発明では強磁性体が好ましく、超常磁性を持つことが好ましい。一般に、強磁性体材料の粒径が数100〜数10nm以下になると低い磁界で飽和を示すにもかかわらず、ヒステリシスを示さず、残留磁化もない超常磁性を示す。そのため、コア101のサイズは前述の超常磁性特性が現れるサイズであることが望ましい。
金属層102の素材としては、プラズモン共鳴による検出に適していればよい。すなわちプラズモン共鳴現象が生じうる金属元素であれば、制約はないが、その中でも、金、銀、銅、白金、アルミニウム、亜鉛、カリウムなど金属の複素誘電率をε=ε1+iε2としたとき、|ε1|≫ε2、ε1<0となる金属が好ましい。
金属層102の膜厚は、金属層を介しても中の磁気によって捕捉微粒子を捕集可能であれば特に制約はないが、金属層102を含んだ微粒子の寸法が、4nm〜300nmの範囲にあることが好ましい。図2では磁性体からなる単一の粒子が、コアを形成している状態を図示しているが、寸法が超常磁性を示す磁性粒子を樹脂等の非磁性材料中に複数分散したものでコアを形成しても構わない。
金属層102の表面に固定された標的物質捕捉体103は、標的物質と特異的な結合対を形成するものであれば、特に制約はない。具体的には、抗体、核酸などが挙げられる。このようにして、溶液中に試薬となる標的物質を捕捉する捕捉微粒子を含んだ試薬溶液が作製できる。
捕捉体を有する磁性粒子を分散させる溶液については、特に制限は設けないが、磁性粒子が凝集することなく安定して分散であり、抗原抗体反応やDNAハイブリダイゼーション反応がおこるようなpHである溶液が好ましい。
捕捉体を有する磁性粒子を分散させる溶液については、特に制限は設けないが、磁性粒子が凝集することなく安定して分散であり、抗原抗体反応やDNAハイブリダイゼーション反応がおこるようなpHである溶液が好ましい。
具体的には、検体中に含まれる標的物質は、非生体物質と生体物質に大別される。
非生体物質として産業上利用価値の大きいものとしては、環境汚染物質としての塩素置
換数/位置の異なるPCB類、同じく塩素置換数/位置の異なるダイオキシン類、いわゆ
る環境ホルモンと呼ばれる内分泌撹乱物質等が挙げられる。
換数/位置の異なるPCB類、同じく塩素置換数/位置の異なるダイオキシン類、いわゆ
る環境ホルモンと呼ばれる内分泌撹乱物質等が挙げられる。
生体物質としては、核酸、タンパク質、糖鎖、脂質及びそれらの複合体から選択される生体物質が含まれ、更に詳しくは、核酸、タンパク質、糖鎖、脂質から選択される生体分子を含んでなるものであり、具体的には、DNA、RNA、アプタマー、遺伝子、染色体、細胞膜、ウイルス、抗原、抗体、レクチン、ハプテン、ホルモン、レセプター、酵素、ペプチド、スフィンゴ糖、スフィンゴ脂質の何れかから選択された物質を含むものであれば、如何なる物質にも本発明を適用することができる。更には、前記の「生体物質」を産生する細菌や細胞そのものも、本発明が対象とする「生体物質」として標的物質となり得る。
<1−2.標的物質検出素子>
標的物質検出素子を、図1を用いて説明する。標的物質検出素子は、周期的な凹凸構造を有する磁性体からなる表面を有する基体106を有して構成され、この表面に標的物質を捕捉した磁性粒子からなる複合体105が磁気的な相互作用により配置される。図2に示す状態で、標的物質を捕捉した捕捉微粒子と、標的物質を捕捉していない捕捉微粒子と、を含んだ混合溶液201を基体106の周期的な凹凸構造を有する表面に滴下すると、磁気的な相互作用が働き磁性粒子が基体の全面に配置させられ、可視光に対してプラズモン共鳴を検出し得る回折格子として作用する表面が作成される。なお、図2に示すように液媒体中での分散状態で磁性粒子と標的物質の反応が行なわれるので、必要に応じて撹拌などを行なうことで、これらの反応を効率良く行なうことができる。
標的物質検出素子を、図1を用いて説明する。標的物質検出素子は、周期的な凹凸構造を有する磁性体からなる表面を有する基体106を有して構成され、この表面に標的物質を捕捉した磁性粒子からなる複合体105が磁気的な相互作用により配置される。図2に示す状態で、標的物質を捕捉した捕捉微粒子と、標的物質を捕捉していない捕捉微粒子と、を含んだ混合溶液201を基体106の周期的な凹凸構造を有する表面に滴下すると、磁気的な相互作用が働き磁性粒子が基体の全面に配置させられ、可視光に対してプラズモン共鳴を検出し得る回折格子として作用する表面が作成される。なお、図2に示すように液媒体中での分散状態で磁性粒子と標的物質の反応が行なわれるので、必要に応じて撹拌などを行なうことで、これらの反応を効率良く行なうことができる。
基体106は、光の波長と同じ程度のサイズの周期構造を持つように構成されて、プラズモン共鳴を検出し得る構造となっている。具体的には、凹凸が周期的に並んだ表面を磁性材料から形成した基体に形成した構造を利用できる。この基体用の磁性材料としては、鉄、コバルト、ニッケル等の金属またはこれらの酸化物、合金、もしくはこれらの複合体などを用いることができる。また、透磁率の高い材料、例えばフェライト、ガラス、金属酸化物などを用いて基体を形成し、磁性粒子の固定ために磁界を付与して用いる構成としてもよい。ここでは、各材料を適宜選択して用いることが好ましい。
標的物質を補足した磁性粒子と、補足していない磁性粒子とが、固定化されたそれぞれの回折格子は、標的物質の結合以外のパラメータにその特性が影響されないように分析的な手法を用いて、いくつかの検出素子を標本して、あらかじめ各種検査をすることが望ましい。
<1−3.標的物質検出の原理および方法>
上記の凹凸構造を有する素子を用いる場合の標的物質検出の原理ならびに検出の方法を、図1〜4ならびに図7及び8を用いて説明する。まず、捕捉体を金の被覆層に有する磁性粒子を所望の濃度に調整した溶液を用意する。これを参照用と標的物質検出用に取り分け、図2に示すように標的物質検出用の磁性粒子溶液を標的物質と反応させた後、図3の(a)及び(b)に示すようにそれぞれを検出素子と同量を用いて反応させる。この反応により磁性粒子が基体の周期的構造を有する表面に固定された状態で、参照用の検出素子と標的物質検出用の検出素子に、図1及び図7に示すように、それぞれ偏向させた入射光を照射し、反射光を角度スキャンさせながら反射光の強度を検出する。これにより図8に示すような反射強度の角度依存のスペクトルを得ることが可能であり、磁性粒子に結合した標的物質の濃度を高感度に測定することができる。すなわち、プラズモン共鳴によって反射光強度が減衰する入射角は磁性微粒子に捕捉体を介して捕捉された標的物質の濃度(捕捉量)に応じてシフトするので、この標的物質の濃度(捕捉量)に基づく角度依存のスペクトルの変化から標的物質の濃度(捕捉量)を求めることができる。参照用の検出素子での角度依存のスペクトルに対する反射光強度の減衰ピークの位置を各種濃度の標準サンプルを用いて予め測定して検量線(検量用データ)を作成しておき、そのデータに基づいて測定用サンプルでの減衰ピークのシフト幅から測定用サンプル中の標的物質の検出及び定量を行うことができる。
上記の凹凸構造を有する素子を用いる場合の標的物質検出の原理ならびに検出の方法を、図1〜4ならびに図7及び8を用いて説明する。まず、捕捉体を金の被覆層に有する磁性粒子を所望の濃度に調整した溶液を用意する。これを参照用と標的物質検出用に取り分け、図2に示すように標的物質検出用の磁性粒子溶液を標的物質と反応させた後、図3の(a)及び(b)に示すようにそれぞれを検出素子と同量を用いて反応させる。この反応により磁性粒子が基体の周期的構造を有する表面に固定された状態で、参照用の検出素子と標的物質検出用の検出素子に、図1及び図7に示すように、それぞれ偏向させた入射光を照射し、反射光を角度スキャンさせながら反射光の強度を検出する。これにより図8に示すような反射強度の角度依存のスペクトルを得ることが可能であり、磁性粒子に結合した標的物質の濃度を高感度に測定することができる。すなわち、プラズモン共鳴によって反射光強度が減衰する入射角は磁性微粒子に捕捉体を介して捕捉された標的物質の濃度(捕捉量)に応じてシフトするので、この標的物質の濃度(捕捉量)に基づく角度依存のスペクトルの変化から標的物質の濃度(捕捉量)を求めることができる。参照用の検出素子での角度依存のスペクトルに対する反射光強度の減衰ピークの位置を各種濃度の標準サンプルを用いて予め測定して検量線(検量用データ)を作成しておき、そのデータに基づいて測定用サンプルでの減衰ピークのシフト幅から測定用サンプル中の標的物質の検出及び定量を行うことができる。
なお、角度依存のスペクトルは公知の光学的検出装置を用いて測定することができ、更にそのデータの分析は予め作製した検量線を利用するプログラムに基づいてコンピュータにより自動的に行うことが可能である。この自動化は以下の第二の実施形態に持て起用できる。図4に反応から検出及び定量までの各ステップのフローチャートを示す。
<2−2.標的物質検出素子>
次に本発明の第ニの実施形態について、図5を参照しながら説明する。なお、標的物質検出用の磁性粒子については、第一の実施形態と同様の手法にて作成することができる。
次に本発明の第ニの実施形態について、図5を参照しながら説明する。なお、標的物質検出用の磁性粒子については、第一の実施形態と同様の手法にて作成することができる。
標的物質検出素子を、図5を用いて説明する。標的物質検出素子は、透磁率が高く周期的な凹凸構造を持った基体である502の裏面に、磁石501を配置した構成を有する。標的物質を捕捉した複合体105と、標的物質を捕捉していない磁性粒子を含んだ混合溶液201を基体502に滴下すると、磁気的な相互作用が働き磁性粒子が基体の全面に配置され、検出素子503の表面は、可視光に対して回折格子として作用する。
磁石501としては、電磁石、永久磁石などを用いることが可能である。ここでは、各種磁石が適宜選択されて用いられる。基体502としては、凹凸が周期的に並んだ透磁率の高い材料、表面に凹凸溝が刻んであり透磁率の高い基体が用いられる。具体的には、フェライト、ガラス、パーマロイなどを用いることができる。標的物質の検出は、第一の実施形態と同様の原理・手法にて実施することができる。
<3−2.標的物質検出素子>
次に本発明の第三の実施形態について、図6を参照しながら説明する。標的物質検出用の試薬については、第一の実施形態と同様の手法にて作成することができる。
<3−2.標的物質検出素子>
次に本発明の第三の実施形態について、図6を参照しながら説明する。標的物質検出用の試薬については、第一の実施形態と同様の手法にて作成することができる。
標的物質検出素子を、図6を用いて説明する。標的物質検出素子604は、磁性体と非磁性体が周期的に並べられた基体601から構成される。この磁性体部分を有する基体106の表面に、標的物質を捕捉した複合体105と、標的物質を有しない磁性粒子を含んだ混合溶液201を滴下すると、複合体及び磁性粒子が基体106表面の磁性体からなる部分の全面に配置されて、これが可視光に対してプラズモン共鳴を検出し得る回折格子として作用する。
601は磁性体と非磁性体の多層膜から構成されており、その表面は光の波長の数分の一以下に鏡面研磨され、さらに金属がコートされている構成が好ましい。602は磁性体であり、鉄、コバルト、ニッケル等の金属またはこれらの酸化物、合金、もしくはこれらの複合体を用いることができる。ここでは、フェロ磁性もしくはフェリ磁性を示す材料であることが好ましい。603は非磁性材料であり、SiO2、Al2O3、などガラス材料や金属酸化物が適宜選択されて用いられる。
標的物質の検出は、第一の実施形態と同様の原理・手法にて実施することができる。
以下、本発明の実施例を述べるが、本発明はここに記述した内容だけに制限を受けるものではない。
(実施例1)
<磁性粒子作成>
金で被覆された磁性粒子は、非特許文献1に記載の方法で作成することができる。まず、Fe3O4粒子を、Fe(II),Fe(III)の塩化物をアルカリ溶液中におき共沈法で作成する。そして、大気中においてFe3O4を徐々に加熱することで、γ−Fe2O3粒子が得られる。金は、γ−Fe2O3の表面でAu3+を還元することにより得られる。上記プロセスにより、直径60nm程度のコア・シェル型微粒子が得られる。
<磁性粒子作成>
金で被覆された磁性粒子は、非特許文献1に記載の方法で作成することができる。まず、Fe3O4粒子を、Fe(II),Fe(III)の塩化物をアルカリ溶液中におき共沈法で作成する。そして、大気中においてFe3O4を徐々に加熱することで、γ−Fe2O3粒子が得られる。金は、γ−Fe2O3の表面でAu3+を還元することにより得られる。上記プロセスにより、直径60nm程度のコア・シェル型微粒子が得られる。
本製法で作製したコア・シェル構造の粒子溶液に、金と親和性の高いチオール基を持つ、11−Mercaptoundecanoic acidのエタノール溶液を加え微粒子を表面修飾する。その状態で、N−Hydroxysulfosuccinimide(同仁化学研究所社製)水溶液と1−Ethyl−3−[3−dimethylamino]propyl]carbodiimide hydrochloride(同仁化学研究所社製)水溶液を加え、室温で15分間インキュベートする。これにより、微粒子表面にスクシンイミド基が露出される。続いて、固定化する抗体として、標的物質に特異的な抗ヒトインスリンモノクローナル抗体/2−[N−morpholino]ethane sulfonic acid緩衝液(pH6.0)を加え、室温で2時間インキュベートする。金表面上に配置された前記スクシンイミド基と抗ヒトインスリンモノクローナル抗体のアミノ基を反応させることにより、抗ヒトインスリンモノクローナル抗体を微粒子表面上に固定化する。微粒子表面上の未反応のスクシンイミド基は、Hydroxylamine Hydrochlorideを添加して脱離させる。
以上の工程によって、溶液中で試薬となる標的物質を捕捉する捕捉微粒子を含んだ試薬溶液が作製できる。
<標的物質との反応>
まず、上記試薬溶液を参照用と測定用に同じ量ずつ取り分ける。測定用の試薬溶液に、標的物質であるインスリンを混入させ反応させる。スターラーで攪拌することにより、反応を促進することが可能である。
まず、上記試薬溶液を参照用と測定用に同じ量ずつ取り分ける。測定用の試薬溶液に、標的物質であるインスリンを混入させ反応させる。スターラーで攪拌することにより、反応を促進することが可能である。
<標的物質検出素子の作成>
図3を参照しながら説明する。周期550nm、振幅50nmサイズ、面積3mm□の回折格子型の基体106を電子線リソグラフィーにより作製する。参照用の試薬溶液と、インスリンを混入し反応させた試薬溶液とを、参照用と、検出用それぞれの基体に滴下して、磁気的な相互作用により、基体106に固定化させ回折格子として作用する参照用の基体と測定用の基体を作成する。ここでは、回折格子型の基体を電子線リソグラフィーにより作製したが、光干渉露光などの手法を用いても作製することが可能である。 <標的物質検出>
図7を参照しながら説明する。光源701としては、レーザーダイオード(三洋電機、DL3038−033)を用い、702のコリメートレンズとしては、平凸レンズ(シグマ光機、平凸レンズ5mmφ)を用い、703の偏光フィルターとしては可視光偏光フィルター(シグマ光機、SPF−30C−32)を用い、これら入射光学系を常盤の上に固定する。集光レンズ704としては、平凸レンズ(シグマ光機、平凸レンズ5mmφ)を用い、光センサー705としてはパワーメータ(アドバンテスト、TQ8210)を用い、アーム706に固定する。ゴニオメータ707としては、2軸小型自動回転ステージ(シグマ光機、SKIDS−60YAW(θz)−Aθ(Ver2.0))を用いる。ゴニオメータの中心に標的物質検出素子107を設置し、回転盤とアームを同期させながら回転させることにより、反射光の角度スペクトルを測定することができる。参照用の検出素子(a)と標的物質と反応させた検出素子(b)をそれぞれ測定することにより、図8に示すような反射強度の角度依存のスペクトルを得ることが可能であり、微粒子に結合したインスリンの濃度を高感度に測定することができる。
図3を参照しながら説明する。周期550nm、振幅50nmサイズ、面積3mm□の回折格子型の基体106を電子線リソグラフィーにより作製する。参照用の試薬溶液と、インスリンを混入し反応させた試薬溶液とを、参照用と、検出用それぞれの基体に滴下して、磁気的な相互作用により、基体106に固定化させ回折格子として作用する参照用の基体と測定用の基体を作成する。ここでは、回折格子型の基体を電子線リソグラフィーにより作製したが、光干渉露光などの手法を用いても作製することが可能である。 <標的物質検出>
図7を参照しながら説明する。光源701としては、レーザーダイオード(三洋電機、DL3038−033)を用い、702のコリメートレンズとしては、平凸レンズ(シグマ光機、平凸レンズ5mmφ)を用い、703の偏光フィルターとしては可視光偏光フィルター(シグマ光機、SPF−30C−32)を用い、これら入射光学系を常盤の上に固定する。集光レンズ704としては、平凸レンズ(シグマ光機、平凸レンズ5mmφ)を用い、光センサー705としてはパワーメータ(アドバンテスト、TQ8210)を用い、アーム706に固定する。ゴニオメータ707としては、2軸小型自動回転ステージ(シグマ光機、SKIDS−60YAW(θz)−Aθ(Ver2.0))を用いる。ゴニオメータの中心に標的物質検出素子107を設置し、回転盤とアームを同期させながら回転させることにより、反射光の角度スペクトルを測定することができる。参照用の検出素子(a)と標的物質と反応させた検出素子(b)をそれぞれ測定することにより、図8に示すような反射強度の角度依存のスペクトルを得ることが可能であり、微粒子に結合したインスリンの濃度を高感度に測定することができる。
(実施例2)
実施例1で示した方法と同様の方法で、捕捉微粒子を含んだ試薬溶液を作製ならびに標的物質との反応をおこなうことが可能である。
実施例1で示した方法と同様の方法で、捕捉微粒子を含んだ試薬溶液を作製ならびに標的物質との反応をおこなうことが可能である。
<標的物質検出素子の作成>
上記参照用の試薬溶液と、インスリンを混入し反応させた試薬溶液を用意し、それぞれの基体に滴下して磁気的な相互作用により、基体502に固定化させ回折格子として作用する参照用の基体と測定用の基体を作成する。
<標的物質検出>
参照用の検出素子(a)と標的物質と反応させた検出素子(b)を、図7に示す装置でそれぞれ測定することにより、図8に示すような反射強度の角度依存のスペクトルを得ることが可能であり、微粒子に結合したインスリンの濃度を高感度に測定することができる。
上記参照用の試薬溶液と、インスリンを混入し反応させた試薬溶液を用意し、それぞれの基体に滴下して磁気的な相互作用により、基体502に固定化させ回折格子として作用する参照用の基体と測定用の基体を作成する。
<標的物質検出>
参照用の検出素子(a)と標的物質と反応させた検出素子(b)を、図7に示す装置でそれぞれ測定することにより、図8に示すような反射強度の角度依存のスペクトルを得ることが可能であり、微粒子に結合したインスリンの濃度を高感度に測定することができる。
(実施例3)
実施例1で示した方法と同様の方法で、捕捉微粒子を含んだ試薬溶液を作製ならびに標的物質との反応をおこなうことが可能である。
実施例1で示した方法と同様の方法で、捕捉微粒子を含んだ試薬溶液を作製ならびに標的物質との反応をおこなうことが可能である。
<標的物質検出素子の作成>
上記参照用の試薬溶液と、インスリンを混入し反応させた試薬溶液を用意し、それぞれの基体に滴下して磁気的な相互作用により、基体601に固定化させ回折格子として作用する参照用の基体と測定用の基体を作成する。
上記参照用の試薬溶液と、インスリンを混入し反応させた試薬溶液を用意し、それぞれの基体に滴下して磁気的な相互作用により、基体601に固定化させ回折格子として作用する参照用の基体と測定用の基体を作成する。
<標的物質検出>
参照用の検出素子(a)と標的物質と反応させた検出素子(b)を、図7に示す装置でそれぞれ測定することにより、図8に示すような反射強度の角度依存のスペクトルを得ることが可能であり、微粒子に結合したインスリンの濃度を高感度に測定することができる。
参照用の検出素子(a)と標的物質と反応させた検出素子(b)を、図7に示す装置でそれぞれ測定することにより、図8に示すような反射強度の角度依存のスペクトルを得ることが可能であり、微粒子に結合したインスリンの濃度を高感度に測定することができる。
101 磁性粒子
102 金
103 捕捉体
104 標的物質
105 複合体
106 基体
107 標的物質検出素子
201 検体溶液
301 緩衝液
501 磁石
502 基体
503 標的物質検出素子
601 基体
602 磁性体
603 非磁性体
604 標的物質検出素子
701 光源
702 コリメートレンズ
703 偏光フィルター
704 集光レンズ
705 光センサー
706 アーム
707 ゴニオメータ
102 金
103 捕捉体
104 標的物質
105 複合体
106 基体
107 標的物質検出素子
201 検体溶液
301 緩衝液
501 磁石
502 基体
503 標的物質検出素子
601 基体
602 磁性体
603 非磁性体
604 標的物質検出素子
701 光源
702 コリメートレンズ
703 偏光フィルター
704 集光レンズ
705 光センサー
706 アーム
707 ゴニオメータ
Claims (5)
- プラズモン共鳴を利用して検体中の標的物質を検出するための素子であって、
前記標的物質との結合能を有する捕捉体を保持する金属により被覆された磁性粒子を磁気的に固定し得る表面と、該表面に設けられたプラズモン共鳴を生じ得る周期構造と、を有し、
前記磁性体粒子が前記基体の前記周期構造を有する表面に固定されたときに、該表面に励起光を入射することで生じたプラズモン共鳴を検出し、検出されたプラズモン共鳴の該磁性体粒子表面への前記標的物質の結合に基づく変化から該標的物質の該磁性粒子への結合量を求めるために用いるものである
ことを特徴とする標的物質検出用の素子。 - 前記周期構造が、前記基体の表面に設けられた周期的な凹凸を有する請求項1に記載の素子。
- 前記周期構造が、前記基体が磁気的性質の異なる少なくとも2つの材料の周期的な配置を有する請求項1に記載の素子。
- 検体中の標的物質を検出するための装置であって、
前記標的物質と、前記標的物質との結合能を有する捕捉体を表面に有する、金属により被覆された磁性粒子とを結合させる手段と、
前記磁性粒子を磁気的に固定し得る表面にプラズモン共鳴を生じ得る周期構造を設けた基体を有する検出用素子に、磁性粒子を固定するための手段と、
前記周期構造に励起光を入射することで生じたプラズモン共鳴を光学的に検出するための検出手段と、
前記検出手段で検出されたプラズモン共鳴の該磁性体粒子表面へ前記標的物質が結合している場合における変化に基づいて該標的物質の該磁性粒子への結合量を求めるための定量手段と、
を有することを特徴とする標的物質検出装置。 - 検体中の標的物質を検出する方法であって、
前記標的物質と、前記標的物質との結合能を有する捕捉体を表面に有する、金属により被覆された磁性粒子とを結合させる工程と、
前記磁性粒子を磁気的に固定し得る表面にプラズモン共鳴を生じ得る周期構造を設けた基体を有する検出用素子に、前記標的物質が結合した磁性粒子を固定させる工程と、
前記標的物質が結合した磁性粒子が固定されている周期構造に励起光を入射することで生じたプラズモン共鳴を検出し、検出されたプラズモン共鳴の該磁性体粒子表面への前記標的物質の結合による変化に基づいて前記標的物質の結合量を求める工程と
を有することを特徴とする標的物質検出方法。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004188881A JP2006010534A (ja) | 2004-06-25 | 2004-06-25 | コア・シェル型磁性粒子センサー |
| US11/165,504 US7387901B2 (en) | 2004-06-25 | 2005-06-24 | Target substance detecting element, target substance detection apparatus and target substance detection method |
| US12/123,167 US7691648B2 (en) | 2004-06-25 | 2008-05-19 | Target substance detecting element, target substance detection apparatus and target substance detection method |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004188881A JP2006010534A (ja) | 2004-06-25 | 2004-06-25 | コア・シェル型磁性粒子センサー |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006010534A true JP2006010534A (ja) | 2006-01-12 |
| JP2006010534A5 JP2006010534A5 (ja) | 2007-01-25 |
Family
ID=35506368
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004188881A Withdrawn JP2006010534A (ja) | 2004-06-25 | 2004-06-25 | コア・シェル型磁性粒子センサー |
Country Status (2)
| Country | Link |
|---|---|
| US (2) | US7387901B2 (ja) |
| JP (1) | JP2006010534A (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007132795A1 (en) * | 2006-05-12 | 2007-11-22 | Canon Kabushiki Kaisha | Detecting element, detecting device and detecting method |
| JP2018036176A (ja) * | 2016-09-01 | 2018-03-08 | 旭化成株式会社 | コアシェル型ナノ粒子とタンパク質との複合体 |
| JP2019128157A (ja) * | 2018-01-19 | 2019-08-01 | 国立大学法人電気通信大学 | 分光用デバイス、分光器、及び分光測定方法 |
| WO2020241146A1 (ja) * | 2019-05-28 | 2020-12-03 | パナソニック株式会社 | 検出方法及び検出装置 |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7659987B2 (en) * | 2004-09-16 | 2010-02-09 | Canon Kabushiki Kaisha | Device and method for acquiring information on objective substance to be detected by detecting a change of wavelength characteristics on the optical transmittance |
| US8962302B2 (en) * | 2005-11-07 | 2015-02-24 | Canon Kabushiki Kaisha | Biological tissue processing substrate for fixing proteins or protein degradation products in tissue for analysis |
| WO2007072986A1 (en) * | 2005-12-22 | 2007-06-28 | Canon Kabushiki Kaisha | Substrate for target substance detecting device, target substance detecting device, target substance detecting apparatus and method using the same, and kit therefor |
| WO2007083817A1 (en) * | 2006-01-18 | 2007-07-26 | Canon Kabushiki Kaisha | Target substance-detecting element |
| WO2008123844A2 (en) * | 2006-02-08 | 2008-10-16 | University Of Toledo | System for detecting nanoparticles using modulated surface plasmon resonance (mspr) |
| JP2007286045A (ja) * | 2006-03-20 | 2007-11-01 | Canon Inc | 検出装置、検出素子用基板、検出素子、検出素子用キット及び検出方法 |
| JP5164411B2 (ja) * | 2006-03-31 | 2013-03-21 | キヤノン株式会社 | 標的物質検出方法および標的物質検出キット |
| US8945946B2 (en) * | 2006-03-31 | 2015-02-03 | Canon Kabushiki Kaisha | Sensor element and detection method of magnetic particles using this element, and detection method of target substance |
| JP2007278748A (ja) * | 2006-04-04 | 2007-10-25 | Canon Inc | 標的物質検出素子、検出材料、及び検出キット |
| JP4861739B2 (ja) * | 2006-04-11 | 2012-01-25 | キヤノン株式会社 | 磁気センサ、該センサの作製方法、並びに、該センサを用いた標的物質検出装置及びバイオセンサキット |
| JP5300205B2 (ja) * | 2007-03-22 | 2013-09-25 | キヤノン株式会社 | 標的物質検出素子、標的物質検出方法、標的物質検出素子の製造方法 |
| US20080241964A1 (en) * | 2007-03-27 | 2008-10-02 | Canon Kabushiki Kaisha | Material for improving sensitivity of magnetic sensor and method thereof |
| US9341621B2 (en) * | 2007-05-31 | 2016-05-17 | Purdue Research Foundation | Ultrasensitive detection of biomolecules using immunoseparation and diffractometry |
| US8076161B2 (en) * | 2007-05-31 | 2011-12-13 | Canon Kabushiki Kaisha | Target substance detection kit and target substance detection method |
| US20080309323A1 (en) * | 2007-06-12 | 2008-12-18 | Canon Kabushiki Kaisha | Method for biochemical analysis |
| JP2009025295A (ja) * | 2007-06-21 | 2009-02-05 | Canon Inc | 標的物質検出装置、および標的物質検出方法 |
| US8159676B2 (en) * | 2008-01-21 | 2012-04-17 | University Of North Texas, Health Science Center At Fort Worth | Ratiometric surface plasmon coupled emission detector |
| US9563945B2 (en) * | 2012-07-05 | 2017-02-07 | Bernard Fryshman | Object image recognition and instant active response with enhanced application and utility |
| KR101593545B1 (ko) * | 2014-05-29 | 2016-02-26 | 서울대학교 산학협력단 | 재사용이 가능한 화학적 또는 생물학적 센서 및 그 사용방법 |
| US10809195B2 (en) * | 2015-12-23 | 2020-10-20 | Koninklijke Philips N.V. | Optical detection of particles in a fluid |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3452837B2 (ja) | 1999-06-14 | 2003-10-06 | 理化学研究所 | 局在プラズモン共鳴センサー |
| US7998746B2 (en) * | 2000-08-24 | 2011-08-16 | Robert Otillar | Systems and methods for localizing and analyzing samples on a bio-sensor chip |
| JP4199609B2 (ja) | 2002-07-12 | 2008-12-17 | 三菱化学株式会社 | 分析用チップ、分析用チップユニット及び分析装置ならびに分析用チップの作製方法 |
| JP2006010529A (ja) | 2004-06-25 | 2006-01-12 | Canon Inc | 磁性粒子分離装置および分離方法 |
| US20060011558A1 (en) * | 2004-07-15 | 2006-01-19 | Fencl Forrest B | Disinfecting system and method for liquid systems |
| JP2006208294A (ja) | 2005-01-31 | 2006-08-10 | Canon Inc | プラズモン共鳴および蛍光の同時イメージング装置及びイメージング方法 |
-
2004
- 2004-06-25 JP JP2004188881A patent/JP2006010534A/ja not_active Withdrawn
-
2005
- 2005-06-24 US US11/165,504 patent/US7387901B2/en not_active Expired - Fee Related
-
2008
- 2008-05-19 US US12/123,167 patent/US7691648B2/en not_active Expired - Fee Related
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007132795A1 (en) * | 2006-05-12 | 2007-11-22 | Canon Kabushiki Kaisha | Detecting element, detecting device and detecting method |
| US8045141B2 (en) | 2006-05-12 | 2011-10-25 | Canon Kabushiki Kaisha | Detecting element, detecting device and detecting method |
| JP2018036176A (ja) * | 2016-09-01 | 2018-03-08 | 旭化成株式会社 | コアシェル型ナノ粒子とタンパク質との複合体 |
| JP2019128157A (ja) * | 2018-01-19 | 2019-08-01 | 国立大学法人電気通信大学 | 分光用デバイス、分光器、及び分光測定方法 |
| JP7084020B2 (ja) | 2018-01-19 | 2022-06-14 | 国立大学法人電気通信大学 | 分光用デバイス、分光器、及び分光測定方法 |
| WO2020241146A1 (ja) * | 2019-05-28 | 2020-12-03 | パナソニック株式会社 | 検出方法及び検出装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| US7387901B2 (en) | 2008-06-17 |
| US20050287681A1 (en) | 2005-12-29 |
| US20080225292A1 (en) | 2008-09-18 |
| US7691648B2 (en) | 2010-04-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7387901B2 (en) | Target substance detecting element, target substance detection apparatus and target substance detection method | |
| US7410811B2 (en) | Analytical method and device utilizing magnetic materials | |
| US9575081B2 (en) | Device and methods for detecting analytes in saliva | |
| JP5970153B2 (ja) | 凝集パラメータの測定 | |
| US20130088221A1 (en) | Detection of magnetic particles and their clustering | |
| Akama et al. | Wash-and amplification-free digital immunoassay based on single-particle motion analysis | |
| JP7249281B2 (ja) | 磁気式多ビーズアッセイのための方法および装置 | |
| RU2456618C2 (ru) | Система и способ обнаружения с помощью магнитной и/или электрической метки | |
| JP5401724B2 (ja) | 被覆磁性微粒子を用いたバイオセンシング方法及び該方法に用いるバイオセンシング装置 | |
| JP2010534320A (ja) | 磁気センサ装置 | |
| JP2007218900A (ja) | 標的物質検出用の素子 | |
| US20120062219A1 (en) | Sensor device for magnetic particles with a high dynamic range | |
| WO2012073182A1 (en) | A sensor device for magnetically actuated particles | |
| JP2012506043A (ja) | 磁気標識された標的成分の量を決定するための方法及び装置 | |
| EP2517015A1 (en) | Analyte measurement apparatus and method | |
| US9250181B2 (en) | Sensor device with imaging optics | |
| CN114923886A (zh) | 一种基于光栅与磁阵列式的单分子荧光检测方法 | |
| Panferov et al. | Post-assay chemical enhancement for highly sensitive lateral flow immunoassays: A critical review | |
| Kastner et al. | The effect of layer thickness and immobilization chemistry on the detection of CRP in LSPR assays | |
| JP2009115590A (ja) | バイオセンサ用マーカ、バイオセンサ、及びバイオセンサ用マーカ検出方法 | |
| JP2006162466A (ja) | 測定すべき物質の測定方法および測定試薬 | |
| JP2021081359A (ja) | 分子間相互作用の解析方法および解析装置 | |
| US7829349B2 (en) | Base carrier for detecting target substance, element for detecting target substance, method for detecting target substance using the element, and kit for detecting target substance | |
| Morozova et al. | Force differentiation in recognition of cross-reactive antigens by magnetic beads | |
| JP6999158B2 (ja) | 分析方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20061127 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20061127 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20081009 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20090608 |