JP2005515216A - キナゾリノン誘導体 - Google Patents
キナゾリノン誘導体 Download PDFInfo
- Publication number
- JP2005515216A JP2005515216A JP2003556396A JP2003556396A JP2005515216A JP 2005515216 A JP2005515216 A JP 2005515216A JP 2003556396 A JP2003556396 A JP 2003556396A JP 2003556396 A JP2003556396 A JP 2003556396A JP 2005515216 A JP2005515216 A JP 2005515216A
- Authority
- JP
- Japan
- Prior art keywords
- group
- compound
- cyclo
- disease
- optionally substituted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/70—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings condensed with carbocyclic rings or ring systems
- C07D239/72—Quinazolines; Hydrogenated quinazolines
- C07D239/86—Quinazolines; Hydrogenated quinazolines with hetero atoms directly attached in position 4
- C07D239/88—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/70—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings condensed with carbocyclic rings or ring systems
- C07D239/72—Quinazolines; Hydrogenated quinazolines
- C07D239/95—Quinazolines; Hydrogenated quinazolines with hetero atoms directly attached in positions 2 and 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/08—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing alicyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
Landscapes
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Diabetes (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Dermatology (AREA)
- Obesity (AREA)
- Emergency Medicine (AREA)
- Endocrinology (AREA)
- Hematology (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Immunology (AREA)
- Pain & Pain Management (AREA)
- Heart & Thoracic Surgery (AREA)
- Molecular Biology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- AIDS & HIV (AREA)
- Cardiology (AREA)
Abstract
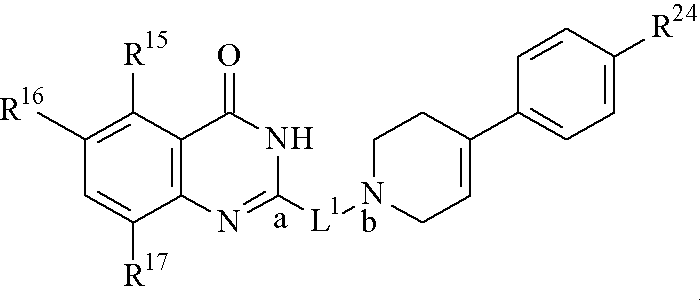
式
【化1】
[式中、R1は置換された環状アミノ基または任意に置換されたアミノ基、
R2は置換基、
nは0ないし4の整数、
L1は(1)シクロ(低級)アルキレン基、(2)シクロ(低級)アルケニレン基、(3)1個またはそれ以上の窒素原子を有する飽和または不飽和単環基のジラジカルであって、前記単環基から1個の水素原子を除去した後に得られもの、または(4)−N(R3)−L2−(式中、R3は水素または低級アルキル基、L2は低級アルキレン基または低級アルケニレン基)、
をそれぞれ意味する。]
で表され、ポリ(アデノシン5’−ジホスホ−リボース)ポリメラーゼ(PARP)阻害活性を有するキナゾリノン誘導体またはそのプロドラッグまたはその塩。
【化1】
[式中、R1は置換された環状アミノ基または任意に置換されたアミノ基、
R2は置換基、
nは0ないし4の整数、
L1は(1)シクロ(低級)アルキレン基、(2)シクロ(低級)アルケニレン基、(3)1個またはそれ以上の窒素原子を有する飽和または不飽和単環基のジラジカルであって、前記単環基から1個の水素原子を除去した後に得られもの、または(4)−N(R3)−L2−(式中、R3は水素または低級アルキル基、L2は低級アルキレン基または低級アルケニレン基)、
をそれぞれ意味する。]
で表され、ポリ(アデノシン5’−ジホスホ−リボース)ポリメラーゼ(PARP)阻害活性を有するキナゾリノン誘導体またはそのプロドラッグまたはその塩。
Description
本発明は、薬理活性を有する新規キナゾリノン誘導体、それらの製造法ならびにそれらを含有する医薬組成物に関する。
ポリ(アデノシン5’−ジファスホ−リボース)ポリメラーゼ[「ポリ(ADPリボース)ポリメラーゼ」すなわち「PARP」、「ポリ(ADPリボース)シンセターゼ」としては「PARS」と呼ばれることもある]は、筋肉、心臓および脳の細胞などの種々の器官の細胞の核にある酵素である。PARPはDNAの鎖切断の修復に生理的役割を果たす。損傷したDNA断片によって一旦活性化されると、PARPは、最高100個のADPリボースをヒストンおよびPARP自体などの種々の核タンパク質に連結するように触媒作用を及ぼす。
PARP阻害活性を有するいくつかのキナゾリノン誘導体が、たとえばWO95/24379、WO98/33802およびWO99/11624において既知となっている。
本発明は、PARP阻害活性などの薬理活性を有する新規キナゾリノン化合物、それらの製造方法、それらを含有する医薬組成物、ならびにそれらの用途に関する。
本発明の一つの目的は、PARP阻害活性を有する新規キナゾリノン化合物を提供することである。
本発明の他の目的は、キナゾリノン化合物の製造法を提供することである。
本発明のさらに他の目的は、キナゾリノン化合物を有効成分として含有する医薬組成物を提供することである。
本発明のいま一つの目的は、キナゾリノン化合物の、種々の疾患を治療または予防するための医薬の製造への利用を提供する、またはPARP活性を阻害するに有効な量のキナゾリノン化合物を投与することによって種々の疾患を治療または予防するための方法を提供することである。
本発明のキナゾリノン化合物は下記の式(I)
[式中、R1は置換された環状アミノ基、任意に置換された炭素環基または任意に置換されたアミノ基、
R2は置換基、
nは0ないし4の整数、
L1は(1)シクロ(低級)アルキレン基、(2)シクロ(低級)アルケニレン基、(3)1個またはそれ以上の窒素原子を有する飽和または不飽和単環基のジラジカルであって、前記単環基から1個の水素原子を除去した後に得られるもの、または(4)−N(R3)−L2−(式中、R3は水素または低級アルキル基、L2は低級アルキレン基または低級アルケニレン基)、
をそれぞれ意味する。]
で表される化合物またはそのプロドラッグまたはその塩。
R2は置換基、
nは0ないし4の整数、
L1は(1)シクロ(低級)アルキレン基、(2)シクロ(低級)アルケニレン基、(3)1個またはそれ以上の窒素原子を有する飽和または不飽和単環基のジラジカルであって、前記単環基から1個の水素原子を除去した後に得られるもの、または(4)−N(R3)−L2−(式中、R3は水素または低級アルキル基、L2は低級アルキレン基または低級アルケニレン基)、
をそれぞれ意味する。]
で表される化合物またはそのプロドラッグまたはその塩。
化合物(I)またはそのプロドラッグまたはその塩は、下記の方法によって製造することができる。下記の式において、化合物はプロドラッグまたはそれらの塩であってもよい。
[式中、R1、R2、nおよびL1はそれぞれ前記定義の通りである.]
この製造法において、化合物(I)またはその塩は、塩基、たとえば無機塩基、たとえばアルカリ金属[たとえばナトリウムまたはカリウム]、そのアルコキシド、水酸化物、炭酸塩または重炭酸塩、または有機塩基、たとえばトリアルキルアミン[たとえばトリメチルアミンまたはトリエチルアミン]などの存在下で、化合物(II)を環化反応に付すことによって製造することができる。
この製造法において、化合物(I)またはその塩は、塩基、たとえば無機塩基、たとえばアルカリ金属[たとえばナトリウムまたはカリウム]、そのアルコキシド、水酸化物、炭酸塩または重炭酸塩、または有機塩基、たとえばトリアルキルアミン[たとえばトリメチルアミンまたはトリエチルアミン]などの存在下で、化合物(II)を環化反応に付すことによって製造することができる。
この反応は、通常、慣用の溶媒、たとえば水、アルコール(たとえばメタノール、エタノールまたはイソプロピルアルコール)、エーテル、テトラヒドロフラン、ジオキサン、ジエチルエーテル、アミド(たとえばN,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド)、ニトリル(たとえばアセトニトリル)、または反応に悪影響を及ぼさない他の有機溶媒中で行われる。反応温度は特に限定されず、反応は、通常、冷却ないし加熱下で行うことができる。
[式中、Xは脱離基、
は1個またはそれ以上の窒素原子を有する飽和または不飽和単環基であり、
R1およびnはそれぞれ前記定義の通りである。]
この製造法において、化合物(I−a)またはその塩は、塩基、たとえば無機塩基、たとえばアルカリ金属[たとえばナトリウムまたはカリウム]、そのアルコキシド、水酸化物、炭酸塩または重炭酸塩、または有機塩基、たとえばトリアルキルアミン[たとえばトリメチルアミンまたはトリエチルアミン]などの存在下で、化合物(III)またはその塩を化合物(VI)またはその塩と反応させることによって製造することができる。
R1およびnはそれぞれ前記定義の通りである。]
この製造法において、化合物(I−a)またはその塩は、塩基、たとえば無機塩基、たとえばアルカリ金属[たとえばナトリウムまたはカリウム]、そのアルコキシド、水酸化物、炭酸塩または重炭酸塩、または有機塩基、たとえばトリアルキルアミン[たとえばトリメチルアミンまたはトリエチルアミン]などの存在下で、化合物(III)またはその塩を化合物(VI)またはその塩と反応させることによって製造することができる。
この反応は、通常、慣用の溶媒、たとえばアルコール(たとえばメタノール、エタノールまたはイソプロピルアルコール)、テトラヒドロフラン、ジオキサン、ジエチルエーテル、アミド(たとえばN,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド)、ニトリル(アセトニトリル)、または反応に悪影響を及ぼさない他の有機溶媒中で行われる。反応温度は特に限定されず、反応は、通常、冷却ないし加熱下で行うことができる。
本発明の化合物は、有機化合物の精製に用いられる慣用の精製方法、たとえば再結晶、カラムクロマトグラフィー、薄層クロマトグラフィー、高速液体クロマトグラフィーなどによって精製することができる。化合物は、NMRスペクトログラフィー、質量スペクトログラフィー、IRスペクトログラフィー、元素分析および融点測定などの慣用の方法によって同定することができる。
出発化合物(II)またはその塩のいくつかは新規であり、既知の製造法またはそれに類似する製造法、たとえばJ.Med.Chem.1998,41,5247−5256およびJ.Org.Chem.,21,478−(1956)に記載の製造法にしたがって製造することができる。下記の製造法を例として示す。
[式中、R1、R2、nおよびL1はそれぞれ前記定義の通りである。]
本発明の化合物(I)の好適な塩は、医薬として許容される慣用の無毒の塩であって、例としては、有機酸付加塩(たとえば蟻酸塩、酢酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸、シュウ酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩など)、無機酸付加塩(たとえば塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩など)、アミノ酸との塩(たとえばアスパラギン酸塩、グルタミン酸塩など)などを挙げることができる。
本発明の化合物(I)の好適な塩は、医薬として許容される慣用の無毒の塩であって、例としては、有機酸付加塩(たとえば蟻酸塩、酢酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸、シュウ酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩など)、無機酸付加塩(たとえば塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩など)、アミノ酸との塩(たとえばアスパラギン酸塩、グルタミン酸塩など)などを挙げることができる。
「プロドラッグ」は、生体変換後に医薬的に活性となる、化学的または代謝的に分解可能な基を有する本発明の化合物の誘導体を意味する。
本発明の化合物(I)は、1個またはそれ以上の非対称中心を有することがあり、それらは、鏡像体またはジアステレオ異性体として存在することができる。さらに、アルケニル基を有する化合物(I)のいくつかはシスまたはトランス異性体として存在することがある。各々の場合において、本発明は混合物および別個の異性体の両方を包含する。
化合物(I)は、互変異形態で存在することもあり、本発明は混合物および別個の互変異性体の両方を包含する。
化合物(I)またはその塩は、溶媒和の形態で存在することができ、それも本発明の範囲に含まれる。溶媒和としては、好ましくは水和物およびエタノレートが挙げられる。
生物学的研究に好適な化合物(I)の放射能標識誘導体もまた本発明の範囲に含まれる。
本明細書の以上および以下の記述において、本発明の範囲に包含される種々の定義の好適な例および実例を次に詳細に説明する。
「低級」とは、特記ない限り、炭素原子1ないし6個を有する基を意味する。
好適な「低級アルキル基」としては、炭素原子1ないし6個、特に1ないし2個を有する直鎖または分枝状アルキルを挙げることができる。好ましい例としては、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、第三級ブチル、ペンチルおよびヘキシルを挙げることができる。
好適な「低級アルコキシ基」としては、炭素原子1ないし6個、特に1ないし2個を有する直鎖または分枝状アルコキシを挙げることができる。好ましい例としては、メトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、イソブトキシ、第二級ブトキシおよび第三級ブトキシを挙げることができ、好ましいものとしては、メトキシを挙げることができる。
好適な「低級アルキルアミノ基」としては、モノ(低級)アルキルアミノおよびジ(低級)アルキルアミノを挙げることができる。好ましい例としては、メチルアミノ、ジメチルアミノ、エチルアミノ、ジメチルアミノ、n−プロピルアミノ、イソプロピルアミノ、n−ブチルアミノ、イソブチルアミノ、第二級ブチルアミノおよび第三級ブチルアミノを挙げることができ、好ましいものとしては、ジメチルアミノおよびジエチルアミノを挙げることができる。
好適な「アリール基」は、好ましくは炭素原子6ないし12個を有する単環、二環または多環芳香基を意味し、例としては、フェニル、ナフチル、テトラヒドロナフチル、インデニル、インダニル(1,2−ジヒドロインデニル)、フルオレニルなどを挙げることができ、好ましいものとしては、フェニルまたはナフチルを挙げることができる。
「ハロゲン」は、フッ素、塩素、臭素またはヨウ素を意味する。
好適な「ハロ(低級)アルキル基」は、炭素原子を1ないし4個、特に1または2個、および同一または異なるハロゲン原子、好ましくはフッ素、塩素および臭素、特にフッ素および塩素を、1ないし9個、特に1ないし5個有する。好ましい例としては、トリフルオロメチル、トリクロロメチル、クロロジフルオロメチル、ジクロロフルオロメチル、クロロメチル、ブロモメチル、1−フルオロエチル、2−フルオロエチル、2,2−ジフルオロエチル、2,2,2−トリフルオロエチル、2,2,2−トリクロロエチルおよびペンタフルオロエチルを挙げることができ、好ましいものとしては、トリフルオロメチルを挙げることができる。
「炭素環基」はシクロ(低級)アルキルまたはシクロ(低級)アルケニルを意味する。
「シクロ(低級)アルキレン」における好適な「シクロ(低級)アルキル基」および「シクロ(低級)アルキル部分」としては、炭素原子3ないし7個、特に5ないし6個を有する飽和炭素環基を挙げることができる。好ましい例としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルおよびシクロヘプチルを挙げることができ、好ましいものとしては、シクロプロピルおよびシクロヘキシル(たとえば1,3−シクロへキシレン、1,4−シクロへキシレンなど)を挙げることができる。
「シクロ(低級)アルケニレン」における好適な「シクロ(低級)アルケニル基」および「シクロ(低級)アルケニル部分」としては、炭素原子を3ないし7個、特に5ないし6個有する部分飽和炭素環基を挙げることができる。好ましい例としては、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニルおよびシクロヘプテニルを挙げることができ、好ましいものとしてはシクロペンテニルおよびシクロヘキセニルを挙げることができる。
「シクロ(低級)アルキレン基」の好ましい例としては、シクロペンテニレン(たとえば1,3−シクロシクロペント−1−エニレンなど)、シクロヘキセニレン(たとえば1,3−シクロヘックス−1−エニレンなど)を挙げることができる。
「ヘテロアリール(低級)アルキル」および「ヘテロ芳香族アシル」における好適な「ヘテロアリール基」および「ヘテロアリール」部分は、好ましくは1ないし3個のヘテロ原子、特に1または2個の同一または異なるヘテロ原子を有する5ないし7員環を意味する。ヘテロアリール中のヘテロ原子は、酸素、硫黄または窒素原子である。例としては、フリル、チエニル、ピラゾリル、イミダゾリル、トリアゾリル(たとえば1,2,3−および1,2,4−トリアゾリルなど)、イソオキサゾリル、チアゾリル、イソチアゾリル、オキサジアゾリル(たとえば1,3,4−および1,2,5−オキサジアゾリルなど)、アゼピニル、ピロリル、ピリジニル、ピペラジニル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル(たとえば1,3,5−、1,2,4−および1,2,3−トリアジニルなど)、オキサジニル(たとえば1,2,4−および1,2,6−オキサジニルなど)、オキセピニル、チエピニルおよびジアゼピニル(たとえば1,2,4−ジアゼピニルなど)を挙げることができ、好ましいものとしてはチエニル、ピラゾリル、イミダゾリル、チアゾリル、ピリジニルおよびピラジニルを挙げることができる。
好適な「環状アミノ基」としては、1個またはそれ以上の窒素原子をヘテロ原子として有するヘテロ芳香族または脂肪族環系であって、複素環は飽和または不飽和であり、一つの環系または数個の縮合環系であり、窒素、酸素、硫黄などのさらなるヘテロ原子を任意に含むことができる。環状アミノ基は、さらにスピロ環系または架橋環系をも意味する。環状アミノ基を形成する原子の数は限定されず、たとえば単環系の場合、3ないし8個の原子からなり、三環系の場合、7ないし11個の原子からなる。
「環状アミノ基」の好ましい例としては下記のものを挙げることができる。
(1) ヘテロ原子として1個またはそれ以上の窒素原子を有する飽和単環基を有する環状アミノ基の例としては、アゼチジニル(3−アゼチジニル)、ピロリジニル(たとえば1−および3−ピロリジニルなど)、ピペリジル(たとえば1−および4−ピペリジルなど)、ホモピペリジノ(たとえばヘキサヒドロ−1H−アゼピン−1−イルなど)、ホモピペラジニル(たとえばヘキサヒドロ−1H−1,4−ジアゼピン−1−イルなど)、イミダゾリジニル(たとえば1−イミダゾリジニルなど)、ピペラジニル(たとえば1−ピペラジニルなど)、ペルヒドロピリミジニル(たとえばペルヒドロピリミジン−1−イルなど)およびジアザシクロヘプタニル(たとえば1,4−ジアザシクロヘプタン−1−イルなど);
(2) ヘテロ原子として1個またはそれ以上の窒素原子を有する不飽和単環基を有する環状アミノ基の例としては、ピロリニル(たとえば2−ピロリン−1−イルなど)、ピロリル(たとえば1−ピロリルなど)、テトラヒドロピリジニル(たとえば3,6−ジヒドロ−1(2H)−ピリジニルなど)、ピリジニル(たとえば2−ピリジニルなど)、テトラヒドロアゼピニル(たとえば2,3,6,7−テトラヒドロ−1H−アゼピン−1−イル、2,3,4,7−テトラヒドロ−1H−アゼピン−1−イルなど)、イミダゾリル(1−イミダゾリル)、ピラゾリル、トリアゾリル、テトラゾリル、テトラゾリル、ピリミジニル、ピラジニル、ピリダジニル、ジヒドロ−ピリダジニル(たとえば1,2−ジヒドロ−ピリダジン−1−イルなど)およびジヒドロ−ピリミジニル(たとえば1,2−ジヒドロ−ピリミジン−1−イルなど);
(3) ヘテロ原子として1ないし3個の窒素原子および1ないし2個の硫黄原子を有する飽和および不飽和単環基を有する環状アミノ基の例としては、チアゾリジニル(たとえば3−チアゾリジニルなど)、イソチアゾリニル(たとえば2−イソチアゾリニルなど)およびチオモルホリノ;
(4) ヘテロ原子として1ないし3個の窒素原子および1ないし2個の酸素原子を有する飽和および不飽和単環基を有する環状アミノ基の例としては、オキサゾリル、イソオキサゾリル、オキサジアゾリル(たとえば1,2,4−オキサジアゾリルおよび1,3,4−オキサジアゾリル)またはモルホリニル;
(5) 飽和および不飽和縮合環基を有する環状アミノ基の例としては、インドリル(たとえば1−インドリルなど)、ジヒドロベンゾイミダゾリル(たとえば1,2−ジヒドロベンゾイミダゾール−1−イルなど)、ペルヒドロピロロ[1,2−a]ピラジニル(たとえばペルヒドロピロロ[1,2−a]ピラジン−2−イルなど)、テトラヒドロベンゾ[f]イソキノリニル(たとえば1,4,5,6−テトラヒドロベンゾ[f]イソキノリン−3(2H)−イルなど)、ヘキサヒドロベンズ[f]イソキノリニル(たとえばシス−およびトランス−1,4,4a,5,6,10b−ヘキサヒドロベンズ[f]イソキノリン−3(2H)−イルなど)、テトラヒドロピリド[3,4−b]インドリル(たとえば1,3,4,9−テトラヒドロ−2H−ピリド[3,4−b]インドール−2−イルなど)、テトラヒドロベンズアゼピニル(たとえば1,2,4,5−テトラヒドロ−3H−3−ベンズアゼピン−3−イルなど)、ジヒドロイソキノリニル(たとえば3,4−ジヒドロ−2(1H)−イソキノリニルなど);
(6) スピロ環状基を有する環状アミノ基の例としては、アザスピロ[4,5]デカニル(たとえば2−アザスピロ[4,5]デカン−2−イルなど)、スピロ[1H−インデン−1,4’−ピペリジニル](たとえばスピロ[1H−インデン−1,4’−ピペリジン−1’−イル]など)およびジヒドロスピロ[1H−インデン−1,4’−ピペリジニル](たとえば2,3−ジヒドロスピロ[1H−インデン−1,4’−ピペリジン−1’−イル]など);
(7) 複素環基で架橋された環状アミノ基の例としては、アザビシクロ[2,2,1]ヘプタニル(たとえば2−アザビシクロ[2,2,1]ヘプタン−7−イルなど)およびジアザビシクロ[2.2.1]ヘプチル(たとえば2,5−ジアザビシクロ[2.2.1]ヘプト−2−イルなど)。
(1) ヘテロ原子として1個またはそれ以上の窒素原子を有する飽和単環基を有する環状アミノ基の例としては、アゼチジニル(3−アゼチジニル)、ピロリジニル(たとえば1−および3−ピロリジニルなど)、ピペリジル(たとえば1−および4−ピペリジルなど)、ホモピペリジノ(たとえばヘキサヒドロ−1H−アゼピン−1−イルなど)、ホモピペラジニル(たとえばヘキサヒドロ−1H−1,4−ジアゼピン−1−イルなど)、イミダゾリジニル(たとえば1−イミダゾリジニルなど)、ピペラジニル(たとえば1−ピペラジニルなど)、ペルヒドロピリミジニル(たとえばペルヒドロピリミジン−1−イルなど)およびジアザシクロヘプタニル(たとえば1,4−ジアザシクロヘプタン−1−イルなど);
(2) ヘテロ原子として1個またはそれ以上の窒素原子を有する不飽和単環基を有する環状アミノ基の例としては、ピロリニル(たとえば2−ピロリン−1−イルなど)、ピロリル(たとえば1−ピロリルなど)、テトラヒドロピリジニル(たとえば3,6−ジヒドロ−1(2H)−ピリジニルなど)、ピリジニル(たとえば2−ピリジニルなど)、テトラヒドロアゼピニル(たとえば2,3,6,7−テトラヒドロ−1H−アゼピン−1−イル、2,3,4,7−テトラヒドロ−1H−アゼピン−1−イルなど)、イミダゾリル(1−イミダゾリル)、ピラゾリル、トリアゾリル、テトラゾリル、テトラゾリル、ピリミジニル、ピラジニル、ピリダジニル、ジヒドロ−ピリダジニル(たとえば1,2−ジヒドロ−ピリダジン−1−イルなど)およびジヒドロ−ピリミジニル(たとえば1,2−ジヒドロ−ピリミジン−1−イルなど);
(3) ヘテロ原子として1ないし3個の窒素原子および1ないし2個の硫黄原子を有する飽和および不飽和単環基を有する環状アミノ基の例としては、チアゾリジニル(たとえば3−チアゾリジニルなど)、イソチアゾリニル(たとえば2−イソチアゾリニルなど)およびチオモルホリノ;
(4) ヘテロ原子として1ないし3個の窒素原子および1ないし2個の酸素原子を有する飽和および不飽和単環基を有する環状アミノ基の例としては、オキサゾリル、イソオキサゾリル、オキサジアゾリル(たとえば1,2,4−オキサジアゾリルおよび1,3,4−オキサジアゾリル)またはモルホリニル;
(5) 飽和および不飽和縮合環基を有する環状アミノ基の例としては、インドリル(たとえば1−インドリルなど)、ジヒドロベンゾイミダゾリル(たとえば1,2−ジヒドロベンゾイミダゾール−1−イルなど)、ペルヒドロピロロ[1,2−a]ピラジニル(たとえばペルヒドロピロロ[1,2−a]ピラジン−2−イルなど)、テトラヒドロベンゾ[f]イソキノリニル(たとえば1,4,5,6−テトラヒドロベンゾ[f]イソキノリン−3(2H)−イルなど)、ヘキサヒドロベンズ[f]イソキノリニル(たとえばシス−およびトランス−1,4,4a,5,6,10b−ヘキサヒドロベンズ[f]イソキノリン−3(2H)−イルなど)、テトラヒドロピリド[3,4−b]インドリル(たとえば1,3,4,9−テトラヒドロ−2H−ピリド[3,4−b]インドール−2−イルなど)、テトラヒドロベンズアゼピニル(たとえば1,2,4,5−テトラヒドロ−3H−3−ベンズアゼピン−3−イルなど)、ジヒドロイソキノリニル(たとえば3,4−ジヒドロ−2(1H)−イソキノリニルなど);
(6) スピロ環状基を有する環状アミノ基の例としては、アザスピロ[4,5]デカニル(たとえば2−アザスピロ[4,5]デカン−2−イルなど)、スピロ[1H−インデン−1,4’−ピペリジニル](たとえばスピロ[1H−インデン−1,4’−ピペリジン−1’−イル]など)およびジヒドロスピロ[1H−インデン−1,4’−ピペリジニル](たとえば2,3−ジヒドロスピロ[1H−インデン−1,4’−ピペリジン−1’−イル]など);
(7) 複素環基で架橋された環状アミノ基の例としては、アザビシクロ[2,2,1]ヘプタニル(たとえば2−アザビシクロ[2,2,1]ヘプタン−7−イルなど)およびジアザビシクロ[2.2.1]ヘプチル(たとえば2,5−ジアザビシクロ[2.2.1]ヘプト−2−イルなど)。
上記の中で、R1に含まれる好ましい「環状アミノ基」としては、上記の(1)または(2)を挙げることができ、最も好ましいものとして、ピペリジニル、テトラヒドロピリジニルおよびピペラジニルを挙げることができる。
「1個またはそれ以上の窒素原子を有する飽和または不飽和単環基のジラジカルであって、前記単環基から1個の水素原子を除去した後に得られるもの」の好ましい例としては、アゼチジニレン(たとえば1,2−または1,3−アゼチジニレン)、ピロリジニレン(たとえば1,2−または1,3−ピロリジニレン)、ピペリジニレン(たとえば1,3−または1,4−ピペリジニレン)を挙げることができる。
大きな細胞ストレスが加わっている間、PARP活性が、蓄積エネルギーの枯渇による細胞損傷または細胞死を急速に引き起こし、NMDAおよびNO誘発神経毒性の両方に重要な働きをすることが知られている(Zhangら,Science,263:687−89(1994))。したがって、本発明の化合物(I)などのPARP阻害活性を有する化合物または医薬として許容されるその塩は、NMDAおよびNO誘発毒性を要因とする種々の疾患の治療および予防に有用である。そのような疾患としては、たとえばネクローシスまたはアポトーシスによる細胞損傷または細胞死から生じる組織損傷;虚血および再潅流障害から生じる神経組織損傷、神経障害および神経変性疾患;神経変性疾患;頭部外傷;発作;アルツハイマー病;パーキンソン病;癲癇;筋萎縮性側索硬化症(ALS);ハンチントン舞踏病;統合失調症;慢性疼痛症;低酸素後の虚血およびニューロン損失;低血糖症;虚血;外傷;および神経発作を挙げることができる。
PARP阻害剤が梗塞の大きさを推定することに役立つことが示されている(Thiemermannら,Proc.Natl.Acad.Sci.USA,94:679−83(1997))。したがって、本発明の化合物(I)などのPARP阻害活性を有する化合物または医薬として許容されるその塩は、既往虚血性心疾患または骨格様筋組織の治療および予防に有用である。
PARPがDNA修復を増進する働きをすると考えられることも知られている。したがって、本発明の化合物(I)などのPARP阻害活性を有する化合物または医薬として許容されるその塩は、放射線感受性低酸素腫瘍細胞;放射線療法後のDNAの潜在性致死損傷から回復する腫瘍細胞の治療および予防に有効である。
さらに、本発明の化合物(I)などのPARP阻害活性を有する化合物または医薬として許容されるその塩は、細胞の寿命および増殖能を増大し、老化細胞の遺伝子発現を変化することに有用である。また、皮膚老化;アルツハイマー病;アテローム硬化症;変形性関節症;骨粗鬆症;筋ジストロフィー症;複製老化に関わる骨格様筋の変性疾患;年齢関連黄斑変性症;免疫老化;エイズ;および他の免疫老化疾患の治療および予防に有用である。
さらに、本発明の化合物(I)などのPARP阻害活性を有する化合物または医薬として許容されるその塩は、炎症性腸疾患(たとえば大腸炎);関節炎;糖尿病;内毒素ショック;敗血症性ショック;および腫瘍の治療および予防に有効である。また、腫瘍細胞の増殖を減少することに有用であり、アルキルアミン剤と共に用いて腫瘍細胞を治療する際に相乗効果をもたらす。
本発明の化合物(I)などのPARP阻害活性を有する化合物または医薬として許容されるその塩は、下垂体卒中;結膜炎;網膜芽細胞腫;網膜症;急性網膜壊死症候群;シェーグレン症候群の治療および予防に有用である。
化合物(I)またはそのプロドラッグまたはその塩は、単独に投与することができ、または好ましくは医薬として許容される賦形剤または担体との混合形態で投与することができる。
本発明の有効成分は、化合物(I)を有効成分として、外用(局所塗布)、経腸、静脈内、筋肉内、非経口または粘膜内投与に適した有機または無機の担体または賦形剤と共に含有する医薬製剤の形態、たとえば固体、半固体または液体の形態で用いることができる。有効成分は、たとえば慣用の無毒の医薬として許容される担体と共に配合し、軟膏、クリーム、硬膏、錠剤、ペレット剤、カプセル剤、坐剤、液剤(食塩水など)、乳剤、懸濁剤(オリーブ油など)、エアロゾール、ピル、粉末、シロップ、注射剤、トローチ、バップ、芳香水、ローション、口腔錠、舌下錠、点鼻剤および用途に適した他の形態として製剤することができる。使用可能な担体としては、水、ワックス、ブドウ糖、乳糖、アカシアゴム、ゼラチン、マニトール、澱粉のり、三珪酸マグネシウム、タルク、トウモロコシ澱粉、ケラチン、パラフィン、コロイドシリカ、ポテト澱粉、尿素、および製造の際の用途に適した他の担体であって、固体、半固体または液体の形態のものを挙げることができ、さらに、補助剤、安定化剤、増粘剤、着色剤および香料を用いてもよい。有効化合物は、疾患の経過または症状に応じて所望の効果を得るために十分な有効量が医薬組成物に含有される。
有効成分は、たとえば経口投与、注射、外用、吸入、粘膜への塗布用に製剤することができる。
本発明を用いる治療が可能となる哺乳類としては、カウ、ウマなどの家畜哺乳類、イヌ、ネコ、ラットなどの家庭内動物およびヒトを挙げることができ、好ましくはヒトを挙げることができる。
化合物(I)の治療有効用量は、個々の患者の年齢および症状により変動するが、化合物(I)のヒトへの平均一回量約0.01mg、0.1mg、1mg、10mg、50mg、100mg、250mg、500mgおよび1000mgが前記疾患の治療に有効であろう。一般的に、0.01mg/人ないし約1000mg/人の範囲の量を一日当たり投与すればよい。
目的化合物(I)の有用性を示すために、化合物(I)の薬理試験データを以下に示す。
(1) 試験化合物
化合物A:
2−[3−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)−1−シクロペンテン−1−イル]−4(3H)−キナゾリノン(実施例2−4の化合物化合物)
化合物B:
2−[4−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)−1−ピペリジニル]−4(3H)−キナゾリノン(実施例6−3の化合物)
(1) 試験化合物
化合物A:
2−[3−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)−1−シクロペンテン−1−イル]−4(3H)−キナゾリノン(実施例2−4の化合物化合物)
化合物B:
2−[4−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)−1−ピペリジニル]−4(3H)−キナゾリノン(実施例6−3の化合物)
PARP阻害活性(試験管内のアッセイ)
(2) アッセイ条件
指示濃度1mCi/ml32P−NAD、50mMトリスHCl、25mM−MgCl2、1mM−DTT(ジチオスレイトール)、0.05mM−NAD(ニコチンアミドアデニンジヌクレオチド)、1mg/ml活性DNA、pH8.0からなる100μl反応緩衝液内の試験化合物と共に、組換え型ヒトPARP(5.3mgタンパク質/ml)をインキューベートした。インキュベーションを室温で15分間実施し、200μlの氷冷20%トリクロロ酢酸を加えて反応を停止させ、GF/Bフィルターで急速濾過した。フィルターをシンチレーション液で処理して、酸不溶計数を測定して、単位活性を定量化した。
(2) アッセイ条件
指示濃度1mCi/ml32P−NAD、50mMトリスHCl、25mM−MgCl2、1mM−DTT(ジチオスレイトール)、0.05mM−NAD(ニコチンアミドアデニンジヌクレオチド)、1mg/ml活性DNA、pH8.0からなる100μl反応緩衝液内の試験化合物と共に、組換え型ヒトPARP(5.3mgタンパク質/ml)をインキューベートした。インキュベーションを室温で15分間実施し、200μlの氷冷20%トリクロロ酢酸を加えて反応を停止させ、GF/Bフィルターで急速濾過した。フィルターをシンチレーション液で処理して、酸不溶計数を測定して、単位活性を定量化した。
PARP阻害活性(%)=
[1−(試験化合物との酵素活性)/(賦形剤との酵素活性)]×100
(3) 結果
試験化合物におけるPARP阻害活性(IC50)
[1−(試験化合物との酵素活性)/(賦形剤との酵素活性)]×100
(3) 結果
試験化合物におけるPARP阻害活性(IC50)
本発明は、有効なPARP阻害活性を有する新規キナゾリン化合物に関する。本発明に含まれるPARP阻害剤は、マウスにMPTP処理を行うことによって誘発された線条DAおよびその代謝物の減少を防止することに有効な新規キナゾリン化合物に関する。したがって、これらの化合物がパーキンソン病などの神経変性疾患の治療において防御上の利点を有することがあるということが示唆される。
本書で使用する略語は下記の意味を有する。
略語 定義
Me メチル
Et エチル
TBu 第三級ブチル
Bzl ベンジル
Ph フェニル
Ac アセチル
Bz ベンゾイル
ここに引用される特許明細書、特許出願書および刊行物は、引用されることによって本明細書に包含される。
Me メチル
Et エチル
TBu 第三級ブチル
Bzl ベンジル
Ph フェニル
Ac アセチル
Bz ベンゾイル
ここに引用される特許明細書、特許出願書および刊行物は、引用されることによって本明細書に包含される。
以下の製造例および実施例は、本発明を詳しく説明するために示したものであって、本発明の範囲を制限すると解釈されるべきではない。
製造例1
N−エチル−N,N−ジイソプロピルアミン(0.174mL、1.00mモル)とO−(7−アザベンゾトリアゾール−1−イル)−N,N,N',N'−テトラメチルウロニウム・ヘキサフルオロホスフェート(380mg、1.00mモル)を、2−アミノベンズアミド(136mg、1.00mモル)と1−(4−フェニルシクロヘキシル)−3−ピペリジンカルボン酸(287mg、1.00mモル)のN,N−ジメチルホルムアミド(3mL)中の溶液に室温で加えた。混合物を室温で6時間攪拌した。水で反応を停止させ、有機物質をクロロホルムで抽出した。粗製の生成物をメタノールとクロロホルムで洗浄して、N−[2−(アミノカルボニル)フェニル]−1−(4−フェニルシクロヘキシル)−3−ピペリジンカルボキサミド(188mg、46.4%)を生成物として得た。
質量分析 (APCI): 405.93 (M++H)
N−エチル−N,N−ジイソプロピルアミン(0.174mL、1.00mモル)とO−(7−アザベンゾトリアゾール−1−イル)−N,N,N',N'−テトラメチルウロニウム・ヘキサフルオロホスフェート(380mg、1.00mモル)を、2−アミノベンズアミド(136mg、1.00mモル)と1−(4−フェニルシクロヘキシル)−3−ピペリジンカルボン酸(287mg、1.00mモル)のN,N−ジメチルホルムアミド(3mL)中の溶液に室温で加えた。混合物を室温で6時間攪拌した。水で反応を停止させ、有機物質をクロロホルムで抽出した。粗製の生成物をメタノールとクロロホルムで洗浄して、N−[2−(アミノカルボニル)フェニル]−1−(4−フェニルシクロヘキシル)−3−ピペリジンカルボキサミド(188mg、46.4%)を生成物として得た。
質量分析 (APCI): 405.93 (M++H)
製造例2
下記の化合物を製造例1と同様の方法にしたがって製造した。
(1) 2−({[3−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)−1−シクロヘキセン−1−イル]−カルボニル}アミノ)ベンズアミド
質量分析 (API-ES): 402.3 (M++H)
(2) 2−({4−[4−(3−メトキシフェニル)−3,6−ジヒドロ−1(2H)−ピリジニル]ブタノイル}−アミノ)ベンズアミド
質量分析 (API-ES): 283.3 (M++H)
(3) 2−({[3−(4−フェニル−1−ピペリジニル)シクロヘキシル]−カルボニル}アミノ)ベンズアミド
質量分析 (APCI): 405.80 (M++H)
下記の化合物を製造例1と同様の方法にしたがって製造した。
(1) 2−({[3−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)−1−シクロヘキセン−1−イル]−カルボニル}アミノ)ベンズアミド
質量分析 (API-ES): 402.3 (M++H)
(2) 2−({4−[4−(3−メトキシフェニル)−3,6−ジヒドロ−1(2H)−ピリジニル]ブタノイル}−アミノ)ベンズアミド
質量分析 (API-ES): 283.3 (M++H)
(3) 2−({[3−(4−フェニル−1−ピペリジニル)シクロヘキシル]−カルボニル}アミノ)ベンズアミド
質量分析 (APCI): 405.80 (M++H)
製造例3
2−{[(4−オキソシクロヘキシル)カルボニル]アミノ}ベンズアミド(260mg、1.00mモル)と4−フェニル−1,2,3,6−テトラヒドロピリジン塩酸塩(293mg、1.50mモル)のテトラヒドロフラン(5mL)中の溶液に、水素化トリアセトキシホウ素ナトリウム(318mg、1.50mモル)と酢酸(0.086mL、1.50mモル)を室温で加えた。混合物を15時間攪拌し、水で反応を停止させた。有機物質をクロロホルムで抽出し、硫酸ナトリウムで乾燥した。シリカゲルクロマトグラフィーで精製して、2−({[4−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)シクロヘキシル]カルボニル}アミノ)ベンズアミド(266mg、66.0%)を生成物として得た。
質量分析 (API-ES): 404.4 (M++H)
2−{[(4−オキソシクロヘキシル)カルボニル]アミノ}ベンズアミド(260mg、1.00mモル)と4−フェニル−1,2,3,6−テトラヒドロピリジン塩酸塩(293mg、1.50mモル)のテトラヒドロフラン(5mL)中の溶液に、水素化トリアセトキシホウ素ナトリウム(318mg、1.50mモル)と酢酸(0.086mL、1.50mモル)を室温で加えた。混合物を15時間攪拌し、水で反応を停止させた。有機物質をクロロホルムで抽出し、硫酸ナトリウムで乾燥した。シリカゲルクロマトグラフィーで精製して、2−({[4−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)シクロヘキシル]カルボニル}アミノ)ベンズアミド(266mg、66.0%)を生成物として得た。
質量分析 (API-ES): 404.4 (M++H)
実施例1
2−{[4−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)ブタノイル]アミノ}ベンズアミド(475mg、1.31mモル)をジオキサン(5mL)に溶解した。溶液に水酸化ナトリウム水溶液(1M、3.92mL)を室温で加え、混合物を同温で15時間攪拌した。有機物質をクロロホルムで抽出し、有機層を水で洗浄し、硫酸ナトリウムで乾燥した。シリカゲルクロマトグラフィーで精製して、シス−またはトランス−2−{3−[4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル]プロピル}−4(3H)−キナゾリノンを得た。
低極性生成物(37mg、38.7%)
1H NMR (200MHz, DMSO-d6, δ): 1.4-1.8 (4H, m), 1.9-2.2 (4H, m), 2.3-2.4 (1H, m), 2.6-2.8 (4H, m), 3.0-3.2 (3H, m), 6.19 (1H, br s), 7.2-7.5 (6H, m), 7.62 (1H, d, J=7.4 Hz), 7.75 (1H, t, J=8.3 Hz), 8.07 (1H, d, J=6.6 Hz), 12.08 (1H, br s).
極性生成物(30mg、31.4%)
1H NMR (200MHz, DMSO-d6, δ): 1.2-1.8 (4H, m), 1.8-2.2 (4H, m), 2.4-2.6 (1H, m), 2.75 (2H, t, J=5.4 Hz), 3.0-3.3 (3H, m), 6.17 (1H, br s), 7.1-7.5 (6H, m), 7.59 (1H, d, J=7.8 Hz), 7.77 (1H, t, J=7.6 Hz), 8.08 (1H, d, J=7.9 Hz), 12.12 (1H, br s)
2−{[4−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)ブタノイル]アミノ}ベンズアミド(475mg、1.31mモル)をジオキサン(5mL)に溶解した。溶液に水酸化ナトリウム水溶液(1M、3.92mL)を室温で加え、混合物を同温で15時間攪拌した。有機物質をクロロホルムで抽出し、有機層を水で洗浄し、硫酸ナトリウムで乾燥した。シリカゲルクロマトグラフィーで精製して、シス−またはトランス−2−{3−[4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル]プロピル}−4(3H)−キナゾリノンを得た。
低極性生成物(37mg、38.7%)
1H NMR (200MHz, DMSO-d6, δ): 1.4-1.8 (4H, m), 1.9-2.2 (4H, m), 2.3-2.4 (1H, m), 2.6-2.8 (4H, m), 3.0-3.2 (3H, m), 6.19 (1H, br s), 7.2-7.5 (6H, m), 7.62 (1H, d, J=7.4 Hz), 7.75 (1H, t, J=8.3 Hz), 8.07 (1H, d, J=6.6 Hz), 12.08 (1H, br s).
極性生成物(30mg、31.4%)
1H NMR (200MHz, DMSO-d6, δ): 1.2-1.8 (4H, m), 1.8-2.2 (4H, m), 2.4-2.6 (1H, m), 2.75 (2H, t, J=5.4 Hz), 3.0-3.3 (3H, m), 6.17 (1H, br s), 7.1-7.5 (6H, m), 7.59 (1H, d, J=7.8 Hz), 7.77 (1H, t, J=7.6 Hz), 8.08 (1H, d, J=7.9 Hz), 12.12 (1H, br s)
実施例2
下記の化合物を実施例1と同様の方法にしたがって製造した。
下記の化合物を実施例1と同様の方法にしたがって製造した。
実施例3
下記の化合物を実施例1と同様の方法にしたがって製造した。
下記の化合物を実施例1と同様の方法にしたがって製造した。
実施例4
下記の化合物を実施例1と同様の方法にしたがって製造した。
(1) 2−[1−(4−フェニルシクロヘキシル)−3−ピペリジニル]−4(3H)−キナゾリノン
1H NMR (200MHz, CDCl3: δ): 1.6-2.3 (13H, m), 2.4-2.6 (2H, m), 2.84 (1H, sept., J=3.8 Hz), 3.09 (1H, br s), 3.18 (1H, br d, J=10.7 Hz), 3.32 (1H, br d, J=11.9 Hz), 7.1-7.5 (6H, m), 7.62 (1H, d, J=7.0 Hz), 7.71 (1H, t, J=6.8 Hz), 8.29 (1H, d, J=8.0 Hz), 12.87 (1H, br s)
質量分析 (APCI): 388.20 (M++H).
下記の化合物を実施例1と同様の方法にしたがって製造した。
(1) 2−[1−(4−フェニルシクロヘキシル)−3−ピペリジニル]−4(3H)−キナゾリノン
1H NMR (200MHz, CDCl3: δ): 1.6-2.3 (13H, m), 2.4-2.6 (2H, m), 2.84 (1H, sept., J=3.8 Hz), 3.09 (1H, br s), 3.18 (1H, br d, J=10.7 Hz), 3.32 (1H, br d, J=11.9 Hz), 7.1-7.5 (6H, m), 7.62 (1H, d, J=7.0 Hz), 7.71 (1H, t, J=6.8 Hz), 8.29 (1H, d, J=8.0 Hz), 12.87 (1H, br s)
質量分析 (APCI): 388.20 (M++H).
実施例5
トリエチルアミン(1.54mL、11.1mモル)を、2−クロロ−4(3H)−キナゾリノン(100mg、0.554mモル)と2−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)エタンアミン二塩酸塩(229mg、0.831mモル)のN,N−ジメチルホルムアミド(3mL)中の懸濁液に加え、混合物を100℃で3時間加熱した。室温まで冷却し、水で反応を停止させ、生成物を酢酸エチルで抽出した。有機層を水で洗浄し、硫酸ナトリウムで乾燥した。シリカゲルクロマトグラフィーで精製して、2−{[2−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)エチル]アミノ}−4(3H)−キナゾリノン(76mg、39.6%)を生成物として得た。
1H NMR (400MHz, DMSO-d6: δ): 2.51 (2H, br s), 2.64 (2H, t, J=6.0 Hz), 2.71 (2H, t, J=5.6 Hz), 3.17 (2H, d, J=3.1 Hz), 3.51 (2H, q, J=5.5 Hz), 6.18 (1H, t, J=3.5 Hz), 6.36 (1H, br s), 7.10 (1H, t, J=7.5 Hz), 7.2-7.3 (2H, m), 7.34 (2H, t, J=6.5 Hz), 7.44 (2H, d, J=7.2 Hz), 7.56 (1H, t, J=7.7 Hz), 7.87 (1H, dd, J=7.9, 1.4 Hz), 11.05 (1H, br s)
トリエチルアミン(1.54mL、11.1mモル)を、2−クロロ−4(3H)−キナゾリノン(100mg、0.554mモル)と2−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)エタンアミン二塩酸塩(229mg、0.831mモル)のN,N−ジメチルホルムアミド(3mL)中の懸濁液に加え、混合物を100℃で3時間加熱した。室温まで冷却し、水で反応を停止させ、生成物を酢酸エチルで抽出した。有機層を水で洗浄し、硫酸ナトリウムで乾燥した。シリカゲルクロマトグラフィーで精製して、2−{[2−(4−フェニル−3,6−ジヒドロ−1(2H)−ピリジニル)エチル]アミノ}−4(3H)−キナゾリノン(76mg、39.6%)を生成物として得た。
1H NMR (400MHz, DMSO-d6: δ): 2.51 (2H, br s), 2.64 (2H, t, J=6.0 Hz), 2.71 (2H, t, J=5.6 Hz), 3.17 (2H, d, J=3.1 Hz), 3.51 (2H, q, J=5.5 Hz), 6.18 (1H, t, J=3.5 Hz), 6.36 (1H, br s), 7.10 (1H, t, J=7.5 Hz), 7.2-7.3 (2H, m), 7.34 (2H, t, J=6.5 Hz), 7.44 (2H, d, J=7.2 Hz), 7.56 (1H, t, J=7.7 Hz), 7.87 (1H, dd, J=7.9, 1.4 Hz), 11.05 (1H, br s)
実施例6
下記の化合物を実施例5と同様の方法にしたがって製造した。
下記の化合物を実施例5と同様の方法にしたがって製造した。
実施例7
下記の化合物を実施例4と同様の方法にしたがって製造した。
(1) 2−[[2−(ジメチルアミノ)エチル](メチル)アミノ]−4(3H)−キナゾリノン
1H NMR (400MHz, DMSO-d6: δ): 2.87 (6H, s), 3.22 (3H, s), 3.3-3.4 (2H, m), 3.94 (2H, t, J=5.9 Hz), 7.15 (1H, t, J=7.6 Hz), 7.30 (1H, br), 7.60 (1H, t, J=7.6 Hz), 7.91 (1H, d, J=7.8 Hz)
下記の化合物を実施例4と同様の方法にしたがって製造した。
(1) 2−[[2−(ジメチルアミノ)エチル](メチル)アミノ]−4(3H)−キナゾリノン
1H NMR (400MHz, DMSO-d6: δ): 2.87 (6H, s), 3.22 (3H, s), 3.3-3.4 (2H, m), 3.94 (2H, t, J=5.9 Hz), 7.15 (1H, t, J=7.6 Hz), 7.30 (1H, br), 7.60 (1H, t, J=7.6 Hz), 7.91 (1H, d, J=7.8 Hz)
実施例8
トリエチルアミン(1.40mL、10.0mモル)を、2−クロロ−4(3H)−キナゾリノン(181mg、1.00mモル)とN,N−ジメチル−1,2−エタンジアミン(0.196mL、1.50mモル)のジオキサン(5mL)中の懸濁液に加え、混合物を還流下に2時間加熱した。室温まで冷却し、水で反応を停止させ、生成物を酢酸エチルで抽出した。有機層を水で洗浄し、硫酸ナトリウムで乾燥した。シリカゲルクロマトグラフィーで精製し、生成物を酢酸エチル中塩化水素溶液(4M、1mL)で処理して、2−{[2−(ジメチルアミノ)エチル]アミノ}−4(3H)−キナゾリノン塩酸塩(141mg、52.3%)を生成物として得た。
1H NMR (400MHz, DMSO-d6: δ): 2.86 (6H, s), 3.36 (2H, br), 4.00 (2H, br d, J=4.5 Hz), 7.36 (1H, t, J=8.0 Hz), 7.7-7.9 (2H, m), 8.00 (1H, d, J=7.9 Hz), 8.5 (1H, br), 10.46 (1H, br)
トリエチルアミン(1.40mL、10.0mモル)を、2−クロロ−4(3H)−キナゾリノン(181mg、1.00mモル)とN,N−ジメチル−1,2−エタンジアミン(0.196mL、1.50mモル)のジオキサン(5mL)中の懸濁液に加え、混合物を還流下に2時間加熱した。室温まで冷却し、水で反応を停止させ、生成物を酢酸エチルで抽出した。有機層を水で洗浄し、硫酸ナトリウムで乾燥した。シリカゲルクロマトグラフィーで精製し、生成物を酢酸エチル中塩化水素溶液(4M、1mL)で処理して、2−{[2−(ジメチルアミノ)エチル]アミノ}−4(3H)−キナゾリノン塩酸塩(141mg、52.3%)を生成物として得た。
1H NMR (400MHz, DMSO-d6: δ): 2.86 (6H, s), 3.36 (2H, br), 4.00 (2H, br d, J=4.5 Hz), 7.36 (1H, t, J=8.0 Hz), 7.7-7.9 (2H, m), 8.00 (1H, d, J=7.9 Hz), 8.5 (1H, br), 10.46 (1H, br)
Claims (13)
- R2がハロゲン、低級アルキルまたは低級アルコキシである請求項1に記載の化合物。
- R1が、(1)ハロゲン、低級アルコキシ、低級アルキルまたはハロ(低級)アルキルで任意に置換されたアリールで置換された環状アミノ基、または(2)低級アルキルアミノである請求項2に記載の化合物。
- R1が、テトラヒドロピリジル、ピペリジルまたはピペラジニルであって、その各々がハロゲンで任意に置換されたアリールで置換されている請求項3に記載の化合物。
- Lがシクロ(低級)アルキレンまたはシクロ(低級)アルケニレンである請求項2、3、4および5のいずれかに記載の化合物。
- 式(I)
R2は置換基、
nは0ないし4の整数、
L1は(1)シクロ(低級)アルキレン基、(2)シクロ(低級)アルケニレン基、(3)1個またはそれ以上の窒素原子を有する飽和または不飽和単環基のジラジカルであって、前記単環基から1個の水素原子を除去した後に得られもの、または(4)−N(R3)−L2−(式中、R3は水素または低級アルキル基、L2は低級アルキレン基または低級アルケニレン基)、
をそれぞれ意味する。]
で表される化合物またはそのプロドラッグまたはその塩の製造法であって、
(1) 下記の式(II)
で表される化合物またはその塩を塩基の存在下で環化反応に付して、式(I)
(上記各式中、R1、R2、nおよびL1はそれぞれ前記定義の通りである。)
で表される化合物またはその塩を得ることを特徴とする前記製造法。 - 医薬として許容される担体または賦形剤と共に、請求項1に記載の化合物またはそのプロドラッグまたは医薬として許容されるその塩を有効成分として含有する医薬組成物。
- 請求項1に記載の化合物またはそのプロドラッグまたは医薬として許容されるその塩の医薬としての用途。
- PARP活性を阻害するための請求項7に記載の医薬組成物。
- NMDAおよびNO誘発毒性を要因とする疾患を治療または予防するための請求項7に記載の医薬組成物。
- 細胞の寿命または増殖能を増大するまたは老化細胞の遺伝子発現を改変する請求項7に記載の医薬組成物。
- 請求項1に記載の化合物またはそのプロドラッグまたは医薬として許容されるその塩をヒトまたは動物に投与することからなる、ネクローシスまたはアポトーシスによる細胞損傷または細胞死から生じる組織損傷;虚血および再潅流障害から生じる神経組織損傷、神経障害および神経変性疾患;神経変性疾患;頭部外傷;発作;アルツハイマー病;パーキンソン病;癲癇;筋萎縮性側索硬化症(ALS);ハンチントン舞踏病;統合失調症;慢性疼痛症;低酸素後の虚血およびニューロン損失;低血糖症;虚血;外傷;神経発作;既往虚血性心疾患または骨格様筋組織;放射線感受性低酸素腫瘍細胞;放射線療法後のDNAの潜在性致死損傷から回復する腫瘍細胞;皮膚老化;アテローム硬化症;変形性関節症;骨粗鬆症;筋ジストロフィー症;複製老化に関わる骨格様筋の変性疾患;年齢関連黄斑変性症;免疫老化;エイズ;および他の免疫老化疾患;炎症性腸疾患(たとえば大腸炎);関節炎;糖尿病;内毒素ショック;敗血症性ショック;および腫瘍を治療または予防するための方法。
- 請求項1に記載の化合物またはそのプロドラッグまたは医薬として許容されるその塩の、医薬の製造への利用。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AUPR9756A AUPR975601A0 (en) | 2001-12-24 | 2001-12-24 | Quinazolinone derivatives |
| PCT/JP2002/013286 WO2003055865A1 (en) | 2001-12-24 | 2002-12-19 | Quinazolinone derivative |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005515216A true JP2005515216A (ja) | 2005-05-26 |
Family
ID=3833368
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003556396A Withdrawn JP2005515216A (ja) | 2001-12-24 | 2002-12-19 | キナゾリノン誘導体 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20050043333A1 (ja) |
| EP (1) | EP1458688A1 (ja) |
| JP (1) | JP2005515216A (ja) |
| AU (1) | AUPR975601A0 (ja) |
| CA (1) | CA2471348A1 (ja) |
| WO (1) | WO2003055865A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015506965A (ja) * | 2012-02-09 | 2015-03-05 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツングMerck Patent Gesellschaft mit beschraenkter Haftung | Tankおよびparpのインヒビターとしてのテトラヒドロ−キナゾリノン誘導体 |
| JP2025508714A (ja) * | 2022-02-16 | 2025-04-10 | デューク ストリート バイオ リミテッド | 医薬化合物 |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7151102B2 (en) | 2000-10-30 | 2006-12-19 | Kudos Pharmaceuticals Limited | Phthalazinone derivatives |
| ES2357057T3 (es) | 2002-04-30 | 2011-04-15 | Kudos Pharmaceuticals Limited | Derivados de ftalazinona. |
| US7449464B2 (en) | 2003-03-12 | 2008-11-11 | Kudos Pharmaceuticals Limited | Phthalazinone derivatives |
| GB0305681D0 (en) | 2003-03-12 | 2003-04-16 | Kudos Pharm Ltd | Phthalazinone derivatives |
| WO2005054209A1 (en) | 2003-11-20 | 2005-06-16 | Janssen Pharmaceutica N.V. | 7-phenylalkyl substituted 2-quinolinones and 2 quinoxalinones as poly(adp-ribose) polymerase inhibitors |
| NZ547984A (en) | 2003-12-01 | 2009-03-31 | Kudos Pharm Ltd | DNA damage repair inhibitors for treatment of cancer |
| KR101211950B1 (ko) | 2004-06-30 | 2012-12-13 | 얀센 파마슈티카 엔.브이. | Parp 저해제로서의 프탈아진 유도체 |
| MXPA06014933A (es) | 2004-06-30 | 2007-02-28 | Janssen Pharmaceutica Nv | Derivados de 2-alquil quinazolinona sustituidos como inhibidores de poli(adp-ribosa) polimerasa-1. |
| GB0419072D0 (en) | 2004-08-26 | 2004-09-29 | Kudos Pharm Ltd | Phthalazinone derivatives |
| JP2008526803A (ja) * | 2005-01-07 | 2008-07-24 | ラボラトリオス・デル・ドクトル・エステベ・ソシエダッド・アノニマ | Cns障害、痛み、発作、中毒およびてんかんの治療に用いるための置換2‐アミノ‐キナゾリン4‐cn化合物、その調製、並びに中間生成物としてのその使用 |
| GB0521373D0 (en) | 2005-10-20 | 2005-11-30 | Kudos Pharm Ltd | Pthalazinone derivatives |
| EP2134691B1 (en) | 2007-03-08 | 2012-01-25 | Janssen Pharmaceutica, N.V. | Quinolinone derivatives as parp and tank inhibitors |
| WO2009034326A1 (en) | 2007-09-14 | 2009-03-19 | Astrazeneca Ab | Phthalazinone derivatives |
| WO2009041565A1 (ja) * | 2007-09-26 | 2009-04-02 | Santen Pharmaceutical Co., Ltd. | キナゾリノン誘導体又はキノキサリン誘導体を有効成分として含む角結膜障害の予防又は治療剤 |
| JP2009196973A (ja) * | 2007-09-26 | 2009-09-03 | Santen Pharmaceut Co Ltd | キナゾリノン誘導体又はキノキサリン誘導体を有効成分として含有する後眼部疾患の予防又は治療剤 |
| PL2215075T3 (pl) | 2007-10-26 | 2014-04-30 | Janssen Pharmaceutica Nv | Pochodne chinolinonu jako inhibitory PARP |
| UY31603A1 (es) | 2008-01-23 | 2009-08-31 | Derivados de ftalazinona | |
| AU2009228945B2 (en) | 2008-03-27 | 2013-05-02 | Janssen Pharmaceutica Nv | Quinazolinone derivatives as tubulin polymerization inhibitors |
| ES2529545T3 (es) | 2008-03-27 | 2015-02-23 | Janssen Pharmaceutica, N.V. | Tetrahidrofenantridinonas y tetrahidrociclopentaquinolinonas como inhibidores de la polimerización de tubulina y PARP |
| DK2346495T4 (da) | 2008-10-07 | 2023-08-28 | Kudos Pharm Ltd | Farmaceutisk formulering 514 |
| WO2011058367A2 (en) | 2009-11-13 | 2011-05-19 | Astrazeneca Ab | Diagnostic test for predicting responsiveness to treatment with poly(adp-ribose) polymerase (parp) inhibitor |
| PL2611300T3 (pl) * | 2010-09-03 | 2016-10-31 | Podstawione skondensowane pochodne dihydropirymidynonów | |
| JP5927071B2 (ja) | 2011-07-13 | 2016-05-25 | 参天製薬株式会社 | Parp阻害活性を有する新規化合物 |
| IN2015MN00002A (ja) | 2012-07-09 | 2015-10-16 | Lupin Ltd | |
| JP2018523679A (ja) | 2015-08-17 | 2018-08-23 | ルピン・リミテッド | Parp阻害剤としてのヘテロアリール誘導体 |
| DE102015012049A1 (de) * | 2015-09-15 | 2017-03-16 | Merck Patent Gmbh | Verbindungen als ASIC-Inhibitoren und deren Verwendungen |
| AU2018260094A1 (en) | 2017-04-28 | 2019-11-07 | Akribes Biomedical Gmbh | A PARP inhibitor in combination with a glucocorticoid and/or ascorbic acid and/or a protein growth factor for the treatment of impaired wound healing |
| TWI813611B (zh) | 2017-12-21 | 2023-09-01 | 美商律幫治療股份有限公司 | 作為parp14抑制劑之喹唑啉酮 |
| GB201913030D0 (en) | 2019-09-10 | 2019-10-23 | Francis Crick Institute Ltd | Treatment of hr deficient cancer |
| GB2632441A (en) * | 2023-08-08 | 2025-02-12 | Duke Street Bio Ltd | Deuterated PARP1 inhibitor compounds |
| WO2025091346A1 (en) * | 2023-11-01 | 2025-05-08 | Suzhou Eoc Medical Research Co., Ltd. | Parp inhibitors and uses thereof |
| WO2025111705A1 (en) * | 2023-11-30 | 2025-06-05 | Waverley Pharma Inc. | Quinazolinone derivatives as poly (adp ribose) polymerase 1 (parp-1) inhibitors |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3412080A1 (de) * | 1984-03-31 | 1985-10-03 | Bayer Ag, 5090 Leverkusen | 2-(1h-pyrazol-1-yl)-4-(3h)-chinazolinone enthaltende mikrobizide mittel |
| GB9404485D0 (en) * | 1994-03-09 | 1994-04-20 | Cancer Res Campaign Tech | Benzamide analogues |
| US6156758A (en) * | 1999-09-08 | 2000-12-05 | Isis Pharmaceuticals, Inc. | Antibacterial quinazoline compounds |
| AUPR201600A0 (en) * | 2000-12-11 | 2001-01-11 | Fujisawa Pharmaceutical Co., Ltd. | Quinazolinone derivative |
| BR0116113A (pt) * | 2000-12-12 | 2004-08-03 | Neurogen Corp | Espiro[isobenzofuran-1,4'-piperidin]-3-onas e 3h-espiroisoben-zofuran-1,4'-piperidinas |
| AUPS019702A0 (en) * | 2002-01-29 | 2002-02-21 | Fujisawa Pharmaceutical Co., Ltd. | Condensed heterocyclic compounds |
-
2001
- 2001-12-24 AU AUPR9756A patent/AUPR975601A0/en not_active Abandoned
-
2002
- 2002-12-19 CA CA002471348A patent/CA2471348A1/en not_active Abandoned
- 2002-12-19 EP EP02788856A patent/EP1458688A1/en not_active Withdrawn
- 2002-12-19 WO PCT/JP2002/013286 patent/WO2003055865A1/en not_active Ceased
- 2002-12-19 JP JP2003556396A patent/JP2005515216A/ja not_active Withdrawn
- 2002-12-19 US US10/499,348 patent/US20050043333A1/en not_active Abandoned
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015506965A (ja) * | 2012-02-09 | 2015-03-05 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツングMerck Patent Gesellschaft mit beschraenkter Haftung | Tankおよびparpのインヒビターとしてのテトラヒドロ−キナゾリノン誘導体 |
| JP2025508714A (ja) * | 2022-02-16 | 2025-04-10 | デューク ストリート バイオ リミテッド | 医薬化合物 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2471348A1 (en) | 2003-07-10 |
| AUPR975601A0 (en) | 2002-01-31 |
| US20050043333A1 (en) | 2005-02-24 |
| WO2003055865A1 (en) | 2003-07-10 |
| EP1458688A1 (en) | 2004-09-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2005515216A (ja) | キナゾリノン誘導体 | |
| US10717711B2 (en) | Amino quinazolines as kinase inhibitors | |
| JP2005516053A (ja) | 縮合複素環式化合物 | |
| JP5014551B2 (ja) | ホスホジエステラーゼ阻害剤として有効なβ−カルボリン誘導体 | |
| JP4465188B2 (ja) | 新規な化合物 | |
| US20040077667A1 (en) | Quinazolinone derivatives | |
| US20050171101A1 (en) | Phenanthridinones as parp inhibitors | |
| JP2013519732A (ja) | 疼痛治療のためのナトリウムチャンネル阻害薬としてのアリールカルボキサミド誘導体 | |
| CN101805309A (zh) | 用作组蛋白脱乙酰基酶抑制剂的苯甲酰胺衍生物 | |
| KR20080057318A (ko) | 2-아미노-7,8-디히드로-6h-피리도[4,3-d]피리미딘-5-온 | |
| US11753418B2 (en) | Compounds for the modulation of Myc activity | |
| AU2006236557A1 (en) | 2-amino-quinazolin-5-ones as HSP90 inhibitors useful in treating proliferation diseases | |
| KR20150053919A (ko) | 아미노 퀴나졸린 키나제 억제제의 전구약물 | |
| JP7764472B2 (ja) | サイクリン依存性キナーゼ7(cdk7)非共有結合阻害剤 | |
| KR101803866B1 (ko) | 동맥경화증 치료에 유용한 콜레스테릴 에스테르-전달 단백질(cetp) 억제제로서 5-벤질아미노메틸-6-아미노피라졸로[3,4-b]피리딘 유도체 | |
| JP7763538B2 (ja) | Parp7阻害剤及びその使用 | |
| EP4232451A1 (en) | Cftr modulator compounds, compositions, and uses thereof | |
| US12215101B2 (en) | Pro drugs of PDE10 compounds | |
| HK40083035A (en) | Parp7 inhibitor and use thereof | |
| HK40083035B (zh) | Parp7抑制剂及其用途 | |
| JP2010229096A (ja) | 医薬組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7421 Effective date: 20050225 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050324 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20050520 |
|
| A300 | Application deemed to be withdrawn because no request for examination was validly filed |
Free format text: JAPANESE INTERMEDIATE CODE: A300 Effective date: 20060307 |