JP2005296816A - 触媒及びその製造方法 - Google Patents
触媒及びその製造方法 Download PDFInfo
- Publication number
- JP2005296816A JP2005296816A JP2004117172A JP2004117172A JP2005296816A JP 2005296816 A JP2005296816 A JP 2005296816A JP 2004117172 A JP2004117172 A JP 2004117172A JP 2004117172 A JP2004117172 A JP 2004117172A JP 2005296816 A JP2005296816 A JP 2005296816A
- Authority
- JP
- Japan
- Prior art keywords
- porous oxide
- potential
- noble metal
- ceo
- oxide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000003054 catalyst Substances 0.000 title claims description 33
- 238000004519 manufacturing process Methods 0.000 title claims description 11
- 229910000510 noble metal Inorganic materials 0.000 claims abstract description 39
- 239000006104 solid solution Substances 0.000 claims abstract description 26
- 239000000243 solution Substances 0.000 claims abstract description 16
- 239000000126 substance Substances 0.000 claims abstract description 16
- 229910018072 Al 2 O 3 Inorganic materials 0.000 abstract description 39
- 239000002131 composite material Substances 0.000 abstract description 29
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 26
- 239000000843 powder Substances 0.000 description 19
- MCMNRKCIXSYSNV-UHFFFAOYSA-N ZrO2 Inorganic materials O=[Zr]=O MCMNRKCIXSYSNV-UHFFFAOYSA-N 0.000 description 12
- 239000007864 aqueous solution Substances 0.000 description 12
- 239000007789 gas Substances 0.000 description 11
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 10
- 239000001301 oxygen Substances 0.000 description 10
- 229910052760 oxygen Inorganic materials 0.000 description 10
- 238000000034 method Methods 0.000 description 9
- CETPSERCERDGAM-UHFFFAOYSA-N ceric oxide Chemical compound O=[Ce]=O CETPSERCERDGAM-UHFFFAOYSA-N 0.000 description 8
- 229910000422 cerium(IV) oxide Inorganic materials 0.000 description 8
- 238000000746 purification Methods 0.000 description 8
- 239000013078 crystal Substances 0.000 description 7
- 230000000052 comparative effect Effects 0.000 description 6
- 239000000203 mixture Substances 0.000 description 5
- 229910052697 platinum Inorganic materials 0.000 description 5
- HSJPMRKMPBAUAU-UHFFFAOYSA-N cerium(3+);trinitrate Chemical compound [Ce+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O HSJPMRKMPBAUAU-UHFFFAOYSA-N 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 239000000446 fuel Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 235000011114 ammonium hydroxide Nutrition 0.000 description 3
- IXSUHTFXKKBBJP-UHFFFAOYSA-L azanide;platinum(2+);dinitrite Chemical compound [NH2-].[NH2-].[Pt+2].[O-]N=O.[O-]N=O IXSUHTFXKKBBJP-UHFFFAOYSA-L 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000012065 filter cake Substances 0.000 description 3
- 238000010438 heat treatment Methods 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 238000005470 impregnation Methods 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 238000001179 sorption measurement Methods 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 229910052684 Cerium Inorganic materials 0.000 description 2
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 2
- BYFGZMCJNACEKR-UHFFFAOYSA-N aluminium(i) oxide Chemical class [Al]O[Al] BYFGZMCJNACEKR-UHFFFAOYSA-N 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 238000005191 phase separation Methods 0.000 description 2
- 239000010948 rhodium Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- BNGXYYYYKUGPPF-UHFFFAOYSA-M (3-methylphenyl)methyl-triphenylphosphanium;chloride Chemical compound [Cl-].CC1=CC=CC(C[P+](C=2C=CC=CC=2)(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 BNGXYYYYKUGPPF-UHFFFAOYSA-M 0.000 description 1
- IVORCBKUUYGUOL-UHFFFAOYSA-N 1-ethynyl-2,4-dimethoxybenzene Chemical compound COC1=CC=C(C#C)C(OC)=C1 IVORCBKUUYGUOL-UHFFFAOYSA-N 0.000 description 1
- XNDZQQSKSQTQQD-UHFFFAOYSA-N 3-methylcyclohex-2-en-1-ol Chemical compound CC1=CC(O)CCC1 XNDZQQSKSQTQQD-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 241000282320 Panthera leo Species 0.000 description 1
- 229910004298 SiO 2 Inorganic materials 0.000 description 1
- 229910010413 TiO 2 Inorganic materials 0.000 description 1
- QCWXUUIWCKQGHC-UHFFFAOYSA-N Zirconium Chemical compound [Zr] QCWXUUIWCKQGHC-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 150000003973 alkyl amines Chemical class 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- WUKWITHWXAAZEY-UHFFFAOYSA-L calcium difluoride Chemical group [F-].[F-].[Ca+2] WUKWITHWXAAZEY-UHFFFAOYSA-L 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- GWXLDORMOJMVQZ-UHFFFAOYSA-N cerium Chemical group [Ce] GWXLDORMOJMVQZ-UHFFFAOYSA-N 0.000 description 1
- 229910000420 cerium oxide Inorganic materials 0.000 description 1
- UNJPQTDTZAKTFK-UHFFFAOYSA-K cerium(iii) hydroxide Chemical compound [OH-].[OH-].[OH-].[Ce+3] UNJPQTDTZAKTFK-UHFFFAOYSA-K 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000011247 coating layer Substances 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- RKTYLMNFRDHKIL-UHFFFAOYSA-N copper;5,10,15,20-tetraphenylporphyrin-22,24-diide Chemical compound [Cu+2].C1=CC(C(=C2C=CC([N-]2)=C(C=2C=CC=CC=2)C=2C=CC(N=2)=C(C=2C=CC=CC=2)C2=CC=C3[N-]2)C=2C=CC=CC=2)=NC1=C3C1=CC=CC=C1 RKTYLMNFRDHKIL-UHFFFAOYSA-N 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 239000002563 ionic surfactant Substances 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 239000011812 mixed powder Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- BMMGVYCKOGBVEV-UHFFFAOYSA-N oxo(oxoceriooxy)cerium Chemical compound [Ce]=O.O=[Ce]=O BMMGVYCKOGBVEV-UHFFFAOYSA-N 0.000 description 1
- GPNDARIEYHPYAY-UHFFFAOYSA-N palladium(ii) nitrate Chemical compound [Pd+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O GPNDARIEYHPYAY-UHFFFAOYSA-N 0.000 description 1
- 239000010970 precious metal Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 1
- VXNYVYJABGOSBX-UHFFFAOYSA-N rhodium(3+);trinitrate Chemical compound [Rh+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O VXNYVYJABGOSBX-UHFFFAOYSA-N 0.000 description 1
- SONJTKJMTWTJCT-UHFFFAOYSA-K rhodium(iii) chloride Chemical compound [Cl-].[Cl-].[Cl-].[Rh+3] SONJTKJMTWTJCT-UHFFFAOYSA-K 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000001350 scanning transmission electron microscopy Methods 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 229910052726 zirconium Inorganic materials 0.000 description 1
Images
Landscapes
- Exhaust Gas Treatment By Means Of Catalyst (AREA)
- Catalysts (AREA)
Abstract
【課題】複数種の酸化物がnmレベルで分散した複合酸化物のような担体を用いても、特定の酸化物に選択的に貴金属を担持できるようにする。
【解決手段】第1多孔質酸化物と第2多孔質酸化物とを含む担体に貴金属薬液を接触させ、第1多孔質酸化物及び第2多孔質酸化物と貴金属薬液とのζ電位の引力斥力によって第1多孔質酸化物又は第2多孔質酸化物の一方に選択的に貴金属を担持する。
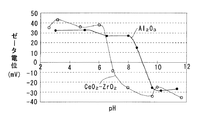
CeO2−ZrO2固溶体はpHが 6.5未満では正のζ電位を示し、pHが 6.5を超えると負のζ電位を示す。また Al2O3はpHが 9.0未満では正のζ電位を示し、pHが 9.0を超えると負のζ電位を示す。そこでpHが 6.5〜 9.0の範囲で正のζ電位を示すテトラアンミン白金を用いて担持すれば、テトラアンミン白金はCeO2−ZrO2固溶体には引き寄せられ、 Al2O3とは反撥する。
【選択図】 図1
【解決手段】第1多孔質酸化物と第2多孔質酸化物とを含む担体に貴金属薬液を接触させ、第1多孔質酸化物及び第2多孔質酸化物と貴金属薬液とのζ電位の引力斥力によって第1多孔質酸化物又は第2多孔質酸化物の一方に選択的に貴金属を担持する。
CeO2−ZrO2固溶体はpHが 6.5未満では正のζ電位を示し、pHが 6.5を超えると負のζ電位を示す。また Al2O3はpHが 9.0未満では正のζ電位を示し、pHが 9.0を超えると負のζ電位を示す。そこでpHが 6.5〜 9.0の範囲で正のζ電位を示すテトラアンミン白金を用いて担持すれば、テトラアンミン白金はCeO2−ZrO2固溶体には引き寄せられ、 Al2O3とは反撥する。
【選択図】 図1
Description
本発明は、例えば自動車の排ガス浄化用触媒とその製造方法に関する。
自動車の排気系に用いられている排ガス浄化用触媒として、排ガス中のHC、CO及びNOx を同時に浄化する三元触媒が広く用いられている。この三元触媒は、アルミナ( Al2O3)などの多孔質酸化物を担体とし、その担体に白金(Pt)やロジウム(Rh)などの貴金属を担持した構成とされ、触媒に吸着したHC及びCOを酸化して浄化するとともに、NOx を還元して浄化している。
この三元触媒は、混合気の空燃比が理論空燃比のストイキ雰囲気の排ガスと接触した場合に最も浄化率が高くなるように設計されている。ところが現実の空燃比は、自動車の走行条件によってストイキを中心にしてリッチ側あるいはリーン側に変動するため、排ガス雰囲気も変動する。そのため、上記構成の三元触媒のみで必ずしも高い浄化性能が確保されるとは限らない。
そこで従来より、担体中にセリア(CeO2)を含有させた三元触媒が知られている。セリアは酸素を吸放出する特性を有するため、酸素過剰のリ−ン雰囲気でセリアに酸素が貯蔵され、還元成分過剰のリッチ雰囲気で酸素が放出される。したがってセリアを含有することで排ガスの雰囲気の変動を緩和させることができ、浄化性能が向上する。またセリアにジルコニア(ZrO2)を複合化させたセリア−ジルコニア複合酸化物を担体中に含有させることも好ましい。ジルコニアを複合化することで、セリアの熱安定性を大幅に向上させることができる。
例えば特開平10−182155号公報には、少なくともアルミナと、セリア又はジルコニアの少なくとも1種とからなる複合酸化物に貴金属を担持した排ガス浄化用触媒が開示されている。
ところで近年の高速走行の増加などにより、自動車の排ガス温度はきわめて高くなっている。そのため排ガス浄化用触媒はさらに厳しい使用条件に耐える必要がある。ところが上記した従来の排ガス浄化用触媒では、例えば1000℃で数時間加熱する程度の耐久試験ではなんら不具合は発生しないが、1000℃で20時間程度加熱する過酷な耐久試験を行うと、担体の組成によってはセリアとジルコニアの固溶体に相分離が生じる場合があることが明らかとなった。
そこで特開2002−079097号公報にはCeO2、ZrO2及び Al2O3がnmレベルで分散した複合酸化物が記載され、その複合酸化物に貴金属を担持した触媒が記載されている。この複合酸化物では、CeO2及びZrO2には Al2O3が固溶しないので、CeO2−ZrO2固溶体の粒界に Al2O3が均一な分散状態で介在している。これにより結晶成長による比表面積の低下が生じにくく耐熱性が向上し、CeO2−ZrO2固溶体の相分離も防止される、したがってそれに伴う貴金属の粒成長も抑制され、耐久試験後も高い浄化活性が発現される。また特開2003−275588号公報には、CeO2と Al2O3がnmスケールで分散した複合酸化物を含む担体に貴金属を担持してなるCOシフト反応用触媒が開示されている。
これらの複合酸化物に貴金属を担持する場合には、硝酸塩など水溶性の貴金属塩の溶液を複合酸化物粉末と接触させ、吸着法あるいは含浸法によって担持している。このような担持法では、貴金属は複合酸化物中の各酸化物に均一に担持される。
特開2002−079097号公報に記載の触媒では、CeO2−ZrO2固溶体の酸素吸放出能を利用することで高い浄化活性が発現される。また特開2003−275588号公報に記載の触媒では、CeO2と貴金属との共存によって高い水素生成能が発現される。したがって、貴金属はCeO2−ZrO2固溶体あるいはCeO2に選択的に担持することが好ましい。
しかしながら吸着法あるいは含浸法による担持では、貴金属は複合酸化物を構成する複数種の酸化物に均一に担持されるため、特定の酸化物に選択的に担持することは困難であった。また、例えばCeO2−ZrO2固溶体粉末に予め貴金属を担持しそれに Al2O3粉末を混合すれば、CeO2−ZrO2固溶体粉末に選択的に貴金属を担持した触媒が得られるが、それではCeO2−ZrO2固溶体と Al2O3とがnmレベルで分散した複合酸化物を用いた触媒に比べて活性が大きく低下してしまう。
特開平10−182155号
特開2002−079097号
特開2003−275588号
本発明は上記した事情に鑑みてなされたものであり、複数種の酸化物がnmレベルで分散した複合酸化物のような担体を用いても、特定の酸化物に選択的に貴金属を担持できるようにすることを解決すべき課題とする。
上記課題を解決する本発明の触媒の製造方法の特徴は、第1多孔質酸化物と第2多孔質酸化物とを含む担体に貴金属薬液を接触させ、第1多孔質酸化物及び第2多孔質酸化物と貴金属薬液との静電的な引力斥力によって第1多孔質酸化物又は第2多孔質酸化物の一方に選択的に貴金属を担持することにある。
静電的な引力斥力は、ζ電位の引力斥力であるのが望ましい。この場合、所定のpH範囲で第1多孔質酸化物はζ電位が負であり第2多孔質酸化物はζ電位が正であれば、所定のpH範囲でζ電位が正の貴金属薬液を用いることで、第1多孔質酸化物に選択的に貴金属を担持することができる。
また上記製造方法により製造される本発明の触媒の特徴は、第1多孔質酸化物と、第1多孔質酸化物と固溶しない第2多孔質酸化物とを含み、第1多孔質酸化物と第2多孔質酸化物とがnmスケールで分散した複合酸化物よりなる担体と、第1多孔質酸化物に選択的に担持された貴金属と、からなることにある。
第1多孔質酸化物と第2多孔質酸化物とは、所定のpH範囲でζ電位の正負が異なることが望ましい。
本発明の製造方法によれば、第1多孔質酸化物及び第2多孔質酸化物と貴金属薬液との静電的な引力斥力によって第1多孔質酸化物又は第2多孔質酸化物の一方に選択的に貴金属を担持することができる。したがって得られる本発明の触媒によれば、貴金属が担持された第1多孔質酸化物又は第2多孔質酸化物の特性を最大に引き出すことができ、従来無駄になっていた余分な貴金属の担持量を従来より低減できるためコストも低下する。
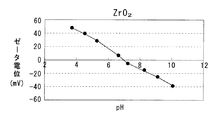
本発明の触媒の製造方法では、第1多孔質酸化物及び第2多孔質酸化物と貴金属薬液との静電的な引力斥力を利用している。静電的な引力斥力としては、電気泳動速度、ζ電位などを用いることができる。例えばζ電位で説明すると、多孔質酸化物を水中に懸濁させた溶液においては、pHによってζ電位が異なる。例えばCeO2では、図3に示すようにpH 5.9が等電点であり、pHが 5.9未満では正のζ電位を示し、pHが 5.9を超えると負のζ電位を示す。
また高温還元処理された Al2O3はpH 9.0が等電点であり、pHが 9.0未満では正のζ電位を示し、pHが 9.0を超えると負のζ電位を示す。
一方例えばテトラアンミン白金は、水溶液のpHが 6.5〜 9.0の範囲で正のζ電位を示す。したがって例えばCeO2粉末と Al2O3粉末との混合粉末にpHが 6.5〜 9.0のテトラアンミン白金水溶液を接触あるいは含浸させれば、負のζ電位をもつCeO2粉末に正のζ電位をもつテトラアンミン白金が引き寄せられ、正のζ電位をもつ Al2O3とテトラアンミン白金とは反撥するので、CeO2粉末に選択的にPtを担持することができる。この作用は分子レベルで生じるので、CeO2と Al2O3とがnmレベルで分散した複合酸化物でも同様に、CeO2に選択的にPtを担持することができる。
すなわち本発明の製造方法に用いられる第1多孔質酸化物及び第2多孔質酸化物は、それぞれ独立した単独酸化物であってもよいし、複数種の酸化物が複合化された複合酸化物あるいは固溶体を用いることもできる。複数種の酸化物が複合化された複合酸化物を用いる場合は、各酸化物がnmレベルで分散したものを用いることが好ましい。
nmレベルの分散とは、1nm程度の高分解能を有するミクロ分析装置を用いて測定しても、独立した粒子として観察されないレベルの分散状態のことをいう。このようなミクロ分析装置としては、例えば日立製作所(株)製の「HD−2000」などのFE−STEM走査形透過電子顕微鏡がある。
例えばCeO2と Al2O3とがnmレベルで分散している状態は、FE−STEMの EDSを用いた重なりのない一つの粒子の、直径 0.5nm程度のビーム径による微少範囲分析を行うことで確認することができる。そしてこの微小範囲分析による結果、複合酸化物の90%以上が、Ce及びAlの仕込み組成比±20%以内の組成比であることが望ましい。なおFE−STEMは、Field Effect-Scanning Transmission Electron Microscopyの略称であり、EDS は、Energy Dispersion Spectroscopyの略称である。
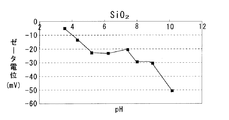
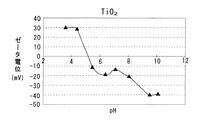
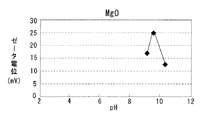
第1多孔質酸化物及び第2多孔質酸化物としては、所定のpH範囲で互いにζ電位の正負が異なるものが用いられる。例えば上記したCeO2と Al2O3、CeO2−ZrO2固溶体と Al2O3、CeO2−Al2O3 複合酸化物、CeO2−ZrO2−Al2O3 複合酸化物など各種の酸化物から選択して用いることができる。各種酸化物のpHとζ電位との関係を図4〜7に示す。
また貴金属薬液は、テトラアンミン白金、ジニトロジアンミン白金、硝酸ロジウム、塩化ロジウム、硝酸パラジウムなどを用いることができる。多孔質酸化物のζ電位と貴金属薬液のζ電位との関係を基に選択される。なお多孔質酸化物のζ電位は、水中に分散させた状態で電圧を印加したときの粒子の泳動速度から計算で求めることができる。
第1多孔質酸化物と第2多孔質酸化物とを含む担体に貴金属薬液を接触させるには、担体粉末に貴金属薬液を含浸させる方法、ハニカム基材に担体粉末からなるコート層を形成しそのコート層に貴金属薬液を含浸させる方法などがある。貴金属薬液の溶液を吸着させた後、濾過あるいはハニカム基材を引き上げて焼成する吸着法、溶液とともに蒸発乾固する含浸法のいずれも用いることができる。
以下、実施例及び比較例により本発明を具体的に説明する。
(実施例1)
硝酸アルミニウム、硝酸セリウム及びオキシ硝酸ジルコニルを、 Al2O3が0.40モル、CeO2が0.48モル、ZrO2が0.32モルとなる比率で溶解した高濃度の水溶液を調製した。この水溶液に、0.40モルの過酸化水素を含む過酸化水素水を加えて撹拌混合して混合水溶液を調製した。
硝酸アルミニウム、硝酸セリウム及びオキシ硝酸ジルコニルを、 Al2O3が0.40モル、CeO2が0.48モル、ZrO2が0.32モルとなる比率で溶解した高濃度の水溶液を調製した。この水溶液に、0.40モルの過酸化水素を含む過酸化水素水を加えて撹拌混合して混合水溶液を調製した。
一方、上記の混合水溶液を中和して余りある濃度のアンモニア水を用意し、上記の混合水溶液をアンモニア水中に添加して中和した。10分間撹拌し、最後の1分はホモジナイザーをかけながら撹拌した。そして、水酸化セリウム、水酸化ジルコニウム及び水酸化アルミニウムの沈殿を含む懸濁液を得た。沈殿した粉末をを 400℃で5時間仮焼した後、ミキサーを用いて75μm以下に粉砕した。この粉末を空気中 700℃で5時間焼成後、窒素気流中、5%の水素を流通させながら、 700℃で5時間の還元処理を行った。こうして Al2O3−CeO2−ZrO2複合酸化物粉末を調製した。
この Al2O3−CeO2−ZrO2複合酸化物では、CeO2とZrO2が固溶体を形成し、その粒界に Al2O3が均一な分散状態を保持している。CeO2−ZrO2固溶体は、酸化第2セリウムの蛍石構造を保ったままセリウムの位置の一部をジルコニウムが置換して固溶体となり、ジルコニアが十分固溶している。その固溶体中では、ジルコニアの骨格が形成される。したがって立方晶の結晶構造が安定となり、その固溶体が多くの酸素を排出しても立方晶が維持される。その機構は明らかではないが、立方晶の場合には酸素の移動が容易となると考えられ、他の正方晶や単斜晶などに比べて高い酸素吸放出能を示す。そして粒界に Al2O3が存在しているので、 Al2O3が障壁となってCeO2−ZrO2どうしの凝集が抑制される。
すなわちこの Al2O3−CeO2−ZrO2複合酸化物においては、CeO2−ZrO2固溶体が酸素吸放出能を発現する機能性材料であり、 Al2O3が焼結抑制材であるので、CeO2−ZrO2固溶体に貴金属を選択的に担持することで酸素吸放出能を最大に引き出すことができる。
ここで図1に示すように、CeO2−ZrO2固溶体はpH 6.5が等電点であり、pHが 6.5未満では正のζ電位を示し、pHが 6.5を超えると負のζ電位を示す。また Al2O3はpH 9.0が等電点であり、pHが 9.0未満では正のζ電位を示し、pHが 9.0を超えると負のζ電位を示す。
そこで本実施例では、pHが 7.5のテトラアンミン白金水溶液の所定量を Al2O3−CeO2−ZrO2複合酸化物粉末の所定量に含浸させ、蒸発乾固後 250℃で1時間焼成してPtを担持した。Ptの担持量は1重量%である。テトラアンミン白金はpHが 6.5〜 9.0の範囲で正のζ電位を示すので、そのpH範囲でζ電位が負であるCeO2−ZrO2固溶体には引き寄せられ、ζ電位が正である Al2O3とは反撥する。
(比較例1)
実施例1と同一の Al2O3−CeO2−ZrO2複合酸化物を用い、pHが 7.5のジニトロジアンミン白金水溶液の所定量を Al2O3−CeO2−ZrO2複合酸化物粉末の所定量に含浸させ、蒸発乾固後 250℃で1時間焼成してPtを担持した。Ptの担持量は1重量%である。ジニトロジアンミン白金はpHが 6.5〜 9.0の範囲で負のζ電位を示すので、そのpH範囲でζ電位が負であるCeO2−ZrO2固溶体とは反撥し、ζ電位が正である Al2O3には引き寄せられる。
実施例1と同一の Al2O3−CeO2−ZrO2複合酸化物を用い、pHが 7.5のジニトロジアンミン白金水溶液の所定量を Al2O3−CeO2−ZrO2複合酸化物粉末の所定量に含浸させ、蒸発乾固後 250℃で1時間焼成してPtを担持した。Ptの担持量は1重量%である。ジニトロジアンミン白金はpHが 6.5〜 9.0の範囲で負のζ電位を示すので、そのpH範囲でζ電位が負であるCeO2−ZrO2固溶体とは反撥し、ζ電位が正である Al2O3には引き寄せられる。
<試験・評価>
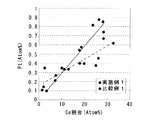
実施例1及び比較例1の触媒粉末について、FE−STEMで観察しながら、観察範囲内に複数個のスポットを決め、それぞれのスポットについて元素分析を行った。そしてそのスポットを構成するCe元素及びPt元素の原子%を算出し、結果を図2に示す。
実施例1及び比較例1の触媒粉末について、FE−STEMで観察しながら、観察範囲内に複数個のスポットを決め、それぞれのスポットについて元素分析を行った。そしてそのスポットを構成するCe元素及びPt元素の原子%を算出し、結果を図2に示す。
図2から、実施例1及び比較例1ともにCe元素の割合が多くなるにつれてPt元素の割合も多くなり、いずれの触媒でもCeO2−ZrO2固溶体にPtが担持されている。しかし実施例1の触媒の方がその傾向が強く、CeO2−ZrO2固溶体に選択的にPtが担持されていることが明らかである。比較例1の触媒はその傾向が弱く、実施例1と比較して Al2O3にPtが担持されている割合が多い。
(実施例2)
硝酸アルミニウム9水和物 0.2モル(75.1g)を2000mlのイオン交換水に混合し、プロペラ撹拌器で5分間撹拌して溶解した。そこへ濃度28重量%の硝酸セリウム水溶液 304g(CeO2換算で 0.5モル相当)を混合し、さらに5分間撹拌した。得られた混合水溶液に、25%アンモニア水 177gを加え、さらに10分間撹拌して沈殿物を含む水溶液とした。これを2気圧の加圧下にて 120℃で2時間熱処理する熟成工程を行い、沈殿物を熟成した。
硝酸アルミニウム9水和物 0.2モル(75.1g)を2000mlのイオン交換水に混合し、プロペラ撹拌器で5分間撹拌して溶解した。そこへ濃度28重量%の硝酸セリウム水溶液 304g(CeO2換算で 0.5モル相当)を混合し、さらに5分間撹拌した。得られた混合水溶液に、25%アンモニア水 177gを加え、さらに10分間撹拌して沈殿物を含む水溶液とした。これを2気圧の加圧下にて 120℃で2時間熱処理する熟成工程を行い、沈殿物を熟成した。
その後、吸引濾過器を用いて濾過し、フィルタケーキを得た。このフィルタケーキを 500mlのイオン交換水中にプロペラ撹拌器を用いて再度分散させ、さらにアルキルアミン系イオン性界面活性剤(「アーマック T50」ライオン(株)製) 9.1gを添加し、ロータ径17mm、ギャップ1mmのホモジナイザーを用いて10000rpmで5分間混合した。次いで吸引濾過器を用いて濾過し、得られたフィルタケーキを 400℃で5時間焼成して、CeO2−Al2O3複合酸化物粉末を調製した。得られた複合酸化物粉末は、約89重量%のCeO2と約11重量%の Al2O3から構成されている。
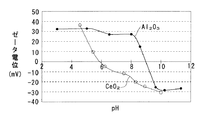
ここで図3に示すように、CeO2はpH 5.9が等電点であり、pHが 5.9未満では正のζ電位を示し、pHが 5.9を超えると負のζ電位を示す。また Al2O3はpH 9.0が等電点であり、pHが 9.0未満では正のζ電位を示し、pHが 9.0を超えると負のζ電位を示す。
そこで本実施例では、pHが 8.0のテトラアンミン白金水溶液の所定量を Al2O3−CeO2複合酸化物粉末の所定量に含浸させ、蒸発乾固後 250℃で1時間焼成してPtを担持した。Ptの担持量は1重量%である。テトラアンミン白金はpHが 6.5〜 9.0の範囲で正のζ電位を示すので、そのpH範囲でζ電位が負であるCeO2には引き寄せられ、ζ電位が正である Al2O3とは反撥する。したがって本実施例においても、CeO2に選択的にPtを担持することができる。
本発明の触媒は、排ガス浄化用触媒、水素生成触媒など種々の分野に用いることができる。
Claims (5)
- 第1多孔質酸化物と、該第1多孔質酸化物と固溶しない第2多孔質酸化物とを含み、該第1多孔質酸化物と該第2多孔質酸化物とがnmスケールで分散した複合酸化物よりなる担体と、該第1多孔質酸化物に選択的に担持された貴金属と、からなることを特徴とする触媒。
- 前記第1多孔質酸化物と前記第2多孔質酸化物とは所定のpH範囲でζ電位の正負が異なる請求項1に記載の触媒。
- 第1多孔質酸化物と第2多孔質酸化物とを含む担体に貴金属薬液を接触させ、該第1多孔質酸化物及び該第2多孔質酸化物と該貴金属薬液との静電的な引力斥力によって該第1多孔質酸化物又は該第2多孔質酸化物の一方に選択的に貴金属を担持することを特徴とする触媒の製造方法。
- 前記静電的な引力斥力はζ電位の引力斥力である請求項3に記載の触媒の製造方法。
- 所定のpH範囲で前記第1多孔質酸化物はζ電位が負であり前記第2多孔質酸化物はζ電位が正であり、該所定のpH範囲でζ電位が正の前記貴金属薬液を用いることで、前記第1多孔質酸化物に選択的に貴金属を担持する請求項4に記載の触媒の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004117172A JP2005296816A (ja) | 2004-04-12 | 2004-04-12 | 触媒及びその製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004117172A JP2005296816A (ja) | 2004-04-12 | 2004-04-12 | 触媒及びその製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005296816A true JP2005296816A (ja) | 2005-10-27 |
Family
ID=35329010
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004117172A Pending JP2005296816A (ja) | 2004-04-12 | 2004-04-12 | 触媒及びその製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005296816A (ja) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006095513A (ja) * | 2004-08-30 | 2006-04-13 | Toyota Central Res & Dev Lab Inc | 複合金属酸化物多孔体の製造方法 |
| JP2007268472A (ja) * | 2006-03-31 | 2007-10-18 | Toyota Central Res & Dev Lab Inc | 排ガス浄化用触媒の製造方法及び排ガス浄化用触媒 |
| WO2007139233A1 (ja) * | 2006-05-31 | 2007-12-06 | Toyota Jidosha Kabushiki Kaisha | 排ガス浄化触媒製造方法 |
| JP2008200603A (ja) * | 2007-02-20 | 2008-09-04 | Denso Corp | 触媒材料の製造方法およびそれによって製造される触媒材料 |
| JP2011526197A (ja) * | 2008-03-27 | 2011-10-06 | ユミコア・アクチエンゲゼルシャフト・ウント・コムパニー・コマンディットゲゼルシャフト | 排出物質浄化用途のための強化されたレドックスos材料のための塩基性交換 |
| US9403151B2 (en) | 2009-01-30 | 2016-08-02 | Umicore Ag & Co. Kg | Basic exchange for enhanced redox OS materials for emission control applications |
-
2004
- 2004-04-12 JP JP2004117172A patent/JP2005296816A/ja active Pending
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006095513A (ja) * | 2004-08-30 | 2006-04-13 | Toyota Central Res & Dev Lab Inc | 複合金属酸化物多孔体の製造方法 |
| JP2007268472A (ja) * | 2006-03-31 | 2007-10-18 | Toyota Central Res & Dev Lab Inc | 排ガス浄化用触媒の製造方法及び排ガス浄化用触媒 |
| WO2007139233A1 (ja) * | 2006-05-31 | 2007-12-06 | Toyota Jidosha Kabushiki Kaisha | 排ガス浄化触媒製造方法 |
| US7790649B2 (en) | 2006-05-31 | 2010-09-07 | Toyota Jidosha Kabushiki Kaisha | Production process of exhaust gas purifying catalyst |
| JP2008200603A (ja) * | 2007-02-20 | 2008-09-04 | Denso Corp | 触媒材料の製造方法およびそれによって製造される触媒材料 |
| JP2011526197A (ja) * | 2008-03-27 | 2011-10-06 | ユミコア・アクチエンゲゼルシャフト・ウント・コムパニー・コマンディットゲゼルシャフト | 排出物質浄化用途のための強化されたレドックスos材料のための塩基性交換 |
| US9403151B2 (en) | 2009-01-30 | 2016-08-02 | Umicore Ag & Co. Kg | Basic exchange for enhanced redox OS materials for emission control applications |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2515542C2 (ru) | Катализатор очистки выхлопных газов и способ его изготовления | |
| US8026193B2 (en) | Metal oxide particle, production process thereof and exhaust gas purifying catalyst | |
| US8389435B2 (en) | Metal oxide catalyst carrier particle and exhaust gas purification catalyst | |
| US9339793B2 (en) | Catalyst composition for exhaust gas cleaning and catalyst for automobile exhaust gas cleaning | |
| JPH0243951A (ja) | 排ガス浄化用触媒およびその製造方法 | |
| KR100881300B1 (ko) | 금속 산화물 입자의 제조 공정 및 배기 가스 정화용 촉매 | |
| EP1771383A2 (en) | Zirconia core particles coated with ceria particles, production process thereof and exhaust gas purifying catalyst | |
| JP5526502B2 (ja) | 排気ガス浄化用触媒及びその製造方法 | |
| US20070197373A1 (en) | Zirconia core particles coated with ceria particles, production process thereof and exhaust gas purifying catalyst | |
| US8097553B2 (en) | Catalyst support powder and exhaust gas purifying catalyst | |
| JP2005296816A (ja) | 触媒及びその製造方法 | |
| US10022708B2 (en) | Exhaust gas purification catalyst for motor vehicle | |
| EP1742733A1 (en) | Exhaust gas purifying catalyst and production process thereof | |
| US7632776B2 (en) | Exhaust gas purifying catalyst and production process thereof | |
| JP5131053B2 (ja) | 貴金属担持触媒及び触媒装置 | |
| JP4835028B2 (ja) | 排気ガス浄化用触媒 | |
| JP2020070219A (ja) | セリア・ジルコニア系複合酸化物酸素吸収放出材料および排ガス浄化触媒 | |
| JP4577408B2 (ja) | 排気ガス浄化用触媒 | |
| JP5705784B2 (ja) | 排ガス浄化触媒 | |
| JP2007105632A (ja) | 排ガス浄化触媒 | |
| JP3897483B2 (ja) | 排ガス浄化用触媒とその製造方法及び排ガス浄化方法 | |
| JP4930898B2 (ja) | 排ガス浄化用触媒の製造方法及び排ガス浄化用触媒 | |
| JP5140987B2 (ja) | 触媒担体及びその製造方法、並びに排ガス浄化触媒 | |
| JP5705785B2 (ja) | 排ガス浄化触媒 | |
| WO2006115239A1 (ja) | 排気ガス浄化用触媒 |