JP2005281237A - 光学活性なフタルイミド誘導体の製造法 - Google Patents
光学活性なフタルイミド誘導体の製造法 Download PDFInfo
- Publication number
- JP2005281237A JP2005281237A JP2004099858A JP2004099858A JP2005281237A JP 2005281237 A JP2005281237 A JP 2005281237A JP 2004099858 A JP2004099858 A JP 2004099858A JP 2004099858 A JP2004099858 A JP 2004099858A JP 2005281237 A JP2005281237 A JP 2005281237A
- Authority
- JP
- Japan
- Prior art keywords
- group
- optically active
- substituent
- manufacturing
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Landscapes
- Plural Heterocyclic Compounds (AREA)
- Indole Compounds (AREA)
Abstract
Description
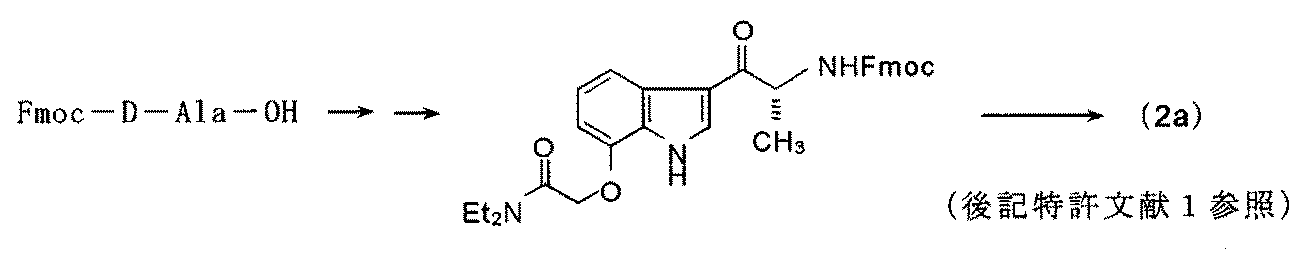
例えば、β3作用薬(I)の製造中間体として、Fmoc-D-Ala-OHを出発原料とする光学活性なアミン中間体(2a)の合成法が知られている。
一方、光学分割の際に、溶液中でラセミ化を同時進行させつつ、目的とするジアステレオマー塩を結晶化させる試みがあり、ほぼ定量的な収率で必要なジアステレオマー塩の結晶を取得した報告がある(後記非特許文献1参照)。
フタルイミド誘導体(1)のケトカルボニル基はアリール基に隣接するので、反応条件を適宜選択すれば、接触還元反応により、二級アルコール体(3a)又はメチレン体(3b)にまで還元することが可能である。二級アルコール体(3a)が生成する場合は、隣接する不斉炭素によって特定のジアステレオマーが選択的に生成する(前記特許文献2参照)。その他の一般的な還元方法によってもメチレン体(3b)にまで還元することは可能である(前記特許文献1参照)。
そして、還元の後、常法に従って脱フタロイル化すれば容易に光学活性アミン(2)を得ることができる。
また、光学分割や不斉合成のための分割剤や不斉合成試薬を使用することもないのでその回収の必要がなく、実用的な規模で目的とする光学活性な製造中間体を得ることが可能である。
で表されるフタルイミド誘導体のラセミ体より、ラセミ化優先晶出法を利用して目的とする光学活性体を取得することを特徴とする、化合物(1)の光学活性体の製造方法である。
特に好ましいフェニル基は下式
で表すことができる。特に、フェニル基にメチレンジオキシ基が置換した場合はメチレンジオキシベンゼン環、エチレンジオキシ基が置換した場合はエチレンジオキシベンゼン環をそれぞれ形成することになる。
また、ベンジル基はニトロ基、クロロ基等の電子吸引性置換基が1個から2個置換していてもよい。
C1−C4アルコキシ基とは直鎖若しくは分枝鎖を有することのある炭素数1から4のアルコキシ基であって、メトキシ、エトキシ、プロピルオキシ、イソプロピルオキシ、ブチルオキシ、イソブチルオキシ、tert-ブチルオキシ等を例示できる。
で表されるベンジルオキシ体は、汎用性が広く特に有用である。(4)は還元反応によりフェノール体(5)を与えるが、該フェノールを適宜アルキル化し脱フタロイル化すれば光学活性アミン、例えば(2c)又は(2d)を容易に取得でき、各種β3作用薬の製造に提供することができる。
で表すことができる。
ここで、ベンジル基はニトロ基、クロロ基等の電子吸引性置換基が1個から2個置換していてもよい。
水酸基の等価体としては、例えばメトキシ基、tert−ブチルオキシ基、ベンジルオキシ基、ジフェニルメトキシ基、トリフェニルメトキシ基等が挙げられる。
カルボキシル基の等価体としては、例えばメトキシカルボニル基、エトキシカルボニル基、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基等が挙げられる。
C1−C4アルキル基とは直鎖若しくは分枝鎖を有することのある炭素数1から4のアルキル基であって、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert-ブチル等を例示できる。
また、本明細書においては、特に言及しない限り、不斉炭素を有する化学式はすべての可能な光学活性体およびそれらの混合物を表すものとする。
ここで用いられる溶媒は、テトラヒドロフラン(THF)、n−ブチルアルコール、t−アミルアルコール、イソプロピルアルコール(IPA)、酢酸エチル、アセトン、メタノール、ジメトキシエタン(DME)、酢酸イソプロピルが好ましいが、より好ましくは、IPA、酢酸エチル、DME若しくは酢酸イソプロピルであり、最も好ましくは、IPA若しくは酢酸エチルである。
ラセミ化剤として用いられる塩基は、テトラメチルエチレンジアミン(TMEDA)、トリエチルアミン、1,8-ジアザビシクロ[5,4,0]-7-ウンデセン(DBU)、N−メチルピペラジン、テトラ−n−ブチルアンモニウムフルオリド(TBAF)、ジアザビシクロ[2,2,2]オクタン(DABCO)、カリウムt−ブトキシド、ジイソプロピルエチルアミン、N−メチルモルホリン、4−ジメチルアミノピリジン、N−メチルピペリジン、1,5−ジアザビシクロ[4,3,0]−5−ノネン(DBN)が好ましいが、より好ましくは、DBU、DBN、DABCO、TMDEA、最も好ましくは、DBU、DBNである。
本発明に用いるフタルイミド誘導体のラセミ体は公知の方法に従い、又はそれに準じて製造することができる。
また、接種に使用する光学活性体は、フタロイル化合物のラセミ体から例えば光学活性カラムを用いる高速液体クロマトグラフを利用して必要量を分取すれば容易に入手できる。
以下に参考例および実施例を挙げて本発明を更に具体的に説明する。尚、実施例2における化合物(1b)のメトキシ基は例えばBBr3を用いて酸処理することにより容易に水酸基となるので、文献(前記特許文献2参照)に従って、得られた(1b)は容易に光学活性アミン(2b)へと誘導できる。
(1a)〔(R)体〕の調製
種晶(R)体の化合物(1a)(光学純度100.0%ee、化学純度99.9%、特開平11−255743参照)100mgを接種した後、約65℃から20℃まで徐々に冷却して、析出した結晶を濾取、乾燥して、(R)体の化合物(1a)を14.7g(収率72.5、光学純度99.4%ee、化学純度99.7%)得た。
尚、原料のラセミ体はN,N−ジエチル−(1H−インドール−7−イルオキシ)−アセトアミド(前記特許文献1参照)に対して(±)−2−フタルイミドプロピオン酸クロライド(前記特許文献2参照)を反応させて合成した。
(1b)〔(S)体〕の調製
種晶(S)体の化合物(1b)(光学純度100.0%ee、化学純度99.9%、WO2004-5251参照)100mgを接種した後、約70℃から20℃まで徐々に冷却して、析出した結晶を濾取、乾燥して、(S)体の化合物(1b)を16g(収率80%、光学純度99.5%ee、化学純度99.7%)得た。
尚、原料のラセミ体は国際特許公報(前記特許文献2参照)の記載に準じ、アニソールと(±)−2−フタルイミドプロピオン酸クロライドを反応させて合成した。
Claims (5)
- Arが置換基を有することのあるフェニル基である、請求項1の製造方法。
- Arが置換基を有することのあるインドリル基である、請求項1の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004099858A JP2005281237A (ja) | 2004-03-30 | 2004-03-30 | 光学活性なフタルイミド誘導体の製造法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004099858A JP2005281237A (ja) | 2004-03-30 | 2004-03-30 | 光学活性なフタルイミド誘導体の製造法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005281237A true JP2005281237A (ja) | 2005-10-13 |
Family
ID=35180011
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004099858A Pending JP2005281237A (ja) | 2004-03-30 | 2004-03-30 | 光学活性なフタルイミド誘導体の製造法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005281237A (ja) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6127961A (ja) * | 1984-07-17 | 1986-02-07 | Nippon Soda Co Ltd | N−置換フタルイミドの製造方法 |
| JPH0356482A (ja) * | 1989-07-24 | 1991-03-12 | Mochida Pharmaceut Co Ltd | 光学活性な2―フタルイミドオキシーフェニル酢酸誘導体およびその製造方法 |
| JPH07330726A (ja) * | 1994-06-01 | 1995-12-19 | Kissei Pharmaceut Co Ltd | インドール誘導体 |
| JP2003238507A (ja) * | 2002-02-15 | 2003-08-27 | Ajinomoto Co Inc | 光学活性β−フェニルアラニン誘導体の製造方法 |
-
2004
- 2004-03-30 JP JP2004099858A patent/JP2005281237A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6127961A (ja) * | 1984-07-17 | 1986-02-07 | Nippon Soda Co Ltd | N−置換フタルイミドの製造方法 |
| JPH0356482A (ja) * | 1989-07-24 | 1991-03-12 | Mochida Pharmaceut Co Ltd | 光学活性な2―フタルイミドオキシーフェニル酢酸誘導体およびその製造方法 |
| JPH07330726A (ja) * | 1994-06-01 | 1995-12-19 | Kissei Pharmaceut Co Ltd | インドール誘導体 |
| JP2003238507A (ja) * | 2002-02-15 | 2003-08-27 | Ajinomoto Co Inc | 光学活性β−フェニルアラニン誘導体の製造方法 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20050080268A1 (en) | Process of preparing O-carbamoyl compounds in the presence of active amine group | |
| KR101379154B1 (ko) | 카르보닐 비대칭 알킬화 | |
| HU226881B1 (en) | Efficient enantioselective addition reaction using an organozinc reagent | |
| US20090182156A1 (en) | Synthesis and preparations of duloxetine salts | |
| AU2007243490A1 (en) | Production of chirally pure amino alcohol intermediates, derivatives thereof, and uses thereof | |
| JP2006500407A (ja) | チュブリン阻害剤の合成に有用な中間体の合成方法 | |
| DK2958893T3 (en) | Asymmetric synthesis of a substituted pyrrolidine-2-carboxamide | |
| KR101430116B1 (ko) | 스트레커 반응용 촉매를 사용하는 키랄성 α-아미노나이트릴의 제조방법 | |
| RU2512591C2 (ru) | Способ получения плевромутилинов | |
| JP2005281237A (ja) | 光学活性なフタルイミド誘導体の製造法 | |
| KR101304640B1 (ko) | 신규의 로수바스타틴 엔-메틸벤질아민 염 및 그의 제조방법 | |
| JP5406194B2 (ja) | R−ゴシポールl−フェニルアラニノールジエナミンを調製するための方法 | |
| WO2015022702A2 (en) | Process for preparation of 4,5-dimethoxybenzene derivatives and use in the synthesis of ivabradine and salts thereof | |
| JP6050363B2 (ja) | アリール化β−ジカルボニル化合物とその製造方法 | |
| JP4157272B2 (ja) | 2r−[1−ヒドロキシ−1−トリフルオロメチル−3−シクロプロピルプロピン−2−イル]−4−クロロアニリンの光学純度を高める方法 | |
| US8058456B2 (en) | Optically active 3-amino-2,5-dioxopyrrolidine-3-carboxylate, process for production of the compound, and use of the compound | |
| US7122696B2 (en) | Processes for preparation of N-protected-β-amino alcohols and N-protected-β-amino epoxides | |
| JP5344523B2 (ja) | 立体選択的にストレッカー反応を進行させ得る触媒、およびそれを用いたα−アミノニトリル誘導体を立体選択的に製造するための方法 | |
| JP5396841B2 (ja) | α−トリフルオロメチル−β−置換−β−アミノ酸類の製造方法 | |
| WO2006090265A2 (en) | Processes for the preparation of levetiracetam, its intermediate and the use of levetiracetam in pharmaceutical compositions | |
| JP2000007664A (ja) | 光学活性ピペラジン化合物、その中間体及びそれらの製造方法 | |
| JP5510040B2 (ja) | 光学活性(r)−1−(4−フルオロフェニル)エチルアミンを得る光学分割 | |
| JP3778843B2 (ja) | 光学活性アミン誘導体および合成法 | |
| KR20050062944A (ko) | 디이소프로필((1-((2-아미노-6-클로로-9h-퓨린-9-일)메틸)사이클로프로필)옥시)-메틸포스포네이트의 새로운 제조방법 | |
| JPWO2003074464A1 (ja) | 光学活性カルボン酸の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070228 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20070228 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20070228 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100803 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101001 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110118 |