JP2005151907A - 胎盤又は羊膜由来ヒト幹細胞及びその樹立方法並びに臓器への分化誘導方法 - Google Patents
胎盤又は羊膜由来ヒト幹細胞及びその樹立方法並びに臓器への分化誘導方法 Download PDFInfo
- Publication number
- JP2005151907A JP2005151907A JP2003397524A JP2003397524A JP2005151907A JP 2005151907 A JP2005151907 A JP 2005151907A JP 2003397524 A JP2003397524 A JP 2003397524A JP 2003397524 A JP2003397524 A JP 2003397524A JP 2005151907 A JP2005151907 A JP 2005151907A
- Authority
- JP
- Japan
- Prior art keywords
- human
- stem cell
- human stem
- cell
- cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000000130 stem cell Anatomy 0.000 title claims abstract description 107
- 210000001691 amnion Anatomy 0.000 title claims abstract description 26
- 210000002826 placenta Anatomy 0.000 title claims abstract description 25
- 238000000034 method Methods 0.000 title claims description 29
- 210000000056 organ Anatomy 0.000 title claims description 18
- 210000004027 cell Anatomy 0.000 claims abstract description 56
- 102000002260 Alkaline Phosphatase Human genes 0.000 claims abstract description 12
- 108020004774 Alkaline Phosphatase Proteins 0.000 claims abstract description 12
- 101710150336 Protein Rex Proteins 0.000 claims abstract description 12
- 230000000694 effects Effects 0.000 claims abstract description 12
- 108091023040 Transcription factor Proteins 0.000 claims abstract description 9
- 102000040945 Transcription factor Human genes 0.000 claims abstract description 9
- 230000035755 proliferation Effects 0.000 claims abstract description 7
- 210000001161 mammalian embryo Anatomy 0.000 claims description 36
- 108090000623 proteins and genes Proteins 0.000 claims description 22
- 210000001519 tissue Anatomy 0.000 claims description 20
- 238000012258 culturing Methods 0.000 claims description 11
- 102000004058 Leukemia inhibitory factor Human genes 0.000 claims description 9
- 108090000581 Leukemia inhibitory factor Proteins 0.000 claims description 9
- 210000003754 fetus Anatomy 0.000 claims description 9
- 108091003079 Bovine Serum Albumin Proteins 0.000 claims description 7
- 230000010261 cell growth Effects 0.000 claims description 5
- 210000002919 epithelial cell Anatomy 0.000 claims description 5
- 239000003102 growth factor Substances 0.000 claims description 5
- 102000009024 Epidermal Growth Factor Human genes 0.000 claims description 3
- 101800003838 Epidermal growth factor Proteins 0.000 claims description 3
- 229940116977 epidermal growth factor Drugs 0.000 claims description 3
- 238000012216 screening Methods 0.000 claims description 3
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 claims description 3
- 239000012894 fetal calf serum Substances 0.000 claims 2
- 239000002699 waste material Substances 0.000 abstract description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 10
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 10
- 101100045395 Mus musculus Tap1 gene Proteins 0.000 description 9
- 102100035423 POU domain, class 5, transcription factor 1 Human genes 0.000 description 8
- 101710126211 POU domain, class 5, transcription factor 1 Proteins 0.000 description 8
- 102000004142 Trypsin Human genes 0.000 description 7
- 108090000631 Trypsin Proteins 0.000 description 7
- 210000001035 gastrointestinal tract Anatomy 0.000 description 7
- 238000012546 transfer Methods 0.000 description 7
- 238000002054 transplantation Methods 0.000 description 7
- 239000012588 trypsin Substances 0.000 description 7
- 101100394230 Caenorhabditis elegans ham-1 gene Proteins 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 210000000601 blood cell Anatomy 0.000 description 6
- 210000002798 bone marrow cell Anatomy 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 5
- 230000004069 differentiation Effects 0.000 description 5
- 210000002257 embryonic structure Anatomy 0.000 description 5
- 239000012091 fetal bovine serum Substances 0.000 description 5
- 239000003550 marker Substances 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 210000004748 cultured cell Anatomy 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 238000001000 micrograph Methods 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- 241000283690 Bos taurus Species 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241000699660 Mus musculus Species 0.000 description 3
- 239000002771 cell marker Substances 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 210000003161 choroid Anatomy 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 230000003511 endothelial effect Effects 0.000 description 3
- 210000002219 extraembryonic membrane Anatomy 0.000 description 3
- 210000001654 germ layer Anatomy 0.000 description 3
- 210000003494 hepatocyte Anatomy 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 210000005036 nerve Anatomy 0.000 description 3
- 210000001178 neural stem cell Anatomy 0.000 description 3
- 238000011580 nude mouse model Methods 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 230000009261 transgenic effect Effects 0.000 description 3
- 230000002792 vascular Effects 0.000 description 3
- 108010088751 Albumins Proteins 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 206010010356 Congenital anomaly Diseases 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 2
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 2
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 2
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 2
- 102100033421 Keratin, type I cytoskeletal 18 Human genes 0.000 description 2
- 108010066327 Keratin-18 Proteins 0.000 description 2
- 229930193140 Neomycin Natural products 0.000 description 2
- 102000008730 Nestin Human genes 0.000 description 2
- 108010088225 Nestin Proteins 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 2
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 2
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 description 2
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 210000001643 allantois Anatomy 0.000 description 2
- 210000004381 amniotic fluid Anatomy 0.000 description 2
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 210000001130 astrocyte Anatomy 0.000 description 2
- 210000002459 blastocyst Anatomy 0.000 description 2
- 210000001109 blastomere Anatomy 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 238000012790 confirmation Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 229940126864 fibroblast growth factor Drugs 0.000 description 2
- 230000002518 glial effect Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 210000003716 mesoderm Anatomy 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 229960004927 neomycin Drugs 0.000 description 2
- 210000005055 nestin Anatomy 0.000 description 2
- 210000004498 neuroglial cell Anatomy 0.000 description 2
- 210000002569 neuron Anatomy 0.000 description 2
- 206010033675 panniculitis Diseases 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 230000010349 pulsation Effects 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 238000011069 regeneration method Methods 0.000 description 2
- 210000002027 skeletal muscle Anatomy 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 210000004304 subcutaneous tissue Anatomy 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- BRZYSWJRSDMWLG-DJWUNRQOSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-[(1r)-1-hydroxyethyl]oxan-2-yl]oxy-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H]([C@@H](C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-DJWUNRQOSA-N 0.000 description 1
- 101100150905 Caenorhabditis elegans ham-3 gene Proteins 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 102100028072 Fibroblast growth factor 4 Human genes 0.000 description 1
- 102100037665 Fibroblast growth factor 9 Human genes 0.000 description 1
- 101000834253 Gallus gallus Actin, cytoplasmic 1 Proteins 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 102100021519 Hemoglobin subunit beta Human genes 0.000 description 1
- 108091005904 Hemoglobin subunit beta Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101001060274 Homo sapiens Fibroblast growth factor 4 Proteins 0.000 description 1
- 101001027380 Homo sapiens Fibroblast growth factor 9 Proteins 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 101100045406 Mus musculus Tap2 gene Proteins 0.000 description 1
- 206010028851 Necrosis Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 102000002584 Octamer Transcription Factor-3 Human genes 0.000 description 1
- 108010068425 Octamer Transcription Factor-3 Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102100024616 Platelet endothelial cell adhesion molecule Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000001172 blastoderm Anatomy 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 210000004413 cardiac myocyte Anatomy 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000003501 co-culture Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 210000004351 coronary vessel Anatomy 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 210000004207 dermis Anatomy 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 210000003981 ectoderm Anatomy 0.000 description 1
- 210000001705 ectoderm cell Anatomy 0.000 description 1
- 210000001671 embryonic stem cell Anatomy 0.000 description 1
- 210000001900 endoderm Anatomy 0.000 description 1
- 210000004039 endoderm cell Anatomy 0.000 description 1
- 210000004696 endometrium Anatomy 0.000 description 1
- 210000003989 endothelium vascular Anatomy 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002073 fluorescence micrograph Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 210000000777 hematopoietic system Anatomy 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- -1 is introduced Proteins 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000008774 maternal effect Effects 0.000 description 1
- 210000001704 mesoblast Anatomy 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 230000003169 placental effect Effects 0.000 description 1
- 210000005152 placental membrane Anatomy 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 208000001608 teratocarcinoma Diseases 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 230000005740 tumor formation Effects 0.000 description 1
- 210000003954 umbilical cord Anatomy 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
Images
Abstract
【課題】分娩時に廃棄物として処理されるヒト胎盤又は羊膜から、幹細胞として充分な回数の継代(30回以上)が可能なヒト幹細胞を提供する。
【解決手段】前記ヒト幹細胞は、以下の細胞生物学的特徴を有する:
(1)ヒト胎盤又は羊膜由来である。
(2)正常2倍体の核型を有する。
(3)未分化状態での増殖を継続する。
(4)アルカリホスファターゼ活性が陽性である。
(5)転写因子Rex−1、Oct−4、及びEcat−4が発現する。
(6)多分化能力を維持しながら30回以上の継代が可能である。
【選択図】なし
【解決手段】前記ヒト幹細胞は、以下の細胞生物学的特徴を有する:
(1)ヒト胎盤又は羊膜由来である。
(2)正常2倍体の核型を有する。
(3)未分化状態での増殖を継続する。
(4)アルカリホスファターゼ活性が陽性である。
(5)転写因子Rex−1、Oct−4、及びEcat−4が発現する。
(6)多分化能力を維持しながら30回以上の継代が可能である。
【選択図】なし
Description
本発明は、胎盤又は羊膜由来ヒト幹細胞(以下、単にヒト幹細胞と称することもある)及びその樹立方法、並びに、その幹細胞からの臓器への分化誘導方法に関する。前記ヒト幹細胞は、例えば、種々の組織若しくは器官の障害又は疾病に罹患した患者の移植医療用臓器の材料として用いることができる。
分化多能性を示す幹細胞の存在は、例えば、造血系、腸管、骨格筋、皮膚、又は中枢神経などで示唆され、存在が実証されつつある。例えば、神経幹細胞から全ての細胞系譜に分化転換することができるとの報告(非特許文献1)や、骨髄細胞からも同様に外胚葉細胞、中胚葉細胞、及び内胚葉細胞全てに分化できるという報告(非特許文献2)もなされている。一方、骨髄細胞には多分化能力は殆ど認められないという逆の報告(非特許文献3)もあり、細胞関連幹細胞の多分化能力に関しては知見が錯綜している。また、多分化能力を保有する細胞には胚性幹細胞があり、ヒトの再生医療や遺伝子治療に道を開く万能細胞として、脚光を浴びるようになってきたが、ヒトとして誕生する可能性のある胚を破壊して培養細胞に変える手法は倫理面からは非常に問題が多い。
従って、多分化能力を持ち、かつ倫理面からも問題を引き起こすことのないヒト幹細胞の樹立は、臓器移植医療が立ち遅れている我が国においては、緊急の課題である。
クラーク・ディー・エル(Clarke DL)ら,「サイエンス(Science)」,(米国),2000年,第288巻,p.660−1662 ジャン・ワイ(Jiang Y)ら,「ネイチャー(Nature)」,(英国),2002年,第418巻,p.41−49 ウェイガーズ・エー・ジェー(Wagers AJ)ら,「サイエンス(Science)」,(米国),2002年,第297巻,p.2256−2259
従って、多分化能力を持ち、かつ倫理面からも問題を引き起こすことのないヒト幹細胞の樹立は、臓器移植医療が立ち遅れている我が国においては、緊急の課題である。
クラーク・ディー・エル(Clarke DL)ら,「サイエンス(Science)」,(米国),2000年,第288巻,p.660−1662 ジャン・ワイ(Jiang Y)ら,「ネイチャー(Nature)」,(英国),2002年,第418巻,p.41−49 ウェイガーズ・エー・ジェー(Wagers AJ)ら,「サイエンス(Science)」,(米国),2002年,第297巻,p.2256−2259
従って、本発明の課題は、分娩時に廃棄物として処理されるヒト胎盤又は羊膜から、幹細胞として充分な回数の継代(30回以上)が可能なヒト幹細胞を提供し、更に、前記幹細胞を用いる臓器の製造方法を提供することにある。
前記課題は、本発明による、以下の細胞生物学的特徴を有することを特徴とする、ヒト幹細胞:
(1)ヒト胎盤又は羊膜由来である。
(2)正常2倍体の核型を有する。
(3)未分化状態での増殖を継続する。
(4)アルカリホスファターゼ活性が陽性である。
(5)転写因子Rex−1、Oct−4、及びEcat−4が発現する。
(6)多分化能力を維持しながら30回以上の継代が可能である。
により解決することができる。
また、本発明は、ヒト胎盤又は羊膜より得られた細胞を、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として培養し、コロニーを形成させることを特徴とする、ヒト幹細胞の樹立方法に関する。
また、本発明は、ヒト胎盤又は羊膜より得られた細胞を、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として培養し、コロニーを形成させ、このコロニーを、(a)核型、(b)未分化状態での増殖性、(c)アルカリホスファターゼ活性の有無、(d)Rex−1、Oct−4、及びEcat−4の発現性、並びに(e)多分化能の有無を指標にスクリーニングすることを特徴とする、ヒト幹細胞の樹立方法に関する。
また、本発明は、前記ヒト幹細胞に、外来遺伝子を導入することにより得ることのできる、ヒト形質転換体に関する。
また、本発明は、前記ヒト幹細胞又は前記ヒト形質転換体に由来する、ヒト分化細胞、ヒト分化組織、又はヒト臓器に関する。
また、本発明は、前記ヒト幹細胞又は前記ヒト形質転換体に由来する、ヒト−動物キメラ胚、キメラ胎児、又はキメラ個体に関する。
また、本発明は、前記ヒト幹細胞又は前記ヒト形質転換体を用いることを特徴とする、臓器の製造方法に関する。
更に、本発明は、拒絶反応を抑えるために骨髄細胞に分化させた幹細胞を、移植用に分化させた臓器細胞と同時に患者に移植する方法を提供する。
例えば、心筋梗塞の患者に同一株でありながら自発性拍動を行う迄に分化させたヒト幹細胞と、骨髄細胞に分化させた幹細胞とを同時に移植することで、拒絶反応を抑制させるという方法を提供する。
(1)ヒト胎盤又は羊膜由来である。
(2)正常2倍体の核型を有する。
(3)未分化状態での増殖を継続する。
(4)アルカリホスファターゼ活性が陽性である。
(5)転写因子Rex−1、Oct−4、及びEcat−4が発現する。
(6)多分化能力を維持しながら30回以上の継代が可能である。
により解決することができる。
また、本発明は、ヒト胎盤又は羊膜より得られた細胞を、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として培養し、コロニーを形成させることを特徴とする、ヒト幹細胞の樹立方法に関する。
また、本発明は、ヒト胎盤又は羊膜より得られた細胞を、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として培養し、コロニーを形成させ、このコロニーを、(a)核型、(b)未分化状態での増殖性、(c)アルカリホスファターゼ活性の有無、(d)Rex−1、Oct−4、及びEcat−4の発現性、並びに(e)多分化能の有無を指標にスクリーニングすることを特徴とする、ヒト幹細胞の樹立方法に関する。
また、本発明は、前記ヒト幹細胞に、外来遺伝子を導入することにより得ることのできる、ヒト形質転換体に関する。
また、本発明は、前記ヒト幹細胞又は前記ヒト形質転換体に由来する、ヒト分化細胞、ヒト分化組織、又はヒト臓器に関する。
また、本発明は、前記ヒト幹細胞又は前記ヒト形質転換体に由来する、ヒト−動物キメラ胚、キメラ胎児、又はキメラ個体に関する。
また、本発明は、前記ヒト幹細胞又は前記ヒト形質転換体を用いることを特徴とする、臓器の製造方法に関する。
更に、本発明は、拒絶反応を抑えるために骨髄細胞に分化させた幹細胞を、移植用に分化させた臓器細胞と同時に患者に移植する方法を提供する。
例えば、心筋梗塞の患者に同一株でありながら自発性拍動を行う迄に分化させたヒト幹細胞と、骨髄細胞に分化させた幹細胞とを同時に移植することで、拒絶反応を抑制させるという方法を提供する。
本発明の胎盤又は羊膜由来ヒト幹細胞は、幹細胞としての生体内又は生体外培養系における分化転換制御機構解明の為の分子生物学、発生学、又は生化学等の研究材料として、あるいは、臓器移植用の臓器作成の材料として有用であり、本発明の分化誘導は、体外培養系を用いた種々の医療用細胞、組織、又は器官の再生に極めて価値の高いものである。また、遺伝子導入ヒト幹細胞と動物胚とでキメラ胚を作成することにより、有用医薬品のバイオリアクターとなる遺伝子組み換え動物生産のためのドナー細胞としても有益である。
本発明のヒト幹細胞は、以下の細胞生物学的特徴を有する:
(1)ヒト胎盤又は羊膜由来である。
(2)正常2倍体の核型を有する。
(3)未分化状態での増殖を継続する。
(4)アルカリホスファターゼ活性が陽性である。
(5)転写因子Rex−1、Oct−4、及びEcat−4が発現する。
(6)多分化能力を維持しながら30回以上の継代が可能である。
(1)ヒト胎盤又は羊膜由来である。
(2)正常2倍体の核型を有する。
(3)未分化状態での増殖を継続する。
(4)アルカリホスファターゼ活性が陽性である。
(5)転写因子Rex−1、Oct−4、及びEcat−4が発現する。
(6)多分化能力を維持しながら30回以上の継代が可能である。
本発明のヒト幹細胞は、ヒト胎盤又は羊膜由来である。本明細書において「胎盤」とは、胎膜のうちの脈絡膜(あるいは奬膜)の絨毛が母体の子宮内膜と接合する部分で、胎児に属する脈絡膜を胎盤と呼ぶ。また、本明細書において「羊膜」とは、胎膜のうちで最内方の直接胎児を覆っている透明な薄膜であり、臍帯を包み、外側は尿膜で被われている。中には羊水を満たし胎児はその羊水中に浮遊している。そこで胎膜とは脈絡膜、尿膜、羊膜からなり、主に胚の栄養外胚葉と内細胞塊からの胚盤葉上層に由来する。
本発明のヒト幹細胞は、正常2倍体の核型(すなわち、46XX又は46XY)を有する。
また、本発明のヒト幹細胞は、未分化状態及び多分化能力を維持しながら30回以上(好ましくは40回以上、より好ましくは50回以上、更に好ましくは60回以上)の継代が可能である。
なお、本明細書において「継代」とは、コンフルエントな状態に達した細胞培養容器中の細胞の一部(例えば、1/5〜1/10)を、実質的に同一の、別の細胞培養容器に移し、再度、コンフルエントな状態まで細胞増殖させることを意味し、この一連の操作を継代数として1回と規定する。なお、通常の1回の継代で、各細胞は、約5回の細胞分裂を行うことができる。
また、本発明のヒト幹細胞は、未分化状態及び多分化能力を維持しながら30回以上(好ましくは40回以上、より好ましくは50回以上、更に好ましくは60回以上)の継代が可能である。
なお、本明細書において「継代」とは、コンフルエントな状態に達した細胞培養容器中の細胞の一部(例えば、1/5〜1/10)を、実質的に同一の、別の細胞培養容器に移し、再度、コンフルエントな状態まで細胞増殖させることを意味し、この一連の操作を継代数として1回と規定する。なお、通常の1回の継代で、各細胞は、約5回の細胞分裂を行うことができる。
本発明のヒト幹細胞が未分化状態を維持しているか否かは、例えば、哺乳動物(例えばマウス又はウシ)で確立されている、公知の各種未分化マーカー(例えば特開2002−176973号公報)により確認することができる。前記未分化マーカーとしては、例えば、アルカリホスファターゼ活性が陽性であること、あるいは、転写因子Oct−4、Rex−1、及びEcat−4が発現すること等を挙げることができる。
アルカリホスファターゼ活性及び転写因子Oct−4の発現については、例えば、特開2002−176973号公報に記載の方法により確認することができ、転写因子Rex−1の発現については、例えば、ジャン・ワイ(Jiang Y)ら,「ネイチャー(Nature)」,(英国),2002年,第418巻,p.41−49により確認することができ、転写因子Ecat−4の発現については、例えば、ミツイ・ケー(Mitsui.K.)ら、「セル(Cell)」,(米国),2003年,第113巻,p.631−642により確認することができる。
アルカリホスファターゼ活性及び転写因子Oct−4の発現については、例えば、特開2002−176973号公報に記載の方法により確認することができ、転写因子Rex−1の発現については、例えば、ジャン・ワイ(Jiang Y)ら,「ネイチャー(Nature)」,(英国),2002年,第418巻,p.41−49により確認することができ、転写因子Ecat−4の発現については、例えば、ミツイ・ケー(Mitsui.K.)ら、「セル(Cell)」,(米国),2003年,第113巻,p.631−642により確認することができる。
本発明のヒト幹細胞が多分化能力を保持しているか否かは、例えば、哺乳動物(例えばマウス又はウシ)で確立されている、公知の各種確認方法(例えば特開2002−176973号公報)により確認することができる。
多分化能の確認方法としては、例えば、培養系で血液前駆細胞、神経細胞、又は肝細胞に分化させ、Flk−1(血管内皮マーカー)、CD45若しくはCD34(血球マーカー)、GFAP(glial fibrillary acidic protein)(星状膠細胞マーカー)、ネスチン(Nestin)(神経幹細胞マーカー)、アルブミン若しくはサイトケラチン18(幹細胞マーカー)に対する抗体で染色してその多分化能を確認する方法、あるいは、ヒト幹細胞にマーカー遺伝子となる強化緑色蛍光タンパク質(EGFP)遺伝子を導入し、EGFP遺伝子導入肝細胞を先天性胸腺欠損マウスの皮下組織に移植し、テラトカルシノーマ形成能の有無及び形成されたカルシノーマを組織学的に解析することにより確認する方法などを挙げることができる。
更には、本発明のヒト幹細胞にマーカー遺伝子となる、例えばEGFP遺伝子を導入し、EGFP導入ヒト幹細胞とヒト以外の動物胚とでキメラ胚を作成し、そのキメラ胚を体外培養あるいは仮親に移植し発達させた後、培養キメラ胚、又は移植されたキメラ胎児を蛍光顕微鏡で観察することにより、EGFP遺伝子導入ヒト幹細胞のキメラ胚三胚葉における寄与状態を調べることにより、多分化能力を確認することができる。
多分化能の確認方法としては、例えば、培養系で血液前駆細胞、神経細胞、又は肝細胞に分化させ、Flk−1(血管内皮マーカー)、CD45若しくはCD34(血球マーカー)、GFAP(glial fibrillary acidic protein)(星状膠細胞マーカー)、ネスチン(Nestin)(神経幹細胞マーカー)、アルブミン若しくはサイトケラチン18(幹細胞マーカー)に対する抗体で染色してその多分化能を確認する方法、あるいは、ヒト幹細胞にマーカー遺伝子となる強化緑色蛍光タンパク質(EGFP)遺伝子を導入し、EGFP遺伝子導入肝細胞を先天性胸腺欠損マウスの皮下組織に移植し、テラトカルシノーマ形成能の有無及び形成されたカルシノーマを組織学的に解析することにより確認する方法などを挙げることができる。
更には、本発明のヒト幹細胞にマーカー遺伝子となる、例えばEGFP遺伝子を導入し、EGFP導入ヒト幹細胞とヒト以外の動物胚とでキメラ胚を作成し、そのキメラ胚を体外培養あるいは仮親に移植し発達させた後、培養キメラ胚、又は移植されたキメラ胎児を蛍光顕微鏡で観察することにより、EGFP遺伝子導入ヒト幹細胞のキメラ胚三胚葉における寄与状態を調べることにより、多分化能力を確認することができる。
本発明のヒト幹細胞は、例えば、本発明のヒト幹細胞樹立方法、すなわち、ヒト胎盤又は羊膜から得られた細胞を、所定の培地で培養し、コロニーを形成させることにより樹立することができる。例えば、無菌的に取り出したヒト胎盤又は羊膜を機械的に予め細切した後、プロテアーゼ(例えば、トリプシン)処理により各細胞まで解離させた後、以下の培養に使用することができる。
本発明のヒト幹細胞樹立方法では、培地として、MEMα培地に、牛胎児血清(FCS)、上皮細胞成長因子(EGF)、及び白血病阻害因子(LIF)を添加した培地(以下、樹立用培地と称する)を使用する。前記樹立用培地に添加する各成分の添加量は、例えば、FCSは5〜10%、EGFは10〜50ng/mL、LIFは10〜50ng/mLであることができる。
本発明の樹立方法では、前記樹立用培地を用いて、適当な培養容器(例えば、プラスチック4ウェル皿)上で培養してコロニーを形成させる。培養条件は、通常の動物培養細胞の培養に用いられる一般的な培養条件をそのまま適用することができ、例えば、36.5〜37.5℃(好ましくは37℃)及び5%CO2の条件化で培養を実施することができる。
初代培養では、培養開始から3〜4日後に、双極性の形態を有した間葉系細胞コロニーが出現する。培養開始から7〜10日間でコンフルエントに達した後、トリプシン処理によって細胞を培地から剥がし、剥がれた細胞を個々の細胞に分散させた後、初代培養で用いた培地(すなわち、樹立用培地)で再培養を行う。培養細胞中には繊維芽細胞とは異なる双極性又は多極性の形態を有する細胞(径30〜60μm)がわずかに出現するが、これらの細胞をピペットを用いて取り出し、トリプシンで分離せず塊のまま新しい培養皿に移しかえ、初代培養と同一条件でコンフルエントになるまで培養を継続する。1日に1回分裂する特徴を有するこの細胞が培養条件を変えることで、神経、皮膚、消化管等、種々の細胞組織に分化できる多能性を有するヒト幹細胞である。
初代培養では、培養開始から3〜4日後に、双極性の形態を有した間葉系細胞コロニーが出現する。培養開始から7〜10日間でコンフルエントに達した後、トリプシン処理によって細胞を培地から剥がし、剥がれた細胞を個々の細胞に分散させた後、初代培養で用いた培地(すなわち、樹立用培地)で再培養を行う。培養細胞中には繊維芽細胞とは異なる双極性又は多極性の形態を有する細胞(径30〜60μm)がわずかに出現するが、これらの細胞をピペットを用いて取り出し、トリプシンで分離せず塊のまま新しい培養皿に移しかえ、初代培養と同一条件でコンフルエントになるまで培養を継続する。1日に1回分裂する特徴を有するこの細胞が培養条件を変えることで、神経、皮膚、消化管等、種々の細胞組織に分化できる多能性を有するヒト幹細胞である。
得られた細胞に関して、(a)核型、(b)未分化状態での増殖性、(c)アルカリホスファターゼ活性の有無、(d)Rex−1、Oct−4、及びEcat−4の発現性、並びに(e)多分化能の有無を分析することにより、得られた細胞が本発明のヒト幹細胞であることを確認する。すなわち、(a)正常2倍体の核型を有し、(b)未分化状態での増殖を継続し、(c)アルカリホスファターゼ活性が陽性であり、(d)転写因子Rex−1、Oct−4、及びEcat−4が発現し、(e)多分化能力を維持しながら30回以上の継代が可能であれば、本発明のヒト幹細胞である。
本発明の樹立方法における好ましい態様は、
(i)ヒト胎盤又は羊膜より得られた細胞を、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として継代培養し、双極性又は多極性の形態を有する細胞コロニーを得る工程、
(ii)前記細胞塊を取り出し、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として培養し、球形又は楕円形の形態を有する細胞からなるコロニーを得る工程、並びに
(iii)前記工程(ii)で得られた細胞に関して、(a)核型、(b)未分化状態での増殖性、(c)アルカリホスファターゼ活性の有無、(d)Rex−1、Oct−4、及びEcat−4の発現性、並びに(e)多分化能の有無を分析する工程
を含む。
(i)ヒト胎盤又は羊膜より得られた細胞を、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として継代培養し、双極性又は多極性の形態を有する細胞コロニーを得る工程、
(ii)前記細胞塊を取り出し、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として培養し、球形又は楕円形の形態を有する細胞からなるコロニーを得る工程、並びに
(iii)前記工程(ii)で得られた細胞に関して、(a)核型、(b)未分化状態での増殖性、(c)アルカリホスファターゼ活性の有無、(d)Rex−1、Oct−4、及びEcat−4の発現性、並びに(e)多分化能の有無を分析する工程
を含む。
本発明には、本発明のヒト幹細胞に、任意の所望の外来遺伝子を導入することにより得ることができるヒト形質転換体(すなわち、遺伝子導入細胞)が含まれる。本発明のヒト幹細胞への遺伝子導入方法としては、公知の遺伝子導入法、例えば、市販の遺伝子導入試薬[例えば、FuGene(ロシュ)又はEffectene(キアゲン)]を用いる方法を挙げることができる。
また、本発明には、本発明のヒト幹細胞又は形質転換体に由来する分化細胞、分化組織、又は臓器が含まれる。前記組織又は臓器としては、例えば、神経、筋肉(例えば、心筋又は骨格筋)、消化管、肝臓、膵臓、皮膚、血球、骨髄、又は血管等を挙げることができる。本発明の分化細胞、分化組織、又は臓器は、本発明のヒト幹細胞又は形質転換体を用いること以外は、その目的に応じて、公知の分化方法を適宜選択することにより、得ることができる。
更に、本発明には、本発明のヒト幹細胞又は形質転換体に由来するヒト−動物(例えば、哺乳動物、例えば、マウス、ラット、ウシ、ウマ、ブタ、サル)キメラ胚、キメラ胎児、又はキメラ個体が含まれる。本発明のキメラ胚、キメラ胎児、又はキメラ個体は、本発明のヒト幹細胞又は形質転換体を用いること以外は、その目的に応じて、公知の作出方法を適宜選択することにより、得ることができる。
例えば、後述の実施例3にも具体的に記載したように、ヒト幹細胞又はそれに遺伝子を導入した形質転換体(実施例3ではEGFP導入ヒト幹細胞)とヒト以外の動物胚(実施例3ではマウス胚)とでキメラ胚を作成し、そのキメラ胚を体外培養あるいは仮親に移植し発達させることにより、培養キメラ胚、キメラ胎児、又はキメラ個体(実施例3ではキメラ胚)を得ることができる。
より詳細には、例えば、ヒト幹細胞10〜15個を、8〜16細胞期の動物受精胚中の割球あるいは囲卵腔との空隙に注入してキメラ胚を作成した後、適当な培地にて胚盤胞にまで発達させ、仮親動物の子宮内に移植することによりキメラ個体を得ることができる。
例えば、後述の実施例3にも具体的に記載したように、ヒト幹細胞又はそれに遺伝子を導入した形質転換体(実施例3ではEGFP導入ヒト幹細胞)とヒト以外の動物胚(実施例3ではマウス胚)とでキメラ胚を作成し、そのキメラ胚を体外培養あるいは仮親に移植し発達させることにより、培養キメラ胚、キメラ胎児、又はキメラ個体(実施例3ではキメラ胚)を得ることができる。
より詳細には、例えば、ヒト幹細胞10〜15個を、8〜16細胞期の動物受精胚中の割球あるいは囲卵腔との空隙に注入してキメラ胚を作成した後、適当な培地にて胚盤胞にまで発達させ、仮親動物の子宮内に移植することによりキメラ個体を得ることができる。
本発明には、本発明のヒト幹細胞を用いた種々の方法が含まれる。例えば、本発明には、拒絶反応を抑えるために骨髄細胞に分化させた幹細胞を、移植用に分化させた臓器細胞と同時に患者に移植する方法が含まれる。例えば、心筋梗塞の患者に同一株でありながら自発性拍動を行う迄に分化させたヒト幹細胞と、骨髄細胞に分化させた幹細胞とを同時に移植することで、拒絶反応を抑制することができる。
本発明方法では、例えば、冠状動脈の壊死に対し、心筋細胞や血管内皮の再生を誘導するために、本発明の幹細胞を、例えば、静脈内への注射、あるいは、カテーテルでの心室内への投与を行うことができる。細胞投与量は、例えば、1000〜10万個とすることができる(例えば、特表2002−507407号公報)。
本発明方法では、例えば、冠状動脈の壊死に対し、心筋細胞や血管内皮の再生を誘導するために、本発明の幹細胞を、例えば、静脈内への注射、あるいは、カテーテルでの心室内への投与を行うことができる。細胞投与量は、例えば、1000〜10万個とすることができる(例えば、特表2002−507407号公報)。
以下、実施例によって本発明を具体的に説明するが、これらは本発明の範囲を限定するものではない。
実施例1:胎盤又は羊膜由来ヒト幹細胞の取得
帝王切開により無菌的に取り出したヒト新生子の胎盤及び羊膜を、それぞれ、滅菌した外科用鋏で約0.5〜1cm2に切断し、70%エタノールを噴霧し火炎滅菌を行なった後、抗生物質添加PBS(−)(Dulbecco,Ca及びMg不含)(ペニシリン2000単位/mL;明治製菓、ストレプトマイシン100μg/mL;明治製菓、及びファンギゾン25μg/mL;Gibco BRL)で数回洗浄した。滅菌ペトリ皿上で前記サンプルを更に1〜2mm2程度に細切後、0.25%トリプシン及び0.1%EDTA(Gibco BRL)水溶液のドロップ中で37℃及び5%CO2条件下で10分間培養した。このサンプルの入ったトリプシン液を5mLの前記PBS(−)で希釈し、遠心分離(1000rpm,5分間)後、沈殿を5mLのPBS(−)で懸濁後、再度、同条件で遠心分離した。
帝王切開により無菌的に取り出したヒト新生子の胎盤及び羊膜を、それぞれ、滅菌した外科用鋏で約0.5〜1cm2に切断し、70%エタノールを噴霧し火炎滅菌を行なった後、抗生物質添加PBS(−)(Dulbecco,Ca及びMg不含)(ペニシリン2000単位/mL;明治製菓、ストレプトマイシン100μg/mL;明治製菓、及びファンギゾン25μg/mL;Gibco BRL)で数回洗浄した。滅菌ペトリ皿上で前記サンプルを更に1〜2mm2程度に細切後、0.25%トリプシン及び0.1%EDTA(Gibco BRL)水溶液のドロップ中で37℃及び5%CO2条件下で10分間培養した。このサンプルの入ったトリプシン液を5mLの前記PBS(−)で希釈し、遠心分離(1000rpm,5分間)後、沈殿を5mLのPBS(−)で懸濁後、再度、同条件で遠心分離した。
得られた沈殿を、10%FCS(Gibco BRL)と抗生物質及び抗菌剤(ペニシリン、ストレプトマイシン、及びファンギゾン)を含有し、更に10ng/mL−EGF(Sigma)、10ng/mL−LIF(Sigma)を加えたMEMα(Gibco BRL)を各ウェルに500μLずつ入れた4ウェル皿(Nunc)上で、37.0℃及び5%CO2の条件下で培養を続けた。
培養3〜4日後に細切されたサンプルの周囲又はウェル中に双極性の形態を有する間葉系細胞がコロニーとなって出現した。更に4〜7日間程度培養を続け、コンフルエントに達した時点でトリプシン液で約6〜7分間処理した後、ピペットを用いて細胞を解離した。解離後、PBS(−)で希釈し、遠心分離を2回行なって洗浄した後、得られた沈殿を前記と同じ培養条件で4ウェル皿上に1/4〜1/5濃度で蒔いた(第1継代)。
培養3〜4日後に細切されたサンプルの周囲又はウェル中に双極性の形態を有する間葉系細胞がコロニーとなって出現した。更に4〜7日間程度培養を続け、コンフルエントに達した時点でトリプシン液で約6〜7分間処理した後、ピペットを用いて細胞を解離した。解離後、PBS(−)で希釈し、遠心分離を2回行なって洗浄した後、得られた沈殿を前記と同じ培養条件で4ウェル皿上に1/4〜1/5濃度で蒔いた(第1継代)。
培養細胞中には繊維芽細胞とは異なる双極性又は多極性の形態を有する細胞(径30〜60μm)がわずかに出現した。これらの細胞をピペットを用いて取り出し、トリプシンで分離せず塊のまま新しい培養皿に移しかえ、初代培養と同一条件でコンフルエントになるまで培養を継続した。これらの細胞をES細胞としての各種マーカーによるスクリーニング及び継代を、特開2002−176973号公報に記載の手順に従って実施することで、ヒト未分化幹細胞株を樹立することができた(Ham1〜Ham8)。この内、Ham1及びHam4〜Ham8は羊膜由来であり、Ham2及びHam3は胎盤由来である。
具体的には、未分化マーカーとしては、(1)アルカリホスファターゼ活性が陽性であること、(2)転写因子Oct−4、Rex−1、Ecat−4が発現することを確認すると共に、継代20代で正常核型(46XX又は46XY)であることを確認した。可能継代数については少なくとも60代までは継代が可能であることを確認した。
具体的には、未分化マーカーとしては、(1)アルカリホスファターゼ活性が陽性であること、(2)転写因子Oct−4、Rex−1、Ecat−4が発現することを確認すると共に、継代20代で正常核型(46XX又は46XY)であることを確認した。可能継代数については少なくとも60代までは継代が可能であることを確認した。
多分化能力に関しては、継代数20の胎盤又は羊膜由来ヒト幹細胞(Ham1〜8)を、EGF、FGF(繊維芽細胞成長因子)2、及びFGF9を各々20ng/mL濃度で含有するMEMα培地で10日〜30日間培養させた結果、それぞれ、星状膠細胞マーカー及び神経幹細胞マーカーであるGFAP抗体及びネスチン抗体と抗体陽性反応を示す神経細胞が検出された。
更に、ヒト幹細胞(Ham1〜8)を血管内皮細胞増殖因子(VEGF)を50ng/mL濃度で含有し、FCS10%を添加したMEMα培地で14日間程培養することにより、血管内皮系の表現形を示すものや、血球系の表現形を示す細胞コロニーが出現し、それぞれ血管内皮マーカーであるFlk−1抗体、血球マーカーであるCD45抗体及びCD31抗体に陽性反応を示した。また、ヒト幹細胞(Ham1〜Ham8)をFGF4を20ng/mL、肝細胞増殖因子(HGF)を20ng/mL濃度で含有し、FCS10%添加のMEMα培地で14日間培養することにより、約50%がアルブミン抗体及びサイトケラチン18抗体に陽性の肝細胞表現形となった。
なお、各種抗体及び細胞増殖因子はSigmaより購入した。
以上の結果により、胎盤又は羊膜由来ヒト幹細胞が培養系で多分化能力を有することが証明された。
更に、ヒト幹細胞(Ham1〜8)を血管内皮細胞増殖因子(VEGF)を50ng/mL濃度で含有し、FCS10%を添加したMEMα培地で14日間程培養することにより、血管内皮系の表現形を示すものや、血球系の表現形を示す細胞コロニーが出現し、それぞれ血管内皮マーカーであるFlk−1抗体、血球マーカーであるCD45抗体及びCD31抗体に陽性反応を示した。また、ヒト幹細胞(Ham1〜Ham8)をFGF4を20ng/mL、肝細胞増殖因子(HGF)を20ng/mL濃度で含有し、FCS10%添加のMEMα培地で14日間培養することにより、約50%がアルブミン抗体及びサイトケラチン18抗体に陽性の肝細胞表現形となった。
なお、各種抗体及び細胞増殖因子はSigmaより購入した。
以上の結果により、胎盤又は羊膜由来ヒト幹細胞が培養系で多分化能力を有することが証明された。
実施例2:胎盤又は羊膜由来ヒト幹細胞への遺伝子導入
本実施例では、本発明のヒト幹細胞への遺伝子導入を実施した。
遺伝子導入に使用したDNA断片は以下の手順で調製した。すなわち、サイトメガロウイルスエンハンサー、ニワトリβ−アクチンプロモーター、ウサギβグロビン配列、ネオマイシン耐性遺伝子、及び強化緑色蛍光タンパク質(EGFP)cDNAを含む遺伝子ベクターを、定法によりサブクローン化した後、PVUI/HindIIIで消化して得られたDNA断片を1%アガロースゲル電気泳動によりベクターから分離し、精製した。精製遺伝子断片は、10mmol/L−Tris−HCl/10mmol/L−EDTA液中に、1μg/μLの濃度になるように溶解し、遺伝子導入に使用するまで凍結保存した。
本実施例では、本発明のヒト幹細胞への遺伝子導入を実施した。
遺伝子導入に使用したDNA断片は以下の手順で調製した。すなわち、サイトメガロウイルスエンハンサー、ニワトリβ−アクチンプロモーター、ウサギβグロビン配列、ネオマイシン耐性遺伝子、及び強化緑色蛍光タンパク質(EGFP)cDNAを含む遺伝子ベクターを、定法によりサブクローン化した後、PVUI/HindIIIで消化して得られたDNA断片を1%アガロースゲル電気泳動によりベクターから分離し、精製した。精製遺伝子断片は、10mmol/L−Tris−HCl/10mmol/L−EDTA液中に、1μg/μLの濃度になるように溶解し、遺伝子導入に使用するまで凍結保存した。
実施例1で樹立したヒト幹細胞(Ham−1)を用いて、その継代数15のヒト幹細胞を凍結融解後、4ウェル皿(Nunc)1枚に播種し、脂質をベースとする市販の遺伝子導入試薬(FuGene;ロシュ)と前記遺伝子断片との共培養により、ヒト幹細胞への遺伝子導入を実施した。
すなわち、
(1)血清不含のMEMα培地80μLを滅菌済試験管に注入し、
(2)更にFuGene5μLを添加し、よく混和し、
(3)前記混合液にDNA2μLを添加し、よく混和後30分間程室温培養し、
(4)遺伝子導入処置のために、DNA−FuGene混合液20μLを取り、培養ヒト幹細胞の入った各ウェルに同量ずつ添加し、
(5)DNA−Reagent混合液添加培地中で、少なくとも24時間、最長で48時間程度培養を続け、
(6)続いて、ネオマイシン系抗生物質G418を400μg/mL濃度で含むFCS含有MEMα培地で7〜10日間培養することにより、遺伝子導入ヒト幹細胞だけを選択した。更に通常培地に切り替えて継代を重ねた後(継代数=17〜60)、遺伝子導入ヒト幹細胞を凍結保存した。
(1)血清不含のMEMα培地80μLを滅菌済試験管に注入し、
(2)更にFuGene5μLを添加し、よく混和し、
(3)前記混合液にDNA2μLを添加し、よく混和後30分間程室温培養し、
(4)遺伝子導入処置のために、DNA−FuGene混合液20μLを取り、培養ヒト幹細胞の入った各ウェルに同量ずつ添加し、
(5)DNA−Reagent混合液添加培地中で、少なくとも24時間、最長で48時間程度培養を続け、
(6)続いて、ネオマイシン系抗生物質G418を400μg/mL濃度で含むFCS含有MEMα培地で7〜10日間培養することにより、遺伝子導入ヒト幹細胞だけを選択した。更に通常培地に切り替えて継代を重ねた後(継代数=17〜60)、遺伝子導入ヒト幹細胞を凍結保存した。
実施例3:遺伝子導入ヒト幹細胞の多能性の確認
本実施例では、実施例2で得られたEGFP導入ヒト幹細胞と、動物胚(ddYマウス)とでキメラ胚を作成し、培養系で多分化能力を試験した。
凍結融解した継代数17のEGFP導入ヒト幹細胞を1日〜2日間培養した後、0.25%トリプシン−EDTA液(Gibco BRL)で5分間処理し、培養皿より剥離させた。蛍光顕微鏡下で発光ヒト幹細胞を10〜15個ずつマイクロピペットに吸引し、8〜16細胞期のマウス受精胚中の割球と囲卵腔との空隙に注入することにより、キメラ胚を作成した。
本実施例では、実施例2で得られたEGFP導入ヒト幹細胞と、動物胚(ddYマウス)とでキメラ胚を作成し、培養系で多分化能力を試験した。
凍結融解した継代数17のEGFP導入ヒト幹細胞を1日〜2日間培養した後、0.25%トリプシン−EDTA液(Gibco BRL)で5分間処理し、培養皿より剥離させた。蛍光顕微鏡下で発光ヒト幹細胞を10〜15個ずつマイクロピペットに吸引し、8〜16細胞期のマウス受精胚中の割球と囲卵腔との空隙に注入することにより、キメラ胚を作成した。
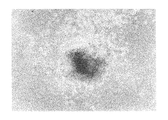
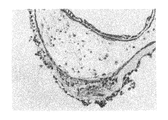
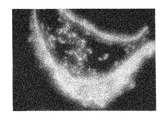
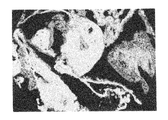
ヒト幹細胞を注入した30個のキメラ胚のうち、胚盤胞以降にまで発達したのは19個(63%)であり、培養3週間で、3胚葉においてEGFP遺伝子が発現したものは14個〜18個に認められた(表3「ヒト幹細胞の子孫細胞を有するマウス胚組織のキメラ率」及び図1〜図5)。更にこれらキメラ胚を有する胚を4%ホルマリンで固定後、スライド標本に作製し、組織学的にヒト幹細胞の多分化能力を解析した。その結果、白血球、表皮、真皮、骨、及び消化管等にEGFP導入ヒト幹細胞の存在を示す蛍光が認められた(図6〜図11)。
キメラ占有率はおよそ40〜70%であった。これらの結果により、ヒト幹細胞が明らかに全胚葉への多分化能力を有していることが証明された。
キメラ占有率はおよそ40〜70%であった。これらの結果により、ヒト幹細胞が明らかに全胚葉への多分化能力を有していることが証明された。
実施例4:ヒト幹細胞の先天性胸腺欠損マウス(すなわち、ヌードマウス)への生体内移植
ヒト幹細胞の免疫不全症ヌードマウス体内での腫瘍形成能を確認するため、6〜8週齢のヌードマウス皮下組織におよそ5〜8×106個ずつ25G針を用い注入した。マウスは2箇月後屠殺したところ、移植された10頭のうち8頭で腫瘍形成が認められ、それらを摘出後全組織標本を作成し、組織学的な検査を行なった。それらの標本には、3胚葉全ての組織(神経膠、骨、上皮様組織、及び消化管)が形成されており、ヒト幹細胞の多分化能力が確認された。また、実施例1で樹立した胎盤又は羊膜由来ヒト幹細胞Ham2〜8についても同様の工程を実施することにより、同様の結果を得ることができた。
ヒト幹細胞の免疫不全症ヌードマウス体内での腫瘍形成能を確認するため、6〜8週齢のヌードマウス皮下組織におよそ5〜8×106個ずつ25G針を用い注入した。マウスは2箇月後屠殺したところ、移植された10頭のうち8頭で腫瘍形成が認められ、それらを摘出後全組織標本を作成し、組織学的な検査を行なった。それらの標本には、3胚葉全ての組織(神経膠、骨、上皮様組織、及び消化管)が形成されており、ヒト幹細胞の多分化能力が確認された。また、実施例1で樹立した胎盤又は羊膜由来ヒト幹細胞Ham2〜8についても同様の工程を実施することにより、同様の結果を得ることができた。
本発明のヒト幹細胞は、例えば、種々の組織若しくは器官の障害又は疾病に罹患した患者の移植医療用臓器の材料として利用することができる。
Claims (6)
- 以下の細胞生物学的特徴を有することを特徴とする、ヒト幹細胞。
(1)ヒト胎盤又は羊膜由来である。
(2)正常2倍体の核型を有する。
(3)未分化状態での増殖を継続する。
(4)アルカリホスファターゼ活性が陽性である。
(5)転写因子Rex−1、Oct−4、及びEcat−4が発現する。
(6)多分化能力を維持しながら30回以上の継代が可能である。 - ヒト胎盤又は羊膜より得られた細胞を、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として培養し、コロニーを形成させることを特徴とする、ヒト幹細胞の樹立方法。
- ヒト胎盤又は羊膜より得られた細胞を、牛胎児血清、上皮細胞成長因子、及び白血病阻害因子を含有するMEMαを培地として培養し、コロニーを形成させ、このコロニーを、(a)核型、(b)未分化状態での増殖性、(c)アルカリホスファターゼ活性の有無、(d)Rex−1、Oct−4、及びEcat−4の発現性、並びに(e)多分化能の有無を指標にスクリーニングすることを特徴とする、ヒト幹細胞の樹立方法。
- 請求項1に記載のヒト幹細胞に、外来遺伝子を導入することにより得ることのできる、ヒト形質転換体。
- 請求項1に記載のヒト幹細胞又は請求項4に記載のヒト形質転換体に由来する、ヒト分化細胞、ヒト分化組織、又はヒト臓器。
- 請求項1に記載のヒト幹細胞又は請求項4に記載のヒト形質転換体に由来する、ヒト−動物キメラ胚、キメラ胎児、又はキメラ個体。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003397524A JP2005151907A (ja) | 2003-11-27 | 2003-11-27 | 胎盤又は羊膜由来ヒト幹細胞及びその樹立方法並びに臓器への分化誘導方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003397524A JP2005151907A (ja) | 2003-11-27 | 2003-11-27 | 胎盤又は羊膜由来ヒト幹細胞及びその樹立方法並びに臓器への分化誘導方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005151907A true JP2005151907A (ja) | 2005-06-16 |
| JP2005151907A5 JP2005151907A5 (ja) | 2006-02-02 |
Family
ID=34722656
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003397524A Pending JP2005151907A (ja) | 2003-11-27 | 2003-11-27 | 胎盤又は羊膜由来ヒト幹細胞及びその樹立方法並びに臓器への分化誘導方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005151907A (ja) |
Cited By (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008509699A (ja) * | 2004-08-16 | 2008-04-03 | セルリサーチ コーポレイション ピーティイー リミテッド | 臍帯羊膜からの幹/前駆細胞の単離 |
| US7682803B2 (en) | 2005-10-13 | 2010-03-23 | Anthrogenesis Corporation | Immunomodulation using placental stem cells |
| US7700090B2 (en) | 2002-02-13 | 2010-04-20 | Anthrogenesis Corporation | Co-culture of placental stem cells and stem cells from a second source |
| US7914779B2 (en) | 2001-02-14 | 2011-03-29 | Anthrogenesis Corporation | Tissue matrices comprising placental stem cells, and methods of making the same |
| US7976836B2 (en) | 2000-12-06 | 2011-07-12 | Anthrogenesis Corporation | Treatment of stroke using placental stem cells |
| US8057789B2 (en) | 2002-02-13 | 2011-11-15 | Anthrogenesis Corporation | Placental stem cells derived from post-partum mammalian placenta, and uses and methods of treatment using said cells |
| US8057788B2 (en) | 2000-12-06 | 2011-11-15 | Anthrogenesis Corporation | Placental stem cell populations |
| US8263065B2 (en) | 2007-09-28 | 2012-09-11 | Anthrogenesis Corporation | Tumor suppression using human placental perfusate and human placenta-derived intermediate natural killer cells |
| US8367409B2 (en) | 2008-11-19 | 2013-02-05 | Anthrogenesis Corporation | Amnion derived adherent cells |
| US8460650B2 (en) | 2007-02-12 | 2013-06-11 | Anthrogenesis Corporation | Treatment of inflammatory diseases using placental stem cells |
| US8562972B2 (en) | 2006-10-23 | 2013-10-22 | Anthrogenesis Corporation | Methods and compositions for treatment of bone defects with placental cell populations |
| US8562973B2 (en) | 2010-04-08 | 2013-10-22 | Anthrogenesis Corporation | Treatment of sarcoidosis using placental stem cells |
| US8728805B2 (en) | 2008-08-22 | 2014-05-20 | Anthrogenesis Corporation | Methods and compositions for treatment of bone defects with placental cell populations |
| WO2014132936A1 (ja) * | 2013-02-28 | 2014-09-04 | 国立大学法人 富山大学 | 胎盤・胎盤周囲組織幹細胞の選択的増幅方法 |
| US8828376B2 (en) | 2008-08-20 | 2014-09-09 | Anthrogenesis Corporation | Treatment of stroke using isolated placental cells |
| JP2014230521A (ja) * | 2013-05-29 | 2014-12-11 | 国立大学法人 東京医科歯科大学 | 細胞のリプログラミングのための組成物 |
| US8926964B2 (en) | 2010-07-13 | 2015-01-06 | Anthrogenesis Corporation | Methods of generating natural killer cells |
| US9040035B2 (en) | 2011-06-01 | 2015-05-26 | Anthrogenesis Corporation | Treatment of pain using placental stem cells |
| US9121007B2 (en) | 2010-01-26 | 2015-09-01 | Anthrogenesis Corporatin | Treatment of bone-related cancers using placental stem cells |
| US9254302B2 (en) | 2010-04-07 | 2016-02-09 | Anthrogenesis Corporation | Angiogenesis using placental stem cells |
| US9663765B2 (en) | 2009-11-12 | 2017-05-30 | Vbi Technologies, L.L.C. | Subpopulations of spore-like cells and uses thereof |
| US9763983B2 (en) | 2013-02-05 | 2017-09-19 | Anthrogenesis Corporation | Natural killer cells from placenta |
| US10104880B2 (en) | 2008-08-20 | 2018-10-23 | Celularity, Inc. | Cell composition and methods of making the same |
| JP7454379B2 (ja) | 2017-12-28 | 2024-03-22 | 株式会社カネカ | 接着性幹細胞を含む細胞集団とその製造方法、及び医薬組成物 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7993918B2 (en) | 2006-08-04 | 2011-08-09 | Anthrogenesis Corporation | Tumor suppression using placental stem cells |
| AR093183A1 (es) | 2010-12-31 | 2015-05-27 | Anthrogenesis Corp | Aumento de la potencia de celulas madre de placenta usando moleculas de arn moduladoras |
-
2003
- 2003-11-27 JP JP2003397524A patent/JP2005151907A/ja active Pending
Cited By (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9149569B2 (en) | 2000-12-06 | 2015-10-06 | Anthrogenesis Corporation | Treatment of diseases or disorders using placental stem cells |
| US7976836B2 (en) | 2000-12-06 | 2011-07-12 | Anthrogenesis Corporation | Treatment of stroke using placental stem cells |
| US8057788B2 (en) | 2000-12-06 | 2011-11-15 | Anthrogenesis Corporation | Placental stem cell populations |
| US8580563B2 (en) | 2000-12-06 | 2013-11-12 | Anthrogenesis Corporation | Placental stem cells |
| US8293223B2 (en) | 2000-12-06 | 2012-10-23 | Anthrogenesis Corporation | Treatment of organ injuries and burns using placental stem cells |
| US8545833B2 (en) | 2000-12-06 | 2013-10-01 | Anthrogenesis Corporation | Treatment of radiation injury using placental stem cells |
| US8435788B2 (en) | 2001-02-14 | 2013-05-07 | Anthrogenesis Corporation | Tissue matrices comprising placental stem cells |
| US7914779B2 (en) | 2001-02-14 | 2011-03-29 | Anthrogenesis Corporation | Tissue matrices comprising placental stem cells, and methods of making the same |
| US9139813B2 (en) | 2001-02-14 | 2015-09-22 | Anthrogenesis Corporation | Renovation and repopulation of decellularized tissues and cadaveric organs by stem cells |
| US7700090B2 (en) | 2002-02-13 | 2010-04-20 | Anthrogenesis Corporation | Co-culture of placental stem cells and stem cells from a second source |
| US8057789B2 (en) | 2002-02-13 | 2011-11-15 | Anthrogenesis Corporation | Placental stem cells derived from post-partum mammalian placenta, and uses and methods of treatment using said cells |
| US8753883B2 (en) | 2002-02-13 | 2014-06-17 | Anthrogenesis Corporation | Treatment of psoriasis using placental stem cells |
| US9737568B2 (en) | 2004-08-16 | 2017-08-22 | Cellresearch Corporation Pte Ltd | Isolation, cultivation and uses of stem/progenitor cells |
| US10363275B2 (en) | 2004-08-16 | 2019-07-30 | Cellresearch Corporation Pte Ltd | Isolation, cultivation and uses of stem/progenitor cells |
| US9085755B2 (en) | 2004-08-16 | 2015-07-21 | Cellresearch Corporation Pte Ltd. | Isolation, cultivation and uses of stem/progenitor cells |
| JP2008509699A (ja) * | 2004-08-16 | 2008-04-03 | セルリサーチ コーポレイション ピーティイー リミテッド | 臍帯羊膜からの幹/前駆細胞の単離 |
| JP2013066473A (ja) * | 2004-08-16 | 2013-04-18 | Cellresearch Corp Pte Ltd | 臍帯羊膜からの幹/前駆細胞の単離 |
| US8216566B2 (en) | 2005-10-13 | 2012-07-10 | Anthrogenesis Corporation | Treatment of multiple sclerosis using placental stem cells |
| US9539288B2 (en) | 2005-10-13 | 2017-01-10 | Anthrogenesis Corporation | Immunomodulation using placental stem cells |
| US7682803B2 (en) | 2005-10-13 | 2010-03-23 | Anthrogenesis Corporation | Immunomodulation using placental stem cells |
| US8895256B2 (en) | 2005-10-13 | 2014-11-25 | Anthrogenesis Corporation | Immunomodulation using placental stem cells |
| US8591883B2 (en) | 2005-12-29 | 2013-11-26 | Anthrogenesis Corporation | Placental stem cell populations |
| US8691217B2 (en) | 2005-12-29 | 2014-04-08 | Anthrogenesis Corporation | Placental stem cell populations |
| US8455250B2 (en) | 2005-12-29 | 2013-06-04 | Anthrogenesis Corporation | Co-culture of placental stem cells and stem cells from a second source |
| US10383897B2 (en) | 2005-12-29 | 2019-08-20 | Celularity, Inc. | Placental stem cell populations |
| US8202703B2 (en) | 2005-12-29 | 2012-06-19 | Anthrogenesis Corporation | Placental stem cell populations |
| US9078898B2 (en) | 2005-12-29 | 2015-07-14 | Anthrogenesis Corporation | Placental stem cell populations |
| US10105399B2 (en) | 2006-10-23 | 2018-10-23 | Celularity, Inc. | Methods and compositions for treatment of bone defects with placental cell populations |
| US9339520B2 (en) | 2006-10-23 | 2016-05-17 | Anthrogenesis Corporation | Methods and compositions for treatment of bone defects with placental cell populations |
| US8562972B2 (en) | 2006-10-23 | 2013-10-22 | Anthrogenesis Corporation | Methods and compositions for treatment of bone defects with placental cell populations |
| US8916146B2 (en) | 2007-02-12 | 2014-12-23 | Anthrogenesis Corporation | Treatment of inflammatory diseases using placental stem cells |
| US8460650B2 (en) | 2007-02-12 | 2013-06-11 | Anthrogenesis Corporation | Treatment of inflammatory diseases using placental stem cells |
| US9216200B2 (en) | 2007-09-28 | 2015-12-22 | Anthrogenesis Corporation | Tumor suppression using human placental perfusate and human placenta-derived intermediate natural killer cells |
| US8263065B2 (en) | 2007-09-28 | 2012-09-11 | Anthrogenesis Corporation | Tumor suppression using human placental perfusate and human placenta-derived intermediate natural killer cells |
| US8828376B2 (en) | 2008-08-20 | 2014-09-09 | Anthrogenesis Corporation | Treatment of stroke using isolated placental cells |
| US10104880B2 (en) | 2008-08-20 | 2018-10-23 | Celularity, Inc. | Cell composition and methods of making the same |
| US8728805B2 (en) | 2008-08-22 | 2014-05-20 | Anthrogenesis Corporation | Methods and compositions for treatment of bone defects with placental cell populations |
| US9198938B2 (en) | 2008-11-19 | 2015-12-01 | Antrhogenesis Corporation | Amnion derived adherent cells |
| US8367409B2 (en) | 2008-11-19 | 2013-02-05 | Anthrogenesis Corporation | Amnion derived adherent cells |
| US9663765B2 (en) | 2009-11-12 | 2017-05-30 | Vbi Technologies, L.L.C. | Subpopulations of spore-like cells and uses thereof |
| JP2018126171A (ja) * | 2009-11-12 | 2018-08-16 | ブイビーアイ テクノロジーズ, エルエルシー | 胞子様細胞の亜集団およびその用途 |
| US9121007B2 (en) | 2010-01-26 | 2015-09-01 | Anthrogenesis Corporatin | Treatment of bone-related cancers using placental stem cells |
| US9254302B2 (en) | 2010-04-07 | 2016-02-09 | Anthrogenesis Corporation | Angiogenesis using placental stem cells |
| US8562973B2 (en) | 2010-04-08 | 2013-10-22 | Anthrogenesis Corporation | Treatment of sarcoidosis using placental stem cells |
| US9464274B2 (en) | 2010-07-13 | 2016-10-11 | Anthrogenesis Corporation | Methods of generating natural killer cells |
| US8926964B2 (en) | 2010-07-13 | 2015-01-06 | Anthrogenesis Corporation | Methods of generating natural killer cells |
| US9040035B2 (en) | 2011-06-01 | 2015-05-26 | Anthrogenesis Corporation | Treatment of pain using placental stem cells |
| US11090339B2 (en) | 2011-06-01 | 2021-08-17 | Celularity Inc. | Treatment of pain using placental stem cells |
| US9763983B2 (en) | 2013-02-05 | 2017-09-19 | Anthrogenesis Corporation | Natural killer cells from placenta |
| JPWO2014132936A1 (ja) * | 2013-02-28 | 2017-02-02 | 国立大学法人富山大学 | 胎盤・胎盤周囲組織幹細胞の選択的増幅方法 |
| WO2014132936A1 (ja) * | 2013-02-28 | 2014-09-04 | 国立大学法人 富山大学 | 胎盤・胎盤周囲組織幹細胞の選択的増幅方法 |
| JP2014230521A (ja) * | 2013-05-29 | 2014-12-11 | 国立大学法人 東京医科歯科大学 | 細胞のリプログラミングのための組成物 |
| JP7454379B2 (ja) | 2017-12-28 | 2024-03-22 | 株式会社カネカ | 接着性幹細胞を含む細胞集団とその製造方法、及び医薬組成物 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2005151907A (ja) | 胎盤又は羊膜由来ヒト幹細胞及びその樹立方法並びに臓器への分化誘導方法 | |
| JP2005151907A5 (ja) | ||
| JP4330995B2 (ja) | 絨毛膜絨毛、羊水、および胎盤からの胎児性幹細胞を単離、増殖、および分化させる方法、ならびにその治療的使用方法 | |
| JP4383896B2 (ja) | 脈管形成性の始原細胞をインビトロで同定し、単離し、または分化させるための新規な方法 | |
| Tamagawa et al. | Establishment and characterization of a pluripotent stem cell line derived from human amniotic membranes and initiation of germ layers in vitro | |
| KR101195838B1 (ko) | 분리된 전분화능 성체줄기세포 및 그의 분리 및 배양 방법 | |
| US8268302B2 (en) | Cultures, products and methods using umbilical cord matrix cells | |
| JP4950661B2 (ja) | 分娩後由来細胞類を使用する、神経組織の再生および修復 | |
| US20030161818A1 (en) | Cultures, products and methods using stem cells | |
| JP2012502653A (ja) | 人工多能性幹細胞のマーカー | |
| JP2022105142A (ja) | 哺乳動物種における誘導組織再生のための組成物および方法 | |
| US20070202596A1 (en) | Selective antibody targeting of undifferentiated stem cells | |
| JP2003512052A (ja) | 分化前駆細胞及び系統欠失胚性幹細胞の産生方法 | |
| US20080299090A1 (en) | Use Of Umbilical Cord Matrix Cells | |
| JP2005520516A (ja) | 幹細胞の特定細胞系統への分化を誘発する方法 | |
| EP1414945B1 (en) | Cell culture method for obtaining prostate-like acini | |
| JP4153878B2 (ja) | Gt遺伝子が除去された複製豚及びその生産方法 | |
| JP2003516141A (ja) | 長期細胞培養組成物とそれから誘導される遺伝的に修飾された動物 | |
| JP7148402B2 (ja) | インビトロで多能性幹細胞を分化誘導する方法 | |
| CN116157510A (zh) | 用于制造多能干细胞的材料和方法 | |
| Saxena et al. | Role of stem cell research in therapeutic purpose--a hope for new horizon in medical biotechnology. | |
| JP2005523685A (ja) | 体細胞由来胚幹細胞及びそれらの分化子孫 | |
| JP2002176973A (ja) | 哺乳動物胚性幹細胞とその樹立方法並びにその継代培養方法 | |
| JPWO2005040361A1 (ja) | 幹細胞の簡易調製法およびそれに使用するフィーダー細胞 | |
| WO2008116160A1 (en) | Use of umbilical cord matrix cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20051209 |