FR2556592A1 - Compositions pharmaceutiques contenant des derives de l'acide campho-methylidene cinnamique - Google Patents
Compositions pharmaceutiques contenant des derives de l'acide campho-methylidene cinnamique Download PDFInfo
- Publication number
- FR2556592A1 FR2556592A1 FR8418920A FR8418920A FR2556592A1 FR 2556592 A1 FR2556592 A1 FR 2556592A1 FR 8418920 A FR8418920 A FR 8418920A FR 8418920 A FR8418920 A FR 8418920A FR 2556592 A1 FR2556592 A1 FR 2556592A1
- Authority
- FR
- France
- Prior art keywords
- sep
- radical
- alkyl
- denotes
- cinnamic acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C255/00—Carboxylic acid nitriles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/41—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by hydrogenolysis or reduction of carboxylic groups or functional derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/61—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups
- C07C45/67—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups by isomerisation; by change of size of the carbon skeleton
- C07C45/68—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups by isomerisation; by change of size of the carbon skeleton by increase in the number of carbon atoms
- C07C45/72—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups by isomerisation; by change of size of the carbon skeleton by increase in the number of carbon atoms by reaction of compounds containing >C = O groups with the same or other compounds containing >C = O groups
- C07C45/74—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups by isomerisation; by change of size of the carbon skeleton by increase in the number of carbon atoms by reaction of compounds containing >C = O groups with the same or other compounds containing >C = O groups combined with dehydration
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C49/00—Ketones; Ketenes; Dimeric ketenes; Ketonic chelates
- C07C49/587—Unsaturated compounds containing a keto groups being part of a ring
- C07C49/703—Unsaturated compounds containing a keto groups being part of a ring containing hydroxy groups
- C07C49/747—Unsaturated compounds containing a keto groups being part of a ring containing hydroxy groups containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C49/00—Ketones; Ketenes; Dimeric ketenes; Ketonic chelates
- C07C49/587—Unsaturated compounds containing a keto groups being part of a ring
- C07C49/753—Unsaturated compounds containing a keto groups being part of a ring containing ether groups, groups, groups, or groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C49/00—Ketones; Ketenes; Dimeric ketenes; Ketonic chelates
- C07C49/587—Unsaturated compounds containing a keto groups being part of a ring
- C07C49/757—Unsaturated compounds containing a keto groups being part of a ring containing —CHO groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/76—Unsaturated compounds containing keto groups
- C07C59/86—Unsaturated compounds containing keto groups containing six-membered aromatic rings and other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/76—Unsaturated compounds containing keto groups
- C07C59/90—Unsaturated compounds containing keto groups containing singly bound oxygen-containing groups
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
COMPOSITIONS PHARMACEUTIQUES CONTENANT DES DERIVES DE L'ACIDE CAMPHO-METHYLIDENE CINNAMIQUE. LA PRESENTE INVENTION CONCERNE UNE COMPOSITION PHARMACEUTIQUE CONTENANT, A TITRE D'INGREDIENT ACTIF, UN DERIVE D'ACIDE CAMPHO-METHYLIDENE CINNAMIQUE DE FORMULE: (CF DESSIN DANS BOPI) DANS LAQUELLE : R DESIGNE ALKYLE EN C-C, LINEAIRE OU RAMIFIE OU ALCOXY EN C-C, N ETANT UN NOMBRE ENTIER ALLANT DE 0 A 4; LORSQUE N EST EGAL OU SUPERIEUR A 2, LES RADICAUX R PEUVENT ETRE IDENTIQUES OU DIFFERENTS, R DESIGNE H, ALKYLE EN C-C, ARYLE EVENTUELLEMENT SUBSTITUE PAR DES ATOMES D'HALOGENE OU PAR: ALKYLE OU ALCOXY EN
Description
Compositions pharmaceutiques contenant des derives de 17acide camphre méthylidène cinnamique.
La présente invention est relative a l'utilisation en tant que médica- ments, des dérivés de l'acide caspho-niethylidene cinnamique.
La demanderesse a en effet découvert que certalns dérives de l'acide campho-méthyliddne cinnamique pressentent une activite renforcée dans le traitement topique et systémique de l'acnés du psoriasis et d'autres dermatoses ou affections dernatologiques, inflammatoires et allergiques ainsi qu'une activité antitumorale.
L'invention a donc pour objet une composition pharmaceutique contenant à titre d'ingrédient actif, un composé ayant pour formule
dans laquelle :
R1 désigne un radical alkyle en C1-C4, linéaire ou ramifié ou un radical alcoxy en C1-C4, n étant un nombre entier allant de 0 à 4; lorsque n est égal ou supérieur à 2, les radicaux R1 peuvent être identiques ou différents;
R2 désigne un atome d'hydrogène, un radical alkyle en C1-C4, un radical aryle éventuellement substitué par des atomes d'halogène ou par des groupes alkyle ou alcoxy en Cl-C4. un radical-CN,
et R3 désigne un radical -COOR5,
R -CHO,-CH(OR9)2 ou -CH2OR9;;
R4 et R5, identiques ou différents, étant des radicaux alkyle, alcényle, cycloalkyle ou aralkyle contenant au maximum 20 atomes de carbone, éventuellement substitués par des groupes hydroxy, alcoxy, amine ou ammonium quaternaire,
R6 et R7, identiques ou différents, désignant un atome d'hydrogène ou des radicaux alkyle, alcényle, cycloalkyle ou aralkyle contenant au maximum 20 atomes de carbone, éventuellement substitués par des groupes hydroxy, alcoxy, amine ou ammonium quaternaire;
Rg désigne un atome d'hydrogène ou un radical alkyle, cycloalkyle ou aralkyle contenant au maximum 20 atomes de carbone;;
ou bien lorsque R2 désigne un atome dthydrogène, un radical alkyle ou un radical aryle éventuellement substitué, R3 peut représenter un radical où M est un atome d'hydrogène, un métal alcalin ou le groupement (R8)4, R8 désignant de l'hydrogène ou un groupe alkyle ou hydroxyalkyle en C1-C4; les deux radicaux
et méthylidène camphre étant en position para ou méta l'un par rapport à l'autre sur le noyau aromatique, dans un support ou excipient non toxique.
dans laquelle :
R1 désigne un radical alkyle en C1-C4, linéaire ou ramifié ou un radical alcoxy en C1-C4, n étant un nombre entier allant de 0 à 4; lorsque n est égal ou supérieur à 2, les radicaux R1 peuvent être identiques ou différents;
R2 désigne un atome d'hydrogène, un radical alkyle en C1-C4, un radical aryle éventuellement substitué par des atomes d'halogène ou par des groupes alkyle ou alcoxy en Cl-C4. un radical-CN,
et R3 désigne un radical -COOR5,
R -CHO,-CH(OR9)2 ou -CH2OR9;;
R4 et R5, identiques ou différents, étant des radicaux alkyle, alcényle, cycloalkyle ou aralkyle contenant au maximum 20 atomes de carbone, éventuellement substitués par des groupes hydroxy, alcoxy, amine ou ammonium quaternaire,
R6 et R7, identiques ou différents, désignant un atome d'hydrogène ou des radicaux alkyle, alcényle, cycloalkyle ou aralkyle contenant au maximum 20 atomes de carbone, éventuellement substitués par des groupes hydroxy, alcoxy, amine ou ammonium quaternaire;
Rg désigne un atome d'hydrogène ou un radical alkyle, cycloalkyle ou aralkyle contenant au maximum 20 atomes de carbone;;
ou bien lorsque R2 désigne un atome dthydrogène, un radical alkyle ou un radical aryle éventuellement substitué, R3 peut représenter un radical où M est un atome d'hydrogène, un métal alcalin ou le groupement (R8)4, R8 désignant de l'hydrogène ou un groupe alkyle ou hydroxyalkyle en C1-C4; les deux radicaux
et méthylidène camphre étant en position para ou méta l'un par rapport à l'autre sur le noyau aromatique, dans un support ou excipient non toxique.
Parmi les radicaux R4, R5, R6, R7 et Rg préférés, on peut citer les radicaux méthyle, éthyle, propyle, butyle, hexyle, 2-éthylhexyle, manthyle, oléyle, benzyle, p-méthoxy benzyle. Un radical aryle préféré pour R2 est le radical phényle.
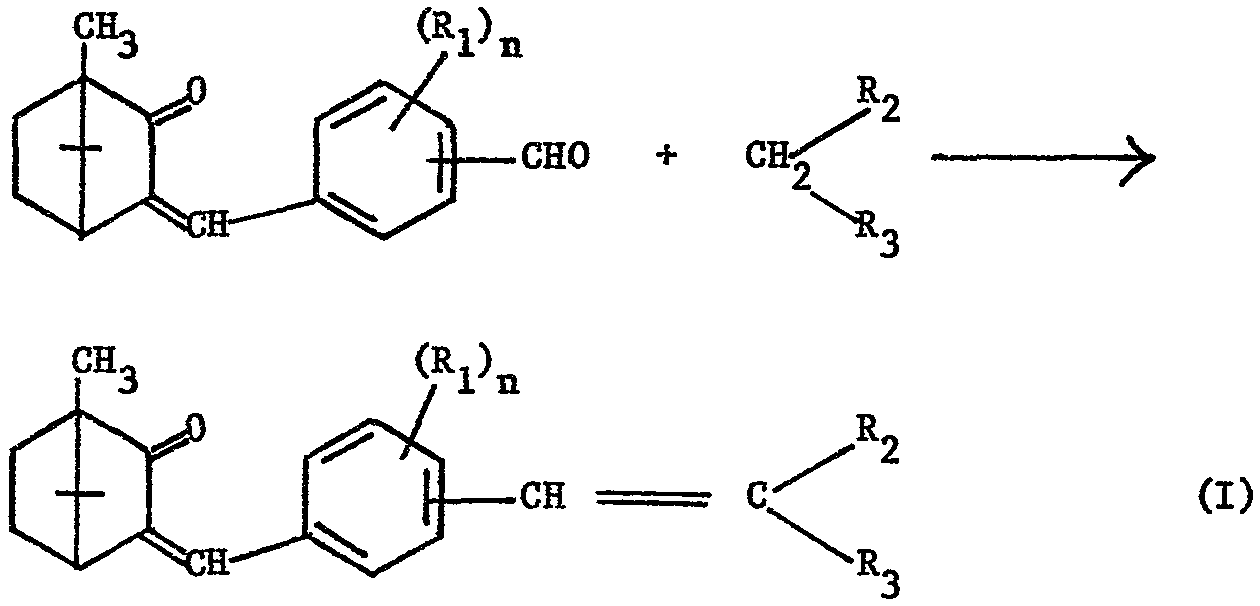
D'une manière générale, les composés de formule (I) peuvent être préparés par des procédés connus, consistant à condenser l'acide malonique ou un de ses dérivés sur un aldéhyde aromatique selon le schéma réactionnel suivant
n, Rl, R2 et R3 ayant les significations susmentionnées.
n, Rl, R2 et R3 ayant les significations susmentionnées.
Les composes de formule (I) plus particulièrement utilisés dans la composition pharmaceutique de l'invention sont les composés (1) a (16) suivants
<tb> Compose' <SEP> n <SEP> -CH=C <SEP> R2 <SEP> Mode <SEP> Point <SEP> de
<tb> t <SEP> e <SEP> A <SEP> Operat. <SEP> 1 <SEP> Analyse
<tb> <SEP> -CH=CH-COOH <SEP> Indice <SEP> d'acide <SEP> N <SEP> Theorie <SEP> e <SEP> 3,22 <SEP> meq/g
<tb> <SEP> Trouve' <SEP> : <SEP> os <SEP> al <SEP> meq/g
<tb> <SEP> Theorie <SEP> : <SEP> C <SEP> : <SEP> .... <SEP> H <SEP> ....
<tb> <SEP> l <SEP> IT <SEP> p <SEP> n <SEP> $ <SEP> P: <SEP> P:
<tb> <SEP> rl <SEP> \Q <SEP> m <SEP> 6 <SEP> m <SEP> s: <SEP> m <SEP> m
<tb> <SEP> 3ar <SEP>
<tb> <SEP> 0 <SEP> 3-J
<tb> <SEP> .. <SEP> ....<SEP> \ <SEP> q) <SEP> un <SEP> X <SEP> e <SEP> gô <SEP> eD
<tb> <SEP> s <SEP> a= <SEP> - <SEP> s
<tb> <SEP> ^ <SEP> \o" <SEP> u; <SEP> c <SEP> Po" <SEP> oo"
<tb> <SEP> h <SEP> h <SEP> 12
<tb> <SEP> < : <SEP> as <SEP> S <SEP> > <SEP> a} <SEP> w <SEP> X <SEP> w <SEP> a) <SEP> w <SEP> s
<tb> <SEP> o <SEP> @ <SEP> <SEP> O <SEP> B <SEP> 90 <SEP> B <SEP> S0 <SEP> B <SEP> S0 <SEP> B
<tb> <SEP> .. <SEP> .. <SEP> o <SEP> o <SEP> O <SEP> C) <SEP> U <SEP> U <SEP> O <SEP> U
<tb> <SEP> rc <SEP> Eb
<tb> <SEP> (d <SEP> a <SEP> o
<tb> <SEP> rl <SEP> p) <SEP> .rl <SEP> YU <SEP> 'if <SEP> 'Q
<tb> <SEP> o <SEP> o <SEP> r <SEP> g <SEP> 5 <SEP> " <SEP> 5 <SEP> o <SEP> I;
<tb> <SEP> COEthyle
<tb> <SEP> . <SEP> ..<SEP> .
<tb> <SEP> -CH=CR-C02*CH2*3CH3 <SEP> Theorie <SEP> ; <SEP> C <SEP> 78,65 <SEP> R <SEP> ; <SEP> 8,25
<tb> <SEP> a)c <SEP> FI
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> Xo <SEP> <
<tb> <SEP> x <SEP> >
<tb> <SEP> @ <SEP> a)
<tb> <SEP> ,cb <SEP> X <SEP> X <SEP> a
<tb> <SEP> *@<SEP> 1 <SEP> X <SEP> lY <SEP> X <SEP> P:
<tb> <SEP> Z <SEP> ss <SEP> eS <SEP> Z <SEP> z <SEP> CS <SEP> <SEP> OS <SEP> cOs <SEP> <SEP> eve <SEP> rJ
<tb> <SEP> S <SEP> es <SEP> U <SEP> 4 <SEP> C) <SEP> d <SEP> U
<tb> <SEP> e <SEP> <SEP> o <SEP> o <SEP> z <SEP> \ <SEP> / <SEP> a <SEP> \O <SEP> ON <SEP> a
<tb> <SEP> y <SEP> 4 <SEP> X <SEP> " <SEP> M <SEP> F <SEP> 11 <SEP> .H <SEP> Q <SEP> W
<tb> <SEP> O <SEP> = <SEP> <SEP> oz <SEP> m <SEP> <SEP> m <SEP> ov <SEP> m <SEP> a
<tb> <SEP> l <SEP> qa <SEP> I <SEP> c <SEP> S <SEP> I <SEP> a <SEP> qa
<tb> <SEP> a <SEP> O <SEP> O <SEP> O <SEP> O <SEP> O
<tb>
<tb> t <SEP> e <SEP> A <SEP> Operat. <SEP> 1 <SEP> Analyse
<tb> <SEP> -CH=CH-COOH <SEP> Indice <SEP> d'acide <SEP> N <SEP> Theorie <SEP> e <SEP> 3,22 <SEP> meq/g
<tb> <SEP> Trouve' <SEP> : <SEP> os <SEP> al <SEP> meq/g
<tb> <SEP> Theorie <SEP> : <SEP> C <SEP> : <SEP> .... <SEP> H <SEP> ....
<tb> <SEP> l <SEP> IT <SEP> p <SEP> n <SEP> $ <SEP> P: <SEP> P:
<tb> <SEP> rl <SEP> \Q <SEP> m <SEP> 6 <SEP> m <SEP> s: <SEP> m <SEP> m
<tb> <SEP> 3ar <SEP>
<tb> <SEP> 0 <SEP> 3-J
<tb> <SEP> .. <SEP> ....<SEP> \ <SEP> q) <SEP> un <SEP> X <SEP> e <SEP> gô <SEP> eD
<tb> <SEP> s <SEP> a= <SEP> - <SEP> s
<tb> <SEP> ^ <SEP> \o" <SEP> u; <SEP> c <SEP> Po" <SEP> oo"
<tb> <SEP> h <SEP> h <SEP> 12
<tb> <SEP> < : <SEP> as <SEP> S <SEP> > <SEP> a} <SEP> w <SEP> X <SEP> w <SEP> a) <SEP> w <SEP> s
<tb> <SEP> o <SEP> @ <SEP> <SEP> O <SEP> B <SEP> 90 <SEP> B <SEP> S0 <SEP> B <SEP> S0 <SEP> B
<tb> <SEP> .. <SEP> .. <SEP> o <SEP> o <SEP> O <SEP> C) <SEP> U <SEP> U <SEP> O <SEP> U
<tb> <SEP> rc <SEP> Eb
<tb> <SEP> (d <SEP> a <SEP> o
<tb> <SEP> rl <SEP> p) <SEP> .rl <SEP> YU <SEP> 'if <SEP> 'Q
<tb> <SEP> o <SEP> o <SEP> r <SEP> g <SEP> 5 <SEP> " <SEP> 5 <SEP> o <SEP> I;
<tb> <SEP> COEthyle
<tb> <SEP> . <SEP> ..<SEP> .
<tb> <SEP> -CH=CR-C02*CH2*3CH3 <SEP> Theorie <SEP> ; <SEP> C <SEP> 78,65 <SEP> R <SEP> ; <SEP> 8,25
<tb> <SEP> a)c <SEP> FI
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> Xo <SEP> <
<tb> <SEP> x <SEP> >
<tb> <SEP> @ <SEP> a)
<tb> <SEP> ,cb <SEP> X <SEP> X <SEP> a
<tb> <SEP> *@<SEP> 1 <SEP> X <SEP> lY <SEP> X <SEP> P:
<tb> <SEP> Z <SEP> ss <SEP> eS <SEP> Z <SEP> z <SEP> CS <SEP> <SEP> OS <SEP> cOs <SEP> <SEP> eve <SEP> rJ
<tb> <SEP> S <SEP> es <SEP> U <SEP> 4 <SEP> C) <SEP> d <SEP> U
<tb> <SEP> e <SEP> <SEP> o <SEP> o <SEP> z <SEP> \ <SEP> / <SEP> a <SEP> \O <SEP> ON <SEP> a
<tb> <SEP> y <SEP> 4 <SEP> X <SEP> " <SEP> M <SEP> F <SEP> 11 <SEP> .H <SEP> Q <SEP> W
<tb> <SEP> O <SEP> = <SEP> <SEP> oz <SEP> m <SEP> <SEP> m <SEP> ov <SEP> m <SEP> a
<tb> <SEP> l <SEP> qa <SEP> I <SEP> c <SEP> S <SEP> I <SEP> a <SEP> qa
<tb> <SEP> a <SEP> O <SEP> O <SEP> O <SEP> O <SEP> O
<tb>
<tb> Compose' <SEP> n <SEP> CHCR2 <SEP> Mode <SEP> Point <SEP> de <SEP> Analyse
<tb> N0 <SEP> R3 <SEP> Opdrat.<SEP> fusion
<tb> <SEP> CN <SEP> Thorie <SEP> : <SEP> C <SEP> : <SEP> 77,82 <SEP> H <SEP> : <SEP> 8,33 <SEP> N <SEP> : <SEP> 3,13
<tb> <SEP> elol <SEP> Ne
<tb> (3c\l <SEP> en <SEP> 830C <SEP> Trouv <SEP> t <SEP> C <SEP> : <SEP> 77,83 <SEP> H <SEP> : <SEP> 8,28 <SEP> N <SEP> t <SEP> 3,12
<tb> <SEP> Cr)cV
<tb> <SEP> bDO
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> Z <SEP> rzz
<tb> <SEP> unun
<tb> <SEP> e <SEP> OD <SEP> N <SEP> al <SEP> t <SEP> ul <SEP> <SEP> sD <SEP> W0 <SEP>
<tb> 7 <SEP> o <SEP> \Co2-menthyle <SEP> gs <SEP> t <SEP> en <SEP> X <SEP> 78,01 <SEP> o <SEP> o <SEP> 9,29
<tb> <SEP> Q000 <SEP> aror <SEP> oa\ <SEP> h
<tb> <SEP> eo <SEP> co <SEP> cn <SEP> as <SEP> os <SEP> aw <SEP> b <SEP> b <SEP> ~ <SEP> ~ <SEP> tD
<tb> <SEP> w <SEP> * <SEP> S <SEP> p
<tb> <SEP> m <SEP> m <SEP> im <SEP> mm <SEP> m <SEP> O
<tb> <SEP> X <SEP> Eq
<tb> <SEP> E
<tb> <SEP> NFi <SEP> V1 <SEP> \oa\ <SEP> c-VI <SEP> Q)\D
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> oD <SEP> ';f
<tb> <SEP> ps <SEP> v <SEP> * <SEP> @ <SEP> u
<tb> <SEP> ri <SEP> uu
<tb> <SEP> < d <SEP> Uo <SEP> oU <SEP> Uu <SEP> uO
<tb> <SEP> .o: <SEP> \91 <SEP> w <SEP> C <SEP> w <SEP> 78,11 <SEP> H <SEP> : <SEP> u
<tb> 9 <SEP> <SEP> -CH=CH-CO2-CCH3 <SEP> A <SEP> o <SEP> E <SEP> o <SEP> D <SEP> 1440C <SEP> Trouv <SEP> t <SEP> %
<tb> <SEP> w <SEP> o <SEP> w <SEP> o <SEP> w <SEP> o <SEP> w <SEP> o <SEP> ^ <SEP> o <SEP> E
<tb> <SEP> en <SEP> positon <SEP> para
<tb> 10 <SEP> o <SEP> -CH=CH-COO(CH2) <SEP> 8-CHCH- <SEP> Theorie <SEP> : <SEP> C <SEP> : <SEP> 81,38 <SEP> H <SEP> : <SEP> 10,06
<tb> <SEP> au <SEP> A <SEP> U <SEP> m <SEP> huile <SEP> "U1 <SEP> e <SEP> Q <SEP> :<SEP> e
<tb> <SEP> en <SEP> v <SEP> v <SEP> ~ <SEP> para
<tb> <SEP> ri <SEP> oo <SEP> v <SEP> v <SEP> c <SEP> I
<tb> <SEP> . <SEP> Indice <SEP> d'acide <SEP> t <SEP> The'orie <SEP> : <SEP> 2,59 <SEP> nieq/g
<tb> il <SEP> O <SEP> -CH <SEP> phe'nyle <SEP> + <SEP> 2380C <SEP> Trouv <SEP> : <SEP> 2,56 <SEP> meq/g
<tb> <SEP> u <SEP> F9 <SEP> FJ <SEP> + <SEP> cl
<tb> <SEP> en <SEP> 0A <SEP> <SEP> para <SEP> + <SEP> B
<tb> <SEP> > s <SEP> H <SEP> H <SEP> P.<SEP> l <SEP> H
<tb> <SEP> <SEP> z <SEP> e <SEP> d <SEP> d <SEP> <SEP> w <SEP> t <SEP> S <SEP> ffi <SEP> o <SEP> X <SEP> A
<tb> <SEP> / <SEP> N <SEP> ffi <SEP> a} <SEP> X <SEP> A <SEP> <SEP> Pe <SEP> c <SEP> Pz <SEP> Q <SEP> Q <SEP> A
<tb> <SEP> \ <SEP> X <SEP> z <SEP> <SEP> e <SEP> <SEP> cs <SEP> 8 <SEP> z <SEP> g <SEP> oN <SEP> o <SEP> o <SEP> me <SEP> HE <SEP> \g <SEP> .
<tb> <SEP> g <SEP> U <SEP> U <SEP> S <SEP> o <SEP> o <SEP> ^ <SEP> o <SEP> S <SEP> Q <SEP> S <SEP> O <SEP> U <SEP> W <SEP> X
<tb> <SEP> x <SEP> \ <SEP> / <SEP> ,, <SEP> n <SEP> U <SEP> W <SEP> Y <SEP> .4 <SEP> m <SEP> & <SEP> g <SEP> .
<tb> <SEP> a <SEP> o0 <SEP> / <SEP> <SEP> 8 <SEP> <SEP> ,l <SEP> o0 <SEP> O <SEP> = <SEP> v
<tb> <SEP> x <SEP> A <SEP> & <SEP> ffi <SEP> o <SEP> O <SEP> O <SEP> a <SEP> Y <SEP> d
<tb> <SEP> X <SEP> Xd <SEP> | <SEP> S <SEP> Q <SEP> i <SEP> a <SEP> X <SEP> ~ <SEP> @
<tb> <SEP> d <SEP> o
<tb> <SEP> va)
<tb> <SEP> o <SEP> O <SEP> o <SEP> ~
<tb>
<tb> N0 <SEP> R3 <SEP> Opdrat.<SEP> fusion
<tb> <SEP> CN <SEP> Thorie <SEP> : <SEP> C <SEP> : <SEP> 77,82 <SEP> H <SEP> : <SEP> 8,33 <SEP> N <SEP> : <SEP> 3,13
<tb> <SEP> elol <SEP> Ne
<tb> (3c\l <SEP> en <SEP> 830C <SEP> Trouv <SEP> t <SEP> C <SEP> : <SEP> 77,83 <SEP> H <SEP> : <SEP> 8,28 <SEP> N <SEP> t <SEP> 3,12
<tb> <SEP> Cr)cV
<tb> <SEP> bDO
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> Z <SEP> rzz
<tb> <SEP> unun
<tb> <SEP> e <SEP> OD <SEP> N <SEP> al <SEP> t <SEP> ul <SEP> <SEP> sD <SEP> W0 <SEP>
<tb> 7 <SEP> o <SEP> \Co2-menthyle <SEP> gs <SEP> t <SEP> en <SEP> X <SEP> 78,01 <SEP> o <SEP> o <SEP> 9,29
<tb> <SEP> Q000 <SEP> aror <SEP> oa\ <SEP> h
<tb> <SEP> eo <SEP> co <SEP> cn <SEP> as <SEP> os <SEP> aw <SEP> b <SEP> b <SEP> ~ <SEP> ~ <SEP> tD
<tb> <SEP> w <SEP> * <SEP> S <SEP> p
<tb> <SEP> m <SEP> m <SEP> im <SEP> mm <SEP> m <SEP> O
<tb> <SEP> X <SEP> Eq
<tb> <SEP> E
<tb> <SEP> NFi <SEP> V1 <SEP> \oa\ <SEP> c-VI <SEP> Q)\D
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> oD <SEP> ';f
<tb> <SEP> ps <SEP> v <SEP> * <SEP> @ <SEP> u
<tb> <SEP> ri <SEP> uu
<tb> <SEP> < d <SEP> Uo <SEP> oU <SEP> Uu <SEP> uO
<tb> <SEP> .o: <SEP> \91 <SEP> w <SEP> C <SEP> w <SEP> 78,11 <SEP> H <SEP> : <SEP> u
<tb> 9 <SEP> <SEP> -CH=CH-CO2-CCH3 <SEP> A <SEP> o <SEP> E <SEP> o <SEP> D <SEP> 1440C <SEP> Trouv <SEP> t <SEP> %
<tb> <SEP> w <SEP> o <SEP> w <SEP> o <SEP> w <SEP> o <SEP> w <SEP> o <SEP> ^ <SEP> o <SEP> E
<tb> <SEP> en <SEP> positon <SEP> para
<tb> 10 <SEP> o <SEP> -CH=CH-COO(CH2) <SEP> 8-CHCH- <SEP> Theorie <SEP> : <SEP> C <SEP> : <SEP> 81,38 <SEP> H <SEP> : <SEP> 10,06
<tb> <SEP> au <SEP> A <SEP> U <SEP> m <SEP> huile <SEP> "U1 <SEP> e <SEP> Q <SEP> :<SEP> e
<tb> <SEP> en <SEP> v <SEP> v <SEP> ~ <SEP> para
<tb> <SEP> ri <SEP> oo <SEP> v <SEP> v <SEP> c <SEP> I
<tb> <SEP> . <SEP> Indice <SEP> d'acide <SEP> t <SEP> The'orie <SEP> : <SEP> 2,59 <SEP> nieq/g
<tb> il <SEP> O <SEP> -CH <SEP> phe'nyle <SEP> + <SEP> 2380C <SEP> Trouv <SEP> : <SEP> 2,56 <SEP> meq/g
<tb> <SEP> u <SEP> F9 <SEP> FJ <SEP> + <SEP> cl
<tb> <SEP> en <SEP> 0A <SEP> <SEP> para <SEP> + <SEP> B
<tb> <SEP> > s <SEP> H <SEP> H <SEP> P.<SEP> l <SEP> H
<tb> <SEP> <SEP> z <SEP> e <SEP> d <SEP> d <SEP> <SEP> w <SEP> t <SEP> S <SEP> ffi <SEP> o <SEP> X <SEP> A
<tb> <SEP> / <SEP> N <SEP> ffi <SEP> a} <SEP> X <SEP> A <SEP> <SEP> Pe <SEP> c <SEP> Pz <SEP> Q <SEP> Q <SEP> A
<tb> <SEP> \ <SEP> X <SEP> z <SEP> <SEP> e <SEP> <SEP> cs <SEP> 8 <SEP> z <SEP> g <SEP> oN <SEP> o <SEP> o <SEP> me <SEP> HE <SEP> \g <SEP> .
<tb> <SEP> g <SEP> U <SEP> U <SEP> S <SEP> o <SEP> o <SEP> ^ <SEP> o <SEP> S <SEP> Q <SEP> S <SEP> O <SEP> U <SEP> W <SEP> X
<tb> <SEP> x <SEP> \ <SEP> / <SEP> ,, <SEP> n <SEP> U <SEP> W <SEP> Y <SEP> .4 <SEP> m <SEP> & <SEP> g <SEP> .
<tb> <SEP> a <SEP> o0 <SEP> / <SEP> <SEP> 8 <SEP> <SEP> ,l <SEP> o0 <SEP> O <SEP> = <SEP> v
<tb> <SEP> x <SEP> A <SEP> & <SEP> ffi <SEP> o <SEP> O <SEP> O <SEP> a <SEP> Y <SEP> d
<tb> <SEP> X <SEP> Xd <SEP> | <SEP> S <SEP> Q <SEP> i <SEP> a <SEP> X <SEP> ~ <SEP> @
<tb> <SEP> d <SEP> o
<tb> <SEP> va)
<tb> <SEP> o <SEP> O <SEP> o <SEP> ~
<tb>
<tb> <SEP> R
<tb> o^o- <SEP> n <SEP> -CH-C"" <SEP> 2 <SEP> Mode <SEP> Point <SEP> de <SEP> Analyse
<tb> <SEP> N0 <SEP> o- <SEP> 0pe'rat <SEP> fusion
<tb> <SEP> -CH <SEP> Qo <SEP> <SEP> e <SEP> N <SEP> n <SEP> o <SEP> <
<tb> <SEP> N <SEP> p <SEP> O <SEP> t <SEP> II
<tb> <SEP> 12 <SEP> 0 <SEP> e9 <SEP> b <SEP> b <SEP> rv <SEP> b <SEP> b <SEP> N
<tb> <SEP> s <SEP> s <SEP> *v <SEP>
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> CO <SEP> ;r <SEP> b <SEP> u8- <SEP> b <SEP> ethyle
<tb> <SEP> Q <SEP> D <SEP> ;Jm <SEP> m <SEP> m <SEP> 2
<tb> <SEP> n <SEP> n
<tb> <SEP> <SEP> CH3 <SEP> Trouv <SEP> b <SEP> 78,35 <SEP> H <SEP> :<SEP> 8,02
<tb> <SEP> RI
<tb> <SEP> en <SEP> position <SEP> UU <SEP> UU
<tb> <SEP> s <SEP>
<tb> <SEP> 9) <SEP> PI <SEP> O) <SEP> (1) <SEP> 01
<tb> <SEP> Thorie <SEP> w <SEP> ,1 <SEP> 78,07 <SEP> H <SEP> : <SEP> 7 > 74
<tb> <SEP> <SEP> <SEP> CH=CH-Co2e'thyle <SEP> t <SEP> 85 > 50C <SEP> Trouve' <SEP> : <SEP> C <SEP> : <SEP> 78,04 <SEP> H <SEP> g <SEP> 7,72
<tb> <SEP> 0
<tb> <SEP> en <SEP> position <SEP> nieta
<tb> <SEP> ~ <SEP> ~ <SEP> ~
<tb> <SEP> AU: <SEP> Theorie <SEP> : <SEP> V <SEP> 81,60 <SEP> H <SEP> Q
<tb> <SEP> 15 <SEP> en <SEP> para <SEP> n <SEP> o <SEP> o <SEP> o <SEP> U <SEP> oO
<tb> <SEP> ci <SEP> rn <SEP> ao <SEP> O <SEP> v, <SEP> J
<tb> <SEP> nt
<tb> <SEP> 16 <SEP> o <SEP> -CH-C"" <SEP> 3 <SEP> N <SEP> 1140C <SEP> Trouve' <SEP> : <SEP> C <SEP> 81,60 <SEP> H <SEP> :<SEP> 7,85 <SEP> 0 <SEP> 10,52
<tb> <SEP> CHO
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> x <SEP> H <SEP> nl <SEP> > s <SEP> G} <SEP> sd
<tb> <SEP> D <SEP> :N <SEP> b <SEP> XC <SEP> d <SEP> S <SEP> v <SEP> nl <SEP> rss
<tb> <SEP> O <SEP> S <SEP> s <SEP> td <SEP> $ <SEP> g <SEP> <SEP>
<tb> <SEP> <SEP> <SEP> o <SEP> 8 <SEP> U <SEP> d <SEP> ^s <SEP> g <SEP> a <SEP> 8 <SEP> 8
<tb> <SEP> \ <SEP> / <SEP> \ <SEP> \ <SEP> t <SEP> <SEP> Qo <SEP> S <SEP> m <SEP> <SEP> m <SEP> o
<tb> <SEP> cvt <SEP> v <SEP> H <SEP> \ <SEP> d <SEP> X <SEP> \ <SEP> / <SEP>
<tb> <SEP> E <SEP> O <SEP> O- <SEP> O <SEP> O <SEP> O <SEP> X <SEP> / <SEP> .X
<tb> <SEP> :1:<SEP> m <SEP> 1 <SEP> :n <SEP> v <SEP> l <SEP> O <SEP> 11 <SEP> Opz
<tb> <SEP> I <SEP> 11) <SEP> I <SEP> d <SEP> .~~~ <SEP> ? <SEP> @ <SEP> P <SEP> @
<tb> <SEP> d <SEP> o <SEP> o <SEP> o <SEP> o <SEP> o
<tb> <SEP> O <SEP> O <SEP> rs <SEP> X <SEP> < <SEP> . <SEP> uo <SEP> a57
<tb> <SEP> o
<tb> <SEP> c7
<tb>
<tb> o^o- <SEP> n <SEP> -CH-C"" <SEP> 2 <SEP> Mode <SEP> Point <SEP> de <SEP> Analyse
<tb> <SEP> N0 <SEP> o- <SEP> 0pe'rat <SEP> fusion
<tb> <SEP> -CH <SEP> Qo <SEP> <SEP> e <SEP> N <SEP> n <SEP> o <SEP> <
<tb> <SEP> N <SEP> p <SEP> O <SEP> t <SEP> II
<tb> <SEP> 12 <SEP> 0 <SEP> e9 <SEP> b <SEP> b <SEP> rv <SEP> b <SEP> b <SEP> N
<tb> <SEP> s <SEP> s <SEP> *v <SEP>
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> CO <SEP> ;r <SEP> b <SEP> u8- <SEP> b <SEP> ethyle
<tb> <SEP> Q <SEP> D <SEP> ;Jm <SEP> m <SEP> m <SEP> 2
<tb> <SEP> n <SEP> n
<tb> <SEP> <SEP> CH3 <SEP> Trouv <SEP> b <SEP> 78,35 <SEP> H <SEP> :<SEP> 8,02
<tb> <SEP> RI
<tb> <SEP> en <SEP> position <SEP> UU <SEP> UU
<tb> <SEP> s <SEP>
<tb> <SEP> 9) <SEP> PI <SEP> O) <SEP> (1) <SEP> 01
<tb> <SEP> Thorie <SEP> w <SEP> ,1 <SEP> 78,07 <SEP> H <SEP> : <SEP> 7 > 74
<tb> <SEP> <SEP> <SEP> CH=CH-Co2e'thyle <SEP> t <SEP> 85 > 50C <SEP> Trouve' <SEP> : <SEP> C <SEP> : <SEP> 78,04 <SEP> H <SEP> g <SEP> 7,72
<tb> <SEP> 0
<tb> <SEP> en <SEP> position <SEP> nieta
<tb> <SEP> ~ <SEP> ~ <SEP> ~
<tb> <SEP> AU: <SEP> Theorie <SEP> : <SEP> V <SEP> 81,60 <SEP> H <SEP> Q
<tb> <SEP> 15 <SEP> en <SEP> para <SEP> n <SEP> o <SEP> o <SEP> o <SEP> U <SEP> oO
<tb> <SEP> ci <SEP> rn <SEP> ao <SEP> O <SEP> v, <SEP> J
<tb> <SEP> nt
<tb> <SEP> 16 <SEP> o <SEP> -CH-C"" <SEP> 3 <SEP> N <SEP> 1140C <SEP> Trouve' <SEP> : <SEP> C <SEP> 81,60 <SEP> H <SEP> :<SEP> 7,85 <SEP> 0 <SEP> 10,52
<tb> <SEP> CHO
<tb> <SEP> en <SEP> position <SEP> para
<tb> <SEP> x <SEP> H <SEP> nl <SEP> > s <SEP> G} <SEP> sd
<tb> <SEP> D <SEP> :N <SEP> b <SEP> XC <SEP> d <SEP> S <SEP> v <SEP> nl <SEP> rss
<tb> <SEP> O <SEP> S <SEP> s <SEP> td <SEP> $ <SEP> g <SEP> <SEP>
<tb> <SEP> <SEP> <SEP> o <SEP> 8 <SEP> U <SEP> d <SEP> ^s <SEP> g <SEP> a <SEP> 8 <SEP> 8
<tb> <SEP> \ <SEP> / <SEP> \ <SEP> \ <SEP> t <SEP> <SEP> Qo <SEP> S <SEP> m <SEP> <SEP> m <SEP> o
<tb> <SEP> cvt <SEP> v <SEP> H <SEP> \ <SEP> d <SEP> X <SEP> \ <SEP> / <SEP>
<tb> <SEP> E <SEP> O <SEP> O- <SEP> O <SEP> O <SEP> O <SEP> X <SEP> / <SEP> .X
<tb> <SEP> :1:<SEP> m <SEP> 1 <SEP> :n <SEP> v <SEP> l <SEP> O <SEP> 11 <SEP> Opz
<tb> <SEP> I <SEP> 11) <SEP> I <SEP> d <SEP> .~~~ <SEP> ? <SEP> @ <SEP> P <SEP> @
<tb> <SEP> d <SEP> o <SEP> o <SEP> o <SEP> o <SEP> o
<tb> <SEP> O <SEP> O <SEP> rs <SEP> X <SEP> < <SEP> . <SEP> uo <SEP> a57
<tb> <SEP> o
<tb> <SEP> c7
<tb>
Les modes opératoires (A) à (N) utilisés pour les préparations des composés (1) a (16) sont explicités ci-après.
Mode opératoire A
Dans un ballon équipé de 250 ml, on place
22 g d'acide malonique
40 ml de pyridine sèche
Le mélange est agité jusqu'à dissolution complete. On ajoute alors 1 ml de piperidine, puis 27 g de 4'-formyl-3-benzylidene camphre et le tout est chauffé progressivement jusqu'à 110 C. I1 se produit un dégagement gazeux qui cesse après environ 1 heure 30 de chauffage.
Dans un ballon équipé de 250 ml, on place
22 g d'acide malonique
40 ml de pyridine sèche
Le mélange est agité jusqu'à dissolution complete. On ajoute alors 1 ml de piperidine, puis 27 g de 4'-formyl-3-benzylidene camphre et le tout est chauffé progressivement jusqu'à 110 C. I1 se produit un dégagement gazeux qui cesse après environ 1 heure 30 de chauffage.
La solution est ensuite refroidie et acidifiée par addition de 100 ml d'acide chlorhydrique 6N. Le précipité formé est filtré, lavé à l'eau jusqu'à neutralité, séché sous vide.
on obtient 30 g de composé (1) (rendement = 96%)
Mode opératoire B
Dans un ballon équipé de 1 litre, on place
69 g de malonate de 2-éthyl hexyle
2 ml de piéridine
500 ml d'éthanol
54 g de 4t-formyl-3-benzylidène camphre.
Mode opératoire B
Dans un ballon équipé de 1 litre, on place
69 g de malonate de 2-éthyl hexyle
2 ml de piéridine
500 ml d'éthanol
54 g de 4t-formyl-3-benzylidène camphre.
Le mélange est chauffé au reflux pendant 24 heures. On rajoute alors 2 ml supplémentaires de pipéridine et on porte à reflux pendant 6 heures.
La solution est refroidie et concentrée sous vide. Le résidu est repris dans 500 ml de toluène. La phase organique est lavée plusieurs fois à l'eau, séchée et concentrée sous vide.
L'huile obtenue est chromatographiée sur silice (éluant : acétone/ hexane (1/9).
on obtient 55 g de composé (2) (rendement : 47%).
Pour préparer les composés (4) et (7), on remplace le malonate de 2éthylhexyle, respectivement Far du malonate d'éthyle et du malonate de menthyle.
Mode opératoire C
Dans un ballon de 250 ml équipé, on place
10,6 ml de cyanoacétate d'éthyle
50 ml d'éthanol absolu et
1,5 g de fluorure de potassium comme catalyseur.
Dans un ballon de 250 ml équipé, on place
10,6 ml de cyanoacétate d'éthyle
50 ml d'éthanol absolu et
1,5 g de fluorure de potassium comme catalyseur.
A ce mélange on ajoute par petites portions, 27 g de 4'-formyl-3 ben zylidène camphre. Le mélange réactionnel devient pâteux, on introduit alors 125 ml d'éthanol absolu et on laisse agiter à 500C pendant 1 heure.
Le mélange est refroidi et le précipité essoré, lavé avec 200 ml d'éthanol puis 200 ml d'eau et enfin séché sous vide.
On obtient 32,7 g de composé (3) (rendement : 90%).
Pour obtenir le composé (6), on remplace le cyanoacétate d'éthyle par du cyanoacétate de 2'-éthylhexyle.
Mode opératoire D
Dans un réacteur de 2 litres équipé, on place
56 g d'acide p-(2-oxo 3-bornylidène méthyl) cinnamique (composé 1)
27 g de butanol
800 ml de benzène sec et
4 ml d'acide sulfurique concentré.
Dans un réacteur de 2 litres équipé, on place
56 g d'acide p-(2-oxo 3-bornylidène méthyl) cinnamique (composé 1)
27 g de butanol
800 ml de benzène sec et
4 ml d'acide sulfurique concentré.
Le mélange est chauffé au reflux pendant 4 heures en séparant l'eau formé à l'aide d'un appareil de Dean-Stark.
La solution est ensuite refroidie puis lavée à l'eau, séchée et évaporée à sec.
Le résidu est recristallisé dans l'êthanol.
On obtient 70 g de composé (5) (rendement = 76%).
Mode opératoire E
Dans un réacteur de 500 ml équipé, on place
31 g d'acide p-(2-oxo 3-bornylidène méthyl) cinnamique (composé 1)
200 ml de toluène sec et
24 g de chlorure de thionyle.
Dans un réacteur de 500 ml équipé, on place
31 g d'acide p-(2-oxo 3-bornylidène méthyl) cinnamique (composé 1)
200 ml de toluène sec et
24 g de chlorure de thionyle.
Le mélange est porté au reflux pendant 2 heures. L'excès de chlorure de thionyle est chassé puis le toluène est distillé sous vide.
Le résidu est recristallisé dans un mélange toluene-hexane 40/60.
Après séchage, on obtient 26 g de chlorure d'acide p-(2-oxo 3-borny lidène méthyl)cinnamique (rendement = 80%).
Mode opératoire F
Dans un ballon de 250 ml équipé, on place
10 g de chlorure d'acide obtenu en E
3,9 g de 2-éthyl hexylamine
4,2 ml de triéthylamine et
100 ml de chlorure de méthylène.
Dans un ballon de 250 ml équipé, on place
10 g de chlorure d'acide obtenu en E
3,9 g de 2-éthyl hexylamine
4,2 ml de triéthylamine et
100 ml de chlorure de méthylène.
Le mélange est porté à reflux pendant 2 heures. Après refroidissement, la phase organique est lavée à l'eau, séchee, filtrée et concentrée à sec.
Le résidu huileux est séché sous vide pour donner un solide amorphe.
On obtient ainsi 12,2 g de composé (8) (rendement = 96%).
Mode opératoire G
Dans un ballon de 100 ml équipé on place
4,15 g d'alcool p-méthoxybenzylique,
20 ml de pyridine et on introduit par petites portions, à température ambiante, 9,9 g dé chlorure d'acide obtenu en E.
Dans un ballon de 100 ml équipé on place
4,15 g d'alcool p-méthoxybenzylique,
20 ml de pyridine et on introduit par petites portions, à température ambiante, 9,9 g dé chlorure d'acide obtenu en E.
La réaction est légèrement exothermique.
En fin d'addition, le mélange est porté à 700C pendant 1 heure.
Après refroidissement, la solution est ensuite versée dans un mélange de 200 ml de glace et 30 ml d'acide chlorhydrique concentré.
Le précipité formé est filtré, lavé à l'eau et recristallisé dans l'acé- tone. On obtient 6,8 g de composé (9) (rendement - 52%).
Mode opératoire H
Dans un réacteur de 2 litres équipé, on place
300 ml de benzène sec
200 ml de toluène sec
228 g d'alcool oléique
3,2 ml d'acide sulfurique concentré puis
45 g d'acide p-(2-oxo 3-bornylidène méthyl) cinnamique (composé 1).
Dans un réacteur de 2 litres équipé, on place
300 ml de benzène sec
200 ml de toluène sec
228 g d'alcool oléique
3,2 ml d'acide sulfurique concentré puis
45 g d'acide p-(2-oxo 3-bornylidène méthyl) cinnamique (composé 1).
Le mélange est chauffé au reflux pendant 5 heures en séparant l'eau formée à l'aide d'un appareil de Dean Star.
La solution est ensuite refroidie puis lavée à l'eau, séchée et évaporée à sec. Le résidu est soumis à une distillation sous 0,1 mmHg à 160-1740C afin d'éliminer l'alcool oléique en excès. On isole l'ester attendu par une chromatographie sur colonne en présence de gel de silice et de choroforme (10 1 CHCl3 + 2 kg de gel de silice).
On concentre la partie chloroformique contenant le p-(2-oxo-3-bornyli- dène méthyle) cinnamate d'oléyle et on obtient 40 g de composé 10) (rendement 40%).
Mode ogeratoire I
On chauffe pendant 2 heures a 180-190 C un mélange contenant 17,4 g (0,1 mole) de phénylacétate de potassium, 5 g (0,035 mole) de carbonate de potassium, 0,5 ml de pyridine, 26,8 g (0,1 mole) de 4'-formyl-3-benzylidène camphre et 15,3 g (0,15 mole) d'anhydride acétique. On maintient un courant d'azote durant le temps de chauffage.
On chauffe pendant 2 heures a 180-190 C un mélange contenant 17,4 g (0,1 mole) de phénylacétate de potassium, 5 g (0,035 mole) de carbonate de potassium, 0,5 ml de pyridine, 26,8 g (0,1 mole) de 4'-formyl-3-benzylidène camphre et 15,3 g (0,15 mole) d'anhydride acétique. On maintient un courant d'azote durant le temps de chauffage.
Après refroidissement, on ajoute 300 nil de glace puis 50 ml de potasse 6N. On extrait par 50 ml d'éther, puis on acidifie la phase aqueuse. Le précipité est recristallisé dans 100 mi d'alcool éthylique à 502. On obtient 15,2 g de composé (11).
Mode opératoire J
Dans un ballon équipé d'un Dean Stark, on chauffe au reflux une solution de 7,72 g (0,02 mole) du compose (11) obtenu selon le mode opératoire I, 5 ml d'hexanol, 50 ml de toluene et 3 gouttes d'acide sulfurique concentré.
Dans un ballon équipé d'un Dean Stark, on chauffe au reflux une solution de 7,72 g (0,02 mole) du compose (11) obtenu selon le mode opératoire I, 5 ml d'hexanol, 50 ml de toluene et 3 gouttes d'acide sulfurique concentré.
Après 3 heures au reflux, le mélange réactionnel est concentré. Le résidu est recristallisé dans l'éthanol. On obtient 5,9 g de produit jause pâle (12).
Mode opératoire K
Dans un ballon de 250 ml, on ajoute 5 ml (10-2 mole) de diethylphos- phono-2 propionate d'éthyle, 5,4 g de 4'-formyl 3-benzylidène camphre (2.10-2 mo'e), 40 ml d'une solution saturée de carbonate de potassium et 40 ml d'eau.
Dans un ballon de 250 ml, on ajoute 5 ml (10-2 mole) de diethylphos- phono-2 propionate d'éthyle, 5,4 g de 4'-formyl 3-benzylidène camphre (2.10-2 mo'e), 40 ml d'une solution saturée de carbonate de potassium et 40 ml d'eau.
Après 24 heures d'agitation vigoureuse à la température ambiante, on extrait avec 3 fois 50 mi de toluene. La phase organique est lavée à l'eau, distillée, séchée puis évaporée pour conduire à 8 g d'une huile jaunatre qui cristallise à froid. On effectue une recristallisation dans l'hexane qui conduit a 5,2 g de cristaux blancs du composé (13).
Mode opératoire L
Dans un ballon de 100 mi, on place 1 g d'hydroxyde de potassium pulvéri- se en suspension dans 30 ml de dioxane. On ajoute goutte goutte une solution de 1,12 g (5.10-3 mole) de diéthylphosphonoacétate d'éthyle, et de 1,34 g de 3'-formyl 3-benzylidène camphre (5.10-3 mole) dans 30 ml de dioxane. Après 1 heure d'agitation, on dilue le milieu réactionnel avec 40 mi de toluène. Après filtration et evaporation des solvants, on obtient une huile qui cristallise à froid. Après recristallisation dans l'hexane, on obtient un produit qui fond à 85,50C (14).
Dans un ballon de 100 mi, on place 1 g d'hydroxyde de potassium pulvéri- se en suspension dans 30 ml de dioxane. On ajoute goutte goutte une solution de 1,12 g (5.10-3 mole) de diéthylphosphonoacétate d'éthyle, et de 1,34 g de 3'-formyl 3-benzylidène camphre (5.10-3 mole) dans 30 ml de dioxane. Après 1 heure d'agitation, on dilue le milieu réactionnel avec 40 mi de toluène. Après filtration et evaporation des solvants, on obtient une huile qui cristallise à froid. Après recristallisation dans l'hexane, on obtient un produit qui fond à 85,50C (14).
Mode opératoire N
On refroidit à -300C sous argon 250 cm3 d'éther. On ajoute 3,8 g d'hydrure de lithium et d'aluminium. On ajoute lentement à cette température 33,8 g de 4' -Ê2-éthoxycarbonyl-trans-éthen-yl-trans-benzylidene-camphre obtenu selon le mode opératoire D en remplaçant le butanol par l'éthanol. On laisse revenir lentement le mélange réactionnel à température ambiante, puis 3 on ajoute 100 cm d'acetate d'éthyle. On dilue à lteau et on filtre sur célite. La phase organique est décantée et le solvant est distillé sous pression réduite.
On refroidit à -300C sous argon 250 cm3 d'éther. On ajoute 3,8 g d'hydrure de lithium et d'aluminium. On ajoute lentement à cette température 33,8 g de 4' -Ê2-éthoxycarbonyl-trans-éthen-yl-trans-benzylidene-camphre obtenu selon le mode opératoire D en remplaçant le butanol par l'éthanol. On laisse revenir lentement le mélange réactionnel à température ambiante, puis 3 on ajoute 100 cm d'acetate d'éthyle. On dilue à lteau et on filtre sur célite. La phase organique est décantée et le solvant est distillé sous pression réduite.
Le résidu est dissous dans 160 cm3 d'éther. On ajoute cette solution à une suspension de 50 g de dioxyde de manganese activé dans 160 cm d'hexane.
On agite pendant deux heures a température ambiante puis on filtre. Le solvant est évaporé. Le produit est purifié par chromatographie sur gel de silice en utilisant un mélange toluene-acétate d'éthyle 95:5 comme solvant, puis recristallisé dans l'éther isopropylique (composé 15).
Mode opératoire N 3 3
A une solution bouillante de 0,3 cm de soude a 30% dans 10 cm de méthanol, on ajoute goutte a goutte une solution chaude de 8 g de 4'-formyl 3-benzylidene-camphre et 10 cm3 de propanal dans 70 cm3 de méthanol. on chauffe au reflux pendant 1 heure puis on refroidit et on verse le mélange réactionnel dans de l'eau. Après extraction à l'éther et évaporation, on obtient par recristallisation dans l'éther isopropylique 3,7 g de cristaux jaune-pâle de composé (16).
A une solution bouillante de 0,3 cm de soude a 30% dans 10 cm de méthanol, on ajoute goutte a goutte une solution chaude de 8 g de 4'-formyl 3-benzylidene-camphre et 10 cm3 de propanal dans 70 cm3 de méthanol. on chauffe au reflux pendant 1 heure puis on refroidit et on verse le mélange réactionnel dans de l'eau. Après extraction à l'éther et évaporation, on obtient par recristallisation dans l'éther isopropylique 3,7 g de cristaux jaune-pâle de composé (16).
On peut obtenir les alcools de formule (I) dans laquelle R3 désigne -CH2OH par exemple par réduction des aldéhydes correspondants dans lesquels
R3 désigne -CHO.
R3 désigne -CHO.
Les acétals de formule (I) dans laquelle R3 désigne -CH(OR9)2 dérivent des aldéhydes par addition sur ceux-ci d'alcanols, de cycloalcanols ou d'alcools araîkyliques en milieu acide. Ils peuvent également etre obtenus par addition d'aldéhydes sur les alcools de formule (I) dans laquelle R3 désigne -CH2OR, en milieu acide.
Les éthers de formule (I) dans laquelle R3 désigne -CH20R9 sont obtenus à partir des alcools de formule (I) dans laquelle R3 désigne -CH20H par action d'un halogénure d'alkyle, de cycloalkyle ou d'aralkyle.
Des essais effectués sur le rat et la souris ont permis de mettre en évidence la très faible toxicité des composés selon l'invention dont la DL5O par voie orale est généralement supérieure à 3 g/kg.
Les composés de formule (I) présentent une activité dans le traitement topique et systémique de néoplasies bégnines ou malignes, de lésions préma- lignes ainsi que dans la prophylaxie systémique et topique de ces affections.
Ils conviennent en outre dans le traitement-des dermatoses telles que l'acné ou le psoriasis. Ils peuvent également être utilisés par voie orale en vue de traiter certaines affections rhumatismales telles que par exemple la polyarthrite chronique.
Les composés de formule (I) sont généralement administrés par voie orale à une dose journaliere d'environ 2 pg à 5 mg par kg, et de préférence de 10 yg à 2 mg par kg.
Comme support de la composition pharmaceutique de l'invention, on peut utiliser tous excipients conventionnels non toxiques, le composé actif se trouvant soit à l'état soluble, soit à l'état dispersé dans le support.
Les excipients peuvent être constitués par des substances organiques ou minérales, par exemple par de l'eau, de la gélatine, du lactose, de l'amidon, du stéarate de magnésium, du talc, de la gomme arabique, des alcanols, des glycols, des polyalkyleneglycols, des huiles, des cires, des esters d'acides gras, etc.
L'administration peut être effectuée par voie entérale, parentérale ou topique. Par voie entérale, les médicaments peuvent se présenter sous forme de comprimés, de gélules, de dragées, de sirops, de suspensions, de solutions ou de suppositoires. Par voie parentérale, les compositions peuvent se présenter sous forme de solutions pour perfusion ou pour injection.
Par voie topique, les compositions pharmaceutiques à base des composés selon l'invention se présentent sous forme d'onguewts, de teintures, de crèmes, de solutions, de lotions, de gels, de sprays ou encore de suspen- sions.
Les compositions par voie topique contiennent de préférence de 0S00052 à environ 5% en poids de composé selon l'invention.
Ces compositions par voie topique peuvent se présenter sous forme anhydre ou sous forme aqueuse selon l'indication clinique et peuvent contenir d'autres ingrédients, notamment des agents anti-oxydants.
Les compositions pharmaceutiques selon l'invention sont illustrées par les exemples non limitatifs suivants.
Exemple 1
Gélule
On utilise 0,3 g de poudre ayant la composition suivante
Acide para-(2-oxo-3-bornylidene méthyl)cinnamique 50 mg
Amidon de mats 0,06 g
Lactose q.s.p. 0,3 g
La poudre est conditionnée dans une gélule composée de gélatine, de bioxyde de titane et d'un conservateur.
Gélule
On utilise 0,3 g de poudre ayant la composition suivante
Acide para-(2-oxo-3-bornylidene méthyl)cinnamique 50 mg
Amidon de mats 0,06 g
Lactose q.s.p. 0,3 g
La poudre est conditionnée dans une gélule composée de gélatine, de bioxyde de titane et d'un conservateur.
Ces gélules sont administrées par voie orale à raison de 2 a 3 gélules/ jour pour le traitement des dermatoses.
Exemple 2
Onguent
Un onguent pour l'administration par voie topique a la composition suivante :
Ester butylique de l'acide para-(2-oxo 3-bornylidene
méthyl) cinnamique lg
Vaseline 49 g
Cérésine 15 g
Huile de vaseline 35 g
Cet onguent est utilisé pour le traitement de l'acné.
Onguent
Un onguent pour l'administration par voie topique a la composition suivante :
Ester butylique de l'acide para-(2-oxo 3-bornylidene
méthyl) cinnamique lg
Vaseline 49 g
Cérésine 15 g
Huile de vaseline 35 g
Cet onguent est utilisé pour le traitement de l'acné.
Claims (8)
1. Composition pharmaceutique caractérise par le fait qu'elle contient à titre d'ingrédient actif, un dérive d'acide campho-méthylidène cinnamique de formule
dans laquelle :
R1 désigne un radical alkyle en C1-C4,linéaire ou ramifié ou un radical alcoxy en C1-C4, n étant un nombre entier allant de o a 4; lorsque n est égal ou supérieur à 2, les radicaux R1 peuvent être identiques ou différents;
R2 désigne un atome d'hydrogene, un radical alkyle en C1-C41 un radical aryle éventuellement substitué par des atomes d'halogène ou par des groupes alkyle ou alcoxy en C1-C4, un radical-CN, -COOR4 ou
et R3 désigne un radical -COOR5,
CHO, -CH (OR9)2 ou-CH20R9;;
R4 et R5, identiques ou différents, étant des radicaux alkyle, alcényle, cycloalkyle ou aralkyle contenant au maximum 20 atomes de carbone, éventuellement substitués par des groupes hydroxy, alcoxy, amine ou ammonium quaternaire,
R6 et R7, identiques ou différents, désignant un atome d'hydrogene ou des radicaux alkyle, alcényle, cycloalkyle ou araîkyle contenant au maximum 20 atomes de carbone, éventuellement substitués par des groupes hydroxy, alcoxy, amine ou ammonium quaternaire;
Rg désigne un atome d'hydrogène ou un radical alkyle, cycloalkyle ou aralkyle contenant au maximum 20 atomes de carbone;;
ou bien lorsque R2 désigne un atome d'hydrogène, un radical alkyle ou un radical aryle éventuellement substitué, R3 peut representer un radical où M est un atome d'hydrogène, un métal alcalin ou le groupement (R)4, R8 désignant de l'hydrogène ou un groupe alkyle ou hydroxyalkyle en C1-C4; les deux radicaux
et méthylidène camphre étant en position para ou méta l'un par rapport à l'autre sur le noyau aromatique, dans un support ou excipient non toxique.
2. Composition pharmaceutique selon la revendication 1, caractérisée par le fait qu'elle contient à titre d'ingrédient actif un composé de formule
dans laquelle n = O et le groupement
est en position méta et désigne -CH 2 CH - C02 éthyle ou bien en position para et désigne
<tb> -CH=CH-CO2(CH2)3-CH3
<tb> <SEP> C02éthyle
<tb> -CH <SEP> = <SEP> C
<tb> <SEP> COZéthyle
<tb> <SEP> C02-éthyle
<tb> <SEP> CH <SEP> =
<tb> <SEP> CN
<tb> <SEP> 2 <SEP> - <SEP> 2-éthylhexyle
<tb> <SEP> CO, <SEP> - <SEP> 2-éthylhexyle
<tb> - <SEP> CH <SEP> = <SEP> C
<tb> <SEP> C02 <SEP> 2-éthylhexyle
<tb> <SEP> C02H
<tb> - <SEP> CH <SEP> = <SEP> C
<tb> <SEP> H
-CH=CH-CO2-(CH2)8-CH=CH-(CH2)7-CH3
<tb> -CH=C H-CONH-2-é thylhexyle
<tb> <SEP> C02-menthyle
<tb> <SEP> M
<tb> -CH <SEP> = <SEP> C
<tb> -CH <SEP> = <SEP> C <SEP> <
<tb> <SEP> c <SEP> C02enthyle
<tb> <SEP> -CHCOZ-2-éthylhexyle
<tb> -CH <SEP> = <SEP> C
<tb> M
<tb> <SEP> cN
<tb> -CH = CH - CHO
<tb> <SEP> M <SEP> CH3
<tb> -CH <SEP> = <SEP> C
<tb> <SEP> M <SEP> 2-éthyle
<tb> <SEP> phényle
<tb> -CH <SEP> = <SEP> C
<tb> <SEP> / <SEP> C02C <SEP> 6H13
<tb> <SEP> phényle
<tb> <SEP> M
<tb> <SEP> -CH <SEP> = <SEP> C
<tb> -CH <SEP> e <SEP> Cphényle
<tb> <SEP> CO <SEP> H
3.Composition pharmaceutique selon la revendication 1, caractérisée par le fait qu'elle contient à titre d'ingrédient actif l'acide para-(2-oxo 3-bornylidène méthyl) cinnamique.
4. Composition pharmaceutique selon la revendication 1, caractérisée par le fait qu'elle contient à titre d'ingrédient actif l'ester butylique de l'acide para (2-oxo 3-bornylidène méthyl) cinnamique.
5. Composition pharmaceutique pour le traitement et la prophylaxie de néoplasies et d'affections dermatologiques et rhumatismales, caractérisée par le fait qu'elle contient à titre d'ingrédient actif un dérivé d'acide campho méthylidène cinnamique de formule (I) selon la revendication 1, dans un support ou excipient non toxique.
6. Composition pharmaceutique, pour le traitement et la propylaxie de néoplasies et d'affections dermatologiques et rhumatismales, caractérisée par le fait qu'elle contient à titre d'ingrédient actif un dérivé acide campho méthylidène cinnamique selon la revendication 2 dans un support ou excipient non toxique.
7. Composition pharmaceutique pour le traitement et la prophylaxie de néoplasies et d'affections dermatologiques et rhumatismales, caractérisée par le fait qu'elle contient à titre d'ingrédient actif, l'acide para-(2-oxo 3-bornylidène methyl)cinnamique, dans un support ou excipient non toxique.
8. Composition pharmaceutique pour le traitement etla prophylaxie de néoplasies et d'affections dermatologiques et rhumatismales caractérisée par le fait qu'elle contient à titre d'ingrédient actif, l'ester butylique de l'acide para-(2-oxo-3-bornylidène methyl) cinnamique dans un support ou excipient non toxique.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| LU85138A LU85138A1 (fr) | 1983-12-14 | 1983-12-14 | Compositions pharmaceutiques contenant des derives de l'acide campho-methylidene cinnamique |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| FR2556592A1 true FR2556592A1 (fr) | 1985-06-21 |
| FR2556592B1 FR2556592B1 (fr) | 1986-08-22 |
Family
ID=19730192
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| FR8418920A Expired FR2556592B1 (fr) | 1983-12-14 | 1984-12-11 | Compositions pharmaceutiques contenant des derives de l'acide campho-methylidene cinnamique |
Country Status (2)
| Country | Link |
|---|---|
| FR (1) | FR2556592B1 (fr) |
| LU (1) | LU85138A1 (fr) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2625195A1 (fr) * | 1987-12-23 | 1989-06-30 | Oreal | Nouveaux derives insatures du benzylidene-3 camphre, leur procede de preparation et leur utilisation en tant qu'absorbeurs du rayonnement ultra-violet en cosmetique et en tant qu'intermediaires de synthese de composes organo-siliciques |
| WO1993016026A1 (fr) * | 1992-02-15 | 1993-08-19 | Merck Patent Gmbh | UTILISATION DE DERIVES α-HYDROXYCETOALKYLE COMME SUBSTANCES FILTRANTES PROTECTRICES POUR L'EXPOSITION AUX RAYONS LUMINEUX |
| US5639883A (en) * | 1994-07-12 | 1997-06-17 | Merck Patent Gesellschaft Mit Beschrankter Haftung | Process for preparing substituted 4-methylidenecinnamic acid derivatives |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3781417A (en) * | 1970-10-22 | 1973-12-25 | Merck Patent Gmbh | Light protection agent for cosmetic purposes |
| FR2421878A2 (fr) * | 1978-04-05 | 1979-11-02 | Oreal | Nouveaux benzylidene camphres, leur procede de preparation et compositions cosmetiques les contenant |
| GB2121801A (en) * | 1982-06-15 | 1984-01-04 | Oreal | 3-benzylidene camphor derivatives |
-
1983
- 1983-12-14 LU LU85138A patent/LU85138A1/fr unknown
-
1984
- 1984-12-11 FR FR8418920A patent/FR2556592B1/fr not_active Expired
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3781417A (en) * | 1970-10-22 | 1973-12-25 | Merck Patent Gmbh | Light protection agent for cosmetic purposes |
| FR2421878A2 (fr) * | 1978-04-05 | 1979-11-02 | Oreal | Nouveaux benzylidene camphres, leur procede de preparation et compositions cosmetiques les contenant |
| GB2121801A (en) * | 1982-06-15 | 1984-01-04 | Oreal | 3-benzylidene camphor derivatives |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2625195A1 (fr) * | 1987-12-23 | 1989-06-30 | Oreal | Nouveaux derives insatures du benzylidene-3 camphre, leur procede de preparation et leur utilisation en tant qu'absorbeurs du rayonnement ultra-violet en cosmetique et en tant qu'intermediaires de synthese de composes organo-siliciques |
| BE1002221A4 (fr) * | 1987-12-23 | 1990-10-16 | Oreal | Nouveaux derives insatures du benzylidene-3 camphre, leur procede de preparation et leur utilisation en tant qu'absorbeurs du rayonnement ultra-violet en cosmetique et en tant qu'intermediaires de synthese de composes organo-siliciques. |
| WO1993016026A1 (fr) * | 1992-02-15 | 1993-08-19 | Merck Patent Gmbh | UTILISATION DE DERIVES α-HYDROXYCETOALKYLE COMME SUBSTANCES FILTRANTES PROTECTRICES POUR L'EXPOSITION AUX RAYONS LUMINEUX |
| US5639883A (en) * | 1994-07-12 | 1997-06-17 | Merck Patent Gesellschaft Mit Beschrankter Haftung | Process for preparing substituted 4-methylidenecinnamic acid derivatives |
Also Published As
| Publication number | Publication date |
|---|---|
| LU85138A1 (fr) | 1985-09-12 |
| FR2556592B1 (fr) | 1986-08-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CH672638A5 (fr) | ||
| MC1990A1 (fr) | Nouveaux derives du benzocycloheptene | |
| MC1230A1 (fr) | Derives de stilbene | |
| EP0001534B1 (fr) | Nouveaux dérivés du pyrrole, leur procédé de préparation et leurs applications en thérapeutique | |
| EP0409728B1 (fr) | Esters bi-aromatiques, leur procédé de préparation et leur utilisation en médecine humaine ou vétérinaire et en cosmétique | |
| FR2647676A1 (fr) | Nouveaux derives de pyridazinone, leurs procedes de preparation, medicaments les contenant, utiles notamment comme inhibiteurs de l'aldose reductase | |
| EP0418933A1 (fr) | Dérivés d'alcadiènes, leurs préparations, les médicaments les contenant et produits intermédiaires | |
| EP0209770A1 (fr) | Esters et amides de l'acide eicosatriynoique et leur application en pharmacie et en cosmétique | |
| CH641798A5 (fr) | Derives de dibenzothiepinne et leur procede de synthese. | |
| EP0051514B1 (fr) | Dérivé d'acide cinnamoyl-cinnamique, son procédé de préparation et son application en thérapeutique | |
| LU81676A1 (fr) | Nouveaux derives d'aurones,leur procede de preparation et leur utilisation comme produits pharmaceutiques | |
| EP0122827A1 (fr) | (Carbéthoxy-2 benzalkylamido-4 phénoxy)-1 amino-3 propanols-2, leurs préparations et leurs utilisations en thérapeutique | |
| BE884387A (fr) | Composition a base d'acides aryloxyalkylaminobenzoiques, leurs sels et leurs esters | |
| EP0017578B1 (fr) | Acides 5-(2-hydroxy-3-thiopropoxy)chromone-2-carboxyliques, leurs sels et esters, procédé de préparation et médicaments | |
| FR2556592A1 (fr) | Compositions pharmaceutiques contenant des derives de l'acide campho-methylidene cinnamique | |
| BE779775A (fr) | Derives de l'uree, procede pour les preparer et leurs applications | |
| EP0294258A1 (fr) | Dérivés d'hydrazine, procédé d'obtention et compositions pharmaceutiques les contenant | |
| CH615414A5 (fr) | ||
| CA1211105A (fr) | Procede pour la preparation de derives de p-acylaminophenol et derives obtenus par ce procede | |
| EP0020230B1 (fr) | Acides p-biphényl-4 méthyl-2 buten-3 oiques, procédé pour leur préparation, compositions pharmaceutiques les contenant et leur utilisation | |
| CH392483A (fr) | Procédé de préparation de nouveaux esters d'acides 4-halo-3-sulfamoyl-benzoïques | |
| EP0100257B1 (fr) | Nouveaux dérivés aminoalkyl naphtaléniques, leurs sels d'addition d'acide et le procédé de préparation ainsi que l'application en thérapeutique de ces dérivés et sels | |
| EP0172041A1 (fr) | Acides dihydro-5,6-4H-cyclopenta [b] thiophènecarboxyliques-6, procédés de préparation et médicaments les contenant | |
| CH601228A5 (en) | Antiinflammatory indomethacin esters active topically and orally | |
| BE621255A (fr) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| ST | Notification of lapse |