ES2945809T3 - Composiciones farmacéuticas sólidas efervescentes prácticamente sin sodio - Google Patents
Composiciones farmacéuticas sólidas efervescentes prácticamente sin sodio Download PDFInfo
- Publication number
- ES2945809T3 ES2945809T3 ES19382846T ES19382846T ES2945809T3 ES 2945809 T3 ES2945809 T3 ES 2945809T3 ES 19382846 T ES19382846 T ES 19382846T ES 19382846 T ES19382846 T ES 19382846T ES 2945809 T3 ES2945809 T3 ES 2945809T3
- Authority
- ES
- Spain
- Prior art keywords
- acid
- composition
- pharmaceutically acceptable
- effervescent
- solid pharmaceutical
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/06—Aluminium, calcium or magnesium; Compounds thereof, e.g. clay
- A61K33/10—Carbonates; Bicarbonates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0002—Galenical forms characterised by the drug release technique; Application systems commanded by energy
- A61K9/0007—Effervescent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4015—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil having oxo groups directly attached to the heterocyclic ring, e.g. piracetam, ethosuximide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Inorganic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Pain & Pain Management (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
La presente invención se refiere a una composición farmacéutica sólida efervescente, esencialmente libre de contenido de sodio, que comprende: una cantidad terapéuticamente eficaz de un ingrediente farmacéutico activo; uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad de 1 a 31% en peso de la composición; y uno o más ácidos farmacéuticamente aceptables, sales de ácidos farmacéuticamente aceptables o, alternativamente, una mezcla de los mismos, en una cantidad de 2 a 62% en peso de la composición; junto con uno o más excipientes o vehículos farmacéuticamente aceptables; donde, el contenido total del ion sodio en la composición farmacéutica sólida efervescente es igual o inferior a 1 mmol. También se relaciona con procesos para su preparación y su uso en terapia. (Traducción automática con Google Translate, sin valor legal)
Description
DESCRIPCIÓN
Composiciones farmacéuticas sólidas efervescentes prácticamente sin sodio
[0001] La presente invención se refiere al campo de la farmacia. Particularmente, a una composición farmacéutica sólida efervescente que está prácticamente libre de sodio y que tiene una rápida disgregación al entrar en contacto con agua antes de su administración. También se refiere a procesos para su preparación y su uso en terapia.
Estado de la técnica
[0002] Los comprimidos y las cápsulas son las formas farmacéuticas preferidas para la administración de fármacos debido a que se dosifican con precisión, son fácilmente producidos a gran escala y contribuyen a un buen cumplimiento del tratamiento. Sin embargo, algunos pacientes pueden tener problemas para tragar comprimidos o cápsulas. Tal afección es particularmente importante entre los ancianos, víctimas de accidentes cerebrovasculares, niños, pacientes afectados por trastornos psiquiátricos que se niegan a tragar o, en general, personas que padecen disfagia por cualquier otro motivo.
[0003] Las formas farmacéuticas líquidas, tales como soluciones orales, suspensiones o jarabes, constituyen alternativas para aquellos pacientes que presentan dificultad para tragar. Sin embargo, estas formas farmacéuticas proporcionan un control menos preciso de la dosis ya que necesitan ser manipuladas por el paciente o cuidador; son más difíciles de transportar y más propensas a contaminarse y estropearse, debido a la falta de envases de dosis unitarias.
[0004] En este contexto, las composiciones sólidas efervescentes representan una excelente solución para los pacientes que padecen dificultades para tragar. Permiten un control preciso de la dosis y pueden envasarse en monodosis, facilitando su transporte y mejorando la adherencia de los pacientes al tratamiento. En particular, las composiciones sólidas efervescentes tienen una disgregación rápida y también pueden tener un tiempo de disolución rápido al entrar en contacto con una pequeña cantidad de agua para producir una suspensión o una solución respectivamente antes de su administración. En particular, las composiciones farmacéuticas sólidas efervescentes se disgregan rápidamente en contacto con el agua gracias a la liberación de gas CO2 para producir suspensiones o soluciones líquidas que se pueden tragar más fácilmente que los comprimidos o las cápsulas enteras. La efervescencia se puede lograr utilizando una pareja (o par) ácido-base efervescente, que produce gas cuando los iones de carbonato (base) se protonan en ambientes acuosos ácidos. Por lo tanto, los sistemas efervescentes dependen de la reacción entre un ácido (o cualquier otro constituyente que cree un ambiente ácido) y un carbonato o bicarbonato.
[0005] El carbonato de sodio y el bicarbonato de sodio son las fuentes de CO2 preferidas en los sistemas efervescentes por su alta solubilidad en agua y su buena palatabilidad. Desafortunadamente, estos productos tienden a suministrar cantidades significativas de sodio junto con el principio farmacéutico activo. Las directrices de organizaciones tales como la Organización Mundial de la Salud ( OMS) y la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA) sugieren disminuir la ingesta de sodio en general y, particularmente, en la población que padece hipertensión y otras enfermedades cardiovasculares.
[0006] Además, la Agencia Europea de Medicamentos (EMA) recientemente ha prestado atención al sodio utilizado como excipiente en medicamentos de uso humano (EMA/CHMP/338679/2014). En este documento, la EMA dice que es probable que la mayoría de los medicamentos que contienen altos niveles de sodio sean efervescentes o solubles. La EMA advierte que un estudio en 1.292.337 pacientes mayores de 18 años informó recientemente que el alto contenido de sodio de algunos medicamentos efervescentes, solubles y dispersables podrían estar asociados a un mayor riesgo de enfermedad cardiovascular (George, J. et al. The Association of Cardiovascular Events with Sodium-Containing Effervescent, Dispersible and Soluble Medications; Nested Case-control Study, BMJ, 2013; 347: f6954).
[0007] La OMS recomienda que los adultos consuman menos de 2 g (u 87 mmol) de sodio por día. Los comprimidos efervescentes divulgados en el estado de la técnica normalmente contienen niveles extremadamente altos de sodio, incluso representando el 25 % de la cantidad diaria máxima recomendada por la OMS para el sodio en la dieta. Entonces, existe la necesidad de proporcionar composiciones farmacéuticas sólidas efervescentes que suministren un bajo contenido de ion de sodio o incluso que estén prácticamente libres de sodio. Esto es particularmente importante para los medicamentos que deben administrarse crónicamente, ya que la cantidad acumulada de sodio suministrada por las formulaciones sólidas efervescentes convencionales es inaceptablemente alta para pacientes con enfermedades cardiovasculares o con dietas bajas en sodio.
[0008] Se han propuesto diferentes enfoques para reducir o eliminar el contenido de iones de sodio de las composiciones sólidas efervescentes farmacéuticas, tales como los comprimidos efervescentes. Un enfoque, como se muestra en el documento WO2015/040460, ha sido reemplazar parcial o totalmente el carbonato de sodio o las sales de bicarbonato de sodio por la cantidad equivalente de carbonato de potasio o sales de bicarbonato de potasio. Sin embargo, las sales de potasio son en general menos estables que las sales de sodio, por ejemplo, el bicarbonato de potasio se descompone a temperaturas más bajas (entre 100 y 200 °C) que el bicarbonato de sodio (aproximadamente 270 °C). Por lo tanto, las sales de potasio tienen una tendencia inherente a ser metaestables y muy
reactivas. Por consiguiente, el uso de sales de potasio puede requerir un envase especial para hacer frente a la corrosión y precauciones extraordinarias del equipo utilizado. Por lo tanto, las composiciones farmacéuticas sólidas efervescentes basadas en fuentes de carbonato de potasio pueden ser difíciles de preparar, haciéndolas menos rentables, especialmente a escala industrial. Asimismo, también se divulga en el estado de la técnica que una ingesta dietética excesiva de potasio también podría conducir a hiperpotasemia, una afección que incluye síntomas tales como debilidad muscular, fatiga y arritmia entre otros. De manera adicional, las composiciones que contienen potasio presentan un sabor metálico y amargo que es difícil de enmascarar.
[0009] Algunos autores han propuesto carbonatos de metales alcalinotérreos como sustitutos potenciales de los carbonatos de sodio y potasio para composiciones farmacéuticas sólidas efervescentes para superar las preocupaciones anteriores y al mismo tiempo ser rentables a escala industrial.
[0010] Sin embargo, los carbonatos de metales alcalinotérreos, tales como el carbonato de calcio o el carbonato de magnesio, son poco solubles en agua y, por tanto, la rápida disgregación por la reacción de efervescencia se ve fuertemente obstaculizada. Por lo tanto, las composiciones efervescentes que comprenden carbonatos de metales alcalinotérreos normalmente no se disuelven rápidamente y, como resultado, la mezcla de agua lograda después de la disgregación de la composición efervescente no es transparente ni clara dejando residuos y/o espumas que dificultan la bioabsorción del principio activo. Asimismo, el sabor de las soluciones producidas por estas composiciones en agua es desagradable, comprometiendo de este modo la adherencia al tratamiento. Por estas razones, la obtención de composiciones farmacéuticas sólidas efervescentes a base de carbonatos o bicarbonatos de metales alcalinotérreos que tengan una rápida disgregación y produzcan soluciones acuosas transparentes y agradables al paladar sigue siendo un desafío.
[0011] La fabricación de comprimidos efervescentes requiere el control de algunas etapas y condiciones críticas. La humedad relativa baja y las temperaturas entre moderadas y frías son esenciales para evitar la disolución de los agentes efervescentes y evitar que se produzca la reacción de efervescencia durante el proceso de fabricación. Por lo tanto, los métodos secos tales como la granulación por vía seca o la compresión directa son los métodos preferidos para producir composiciones sólidas efervescentes debido a que no hay líquidos involucrados. Cuando se necesitan procesos de granulación por vía húmeda, se pueden utilizar disolventes no acuosos tales como etanol o isopropanol. Por otra parte, si se va a utilizar agua como disolvente, deben llevarse a cabo dos etapas de granulación separadas, es decir, una para los componentes alcalinos y una para los ácidos, con una etapa posterior de mezcla en seco. En este contexto, las ventajas de los métodos por vía seca son evidentes, ya que estos permiten evitar el uso de disolventes orgánicos, reducen el número de etapas del proceso y conducen a un proceso de fabricación más rentable y respetuoso con el medio ambiente.
[0012] La solicitud de patente europea EP1837019 A1 divulga composiciones farmacéuticas orales en forma de comprimidos bucodispersables que contienen carbonato de calcio y opcionalmente vitamina D y/o flúor para el tratamiento o prevención de la osteoporosis. Las formulaciones divulgadas en el presente documento se obtuvieron siguiendo métodos por vía seca tales como compresión rotatoria y compresión directa (cf.párrafos [0086] a [0090]). Por otra parte, los comprimidos bucodispersables divulgados en el documento EP1837019 comprenden un alto porcentaje de la pareja efervescente (es decir, de aproximadamente el 81 % a aproximadamente el 94 % p/p) y más específicamente un alto porcentaje de carbonato de calcio (es decir, de aproximadamente el 65 % a aproximadamente el 80 % p/p), lo cual es desventajoso debido a que son extremadamente abrasivos y tienden a dañar las herramientas de formación de comprimidos, provocando de este modo un fuerte impacto económico en el proceso de fabricación.
[0013] La solicitud de patente PCT WO00/28973 divulga procesos para la fabricación de composiciones farmacéuticas administrables por vía oral en forma de comprimido que contiene un compuesto de calcio fisiológicamente tolerable, tal como, por ejemplo, carbonato de sodio. En este contexto, el ejemplo 6 divulga comprimidos efervescentes que comprenden carbonato de calcio, ácido cítrico y vitamina D3 junto con otros excipientes farmacéuticos, en donde la cantidad de pareja efervescente es de aproximadamente el 90 % p/p y la cantidad de carbonato de calcio es de aproximadamente el 33 % p/p. Los comprimidos efervescentes como se divulgan en el ejemplo 6 se obtienen siguiendo un proceso de granulación por vía húmeda (como se divulga en el ejemplo 1), en donde se necesitan al menos dos procesos de etapas separadas (ejemplo 2). La necesidad de al menos dos etapas de granulación, siendo una de ellas un proceso de granulación por vía húmeda, hace que los comprimidos efervescentes del documento WO 00/28973 sean más difíciles de producir, dificultando al mismo tiempo la integridad del comprimido efervescente final y su tiempo de efervescencia. Asimismo, como se ha mencionado anteriormente, el uso de altas cantidades del par efervescente y particularmente de carbonato cálcico es inapropiado debido a su abrasividad que daña las herramientas de formación de comprimidos.
[0014] Por último, la solicitud de patente europea EP1067904 A1 divulga formulaciones gaseosas de disolución rápida para aplicaciones orales, que contienen cetirizina o sus sales farmacéuticamente compatibles, una base gaseosa que comprende carbonatos alcalinos o alcalinotérreos y otros excipientes farmacéuticos. Los ejemplos 6 y 7 a 9 divulgan gránulos solubles y comprimidos dispersables, respectivamente, que comprenden cetirizina como principio farmacéutico activo y carbonato de calcio y ácido cítrico como pareja efervescente y se obtienen por proceso de lecho separado (párrafo 31). Asimismo, aunque los ejemplos 6 a 9 divulgan formulaciones que contienen porcentajes inferiores de la pareja efervescente en comparación con las formulaciones divulgadas en los documentos Ep 1837019
A1 y WO00/28973, la cantidad de carbonato de calcio en las formulaciones del documento EP 1067904 sigue siendo demasiado alta (es decir, mayor del 32 % p/p), por lo que todavía se obtienen de este modo mezclas demasiado abrasivas.
[0015] Por lo tanto, a partir de lo conocido en la técnica se deduce que existe una necesidad sentida desde hace mucho tiempo de proporcionar composiciones efervescentes que sin contribuir a aumentar la ingesta diaria de sodio tengan también un rápido tiempo de efervescencia que dé lugar a líquidos agradables al paladar y transparentes. Asimismo, también existe la necesidad de proporcionar procesos sencillos para la fabricación de tales composiciones efervescentes que sean fáciles de aumentar de escala, respetuoso con el medio ambiente, rentable y que pueda evitar el uso de mezclas muy abrasivas como las que contienen grandes cantidades de carbonato cálcico.
Resumen de la invención
[0016] Los inventores de la presente invención han encontrado sorprendentemente una composición farmacéutica efervescente sólida que no contribuye a aumentar la ingesta dietética de sodio de los pacientes y al mismo tiempo presenta un tiempo de efervescencia rápido y produce líquidos agradables al paladar y sin residuos.
[0017] Las composiciones de la presente invención se definen como "prácticamente libres de sodio" de acuerdo con las directrices actualizadas de la EMA (cf.EMA/CHMP/338679/2014). Por lo tanto, la composición de la presente invención es apropiada para niños y ancianos, así como otros pacientes que necesiten reducir, controlar o evitar la ingesta de sodio en la dieta tal como, por ejemplo, pacientes que padecen hipertensión u otras enfermedades cardiovasculares. Otra ventaja asociada a las composiciones "prácticamente libres de sodio" de la presente invención es que también son apropiadas para ser administradas crónicamente, debido a que la cantidad de ion de sodio liberada de las composiciones es nula o lo suficientemente baja, por lo que no se pueden lograr altos niveles acumulativos de iones de sodio.
[0018] Además, la composición de la presente invención se disgrega en 5 minutos o menos al entrar en contacto con 200 ml de agua R a 15-25 °C, sin dejar aglomerados ni residuos cuando cesa la efervescencia, cumpliendo de este modo la prueba de disgregación establecida para los comprimidos efervescentes por la Farmacopea Europea. Particularmente, la composición de la presente invención (después de la disgregación) crea una solución de agua agradable al paladar sin residuos y/o espuma, que proporciona una excelente biodisponibilidad del principio activo, así como una manera fácil de ingerir, incluso para aquellos pacientes que experimentan dificultades para tragar comprimidos y cápsulas convencionales. Además, el agradable sabor de la solución acuosa también mejora la fidelidad al tratamiento. También, la composición de la presente invención reduce el riesgo de esofagitis inducida por fármacos, que ocurre cuando un comprimido queda atrapado en el esófago, haciendo que el tamaño y la forma de la composición sean irrelevantes permitiendo grandes cantidades de principios activos en una sola dosis.
[0019] De manera adicional, la composición de la presente invención comprende uno o más carbonatos o bicarbonatos de metales alcalinotérreos, particularmente carbonato de calcio o bicarbonato de calcio, lo cual es ventajoso para personas con necesidades especiales de calcio como bebés, niños pequeños, adolescentes, mujeres embarazadas o en periodo de lactancia, así como personas de la tercera edad; y otras personas con mayores requerimientos de calcio por estar en riesgo de desarrollar la enfermedad de los huesos quebradizos u osteoporosis; tal como, por ejemplo, pacientes que padecen epilepsia y se trata con fármacos antiepilépticos.
[0020] En los últimos años, existe una evidencia creciente que sugiere que la epilepsia y su tratamiento pueden tener efectos adversos sobre la mineralización ósea y el metabolismo del calcio. Numerosos estudios han demostrado una reducción significativa de la densidad mineral ósea y un aumento del riesgo de fracturas en pacientes tratados con antiepilépticos inductores de enzimas (fenobarbital, carbamazepina y fenitαna). Aunque los datos sobre los efectos óseos específicos de los nuevos fármacos antiepilépticos son limitados, se han notificado alteraciones del metabolismo óseo con oxcarbazepina, gabapentina y, en estudios preclínicos, para levetiracetam (Meier, C. et al. Antiepileptics and Bone Health, Ther. Adv. Musculoskelet.Dis., 2011, 3(5), pág. 235-243).
[0021] Por último, en cuanto al proceso de preparación de las composiciones de la invención, la baja cantidad de pareja ácido/base y, particularmente, la baja cantidad de uno o más carbonatos o bicarbonatos de metales alcalinotérreos, proporciona una mezcla mucho menos abrasiva para la compresión, aumentando de este modo la vida útil de las herramientas de formación de comprimidos. Además, la combinación específica de excipientes de la composición de la presente invención permite fabricarlos por métodos por vía seca, tales como la compresión directa y los procesos de granulación por vía seca (tales como los procesos de granulación MAGD) con un proceso simple, respetuoso con el medio ambiente y rentable, que puede ser adecuado para la escala industrial. De manera adicional, las composiciones de la invención también se pueden fabricar mediante un simple proceso de granulación por vía húmeda, el cual implica una única y sencilla etapa de granulación por vía húmeda utilizando una cantidad insignificante de líquido de granulación en lugar de los complejos procesos divulgados en el estado de la técnica que comprenden al menos dos etapas de granulación.
[0022] Por tanto, el primer aspecto de la presente invención se refiere a una composición farmacéutica sólida efervescente que comprende: una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde
dicho principio farmacéutico activo es lacosamida; uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 1 al 31 % en peso de la composición; y uno o más ácidos farmacéuticamente aceptables, sales ácidas farmacéuticamente aceptables o, alternativamente, una mezcla de los mismos, en una cantidad del 2 al 62 % en peso de la composición; junto con uno o más excipientes o vehículos farmacéuticamente aceptables; en donde, el contenido total del ion de sodio en la composición farmacéutica sólida efervescente es igual o inferior a 1 mmol.
[0023] El segundo aspecto de la invención se refiere a un proceso para la preparación de la composición farmacéutica sólida efervescente del primer aspecto de la invención.
[0024] Y, el tercer aspecto de la invención se refiere a la composición farmacéutica sólida efervescente del primer aspecto de la invención para su uso en terapia; y particularmente en el tratamiento de enfermedades crónicas. Descripción detallada de la invención
[0025] Todos los términos como se utilizan en el presente documento en esta solicitud, a menos que se indique de otro modo, se entenderán en su significado habitual, como se conoce en la técnica. Otras definiciones más específicas para determinados términos como se utilizan en la presente solicitud son como se exponen a continuación y tienen por objeto aplicarse de manera uniforme a lo largo de la memoria descriptiva y las reivindicaciones a menos que una definición expuesta expresamente de otro modo proporcione una definición más amplia.
[0026] Para los fines de la presente invención, cualquier intervalo dado incluye los extremos tanto inferior como superior del intervalo. Los intervalos y valores dados, tales como las temperaturas, los tiempos y similares, deben considerarse aproximados, a menos que se indique específicamente.
[0027] La expresión "porcentaje (%) en peso" se refiere al porcentaje de cada ingrediente de la composición en relación con el peso total.
[0028] La expresión "relación molar" se refiere al número de moles de un compuesto con respecto al número de moles de otro compuesto. Por ejemplo, se refiere al número de moles de uno o más ácidos o sales ácidas farmacéuticamente aceptables con respecto al número de moles de uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos.
[0029] Los términos "sodio" e "ion de sodio" son sinónimos y se utilizan en el presente documento indistintamente.
[0030] Las expresiones "prácticamente sin sodiol" o "prácticamente libre de sodio" tienen el mismo significado y se utilizan indistintamente. Se refieren a composiciones farmacéuticas que comprenden menos de 1 mmol de ion de sodio por unidad de dosis.
[0031] El primer aspecto de la invención se refiere a una composición farmacéutica sólida efervescente. Para los fines de la invención, la expresión "composición sólida" se refiere a cualquier composición en estado sólido que esté libre de medios líquidos. Asimismo, la composición sólida de la invención es una "composición farmacéutica" que comprende una "cantidad terapéuticamente eficaz de un principio farmacéutico activo" junto con uno o más "excipientes o vehículos farmacéuticamente aceptables". La expresión "composición farmacéutica" se refiere a una composición adecuada para su uso en la tecnología farmacéutica de uso médico. La expresión "cantidad terapéuticamente eficaz de un principio farmacéutico activo" como se utiliza en el presente documento, se refiere a la cantidad de un principio farmacéutico activo que, cuando se administra, es suficiente para prevenir el desarrollo de, o aliviar en cierta medida, uno o más de los síntomas de la enfermedad que se está tratando. La dosis del principio farmacéutico activo administrada de acuerdo con esta invención será, por supuesto, determinada por las circunstancias particulares que rodean al caso, incluyendo el compuesto administrado, la vía de administración, la afección particular que se está tratando y consideraciones similares. Para el fin de la invención, las expresiones "principio farmacéutico activo" y "API" tienen el mismo significado y se utilizan indistintamente. Se refieren al principio activo o ingrediente central en la composición que provoca el efecto directo (terapéuticamente) en el diagnóstico, prevención, tratamiento, cura o alivio de una enfermedad o afección.
[0032] Para el fin de la invención, la expresión "composición efervescente" se refiere a una composición que generalmente contiene sustancias ácidas y carbonatos o hidrogenocarbonatos que reaccionan rápidamente en presencia de agua para liberar dióxido de carbono. Las composiciones efervescentes están destinadas a disolverse o dispersarse en agua antes de la administración. Las composiciones efervescentes de la invención cumplen con los requisitos establecidos por la Ph. Eur. para la prueba de disgregación de comprimidos efervescentes que dice lo siguiente: "[...] coloque un comprimido en un vaso de precipitados de 250 ml que contenga 200 ml de agua R a 15 25 °C. Se desprenden numerosas burbujas de gas. Cuando cesa el desprendimiento de gas alrededor del comprimido o sus fragmentos, el comprimido debería haberse disgregado, disolviéndose o dispersándose en el agua de modo que no queden aglomerados. Repita la operación en cinco comprimidos adicionales. Los comprimidos cumplen con la prueba si cada uno de los seis comprimidos utilizados en la prueba se disgrega en 5 minutos [...]". Por lo tanto, para el fin de la invención, la expresión "tiempo efervescente" se refiere al tiempo que transcurre hasta la disgregación de
la composición medida por la prueba de disgregación de comprimidos efervescentes de la Farmacopea Europea 9.8a edición, que comprende colocar la composición en un vaso de precipitados que contiene 200 ml de agua R a 15-25 °C.
[0033] Para el fin de la invención, la expresión "relación molar" se refiere a la relación entre el componente ácido y el componente alcalino de la composición. Preferentemente, la expresión "relación molar" se refiere a la relación entre los ácidos o sales ácidas farmacéuticamente aceptables, o mezclas de los mismos; y los carbonatos o hidrogenocarbonatos de metales alcalinotérreos o mezclas de los mismos. Por ejemplo, una "relación molar" de X:Y, define una composición de la invención que comprende X mol del componente ácido por Y mol del componente alcalino. Preferentemente, la "relación molar" se expresa como X:1, definiendo una composición de la invención que comprende X mol del componente ácido por 1 mol del componente alcalino.
[0034] La composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida.
[0035] En una realización, la composición de la invención comprende una cantidad terapéuticamente eficaz del principio farmacéutico activo como se define anteriormente del 0,5 % al 60 % en peso de la composición, preferentemente del 0,5 al 50 %, más preferentemente del 0,5 al 45 %.
[0036] La composición de la presente invención comprende un contenido del ion de sodio igual o inferior a 1 mmol. Para el fin de la invención, la medida del ion de sodio en las composiciones de la invención se realiza mediante espectroscopia de absorción atómica (AAS), espectroscopia de emisión atómica (AES), espectroscopia de masas (MS), y/o cualquiera de dichas técnicas con un plasma acoplado inductivamente, tales como ICP-AAS, ICP-AES e ICP-MS. Sin embargo, el experto en la materia puede utilizar otras técnicas equivalentes.
[0037] En una realización preferida, la composición está libre de ion de sodio. La expresión "libre de ion de sodio" se refiere a una composición cuyo contenido de ion de sodio no es detectable por ninguna de las técnicas definidas anteriormente.
[0038] Además, la composición de la invención cumple con la prueba de disgregación de comprimidos efervescentes establecida por la Ph. Eur., que consiste en colocar la composición de la invención en un vaso de precipitados de 250 ml que contiene 200 ml de agua R a 15-25 °C y disgregarla en un tiempo igual o inferior a 5 minutos. En otra realización, la composición de la invención se disgrega en un tiempo igual o inferior a 4 minutos, preferentemente igual o inferior a 3 minutos; más preferentemente igual o inferior a 2 minutos, mucho más preferentemente igual o inferior a 1 minuto y 30 segundos cuando se coloca en un vaso de precipitados de 250 ml que contiene 200 ml de agua R a 15-25 °C.
[0039] La expresión "farmacéuticamente aceptable" se refiere al producto adecuado para su uso en la tecnología farmacéutica para preparar composiciones de uso médico. Cada componente debe ser aceptable en el sentido de ser compatible con los otros ingredientes de la composición. También debe ser adecuado para su uso en contacto con el tejido u el órgano de seres humanos y animales sin excesiva toxicidad, irritación, respuesta alérgica, inmunogenicidad u otros problemas o complicaciones que corresponden a una relación beneficio/riesgo razonable.
[0040] La composición de la invención comprende uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 1 al 31 % en peso de la composición, preferentemente del 1 al 28 %, más preferentemente del 1 al 25 %, mucho más preferentemente del 1 al 22 %, aún más preferentemente del 1 al 19 %, aún más preferentemente del 1 al 16 %, más preferentemente del 1 al 13 %, e incluso más preferentemente del 1 al 12 %. En otra realización, la composición de la invención comprende uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 2 al 31 % en peso de la composición, preferentemente del 3 al 31 %, más preferentemente del 4 al 31 %, mucho más preferentemente del 5 al 31 %, aún más preferentemente del 6 al 31 %, aún más preferentemente del 7 al 31 %. En otra realización, la composición de la invención comprende uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 2 al 28 % en peso de la composición, preferentemente del 3 al 25 %, más preferentemente del 5 al 22 %, mucho más preferentemente del 5 al 19 %, aún más preferentemente del 5 al 16 %, aún más preferentemente del 5 al 13 %, aún más preferentemente del 7 al 12 %. Como se ha mencionado anteriormente, estas composiciones son ventajosas debido a la baja cantidad de carbonatos de metales alcalinotérreos, lo que da como resultado una mezcla mucho menos abrasiva para la compresión. En otra realización, la composición de la invención comprende uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 26 al 31 % en peso de la composición, preferentemente del 27,5 al 30 %.
[0041] En una realización, la composición de la invención comprende uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables seleccionados del grupo que consiste en carbonato de calcio, carbonato de magnesio, hidrogenocarbonato de calcio, hidrogenocarbonato de magnesio y una mezcla de los mismos. En una realización, la composición de la invención comprende carbonato de calcio como un carbonato de metal alcalinotérreo farmacéuticamente aceptable. En una realización, la composición de la invención comprende un carbonato de metal alcalinotérreo farmacéuticamente aceptable; particularmente carbonato de calcio, en una cantidad
del 1 al 31 % en peso de la composición. Todas las realizaciones definidas anteriormente para los carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables también se aplican al carbonato de calcio.
[0042] La composición de la invención comprende uno o más ácidos farmacéuticamente aceptables, sales ácidas farmacéuticamente aceptables o una mezcla de los mismos, en una cantidad del 2 al 62 % en peso de la composición, preferentemente del 2 al 56 %, más preferentemente del 2 al 50 %, mucho más preferentemente del 2 al 44 %, aún más preferentemente del 2 al 38 %, aún más preferentemente del 2 al 32 %, aún más preferentemente del 2 al 27 %. En otra realización, la composición de la invención comprende uno o más ácidos farmacéuticamente aceptables, sales ácidas farmacéuticamente aceptables o una mezcla de los mismos en una cantidad del 4 al 62% en peso de la composición, preferentemente del 6 al 62 %, más preferentemente del 8 al 62 %, mucho más preferentemente del 10 al 62 %, aún más preferentemente del 12 al 62 %. En otra realización, la composición de la invención comprende uno o más ácidos farmacéuticamente aceptables, sales ácidas farmacéuticamente aceptables o una mezcla de los mismos en una cantidad del 4 al 56 % en peso de la composición, preferentemente del 6 al 50 %, más preferentemente del 10 al 44 %, mucho más preferentemente del 10 al 38 %, aún más preferentemente del 10 al 32 %, aún más preferentemente del 10 % al 27 %, aún más preferentemente del 12 al 27 %. En otra realización, la composición de la invención comprende uno o más ácidos farmacéuticamente aceptables, sales ácidas farmacéuticamente aceptables o una mezcla de los mismos en una cantidad del 55 al 61 % en peso de la composición, preferentemente del 55,5 al 60,5 %. Como se ha mencionado anteriormente, estas composiciones son ventajosas debido a la baja cantidad de ácidos farmacéuticamente aceptables o sales ácidas farmacéuticamente aceptables, lo que da como resultado una mezcla mucho menos abrasiva para la compresión.
[0043] En una realización, la composición de la invención comprende uno o más ácidos farmacéuticamente aceptables. En una realización, la composición de la invención comprende uno o más ácidos farmacéuticamente aceptables seleccionados del grupo que consiste en un ácido inorgánico, un ácido monocarboxílico, un ácido dicarboxílico, un ácido tricarboxílico y ceto- y oxi-derivados de los mismos. En una realización, la composición de la invención comprende uno o más ácidos farmacéuticamente aceptables seleccionados del grupo que consiste en ácido fosfórico, ácido cítrico, ácido glutámico, ácido glutárico, ácido málico, ácido maleico, ácido adípico, ácido ascórbico, ácido fumárico, ácido tartárico, ácido alfa- y beta-cetoglutárico, ácido aspártico, ácido múcico, ácido glucónico, ácido glucurónico, ácido glicólico, ácido láctico, ácido lactobiónico, ácido malónico y ácido succínico. En una realización, la composición de la invención comprende uno o más ácidos farmacéuticamente aceptables seleccionados del grupo que consiste en ácido cítrico, ácido málico, ácido maleico, ácido glutámico, ácido glutárico y ácido alfa-cetoglutárico. Particularmente, en la cantidad y relación molar como se han definido anteriormente y a continuación en la presente invención.
[0044] En una realización, la composición de la invención comprende una o más sales ácidas farmacéuticamente aceptables. La expresión "sal ácida" se refiere a una sal que produce una solución ácida después de disolverse en un disolvente. La solución ácida formada por la sal ácida se produce durante la neutralización parcial de ácidos dipróticos o polipróticos.
[0045] Se produce una semineutralización debido al resto de átomos de hidrógeno reemplazables de la disociación parcial de ácidos débiles que no han reaccionado con iones de hidróxido (OH-) para crear moléculas de agua. Para el fin de la invención, una sal ácida es un compuesto iónico que consiste en un anión, aportado por un ácido de partida débil; y un catión, aportado por una fuerte base de partida.
[0046] En una realización, la sal ácida es una sal de adición de ácido formada entre un ácido inorgánico u orgánico y un aminoácido. Los ejemplos de aminoácidos apropiados incluyen, sin limitación, clorhidrato de glicina o clorhidrato de alanina. En otra realización, la sal ácida es una sal de adición de ácido seleccionada del grupo que consiste en clorhidrato de glicina, clorhidrato de alanina, clorhidrato de fenilalanina y clorhidrato de leucina. Particularmente, en la cantidad y relación molar como se han definido anteriormente y a continuación en la presente invención.
[0047] En una realización, la composición de la invención comprende una mezcla de uno o más ácidos farmacéuticamente aceptables y una o más sales ácidas farmacéuticamente aceptables. En una realización, la composición de la invención comprende una mezcla de uno o más ácidos farmacéuticamente aceptables seleccionados del grupo que consiste en ácido fosfórico, ácido cítrico, ácido glutámico, ácido glutárico, ácido málico, ácido maleico, ácido adípico, ácido ascórbico, ácido fumárico, ácido tartárico, ácido a- y p-cetoglutárico, ácido aspártico, ácido múcico, ácido glucónico, ácido glucurónico, ácido glicólico, ácido láctico, ácido lactobiónico, ácido malónico, ácido succínico; y una o más sales ácidas farmacéuticamente aceptables seleccionadas del grupo que consiste en clorhidrato de glicina, clorhidrato de alanina, clorhidrato de fenilalanina y clorhidrato de leucina. En una realización, la composición de la invención comprende una mezcla de uno o más ácidos farmacéuticamente aceptables seleccionados del grupo que consiste en ácido cítrico, ácido málico y ácido maleico; y una o más sales ácidas farmacéuticamente aceptables seleccionadas del grupo que consiste en clorhidrato de glicina, clorhidrato de alanina, clorhidrato de fenilalanina y clorhidrato de leucina. Particularmente, en la cantidad y relación molar como se han definido anteriormente y a continuación en la presente invención.
[0048] En una realización, la composición de la invención es aquella en donde cuando la composición se disgrega
después de colocarla en un vaso de precipitados que contiene 200 ml de agua R a 15-25 °C, la solución de agua resultante tiene un pH de 1,5 a 7; particularmente un pH de 2 a 6,5; y más particularmente de 2,5 a 6,5. El pH mencionado anteriormente permite una disgregación más rápida permitiendo mejorar la biodisponibilidad del principio farmacéutico activo y también tener un sabor agradable y, por tanto, mejorando la fidelidad al tratamiento. Asimismo, el pH mencionado anteriormente de 2,5 a 6,5 permite una disgregación y disolución más rápida dando como resultado una solución transparente que permite una mejora mejorada de la biodisponibilidad del principio farmacéutico activo y también tiene un sabor agradable y, por tanto, mejorando el cumplimiento del tratamiento.
[0049] En una realización preferida, las composiciones de la invención comprenden ácidos o sales ácidas farmacéuticamente aceptables, o una mezcla de los mismos; y carbonatos o hidrogenocarbonatos de metales alcalinotérreos o una mezcla de los mismos en una relación molar de 0,5:1 a 8:1; preferentemente de 0,5:1 a 5:1, más preferentemente de 0,8:1 a 3:1. En una realización, la relación molar entre los ácidos farmacéuticamente aceptables, las sales ácidas, o una mezcla de los mismos, y los carbonatos o hidrogenocarbonatos de metales alcalinotérreos o mezclas de los mismos es de 1,5:1 a 2,5:1. En una realización más preferida, las composiciones de la invención comprenden ácidos o sales ácidas farmacéuticamente aceptables, o una mezcla de los mismos; y carbonato de calcio en una relación molar de 0,5:1 a 8:1; preferentemente de 0,5:1 a 5:1, más preferentemente de 0,8:1 a 3:1. En una realización, la relación molar entre los ácidos farmacéuticamente aceptables, las sales ácidas farmacéuticamente aceptables, o mezclas de los mismos, y el carbonato de calcio es de 1:1 a 2,5:1.
[0050] En una realización, la composición de la invención comprende uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 7 al 12 % en peso de la composición, y, uno o más ácidos o sales ácidas farmacéuticamente aceptables o una mezcla de los mismos en una cantidad del 12 al 27 % en peso de la composición. En una realización, la composición de la invención comprende uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 7 al 12 % en peso de la composición; y uno o más ácidos o sales ácidas farmacéuticamente aceptables en una cantidad del 12 al 27 % en peso de la composición; en donde la relación molar entre el uno o más ácidos o sales ácidas farmacéuticamente aceptables; y el uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos es de 0,5:1 a 8:1; preferentemente de 0,5:1 a 5:1, más preferentemente de 0,8:1 a 3:1. En una realización, la relación molar entre el uno o más ácidos o sales ácidas farmacéuticamente aceptables y el uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos es de 1,5:1 a 2,5:1.
[0051] En una realización, la composición de la invención comprende carbonato de calcio en una cantidad del 7 al 12 % en peso de la composición, y, uno o más ácidos o sales ácidas farmacéuticamente aceptables en una cantidad del 12 al 27 % en peso de la composición. En una realización, la composición de la invención comprende carbonato de calcio en una cantidad del 7 al 12% en peso de la composición; y uno o más ácidos o sales ácidas farmacéuticamente aceptables en una cantidad del 12 al 27 % en peso de la composición; en donde la relación molar entre el uno o más ácidos o sales ácidas farmacéuticamente aceptables; y el carbonato de calcio es de 0,5:1 a 8:1; preferentemente de 0,5:1 a 5:1, más preferentemente de 0,8:1 a 3:1. En una realización, la relación molar entre el uno o más ácidos o sales ácidas farmacéuticamente aceptables y el carbonato de calcio es de 1,5:1 a 2,5:1.
[0052] En una realización, la composición de la invención comprende carbonato de calcio en una cantidad del 27,5 al 30 % en peso de la composición, y, uno o más ácidos o sales ácidas farmacéuticamente aceptables en una cantidad del 55,5 al 60,5 % en peso de la composición. En una realización, la composición de la invención comprende carbonato de calcio en una cantidad del 27,5 al 30 % en peso de la composición; y uno o más ácidos o sales ácidas farmacéuticamente aceptables en una cantidad del 55,5 al 60,5 % en peso de la composición; en donde la relación molar entre el uno o más ácidos o sales ácidas farmacéuticamente aceptables; y el carbonato de calcio es de 0,5:1 a 8:1; preferentemente de 0,5:1 a 5:1, más preferentemente de 0,8:1 a 3:1. En una realización, la relación molar entre el uno o más ácidos o sales ácidas farmacéuticamente aceptables y el carbonato de calcio es de 1:1 a 2,5:1.
[0053] La cantidad de la "pareja ácido-base efervescente" de la composición de la presente invención es del 3 al 93 % en peso de la composición, particularmente del 3 al 80 %; particularmente del 6 % al 80 %; más particularmente del 9 % al 75 %, mucho más particularmente del 12 al 66 %, aún más particularmente del 15 al 57 %. En una realización, la cantidad de la "pareja ácido-base efervescente" de la composición de la presente invención es del 18 al 52 % en peso de la composición, particularmente del 18 al 57%, más particularmente del 20 al 48%, mucho más particularmente del 20 al 42 %. En otra realización, la cantidad de la "pareja ácido-base efervescente" de la composición de la presente invención es del 26 al 36 % en peso de la composición. Las expresiones "pareja ácidobase efervescente", "par ácido-base efervescente", "pareja efervescente" y "par efervescente" tienen el mismo significado y se utilizan indistintamente. Se refieren a la suma de la cantidad del componente ácido y un componente alcalino/básico. Para el fin de la presente invención, la expresión "componente ácido" se refiere a la suma de los pesos del ácido y/o sales ácidas farmacéuticamente aceptables y la expresión "componente básico" se refiere a la cantidad del uno o más carbonato o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables presentes en la composición. Como se ha mencionado anteriormente, la cantidad del par efervescente de la composición de la presente invención es menor del 93 % en peso de la composición, particularmente menor del 80 %, preferentemente menor del 75 %, más preferentemente menor del 66 %, mucho más preferentemente menor del 57 %, aún más preferentemente menor del 48 %. En una realización, la cantidad del par efervescente de la composición es menor del 42 % en peso de la composición. En otra realización la cantidad del par efervescente de la composición es menor del
91 % en peso de la composición, particularmente igual o inferior al 90,5 %. Las composiciones de la invención son ventajosas debido a que los contenidos del par efervescente inferiores a los divulgados en el estado de la técnica son mucho menos abrasivos y, de este modo, prolongan la vida útil de las herramientas de formación de comprimidos, particularmente cuando se utilizan métodos de granulación por vía seca o de compresión directa.
[0054] En una realización, la composición de la invención es aquella que comprende:
ácido cítrico como ácido farmacéuticamente aceptable;
uno o más carbonatos de metales alcalinotérreos; particularmente carbonato de calcio; y
la relación molar entre el ácido cítrico y el carbonato de metal alcalinotérreo es de 0,5:1 a 5:1; particularmente de 0,8:1 a 2:1.
[0055] En una realización, la composición de la invención es aquella que comprende:
ácido maleico como ácido farmacéuticamente aceptable;
uno o más carbonatos de metales alcalinotérreos; particularmente carbonato de calcio; y
la relación molar entre el ácido farmacéuticamente aceptable y el carbonato de metal alcalinotérreo es de 0,8:1 a 5:1; preferentemente de 1,5:1 a 3:1.
[0056] En una realización, la composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene una distribución de tamaño de partícula de modo que D(v, 50) es mayor de 67 μm, particularmente mayor de 80 μm, más particularmente mayor de 100 μm, y mucho más particularmente mayor de 125 μm. El término "D(v, 50)", también conocido como diámetro medio en volumen, se refiere al diámetro en el que el 50 % de la distribución del volumen está por encima y el 50 % está por debajo. El D(v, 50) puede medirse por los métodos conocidos divulgados en el estado de la técnica. Comúnmente, el D(v,50) se calcula midiendo el diámetro de esfera equivalente característico, conocido como diámetro en volumen, por difracción láser. En la presente invención, el D(v,50) se ha determinado utilizando un aparato Malvern.
[0057] Sin embargo, el experto en la materia puede utilizar otros aparatos equivalentes. Las composiciones de la invención que comprenden un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tienen D (v, 50) de la realización son ventajosas para la preparación de composiciones efervescentes por compresión directa, granulación por vía seca y granulación seca activada por humedad (MADG).
[0058] En una realización, la composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene una distribución de tamaño de partícula de modo que D(v, 10) es mayor de 12 μm, particularmente mayor de 25 μm, más particularmente mayor de 30 μm, y mucho más particularmente mayor de 35 μm. El término "D(v, 10)" se refiere al diámetro en el que el 10 % de la distribución del volumen está por debajo de este valor. El D(v, 10) puede medirse por los métodos conocidos divulgados en el estado de la técnica. Comúnmente, el D(v, 10) se calcula midiendo el diámetro de esfera equivalente característico, conocido como diámetro en volumen, por difracción láser. En la presente invención, el D(v,10) se ha determinado utilizando un aparato Malvern. Sin embargo, el experto en la materia puede utilizar otros aparatos equivalentes. Las composiciones de la invención que comprenden un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tienen D (v, 10) de la realización son ventajosas para la preparación de composiciones efervescentes por compresión directa, granulación por vía seca y granulación seca activada por humedad (MADG).
[0059] En una realización, la composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene una distribución de tamaño de partícula de modo que D(v, 90) es mayor de 213 μm; particularmente mayor de 265 μm, más particularmente mayor de 330 μm, y mucho más particularmente mayor de 410 μm. El término "D(v, 90)" se refiere al diámetro en el que el 90 % de la distribución del volumen está por debajo de este valor. El D(v, 90) puede medirse por los métodos conocidos divulgados en el estado de la técnica. Comúnmente, el D(v, 90) se calcula midiendo el diámetro de esfera equivalente característico, conocido como diámetro en volumen, por difracción láser. En la presente invención, el D(v,90) se ha determinado utilizando un aparato Malvern. Sin embargo, el experto en la materia puede utilizar otros aparatos equivalentes. Las composiciones de la invención que comprenden un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tienen D (v, 90) de la realización son ventajosas para la preparación de composiciones efervescentes por compresión directa, granulación por vía seca y granulación seca activada por humedad (MADG).
[0060] En una realización, la composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene un intervalo de
tamaño de partícula igual o inferior a 3,5, particularmente igual o inferior a 3, más particularmente igual o inferior a 2,5, y mucho más particularmente igual o inferior a 2. Las expresiones "intervalo de tamaño de partícula" o "intervalo de PS" tienen el mismo significado y se utilizan indistintamente. Se refieren al ancho del pico que indica la distribución de tamaño de partícula monomodal. El intervalo de tamaño de partícula se calcula mediante la siguiente fórmula [d(v,90) - d(v,10)]/d(v,50). Para el fin de la presente invención, el D(v, 90), D(v, 10) y D(v, 50) pueden medirse mediante los métodos conocidos divulgados en el estado de la técnica como se ha definido anteriormente. Las composiciones de la invención que comprenden un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene un intervalo de tamaño de partícula de la realización son ventajosas para la preparación de composiciones efervescentes por compresión directa, granulación por vía seca y granulación seca activada por humedad (MADG).
[0061] En una realización, la composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene una distribución de tamaño de partícula de modo que: D(v, 50) es mayor de 67 μm; D(v, 10) es mayor de 12 μm; y D(v, 90) es mayor de 213 μm. En una realización particular, la composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene una distribución de tamaño de partícula de modo que: D(v, 50) es mayor de 80 μm; D(v, 10) es mayor de 25 μm; y D(v, 90) es mayor de 265 μm. En una realización más particular, la composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene una distribución de tamaño de partícula de modo que: D(v, 50) es mayor de 100 μm; D(v, 10) es mayor de 30 μm; y D(v, 90) es mayor de 330 μm. En una realización mucho más particular, la composición de la invención comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene una distribución de tamaño de partícula de modo que: D(v, 50) es mayor de 125 μm; D(v, 10) es mayor de 35 μm; y D(v, 90) es mayor de 410 μm. Las composiciones de la invención que comprenden un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida, que tiene una distribución de tamaño de partícula D(v,10), D(v,50) y D(v,90) de la realización son ventajosas para la preparación de composiciones efervescentes por compresión directa, granulación por vía seca y granulación seca activada por humedad (MADG).
[0062] En una realización, la composición de la invención es una composición granulada que comprende una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida. Como se ha mencionado anteriormente, estas composiciones granuladas de la presente invención se pueden preparar por cualquier método conocido en el estado de la técnica como, por ejemplo, pero sin limitación, granulación por vía seca, granulación por vía húmeda, granulación seca activada por humedad (MADG) y compresión directa. En una realización, la composición de la invención es una composición granulada por vía húmeda y la cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida; que tiene particularmente una distribución de tamaño de partícula D (v, 50), D(v, 10), D(v, 90), intervalo de tamaño de partícula y una combinación de D(v, 50), D(v, 10) y D(v, 90) como se ha definido anteriormente para las composiciones de compresión directa, granulación por vía seca y/o MADG de la presente invención.
[0063] Las composiciones de la presente invención comprenden uno o más excipientes o vehículos farmacéuticamente aceptables. La expresión "excipientes o vehículos farmacéuticamente aceptables" se refiere a los excipientes o vehículos adecuados para su uso en la tecnología farmacéutica para preparar composiciones de uso médico. Los excipientes y/o vehículos apropiados, y sus cantidades, pueden ser determinados fácilmente por los expertos en la materia de acuerdo con el tipo de formulación que se esté preparando.
[0064] Las composiciones sólidas de la invención se pueden formular en cualquier forma que incluya cualquier forma farmacéutica de dosis unitaria única y cualquier forma farmacéutica de dosis unitaria múltiple. La expresión "dosis unitaria única" abarca una entidad tal como un solo comprimido, una sola cápsula. El término "forma farmacéutica de dosis unitaria única" define una forma farmacéutica que consiste únicamente en una unidad que contiene la cantidad terapéuticamente eficaz del principio activo. La expresión "forma farmacéutica de dosis unitaria múltiple" define una forma farmacéutica que consiste en más de una unidad que contiene la cantidad terapéuticamente eficaz del principio activo. Por lo general, las formas farmacéuticas de dosis unitaria múltiple se basan en subunidades tales como gránulos, microgránulos o minicomprimidos. Por lo general, se administran en cápsulas de gelatina dura o se transforman en comprimidos. Por tanto, también es parte de la invención una forma farmacéutica de dosis unitaria que comprenda la composición de la presente invención. En una realización, la forma farmacéutica de dosis unitaria que comprende la composición de la presente invención es una forma farmacéutica de dosis unitaria única. En una realización, la forma farmacéutica de dosis unitaria que comprende la composición de la presente invención es una forma farmacéutica de dosis unitaria múltiple.
[0065] En una realización, las composiciones de la presente invención comprenden uno o más excipientes y/o vehículos farmacéuticamente aceptables seleccionados del grupo que consiste en diluyente, lubricante, aglutinante, deslizante, disgregante, lubricante y mezclas de los mismos.
[0066] Los términos "material de relleno" y "diluyente" tienen el mismo significado y se utilizan indistintamente. Se refieren a cualquier excipiente o (material) vehículo farmacéuticamente aceptable que complete el tamaño de una
composición, haciéndolo práctico de producir y cómodo de utilizar para el consumidor. Los materiales comúnmente utilizados como material de relleno incluyen carbonato de calcio, carbonato de magnesio, lactato cálcico, fosfato de calcio, fosfato de calcio dibásico, sulfato de calcio tribásico, carboximetilcelulosa de calcio, celulosa, productos de celulosa, tales como celulosa microcristalina y sus sales, dextrina y derivados de dextrina, dextrosa, fructosa, lactitol, lactosa, almidones y almidones modificados, carbonato de magnesio, óxido de magnesio, maltitol, maltodextrinas, maltosa, manitol, sorbitol, almidón y derivados del almidón, polidextrosa, polietilenglicol, sacarosa, azúcar, xilitol, inositol, isomalt, polivinilpirrolidona (reticulada), eritritol, sacarosa, azúcar, trehalosa y mezclas de los mismos. En una realización, la composición de la invención es aquella en donde los excipientes o vehículos farmacéuticamente aceptables comprenden uno o más materiales de relleno seleccionados del grupo que consiste en xilitol, manitol, sorbitol, inositol, isomalt, maltitol, lactitol, lactosa y povidona; particularmente isomalt. En una realización, la composición de la invención es aquella en donde los excipientes o vehículos farmacéuticamente aceptables comprenden uno o más materiales de relleno, preferentemente isomalt, en una cantidad del 10 al 50 % en peso de la composición.
[0067] El término "lubricante" se refiere a una sustancia que evita que los ingredientes de la composición se agrupen y se peguen a los punzones de comprimido o a la máquina de relleno de cápsula, y mejora la fluidez de la mezcla de la composición. Los materiales comúnmente utilizados como lubricantes incluyen oleato de sodio, estearato de sodio, benzoato de sodio, estearato de sodio, cloruro de sodio, ácido esteárico, estearilfumarato de sodio, estearato de calcio, estearato de magnesio, laurilsulfato de magnesio, estearilfumarato de sodio, ésteres de sacarosa o ácidos grasos, cinc, estearato de zinc, ácido esteárico, estearato de sacarosa, talco, leucina, polietilenglicol, behenato de glicerilo, monoestearato de glicerilo, ácido mirístico, ácido palmítico, poloxámero, benzoato de potasio y mezclas de los mismos; particularmente leucina, polietilenglicol (PEG6000) y estearato de magnesio. Particularmente, se prefiere la presencia de un lubricante cuando la composición es un comprimido para mejorar el proceso de formación de comprimidos.
[0068] El término "aglutinante" se refiere a cualquier compuesto farmacéuticamente aceptable que tenga propiedades de unión. Los materiales comúnmente utilizados como aglutinantes incluyen povidona, tal como polivinilpirrolidona K30, polímeros de metilcelulosa, hidroxietilcelulosa, hidroxietilmetilcelulosa, hidroxipropilcelulosa, L-hidroxipropilcelulosa (poco sustituida), hidroxipropilmetilcelulosa (HPMC), carboximetilcelulosa sódica, carboximetileno, carboximetil-hidroxietilcelulosa y otros derivados de celulosa, almidones y almidones modificados, goma arábiga, agar, ácido algínico, alginato de amonio, quitosano, dextratos, dextrina, dextrosa, goma guar, lactosa, fructosa, lactitol, lactosa, maltosa, maltitol, maltodextrina, maltosa, polidextrosa, óxido de polietileno, povidona, alginato de sodio, sacarosa, azúcar, sorbitol, xilitol y una mezcla de los mismos. En una realización, la composición de la invención es aquella en donde los excipientes o vehículos farmacéuticamente aceptables comprenden uno o más aglutinantes. En una realización, la composición de la invención es aquella en donde los excipientes o vehículos farmacéuticamente aceptables comprenden uno o más aglutinantes en una cantidad del 0 % al 10 % en peso de la composición.
[0069] En una realización, la composición de la invención es una composición de compresión directa y el uno o más aglutinantes se selecciona del grupo que consiste en almidones o almidones modificados, fructosa, lactitol, lactosa, maltosa, maltodextrina, manitol, sorbitol, azúcar, xilitol, dextrina, polivinilpirrolidona, lactosa y una mezcla de los mismos.
[0070] El término "deslizante" se refiere a una sustancia que mejora las características de flujo de las mezclas de polvos en estado seco. Los materiales comúnmente utilizados como deslizantes incluyen estearato de magnesio, dióxido de silicio coloidal, celulosa, sílice coloidal hidrófoba, óxido de magnesio, silicato de magnesio, trisilicato de magnesio, estearato de sodio, almidón, talco o una mezcla de los mismos. En una realización, la composición de la invención es aquella en donde los excipientes o vehículos farmacéuticamente aceptables comprenden uno o más deslizantes. En una realización, la composición de la invención es aquella en donde los excipientes o vehículos farmacéuticamente aceptables comprenden uno o más deslizantes en una cantidad del 0 % al 10 % en peso de la composición.
[0071] El término "disgregante" se refiere a una sustancia que ayuda a que la composición se rompa y libere el principio activo de la misma, particularmente, comprimidos y cápsulas. Los materiales comúnmente utilizados como disgregantes incluyen agar, ácido algínico, asparagina, alginato de calcio, quitosano, dióxido de silicio coloidal, almidón de maíz y derivados del almidón de maíz, croscarmelosa de sodio, crospovidona, glicina, goma guar, hidroxipropilcelulosa, hidroxipropilalmidón, lactosa, maltosa, metilcelulosa, povidona, alginato de sodio, glicolato sódico de almidón, almidón y derivados del almidón o una mezcla de los mismos. En una realización, la composición de la invención es aquella en donde los excipientes o vehículos farmacéuticamente aceptables comprenden uno o más disgregantes. En una realización, la composición de la invención es aquella en donde los excipientes o vehículos farmacéuticamente aceptables comprenden uno o más disgregantes en una cantidad del 0 % al 10 % en peso de la composición. En el caso de composiciones efervescentes, estas no pueden contener disgregantes debido a que el par efervescente puede actuar como tal.
[0072] Adicionalmente, las composiciones de la presente invención pueden contener otros ingredientes, tales como saborizantes, agentes enmascarantes del sabor, edulcorantes, colorantes, y otros componentes conocidos en el estado de la técnica para su uso en formulaciones sólidas.
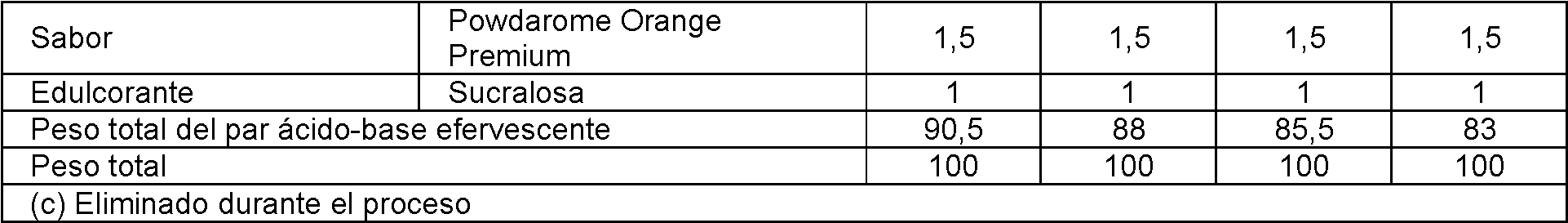
[0073] El término "edulcorante" se refiere a una sustancia que da el sabor básico de dulzura a la composición. Los materiales comúnmente utilizados como edulcorantes incluyen acesulfamo de potasio, aspartamo, ácido ciclámico y sales ciclámicas, sacarina y sales de sacarina, tagatosa, taumatina, sucralosa o una mezcla de los mismos.
[0074] En una realización, la composición de la presente invención comprende:
una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida;
uno o más carbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 1 al 22 % en peso de la composición; particularmente carbonato de calcio,
uno o más ácidos farmacéuticamente aceptables en una cantidad del 2 al 44 % en peso de la composición; particularmente ácido cítrico, ácido maleico o mezclas de los mismos,
uno o más diluyentes en una cantidad del 5 al 50 % en peso; particularmente isomalt,
uno o más lubricantes en una cantidad del 1 al 10 % en peso; particularmente leucina, y
opcionalmente uno o más excipientes o vehículos farmacéuticamente aceptables,
siendo la suma de ingredientes el 100 %.
[0075] En una realización, la composición de la presente invención comprende:
una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida;
uno o más carbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 1 al 16 % en peso de la composición; particularmente carbonato de calcio,
uno o más ácidos farmacéuticamente aceptables en una cantidad del 2 al 32 % en peso de la composición; particularmente ácido cítrico, ácido maleico o mezclas de los mismos,
uno o más diluyentes en una cantidad del 5 al 45 % en peso; particularmente isomalt, y
uno o más lubricantes en una cantidad del 1 al 8 % en peso; particularmente leucina, y
opcionalmente uno o más excipientes o vehículos farmacéuticamente aceptables,
siendo la suma de ingredientes el 100 %.
[0076] En una realización, la composición de la presente invención comprende:
una cantidad terapéuticamente eficaz de un principio farmacéutico activo en una cantidad del 5 al 45 % en peso de la composición, en donde dicho principio farmacéutico activo es lacosamida;
uno o más carbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 1 al 15 % en peso de la composición; particularmente carbonato de calcio,
uno o más ácidos farmacéuticamente aceptables en una cantidad del 2 al 30 % en peso de la composición; particularmente ácido cítrico, ácido maleico o mezclas de los mismos,
uno o más diluyentes en una cantidad del 5 al 45 % en peso; particularmente isomalt,
uno o más lubricantes en una cantidad del 1 al 8 % en peso; particularmente leucina, y
opcionalmente uno o más excipientes o vehículos farmacéuticamente aceptables,
siendo la suma de ingredientes el 100 %.
[0077] En una realización, la composición de la presente invención comprende:
una cantidad terapéuticamente eficaz de un principio farmacéutico activo en una cantidad del 20 al 45 % en peso de la composición, en donde dicho principio farmacéutico activo es lacosamida;
uno o más carbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 5 al 15 % en peso de la composición; particularmente carbonato de calcio,
uno o más ácidos farmacéuticamente aceptables en una cantidad del 10 al 30% en peso de la composición; particularmente ácido cítrico, ácido maleico o mezclas de los mismos,
uno o más diluyentes en una cantidad del 9 al 45 % en peso; particularmente isomalt,
uno o más lubricantes en una cantidad del 1 al 8 % en peso; particularmente leucina, y
opcionalmente uno o más excipientes o vehículos farmacéuticamente aceptables,
siendo la suma de ingredientes el 100 %.
[0078] En una realización, la composición de la presente invención comprende:
una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida;
uno o más carbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 1 al 35 % en peso de la composición; particularmente carbonato de calcio,
uno o más ácidos farmacéuticamente aceptables en una cantidad del 2 al 65 % en peso de la composición; particularmente ácido cítrico, ácido maleico o mezclas de los mismos,
uno o más lubricantes en una cantidad del 1 al 10% en peso; particularmente leucina, benzoato de sodio, polietilenglicol 6000 o una mezcla de los mismos y
opcionalmente uno o más excipientes o vehículos farmacéuticamente aceptables,
siendo la suma de ingredientes el 100 %.
[0079] En una realización, la composición de la presente invención comprende:
una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida;
uno o más carbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 5 al 35 % en peso de la composición; particularmente carbonato de calcio,
uno o más ácidos farmacéuticamente aceptables en una cantidad del 10 al 65% en peso de la composición; particularmente ácido cítrico, ácido maleico o mezclas de los mismos,
uno o más lubricantes en una cantidad del 1 al 10 % en peso; particularmente leucina, benzoato de sodio, polietilenglicol 6000 o una mezcla de los mismos y
opcionalmente uno o más excipientes o vehículos farmacéuticamente aceptables,
siendo la suma de ingredientes el 100 %.
[0080] En una realización, la composición de la presente invención comprende:
una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida;
uno o más carbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 10 al 35 % en peso de la composición; particularmente carbonato de calcio,
uno o más ácidos farmacéuticamente aceptables en una cantidad del 30 al 65 % en peso de la composición; particularmente ácido cítrico, ácido maleico o mezclas de los mismos,
uno o más lubricantes en una cantidad del 1 al 10% en peso; particularmente leucina, benzoato de sodio, polietilenglicol 6000 o una mezcla de los mismos y
opcionalmente uno o más excipientes o vehículos farmacéuticamente aceptables,
siendo la suma de ingredientes el 100 %.
[0081] En una realización, la composición de la invención es una composición efervescente seleccionada entre polvo efervescente, granulados efervescentes, microgránulos efervescentes y comprimidos efervescentes. En una realización, la composición de la invención es un comprimido efervescente. Todas las realizaciones divulgadas para la composición de la composición farmacéutica sólida efervescente (tomadas solas o junto con otras realizaciones divulgadas anteriormente o a continuación) divulgadas en la presente invención también se aplican al comprimido efervescente.
[0082] En una realización, la composición de la invención es un comprimido efervescente seleccionado del grupo que consiste en comprimido efervescente de compresión directa y comprimido efervescente de granulación. En una realización, la composición de la invención es un comprimido efervescente de granulación seleccionada entre granulación por vía seca, granulación por vía húmeda y granulación seca activada por humedad (MADG); particularmente granulación por vía seca y granulación seca activada por humedad.
[0083] Comúnmente, la combinación de excipientes de las composiciones puede modificar algunos parámetros físicos de la composición tales como, por ejemplo, la dureza y la disgregación. La dureza de los comprimidos es importante para transportar comprimidos sin ninguna rotura y utilizándolos de manera segura; la disgregación también es importante para dispersarse rápidamente, en el caso del producto efervescente la disgregación se realiza por efervescencia al entrar en contacto con el agua y quedando el producto listo para su uso en poco tiempo. A medida que el comprimido se vuelve más duro, la fragilidad se vuelve menor, pero esto hace que el tiempo de efervescencia se vuelva más lento. En particular, las composiciones sólidas efervescentes de la presente invención no se rompen durante el proceso de preparación y transporte; y también se disgregan en agua rápidamente por efervescencia.
[0084] En una realización, la composición de la invención es un comprimido que tiene una dureza de 15 a 140 N; particularmente de 15 a 70 N, más particularmente de 15 a 40 N, mucho más particularmente de 20 a 35 N.
[0085] En una realización, la composición de la invención es un comprimido que tiene una humedad residual igual o inferior al 2 % en relación con el peso total de la composición.
[0086] También es parte de la invención un proceso para la preparación de las composiciones de la presente invención. Los expertos en la materia pueden determinar fácilmente el proceso apropiado de acuerdo con el tipo de formulación que se esté preparando. Todas las realizaciones divulgadas para la composición de la invención, también se aplican a sus procesos de preparación.
[0087] En una realización, las composiciones sólidas efervescentes de la presente invención son polvo efervescente. Por ejemplo, el proceso comprende: (a) mezclar los excipientes adecuados con el principio farmacéuticamente activo; y (b) opcionalmente lubricar la mezcla obtenida en la etapa (a).
[0088] En una realización, las composiciones sólidas efervescentes de la presente invención son gránulos efervescentes. Por ejemplo, el proceso comprende preparar una suspensión de granulación del principio activo en un disolvente adecuado y opcionalmente otros excipientes adecuados tamizando el principio activo húmedo a través de un tamiz que tiene un tamiz ligero apropiado; secar la suspensión húmeda obtenida en la etapa anterior; y tamizar el granulado seco obtenido en la etapa anterior a través de un tamiz que tenga un tamiz ligero apropiado.
[0089] Otro proceso alternativo para la preparación de gránulos comprende mezclar agua con el principio activo y amasar en un mortero; tamizar a través de un tamiz que tenga un tamiz ligero apropiado; secar la mezcla obtenida en la etapa anterior; y tamizar a través de un tamiz que tenga un tamiz ligero apropiado.
[0090] En una realización, la composición sólida efervescente de la presente invención es un comprimido efervescente. Cualquier método para la preparación de comprimidos de compresión directa o comprimidos de granulación divulgado en el estado de la técnica puede utilizarse para la preparación de la presente invención como se muestra en los datos experimentales (cf.sección 2.1.2.). Particularmente, los comprimidos de granulación por vía seca de la presente invención se pueden preparar mediante el proceso de granulación por vía seca comúnmente utilizado y también mediante un proceso de granulación seca activada por humedad (abreviado como MADG) o un proceso de granulación seca activada por efervescencia con humedad (abreviado como MEDG).
[0091] En una realización, la composición sólida efervescente de la presente invención es un comprimido de compresión directa. Por ejemplo, el proceso para la preparación de los comprimidos de compresión directa de la invención comprende las siguientes etapas:
(c) mezclar los excipientes adecuados con el principio farmacéuticamente activo;
(d) opcionalmente lubricar la mezcla obtenida en la etapa (c); y
(e) comprimir la mezcla obtenida en la etapa (d) con un punzón adecuado para producir una composición de compresión directa de la presente invención.
[0092] En una realización, el proceso para preparar los comprimidos de compresión directa de la presente invención comprende las siguientes etapas:
(f) mezclar diluyente(s) con el principio farmacéuticamente activo y opcionalmente con otros excipientes adecuados;
(g) opcionalmente lubricar la mezcla obtenida en la etapa (f); y
(h) comprimir la mezcla obtenida en la etapa (g) con un punzón adecuado para producir una composición de compresión directa de la presente invención.
[0093] En una realización, la composición sólida efervescente de la presente invención es un comprimido de granulación.
[0094] En una realización, la composición sólida efervescente de la presente invención es un comprimido de granulación por vía seca. En una realización, el proceso para la preparación de comprimidos de granulación por vía seca de la invención comprende las siguientes etapas:
(i) preparar el principio activo granulado;
(j) mezclar los excipientes adecuados con el principio activo granulado obtenido en la etapa (i);
(k) opcionalmente lubricar la mezcla obtenida en la etapa (j); y
(l) comprimir la mezcla obtenida en la etapa (k) con un punzón adecuado para producir una composición de compresión por granulación por vía seca de la presente invención.
[0095] En una realización, el proceso para preparar los comprimidos de compresión por granulación por vía seca de la presente invención comprende las siguientes etapas:
(m) preparar el principio activo granulado mediante:
(m1) compactación del principio activo y opcionalmente otros excipientes adecuados;
(m2) tamizado de la mezcla compactada obtenida en la etapa (m1) a través de un tamiz que tenga un tamiz ligero apropiado;
(n) mezclar los excipientes adecuados con el principio activo granulado obtenido en la etapa (m);
(p) opcionalmente lubricar la mezcla obtenida en la etapa (n); y
(q) comprimir la mezcla obtenida en la etapa (q) con un punzón adecuado para producir una composición de compresión por granulación por vía seca de la presente invención.
[0096] En una realización, la composición sólida efervescente de la presente invención es un comprimido de granulación seca activada por humedad (MADG). En una realización, el proceso para la preparación de comprimidos por MADG de la presente invención comprende las siguientes etapas:
(m") preparar el principio activo granulado mezclando el principio activo con agua en una cantidad del 1 al 4 % en peso y opcionalmente otros excipientes adecuados;
(n) mezclar los excipientes adecuados con el principio activo granulado obtenido en la etapa (m");
(p) opcionalmente lubricar la mezcla obtenida en la etapa (n); y
(q) comprimir la mezcla obtenida en la etapa (q) con un punzón adecuado para producir una composición de compresión por granulación por vía seca de la presente invención.
[0097] En una realización, la etapa (m") del proceso para la preparación de los comprimidos por MADG de la presente invención comprende pulverizar el agua sobre el principio activo y opcionalmente otros excipientes adecuados.
[0098] En una realización, la composición sólida efervescente de la presente invención es un
comprimido de granulación por vía húmeda. En una realización, el proceso para preparar los comprimidos de compresión por granulación por vía húmeda de la presente invención comprende las siguientes etapas:
(m') preparar el principio activo granulado mediante:
(m1') preparación de una suspensión de granulación del principio activo en uno o más disolventes orgánicos adecuados y opcionalmente otros excipientes adecuados;
(m2') tamizado del principio activo húmedo a través de un tamiz que tenga un tamiz ligero apropiado;
(m3') secado del principio activo obtenido en la etapa (m2'); y
(m4') tamizado del principio activo seco obtenido en la etapa (m3') a través de un tamiz que tenga un tamiz ligero apropiado.
(n') mezclar los excipientes adecuados con el principio activo granulado obtenido en la etapa (m');
(p') opcionalmente lubricar la mezcla obtenida en la etapa (n'); y
(q') comprimir la mezcla obtenida en la etapa (q') con un punzón adecuado para producir una composición de compresión por granulación por vía húmeda de la presente invención.
[0099] En una realización, el proceso para preparar los comprimidos de compresión por granulación por vía húmeda de la presente invención comprende las siguientes etapas:
(r) preparar un primer granulado que comprende el uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables como se definen en la presente invención siguiendo el proceso como se ha definido anteriormente; y opcionalmente el principio activo;
(s) preparar un segundo granulado que comprende el uno o más ácidos farmacéuticamente aceptables, sales ácidas farmacéuticamente aceptables o, alternativamente, una mezcla de los mismos como se define en la presente invención siguiendo el proceso como se ha definido anteriormente; y opcionalmente el principio activo; (n") mezclar los excipientes adecuados con el primer granulado obtenido en la etapa (r); y el segundo granulado obtenido en la etapa (s); y opcionalmente el principio activo;
(p') opcionalmente lubricar la mezcla obtenida en la etapa (n'); y
(q') comprimir la mezcla obtenida en la etapa (q') con un punzón adecuado para producir una composición de compresión por granulación por vía húmeda de la presente invención.
[0100] En una realización, el disolvente apropiado de las etapas de granulación de los procesos definidos anteriormente se selecciona del grupo que consiste en agua, disolventes orgánicos solubles, tales como alcoholes seleccionados entre etanol e isopropanol, y una mezcla de los mismos.
[0101] Otro aspecto de la invención se refiere a una composición de la presente invención como se ha definido anteriormente para su uso como medicamento. En una realización, la composición de la presente invención como se ha definido anteriormente cuando el principio activo es lacosamida para su uso en el tratamiento de ataques de inicio parcial. En una realización, la composición de la presente invención como se ha definido anteriormente cuando el principio activo es lacosamida para su uso en el tratamiento de ataques de inicio parcial. Este aspecto también podría formularse como el uso de la composición de la invención que comprende lacosamida como se ha definido anteriormente para la preparación de un medicamento para el tratamiento de ataques de inicio parcial. También se refiere a un método para el tratamiento de un mamífero que padece ataques de inicio parcial, en donde el método comprende administrar a dicho mamífero la composición de la presente invención que comprende lacosamida como se ha definido anteriormente.
[0102] Las composiciones de la presente invención como se han definido anteriormente están particularmente indicadas para enfermedades crónicas debido a que están prácticamente libres de sodio. Entonces, otra realización de este aspecto de la invención se refiere a composiciones de la presente invención como se han definido anteriormente para su uso en el tratamiento de enfermedades crónicas. En una realización preferida, la enfermedad crónica es, pero sin limitación, epilepsia; trastornos tromboembólicos; trastornos psicóticos, tales como esquizofrenia o trastorno bipolar; trastornos neurodegenerativos, tales como enfermedad de Parkinson o Alzheimer; trastornos alérgicos, tales como rinitis alérgica; trastornos asociados al vértigo; osteoporosis; y dolor crónico.
[0103] A lo largo de toda la descripción y las reivindicaciones la palabra "comprender" y variaciones de la palabra, no pretenden excluir otras características técnicas, aditivos, componentes o etapas. Asimismo, la palabra "comprender" abarca el caso de "consistir en". Objetos, ventajas y características adicionales de la invención serán evidentes para los expertos en la materia tras examinar la descripción o pueden aprenderse poniendo en práctica la invención. Los siguientes ejemplos se proporcionan a modo de ilustración y no pretenden ser limitantes de la presente invención. Asimismo, la presente invención cubre todas las posibles combinaciones de realizaciones particulares y preferidas divulgadas en el presente documento.
Ejemplos
1. Consideración general
[0104] Método para la medida del tiempo de efervescencia de las composiciones. de la invención de acuerdo con la prueba de disgregación para comprimidos efervescentes de la Eur. Pharm. 9.8 versión online para comprimido efervescente lo que implica:
DEFINICIÓN: Los comprimidos efervescentes son comprimidos no recubiertos que contienen generalmente sustancias ácidas y carbonatos o hidrogenocarbonatos, que reaccionan rápidamente en presencia de agua para liberar dióxido de carbono. Están destinados a ser disueltos o dispersados en agua antes de la administración. PRUEBAS: Disgregación. Coloque 1 comprimido en un vaso de precipitados que contenga 200 ml de agua R a 15-25 °C; se desprenden numerosas burbujas de gas. Cuando cese el desprendimiento de gas alrededor del comprimido o sus fragmentos, el comprimido se ha disgregado, disolviéndose o dispersándose en el agua de manera que no queden aglomerados de partículas. Repita la operación en otros 5 comprimidos. Los comprimidos cumplen con la prueba si cada uno de los 6 comprimidos utilizados se disgregan de la manera prescrita dentro de 5 minutos, a menos que se justifique y autorice lo contrario.
[0105] Las composiciones que comprenden levetiracetam (composiciones Ej. 1-8), así como sus procesos de preparación (procesos generales 1, 2 y 3) y su caracterización (sección 21.4.1. parámetros físicos y sección 2.1.4.2. prueba de disgregación) se divulgan, pero no forman parte de la presente invención
2. Composiciones farmacéuticas sólidas
2.1. Comprimidos
2.1.1. Composiciones que comprenden levetiracetam (que no forman parte de la invención)
[0106] La composición cualitativa y cuantitativa de los comprimidos que no forman parte de la presente invención se muestran en la Tabla 1, en donde la cantidad de cada uno de los componentes se expresa en porcentaje en peso:
T l 1
2.1.2. Composiciones que comprenden lacosamida
[0107] La composición cualitativa y cuantitativa de los comprimidos de la presente invención se muestran en la Tabla 2, en donde la cantidad de cada uno de los componentes se expresa en porcentaje en peso:
T l 2
2.1.3. Proceso de preparación
[0108] Las composiciones que no forman parte de la invención (Ejemplos 1-8) definidas en la Tabla 1 se prepararon siguiendo los procesos generales que no forman parte de la invención como se define a continuación utilizando los ingredientes y las cantidades especificadas en la Tabla 1.
[0109] Las composiciones de la invención (Ejemplos 9-12) definidas en la Tabla 2 se prepararon siguiendo el proceso general 4.
2.1.3.1. Proceso general 1 (Compresión directa) (que no forma parte de la invención)
[0110]
1. todos los componentes se pesaron por separado;
2. en caso de que presenten aglomerados, tamizar por separado a través de un tamiz de malla de 800 μm; 3. todos los componentes se mezclaron en el tubo agitador heidolph a 60 rpm durante 5 minutos;
4. en caso de que la mezcla presente aglomerados, tamizar a través de un tamiz de malla de 800 μm;
5. proceder a la compresión directa en máquina excéntrica (Bonals) con punzones planos redondos de 18 mm.
[0111] Los comprimidos efervescentes del Ejemplo 1 se prepararon siguiendo el proceso general 1.
[0112] Los comprimidos efervescentes de los Ejemplos 2 y 4 se prepararon siguiendo el proceso general 1 pero agregando una etapa de trituración del polietilenglicol en un mezclador en V después de la etapa 1.
[0113] Los comprimidos efervescentes del Ejemplo 3 se prepararon siguiendo el proceso general 1 pero agregando una etapa de trituración del polietilenglicol en un mezclador en V después de la etapa 1; y mezclando en la etapa 4 todos los componentes excepto el lubricante, los sabores y el edulcorante los cuales se agregan a la mezcla resultante de la etapa 4) manteniendo la agitación a 60 rpm durante 10 minutos.
[0114] Los comprimidos efervescentes del Ejemplo 5 se prepararon siguiendo el proceso general 1 pero mezclando en la etapa 4 todos los componentes excepto el lubricante que se agrega a la mezcla resultante de la etapa 4) manteniendo la agitación a 60 rpm durante 10 minutos.
2.1.3.2. Proceso general 2 (Compresión directa) (que no forma parte de la invención)
[0115]
1. todos los componentes se pesaron por separado;
2. en caso de que presenten aglomerados, tamizar por separado cada uno a través de un tamiz de malla de 800 μm;
3. mezclar el principio activo, el diluyente, el carbonato base de metal alcalinotérreo y el ácido en un mezclador en V a 20 rpm durante 10 minutos;
4. en caso de que la mezcla presente aglomerados, tamizar a través de un tamiz de malla de 800 μm;
5. agregar los sabores, los edulcorantes y el agente enmascarante del sabor a la mezcla anterior y mezclar en un mezclador en V a 20 rpm durante 10 minutos;
6. agregar los lubricantes a la mezcla anterior y dejar mezclar en un mezclador en V a 20 rpm durante 10 minutos; 7. en caso de aparecer algunos aglomerados en la mezcla, tamizar a través de un tamiz de malla de 800 μm; 8. proceder a la compresión directa en máquina excéntrica (Bonals) con punzones planos redondos de teflón de 25 mm.
[0116] Los comprimidos efervescentes del Ejemplo 7 se prepararon siguiendo el proceso general 2 pero agregando el ácido maleico en la etapa 3 y el ácido cítrico en la etapa 5 con los sabores, los edulcorantes y el agente de enmascaramiento del sabor.
[0117] Los comprimidos efervescentes del Ejemplo 8 se prepararon siguiendo el proceso general 2.
2.1.3.3. Proceso general 3 (MEDG) (que no forma parte de la invención)
[0118]
A) Preparación del principio activo granulado:
1. pesar todos los componentes por separado;
2. mezclar el agua con el principio activo y amasar en un mezclador en V;
3. tamizar a través de un tamiz de malla de 1000 μm;
4. secar a 40 °C durante 24 h; y
5. tamizar a través de un tamiz de malla de 800 μm.
B) preparación de los comprimidos a partir del principio activo granulado:
1. pesar todos los componentes y el principio activo granulado por separado;
2. si presentan aglomerados, tamizar a través de un tamiz de malla de 800 μm;
3. mezclar todos los componentes (excepto el lubricante) en mezclador bicónico a 20 rpm durante 10 min;
4. agregar lubricante a la mezcla anterior y mezclar en el mezclador bicónico a 20 rpm durante 10 min;
5. en caso de aparecer algunos aglomerados en la mezcla, tamizar a través de un tamiz de malla de 800 μm; 6. proceder a la compresión directa en máquina excéntrica (Bonals) con punzones planos redondos de teflón de 25 mm.
[0119] Los comprimidos efervescentes del Ejemplo 6 se prepararon siguiendo el proceso general 3.
2.1.3.4. Proceso general 4 (Granulación húmeda)
[0120]
1. Se tamizaron lacosamida, ácido cítrico anhidro, carbonato de calcio (intragranular) y povidona K30 a través de un tamiz vibrador utilizando un tamiz ASTM N.° 18 y posteriormente se transfirieron a un granulador mezclador rápido.
2. Se tomó agua purificada como vehículo aglutinante.
3. Los ingredientes de la etapa 1 se granularon utilizando el vehículo aglutinante de la etapa 2 (agua purificada) para obtener una masa húmeda.
4. La masa húmeda de la etapa 3 se secó en un secador de lecho fluido hasta que la pérdida por secado no superaba el 0,5 % p/p a 75 °C.
5. Los gránulos secos obtenidos en la etapa 4 se clasificaron por tamaño a través de un molino conjunto utilizando un filtro de 1,5 mm.
6. Se tamizaron carbonato de calcio (extragranular), sucralosa, powdarome orange premium, PEG 6000 y benzoato de sodio a través de ASTM N.° 30.
7. Los ingredientes tamizados de la etapa 6 se mezclaron con gránulos secos clasificados por tamaño de la etapa 5 durante 30 minutos.
8. La mezcla de la etapa 7 se comprimió utilizando herramientas apropiadas.
[0121] Los comprimidos efervescentes de los Ejemplos 9-12 se prepararon siguiendo el proceso general 4.
2.1.4. Caracterización
2.1.4.1. Parámetros físicos
[0122] Se calcularon los parámetros físicos de los comprimidos efervescentes de la presente invención. Los comprimidos de la presente invención eran comprimidos redondos blancos que tenían una superficie homogénea sin exfoliación. Los parámetros físicos de los comprimidos efervescentes que no forman parte de la presente invención (Ejemplos 1-8) se muestran en la Tabla 2:
T l 2
[0123] Como se muestra en los valores de los parámetros físicos, las composiciones que no forman parte de la presente invención (Ejemplos 1-8) tienen la dureza apropiada y el tiempo de efervescencia adecuado para ser
utilizadas en terapia.
2.I.4.2. Prueba de disgregación de comprimidos efervescentes
[0124] La prueba de disgregación de comprimidos efervescentes que no forma parte de la invención preparados en los ejemplos 2-8 se midió siguiendo la prueba de disgregación de comprimidos efervescentes establecida en la Eur. Ph: Coloque un comprimido en un vaso de precipitados de 250 ml que contenga 200 ml de agua R a 15-25 °C. Se desprenden numerosas burbujas de gas. Cuando cesa el desprendimiento de gas alrededor del comprimido o sus fragmentos, el comprimido debería haberse disgregado, disolviéndose o dispersándose en el agua de modo que no queden aglomerados. Repita la operación en cinco comprimidos adicionales. Los comprimidos cumplen con la prueba si cada uno de los seis comprimidos utilizados en la prueba se disgregan en 5 minutos, a menos que se especifique lo contrario en la monografía individual
El valor del tiempo de efervescencia, el pH de la solución de agua desionizada resultante y su aspecto visual se resumen en la Tabla 3:
T l
[0125] Por lo tanto, las composiciones efervescentes de la presente invención tienen un tiempo de efervescencia inferior a 5 minutos dando una solución acuosa sin residuos. Significa que las composiciones de la invención se disgregan rápida y completamente al entrar en contacto con el agua desprendiendo dióxido de carbono y crean una solución acuosa sin residuos y/o espuma que tiene un sabor agradable y, por tanto, mejorando el cumplimiento del tratamiento.
Listado de citas
[0126] 123456*89
1. EMA/CHMP/338679/2014
2. George, J. et al. The Association of Cardiovascular Events with Sodium-Containing Effervescent, Dispersible and Soluble Medications; Nested Case-control Study, BMJ, 2013; 347: f6954
3. WC2015/040460
4. EP1837019
5. WO00/28973
6. EP1067904
7. EP1837019
8. WO00/28973
9. Meier, C. et al. Antiepileptics and Bone Health, Ther. Adv. Musculoskelet. Dis., 2011, 3(5), pág. 235-243.
Claims (14)
1. Una composición farmacéutica sólida efervescente que comprende:
una cantidad terapéuticamente eficaz de un principio farmacéutico activo, en donde dicho principio farmacéutico activo es lacosamida;
uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 1 al 31 % en peso de la composición; y
uno o más ácidos farmacéuticamente aceptables, sales ácidas farmacéuticamente aceptables o, alternativamente, una mezcla de los mismos, en una cantidad del 2 al 62 % en peso de la composición;
junto con uno o más excipientes o vehículos farmacéuticamente aceptables;
en donde, el contenido total del ion de sodio en la composición farmacéutica sólida efervescente es igual o inferior a 1 mmol.
2. La composición farmacéutica sólida efervescente de acuerdo con la reivindicación 1, en donde la composición es un comprimido efervescente.
3. La composición farmacéutica sólida efervescente de acuerdo con cualquiera de las reivindicaciones 1-2, en donde el tiempo de disgregación es igual o inferior a 5 minutos, cuando el tiempo de disgregación se mide utilizando la prueba de disgregación de comprimidos efervescentes establecida en la Ph. Eur., que consiste en colocar un comprimido en un vaso de precipitados de 250 ml que contiene 200 ml de agua R a 15-25 °C, dejando que se desprendan numerosas burbujas de gas, y midiendo el tiempo en que cesa el desprendimiento de gas alrededor del comprimido o sus fragmentos y el comprimido se ha disgregado, disolviéndose o dispersándose en el agua de modo que no queden aglomerados.
4. La composición farmacéutica sólida efervescente de acuerdo con cualquiera de las reivindicaciones 1-3, en donde la composición está libre de sodio.
5. La composición farmacéutica sólida efervescente de acuerdo con cualquiera de las reivindicaciones 1-4, en donde la cantidad terapéuticamente eficaz del principio farmacéutico activo es del 0,5 % al 60 % en peso de la composición.
6. La composición farmacéutica sólida efervescente de acuerdo con cualquiera de las reivindicaciones 1-5, en donde la composición comprende:
uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables en una cantidad del 2 al 28 % en peso de la composición, preferentemente del 3 al 25 %, más preferentemente del 5 al 22%, mucho más preferentemente del 5 al 19%, aún más preferentemente del 5 al 16%, aún más preferentemente del 5 al 13 %, aún más preferentemente del 7 al 12 %; o alternativamente del 27,5 al 30 % y uno o más ácidos o sales ácidas farmacéuticamente aceptables, en una cantidad del 4 al 56 % en peso de la composición, preferentemente del 6 al 50 %, más preferentemente del 10 al 44 %, mucho más preferentemente del 10 al 38 %, aún más preferentemente del 10 al 32 %, aún más preferentemente del 10 % al 27 %, aún más preferentemente del 12 al 27 %; o alternativamente del 55,5 % al 60,5 %.
7. La composición farmacéutica sólida efervescente de acuerdo con cualquiera de las reivindicaciones 1-6, en donde uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos farmacéuticamente aceptables es carbonato de calcio.
8. La composición farmacéutica sólida efervescente de acuerdo con cualquiera de las reivindicaciones 1-7, en donde la composición comprende uno o más ácidos farmacéuticamente aceptables seleccionados del grupo que consiste en un ácido inorgánico, un ácido monocarboxílico, un ácido dicarboxílico, un ácido tricarboxílico y ceto- y oxi-derivados de los mismos.
9. La composición farmacéutica sólida efervescente de acuerdo con cualquiera de las reivindicaciones 1-8, en donde la composición comprende:
uno o más ácidos farmacéuticamente aceptables seleccionados del grupo que consiste en ácido fosfórico, ácido cítrico, ácido glutámico, ácido glutárico, ácido málico, ácido maleico, ácido adípico, ácido ascórbico, ácido fumárico, ácido tartárico, ácido alfa- y beta-cetoglutárico, ácido aspártico, ácido múcico, ácido glucónico, ácido glucurónico, ácido glicólico, ácido láctico, ácido lactobiónico, ácido malónico y ácido succínico; o como alternativa una o más sales ácidas farmacéuticamente aceptables seleccionadas del grupo que consiste en clorhidrato de glicina, clorhidrato de alanina, clorhidrato de fenilalanina y clorhidrato de leucina; o como alternativa
una mezcla de uno o más ácidos farmacéuticamente aceptables seleccionados del grupo que consiste en ácido cítrico, ácido glutámico, ácido glutárico, ácido málico, ácido maleico, ácido adípico, ácido ascórbico, ácido fumárico, ácido tartárico y ácido cetoglutárico; y una o más sales ácidas farmacéuticamente aceptables seleccionadas del grupo que consiste en clorhidrato de glicina, clorhidrato de alanina, clorhidrato de fenilalanina y clorhidrato de leucina; o como alternativa
ácido maleico o ácido cítrico o mezclas de los mismos.
10. La composición farmacéutica sólida efervescente de acuerdo con las reivindicaciones 1 - 9, en donde la relación molar entre uno o más ácidos o sales ácidas farmacéuticamente aceptables, o una mezcla de los mismos; y el uno o más carbonatos o hidrogenocarbonatos de metales alcalinotérreos es de 0,5:1 a 8:1; preferentemente de 0,5:1 a 5:1, más preferentemente de 0,8:1 a 3:1, aún más preferentemente de 1:1 a 2,5:1.
11. La composición farmacéutica sólida efervescente de acuerdo con las reivindicaciones 1-10, en donde el tiempo de disgregación es igual o inferior a 3 minutos, cuando el tiempo de disgregación se mide utilizando la prueba de disgregación de comprimidos efervescentes establecida en la Ph. Eur., que consiste en colocar un comprimido en un vaso de precipitados de 250 ml que contiene 200 ml de agua R a 15-25 °C, dejando que se desprendan numerosas burbujas de gas, y midiendo el tiempo en que cesa el desprendimiento de gas alrededor del comprimido o sus fragmentos y el comprimido se ha disgregado, disolviéndose o dispersándose en el agua de modo que no queden aglomerados.
12. La composición farmacéutica sólida efervescente de acuerdo con cualquiera de las reivindicaciones 1-11, que comprende: ácido cítrico como ácido farmacéuticamente aceptable; uno o más carbonatos de metales alcalinotérreos; particularmente carbonato de calcio; y la relación molar entre el ácido cítrico y el carbonato de metal alcalinotérreo es de 0,5:1 a 5:1; particularmente de 0,8:1 a 2:1; o alternativamente ácido maleico como el ácido farmacéuticamente aceptable; uno o más carbonatos de metales alcalinotérreos; particularmente carbonato de calcio; y la relación molar entre el ácido farmacéuticamente aceptable y el carbonato de metal alcalinotérreo es de 0,8:1 a 5:1; preferentemente de 1,5:1 a 3:1.
13. Un proceso para la preparación de la composición farmacéutica sólida efervescente como se define en cualquiera de las reivindicaciones 1-12, en donde:
cuando la composición es un comprimido efervescente de compresión directa, entonces, el proceso comprende las siguientes etapas:
(c) mezclar los excipientes adecuados con el principio farmacéuticamente activo;
(d) opcionalmente lubricar la mezcla obtenida en la etapa (c); y
(e) comprimir la mezcla obtenida en la etapa (d) con un punzón adecuado;
o, como alternativa,
cuando la composición es un comprimido efervescente de granulación por vía seca, entonces, el proceso comprende las siguientes etapas:
(m) preparar el principio activo granulado mediante:
(m1) compactación del principio activo y opcionalmente otros excipientes adecuados;
(m2) tamizado de la mezcla compactada obtenida en la etapa (m1) a través de un tamiz que tenga un tamiz ligero apropiado;
(n) mezclar los excipientes adecuados con el principio activo granulado obtenido en la etapa (m);
(p) opcionalmente lubricar la mezcla obtenida en la etapa (n); y
(q) comprimir la mezcla obtenida en la etapa (q) con un punzón adecuado;
o, como alternativa,
cuando la composición es un comprimido efervescente de granulación seca activada por humedad (MADG), entonces, el proceso comprende las siguientes etapas:
(m") preparar el principio activo granulado mezclando el principio activo con agua en una cantidad del 1 al 4 % en peso y opcionalmente otros excipientes adecuados;
(n) mezclar los excipientes adecuados con el principio activo granulado obtenido en la etapa (m"); opcionalmente lubricar la mezcla obtenida en la etapa (n); y
comprimir la mezcla obtenida en la etapa (q) con un punzón adecuado;
o, como alternativa,
cuando la composición es un comprimido efervescente de granulación por vía húmeda, entonces, el proceso comprende las siguientes etapas:
(m') preparar el principio activo granulado mediante:
(m1') preparación de una suspensión de granulación del principio activo en uno o más disolventes orgánicos adecuados y opcionalmente otros excipientes adecuados;
(m2') tamizado del principio activo húmedo a través de un tamiz que tenga un tamiz ligero apropiado;
(m3') secado del principio activo obtenido en la etapa (m2'); y (m4') tamizado del principio activo seco obtenido en la etapa (m3') a través de un tamiz que tenga un tamiz ligero apropiado.
(n') mezclar los excipientes adecuados con el principio activo granulado obtenido en la etapa (m');
(p') opcionalmente lubricar la mezcla obtenida en la etapa (n'); y
(q') comprimir la mezcla obtenida en la etapa (q') con un punzón adecuado.
14. Una composición farmacéutica sólida efervescente como se define en las reivindicaciones 1-12 para su uso en terapia; preferentemente para su uso en el tratamiento de enfermedades crónicas; en donde las enfermedades crónicas se seleccionan del grupo que consiste en epilepsia; trastornos tromboembólicos; trastornos psicóticos, tales como esquizofrenia o trastorno bipolar; trastornos neurodegenerativos, tales como enfermedad de Parkinson o Alzheimer; trastornos alérgicos, tales como rinitis alérgica; trastornos asociados al vértigo; osteoporosis y dolor crónico; más preferentemente epilepsia.
REFERENCIAS CITADAS EN LA DESCRIPCIÓN
Esta lista de referencias citadas por el solicitante es únicamente para la comodidad del lector. No forma parte del documento de patente europea. A pesar del cuidado tenido en la recopilación de las referencias, no se pueden excluir errores u omisiones y la EPO niega toda responsabilidad en este sentido.
Documentos de patente citados en la descripción
• WO2015040460A [0008] [0126]
• EP1837019A1 [0012] [0014]
• EP1837019A [0012] [0126]
• WO0028973A [0013] [0014] [0126]
• EP1067904A1 [0014]
• EP1067904A [0014] [0126]
Literatura diferente de patentes citada en la descripción
• GEORGE, J. et al. The Association of Cardiovascular Events with Sodium-Containing Effervescent, Dispersible and Soluble Medications; Nested Case-control Study. BMJ, 2013, vol. 347, f6954-[0006]
• MEIER, C. et al. Antiepileptics and Bone Health. Ther. Adv. Musculoskelet. Dis., 2011, vol. 3, 5235-243 [0020]
[0126]
• European Pharmacopeia [0032]
• GEORGE, J. et al. The Association of Cardiovascular Events with Sodium-Containing Effervescent, Dispersible and Soluble Medications Nested Case-control Study, BMJ, 2013, vol. 347, f6954-[0126]
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP19382846.4A EP3799864B1 (en) | 2019-10-02 | 2019-10-02 | Essentially sodium-free effervescent solid pharmaceutical compositions |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2945809T3 true ES2945809T3 (es) | 2023-07-07 |
Family
ID=68137998
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES19382846T Active ES2945809T3 (es) | 2019-10-02 | 2019-10-02 | Composiciones farmacéuticas sólidas efervescentes prácticamente sin sodio |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20220226368A1 (es) |
| EP (2) | EP3799864B1 (es) |
| AU (1) | AU2020358162A1 (es) |
| CA (1) | CA3154799C (es) |
| ES (1) | ES2945809T3 (es) |
| PT (1) | PT3799864T (es) |
| WO (1) | WO2021064636A1 (es) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113425729B (zh) * | 2021-06-24 | 2022-11-15 | 上海奥全生物医药科技有限公司 | 一种含有利伐沙班的药物组合物及其应用 |
| EP4570243A1 (en) | 2023-12-13 | 2025-06-18 | Sanovel Ilac Sanayi Ve Ticaret Anonim Sirketi | Effervescent tablet formulation of brivaracetam |
| TR2023017170A1 (tr) * | 2023-12-13 | 2025-06-23 | Sanovel İlaç Sanayi̇ Ve Ti̇caret Anoni̇m Şi̇rketi̇ | Bri̇varasetam i̇çeren bi̇r saşe formülasyonu |
| EP4570238A1 (en) * | 2023-12-13 | 2025-06-18 | Sanovel Ilac Sanayi Ve Ticaret Anonim Sirketi | A sachet formulation comprising brivaracetam |
| TR2023017169A1 (tr) * | 2023-12-13 | 2025-06-23 | Sanovel İlaç Sanayi̇ Ve Ti̇caret Anoni̇m Şi̇rketi̇ | Bri̇varasetam i̇çeren efervesan tablet formülasyonu |
| WO2025212687A1 (en) * | 2024-04-01 | 2025-10-09 | Tsi Group Co., Ltd. | Compositions and methods of preparation of a clear, effervescent delivery form for nutritional ingredients |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19814256A1 (de) * | 1998-03-31 | 1999-10-07 | Asta Medica Ag | Feste, schnellzerfallende Cetirizin-Formulierungen |
| DE19814257A1 (de) * | 1998-03-31 | 1999-10-07 | Asta Medica Ag | Brauseformulierungen |
| GB9825033D0 (en) | 1998-11-13 | 1999-01-13 | Nycomed Pharma As | Process |
| FR2787715B1 (fr) * | 1998-12-23 | 2002-05-10 | Synthelabo | Composition pharmaceutique comprenant un compose hypnotique ou un de ses sels pharmaceutiquement acceptables |
| JP2008500288A (ja) * | 2004-05-28 | 2008-01-10 | イメイジノット ピーティーワイ エルティーディー | 経口治療用化合物の供給系 |
| ES2255429B1 (es) | 2004-10-25 | 2007-08-16 | Italfarmaco, S.A. | Composiciones farmaceuticas bucodispersables. |
| CN101966165B (zh) * | 2009-07-14 | 2012-06-13 | 无锡健而乐医药科技有限公司 | 口腔吸收固体泡腾制剂 |
| WO2011136751A2 (en) * | 2010-04-26 | 2011-11-03 | Mahmut Bilgic | Water soluble pharmaceutical composition |
| CN104248626B (zh) * | 2013-06-25 | 2016-12-28 | 北大方正集团有限公司 | 左乙拉西坦泡腾干混悬剂及其制备方法 |
| MA38912A1 (fr) | 2013-09-21 | 2017-03-31 | Effrx Pharmaceuticals Sa | Formulations pharmaceutiques effervescentes pauvres en sodium |
| FR3025104B1 (fr) * | 2014-08-29 | 2017-11-24 | Hy-Nutrition | Bolus a liberation immediate |
| EP3258921A1 (en) * | 2015-02-20 | 2017-12-27 | UCB Biopharma SPRL | Combination treatment |
-
2019
- 2019-10-02 PT PT193828464T patent/PT3799864T/pt unknown
- 2019-10-02 EP EP19382846.4A patent/EP3799864B1/en active Active
- 2019-10-02 ES ES19382846T patent/ES2945809T3/es active Active
-
2020
- 2020-10-01 WO PCT/IB2020/059214 patent/WO2021064636A1/en not_active Ceased
- 2020-10-01 EP EP20811434.8A patent/EP4041199A1/en active Pending
- 2020-10-01 AU AU2020358162A patent/AU2020358162A1/en active Pending
- 2020-10-01 CA CA3154799A patent/CA3154799C/en active Active
-
2022
- 2022-03-29 US US17/707,425 patent/US20220226368A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2021064636A1 (en) | 2021-04-08 |
| PT3799864T (pt) | 2023-05-25 |
| CA3154799A1 (en) | 2021-04-08 |
| EP4041199A1 (en) | 2022-08-17 |
| CA3154799C (en) | 2024-10-22 |
| EP3799864B1 (en) | 2023-03-01 |
| EP3799864A1 (en) | 2021-04-07 |
| AU2020358162A1 (en) | 2022-04-07 |
| US20220226368A1 (en) | 2022-07-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2945809T3 (es) | Composiciones farmacéuticas sólidas efervescentes prácticamente sin sodio | |
| ES2273510T3 (es) | Procedimiento para preparar composiciones orales de calcio. | |
| US8048449B2 (en) | Mouth dissolving pharmaceutical composition and process for preparing the same | |
| ES2212341T3 (es) | Preparacion farmaceutica que comprende clodronato como ingrediente activo y celulosa microcristalina modificada con silice como excipiente. | |
| ES2325484T3 (es) | Comprimidos de desintegracion rapida en la cavidad oral. | |
| ES2923214T3 (es) | Composición farmacéutica que comprende mesilato de lenvatinib | |
| ES2980745T3 (es) | Composición farmacéutica, que comprende partículas de aglutinante de fosfato | |
| ES2987493T3 (es) | Comprimido oral desintegrable de edoxaban tosilato hidrato | |
| JPWO2003074085A1 (ja) | 口腔内速崩壊性錠剤 | |
| WO2005055989A1 (ja) | 薬物含有粒子および該粒子を含む固形製剤 | |
| JPH01313420A (ja) | 医薬咀しゃく錠組成物 | |
| CA2618977C (en) | Orally disintegratable tablet | |
| CN103826610B (zh) | (三甲氧基苯氨基)嘧啶基配制品 | |
| ES2596324T3 (es) | Preparación de teneligliptina con elución estabilizada | |
| PT1837019E (pt) | Composições farmacêuticas orodispersíveis | |
| ES2614757T3 (es) | Nueva composición de alfentanilo para el tratamiento del dolor agudo | |
| JP3996626B2 (ja) | 口腔内速崩壊錠 | |
| TWI630911B (zh) | 包含異菸鹼醯胺(isoniazid)顆粒及利福噴丁(rifapentine)顆粒之可分散錠劑型態的抗肺結核穩定醫藥組合物及其製備方法 | |
| US7811604B1 (en) | Non-effervescent, orally disintegrating solid pharmaceutical dosage forms comprising clozapine and methods of making and using the same | |
| ES2314440T3 (es) | Composicion farmaceutica bucodispersable de un compuesto antitrombotico. | |
| JP2007197438A (ja) | 口腔内速崩壊錠剤 | |
| ES2697807T3 (es) | Comprimido masticable pediátrico que contiene agente antiviral y procedimiento para su preparación | |
| JPH11508579A (ja) | 治療用発泡性組成物 | |
| WO2008026907A1 (es) | Composición farmacéutica que comprende ibandronato y vitamina d3 para el tratamiento de osteoporosis | |
| TW202510841A (zh) | 賦形劑造粒物 |