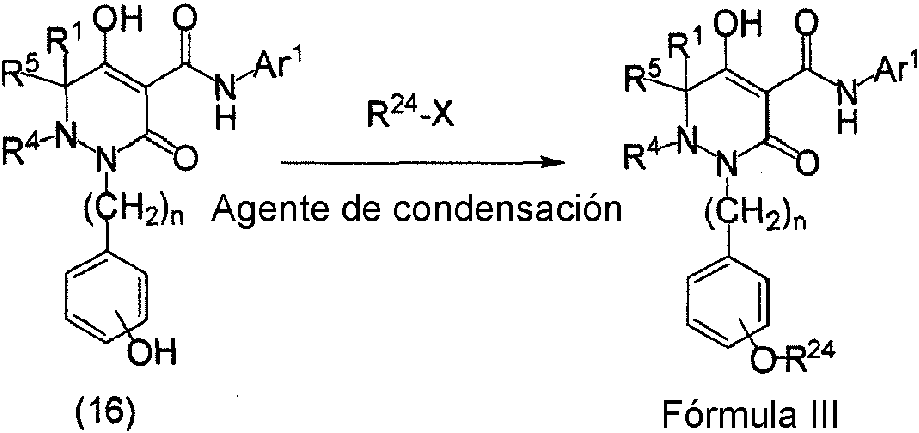
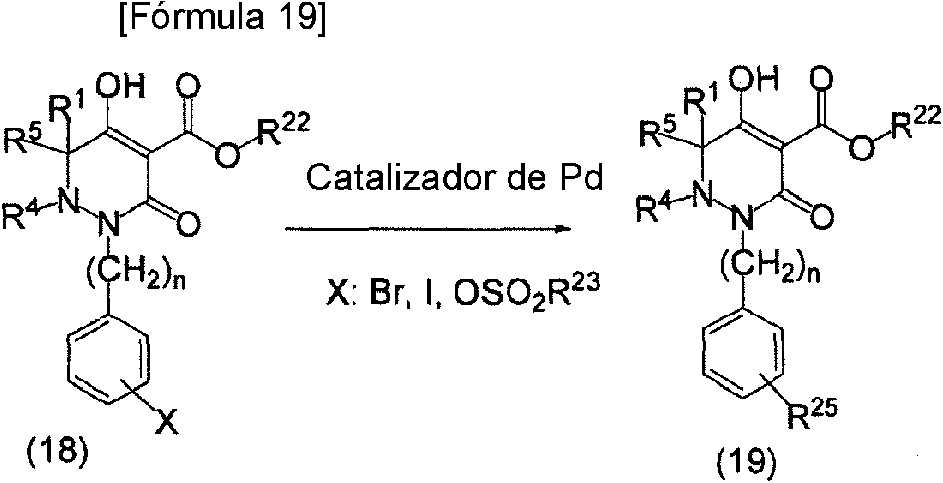
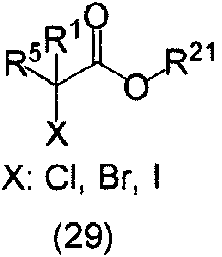
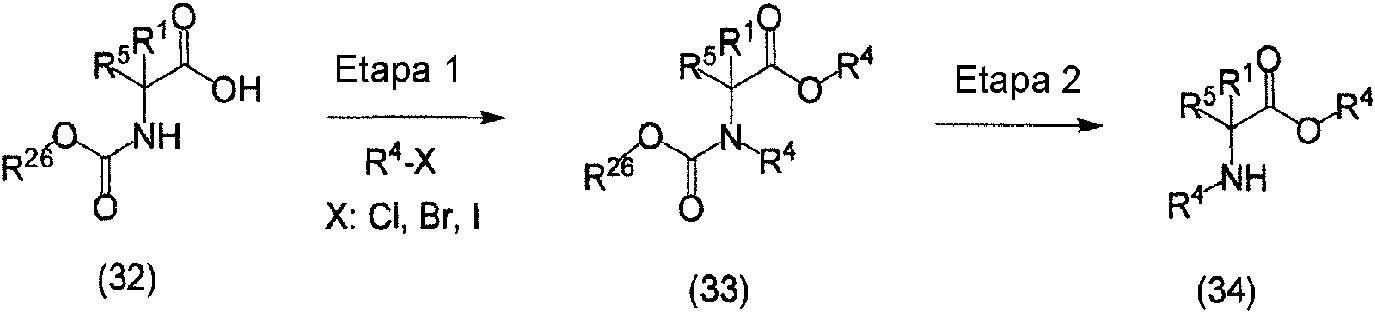
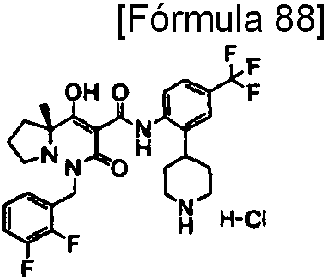
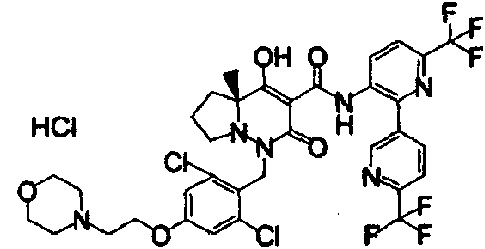
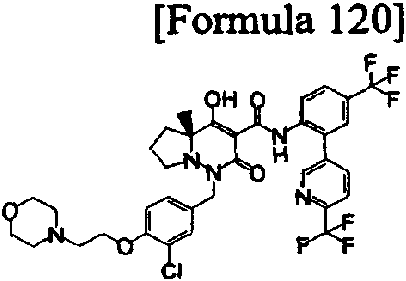
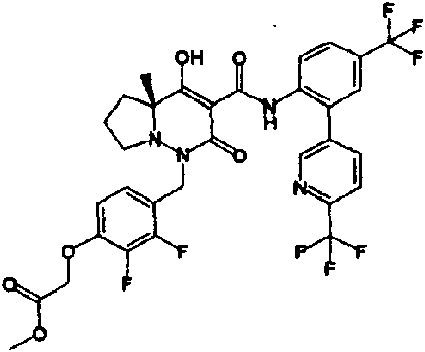
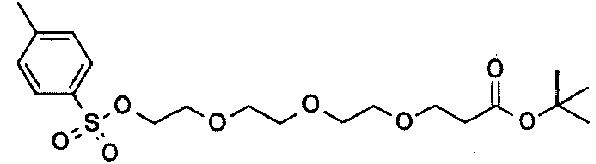
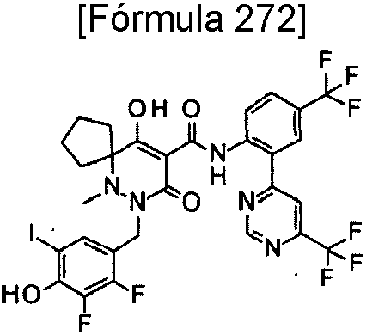
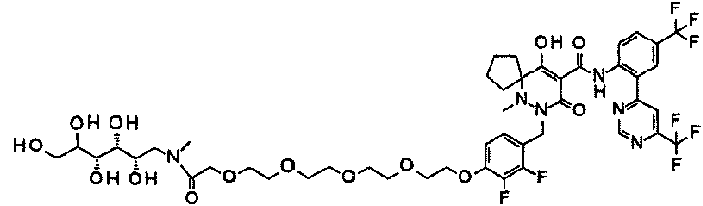
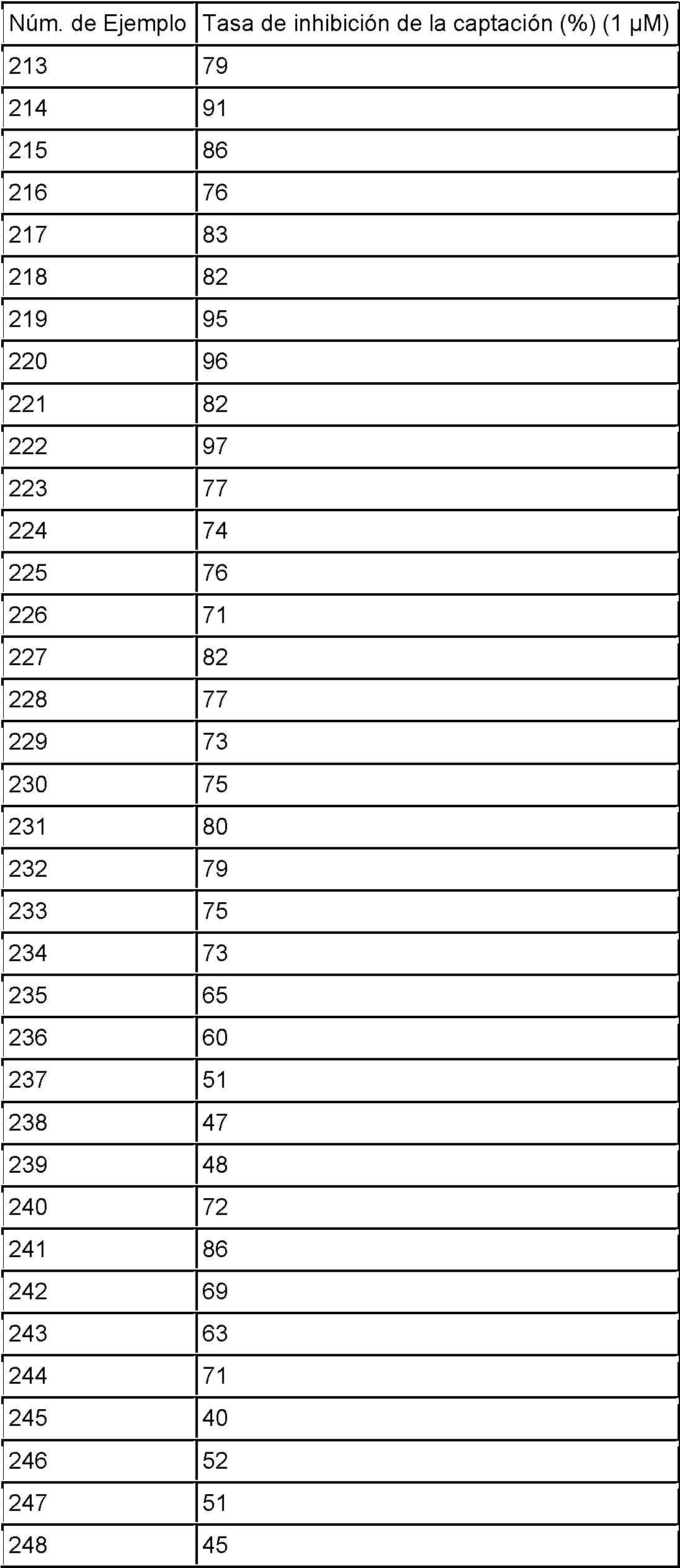
ES2811126T3 - Derivado de dihidropiridazin-3,5-diona - Google Patents
Derivado de dihidropiridazin-3,5-diona Download PDFInfo
- Publication number
- ES2811126T3 ES2811126T3 ES14765619T ES14765619T ES2811126T3 ES 2811126 T3 ES2811126 T3 ES 2811126T3 ES 14765619 T ES14765619 T ES 14765619T ES 14765619 T ES14765619 T ES 14765619T ES 2811126 T3 ES2811126 T3 ES 2811126T3
- Authority
- ES
- Spain
- Prior art keywords
- alkyl
- alkoxy
- optionally substituted
- substituents
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- -1 cyano, carboxy Chemical group 0.000 claims abstract description 493
- 150000001875 compounds Chemical class 0.000 claims abstract description 468
- 125000001424 substituent group Chemical group 0.000 claims abstract description 456
- 150000003839 salts Chemical class 0.000 claims abstract description 369
- 125000005843 halogen group Chemical group 0.000 claims abstract description 354
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 243
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 226
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 217
- 239000012453 solvate Substances 0.000 claims abstract description 184
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims abstract description 169
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims abstract description 166
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims abstract description 159
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 139
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims abstract description 112
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims abstract description 104
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 98
- 125000006274 (C1-C3)alkoxy group Chemical group 0.000 claims abstract description 88
- 125000003118 aryl group Chemical group 0.000 claims abstract description 86
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 claims abstract description 83
- 125000000446 sulfanediyl group Chemical group *S* 0.000 claims abstract description 73
- 125000004076 pyridyl group Chemical group 0.000 claims abstract description 67
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims abstract description 65
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 claims abstract description 61
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 61
- 125000004043 oxo group Chemical group O=* 0.000 claims abstract description 57
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 46
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 44
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 41
- 125000000304 alkynyl group Chemical group 0.000 claims abstract description 40
- 125000004433 nitrogen atom Chemical group N* 0.000 claims abstract description 37
- 150000002367 halogens Chemical class 0.000 claims abstract description 35
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims abstract description 35
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims abstract description 29
- 125000006584 (C3-C10) heterocycloalkyl group Chemical group 0.000 claims abstract description 23
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 23
- 229910006069 SO3H Inorganic materials 0.000 claims abstract description 21
- 125000005865 C2-C10alkynyl group Chemical group 0.000 claims abstract description 19
- 125000000753 cycloalkyl group Chemical group 0.000 claims abstract description 14
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 claims abstract description 14
- 125000002837 carbocyclic group Chemical group 0.000 claims abstract description 13
- 125000000168 pyrrolyl group Chemical group 0.000 claims abstract description 12
- 125000006374 C2-C10 alkenyl group Chemical group 0.000 claims abstract description 7
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 163
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 158
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 87
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 58
- 125000006582 (C5-C6) heterocycloalkyl group Chemical group 0.000 claims description 49
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 49
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 42
- 125000004649 C2-C8 alkynyl group Chemical group 0.000 claims description 41
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims description 39
- 125000002757 morpholinyl group Chemical group 0.000 claims description 37
- 125000005842 heteroatom Chemical group 0.000 claims description 33
- 239000002253 acid Substances 0.000 claims description 27
- 229920006395 saturated elastomer Polymers 0.000 claims description 24
- 201000005991 hyperphosphatemia Diseases 0.000 claims description 20
- 229910052760 oxygen Inorganic materials 0.000 claims description 20
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 19
- 125000000719 pyrrolidinyl group Chemical group 0.000 claims description 19
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 18
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims description 16
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 claims description 15
- 208000005770 Secondary Hyperparathyroidism Diseases 0.000 claims description 14
- 125000004527 pyrimidin-4-yl group Chemical group N1=CN=C(C=C1)* 0.000 claims description 14
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 claims description 13
- 125000004200 2-methoxyethyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])* 0.000 claims description 12
- 125000001376 1,2,4-triazolyl group Chemical group N1N=C(N=C1)* 0.000 claims description 11
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 9
- 125000003342 alkenyl group Chemical group 0.000 claims description 8
- 201000010099 disease Diseases 0.000 claims description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 8
- 125000000031 ethylamino group Chemical group [H]C([H])([H])C([H])([H])N([H])[*] 0.000 claims description 8
- 230000002265 prevention Effects 0.000 claims description 7
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 5
- 125000006728 (C1-C6) alkynyl group Chemical group 0.000 claims description 4
- CCBKKKYZCOBIJN-UHFFFAOYSA-N 7-[[2,3-difluoro-4-[2-[2-methoxyethyl(methyl)amino]ethoxy]phenyl]methyl]-10-hydroxy-6-methyl-8-oxo-n-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-diazaspiro[4.5]dec-9-ene-9-carboxamide Chemical compound FC1=C(F)C(OCCN(C)CCOC)=CC=C1CN1C(=O)C(C(=O)NC=2C(=CC(=CC=2)C(F)(F)F)C=2N=CN=C(C=2)C(F)(F)F)=C(O)C2(CCCC2)N1C CCBKKKYZCOBIJN-UHFFFAOYSA-N 0.000 claims description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 4
- CFEBSMASIVKGFD-SSEXGKCCSA-N (3S)-3-tert-butyl-1-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-4-hydroxy-2-methyl-6-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-3H-pyridazine-5-carboxamide Chemical compound C(C)(C)(C)[C@@H]1N(N(C(C(=C1O)C(=O)NC1=C(C=C(C=C1)C(F)(F)F)C1=NC=NC(=C1)C(F)(F)F)=O)CC1=C(C(=C(C=C1)OCCN1CCOCC1)F)F)C CFEBSMASIVKGFD-SSEXGKCCSA-N 0.000 claims description 3
- MTICOJZCSDQJGF-JGCGQSQUSA-N (3S)-3-tert-butyl-N-[2-(6-cyano-5-methylpyrimidin-4-yl)-4-(trifluoromethyl)phenyl]-1-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-4-hydroxy-2-methyl-6-oxo-3H-pyridazine-5-carboxamide Chemical compound C(C)(C)(C)[C@@H]1N(N(C(C(=C1O)C(=O)NC1=C(C=C(C=C1)C(F)(F)F)C1=NC=NC(=C1C)C#N)=O)CC1=C(C(=C(C=C1)OCCN1CCOCC1)F)F)C MTICOJZCSDQJGF-JGCGQSQUSA-N 0.000 claims description 3
- IRZLGLNQNDFKKD-JGCGQSQUSA-N (3S)-3-tert-butyl-N-[4-chloro-2-(6-methylsulfanylpyridin-3-yl)phenyl]-1-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-4-hydroxy-2-methyl-6-oxo-3H-pyridazine-5-carboxamide Chemical compound C(C)(C)(C)[C@@H]1N(N(C(C(=C1O)C(=O)NC1=C(C=C(C=C1)Cl)C=1C=NC(=CC1)SC)=O)CC1=C(C(=C(C=C1)OCCN1CCOCC1)F)F)C IRZLGLNQNDFKKD-JGCGQSQUSA-N 0.000 claims description 3
- VKYFVFIPASNPNM-WJOKGBTCSA-N (3S)-3-tert-butyl-N-[4-chloro-2-[6-(trifluoromethyl)pyridin-3-yl]phenyl]-1-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-4-hydroxy-2-methyl-6-oxo-3H-pyridazine-5-carboxamide Chemical compound C(C)(C)(C)[C@@H]1N(N(C(C(=C1O)C(=O)NC1=C(C=C(C=C1)Cl)C=1C=NC(=CC1)C(F)(F)F)=O)CC1=C(C(=C(C=C1)OCCN1CCOCC1)F)F)C VKYFVFIPASNPNM-WJOKGBTCSA-N 0.000 claims description 3
- HTLRVHVJGODTHE-SSEXGKCCSA-N (3S)-3-tert-butyl-N-[4-chloro-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-1-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-4-hydroxy-2-methyl-6-oxo-3H-pyridazine-5-carboxamide Chemical compound C(C)(C)(C)[C@@H]1N(N(C(C(=C1O)C(=O)NC1=C(C=C(C=C1)Cl)C1=NC=NC(=C1)C(F)(F)F)=O)CC1=C(C(=C(C=C1)OCCN1CCOCC1)F)F)C HTLRVHVJGODTHE-SSEXGKCCSA-N 0.000 claims description 3
- NEKSDVOWKZFETF-UHFFFAOYSA-N 7-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-10-hydroxy-6-methyl-8-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-diazaspiro[4.5]dec-9-ene-9-carboxamide Chemical compound CN1N(CC2=C(F)C(F)=C(OCCN3CCOCC3)C=C2)C(=O)C(C(=O)NC2=C(C=C(C=C2)C(F)(F)F)C2=CC(=NC=N2)C(F)(F)F)=C(O)C11CCCC1 NEKSDVOWKZFETF-UHFFFAOYSA-N 0.000 claims description 3
- 125000004414 alkyl thio group Chemical group 0.000 claims description 3
- CPEONABTMRSIKA-UHFFFAOYSA-N 1,4$l^{2}-oxazinane Chemical group C1COCC[N]1 CPEONABTMRSIKA-UHFFFAOYSA-N 0.000 claims description 2
- REEWOUZNOTYCSO-UHFFFAOYSA-N 6-[[2,3-difluoro-4-[2-[methyl(oxetan-3-yl)amino]ethoxy]phenyl]methyl]-9-hydroxy-5-methyl-7-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-5,6-diazaspiro[3.5]non-8-ene-8-carboxamide Chemical compound FC1=C(CN2N(C3(CCC3)C(=C(C2=O)C(=O)NC2=C(C=C(C=C2)C(F)(F)F)C2=NC=NC(=C2)C(F)(F)F)O)C)C=CC(=C1F)OCCN(C1COC1)C REEWOUZNOTYCSO-UHFFFAOYSA-N 0.000 claims description 2
- YCCALBOEEJXDKL-QHCPKHFHSA-N 7-[[2,3-difluoro-4-[2-[(2S)-2-(methoxymethyl)pyrrolidin-1-yl]ethoxy]phenyl]methyl]-10-hydroxy-6-methyl-8-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-diazaspiro[4.5]dec-9-ene-9-carboxamide Chemical compound COC[C@@H]1CCCN1CCOC1=CC=C(CN2N(C)C3(CCCC3)C(O)=C(C(=O)NC3=C(C=C(C=C3)C(F)(F)F)C3=NC=NC(=C3)C(F)(F)F)C2=O)C(F)=C1F YCCALBOEEJXDKL-QHCPKHFHSA-N 0.000 claims description 2
- QGSRLPXTHJYRQE-UHFFFAOYSA-N 7-[[2,3-difluoro-4-[2-[2-[2-[2-[2-methoxyethyl(methyl)amino]ethoxy]ethoxy]ethoxy]ethoxy]phenyl]methyl]-10-hydroxy-6-methyl-8-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-diazaspiro[4.5]dec-9-ene-9-carboxamide Chemical compound COCCN(C)CCOCCOCCOCCOC1=CC=C(CN2N(C)C3(CCCC3)C(O)=C(C(=O)NC3=C(C=C(C=C3)C(F)(F)F)C3=NC=NC(=C3)C(F)(F)F)C2=O)C(F)=C1F QGSRLPXTHJYRQE-UHFFFAOYSA-N 0.000 claims description 2
- KJYLTHZUTSYIBQ-UHFFFAOYSA-N 7-[[4-[3-(dimethylamino)-2,2-dimethylpropoxy]-2,3-difluorophenyl]methyl]-10-hydroxy-6-methyl-8-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-diazaspiro[4.5]dec-9-ene-9-carboxamide Chemical compound CN(C)CC(C)(C)COC1=CC=C(CN2N(C)C3(CCCC3)C(O)=C(C(=O)NC3=CC=C(C=C3C3=NC=NC(=C3)C(F)(F)F)C(F)(F)F)C2=O)C(F)=C1F KJYLTHZUTSYIBQ-UHFFFAOYSA-N 0.000 claims description 2
- 208000001647 Renal Insufficiency Diseases 0.000 claims description 2
- 125000004567 azetidin-3-yl group Chemical group N1CC(C1)* 0.000 claims description 2
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid group Chemical group C(CCCCCC)(=O)O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 claims description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid group Chemical group C(CCCCC)(=O)O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 claims description 2
- 201000006370 kidney failure Diseases 0.000 claims description 2
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N pentanoic acid group Chemical group C(CCCC)(=O)O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 claims description 2
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims 5
- 125000006299 oxetan-3-yl group Chemical group [H]C1([H])OC([H])([H])C1([H])* 0.000 claims 1
- 125000000547 substituted alkyl group Chemical group 0.000 claims 1
- 125000004429 atom Chemical group 0.000 abstract description 19
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 abstract description 9
- 125000000041 C6-C10 aryl group Chemical group 0.000 abstract description 8
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 abstract 8
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 abstract 4
- 125000004209 (C1-C8) alkyl group Chemical group 0.000 abstract 4
- 238000000034 method Methods 0.000 description 82
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 67
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 66
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 58
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 42
- 150000001721 carbon Chemical group 0.000 description 40
- 238000006243 chemical reaction Methods 0.000 description 40
- 239000000203 mixture Substances 0.000 description 39
- 239000002904 solvent Substances 0.000 description 37
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 36
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 31
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 30
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 28
- 125000000623 heterocyclic group Chemical group 0.000 description 28
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 27
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 24
- 239000011541 reaction mixture Substances 0.000 description 24
- 229910052698 phosphorus Inorganic materials 0.000 description 23
- 239000011574 phosphorus Substances 0.000 description 23
- 229910052717 sulfur Inorganic materials 0.000 description 23
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 22
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 21
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 20
- 238000004587 chromatography analysis Methods 0.000 description 19
- 238000002425 crystallisation Methods 0.000 description 19
- 230000008025 crystallization Effects 0.000 description 19
- 239000012299 nitrogen atmosphere Substances 0.000 description 19
- 230000002829 reductive effect Effects 0.000 description 19
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 18
- 239000003814 drug Substances 0.000 description 18
- 239000000243 solution Substances 0.000 description 18
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 17
- 239000012044 organic layer Substances 0.000 description 17
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 17
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 16
- 125000004430 oxygen atom Chemical group O* 0.000 description 16
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 15
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 15
- 239000012043 crude product Substances 0.000 description 15
- 239000003112 inhibitor Substances 0.000 description 15
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 15
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical group C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 14
- 208000020832 chronic kidney disease Diseases 0.000 description 14
- 125000006413 ring segment Chemical group 0.000 description 14
- 239000002585 base Substances 0.000 description 13
- 125000004193 piperazinyl group Chemical group 0.000 description 13
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 13
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 12
- 125000003277 amino group Chemical group 0.000 description 12
- 208000022831 chronic renal failure syndrome Diseases 0.000 description 12
- 229940079593 drug Drugs 0.000 description 12
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 12
- 125000003386 piperidinyl group Chemical group 0.000 description 12
- 239000011734 sodium Substances 0.000 description 12
- 229910052708 sodium Inorganic materials 0.000 description 12
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 12
- 125000005330 8 membered heterocyclic group Chemical group 0.000 description 11
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 11
- 239000003463 adsorbent Substances 0.000 description 11
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 11
- 238000009835 boiling Methods 0.000 description 11
- 229910000027 potassium carbonate Inorganic materials 0.000 description 11
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 10
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 239000000470 constituent Substances 0.000 description 9
- 229910052739 hydrogen Inorganic materials 0.000 description 9
- 230000003449 preventive effect Effects 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 239000012312 sodium hydride Substances 0.000 description 9
- 229910000104 sodium hydride Inorganic materials 0.000 description 9
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 9
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 9
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 9
- PIKNVEVCWAAOMJ-UHFFFAOYSA-N 3-fluorobenzaldehyde Chemical compound FC1=CC=CC(C=O)=C1 PIKNVEVCWAAOMJ-UHFFFAOYSA-N 0.000 description 8
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 8
- 150000001412 amines Chemical class 0.000 description 8
- 239000007864 aqueous solution Substances 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 8
- 150000002148 esters Chemical class 0.000 description 8
- 150000007857 hydrazones Chemical class 0.000 description 8
- 230000002401 inhibitory effect Effects 0.000 description 8
- 229910052763 palladium Inorganic materials 0.000 description 8
- 125000001544 thienyl group Chemical group 0.000 description 8
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 7
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 7
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 7
- 102100029797 Sodium-dependent phosphate transporter 1 Human genes 0.000 description 7
- 102100032419 Sodium-dependent phosphate transporter 2 Human genes 0.000 description 7
- 238000010521 absorption reaction Methods 0.000 description 7
- 239000004480 active ingredient Substances 0.000 description 7
- 125000002393 azetidinyl group Chemical group 0.000 description 7
- 239000012267 brine Substances 0.000 description 7
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 7
- 229910000024 caesium carbonate Inorganic materials 0.000 description 7
- 239000003054 catalyst Substances 0.000 description 7
- 238000004128 high performance liquid chromatography Methods 0.000 description 7
- 239000001257 hydrogen Substances 0.000 description 7
- 239000000651 prodrug Substances 0.000 description 7
- 229940002612 prodrug Drugs 0.000 description 7
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 7
- 229910052938 sodium sulfate Inorganic materials 0.000 description 7
- 235000011152 sodium sulphate Nutrition 0.000 description 7
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 7
- 125000004434 sulfur atom Chemical group 0.000 description 7
- 125000006833 (C1-C5) alkylene group Chemical group 0.000 description 6
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 6
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 6
- 108010092528 Phosphate Transport Proteins Proteins 0.000 description 6
- 102000016462 Phosphate Transport Proteins Human genes 0.000 description 6
- 101710116331 Sodium-dependent phosphate transporter 1 Proteins 0.000 description 6
- 101710116332 Sodium-dependent phosphate transporter 2 Proteins 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 230000001419 dependent effect Effects 0.000 description 6
- 210000001035 gastrointestinal tract Anatomy 0.000 description 6
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 6
- 230000014759 maintenance of location Effects 0.000 description 6
- 125000002950 monocyclic group Chemical group 0.000 description 6
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 6
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 6
- PAQZWJGSJMLPMG-UHFFFAOYSA-N propylphosphonic anhydride Substances CCCP1(=O)OP(=O)(CCC)OP(=O)(CCC)O1 PAQZWJGSJMLPMG-UHFFFAOYSA-N 0.000 description 6
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 6
- 238000003786 synthesis reaction Methods 0.000 description 6
- 229940124597 therapeutic agent Drugs 0.000 description 6
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 6
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 5
- 150000001408 amides Chemical group 0.000 description 5
- 230000037396 body weight Effects 0.000 description 5
- 229910052801 chlorine Inorganic materials 0.000 description 5
- 229910052731 fluorine Inorganic materials 0.000 description 5
- 125000001153 fluoro group Chemical group F* 0.000 description 5
- 125000002541 furyl group Chemical group 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 238000000622 liquid--liquid extraction Methods 0.000 description 5
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 5
- 239000008194 pharmaceutical composition Substances 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- 125000003373 pyrazinyl group Chemical group 0.000 description 5
- 125000002098 pyridazinyl group Chemical group 0.000 description 5
- 229910000029 sodium carbonate Inorganic materials 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 238000000638 solvent extraction Methods 0.000 description 5
- WDBAXYQUOZDFOJ-UHFFFAOYSA-N 2,3-difluorobenzaldehyde Chemical compound FC1=CC=CC(C=O)=C1F WDBAXYQUOZDFOJ-UHFFFAOYSA-N 0.000 description 4
- WADSJYLPJPTMLN-UHFFFAOYSA-N 3-(cycloundecen-1-yl)-1,2-diazacycloundec-2-ene Chemical compound C1CCCCCCCCC=C1C1=NNCCCCCCCC1 WADSJYLPJPTMLN-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 4
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 4
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 4
- 229920002472 Starch Polymers 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 150000001413 amino acids Chemical class 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 125000006580 bicyclic heterocycloalkyl group Chemical group 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- 238000010511 deprotection reaction Methods 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 4
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 4
- 125000001786 isothiazolyl group Chemical group 0.000 description 4
- 125000000842 isoxazolyl group Chemical group 0.000 description 4
- 125000000468 ketone group Chemical group 0.000 description 4
- 125000001064 morpholinomethyl group Chemical group [H]C([H])(*)N1C([H])([H])C([H])([H])OC([H])([H])C1([H])[H] 0.000 description 4
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 4
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- 125000001715 oxadiazolyl group Chemical group 0.000 description 4
- 125000002971 oxazolyl group Chemical group 0.000 description 4
- 125000003566 oxetanyl group Chemical group 0.000 description 4
- 125000003226 pyrazolyl group Chemical group 0.000 description 4
- 238000010898 silica gel chromatography Methods 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 4
- 235000019698 starch Nutrition 0.000 description 4
- 125000001113 thiadiazolyl group Chemical group 0.000 description 4
- 125000000335 thiazolyl group Chemical group 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- 238000005804 alkylation reaction Methods 0.000 description 3
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 3
- 229940024606 amino acid Drugs 0.000 description 3
- 235000001014 amino acid Nutrition 0.000 description 3
- 150000001502 aryl halides Chemical class 0.000 description 3
- 238000010533 azeotropic distillation Methods 0.000 description 3
- YNHIGQDRGKUECZ-UHFFFAOYSA-L bis(triphenylphosphine)palladium(ii) dichloride Chemical compound [Cl-].[Cl-].[Pd+2].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-L 0.000 description 3
- 125000001589 carboacyl group Chemical group 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 235000010980 cellulose Nutrition 0.000 description 3
- 125000001309 chloro group Chemical group Cl* 0.000 description 3
- TXWOGHSRPAYOML-UHFFFAOYSA-N cyclobutanecarboxylic acid Chemical compound OC(=O)C1CCC1 TXWOGHSRPAYOML-UHFFFAOYSA-N 0.000 description 3
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 3
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 3
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 3
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 3
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 3
- 125000001041 indolyl group Chemical group 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
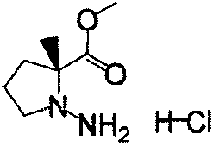
- YCYWAVUCBMJUPK-OGFXRTJISA-N methyl (2r)-2-methylpyrrolidine-2-carboxylate;hydrochloride Chemical compound Cl.COC(=O)[C@@]1(C)CCCN1 YCYWAVUCBMJUPK-OGFXRTJISA-N 0.000 description 3
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 3
- 125000001624 naphthyl group Chemical group 0.000 description 3
- 150000002989 phenols Chemical class 0.000 description 3
- 125000005936 piperidyl group Chemical group 0.000 description 3
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 239000000376 reactant Substances 0.000 description 3
- 238000007363 ring formation reaction Methods 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- 238000001308 synthesis method Methods 0.000 description 3
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 3
- 235000019798 tripotassium phosphate Nutrition 0.000 description 3
- LJDNCDIOQMZIJN-MRXNPFEDSA-N (4aR)-1-[(2,3-difluoro-4-iodophenyl)methyl]-4-hydroxy-4a-methyl-2-oxo-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxylic acid Chemical compound FC1=C(C=CC(=C1F)I)CN1N2[C@@](C(=C(C1=O)C(=O)O)O)(CCC2)C LJDNCDIOQMZIJN-MRXNPFEDSA-N 0.000 description 2
- XEMMEFHPILYXGE-AREMUKBSSA-N (4aR)-1-[(2,3-difluorophenyl)methyl]-4-hydroxy-4a-methyl-2-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound FC1=C(C=CC=C1F)CN1N2[C@@](C(=C(C1=O)C(=O)NC1=C(C=C(C=C1)C(F)(F)F)C1=NC=NC(=C1)C(F)(F)F)O)(CCC2)C XEMMEFHPILYXGE-AREMUKBSSA-N 0.000 description 2
- CGWDZLGBTUGOIV-JGCGQSQUSA-N (4aR)-1-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-4-hydroxy-4a-methyl-2-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound C[C@]12CCCN1N(CC1=CC=C(OCCN3CCOCC3)C(F)=C1F)C(=O)C(C(=O)NC1=C(C=C(C=C1)C(F)(F)F)C1=NC=NC(=C1)C(F)(F)F)=C2O CGWDZLGBTUGOIV-JGCGQSQUSA-N 0.000 description 2
- XXPRMIALHLXIDU-UUWRZZSWSA-N (4aR)-1-[[2,3-difluoro-4-(3-morpholin-4-ylprop-1-ynyl)phenyl]methyl]-4-hydroxy-4a-methyl-2-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyridin-3-yl]phenyl]-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound C[C@]12CCCN1N(CC1=CC=C(C#CCN3CCOCC3)C(F)=C1F)C(=O)C(C(=O)NC1=C(C=C(C=C1)C(F)(F)F)C1=CN=C(C=C1)C(F)(F)F)=C2O XXPRMIALHLXIDU-UUWRZZSWSA-N 0.000 description 2
- GDLHQHRXMXMTIQ-JGCGQSQUSA-N (4aR)-1-[[2,3-difluoro-4-(morpholin-4-ylmethyl)phenyl]methyl]-4-hydroxy-4a-methyl-2-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyridin-3-yl]phenyl]-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound C[C@]12CCCN1N(CC1=CC=C(CN3CCOCC3)C(F)=C1F)C(=O)C(C(=O)NC1=C(C=C(C=C1)C(F)(F)F)C1=CN=C(C=C1)C(F)(F)F)=C2O GDLHQHRXMXMTIQ-JGCGQSQUSA-N 0.000 description 2
- PRACBPDDYXNYIK-DHYKOVJISA-N (4aR)-1-[[4-[3-[(2R)-2,3-dihydroxypropoxy]propoxy]-2,3-difluorophenyl]methyl]-4-hydroxy-4a-methyl-2-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyridin-3-yl]phenyl]-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound C[C@]12CCCN1N(CC1=CC=C(OCCCOC[C@H](O)CO)C(F)=C1F)C(=O)C(C(=O)NC1=CC=C(C=C1C1=CC=C(N=C1)C(F)(F)F)C(F)(F)F)=C2O PRACBPDDYXNYIK-DHYKOVJISA-N 0.000 description 2
- SCSALJRMSJVVSA-GSTQUKTASA-N (4aR)-1-[[4-[4-[(2R)-2,3-dihydroxypropoxy]butoxy]-2,3-difluorophenyl]methyl]-4-hydroxy-4a-methyl-2-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound C[C@]12CCCN1N(CC1=CC=C(OCCCCOC[C@H](O)CO)C(F)=C1F)C(=O)C(C(=O)NC1=CC=C(C=C1C1=CC(=NC=N1)C(F)(F)F)C(F)(F)F)=C2O SCSALJRMSJVVSA-GSTQUKTASA-N 0.000 description 2
- ZXFIOLGNJMTNAD-GMWXTNTRSA-N (4aR)-1-[[4-[6-[(2R)-2,3-dihydroxypropoxy]hexoxy]-2,3-difluorophenyl]methyl]-4-hydroxy-4a-methyl-2-oxo-N-[2-(trifluoromethyl)-4-[6-(trifluoromethyl)pyridin-3-yl]pyrimidin-5-yl]-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound C[C@]12CCCN1N(CC1=CC=C(OCCCCCCOC[C@H](O)CO)C(F)=C1F)C(=O)C(C(=O)NC1=C(N=C(N=C1)C(F)(F)F)C1=CN=C(C=C1)C(F)(F)F)=C2O ZXFIOLGNJMTNAD-GMWXTNTRSA-N 0.000 description 2
- POQJGRMVYIGSDZ-JOCHJYFZSA-N (4aR)-N-(4-bromo-3,5-difluorophenyl)-1-[(3-chloro-2-fluorophenyl)methyl]-4-hydroxy-4a-methyl-2-oxo-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound BrC1=C(C=C(C=C1F)NC(=O)C1=C([C@@]2(N(N(C1=O)CC1=C(C(=CC=C1)Cl)F)CCC2)C)O)F POQJGRMVYIGSDZ-JOCHJYFZSA-N 0.000 description 2
- GAWZCDMZIYPLMG-UUWRZZSWSA-N (4aR)-N-[2-(2-cyanopyridin-4-yl)-4-(trifluoromethyl)phenyl]-1-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-4-hydroxy-4a-methyl-2-oxo-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound C(#N)C1=NC=CC(=C1)C1=C(C=CC(=C1)C(F)(F)F)NC(=O)C1=C([C@@]2(N(N(C1=O)CC1=C(C(=C(C=C1)OCCN1CCOCC1)F)F)CCC2)C)O GAWZCDMZIYPLMG-UUWRZZSWSA-N 0.000 description 2
- GKHBXOHYQOGMRA-UUWRZZSWSA-N (4aR)-N-[2-(6-cyano-5-methylpyrimidin-4-yl)-4-(trifluoromethyl)phenyl]-1-[[2,3-difluoro-4-(2-morpholin-4-ylethoxy)phenyl]methyl]-4-hydroxy-4a-methyl-2-oxo-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound CC1=C(N=CN=C1C#N)C1=C(NC(=O)C2=C(O)[C@@]3(C)CCCN3N(CC3=CC=C(OCCN4CCOCC4)C(F)=C3F)C2=O)C=CC(=C1)C(F)(F)F GKHBXOHYQOGMRA-UUWRZZSWSA-N 0.000 description 2
- SUPUSGZANQHTMS-HNNXBMFYSA-N (4aS)-1-[(3-fluorophenyl)methyl]-4-hydroxy-N-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-4a,5,6,7-tetrahydropyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound FC=1C=C(C=CC=1)CN1N2[C@H](C(=C(C1=O)C(=O)NC1=C(OC(=C1)C)C(F)(F)F)O)CCC2 SUPUSGZANQHTMS-HNNXBMFYSA-N 0.000 description 2
- QVAXWXVFUVWSPB-LBPRGKRZSA-N (4aS)-1-[(3-fluorophenyl)methyl]-4a,5,6,7-tetrahydropyrrolo[1,2-b]pyridazine-2,4-dione Chemical compound FC=1C=C(C=CC=1)CN1N2[C@H](C(CC1=O)=O)CCC2 QVAXWXVFUVWSPB-LBPRGKRZSA-N 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 2
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 2
- 238000005160 1H NMR spectroscopy Methods 0.000 description 2
- HZNVUJQVZSTENZ-UHFFFAOYSA-N 2,3-dichloro-5,6-dicyano-1,4-benzoquinone Chemical compound ClC1=C(Cl)C(=O)C(C#N)=C(C#N)C1=O HZNVUJQVZSTENZ-UHFFFAOYSA-N 0.000 description 2
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 2
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 2
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 2
- BMTZEAOGFDXDAD-UHFFFAOYSA-M 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholin-4-ium;chloride Chemical compound [Cl-].COC1=NC(OC)=NC([N+]2(C)CCOCC2)=N1 BMTZEAOGFDXDAD-UHFFFAOYSA-M 0.000 description 2
- CFKMVGJGLGKFKI-UHFFFAOYSA-N 4-chloro-m-cresol Chemical compound CC1=CC(O)=CC=C1Cl CFKMVGJGLGKFKI-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- 239000001856 Ethyl cellulose Substances 0.000 description 2
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 239000007821 HATU Substances 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 229930194542 Keto Natural products 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- JGFFTJDJHXLDNJ-UHFFFAOYSA-L [O-]OOO[O-].[K+].[K+] Chemical compound [O-]OOO[O-].[K+].[K+] JGFFTJDJHXLDNJ-UHFFFAOYSA-L 0.000 description 2
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 150000001350 alkyl halides Chemical class 0.000 description 2
- 150000008052 alkyl sulfonates Chemical class 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 230000029936 alkylation Effects 0.000 description 2
- 150000003863 ammonium salts Chemical class 0.000 description 2
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- 150000004982 aromatic amines Chemical class 0.000 description 2
- 150000001543 aryl boronic acids Chemical class 0.000 description 2
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 2
- 125000004604 benzisothiazolyl group Chemical group S1N=C(C2=C1C=CC=C2)* 0.000 description 2
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 2
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- QARVLSVVCXYDNA-UHFFFAOYSA-N bromobenzene Chemical compound BrC1=CC=CC=C1 QARVLSVVCXYDNA-UHFFFAOYSA-N 0.000 description 2
- 159000000007 calcium salts Chemical class 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 125000005708 carbonyloxy group Chemical group [*:2]OC([*:1])=O 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 238000010531 catalytic reduction reaction Methods 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 229940099112 cornstarch Drugs 0.000 description 2
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000000502 dialysis Methods 0.000 description 2
- WMKGGPCROCCUDY-PHEQNACWSA-N dibenzylideneacetone Chemical compound C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 WMKGGPCROCCUDY-PHEQNACWSA-N 0.000 description 2
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 208000028208 end stage renal disease Diseases 0.000 description 2
- 201000000523 end stage renal failure Diseases 0.000 description 2
- 125000004185 ester group Chemical group 0.000 description 2
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 2
- IOAQSQJEFPKKLD-FJXQXJEOSA-N ethyl (2S)-4,4-dimethylpyrrolidine-2-carboxylate hydrochloride Chemical compound Cl.CCOC(=O)[C@@H]1CC(C)(C)CN1 IOAQSQJEFPKKLD-FJXQXJEOSA-N 0.000 description 2
- 235000019325 ethyl cellulose Nutrition 0.000 description 2
- 229920001249 ethyl cellulose Polymers 0.000 description 2
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 2
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 150000008424 iodobenzenes Chemical class 0.000 description 2
- 239000012948 isocyanate Substances 0.000 description 2
- 150000002513 isocyanates Chemical class 0.000 description 2
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 2
- JMMWKPVZQRWMSS-UHFFFAOYSA-N isopropanol acetate Natural products CC(C)OC(C)=O JMMWKPVZQRWMSS-UHFFFAOYSA-N 0.000 description 2
- 229940011051 isopropyl acetate Drugs 0.000 description 2
- 125000005956 isoquinolyl group Chemical group 0.000 description 2
- GWYFCOCPABKNJV-UHFFFAOYSA-M isovalerate Chemical compound CC(C)CC([O-])=O GWYFCOCPABKNJV-UHFFFAOYSA-M 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- GXHFUVWIGNLZSC-UHFFFAOYSA-N meldrum's acid Chemical compound CC1(C)OC(=O)CC(=O)O1 GXHFUVWIGNLZSC-UHFFFAOYSA-N 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 2
- DSLFTBDJHAJGPF-LBPRGKRZSA-N methyl (2S)-1-[(3-fluorophenyl)methylideneamino]pyrrolidine-2-carboxylate Chemical compound COC(=O)[C@@H]1CCCN1N=CC1=CC(F)=CC=C1 DSLFTBDJHAJGPF-LBPRGKRZSA-N 0.000 description 2
- QMIFEEFRVZBTFO-RGMNGODLSA-N methyl (2S)-5,5-dimethylpyrrolidine-2-carboxylate hydrochloride Chemical compound Cl.COC(=O)[C@@H]1CCC(C)(C)N1 QMIFEEFRVZBTFO-RGMNGODLSA-N 0.000 description 2
- YCYWAVUCBMJUPK-FJXQXJEOSA-N methyl (2s)-2-methylpyrrolidine-2-carboxylate;hydrochloride Chemical compound [Cl-].COC(=O)[C@]1(C)CCC[NH2+]1 YCYWAVUCBMJUPK-FJXQXJEOSA-N 0.000 description 2
- 150000004702 methyl esters Chemical class 0.000 description 2
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 2
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 2
- 235000019796 monopotassium phosphate Nutrition 0.000 description 2
- 125000006203 morpholinoethyl group Chemical group [H]C([H])(*)C([H])([H])N1C([H])([H])C([H])([H])OC([H])([H])C1([H])[H] 0.000 description 2
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 150000002825 nitriles Chemical class 0.000 description 2
- 239000012038 nucleophile Substances 0.000 description 2
- KJIFKLIQANRMOU-UHFFFAOYSA-N oxidanium;4-methylbenzenesulfonate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1 KJIFKLIQANRMOU-UHFFFAOYSA-N 0.000 description 2
- 125000000466 oxiranyl group Chemical group 0.000 description 2
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 2
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 2
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 2
- 229920001592 potato starch Polymers 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 2
- 125000001325 propanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 2
- 125000002112 pyrrolidino group Chemical group [*]N1C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- 229910052702 rhenium Inorganic materials 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 2
- 235000010288 sodium nitrite Nutrition 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 125000001425 triazolyl group Chemical group 0.000 description 2
- COIOYMYWGDAQPM-UHFFFAOYSA-N tris(2-methylphenyl)phosphane Chemical compound CC1=CC=CC=C1P(C=1C(=CC=CC=1)C)C1=CC=CC=C1C COIOYMYWGDAQPM-UHFFFAOYSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 1
- KQDCNVVEIHHIHW-YFKPBYRVSA-N (2S)-5,5-dimethylpyrrolidine-1,2-dicarboxylic acid Chemical compound CC1(C)CC[C@@H](C(O)=O)N1C(O)=O KQDCNVVEIHHIHW-YFKPBYRVSA-N 0.000 description 1
- YQXRKJHVAUKXRN-LLVKDONJSA-N (2r)-2-methyl-1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrolidine-2-carboxylic acid Chemical compound CC(C)(C)OC(=O)N1CCC[C@]1(C)C(O)=O YQXRKJHVAUKXRN-LLVKDONJSA-N 0.000 description 1
- LWHHAVWYGIBIEU-ZCFIWIBFSA-N (2r)-2-methylpyrrolidin-1-ium-2-carboxylate Chemical compound OC(=O)[C@@]1(C)CCCN1 LWHHAVWYGIBIEU-ZCFIWIBFSA-N 0.000 description 1
- XPRHZDASJAMLSE-SSDOTTSWSA-N (2r)-2-methylpyrrolidine-1,2-dicarboxylic acid Chemical compound OC(=O)[C@@]1(C)CCCN1C(O)=O XPRHZDASJAMLSE-SSDOTTSWSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- LWHHAVWYGIBIEU-LURJTMIESA-N (2s)-2-methylpyrrolidin-1-ium-2-carboxylate Chemical compound [O-]C(=O)[C@]1(C)CCC[NH2+]1 LWHHAVWYGIBIEU-LURJTMIESA-N 0.000 description 1
- IYOXBCOLEAZKBF-VKHMYHEASA-N (2s)-4,4-difluoropyrrolidine-1,2-dicarboxylic acid Chemical compound OC(=O)[C@@H]1CC(F)(F)CN1C(O)=O IYOXBCOLEAZKBF-VKHMYHEASA-N 0.000 description 1
- SFPBDVPSCZYAHV-QMMMGPOBSA-N (2s)-5,5-dimethyl-1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrolidine-2-carboxylic acid Chemical compound CC(C)(C)OC(=O)N1[C@H](C(O)=O)CCC1(C)C SFPBDVPSCZYAHV-QMMMGPOBSA-N 0.000 description 1
- MZKJBYWZZBXBFK-HSZRJFAPSA-N (4aR)-1-[(2,3-difluorophenyl)methyl]-4-hydroxy-N-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-4a-propyl-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound FC1=C(C=CC=C1F)CN1N2[C@@](C(=C(C1=O)C(=O)NC1=C(OC(=C1)C)C(F)(F)F)O)(CCC2)CCC MZKJBYWZZBXBFK-HSZRJFAPSA-N 0.000 description 1
- RCPPBWALZFWUMT-JOCHJYFZSA-N (4aR)-1-[(2,3-difluorophenyl)methyl]-4a-ethyl-4-hydroxy-N-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound FC1=C(C=CC=C1F)CN1N2[C@@](C(=C(C1=O)C(=O)NC1=C(OC(=C1)C)C(F)(F)F)O)(CCC2)CC RCPPBWALZFWUMT-JOCHJYFZSA-N 0.000 description 1
- YRIGCYLTFVOBHB-OAQYLSRUSA-N (4aR)-1-[(3-fluorophenyl)methyl]-4-hydroxy-4a-methyl-N-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound FC=1C=C(C=CC=1)CN1N2[C@@](C(=C(C1=O)C(=O)NC1=C(OC(=C1)C)C(F)(F)F)O)(CCC2)C YRIGCYLTFVOBHB-OAQYLSRUSA-N 0.000 description 1
- QSSFNOGYIASIRK-HSZRJFAPSA-N (4aR)-1-[(3-fluorophenyl)methyl]-4-hydroxy-N-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-4a-propyl-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound FC=1C=C(C=CC1)CN1N2[C@@](C(=C(C1=O)C(=O)NC1=C(OC(=C1)C)C(F)(F)F)O)(CCC2)CCC QSSFNOGYIASIRK-HSZRJFAPSA-N 0.000 description 1
- OYAWPVSYFAJGCW-JOCHJYFZSA-N (4aR)-4a-ethyl-1-[(3-fluorophenyl)methyl]-4-hydroxy-N-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-6,7-dihydro-5H-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound C(C)[C@]12N(N(C(C(=C1O)C(=O)NC1=C(OC(=C1)C)C(F)(F)F)=O)CC1=CC(=CC=C1)F)CCC2 OYAWPVSYFAJGCW-JOCHJYFZSA-N 0.000 description 1
- LPZAHVWYNFYKRF-ZDUSSCGKSA-N (4aS)-1-[(2,3-difluorophenyl)methyl]-6,6-difluoro-4-hydroxy-N-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-5,7-dihydro-4aH-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound FC1=C(C=CC=C1F)CN1N2[C@H](C(=C(C1=O)C(=O)NC1=C(OC(=C1)C)C(F)(F)F)O)CC(C2)(F)F LPZAHVWYNFYKRF-ZDUSSCGKSA-N 0.000 description 1
- NYMWBLVQUGWVPH-INIZCTEOSA-N (4aS)-1-[(3-fluorophenyl)methyl]-4-hydroxy-6,6-dimethyl-N-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-5,7-dihydro-4aH-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound FC=1C=C(C=CC=1)CN1N2[C@H](C(=C(C1=O)C(=O)NC1=C(OC(=C1)C)C(F)(F)F)O)CC(C2)(C)C NYMWBLVQUGWVPH-INIZCTEOSA-N 0.000 description 1
- NDZJSRJWCFMQJN-INIZCTEOSA-N (4as)-1-[(3-fluorophenyl)methyl]-4-hydroxy-7,7-dimethyl-n-[5-methyl-2-(trifluoromethyl)furan-3-yl]-2-oxo-5,6-dihydro-4ah-pyrrolo[1,2-b]pyridazine-3-carboxamide Chemical compound O1C(C)=CC(NC(=O)C=2C(N(CC=3C=C(F)C=CC=3)N3C(C)(C)CC[C@H]3C=2O)=O)=C1C(F)(F)F NDZJSRJWCFMQJN-INIZCTEOSA-N 0.000 description 1
- 125000006527 (C1-C5) alkyl group Chemical group 0.000 description 1
- 125000004916 (C1-C6) alkylcarbonyl group Chemical group 0.000 description 1
- VLSDXINSOMDCBK-BQYQJAHWSA-N (E)-1,1'-azobis(N,N-dimethylformamide) Chemical compound CN(C)C(=O)\N=N\C(=O)N(C)C VLSDXINSOMDCBK-BQYQJAHWSA-N 0.000 description 1
- FIARMZDBEGVMLV-UHFFFAOYSA-N 1,1,2,2,2-pentafluoroethanolate Chemical group [O-]C(F)(F)C(F)(F)F FIARMZDBEGVMLV-UHFFFAOYSA-N 0.000 description 1
- 125000004867 1,1-dimethylpropylcarbonyl group Chemical group CC(CC)(C(=O)*)C 0.000 description 1
- BKWQKVJYXODDAC-UHFFFAOYSA-N 1,2-dihydropyridazine Chemical class N1NC=CC=C1 BKWQKVJYXODDAC-UHFFFAOYSA-N 0.000 description 1
- 125000004317 1,3,5-triazin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=N1 0.000 description 1
- OMFPPWYSLQAUBI-UHFFFAOYSA-N 1-(2-chloroethoxy)-2,3-difluorobenzene Chemical compound FC1=CC=CC(OCCCl)=C1F OMFPPWYSLQAUBI-UHFFFAOYSA-N 0.000 description 1
- 125000004870 1-ethylpropylcarbonyl group Chemical group C(C)C(CC)C(=O)* 0.000 description 1
- 125000004678 1-methylpropylcarbonyl group Chemical group CC(CC)C(=O)* 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- HROVUTIERHLARY-UHFFFAOYSA-N 2,3-difluoro-4-[2-[2-methoxyethyl(methyl)amino]ethoxy]benzaldehyde Chemical compound COCCN(C)CCOC1=CC=C(C=O)C(F)=C1F HROVUTIERHLARY-UHFFFAOYSA-N 0.000 description 1
- LCZASQOOGUQRIA-UHFFFAOYSA-N 2,4,6-tripropyl-1,3,5,2,4,6-trioxatriphosphinane Chemical compound CCCP1OP(CCC)OP(CCC)O1 LCZASQOOGUQRIA-UHFFFAOYSA-N 0.000 description 1
- GTEZSHJBMRWRIG-UHFFFAOYSA-N 2-amino-3-[4-(naphthalene-2-carbonyloxy)phenyl]propanoic acid Chemical group C1=CC(CC(N)C(O)=O)=CC=C1OC(=O)C1=CC=C(C=CC=C2)C2=C1 GTEZSHJBMRWRIG-UHFFFAOYSA-N 0.000 description 1
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004883 2-ethylbutylcarbonyl group Chemical group C(C)C(CC(=O)*)CC 0.000 description 1
- 125000004680 2-methylbutylcarbonyl group Chemical group CC(CC(=O)*)CC 0.000 description 1
- QTWJRLJHJPIABL-UHFFFAOYSA-N 2-methylphenol;3-methylphenol;4-methylphenol Chemical compound CC1=CC=C(O)C=C1.CC1=CC=CC(O)=C1.CC1=CC=CC=C1O QTWJRLJHJPIABL-UHFFFAOYSA-N 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- KPGXRSRHYNQIFN-UHFFFAOYSA-L 2-oxoglutarate(2-) Chemical compound [O-]C(=O)CCC(=O)C([O-])=O KPGXRSRHYNQIFN-UHFFFAOYSA-L 0.000 description 1
- NKMKDPVCESDJCN-UHFFFAOYSA-N 3-[di(propan-2-yl)carbamoylimino]-1,1-di(propan-2-yl)urea Chemical compound CC(C)N(C(C)C)C(=O)N=NC(=O)N(C(C)C)C(C)C NKMKDPVCESDJCN-UHFFFAOYSA-N 0.000 description 1
- 125000006284 3-fluorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C(F)=C1[H])C([H])([H])* 0.000 description 1
- 125000004180 3-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(F)=C1[H] 0.000 description 1
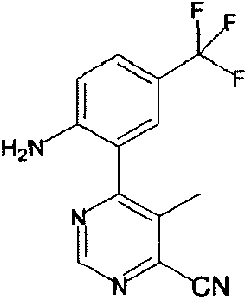
- KMEWDOIGJMUGOA-UHFFFAOYSA-N 4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyridin-3-yl]aniline Chemical compound FC(C1=CC(=C(N)C=C1)C=1C=NC(=CC1)C(F)(F)F)(F)F KMEWDOIGJMUGOA-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N 4-hydroxybenzoic acid Chemical class OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 125000004875 4-methylpentylcarbonyl group Chemical group CC(CCCC(=O)*)C 0.000 description 1
- MODHHZGJZVIYBK-UHFFFAOYSA-N 7-[[2,3-difluoro-4-[2-[methyl(oxetan-3-yl)amino]ethoxy]phenyl]methyl]-10-hydroxy-6-methyl-8-oxo-N-[4-(trifluoromethyl)-2-[6-(trifluoromethyl)pyrimidin-4-yl]phenyl]-6,7-diazaspiro[4.5]dec-9-ene-9-carboxamide Chemical compound FC1=C(CN2N(C3(CCCC3)C(=C(C2=O)C(=O)NC2=C(C=C(C=C2)C(F)(F)F)C2=NC=NC(=C2)C(F)(F)F)O)C)C=CC(=C1F)OCCN(C1COC1)C MODHHZGJZVIYBK-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 206010067484 Adverse reaction Diseases 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 206010061728 Bone lesion Diseases 0.000 description 1
- 125000006314 C5-C8 alkoxy group Chemical group 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- 238000006969 Curtius rearrangement reaction Methods 0.000 description 1
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- AEMOLEFTQBMNLQ-AQKNRBDQSA-N D-glucopyranuronic acid Chemical compound OC1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-AQKNRBDQSA-N 0.000 description 1
- 239000004287 Dehydroacetic acid Substances 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 208000018522 Gastrointestinal disease Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102100033839 Glucose-dependent insulinotropic receptor Human genes 0.000 description 1
- AEMRFAOFKBGASW-UHFFFAOYSA-M Glycolate Chemical compound OCC([O-])=O AEMRFAOFKBGASW-UHFFFAOYSA-M 0.000 description 1
- 101000996752 Homo sapiens Glucose-dependent insulinotropic receptor Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 208000037147 Hypercalcaemia Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical class NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 229910017569 La2(CO3)3 Inorganic materials 0.000 description 1
- 229920002884 Laureth 4 Polymers 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102000008109 Mixed Function Oxygenases Human genes 0.000 description 1
- 108010074633 Mixed Function Oxygenases Proteins 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- 238000007126 N-alkylation reaction Methods 0.000 description 1
- QIAFMBKCNZACKA-UHFFFAOYSA-N N-benzoylglycine Chemical compound OC(=O)CNC(=O)C1=CC=CC=C1 QIAFMBKCNZACKA-UHFFFAOYSA-N 0.000 description 1
- 101150020251 NR13 gene Proteins 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229910002666 PdCl2 Inorganic materials 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920002701 Polyoxyl 40 Stearate Polymers 0.000 description 1
- 241000350481 Pterogyne nitens Species 0.000 description 1
- 108091006788 SLC20A1 Proteins 0.000 description 1
- 108091006792 SLC20A2 Proteins 0.000 description 1
- 108091006574 SLC34A1 Proteins 0.000 description 1
- 108091006576 SLC34A2 Proteins 0.000 description 1
- 108091006575 SLC34A3 Proteins 0.000 description 1
- KHNXRSIBRKBJDI-UHFFFAOYSA-N Sevelamer hydrochloride Chemical compound Cl.NCC=C.ClCC1CO1 KHNXRSIBRKBJDI-UHFFFAOYSA-N 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 102100025262 Sodium-dependent phosphate transport protein 2A Human genes 0.000 description 1
- 102100038437 Sodium-dependent phosphate transport protein 2B Human genes 0.000 description 1
- 102100038440 Sodium-dependent phosphate transport protein 2C Human genes 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 235000009470 Theobroma cacao Nutrition 0.000 description 1
- 244000299461 Theobroma cacao Species 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 1
- 208000005475 Vascular calcification Diseases 0.000 description 1
- ZVQOOHYFBIDMTQ-UHFFFAOYSA-N [methyl(oxido){1-[6-(trifluoromethyl)pyridin-3-yl]ethyl}-lambda(6)-sulfanylidene]cyanamide Chemical compound N#CN=S(C)(=O)C(C)C1=CC=C(C(F)(F)F)N=C1 ZVQOOHYFBIDMTQ-UHFFFAOYSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 229940022663 acetate Drugs 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- YKIOKAURTKXMSB-UHFFFAOYSA-N adams's catalyst Chemical compound O=[Pt]=O YKIOKAURTKXMSB-UHFFFAOYSA-N 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 230000006838 adverse reaction Effects 0.000 description 1
- 150000001294 alanine derivatives Chemical class 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 125000005210 alkyl ammonium group Chemical group 0.000 description 1
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 230000002421 anti-septic effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 229940064004 antiseptic throat preparations Drugs 0.000 description 1
- 125000000637 arginyl group Chemical class N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 235000019568 aromas Nutrition 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical group 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- ZSIQJIWKELUFRJ-UHFFFAOYSA-N azepane Chemical compound C1CCCNCC1 ZSIQJIWKELUFRJ-UHFFFAOYSA-N 0.000 description 1
- QXNDZONIWRINJR-UHFFFAOYSA-N azocane Chemical compound C1CCCNCCC1 QXNDZONIWRINJR-UHFFFAOYSA-N 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 125000000928 benzodioxinyl group Chemical group O1C(=COC2=C1C=CC=C2)* 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000024279 bone resorption Effects 0.000 description 1
- VPEPQDBAIMZCGV-UHFFFAOYSA-N boron;5-ethyl-2-methylpyridine Chemical compound [B].CCC1=CC=C(C)N=C1 VPEPQDBAIMZCGV-UHFFFAOYSA-N 0.000 description 1
- NNTOJPXOCKCMKR-UHFFFAOYSA-N boron;pyridine Chemical compound [B].C1=CC=NC=C1 NNTOJPXOCKCMKR-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 229910052792 caesium Inorganic materials 0.000 description 1
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 1
- 239000004203 carnauba wax Substances 0.000 description 1
- 235000013869 carnauba wax Nutrition 0.000 description 1
- OSUPRVCFDQWKQN-UHFFFAOYSA-N cerium;nitric acid Chemical compound [Ce].O[N+]([O-])=O.O[N+]([O-])=O.O[N+]([O-])=O.O[N+]([O-])=O.O[N+]([O-])=O.O[N+]([O-])=O OSUPRVCFDQWKQN-UHFFFAOYSA-N 0.000 description 1
- 239000007810 chemical reaction solvent Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 229960002242 chlorocresol Drugs 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229930003836 cresol Natural products 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- SNRCKKQHDUIRIY-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloromethane;dichloropalladium;iron(2+) Chemical compound [Fe+2].ClCCl.Cl[Pd]Cl.C1=C[CH-]C(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.C1=C[CH-]C(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 SNRCKKQHDUIRIY-UHFFFAOYSA-L 0.000 description 1
- 238000006114 decarboxylation reaction Methods 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 235000019258 dehydroacetic acid Nutrition 0.000 description 1
- 229940061632 dehydroacetic acid Drugs 0.000 description 1
- JEQRBTDTEKWZBW-UHFFFAOYSA-N dehydroacetic acid Chemical compound CC(=O)C1=C(O)OC(C)=CC1=O JEQRBTDTEKWZBW-UHFFFAOYSA-N 0.000 description 1
- PGRHXDWITVMQBC-UHFFFAOYSA-N dehydroacetic acid Natural products CC(=O)C1C(=O)OC(C)=CC1=O PGRHXDWITVMQBC-UHFFFAOYSA-N 0.000 description 1
- 125000005131 dialkylammonium group Chemical group 0.000 description 1
- 235000019700 dicalcium phosphate Nutrition 0.000 description 1
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 125000006263 dimethyl aminosulfonyl group Chemical group [H]C([H])([H])N(C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- FPAFDBFIGPHWGO-UHFFFAOYSA-N dioxosilane;oxomagnesium;hydrate Chemical compound O.[Mg]=O.[Mg]=O.[Mg]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O FPAFDBFIGPHWGO-UHFFFAOYSA-N 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 150000002081 enamines Chemical group 0.000 description 1
- 230000037149 energy metabolism Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 150000002085 enols Chemical group 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 1
- BXHIDBJBTCECMT-SBSPUUFOSA-N ethyl (2R)-2-ethylpyrrolidine-2-carboxylate hydrochloride Chemical compound Cl.C(C)OC(=O)[C@@]1(NCCC1)CC BXHIDBJBTCECMT-SBSPUUFOSA-N 0.000 description 1
- HUADKQKHGLRRTM-DDWIOCJRSA-N ethyl (2R)-2-methylpyrrolidine-2-carboxylate hydrochloride Chemical compound Cl.C(C)OC(=O)[C@@]1(NCCC1)C HUADKQKHGLRRTM-DDWIOCJRSA-N 0.000 description 1
- PSYAXNJYMWIKNZ-HNCPQSOCSA-N ethyl (2R)-2-propylpyrrolidine-2-carboxylate hydrochloride Chemical compound Cl.C(C)OC(=O)[C@@]1(NCCC1)CCC PSYAXNJYMWIKNZ-HNCPQSOCSA-N 0.000 description 1
- BXHIDBJBTCECMT-FVGYRXGTSA-N ethyl (2S)-2-ethylpyrrolidine-2-carboxylate hydrochloride Chemical compound Cl.C(C)OC(=O)[C@]1(NCCC1)CC BXHIDBJBTCECMT-FVGYRXGTSA-N 0.000 description 1
- 235000010944 ethyl methyl cellulose Nutrition 0.000 description 1
- 239000001761 ethyl methyl cellulose Substances 0.000 description 1
- 125000004672 ethylcarbonyl group Chemical group [H]C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229940097042 glucuronate Drugs 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N glutaric acid Chemical compound OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 150000002332 glycine derivatives Chemical class 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004871 hexylcarbonyl group Chemical group C(CCCCC)C(=O)* 0.000 description 1
- 125000005935 hexyloxycarbonyl group Chemical group 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229940079826 hydrogen sulfite Drugs 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- 230000000148 hypercalcaemia Effects 0.000 description 1
- 208000030915 hypercalcemia disease Diseases 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000005932 isopentyloxycarbonyl group Chemical group 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- 239000008274 jelly Substances 0.000 description 1
- NZPIUJUFIFZSPW-UHFFFAOYSA-H lanthanum carbonate Chemical compound [La+3].[La+3].[O-]C([O-])=O.[O-]C([O-])=O.[O-]C([O-])=O NZPIUJUFIFZSPW-UHFFFAOYSA-H 0.000 description 1
- 229960001633 lanthanum carbonate Drugs 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- LVWZTYCIRDMTEY-UHFFFAOYSA-N metamizole Chemical compound O=C1C(N(CS(O)(=O)=O)C)=C(C)N(C)N1C1=CC=CC=C1 LVWZTYCIRDMTEY-UHFFFAOYSA-N 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- INBHDEHFDWNZTK-LBPRGKRZSA-N methyl (2S)-1-[(3-fluorophenyl)methylamino]pyrrolidine-2-carboxylate Chemical compound COC(=O)[C@H]1N(CCC1)NCC1=CC(=CC=C1)F INBHDEHFDWNZTK-LBPRGKRZSA-N 0.000 description 1
- HQEIPVHJHZTMDP-NUBCRITNSA-N methyl (2r)-pyrrolidine-2-carboxylate;hydrochloride Chemical compound Cl.COC(=O)[C@H]1CCCN1 HQEIPVHJHZTMDP-NUBCRITNSA-N 0.000 description 1
- TWHZGAYWZCCUSQ-YFKPBYRVSA-N methyl (2s)-1-nitrosopyrrolidine-2-carboxylate Chemical compound COC(=O)[C@@H]1CCCN1N=O TWHZGAYWZCCUSQ-YFKPBYRVSA-N 0.000 description 1
- HQEIPVHJHZTMDP-JEDNCBNOSA-N methyl (2s)-pyrrolidine-2-carboxylate;hydrochloride Chemical compound Cl.COC(=O)[C@@H]1CCCN1 HQEIPVHJHZTMDP-JEDNCBNOSA-N 0.000 description 1
- ULKQCHTVPMPZBP-UHFFFAOYSA-N methyl 1-(methylamino)cyclobutane-1-carboxylate Chemical compound COC(=O)C1(NC)CCC1 ULKQCHTVPMPZBP-UHFFFAOYSA-N 0.000 description 1
- UTBCRHAMJFMIIR-UHFFFAOYSA-N methyl 3-chloro-3-oxopropanoate Chemical compound COC(=O)CC(Cl)=O UTBCRHAMJFMIIR-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 125000004674 methylcarbonyl group Chemical group CC(=O)* 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 235000019426 modified starch Nutrition 0.000 description 1
- 125000006578 monocyclic heterocycloalkyl group Chemical group 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- OQJBFFCUFALWQL-UHFFFAOYSA-N n-(piperidine-1-carbonylimino)piperidine-1-carboxamide Chemical compound C1CCCCN1C(=O)N=NC(=O)N1CCCCC1 OQJBFFCUFALWQL-UHFFFAOYSA-N 0.000 description 1
- 125000006124 n-propyl sulfonyl group Chemical group 0.000 description 1
- 125000006252 n-propylcarbonyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 125000005461 organic phosphorous group Chemical group 0.000 description 1
- 230000011164 ossification Effects 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 125000005475 oxolanyl group Chemical group 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000000199 parathyroid hormone Substances 0.000 description 1
- 239000003182 parenteral nutrition solution Substances 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 229940067107 phenylethyl alcohol Drugs 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 1
- 125000004437 phosphorous atom Chemical group 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229940099429 polyoxyl 40 stearate Drugs 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 229940088417 precipitated calcium carbonate Drugs 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 150000003147 proline derivatives Chemical class 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical group C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- RUUOPSRRIKJHNH-UHFFFAOYSA-N pyridazine-3-carboxylic acid Chemical compound OC(=O)C1=CC=CN=N1 RUUOPSRRIKJHNH-UHFFFAOYSA-N 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- NISJKLIMPQPAQS-UHFFFAOYSA-N pyrrolo[1,2-b]pyridazine Chemical class C1=CC=NN2C=CC=C21 NISJKLIMPQPAQS-UHFFFAOYSA-N 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000005258 radioactive decay Effects 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 230000002000 scavenging effect Effects 0.000 description 1
- 125000005930 sec-butyloxycarbonyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 150000003354 serine derivatives Chemical class 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 229960003027 sevelamer hydrochloride Drugs 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- VFWRGKJLLYDFBY-UHFFFAOYSA-N silver;hydrate Chemical compound O.[Ag].[Ag] VFWRGKJLLYDFBY-UHFFFAOYSA-N 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- GGCZERPQGJTIQP-UHFFFAOYSA-N sodium;9,10-dioxoanthracene-2-sulfonic acid Chemical compound [Na+].C1=CC=C2C(=O)C3=CC(S(=O)(=O)O)=CC=C3C(=O)C2=C1 GGCZERPQGJTIQP-UHFFFAOYSA-N 0.000 description 1
- 230000002037 soft tissue calcification Effects 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 125000003003 spiro group Chemical group 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 229940086735 succinate Drugs 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 125000006253 t-butylcarbonyl group Chemical group [H]C([H])([H])C(C(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 150000005621 tetraalkylammonium salts Chemical class 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 150000003587 threonine derivatives Chemical class 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-M toluene-4-sulfonate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-M 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 125000005208 trialkylammonium group Chemical group 0.000 description 1
- TUQOTMZNTHZOKS-UHFFFAOYSA-N tributylphosphine Chemical compound CCCCP(CCCC)CCCC TUQOTMZNTHZOKS-UHFFFAOYSA-N 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- 125000005034 trifluormethylthio group Chemical group FC(S*)(F)F 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 210000005239 tubule Anatomy 0.000 description 1
- 150000003679 valine derivatives Chemical class 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/501—Pyridazines; Hydrogenated pyridazines not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/5025—Pyridazines; Hydrogenated pyridazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/504—Pyridazines; Hydrogenated pyridazines forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/18—Drugs for disorders of the endocrine system of the parathyroid hormones
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D237/00—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings
- C07D237/02—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings
- C07D237/04—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having less than three double bonds between ring members or between ring members and non-ring members
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains three hetero rings
- C07D487/18—Bridged systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Obesity (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Luminescent Compositions (AREA)
Abstract
Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen como en cualquiera de los siguientes apartados (1) y (2): (1) R1 es un átomo de hidrógeno o alquilo C1-C10; R4 es un átomo de hidrógeno, alquilo C1-C4 opcionalmente sustituido con uno o más sustituyentes Rf, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg, (alquil C1-C6)carbonilo, (aril C6-C10)carbonilo, un grupo -C(O)NR37R38, cicloalquilo C3-C7, o heterocicloalquilo de 5 a 8 miembros; y R5 es un átomo de hidrógeno o alquilo C1-C4; y (2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6; y R4 se define como antes; R3 es alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes Rh o R3 es alquilo C1-C4 sustituido con Re; R37 y R38 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C3; cada Rh se selecciona independientemente entre un átomo de halógeno, (alcoxi C1-C4)carbonilo, y un grupo -(O(CH2)a)b-alcoxi C1-C4, en donde a es un número entero seleccionado entre 2 a 4, y b es un número entero seleccionado entre 1 y 4; Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra; cada Rf se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, carboxi, (alcoxi C1-C6)carbonilo, alcoxi C1-C6 y arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg; cada Rg se selecciona independientemente entre un átomo de halógeno, alquilo C1-C6, alquinilo C2-C6 y 30 alcoxi C1-C6, en donde los grupos alquilo, alquinilo y alcoxi están cada uno opcionalmente sustituidos con uno o más sustituyentes seleccionados entre hidroxi y ciano; cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 10 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente susituido con alcoxi C1-C4), alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, un grupo -(O(CH2)q1)q2-NR41R42 (en donde q1 es un número entero seleccionado entre 1 y 4, y q2 es un número entero seleccionado entre 2 a 6), un grupo -(O(CH2)r1)r2-C(O)NR43R44 (en donde r1 es un número entero seleccionado entre 1 y 4, y r2 es un número entero seleccionado entre 1 y 4), un grupo -(O(CH2)s1)s2-NR45-C(O)R46 (en donde s1 y s2 son cada uno independientemente un número entero seleccionado entre 2 a 4), un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, y un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52 (en donde r1 es un número entero seleccionado entre 1 y 4, y r2 es un número entero seleccionado entre 1 y 4); R10, R11, R12, R13 y R15 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)alcoxi C1-C6, (alcoxi C1-C4)carbonilo, un grupo -(O(CH2)o)pOH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 3 a 10 miembros, heteroarilo de 5 a 10 miembros y un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 10 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (en donde el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4, (alcoxi C1-C4)carbonilo, (alquil C1- C4)tio, morfolino, (alquil C1-C3)sulfonilo y -C(O)NR53R54; Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd; Rb, Rc y Rd se seleccionan cada uno independientemente entre alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4, un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, un grupo -SF5, ciano, hidroxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14; cada R14 se selecciona independientemente entre un átomo de halógeno, oxo, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6)carbonilo, un grupo -NR27R28, un grupo -SO2NR35R36, (alquil C1-C4)tio y heterocicloalquilo de 5 a 10 miembros; R27 y R28 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C4)carbonilo; R35 y R36 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4; R39 es un átomo de hidrógeno, u alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6; R40 es un átomo de hidrógeno, alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6, ((alcoxi C1-C4)carbonil)alquilo C1-C6, alquilo C1-C6 sustituido con hidroxilo, un grupo -(CH2)u-NR55R56 (en donde u es un número entero seleccionado entre 1 y 4), un grupo -CH((CH2)v1COOR57)-(CH2)v2-COOR57 (en donde v1 es un número entero seleccionado entre 0 y 2, y v2 es un número entero seleccionado entre 1 y 3), un grupo -(CH2)w-SO3H (en donde w es un número entero seleccionado entre 1 y 4), un grupo -(CH2)x1-CH(COOH)-(CH2)x2-SO3H (en donde x1 es un número entero seleccionado entre 0 y 2, y x2 es un número entero seleccionado entre 1 y 3), oxacicloalquilo de 3 a 6 miembros, o un grupo -(CH2)t1-O-(CH2)t2-C(O)NR58R59 (en donde t1 y t2 son cada uno independientemente un número entero seleccionado entre 1 y 3); R41 es un átomo de hidrógeno o alquilo C1-C3; R42 es alquilo C1-C8 sustituido con uno o más grupos hidroxi, o (alcoxi C1-C3)alquilo C1-C4; R43 es un átomo de hidrógeno o alquilo C1-C3; R44 es alquilo C1-C8 sustituido con uno o más grupos hidroxi, o R43 y R44 junto con el átomo de nitrógeno al que están anclados pueden formar morfolino; R45 es un átomo de hidrógeno o alquilo C1-C3; R46 es alquilo C1-C6 sustituido con uno o más grupos hidroxi; R47 es alquilo C1-C3; R48 es (alcoxi C1-C3)alquilo C1-C4; R49 es un átomo de hidrógeno y alquilo C1-C4; R50 es -(CH2)z-NR60R61 (z es un número entero seleccionado entre 1 y 4, R60 es un átomo de hidrógeno o alquilo C1-C4 y R61 es (alcoxi C1-C3)alquilo C1-C4 o R60 y R61 junto con el átomo de nitrógeno al que están anclados pueden formar morfolino); R51 es un átomo de hidrógeno o alquilo C1-C4; R52 es alquilo C1-C8 sustituido con uno o más grupos hidroxi; R53 y R54 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4; R55 es un átomo de hidrógeno o alquilo C1-C4; R56 es (alquil C1-C4)carbonilo; R57 es un átomo de hidrógeno o alquilo C1-C4; R58 es un átomo de hidrógeno o alquilo C1-C3; y R59 es alquilo C1-C8 sustituido con uno o más grupos hidroxi.
Description
DESCRIPCIÓN
Derivado de dihidropiridazin-3,5-diona
Campo técnico
La presente invención se refiere a un derivado de dihidropiridazin-3,5-diona o una sal del mismo, o un solvato del compuesto o la sal. La presente invención también se refiere a un fármaco, una composición farmacéutica, un inhibidor del transportador de fosfato dependiente de sodio y un agente preventivo y/o terapéutico para la hiperfosfatemia, el hiperparatiroidismo secundario y la insuficiencia renal crónica, que contiene el derivado de dihidropiridazin-3,5-diona o la sal del mismo, o el solvato del compuesto o la sal como ingrediente activo, así como los derivados de dihidropiridazin-3,5-diona antes mencionados para su uso en un método de prevención y/o tratamiento.
Técnica anterior
El fósforo se encuentra en cada célula y representa 1% del peso corporal de una persona. Este elemento juega un papel esencial en el mantenimiento de la vida, tal como en el metabolismo energético de las células. La concentración de fósforo en la sangre se determina mediante la absorción desde el tracto gastrointestinal y la excreción desde el riñón, así como la formación y resorción ósea y se ajusta a un nivel constante. La absorción de fósforo en el tracto gastrointestinal se realiza principalmente mediante un transportador de fosfato dependiente de sodio NaPi-IIb (SLC34A2) (Documentos No Relacionados con Patentes 1 y 2). El fósforo en la sangre es filtrado por el glomérulo renal y es reabsorbida en las cantidades necesarias, principalmente por NaPi-IIa (SLC34A1) y NaPi-IIc (SLC34A3) en el túbulo renal (Documentos No Relacionados con Patentes 1 y 3). El riñón juega un papel muy importante en la regulación del fósforo in vivo. En pacientes con insuficiencia renal en etapa terminal y pacientes en diálisis con insuficiencia renal, el fósforo se acumula en el organismo, lo que da como resultado un aumento de la concentración de fósforo en la sangre, es decir, hiperfosfatemia.
La hiperfosfatemia provoca la calcificación de los tejidos blandos. En particular, la calcificación vascular se considera responsable de la disfunción del corazón, que conduce a la muerte del paciente. La hiperfosfatemia también provoca la hipersecreción de hormonas paratiroideas, es decir, hiperparatiroidismo secundario, y causa lesiones óseas. Por lo tanto, la hiperfosfatemia se considera un factor problemático que deteriora el pronóstico y la calidad de vida de los pacientes con insuficiencia renal en etapa terminal y los pacientes sometidos a diálisis.
En el tratamiento actual de la hiperfosfatemia, se utilizan adsorbentes de fósforo con el fin de suprimir la absorción de fósforo en el tracto gastrointestinal. Los adsorbentes poliméricos no metálicos tipificados por el hidrocloruro de sevelámero, preparaciones de sales de calcio tipificadas por carbonato de calcio precipitado, o adsorbentes metálicos tipificados por carbonato de lantano se utilizan como adsorbentes de fósforo. Sin embargo, se ha informado de que estos adsorbentes tienen reacciones adversas, tales como trastornos gastrointestinales, incluyendo estreñimiento y diarrea, hipercalcemia causada por un aumento en la concentración sérica de calcio y acumulación de metales in vivo. Además, estos adsorbentes requieren una ingesta diaria de unos pocos gramos y, por lo tanto, presentan problemas de incumplimiento. En consecuencia, existe una fuerte demanda para el desarrollo de una nueva terapia para la hiperfosfatemia mejorada en términos de estos problemas de los adsorbentes de fósforo.
La inhibición de NaPi-IIb, que desempeña un papel importante en la absorción de fósforo en el tracto gastrointestinal, puede suprimir la absorción de fósforo en el tracto gastrointestinal, al igual que con los adsorbentes de fósforo, para disminuir la concentración de fósforo en la sangre (Documentos No Relacionados con Patentes 2 y 4). Además, PiT-1 (SLC20A1) y PiT-2 (SLC20A2), que son transportadores de fosfato dependientes de sodio como NaPi-IIb, son parcialmente responsables de la absorción de fósforo en el tracto gastrointestinal (Documentos No Relacionados con Patentes 1 y 6). Por lo tanto, se puede esperar que un compuesto que inhiba NaPi-IIb, PiT-1 y PiT-2 produzca un efecto inhibidor de la absorción de fósforo más fuerte y disminuya la concentración de fósforo en la sangre, en comparación con un inhibidor solo para NaPi-IIb. Mientras tanto, la supresión de la absorción de fósforo por la inhibición de estos transportadores de fosfato dependientes de sodio se basa en el mecanismo de acción diferente del de los adsorbentes de fósforo utilizados actualmente. Por lo tanto, se puede esperar que el inhibidor del transportador de fosfato dependiente de sodio sirva como un nuevo agente preventivo y/o terapéutico para la hiperfosfatemia en lugar de los adsorbentes de fósforo convencionales. Se espera adicionalmente que el inhibidor del transportador de fosfato dependiente de sodio ejerza efectos preventivos y/o terapéuticos sobre el hiperparatiroidismo secundario y la insuficiencia renal crónica al disminuir la concentración de fósforo en la sangre (Documento No Relacionado con Patentes 5). NTX1942 (Documento de Patente 1) y se ha informado hasta ahora que los compuestos descritos en los Documentos de Patente 2 y 4 son inhibidores de NaPi-IIb. Asimismo, se ha informado sobre un compuesto que tiene un esqueleto de piridazina en el Documento de Patente 3 que hace mención al tratamiento de la anemia, la isquemia y la hipoxia por la actividad inhibidora de HIF hidroxilasas del compuesto.
El Documento de Patente 5 describe análogos de piridona y piridazona que se informa que son moduladores de GPR119.
El Documento de Patente 6 se refiere a derivados de pirrolo[1,2-b]piridazina y su uso como moduladores de HIF. Lista de referencias
Documentos de patente
Documento de Patente 1: WO 2012/006475
Documento de Patente 2: WO 2011/136269
Documento de Patente 3: WO 2011/048611
Documento de Patente 4: WO 2013/062065
Documento de Patente 5: WO 2010/009183 A1
Documento de Patente 6: WO 2010/022240 A1
Documentos no relacionados con patentes
Documento No Relacionado con Patentes 1: J Pharm Sci. sep 2011; 100 (9): 3719-30;
Documento No Relacionado con Patentes 2: J Am Soc Nephrol. nov 2009; 20 (11): 2348-58;
Documento No Relacionado con Patentes 3: Pflugers Arch. feb. 2004; 447 (5): 763-7;
Documento No Relacionado con Patentes 4: Am J Physiol Renal Physiol. nov 2011; 301 (5): F1105-13; Documento No Relacionado con Patentes 5: Kidney Int. nov 2003; 64 (5): 1653-61; y
Documento No Relacionado con Patentes 6: Mol Aspects Med. abril-jun 2013; 34 (2-3): 386-95.
Compendio de la invención
Problema técnico
Existe una fuerte demanda para el desarrollo de una nueva terapia de hiperfosfatemia mejorada en términos de estos problemas de los adsorbentes de fósforo existentes.
Solución al problema
Los autores de la presente invención han realizado estudios diligentes a la luz de los problemas descritos anteriormente y, en consecuencia, completaron la presente invención al encontrar por primera vez que un compuesto representado por la fórmula (I) que se muestra a continuación, que difiere en gran medida en la estructura química de los inhibidores de NaPi-IIb conocidos en la técnica, tiene un excelente efecto inhibidor de NaPi-IIb, efecto inhibidor de PiT-1 y/o efecto inhibidor de PiT-2, es útil en la prevención y/o tratamiento de la hiperfosfatemia, hiperparatiroidismo secundario e insuficiencia renal crónica, y tiene excelente eficacia farmacológica en estas enfermedades. Específicamente, un aspecto de la presente invención proporciona compuestos mostrados a continuación, o sales de los mismos, o solvatos de los compuestos o las sales, como se define en las reivindicaciones adjuntas.
En la presente memoria se describen los siguientes compuestos (1-1) a (1-54):
(1-1) Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal:
[Fórmula 1]
en donde R1, R4 y R5 se definen como en cualquiera de los siguientes apartados (1) a (3):
(1) R1 es un átomo de hidrógeno o alquilo C1-C10;
R4 es un átomo de hidrógeno, alquilo C1-C4 opcionalmente sustituido con uno o más sustituyentes Rf, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg, (alquil C1-C6)carbonilo, (aril C6-C10)carbonilo, un grupo -C(O)NR37R38, cicloalquilo C3-C7 , o heterocicloalquilo de 5 a 8 miembros; y
R5 es un átomo de hidrógeno o alquilo C1-C4 ;
(2) R1 y R5 junto con el átomo de carbono al que están unidos forman un anillo carbocíclico saturado C3-C6 ; y
R4 se define como antes; y
(3) R1 es un átomo de hidrógeno o alquilo C1-C10 lineal;
R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados forman un anillo heterocíclico saturado de 5 a 8 miembros, en donde el anillo heterocíclico saturado está opcionalmente sustituido con uno o más sustituyentes R2;
R3 es alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes Rh o R3 es alquilo C1-C4 sustituido con Re;
R37 y R38 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C3 ; cada R2 se selecciona independientemente entre alquilo C1-C5 y un átomo de halógeno; y/o
dos o más sustituyentes R2 en el anillo heterocíclico saturado de 5 a 8 miembros juntos pueden formar alquileno C1-C5 que conecta los átomos del anillo a los que están anclados;
cada Rh se selecciona independientemente entre un átomo de halógeno, (alcoxi C1-C4)carbonilo, y un grupo -(O(CH2)a)b-alcoxi C1-C4 , en donde a es un número entero seleccionado entre 2 a 4, y b es un número entero seleccionado entre 1 y 4;
Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra;
cada Rf se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, carboxi, (alcoxi C1-C6)carbonilo, alcoxi C1-C6 y arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg; cada Rg se selecciona independientemente entre un átomo de halógeno, alquilo C1-C6 , alquinilo C2-C6 y alcoxi C1-C6, en donde los grupos alquilo, alquinilo y alcoxi están cada uno opcionalmente sustituidos con uno o más sustituyentes seleccionados entre hidroxi y ciano;
cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 10 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4), alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, un grupo -(O(CH2)q1)q2-NR41R42 (en donde q1 es un número entero seleccionado entre 1 y 4, y q2 es un número entero seleccionado entre 2 a 6), un grupo -(O(CH2)n)r2-C(O)NR43R44 (en donde r1 es un número entero seleccionado entre 1 y 4, y r2 es un número entero seleccionado entre 1 y 4), un grupo -(O(CH2)s1)s2-NR45-C(O)R46 (en donde s1 y s2 son cada uno independientemente un número entero seleccionado entre 2 a 4), un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, y un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52 (en donde r1 es un número entero seleccionado entre 1 y 4, y r2 es un número entero seleccionado entre 1 y 4);
R10, R11, R12, R13 y R15 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)alcoxi C1-C6, (alcoxi C1-C4)carbonilo, un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 3 a 10 miembros, heteroarilo de 5 a 10 miembros y un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 10 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (en donde el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4 , (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolino, (alquil C1-C3)sulfonilo y -C(O)NR53R54;
Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 , un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, un grupo -SF5 , ciano, hidroxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14;
cada R14 se selecciona independientemente entre un átomo de halógeno, oxo, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6)carbonilo, un grupo -NR27R28, un grupo -SO2NR35R36, (alquil
Ci-C4)tio y heterocicloalquilo de 5 a 10 miembros;
R27 y R28 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C4)carbonilo;
R35 y R36 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4; R39 es un átomo de hidrógeno, u alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6;
R40 es un átomo de hidrógeno, alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6 , ((alcoxi C1-C4)carbonil)alquilo C1-C6 , alquilo C1-C6 sustituido con hidroxilo, un grupo -(CH2)u-NR55R56 (en donde u es un número entero seleccionado entre 1 y 4), un grupo -CH((CH2)v1COOR57)-(CH2)v2-COOR57 (en donde v1 es un número entero seleccionado entre 0 y 2, y v2 es un número entero seleccionado entre 1 y 3), un grupo -(CH2VSO 3H (en donde w es un número entero seleccionado entre 1 y 4), un grupo -(CH2)x1-CH(COOH)-(CH2)x2-SO3H (en donde x1 es un número entero seleccionado entre 0 y 2, y x2 es un número entero seleccionado entre 1 y 3), oxacicloalquilo de 3 a 6 miembros, o un grupo -(CH2)t1-O-(CH2)t2-C(0)NR58R59 (en donde t1 y t2 son cada uno independientemente un número entero seleccionado entre 1 y 3);
R41 es un átomo de hidrógeno o alquilo C1-C3;
R42 es alquilo C1-C8 sustituido con uno o más grupos hidroxi, o (alcoxi C1-C3)alquilo C1-C4;
R43 es un átomo de hidrógeno o alquilo C1-C3;
R44 es alquilo C1-C8 sustituido con uno o más grupos hidroxi, o
R43 y R44 junto con el átomo de nitrógeno al que están anclados pueden formar morfolino;
R45 es un átomo de hidrógeno o alquilo C1-C3;
R46 es alquilo C1-C6 sustituido con uno o más grupos hidroxi;
R47 es alquilo C1-C3 ;
R48 es (alcoxi C1-C3)alquilo C1-C4 ;
R49 es un átomo de hidrógeno y alquilo C1-C4 ;
R50 es -(CH2)z-NR60R61 (z es un número entero seleccionado entre 1 y 4, R60 es un átomo de hidrógeno o alquilo C1-C4 y R61 es (alcoxi C1-C3)alquilo C1-C4 o R60 y R61 junto con el átomo de nitrógeno al que están anclados pueden formar morfolino);
R51 es un átomo de hidrógeno o alquilo C1-C4;
R52 es alquilo C1-C8 sustituido con uno o más grupos hidroxi;
R53 y R54 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 ; R55 es un átomo de hidrógeno o alquilo C1-C4;
R56 es (alquil C1-C4)carbonilo;
R57 es un átomo de hidrógeno o alquilo C1-C4;
R58 es un átomo de hidrógeno o alquilo C1-C3; y
R59 es alquilo C1-C8 sustituido con uno o más grupos hidroxi.
(1-2) El compuesto de acuerdo con el apartado (1-1) o una sal del mismo, o un solvato del compuesto o la sal, en donde
cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;
R10, R11, R12, R13 y R15 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)carbonilo, un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 3 a 10 miembros, heteroarilo de 5 a 10 miembros y un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 10 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno y alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi); y
R39 y R40 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6.
(1-3) El compuesto de acuerdo con los apartados (1-1) o (1-2) o una sal del mismo, o un solvato del compuesto o la sal, en donde
heterocicloalquiloxi de 3 a 10 miembros en la definición de Ra es heterocicloalquiloxi de 3 a 6 miembros; heterocicloalquilo de 3 a 10 miembros en la definición de R10, R11, R12, R13 y R15 es heterocicloalquilo de 3 a 6 miembros; y
heteroarilo de 5 a 10 miembros en la definición de R10, R11, R12, R13 y R15 es heteroarilo de 5 a 6 miembros.
(1-4) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-3) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 o un átomo de halógeno;
Rc es un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, o un grupo -SF5 ; y
Rd es ciano, hidroxi, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14
(1-5) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-4) o una sal del mismo, o un solvato del compuesto o la sal, en donde
cada Ra se selecciona independientemente entre un átomo de halógeno, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 6 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4), alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, un grupo -(O(CH2)q1)q2-NR41R42, un grupo -(O(CH2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, y un grupo -(O(CH2)y1)y2-O-CH2-NR51R52;
R10 es carboxi, heterocicloalquilo de 3 a 6 miembros, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, o un grupo -(O(CH2)o)p-OH;
R11 es hidroxi, carboxi, heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH, cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi o un grupo -Nr39R40; R12 es un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)alcoxi C1-C6 , (alcoxi C1-C3)carbonilo, heterocicloalquilo de 3 a 6 miembros, heteroarilo de 5 o 6 miembros, o un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 6 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (en donde el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4, (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolinilo, (alquil C1-C3)sulfonilo y -C(O)NR53R54;
R13 es heterocicloalquilo de 5 o 6 miembros; y
o y p son cada uno independientemente un número entero seleccionado entre 2 a 4.
(1-6) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-5) o una sal del mismo, o un solvato del compuesto o la sal, en donde
cada Ra se selecciona independientemente entre un átomo de halógeno, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 6 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;
cada R10 se selecciona independientemente entre carboxi, heterocicloalquilo de 3 a 6 miembros, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, y un grupo -(O(CH2)o)p-OH;
cada R11 se selecciona independientemente entre hidroxi, carboxi, heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH y cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi;
cada R12 se selecciona independientemente entre un átomo de halógeno, hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, heterocicloalquilo de 3 a 6 miembros, heteroarilo de 5 o 6 miembros y un grupo -NR39R40;
R13 es heterocicloalquilo de 5 o 6 miembros; y
o y p son cada uno independientemente un número entero seleccionado entre 2 a 4.
(1-7) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-5) o una sal del mismo, o un solvato del compuesto o la sal, en donde cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, alquilo C1-C6, (carboxi)alquilo C1-C8 , (morfolino)alquilo C1-C4 , [HO-((CH2)oO)p]alquilo C1-C6 , (alcoxi C1-C6)alquilo C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , alcoxi C1-C6 sustituido con uno o más grupos hidroxi, ((alcoxi C1
C3)carbonil)alcoxi C1-C3 , (alcoxi Ci-C6)alcoxi Ci-Cs opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi Ci-C3(alcoxi Ci-C4))alcoxi C1-C4, (carboxi)alcoxi Ci-Cs, (heterocicloalquil de 3 a 6 miembros)alcoxi Ci-C6 (el radical heterocicloalquilo está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi Ci-C4)alquilo C1-C4 (el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4 , (alcoxi Ci-C4)carbonilo, (alquil Ci-C4)tio, morfolino, (alquil Ci-C3)sulfonilo y (di(alquil Ci-C3)amino)carbonilo), alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)viCOOR57)-(CH2)v2-CoOR57, [N-(oxacicloalquil de 3 a 6 miembros)-N-(alquil Ci-C3)amino]alcoxi C1-C4 , [N,N-di((hidroxi)alquil C1-C4)-aminojalcoxi C1-C4 , [N-((alcoxi Ci-C3)carbonil)alquil Ci-C3-N-(alquil Ci-C3)amino]alcoxi C1-C4 (piridinil)alcoxi Ci-C4(pirimidinil)alcoxi C1-C4 , (1,2,4-triazolil)alcoxi C1-C4 , [N-(hidroxi)alquil Ci-C4-N-(alquil Ci-C3)amino]alcoxi C1-C4 , [N,N-di((alcoxi Ci-C3)alquil Ci-C4)amino]alcoxi C1-C6 , [N,N-di(alquil Ci-C3)amino]alcoxi C1-C6 , [N-[N-(alquil Ci-C4)carbonil-N-(alquil Ci-C3)amino]alquil Ci-C4-N-(alquil Ci-C3)amino]alcoxi C1-C4 , [N-[N-(alquil Ci-C4)carbonil-amino]alquil Ci-C4-N-(alquil Ci-C3)amino]alcoxi C1-C4 , un grupo -(O(CH2)ri)r2-C(O)NR43R44, un grupo -(O(CH2)qi)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(c H2)w SO3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)xi-CH(COOH)-(CH2)x2-SO3H, un grupo -(O(CH2)si)s2-NR45-C(O)R46, un grupo -C(O)NR47R4S, piridinilo, un grupo -n R49R50, un grupo -(O(cH2)yi)y2-O-CH2-C(O)NR51R52, (carboxi)alquinilo C2-C6, (heterocicloalquilo de 3 a 6 miembros)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos oxo, alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8, (alcoxi Ci-C6)alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, (cicloalquil C3-C6)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos hidroxi, [N-((alcoxi Ci-C3)alquil Ci-C4)-N-(alquil Ci-C3)amino]alquinilo C2-C6 , (alcoxi Ci-C3)carbonilo, (morfolino)(alquil Ci-C4)tio opcionalmente sustituido con uno o más grupos oxo, oxacicloalquiloxi de 3 a 6 miembros, o heterocicloalquiloxi que contiene nitrógeno de 4 a 6 miembros (el radical heterocicloalquilo que contiene nitrógeno está opcionalmente sustituido con un sustituyente seleccionado entre (alcoxi Ci-C3)alquilo C1-C4 y alquilo C1-C3).
(1-8) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-7) o una sal del mismo, o un solvato del compuesto o la sal, en donde cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, alquilo C1-C6, (carboxi)alquilo Ci-Cs, (morfolino)alquilo C1-C4 , (alcoxi Ci-C6)alquilo Ci-Cs sustituido con uno o más grupos hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi Ci-C3)alquil Ci-C4)-N-(alquil Ci-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6 (el radical morfolino está opcionalmente sustituido con uno o dos sustituyentes seleccionados entre oxo y alquilo C1-C3), (alcoxi Ci-C6)alcoxi Ci-Cs opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi Ci-C3(alcoxi Ci-C4))alcoxi C1-C4 , (carboxi)alcoxi Ci-Cs (pirrolidinil)alcoxi C1-C4 (el radical pirrolidinilo está opcionalmente sustituido con (alquil Ci-C3)alcoxi C1-C4), alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)viCOOR57)-(CH2)v2-COOR57, [N-(oxetanil)-N-(alquil Ci-C3)amino]alcoxi C1-C4 , [N,N-di(alquil Ci-C3)amino]alcoxi C1-C6 , un grupo -(O(CH2)ri)r2-C(O)NR43R44, un grupo -(O(CH2)qi)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)w-So3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)xi-CH(COOH)-(CH2)x2-SO3H, (carboxi)alquinilo C2-C6 , (morfolino)alquinilo C2-C6 , alquinilo C2-Cs opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-Cs, (alcoxi Ci-C6)alquinilo C2-Cs sustituido con uno o más grupos hidroxi, o (alcoxi Ci-C3)carbonilo.
(1-9) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-3) o una sal del mismo, o un solvato del compuesto o la sal, en donde cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, alquilo C1-C3, (carboxi)alquilo Ci-Cs, (alcoxi Ci-C6)alquilo Ci-Cs sustituido con uno o más grupos hidroxi, alcoxi C1-C3 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi Ci-C3)alquil Ci-C4)-N-(alquil Ci-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6 , (alcoxi Ci-C6)alcoxi Ci-Cs sustituido con uno o más grupos hidroxi, (carboxi)alquinilo C2-C6 , (morfolino)alquinilo C2-C6 , alquinilo C2-Cs opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-Cs, (alcoxi Ci-C6)alquinilo C2-Cs sustituido con uno o más grupos hidroxi, y (alcoxi Ci-C3)carbonilo.
(1-10) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-9) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es metilo sustituido con Re.
(1-11) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-10) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo opcionalmente sustituido con uno o más sustituyentes Ra en el anillo de benceno.
(1-12) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-11) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo opcionalmente sustituido con uno a tres sustituyentes Ra en el anillo de benceno.
(1-13) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-6) y (1-10) a (1-12) o una sal del mismo, o un solvato del compuesto o la sal, en donde Re es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;
los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;
Ri es un átomo de halógeno o alcoxi C1-C3;
Rj es un átomo de halógeno, nitro o ciano; y
Rk es hidroxi, un átomo de halógeno, (alcoxi Ci-C4)carbonilo, heterocicloalquiloxi de 5 a 10 miembros (el
grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4), alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, un grupo -(O(CH2)q1)q2-NR41R42, un grupo -(O(CH2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, o un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52.
(1-14) El compuesto de acuerdo con el apartado (1-13) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rk es hidroxi, un átomo de halógeno, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 6 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4), alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, un grupo -(O(CH2)q1)q2-NR41R42, un grupo -(O(CH2)n )r2-C(O)NR43R44, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, o un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52;
R10 es un carboxi, hidroxi, morfolinilo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, o un grupo -(O(CH2)o)p-OH;
R11 es un hidroxi, carboxi, morfolinilo opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH, cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi o un grupo -NR39R40;
R12 es un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)alcoxi C1-C6 , (alcoxi C1-C3)carbonilo, heterocicloalquilo de 3 a 6 miembros, heteroarilo de 5 o 6 miembros que contiene un átomo de nitrógeno, o un grupo -NR39R40,
en donde el grupo heterocicloalquilo de 3 a 6 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (en donde el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4, (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolinilo, (alquil C1-C3)sulfonilo y -C(O)NR53R54;
R13 es morfolinilo; y
o y p son cada uno independientemente un número entero seleccionado entre 2 a 4.
(1-15) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-6) y (1-10) a (1-13) o una sal del mismo, o un solvato del compuesto o la sal,
en donde Re es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;
los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;
Ri es un átomo de halógeno o alcoxi C1-C3;
Rj es un átomo de halógeno, nitro o ciano; y
Rk es hidroxi, un átomo de halógeno, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 5 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12 o (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13.
(1-16) El compuesto de acuerdo con los apartados (1-14) o (1-15) o una sal del mismo, o un solvato del compuesto o la sal,
en donde Rk es hidroxi, un átomo de halógeno, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 6 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12 o (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;
cada R10 se selecciona independientemente entre hidroxi, carboxi, morfolinilo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, y un grupo -(O(CH2)o)p-OH;
cada R11 se selecciona independientemente entre hidroxi, carboxi, morfolinilo opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH y cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi;
cada R12 se selecciona independientemente entre un átomo de halógeno, hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, heterocicloalquilo de 3 a 6 miembros, piridinilo, pirrilo y un grupo -NR39R40;
R13 es morfolinilo; y
o y p son cada uno independientemente un número entero seleccionado entre 2 a 4.
(1-17) El compuesto de acuerdo con los apartados (1-13) o (1-14) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rk es un átomo de halógeno, hidroxi, alquilo C1-C6 , (carboxi)alquilo C1-C8, (morfolino)alquilo C1-C4 , [HO-((CH2)oO)p]alquilo C1-C6, (alcoxi C1-C6)alquilo C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , alcoxi C1-C6 sustituido con uno o más grupos hidroxi, ((alcoxi C1-C3)carbonil)alcoxi C1-C3 , (alcoxi C1-C6)alcoxi C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3(alcoxi C1-C4))alcoxi C1-C4 , (carboxi)alcoxi C1-C8 , (heterocicloalquil de 3 a 6 miembros)alcoxi C1-C6 (el radical heterocicloalquilo contiene uno a tres heteroátomos seleccionados entre O o N, y está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el radical alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4, (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolino, (alquil C1-C3)sulfonilo y (di(alquil C1-C3)amino)carbonilo), alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)v1COOR57)-(CH2)v2-Co Or57, [N-(oxacicloalquil de 3 a 6 miembros)-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di((hidroxi)alquil C1-C4)-amino]alcoxi C1-C4 , [N-((alcoxi C1-C3)carbonil)alquil C1-C3-N-(alquil C1-C3)amino]alcoxi C1-C4 (piridinil)alcoxi C1-C4(pirimidinil)alcoxi C1-C4 , (1,2,4-triazolil)alcoxi C1-C4 , [N-(hidroxi)alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di(alcoxi C1-C3(alquil C1-C3))amino]alcoxi C1-C6, [N,N-di(alquil C1-C3)amino]alcoxi C1-C6, [N-[N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, [N-[N-(alquil C1-C4)carbonil-amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, un grupo -(O(CH2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)q1)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo
-NH-(CH2)w-s O3H alcoxi C1-C4 sustituido con un grupo -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, un grupo -NR49R50, un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52, (carboxi) alquinilo C2-C8 , (heterocicloalquilo de 3 a 6 miembros)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos oxo, alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8 , (alcoxi C1-C6)alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, (cicloalquil C3-C6)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, (morfolino)(alquil C1-C4)tio, oxacicloalquiloxi de 3 a 6 miembros o heterocicloalquiloxi que contiene nitrógeno de 3 a 6 miembros (el radical heterocicloalquilo que contiene nitrógeno está opcionalmente sustituido con un sustituyente seleccionado entre (alcoxi C1-C3)alquilo C1-C4 y alquilo C1-C3).
(1-18) El compuesto de acuerdo con cualquiera de los apartados (1-13), (1-14) y (1-17) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rk es hidroxi, un átomo de halógeno, alquilo C1-C6, (carboxi)alquilo C1-C8 , (morfolino)alquilo C1-C4 , (alcoxi C1-C6)alquilo C1-C8 sustituido con uno o más grupos hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6 , (alcoxi C1-C6)alcoxi C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3(alcoxi C1-C4))alcoxi C1-C4 , (carboxi)alcoxi C1-C8 (pirrolidinil)alcoxi C1-C4 (el radical pirrolidinilo está sustituido con (alquil C1-C3)C)alcoxi C1-C4), alcoxi C1-C4 sustituido con un grupo -NH-CH((Ch2)v1COOR57)-(CH2)v2-COOR57, [N-(oxetanil)-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di(alquil C1-C3)amino]alcoxi C1-C6 , un grupo -(O(CH2)ri)r2-C(O)NR43R44, un grupo -(O(CH2)q1)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)w-SO3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, (carboxi) alquinilo C2-C8 , (morfolino)alquinilo C2-C6 , alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8, (alcoxi C1-C6)alquinilo C2-C8 sustituido con uno o más grupos hidroxi, o (alcoxi C1-C3)carbonilo.
(1-19) El compuesto de acuerdo con cualquiera de los apartados (1-13) a (1-18) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rk es hidroxi, un átomo de halógeno, alquilo C1-C6 , (carboxi)alquilo C1-C8 , (alcoxi C1-C6)alquilo C1-C8 sustituido con uno o más grupos hidroxi, alcoxi C1-C3 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4, (morfolino)alcoxi C1-C6 , (alcoxi C1-C6)alcoxi C1-C8 sustituido con uno o más grupos hidroxi, (carboxi) alquinilo C2-C8 , (morfolino)alquinilo C2-C6 , alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8 , (alcoxi C1-C6)alquinilo C2-C8 sustituido con uno o más grupos hidroxi, o (alcoxi C1-C3)carbonilo.
(1-20) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-19) o una sal del mismo, o un solvato del compuesto o la sal,
en donde R1, R4 y R5 se definen como en cualquiera de los siguientes apartados (1) a (3):
(1) R1 es un átomo de hidrógeno o alquilo C1-C6 ;
R4 es alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno o fenilo; y
R5 es un átomo de hidrógeno o alquilo C1-C4 ;
(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado
C3-C6 ; y
R4 se define como antes; y
(3) R1 es un átomo de hidrógeno o alquilo C1-C6 lineal;
R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados forman un anillo heterocíclico saturado de 5 a 8 miembros.
(1-21) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-3), (1-10) a (1-12) y (1-20) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1, R4 y R5 se definen como en los siguientes apartados (1) o (2):
(1) R1 se selecciona entre alquilo C1-C6 ;
R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o fenilo; y
R5 es un átomo de hidrógeno o alquilo C1-C4 ; o
(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 ; y
R4 se define como antes;
R3 es alquilo C1-C4 sustituido con Re;
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno, alquinilo C2-C6 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C6 opcionalmente sustituido con uno o más sustituyentes R12, heterocicloalquiloxi de 3 a 6 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4), un grupo -(O(CH2)q1)q2-NR41R42, un grupo -(O(CH2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, y un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52;
R11 y R12 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más hidroxi, (alcoxi C1-C4)alcoxi C1-C6 , heterocicloalquilo de 3 a 6 miembros, heteroarilo de 5 a 6 miembros y un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 6 miembros está opcionalmente sustituido con uno o dos sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (en donde el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4 , (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolino, (alquil C1-C3)sulfonilo y -C(O)NR53R54;
Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4, un grupo -SO2NR35R36 (en donde R35 y R36 se seleccionan cada uno independientemente entre alquilo C1-C4) y (alquil C1-C4)tio. (1-22) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-3), (1-5) a (1-7), (1-10) a (1-12), (1-20), y (1-21) o una sal del mismo, o un solvato del compuesto o la sal, en donde cada Ra se selecciona independientemente entre un átomo de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4, (alcoxi C1-C4)alcoxi C1-C6 (el radical alcoxi C1-C4 está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C3(alcoxi C1-C4))alcoxi C1-C4, (carboxi)alcoxi C1-C6 , (heterocicloalquil de 3 a 6 miembros)alcoxi C1-C6 (el radical heterocicloalquilo está opcionalmente sustituido con uno o dos sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)alquilo C1-C4 (el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), C1-4alcoxi, (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolino, (alquil C1-C3)sulfonilo y (di(alquil C1-C3)amino)carbonilo), alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)v1COOR57)-(CH2 )v2-COOR57, [N-(oxacicloalquil de 3 a 6 miembros)-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di((hidroxi)alquil C1-C4)-amino]alcoxi C1-C4 , [N-((alcoxi C1-C3)carbonil)alquil C1-C3-N-(alquil C1-C3)amino]alcoxi C1-C4 , (1,2,4-triazolil)alcoxi C1-C4, [N-(hidroxi)alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, [N,N-di((alcoxi C1-C3)alquil C1-C4)amino]alcoxi C1-C6 , [N,N-di(alquil C1-C3)amino]alcoxi C1-C6 , [N-[N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, [N-[N-(alquil C1-C4)carbonilamino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno,
un grupo -(O(CH2)ri)r2-C(O)NR43R44, un grupo -(O(CH2)qi)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)w-SO3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, un grupo -NR49R50, un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52, (heterocicloalquil de 3 a 6 miembros)alquinilo C2-C6 (el radical heterocicloalquilo está opcionalmente sustituido con uno o más grupos oxo), [N-((alcoxi C1-C3)alquil C1-C4-N-(alquil C1-C3)amino]alquinilo C2-C6 , alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, oxacicloalquiloxi de 3 a 6 miembros, o heterocicloalquiloxi que contiene nitrógeno de 4 a 6 miembros (el radical heterocicloalquilo está opcionalmente sustituido con un sustituyente seleccionado entre (alcoxi C1-C3)alquilo C1-C4 y alquilo C1-C3).
(1-23) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-3), (1-10) a (1-13), (1-20) y (1-21) o una sal del mismo, o un solvato del compuesto o la sal, en donde Re es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;
los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;
Ri es un átomo de halógeno;
Rj es un átomo de halógeno; y
Rk es un átomo de halógeno, heterocicloalquiloxi de 3 a 6 miembros (el radical heterocicloalquilo comprende un heteroátomo seleccionado entre O y N y está opcionalmente sustituido con alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4), alquinilo C2-C6 opcionalmente sustituido con R11, opcionalmente R12-alcoxi C1-C6 sustituido, un grupo -(O(CH2)q1)q2-NR41R42, un grupo -(O(CH2)n )r2-C(O)NR43R44, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, un grupo -NR49R50, o un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52 (1-24) El compuesto de acuerdo con los apartados (1-21) o (1-23) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R11 es morfolino;
R12 se selecciona entre heterocicloalquilo de 5 a 6 miembros que contiene uno o dos heteroátomos seleccionados entre O y N, (alcoxi C1-C4)alcoxi C1-C6 o un grupo -Nr39R40.
(1-25) El compuesto de acuerdo con cualquiera de los apartados (1-13), (1-14), (1-17) y (1-23) o una sal del mismo, o un solvato del compuesto o la sal,
en donde Rk es [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , (alcoxi C1-C4)alcoxi C1-C6 (el radical alcoxi C1-C4 está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C3(alcoxi C1-C4))alcoxi C1-C4 , (carboxi)alcoxi C1-C6, (heterocicloalquil de 3 a 6 miembros)alcoxi C1-C6 (el radical heterocicloalquilo comprende uno a tres heteroátomos que se seleccionan de O o N y están opcionalmente sustituidos con uno o dos sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el radical alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4 , (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolino, (alquil C1-C3)sulfonilo y (di(alquil C1-C3)amino)carbonilo), alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(oxacicloalquil de 3 a 6 miembros)-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di(hidroxi)alquil C1-C4)-amino]alcoxi C1-C4 , [N-((alcoxi C1-C3)carbonil)alquil C1-C3-N-(alquil C1-C3)amino]alcoxi C1-C4 , (1,2,4-triazolil)alcoxi C1-C4 , [N-(hidroxi)alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, [N,N-di(alcoxi C1-C3(C1-4 alquil))amino]alcoxi C1-C6 , [N,N-di(alquil C1-C3)amino]alcoxi C1-C6 , [N-[N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquil C1-C4-N-(C1-4 alquil)amino]alcoxi C1-C4, [N-[N-(alquil C1-C4)carbonil-amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, un grupo -(O(CH2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)q1)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)w-SO3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, un grupo -NR49R50, un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52, (heterocicloalquil de 3 a 6 miembros)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos oxo (el radical heterocicloalquilo comprende uno a tres heteroátomos seleccionados entre O y N), [N-((alcoxi C1-C3)alquil C1-C4-N-(alquil C1-C3)amino]alquinilo C2-C6, oxacicloalquiloxi de 3 a 6 miembros, o heterocicloalquiloxi que contiene nitrógeno de 4 a 6 miembros (el radical heterocicloalquilo que contiene nitrógeno está opcionalmente sustituido con un sustituyente seleccionado entre (alcoxi C1-C3)alquilo C1-C4 y alquilo C1-C3).
(1-26) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-3), (1-5), (1-7), (1-8), (1-10) a (1 20), y (1-21) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1, R4 y R5 se definen como en los siguientes apartados (1) o (2):
(1) R1 es alquilo C1-C6 ;
R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o fenilo; y
R5 es un átomo de hidrógeno o alquilo C1-C4 ; o
(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado
C3-C6 ; y
R4 se define como antes;
R3 es alquilo C1-C4 sustituido con Re;
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno, alquinilo C2-C6 opcionalmente sustituido con R11, y alcoxi C1-C6 opcionalmente sustituido con R12;
R11 y R12 se seleccionan cada uno independientemente entre heterocicloalquilo de 5 o 6 miembros y -NR39R40;
R39 y R40 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6 ;
Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4, un grupo -SO2NR35R36 (en donde R35 y R36 se seleccionan cada uno independientemente entre alquilo C1-C4) y (alquil C1-C4)tio. (1-27) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-26) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es un átomo de halógeno;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd es un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(1-28) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-12), (1-20), (1-21), (1-23), (1-26) y (1-27) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
R11 y R12 se seleccionan cada uno independientemente entre morfolinilo y un grupo -NR39R40;
R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o fenilo;
Ar1 es fenilo, piridinilo o pirimidinilo, en donde los grupos fenilo, piridinilo y pirimidinilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb es un átomo de halógeno;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd es un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo, piridinilo o pirimidinilo, en donde los grupos fenilo, piridinilo y pirimidinilo están cada uno opcionalmente sustituidos con uno o más sustituyentes R14.
(1-29) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-4), (1-10) a (1-17), (1-20), (1-21), (1-23), y (1-26) a (1-28) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Re es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;
los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;
Ri es un átomo de halógeno;
Rj es un átomo de halógeno; y
Rk es hidroxi, alquinilo C2-C6 opcionalmente sustituido con un sustituyente R11o alcoxi C1-C6 opcionalmente sustituido con un sustituyente R12.
(1-30) El compuesto de acuerdo con cualquiera de los apartados (1-26) a (1-29) o una sal del mismo, o un solvato del compuesto o la sal, en donde R11 y R12 se seleccionan cada uno independientemente entre morfolinilo, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino] y [N,N-di(alquil C1-C3)amino].
(1-31) El compuesto de acuerdo con cualquiera de los apartados (1-26) a (1-30) o una sal del mismo, o un solvato del compuesto o la sal, en donde R11 y R12 se seleccionan cada uno independientemente entre morfolinilo y [N-((metoxi)etil)-N-(metil)amino].
(1-32) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-31) o una sal del mismo, o un
solvato del compuesto o la sal, en donde R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 y R4 es alquilo C1-C4
(1-33) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-3), (1-5), (1-6), (1-10) a (1-12) y (1-20) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6; R4 es alquilo C1-C4;
R3 es alquilo C1-C4 sustituido con Re;
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno y alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12;
cada R12 se selecciona independientemente entre heterocicloalquilo de 5 o 6 miembros y -NR39R40; R39 y R40 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4 ;
Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y (alquil C1-C4)tio
(1-34) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-33) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es un átomo de halógeno;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd es un átomo de halógeno o un heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(1-35) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-34) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo opcionalmente sustituido con uno a tres sustituyentes Ra en el anillo de benceno.
(1-36) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-35) o una sal del mismo, o un solvato del compuesto o la sal, en donde Ra se selecciona entre un átomo de halógeno, (morfolino)alcoxi C1-C4, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di(alquil C1-C3)amino]alcoxi C1-C4 (1-37) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-5), (1-10) a (1-16), (1-20) y (1-33) a (1-36) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Re es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;
los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;
Ri y Rj son cada uno independientemente un átomo de halógeno; y
Rk es alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12.
(1-38) El compuesto de acuerdo con cualquiera de los apartados (1-13) a (1-18), (1-20), (1-25), (1-29) y (1 37) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rk es un átomo de halógeno, (morfolino)alcoxi C1-C4 , [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di(alquil C1-C3)amino]alcoxi C1-C4
(1-39) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-6), (1-10) a (1-16), (1-20) a (1-23), (1-26), (1-33) a (1-35), (1-37) y (1-38) o una sal del mismo, o un solvato del compuesto o la sal, en donde Ar1 es fenilo o piridinilo;
Rd es piridinilo o pirimidinilo;
R12 se selecciona entre morfolinilo, [N-(2-(metoxi)etil)-N-(metil)amino], [N,N-dimetilamino].
(1-40) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-39) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es un átomo de halógeno;
Rc es un átomo de halógeno, metilo o trifluorometilo;
Rd es un átomo de halógeno, trifluorometilo, fenilo opcionalmente sustituido con uno a tres sustituyentes R14 y heteroarilo de 5 a 6 miembros opcionalmente sustituido con uno a tres sustituyentes R14, en donde
el heteroarilo comprende de uno a tres heteroátomos seleccionados entre O, S y N.
(1-41) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-40) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R14 se seleccionan cada uno de metilo, trifluorometilo, ciano, nitro, un átomo de halógeno, metoxi, etoxi, trifluorometoxi, metiltio, metoxicarbonilo y dimetilaminosulfonilo.
(1-42) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-41) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R14 se seleccionan cada uno de metilo, trifluorometilo, ciano, un átomo de cloro y metiltio.
(1-43) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-42) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Ar1 es fenilo o heteroarilo de 5 a 6 miembros que comprende de uno a tres heteroátomos seleccionados entre O, S y N, en donde el fenilo y el heteroarilo están sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd.
(1-44) El compuesto, de acuerdo con cualquiera de los apartados (1-1) a (1-11), (1-20) a (1-22), (1-24), (1-26) a (1-28), (1-30) a (1-36) y (1-39) a (1-43) o una sal del mismo, o un solvato del compuesto o la sal, en donde el compuesto está representado por la fórmula (Ic);
[Fórmula 2]
en donde, n1 es un número entero seleccionado entre 1 y 4, n2 es un número entero seleccionado entre 0 o más, R1, R4, R5, Ar1, Ra, Rb, Rc, Rd, Re se definen como en cualquiera de (1-1) a (1-11), (1-20) a (1-22), (1 24), (1-26) a (1-28), (1-30) a (1-36) y (1-39) a (1-43).
(1-45) El compuesto de acuerdo con el apartado (1-44) o una sal del mismo, o un solvato del compuesto o la sal, en donde n1 es 1 y n2 es 3.
(1-46) El compuesto, de acuerdo con cualquiera de los apartados (1-13) a (1-20), (1-23) a (1-25), (1-29) a (1 32) y (1-37) a (1-43) o una sal del mismo, o un solvato del compuesto o la sal, en donde el compuesto está representado por la fórmula (Id);
[Fórmula 3]
en donde n1 es un número entero seleccionado entre 1 y 4, n3, n4 y n5 es un número entero seleccionado independientemente de 0 o 1, siempre que al menos uno de n3, n4 y n5 sea 1, R1, R4, R5, Ar1, Ra, Rb, Rc, Rd, Re, Ri, Rj y Rk se definen en cualquiera de (1-13) a (1-20), (1-23) a (1-25), (1-29) a (1-32) y (1-37) a (1 43).
(1-47) El compuesto de acuerdo con el apartado (1-46) o una sal del mismo, o un solvato del compuesto o la sal, en donde n1 es 1.
(1-48) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-47) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Ar1 es 4-(trifluorometil)-2-(6-metiltiopiridin-3-il)fenilo, 4-(trifluorometil)-2-(6-trifluorometilpiridin-3-il)fenilo, 4-(trifluorometil)-2-(4-trifluorometilpirimidin-5-il)fenilo, 4-(trifluorometil)-2-(6-trifluorometilpirimidin-4-il)fenilo, 4-(trifluorometil)-2-(6-ciano-5-metilpirimidin-4-il)fenilo, 4-(trifluorometil)-2-(2-cianopiridin-4-il)fenilo, 4-cloro-2-(6metiltiopiridin-3-il)fenilo, 4-cloro-2-(6-trifluorometilpiridin-3-ilo)fenilo, 4-cloro-2-(4-trifluorometilpirimidin-5-il)fenilo, 4-cloro-2-(6-ciano-5-metilpirimidin-4-il)fenilo, 4-cloro-2-(6- trifluorometilpirimidin-4-il)fenilo o 4-cloro-2-(2-cianopiridin-4-il)fenilo.
(1-49) Un compuesto seleccionado entre:
(4aR)-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-N-[2-(6-ciano-5-metilpirimidin-4-il)-4-(trifluorometil)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-N-[2-(2-cianopiridin-4-il)-4-(trifluorometil)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
ácido 6-[4-[[(4aR)-4-hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoilo] -6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenil]hex-5-inoico;
(4aR)-1-[[2,3-difluoro-4-(3-morfolin-4-ilprop-1-inil)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-1-[[4-[3-[(2R)-2,3-dihidroxipropoxi]propoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-1-[[4-[4-[(2R)-2,3-dihidroxipropoxi]butoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida; (4aR)-1-[[4-[6-[(2R)-2,3-dihidroxipropoxi]hexoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[2-(trifluorometil)-4-[6-(trifluorometil)piridin-3-il]pirimidin-5-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-1-[[2,3-difluoro-4-(morfolin-4-ilmetil)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-N-(4-bromo-3,5-difluorofenil)-1-[(3-cloro-2-fluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(3S)-3-terc-butil-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-3H-piridazin-5-carboxamida;
(3S)-3-terc-butil-N-[4-cloro-2-[6-(trifluorometil)pirimidin-4-il]fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;
(3S)-3-terc-butil-N-[4-cloro-2-[6-(trifluorometil)piridin-3-il]fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;
(3S)-3-terc-butil-N-[4-cloro-2-(6-metilsulfanilpiridin-3-il)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;
(3S)-3-terc-butil-N-[2-(6-ciano-5-metilpirimidin-4-il)-4-(trifluorometil)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;
6- [[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5] non-8-eno-8-carboxamida;
7- [[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
6- [[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida;
7- [[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
ácido 4-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]butanoico;
ácido 5-[2,3-[difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi] pentanoico;
ácido 6-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]hexanoico;
ácido 7-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]heptanoico;
7-[[2,3-difluoro-4-[2-[(2S)-2-(metoximetil)pirrolidin-1-il]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida; ácido (2S)-2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]butanodioico;
ácido 3-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]pentanodioico;
6- (2,3-difluoro-4-(2-(metil(oxetan-3-il)amino)etoxi)bencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida;
7- [[2,3-difluoro-4-[2-[metil(oxetan-3-il)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
7-(2,3-difluoro-4-(2-(metil(oxetan-3-il)amino)etoxi)bencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
7-(4-(3-(dimetilamino)-2,2-dimetilpropoxi)-2,3-difluorobencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
6- [[2,3-difluoro-4-[1-(2-metoxietil)azetidin-3-il]oxifenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida;
7- [[2,3-difluoro-4-[4-[metil-[(2S, 3R, 4R, 5R)-2,3,4,5,6-pentahidroxihexil]amino]-4-oxobutoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
7-[[2,3-difluoro-4-[2-[2-[metil-[(2S, 3R, 4R, 5R)-2,3,4,5,6-pentahidroxihexil]amino]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
7-[[2,3-difluoro-4-[2-[2-[2-[2-[2-metoxietil(metil)amino]etoxi]etoxi]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
ácido 2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]etanosulfónico; y
ácido 2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]etanosulfónico
o una sal del mismo, o un solvato del compuesto o la sal.
(1-50) El compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-49) o la sal del mismo, o el solvato del compuesto o la sal para su uso en la prevención y/o tratamiento de una enfermedad seleccionada entre la hiperfosfatemia, hiperparatiroidismo secundario e insuficiencia renal crónica.
(1-51) Un inhibidor de NaPi-IIb que comprende un compuesto de acuerdo con cualquiera de los apartados (1 1) a (1-49) o una sal del mismo, o un solvato del compuesto o la sal.
(1-52) Un inhibidor de PiT-1 que comprende un compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-49) o una sal del mismo, o un solvato del compuesto o la sal.
(1-53) Un inhibidor de PiT-2 que comprende un compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-49) o una sal del mismo, o un solvato del compuesto o la sal.
(1-54) Un agente preventivo y/o terapéutico para una enfermedad seleccionada entre hiperfosfatemia, hiperparatiroidismo secundario e insuficiencia renal crónica, el agente comprende un compuesto de acuerdo con cualquiera de los apartados (1-1) a (1-49) o una sal del mismo, o un solvato del compuesto o la sal como ingrediente activo.
En la presente memoria se describen también los siguientes compuestos (2-1) a (2-26):
(2-1) Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal:
en donde R1, R4 y R5 se definen como en cualquiera de los siguientes apartados (1) a (3):
(1) R1 es un átomo de hidrógeno o alquilo C1-C10;
R2 *4 es un átomo de hidrógeno, alquilo C1-C4 opcionalmente sustituido con uno o más sustituyentes Rf, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg, (alquil C1-C6)carbonilo, (aril C6-C10)carbonilo, un grupo -C(O)NR37R38, cicloalquilo C3-C7, o heterocicloalquilo de 5 a 8 miembros; y
R5 es un átomo de hidrógeno o alquilo C1-C4;
(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 ; y
R4 se define como antes; y
(3) R1 es un átomo de hidrógeno o alquilo C1-C10 lineal;
R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados forman un anillo heterocíclico saturado de 5 a 8 miembros, en donde el anillo heterocíclico saturado está opcionalmente sustituido con uno o más sustituyentes R2;
R3 es alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes Rh o alquilo C1-C4 sustituido con Re;
R37 y R38 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C3 ; cada R2 se selecciona independientemente entre alquilo C1-C5 y un átomo de halógeno; y/o
dos o más sustituyentes R2 en el anillo heterocíclico saturado de 5 a 8 miembros juntos pueden formar alquileno C1-C5 que conecta los átomos del anillo a los que están anclados;
cada Rh se selecciona independientemente entre un átomo de halógeno, (alcoxi C1-C4)carbonilo, y un grupo -(O(CH2)a)b-alcoxi C1-C4 (en donde a es un número entero seleccionado entre 2 a 4, y b es un número entero seleccionado entre 1 y 4);
Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra;
cada Rf se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, carboxi, (alcoxi C1-C6)carbonilo, alcoxi C1-C6 y arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg; cada Rg se selecciona independientemente entre un átomo de halógeno, alquilo C1-C6 , alquinilo C2-C6 y alcoxi C1-C6, en donde los grupos alquilo, alquinilo y alcoxi están cada uno opcionalmente sustituidos con uno o más sustituyentes seleccionados entre hidroxi y ciano;
cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;
R10, R11, R12, R13 y R15 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)carbonilo, un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 3 a 10 miembros, heteroarilo de 5 a 10 miembros y un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 10 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno y alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi);
Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 , un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, un grupo -SF5 , ciano, hidroxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14;
cada R14 se selecciona independientemente entre un átomo de halógeno, oxo, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6)carbonilo, un grupo -NR27R28, un grupo -SO2NR35R36, (alquil C1-C4)tio y heterocicloalquilo de 5 a 10 miembros;
R27 y R28 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C4)carbonilo;
R35 y R36 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 ; y R39 y R40 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6.
(2-2) El compuesto de acuerdo con el apartado (2-1) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 o un átomo de halógeno;
Rc es un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, o un grupo -SF5 ; y
Rd es ciano, hidroxi, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(2-3) El compuesto de acuerdo con los apartados (2-1) o (2-2) o una sal del mismo, o un solvato del compuesto o la sal, en donde
cada Ra se selecciona independientemente entre un átomo de halógeno, nitro, ciano, (alcoxi C1-C4 )carbonilo, heterocicloalquiloxi de 3 a 6 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;
cada R10 se selecciona independientemente entre carboxi, heterocicloalquilo de 3 a 6 miembros, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, y un grupo -(O(CH2)o)p-OH;
cada R11 se selecciona independientemente entre hidroxi, carboxi, heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH y cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi;
cada R12 se selecciona independientemente entre un átomo de halógeno, hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, heterocicloalquilo de 3 a 6 miembros, heteroarilo de 5 o 6 miembros y un grupo -NR39R40;
R13 es heterocicloalquilo de 5 o 6 miembros; y
o y p son cada uno independientemente un número entero seleccionado entre 2 a 4.
(2-4) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-3) o una sal del mismo, o un solvato del compuesto o la sal, en donde cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, alquilo C1-C6 , (carboxi)alquilo C1-C8 , (morfolino)alquilo C1-C4 , (oxetanil)alquilo C1-C4 , [HO-((CH2)oO)p]alquilo C1-C6, (alcoxi C1-C6)alquilo C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, alcoxi C1-C3 sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, ((alcoxi C1-C3)carbonil)alcoxi C1-C3 , (morfolino)alcoxi C1-C6 opcionalmente sustituido con uno o más grupos oxo, (oxacicloalquilo de 3 a 6 miembros)alcoxi C1-C4 (piridinil)alcoxi C1-C4(pirimidinil)alcoxi C1-C4 , (alcoxi C1-C6)alcoxi C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, (carboxi)alquinilo C2-C6, (morfolino)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos oxo, (oxacicloalquilo de 3 a 6 miembros)alquinilo C2-C6 , (pirrolidin)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos oxo, alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8, (alcoxi C1-C6)alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, (cicloalquil C3-C6)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, (morfolino)(alquil C1-C4)tio opcionalmente sustituido con uno o más grupos oxo, y oxacicloalquiloxi de 3 a 6 miembros.
(2-5) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-4) o una sal del mismo, o un solvato del compuesto o la sal, en donde cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, alquilo C1-C3, (carboxi)alquilo C1-C8 , (alcoxi C1-C6)alquilo C1-C8 sustituido con uno o más grupos hidroxi, alcoxi C1-C3 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6 , (alcoxi C1-C6)alcoxi C1-C8 sustituido con uno o más grupos hidroxi, (carboxi)alquinilo C2-C6 , (morfolino)alquinilo C2-C6 , alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8, (alcoxi C1-C6)alquinilo C2-C8 sustituido con uno o más grupos hidroxi, y (alcoxi C1-C3)carbonilo.
(2-6) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-5) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es metilo sustituido con Re.
(2-7) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-6) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo opcionalmente sustituido con uno o más sustituyentes Ra en el anillo de benceno.
(2-8) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-7) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo opcionalmente sustituido con uno a tres sustituyentes Ra en el anillo de benceno.
(2-9) El compuesto de acuerdo con cualquiera de los apartados (2-1), (2-4) y (2-6) a (2-8) o una sal del mismo, o un solvato del compuesto o la sal, en donde Re es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;
los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;
Ri es un átomo de halógeno o alcoxi C1-C3;
Rj es un átomo de halógeno, nitro o ciano; y
Rk es hidroxi, un átomo de halógeno, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 5 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12o (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13.
(2-10) El compuesto de acuerdo con el apartado (2-9) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rk es hidroxi, un átomo de halógeno, alquilo C1-C6, (carboxi)alquilo C1-C8 , (alcoxi C1-C6)alquilo C1-C8 sustituido con uno o más grupos hidroxi, alcoxi C1-C3 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6 , (alcoxi C1-C6)alcoxi C1-C8 sustituido con uno o más grupos hidroxi, (carboxi) alquinilo C2-C8, (morfolino)alquinilo C2-C6 , alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8 , (alcoxi C1-C6)alquinilo C2-C8 sustituido con uno o más grupos hidroxi, o (alcoxi C1-C3 )carbonilo.
(2-11) El compuesto de acuerdo con el apartado (2-1) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1, R4 y R5 se definen como en los siguientes apartados (1) o (2):
(1) R1 es un átomo de hidrógeno o alquilo C1-C6;
R4 es un átomo de hidrógeno, alquilo C1-C4 opcionalmente sustituido con uno o más sustituyentes Rf, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg, (alquil C1-C6)carbonilo, (aril C6-C10)carbonilo, -C(O)NR37R38, cicloalquilo C3-C7 , o heterocicloalquilo de 5 a 8 miembros; y R5 es un átomo de hidrógeno o alquilo C1-C4 ; o
(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 ; y
R4 se define como antes;
R3 es alquilo C1-C4 sustituido con Re;
Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno, ciano, hidroxi, alquilo C1-C6 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C6 opcionalmente sustituido con uno o más sustituyentes R11, y alcoxi C1-C6 opcionalmente sustituido con uno o más sustituyentes R12;
R10, R11 y R12 se seleccionan cada uno independientemente entre heterocicloalquilo de 4 a 10 miembros opcionalmente sustituido con uno o más sustituyentes y un grupo -NR39R40, en donde los sustituyentes se seleccionan cada uno independientemente entre oxo, un átomo de halógeno y alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi);
Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con alquilo C1-C4 , arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 , un grupo -SO2NR35R36, y (alquil C1-C4)tio.
(2-12) El compuesto de acuerdo con el apartado (2-11) o una sal del mismo, o un solvato del compuesto o la sal, en donde R10, R11 y R12 se seleccionan cada uno independientemente entre heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes.
(2-13) El compuesto de acuerdo con cualquiera de los apartados (2-1) y (2-11) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1, R4 y R5 se definen como en los siguientes apartados (1) o (2):
(1) R1 es alquilo C1-C6 ;
R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o fenilo; y
R5 es un átomo de hidrógeno o alquilo C1-C4 ; o
(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6; y
R4 se define como antes;
R3 es alquilo C1-C4 sustituido con Re;
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno, alquinilo C2-C6 opcionalmente sustituido con R11, y alcoxi C1-C6 opcionalmente sustituido con R12;
R11 y R12 se seleccionan cada uno independientemente entre heterocicloalquilo de 5 o 6 miembros y -NR39R40;
Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4, un grupo -SO2NR35R36 (en donde R35 y R36 se seleccionan cada uno independientemente entre alquilo C1-C4) y (alquil C1-C4)tio. (2-14) El compuesto de acuerdo con cualquiera de los apartados (2-11) a (2-13) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es un átomo de halógeno;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd es un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14
(2-15) El compuesto de acuerdo con el apartado (2-13) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
R11 y R12 se seleccionan cada uno independientemente entre morfolinilo y un grupo -NR39R40;
R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o fenilo;
Ar1 es fenilo, piridinilo o pirimidinilo, en donde los grupos fenilo, piridinilo y pirimidinilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb es un átomo de halógeno;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd es un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo, piridinilo o pirimidinilo, en donde los grupos fenilo, piridinilo y pirimidinilo están cada uno opcionalmente sustituidos con uno o más sustituyentes R14
(2-16) El compuesto de acuerdo con el apartado (2-15) o una sal del mismo, o un solvato del compuesto o la sal, en donde R11 y R12 se seleccionan cada uno independientemente entre morfolinilo y [N-((metoxi)etil)-N-(metil)amino].
(2-17) El compuesto de acuerdo con el apartado (2-11) o (2-12) o una sal del mismo, o un solvato del compuesto o la sal, en donde R10, R11 y R12 se seleccionan cada uno independientemente entre morfolinilo, tiomorfolinilo, azetidinilo, pirrolidinilo, 2-oxa-6-azaespiro[3,3]heptanilo, 3,7-dioxa-9-azabiciclo[3,3,1]nonanilo, piperazinilo, piperidilo y [N-((metoxi)etil)-N-(metil)amino].
(2-18) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-17) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1, R4 y R5 se definen como en cualquiera de los siguientes apartados (1) a (3):
(1) R1 es un átomo de hidrógeno y R4 y R5 se seleccionan cada uno independientemente entre alquilo C1-C6;
(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C5 y R4 es alquilo C1-C6 ; y
(3) R1 es alquilo C1-C6 lineal y
R4 y R5 junto con el átomo de carbono al que están anclados forman un anillo de pirrolidina;
R3 es bencilo sustituido con uno o más sustituyentes Ra en el anillo de benceno;
cada Ra se selecciona independientemente entre un átomo de halógeno, (morfolino)alcoxi C2-C6, (morfolino)alquilo C1-C6 , (carboxi)alquinilo C2-C6, (alcoxi C1-C6)alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, y [N-((metoxi)etil)-N-(metil)amino]etoxi;
Ar1 es fenilo o pirimidilo, en donde cada uno de estos grupos está sustituido con uno a tres grupos, cada uno seleccionado independientemente entre un átomo de halógeno, trifluorometilo, piridinilo sustituido con uno o más sustituyentes R14 y pirimidilo sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre metilo, ciano, trifluorometilo y metiltio.
(2-19) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-18) o una sal del mismo, o un solvato del compuesto o la sal, en donde Ar1 es 4-(trifluorometil)-2-(6-metiltiopiridin-3-il)fenilo, 4-(trifluorometil)-2-(6-trifluorometilpiridin-3-il)fenilo, 4-(trifluorometil)-2-(4-trifluorometilpirimidin-5-il)fenilo, 4-(trifluorometil)-2-(6-trifluorometilpirimidin-4-il)fenilo, 4-(trifluorometil)-2-(6-ciano-5-metilpirimidin-4-il)fenilo, 4-(trifluorometil)-2-(2-cianopiridin-4-il)fenilo, 4-cloro-2-(6-metiltiopiridin-3-il)fenilo, 4-cloro-2-(6-trifluorometilpiridin-3-ilo)fenilo, 4-cloro-2-(4-trifluorometilpirimidin-5-il)fenilo, 4-cloro-2-(6-ciano-5-metilpirimidin-4-il)fenilo, 4-cloro-2-(6- trifluorometilpirimidin-4-il)fenilo o 4-cloro-2-(2-cianopiridin-4-il)fenilo.
(2-20) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-19) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 ; R4 es alquilo C1-C4 ;
R3 es alquilo C1-C4 sustituido con Re;
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno y alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12;
cada R12 se selecciona independientemente entre heterocicloalquilo de 5 o 6 miembros y un grupo -NR39R40;
R39 y R40 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4 ;
Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y (alquil C1-C4)tio.
(2-21) El compuesto de acuerdo con el apartado (2-20) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es un átomo de halógeno;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd se selecciona entre un átomo de halógeno y un heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(2-22) El compuesto de acuerdo con cualquiera de los apartados (2-1), (2-20) y (2-21) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Re es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;
los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;
Ri y Rj son cada uno independientemente un átomo de halógeno; y
Rk es alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12.
(2-23) El compuesto de acuerdo con cualquiera de los apartados (2-20) a (2-22) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo, en donde el grupo bencilo está opcionalmente sustituido con uno a tres sustituyentes Ra.
(2-24) El compuesto de acuerdo con cualquiera de los apartados (2-20) a (2-23) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Ar1 es fenilo o piridinilo;
Rd es piridinilo o pirimidinilo; y
R12 es morfolinilo o [N-((metoxi)etil)-N-(metil)amino].
(2-25) El compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-24) o una sal del mismo, o un solvato del compuesto o la sal, en donde el compuesto está representado por la fórmula I-a:
[Fórmula 5]
en donde q es un número entero seleccionado entre 0 y 3, y R3, R4 y Ar1 se definen como antes en cualquiera de los apartados (2-1) a (2-24).
(2-26) Un compuesto seleccionado entre:
(4aR)-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-N-[2-(6-ciano-5-metilpirimidin-4-il)-4-(trifluorometil)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-N-[2-(2-cianopiridin-4-il)-4-(trifluorometil)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
ácido 6-[4-[[(4aR)-4-hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoilo]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenil]hex-5-inoico;
(4aR)-1-[[2,3-difluoro-4-(3-morfolin-4-ilprop-1-inil)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-1-[[4-[3-[(2R)-2,3-dihidroxipropoxi]propoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-1-[[4-[4-[(2R)-2,3-dihidroxipropoxi]butoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida; (4aR)-1-[[4-[6-[(2R)-2,3-dihidroxipropoxi]hexoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[2-(trifluorometil)-4-[6-(trifluorometil)piridin-3-il]pirimidin-5-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-1-[[2,3-difluoro-4-(morfolin-4-ilmetil)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(4aR)-N-(4-bromo-3,5-difluorofenil)-1-[(3-cloro-2-fluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida;
(3S)-3-terc-butil-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-3H-piridazin-5-carboxamida;
(3S)-3-terc-butil-N-[4-cloro-2-[6-(trifluorometil)pirimidin-4-il]fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;
(3S)-3-terc-butil-N-[4-cloro-2-[6-(trifluorometil)piridin-3-il]fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;
(3S)-3-terc-butil-N-[4-cloro-2-(6-metilsulfanilpiridin-3-il)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;
(3S)-3-terc-butil-N-[2-(6-ciano-5-metilpirimidin-4-il)-4-(trifluorometil)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;
6- [[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida;
7- [[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;
6- [[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida; y
7- [[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
o una sal del mismo, o un solvato del compuesto o la sal.
En la presente memoria se describen también los siguientes compuestos (3-1) a (3-13):
(3-1) Un compuesto representado por la fórmula (I) o una sal del mismo o un solvato del compuesto o la sal:
[Fórmula 6]
en donde
R1 es un átomo de hidrógeno o alquilo C1-C10;
R4 es un átomo de hidrógeno, alquilo C1-C4 opcionalmente sustituido con uno o más sustituyentes Rf, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg, (alquil C1-C6)carbonilo, (aril C6-C10)carbonilo, -C(O)NR37R38, cicloalquilo C3-C7, o heterocicloalquilo de 5 a 8 miembros;
R5 es un átomo de hidrógeno o alquilo C1-C4 ; o
R1 y R5 junto con el átomo de carbono al que están anclados pueden formar un anillo carbocíclico saturado C3-C6 ; o
R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados pueden formar un anillo heterocíclico saturado de 5 a 8 miembros, en donde el anillo heterocíclico saturado de 5 a 8 miembros está opcionalmente sustituido con uno o más sustituyentes R2;
R3 es alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes Rh o alquilo C1-C4 sustituido con Re;
R37 y R38 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C3 ; cada R2 se selecciona independientemente entre alquilo C1-C5 y un átomo de halógeno; y/o
dos o más sustituyentes R2 en el anillo heterocíclico saturado de 5 a 8 miembros juntos pueden formar alquileno C1-C5 que conecta los átomos del anillo a los que están anclados;
cada Rh se selecciona independientemente entre un átomo de halógeno, (alcoxi C1-C4)carbonilo, y -(O(CH2)a)b-alcoxi C1-C4 (en donde a es un número entero seleccionado entre 2 a 4, y b es un número entero seleccionado entre 1 y 4);
Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra;
cada Rf se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, carboxi, (alcoxi C1-C6)carbonilo, alcoxi C1-C6 y arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg; cada Rg se selecciona independientemente entre un átomo de halógeno, alquilo C1-C6 , alquinilo C2-C6 y alcoxi C1-C6 , en donde los grupos alquilo, alquinilo y alcoxi están cada uno opcionalmente sustituidos con uno o más sustituyentes seleccionados entre hidroxi y ciano;
cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 5 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;
los sustituyentes R10, R11, R12, R13 y R15 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)carbonilo, un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 4 a 10 miembros y heteroarilo de 5 a 10 miembros, en donde el heterocicloalquilo de 4 a 10 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un halógeno átomo y alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi);
Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 , un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, un grupo -SF5, ciano, hidroxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes
R14;
cada R14 se selecciona independientemente entre un átomo de halógeno, oxo, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6)carbonilo, -NR27R28, -SO2Nr35R36, (alquil C1-C4)tio y heterocicloalquilo de 5 a 10 miembros;
R27 y R28 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C4)carbonilo; y
R35 y R36 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4.
(3-2) El compuesto de acuerdo con el apartado (3-1) o una sal del mismo, o un solvato del compuesto o la sal, en donde R1 es alquilo C1-C10
(3-3) El compuesto de acuerdo con los apartados (3-1) o (3-2) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 o un átomo de halógeno;
Rc es un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, o un grupo -SF5; y
Rd se selecciona entre ciano, hidroxi, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(3-4) El compuesto de acuerdo con cualquiera de los apartados (3-1) a (3-3) o una sal del mismo, o un solvato del compuesto o la sal, en donde
cada Ra se selecciona independientemente entre un átomo de halógeno, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 5 o 6 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;
cada R10 se selecciona independientemente entre carboxi, heterocicloalquilo de 5 o 6 miembros, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, y un grupo -(O(CH2)o)p-OH;
cada R11 se selecciona independientemente entre hidroxi, carboxi, heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH y cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi;
cada R12 se selecciona independientemente entre un átomo de halógeno, hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, heterocicloalquilo de 5 o 6 miembros y heteroarilo de 5 o 6 miembros;
cada R13 se selecciona independientemente entre heterocicloalquilo de 5 o 6 miembros; y o y p son cada uno independientemente un número entero seleccionado entre 2 a 4.
(3-5) El compuesto de acuerdo con cualquiera de los apartados (3-1) a (3-4) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 se selecciona entre alquilo C1-C4 ;
R3 se selecciona entre alquilo C1-C4 sustituido con Re;
Re se selecciona entre arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno y alcoxi C1-C6 opcionalmente sustituido con R12;
R4 se selecciona entre alquilo C1-C4 ;
R5 se selecciona entre alquilo C1-C4 ; o
de R1, R4 y R5, R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 , o R4 y R5 junto con el átomo de nitrógeno y el átomo de carbono al que están anclados forman un anillo heterocíclico saturado de 5 a 8 miembros;
Ar1 es arilo C6-C10, en donde el grupo arilo está sustituido con dos sustituyentes seleccionados entre Rc y Rd;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno;
Rd es heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más grupos alquilo C1-C4 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14;
R12 es heterocicloalquilo de 5 a 10 miembros; y
R14 es alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno.
(3-6) El compuesto de acuerdo con los apartados (3-1) o (3-2) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 es un átomo de hidrógeno o alquilo C1-C6 ;
R3 es alquilo C1-C4 sustituido con Re;
Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno, ciano, hidroxi, alquilo C1-C6 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C6 opcionalmente sustituido con uno o más sustituyentes R11, y alcoxi C1-C6 opcionalmente sustituido con uno o más sustituyentes R12; R10, R11 y R12 se seleccionan cada uno independientemente entre heterocicloalquilo de 4 a 10 miembros opcionalmente sustituido con uno o más sustituyentes, en donde los sustituyentes se seleccionan cada uno independientemente entre oxo, un átomo de halógeno y alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi);
R4 es un átomo de hidrógeno, alquilo C1-C4 opcionalmente sustituido con uno o más sustituyentes Rf, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg, (alquil C1-C6)carbonilo, (aril C6-C10)carbonilo, -C(O)NR37R38, cicloalquilo C3-C7 , o heterocicloalquilo de 5 a 8 miembros;
R5 es un átomo de hidrógeno o alquilo C1-C4 ; o
R1 y R5 junto con el átomo de carbono al que están anclados pueden formar un anillo carbocíclico saturado C3-C6;
Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con alquilo C1-C4 , arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4, -SO2NR35R36, y (alquil C1-C4)tio.
(3-7) El compuesto de acuerdo con cualquiera de los apartados (3-1), (3-2) y (3-6) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 es alquilo C1-C6 ;
R3 es alquilo C1-C4 sustituido con Re;
Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno, alquinilo C2-C6 opcionalmente sustituido con R11, y alcoxi C1-C6 opcionalmente sustituido con R12;
R11 y R12 se seleccionan cada uno independientemente entre heterocicloalquilo de 5 a 10 miembros; R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o arilo C6-C10;
R5 es un átomo de hidrógeno o alquilo C1-C4 ; o
R1 y R5 junto con el átomo de carbono al que están anclados pueden formar un anillo carbocíclico saturado C3-C6;
Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 , -SO2NR35R36 (en donde R35 y R36 se seleccionan cada uno independientemente entre alquilo C1-C4) y (alquil C1-C4)tio.
(3-8) El compuesto de acuerdo con el apartado (3-7) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es un átomo de halógeno;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd es un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(3-9) El compuesto de acuerdo con (3-7) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
R11 y R12 son cada uno independientemente morfolinilo;
R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o fenilo;
Ar1 es fenilo, piridinilo o pirimidinilo, en donde los grupos fenilo, piridinilo y pirimidinilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb es un átomo de halógeno;
Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd es un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo, piridinilo o pirimidinilo, en donde los grupos fenilo, piridinilo y pirimidinilo están cada uno opcionalmente sustituidos con uno o más sustituyentes R14
(3-10) El compuesto de acuerdo con los apartados (3-6) o (3-7) o una sal del mismo, o un solvato del compuesto o la sal, en donde R10, R11 y R12 se seleccionan cada uno independientemente entre morfolinilo, tiomorfolinilo, azetidinilo, pirrolidinilo, 2-oxa-6-azaespiro[3,3]heptanilo, 3,7-dioxa-9-azabiciclo [3,3,1] nonanilo, piperazinilo y piperidilo.
(3-11) El compuesto de acuerdo con cualquiera de los apartados (3-1) a (3-10) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo opcionalmente sustituido con uno o más sustituyentes Ra en el anillo de benceno.
(3-12) El compuesto de acuerdo con el apartado (3-1) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 es alquilo C1-C6 y R4 y R5 junto con el átomo de carbono al que están anclados forman un anillo de pirrolidina; o
R1 es un átomo de hidrógeno y R4 y R5 se seleccionan cada uno independientemente entre alquilo C1-C6; o
R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C5 y R4 es alquilo C1-C6 ;
R3 es bencilo sustituido con uno o más sustituyentes Ra en el anillo de benceno;
cada Ra se selecciona independientemente entre un átomo de halógeno, (morfolino)alcoxi C2-C6, (morfolino)alquilo C1-C6 , (carboxi)alquinilo C2-C6 y (alcoxi C1-C6)alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi;
Ar1 es fenilo o pirimidilo, en donde cada uno de estos grupos está sustituido con uno a tres grupos, cada uno seleccionado independientemente entre un átomo de halógeno, trifluorometilo, piridinilo sustituido con uno o más sustituyentes R14y pirimidilo sustituido con uno o más sustituyentes R14; y
cada R14 se selecciona independientemente entre metilo, ciano, trifluorometilo y metiltio.
(3-13) El compuesto de acuerdo con cualquiera de los apartados (3-1) a (3-11) o una sal del mismo, o un solvato del compuesto o la sal, en donde Ar1 es 4-(trifluorometil)-2-(6-metiltiopiridin-3-il)fenilo, 4-(trifluorometil)-2-(6-trifluorometilpiridin-3-il)fenilo, 4-(trifluorometil)-2-(4-trifluorometilpirimidin-5-il)fenilo, 4-(trifluorometil)-2-(6-trifluorometilpirimidin-4-il)fenilo, 4-(trifluorometil)-2-(6-ciano-5-metilpirimidin-4-il)fenilo, 4-(trifluorometil)-2-(2-cianopiridin-4-il)fenilo, 4-cloro-2-(6-metiltiopiridin-3-il)fenilo, 4-cloro-2-(6-trifluorometilpiridin-3-ilo)fenilo, 4-cloro-2-(4-trifluorometilpirimidin-5-il)fenilo, 4-cloro-2-(6-ciano-5-metilpirimidin-4-il)fenilo, 4-cloro-2-(6- trifluorometilpirimidin-4-il)fenilo o 4-cloro-2-(2-cianopiridin-4-il)fenilo.
Un aspecto alternativo de la presente invención proporciona un fármaco que comprende un compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-26) y (3-1) a (3-13) o una sal del mismo, o un solvato del compuesto o la sal.
Un aspecto alternativo adicional de la presente invención proporciona una composición farmacéutica que comprende un compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-26) y (3-1) a (3-13) o una sal del mismo, o un solvato del compuesto o la sal.
Un aspecto alternativo adicional de la presente invención proporciona el compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-26) y (3-1) a (3-13) o la sal del mismo, o el solvato del compuesto o la sal para su uso en la prevención y/o tratamiento de una enfermedad seleccionada entre hiperfosfatemia, hiperparatiroidismo secundario e insuficiencia renal crónica.
Un aspecto alternativo adicional de la presente invención proporciona un inhibidor de NaPi-IIb que comprende un compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-26) y (3-1) a (3-13) o una sal del mismo, o un solvato del compuesto o la sal.
Un aspecto alternativo adicional de la presente invención proporciona un agente preventivo y/o terapéutico para una enfermedad seleccionada entre hiperfosfatemia, hiperparatiroidismo secundario e insuficiencia renal crónica, comprendiendo el agente un compuesto de acuerdo con cualquiera de los apartados (2-1) a (2-26) y (3-1) a (3-13) o una sal del mismo, o un solvato del compuesto o la sal como ingrediente activo.
En la presente memoria se describe adicionalmente un compuesto representado por la fórmula (I) en donde R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados forman un anillo heterocíclico saturado de 5 a 8 miembros, se proporciona el siguiente compuesto (4-1):
(4-1) Un compuesto representado por la fórmula (II) o una sal del mismo, o un solvato del compuesto o la sal:
en donde R101 se selecciona entre un átomo de hidrógeno y alquilo C1-C10 lineal;
los R102 pueden ser iguales o diferentes y se seleccionan cada uno independientemente entre un átomo de hidrógeno, alquilo C1-C5 y un átomo de halógeno; o
dos radicales R102 unidos a diferentes átomos de carbono juntos pueden formar alquileno C1-C5 que conecta los átomos de carbono;
los R102' pueden ser iguales o diferentes y se seleccionan cada uno independientemente entre un átomo de hidrógeno, alquilo C1-C5 y un átomo de halógeno;
n es un número entero seleccionado entre 1 y 4;
R103 es alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes Rw o alquilo C1-C4 sustituido con uno o más sustituyentes Rx;
cada Rw se selecciona independientemente entre un átomo de halógeno, (alcoxi C1-C4)carbonilo, y un grupo -(O(CH2)a)b-alcoxi C1-C4 (en donde a es un número entero seleccionado entre 2 a 4, y b es un número entero seleccionado entre 1 y 4);
cada Rx se selecciona independientemente entre arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ry y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ry; cada Ry se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 5 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R110, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R115, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R111, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R112, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R113; R110, R111, R112, R113 y R115 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)carbonilo, un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más grupos oxo y heteroarilo de 5 a 10 miembros;
Ar101 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde el arilo C6-C10 y grupos heteroarilo de 5 a 10 miembros están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rz1, Rz2 y Rz3;
Rz1, Rz2 y Rz3 se seleccionan cada uno independientemente entre alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 , un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, un grupo -SF5 , ciano, hidroxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R114, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R114 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R114; y
cada R114 se selecciona independientemente entre un átomo de halógeno, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6)carbonilo, un grupo -NR127R128 (en donde R127 y R128 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C4)carbonilo, un grupo -SO2 NR135R136 (en donde R135 y R136 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4), (alquil C1-C4)tio y heterocicloalquilo de 5 a 10 miembros.
En la presente memoria se describen los siguientes compuestos (4-2) a (4-12) representados por la fórmula (II).
(4-2) El compuesto de acuerdo con el apartado (4-1) o una sal del mismo, o un solvato del compuesto o la
sal, en donde
Rz1 es alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 o un átomo de halógeno;
Rz2 es un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, y un grupo -SF5 ; y
Rz3 es ciano, hidroxi, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R114, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R114, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R114
(4-3) El compuesto de acuerdo con los apartados (4-1) o (4-2) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rz3 es ciano, hidroxi, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo y heteroarilo de 5 a 6 miembros, en donde el fenilp y heteroarilo de 5 a 6 miembros pueden estar sustituidos con uno o dos sustituyentes R114.
(4-4) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-3) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R101 es un átomo de hidrógeno o alquilo C1-C6 lineal;
R102 puede ser igual o diferente y se seleccionan cada uno independientemente entre un átomo de hidrógeno, alquilo C1-C3 y un átomo de halógeno;
R102' puede ser igual o diferente y se seleccionan cada uno independientemente entre un átomo de hidrógeno, alquilo C1-C3 y un átomo de halógeno;
n es un número entero seleccionado entre 1 y 3;
Rx se selecciona independientemente entre arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ry y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ry;
Ry se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C3)carbonilo, heterocicloalquiloxi de 5 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R110, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R111, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R112, y (alquil C1-C3)tio opcionalmente sustituido con uno o más sustituyentes R113;
R110 se selecciona independientemente entre carboxilo, heterocicloalquilo de 5 a 10 miembros, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, y un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4);
R111 se selecciona independientemente entre hidroxi, carboxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), y cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi;
R112 se selecciona independientemente entre un átomo de halógeno, hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, heterocicloalquilo de 5 a 10 miembros y heteroarilo de 5 a 10 miembros;
R113 se selecciona independientemente entre heterocicloalquilo de 5 a 10 miembros;
Rz1 se selecciona entre forma opcional C1-3 C sustituido con alcoxi1-4 alcoxi y un átomo de halógeno; y R114 se selecciona independientemente entre un átomo de halógeno, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6)carbonilo, un grupo -NR127R128 (en donde R127 y R128 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C3)carbonilo, un grupo -SO2NR135R136 (en donde R135 y R136 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C3), (alquil C1-C3)tio y heterocicloalquilo de 5 a 10 miembros.
(4-5) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-4) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rx es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ry.
(4-6) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-5) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Ar101 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con Rz1, Rz2 y/o Rz3;
Rz1 es un átomo de halógeno u alcoxi C1-C4 opcionalmente sustituido con alcoxi C1-C3;
Rz2 es un átomo de halógeno o alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno; y
Rz3 es heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R114,
fenilo opcionalmente sustituido con uno o más sustituyentes R114, o heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R114
(4-7) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-6) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Ar101 es fenilo o heteroarilo de 5 o 6 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rz1, Rz2 y Rz3;
Rz1 es un átomo de halógeno;
Rz2 se selecciona entre un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, y un grupo -SF5 ; y
Rz3 es ciano, hidroxi o un átomo de halógeno.
(4-8) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-7) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rz3 es fenilo, tienilo, piridinilo, pirimidinilo o quinolinilo, en donde cada uno de estos grupos está opcionalmente sustituido con uno o más sustituyentes R114.
(4-9) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-8) o una sal del mismo, o un solvato del compuesto o la sal, en donde cada R114 se selecciona independientemente entre un átomo de halógeno, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6 )carbonilo, un grupo -NR127R128 (cada R127 y R128 se seleccionan independientemente entre un átomo de hidrógeno, y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C4)carbonilo), un grupo -SO2NR135R136 (cada R135 y R136 se seleccionan independientemente entre un átomo de hidrógeno, y alquilo C1-C4) y (alquil C1-C4)tio
(4-10) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-9) o una sal del mismo, o un solvato del compuesto o la sal, en donde R101 es alquilo C1-C6 lineal
(4-11) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-10) o una sal del mismo, o un solvato del compuesto o la sal, en donde R102 y R102' son un átomo de hidrógeno
(4-12) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-11) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R101 es alquilo C1-C6 lineal;
R102 y R102' son un átomo de hidrógeno;
R103 es alquilo C1-C10 opcionalmente sustituido con Rx;
Rx es fenilo opcionalmente sustituido con uno o más sustituyentes Ry;
cada Ry se selecciona independientemente entre un átomo de halógeno y alcoxi C1-C8 opcionalmente sustituido con R112;
R112 es heterocicloalquilo de 5 o 6 miembros;
Ar101 es fenilo opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rz1Rz2 y Rz3; Rz1 es alcoxi C1-C4 opcionalmente sustituido con alcoxi C1-C3 o un átomo de halógeno;
Rz2 es un átomo de halógeno o alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno;
Rz3 es heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R114; y cada R114 se selecciona independientemente entre alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno.
(4-13) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-12) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rz3 está sustituido con uno o dos sustituyentes R114.
(4-14) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-13) o una sal del mismo, o un solvato del compuesto o la sal, en donde R110, R111, R112, R113 y R115 se seleccionan cada uno independientemente entre tetrahidrofuranilo, pirrolidinilo, morfolinilo, ciclopentilo y piridinilo.
(4-15) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-14) o una sal del mismo, o un solvato del compuesto o la sal, en donde R103 es bencilo opcionalmente sustituido con uno o más sustituyentes Ry en el anillo de benceno.
(4-16) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-15) o una sal del mismo, o un solvato del compuesto o la sal, en donde R103 es bencilo opcionalmente sustituido con uno a tres sustituyentes Ry en el anillo de benceno.
(4-17) El compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-16) o una sal del mismo, o un solvato del compuesto o la sal, en donde los uno a tres sustituyentes Ry son un sustituyente seleccionado entre Ri', Rj' y Rk', dos sustituyentes seleccionados entre las combinaciones de Ri' y Rj', R'i y Rk', y Rj' y Rk', o tres sustituyentes Ri', Rj' y Rk';
Ri' es un átomo de halógeno o alcoxi C1-C3;
Rj' es un átomo de halógeno, nitro o ciano; y
Rk' es hidroxi, un átomo de halógeno, alquilo C1-C6 , (carboxi)alquilo C1-C8 , (morfolino)alquilo C1-C4 , (alcoxi C1-C6)alquilo C1-C8 (el alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), (heterocicloalquilo de 5 a 6
miembros)alcoxi C1-C6 , [HO-((CH2)pO)p]alquilo C1-C6 , (carboxi)alquinilo C2-C6 , (heterocicloalquilo de 3 a 6 miembros)alquinilo C2-C6 (el radical heterocicloalquilo está opcionalmente sustituido con oxo), alcoxi C1-C3 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C6 sustituido con uno o más grupos hidroxi, ((alcoxi C1-C3)carbonil)alcoxi C1-C3 (piridinil)alcoxi C1-C4 , (alcoxi C1-C6)alcoxi C1-C8 (el alcoxi C1-C6 está opcionalmente sustituido con uno o más grupos hidroxi), C opcionalmente sustituido con hidroxi2-8 alquinilo, (cicloalquil C3-C6)alquinilo C2-C6 (el cicloalquilo está opcionalmente sustituido con un grupo hidroxi), [HO-((CH2)oO)p]alquinilo C2-C8 , (alcoxi C1-C6)alquinilo C2-C8 (el alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), (morfolino)(alquil C1-C4)tio, oxacicloalquiloxi de 3 a 6 miembros, o (alcoxi C1-C3)carbonilo.
En la presente memoria se describen los siguientes compuestos (5-1) a (5-12) representados por la fórmula (I):
(5-1) El compuesto de acuerdo con los apartados (1-1), (2-1) o (3-1) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 es un átomo de hidrógeno o alquilo C1-C10 lineal; y
R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados forman un anillo heterocíclico saturado de 5 a 8 miembros, en donde el anillo heterocíclico saturado está opcionalmente sustituido con uno o más sustituyentes R2
(5-2) El compuesto de acuerdo con el apartado (5-1) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb es alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 o un átomo de halógeno; y/o
Rc es un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, o un grupo -SF5; y/o
Rd es ciano, hidroxi, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(5-3) El compuesto de acuerdo con los apartados (5-1) o (5-2) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 es un átomo de hidrógeno o alquilo C1-C6 lineal;
R2 puede ser igual o diferente y se seleccionan cada uno independientemente entre alquilo C1-C3 y un átomo de halógeno;
Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C3)carbonilo, heterocicloalquiloxi de 5 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C3)tio opcionalmente sustituido con uno o más sustituyentes R13;
cada R10 se selecciona independientemente entre carboxilo, heterocicloalquilo de 5 a 10 miembros, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, y un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4);
cada R11 se selecciona independientemente entre hidroxi, carboxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), y cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi;
cada R12 se selecciona entre un átomo de halógeno, hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, heterocicloalquilo de 5 a 10 miembros y heteroarilo de 5 a 10 miembros;
cada R13 se selecciona independientemente entre heterocicloalquilo de 5 a 10 miembros;
Rb es alcoxi C1-C4 opcionalmente sustituido con alcoxi C1-C3 o un átomo de halógeno; y
cada R14 se selecciona independientemente entre un átomo de halógeno, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6)carbonilo, un grupo -NR27R28 (en donde R27 y R28 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C3)carbonilo, un grupo -SO2NR35R36 (en donde R35 y R36 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C3), (alquil C1-C3)tio y heterocicloalquilo de 5 a 10 miembros.
(5-4) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-3) o una sal del mismo, o un solvato del compuesto o la sal, en donde Re se selecciona entre arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra.
(5-5) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-4) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con Rb, Rc y/o Rd;
Rb es un átomo de halógeno u alcoxi C1-C4 opcionalmente sustituido con alcoxi C1-C3 ; y/o
Rc es un átomo de halógeno o alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno; y/o
Rd es heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14, fenilo opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(5-6) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-5) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;
Rb es un átomo de halógeno;
Rc es un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, o un grupo -SF5 ; y
Rd es ciano, hidroxi o un átomo de halógeno.
(5-7) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-6) o una sal del mismo, o un solvato del compuesto o la sal, en donde Rd es fenilo, tienilo, piridinilo, pirimidinilo o quinolinilo, en donde cada uno de estos grupos está opcionalmente sustituido con uno o más sustituyentes R14.
(5-8) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-7) o una sal del mismo, o un solvato del compuesto o la sal, en donde R1 es alquilo C1-C6 lineal.
(5-9) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-8) o una sal del mismo, o un solvato del compuesto o la sal, en donde R2 es un átomo de hidrógeno.
(5-10) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-9) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R1 es alquilo C1-C6 lineal;
R2 es un átomo de hidrógeno;
R3 es alquilo C1-C4 sustituido con Re;
Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;
cada Ra se selecciona independientemente entre un átomo de halógeno y alcoxi C1-C8 opcionalmente sustituido con R12;
cada R12 se selecciona independientemente entre heterocicloalquilo de 5 o 6 miembros;
Ar1 es fenilo opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd; Rb es alcoxi C1-C4 opcionalmente sustituido con alcoxi C1-C3 y un átomo de halógeno; y/o
Rc es un átomo de halógeno o alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno; y/o
Rd es heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14; y cada R14 se selecciona independientemente entre alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno.
(5-11) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-10) o una sal del mismo, o un solvato del compuesto o la sal, en donde R10, R11, R12, R13 y R15 se seleccionan cada uno independientemente entre tetrahidrofuranilo, pirrolidinilo, morfolinilo, ciclopentilo y piridinilo.
(5-12) El compuesto de acuerdo con cualquiera de los apartados (5-1) a (5-11) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo opcionalmente sustituido con uno o más sustituyentes Ra en el anillo de benceno.
Una realización alternativa de la presente invención proporciona los siguientes compuestos (6-1) a (6-10) representados por la fórmula (I):
(6-1) Un compuesto representado por la fórmula I-b o una sal del mismo, o un solvato del compuesto o la sal:
[Fórmula 8]
en donde
R4' se selecciona entre alquilo C1-C4 ;
q es un número entero seleccionado entre 0 y 3;
R3' se selecciona entre alquilo C1-C4 sustituido con Re’;
Re’ es arilo C6-C10, en donde el grupo arilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados cada uno independientemente entre un átomo de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12', heterocicloalquiloxi de 4 a 6 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4), un grupo -(O(CH2)q1)q2-NR41'R42' (en donde q1 es un número entero seleccionado entre 1 y 4, y q2 es un número entero seleccionado entre 2 a 6), un grupo -(O(CH2)r1)r2-C(O)NR43'R44' (en donde r1 es un número entero seleccionado entre 1 y 4, y r2 es un número entero seleccionado entre 1 y 4), un grupo -(O(CH2)s1)s2-NR45'-C(O)R46' (en donde s1 y s2 son cada uno independientemente un número entero seleccionado entre 2 a 4), un grupo -C(O)NR47'R48', piridinilo, pirrolilo, un grupo -NR49'R50', y un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51'R52' (en donde r1 es un número entero seleccionado entre 1 y 4, y r2 es un número entero seleccionado entre 1 y 4);
cada R12' se selecciona independientemente entre (alcoxi C1-C4)alcoxi C1-C6 , heterocicloalquilo de 5 o 6 miembros y un grupo -NR39'R40', en donde el grupo heterocicloalquilo de 5 o 6 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (en donde el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4 , alcoxi C1-C4carbonilo, (alquil C1-C4)tio, morfolino, (alquil C1-C3)sulfonilo y -C(O)NR13'R14';
R39' se selecciona entre un hidrógeno y alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6 ;
R40' se selecciona independientemente entre un átomo de hidrógeno, alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6 , ((alcoxi C1-C4)carbonil)alquilo C1-C6 , alquilo C1-C6 sustituido con hidroxilo, un grupo -(CH2)u-NR55'R56' (en donde u es un número entero seleccionado entre 1 y 4), un grupo -CH((CH2)v1COOR57')-(CH2)v2-COOR57' (en donde v1 es un número entero seleccionado entre 0 y 2, y v2 es un número entero seleccionado entre 1 y 3), un grupo -(CH2V-SO3H (en donde w es un número entero seleccionado entre 1 y 4), un grupo -(CH2)x1-CH(COOH)-(CH2)x2-SO3H (en donde x1 es un número entero seleccionado entre 0 y 2, y x2 es un número entero seleccionado entre 1 y 3), oxacicloalquilo de 3 a 6 miembros y un grupo -(CH2)t1-O-(CH2)t2-C(O)NR58'R59' (en donde t1 y t2 son cada uno independientemente un número entero seleccionado entre 1 y 3);
R41' es un átomo de hidrógeno o alquilo C1-C3 ;
R42' es alquilo C1-C8 sustituido con uno o más grupos hidroxi o (alcoxi C1-C3)alquilo C1-C4:
R43' es un átomo de hidrógeno o alquilo C1-C3 ;
R44' es alquilo C1-C8 sustituido con uno o más grupos hidroxi, en el que
R43' y R44' junto con el átomo de nitrógeno al que están anclados pueden formar morfolino;
R45' es un átomo de hidrógeno y alquilo C1-C3 ;
R46' es alquilo C1-C6 sustituido con uno o más grupos hidroxi;
R47' es alquilo C1-C3 ;
R48' es (alcoxi C1-C3)alquilo C1-C4 ;
R49' es un átomo de hidrógeno o alquilo C1-C4;
R50' es -(CH2)z-NR60'R61' (z es un número entero seleccionado entre 1 y 4, R60' es un átomo de hidrógeno y alquilo C1-C4 y R61' es (alcoxi C1-C3)alquilo C1-C4 o R60' y R61' junto con el átomo de nitrógeno al que están anclados pueden formar morfolino);
R51' es un átomo de hidrógeno y alquilo C1-C4 ;
R52' es alquilo C1-C8 sustituido con uno o más grupos hidroxi;
R53' y R54' se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4; R55' es un átomo de hidrógeno o alquilo C1-C4 ;
R56' es (alquil C1-C4)carbonilo;
R57' es un átomo de hidrógeno o alquilo C1-C4;
R58' es un átomo de hidrógeno o alquilo C1-C3;
R59' es alquilo C1-C8 sustituido con uno o más grupos hidroxi;
Ar2 es fenilo o heteroarilo de 5 o 6 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb', Rc' y Rd';
Rb', Rc' y Rd' se seleccionan cada uno independientemente entre alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 , un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14'; y cada R14' se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y (alquil C1-C4)tio.
(6-2) El compuesto de acuerdo con el apartado (6-1) o una sal del mismo, o un solvato del compuesto o la sal, en donde
R4' es alquilo C1-C4 ;
q es un número entero seleccionado entre 0 y 3;
R3' es alquilo C1-C4 sustituido con Re';
Re' es arilo C6-C10, en donde el grupo arilo está opcionalmente sustituido con uno a tres sustituyentes cada uno independientemente seleccionado entre un átomo de halógeno y alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12';
cada R12' se selecciona independientemente entre heterocicloalquilo de 5 o 6 miembros y un grupo -NR39'R40';
R39' y R40' se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con alcoxi C1-C4 ;
Ar2 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb', Rc' y Rd';
Rb', Rc' y Rd' se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14'; y
cada R14' se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y (alquil C1-C4)tio.
(6-3) El compuesto de acuerdo con los apartados (6-1) o (6-2) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rb' es un átomo de halógeno;
Rc' es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y
Rd' es un átomo de halógeno o un heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14.
(6-4) El compuesto de acuerdo con cualquiera de los apartados (6-1) a (6-3) o una sal del mismo, o un solvato del compuesto o la sal, en donde R3' es bencilo, en donde el fenilo en el grupo bencilo está opcionalmente sustituido con uno a tres sustituyentes cada uno independientemente seleccionado entre un átomo de halógeno y alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12'.
(6-5) El compuesto de acuerdo con cualquiera de los apartados (6-1) a (6-4) o una sal del mismo, o un solvato del compuesto o la sal, en donde Re' es fenilo, en donde el grupo fenilo está opcionalmente sustituido con uno sustituyente seleccionado entre Ri', Rj' y Rk', dos sustituyentes seleccionados entre combinaciones de Ri' y Rj', Ri' y Rk', y Rj' y Rk', o tres sustituyentes Ri', Rj' y Rk';
Ri' y Rj' son cada uno independientemente un átomo de halógeno; y
Rk' es alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12
(6-6) El compuesto de acuerdo con cualquiera de los apartados (6-1) a (6-5) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Ar2 es fenilo o piridinilo;
Rd' es piridinilo o pirimidinilo; y
R12' es morfolinilo o -NR39'R40'.
(6-7) El compuesto de acuerdo con cualquiera de los apartados (6-1) a (6-6) o una sal del mismo, o un solvato del compuesto o la sal, en donde R12' se selecciona entre morfolinilo, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino] y [N,N-di(alquil C1-C3)amino].
(6-8) El compuesto de acuerdo con cualquiera de los apartados (6-1) a (6-3) o una sal del mismo, o un solvato del compuesto o la sal, en donde Ra se selecciona entre un átomo de halógeno, (morfolino)alcoxi C1-C4 , [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 y [N,N-di(alquil C1-C3)amino]alcoxi C1-C4
(6-9) El compuesto de acuerdo con (6-5) o (6-6) o una sal del mismo, o un solvato del compuesto o la sal, en donde
Rk se selecciona entre (morfolino)alcoxi C1-C4 , [N-((alcoxi Ci-C3)alquil Ci-C4)-N-(alquil Ci-C3)amino]alcoxi C1-C4 y [N,N-di(alquil C1-C3)amino]alcoxi C1-C4
(6-10) El compuesto de acuerdo con cualquiera de los apartados (6-1) a (6-6) o una sal del mismo, o un solvato del compuesto o la sal, en donde R12' es un grupo -NR39'R40'.
Un aspecto alternativo de la presente invención proporciona un fármaco que comprende un compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-12), (5-1) a (5-12) y (6-1) a (6-10) o una sal del mismo, o un solvato del compuesto o la sal.
Un aspecto alternativo adicional de la presente invención proporciona una composición farmacéutica que comprende un compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-12), (5-1) a (5-12) y (6-1) a (6-10) o una sal del mismo, o un solvato del compuesto o la sal.
Un aspecto alternativo adicional de la presente invención proporciona el compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-12), (5-1) a (5-12) y (6-1) a (6-10) o la sal del mismo, o el solvato del compuesto o la sal para su uso en la prevención y/o el tratamiento de una enfermedad seleccionada entre hiperfosfatemia, hiperparatiroidismo secundario e insuficiencia renal crónica.
Un aspecto alternativo adicional de la presente invención proporciona un inhibidor de NaPi-IIb que comprende un compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-12), (5-1) a (5-12) y (6-1) a (6-10) o una sal del mismo, o un solvato del compuesto o la sal.
Un aspecto alternativo adicional de la presente invención proporciona un agente preventivo y/o terapéutico para una enfermedad seleccionada entre hiperfosfatemia, hiperparatiroidismo secundario e insuficiencia renal crónica, comprendiendo el agente un compuesto de acuerdo con cualquiera de los apartados (4-1) a (4-12), (5-1) a (5-12) y (6-1) a (6-10) o una sal del mismo, o un solvato del compuesto o la sal como ingrediente activo.
Efectos ventajosos de la invención
El compuesto, la sal del mismo o el solvato del compuesto o la sal tiene un excelente efecto inhibidor de NaPi-IIb, efecto inhibidor de PiT-1 o efecto inhibidor de PiT-2, y es útil como agente de prevención y/o tratamiento para la hiperfosfatemia. Adicionalmente, el compuesto, la sal del mismo o el solvato del compuesto o la sal son útiles como agente de prevención y/o tratamiento para el hiperparatiroidismo secundario o la insuficiencia renal crónica.
Descripción de las realizaciones
A continuación, se describirá un compuesto de la presente invención o una sal del mismo, o un solvato del compuesto o la sal, un método para producir el mismo, y un fármaco que contiene este compuesto.
Definición
En la presente invención, un "átomo de halógeno" significa un átomo de flúor, un átomo de cloro, un átomo de bromo, un átomo de yodo y similares. En la presente invención, los ejemplos preferidos del átomo de halógeno utilizado como sustituyente para arilo, heteroarilo, etc. incluyen un átomo de flúor, un átomo de cloro y un átomo de bromo. En la presente invención, los ejemplos preferidos del átomo de halógeno utilizado como sustituyente para alquilo o un grupo que contiene parcialmente alquilo (alcoxi, alquenilo, alquiltio, etc.) incluyen un átomo de flúor. Los ejemplos específicos de grupos que tienen el átomo de halógeno como sustituyente incluyen trifluorometilo, pentafluoroetilo, trifluorometoxi, pentafluoroetoxi, trifluorometiltio y pentafluoroetiltio.
En la presente invención, "alquilo C1-C3” se refiere a un grupo monovalente derivado de un hidrocarburo alifático saturado lineal y ramificado que tiene de 1 a 3 átomos de carbono por la pérdida de un átomo de hidrógeno arbitrario. Los ejemplos específicos del mismo incluyen metilo, etilo, n-propilo e isopropilo.
En la presente invención, "alquilo C1-C4” se refiere a un grupo monovalente derivado de un hidrocarburo alifático saturado lineal y ramificado que tiene de 1 a 4 átomos de carbono por la pérdida de un átomo de hidrógeno arbitrario. Los ejemplos específicos del mismo incluyen metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, secbutilo, t-butilo y 1-metilpropilo.
En la presente invención, "alquilo C1-C5” se refiere a un grupo monovalente derivado de un hidrocarburo alifático saturado lineal y ramificado que tiene de 1 a 5 átomos de carbono por la pérdida de un átomo de hidrógeno arbitrario. Los ejemplos específicos del mismo incluyen metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, secbutilo, t-butilo, 1 -metilpropilo, n-pentilo, isopentilo, 2-metilbutilo, 1,1 -dimetilpropilo y 1 -etilpropilo.
En la presente invención, "alquilo C1-C6” se refiere a un grupo monovalente derivado de un hidrocarburo alifático
saturado lineal y ramificado que tiene de 1 a 6 átomos de carbono por la pérdida de un átomo de hidrógeno arbitrario. Los ejemplos específicos del mismo incluyen metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, secbutilo, t-butilo, 1 -metilpropilo, n-pentilo, isopentilo, 2-metilbutilo, 1,1 -dimetilpropilo, 1 -etilpropilo, hexilo, 4-metilpentilo y 2-etilbutilo.
En la presente invención, "alquilo C1-C8” se refiere a un grupo monovalente derivado de un hidrocarburo alifático saturado lineal y ramificado que tiene de 1 a 8 átomos de carbono por la pérdida de un átomo de hidrógeno arbitrario. Los ejemplos específicos del mismo incluyen los grupos enumerados anteriormente en la definición de "alquilo C1-C6" así como n-heptilo, 5-metilhexilo, 1 -propilbutilo, 2-etil-2-metilbutilo, n-octilo, 5-metilheptilo, 2,3-dimetilhexilo, 1 -metil-1 -propilbutilo y 2, 2-dietilbutilo.
En la presente invención, "alquilo C1-C10” se refiere a un grupo monovalente derivado de un hidrocarburo alifático saturado lineal y ramificado que tiene de 1 a 10 átomos de carbono por la pérdida de un átomo de hidrógeno arbitrario. Los ejemplos específicos del mismo incluyen los grupos enumerados anteriormente en la definición de "alquilo C1-C8" así como 7-metiloctilo, 5-etilheptilo, n-decilo, 8-metilnonilo, 5,5-dimetiloctilo y 4-etil-6-metilheptilo. En la presente invención, "alquilo C1-C6 lineal" se refiere a un grupo monovalente derivado de un hidrocarburo alifático saturado lineal que tiene de 1 a 6 átomos de carbono por la pérdida de un átomo de hidrógeno arbitrario. “Alquilo C1-C6 lineal" significa específicamente metilo, etilo, n-propilo, n-butilo, n-pentilo y n-hexilo.
En la presente invención, "alquilo C1-C10 lineal" se refiere a un grupo monovalente derivado de un hidrocarburo alifático saturado lineal que tiene de 1 a 10 átomos de carbono por la pérdida de un átomo de hidrógeno arbitrario. “Alquilo C1-C10 lineal" significa específicamente metilo, etilo, n-propilo, n-butilo, n-pentilo, n-hexilo, n-heptilo, n-octilo, n-nonilo y n-decilo.
En la presente invención, "morfolino" significa morfolin-4-ilo.
En la presente invención, "(morfolino)alquilo C1-C6" significa un grupo alquilo C1-C6 sustituido con morfolino. "alquilo C1-C6" se define como antes. Los ejemplos específicos del mismo incluyen morfolinometilo, morfolinoetilo, morfolinon-propilo, morfolinopropilo, morfolino-n-butilo, morfolinoisobutilo, morfolino-sec-butilo, morfolino-t-butilo, morfolino-1-metilpropilo, morfolino-n-pentilo, morfolinopentilo, morfolino-2-metilbutilo, morfolino-1,1-dimetilpropilo, morfolino-1-etilpropilo, morfolinohexilo, morfolino-4-metilpentilo y morfolino-2-etilbutilo. Los ejemplos preferidos del mismo incluyen morfolinometilo.
En la presente invención, "(morfolino)alquilo C1-C4" significa un grupo alquilo C1-C4 sustituido con morfolino. "alquilo C1-C4" se define como antes. Los ejemplos específicos del mismo incluyen morfolinometilo, morfolinoetilo, morfolinon-propilo, morfolinopropilo, morfolino-n-butilo, morfolinoisobutilo, morfolino-sec-butilo, morfolino-t-butilo y morfolino-1-metilpropilo. Los ejemplos preferidos del mismo incluyen morfolinometilo.
En la presente invención, "(oxetanil)alquilo C1-C4" significa un grupo alquilo C1-C4 sustituido con oxetanilo. "alquilo C1-C4" se define como antes. Los ejemplos específicos del mismo incluyen oxetanilmetilo, oxetaniletilo, oxetanil-npropilo, oxetanilisopropilo, oxetanil-n-butilo, oxetanilisobutilo, oxetanil-sec-butilo, oxetanil-t-butilo y oxetanil-1-metilpropilo. Los ejemplos preferidos del mismo incluyen oxetanilmetilo.
En la presente invención, "(heterocicloalquil de 4 a 6 miembros)alquilo C1-C4" significa alquilo C1-C4 sustituido con heterocicloalquilo de 4 a 6 miembros. “Alquilo C1-C4" se define como antes. “Heterocicloalquilo de 4 a 6 miembros" significa un grupo heterocíclico saturado compuesto de 4 a 6 átomos que constituyen el anillo que contiene de uno a tres heteroátomos seleccionados entre O, S y N. "(Heterocicloalquil de 4 a 6 miembros)alquilo C1-C4” incluye "(morfolino)alquilo C1-C4" y "(oxetanil)alquilo C1-C4".
En la presente invención, "(carboxi)alquilo C1-C8" significa alquilo C1-C8 sustituido con carboxi. "Alquilo C1-C8" se define como antes. Los ejemplos específicos del mismo incluyen carboxi-n-hexilo, carboxi-n-heptilo, carboxi-5-metilhexilo, carboxi-1-propilbutilo, carboxi-2-etil-2-metilbutilo, carboxi-n-octilo, carboxi-5-metilheptilo, carboxi-2,3-dimetilhexilo, carboxi-1-metil-1 -propilbutilo y carboxi-2,2-dietilbutilo. Los ejemplos preferidos del mismo incluyen carboxi-n-hexilo, carboxi-n-heptilo, y carboxi-n-octilo.
En la presente invención, "(alcoxi C1-C6)alquilo C1-C8" significa alquilo C1-C8 sustituido con alcoxi C1-C6. "Alcoxi C1-C6" y "alquilo C1-C8" se definen como antes y a continuación. Los ejemplos específicos del mismo incluyen etoxi-npropilo, n-propoxi-n-propilo, n-butoxi-n-propilo, n-heptoxipropilo, n-propoxi-n-hexilo, n-butoxi -n-hexilo, n-propoxi-nheptilo y n-butoxi-n-heptilo Los ejemplos preferidos del mismo incluyen n-propoxi-n-propilo y n-butoxi-n-heptilo. En la presente invención, "(alcoxi C1-C3)alquilo C1-C4" significa alquilo C1-C4 sustituido con alcoxi C1-C3. "Alcoxi C1-C3" y "alquilo C1-C4" se definen como antes y a continuación. Los ejemplos específicos del mismo incluyen metoximetilo, metoxietilo, etoximetilo, metoxi-n-propilo, etoxi-n-propilo, metoxi-n-butilo y etoxi-n-butilo.
En la presente invención, "(alcoxi Ci-C4)alquilo C1-C4” significa alquilo C1-C4 sustituido con alcoxi C1-C4. "Alcoxi Ci-C4” y “alquilo C1-C4” se definen como antes y a continuación. Los ejemplos específicos del mismo incluyen los grupos enumerados anteriormente en la definición de "(alcoxi C1-C3 )alquilo C1-C4" así como n-butoximetilo, nbutoxietilo, n-butoxi-n-propilo y n-butoxi-n-butilo.
En la presente invención, "(alcoxi C1-C3)alquilo C1-C6” significa alquilo C1-C6 sustituido con alcoxi C1-C3”. “Alcoxi C1-C3” y “alquilo C1-C6” se definen como antes y a continuación. Los ejemplos específicos del mismo incluyen los grupos enumerados anteriormente en las definiciones de "(alcoxi C1-C3)alquilo C1-C4” y “(alcoxi C1-C4)alquilo C1-C4". Los ejemplos preferidos del mismo incluyen metoxi-n-propilo.
En la presente invención, "[HO-((CH2)oO)p]alquilo C1-C6” se refiere a alquilo C1-C6 sustituido con un grupo -(O(CH2)o)p-OH. Alquilo C1-C6 se define como antes. Los ejemplos específicos del mismo incluyen [HO-((CH2)2O)3]propilo
En la presente invención, "alquileno C1-C5” se refiere a un grupo divalente derivado de un hidrocarburo alifático saturado lineal o ramificado que tiene de 1 a 5 átomos de carbono por la pérdida de dos átomos de hidrógeno arbitrarios. “Alquileno C1-C5" incluye "alquileno C1-C3". Los ejemplos específicos del mismo incluyen
-CH2-, -CH(CH3)-, -C(CH3)2-, -CH2CH2-, -CH2CH (CH3)-, -CH2C (CH3)2-, -CH(CH2CH3)-, -C(CH2CH3)2- y -CH(CH2CH2CH3 )-. Se prefiere -CH2-.
En la presente invención, dos o más sustituyentes R2 en un anillo heterocíclico saturado de 5 a 8 miembros juntos pueden formar alquileno C1-C5 que conecta los átomos del anillo a los que están anclados. En este caso, el anillo heterocíclico saturado forma un anillo biciclo o un anillo triciclo y así sucesivamente.
En la presente invención, "alquinilo C2-C10” se refiere a un grupo monovalente derivado de un hidrocarburo alifático lineal o ramificado que tiene de 2 a 10 átomos de carbono y que tiene al menos un triple enlace (dos átomos de carbono SP adyacentes) por la pérdida de un átomo de hidrógeno arbitrario. Los ejemplos específicos del mismo incluyen etinilo, 1 -propinilo, 2-propinilo, 1 -butinilo, 2-butinilo, 3-butinilo, 1 -metil-2-propinilo, 1 -pentinilo, 2-pentinilo, 3-pentinilo, 4-pentinilo, 1 -metil-2-butinilo, 1 -metil-3-butinilo, 2-metil-3-butinilo, 3-metil-1 -butinilo, 1, 1 -dimetil-2-propinilo, 1 -hexinilo, heptinilo, heptadiinilo, octinilo y octadiinilo.
En la presente invención, “alquinilo C2-C10 opcionalmente sustituido” significa alquinilo C2-C10” no sustituido descrito anteriormente o alquinilo C2-C10 en el que uno o más átomos de hidrógeno se reemplazan por uno o varios sustituyentes predeterminados. Dos o más sustituyentes en este grupo pueden ser iguales o diferentes entre sí. Un átomo de carbono puede estar sustituido con una pluralidad de sustituyentes.
En la presente invención, "alquinilo C2-C6” se refiere a un grupo monovalente derivado de un hidrocarburo alifático lineal o ramificado que tiene de 2 a 6 átomos de carbono y que tiene al menos un triple enlace (dos átomos de carbono SP adyacentes) por la pérdida de un átomo de hidrógeno arbitrario. Los ejemplos específicos del mismo incluyen etinilo, 1 -propinilo, 2-propinilo, 1 -butinilo, 2-butinilo, 3-butinilo, 1 -metil-2-propinilo, 1 -pentinilo, 2-pentinilo, 3-pentinilo, 4-pentinilo, 1 -metil-2-butinilo, 1 -metil-3-butinilo, 2-metil-3-butinilo, 3-metil-1-butinilo, 1,1 -dimetil-2-propinilo y 1- hexinilo.
En la presente invención, “alquinilo C2-C10 opcionalmente sustituido” significa alquinilo C2-C10 no sustituido descrito anteriormente o alquinilo C2-C6 en el que uno o más átomos de hidrógeno se reemplazan con sustituyentes predeterminados. Dos o más sustituyentes en este grupo pueden ser iguales o diferentes entre sí. Un átomo de carbono puede estar sustituido con una pluralidad de sustituyentes.
En la presente invención, "(carboxi)alquinilo C2-C6” significa alquinilo C2-C6 sustituido con carboxi. Alquinilo C2-C6 se define como antes. Los ejemplos específicos del mismo incluyen carboxietinilo, carboxi-1-propinilo, carboxi-2-propinilo, carboxi-1-butinilo, carboxi-2-butinilo, carboxi-3-butinilo, carboxi-1-metil-2-propinilo, carboxi-1- pentinilo, carboxi-2-pentinilo, carboxi-3-pentinilo, carboxi-4-pentinilo, carboxi-1-metil-2-butinilo, carboxi-1-metil-3-butinilo, carboxi-2-metil-3-butinilo, carboxi-3-metil-1-butinilo, carboxi-1,1-dimetil-2-propinilo y carboxi-1-hexinilo. Los ejemplos preferidos del mismo incluyen carboxi-1-pentinilo y carboxi-1-hexinilo.
En la presente invención, "(alcoxi C1-C6)alquinilo C2-C8” significa alquinilo C2-C8 sustituido con alcoxi C1-C6. Alcoxi C1-C6 y alquinilo C2-C8 se definen como antes. Los ejemplos específicos del mismo incluyen etoxi-1-propinilo, propoxi-1-propinilo, butoxi-1-propinilo, propoxi-1-butinilo, propoxi-1-hexinilo, butoxi-1-hexinilo, propoxi-1 -heptinilo y butoxi-1 -heptinilo. Los ejemplos preferidos del mismo incluyen etoxi-1-propinilo, propoxi-1-propinilo, butoxi-1-propinilo, propoxi-1-butinilo, propoxi-1-hexinilo y butoxi-1-heptinilo.
En la presente invención, "(morfolino)alquinilo C2-C6” significa alquinilo C2-C6 sustituido con morfolino. alquinilo C2-C6 se define como antes. Los ejemplos específicos del mismo incluyen morfolinoetinilo, morfolino-1-propinilo, morfolino-2- propinilo, morfolino-1-butinilo, morfolino-2-butinilo, morfolino-3-butinilo, morfolino-1-pentinilo, morfolino-2-pentinilo,
morfolino- 3-pentinilo, morfolino-4-pentinilo y morfolino-1-hexinilo. Los ejemplos preferidos del mismo incluyen morfolino-1-propinilo, morfolino-1-butinilo y morfolino-1-heptinilo.
En la presente invención, los ejemplos de "(morfolino)alquinilo C2-C6 sustituido con uno o varios grupos oxo" incluyen (morfolino)alquinilo C2-C6 sustituido con uno o dos grupos oxo. Los ejemplos preferidos del mismo incluyen 3-(3-oxomorfolin-4-il)-1-propinilo y (1,1 -dioxotiomorfolin-4-il)-1 -propinilo.
En la presente invención, "(oxacicloalquil de 3 a 6 miembros)alquinilo C2-C6” significa alquinilo C2-C6 sustituido con oxacicloalquilo de 3 a 6 miembros. Oxacicloalquilo de 3 a 6 miembros y alquinilo C2-C6 se definen como en la memoria descriptiva.
En la presente invención, "(oxetanil)alquinilo C2-C6” significa alquinilo C2-C6 sustituido con oxetanilo. alquinilo C2-C6 se define como antes. Los ejemplos específicos del mismo incluyen oxetaniletinilo, oxetanil-1-propinilo, oxetanil-2-propinilo, oxetanil-1-butinilo, oxetanil-2-butinilo, oxetanil-3-butinilo, oxetanil-1-pentinilo, oxetanil-2-pentinilo, oxetanil-3-pentinilo, oxetanil-4-pentinilo y oxetanil-1-hexinilo. Los ejemplos preferidos del mismo incluyen oxetanil-1-propinilo, oxetanil-1-butinilo y oxetanil-1-pentinilo.
En la presente invención, "(pirrolidin)alquinilo C2-C6” significa alquinilo C2-C6 sustituido con pirrolidino. Alquinilo C2-C6 se define como antes. Los ejemplos específicos del mismo incluyen pirrolidinoetinilo, pirrolidino-1-propinilo, pirrolidino-2-propinilo, pirrolidino-1-butinilo, pirrolidino-2-butinilo, pirrolidino-3-butinilo, pirrolidino-1-pentinilo, pirrolidino-2-pentinilo, 3-pentinilo, pirrolidino-4-pentinilo y pirrolidino-1-hexinilo. Los ejemplos preferidos del mismo incluyen pirrolidino-1-propinilo.
En la presente invención, "(cicloalquil C3-C6)alquinilo C2-C6” significa alquinilo C2-C6 sustituido con cicloalquilo C3-C6. Cicoalquilo C3-C6 y alquinilo C2-C6 se definen como antes. Los ejemplos específicos del mismo incluyen ciclopropiletinilo, ciclobutiletinilo, ciclopentiletinilo, ciclohexiletinilo, ciclopropil-1-propinilo, ciclobutil-1-propinilo, ciclopentil-1-propinilo, ciclohexil-1-propinilo, ciclopropil-1-butinilo, ciclobutil-1-butinilo, ciclopentil-1-butinilo, y ciclohexil-1-butinilo. Los ejemplos preferidos del mismo incluyen ciclopropiletinilo, ciclobutiletinilo, ciclopentiletinilo, ciclopropil-1-propinilo, ciclobutil-1-propinilo y ciclopentil-1-propinilo.
En la presente invención, "[HO-((CH2)oO)p]alquinilo C2-C8” significa alquinilo C2-C8 sustituido con un grupo -(O(CH2)o)p-OH. Alquinilo C2-C8 se define como antes. Los ejemplos específicos del mismo incluyen [HO-((CH2)2O)3]propinilo y [HO-((CH2)2O)2]propinilo.
En la presente invención, "[N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alquinilo C2-C6” significa alquinilo C2-C6 sustituido con N-((alcoxi C1-C3)alquil C1-C4 )-N-(alquil C1-C3)amino. En este contexto, "[N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]” y “alquinilo C2-C6” se definen como en esta memoria descriptiva. Los ejemplos específicos incluyen [N-(2-metoxietil)-N-(metil)amino]etinilo, [N-(2-metoxi-1,1-dimetiletil)-N-(metil)amino]etinilo y [N-(2-metoxi-2-metil-1-propil)-N-(metil)amino]etinilo.
En la presente invención, "alcoxi C1-C3” significa un grupo (alquil C1-C3)-O-. En este contexto, alquilo C1-C3 se define como antes. Los ejemplos específicos del mismo incluyen metoxi, etoxi, 1-propoxi y 2-propoxi.
En la presente invención, "alcoxi C1-C4” significa un grupo (alquil C1-C4)-O-. En este contexto, alquilo C1-C4 se define como antes. Los ejemplos específicos del mismo incluyen metoxi, etoxi, 1-propoxi, 2-propoxi, n-butoxi, i-butoxi, secbutoxi y t-butoxi.
En la presente invención, "alcoxi C1-C5” significa un grupo (alquil C1-C5)-O-. En este contexto, alquilo C1-C5 se define como antes. Los ejemplos específicos del mismo incluyen metoxi, etoxi, 1-propoxi, 2-propoxi, n-butoxi, i-butoxi, secbutoxi, t-butoxi y 1 -pentiloxi.
En la presente invención, "alcoxi C1-C6” significa un grupo (alquil C1-C6)-O-. En este contexto, alquilo C1-C6 se define como antes. Los ejemplos específicos del mismo incluyen metoxi, etoxi, 1-propoxi, 2-propoxi, n-butoxi, i-butoxi, secbutoxi, t-butoxi, 1 -pentiloxi y 1 -hexiloxi.
En la presente invención, "alcoxi C1-C8” significa un grupo (alquil C1-C8)-O-. Los ejemplos específicos del mismo incluyen los grupos enumerados anteriormente en la definición de "alcoxi C1-C6", así como 1-heptiloxi y 1 -octiloxi. En la presente invención, "(carboxi)alcoxi C1-C8” significa alcoxi C1-C8 sustituido con un grupo carboxi. "alcoxi C1-C8” se define como antes. Los ejemplos específicos del mismo incluyen carboxi-n-propoxi, carboxi-n-butoxi, carboxi-npentoxi y carboxi-n-hexoxi.
En la presente invención, "(morfolino)alcoxi C1-C6” significa alcoxi C1-C6 sustituido con morfolino. "Alcoxi C1-C6” se define como antes. Los ejemplos específicos del mismo incluyen morfolinometoxi, morfolinoetoxi, morfolino-1propoxi, morfolino-2-propoxi, morfolino-n-butoxi, morfolino-i-butoxi, morfolino-sec-butoxi, morfolino-t-butoxi, morfolino-1-pentiloxi y morfolino-1-hexiloxi. Los ejemplos preferidos del mismo incluyen morfolinoetoxi.
En la presente invención, "(oxacicloalquil de 3 a 6 miembros)alcoxi C1-C4” significa alcoxi C1-C4 sustituido con oxacicloalquilo de 3 a 6 miembros. "Alcoxi C1-C4” se define como antes. Oxacicloalquilo de 3 a 6 miembros significa un grupo heterocíclico saturado compuesto de 3 a 6 átomos que constituyen el anillo que contiene uno o dos, (preferiblemente uno) átomos de oxígeno". (Oxacicloalquilo de 3 a 6 miembros)alcoxi C1-C4" incluye (oxiranil)alcoxi C1-C4, (oxetanil)alcoxi C1-C4 y (oxolanil)alcoxi C1-C4. Los ejemplos específicos del mismo incluyen oxiranilmetoxi, oxiraniletoxi, oxiranil-1-propoxi, oxiranil-n-butoxi, oxetanilmetoxi, oxetaniletoxi, oxetanil-1-propoxi, oxetanil-n-butoxi, oxolanilmetoxi, oxolaniletoxi, oxolanil-1-propoxi, y oxolanil-n-butoxi. Los ejemplos preferidos del mismo incluyen oxolanilmetoxi, oxiranilmetoxi y oxetanilmetoxi.
En la presente invención, "oxacicloalquiloxi de 3 a 6 miembros" significa oxacicloalquil-O- de 3 a 6 miembros. "Oxacicloalquilo de 3 a 6 miembros" se define como antes. Los ejemplos específicos del mismo incluyen oxiraniloxi, oxetaniloxi, oxolaniloxi y oxaniloxi. Se prefieren oxetaniloxi, oxolaniloxi u oxianiloxi.
En la presente invención, "heterocicloalquiloxi que contiene nitrógeno de 4 a 6 miembros" significa heterocicloalquil-O- que contiene nitrógeno de 4 a 6 miembros. "Heterocicloalquilo que contiene nitrógeno de 4 a 6 miembros" significa un grupo heterocíclico saturado compuesto de 4 a 6 átomos constituyentes de anillo que contienen uno o dos átomos de nitrógeno. Los ejemplos específicos del mismo incluyen pirrolidiniloxi y azetidiniloxi.
En la presente invención, "(piridinil)alcoxi C1-C4” significa alcoxi C1-C4 sustituido con piridinilo. "Alcoxi C1-C4” se define como antes. Los ejemplos específicos del mismo incluyen piridinilmetoxi, piridiniletoxi, piridinil-1-propoxi y piridinil-n-butoxi. Los ejemplos preferidos del mismo incluyen piridinilmetoxi.
En la presente invención, "(pirimidinil)alcoxi C1-C4” significa alcoxi C1-C4 sustituido con pirimidinilo. "Alcoxi C1-C4” se define como antes. Los ejemplos específicos del mismo incluyen pirimidinilmetoxi, pirimidiniletoxi, pirimidinil-1-propoxi y pirimidinil-n-butoxi. Los ejemplos preferidos del mismo incluyen pirimidinilmetoxi.
En la presente invención, "(1,2,4-triazolil)alcoxi C1-C4” significa alcoxi C1-C4 sustituido con 1,2,4-triazolilo. "alcoxi C1-C4” se define como antes. Los ejemplos específicos del mismo incluyen 1,2,4-triazolilmetoxi, 1,2,4-triazoliletoxi, 1,2,4-triazolil-1 -propoxi y 1,2,4-triazolil-n-butoxi. Los ejemplos preferidos del mismo incluyen 1,2,4-triazoliletoxi. En la presente invención, "(heterocicloalquil de 3 a 6 miembros)alcoxi C1-C6” significa alcoxi C1-C6 sustituido con heterocicloalquilo de 3 a 6 miembros. Heterocicloalquilo de 3 a 6 miembros significa un grupo heterocíclico saturado compuesto de 3 a 6 átomos que constituyen el anillo que contiene de uno a tres heteroátomos seleccionados entre O, S y N. Alcoxi C1-C6 se define como antes. "(Heterocicloalquilo de 3 a 6 miembros)alcoxi C1-C6" incluye (morfolino)alcoxi C1-C6 , (oxacicloalquil de 3 a 6 miembros)alcoxi C1-C4 , (pirrolidinil)alcoxi C1-C4, (azetidinil)alcoxi C1-C4 y (piperidinil)alcoxi C1-C4. Entre los ejemplos específicos del mismo se incluyen morfolinometoxi, morfolinoetoxi, morfolino-1,1-dimetil-etoxi(morfolino-t-butoxi), morfolino-1-metil-etoxi(morfolino-2-propoxi), tetrahidrofuranilmetoxi, pirrolidinilmetoxi, pirrolidiniletoxi, azetidinilmetoxi, azetidiniletoxi, piperidinilmetoxi, piperidiniletoxi, piperazinilmetoxi, piperaziniletoxi.
En la presente invención, "(heteroarilo de 5 o 6 miembros)alcoxi C1-C4” significa alcoxi C1-C4 sustituido con heteroarilo de 5 o 6 miembros. Heteroarilo de 5 o 6 miembros y alcoxi C1-C4 se definen como en la presente memoria. Los ejemplos específicos del mismo incluyen 1,2,4-triazoliletoxi.
En la presente invención, "(alcoxi C1-C6)alcoxi C1-C6” significa alcoxi C1-C6 sustituido con alcoxi C1-C6. "Alcoxi C1-C6” se define como antes. “(Alcoxi C1-C6)alcoxi C1-C6” incluye “(alcoxi C1-C4)alcoxi C1-C6”, “alcoxi C1-C3(alcoxi C1-C4)” y similares. Los ejemplos específicos del mismo incluyen metoximetoxi, metoxietoxi, etoximetoxi, etoxietoxi, metoxipropoxi, etoxipropoxi, propoximetoxi, propoxietoxi, propoxipropoxi, metoxibutoxi, etoxibutoxi, propoxibutoxi, butoximetoxi, butoxietoxi, butoxipropoxi, butoxibutoxi, metoxipentoxi, etoxipentoxi, propoxipentoxi, butoxipentoxi, pentoximetoxi, pentoxietoxi, pentoxipropoxi, pentoxibutoxi, pentoxipentoxi, metoxihexoxi, etoxihexoxi, propoxihexoxi, butoxihexoxi, pentoxihexoxi, hexoximetoxi, hexoxietoxi, hexoxipropoxi, hexoxibutoxi, hexoxipentoxi, y hexoxihexoxi. Los ejemplos preferidos del mismo incluyen propoxibutoxi, propoxipentoxi, y propoxihexoxi.
En la presente invención, "(alcoxi C1-C6)alcoxi C1-C8” significa alcoxi C1-C8 sustituido con alcoxi C1-C6. "Alcoxi C1-C6” y “alcoxi C1-C8” se definen como antes. Los ejemplos específicos del mismo incluyen los grupos enumerados anteriormente en la definición de "(alcoxi C1-C6)alcoxi C1-C6", así como hexoxiheptiloxi y hexoxioctiloxi.
En la presente invención, "(alcoxi C1-C3(alcoxi C1-C4))alcoxi C1-C4” significa alcoxi C1-C4 sustituido con alcoxi C1-C3(alcoxi C1-C4). "Alcoxi C1-C3(alcoxi C1-C4)" significa alcoxi C1-C4 sustituido con alcoxi C1-C3”. “Alcoxi C1-C4” y “alcoxi C1-C3” se definen como antes. Los ejemplos específicos del mismo incluyen metoxietoxietoxi, etoxietoxietoxi y metoxietoximetoxi.
En la presente invención, "[N-((alcoxi Ci-C3)alquil Ci-C4)-N-(alquil Ci-C3)amino]alcoxi C1-C4” significa alcoxi C1-C4 sustituido con N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino. En este contexto, "[N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]” significa amino sustituido con (alcoxi C1-C3)alquilo C1-C4 y alquilo C1-C3. (Alcoxi C1-C3)alquilo C1-C4 y alquilo C1-C3 se definen como antes. Los ejemplos específicos de "[N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4" incluyen [N-metoxietil)-N-(metil)amino]etoxi, [N-(metoxi-1,1-dimetiletil)-N-(metil)amino]etoxi y [N-(-metoxi-2-metil-1-propil)-N-(metil)amino]etoxi.
En la presente invención, "[N-(heterocicloalquil de 3 a 6 miembros)-N-(alquil C1-C3)amino]alcoxi C1-C4” significa alcoxi C1-C4 sustituido con N-(heterocicloalquil de 3 a 6 miembros)-N-(alquil C1-C3)amino. En este contexto, "[N-(heterocicloalquil de 3 a 6 miembros)-N-(alquil C1-C3)amino]” significa amino sustituido con heterocicloalquilo de 3 a 6 miembros y alquilo C1-C3. El heterocicloalquilo de 3 a 6 miembros se ha definido en la presente memoria. Los ejemplos específicos del mismo incluyen [N-tetrahidrofuranil-N-(metil)amino]etoxi, [N-tetrahidropiranil-N-(metil)amino]etoxi y [N-oxetanil-N-(metil)amino]etoxi.
En la presente invención, [N,N-di((hidroxi)alquil C1-C4)-amino]alcoxi C1-C4 significa alcoxi C1-C4 sustituido con N,N-di((hidroxi)alquil C1-C4)-amino. "[N,N-di((hidroxi)alquil C1-C4)-amino]” significa amino sustituido con dos grupos (hidroxi)alquilo C1-C4. (Hidroxi)alquilo C1-C4 significa alquilo C1-C4 sustituido con un grupo hidroxi. Los ejemplos específicos del mismo incluyen [N,N-di(2-hidroxietil)amino]etoxi.
En la presente invención, "[N-((alcoxi C1-C3)carbonil)alquil C1-C3-N-(alquil C1-C3)amino]alcoxi C1-C4” significa alcoxi C1-C4 sustituido con N-((alcoxi C1-C3)carbonil)alquil C1-C3-N-(alquil C1-C3)amino. [N-((alcoxi C1-C3)carbonil)alquil C1-C3-N-(alquil C1-C3)amino] significa amino sustituido con ((alcoxi C1-C3)carbonil)alquilo C1-C3 y alquilo C1-C3. "((Alcoxi C1-C3)carbonil)alquilo C1-C3” significa alquilo C1-C3 sustituido con (alcoxi C1-C3)carbonilo. Los ejemplos específicos del mismo incluyen [N-((metoxi)carbonil)metil-N-metilamino]etoxi.
En la presente invención, "[N-(hidroxi)alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4” significa alcoxi C1-C4 sustituido con N-(hidroxi)alquil C1-C4-N-(alquil C1-C3)amino. "N-(hidroxi)alquil C1-C4-N-(alquil C1-C3)amino” significa amino sustituido con (hidroxi)alquilo C1-C4 y alquilo C1-C3. "(Hidroxi)alquilo C1-C4” significa alquilo C1-C4 sustituido con un grupo hidroxi. Los ejemplos específicos del mismo incluyen [N-(2-hidroxietil)-N-metilamino]etoxi.
En la presente invención, "[N,N-di((alcoxi C1-C3)alquil C1-C4)amino]alcoxi C1-C6” significa alcoxi C1-C6 sustituido con N,N-di((alcoxi C1-C3)alquil C1-C4)amino. "N,N-di((alcoxi C1-C3)alquil C1-C4)amino” significa amino sustituido con dos grupos (alcoxi C1-C3) alquilo C1-C4. "(Alcoxi C1-C3)alquilo C1-C4” se define como antes. Los ejemplos específicos del mismo incluyen [N,N-di((metoxi)etoxi)amino]etoxi.
En la presente invención, "[N,N-di(alquil C1-C3)amino]alcoxi C1-C6” significa alcoxi C1-C6 sustituido con N,N-di(alquil C1-C3)amino. "N,N-di(alquil C1-C3)amino” significa amino sustituido con dos grupos alquilo C1-C3. "Alcoxi C1-C6” y “alquilo C1-C3" se definen como antes. Los ejemplos específicos del mismo incluyen 3-[N,N-di(metil)amino]-2,2-dimetil-propoxi.
En la presente invención, "[N-[N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4” significa alcoxi C1-C4 sustituido con N-[N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquil C1-C4-N-(alquil C1-C3)amino. Alcoxi C1-C4 se define como antes. "N-[N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquil C1-C4-N-(alquil C1-C3)amino” significa amino sustituido con [N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquilo C1-C4 y alquilo C1-C3. Alquilo C1-C3 se define como antes. "[N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquilo C1-C4” significa alquilo C1-C4 sustituido con N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino. "N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino” significa amino sustituido con (alquil C1-C4)carbonilo y alquilo C1-C3. Los ejemplos específicos del mismo incluyen 2-[N-[2-(N-acetil-N-(metil)amino)etil]-N-(metil)amino]etoxi.
En la presente invención, "[N-[N-(alquil C1-C4)carbonil-amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4” significa alcoxi C1-C4 sustituido con N-[N-(alquil C1-C4)carbonil-amino]alquil C1-C4-N-(alquil C1-C3)amino. Alcoxi C1-C4 se define como antes. "N-[N-(alquil C1-C4)carbonil-amino]alquil C1-C4-N-(alquil C1-C3)amino” significa amino sustituido con [N-(alquil C1-C4)carbonil-amino] alquilo C1-C4 y alquilo C1-C3. Alquilo C1-C3 se define como antes. "[N-(alquil C1-C4)carbonil-amino]alquilo C1-C4” significa alquilo C1-C4 sustituido con un N-(alquil C1-C4)carbonil-amino. "N-(alquil C1-C4)carbonil-amino” significa amino sustituido con un (alquil C1-C4)carbonilo. Los ejemplos específicos del mismo incluyen 2-[N-[2-(acetilamino)etil]-N-(metil)amino]etoxi.
En la presente invención, "(alquil C1-C3)tio” significa un grupo (alquil C1-C3)-S-. En este contexto, alquilo C1-C3 se define como antes. Los ejemplos específicos del mismo incluyen metiltio, etiltio, n-propiltio e i-propiltio.
En la presente invención, "(alquil C1-C4)tio” significa un grupo (alquil C1-C4)-S-. En este contexto, alquilo C1-C4 se define como antes. Los ejemplos específicos del mismo incluyen metiltio, etiltio, n-propiltio, i-propiltio, n-butiltio, ibutiltio y t-butiltio.
En la presente invención, "(morfolino)(alquil Ci-C4)tio” significa (alquil Ci-C4)tio sustituido con morfolino. (alquil Ci-C4)tio se define como antes. Los ejemplos específicos del mismo incluyen morfolinometiltio, morfolinoetiltio, morfolino-n-propiltio, morfolino-i-propiltio, morfolino-n-butiltio, morfolino-i-butiltio y morfolino-t-butiltio. Los ejemplos preferidos del mismo incluyen morfolinoetiltio.
En la presente invención, "(heterocicloalquil de 5 o 6 miembros)(alquil C1-C4)tio” significa (alquil C1-C4)tio sustituido con heterocicloalquilo de 5 o 6 miembros. Heterocicloalquilo de 5 o 6 miembros y (alquil C1-C4)tio se definen como en la presente memoria. "(Heterocicloalquilo de 5 o 6 miembros)(alquil C1-C4)tio” incluye “(morfolino)(alquil C1-C4)tio". Los ejemplos preferidos del mismo incluyen 2-morfolinoetiltio.
En la presente invención, "(alquil C1-C6)carbonilo” significa un grupo (alquil C1-C6)-C(O)-. En este contexto, alquilo C1-C6 se define como antes. "(Alquil C1-C6)carbonilo” incluye “(alquil C1-C4)carbonilo". Los ejemplos específicos del mismo incluyen metilcarbonilo, etilcarbonilo, n-propilcarbonilo, i-propilcarbonilo, n-butilcarbonilo, i-butilcarbonilo, secbutilcarbonilo, t-butilcarbonilo, 1-metilpropilcarbonilo, n-pentilcarbonilo, isopentilcarbonilo, 2-metilbutilocarbonilo, 1,1-dimetilpropilcarbonilo, 1-etilpropilcarbonilo, hexilcarbonilo, 4-metilpentilcarbonilo y 2-etilbutilcarbonilo.
En la presente invención, "di(alquil C1-C3 )amino)carbonilo” significa carbonilo sustituido con di(alquil C1-C3 )amino. "Di(alquil C1-C3 )amino” significa amino sustituido con dos grupos alquilo C1-C3. Los ejemplos específicos del mismo incluyen dimetilaminocarbonilo y dietilaminocarbonilo.
En la presente invención, "(alquil C1-C3 )sulfonilo” significa un grupo (alquil C1-C3 )-SO2-. En este contexto, alquilo C1-C3 se define como antes. Los ejemplos específicos del mismo incluyen metilsulfonilo, etilsulfonilo y n-propilsulfonilo. Los ejemplos preferidos del mismo incluyen metilsulfonilo.
En la presente invención, "(alcoxi C1-C6)carbonilo” significa un grupo (alquil C1-C6)-O-C(O)-. En este contexto, alquilo C1-C6 se define como antes. Los ejemplos específicos del mismo incluyen grupos enumerados más adelante en la definición de "(alcoxi C1-C4)carbonilo ", así como n-pentiloxicarbonilo, isopentiloxicarbonilo, 2-metilbutoxicarbonilo, 1,1-dimetilpropoxicarbonilo, 1-etilpropoxicarbonilo, hexiloxicarbonilo, 4-metilpentiloxicarbonilo y 2-etilbutoxicarbonilo. En la presente invención, "(alcoxi C1-C4)carbonilo” significa un grupo (alquil C1-C4)-O-C(O)-. En este contexto, alquilo C1-C4 se define como antes. Los ejemplos específicos del mismo incluyen metoxicarbonilo, etoxicarbonilo, npropoxicarbonilo, i-propoxicarbonilo, n-butoxicarbonilo, i-butoxicarbonilo, sec-butoxicarbonilo, t-butoxicarbonilo y 1-metilpropoxicarbonilo.
En la presente invención, "(alcoxi C1-C3)carbonilo” significa un grupo (alquil C1-C3)-O-C(O)-. En este contexto, alquilo C1-C3 se define como antes. Los ejemplos específicos del mismo incluyen metoxicarbonilo, etoxicarbonilo, npropoxicarbonilo e i-propoxicarbonilo.
En la presente invención, "((alcoxi C1-C4)carbonil)alquilo C1-C6” significa alquilo C1-C6 sustituido con (alcoxi C1-C4)carbonilo. En este contexto, (alcoxi C1-C4)carbonilo y alquilo C1-C6 se definen como antes. Los ejemplos específicos del mismo incluyen metoxicarbonilmetilo, metoxicarboniletilo, etoxicarbonilmetilo, etoxicarboniletilo, npropoxicarbonilmetilo e i-propoxicarbonilmetilo. Los ejemplos preferidos del mismo incluyen metoxicarbonilmetilo y metoxicarboniletilo.
En la presente invención, "((alcoxi C1-C3)carbonil)alcoxi C1-C3” significa alcoxi C1-C3 sustituido con un grupo (alcoxi C1-C3)carbonilo. En este contexto, (alcoxi C1-C3)carbonilo y alquilo C1-C3 se definen como antes. Los ejemplos específicos del mismo incluyen metoxicarbonilmetoxi, metoxicarboniletoxi, etoxicarbonilmetoxi, etoxicarboniletoxi, npropoxicarbonilmetoxi e i-propoxicarbonilmetoxi. Los ejemplos preferidos del mismo incluyen metoxicarbonilmetoxi y metoxicarboniletoxi.
En la presente invención, "arilo C6-C10” significa un grupo de anillo hidrocarbonado aromático monovalente. Los ejemplos de arilo C6-C10 incluyen fenilo, 1 -naftilo y 2-naftilo.
En la presente invención, "(aril C6-C10)carbonilo” significa un grupo (aril C6-C10)-C(O)-. En este contexto, arilo C6-C10 se define como antes. Los ejemplos específicos del mismo incluyen fenilcarbonilo, 1-naftilcarbonilo y 2-naftilcarbonilo.
En la presente invención, "heteroarilo de 5 a 10 miembros" significa un grupo anular aromático compuesto de 5 a 10 átomos que constituyen el anillo que contiene uno o varios (p. ej., de 1 a 5, preferiblemente de 1 a 3) heteroátomos. El anillo puede ser un anillo monocíclico o bicíclico. Los ejemplos de "heteroarilo de 5 a 10 miembros" incluyen "heteroarilo de 5 o 6 miembros". Entre los ejemplos específicos de "heteroarilo de 5 a 10 miembros" se incluyen tienilo, piridazinilo, pirazinilo, tiazolilo, oxazolilo, isotiazolilo, tiadiazolilo, oxadiazolilo, isoxazolilo, pirazolilo, quinolinilo, isoquinolilo, benzotiazolilo, benzoxazolilo, benzimidazolilo, piridinilo, pirimidinilo, indolilo, imidazolilo, furilo, tioxazolilo,
pirrolilo, tetrazolilo, oxopirimidinilo, naftilo, benzodioxinilo, benzisoxazolilo, benzisotiazolilo, indazolilo, benzotienilo, benzofuranilo, benzopiranilo y triazolilo.
En la presente invención, "heteroarilo de 5 o 6 miembros" significa un grupo anular aromático compuesto de 5 o 6 átomos que constituyen el anillo que contienen uno o varios (por ejemplo, 1 a 4, preferiblemente 1 a 3, más preferiblemente 1 o 2) heteroátomos Los ejemplos específicos del mismo incluyen tienilo, piridazinilo, pirazinilo, tiazolilo, oxazolilo, isotiazolilo, tiadiazolilo, oxadiazolilo, isoxazolilo, pirazolilo, piridinilo, pirimidinilo, furilo, tioxazolilo y triazolilo.
En la presente invención, un "anillo carbocíclico saturado C3-C6” se refiere a un anillo de cicloalcano que tiene 3 a 6 átomos de carbono constituyentes del anillo e incluye, por ejemplo, ciclopropano, ciclobutano, ciclopentano y ciclohexano. En la fórmula (I), R1 y R5 junto con el átomo de carbono al que están anclados pueden formar un anillo carbocíclico saturado C3-C6 En este caso, el anillo carbocíclico saturado C3-C6 forma un anillo espiro. En la fórmula (I) , el anillo carbocíclico saturado C3-C6 formado por R1 y R5 junto con el átomo de carbono al que están anclados es preferiblemente ciclobutano, ciclopentano o ciclohexano, particularmente preferiblemente ciclobutano o ciclopentano. En la presente invención, un "anillo heterocíclico saturado de 5 a 8 miembros" significa un grupo heterocíclico saturado compuesto de 5 a 8 átomos constituyentes del anillo que contiene un N como heteroátomo. Los ejemplos específicos del mismo incluyen pirrolidina, piperidina, azepano y azocano y particularmente incluyen pirrolidina y piperidina.
En la presente invención, n es preferiblemente un número entero seleccionado entre 1 y 3, particularmente preferiblemente 1 o 2.
Cuando Re (o Rx) es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra (o Ry) o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra (o Ry), el arilo C6-C10 es preferiblemente fenilo, y el heteroarilo de 5 a 10 miembros es preferiblemente indolilo. Particularmente, cuando R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados no forman un anillo heterocíclico saturado de 5 a 8 miembros, Re es preferiblemente fenilo.
En la presente invención, Ar1 (o Ar101) Es preferiblemente fenilo, naftilo, furilo, tienilo, piridazinilo, pirazinilo, tiazolilo, oxazolilo, isotiazolilo, tiadiazolilo, oxadiazolilo, isoxazolilo, pirazolilo, quinolinilo, isoquinolilo, benzotiazolilo, benzoxazolilo, benzimidazolilo, piridinilo, pirimidinilo, o indolilo. Estos grupos están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb (o Rz1), Rc (o Rz2) y Rd (o Rz3). Cuando R4 y R5 junto con el átomo de carbono al que están anclados forman un anillo heterocíclico saturado de 5 a 8 miembros o, en el caso del compuesto representado por la fórmula (II), Ar1 (o Ar101) es más preferiblemente fenilo, furilo, piridinilo o pirimidinilo.
Cuando R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados no forman un anillo heterocíclico saturado de 5 a 8 miembros, Ar1 es preferiblemente fenilo, piridinilo o pirimidinilo.
En la presente invención, Rd (o Rz3) Es preferiblemente fenilo, tienilo, piridinilo, pirimidinilo, quinolinilo, pirazolilo, imidazolilo, isoxazolilo, oxazolilo, tiazolilo, isotiazolilo, piridazinilo, pirazinilo, furilo, tiadiazolilo, tioxazolilo, oxadiazolilo, pirrolilo, tetrazolilo, oxopirimidinilo, naftilo, benzodioxinilo, isoquinolinilo, benzoxazolilo, benzotiazolilo, benzisoxazolilo, benzisotiazolilo, indolilo, indazolilo, benzotienilo, benzofuranilo, benzopiranilo, piperazinilo, piperidilo, morfolinilo, tiomorfolinilo, pirrolidinilo, dioxopirrolidinilo, dioxopiperidinilo, dioxotetrahidropirimidinilo, oxoimidazolidinilo, o dioxoimidazolidinilo. Estos grupos están cada uno opcionalmente sustituidos con uno o más sustituyentes R14. Cuando R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados forman un anillo heterocíclico saturado de 5 a 8 miembros o, en el caso del compuesto representado por la fórmula (II) , Rd (o Rz3) es preferiblemente fenilo, tienilo, piridinilo, pirimidinilo, quinolinilo, piperidinilo, morfolinilo, tiomorfolinilo o piperazinilo, más preferiblemente fenilo, tienilo, piridinilo, pirimidinilo, quinolinilo o piperidinilo. Cuando R4 y R5 junto con el átomo de carbono y el átomo de nitrógeno al que están anclados no forman un anillo heterocíclico saturado de 5 a 8 miembros, Rd (o Rz3) es preferiblemente fenilo, piridinilo, pirimidinilo, morfolinilo, tiomorfolinilo, piperidinilo o piperazinilo, más preferiblemente fenilo, piridinilo o pirimidinilo.
En la presente invención, "cicloalquilo C3-C6” significa un grupo hidrocarbonado alifático saturado cíclico que tiene de 3 a 6 átomos de carbono. Los ejemplos específicos del mismo incluyen ciclopropilo, ciclobutilo, ciclopentilo y ciclohexilo.
En la presente invención, "cicloalquilo C3-C7” significa un grupo hidrocarbonado alifático saturado cíclico que tiene de 3 a 7 átomos de carbono. Los ejemplos específicos del mismo incluyen ciclopropilo, ciclobutilo, ciclopentilo, ciclohexilo y cicloheptilo.
En la presente invención, "heterocicloalquilo de 3 a 10 miembros" significa un grupo heterocíclico saturado
compuesto de 3 a 10 átomos constituyentes del anillo que contienen de uno a tres heteroátomos seleccionados entre O, S y N. El heterocicloalquilo puede ser monocíclico, bicíclico, o heterocicloalquilo espirocíclico. Los ejemplos específicos de "heterocicloalquilo de 3 a 10 miembros" incluyen los grupos enumerados más adelante en la definición de "heterocicloalquilo de 4 a 10 miembros", así como oxiranilo.
En la presente invención, "heterocicloalquilo de 4 a 10 miembros" significa un grupo heterocíclico saturado compuesto de 4 a 10 átomos que constituyen el anillo que contiene de uno a tres heteroátomos seleccionados entre O, S y N. El heterocicloalquilo puede ser heterocicloalquilo monocíclico, bicíclico o espirocíclico. Los ejemplos de "heterocicloalquilo de 4 a 10 miembros" incluyen "heterocicloalquilo de 5 a 10 miembros", "heterocicloalquilo de 5 a 8 miembros", "heterocicloalquilo de 6 a 8 miembros" y " heterocicloalquilo de 5 o 6 miembros". Los ejemplos específicos de "heterocicloalquilo de 4 a 10 miembros" incluyen grupos enumerados más adelante en la definición de "heterocicloalquilo de 5 a 10 miembros", así como oxetanilo, azetidinilo y 3,7-dioxa-9-azabiciclo[3,3,1]nonanilo. En la presente invención, "heterocicloalquilo de 5 a 10 miembros" significa un grupo heterocíclico saturado compuesto de 5 a 10 átomos constituyentes del anillo que contienen de uno a tres heteroátomos seleccionados entre O, S y N. El heterocicloalquilo puede ser heterocicloalquilo monocíclico, bicíclico, o espirocíclico. Los ejemplos de "heterocicloalquilo de 5 a 10 miembros" incluyen "heterocicloalquilo de 6 a 8 miembros" y "heterocicloalquilo de 5 a 6 miembros". Los ejemplos específicos de "heterocicloalquilo de 5 a 10 miembros" incluyen piperazinilo, piperidinilo, morfolinilo, tiomorfolinilo, pirrolidinilo, tetrahidropiranilo, tetrahidrofuranilo, 2-oxa-6-azaespiro[3,3]heptilo, 2-azaespiro[3,3]heptilo, 2,6-diazaespiro[3,3]heptilo, y 2-tia-6-azaespiro[3,3]heptilo.
En la presente invención, "heterocicloalquilo de 4 a 8 miembros" significa un grupo heterocíclico saturado compuesto de 4 a 8 átomos constituyentes del anillo que contienen de uno a tres heteroátomos seleccionados entre O, S y N. El heterocicloalquilo puede ser heterocicloalquilo monocíclico, bicíclico, o espirocíclico. Los ejemplos específicos de "heterocicloalquilo de 4 a 8 miembros" incluyen los descritos como ejemplos específicos de "heterocicloalquilo de 5 a 8 miembros".
En la presente invención, "heterocicloalquilo de 5 a 8 miembros" significa un grupo heterocíclico saturado compuesto de 5 a 8 átomos constituyentes del anillo que contienen de uno a tres heteroátomos seleccionados entre O, S y N. El heterocicloalquilo puede ser heterocicloalquilo monocíclico, bicíclico, o espirocíclico. Los ejemplos de "heterocicloalquilo de 5 a 8 miembros" incluyen "heterocicloalquilo de 6 a 8 miembros" y "heterocicloalquilo de 5 a 6 miembros". Los ejemplos específicos de "heterocicloalquilo de 5 a 8 miembros" incluyen los descritos como ejemplos específicos de "heterocicloalquilo de 6 a 8 miembros".
En la presente invención, "heterocicloalquilo de 6 a 8 miembros" significa un grupo heterocíclico saturado compuesto de 6 a 8 átomos constituyentes del anillo que contienen de uno a tres heteroátomos seleccionados entre O, S y N. El heterocicloalquilo puede ser heterocicloalquilo monocíclico, bicíclico, o espirocíclico. Los ejemplos específicos del mismo incluyen piperazinilo, piperidinilo, morfolinilo, tiomorfolinilo, tetrahidrofuranilo, 2-oxa-6-azaespiro[3,3]heptilo, 2-azaespiro[3,3]heptilo, 2,6-diazaespiro[3,3]heptilo y 2-tia-6-azaespiro[3,3]heptilo y particularmente incluyen 2-oxo-6-azaespiro[3,3]heptilo, 2-azaespiro[3,3]heptilo, 2,6-diazaespiro[3,3]heptilo y 2-tia-6-azaespiro[3,3]heptilo
En la presente invención, "heterocicloalquilo de 3 a 6 miembros" significa un grupo heterocíclico saturado compuesto de 3 a 6 átomos que constituyen el anillo que contiene de uno a tres heteroátomos seleccionados entre O, S y N. Los ejemplos específicos del mismo incluyen los grupos enumerados más adelante en la definición de "heterocicloalquilo de 5 o 6 miembros", así como oxetanilo.
En la presente invención, "heterocicloalquilo de 4 a 6 miembros" significa un grupo heterocíclico saturado compuesto de 4 a 6 átomos constituyentes de anillo que contienen de uno a tres heteroátomos seleccionados entre O, S y N. Los ejemplos específicos del mismo incluyen los grupos enumerados más adelante en la definición de "heterocicloalquilo de 5 o 6 miembros".
En la presente invención, "heterocicloalquilo de 5 o 6 miembros" significa un grupo heterocíclico saturado compuesto de 5 o 6 átomos que constituyen el anillo que contiene de uno a tres heteroátomos seleccionados entre O, S y N. Los ejemplos específicos del heterocicloalquilo incluyen piperazinilo, piperidinilo, morfolinilo, tiomorfolinilo, pirrolidinilo, tetrahidropiranilo y tetrahidrofuranilo.
En la presente invención, "oxacicloalquilo de 3 a 6 miembros" significa un grupo heterocíclico saturado compuesto de 3 a 6 átomos que constituyen el anillo que contiene uno o dos átomos de oxígeno. Los ejemplos específicos del mismo incluyen oxetanilo, tetrahidrofuranilo y tetrahidropiranilo.
En la presente invención, "heterocicloalquiloxi de 3 a 10 miembros" significa un grupo heterocicloalquil-O- de 3 a 10 miembros. En este contexto, el heterocicloalquilo de 3 a 10 miembros se define como antes. Los ejemplos específicos del mismo incluyen oxiraniloxi, oxetaniloxi, tetrahidrofuraniloxi y tetrahidropiraniloxi. Se prefiere el tetrahidropiraniloxi.
En la presente invención, "heterocicloalquiloxi de 5 a 10 miembros" significa un grupo heterocicloalquil-O- de 5 a 10 miembros. En este contexto, el heterocicloalquilo de 5 a 10 miembros se define como antes. "Heterocicloalquiloxi de 5 a 10 miembros" es preferiblemente tetrahidropiraniloxi o tetrahidrofuraniloxi, particularmente preferiblemente tetrahidropiraniloxi.
En la presente invención, "heterocicloalquiloxi de 4 a 6 miembros" significa un grupo heterocicloalquil-O- de 4 a 6 miembros. En este contexto, el heterocicloalquilo de 4 a 6 miembros se define como antes.
En la presente invención, "heterocicloalquiloxi de 5 o 6 miembros" significa un grupo heterocicloalquil-O- de 5 o 6 miembros. En este contexto, el heterocicloalquilo de 5 o 6 miembros se define como antes.
En la presente invención, "heterocicloalquiloxi de 3 a 6 miembros" significa un grupo heterocicloalquil-O- de 3 a 6 miembros. En este contexto, el heterocicloalquilo de 3 a 6 miembros se define como antes.
En la presente invención, "heterocicloalquilo de 3 a 10 miembros", "heterocicloalquilo de 4 a 10 miembros", "heterocicloalquilo de 5 a 10 miembros", "heterocicloalquilo de 5 a 8 miembros", "heterocicloalquilo de 6 a 8 miembros” , “heterocicloalquilo de 4 a 8 miembros”, “heterocicloalquilo de 3 a 6 miembros”, “heterocicloalquilo de 5 a 6 miembros”, “heterocicloalquiloxi de 5 a 10 miembros”, “heterocicloalquiloxi de 3 a 6 miembros”, “heterocicloalquiloxi de 5 o 6 miembros", o "heterocicloalquiloxi que contiene nitrógeno de 4 a 6" pueden estar sustituidos con uno o varios sustituyentes predeterminados. En este caso, los sustituyentes se añaden a cada uno de estos grupos a través de un átomo de carbono o un heteroátomo que constituye el anillo del heterocicloalquilo o del heterocicloalquiloxi.
Cuando Re (o Rx) es un heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra (o Ry), este grupo contiene, por ejemplo, de uno a tres átomos de nitrógeno como grupos que constituyen el anillo. Cuando Ra (o Ry) es heterocicloalquiloxi de 5 a 10 miembros, heterocicloalquiloxi de 3 a 6 miembros o heterocicloalquiloxi de 4 a 6 miembros, este grupo contiene, por ejemplo, de uno a tres átomos de oxígeno o un átomo de nitrógeno como grupos que constituyen el anillo. Los ejemplos del grupo heterocicloalquiloxi incluyen tetrahidropiraniloxi, oxetaniloxi, pirrolidiniloxi, azetidiniloxi y piperidiniloxi.
Cuando R10 (o R110) es heterocicloalquilo de 3 a 10 miembros, heterocicloalquilo de 4 a 10 miembros, heterocicloalquilo de 5 a 10 miembros, heterocicloalquilo de 3 a 6 miembros o heterocicloalquilo de 5 o 6 miembros, este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un átomo de nitrógeno, un átomo de oxígeno y un átomo de azufre, preferiblemente un átomo de nitrógeno y un átomo de oxígeno, como grupos que constituyen el anillo. Cuando R10 (o R110) es heterocicloalquilo de 3 a 10 miembros, heterocicloalquilo de 4 a 10 miembros, heterocicloalquilo de 5 a 10 miembros, heterocicloalquilo de 3 a 6 miembros o heterocicloalquilo de 5 a 6 miembros, este grupo es preferiblemente morfolinilo, homomorfolinilo, tiomorfolinilo, piperidinilo, piperazinilo, homopiperazinilo, pirrolidinilo, azetidinilo, tetrahidropiranilo o tetrahidrofuranilo, más preferiblemente morfolinilo. Estos grupos están cada uno opcionalmente sustituidos con los sustituyentes descritos como sustituyentes para el grupo heterocicloalquilo correspondiente.
Cuando R11 (o R111) es heterocicloalquilo de 3 a 10 miembros, heterocicloalquilo de 4 a 10 miembros, heterocicloalquilo de 5 a 10 miembros o heterocicloalquilo de 5 o 6 miembros, este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un nitrógeno átomo y un átomo de oxígeno como grupos que constituyen el anillo.
Cuando R11 (o R111) es cicloalquilo C3-C6 , heterocicloalquilo de 3 a 10 miembros, heterocicloalquilo de 4 a 10 miembros, heterocicloalquilo de 5 a 10 miembros o heterocicloalquilo de 5 o 6 miembros, este grupo es preferiblemente ciclopentilo, morfolinilo, pirrolidinilo, homomorfolinilo, tiomorfolinilo, piperidinilo, piperazinilo, homopiperazinilo, tetrahidropiranilo o tetrahidrofuranilo, más preferiblemente ciclopentilo, morfolinilo o pirrolidinilo. Estos grupos están cada uno opcionalmente sustituidos con los sustituyentes descritos como sustituyentes para el grupo cicloalquilo o heterocicloalquilo correspondiente.
Cuando R12 (o R112) es heterocicloalquilo de 3 a 10 miembros, heterocicloalquilo de 4 a 10 miembros, heterocicloalquilo de 5 a 10 miembros, heterocicloalquilo de 3 a 6 miembros o heterocicloalquilo de 5 o 6 miembros, este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un átomo de nitrógeno, un átomo de oxígeno y un átomo de azufre, preferiblemente un átomo de nitrógeno y un átomo de oxígeno como grupos que constituyen el anillo.
Cuando R12 (o R112) es un heteroarilo de 5 a 10 miembros o un heteroarilo de 5 o 6 miembros, este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un átomo de nitrógeno, un átomo de oxígeno y un átomo de azufre, preferiblemente un átomo de nitrógeno y un átomo de oxígeno como grupos que constituyen el
anillo. Más preferiblemente, este grupo contiene un átomo de nitrógeno como heteroátomo.
Cuando R12 (o R112) es heterocicloalquilo de 3 a 10 miembros, heterocicloalquilo de 4 a 10 miembros, heterocicloalquilo de 5 a 10 miembros, heterocicloalquilo de 3 a 6 miembros, heterocicloalquilo de 5 a 6 miembros, heteroarilo de 5 a 10 miembros o heteroarilo de 5 o 6 miembros, este grupo es preferiblemente morfolinilo, tetrahidrofuranilo, tetrahidropiranilo, pirrolidinilo, piperidinilo, piperazinilo, azetidinilo, tiomorfolinilo, oxetanilo, piridinilo o 1,2,4-triazolilo, más preferiblemente morfolinilo, tetrahidrofuranilo, piridinilo, o 1,2,4-triazolilo. Cada uno de estos grupos está opcionalmente sustituido con el sustituyente o los sustituyentes descritos como sustituyentes para el grupo heterocicloalquilo o heteroarilo correspondiente.
Cuando R13 (o R113) es heterocicloalquilo de 3 a 10 miembros, heterocicloalquilo de 4 a 10 miembros, heterocicloalquilo de 5 a 10 miembros o heterocicloalquilo de 5 o 6 miembros, este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un nitrógeno átomo, un átomo de oxígeno y un átomo de azufre, preferiblemente un átomo de nitrógeno y un átomo de oxígeno como grupos que constituyen el anillo.
Cuando R13 (o R113) es heterocicloalquilo de 4 a 10 miembros, heterocicloalquilo de 5 a 10 miembros o heterocicloalquilo de 5 o 6 miembros, este grupo es preferiblemente morfolinilo, homomorfolinilo, tiomorfolinilo, piperidinilo, piperazinilo, homopiperazinilo, pirrolidinilo, azetidinilo o tetrahidropiranilo más preferiblemente morfolinilo. Estos grupos están cada uno opcionalmente sustituidos con el sustituyente o los sustituyentes descritos como sustituyentes para el grupo heterocicloalquilo correspondiente.
Cuando R10 (o R110), R11 (o R111), R12 (o R112), R13 (o R113) o R15 (o R115) es cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 3 a 10 miembros, heterocicloalquilo de 3 a 8 miembros, heterocicloalquilo de 5 o 6 miembros (cada uno de estos grupos heterocicloalquilo está opcionalmente sustituido con uno o más sustituyentes seleccionados entre los sustituyentes descritos como sustituyentes para el grupo heterocicloalquilo correspondiente, tales como oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo C1-C4 está opcionalmente sustituido con uno o más grupos hidroxi)), o heteroarilo de 5 a 10 miembros, este grupo cicloalquilo es preferiblemente ciclopentilo, ciclohexilo o ciclobutilo (cada uno de estos grupos está opcionalmente sustituido con uno o más grupos hidroxi); este grupo heterocicloalquilo es preferiblemente tetrahidrofuranilo, pirrolidinilo, morfolinilo, homomorfolinilo, tiomorfolinilo, piperidinilo, piperazinilo, homopiperazinilo, azetidinilo o tetrahidropiranilo (cada uno de estos grupos está opcionalmente sustituido con uno o más de los sustituyentes descritos anteriormente); y este grupo heteroarilo es preferiblemente piridinilo, pirimidinilo, piridazinilo, pirazinilo, 1,2,4-triazolilo. El grupo cicloalquilo es más preferiblemente ciclopentilo (este grupo está opcionalmente sustituido con uno o más grupos hidroxi); el grupo heterocicloalquilo es más preferiblemente tetrahidrofuranilo, pirrolidinilo o morfolinilo (cada uno de estos grupos está opcionalmente sustituido con uno o más de los sustituyentes descritos anteriormente); y el grupo heteroarilo es más preferiblemente piridinilo.
Cuando Ar1 (o Ar101) es un heteroarilo de 5 a 10 miembros o un heteroarilo de 5 a 6 miembros, este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un átomo de nitrógeno, un átomo de oxígeno y un átomo de azufre como grupos que forman el anillo. Ar1 (o Ar101) está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb (o Rz1; lo mismo se verifica para la descripción siguiente), Rc (o Rz2; lo mismo se verifica para la descripción siguiente) y Rd (o Rz3; lo mismo se verifica para la descripción siguiente), es decir, opcionalmente sustituido con Rb, Rc o Rd, con Rb y Rc, Rc y Rd, o Rb y Rd, o con Rb, Rc y Rd.
Cuando Rd (o Rz3) es un heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14 (o R114), este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un átomo de nitrógeno, un átomo de oxígeno y un átomo de azufre, como grupos que constituyen el anillo.
Cuando Rd (o Rz3) es heteroarilo de 5 a 10 miembros o heteroarilo de 5 a 6 miembros opcionalmente sustituido con uno o más sustituyentes R14 (o R114), este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un átomo de nitrógeno y un átomo de azufre como grupos que constituyen el anillo.
Cuando R14 (o R114; lo mismo se verifica para la descripción siguiente) es un heterocicloalquilo de 5 a 10 miembros, este grupo contiene, por ejemplo, de uno a tres heteroátomos seleccionados entre un átomo de nitrógeno y un átomo de oxígeno como grupos que constituyen el anillo. Cuando R14 es heterocicloalquilo de 5 a 10 miembros, este grupo es preferiblemente 2-oxa-6-azaespiro[3,3]heptilo, 2-azaespiro[3,3]heptilo, 2,6-diazaespiro[3,3]heptilo o 2-tia-6-azaespiro[3,3]heptilo, particularmente preferiblemente 2-oxa-6-azaespiro[3,3]heptilo.
Cuando Re (o Rx) es arilo C6-C10 (por ejemplo, fenilo) opcionalmente sustituido con uno o más sustituyentes Ra (o Ry) o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra (o Ry), este grupo está sustituido, por ejemplo, con 1 a 4 sustituyentes Ra (o Ry), preferiblemente 1 a 3 sustituyentes Ra (o Ry).
Cuando R10 (o R110; lo mismo se verifica para la descripción siguiente), R11 (o R111; lo mismo se verifica para la descripción siguiente), R12 (o R112; lo mismo se verifica para la descripción siguiente), R13 (o R113; lo mismo se verifica para la descripción siguiente), o R15 (o R115; lo mismo se verifica para la descripción siguiente) es alcoxi C1C6 opcionalmente sustituido con uno o más grupos hidroxi, este grupo está sustituido, por ejemplo, con 1 a 5 grupos hidroxi, preferiblemente 1 a 4 grupos hidroxi.
Cuando R10, R11, R12, R13 o R15 es un heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más grupos oxo, este grupo está sustituido, por ejemplo, con 1 a 3 grupos oxo, preferiblemente 1 o 2 grupos oxo.
Cuando R10, R11, R12, R13o R15 es cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, este grupo está sustituido, por ejemplo, con 1 a 3 grupos hidroxi, preferiblemente 1 o 2 grupos hidroxi.
Cuando Rb, Rc o Rd es heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, este grupo está sustituido, por ejemplo, con 1 a 4 sustituyentes R14, preferiblemente de 1 a 3 sustituyentes R14.
Cuando R4 es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg, este grupo arilo C6-C10 es preferiblemente fenilo.
En el grupo -NR39R40, R39 es preferiblemente un átomo de hidrógeno o alquilo C1-C3, más preferiblemente metilo. R40 es preferiblemente alquilo C1-C3 , alquilo C1-C4 sustituido con alcoxi C1-C3 , un grupo
-CH((CH2)v1COOR57)-(CH2)v2-COOR57, heterocicloalquilo de 4 a 6 miembros, un grupo -(CH2V S O 3H, o un grupo -(CH2)x1-CH(COOH)-(CH2)x2-SO3H, más preferiblemente metoxietilo, 2-metoxi-1,1-dimetiletilo, 2-metoxi-2-metil-1-propilo, un grupo -C2H3-(COOH)2, un grupo -C3H5-(COOH)2, oxetanilo, metilo, un grupo -C2H4-SO3 H, o un grupo -CH(COOH)-CH2-SO3H. Los ejemplos del grupo -NR39R40 incluyen N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino. En este contexto, "[N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]” se define como antes. El grupo -NR39R40 es preferiblemente N-(2-metoxietil)-N-(metil)amino, [N-(2-metoxi-1,1-dimetiletil)-N-(metil)amino]etoxi, [N-(2-metoxi-2,2-dimetiletil)-N-(metil)amino]etoxi, un grupo -NH-CH(c Oo H)-CH2(COOH), un grupo -NH-CH(CH2c Oo H)-CH2COOH, N-oxetanil-N-metilamino, dimetilamino, un grupo -NH-C2 H4-SO3H, o un grupo -NH-CH(Co OH)-CH2-SO3H.
En el grupo -(O(CH2)q1)q2-NR41R42, q1 es preferiblemente 2, y q2 es preferiblemente un número entero seleccionado entre 2 a 5. R41 es preferiblemente un átomo de hidrógeno o metilo, y R42 es preferiblemente alquilo C1-C6 (preferiblemente n-hexilo) sustituido con 1 a 5 grupos hidroxi (preferiblemente 5 grupos hidroxi) o metoxietilo.
En el grupo -(O(CH2)r1)r2-C(O)NR43R44, r1 es preferiblemente 2 o 3, y r2 es preferiblemente 1. R43 es preferiblemente metilo. R44 es preferiblemente alquilo C1-C6 (preferiblemente n-hexilo) sustituido con 1 a 5 grupos hidroxi (preferiblemente 5 grupos hidroxi).
El compuesto de la fórmula (I) en donde R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 se puede representar mediante la siguiente fórmula (I-a) o (I-b):
[Fórmula 9]
El grupo -(CH2)q- en donde q es 0 significa un enlace sencillo.
En la presente invención, el compuesto de la fórmula (I) en donde R3 es alquilo C1-C4 sustituido con Re, que se puede representar mediante la fórmula (I-c) que se muestra a continuación. En la presente invención, el compuesto de la fórmula (I) en donde R3 es alquilo C1-C4 sustituido con Re, Re está sustituido con uno a tres sustituyentes Ra, y el uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk se puede representar mediante la fórmula (Id) que se muestra a continuación.
[Fórmula 10]
En la fórmula (I-c), ni es un número entero seleccionado entre 1 y 4; n2 es un número entero seleccionado entre 0 o más; y R1, R4, R5, Ar1, Ra, Rb, Rc, Rd y Re se definen en cualquiera de los apartados (1-1) a (1-48), (2-1) a (2-25), (3-1) a (3- 12), (4-1) a (4-12), (5-1) a (5-12) y (6-1) a (6-10). En la fórmula (I-d), n3, n4 y n5 son cada uno independientemente un número entero seleccionado entre 0 y 1, siempre que al menos uno de n3, n4 y n5 sea 1; n1 se define como antes; R1, R4, R5, Ar1, Rb, Rc, Rd y Re se definen en cualquiera de los apartados (1-1) a (1-48), (2 1) a (2-25), (3-1) a (3- 12), (4-1) a (4-12), (5-1) a (5-12) y (6-1) a (6-10).
En la presente invención, n2 es preferiblemente un número entero seleccionado entre 1 y 4, más preferiblemente un número entero seleccionado entre 1 y 3.
En la presente invención, la frase "opcionalmente sustituido con" o "sustituido con" significa "opcionalmente sustituido con un sustituyente" o "sustituido con un sustituyente" respectivamente, a menos que se especifique el número de sustituyentes (por ejemplo, "uno o más", "de uno a tres”, “uno o dos”, “dos" o "uno"). Por ejemplo, "B opcionalmente sustituido con A" y "B sustituido con A" significa "B opcionalmente sustituido con un A" y "B sustituido con un A" respectivamente.
En la presente descripción, los ejemplos de la sal del compuesto representado por la fórmula (I), (II), (III), (la), (Ib), (Ic) o (Id) incluyen sales de adición de ácido y sales de adición de bases. Los ejemplos de las sales de adición de ácido incluyen: hidrocloruro, hidrobromuro, yoduro, fosfato, fosfonato y sulfato; sulfonatos tales como metanosulfonato, etanosulfonato, bencenosulfonato y p-toluenosulfonato; y carboxilatos tales como acetato, citrato, malato, tartrato, succinato, salicilato, maleato, fumarato, benzoato, malonato, glicolato, oxalato, glucuronato, adipato, glutarato, cetoglutarato e hipurato. Los ejemplos de las sales de adición de bases incluyen: sales de metales alcalinos tales como sal de sodio y sal de potasio; sales de metales alcalinotérreos tales como sal de magnesio y sal de calcio; sales de amonio tales como sal de amonio, sal de alquilamonio, sal de dialquilamonio, sal de trialquilamonio y sal de tetraalquilamonio; y sales de aminoácidos tales como sal de lisina, sal de arginina, sal de glicina, sal de valina, sal de treonina, sal de serina, sal de prolina y sal de alanina. Cada una de estas sales se produce por el contacto del compuesto con un ácido o una base disponible en la producción farmacéutica.
En la presente descripción, el compuesto representado por la fórmula (I), (II), (III), (Ia), (Ib), (Ic) o (Id) o la sal del mismo puede ser un anhidrato o puede formar un solvato tal como un hidrato. En este contexto, el "solvato" se refiere a un sólido formado por un complejo de la molécula de compuesto y una molécula de disolvente y se refiere, por ejemplo, a un hidrato formado a partir de agua como disolvente. El solvato que no sea el hidrato incluye un sólido que contiene un alcohol (p. ej., metanol, etanol y n-propanol), dimetilformamida o similares.
El compuesto representado por la fórmula (I), (II), (III), (Ia), (Ib), (Ic) o (Id) y la sal del mismo se pueden encontrar en forma de algunos tautómeros, por ejemplo, formas ceto y enol, formas imina y enamina, y sus mezclas. Tales tautómeros están presentes en forma de una mezcla tautomérica en una solución. En forma sólida, suele ser predominante uno de los tautómeros. Aunque uno de los tautómeros puede describirse en la presente memoria, todos los tautómeros del compuesto de la presente invención están incluidos en la presente invención.
La presente invención incluye adicionalmente todos los estereoisómeros (p. ej., enantiómeros y diastereómeros (incluidos los isómeros geométricos cis y trans)) del compuesto representado por la fórmula (I), (II), (III), (Ia), (Ib), (Ic), o (Id), racematos de los isómeros, y otras mezclas. El compuesto de la presente invención puede tener, por ejemplo, uno o más átomos asimétricos. El compuesto de la presente invención incluye mezclas racémicas, mezclas diastereoméricas y enantiómeros de tal compuesto.
El compuesto representado por la fórmula (I), (II), (III), (I-a), (I-b), (I-c) o (I-d) se puede obtener en forma libre. En este caso, el compuesto libre puede convertirse mediante un método de rutina en la sal que puede formar el compuesto o en el hidrato o el solvato del compuesto o la sal.
Alternativamente, el compuesto representado por la fórmula (I), (II), (III), (la), (Ib), (Ic) o (Id) se puede obtener en forma de la sal, hidrato o solvato del compuesto. En este caso, esta forma se puede convertir a la forma libre del compuesto de acuerdo con un método de rutina.
Cada elemento que constituye el compuesto representado por la fórmula (I), (II), (III), (I-a), (I-b), (I-c) o (I-d) puede ser cualquier isótopo. La presente invención abarca un compuesto de la fórmula (I), (II), (III), (I-a), (I-b), (I-c) o (I-d) que contiene dicho isótopo. El isótopo en el compuesto se refiere a una variante del elemento en el que al menos un átomo se reemplaza por un átomo con el mismo número atómico (el mismo número de protones) y un número másico diferente (número total de protones y neutrones). Los ejemplos del isótopo contenido en el fármaco de la presente invención incluyen un átomo de hidrógeno, un átomo de carbono, un átomo de nitrógeno, un átomo de oxígeno, un átomo de fósforo, un átomo de azufre, un átomo de flúor y un átomo de cloro que incluyen 2H, 3H, 13C, 14C, 15N, 17O, 18O, 31P, 32P, 35S, 18F y 36Cl. En particular, un radioisótopo, tal como 3H o 14C, que experimenta desintegración radiactiva, es útil, por ejemplo, en las pruebas de distribución histológica in vivo del fármaco o el compuesto. Los isótopos estables rara vez varían en abundancia sin descomposición y también están libres de radiactividad. Por lo tanto, estos isótopos estables se pueden usar con seguridad. El isótopo en el compuesto que sirve como ingrediente activo en el fármaco de la presente invención se puede convertir de acuerdo con un método de rutina mediante la sustitución de un reactivo utilizado en síntesis con un reactivo que contiene el isótopo correspondiente.
El compuesto representado por la fórmula (I), (II), (III), (I-a), (I-b), (I-c) o (I-d) se puede administrar en forma de un profármaco. La presente invención también incluye dicho profármaco del compuesto representado por la fórmula (I), (II), (III), (I-a), (I-b), (I-c) o (I-d). En este contexto, el "profármaco" de la presente invención significa un derivado del compuesto de fórmula (I), (II), (III), (Ia), (Ib), (Ic) o (Id) que se convierte después de la administración en el compuesto de fórmula (I), (II), (III), (Ia), (Ib), (Ic) o (Id) o la sal farmacéuticamente aceptable del mismo mediante degradación enzimática o no enzimática bajo condiciones fisiológicas El profármaco puede estar inactivo cuando se administra a un paciente. El profármaco se convierte in vivo en el compuesto activo de la fórmula (I), (II), (III), (I-a), (I b), (I-c) o (I-d).
El profármaco se convierte, por ejemplo, en una formulación farmacéutica deseada a un pH concreto o mediante la acción de una enzima. El profármaco es típicamente un compuesto que forma un ácido libre in vivo y un compuesto que tiene un grupo éster hidrolizable. Tal grupo éster hidrolizable es, por ejemplo, pero no está limitado a, un grupo representado por la fórmula -COORx, en donde Rx se selecciona entre alquilo C1-C4 , (alcanoil C2-C7)oximetilo, 1-(alcanoil(C4-C9)oxi)etilo, 1-metil-1-(alcanoil(C5-C10)oxi)-etilo, (alcoxi C3-C6)carboniloximetilo, 1-[(alcoxi C4-C7)carboniloxi]etilo, 1-metil-1-[(alcoxi C5-C8)carboniloxi]etilo, N-[(alcoxi C3-C9)carbonil]aminometilo, 1-(N-[(alcoxi C4-C10)carbonil]amino)etilo, 3-ftalidilo, 4-crotonolactonilo, Y-butirolacton-4-ilo, [N,N-di(alquil C1-C2)amino]alquilo C2-C3 (p. ej., N,N-dimetilaminoetilo), (carbamoil)alquilo C1-C2 , [N,N-di(alquil C1-C2)carbamoil]alquilo C1-C2 , (piperidin)alquilo C2-C3, (pirrolidin)alquilo C2-C3 y (morfolino)alquilo C2-C3.
Fármaco de la presente invención.
Un aspecto de la presente descripción proporciona un fármaco y una composición farmacéutica que contienen el compuesto representado por la fórmula (I), (II), (III), (Ia), (Ib), (Ic) o (Id) o la sal del mismo, o el solvato del compuesto o la sal.
El fármaco de la presente descripción contiene el compuesto representado por la fórmula (I), (II), (III), (Ia), (Ib), (Ic) o (Id) como ingrediente activo y adicionalmente contiene un portador farmacéuticamente aceptable. El término "portador farmacéuticamente aceptable" utilizado en la presente memoria significa uno o más excipientes sólidos o líquidos o materiales encapsulantes compatibles que son adecuados para la administración a mamíferos. El término "farmacéuticamente aceptable" utilizado en la presente memoria significa farmacéuticamente disponible desde el punto de vista de eficacia, seguridad, etc. El portador farmacéuticamente aceptable utilizado es adecuado para la administración a un animal, preferiblemente un mamífero, que debe ser tratado, desde el punto de vista de la seguridad y tiene suficientemente alta pureza.
Los ejemplos de un material que se puede utilizar como el portador farmacéuticamente aceptable incluyen: azúcares tales como lactosa, glucosa y sacarosa; almidones tales como almidón de maíz y almidón de patata; celulosa y sus derivados tales como carboximetilcelulosa sódica, etilcelulosa y metilcelulosa; goma de tragacanto en polvo; malta; gelatina; talco; lubricantes sólidos tales como ácido esteárico y estearato de magnesio; sulfato de calcio; aceites vegetales tales en forma de aceite de cacahuete, aceite de semilla de algodón, aceite de sésamo, aceite de oliva, aceite de maíz y aceite de cacao; alcoholes polihidroxilados tales como propilenglicol, glicerina, sorbitol, manitol y polietilenglicol; ácido algínico; emulsionantes tales como TWEEN; agentes humectantes tales como lecitina; colorantes; aromas; agentes para formación de comprimidos; estabilizadores; antioxidantes; antisépticos; agua libre de pirógenos; solución salina isotónica; y soluciones tampón de fosfato.
El compuesto de la presente invención se puede utilizar como un inhibidor de NaPi-IIb o un agente preventivo y/o
terapéutico para la hiperfosfatemia, el hiperparatiroidismo secundario o la insuficiencia renal crónica. En este caso, los ejemplos de un método de administración del mismo incluyen las vías oral, rectal, parenteral (intravenosa, intramuscular o subcutánea), intracisternal, intravaginal, intraperitoneal, intravesical y local (goteo, polvo, pomada, gel o crema) e inhalación (en la cavidad bucal o utilizando aerosoles nasales). Los ejemplos de la forma de dosificación del mismo incluyen comprimidos, cápsulas, gránulos, polvos, píldoras, soluciones y suspensiones orales acuosas y no acuosas, y soluciones parenterales cargadas en recipientes adaptados para la división en dosis individuales. Alternativamente, la forma de dosificación se puede adaptar a diversos métodos de administración que abarcan formulaciones de liberación controlada como en la implantación subcutánea.
Estas preparaciones se producen mediante un método bien conocido que utiliza aditivos como excipientes, lubricantes (agentes de recubrimiento), aglutinantes, disgregantes, estabilizadores, correctores y diluyentes.
Los ejemplos de los excipientes pueden incluir almidones tales como almidón, almidón de patata y almidón de maíz, lactosa, celulosa cristalina e hidrogenofosfato de calcio.
Los ejemplos de los agentes de recubrimiento pueden incluir etilcelulosa, hidroxipropilcelulosa, hidroxipropilmetilcelulosa, goma laca, talco, cera de carnauba y parafina.
Los ejemplos de los aglutinantes pueden incluir polivinilpirrolidona, Macrogol y los mismos compuestos que los enumerados como excipientes.
Los ejemplos de los disgregantes pueden incluir los mismos compuestos que los enumerados como excipientes y almidones y celulosas modificados químicamente tales como croscarmelosa de sodio, carboximetil almidón de sodio y polivinilpirrolidona entrecruzada.
Los ejemplos de los estabilizadores pueden incluir: ésteres p-hidroxibenzoato tales como metilparabeno y propilparabeno; alcoholes tales como clorobutanol, alcohol bencílico y alcohol feniletilico; cloruro de benzalconio; fenoles tales como fenol y cresol; timerosal; ácido deshidroacético; y ácido sórbico.
Los ejemplos de los correctores pueden incluir edulcorantes, acidulantes y aromas utilizados habitualmente.
Las preparaciones líquidas se pueden producir utilizando un disolvente tal como etanol, fenol, clorocresol, agua purificada o agua destilada.
Los ejemplos de los tensioactivos o emulsionantes pueden incluir estearato de polioxilo 40 y Lauromacrogol.
Cuando el compuesto de la presente invención se utiliza como un inhibidor de NaPi-IIb, un inhibidor de PiT-1, un inhibidor de PiT-2 o un agente preventivo y/o terapéutico para la hiperfosfatemia, el hiperparatiroidismo secundario o la insuficiencia renal crónica, la cantidad del fármaco de la presente invención utilizada difiere según los síntomas, la edad, el peso corporal, las condiciones de salud relativas, la presencia de otros medicamentos, métodos de administración, etc. En el caso de los agentes orales, una cantidad eficaz general, por ejemplo, para un paciente (animal de sangre caliente, particularmente un ser humano) es preferiblemente de 1 a 20 mg/kg de peso corporal, más preferiblemente de 1 a 10 mg/kg de peso corporal, por día en términos de la cantidad del ingrediente activo (el compuesto de la presente invención representado por la fórmula (I)). La dosis diaria en un paciente adulto que tiene un peso corporal normal está en el intervalo de preferiblemente 60 a 1200 mg.
A continuación, se mostrarán métodos generales para producir el compuesto de la presente invención y ejemplos.
Método de síntesis general
El compuesto de la presente invención se puede sintetizar por diversos métodos. Algunos de los métodos se describirán con referencia a los esquemas que se muestran a continuación. Estos esquemas se proporcionan con fines ilustrativos, y la presente invención no está limitada por las reacciones químicas y las condiciones descritas en la presente memoria. Aunque algunos sustituyentes están excluidos de los esquemas que se muestran a continuación, para facilitar la comprensión, no se pretende que tal exclusión limite la descripción de los esquemas. Los compuestos típicos de la presente invención se pueden sintetizar utilizando intermedios apropiados, compuestos conocidos en la técnica y reactivos. En las fórmulas de los métodos de síntesis generales descritos a continuación, los grupos de variables representados por R1, R2, etc. y las variables representadas por n, etc. tienen los mismos significados que los de los grupos de variables representados por R1, R2, etc. y las variables representadas por n, etc. en los compuestos representados por fórmulas generales definidas en la presente memoria.
El compuesto de la presente invención se puede sintetizar mediante los métodos de producción que se muestran a continuación.
Esquema 1 (Método A)
en donde R21 representa alquilo C1-C3 ; R22 representa alquilo C1-C5 ; y R3=O (2) representa aldehído o cetona formada por la conversión de un átomo de carbono en la posición de enlace del alquilo representado por R3 a carbonilo.
La Etapa 1 implica hacer reaccionar un compuesto de fórmula (1) con aldehído o cetona (2) en un disolvente apropiado tal como metanol o diclorometano para sintetizar un compuesto (3). La reacción se realiza a una temperatura de, por ejemplo, 0°C a temperatura ambiente durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. El derivado de hidrazona obtenido (3) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
Se ha informado sobre una gran cantidad de métodos aplicables en cuanto al método de síntesis para la hidrazina (1) que se muestra en el Esquema 1 (esta reacción se puede realizar con referencia a, por ejemplo, Synthetic communications, 40, 654-660; 2010, Journal of Heterocyclic Chemistry, 24 (3), 725-731; 1 98 7 y Síntesis, (6), 423 424; 1979).
La Etapa 2 implica reducir la hidrazona (3) en presencia de un agente reductor tal como cianoborohidruro de sodio o borano-piridina en un disolvente apropiado tal como metanol o ácido acético para obtener la hidrazina (4). La reacción se realiza a una temperatura de, por ejemplo, 0°C a 50°C durante un tiempo de, por ejemplo, 0,5 horas a 60 horas. La hidrazina obtenida (4) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
La Etapa 3 implica hacer reaccionar la hidrazina (4) con el semiéster (5) utilizando un agente de condensación tal como N,N'-diciclohexilcarbodiimida (DCC), n-hidrato de cloruro de 4-(4,6-dimetoxi-1,3,5-triazin-2-il)-4-metilmorfolinio (DMT-MM), hexafluorofosfato de O-(7-azabenzotriazol-1-il)-N,N,N’,N'-tetrametiluronio (HATU), hexafluorofosfato de bromo-tris-pirrolidino-fosfonio (PyBrop) o anhídrido cíclico del ácido 1-propanofosfónico (T3P) en un disolvente apropiado tal como diclorometano, N,N-dimetilformamida, N,N-dimetilacetamida, acetonitrilo, tetrahidrofurano o acetato de etilo. La reacción se realiza a una temperatura de, por ejemplo, 0°C a 50°C durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. La forma de éster obtenida (6) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
El semiéster (5) que se muestra en el Esquema 1 se puede sintetizar a partir del ácido de Meldrum y un alcohol (esta reacción se puede realizar con referencia, por ejemplo, a Organic Letters, 7 (3), 463-465; 2005).
La Etapa 4 implica la ciclación de la forma del éster (6) utilizando una base tal como carbonato de potasio, carbonato de cesio, metóxido de sodio o hidruro de sodio en un disolvente apropiado tal como metanol, N,N-dimetilformamida, N,N-dimetilacetamida, dimetilsulfóxido, éter dietílico o tetrahidrofurano. La reacción se realiza a una temperatura de, por ejemplo, 0°C a 110°C durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. La forma ciclada obtenida (7) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
La Etapa 5 implica hacer reaccionar la forma ciclada (7) con diversas aminas (8) en un disolvente apropiado tal como benceno, tolueno, xileno, acetato de etilo, tetrahidrofurano, N,N-dimetilformamida, N,N-dimetilacetamida o dimetilsulfóxido. La reacción se realiza a una temperatura de, por ejemplo, 50°C a 120°C durante un tiempo de, por ejemplo, 0,5 horas a 5 horas. La forma de amida obtenida (fórmula I) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
R21 es preferiblemente metilo y R22 es preferiblemente metilo o i-butilo.
El compuesto de la fórmula I también se puede sintetizar a través de la reacción entre una forma ceto (9) y el isocianato como se muestra en el Esquema 2 (Método B).
Esquema 2 (Método B)
[Fórmula 12]
en donde R22 se ha definido en el Esquema 1.
La forma ceto (9) como producto en la Etapa 1 se puede sintetizar mediante la descarboxilación de una forma de éster (7) (esta reacción se puede realizar con referencia a, por ejemplo, Synthesis, (15), 2487-2491; 2009).
La Etapa 2 implica hacer reaccionar la forma ceto (9) con isocianato en presencia de una base tal como hidruro de sodio, carbonato de potasio o carbonato de cesio en un disolvente apropiado como N,N-dimetilformamida, N,N-dimetilacetamida o tetrahidrofurano. La reacción se realiza a una temperatura de, por ejemplo, 0°C a 50°C durante un tiempo de, por ejemplo, 0,5 horas a 5 horas. La forma de amida obtenida (fórmula I) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
El compuesto de la fórmula I también se puede sintetizar mediante la ciclación de una forma de amida como se muestra en el Esquema 3 (Método C).
Esquema 3 (Método C)
[Fórmula 13]
en donde R21 se ha definido en el Esquema 1.
La Etapa 1 implica hacer reaccionar la hidrazina (4) con la semiamida (10) en presencia de un agente de condensación como N,N'-diciclohexilcarbodiimida (DCC), n-hidrato de cloruro de 4-(4,6-dimetoxi-1,3,5-triazin-2-il)-4-metilmorfolinio (DMT-MM), hexafluorofosfato de O-(7-azabenzotriazol-1-il)-N,N,N’,N'-tetrametiluronio (HATU), hexafluorofosfato de bromo-tris-pirrolidino-fosfonio (PyBrop), o anhídrido cíclico del ácido 1-propanofosfónico (T3P) en un disolvente apropiado tal como diclorometano, N,N-dimetilformamida, N,N-dimetilacetamida, acetonitrilo, tetrahidrofurano o acetato de etilo. La reacción se realiza a una temperatura de, por ejemplo, 0°C a 50°C durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. La forma de amida obtenida (11) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
La semiamida (10) mostrada en el Esquema 3 se puede sintetizar a partir del ácido y la amina de Meldrum (esta reacción se puede realizar con referencia, por ejemplo, a Bioorganic & Medicinal Chemistry Letters, 19 (13), 3632 3636; 2009).
La Etapa 2 implica la ciclación de la forma de amida (11) utilizando una base tal como metóxido de sodio, carbonato de potasio, carbonato de cesio o hidruro de sodio en un disolvente apropiado como metanol, N,N-dimetilformamida, N,N-dimetilacetamida o tetrahidrofurano. La reacción se realiza a una temperatura de, por ejemplo, 0°C a 110°C durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. El compuesto obtenido de la fórmula I se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
El compuesto de la fórmula I también se puede sintetizar por alquilación como se muestra en el Esquema 4 (Método
D).
Esquema 4 (Método D)
[Fórmula 4]
A continuación se mostrarán tres métodos ilustrativos de la Etapa 1.
El método 1 implica desbencilar un compuesto (12) utilizando un catalizador de paladio tal como paladio (0)-carbono o hidróxido de paladio(N)-carbono o un catalizador de platino tal como óxido de platino (PtO2) en un disolvente apropiado tal como metanol, acetato de etilo, N,N-dimetilformamida o N,N-dimetilacetamida en una atmósfera de hidrógeno. La reacción se realiza a una temperatura de, por ejemplo, temperatura ambiente hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 1 hora a 24 horas. El método 2 implica hacer reaccionar el compuesto (12) en presencia de un agente oxidante tal como 2,3-dicloro-5,6-diciano-p-benzoquinona o hexanitratocerato de amonio (IV) en un disolvente apropiado tal como diclorometano o acetonitrilo. La reacción se realiza a una temperatura de, por ejemplo, temperatura ambiente hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 1 hora a 60 horas. El método 3 implica hacer reaccionar el compuesto (12) en presencia de un ácido orgánico tal como ácido trifluoroacético o ácido trifluorometanosulfónico en un disolvente apropiado tal como diclorometano o metanol. La reacción se realiza a una temperatura de, por ejemplo, 0°C hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 5 horas. La forma NH obtenida (13) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
La Etapa 2 implica hacer reaccionar la forma NH (13) con un agente alquilante tal como haluro de alquilo o sulfonato de alquilo en presencia de una base apropiada tal como hidruro de sodio, t-butóxido de potasio o pentóxido de potasio en un disolvente apropiado tal como N,N-dimetilformamida, N,N-dimetilacetamida, tetrahidrofurano o dimetilsulfóxido. La reacción se realiza a una temperatura de, por ejemplo, 0°C hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. El compuesto obtenido de la fórmula I se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
En -OSO2R23 mostrado en este esquema, R23 es alquilo C1-C5 opcionalmente sustituido con uno o más átomos de halógeno o arilo, en donde el grupo arilo está opcionalmente sustituido con uno o más átomos de halógeno o grupos alquilo. Los ejemplos específicos de R23 incluyen metilo, trifluorometilo, fenilo y 4-metilfenilo.
El compuesto de la fórmula I también se puede sintetizar por alquilación como se muestra en el Esquema 5 (Método E).
Esquema 5 (Método E)
[Fórmula 15]
en donde R22 se ha definido en el Esquema 1.
La reacción de la Etapa 1 del Esquema 5 (Método E) se puede llevar a cabo de la misma manera que en la Etapa 1 del Esquema 4 (Método D).
La reacción de la Etapa 2 del Esquema 5 (Método E) se puede llevar a cabo de la misma manera que en la Etapa 2 del Esquema 4 (Método D). El compuesto de la fórmula I se puede obtener de la misma forma que en la Etapa 5 del Esquema 1 a partir de la forma de éster obtenida (7).
Método de introducción de la cadena lateral.
Esquema 6 (Método F)
[Fórmula 6]
en donde n es un número entero seleccionado entre 1 y 10, y R24 es alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12.
El método del Esquema 6 (Método F) implica hacer reaccionar un derivado de fenol (16) con un agente alquilante tal como haluro de alquilo o sulfonato de alquilo en presencia de una base apropiada tal como hidruro de sodio, carbonato de potasio, carbonato de cesio, t-butóxido de potasio o pentóxido de potasio en un disolvente apropiado tal como tetrahidrofurano, acetonitrilo, N,N-dimetilformamida, N,N-acetamida, dimetilsulfóxido o acetona. La reacción se realiza a una temperatura de, por ejemplo, 0°C hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 12 horas. El compuesto obtenido representado por la fórmula III se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía. El compuesto obtenido en el Esquema 6 se puede someter, si fuera necesario, a la reacción de desprotección de varios grupos protectores y otros procedimientos para sintetizar un derivado.
Esquema 7 (Método G)
[Fórmula 17]
en donde n y R24 se definen como en el Esquema 6.
El método del Esquema 7 (Método G) implica hacer reaccionar un derivado de fenol (16) con diversos alcoholes utilizando un reactivo de Mitsunobu apropiado, tal como azodicarboxilato de dietilo (DeAd), azodicarboxilato de diisopropilo (DIAD), N,N,N’,N'-tetraisopropilazodicarboxamida (TIPA), 1,1’-(azodicarbonil)dipiperidina (ADDP), o N,N,N',N'-tetrametilazodicarboxamida (TMAD) en presencia de un reactivo de fósforo orgánico trivalente apropiado tal como trifenilfosfina o tributilfosfina en un disolvente apropiado tal como diclorometano, tetrahidrofurano, acetonitrilo, tolueno o benceno. La reacción se realiza a una temperatura de, por ejemplo, 0°C hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. El compuesto obtenido representado por la fórmula III se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía. El compuesto obtenido en el Esquema 7 se puede someter, si fuera necesario, a la reacción de desprotección de varios grupos protectores y otros procedimientos para sintetizar un derivado.
Esquema 8 (M étodo H)
[Fórmula 18]
en donde n es un número entero seleccionado entre 1 y 10, y R25 es (alcoxi C1-C4)carbonilo, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11o (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13.
El método del Esquema 8 (Método H) implica hacer reaccionar un derivado de bromobenceno o yodobenceno (17) utilizando un catalizador de paladio tal como tetrakis(trifenilfosfina)paladio (0) (Pd(Ph3P)4), tris(dibencilidenacetona)dipaladio(0) (Pd2(dba)3), complejo de 1,1'-bis(difenilfosfino)ferroceno-dicloruro paladio(ll)-diclorometano (PdCl2(dppf)CH2Cl2), acetato de paladio(ll) (Pd(OAc)2) o diclorobis(trifenilfosfina)paladio(ll) (PdCl2(Ph3PAGS)2) complementado, si fuera necesario, con un ligando de fosfina tal como trifenilfosfina (Ph3P), tri-tbutilfosfina (tBu3p) o tri-o-tolilfosfina ((o-tol)3P), un catalizador de cobre tal como yoduro de cobre(l) y una base apropiada tal como carbonato de sodio, trietilamina o carbonato de potasio en un disolvente apropiado tal como diclorometano, tetrahidrofurano, N,N-dimetilformamida, N,N-dimetilacetamida, tolueno, benceno, 1,2-dimetoxietano, 1,4-dioxano, etanol o acetonitrilo para introducir en el mismo, por ejemplo, azufre, alcano, alquino o alcoxicarbonilo. Cuando R25 es (alcoxi C1-C4)carbonilo, por ejemplo, se puede utilizar monóxido de carbono y alcohol C1-C4 como reactivo en la reacción. Cuando R25 es alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10 o alquinilo C2-C10, por ejemplo, se pueden utilizar acetileno o (alquil C1-C8)-C=CH como reactivo en la reacción. Cuando R25 es (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, por ejemplo, se puede utilizar alquilmercaptano C1-C4 como reactivo en la reacción. La reacción se realiza a una temperatura de, por ejemplo, 0°C hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 60 horas. El compuesto obtenido representado por la fórmula lV se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía. El compuesto obtenido en el Esquema 8 se puede someter, si fuera necesario, a la reacción de hidrogenación de un doble enlace y un triple enlace, la reacción de oxidación o alquilación de un átomo de azufre, la reacción de desprotección de varios grupos protectores y otros procedimientos para sintetizar un derivado.
Esquema 9 (Método l)
en donde R22, R23 y R25 se definen como en los Esquemas 1 y 8.
La reacción del Esquema 9 (Método l) se puede llevar a cabo de la misma manera que en el Esquema 8 con un compuesto (18) como sustancia de partida. El compuesto de la fórmula lV se puede obtener de la misma forma que en la Etapa 5 del Esquema 1 a partir de la forma de éster obtenida (19).
Esquem a 10 (M étodo J)
[Fórmula 20]
en donde
Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde este grupo está opcionalmente sustituido con Rb y/o Rc; y
Rd se selecciona entre heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14.
Los ejemplos de -B (pin) en la fórmula anterior incluyen la siguiente estructura:
[Fórmula 21]
El método del Esquema 10 (Método J) implica hacer reaccionar un derivado de haluro de arilo (20) con ácido aril borónico, ácido heteroaril borónico, ácido heterocicloalquil borónico, éster de ácido aril borónico, éster de ácido heteroaril borónico, éster de ácido heterocicloalquil borónico, ariltrialquilestaño, heteroariltrialquilestaño, heterocicloalquiltrialquilestaño, o similar, utilizando un catalizador de paladio tal como tetrakis(trifenilfosfina)paladio(0) (Pd(Ph3P)4), tris(dibencilidenacetona)dipaladio(0) (Pd2(dba)3), complejo de 1,1'-bis(difenilfosfino)ferroceno-dicloruro de paladio(II)-diclorometano (PdCl2(dppf)-CH2Cl2) o acetato de paladio(II) (Pd(OAc)2) complementado, si fuera necesario, con un ligando de fosfina tal como trifenilfosfina (Ph3P), tri-tbutilfosfina (tBu3P) o tri-o-tolilfosfina ((o-tol)3P) y una base apropiada tal como carbonato de sodio, trietilamina o carbonato de potasio en un disolvente apropiado tal como tetrahidrofurano, acetonitrilo, tolueno, N,N-dimetilformamida, N,N-dimetilacetamida, 1,2-dimetoxietano (DME), o 1,4-dioxano en una atmósfera de nitrógeno para introducir un grupo arilo en el mismo. La reacción se realiza a una temperatura de, por ejemplo, temperatura ambiente hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 12 horas. La forma bisarílica obtenida (fórmula V) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
Esquema 11 (Método K)
[Fórmula 22]
en donde
R23 se define como antes;
Ar1 y Rd se definen como en el Esquema 10; y
R14 se selecciona entre ciano, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y -NR27R28 (R27 y R28 se seleccionan cada uno independientemente entre alquilo C1-C4 opcionalmente
sustituido con (alcoxi Ci-C3)carbonilo.
El método del Esquema 11 (Método K) implica hacer reaccionar haluro de heteroarilo o éster heteroarílico de ácido sulfónico (21) con un nucleófilo tal como amina, nitrilo o alcohol, si fuera necesario en presencia de una base tal como hidruro de sodio, alcóxido de sodio, potasio carbonato, carbonato de sodio, trietilamina, diisopropiletilamina o diazabicicloundeceno (DBU) en un disolvente apropiado como N,N-dimetilformamida, N,N-dimetilacetamida, tetrahidrofurano o dimetilsulfóxido. La reacción se realiza a una temperatura de, por ejemplo, temperatura ambiente hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. La forma bisarílica obtenida (fórmula VI) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
Esquema 12 (Método L)
[Fórmula 23]
SCE: Sustituyente captador de electrones (CN, COOCH3, SO2CH3, etc.)
en donde
R23 se ha definido en el Esquema 11;
Rd es heterocicloalquilo de 5 a 10 miembros, arilo C6-C10, o heteroarilo de 5 a 10 miembros; y
Y se selecciona entre ciano, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y -NR27R28 (R27 y R28 se seleccionan cada uno independientemente entre alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C4)carbonilo.
El método del Esquema 12 (Método L) implica hacer reaccionar haluro de heteroarilo, éster heteroarílico de ácido sulfónico o nitroheteroarilo (22) que tiene un sustituyente captador de electrones (SCE) con un nucleófilo tal como amina, nitrilo o alcohol, si fuera necesario en presencia de una base tal como hidruro de sodio, alcóxido de sodio, carbonato de potasio, carbonato de sodio, trietilamina, diisopropiletilamina o diazabicicloundeceno (DBU) en un disolvente apropiado tal como N,N-dimetilformamida, N,N-dimetilacetamida, tetrahidrofurano, dimetilsulfóxido o un disolvente alcohólico. La reacción se realiza a una temperatura de, por ejemplo, temperatura ambiente hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. La forma bisarílica obtenida (la fórmula VII) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
Síntesis de la sustancia de partida
Esquema 13 (Método M)
[Fórmula 24]
R20: B(OH)2 , B(pin), SnBu3
Y: Cl, Br, I, OSO2R7
en donde Ar1 y Rd se definen como en el Esquema 10.
De acuerdo con el Esquema 13 (Método M), se sintetiza la arilamina (8) (en donde Rd es heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más
sustituyentes R14) para su uso en la reacción de la Etapa 5 del Esquema 1. Este método implica hacer reaccionar el haluro de arilo (23) o (26) con ácido arilborónico, éster de ácido arilborónico, ariltrialquilestaño o similares en presencia de un catalizador de paladio tal como tetrakis(trifenilfosfina)paladio (0) complementado, si fuera necesario, con una base tal como trietilamina, carbonato de sodio, carbonato de potasio, carbonato de cesio o hidróxido de sodio en un disolvente apropiado como agua, tolueno, etanol, N,N-dimetilformamida, N,N-dimetilacetamida, 1,4-dioxano, 1,2-dimetoxietano o tetrahidrofurano. La reacción se realiza a una temperatura de, por ejemplo, temperatura ambiente hasta el punto de ebullición del disolvente durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. La forma bisarílica obtenida (25) o (28) se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
Esquema 14 (Método N)
[Fórmula 25]
Etapa 1
hW-nh2
en donde R1, R4, R5 y R21 se definen como antes.
De acuerdo con el Esquema 14 (Método N), se sintetiza la hidrazina para su uso en la reacción de la Etapa 1 del Esquema 1. El compuesto (1) se puede sintetizar con referencia a, por ejemplo, Bioorganic & Medicinal Chemistry Letters 13 (2003) 2413-2418.
Esquema 15 (Método O)
[Fórmula 26]
en donde R26 es bencilo, metilo o t-butilo, y R1, R4 y R5 se definen como antes.
De acuerdo con el Esquema 15 (Método O), la amina (34) se sintetiza para la síntesis de la hidrazina (1) para su uso en la reacción de la Etapa 1 del Esquema 1.
La Etapa 1 implica la N-alquilación de un aminoácido protegido con carbamato utilizando un reactivo alcalino apropiado tal como hidruro de sodio, carbonato de potasio o carbonato de cesio o una sal de plata tal como óxido de plata(I) en presencia de haluro de alquilo en un disolvente apropiado como como N,N-dimetilformamida, N,N-dimetilacetamida, tetrahidrofurano o dimetilsulfóxido. La reacción se realiza a una temperatura de, por ejemplo, 0°C a 80°C durante un tiempo de, por ejemplo, 0,5 horas a 5 horas. La forma N-alquilada (33) obtenida se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía.
La Etapa 2 implica la desprotección del carbamato (33), por ejemplo, en presencia de un ácido tal como ácido clorhídrico o ácido trifluoroacético o mediante reducción catalítica con hidrógeno en presencia de un catalizador tal como paladio. La reacción se realiza a una temperatura de, por ejemplo, 0°C a 50°C durante un tiempo de, por ejemplo, 0,5 horas a 24 horas. El disolvente de reacción utilizado es, por ejemplo, un disolvente apropiado tal como diclorometano o acetonitrilo para las condiciones ácidas o, por ejemplo, un disolvente tal como acetato de etilo, N,N-dimetilformamida, N,N-dimetilacetamida, dimetilsulfóxido o metanol. para la reducción catalítica con hidrógeno. La forma N-alquilada (34) obtenida se aísla mediante una técnica general y se puede purificar, si fuera necesario, mediante cristalización o cromatografía. La hidrazina (1) mostrada en el Esquema 1 se puede sintetizar a partir de la amina (34) con referencia, por ejemplo, a Synthetic communications, 40, 654-660; 2010, Journal of Heterocyclic Chemistry, 24 (3), 725-731; 1987 y Síntesis, (6), 423-424; 1979.
Esquema 16 (M étodo P)
De acuerdo con el Esquema 16 (Método P), se sintetiza el aminoácido protegido con carbamato (36) para la síntesis del compuesto (33) para su uso en la reacción de la Etapa 1 del Esquema 15. El compuesto (36) se puede sintetizar utilizando el reordenamiento de Curtius para el ácido carboxílico (35) (esta reacción se puede realizar con referencia a, por ejemplo, J. Org. Chem., 1994, 59 (26), 8215-8219). El compuesto (33) se puede sintetizar de la misma manera que en la Etapa 1 del Esquema 15.
En lo sucesivo, la presente invención se describirá con más detalle con referencia a los Ejemplos de Referencia y los Ejemplos. Sin embargo, la presente invención no está limitada por estos ejemplos.
Ejemplos
El contenido de la presente invención se describirá adicionalmente con referencia a los Ejemplos y Ejemplos de Referencia a continuación. Sin embargo, la presente invención no está limitada por el contenido de estos ejemplos. Todas las sustancias de partida y reactivos se obtuvieron de proveedores comerciales o se sintetizaron utilizando métodos conocidos en la técnica. Cada compuesto se purifica mediante HPLC utilizando AutoPurification HPLC/MS System (fabricado por Waters Corp.). Los espectros de RMN H1 o RMN C13 se midieron utilizando Me4Si como patrón interno y Agilent 400-MR (fabricado por Agilent Technologies, Inc.) o AVANCE3 Cryo-TCI (Bruker Corp.) (s = singlete, brs = singlete ancho, d = doblete, t = triplete, q = cuarteto, dd = doble doblete, ddd = doble doblete de dobletes, dt = doble triplete, td = triple doblete y m = multiplete). La espectrometría de masas se realizó utilizando un espectrómetro de masas SQD (fabricado por Waters Corp.), 2020 (fabricado por Shimadzu Corp.) o 2010EV (fabricado por Shimadzu Corp.). La medición del tiempo de retención y la espectrometría de masas en LCMS se realizaron utilizando los siguientes aparatos y condiciones de análisis:
T l 1
Un compuesto que tiene un enlace C=N en una fórmula estructural de hidrazona representada por la siguiente fórmula
[Fórmula 28]
se utilizó en la siguiente reacción sin confirmación particular de si el compuesto estaba en forma cis o en forma trans o una mezcla de las mismas.
<Ejemplo 1> (referencia)
(4aS)-1 -[(3-fluorofenil)metil]-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-4a,5,6,7-tetrahidropirrolo[1,2-b]piridazin-3-carboxamida
Primera Etapa
Éster metílico de ácido (S)-1-[(3-fluoro-benciliden)-amino]-pirrolidin-2-carboxílico
[Fórmula 29]
Se suspendió hidrocloruro de éster metílico de L-prolina (5,00 g, 30,2 mmoles) en diclorometano (60,4 mL), se añadió monohidrato de ácido p-toluenosulfónico (6,03 g, 31,7 mmoles) y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 10 minutos. Después de que la mezcla de reacción se concentró a presión reducida y se añadió tolueno, para la eliminación azeotrópica de agua suspendida en diclorometano (60,4 mL), se añadió nitrito de sodio (2,19 g, 31,7 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 2 horas. Después de filtrar la mezcla de reacción, el producto resultante se concentró a presión reducida para obtener el éster metílico de ácido (S)-1-nitroso-pirrolidin-2-carboxílico como producto bruto. El producto bruto obtenido se disolvió en ácido acético (30,2 mL) y agua (30,2 mL), a continuación, se añadió zinc (19,7 g, 302 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1 hora. Después de que se añadió bicarbonato de sodio a la mezcla de reacción a 0°C, se añadieron metanol (60,4 mL) y 3-fluoro-benzaldehído (3,20 mL, 30,2 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 2 horas. Después de filtrar la mezcla de reacción, el producto resultante se concentró a presión reducida y a continuación, se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (5,68 g, 75%).
LCMS: m/z 251 [M+H]+
Tiempo de retención de HPLC: 0,97 minutos (condiciones de análisis SQD-AA05)
Segunda Etapa
(4aS)-1 -[(3-fluorofenil)metil]-4a,5,6,7-tetrahidropirrolo[1,2-b]piridazin-2,4-diona
[Fórmula 30]
El éster metílico de ácido (S)-1-[(3-fluoro-benciliden)-amino]-pirrolidin-2-carboxílico (5,68 g, 22,7 mmoles) se disolvió en ácido acético (22,7 mL) y metanol (22,7 mL), se añadió cianoborohidruro de sodio (5,70 g, 90,8 mmoles) y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 14 horas. Se añadió una solución acuosa saturada de bicarbonato de sodio a la mezcla de reacción, a continuación, la mezcla se concentró a presión reducida y se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster metílico de ácido (S)-1-(3-fluoro-bencilamino)-pirrolidin-2-carboxílico como producto bruto. El producto bruto obtenido se disolvió en tetrahidrofurano (22,7 mL), se añadieron fosfato tripotásico (9,64 g, 45,4 mmoles) y éster metílico de ácido clorocarbonilacético (2,67 mL, 45,4 mmoles) a 0°C, y la mezcla se agitó bajo atmósfera de nitrógeno a temperatura ambiente durante 3 horas. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con una solución acuosa saturada de bicarbonato de sodio y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster metílico de ácido (S)-1-[(3-fluoro-bencil)-(2-metoxicarbonil-acetil)-amino]-pirrolidin-2-carboxílico como producto bruto. El producto bruto obtenido se disolvió en N,N-dimetilformamida (22,7 mL), se añadió carbonato de cesio (22,2 g, 68,1 mmoles) y la mezcla se agitó en atmósfera de nitrógeno a 80°C durante 9 horas. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster metílico de ácido (S)-1-(3-fluoro-bencil)-4-hidroxi-2-oxo-1,2,4a,5,6,7-hexahidropirrolo[1,2-b]piridazin-3-carboxílico como producto bruto. El producto bruto obtenido se disolvió en acetonitrilo (227 mL), se añadió agua (0,41 mL, 22,7 mmoles) y la mezcla se calentó a reflujo durante 2 horas en atmósfera de nitrógeno. La mezcla de reacción se concentró a presión reducida y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (4,01 g, 67%).
LCMS: m/z 263 [M+H]+
Tiempo de retención de HPLC: 0,81 minutos (condiciones de análisis SQD-AA05)
Tercera Etapa
(4aS)-1 -[(3-fluorofenil)metil]-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-4a,5,6,7-tetrahidropirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 31]
Se disolvió (4aS)-1-[(3-fluorofenil)metil]-4a,5,6,7-tetrahidropirrolo[1,2-b]piridazin-2,4-diona (1,50 g, 5,72 mmoles) en N,N-dimetilformamida (4,00 mL), y a continuación, se añadieron 3-isocianato-5-metil-2-trifluorometil-furano (1,20 g, 6,29 mmoles) e hidruro de sodio (dispersión al 50% en peso en aceite mineral, 0,33 g, 6,86 mmoles) y la mezcla se agitó bajo atmósfera de nitrógeno a temperatura ambiente durante 90 minutos. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (1,62 g, 63%).
LCMS: m/z 454 [M+H]+
Tiempo de retención de HPLC: 1,10 minutos (condiciones de análisis SQD-AA05)
<Ejemplo 2> (referencia)
(4aR)-1 -[(3-fluorouhenil)metil]-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-4a,5,6,7-tetrahidropirrolo[1,2-b]piridazin-3-carboxamida
De una manera similar a las etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir de hidrocloruro de éster metílico de D-prolina y 3-fluoro-benzaldehído.
T l 2
<Ejemplo 3> (referencia)
(4aS)-1 -[(3-fluorofenil)metil]-4-hidroxi-6,6-dimetil-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-5,7-dihidro-4aH-pirrolo[1,2-b]piridazin-3-carboxamida
Primera Etapa
Hidrocloruro de éster etílico de ácido (S)-4,4-dimetil-pirrolidin-2-carboxílico
[Fórmula 32]
Se añadió una solución en 1,4-dioxano (4 M, 5,00 mL) de cloruro de hidrógeno a éster 1-terc-butílico-éster 2-etílico de ácido (S)-4,4-dimetil-pirrolidin-1,2-dicarboxílico (500 mg, 1,84 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1 hora. La mezcla de reacción se concentró a presión reducida, y se añadió tolueno para la eliminación azeotrópica para obtener el compuesto del título en forma de un producto bruto.
Segunda Etapa
De una manera similar a las Etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro de éster etílico de ácido (S)-4,4-dimetil-pirrolidin-2-carboxílico obtenido y 3-fluoro-benzaldehído.
[Tabla 3]
<Ejemplo 4> (referencia)
(4aS)-1 -[(3-fluorofenil)metil]-4-hidroxi-7,7-dimetil-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-5,6-dihidro-4aH-pirrolo[1,2-b]piridazin-3-carboxamida
Primera Etapa
Hidrocloruro de éster metílico de ácido (S)-5,5-dimetil-pirrolidin-2-carboxílico
[Fórmula 33]
O
Se disolvió éster 1-terc-butílico de ácido (S)-5,5-dimetil-pirrolidin-1,2-dicarboxílico (500 mg, 2,06 mmoles) en N,N-dimetilformamida (2,06 mL) y a continuación, se añadieron carbonato de cesio (1,00 g, 3,08 mmoles) y yodometano (0,154 mL, 2,47 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 2 horas. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con agua, una solución saturada de bicarbonato de sodio y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster 1-terc-butílico-éster 2-metílico de ácido (S)-5,5-dimetil-pirrolidin-1,2-dicarboxílico como producto bruto. Se añadió una solución en 1,4-dioxano (4 M, 5,00 mL) de cloruro de hidrógeno al producto bruto obtenido, y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1 hora. La mezcla de reacción se concentró a presión reducida, y se añadió tolueno para la eliminación azeotrópica para obtener el compuesto del título en forma de un producto bruto.
Segunda Etapa
De una manera similar a las etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro de éster metílico de ácido (S)-5,5-dimetil-pirrolidin-2-carboxílico obtenido y 3-fluoro-benzaldehído.
T l 4
<Ejemplo 5> (referencia)
(4aS)-1-[(2,3-Difluorofenil)metil]-6,6-difluoro-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-5,7-dihidro-4aH-pirrolo[1,2-b]piridazin-3-carboxamida
El diéster 2-metílico 1-terc-butílico de ácido (S)-4,4-Difluoropirrolidin-1,2-dicarboxílico se utilizó como sustancia de partida, se utilizó 2,3-difluorobenzaldehído como reactivo, y se llevaron a cabo operaciones similares a las del Ejemplo 3 para sintetizar los compuestos descritos en la siguiente Tabla.
T l
<Ejemplo 6> (referencia)
(4aR)-1-[(3-fluorofenil)metil]-4-hidroxi-4a-metil-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Primera Etapa
Hidrocloruro de éster metílico de ácido (R)-2-metil-pirrolidin-2-carboxílico
[Fórmula 34]
El ácido (R)-2-metil-pirrolidin-2-carboxílico (300 mg, 2,32 mmoles) se disolvió en dioxano (1,20 mL) y agua (0,60 mL), y a continuación, se añadieron hidróxido de sodio (139 mg, 3,48 mmoles) y di-dicarbonato de terc-butilo (608 mg, 2,79 mmoles) a 0°C, y la mezcla se agitó a temperatura ambiente durante 2 horas. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster 1-terc-butílico de ácido (R)-2-metil-pirrolidin-1,2-dicarboxílico como producto bruto. De una manera similar a la Primera Etapa del Ejemplo 4, el compuesto del título se obtuvo a partir del éster 1-terc-butílico de ácido (R)-2-metil-pirrolidin-1,2-dicarboxílico obtenido como producto bruto.
Segunda Etapa
De una manera similar a las etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro de éster metílico de ácido (R)-2-metil-pirrolidin-2-carboxílico obtenido y 3-fluoro-benzaldehído.
T l
<Ejemplo 7> (referencia)
(4aR)-1-[(2,3-Difluorofenil)metil-4-hidroxi-4a-metil-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Primera Etapa
De una manera similar a las Etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro de éster metílico de ácido (R)-2-metil-pirrolidin-2-carboxílico obtenido en la primera etapa de los ejemplos 6 y 2,3-difluorobenzaldehído.
T l 7
<Ejemplo 8> (referencia)
(4aS)-1-[3-Fluorofenil)metil]-4-hidroxi-4a-metil-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Primera Etapa
Hidrocloruro de éster metílico de ácido (S)-2-metil-pirrolidin-2-carboxílico
[Fórmula 35]
De una manera similar a la Primera Etapa del Ejemplo 6, el compuesto del título se obtuvo a partir de ácido (S)-2-metil-pirrolidin-2-carboxílico como producto bruto.
Segunda Etapa
De una manera similar a las etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro de éster metílico de ácido (S)-2-metil-pirrolidin-2-carboxílico obtenido en la primera etapa y 3-fluorobenzaldehído.
Tabla 8
<Ejemplo 9> (referencia)
(4aR)-4a-Etil-1-[(3-fluorofenil)metil]-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Al llevar a cabo operaciones similares a las de las Etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir de hidrocloruro de éster etílico de ácido (S)-2-etil-pirrolidin-2-carboxílico y 3-fluorobenzaldehído.
T l
<Ejemplo 10> (referencia)
(4aR)-1-[(2,3-Difluorofenil)metil]-4a-etil-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Al llevar a cabo operaciones similares a las de las Etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir de hidrocloruro de éster etílico de ácido (R)-2-etil-pirrolidin-2-carboxílico y 2,3-difluorobenzaldehído.
T l 1
<Ejemplo 11> (referencia)
(4aR)-1-[(3-Fluorofenil)metil]-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-4a-propil-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Al llevar a cabo operaciones similares a las de las Etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir de hidrocloruro de éster etílico de ácido (R)-2-metil-pirrolidin-2-carboxílico y 3-fluorobenzaldehído.
Tabla 11
<Ejemplo 12> (referencia)
(4aR)-1-[(2,3-Difluorofenil)metil]-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-4a-propil-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Al llevar a cabo operaciones similares a las de las Etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir de hidrocloruro de éster etílico de ácido (R)-2-propilpirrolidin-2-carboxílico y 2,3-difluorobenzaldehído.
T l 12
<Ejemplo 13>
6-[[2,3-Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
Primera Etapa
2,3-Difluoro-1 -[2-[2-metoxietil(metil)amino]etoxilbenceno
[Fórmula 36]
Se disolvió 2,3-difluoro-1-[2-cloroetoxi]benceno (4,20 g, 22,0 mmoles) en N,N-dimetilformamida (32,9 mL), se añadieron N-(2-metoxietil)-N-metilamina (4,35 g, 48,8 mmoles), yoduro de potasio (6,08 g, 36,6 mmoles) y fosfato de tripotasio (7,77 g, 36,6 mmoles) a 25°C, y la mezcla se agitó en atmósfera de nitrógeno a 100°C durante 2 horas. Después de enfriar la mezcla de reacción a 25°C, se añadió agua (47,0 mL) y el producto resultante se extrajo con acetato de isopropilo (47,0 mL). Se añadió ácido clorhídrico 1 N (47,0 mL) a la capa orgánica para extracción, se añadió una solución acuosa de hidróxido de sodio 5 N (14,1 mL) a la solución acuosa obtenida para la alcalinización, y la mezcla se extrajo con acetato de isopropilo (47,0 mL). La capa orgánica se concentró a presión reducida para obtener el compuesto del título (5,15 g, 95%).
RMN H1 (DMSO-D6Ó: 7,16-7,10 (1H, m), 7,06-7,03 (1H, m), 6,99-6,96 (1H, m), 4,15 (2H, t, J = 5,7 Hz), 3,41 (2H, t, J = 6,0 Hz), 3,22 (3H, s), 2,78 (2H, t, J = 6,0 Hz), 2,59 (2H, t, J = 6,0 Hz), 2,28 (3H, s).
Segunda Etapa
2,3-D¡fluoro-4-f2-f2-metox¡et¡l(met¡l)am¡no]etox¡1benzaldehído
[Fórmula 37]
Se disolvió N,N-diisopropilamina (5,92 mL) en tetrahidrofurano (62,6 mL) y se añadió gota a gota una solución de nbutil litio en hexano (1,6 M, 26,2 mL, 41,9 mmoles) a -20°C. Después de agitar la mezcla a -20°C durante 30 minutos, se enfrió a -50°C y se añadió gota a gota una solución de 2,3-difluoro-1-[2-[2-metoxietil(metil)amino]etoxi]benceno (5,15 g, 21,0 mmoles) en tetrahidrofurano (21,0 mL). Después de agitar la mezcla a -40°C durante 2 horas, se añadió N,N-dimetilformamida (4,94 mL) y la mezcla se agitó durante 30 minutos. Después de calentar la mezcla de reacción a -15°C, se añadió una solución de ácido acético (7,31 mL) en agua (26,1 mL) y tolueno (15,7 mL) para la extracción líquido-líquido. La capa orgánica se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/hexano/trietilamina) para obtener el compuesto del título (2,90 g, 50%).
RMN H1 (DMSO-D6) 5: 10,04 (1H, s), 7,69-7,64 (1H, m), 7,27-7,24 (1H, m), 4,28 (2H, t, J = 5,7 Hz), 3,41 (2H, t, J = 6,0 Hz), 3,22 (3H, s), 2,81 (2H, t, J = 5,7 Hz), 2,60 (2H, t, J = 6,0 Hz), 2,28 (3H, s).
Tercera Etapa
1-[[(E)-2,3-Difluoro-4-[2-[2-[metoxietil(metil)amino]etoxi]fenil]metilidenoamino]-metilamino]ciclobutano-1-carboxilato de metilo
[Fórmula 38]
Se disolvió paratoluenosulfonato de 1-(metilamino)ciclobutanocarboxilato de metilo (1,75 g, 5,54 mmoles) (véase el Ejemplo de Referencia 86) en ácido acético (1,60 mL, 27,7 mmoles) y agua (9,0 mL), se añadió una solución de nitrito de sodio (0,45 g, 6,59 mmoles) disuelto en agua (1,00 mL) a 25°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadieron acetato de etilo (3,50 mL) y cloruro de sodio (1,00 g) a la mezcla de reacción, y la capa orgánica después de la extracción líquido-líquido se lavó con una solución acuosa de hidrogenofosfato de dipotasio al 15%. Se añadió metanol (10,0 mL) a la capa orgánica después del lavado, y se añadió ácido clorhídrico 12 N (3,60 mL) a -10°C. Se añadió polvo de zinc (0,73 g, 11,1 mmoles) a la mezcla de reacción a -30°C, y la mezcla se agitó durante 1 hora. Se añadió a la mezcla de reacción amoniaco acuoso al 28% (3,66 mL), se añadió una solución de 2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]benzaldehído (1,00 g, 3,66 mmoles) en acetato de etilo (2,75 mL) a 0°C y la mezcla se agitó durante 30 minutos. Después de que la mezcla de reacción se concentró, se añadieron acetato de etilo y una solución acuosa de dihidrogenofosfato de potasio al 15% para la extracción líquido-líquido, y posteriormente, la capa orgánica se lavó con una solución acuosa de sulfito de hidrógeno y sodio al 15% y una solución acuosa de hidrogenofosfato de dipotasio al 15%. La capa orgánica se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/metanol) para obtener el compuesto del título (1,07 g, 70%).
LCMS: m/z 414 [M+H]+
Tiempo de retención de HPLC: 0,65 minutos (SQD-TFA05)
Cuarta Etapa
1-[[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil-[3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoil]amino]-metilamino]ciclobutano-1-carboxilato de metilo [Fórmula 39]
Se disolvió 1-[[(E)-[2.3-difluoro-4-[2-[2-metoxietil(meti0amino1etoxi1fenil1metilidenamino1metilamino1ciclobutano-1-carboxilato de metilo (1.00 g. 2.42 mmoles) en acetato de etilo (8.1 mL), se añadió ácido metanosulfónico (1.18 mL, 18.1 mmoles) a 0°C y la mezcla se agitó en atmósfera de nitrógeno durante 10 minutos. Se añadió 5-etil-2-metilpiridina-borano (0.72 mL. 4.84 mmoles) a la mezcla de reacción a 0°C. y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Después de añadir metanol (0.81 mL) a la mezcla de reacción a 0°C. se añadió una solución acuosa de hidróxido de sodio 5 M (2.44 mL). y la mezcla se agitó a 0°C durante 1 hora. Se añadió una solución acuosa de fosfato de tripotasio al 25% a la mezcla de reacción para la extracción líquido-líquido. La capa orgánica se lavó con una solución acuosa de cloruro de sodio al 15%. y el producto resultante se concentró a presión reducida para obtener 1-[[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilamino]-metilamino1ciclobutano-1-carboxilato de metilo como producto bruto.
El producto bruto obtenido y el 3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il1anilino1propanoato (Ejemplo de Referencia 82) (1.05 g. 2.66 mmoles) se disolvieron en acetato de etilo (8.00 mL) y se añadieron N.N-dimetilformamida (4.00 mL). piridina (1.00 mL) y 2.4.6-trióxido de 2.4.6-tripropil-1.3.5.2.4.6-trioxatrifosfinano (una solución 1.7 M en acetato de etilo. 2.85 mL. 4.84 mmoles) a -10°C. y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadió una solución acuosa de cloruro de sodio al 10% a la mezcla de reacción para la extracción líquido-líquido. La capa orgánica se lavó con una solución acuosa de hidrogenofosfato de dipotasio al 15%. y el producto resultante se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/metanol) para obtener el compuesto del título (1.90 g.
97%).
LCMS: m/z 791 [M+H1+
Tiempo de retención de HPLC: 0.81 minutos (SQD-TFA05)
Quinta etapa
6-IT2.3-D¡fluoro-4-r2-r2-metox¡et¡l(met¡l)am¡no1etox¡nbenc¡n-9-h¡drox¡-5-met¡l-7-oxo-N-r4-(tr¡fluoromet¡l)-2-r6-(tr¡fluoromet¡l)p¡r¡m¡d¡n-4-¡nfen¡l1-5.6-d¡azaesp¡ror3.51non-8-eno-8-carboxam¡da
Se suspendió 1-[[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil-[3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoil]amino]metilamino]ciclobutano-1-carboxilato de metilo (2.06 g. 2.60 mmoles) en isopropanol (28.8 mL). se añadió carbonato de potasio (718 mg. 5.20 mmoles) y la mezcla se agitó bajo atmósfera de nitrógeno a 50°C durante 8 horas. Después de concentrar la mezcla de reacción. se añadió ácido clorhídrico 1 M (2.60 mL. 2.60 mmoles) y el producto resultante se extrajo con acetato de etilo. Después de lavar la capa orgánica con una solución acuosa de dihidrogenofosfato de potasio al 10% y una solución acuosa de cloruro de sodio al 10%. la capa orgánica se concentró. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/metanol) para obtener el compuesto del título (1.72 g. 87%).
Aunque existen tautómeros del compuesto del título. se pueden observar isómeros en algunos casos y no en otros casos según el tipo de disolvente para la medición. Por ejemplo. el RMN H1 y el RMN C13 de los principales tautómeros (cloroformo-D) son los siguientes.
LCMS: m/z 759 [M+H1+Tiempo de retención de HPLC: 0.91 minutos (SQD-TFA05)
RMN H1 (CDCls) 5: 16.57 (1H. s). 12.81 (1H. s). 9.61 (1H. s). 8.50 (1H. d. J = 8.7 Hz). 7.95 (1H. s). 7.90 (1H. d. J = 1.6 Hz). 7.80 (1H. dd. J = 8.7. 1.6 Hz). 7.01 (1H. ddd. J = 9.1. 7.2. 1.8 Hz). 6.72 (1H. ddd. J = 8.7. 7.2. 1.3 Hz). 5.08 5.03 (1H. m). 4.19-4.16 (1H. m). 4.19-4.16 (1H. m). 3.54-3.51 (2H. m). 3.37 (3H. s). 2.93 (2H. brs). 2.73 (2H. brs).
2,56 (1H, m), 2,43 (3H, brs), 2,41 (3H, s), 1,86 (1H, m), 1,84 (1H, m), 1,82 (1H, m), 1,71 (1H, m), 1,58 (1H, m).
RMN C13 (CDCI3) 5: 186,1 (qC), 169,8 (qC), 165,7 (qC), 162,8 (qC), 159,3 (CH), 156,6 (qC, q, Jcf = 36,3 Hz), 150,4 (qC, dd, Jcf = 248,4, 10,5 Hz), 147,9 (qC), 141,1 (qC, dd, Jcf = 248,0, 15,0 Hz), 138,8 (qC), 128,3 (CH, q, Jcf = 3,3 Hz), 127,8 (qC), 127,1 (CH), 126,9 (qC, q, Jcf = 33,6 Hz), 125,1 (CH), 124,7 (CH), 123,6 (qC, q, Jcf = 271,8 Hz), 120,5 (qC, q, Jcf = 275,4 Hz), 117,9 (qC, d, Jcf = 11,8 Hz), 115,9 (CH), 109,2 (CH, s), 92,3 (qC), 70,5 (CH2), 68,1 (CH2), 64,1 (qC), 58,9 (CH3), 57,4 (CH2), 56,3 (CH2), 43,4 (CH3), 41,5 (CH2), 35,0 (CH3), 32,4 (CH2), 24,4 (CH2), 13,4 (CH2).
<Ejemplo 14>
7-[[2,3-Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
Primera Etapa
1-[[(E)-2,3-[Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilamino]ciclopentano-1-carboxilato de metilo
Se disolvió paratoluenosulfonato de 1-(metilamino)ciclopentanocarboxilato de metilo (3,60 g, 10,9 mmoles) (véase el Ejemplo de Referencia 88) en ácido acético (3,10 mL, 54,2 mmoles) y agua (18,0 mL), se añadió una solución de nitrito de sodio (0,91 g, 13,2 mmoles) disuelto en agua (2,00 mL) a 25°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadieron acetato de etilo (7,00 mL) y cloruro de sodio (2,00 g) a la mezcla de reacción, y la capa orgánica después de la extracción líquido-líquido se lavó con una solución acuosa de hidrogenofosfato de dipotasio al 15%. Se añadió metanol (20,0 mL) a la capa orgánica después del lavado, y se añadió ácido clorhídrico 12 N (7,30 mL) a -10°C. Se añadió polvo de zinc (1,44 g, 22,0 mmoles) a la mezcla de reacción a -30°C, y la mezcla se agitó durante 1 hora. Se añadió amoníaco acuoso al 28% (7,30 mL) a la mezcla de reacción, se añadió una solución de 2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]benzaldehído (2,00 g, 7,30 mmoles) (Segunda Etapa del Ejemplo 13) en acetato de etilo (5,40 mL) a 0°C y la mezcla se agitó durante 30 minutos. Después de que la mezcla de reacción se concentró, se añadieron acetato de etilo y una solución acuosa de dihidrogenofosfato de potasio al 15% para la extracción líquido-líquido, y posteriormente, la capa orgánica se lavó con una solución acuosa de hidrogenosulfito de sodio al 15% y una solución acuosa de hidrogenofosfato de dipotasio al 15%. La capa orgánica se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/metanol) para obtener el compuesto del título (2,82 g, 90%).
LCMS: m/z 428 [M+H]+Tiempo de retención de HPLC: 0,61 minutos (SQD-FA05)
Segunda Etapa
1-[[[2,3-Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil-[3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoil]amino]-metilamino]ciclopentano-1-carboxilato de metilo
[Fórmula 42]
Se disolvió 1-[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino1etoxi1fenil1metilidenamino1-metilamino1-ciclopentano-1-carboxilato de metilo (1,00 g, 2,34 mmoles) en acetato de etilo (10,0 mL), se añadió ácido metanosulfónico (1,14 mL,
17,6 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 10 minutos. Se añadió 5-etil-2-metilpiridina-borano (0,70 mL, 4,70 mmoles) a la mezcla de reacción a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Después de añadir metanol (1,00 mL) a la mezcla de reacción a 0°C, se añadió una solución acuosa de hidróxido de sodio 5 M (3,00 mL) y la mezcla se agitó a 0°C durante 1 hora. Se añadió una solución acuosa de fosfato de tripotasio al 25% a la mezcla de reacción para la extracción líquido-líquido. La capa orgánica se lavó con una solución acuosa de cloruro de sodio al 15%, y el producto resultante se concentró a presión reducida para obtener 1-[[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilamino]metilamino]-ciclopentano-1-carboxilato de metilo como producto bruto.
El producto bruto obtenido y 3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoato (1,00 g, 2,54 mmoles) se disolvieron en acetato de etilo (8,00 mL) y N,N-dimetilformamida (4,00 mL), y a continuación, se añadieron piridina (1,00 mL) y 2,4,6-trióxido de 2,4,6-tripropil-1,3,5,2,4,6-trioxatrifosfinano (una solución 1,7 M en acetato de etilo, 2,75 mL, 4,68 mmoles) a -10°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadió una solución acuosa de cloruro de sodio al 10% a la mezcla de reacción para la extracción líquido-líquido. La capa orgánica se lavó con una solución acuosa de hidrogenofosfato de dipotasio al 15%, y el producto resultante se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/metanol) para obtener el compuesto del título (1,82 g, 97%).
LCMS: m/z 805 [M+H]+
Tiempo de retención de HPLC: 0,74 minutos (SQD-FA05)
Tercera Etapa
7-[[2,3-Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 43]
Se suspendió 1-[[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil-[3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoil]amino]-metilamino]ciclopentano-1-carboxilato de metilo (500 mg, 0,62 mmoles) en isopropanol (7,00 mL), se añadió carbonato de potasio (175 mg, 1,27 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a 60°C durante 8 horas. Después de concentrar la mezcla de reacción, se añadió ácido clorhídrico 1 M (1,24 mL, 1,24 mmoles) y la mezcla se extrajo con acetato de etilo. Después de lavar la capa orgánica con una solución acuosa de dihidrogenofosfato de potasio al 10% y una solución acuosa de cloruro de sodio al 10%, la capa orgánica se concentró. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/metanol) para obtener el compuesto del título (432 mg, 90%).
Aunque existen tautómeros del compuesto del título, se pueden observar isómeros en algunos casos y no en otros casos según el tipo de disolvente para la medición. Por ejemplo, el RMN H1 y el RMN C13 de los principales tautómeros (cloroformo-D) son los siguientes.
LCMS: m/z 773 [M+H]+
Tiempo de retención de HPLC: 0,95 minutos (SQD-FA05)
RMN H1 (CDCls) 5: 16,55 (1H, s), 12,83 (1H, s), 9,62 (1H, s), 8,49 (1H, d, J = 8,7 Hz), 7,96 (1H, d, J = 1,2 Hz), 7,90 (1H, d, J = 1,6 Hz), 7,79 (1H, dd, J = 8,7, 2,0 Hz), 7,04 (1H, dd, J = 7,4, 7,4 Hz), 6,73 (1H, dd, J = 7,4, 7,4 Hz), 5,05 (1H, d, J = 14,2 Hz), 4,194,18 (1H, m), 4,19 (2H, brs), 3,55 (2H, brs), 3,37 (3H, s), 2,96 (2H, s), 2,76 (2H, s), 2,48 (3H, s) 2,45 (3H, s), 2,15 (1H, m), 1,74 (2H, m), 1,57 (1H, m), 1,50 (1H, m), 1,45 (2H, m), 1,30 (1H, m).
RMN C13 (CDCls) 5: 187,8 (qC), 169,9 (qC), 165,7 (qC), 163,1 (qC), 159,3 (CH), 156,6 (qC, q, J = 36,3 Hz), 150,4 (qC, dd, Jcf = 248,6, 10,6 Hz), 147,9 (qC), 141,1 (qC, dd, Jcf = 248,3, 14,7 Hz), 138,8 (qC), 128,3 (CH), 127,8 (qC), 127,1 (CH), 126,9 (qC, q, Jcf = 33,4 Hz), 125,5 (CH), 124,7 (CH), 123,6 (qC, q, Jcf = 272,1 Hz), 120,5 (qC, q, Jcf = 275,4 Hz), 117,6 (qC, q, Jcf = 12,7 Hz), 116,0 (CH), 109,3 (CH), 93,1 (qC), 71,4 (qC), 70,4 (CH2), 68,0 (CH2), 58,9 (CH3), 57,3 (CH2), 56,3 (CH2), 43,3 (CH3), 41,6 (CH2), 37,6 (CH2), 36,8 (CH3), 31,4 (CH2), 24,8 (CH2), 23,3 (CH2).
<Ejemplo 15> (referencia)
(4aR)-1 -[(3-fluorofenil)metil]-4-hidroxi-N-[5-metil-2-(tritluorometil)furan-3-il]-2-oxo-5,6,7,8-tetrahidro-4aH-pirido[1,2-b]piridazin-3-carboxamida
Primera Etapa
Hidrocloruro de éster metílico de ácido (R)-Piperidina-2-carboxílico
[Fórmula 44]
El ácido (R)-piperidin-2-carboxílico (300 mg, 2,32 mmoles) se disolvió en metanol (4,64 mL), se añadió cloruro de tionilo (0,508 mL, 6,97 mmoles) gota a gota a 0°C y la mezcla se agitó a 50°C durante 18 horas. La mezcla de reacción se concentró a presión reducida, y se añadió tolueno para la eliminación azeotrópica para obtener el compuesto del título en forma de un producto bruto.
Segunda Etapa
De una manera similar a las etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro de éster metílico de ácido (R)-piperidin-2-carboxílico obtenido y 3-fluorobenzaldehído.
Tabla 13
<Ejemplo 16> (referencia)
(4aS)-1 -[(3-Fluorofenil)metil-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-5,6,7,8-tetrahidro-4aH-pirido[1,2-b]piridazin-3-carboxamida
De una manera similar a las etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir de hidrocloruro de éster metílico de ácido (S)-piperidin-2-carboxílico y 3-fluoro-benzaldehído.
T l 14
<Ejemplo 17> (referencia)
(4aS)-1-[(5,6-Difluoro-1H-indol-7-il)metil]-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-5,6,7,8-tetrahidro-4aH-pirido[1,2-b]piridazin-3-carboxamida
De una manera similar a las Etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir de hidrocloruro de éster metílico de ácido (S)-piperidin-2-carboxílico y 5,6-difluoro-1H-indol-7-carbaldehído.
T l 1
<Ejemplo 18> (referencia)
1-[(3-Fluorofenil)metil]-4-hidroxi-4a-metil-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-5,6,7,8-tetrahidropirido[1,2-b]piridazin-3-carboxamida
Primera Etapa
Hidrocloruro de éster metílico de ácido 2-metil-piperidin-2-carboxílico
[Fórmula 45]
De una manera similar a la Primera Etapa del Ejemplo 4, el compuesto del título se obtuvo a partir del éster 1-tercbutílico de ácido 2-metil-piperidin-1,2-dicarboxílico como producto bruto.
Segunda Etapa
De una manera similar a las etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro de éster metílico de ácido 2-metil-piperidin-2-carboxílico obtenido y 3-fluorobenzaldehído.
Tabla 16
<Ejemplo 19> (referencia)
1-[2,3-(Difluorofenil)metil]-4a-etil-4-hidroxi-N-[5-metil-2-(trifluorometil)furan-3-il]-2-oxo-5,6,7,8-tetrahidropirido[1,2-b]piridazin-3-carboxamida
Primera Etapa
Hidrocloruro de éster metílico de ácido 2-etil-piperidin-2-carboxílico
[Fórmula 46]
De una manera similar a la primera etapa del ejemplo 6, el compuesto del título se obtuvo a partir de hidrocloruro de ácido 2-etil-piperidin-2-carboxílico como producto bruto.
Segunda Etapa
De una manera similar a las etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro de éster metílico de ácido 2-etil-piperidin-2-carboxílico obtenido y 2,3-difluoro-benzaldehído.
T l 17
Tiempo de Estructura Nombre de compuesto Condiciones retención de análisis de HPLC m/z
<Ejemplo 20> (referencia)
(4aS,5S,8R)-1 -(3-Fluorobencil)-4-hidroxi-N-(5-metil-2-(trifluorometil)furan-3-il)-2-oxo-2,4a,5,6,7,8-hexahidro-1H-5,8-metanopirido[1,2-b]piridazin-3-carboxamida
Primera Etapa
Hidrocloruro de éster metílico de ácido (1S,3S,6R)-2-aza-biciclo[2,2,1]heptano-3-carboxílico
[Fórmula 47]
Se disolvió éster 2-terc-butílico de ácido (1R,3S,4S)-2-aza-biciclo[2,2,1]heptano-2,3-dicarboxílico (500 mg, 2,07 mmoles) en N,N-dimetilformamida (2,07 mL), se añadieron carbonato de cesio (1,01 g, 3,11 mmoles) y yodometano (0,155 mL, 2,49 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1 hora. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con agua, una solución saturada de bicarbonato de sodio, una solución acuosa de tiosulfato de sodio al 10% y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster 2-tercbutílico y éster 3-metílico de ácido (1R,3S,4S)-2-aza-biciclo[2,2,1]heptano-2,3-dicarboxílico como producto bruto. Se añadió una solución de cloruro de hidrógeno en 1,4-dioxano (4 M, 5,00 mL) al producto bruto obtenido, y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1 hora. La mezcla de reacción se concentró a presión reducida, y se añadió tolueno para la eliminación azeotrópica para obtener el compuesto del título en forma de un producto bruto.
Segunda Etapa
De una manera similar a las Etapas Primera a Tercera del Ejemplo 1, se sintetizaron los compuestos descritos en la siguiente Tabla a partir del hidrocloruro del éster metílico de ácido (1S,3S,6R)-2-aza-biciclo[2,2,1]heptano-3-carboxílico obtenido y 3-fluoro-benzaldehído.
Tabla 18
<Ejemplo de Referencia 1-1>
Éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico
[Fórmula 48]
Primera Etapa
[Fórmula 49]
El éster metílico de ácido (R)-1-((2,3-(difluorobenciliden)amino)-2-metilpirrolidin-2-carboxílico (1,31 g, 4,63 mmoles) se disolvió en metanol (4,6 mL) y ácido acético (4,6 mL), se añadió cianoborohidruro de sodio (1,19 g, 18,98 mmoles), y la mezcla se agitó a temperatura ambiente durante 3 horas. Se añadió una solución acuosa saturada de bicarbonato de sodio, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio anhidro y se filtró, y el disolvente se eliminó por destilación a presión reducida para obtener un producto bruto (1,34 g, 102%) de éster metílico de ácido (R)-1-((2,3-(difluorobencil)amino)-2-metilpirrolidin-2-carboxílico.
Segunda Etapa
[Fórmula 50]
Se disolvieron éster metílico de ácido (R)-1-((2,3-(difluorobencil)amino)-2-metilpirrolidin-2-carboxílico (3,24 g, 11,39 mmoles) y ácido 3-butiloxi-3-propiónico (2,19 g, 13,67 mmoles) en diclorometano (17,7 mL) y a continuación, se añadió hexafluorofosfato de bromotri(pirrolidin-1-il)fosfonio (6,9 g, 14,81 mmoles) y trietilamina (6,37 mL, 45,6 mmoles), y la mezcla se agitó a temperatura ambiente durante 30 minutos. Se añadieron diclorometano y ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se agitó a temperatura ambiente durante 10 minutos. La capa orgánica se separó y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener éster metílico de ácido (R)-1-(N-(2,3-difluorobencil)-3-isobutoxi-3-oxopropanamido)-2-metilpirrolidin-2-carboxílico (4,58 g, 94%)
LCMS: m/z 427 [M+H]+
Tiempo de retención de HPLC: 1,33 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
Se disolvió éster metílico de ácido (R)-1-(N-(2,3-difluorobencil)-3-isobutoxi-3-oxopropanamido)-2-metilpirrolidin-2-carboxílico (30,4 g, 71,2 mmoles) en N,N-dimetilformamida (142 mL), se añadió carbonato de cesio (69,6 g, 214 mmoles) y la mezcla se agitó a 80°C durante 1 hora. Después de dejar enfriar la mezcla, se concentró a presión reducida, se añadió ácido clorhídrico 2 N y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con agua, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo al 0-80%/hexano) para obtener el compuesto del título (25,33 g, 90%).
LCMS: m/z 395 [M+H]+
Tiempo de retención de HPLC: 1,05 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 1-2>
(4aR)-4-Hidroxi-4a-metil-2-oxo-1 -pentil-6,7-dihidro-5H-pirrolo[1,2-si]piridazin-3-carboxilato de metilo
[Fórmula 51]
Se utilizó n-pentil aldehído (0,959 g, 11,1 mmoles) como reactivo, y se llevaron a cabo operaciones similares a las de la Primera Etapa del Ejemplo de Referencia 1-1 para obtener éster metílico de ácido (R)-1-(pentilamino)-2-metilpirrolidin-2-carboxílico (1,73 g) como producto bruto. El derivado de hidrazina obtenido se disolvió en tetrahidrofurano (14 mL), fosfato tripotásico (6,41 g, 30,2 mmoles) y 3-cloro-3-oxopropanoato de metilo (1,62 mL, 15,1 mmoles) y la mezcla se agitó a temperatura ambiente durante la noche. Se añadió acetato de etilo (100 mL) a la mezcla de reacción, y después de lavar la capa orgánica con ácido clorhídrico 1 N, agua y salmuera, se secó sobre sulfato de magnesio. Después de que el producto resultante se filtró, el producto filtrado se concentró a presión reducida, y el residuo se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener éster metílico de ácido (R)-1-(3-metoxi-3-oxo-N-pentilpropanamido)-2-metilpirrolidin-2-carboxílico (1,84 g, 84%) como un aceite de color amarillo. El cuerpo de amida obtenido (1,84 g, 5,59 mmoles) se disolvió en N,N-dimetilformamida (25 mL), se añadió carbonato de cesio (5,47 g, 16,8 mmoles) y la mezcla se agitó a 80°C durante 2 horas. Después de enfriar la mezcla de reacción a temperatura ambiente, se añadió acetato de etilo (50 mL), y después de lavar la capa orgánica con ácido clorhídrico 1 N, agua y salmuera, se secó sobre sulfato de magnesio. Después de que el producto resultante se filtró, el producto filtrado se concentró a presión reducida para obtener el compuesto del título (1,84 g).
LCMS: m/z 297 [M+H]+
Tiempo de retención de HPLC: 1,22 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 2>
(R)-2,5,5-trimetilpirrolidin-2-carboxilato de metilo
[Fórmula 52]
Primera Etapa
[Fórmula 53]
Se añadió 4-clorobenzaldehído (0,736 g, 5,23 mmoles) a una suspensión de éster terc-butílico de 2-aminopropanoato (0,80 g, 5,51 mmoles) y sulfato de magnesio (0,66 g, 5,51 mmoles) en diclorometano (7,3 mL), y la mezcla se agitó a temperatura ambiente durante 2 días. La mezcla de reacción se filtró y el producto filtrado obtenido se concentró a presión reducida. El residuo se disolvió en éter dietílico, se lavó con agua y salmuera, y la capa orgánica se secó sobre sulfato de magnesio y se filtró. El producto filtrado se concentró a presión reducida para obtener éster terc-butílico de 2-((4-clorobenciliden)amino)propanoato (1,29 g) como producto bruto.
Segunda Etapa
[Fórmula 54]
Se disolvieron éster terc-butílico de 2-((4-clorobenciliden)amino)propanoato (2,18 g, 12,2 mmoles) obtenido en la primera etapa y bromuro de (S)-4,4-dibutil-2,6-bis(3,4,5-trifluorofenil)-4,5-dihidro-3H-dinafto[7,6,1,2-cde]azepinio (91 mg, 0,122 mmoles) en tolueno (85 mL) y se añadieron 1-bromo-3-metil-2-buteno (1,71 mL, 14,61 mmoles) e hidróxido de cesio (9,13 g, 60,9 mmoles) a 0°C. Después de agitar la mezcla de reacción a 0°C durante 4 horas, se añadió agua y la mezcla se extrajo con diclorometano. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se filtró. El producto filtrado obtenido se concentró a presión reducida para obtener el éster terc-butílico de ácido (R)-2-((4-clorobenciliden)amino)-2,5-dimetilhex-4-enoico como producto bruto.
Tercera Etapa
Se añadió lentamente ácido clorhídrico 1 N (97 mL, 97 mmoles) a una solución de éster terc-butílico de ácido (R)-2-((4-clorobenciliden)amino)-2,5-dimetilhex-4-enoico (4,09 g, 12,2 mmoles) obtenido en la Segunda Etapa en éter dietílico (97 mL). La mezcla de reacción se agitó intensamente a temperatura ambiente durante 4 horas. La capa orgánica se separó y la capa acuosa se lavó con éter dietílico. Después de ajustar la capa acuosa a pH 9, se extrajo con diclorometano. Los extractos se combinaron, se secaron y se filtraron, y el producto filtrado se concentró a presión reducida para obtener el éster terc-butílico de ácido (R)-2-amino-2,5-dimetilhex-4-enoico como producto bruto.
Cuarta Etapa
[Fórmula 56]
El éster terc-butílico de ácido (R)-2-amino-2,5-dimetilhex-4-enoico (1,03 g, 4,83 mmoles) obtenido en la Tercera Etapa se disolvió en diclorometano (9,7 mL), se añadieron cloruro de p-toluenosulfonilo (1,11 g, 5,79 mmoles), trietilamina (0,81 mL, 5,79 mmoles) y 4-dimetilaminopiridina (5,90 mg, 0,048 mmoles), y la mezcla se agitó a temperatura ambiente durante la noche. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con diclorometano. Los extractos se combinaron, se lavaron con salmuera, se secaron sobre sulfato de sodio y se filtraron, y posteriormente, el producto filtrado se concentró a presión reducida. El residuo se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener éster terc-butílico de ácido (R)-2,5-dimetil-2-(4-metilfenilsulfonamido)hex-4-enoico (1,47 g, 83 %) en forma de aceite de color amarillo.
LCMS: m/z 368 [M+H]+
Tiempo de retención de HPLC: 1,40 minutos (condiciones de análisis SMD-TFA05)
Quinta Etapa
[Fórmula 57]
El éster terc-butílico de ácido (R)-2,5-dimetil-2-(4-metilfenilsulfonamido)hex-4-enoico (1,47 g, 4,00 mmoles) obtenido en la Cuarta Etapa se disolvió en cloroformo (16,0 mL), y la solución se enfrió a 0°C. Se añadió ácido trifluorometanosulfónico (0,14 mL, 1,60 mmoles) a 0°C, y la mezcla de reacción se agitó a 0°C durante 1 hora y a temperatura ambiente durante 2 horas. Se añadió una solución saturada de bicarbonato de sodio a la mezcla de reacción, y la mezcla se extrajo con diclorometano. Los extractos se combinaron, se lavaron con salmuera y se secaron sobre sulfato de sodio. Después de que el producto resultante se filtró, el producto filtrado se concentró a presión reducida para obtener ácido (R)-2,5,5-trimetil-1 -tosilpirrolidin-2-carboxílico como producto bruto.
Sexta Etapa
Se añadió yodometano (2,99 mL, 4,80 mmoles) a una suspensión de ácido (R)-2,5,5-trimetil-1-tosilpirrolidin-2-carboxílico (1,25 g, 4,00 mmoles) obtenido en la Quinta Etapa y carbonato de potasio (829 mg, 6,00 mmoles) en N,N-dimetilformamida (16,0 mL). La mezcla de reacción se agitó a temperatura ambiente durante 1 hora. Se añadió ácido clorhídrico 1 N y la mezcla se extrajo con acetato de etilo. Los extractos se combinaron, se lavaron con salmuera y se secaron sobre sulfato de sodio. Después de que el producto resultante se filtró, el producto filtrado se concentró a presión reducida, y el residuo se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener éster metílico de ácido (R)-2,5,5-trimetil-1-tosilpirrolidin-2-metil éster de ácido carboxílico (1,24 g, 3,81 mmoles) en forma de un sólido de color amarillo pálido.
LCMS: m/z 326 [M+H]+
Tiempo de retención de HPLC: 1,20 minutos (condiciones de análisis SMD-TFA05)
Séptima Etapa
El éster metílico de ácido (R)-2,5,5-trimetil-1 -tosilpirrolidin-2-carboxílico (1,24 g, 3,81 mmoles) obtenido en la Sexta Etapa se disolvió en metanol (38,1 mL) y magnesio (1,85 g, 76 mmoles) fue añadido. La mezcla de reacción se agitó
a temperatura ambiente durante 28 horas. Se añadió ácido clorhídrico 1 N y la capa acuosa se lavó con diclorometano. La capa de agua se ajustó a pH 9 y se extrajo con diclorometano. Los extractos se combinaron, se secaron sobre sulfato de sodio y se filtraron. El producto filtrado se concentró a presión reducida para obtener el compuesto del título (611 mg, 3,57 mmoles) en forma de un aceite incoloro.
RMN H1 (CDCta) ó: 3,73 (3H, s), 2,36-2,30 (1H, m), 1,88-1,80 (1H, m), 1,69-1,53 (2H, m), 1,39 (3H, s), 1,18 (3H, s), 1,17 (3H, s).
<Ejemplo de Referencia 3>
2,3- Difluoro-4-(2-morfolinoetoxi) benzaldehído
[Fórmula 59]
Primera Etapa
[Fórmula 60]
Se añadieron hidrocloruro de 4-(2-cloroetil)morfolina (4,72 g, 25,4 mmoles), carbonato de cesio (18,8 g, 57,7 mmoles) y yoduro de tetrabutilamonio (0,511 g, 1,38 mmoles) a una solución de 2,3-difluorofenol (3,00 g, 23,1 mmoles) en acetonitrilo (46,1 mL), y la mezcla se agitó a 65°C durante 4 horas. Después de enfriar a temperatura ambiente, la mezcla de reacción se filtró a través de una almohadilla de celite, y el producto filtrado se concentró a presión reducida. El residuo se disolvió en acetato de etilo, se lavó con agua, una solución acuosa 2 N de hidróxido de sodio, agua y salmuera, y la capa orgánica se secó sobre sulfato de sodio. Después de que el producto resultante se filtró, el producto filtrado se concentró a presión reducida, y el residuo se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener 4-(2-(2,3-difluorofenoxi)etil)morfolina (5,60 g, 99%) en forma de aceite incoloro.
LCMS: m/z 244 [M+H]+
Tiempo de retención de HPLC: 0,68 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
Una solución de 4-(2-(2,3-difluorofenoxi)etil) morfolina (1,00 g, 4,11 mmoles) y N,N,N’,N’-tetrametiletilendiamina (0,62 mL, 4,11 mmoles) en tetrahidrofurano (13,7 mL) se enfrió a -78°C y se añadió n-butil litio (2,14 mL, 5,34 mmoles). Después de agitar la mezcla a -78°C durante 1 hora, se añadió N,N-dimetilformamida (0,35 mL, 4,52 mmoles) a -78°C. La mezcla de reacción se calentó lentamente a -10°C y la reacción se detuvo con una solución acuosa saturada de cloruro de amonio. La capa acuosa se extrajo con acetato de etilo, y los extractos se combinaron y se lavaron con salmuera, se secaron sobre sulfato de sodio y se filtraron. El producto filtrado se concentró a presión reducida, y el residuo se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título (758 mg, 68%) en forma de un aceite de color amarillo. LCMS: m/z 272 [M+H]+
Tiempo de retención de HPLC: 0,62 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 4>
(4aR)-1-[[2,3-Difluoro-4-(2-morfolin-4-iletoxi) ph6nyl]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico éster 2-metilpropílico
[Fórmula 61]
Primera Etapa
[Fórmula 62]
Se utilizaron 2,3-difluoro-4-(2-morfolinoetoxi)benzaldehído e hidrocloruro de ácido metil (R)-2-metil-pirrolidin-2-carboxílico, y se llevaron a cabo operaciones similares a las de las Etapas Primera a Tercera del Ejemplo 1 para sintetizar (2R)-1-[(E)-[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metilidenamino]-2-metilpirrolidin-2-carboxilato de metilo. LCMS: m/z 412 [M+H]+
Tiempo de retención de HPLC: 0,95 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
Se utilizó éster metílico de ácido (R)-1-((2,3-difluoro-4-(2-morfolinoetoxi)benciliden)amino)-2-metilpirrolidin-2-carboxílico, y se llevaron a cabo operaciones similares a las de la Primera Etapa del Ejemplo de Referencia 1-1 para obtener éster metílico de ácido (R)-1-((2,3-difluoro-4-(2-morfolinoetoxi)bencil)amino)-2-metilpirrolidin-2-carboxílico como producto bruto.
LCMS: m/z 414 [M+H]+
Tiempo de retención de HPLC: 0,63 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
Se utilizaron éster metílico de ácido (R)-1-((2,3-difluoro-4-(2-morfolinoetoxi)bencil)amino)-2-metilpirrolidin-2-carboxílico y ácido 3-butiloxi-3-propiónico, y se llevaron a cabo operaciones similares a las del Ejemplo de Referencia 1-2 para sintetizar (R)-1-(N-(2,3-difluoro-4-(2-morfolinoetoxi)bencil)-3-isobutoxi-3-oxopropanamido)-2-metilpirrolidin-2-carboxilato de metilo.
LCMS: m/z 556 [M+H]+
Tiempo de retención de HPLC: 1,03 minutos (condiciones de análisis SMD-TFA05)
Cuarta Etapa
Se utilizó éster metílico de ácido (R)-1-(N-(2,3-difluoro-4-(2-morfolinoetoxi)bencil)-3-isobutoxi-3-oxopropanamido)-2-metilpirrolidin-2-carboxílico y se llevaron a cabo operaciones similares a las del Ejemplo de Referencia 1-2 para sintetizar el compuesto del título.
LCMS: m/z 524 [M+H]+
Tiempo de retención de HPLC: 1,04 minutos (condiciones de análisis SMD-TFA05)
Los intermedios éster descritos en la siguiente Tabla se sintetizaron utilizando los reactivos de aldehido y derivados de prolina correspondientes para llevar a cabo operaciones similares a las del Ejemplo de Referencia 1-1 o el Ejemplo de Referencia 1-2.
Tabla 19-1
T l 1 -2
<Ejemplo de Referencia 13>
4-(Trifluorometil)-2-[6-(trifluorometil)piridin-3-il]anilina
[Fórmula 65]
Se añadieron tolueno (900 mL), etanol (226 mL) y agua (450 mL) a 2-(tetrametil-1,3,2-dioxaborolan-2-il)-4-(trifluorometil)anilina (60,00 g, 209 mmoles), 5-bromo-2-(trifluorometil)piridina (50,80 g, 225 mmoles), tetrakis(trifenilfosfina)paladio (9,000 g, 7,79 mmoles) y carbonato de potasio (129,0 g, 930 mmoles) en atmósfera de nitrógeno, y la mezcla se agitó a 110°C durante 3 horas. La mezcla de reacción se concentró a presión reducida, se añadió agua (1.000 mL) y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con agua, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/éter de petróleo) para obtener el compuesto del título (63 g, 98%).
LCMS: m/z 307 [M+H]+
Tiempo de retención de HPLC: 0,99 minutos (condiciones de análisis SQD-AA05).
<Ejemplo de Referencia 14>
2-Yodo-5-(2-metoxietoxi)-4-(trifluorometil)anilina
[Fórmula 66]
Primera Etapa
[Fórmula 67]
Se disolvió 2-metoxietanol (0,097 mL, 1,24 mmoles) en N-metilpirrolidona (2 mL) en atmósfera de nitrógeno, se añadió hidruro de sodio (60% en peso, una dispersión en aceite mineral, 30 mg, 1,24 mmoles), y después de agitar la mezcla a temperatura ambiente durante 30 minutos, se añadió 4-bromo-2-fluoro-1-(trifluorometil)benceno (0,118 mL, 0,823 mmoles), y la mezcla se agitó a temperatura ambiente durante 7 días. Se añadió una solución acuosa de dihidrogenofosfato de potasio 0,37 M a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo al 0-10% /hexano) para obtener 4-bromo-2-(2-metoxietoxi)-1-(trifluorometil)benceno (231,2 mg, 94%).
Tiempo de retención de HPLC: 0,63 minutos (condiciones de análisis s Qd-AA50)
TLC (placa de gel de sílice) Valor de Rf: 0,37 (acetato de etilo al 10%/hexano)
Segunda Etapa
[Fórmula 68]
Se disolvieron 4-bromo-2-(2-metoxietoxi)-1-(trifluorometil)benceno (231,2 mg, 0,773 mmoles), ácido carbámico tbutilo (109 mg, 0,928 mmoles), acetato de paladio(II) (5,21 mg, 0,023 mmoles), 2-diciclohexilfosfino-2’,4',6'-triisopropil-1,1 '-bifenilo (33,2 mg, 0,07 mmoles) y carbonato de cesio (353 mg, 1,08 mmoles) en 1,4-dioxano (5,2 mL), y la mezcla se agitó bajo atmósfera de nitrógeno a 100°C durante la noche. Se añadió una solución acuosa de dihidrogenofosfato de potasio 0,37 M a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión
reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo al 0-20%/hexano) para obtener éster terc-butílico de ácido (3-(2-metoxietoxi)-4-(trifluorometil)fenil)carbámico (192,5 mg, 74%)
LCMS: m/z 334 [M-H]-Tiempo de retención de HPLC: 1,02 minutos (condiciones de análisis SQD-AA05)
Tercera Etapa
[Fórmula 69]
Se añadió una solución de cloruro de hidrógeno 4 N/1,4-dioxano (3,9 mL) a éster terc-butílico de ácido (3-(2-metoxietoxi)-4-(trifluorometil)fenil)carbámico (192,5 mg, 0,574 mmoles), y la mezcla se agitó a temperatura ambiente durante la noche. La mezcla de reacción se concentró a presión reducida, se añadió éter/hexano (1/3) al residuo resultante, el sólido depositado se recogió mediante filtración y el producto resultante se secó al vacío para obtener hidrocloruro de 3-(2-metoxietoxi)-4-(trifluorometil)anilina (128,1 mg, 82%).
LCMS: m/z 236 [M+H]+
Tiempo de retención de HPLC: 0,83 minutos (condiciones de análisis SQD-AA05)
Cuarta Etapa
Se disolvió hidrocloruro de 3-(2-metoxietoxi)-4-(trifluorometil)anilina (55,9 mg, 0,206 mmoles) en ácido acético (1,03 mL), se añadió N-yodosuccinimida (50,9 mg, 0,226 mmoles), y la mezcla se agitó a temperatura ambiente durante 2 horas y 20 minutos. La mezcla de reacción se concentró a presión reducida, se añadió acetato de etilo, se lavó con hidróxido de sodio 0,5 N y salmuera, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo al 0-40%/hexano) para obtener el compuesto del título (69,2 mg, 93%).
LCMS: m/z 362 [M+H]+
Tiempo de retención de HPLC: 1,19 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 15>
2', 3'-dimetoxi-4-(2-metoxietoxi)-5-(trifluorometil)-[1,1 '-bifenil]-2-amina
[Fórmula 70
Se añadieron tolueno (2,7 mL) y etanol (1,1 mL) a 2-yodo-5-(2-metoxietoxi)-4-(trifluorometil)anilina (69,2 mg, 0,192 mmoles), ácido (2,3-dimetoxifenil)borónico (34,9 mg, 0,192 mmoles) y 1,1'-bis(difenilfosfino)ferrocenodicloropaladio(II) (7,9 mg, 0,0096 mmoles), a continuación, se añadió una solución acuosa 2 M de carbonato de potasio (0,38 mL) y la mezcla se agitó bajo atmósfera de nitrógeno a 100°C durante 1 hora. Se añadió una solución acuosa de dihidrogenofosfato de potasio 0,37 M a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo al 0-40%/hexano), para obtener el compuesto del título (41,1 mg, 58%).
LCMS: m/z 372 [M+H]+
Tiempo de retención de HPLC: 1,21 minutos (condiciones de análisis SMD-TFA05)
Se utilizaron los derivados y haluros de ácido borónico descritos en la siguiente Tabla, y se llevaron a cabo operaciones similares a las del Ejemplo de Referencia 13 o el Ejemplo de Referencia 15 para sintetizar intermedios de anilina descritos en la siguiente tabla.
T l 2-1
T l 2-2
T l 2-
T l 2-4
T l 2-
T l 2-
<Ejemplo de Referencia 63>
6-(2-Amino-5-(trifluorometil)fenil)pirimidin-4-carbonitrilo [Fórmula 71]
Se disolvieron 2-(6-cloropirimidin-4-il)-4-(trifluorometil)anilina (1,0 g, 3,65 mmoles) y 1,4-diazabiciclo[2,2,2]octano (0,246 g, 2,19 mmoles) en dimetilsulfóxido (3 mL), se añadió una solución acuosa (3 mL) de cianuro de potasio (0,95 g, 14,6 mmoles) a 0°C, y la mezcla se agitó a temperatura ambiente durante la noche. Se añadió una solución acuosa de dihidrogenofosfato de potasio 0,37 M a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (40 -100% acetonitrilo/agua) para obtener el compuesto del título (365,6 mg, 38%).
LCMS: m/z 265 [M+H]+
Tiempo de retención de HPLC: 1,16 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 64>
5-(2-Amino-5-(trifluorometil)fenil)-4-metoxipirimidin-2-carbonitrilo
[Fórmula 72]
Una mezcla de 2-(2-cloro-4-metoxipirimidin-5-il)-4-(trifluorometil)anilina (89 mg, 0,293 mmoles), dicianuro de zinc (20,65 mg, 0,176 mmoles), 1,1'-bis(difenilfosfino)ferroceno (18,07 mg, 0,032 mmoles) y tris (dibencilidenacetona)dipaladio(0)aducto de cloroformo (30,3 mg, 0,029 mmoles) en N,N-dimetilformamida (1,5 mL) se calentó y agitó bajo atmósfera de nitrógeno a 80°C por 1 hora. Adicionalmente, la mezcla de reacción se calentó y se agitó a 110°C durante 9 horas. La mezcla de reacción se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo-agua, ácido fórmico al 0,03%) para obtener 5-(2-amino-5-(trifluorometil)fenil)-4-metoxipirimidin-2-carbonitrilo (57 mg, 66%).
LCMS: m/z 295 [M+H]+
Tiempo de retención de HPLC: 0,82 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 65>
6-(2-Amino-5-(trifluorometil)fenil)-5-cloropirimidin-4-carbonitrilo
[Fórmula 73]
Se utilizó 2-(5,6-dicloropirimidin-4-il)-4-(trifluorometil)anilina, y se realizaron operaciones similares a las del Ejemplo de Referencia 63 para sintetizar el compuesto del título.
LCMS: m/z 299 [M+H]+
Tiempo de retención de HPLC: 0,82 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 66>
6-(2-Amino-5-(trifluorometil)fenil)-5-metoxipirimidin-4-carbonitrilo
Se utilizó 2-(6-cloro-5-metoxipirimidin-4-il)-4-(trifluorometil)anilina, y se llevaron a cabo operaciones similares a las del Ejemplo de Referencia 63 para sintetizar el compuesto del título.
LCMS: m/z 295 [M+H]+
Tiempo de retención de HPLC: 0,81 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 67>
6-(2-Amino-5-(trifluorometil)fenil)-5-metilpirimidin-4-carbonitrilo
[Fórmula 75]
Se utilizó 2-(6-cloro-5-metilpirimidin-4-il)-4-(trifluorometil)anilina, y se realizaron operaciones similares a las del Ejemplo de Referencia 63 para sintetizar el compuesto del título.
LCMS: m/z 279 [M+H]+
Tiempo de retención de HPLC: 0,78 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 68>
5-(2-Amino-5-(trifluorometil)fenil)pirazin-2-carbonitrilo
[Fórmula 76]
Una mezcla de 2-(5-bromopirazin-2-il)-4-(trifluorometil)anilina (27,6 mg, 0,087 mmoles), dicianuro de zinc (6,1 mg, 0,052 mmoles) y tetrakis(trifenilfosfina)paladio(0) (5) mg, 0,0043 mmoles) en N,N-dimetilformamida (0,4 mL) se calentó y se agitó bajo atmósfera de nitrógeno a 80°C durante 18 horas. La mezcla de reacción se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo-agua, ácido fórmico al 0,03%) para obtener 5-(2-amino-5-(trifluorometil)fenil)pirazin-2-carbonitrilo.
LCMS: m/z 265 [M+H]+
Tiempo de retención de HPLC: 0,81 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 69>
2-(6-Metilpirimidin-4-il)-4-(trifluorometil)anilina
[Fórmula 77]
Se disolvieron 2-(6-cloropirimidin-4-il)-4-(trifluorometil)anilina (51,9 mg, 0,19 mmoles), trimetil boroxina (0,053 mL,
0,379 mmoles), cloruro de bis(trifenilfosfina)paladio(II) (13,3 mg, 0,019 mmoles) y fosfato de tripotasio (161 mg, 0,759 mmoles) en 1,4-dioxano (0,95 mL) y la mezcla se agitó a 90°C durante 1 hora. Se añadió una solución acuosa de dihidrogenofosfato de potasio 0,37 M a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo al 0 - 30%/hexano) para obtener el compuesto del título (27,4 mg, 57%).
LCMS: m/z 254 [M+H]+
Tiempo de retención de HPLC: 0,93 minutos (condiciones de análisis SQD-AA05)
<Ejemplo de Referencia 70>
2-(Trifluorometil)-4-(6-(trifluorometil)piridin-3-il)pirimidin-5-amina
[Fórmula 78]
Primera Etapa
Se utilizaron éster etílico de ácido 4-yodo-2-(trifluorometil)pirimidin-5-carboxílico y ácido (6-(trifluorometil)piridin-3-il) borónico, y se realizaron operaciones similares a las del Ejemplo de Referencia 13 para sintetizar 2- éster etílico de ácido (trifluorometil)-4-(6-(trifluorometil)piridin-3-il)pirimidin-5-carboxílico.
LCMS: m/z 366 [M+H]+
Tiempo de retención de HPLC: 1,26 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
El éster etílico de ácido 2-(trifluorometil)-4-(6-(trifluorometil)piridin-3-il)pirimidin-5-carboxílico obtenido en la primera etapa (36 mg, 0,10 mmoles) se disolvió en una mezcla disolvente de etanol (1 mL) y agua (1 mL), y se añadió hidróxido de sodio (7,9 mg, 0,20 mmoles) a temperatura ambiente. Después de agitar la mezcla a temperatura ambiente durante 1 hora, el disolvente se concentró a presión reducida y se añadió ácido clorhídrico 1 N (5 mL) al residuo. Después de que el producto resultante se extrajo con acetato de etilo, la capa orgánica se secó sobre sulfato de magnesio y se filtró. El producto filtrado se concentró a presión reducida para obtener ácido 2-(trifluorometil)-4-(6-(trifluorometil)piridin-3-il)pirimidin-5-carboxílico como producto bruto (30 mg).
LCMS: m/z 338 [M+H]+
Tiempo de retención de HPLC: 1,05 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
Se añadió N,N-dimetilformamida (1,5 mL) a ácido 2-(trifluorometil)-4-(6-(trifluorometil)piridin-3-il)pirimidin-5-carboxílico obtenido en la Segunda Etapa (30 mg, 0,09 mmoles), trietilamina (8,9 mg, 0,09 mmoles) y difenilfosforilazida (DPPA, 24,3 mg, 0,09 mmoles), y la mezcla se agitó a 60°C durante 3 horas. Se añadió agua (1,5
mL) a la mezcla de reacción, y el producto resultante se agitó a 80°C durante 3 horas. La mezcla de reacción se enfrió a temperatura ambiente, se añadió una solución acuosa de hidróxido de sodio 1 N, y después de que el producto resultante se extrajo con acetato de etilo, se secó sobre sulfato de magnesio y se filtró. El producto filtrado se concentró a presión reducida para obtener el compuesto del título (26 mg) en forma de un producto bruto.
LCMS: m/z 309 [M+H]+
Tiempo de retención de HPLC: 1,08 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 71>
4-Bromo-2-(6-(trifluorometil)pirimidin-4-il)anilina
[Fórmula 81]
Se utilizaron 2-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)anilina y 4-cloro-6-(trifluorometil)pirimidina como reactivo y sustancia de partida, respectivamente, y se llevaron a cabo operaciones similares a las del Ejemplo de Referencia 13 para obtener 2-(6-(trifluorometil)pirimidin-4-il)anilina. Se añadió 1-bromopirrolidin-2,5-diona (66,2 mg, 0,372 mmoles) a una solución de 2-(6-(trifluorometil)pirimidin-4-il)anilina (89 mg, 0,372 mmoles) en ácido acético (0,94 mL)/agua (0,0067 mL) a temperatura ambiente. La mezcla de reacción se calentó a 55°C y se agitó durante 3,5 horas. La mezcla de reacción se enfrió a temperatura ambiente, y la eliminación azeotrópica con tolueno se llevó a cabo tres veces. El residuo se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título (60 mg, 50%) en forma de un sólido de color amarillo.
LCMS: m/z 318 [M+H]+
Tiempo de retención de HPLC: 1,24 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 21> (referencia)
(4aR)-1 -[(2,3-Difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 82]
Se disolvieron éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (20 mg, 0,0567 mmoles) y 4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)anilina (Ejemplo de Referencia 50, 18 mg, 0,0596 mmoles) en tolueno (0,2 mL), y la mezcla se agitó a 90°C durante 3,5 horas. Después de dejar enfriar la mezcla, el producto resultante se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título (36 mg, 99%).
LCMS: m/z 628 [M+H]+
Tiempo de retención de HPLC: 1,17 minutos (condiciones de análisis SQD-AA05)
Tautómero mayoritario
RMN H1 (CDCls) 5: 16,47 (1H, s), 12,91 (1H, s), 9,60 (1H, s), 8,47 (1H, d, J = 8,7 Hz), 7,95 (1H, s), 7,90 (1H, s), 7,79 (1H, d, J = 8,7 Hz), 7,13-7,10 (2H, m), 7,05-7,03 (1H, m), 5,08 (1H, d, J = 14,3 Hz), 4,47 (1H, d, J = 14,3 Hz), 3,33 (1H, ddd, J = 9,0,9,0, 3,2 Hz), 2,76 (1H, ddd, J = 9,0, 8,7, 8,7 Hz), 2,56-2,54 (1H, m), 1,76-1,73 (1H, m), 1,69-1,64 (2H, m), 1,00 (3H, s).
Tautómero minoritario
RMN H1 (CDCls) 5: 18,22 (1H, s), 12,98 (1H, s), 9,59 (1H, s), 8,33 (1H, d, J = 8,7 Hz), 7,92 (2H, d, J = 9,6 Hz), 7,79 (1H, d, J = 8,7 Hz), 7,14-7,06 (3H, m), 5,10 (1H, d, J = 14,0 Hz), 4,52 (1H, d, J = 14,6 Hz), 3,29-3,25 (1H, m), 2,78 2,75 (1H, m), 2,64-2,59 (1H, m), 1,73-1,66 (2H, m), 1,49-1,46 (1H, m), 0,84 (3H, s).
Se utilizaron los reactivos de anilina apropiados del Ejemplo de Referencia 13 y 15 a 71 y los intermedios éster apropiados de los Ejemplos de Referencia 1-1 y 1-2 y los Ejemplos de Referencia 4 a 12, y se llevaron a cabo operaciones similares a las del Ejemplo 21 para sintetizar el compuestos descritos en la siguiente Tabla (Ejemplos de Referencia). Obsérvese que en los Ejemplos 59 y 60, se utilizó N,N-dimetilformamida como disolvente en lugar de tolueno.
T l 21-1
Tabla 21-2
T l 21-
T l 21-4
T l 21-
T l 21-
T l 21-7
Tabla 21-8
T l 21-
T l 21-1
Aunque existen tautómeros de los compuestos descritos en esta tabla, por ejemplo, el RMN H1 de los Ejemplos 22 y 52 es el siguiente.
<Ejemplo 22>
Tautómero mayoritario
RMN H1 (CDCb) 5: 16,12 (1H, s), 11,93 (1H, s), 9,35 (1H, s), 8,54 (1H, d, J = 8,8 Hz), 7,77 (1H, d, J = 8,9 Hz), 7,59 (1H, s), 6,97 (1H, dd, J = 7,8, 7,8 Hz), 6,76 (1H, dd, J = 7,8, 7,8 Hz), 4,81 (1H, d, J = 14,2 Hz), 4,32 (1H, d, J = 14,3 Hz), 4,20 (2H, t, J = 5,7 Hz), 3,74 (4H, t, J = 4,5 Hz), 3,29 (1H, ddd, J = 8,8, 8,7, 3,0 Hz), 2,84 (2H, t, J = 5,6 Hz), 2,67 (1H, ddd, J = 8,8, 8,8, 8,8 Hz), 2,61-2,59 (4H, m), 2,55-2,53 (1H, m), 2,45 (3H, s), 1,74-1,71 (1H, m), 1,67-1,62 (2H, m), 0,99 (3H, s).
Tautómero minoritario
RMN H1 (CDCls) 5: 17,93 (1H, s), 12,03 (1H, s), 9,32 (1H, s), 8,36 (1H, d, J = 8,9 Hz), 7,77 (1H, d, J = 8,9 Hz), 7,61 (1H, s), 7,06 (1H, dd, J = 18,5, 10,0 Hz), 6,73 (1H, t, J = 10,0 Hz), 5,00 (1H, d, J = 14,4 Hz), 4,42 (1H, d, J = 14,6 Hz), 4,19 (2H, q, J = 6,7 Hz), 3,74 (4H, t, J = 4,5 Hz), 3,24-3,22 (1H, m), 2,84 (2H, t, J = 5,6 Hz), 2,70-2,66 (1H, m), 2,60 (4H, s), 2,55-2,49 (1H, m), 2,40 (3H, s), 1,67-1,62 (2H, m), 1,44-1,41 (1H, m), 0,79 (3H, s).
<Ejemplo 52>
Tautómero mayoritario
RMN H1 (CDCls) 5: 16,13 (1H, s), 11,97 (1H, s), 8,87 (1H, d, J = 5,0 Hz), 8,46 (1H, d, J = 8,6 Hz), 7,81 (1H, s), 7,74 (1H, d, J = 8,6 Hz), 7,60 (1H, d, J = 4,9 Hz), 7,53 (1H, s), 6,99 (1H, dd, J = 7,8, 7,8 Hz), 6,78 (1H, dd, J = 7,8, 7,8 Hz), 4,83 (1H, d, J = 14,3 Hz), 4,31 (1H, d, J = 14,3 Hz), 4,20 (2H, t, J = 5,7 Hz), 3,74 (4H, t, J = 4,2 Hz), 3,31 (1H, ddd, J = 8,8, 8,8, 3,0 Hz), 2,85-2,83 (2H, m), 2,69 (1H, ddd, J = 8,8, 8,8, 8,8 Hz), 2,61 (4H, brs), 2,56-2,51 (1H, m), 1,75 1,72 (1H, m), 1,67-1,65 (2H, m), 0,99 (3H, s).
Tautómero minoritario
RMN H1 (CDCb) 5: 17,91 (1H, s), 12,05 (1H, s), 8,82 (1H, d, J = 4,9 Hz), 8,24 (1H, d, J = 8,5 Hz), 7,77 (1H, s), 7,74 (1H, d, J = 8,6 Hz), 7,58 (1H, d, J = 5,0 Hz), 7,54 (1H, brs), 7,06 (1H, t, J = 7,8 Hz), 6,73 (1H, t, J = 7,7 Hz), 5,01 (1H, d, J = 14,4 Hz), 4,43 (1H, d, J = 14,5 Hz), 4,19 (2H, dd, J = 12,1,6,2 Hz), 3,74 (4H, t, J = 4,2 Hz), 3,27-3,24 (1H, m),
2,84 (2H, s), 2,74-2,72 (1H, m), 2,61 (3H, brs), 2,50-2,46 (1H, m), 1,78-1,63 (3H, m), 1,45-1,42 (1H, m), 0,81 (3H, s). <Ejemplo 109> (referencia)
(4aR)-N-[2-(5-Ciano-6-metilpiridin-3-il)-4-(trifluorometil)fenil]-1 -[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 83]
Se utilizó (4aR)-N-[2-(6-Cloro-5-cianopiridin-3-il)-4-(trifluorometil)fenil]-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 68) como sustancia de partida, y se llevaron a cabo operaciones similares a las del Ejemplo de Referencia 69 para obtener el compuesto del título.
LCMS: m/z 598 [M+H]+
Tiempo de retención de HPLC: 1,63 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 110> (referencia)
(4aR)-1 -[(2,3-(Difluorofenil)metil]-N-[2-[1-(dimetilsulfamoil)piperidin-4-il]-4-(trifluorometil)fenil]-4-hidroxi-4ametil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-si]piridazin-3-carboxamida
[Fórmula 84]
Primera Etapa
Se utilizaron 2-bromo-4-(trifluorometil)anilina y ácido (1-(terc-butoxicarbonil)-1,2,3,6-tetrahidropiridin-4-il)borónico como reactivo y sustancia de partida, respectivamente, y se llevaron a cabo operaciones similares a las del Ejemplo de Referencia 13 para obtener éster terc-butílico de ácido 4-(2-amino-5-(trifluorometil)fenil)-5,6-dihidropiridin-1(2H)-carboxílico.
LCMS: m/z 243 [M+H-C4HgOCO]+
Tiempo de retención de HPLC: 1,31 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
[Fórmula 86]
El derivado de anilina obtenido en la primera etapa (0,73 g, 2,13 mmoles) se disolvió en metanol (21,2 mL), se añadió hidróxido de paladio-carbono (20% en peso, 0,15 g, 0,21 mmoles) y la mezcla se agitó en atmósfera de hidrógeno a temperatura ambiente durante la noche. Después de que la mezcla de reacción se filtró a través de un celite, el producto filtrado se concentró a presión reducida para obtener éster terc-butílico de ácido 4-(2-amino-5-(trifluorometil)fenil)piperidin-1 -carboxílico (0,70 g, 91%) en forma de un producto bruto.
Tercera Etapa
[Fórmula 87]
El derivado de anilina obtenido en la Segunda Etapa y el compuesto descrito en el Ejemplo de Referencia 1-1 se utilizaron como reactivo y sustancia de partida, respectivamente, y se llevaron a cabo operaciones similares a las del Ejemplo 21 para obtener 4-[2-[[(4aR)-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carbonilo]amino]-5-(trifluorometil)fenil] piperidin-1 -carboxilato de terc-butilo.
LCMS: m/z 565 [M+H-C4 H9OCO]+
Tiempo de retención de HPLC: 1,78 minutos (condiciones de análisis SMD-TFA05)
Cuarta Etapa
Se añadió una solución 4 N de cloruro de hidrógeno/dioxano (5 mL) al derivado de amida obtenido en la Tercera Etapa (0,81 g, 1,23 mmoles) a 0°C, y la mezcla se agitó a temperatura ambiente durante 1 hora. La mezcla de reacción se concentró a presión reducida para obtener hidrocloruro de (4aR)-1-[(2,3-difluorofenil)metil]-4-hidroxi-4ametil-2-oxo-N-[2-piperidin-4-il- 4-(trifluorometil)fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (776 mg) en forma de un sólido amorfo de color amarillo.
LCMS: m/z 565 [M+H]+
Tiempo de retención de HPLC: 1,24 minutos (condiciones de análisis SMD-TFA05)
Quinta etapa
El hidrocloruro obtenido en la Cuarta Etapa (0,030 g, 0,050 mmoles) se disolvió en N,N-dimetilformamida (0,25 mL), y a continuación, se añadieron trietilamina (0,021 mL, 0,15 mmoles) y cloruro de dimetilsulfamoilo (0,0054 mL, 0,050 mmoles) a temperatura ambiente, y la mezcla se agitó durante 2 horas. La mezcla de reacción se purificó directamente mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título (24 mg, 71%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 672 [M+H]+
Tiempo de retención de HPLC: 1,66 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 111> (referencia)
(4aR)-N-[2-[5-Ciano-6-(2-oxa-6-azaespiro[3,3]heptan-6-il)piridin-3-il]-4-(trifluorometil)fenil]-1 -[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 89]
Se disolvió (4aR)-N-[2-(6-cloro-5-cianopiridin-3-il)-4-(trifluorometil)fenil]-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 68) (20 mg, 0,032 mmoles) en 1,2-dicloroetano (0,32 mL) bajo atmósfera de nitrógeno, se añadieron oxalato de 2-oxa-6-azaespiro[3,3]heptano (24,5 mg, 0,129 mmoles) y N,N-diisopropiletilamina (0,068 mL, 0,388 mmoles), y la mezcla se agitó a temperatura ambiente durante la noche a 60°C durante 2 días. Se añadieron una solución acuosa de dihidrogenofosfato de potasio 0,37 M y diclorometano a la mezcla de reacción, la mezcla se agitó intensamente y, posteriormente, la capa de agua se
separó mediante un separador de fases, y la capa orgánica se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo al 30 - 95%/agua) para obtener el compuesto del título (19,7 mg, 89%).
LCMS: m/z 681 [M+H]+
Tiempo de retención de HPLC: 0,99 minutos (condiciones de análisis SMD-TFA50)
<Ejemplo 112> (referencia)
2-[[5-[2-[[(4aR)-1 -[(2,3-Difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carbonil]-5-(trifluorometil)fenil]-3-cianopiridin-2-il]-metilamino]acetato de metilo
[Formula 90]
Se utilizó éster metílico de N-metilglicina como reactivo, y se realizaron operaciones similares a las del Ejemplo 111 para sintetizar el compuesto del título.
LCMS: m/z 685 [M+H]+
Tiempo de retención de HPLC: 1,65 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 113> (referencia)
(4aR)-N-f2-(6-C¡ano-5-met¡lsulfan¡lp¡r¡din-3-¡l)-4-(tr¡fluoromet¡l)fen¡ n -1 -[(2.3-difluorofenil)metil-4-hidroxi-4a-met¡l-2-oxo-6,7-d¡h¡dro-5H-p¡rrolo[1,2-s¡1p¡r¡daz¡n-3-carboxam¡da
[Fórmula 91]
Se disolvió (4aR)-N-[2-(6-ciano-5-nitropiridin-3-il)-4-(trifluorometil)fenil]-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 99) (26,1 mg, 0,042 mmoles) en N,N-dimetilformamida (0,3 mL), se añadió tiometóxido de sodio (2,91 mg, 0,042 mmoles) y la mezcla se agitó a temperatura ambiente durante 3 días. Se añadió una solución acuosa de dihidrogenofosfato de potasio 0,37 M a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo al 30 - 90% (ácido fórmico al 0,1%)/agua (ácido fórmico al 0,1%) para obtener el compuesto del título (17,7 mg, 49%).
LCMS: m/z 630 [M+H]+
Tiempo de retención de HPLC: 1,04 minutos (condiciones de análisis SMD-TFA50)
<Ejemplo 114> (referencia)
(4aR)-N-[2-(6-Ciano-5-metoxipiridin-3-il)-4-(trifluorometil)fenil]-1 -[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 92]
Se utilizó metóxido de sodio como reactivo, y se llevaron a cabo operaciones similares a las del Ejemplo 113 para sintetizar el compuesto del título.
LCMS: m/z 614 [M+H]+
Tiempo de retención de HPLC: 1,62 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo de Referencia 72>
7-[4-[[(4aR)-4-Hidroxi-4a-metil-3-(2-metilpropoxicarbonil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenil]hept-6-inoato
Una suspensión de éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (Ejemplo de Referencia 5) (250 mg, 0,480 mmoles), ácido hept-6-inoico (0,182 mL, 1,44 mmoles), yoduro de cobre(I) (18,3 mg, 0,0960 mmoles), trietilamina (0,335 mL, 2,40 mmoles) y cloruro de bis(trifenilfosfina)paladio(II) (33,7 mg, 0,0480 mmoles) en tetrahidrofurano (0,961 mL) se agitó en atmósfera de nitrógeno a temperatura ambiente durante 2,5 horas. Al mismo tiempo, se ejecutó la misma reacción completamente en otro recipiente a la misma escala, y ambos productos resultantes se combinaron y purificaron mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (328 mg, 66%) en forma de un aceite de color amarillo.
LCMS: m/z 519 [M+H]+
Tiempo de retención de HPLC: 1,00 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 73>
7-[4-[[(4aR)-4-Hidroxi-4a-metil-3-(2-metilprpoxicarbonil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenil]heptanoato
Una solución de ácido 7-[4-[[(4aR)-4-hidroxi-4a-metil-3-(2-metilpropoxicarbonil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b] piridazin-1-il]metil]-2,3-difluorofenil]hept-6-inoico (Ejemplo de Referencia 72) (358 mg, 0,69 mmoles) e hidróxido de paladio-carbono (20% en peso, aproximadamente 50% de humedad con agua, 145 mg) en 2,2,2-trifluoroetanol (7 mL) se agitó en atmósfera de hidrógeno a temperatura ambiente durante 2 horas. Además, se añadió hidróxido de paladio-carbono (20% en peso, aproximadamente 50% de humedad con agua, 145 mg), y la mezcla de reacción se agitó a temperatura ambiente durante 1 hora. Después de que la mezcla de reacción se filtró a través de una almohadilla de celite, el producto filtrado se concentró para obtener el compuesto del título (361 mg, 100%) en forma de un aceite de color pardo claro.
LCMS: m/z 523 [M+H]+
Tiempo de retención de HPLC: 1,05 minutos (condiciones de análisis SQD-AA05)
<Ejemplo 115> (referencia)
7-[4-[[(4aR)-4-hidroxi-4a-metil-3-[[2-(6-metilsulfanilpiridin-3-il)-4-(trifluorometil)fenil]carbamoil]-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1 -il]metil]-2,3-difluorofenil]heptanoato
Se utilizaron 7-[4-[[(4aR)-4-hidroxi-4a-metil-3-(2-metilpropoxicarbonil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenil]heptanoato (Ejemplo de Referencia 73) y 2-(6-(metiltio)piridin-3-il)-4-(trifluorometil)anilina, y se llevaron a cabo operaciones similares a las del Ejemplo 21 para sintetizar el compuesto del título.
LCMS: m/z 733 [M+H]+
Tiempo de retención de HPLC: 1,25 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 116> (referencia)
7-[4-[[(4aR)-3-[[4-cloro-2-[6-(trifluorometil)piridin-3-il]fenil]carbamoil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1 -il]metil]-2,3-difluorofenil]heptanoato
Se utilizaron 7-[4-[[(4aR)-4-hidroxi-4a-metil-3-(2-metilpropoxicarbonil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenil]heptanoato (Ejemplo de Referencia 73) y 4-cloro-2-(6-(trifluorometil)piridin-3-il)anilina, y se llevaron a cabo operaciones similares a las del Ejemplo 21 para sintetizar el compuesto del título.
LCMS: m/z 721 [M+H]+
Tiempo de retención de HPLC: 1,22 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 117> (referencia)
7-[4-[[(4aR)-4-hidroxi-4a-metil-3-[[2-(6-metilsulfanilpiridin-3-il)-4-(trifluorometil)fenil]carbamoil]-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1 -il]metil]-2,3-difluorofenil]hept-6-inoato
[Fórmula 97]
Se utilizó ácido 7-[4-[[(4aR)-4-Hidroxi-4a-metil-3-(2-metilpropoxicarbonil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1 -il]metil]-2,3-difluorofenil]hept-6-inoico (Ejemplo de Referencia 72) como sustancia de partida, se utilizó 2-(6-(metiltio)piridin-3-il)-4-(trifluorometil)anilina como reactivo, y se llevaron a cabo operaciones similares a las del Ejemplo 21 para sintetizar el compuesto del título.
LCMS: m/z 729 [M+H]+
Tiempo de retención de HPLC: 1,61 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 118> (referencia)
7-[4-[[(4aR)-4-hidroxi-4a-metil-3-[[2-(2-metilsulfanilpirimidin-5-il)-4-(trifluorometil)fenil]carbamoil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1 -il]metil]-2,3-difluorofenil]hept-6-inoato
[Fórmula 98]
Se utilizaron ácido 7-[4-[[(4aR)-4-Hidroxi-4a-metil-3-(2-metilpropoxicarbonil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2
b]piridazin-1-il]metil]-2,3-difluorofenil]hept-6-inoico (Ejemplo de Referencia 72) y 2-(2-(metiltio)pirimidin-5-il)-4-(trifluorometil)anilina, y se llevaron a cabo operaciones similares a las del Ejemplo 21 para sintetizar el compuesto del título.
LCMS: m/z 730 [M+H]+
Tiempo de retención de HPLC: 1,58 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 119> (referencia)
7-[4-[[(4aR)-4-hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[5-(trifluorometil)piridin-3-il]fenil]carbamoil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1 -il]metil)-2,3-difluorofenil]hept-6-inoato
[Fórmula 99]
Se utilizaron ácido 7-[4-[[(4aR)-4-hidroxi-4a-metil-3-(2-metilpropoxicarbonil)-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenil]hept-6-inoico (Ejemplo de Referencia 72) y 4-(trifluorometil)-2-(5-(trifluorometil)piridin-3-il)anilina y se llevaron a cabo operaciones similares a las del Ejemplo 21 para sintetizar el compuesto del título.
LCMS: m/z 751 [M+H]+
Tiempo de retención de HPLC: 1,60 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 74>
éster 2-metilpropílico de ácido (4aR)-1-[[-4-[4-[[(4S)-2,2-dimetil-1,3-dioxolan-4-il]metoxi]butoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico
[Fórmula 100]
Primera Etapa
[Fórmula 101]
Se utilizaron 4-(benciloxi)-2,3-difluorobenzaldehído e hidrocloruro de éster metílico de ácido (R)-2-metil-pirrolidin-2-carboxílico como reactivo y sustancia de partida, respectivamente, y se llevaron a cabo operaciones similares a las de la Primera Etapa del ejemplo 1 y el Ejemplo de Referencia 1-1 para sintetizar éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluoro-4-fenilmetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico.
Segunda Etapa
[Fórmula 102]
Se añadió paladio-carbono (10% en peso, 120 mg) a una solución de éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluoro-4-fenilmetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (1,56 g, 3,12 mmoles) en acetato de etilo (100 mL), y la mezcla se agitó en atmósfera de hidrógeno a temperatura ambiente durante 30 minutos. La mezcla de reacción se filtró a través de Celite, el producto filtrado se concentró a presión reducida y el residuo se purificó mediante cromatografía en columna sobre gel de sílice (diclorometano/metanol) para obtener éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (1,02 g, 80%).
LCMS: m/z 411 [M+H]+
Tiempo de retención de HPLC: 1,24 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
[Fórmula 103]
Se añadió una solución de hidróxido de sodio al 60% (2 mL, 30,3 mmoles) a una mezcla de (S)-(2,2-dimetil-1,3-dioxolan-4-il)metanol (2,00 g, 15,1 mmoles) y 1,4-dibromobutano (5,42 mL, 45,4 mmoles). Se añadió hidrogenosulfato de tetrabutilamonio (257 mg, 0,757 mmoles) a esta mezcla, y el producto resultante se agitó intensamente a temperatura ambiente durante la noche. Después de añadir agua, la capa se extrajo con hexano/éter dietílico (1: 4) cuatro veces, y las capas orgánicas se combinaron y se secaron sobre sulfato de magnesio. Después de que el producto resultante se filtró, el producto filtrado se concentró a presión reducida, y el residuo se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener (S)-4-((4-bromobutoxi)metil)-2, 2-dimetil-1,3-dioxolano (2,54 g, 63%) en forma de aceite incoloro.
Cuarta Etapa
Se añadió carbonato de cesio (1,20 mg, 3,65 mmoles) a una solución de éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (500 mg, 1,22 mmoles) y (S)-4-((4-bromobutoxi)metil)-2,2-dimetil-1,3-dioxolano (374 mg, 1,40 mmoles) en acetonitrilo (15,2 mL), y la mezcla se agitó a 70°C durante 1 hora. Después de enfriar la mezcla a temperatura ambiente, se añadió una solución acuosa de dihidrogenofosfato de potasio 0,37 M, y la capa acuosa se extrajo con acetato de etilo. Las capas orgánicas se combinaron, se lavaron con salmuera y se secaron sobre sulfato de magnesio. Después de que el producto resultante se filtró, el producto filtrado se concentró a presión reducida, y el residuo se purificó mediante cromatografía en columna sobre gel de sílice (diclorometano/metanol) para obtener el compuesto del título (414 mg, 57%).
LCMS: m/z 597 [M+H]+
Tiempo de retención de HPLC: 1,52 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 120> (referencia)
(4aR)-1 -[[4-[4-2R)-2,3-Dihidroxipropoxi]butoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-N-[2-(6-metilsulfanilpiridin-3-il)-4-(trifluorometil)fenil]-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Se disolvieron éster 2-metilpropílico de ácido (4aR)-1-[[4-[4-[[(4S)-2,2-dimetil-1,3-dioxolan-4-il]metoxi]butoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (Ejemplo de Referencia
74) (10,6 mg, 0,018 mmoles) y 2-(6-(metiltio)piridin-3-il)-4-(trifluorometil)anilina (5,1 mg, 0,018 mmoles) en tolueno (0,5 mL), y la mezcla se agitó a 100°C durante 1 hora. La mezcla de reacción se concentró a presión reducida, el residuo resultante se disolvió en metanol (0,5 mL), se añadió monohidrato de ácido p-toluenosulfónico (3,4 mg, 0,018 mmoles) y la mezcla se agitó a temperatura ambiente durante 1 hora y media. Se añadió agua a la mezcla de reacción, y la solución turbia de color blanco resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo al 30 - 90% (ácido trifluoroacético al 0,1%)/agua (ácido trifluoroacético al 0,1%)) para obtener el compuesto del título (6,3 mg, 46%) en forma de un sólido amorfo de color pardo claro.
LCMS: m/z 767 [M+H]+
Tiempo de retención de HPLC: 1,51 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 121> (referencia)
(4aR)-N-[4-Cloro-2-[6-(trifluorometil)piridin-3-il]fenil]-1 -[[4-[4-[(2R)-2,3-dihidroxipropoxi]butoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 105]
Se utilizaron éster 2-metilpropílico de ácido (4aR)-1-[[4-[4-[[(4S)-2,2-dimetil-1,3-dioxolan-4-il]metoxi]butoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (Ejemplo de Referencia 74) y 4-cloro-2-(6-(trifluorometil)piridin-3-il)anilina, y se llevaron a cabo operaciones similares a las del Ejemplo 120 para sintetizar el compuesto del título.
LCMS: m/z 755 [M+H]+
Tiempo de retención de HPLC: 1,50 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 122> (referencia)
(4aR)-N-[4-Bromo-2-(6-cloropiridin-3-il)fenil]-1 -[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Se añadieron dimetoxietano (0,2 mL), etilenglicol (0,2 mL) y agua (0,1 mL) a (4aR)-N-(4-bromo-2-yodofenil)-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 331) (14,8 mg, 0,02 mmoles), carbonato de potasio (9,7 mg, 0,07 mmoles), tetrakis(trifenilfosfina)paladio (2,3 mg, 0,002 mmoles) y ácido (6-cloropiridin-3-il)borónico (3,1 mg, 0,02 mmoles), y la mezcla se agitó a 100°C durante 2 horas La materia insoluble se filtró y el producto filtrado se purificó directamente mediante HPLC (YMC-Actus ODS-A 20 x 100 mm 0,005 mm, acetonitrilo con ácido fórmico al 0,1%/agua con ácido fórmico al 0,1%) para obtener el compuesto del título (4,8 mg, 40%) en forma de un sólido de color blanco amorfo.
LCMS: m/z 604 [M+H]+
Tiempo de retención de HPLC: 0,89 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 75>
((4S,5S)-5 -((Hept-6-in-1-iloxi)metil)-2,2-dimetil-1,3-dioxolan-4-il) metanol
[Fórmula 107]
Se añadió hidruro de sodio (60% en peso, una dispersión en aceite mineral, 36 mg, 0,824 mmoles) a una solución de ((4S,5S)-2,2-dimetil-1,3-dioxolano-4,5-diil)dimetanol (133 mg, 0,824 mmoles) en N,N-dimetilformamida (1,1 mL) a temperatura ambiente. Después de agitar la mezcla de reacción a temperatura ambiente durante 30 minutos, se añadió metanosulfonato de hept-6-in-1-ilo (105 mg, 0,550 mmoles), y la mezcla se agitó a temperatura ambiente durante la noche. Se añadió agua lentamente a la mezcla de reacción, y el producto resultante se extrajo con acetato de etilo. Las capas orgánicas se combinaron y concentraron a presión reducida, y el residuo se purificó mediante cromatografía en columna sobre gel de sílice para obtener ((4S,5S)-5-((hept-6-in-1-iloxi)metil)-2,2-dimetil-1,3-dioxolan-4-il)metanol (99,6 mg, 71%).
<Ejemplo de Referencia 76>
(R)-4-((3-bromopropoxi)metil)-2,2-dimetil-1,3-dioxolano
Fórmula 108
Se disolvieron (R)-(-)-2,2-dimetil-1,3-dioxolano-4-metanol (615 mg, 4,66 mmoles) y 6-bromo-1-hexino (500 mg, 3,1 mmoles) en N,N-dimetilformamida (10 mL), hidruro de sodio (60% en peso, una dispersión en aceite mineral, 186 mg, 4,66 mmoles) y la mezcla se agitó a temperatura ambiente durante 12 horas. La mezcla de reacción se añadió a agua y se extrajo con éter dietílico. Después de lavar la capa orgánica con salmuera y secar sobre sulfato de sodio, el producto resultante se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice para obtener (R)-4-((hex-5-in-1-iloxi)metil)-2,2-dimetil-1,3-dioxolano (390 mg, 59 %) en forma de un líquido transparente.
RMN H1 (CDCls) 5: 4,24 (1H, dt, J = 12,0, 6,4 Hz), 4,04 (1H, dd, J = 8,0, 6,4 Hz), 3,71 (1H, dd, J = 8,3, 6,4 Hz), 3,54 3,44 (3H, m), 3,41 (1H, dd, J = 11,0, 5,0 Hz), 2,20 (4H, td, J = 7,0, 3,0 Hz), 1,92 (4H, t, J = 3,0 Hz), 1,72-1,64 (2H, m), 1,62-1,53 (2H, m), 1,40 (3H, s), 1,34 (3H, s).
<Ejemplo de Referencia 77>
4-(Prop-2-in-1 -il)morfolin-3-ona
[Fórmula 109]
Se añadió hidruro de sodio (60% en peso, una dispersión en aceite mineral, 187 mg, 4,68 mmoles) a una solución de morfolin-3-ona (430 mg, 4,25 mmoles) en tetrahidrofurano (5 mL) a 0°C, y la mezcla se agitó a temperatura ambiente durante 10 minutos, y se añadió 3-bromoprop-1-ino (607 mg, 5,1 mmoles) a la mezcla de reacción, y la mezcla se agitó a temperatura ambiente durante 2 horas. La mezcla de reacción se diluyó con acetato de etilo (50 mL), y después de lavar la mezcla de reacción en serie con una solución acuosa saturada de cloruro de amonio, agua y salmuera y secar sobre sulfato de magnesio, el producto resultante se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice para obtener el compuesto del título (312 mg, 53%) en forma de un aceite transparente.
RMN H1 (CDCls) 5: 4,29 (2H, d, J = 2,4 Hz), 4,19 (2H, s), 3,93 (2H, t, J = 5,2 Hz), 3,51 (2H, t, J= 5,2 Hz), 2,25 (1H, m).
<Ejemplo 123> (referencia)
(4aR)-1 -[[2,3-Difluoro-4-[3-(4-hidroxibutoxi)prop-1 -inil]fenil]metil]-N-[2-(2,3-dimetoxifenil)-4-(trifluorometil)fenil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 110]
Se añadieron 4-(prop-2-in-1-iloxi)butan-1-ol (15,5 mg, 0,121 mmoles) y trietilamina (0,020 mL, 0,141 mmoles) a una solución de (4aR)-1-[2,3-(difluoro-4-yodofenil)metil]-N-[2-(2,3-dimetoxifenil)-4-(trifluorometil)fenil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 321) (30 mg, 0,040 mmoles), cloruro de bis(trifenilfosfina)paladio(II) (2,83 mg, 0,0404 mmoles) y yoduro de cobre(I) (1,54 mg, 0,0081 mmoles) en N,N-dimetilformamida (0,40 mL) en atmósfera de nitrógeno a 0°C. La mezcla de reacción se agitó a temperatura ambiente durante 14 horas. Se añadió ácido fórmico a la mezcla de reacción, y la mezcla se purificó directamente mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (15 mg, 50%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 744 [M+H]+
Tiempo de retención de HPLC: 1,63 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 124> (referencia)
(4aR)-1 -[[2,6-Difluoro-4-[7-[(2S,3S)-2,3,4-trihidroxibutoxi]hept-1 -inil]fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida [Fórmula 111]
Se añadieron ((4S,5S)-2,2-dimetil-1,3-dioxolano-4,5-diil)dimetanol (23,9 mg, 0,093 mmoles) y trietilamina (0,019 mL, 0,140 mmoles) a una solución de (4aR)-1-[(2,6-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 322) (35 mg, 0,047 mmoles), cloruro de bis(trifenilfosfina)paladio(II) (3,27 mg, 0,0465 mmoles) y yoduro de cobre(I) (1,77 mg, 0,0093 mmoles), en N,N-dimetilformamida (0,47 mL) bajo atmósfera de nitrógeno a 0°C. La mezcla de reacción se agitó a temperatura ambiente durante la noche. Se añadieron ácido trifluoroacético/agua (1:1, 1,4 mL) y dimetilsulfóxido (0,7 mL) a la mezcla de reacción, y la mezcla se agitó a temperatura ambiente durante 1 hora. La mezcla de reacción se purificó directamente mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (32 mg, 82%) en forma de un sólido amorfo de color naranja.
LCMS: m/z 841 [M+H]+
Tiempo de retención de HPLC: 0,90 minutos (condiciones de análisis SMD-TFA50)
<Ejemplo 125> (referencia)
(4aR)-1 -[[2,6-Difluoro-4-[7-[(2S,3S)-2,3,4-trihidroxibutoxi]heptil]fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida Fórmula 112
Una suspensión de (4aR)-1-[[2,6-difluoro-4-[7-[(2S,3S)-2,3,4-trihidroxibutoxi1hept-1-inil1fenil1metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)-piridin-3-il1fenil1-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
(Ejemplo 124) (20 mg, 0,024 mmoles) e hidróxido de paladio-carbono (20% en peso, 3,34 mg, 0,00476 mmoles) en acetato de etilo se agitó en atmósfera de hidrógeno a temperatura ambiente durante 10 horas. La mezcla de reacción se filtró a través de una almohadilla de celite, y el producto filtrado se concentró a presión reducida. El residuo se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (11,5 mg, 57%) en forma de un sólido amorfo incoloro.
LCMS: m/z 845 [M+H]+
Tiempo de retención de HPLC: 1,60 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 126> (referencia)
(4aR)-1 -[(4-Etinil-2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidina-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 113]
Se utilizó triisopropilsililacetileno como reactivo, y se realizaron operaciones similares a las de la Primera Etapa del ejemplo 123 para obtener (4aR)-1-[[2,3-difluoro-4-[2-tri(propan-2-il))sililetinil]fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida en forma de un producto bruto. El producto bruto obtenido se disolvió en tetrahidrofurano (0,15 mL), se añadió una solución 1 M en tetrahidrofurano (0,12 mL) de fluoruro de tetrabutilamonio, y la mezcla se agitó a temperatura ambiente durante 1 hora. Se añadieron ácido trifluoroacético (0,5 mL), agua (0,5 mL) y dimetilsulfóxido (1 mL) a la mezcla de reacción, y la mezcla se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (22 mg, 84%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 652 [M+H]+
Tiempo de retención de HPLC: 0,87 minutos (condiciones de análisis SQD-FA50).
Se utilizaron los derivados yoduro apropiados de los Ejemplos 319-323 y los reactivos de alquino terminal apropiados, y se llevaron a cabo operaciones similares a las del Ejemplo 123 para sintetizar los compuestos descritos en la siguiente Tabla (Ejemplos de Referencia).
T l 22-1
T l 22-2
Aunque existen tautómeros de algunos de los compuestos descritos en esta tabla, se pueden observar isómeros en algunos casos y no en otros casos según el tipo de disolvente para la medición. Por ejemplo, el RMN H1 del Ejemplo 129 (dimetilsulfóxido-D6) y el Ejemplo 140 (cloroformo-D) es el siguiente.
<Ejemplo 129>
RMN H1 (DMSO-D6) 5: 16,58 (1H, brs), 12,80 (1H, brs), 12,15 (1H, brs), 9,59 (1H, s), 8,59-8,56 (1H, brm), 8,48-8,38 (1H, m), 8,27 (1H, brs), 7,99 (1H, d, J = 9,8 Hz), 7,28 (1H, q, J = 6,8 Hz), 7,24 (1H, q, J = 7,3 Hz), 5,11 (1H, d, J = 14,7 Hz), 4,47-4,38 (1H, m), 3,41-3,30 (2H, m), 2,73 (1H, q, J = 8,6 Hz), 2,54 (2H, t, J = 6,4 Hz), 2,49-2,36 (1H, m), 2,40 (2H, t, J = 7,8 Hz), 1,84-1,75 (2H, m), 1,63 (2H, brs), 0,92 (3H, brs).
<Ejemplo 140>
Tautómero mayoritario
RMN H1 (CDCls) 5: 11,82 (1H, s), 8,78 (1H, d, J = 2,0 Hz), 8,44 (1H, d, J = 8,6 Hz), 7,97 (1H, dd, J = 8,1, 1,9 Hz), 7,86 (1H, d, J = 8,2 Hz), 7,73 (1H, dd, J = 8,7, 1,9 Hz), 7,56 (1H, d, J = 1,8 Hz), 7,15-7,11 (1H, m), 6,98-6,94 (1H, m), 4,84 (1H, d, J = 14,3 Hz), 4,32 (1H, d, J = 13,9 Hz), 3,85-3,79 (4H, m), 3,68 (2H, s), 3,27 (1H, td, J = 8,7, 3,2 Hz), 2,83-2,77 (4H, m), 2,73-2,64 (1H, m), 2,58-2,48 (1H, m), 1,80-1,58 (3H, m), 0,99 (3H, s).
Tautómero minoritario
RMN H1 (CDCls) 5: 11,91 (1H, s), 8,72 (1H, d, J = 2,2 Hz), 8,19 (1H, d, J = 8,2 Hz), 7,96-7,92 (1H, m), 7,80 (1H, d, J = 8,2 Hz), 7,75-7,71 (1H, m), 7,58-7,55 (1H, m), 7,17-7,07 (1H, m), 6,99-6,93 (1H, m), 5,07 (1H, d, J = 14,7 Hz), 4,47 (1H, d, J = 14,9 Hz), 3,79-3,85 (4H, m), 3,67 (2H, s), 3,30-3,20 (1H, m), 2,83-2,77 (4H, m), 2,73-2,64 (1H, m), 2,58 2,48 (1H, m), 1,81-1,58 (3H, m), 0,79 (3H, s).
Se utilizaron los derivados yoduro apropiados de los Ejemplos 319 a 323 y los reactivos de alquino terminal apropiados, y se llevaron a cabo operaciones similares a las del Ejemplo 123 y el Ejemplo 125 para sintetizar los compuestos descritos en la siguiente Tabla (Ejemplos de Referencia).
T l 2
Se utilizaron los derivados yoduro apropiados de los Ejemplos 319 a 323 y los reactivos de alquino terminal apropiados, incluido el del Ejemplo de Referencia 76, y se llevaron a cabo operaciones similares a las del Ejemplo 124 para sintetizar los compuestos descritos en la siguiente Tabla (Ejemplos de Referencia).
T l 24
<Ejemplo 146> (referencia)
Hidrocloruro de (4aR)-1 -[[2,6-dicloro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[2-(trifluorometil)-4-[6-(trifluorometil)piridin-3-il]pirimidin-5-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 114]
Se disolvieron (4aR)-1-[(2,6-dicloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[2-(trifluorometil)-4-[6-(trifluorometil)piridina-3-il]pirimidin-5-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 328) (22 mg, 0,032 mmoles), hidrocloruro de 4-(2-cloroetil)morfolina (12,1 mg, 0,065 mmoles) y yoduro de tetra-n-butilamonio (1,2 mg, 0,0033 mmoles) en N,N-dimetilformamida (0,2 mL), se añadió carbonato de cesio (64 mg, 0,20 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a 60°C durante 3 horas. Se añadieron dimetilsulfóxido (0,4 mL) y ácido clorhídrico concentrado (0,1 mL) a la mezcla de reacción a 0°C, y después de agitar la mezcla durante 5 minutos, el producto resultante se purificó directamente mediante cromatografía en columna C-18 de fase inversa sobre gel de sílice (agua/acetonitrilo) para obtener el compuesto del título (23 mg, 88%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 790 [M+H]+
Tiempo de retención de HPLC: 1,26 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 147> (referencia)
(4aR)-1 -[[4-[3-[(2R)-2,3-Dihidroxipropoxi]propoxi]-2,3-difluorofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 115]
Primera Etapa
[Fórmula 116]
Se añadieron agua (10 mL) e hidróxido de sodio (1,75 g, 43,8 mmoles) a 1,3-dibromopropano (9,17 g, 45,4 mmoles), (S)-(2,2-dimetil-1,3-dioxolan-4-il)metanol (1,5 g, 11,4 mmoles) e hidrogenosulfato de tetra-n-butilamonio (0,19 g, 0,57 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 16 horas. Se añadió agua (30 mL) a la mezcla de reacción, y después de que el producto resultante se extrajo con éter dietílico, la capa orgánica se secó sobre sulfato de magnesio y se filtró. El producto filtrado se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener (S)-4-((3-bromopropoxi)metil)-2,2-dimetil-1,3-dioxolano (640 mg, 22%) en forma de un líquido transparente.
Segunda Etapa
Se disolvieron (4aR)-1-[(2,3-difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 324) (1,0 g, 1,56 mmoles) y (S)-4-((3-bromopropoxi)metil)-2,2-dimetil-1,3-dioxolano (0,47 g, 1,87 mmoles) en N,N-dimetilformamida (3 mL), se añadió carbonato de cesio (0,86 g, 6,23 mmoles) y la mezcla se agitó bajo atmósfera de nitrógeno a 80°C durante 2 horas. Se añadió éter dietílico (30 mL) a la mezcla de reacción, y la materia insoluble se filtró y se concentró a presión reducida. Después de añadir metanol (10 mL) al residuo resultante, se le añadió ácido clorhídrico concentrado (2 mL) gota a gota a 0°C, y la mezcla se agitó a temperatura ambiente durante 2 horas. Se insufló nitrógeno en la mezcla de reacción durante 1 hora para eliminar una cantidad excesiva de cloruro de hidrógeno y, posteriormente, se añadió dimetilsulfóxido (5 mL), el metanol se eliminó a presión reducida y el residuo resultante se purificó mediante cromatografía en columna C-18 sobre gel de sílice de fase inversa (agua/acetonitrilo) para obtener el compuesto del título (1,2 g, 95%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 775 [M+H]+
Tiempo de retención de HPLC: 1,49 minutos (condiciones de análisis SMD-TFA05)
Tautómero mayoritario
RMN H1 (CDCls) 5: 16,21 (1H, s), 11,91 (1H, s), 8,78 (1H, s), 8,44 (1H, d, J = 8,7 Hz), 7,98 (1H, d, J = 8,0 Hz), 7,87 (1H, d, J = 8,0 Hz), 7,73 (1H, d, J = 8,7 Hz), 7,55 (1H, s), 6,92 (1H, dd, J = 7,8, 7,5 Hz), 6,71 (1H, dd, J = 7,8, 7,5 Hz), 4,73 (1H, d, J = 14,2 Hz), 4,30 (1H, d, J = 14,2 Hz), 4,14 (2H, t, J = 6,2 Hz), 3,89-3,87 (1H, m), 3,72-3,69 (3H, m), 3,65-3,64 (1H, m), 3,57-3,54 (2H, m), 3,27-3,24 (1H, m), 2,70-2,62 (1H, m), 2,56-2,55 (1H, m), 2,53-2,50 (1H, m), 2,12-2,08 (3H, m), 1,73-1,70 (1H, m), 1,67-1,61 (2H, m), 1,00 (3H, s).
Tautómero minoritario
RMN H1 (CDCls) 5: 17,97 (1H, s), 11,89 (1H, s), 8,71 (1H, s), 8,19 (1H, d, J = 8,6 Hz), 7,94 (1H, d, J = 7,9 Hz), 7,79 (1H, d, J = 8,0 Hz), 7,73 (1H, d, J = 8,6 Hz), 7,55 (1H, s), 7,06-7,04 (1H, m), 6,73-6,70 (1H, m), 4,99 (1H, d, J = 14,4 Hz), 4,42 (1H, d, J = 14,4 Hz), 4,14 (2H, t, J = 6,2 Hz), 3,89-3,88 (1H, m), 3,72-3,69 (3H, m), 3,65-3,64 (1H, m), 3,57 3,54 (2H, m), 3,25-3,24 (1H, m), 2,70-2,62 (2H, m), 2,41-2,39 (1H, m), 2,12-2,08 (3H, m), 1,67-1,61 (2H, m), 1,43 1,37 (1H, m), 0,77 (3H, s).
<Ejemplo de Referencia 78>
(S)-4-(((5-Bromopentil)oxi)metil)-2,2-dimetil-1,3-dioxolano
[Fórmula 117]
Se utilizaron 1,5-dibromopentano y (S)-(2,2-dimetil-1,3-dioxolan-4-il)metanol, y se llevaron a cabo operaciones similares a las de la Primera Etapa del ejemplo 147 para obtener (S)-4-((hex-5-in-1-iloxi)metil)-2,2-dimetil-1,3-dioxolano en forma de un líquido transparente.
RMN H1 (CDCls) 5: 4,25 (1H, dt, J = 12,0,6,0 Hz), 4,05 (1H, dd, J = 6,4, 8,0 Hz), 3,72 (1H, dd, J = 6,4, 8,0 Hz), 3,53 3,37 (6H, m), 1,87 (2H, dt, J = 14,2, 7,1 Hz), 1,64-1,54 (2H, m), 1,54-1,44 (2H, m), 1,41 (3H, s), 1,35 (3H, s).
<Ejemplo de Referencia 79>
(R)-4-(((5-Bromopentil)oxi)metil)-2,2-dimetil-1,3-dioxolano
[Fórmula 118]
Se utilizaron 1,5-dibromopentano y (R)-(2,2-dimetil-1,3-dioxolan-4-il)metanol, y se llevaron a cabo operaciones similares a las de la Primera Etapa del ejemplo 147 para obtener (R)-4-(((5-bromopentil)oxi)metil)-2,2-dimetil-1,3-dioxolano.
<Ejemplo 148> (referencia)
Hidrocloruro de (4aR)-1-[[2.6-dicloro-4-(2-morfolin-4-iletoxi)feni n meti n -4-hidroxi-4a-metil-2-oxo-N-[6-(tr¡fluoromet¡l)-2-f6-(tr¡fluoromet¡l)p¡r¡d¡n-3-¡l1p¡r¡d¡n-3-¡l1-6.7-d¡h¡dro-5H-pirrolof1.2-b1p¡r¡daz¡n-3-carboxam¡da [Fórmula 119]
Se utilizaron (4aR)-1-[(2,6-dicloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[6-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]piridin-3-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 329) e hidrocloruro de 4-(2-cloroetil)morfolina, y se llevaron a cabo operaciones similares a las del Ejemplo 146 para sintetizar el compuesto del título.
LCMS: m/z 789 [M+H]+
Tiempo de retención de HPLC: 1,29 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 149> (referencia)
(4aR)-1 -[[3-Cloro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Primera Etapa
[Fórmula 121]
Se utilizaron 4-(benciloxi)-3-clorobenzaldehído e hidrocloruro de éster metílico de ácido (R)-2-metil-pirrolidin-2-carboxílico, y se realizaron operaciones similares a las del Ejemplo de Referencia 4 para sintetizar éster 2-metilpropílico de ácido (4aR)-1-[(3-cloro-4-fenilmetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico.
Segunda Etapa
Se utilizó éster 2-metilpropílico de ácido (4aR)-1-[(3-cloro-4-fenilmetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico, y se llevaron a cabo operaciones similares a las de la Segunda Etapa del Ejemplo de Referencia 74 para sintetizar éster 2-metilpropílico de (4aR)-1-[(3-cloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico.
Tercera Etapa
[Fórmula 123]
Se utilizaron éster 2-metilpropílico de ácido (4aR)-1-[(3-Cloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico y 4-(trifluorometil)-2-(6-(trifluorometil)piridin-3-il)anilina (Ejemplo de Referencia 13), y se realizaron operaciones similares a las del Ejemplo 21 para sintetizar (4aR)-1-[(3-cloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida.
Cuarta Etapa
Se utilizaron (4aR)-1-[(3-cloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida e hidrocloruro de 4-(2-cloroetil)morfolina, y se llevaron a cabo operaciones similares a las del Ejemplo 146 para sintetizar el compuesto del título.
LCMS: m/z 754 [M+H]+
Tiempo de retención de HPLC: 1,32 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 150> (referencia)
2-[4-[[(4aR)-4-Hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]carbamoil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenoxi]acetato de metilo
[Fórmula 124]
Primera Etapa
Fórmula 125
Se utilizaron (4aR)-1-[(2,3-Difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 324) y éster terc-butílico de ácido bromoacético, y se llevaron a cabo operaciones similares a las del Ejemplo 146 para sintetizar éster tercbutílico de ácido 2-[4-[[(4aR)-4-hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]carbamoil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenoxi]acético.
LCMS: m/z 757 [M+H]+
Tiempo de retención de HPLC: 1,23 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
Se añadió ácido trifluoroacético (0,3 mL, 4 mmoles) a una solución de éster de terc-butílico de ácido 2-[4-[[(4aR)-4-hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]carbamoil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenoxi]acético (14,7 mg, 0,019 mmoles) en diclorometano (0,075 mL) a temperatura ambiente, y la mezcla se agitó a temperatura ambiente durante 2 horas. La mezcla de reacción se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna de fase inversa (ácido fórmico al 0,1%, acetonitrilo/agua) para obtener ácido 2-[4-[[(4aR)-4-hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]carbamoil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenoxi]acético (12,3 mg, 90%).
LCMS: m/z 701 [M+H]+
Tiempo de retención de HPLC: 1,08 minutos (condiciones de análisis SQD-FA05)
Tercera Etapa
Se añadió (diazometil)trimetilsilano (0,0125 mL, 0,025 mmoles) a una solución de ácido 2-[4-[[(4aR)-4-hidroxi-4ametil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]carbamoil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-2,3-difluorofenoxi]acético (9 mg, 0,013 mmoles) en benceno (0,13 mL)-metanol (0,08 mL) a temperatura ambiente, y la mezcla se agitó a temperatura ambiente durante 1 hora. Después de que se añadió ácido fórmico (0,005 mL) a la mezcla de reacción, el producto resultante se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna de fase inversa (ácido fórmico al 0,1%, acetonitrilo/agua) para obtener el compuesto del título (8,3 mg, 90%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 715 [M+H]+
Tiempo de retención de HPLC: 1,60 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 151> (referencia)
(4aR)-1-[[2,3-Difluoro-4-(piridin-4-ilmetoxi)fenil]metil]-N-[2-(2,3-dimetoxifenil)-4-(trifluorometil)fenil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Se utilizaron (4aR)-1-[(2,3-Difluoro-4-hidroxifenil)metil]-N-[2-(2,3-dimetoxifenil)-4-(trifluorometil)fenil]-4-hidroxi-4ametil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 325) e hidrobromuro de 4-(bromometil)piridina, y se llevaron a cabo operaciones similares a las del Ejemplo 146 para sintetizar el compuesto del título.
LCMS: m/z 725 [M+H]+
Tiempo de retención de HPLC: 1,37 minutos (condiciones de análisis QC-SMD-TFA05)
Se utilizaron los derivados fenólicos de los ejemplos 326, 327 y 330 y los reactivos de bromuro de alquilo, incluidos los de los Ejemplos de Referencia 78 y 79, y se llevaron a cabo operaciones similares a las de la Segunda Etapa del ejemplo 147 para sintetizar los compuestos de los ejemplos descritos en la siguiente Tabla (referencia).
Tabla 25
Aunque existen tautómeros de algunos de los compuestos descritos en esta tabla, se pueden observar isómeros en algunos casos y no en otros casos según el tipo de disolvente para la medición. Por ejemplo, el RMN H1 del Ejemplo 152 (cloroformo-D) y el Ejemplo 156 (dimetilsulfóxido-D6) es el siguiente.
<Ejemplo 152>
Tautómero mayoritario
RMN H1 (CDCb) 5: 16,43 (1H, s), 12,92 (1H, s), 9,61 (1H, s), 8,47 (1H, d, J = 8,7 Hz), 7,95 (1H, s), 7,90 (1H, s), 7,79 (1H, d, J = 8,7 Hz), 7,04 (1H, dd, J = 8,1, 8,1 Hz), 6,70 (1H, dd, J = 8,1, 8,1 Hz), 4,98 (1H, d, J = 14,3 Hz), 4,41 (1H, d, J = 14,3 Hz), 4,07 (2H, t, J = 6,2 Hz), 3,87 (1H, brs), 3,73-3,71 (1H, m), 3,66-3,64 (1H, m), 3,56 (2H, m), 3,53-3,52 (2H, m), 3,33-3,31 (1H, m), 2,74 (1H, ddd, J = 8,5, 8,5, 8,5 Hz), 2,55-2,53 (2H, m), 2,11 (1H, brs), 1,92-1,88 (2H, m), 1,82-1,77 (2H, m), 1,74-1,73 (1H, m), 1,68-1,62 (2H, m), 1,01 (2H, s).
Tautómero minoritario
RMN H1 (CDCls) 5: 18,16 (1H, s), 12,97 (1H, s), 9,59 (1H, s), 8,33 (1H, d, J = 8,7 Hz), 7,92 (2H, d, J = 10,9 Hz), 7,79 (1H, d, J = 8,4 Hz), 7,04 (1H, t, J = 8,1 Hz), 6,70 (1H, t, J = 7,5 Hz), 5,01 (1H, d, J = 17,3 Hz), 4,45 (1H, d, J = 14,6 Hz), 4,07 (2H, t, J = 6,2 Hz), 3,87 (1H, s), 3,72 (1H, d, J = 10,7 Hz), 3,65 (1H, d, J = 11,9 Hz), 3,54 (4H, dt, J = 19,0, 6,0 Hz), 3,26 (1H, s), 2,74 (1H, dd, J = 16,6,8,5 Hz), 2,63-2,61 (2H, m), 2,11 (1H, s), 1,92-1,88 (2H, m), 1,74-1,73 (2H, m), 1,67-1,65 (2H, m), 1,50-1,47 (1H, m), 0,85 (3H, s).
<Ejemplo 156>
RMN H1 (DMSO-D6) 5: 15,77 (1H, brs), 12,17 (1H, brs), 9,71 (1H, s), 9,14 (1H, s), 8,54 (1H, d, J = 6,6 Hz), 8,16 (1H, d, J = 8,1 Hz), 7,13 (1H, brs), 7,00 (1H, t, J = 6,8 Hz), 4,99-4,17 (3H, m), 4,08 (2H, t, J = 6,1 Hz), 3,59-3,54 (1H, m), 3,41-3,24 (6H, m), 2,70 (1H, q, J = 8,1 Hz), 2,41 (1H, brs), 1,79-1,48 (8H, m), 1,47-1,31 (4H, m), 0,92 (3H, brs).
<Ejemplo 157> (referencia)
(4aR)-1 -[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Se añadieron trifenilfosfina (17,2 mg, 0,066 mmoles), N-(2-hidroxietil)morfolina (7,5 mg, 0,057 mmoles) y azodicarboxilato de dietilo (0,03 mL, 0,065 mmoles) a una solución de (4aR)-1-[(2,3-difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 327) (10,6 mg, 0,016 mmoles) en tetrahidrofurano (0,2 mL), y la mezcla se agitó a temperatura ambiente durante 1,5 horas Después de concentrar la mezcla de reacción, el residuo se purificó mediante cromatografía en columna de fase inversa sobre gel de sílice para obtener el compuesto del título (8,0 mg, 0,011 mmoles) en forma de un sólido de color blanco. Se confirmó midiendo RMN H1 y RMN C13 que este sólido incluía dos tautómeros.
LCMS: m/z 757 [M+H]+
Tiempo de retención de HPLC: 1,30 minutos (SMD-TFA05)
Tautómero mayoritario
RMN H1 (CDCls) 5: 16,44 (1H, s), 12,92 (1H, s), 9,61 (1H, d, J = 1,0 Hz), 8,47 (1H, d, J = 8,7 Hz), 7,95 (1H, d, J = 1,0 Hz), 7,90 (1H, d, J = 2,0 Hz), 7,79 (1H, dd, J = 8,7, 2,0 Hz), 7,05 (1H, ddd, J = 9,0, 6,8, 2,2 Hz), 6,71 (1H, ddd, J = 9,0, 7,5, 1,2 Hz), 4,99 (1H, d, J = 14,2 Hz), 4,40 (1H, d, J = 14,2 Hz), 4,19 (2H, t, J = 5,7 Hz), 3,74 (4H, t, J = 4,6 Hz), 3,32 (1H, ddd, J = 8,9, 8,9, 3,5 Hz), 2,84 (2H, t, J = 5,7 Hz), 2,74 (1H, ddd, J = 8,9, 8,9, 8,9 Hz), 2,61-2,59 (4H, m), 2,56-2,54 (1H, m), 1,76-1,73 (1H, m), 1,68-1,63 (2H, m), 1,00 (3H, s)
RMN C13 (CDCb) 5: 187,4 (qC), 169,8 (qC), 165,7 (qC), 162,5 (qC), 159,3 (CH), 156,6 (qC, Jcf = 36,3 Hz), 150,3
(qC, Jcf = 248,7, 10,5 Hz), 147,8 (qC, Jcf = 5,5 Hz), 141,3 (qC, Jcf = 247,9, 14,6 Hz), 138,7 (qC), 128,3 (CH, Jcf = 3.3 Hz), 128,0 (qC), 127,1 (CH, Jcf = 3,8 Hz), 127,0 (qC, Jcf = 33,5 Hz), 125,1 (CH), 124,8 (CH), 123,6 (qC, Jcf = 272.0 Hz), 120,5 (qC, Jcf = 275,4 Hz), 118,4 (qC, Jcf = 12,7 Hz), 116,0 (CH, Jcf = 2,5 Hz), 109,5 (CH, Jcf = 2,5 Hz), 93.6 (qC), 68,0 (CH2), 66,9 (CH2X2 ), 64,2 (qC), 57,5 (CH2), 54,1 (CH2X2 ), 51,9 (CH2), 43,2 (CH2), 31,9 (CH2), 22,4 (CH3), 19,1 (CH2).
Tautómero minoritario
RMN H1 (CDCI3) 5: 18,17 (1H, s), 12,97 (1H, s), 9,59 (1H, s), 8,33 (1H, d, J = 8,7 Hz), 7,93 (1H, s), 7,91 (1H, d, J = 2.0 Hz), 7,79 (1H, dd, J = 8,7, 2,0 Hz), 7,05 (1H, ddd, J = 9,0, 6,8, 2,2 Hz), 6,71 (1H, ddd, J = 9,0, 7,5, 1,2 Hz), 5,02 (1H, d, J = 14,5 Hz), 4,45 (1H, d, J = 14,5 Hz), 4,19 (2H, t, J = 5,7 Hz), 3,74 (4H, t, J = 4,6 Hz), 3,25 (1H, ddd, J = 8,8, 8,8, 3,2 Hz), 2,84 (2H, t, J = 5,7 Hz), 2,74 (1H, ddd, J = 8,9, 8,9, 8,9 Hz), 2,61-2,59 (4H, m), 2,56-2,54 (1H, m), 1,76 1,73 (1H, m), 1,68-1,63 (1H, m), 1,49-1,47 (1H, m), 0,84 (3H, s).
RMN C13 (CDCls) 5: 191,8 (qC), 170,2 (qC), 168,1 (qC), 165,5 (qC), 159,3 (CH), 156,6 (qC, Jcf = 36,3 Hz), 150,3 (qC, Jcf = 248,7, 10,5 Hz), 147,8 (qC, Jcf = 5,5 Hz), 141,3 (qC, Jcf = 247,9, 14,6 Hz), 138,7 (qC), 128,2 (CH, Jcf = 3.3 Hz), 128,2 (qC), 127,1 (CH, Jcf = 3,8 Hz), 127,0 (qC, = 33,5 Hz), 125,1 (CH), 125,4 (CH), 123,6 (qC, Jcf = 272,0 Hz), 120,5 (qC, Jcf = 275,4 Hz), 118,4 (qC, Jcf = 12,7 Hz), 116,0 (CH, Jcf = 2,5 Hz), 109,5 (CH, Jcf = 2,5 Hz), 84,3 (qC), 68,0 (CH2), 66,9 (CH2x2), 64,2 (qC), 57,5 (CH2), 54,1 (CH2x2), 50,7 (CH2), 44,0 (CH2), 31,1 (CH2), 21,8 (CH3), 18.6 (CH2).
Se utilizaron los intermedios fenólicos apropiados de los Ejemplos 324, 325 y 327 y reactivos alcohólicos apropiados, y se llevaron a cabo operaciones similares a las del Ejemplo 156 para sintetizar los compuestos de los Ejemplos descritos en la siguiente Tabla (Ejemplos de Referencia).
T l 2
<Ejemplo 163> (referencia)
Hidrocloruro de (4aR)-1-[[2,3-difluoro-4-(2-morfolin-4-iletilsulfanil)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-(4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil)-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida [Fórmula 129]
Se añadió carbonato de cesio (67 mg, 0,206 mmoles) a una solución de (4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 320) (30 mg, 0,04 mmoles), acetato de paladio (1,79 mg, 0,0080 mmoles), trifenilfosfina (8,37 mg, 0,032 mmoles) y triisopropilsilanotiol (9,87 mg, 0,052 mmoles) en tolueno (0,399 mL), y la mezcla se agitó a 100°C durante 2 horas y 45 minutos. Posteriormente, se añadieron acetato de paladio (1,79 mg, 0,0080 mmoles), triisopropilsilanotiol (9,87 mg, 0,052 mmoles) y 1,4-dioxano (0,4 mL), y la mezcla se agitó a 110°C durante 2 horas. Después de que la mezcla de reacción se enfrió a temperatura ambiente, se añadió 4-(2-cloroetil)morfolina- ácido clorhídrico (37,1 mg, 0,199 mmoles) a esta mezcla de reacción, y después de que el producto resultante se calentó a 100°C durante varias horas, se enfrió a temperatura ambiente. Esta mezcla de reacción se purificó mediante cromatografía en columna C18 de fase inversa. Se añadió una solución 4 N de cloruro de hidrógeno/1,4-dioxano al compuesto obtenido, y la solución se concentró y se secó para obtener el compuesto del título (17 mg, 53%) en forma de un sólido de color blanco.
LCMS: m/z 772 [M+H]+
Tiempo de retención de HPLC: 1,35 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 164> (referencia)
Hidrocloruro de (4aR)-1-[[2,3-difluoro-4-(morfolin-4-ilmetil)fenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
{
[Fórmula 130]
Primera Etapa
[Fórmula 131]
Una solución de trifluoroborato de (bromometil)potasio (100 mg, 0,50 mmoles), morfolina (45,7 mg, 0,525 mmoles) y carbonato de potasio (69,1 mg, 0,50 mmoles) en tetrahidrofurano (0,50 mL) se calentó a 80°C durante 1 hora, y a continuación, el producto resultante se enfrió a temperatura ambiente. Después de que la mezcla de reacción se filtró y se lavó con acetona (15 mL), la solución se secó para obtener borato de trifluoro(morfolinometil)potasio (68 mg, 66%) en forma de un producto bruto.
Segunda Etapa
Se añadieron dos veces acetato de paladio (2,45 mg, 0,0109 mmoles), diciclohexil(2’,4',6'-triisopropil-[1,1'-bifenil]-2-il)fosfina (10,39 mg, 0,022 mmoles) y carbonato de cesio (89 mg, 0,272 mmoles) a una solución de borato de
trifluoro(morfolinometil)potasio (28,2 mg, 0,136 mmoles) obtenido en la Primera Etapa y (4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 320) (41 mg, 0,054 mmoles) en una mezcla de dioxano y agua (0,495 mL y 0,0495 mL), y la mezcla se calentó y agitó a 80°C durante la noche. Después de que la mezcla de reacción se enfrió a temperatura ambiente, esta mezcla de reacción se purificó mediante cromatografía en columna de fase inversa. El compuesto obtenido se disolvió en etanol, a continuación, se añadió una solución 4 N de cloruro de hidrógeno/dioxano, y el producto resultante se secó para obtener el compuesto del título (28 mg, 68%) en forma de un sólido de color blanco.
LCMS: m/z 726 [M+H]+
Tiempo de retención de HPLC: 1,28 minutos (condiciones de análisis QC-SMD-TFA05)
Tautómero mayoritario
RMN H1 (CDCb) 5: 13,60 (1H, s), 11,74 (1H, s), 8,74 (1H, d, J = 2,0 Hz), 8,44 (1H, d, J = 8,6 Hz), 7,95 (1H, dd, J = 8,0, 1,8 Hz), 7,86 (1H, d, J = 8,0 Hz), 7,75 (1H, m), 7,72 (1H, dd, J = 8,6, 2,0 Hz), 7,54 (1H, d, J = 1,8 Hz), 7,17 (1H, t, J = 6,7 Hz), 4,86 (1H, d, J = 14,9 Hz), 4,37-4,22 (4H, m), 3,97 (2H, dd, J = 13,2, 2,6 Hz), 3,35 (2H, d, J = 10,4 Hz), 3,27 (1H, dt, J = 8,7,3,2 Hz), 2,92 (2H, m), 2,71 (1H, dd, J = 16,7, 8,7 Hz), 2,60-2,51 (1H, m), 1,87-1,58 (4H, m), 1,04 (3H, s).
Tautómero minoritario
RMN H1 (CDCls) 5: 11,91 (1H, s), 8,70 (1H, d, J = 2,0 Hz), 8,17 (1H, d, J = 8,6 Hz), 7,80 (1H, d, J = 8,0 Hz), 7,57 (1H, d, J = 2,0 Hz), 7,32 (1H, t, J = 6,9 Hz), 5,12 (1H, d, J = 14,9 Hz), 4,48-4,38 (4H, m), 0,80 (3H, s).
<Ejemplo 165> (referencia)
4-[[(4aR)-4-Hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]carbamoil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]metil]-3, 5-difluorobenzoato de metilo
Se añadieron hexacarbonilo de molibdeno (70,2 mg, 0,266 mmoles), 1,1'-bis(difenilfosfino)ferrocenodicloropaladio(II) (un complejo en diclorometano 1:1) (4,4 mg, 0,0053 mmoles) y 1,8-diazabiciclo[5,4,0]undec-7-eno (0,0024 mL, 0,159 mmoles) a una solución de (4aR)-1-[(2,6-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 322) (40 mg, 0,053 mmoles) en metanol (2 mL), y la mezcla se agitó en atmósfera de nitrógeno a 70°C durante 4 horas. La mezcla de reacción se añadió a ácido clorhídrico 1 N, el producto resultante se extrajo con diclorometano y, después de secar la capa orgánica sobre sulfato de magnesio anhidro, el producto resultante se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante TLC preparativa (hexano: acetato de etilo = 2:1) para obtener el compuesto del título (29,3 mg, 81%) en forma de un aceite de color pardo claro.
LCMS: m/z 685 [M+H]+
Tiempo de retención de HPLC: 1,68 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo de Referencia 80>
(4aR)-N-(4-Bromo-3,5-difluorofenil)-4-hidroxi-4a-metil-2-oxo-1,5,6,7-tetrahidropirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 133]
F
Primera Etapa
[Fórmula 134]
Una solución de 4-bromo-3,5-difluoroanilina (2,00 g, 9,62 mmoles) y ácido de Meldrum (2,77 g, 19,2 mmoles) en tolueno (18 mL) se agitó a 90°C durante 3 horas. Después de que la mezcla de reacción se enfrió a 0°C, el depósito se recogió mediante filtración. El sólido obtenido se purificó mediante cromatografía en columna de fase inversa (agua con ácido fórmico al 0,1%/acetonitrilo) para obtener 3-((4-bromo-3,5-difluorofenil)amino)-3-oxopropanoato (2,00 g, 71%) en forma de polvo de color blanco.
LCMS: m/z 294 [M+H]+
Tiempo de retención de HPLC: 0,66 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
[Fórmula 135]
Se utilizaron 2,4-dimetoxibenzaldehído, hidrocloruro de éster metílico de ácido (R)-2-metil-pirrolidin-2-carboxílico, y 3-((4-bromo-3,5-difluorofenil)amino)-3-oxopropanoato, y se llevaron a cabo operaciones similares a las del Ejemplo de Referencia 1-1 para sintetizar (4aR)-N-(4-bromo-3,5-difluorofenil)-1-[(2,4-(dimetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida.
LCMS: m/z 554 [M+H]+
Tiempo de retención de HPLC: 1,64 minutos (condiciones de análisis SQD-FA05)
Tercera Etapa
Se disolvieron (4aR)-N-(4-bromo-3,5-difluorofenil)-1-[(2,4-(dimetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (910 mg, 1,65 mmoles) y triisopropilsilano (0,68 mL, 3,29 mmoles) en ácido trifluoroacético (6 mL), y después la mezcla se enfrió a 0°C, se añadió gota a gota ácido trifluorometanosulfónico (0,15 mL, 1,65 mmoles). Después de agitar la mezcla a temperatura ambiente durante 30 minutos, la mezcla de reacción se añadió a agua helada (50 mL), se neutralizó con carbonato de potasio (5,5 g, 39,8 mmoles), y se extrajo tres veces con acetato de etilo (100 mL). Después de lavar la capa orgánica con salmuera, el producto resultante se secó sobre sulfato de sodio. El producto resultante se filtró, el producto filtrado se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna C-18 de fase inversa (agua con ácido fórmico al 0,1%/acetonitrilo) para obtener el compuesto del título (590 mg, 89%) en forma de un sólido de color blanco.
LCMS: m/z 402 [M+H]+
Tiempo de retención de HPLC: 0,70 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 81>
(4aR)-4-Hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-1,5,6,7-tetrahidropirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 136]
Primera Etapa
[Fórmula 137]
Se disolvió 4-(trifluorometil)-2-(6-(trifluorometil)piridin-3-il)anilina (Ejemplo de Referencia 42) (2,0 g) en tetrahidrofurano (30 mL), se añadió fosfato de tripotasio (4,16 g) y la mezcla se agitó a temperatura ambiente durante 3 minutos. Se añadió 3-cloro-3-oxopropanoato de metilo (1,40 mL) y la mezcla se agitó a temperatura ambiente durante 10 minutos. Se añadieron acetato de etilo (100 mL) y agua (100 mL) para la separación, y la capa orgánica se lavó con salmuera al 12% y se concentró a presión reducida para obtener ácido 3-O-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-1-O-metil-propanodioico en forma de un producto bruto.
LCMS: m/z 407 [M+H]+
Tiempo de retención de HPLC: 0,81 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
[Fórmula 138]
Se añadieron metanol (20 mL) y una solución acuosa de hidróxido de sodio 10 N (1,96 mL) al ácido 3-O-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-1 -O-metil-propanodioico obtenido en la Primera Etapa, y la mezcla se agitó a temperatura ambiente durante 10 horas. Se añadió ácido clorhídrico 6 N para ajustar el pH a 3, se añadieron acetato de etilo y agua para separación, y la capa orgánica se secó sobre sulfato de magnesio anhidro y el disolvente se eliminó por destilación a presión reducida. Se añadieron hexano (90 mL) y acetato de etilo (10 mL) al residuo resultante, la mezcla se agitó y a continuación, se filtró, y el sólido resultante se secó para obtener 3-oxo-3-((4-(trifluorometil)-2-(6-(trifluorometil)piridin-3-il)fenil)amino)propanoato (2,34 g, rendimiento en dos etapas 91%). LCMS: m/z 393 [M+H]+
Tiempo de retención de HPLC: 0,29 minutos (condiciones de análisis SQD-FA50)
Tercera Etapa
[Fórmula 139]
Se suspendió hidrocloruro de éster metílico de ácido (R)-2-metilpirrolidin-2-carboxílico (8,4 g, 46,8 mmoles) en diclorometano (50 mL), se añadió monohidrato de ácido p-toluenosulfónico (9,34 g, 49,1 mmoles) y la mezcla se agitó bajo atmósfera de nitrógeno a temperatura ambiente durante 10 minutos. La mezcla de reacción se concentró a presión reducida, se añadió tolueno para la eliminación azeotrópica, a continuación, el residuo se suspendió en diclorometano (50 mL), se añadió nitrito de sodio (3,55 g, 69,0 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 2 horas. Después de filtrar la mezcla de reacción, el producto resultante se concentró a presión reducida para obtener el éster metílico de ácido (S)-1-nitroso-pirrolidin-2-carboxílico en forma de un producto bruto. El producto bruto obtenido se disolvió en ácido acético (200 mL) y metanol (30 mL), se añadió polvo de zinc (29,4 g, 4501 mmoles) en porciones divididas en corriente de nitrógeno, a 0°C, y la mezcla se agitó durante 1 hora. Se añadió metanol (100 mL) a la mezcla de reacción, la mezcla se filtró a través de una almohadilla de celite, y a continuación, el producto filtrado se concentró a presión reducida. Después de repetir una operación similar dos veces, el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (diclorometano/metanol). Después de añadir una solución 4 N de cloruro de hidrógeno/1,4-dioxano a la fracción obtenida, el producto resultante se concentró a presión reducida para obtener hidrocloruro de éster metílico de ácido (R)-1-amino-2-metilpirrolidin-2-carboxílico (6,4 g, 70%).
LCMS: m/z 158,9 [M+H]+
Tiempo de retención de HPLC: cromatograma de masa de 0,33 minutos (condiciones de análisis SMD-TFA05)
Cuarta Etapa
Se utilizaron éster metílico ácido (R)-2-metil-1-(3-oxo-3-((4-(trifluorometil)-2-(6-(trifluorometil)piridin-3-il)fenil)amino)propanamido)pirrolidin-2-carboxílico e hidrocloruro de éster metílico de ácido (R)-1-amino-2-metilpirrolidin-2-carboxílico como reactivo y sustancia de partida, respectivamente, y se llevaron a cabo operaciones similares a las de la Segunda Etapa del Ejemplo de Referencia 1-1 para sintetizar éster metílico de ácido (R)-2-metil-1-(3-oxo-3-((4-(trifluorometil)-2-(6-(trifluorometil)piridin-3-il)fenil)amino)propanamido)pirrolidin-2-carboxílico.
LCMS: m/z 531 [M-H]-Tiempo de retención de HPLC: 0,88 minutos (SQD-FA05)
Quinta etapa
Se utilizó éster metílico de ácido (R)-2-metil-1-(3-oxo-3-((4-(trifluorometil)-2-(6-(trifluorometil)piridin-3-il)fenil)amino)propanamido)pirrolidin-2-carboxílico, y se llevaron a cabo operaciones similares a las de la Tercera Etapa del Ejemplo de Referencia 1-1 para sintetizar el compuesto del título.
LCMS: m/z 501 [M+H]+
Tiempo de retención de HPLC: 1,03 minutos (SQD-FA05)
<Ejemplo de Referencia 82>
(4aR)-4-Hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il]fenil]-1,5,6,7-tetrahidropirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 141]
Primera Etapa
[Fórmula 142]
Se utilizaron 4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)anilina (Ejemplo de Referencia 50) y ácido de Meldrum, y se realizaron operaciones similares a las de la Segunda Etapa del Ejemplo de Referencia 80 para sintetizar 3- oxo-3-((4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)amino)propanoato.
Segunda Etapa
Se utilizaron hidrocloruro de éster metílico de ácido (R)-1-amino-2-metilpirrolidin-2-carboxílico y 3-oxo-3-((4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenilo)amino)propanoato, y se llevaron a cabo operaciones similares a las de las Etapas Cuarta y Quinta del Ejemplo de Referencia 81 para sintetizar el compuesto del título.
LCMS: m/z 502 [M+H]+
Tiempo de retención de HPLC: 1,02 minutos (SQD-FA05)
<Ejemplo 166> (referencia)
(4aR)-N-(4-Bromo-3,5-difluorofenil)-1 -[(4-bromo-2-fluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 143]
Se añadió una solución 1,7 N en tolueno (0,0644 mL, 0,109 mmoles) de 4-bromo-1-(bromometil)-2-fluorobenceno (14,7 mg, 0,055 mmoles) y 2,2-dimetilpropan-1-olato de potasio a una solución de (4aR)-N-(4-bromo-3,5-difluorofenil)-4-hidroxi-4a-metil-2-oxo-1,5,6,7-tetrahidropirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo de Referencia 80) (20,0 mg, 0,050 mmoles) en N,N-dimetilformamida (0,249 mL), y la mezcla se agitó a temperatura ambiente durante 15 minutos. La mezcla de reacción se purificó directamente mediante cromatografía en columna C18 de fase inversa (acetonitrilo de ácido fórmico al 0,1%/agua) para obtener el compuesto del título (6,0 mg, 20%) en forma de un sólido amorfo de color blanco grisáceo.
LCMS: m/z 588 [M-H]-Tiempo de retención de HPLC: 1,32 minutos (SQD-FA05)
Se utilizaron los intermedios de piridazinona apropiados de los Ejemplos de Referencia 80 a 82 y reactivos de haluro de bencilo apropiados, y se llevaron a cabo operaciones similares a las del Ejemplo 166 para sintetizar los compuestos de los Ejemplos descritos en la siguiente Tabla (Ejemplos de Referencia).
T l 27-1
T l 27-2
T l 27-
Tabla 27-4
Tabla 27-5
T l 27-
T l 27-7
T l 27-
Aunque los compuestos respectivos descritos en esta tabla incluyen sus tautómeros, por ejemplo, el RMN H1 del Ejemplo 196 es el siguiente.
Tautómero mayoritario
RMN H1 (400 MHz, CDCls) 5: 16,40 (1H, s), 12,00 (1H, s), 7,40-7,28 (4H, m), 7,11-7,04 (1H, m), 5,14 (1H, d, J = 14,1 Hz), 4,47 (1H, d, J = 14,1 Hz), 3,37-3,32 (1H, m), 2,82-2,76 (1H, m), 2,61-2,54 (1H, m), 1,76-1,61 (3H, m), 1,01 (3H, s).
Tautómero minoritario
RMN H1 (400 MHz, CDCh) 5: 16,40 (1H, s), 12,18 (1H, s), 7,40-7,28 (4H, m), 7,11-7,04 (1H, m), 5,11 (1H, d, J = 14,4 Hz), 4,53 (1H, d, J = 14,4 Hz), 3,32-3,26 (1H, m), 2,84-2,77 (1H, m), 2,65-2,61 (1H, m), 1,81-1,70 (3H, m), 0,88 (3H, s).
<Ejemplo 234> (referencia)
(4aR)-4-Hidroxi-4a-metil-2-oxo-1-(4,4,4-trifluorobutil)-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 144]
Se utilizaron (4aR)-1-[(2,4-dimetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxilato de metilo (Ejemplo de Referencia 12) y 1,1,1-trifluoro-4-yodobutano, y se llevaron a cabo operaciones similares a las del Tercera Etapa del Ejemplo de Referencia 80, Ejemplo 166 y Ejemplo 21 consecutivamente para obtener el compuesto del título.
LCMS: m/z 612 [M+H]+
Tiempo de retención de HPLC: 1,63 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 235> (referencia)
7-[(4aR)-4-Hidroxi-4a-metil-2-oxo-3-[[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]carbamoil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-1-il]heptanoato de etilo
[Fórmula 145]
Se utilizaron (4aR)-1-[(2,4-dimetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxilato de metilo (Ejemplo de Referencia 12) y 7-bromoheptanoato de etilo, y se llevaron a cabo operaciones similares a las del Ejemplo 234 para obtener el compuesto del título.
LCMS: m/z 657 [M+H]+
Tiempo de retención de HPLC: 1,70 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 236> (referencia)
(4aR)-4-Hidroxi-1 -[8-[2-(2-metoxietoxi)etoxi]octil]-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6
(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 146]
Primera Etapa
[Fórmula 147]
Se añadió yoduro de sodio a una solución de 1-bromo-8-(2-(2-metoxietoxi)etoxi)octano (1,00 g, 3,21 mmoles) en acetona, y la mezcla se agitó a 60°C durante 2 horas. Después de que la mezcla de reacción se enfrió a temperatura ambiente, el precipitado se filtró para su separación, y después de que el producto filtrado se lavó con tiosulfato de sodio y salmuera, el producto resultante se secó sobre sulfato de sodio. Después de que se filtró el resultante, el producto filtrado se concentró a presión reducida para obtener 1-yodo-8-(2-(2-metoxietoxi)etoxi)octano (1,05 g, 91%) en forma de un aceite de color amarillo.
Segunda Etapa
Se utilizó (4aR)-1-[(2,4-(dimetoxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxilato de metilo (Ejemplo de Referencia 12) y la masa de yodo obtenida en la Primera Etapa, y se realizaron operaciones similares a las del ejemplo 234 para obtener el compuesto del título.
LCMS: m/z 732 [M+H]+
Tiempo de retención de HPLC: 1,76 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 237>
(3S)-3-Terc-butil-N-[4-cloro-2-(6-(trifluorometil)pirimidin-4-il]fenil]-1 -[(2,3-difluorofenil)metil]-4-hidroxi-2-metil-6-oxo-3H-pirimidin-5-carboxamida
Primera Etapa
(2S)-3,3-dimetil-2-[metil-[(2-metilpropan-2-il)oxicarbonil]amino]butanoato de metilo
[Fórmula 148]
El ácido (S)-2-((terc-butoxicarbonil)amino)-3,3-dimetilbutanoico (11,3 g, 48,9 mmoles) se disolvió en N,N-dimetilformamida (114 mL), óxido de plata (34,0 g, 147 mmoles)) y se añadieron yodometano (18,3 mL, 294 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a 45°C durante la noche. La mezcla de reacción se diluyó con acetato de etilo (200 mL) y se filtró, se añadió agua y el producto resultante se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (12,7 g, 100 %).
RMN H1 (CDCls) 5: 4,75 (1H, s), 3,71 (3H, s), 2,94 (3H, s), 1,48 (9H, s), 1,08 (9H, s).
Segunda Etapa
Hidrocloruro de (S)-3,3-dimetil-2-(metilamino)butanoato de metilo
[Fórmula 149]
Se añadió ácido clorhídrico (una solución en dioxano, 122 mL, 489 mmoles) a ((2S)-3,3-dimetil-2-[metil-[(2-metilpropan-2-il)oxicarbonil]amino]butanoato de metilo (12,69 g), y la mezcla se agitó a temperatura ambiente durante 1 hora. La mezcla de reacción se concentró a presión reducida para obtener el compuesto del título (9,58 g, 100%).
RMN H1 (DMSO-D6) 5: 9,00 (1H, brs), 3,89-3,86 (1H, m), 3,79 (3H, s), 2,54 (3H, s), 1,02 (9H, s).
Tercera Etapa
(2S)-2-[[(2,3-difluorofenil)metilidenamino]-metilamino]-3,3-dimetilbutanoato de metilo
[Fórmula 150]
El hidrocloruro de (S)-3,3-dimetil-2-(metilamino)butanoato de metilo (70,0 mg, 0,358 mmoles) se disolvió en ácido acético (3,58 mmoles, 205 pL) y agua (716 pL), se añadió nitrito de sodio (33,4 mg, 0,393 mmoles) a 0°C y la mezcla se agitó en atmósfera de nitrógeno durante 1 hora. Se añadió zinc (19,7 g, 302 mmoles) a la mezcla de reacción a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 4 horas. Después de filtrar la mezcla de reacción, se añadieron metanol (3,58 mL) y 2,3-difluorobenzaldehído (39,1 pL, 0,358 mmoles), y la mezcla se agitó a temperatura ambiente durante 30 minutos. La mezcla de reacción se concentró a presión reducida y se diluyó con acetato de etilo, y la capa orgánica se lavó con una solución saturada de bicarbonato de sodio y salmuera, y a continuación, el producto resultante se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (44,2 mg, 41%).
LCMS: m/z 299 [M+H]+
Tiempo de retención de HPLC: 1,13 minutos (condiciones de análisis SQD-AA05)
Cuarta Etapa
Éster 2-metilpropílico de ácido (3S)-3-terc-butil-1-[(2,3-difluorofenil)metil]-4-hidroxi-2-metil-6-oxo-3H-pirimidin-5-carboxílico
Se disolvió ((2S)-2-[[(2,3-difluorofenil)metilidenamino]-metilamino]-3,3-dimetilbutanoato de metilo (44,2 mg, 0,148 mmoles) en ácido clorhídrico (una solución de metanol, 442 pL), se añadió borano-piridina (29,9 pL, 0,296 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 2 horas. La mezcla de reacción se concentró a presión reducida y se diluyó con acetato de etilo, la capa orgánica se lavó con una solución acuosa de hidrógeno fosfato dipotásico 1 N y salmuera, y la capa acuosa se separó mediante un separador de fases y se concentró a presión reducida para obtener (2S)-2-[[(2,3-difluorofenil)metilamino]-metilamino]-3,3-dimetilbutanoato de metilo en forma de un producto bruto. El producto bruto obtenido se disolvió en acetato de etilo (750 pL) y a continuación, se añadieron 3-isobutoxi-3-oxopropanoato (0,026 g, 0,163 mmoles), piridina (35,8 pL, 0,444 mmoles) y 2,4,6-trióxido de 2,4,6-tripropil-1,3,5,2,4,6-trioxatrifosfinano (una solución en acetato de etilo, 174 pl, 0,296 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 1 hora. Se añadió agua a la mezcla de reacción, y el producto resultante se extrajo con acetato de etilo. La capa orgánica se lavó con una solución acuosa de hidrógeno fosfato de dipotasio 1 N y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener
(2S)-2-[[(2,3-difluorofenil)metil-[3-(2-metilpropoxi)-3-oxopropanoil]amino]-metilamino]-3,3-dimetilbutanoato de metilo en forma de un producto bruto. El producto bruto obtenido se disolvió en N,N-dimetilformamida (750 pL), se añadió carbonato de cesio (121 mg, 0,370 mmoles) y la mezcla se agitó en atmósfera de nitrógeno a 80°C durante 2 horas. Se añadió ácido clorhídrico 1 N a la mezcla de reacción a 0°C, y el producto resultante se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título (48,1 mg, 79 %).
LCMS: m/z 411,5 [M+H]+
Tiempo de retención de HPLC: 1,03 minutos (condiciones de análisis SQD-AA05)
Quinta etapa
(3S)-3-Terc-butil-N-[4-cloro-2-[6-(trifluorometil)pirimidin-4-il]fenil]-1 -[(2,3-difluorofenil)metil]-4-hidroxi-2-metil-6-oxo-3H-pirimidin-5-carboxamida
Se disolvieron éster 2-metilpropílico de ácido (3S)-3-terc-butil-1-[(2,3-difluorofenil)metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxílico (6,3 mg, 0,015 mmoles) en tolueno (200 pL), se añadió 4-cloro-2-(6-(trifluorometil)pirimidin-4-il)anilina (Ejemplo de Referencia 53) (4,2 mg, 0,015 mmoles), y la mezcla se calentó durante 1 hora. La mezcla de reacción se concentró y el residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título (8,0 mg, 85%).
LCMS: m/z 610,3 [M+H]+
Tiempo de retención de HPLC: 1,72 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo de Referencia 83>
Hidrocloruro de (S)-2-(etilamino)-3,3-dimetilbutanoato de metilo
Primera Etapa
(2S)-2-[Bencil(etil)amino]-3,3-dimetilbutanoato de metilo
[Fórmula 153]
Se suspendió hidrocloruro de (2S)-2-amino-3,3-dimetilbutanoato de metilo (5,27 g, 29,0 mmoles) en dicloroetano (250 mL) y a continuación, se añadieron benzaldehído (2,93 mL, 29,0 mmoles) y triacetoxihidroborato de sodio (12,3 g, 58,0 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 10 horas. La mezcla de reacción se diluyó con acetato de etilo (200 mL) y se filtró, se añadió agua y el producto resultante se extrajo con acetato de etilo. Se añadió una solución saturada de bicarbonato de sodio a la mezcla de reacción a 0°C, y la mezcla se extrajo con diclorometano. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster metílico de (2S)-2-(bencilamino)-3,3-dimetilbutanoato (6,82 g) en forma de un producto bruto. Una parte del producto bruto obtenido (2,00 g, 8,50 mmoles) se disolvió en diclorometano (42,5 mL), acetaldehído (2,39 mL, 42,5 mmoles) y triacetoxihidroborato de sodio (3,60 g, 17,0 mmoles) y la mezcla se agitó bajo atmósfera de nitrógeno a temperatura ambiente durante 24 horas. Se añadió una solución saturada de bicarbonato de sodio a la mezcla de reacción a 0°C, y la mezcla se extrajo con diclorometano. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (1,65 g, 88 %).
LCMS: m/z 264,3 [M+H]+
Tiempo de retención de HPLC: 1,14 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
Hidrocloruro de metil(S)-3,3-dimetil-2-(metilamino) butanoato
[Fórmula 154]
Se disolvió (2S)-2-[bencil(etil)amino]-3,3-dimetilbutanoato de metilo (1,64 g, 6,23 mmoles) en acetato de etilo (6,23 mL), se añadió hidróxido de paladio-carbono (20% en peso, 328 mg), y la mezcla se agitó en atmósfera de hidrógeno a temperatura ambiente durante 6 horas. La mezcla de reacción se filtró, se añadió ácido clorhídrico (una solución en dioxano, 4,67 mL, 18,7 mmoles), y a continuación, el producto resultante se concentró a presión reducida para obtener el compuesto del título (922 mg, 71%).
RMN H1 (DMSO-D6) 5: 8,98 (1H, brs), 8,76 (1H, brs), 3,88 (1H, d, J = 10,0 Hz), 3,78 (3H, s), 2,94 (2H, q, J = 6,0 Hz), 1,22 (3H, t, J = 7,3 Hz), 1,04 (9H, s).
<Ejemplo de Referencia 84>
(2S)-3,3-dimet¡l-2-(2,2,2-tr¡fluoroet¡lam¡no) butanoato de metilo
[Fórmula 155]
Se suspendió hidrocloruro de (2S)-2-amino-3,3-dimetilbutanoato de metilo (1,00 g, 5,50 mmoles) en tetrahidrofurano (250 mL) y a continuación, se añadieron ácido trifluorometanosulfónico 2,2,2-trifluoroetilo (1,59 mL, 11,0 mmoles) y diisopropiletilamina (4,79 mL, 27,5 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a 60°C durante 27 horas. Después de que la mezcla se enfrió a temperatura ambiente, la mezcla de reacción se filtró, se añadió ácido clorhídrico concentrado, el producto resultante se concentró a presión reducida y el residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título como una solución de acetonitrilo/agua.
LCMS: m/z 228,3 [M+H]+
Tiempo de retención de HPLC: 1,19 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 85>
Hidrocloruro de 1-(metilamino)ciclobutanocarboxilato de metilo
Primera Etapa
1-((terc-Butoxicarbonil)(metil)amino)ciclobutanocarboxilato de metilo
[Fórmula 156]
Se disolvió ácido 1-((terc-butoxicarbonil)amino)ciclobutanocarboxílico (1,00 g, 4,65 mmoles) en N,N-dimetilformamida (9,29 mL) y a continuación, se añadieron hidruro de sodio (55%, 0,61 g, 13,9 mmoles) y yoduro de metilo (1,45 mL, 23,3 mmoles) a 0°C, y la mezcla se agitó bajo atmósfera de nitrógeno a temperatura ambiente durante 3 horas. Se añadió una solución acuosa de ácido clorhídrico 1 N a la mezcla de reacción a 0°C, y la mezcla se extrajo con éter dietílico. La capa orgánica se lavó con agua, una solución saturada de bicarbonato de sodio, una solución acuosa de tiosulfato de sodio al 10% en peso y salmuera, la capa acuosa se separó mediante un separador
de fases, el producto resultante se concentró a presión reducida y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (1,13 g, 100%).
LCMS: m/z 266,3 [M Na]+
Tiempo de retención de HPLC: 0,92 minutos (condiciones de análisis SQD-AA05)
Segunda Etapa
Hidrocloruro de 1-(metilamino)ciclobutanocarboxilato de metilo
[Fórmula 157]
De una manera similar a la segunda etapa del ejemplo 237, el compuesto del título se sintetizó a partir de 1-((tercbutoxicarbonil)(metil)amino)ciclobutanocarboxilato de metilo.
RMN H1 (DMSO-D6) 5: 9,97 (2H, brs), 3,86 (3H, s), 2,60-2,57 (2H, m), 2,50-2,46 (5H, m), 2,06-2,03 (2H, m).
<Ejemplo de Referencia 86>
4-Toluenosulfonato de 1-(metilamino)ciclobutanocarboxilato de metilo
[Fórmula 158]
Se disolvió hidrocloruro de 1-(metilamino)ciclobutanocarboxilato de metilo (1,39 g, 7,75 mmoles) en acetato de etilo (15 mL), y a continuación, se añadió monohidrato de 4-toluenosulfonato (1,47 g, 7,75 mmoles), la mezcla se concentró a presión reducida, se añadió acetato de etilo (15 mL), y el producto resultante se filtró para obtener el compuesto del título (1,96 g, 80%).
RMN H1 (DMSO-D6) 5: 9,10 (2H, brs), 7,48 (2H, d, J = 7,9 Hz), 7,12 (2H, d, J = 7,9 Hz), 3,82 (3H, s), 2,56-2,31 (7H, m), 2,29 (3H, s), 2,05-1,99 (2H, m).
<Ejemplo de Referencia 87>
Hidrocloruro de 1-(metilamino)ciclopentanocarboxilato de metilo
[Fórmula 159]
o
O V
De una manera similar a la primera y segunda etapas del Ejemplo de Referencia 85, el compuesto del título se sintetizó a partir de ácido 1 -((terc-butoxicarbonil)amino)ciclopentanocarboxílico.
RMN H1 (DMSO-D6) 5: 9,71 (2H, brs), 3,79 (3H, s), 3,34 (3H, s), 2,20-2,13 (2H, m), 2,05-1,98 (2H, m), 1,89-1,86 (2H, m), 1,74-1,71 (2H, m).
<Ejemplo de Referencia 88>
4-Toluenosulfonato de 1-(metilamino)ciclopentanocarboxilato de metilo
[Fórmula 160]
Se disolvió hidrocloruro de 1-(metilamino)ciclopentanocarboxilato de metilo (1,50 g, 7,75 mmoles) en acetato de etilo (15 mL) y a continuación, se añadió monohidrato de 4-toluenosulfonato (1,47 g, 7,75 mmoles), la mezcla se
concentró a presión reducida, se añadió acetato de etilo (15 mL) y el producto resultante se filtró para obtener el compuesto del título (2,00 g, 78%).
RMN H1 (DMSO-D6) 5: 9,18 (2H, brs), 7,48 (2H, d, J = 7,9 Hz), 7,11 (2H, d, J = 7,9 Hz), 3,79 (3H, s), 2,57 (3H, brs), 2,29 (3H, s), 2,24-2,10 (2H, m), 1,99-1,86 (2H, m), 1,86-1,65 (2H, metro).
<Ejemplo de Referencia 89>
Hidrocloruro de 1-(metilamino)ciclohexanocarboxilato de metilo
[Fórmula 161]
De una manera similar a la primera y segunda etapas del Ejemplo de Referencia 85, el compuesto del título se sintetizó a partir de ácido 1 -((terc-butoxicarbonil)amino)ciclohexanocarboxílico.
RMN H1 (DMSO-D6) 5: 9,43 (2H, brs), 3,84 (3H, s), 2,51 (3H, s), 2,15-2,12 (2H, m), 1,77-1,73 (4H, m), 1,58-1,55 (1H, m), 1,47-1,44 (2H, m), 1,35-1,29 (1H, m).
LCMS: m/z 172,5 [M+H]+
LCMS: m/z 172,5 [M+H]+
Tiempo de retención de HPLC: 0,52 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 90>
Hidrocloruro de 2-etil-2-(metilamino)butanoato de metilo
Primera Etapa
Éster metílico de 2-(((benciloxi)carbonil)amino)-2-etilbutanoato
[Fórmula 162]
Se disolvió 2-etil-2-(metoxicarbonil)butanoato (307,0 mg, 1,76 mmoles) en tolueno (11,7 mL), y a continuación, se añadieron trietilamina (295 pL, 2,12 mmoles) y difenilfosforilazida (458 pL, 2,12 mmoles), y la mezcla se agitó a temperatura ambiente durante 1,5 horas y a 95°C durante 0,5 horas. Se añadió alcohol bencílico (1,1 mL, 10,6 mmoles) y la mezcla se agitó a 95°C durante la noche. La mezcla de reacción se concentró a presión reducida, se diluyó con éter dietílico, y el producto resultante se lavó con ácido clorhídrico 1 N, una solución saturada de bicarbonato de sodio y salmuera. La capa orgánica se secó sobre sulfato de sodio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/hexano) para obtener el compuesto del título (488,1 mg, 99%).
LCMS: m/z 280 [M+H]+
Tiempo de retención de HPLC: 1,11 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
2-((Benciloxi)carbonil)(metil)amino)-2-etilbutanoato de metilo
[Fórmula 163]
Después de añadir una solución de 2-((((benciloxi)carbonil)amino)-2-etilbutanoato de metilo (481,3 mg, 1,72 mmoles) en N,N-dimetilformamida (3,4 mL) a hidruro de sodio (83 mg, 3,45 mmoles) a 0°C, se añadió yoduro de metilo (269 pL, 4,31 mmoles), y la mezcla se agitó a temperatura ambiente durante 2 horas. La mezcla de reacción se diluyó con éter dietílico y se lavó con ácido clorhídrico 1 N, agua, una solución saturada de bicarbonato de sodio, una solución acuosa de tiosulfato de sodio y salmuera. La capa orgánica se secó sobre sulfato de sodio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/hexano) para obtener el compuesto del título (438,5 mg, 87%).
LCMS: m/z 294 [M+H]+
Tiempo de retención de HPLC: 1,14 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
Hidrocloruro 2-etil-2-(metilamino)butanoato de metilo
[Fórmula 164]
Se añadió paladio-carbono (10% en peso, 15,8 mg) a una solución de 2-(((benciloxi)carbonil)(metil)amino)-2-etilbutanoato de metilo (434,5 mg, 1,48 mmoles) en metanol (7,4 mL) y la mezcla se agitó en atmósfera de hidrógeno a temperatura ambiente durante 1 hora. Se añadió una solución de ácido clorhídrico-metanol (0,5 M, 14,8 mL) a la mezcla de reacción, y el producto resultante se filtró y se concentró a presión reducida para obtener el compuesto del título (281,9 mg, 97%).
RMN H1 (CD3OD) 5: 3,92 (3H, s), 3,34 (1H, m), 2,69 (3H, s), 2,04 (4H, m), 0,99 (6H, t).
LCMS: m/z 160 [M+H]+
Tiempo de retención de HPLC: 0,49 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 91>
4-Cloro-5-metil-6-(trifluorometil)pirimidina
Primera Etapa
5-Metil-6-(trifluorometil)pirimidin-4 (3H)-ona
[Fórmula 165]
Se disolvieron 4,4,4-trifluoro-2-metil-3-oxobutanoato de etilo (200 mg, 1,01 mmoles) e hidrocloruro de formamidina (122 mg, 1,51 mmoles) en etanol (2,0 mL), y la mezcla se agitó a temperatura ambiente durante 2 horas. Se añadió etóxido de sodio (172 mg, 2,52 mmoles) y la mezcla se agitó a 80°C durante 4 horas. Se añadieron ácido clorhídrico 1 N y agua a la mezcla de reacción, y el producto resultante se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se lavó con éter dietílico para obtener el compuesto del título (158 mg, 88%).
LCMS: m/z 179 [M+H]+
Tiempo de retención de HPLC: 0,46 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
4-Cloro-5-metil-6-(trifluorometil)pirimidina
[Fórmula 166]
Cl
Se añadió cloruro de fosforilo (1,06 mL, 11,4 mmoles) a 5-metil-6-(trifluorometil)pirimidin-4(3H)-ona (135 mg, 0,758 mmoles), y la mezcla se agitó a 100°C durante 1 hora. Se añadió una solución saturada de bicarbonato de sodio a la mezcla de reacción, y el producto resultante se extrajo con diclorometano. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio anhidro, se filtró y se concentró a presión reducida para obtener el compuesto del título en forma de un producto bruto.
LCMS: m/z 197 [M+H]+
Tiempo de retención de HPLC: 0,95 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 92>
4,5-Dicloro-6-(trifluorometil)pirimidina
Primera Etapa
5-Cloro-6-(trifluorometil)pirimidin-4 (3H)-ona
[Fórmula 167]
Se disolvieron 6-(trifluorometil)pirimidin-4(3H)-ona (1,0 g, 6,1 mmoles) y N-clorosuccinimida (1,1 g, 7,9 mmoles) en N,N-dimetilformamida (5,0 mL), y la mezcla se agitó a 50°C durante 9 horas. La mezcla de reacción se diluyó con acetato de etilo y se lavó con agua y salmuera. La capa orgánica se secó sobre sulfato de sodio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (agua/acetonitrilo, ácido fórmico al 0,1%) para obtener el compuesto del título (368,5 mg, 31%).
LCMS: m/z 199 [M+H]+
Tiempo de retención de HPLC: 0,68 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
4,5-Dicloro-6-(trifluorometil)pirimidina
[Fórmula 168]
l
Se añadió cloruro de fosforilo (1,4 mL, 15,1 mmoles) a 5-cloro-6-(trifluorometil)pirimidin-4 (3H)-ona (150,0 mg, 0,756 mmoles), y la mezcla se agitó a 100°C durante 1,5 horas. Se añadió agua con hielo a la mezcla de reacción y se extrajo con diclorometano, la capa orgánica se secó sobre sulfato de sodio anhidro, se filtró y se concentró a presión reducida para obtener el compuesto del título (121,5 mg) en forma de un producto bruto.
LCMS: m/z 217 [M+H]+
Tiempo de retención de HPLC: 1,03 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 93>
4-Cloro-2-(6-cloropirimidin-4-il)anilina
[Fórmula 169]
Se añadió dioxano (9,6 mL) al éster de pinacol de ácido 2-amino-4-cloro-fenilborónico (608 mg, 2,4 mmoles), 4,6-dicloropiridina (892 mg, 6,0 mmoles), tetrakis(trifenilfosfina)paladio (138 mg, 0,12 mmoles) y fosfato de potasio (2,03 g, 9,6 mmoles), y la mezcla se agitó a 90°C durante 3 horas. La mezcla de reacción se diluyó con agua y se extrajo con acetato de etilo. La capa orgánica se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/hexano) para obtener el compuesto del título (349,6 mg, 59%).
LCMS: m/z 240 [M+H]+
Tiempo de retención de HPLC: 1,14 minutos (condiciones de análisis SMD-TFA05)
Los derivados de ácido borónico y haluros de descritos en la siguiente Tabla se utilizaron para sintetizar los intermedios de anilina descritos en la siguiente Tabla llevando a cabo operaciones similares a las del Ejemplo de Referencia 93.
T l 2
<Ejemplo de Referencia 99>
6-(2-Amino-5-clorofenil)pirimidin-4-carbonitrilo
[Fórmula 170]
Se utilizó 4-cloro-2-(6-cloropirimidin-4-il)anilina, y se realizaron operaciones similares a las del Ejemplo de Referencia 63 para sintetizar el compuesto del título.
LCMS: m/z 265 [M+H]+
Tiempo de retención de HPLC: 1,16 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 100>
6-(2-Am¡no-5-clorofen¡l)-5-metilp¡r¡m¡d¡n-4-carbon¡tr¡lo
[Fórmula 171]
Se utilizó 4-cloro-2-(6-cloropirimidin-4-il)anilina, y se realizaron operaciones similares a las del Ejemplo de Referencia 63 para sintetizar el compuesto del título.
LCMS: m/z 245 [M+H]+
Tiempo de retención de HPLC: 0,75 minutos (condiciones de análisis SQD-FA05)
<Ejemplos 238 a 300>
Se utilizaron los reactivos de anilina apropiados de los Ejemplos de Referencia 94 a 100 descritos en la Tabla 30, los derivados de benzaldehído apropiados del Ejemplo de Referencia 3 y los conocidos de la bibliografía o comercializados, y las aminas apropiadas de los Ejemplos de Referencia 85 a 90 y las conocidas de la bibliografía o comercializadas para sintetizar los compuestos descritos en la siguiente Tabla llevando a cabo operaciones similares a las de las Etapas tercera a quinta del ejemplo 237.
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (sin aditivos), MeCN/agua (ácido fórmico al 0,1%), MeCN/agua (NEt3 al 0,1%) o CHCh Columna:
YMC-Actus ODS-A (100 x 20 mm D.I., S-5 pm, 12 nm)
YMC-Actus Triart C18 (100 x 30 mm D.I., S-5 pm, 12 nm)
YMC-Actus Triart C18 (50 x 30 mm D.I., S-5 pm, 12 nm)
JAI JAIGEL-H (600 x 20 mm D.I., GPC)
Tabla 29-1
T l 2-2
T l 2-
T l 2-4
T l 2-
Tabla 29-6
T l 2-7
<Ejemplo de Referencia 101>
2-(2,3-Difluorobencil)-5-hidroxi-6,6-dimetil-3-oxo-1-fenil-1,2,3,6-tetrahidropiridazin-4-carboxilato de metilo
Primera Etapa
Se disolvieron fenilhidrazina (0,76 g, 7,1 mmoles) y 2-bromo-2-metilpropionato de etilo (1,93 g, 9,9 mmoles) en N,N-diisopropiletilamina (1,00 g, 7,8 mmoles), y la mezcla se agitó y calentó en atmósfera de nitrógeno a 110°C durante 4 horas. La mezcla de reacción se enfrió a temperatura ambiente, se concentró a presión reducida y se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener un producto bruto. Se añadieron metanol (6 mL) y 2,3-difluorobenzaldehído (0,77 mL, 7,1 mmoles) al producto bruto obtenido, y la mezcla se agitó en atmósfera de nitrógeno a
temperatura ambiente durante 1 hora. La mezcla de reacción se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna C-18 de fase inversa sobre gel de sílice (agua con ácido fórmico al 0,1%/acetonitrilo con ácido fórmico al 0,1%) para obtener etil 2-(2-(2,3-difluorobenciliden)-1-fenilhidrazinil)-2-metilpropanoato (0,51 g, 21%) en forma de un aceite de color amarillo.
LCMS: m/z 347 [M+H]+
Tiempo de retención de HPLC: 1,12 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
[Fórmula 173]
Se utilizó 2-(2-(2,3-difluorobenciliden)-1-fenilhidrazinil)-2-metilpropanoato de etilo obtenido en la primera etapa, y se realizaron operaciones similares a las del Ejemplo de Referencia 1-2 para obtener el compuesto del título (0,38 g, 65%) en forma de aceite de color amarillo.
LCMS: m/z 403 [M+H]+
Tiempo de retención de HPLC: 0,97 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 102>
6-(2,3-Difluorobencil)-9-hidroxi-5-metil-7-oxo-5,6-diazaespiro[3,5]non-8-eno-8-carboxilato de metilo Primera Etapa
[Fórmula 174]
Se disolvieron metilhidrazina (0,10 g, 2,17 mmoles) y 1-bromociclobutanocarboxilato de etilo (0,23 g, 1,1 mmoles) en N,N-diisopropiletilamina (0,30 g, 2,3 mmoles), y la mezcla se agitó y calentó bajo atmósfera de nitrógeno a 110°C durante 15 horas La mezcla de reacción se enfrió a temperatura ambiente, se filtró, se concentró a presión reducida y se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener un producto bruto. El producto bruto obtenido se añadió a la mezcla de reacción, y a continuación, se añadieron metanol (2 mL) y 2,3-difluoro-benzaldehído (0,12 mL, 1,1 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1 hora. La mezcla de reacción se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna C-18 de fase inversa sobre gel de sílice (agua con ácido fórmico al 0,1%/acetonitrilo con ácido fórmico al 0,1%) para obtener 1-(2-(2 (2, 3-difluorobenciliden)-1-metilhidrazinil)ciclobutanocarboxilato (36 mg, 11%) en forma de un aceite incoloro.
LCMS: m/z 297 [M+H]+
Tiempo de retención de HPLC: 1,15 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
[Fórmula 175]
Se utilizó el 1-(2-(2,3-difluorobenciliden)-1-metilhidrazinil)ciclobutanocarboxilato de etilo obtenido en la Primera Etapa, y se llevaron a cabo operaciones similares a las de la Segunda Etapa del Ejemplo de Referencia 101 para
obtener el compuesto del título (50 mg, 78%) en forma de aceite de color rojo.
LCMS: m/z 353 [M+H]+
Tiempo de retención de HPLC: 0,93 minutos (condiciones de análisis SQD-FA05)
<Ejemplo de Referencia 103>
2-(2,3-Difluorobencil)-5-hidroxi-1,6,6-trimetil-3-oxo-1,2,3,6-tetrahidropiridazin-4-carboxilato de metilo Primera Etapa
Se disolvieron metilhidrazina (0,46 g, 10,0 mmoles) y 2-bromo-2-metilpropionato de etilo (1,07 g, 5,5 mmoles) en tetrahidrofurano (5,0 mL), y a continuación, se añadió N,N-diisopropiletilamina (0,84 g, 6,5 mmoles), y la mezcla se agitó y calentó en atmósfera de nitrógeno a 60°C durante 66 horas. Después de que la mezcla de reacción se enfrió a temperatura ambiente, se añadieron metanol (60 mL) y 2,3-difluoro-benzaldehído (0,55 mL, 5,0 mmoles) a la mezcla de reacción, y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1 hora. La mezcla de reacción se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna C-18 de fase inversa sobre gel de sílice (agua con ácido fórmico al 0,1%/acetonitrilo de ácido fórmico al 0,1%) para obtener 2-[2-(2,3-difluorobenciliden)-1-metilhidrazinil]-2-metilpropionato de etilo (0,8 g, 56%) en forma de un aceite incoloro.
LCMS: m/z 285 [M+H]+
Tiempo de retención de HPLC: 1,00 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
[Fórmula 177]
Se utilizó el 2-[2-(2,3-difluorobenciliden)-1-metilhidrazinil]-2-metilpropionato de etilo obtenido en la Primera Etapa, y se llevaron a cabo operaciones similares a las de la Segunda Etapa del Ejemplo de Referencia 101 para obtener el compuesto del título (650 mg, 68%) en forma de aceite de color amarillo.
LCMS: m/z 341 [M+H]+
Tiempo de retención de HPLC: 0,81 minutos (condiciones de análisis SQD-FA05)
Los reactivos de anilina apropiados y los intermedios éster apropiados de los Ejemplos de Referencia 101 a 103 se utilizaron para sintetizar los compuestos descritos en la siguiente Tabla llevando a cabo operaciones similares a las de la quinta etapa del ejemplo 237.
Tabla 30-1
T l -2
<Ejemplo 313>
2-[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-5-hidroxi-1,6,6-trimetil-3-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]piridazin-4-carboxamida
Primera Etapa
[Fórmula 178]
Se utilizaron metilhidrazina, 2-bromo-2-metilpropionato de etilo y el reactivo aldehído sintetizado en el Ejemplo de Referencia 3, y se llevaron a cabo operaciones similares a las del Primera Etapa del Ejemplo de Referencia 103 para obtener 2-(2-(2,3-difluoro-4-(2-morfolinoetoxi)benciliden)-1-metilhidrazinil)-2-metilpropanoato de etilo.
LCMS: m/z 414 [M+H]+
Tiempo de retención de HPLC: 0,96 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
[Fórmula 179]
El 2-(2-(2,3-difluoro-4-(2-morfolinoetoxi)benciliden)-1-metilhidrazinil)-2-metilpropanoato de etilo (50 mg, 0,12 mmoles) obtenido en la Primera Etapa se disolvió en una solución de ácido clorhídrico al 10%-metanol (1,8 mL), se añadió borano-piridina (28 mg, 0,30 mmoles) a 0°C, y la mezcla se agitó durante 1,5 horas. La mezcla de reacción se concentró a presión reducida, se añadió una solución acuosa de hidrógeno fosfato de dipotasio 1 N y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio anhidro y se filtró, y el disolvente se eliminó por destilación a presión reducida para obtener 2-(2-(2,3-difluoro-4-(2-morfolinoetoxi)bencil)-1-metilhidrazinil)-2-metilpropanoato de etilo en forma de un producto bruto.
LCMS: m/z 416 [M+H]+
Tiempo de retención de HPLC: 0,63 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
El producto bruto de 2-(2-(2,3-difluoro-4-(2-morfolinoetoxi)bencil)-1-metilhidrazinil)-2-metilpropanoato de etilo obtenido en la Segunda Etapa se disolvió en acetato de etilo (800 pL), y a continuación, se añadieron el reactivo de ácido carboxílico sintetizado en la Primera Etapa del Ejemplo de Referencia 82, piridina (20 pL, 0,242 mmoles) y 2,4,6-trióxido de tripropil-1,3,5,2,4,6-trioxatrifosfinano (una solución en acetato de etilo, 92 pL, 0,145 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante una noche. Se añadió agua a la mezcla de reacción, y el producto resultante se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener 2-(2-(2,3-difluoro-4-(2-morfolinoetoxi)bencil)-1-metil-2-(3-oxo-3-((4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)amino)propanoil)hidrazinil)-2-metilpropanoato etilo en forma de un producto bruto.
LCMS: m/z 791 [M+H]+
Tiempo de retención de HPLC: 1,19 minutos (condiciones de análisis SMD-TFA05)
Cuarta Etapa
Se utilizó el 2-(2-(2,3-difluoro-4-(2-morfolinoetoxi)bencil)-1-metil-2-(3-oxo-3-((4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)amino)propanoil)hidrazinil)-2-metilpropanoato de etilo obtenido en la Tercera Etapa, y se llevaron a cabo operaciones similares a las de la Tercera Etapa del Ejemplo de Referencia 1-1 para sintetizar el compuesto del título (35,1 mg, 39% de rendimiento en tres etapas).
LCMS: m/z 745 [M+H]+
Tiempo de retención de HPLC: 1,27 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 314>
2-[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-5-hidroxi-1,6,6-trimetil-3-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]piridazin-4-carboxamida
[Fórmula 182]
Se utilizaron el 2-(2-(2,3-difluoro-4-(2-morfolinoetoxi)bencil)-1-metilhidrazinil)-2-metilpropanoato de etilo sintetizado en la segunda etapa del Ejemplo 313 y el reactivo de ácido carboxílico sintetizado en la Primera Etapa del Ejemplo de Referencia 81 y se llevaron a cabo operaciones similares a las del Ejemplo 313 para sintetizar el compuesto del título (36,6 mg, 41% de rendimiento de tres etapas).
LCMS: m/z 744 [M+H]+
Tiempo de retención de HPLC: 1,28 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 315>
2-[[2,3-Difluoro-4-(3-morfolin-4-ilprop-1 -inil)fenil]metil]-5-hidroxi-1,6,6-trimetil-3-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]piridazin-4-carboxamida
Primera Etapa
[Fórmula 183]
Se utilizaron 2,3-Difluoro-4-yodobenzaldehído y 3-isobutiloxi-3-oxopropionato, y se realizaron operaciones similares a las de la Primera y Segunda Etapa del Ejemplo de Referencia 103 para sintetizar 2-(2,3-difluoro-4-yodobencil)-5-hidroxi-1,6,6-trimetil-3-oxo-1,2,3,6-tetrahidropiridazin-4-carboxilato de isobutilo.
LCMS: m/z 509 [M+H]+
Tiempo de retención de HPLC: 1,10 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
Se utilizaron éster isobutílico de ácido (2-(2,3-difluoro-4-yodobencil)-5-hidroxi-1,6,6-trimetil-3-oxo-1,2,3,6-tetrahidropiridazin-4-carboxílico sintetizado en la Primera Etapa y 4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)anilina (Ejemplo de Referencia 50), y se llevaron a cabo operaciones similares a las de la Quinta Etapa del ejemplo 237 para sintetizar 2-(2,3-difluoro-4-yodobencil)-5-hidroxi-1,6,6-trimetil-3-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenilo)-1,2,3,6-tetrahidropiridazin-4-carboxamida.
LCMS: m/z 742 [M+H]+
Tiempo de retención de HPLC: 1,25 minutos (condiciones de análisis SQD-FA05)
Tercera Etapa
[Fórmula 185]
Se utilizó la masa de yodo sintetizada en la Segunda Etapa y 4-(prop-2-in-1-il)morfolina, y se llevaron a cabo operaciones similares a las del Ejemplo 123 para sintetizar el compuesto del título.
LCMS: m/z 739 [M+H]+
Tiempo de retención de HPLC: 1,31 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 316>
N-[4-Cloro-2-[6-(trifluorometil)pirimidin-4-il]fenil]-2-[[2,3-difluoro-4-(3-morfolin-4-ilprop-1 -inil)fenil]metil]-5-hidroxi-1,6,6-trimetil-3-oxopiridazin-4-carboxamida
Se utilizó el reactivo de anilina sintetizado en el Ejemplo de Referencia 53, y se llevaron a cabo operaciones similares a las del Ejemplo 315 para sintetizar el compuesto del título.
LCMS: m/z 705 [M+H]+
Tiempo de retención de HPLC: 1,29 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 317>
6-[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
Primera Etapa
1-[[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metilidenamino]-metilamino]ciclobutano-1-carboxilato de metilo [Fórmula 187]
Se disolvió hidrocloruro de 1-(metilamino)ciclobutanocarboxilato de metilo (Ejemplo de Referencia 85) (300 mg, 1,67 mmoles) en ácido acético (16,7 mmoles, 956 pL) y agua (956 pL), y a continuación, se añadió nitrito de sodio (132 mg, 1,91 mmoles) a 0°C y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadió zinc (1,09 g, 16,7 mmoles) a la mezcla de reacción a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 1,5 horas. Después de filtrar la mezcla de reacción, se añadieron metanol (9,56 mL) y 2,3-difluoro-4-(2-morfolinoetoxi)benzaldehído (324 mg, 1,19 mmoles), y la mezcla se agitó a temperatura ambiente durante 30 minutos. La mezcla de reacción se concentró a presión reducida y se diluyó con acetato de etilo, la capa orgánica se lavó con una solución acuosa de hidrogenofosfato de dipotasio 1 M y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (aminosílice, hexano/acetato de etilo) para obtener el compuesto del título (402 mg, 82%).
LCMS: m/z 412 [M+H]+
Tiempo de retención de HPLC: 0,91 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
1-[[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metil-[3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidina -4-il]anilino]propanoil]amino]-metilamino]ciclobutano-1-carboxilato de metilo
[Fórmula 188]
Se disolvió 1-[[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metilidenamino]-metilamino]ciclobutano-1-carboxilato de metilo (27,5 g, 66,9 mmoles) en acetato de etilo (158 mL), y a continuación, se añadió ácido clorhídrico (una solución 4 M en acetato de etilo, 158 mL) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 10 minutos. Se añadió 5-etil-2-metilpiridina-borano (19,9 mL, 134 mmoles) a la mezcla de reacción a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Después de añadir una solución acuosa de hidróxido de sodio (5 M, 115 mL) y una solución acuosa de fosfato de potasio (1 M, 50,0 mL) a la mezcla de reacción, la mezcla se diluyó con acetato de etilo, la capa orgánica se lavó con solución acuosa 1 M de hidrogenofosfato de dipotasio y salmuera, se secó sobre sulfato de magnesio, se filtró y se concentró a presión reducida para obtener 1-[[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metilamino]-metilamino]ciclobutano-1-carboxilato de metilo en forma de un producto bruto. El producto bruto obtenido y 3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoato (Primera Etapa del Ejemplo de Referencia 82) (27,6 g, 70,2 mmoles) se disolvieron en acetato de etilo (279 mL) y N,N-dimetilformamida (139 mL), y a continuación, se añadieron piridina (5,40 mL, 66,9 mmoles) y 2,4,6-trióxido de 2,4,6-tripropil-1,3,5,2,4,6-trioxatrifosfinano (una solución 1,7 M en acetato de etilo, 79,0 mL, 134 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadió salmuera a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con una solución acuosa 1 M de hidrógeno fosfato de dipotasio y salmuera, se secó sobre sulfato de magnesio, se filtró y se concentró a presión reducida para obtener el compuesto del título (1,15 g, 100%).
LCMS: m/z 789,1 [M+H]+
Tiempo de retención de HPLC: 1,01 minutos (condiciones de análisis SMD-FA05)
Tercera Etapa
6-[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 189]
Se disolvió 1-[[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil-[3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoil]amino]-metilamino]ciclobutano-1-carboxilato de metilo (1,14 g, 1,45 mmoles) en metanol (7,27 mL) y N,N-dimetilformamida (7,27 mL), y a se añadieron continuación carbonato de potasio (602 mg, 4,36 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1,5 horas. Se añadieron ácido fórmico y agua a la mezcla de reacción, y la mezcla se purificó mediante cromatografía en columna C18 de fase inversa (metanol/agua) para obtener el compuesto del título (840 mg, 76%).
LCMS: m/z 757,4 [M+H]+
Tiempo de retención de HPLC: 1,27 minutos (condiciones de análisis SMD-TFA05)
Aunque existen tautómeros de algunos de los compuestos del título, se pueden observar isómeros en algunos casos y no en otros casos según el tipo de disolvente para la medición. Por ejemplo, el RMN H1 y el RMN C13 de los principales tautómeros en cloroformo-D son los siguientes.
<Ejemplo 317: Tautómero mayoritario>
RMN H1 (CDCls) 5: 16,58 (1H, s), 12,81 (1H, s), 9,60 (1H, s), 8,50 (1H, d, J = 8,6 Hz), 7,95 (1H, s), 7,90 (1H, d, J =
1,6 Hz), 7,80 (1H, dd, J = 8,6, 1,6 Hz), 7,02 (1H, ddd, J = 8,6, Jcf = 7,2, 1,6 Hz), 6,72 (1H, ddd, J = 8,6, Jcf = 7,2, 1,6 Hz), 5,06 (1H, brs), 4,20 (1H, brs), 4,20 (2H, t, J = 5,5 Hz), 3,74 (4H, t, J = 4,1 Hz), 2,85 (2H, brs), 2,61 (4H, brs), 2,52 (1H, m), 2,41 (3H, s), 1,85-1,83 (3H, m), 1,73 (1H, m), 1,60 (1H, m).
RMN C13 (CDCls) 5: 186,1 (qC), 169,8 (qC), 165,7 (qC), 162,8 (qC), 159,3 (qC), 156,6 (qC, q, J = 36,4 Hz), 150,4 (qC, dd, J = 248,7, 10,5 Hz), 147,8 (qC, d, J = 5,5 Hz), 141,3 (qC, dd, J = 248,1, 14,6 Hz), 138,8 (qC), 128,3 (CH, q, J = 3,3 Hz), 127,7 (qC), 127,1 (CH), 127,0 (qC, q, J = 33,4 Hz), 125,1 (CH), 124,7 (CH), 123,6 (qC, q, J = 271,8 Hz), 120,5 (qC, q, J = 275,4 Hz), 118,2 (qC, d, J = 12,4 Hz), 115,9 (CH, q, J = 2,5 Hz), 109,6 (CH, d, J = 1,9 Hz), 92,3 (qC), 67,9 (CH2), 66,9 (CH2x2), 64,2 (qC), 57,5 (CH2), 54,1 (CH2x2), 41,6 (CH2), 35,1 (CH3), 32,4 (CH2), 24,5 (CH2), 13,4 (CH2).
<Ejemplo 318>
7-[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
Primera Etapa
1 -[[[2,3-Difluoro-4-(2-morfolin-4-iletoxi)fenil]metilidenamino]-metilamino]ciclopentano-1 -carboxilato de metilo
[Fórmula 190]
Se disolvió hidrocloruro de 1-(metilamino)cidopentanocarboxilato de metilo (300 mg, 1,55 mmoles) en ácido acético (15,5 mmoles, 887 pL) y agua (887 pL), y a continuación, se añadió nitrito de sodio (122 mg, 1,77 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 1 hora. Se añadió zinc (1,01 g, 15,5 mmoles) a la mezcla de reacción a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 1,5 horas. Después de filtrar la mezcla de reacción, se añadieron metanol (8,87 mL) y 2,3-difluoro-4-(2-morfolinoetoxi)benzaldehído (300 mg, 1,11 mmoles), y la mezcla se agitó a temperatura ambiente durante 30 minutos. La mezcla de reacción se concentró a presión reducida y se diluyó con acetato de etilo, la capa orgánica se lavó con una solución acuosa 1 M de hidrógeno fosfato dipotásico y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (aminosílice, hexano/acetato de etilo) para obtener el compuesto del título (375 mg, 80%).
LCMS: m/z 426,2 [M+H]+
Tiempo de retención de HPLC: 0,93 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
Ácido 1-[[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil-[3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4 -il]anilino)propanoil]amino]-metilamino]ciclopentano-1-carboxílico
Se disolvió 1 -[[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metilidenamino]-metilamino]ciclopentano-1 -carboxilato de metilo (29,8 g, 70,3 mmoles) en acetato de etilo (172 mL), y a continuación, se añadió ácido clorhídrico (una solución 4 M en acetato de etilo, 172 mL) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 10 minutos. Se añadió 5-etil-2-metilpiridina-borano (20,9 mL, 141 mmoles) a la mezcla de reacción a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Después de añadir una solución acuosa de hidróxido de sodio (5 M, 125 mL) y una solución acuosa de fosfato de potasio (1 M, 50,0 mL) a la mezcla de reacción, la mezcla se diluyó con acetato de etilo, la capa orgánica se lavó con una solución acuosa 1 M de fosfato de potasio y salmuera, se secó sobre sulfato de magnesio, se filtró y se concentró a presión reducida para obtener 1-[[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metilamino]metilamino]ciclopentano-1-carboxilato de metilo en forma de un producto bruto.
El producto bruto obtenido y 3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoato (Primera Etapa del Ejemplo de Referencia 82) (29,0 g, 73,8 mmoles) se disolvieron en acetato de etilo (293 mL) y N,N-dimetilformamida (146 mL), y a continuación, se añadieron piridina (5,67 mL, 70,3 mmoles) y 2,4,6-trióxido de 2,4,6-tripropil-1,3,5,2,4,6-trioxatrifosfinano (una solución 1,7 M en acetato de etilo, 83,0 mL, 141 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadió salmuera a la mezcla de reacción, y el producto resultante se extrajo con acetato de etilo. La capa orgánica se lavó con una solución acuosa de hidrogenofosfato de dipotasio 1 M y salmuera, se secó sobre sulfato de magnesio, se filtró y se concentró a presión reducida, y el residuo resultante se lavó con metanol para obtener el compuesto del título (39,4 g, 70%).
LCMS: m/z 803,1 [M+H]+
Tiempo de retención de HPLC: 1,03 minutos (condiciones de análisis SMD-FA05)
Tercera Etapa
7-[[2,3-Difluoro-4-(2-morfolin-4-yetoxifenimetil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometilpirimidin-4-il]penil] 6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
Se disolvió ácido 1-[[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil-[3-oxo-3-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilino]propanoil]amino]-metilamino]ciclopentano-1carboxílico (15,0 g, 18,7 mmoles) en metanol (94,0 mL) y N,N-dimetilformamida (94,0 mL), y a continuación, se añadió carbonato de potasio (7,76 g, 56,1 mmoles) y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 1,5 horas. Se añadieron ácido fórmico y agua a la mezcla de reacción, y la mezcla se purificó mediante cromatografía en columna C18 de fase inversa (metanol/agua) para obtener el compuesto del título (13,3 g, 92%).
LCMS: m/z 771,3 [M+H]+
Tiempo de retención de HPLC: 1,29 minutos (condiciones de análisis SMD-TFA05)
Aunque existen tautómeros de algunos de los compuestos del título, se pueden observar isómeros en algunos casos y no en otros casos según el tipo de disolvente para la medición. Por ejemplo, el RMN H1 y el RMN C13 de los principales tautómeros en cloroformo-D son los siguientes.
<Ejemplo 318: Tautómero mayoritario>
, d, J = H, d, J =
36,8 (CH2), 31,4 (CH2), 24,8 (CH2), 23,3 (CH2).
<Ejemplo 319> (referencia)
(4aR)-N-(4-Bromo-3-fluorofenil)-1 -[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Primera Etapa
[Fórmula 194]
Se utilizaron hidrocloruro de éster metílico de ácido (R)-2-metil-pirrolidin-2-carboxílico y 2,3-difluorobenzaldehído, y a continuación, el éster metílico de ácido (R)-1-((2,3-difluoro-4-yodobenciliden)amino)-2-metilpirrolidin-2-carboxílico (2,24 g, 5,49 mmoles) obtenido llevando a cabo operaciones similares a las del Ejemplo 1 se disolvió en ácido acético (5,0 mL) y metanol (5,5 mL), y a continuación, se añadió cianoborohidruro de sodio (1,76 g, 28,0 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 14 horas. Se añadió una solución saturada de bicarbonato de sodio a la mezcla de reacción, y el producto resultante se concentró a presión reducida y se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster metílico de ácido (R)-1-((2,3-difluoro-4-yodobencil)amino)-2-metilpirrolidin-2-carboxílico en forma de un producto bruto.
Segunda Etapa
El producto bruto obtenido en la primera etapa se disolvió en tetrahidrofurano (5,5 mL), y a continuación, se añadieron fosfato tripotásico (2,38 g, 11,2 mmoles) y éster metílico de ácido clorocarbonilacético (1,00 mL, 9,06 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 3 horas. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con una solución saturada de bicarbonato de sodio y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener éster metílico de ácido (S)-1-[(3-fluoro-bencil)-(2-metoxicarbonil-acetilo)-amino]-pirrolidin-2-carboxílico de metilo en forma de un producto bruto.
Tercera Etapa
El producto bruto obtenido se disolvió en N,N-dimetilformamida (1,5 mL) y a continuación, se añadió carbonato de cesio (672 mg, 2,06 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a 80°C durante 5,5 horas. Se añadió ácido clorhídrico 1 N a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida para obtener (4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxilato de metilo en forma de un producto bruto.
Cuarta Etapa
El producto bruto (328 mg, 0,686 mmoles) obtenido en la Tercera Etapa y 4-bromo-3-fluoroanilina (145 mg, 0,763 mmoles) se disolvieron en tolueno (3,4 mL), y la mezcla se agitó a 110°C durante 1 hora. Después de que la mezcla de reacción se dejó enfriar, se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (402 mg, 92%) como un sólido de color blanco grisáceo.
LCMS: m/z 479 [M+H]+
Tiempo de retención de HPLC: 0,97 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 320> (referencia)
(4aR)-1 -[(2,3-Difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Se disolvieron éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (Ejemplo de Referencia 5) (100 mg, 0,192 mmoles) y 4-(trifluorometil)-2-(6-(trifluorometil)piridin-3-il)anilina (Ejemplo de Referencia 42) (73,6 mg 0,240 mmoles) en tolueno (0,96 mL) y la mezcla se agitó a 100°C durante 40 minutos. Después de dejar enfriar la mezcla de reacción, se concentró a presión reducida y el residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (120 mg, 83%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 753 [M+H]+
Tiempo de retención de HPLC: 0,93 minutos (condiciones de análisis SQD-FA50)
<Ejemplo 321> (referencia)
(4R)-1 -[(2,3-Difluoro-4-yodofenil)metil]-N-[2-(2,3-dimetoxifenil)-4-(trifluorometil)fenil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-si]piridazin-3-carboxamida
Se utilizaron éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (Ejemplo de Referencia 5) y 2’,3'-dimetoxi-5-(trifluorometil)-[1,1'-bifenil]-2-amina (Ejemplo de Referencia 16), y se llevaron a cabo operaciones similares a las de la Cuarta Etapa del Ejemplo 319 para sintetizar el compuesto del título.
LCMS: m/z 744 [M+H]+
Tiempo de retención de HPLC: 1,19 minutos (SMD-TFA05)
<Ejemplo 322> (referencia)
(4aR)-1 -[(2,6-Difluoro-4-yodofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridina -3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-si]piridazin-3-carboxamida
Fórmula 199
Primera Etapa
[Fórmula 200]
Se utilizó 2,6-difluoro-4-yodobenzaldehído, y se llevaron a cabo operaciones similares a las de las Etapas Primera a Tercera del Ejemplo 319 para sintetizar éster 2-metilpropílico de ácido (4aR)-1-[(2,6-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico.
LCMS: m/z 521 [M+H]+
Tiempo de retención de HPLC: 1,51 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
Se utilizaron éster 2-metilpropílico de ácido (4aR)-1-[(2,6-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico y 4-(trifluorometil)-2-(6-(trifluorometil)piridin-3-il)anilina (Ejemplo de Referencia 42), y se llevaron a cabo operaciones similares a las de la Cuarta Etapa del Ejemplo 319 para sintetizar el compuesto del título.
LCMS: m/z 753 [M+H]+
Tiempo de retención de HPLC: 1,76 minutos (condiciones de análisis QC-SMD-TFA05)
<Ejemplo 323> (referencia)
(4aR)-1 -[(2,3-Difluoro-4-yodofenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidina -4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Se utilizaron éster 2-metilpropílico de ácido (4aR)-1-[(2,3-sifluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (Ejemplo de Referencia 5) y 4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)anilina (Ejemplo de Referencia 50), y se llevaron a cabo operaciones similares a las de la Cuarta Etapa del Ejemplo 319 para sintetizar el compuesto del título.
LCMS: m/z 754 [M+H]+
Tiempo de retención de HPLC: 0,93 minutos (condiciones de análisis SQD-FA50)
<Ejemplo 324> (referencia)
(4aR)-1 -[(2,3-Difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Se disolvieron éster 2-metilpropílico de ácido (4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (Ejemplo de Referencia 5) (1,086 g, 1,444 mmoles), yoduro de cobre (31,2 mg, 0,164 mmoles) y 2-metil-8-quinolinol (52,7 mg, 0,331 mmoles) en dimetilsulfóxido (4,1 mL) en atmósfera
de nitrógeno, se añadieron hidróxido de tetrabutilamonio (4,24 g, 6,54 mmoles) y agua (1,56 mL), y la mezcla se agitó en atmósfera de nitrógeno a 100°C durante 5 horas. Después de que la mezcla de reacción se dejó enfriar, se añadieron ácido clorhídrico 1 N (5,1 mL), agua (30 mL) y una cantidad apropiada de N-acetil-L-cisteína a la mezcla de reacción, y el producto resultante se extrajo con etilo acetato. La capa orgánica se secó sobre sulfato de magnesio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice para obtener el compuesto del título (834 mg, 90%) en forma de un sólido amorfo de color amarillo pálido.
LCMS: m/z 643 [M+H]+
Tiempo de retención de HPLC: 1,12 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 325> (referencia)
(4aR)-1 -[2,3-(Difluoro-4-hidroxifenil)metil]-N-[2-(2,3-dimetoxifenil)-4-ftrifluorometil)fenil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pvrrolo [1,2-b]piridazin-3-carboxamida
[Fórmula 203]
Se utilizó (4aR)-1-[2,3-(difluoro-4-yodofenil)metil]-N-[2-(2,3-dimetoxifenil)-4-(trifluorometil)fenil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 321), y se llevaron a cabo operaciones similares a las del Ejemplo 324 para sintetizar el compuesto del título.
LCMS: m/z 634 [M+H]+
Tiempo de retención de HPLC: 1,14 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 326> (referencia)
(4aR)-1 -[(2,6-Difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridina -3-il]fenil]-6,7-dihidro-5H-pirrolo (1,2-b]piridazin-3-carboxamida
Se utilizó (4aR)-1-[(2,6-Difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridina-3-ilfenil-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 322), y se realizaron operaciones similares a las del Ejemplo 324 para sintetizar el compuesto del título.
LCMS: m/z 643 [M+H]+
Tiempo de retención de HPLC: 1,12 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 327>
(4aR)-1 -[(2,3-Difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidina-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-si]piridazin-3-carboxamida
[Fórmula 205]
Se utilizó (4aR)-1-[(2,3-Difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida (Ejemplo 323), y se llevaron a cabo operaciones similares a las del Ejemplo 324 para sintetizar el compuesto del título
LCMS: m/z 644 [M+H]+
Tiempo de retención de HPLC: 1,11 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 328> (referencia)
(4aR)-1 -[(2,6-Dicloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[2-(trifluorometil)-4-[6-(trifluorometil)piridina -3-il]pirimidin-5-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
Fórmula 206
Primera Etapa
[Fórmula 207]
Se suspendió hidrocloruro de (R)-2-metilpirrolidin-2-carboxilato de metilo (20 g, 111 mmoles) en diclorometano (100 mL), y a continuación, se añadió monohidrato de ácido p-toluenosulfónico (25 g, 145 mmoles), y la mezcla se agitó bajo atmósfera de nitrógeno a temperatura ambiente durante 10 minutos. La mezcla de reacción se concentró a presión reducida, se añadió tolueno para la eliminación azeotrópica, y a continuación, el residuo se suspendió en diclorometano (250 mL), se añadió nitrito de sodio (11,4 g, 165 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 2 horas. La mezcla de reacción se filtró y a continuación, se concentró a presión reducida para obtener éster metílico de ácido (S)-1-nitroso-pirrolidin-2-carboxílico en forma de un producto bruto. El producto bruto obtenido (362 mg, 2,10 mmoles) se disolvió en ácido acético (10 mL) y metanol (1,0 mL), y a continuación, se añadió zinc (725 mg, 11,2 mmoles) a 9°C, y la mezcla se agitó bajo atmósfera de nitrógeno a 9°C durante 1 hora. Después de que la mezcla de reacción se filtró a través de una almohadilla de celite, el producto filtrado se concentró a presión reducida. Se añadieron metanol (1,0 mL) y 2,4-dicloro-4-hidroxibenzaldehído (200 mg, 1,05 mmoles) al residuo resultante, y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 2 horas. La mezcla de reacción se filtró y a continuación, se concentró a presión reducida, y el producto resultante se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, se secó sobre sulfato de sodio, se filtró y se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener (R)-1-((2,6-dicloro-4-hidroxibenciliden)amino)-2-metilpirrolidin-2-carboxilato de metilo. El producto obtenido (5,3 g, 16,0 mmoles) se disolvió en acetonitrilo (50 mL), y a continuación, se añadieron 2-(clorometoxi)etil trimetilsilano (3,2 g, 19,2 mmoles) y carbonato de cesio (6,3 g, 19,3 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a 25°C durante 24 horas. Se añadió agua (100 mL) a la mezcla de reacción, y el producto resultante se extrajo con acetato de etilo (100 mL) tres veces. La capa orgánica se lavó con agua y salmuera, y a continuación, se secó sobre sulfato de sodio. El sulfato de sodio se filtró y el producto resultante se concentró a presión reducida para obtener un producto bruto de (R)-1-((2,6-dicloro-4-((2-(trimetilsilil)etoxi)metoxi)benciliden)amino)-2-metilpirrolidin-2-carboxilato de metilo en forma de un sólido de color
blanco. El producto bruto obtenido se utilizó para obtener (R)-1-N-(2,6-dicloro-4-((2-(trimetilsilil)etoxi)metoxi)bencil)-3-isobutoxi-3-oxopropanamido)-2-metilpirrolidin-2-carboxilato de metilo llevando a cabo la Primera y Segunda Etapa del Ejemplo de Referencia 1-1.
LCMS: m/z 461 [M+H]+
Tiempo de retención de HPLC: 4,73 minutos (condiciones de análisis Ph-SMD-TFA05)
Segunda Etapa
[Fórmula 208]
H
Se disolvió (R)-1-(N-(2,6-dicloro-4-((2-(trimetilsilil)etoxi)metoxi)bencil)-3-isobutoxi-3-oxopropanamido)-2-metilpirrolidin-2-carboxilato de metilo (7,02 g, 11,6 mmoles) en diclorometano (85 mL), se añadió ácido trifluoroacético (35 mL) y la mezcla se agitó a temperatura ambiente durante 30 minutos. La mezcla de reacción se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener (R)-1-N-(2,6-dicloro-4-hidroxibencilo)-3-isobutoxi-3-oxopropanamido)-2-metilpirrolidin-2-carboxilato de metilo (5,0 g, 91%). Se utilizó el (R)-1-N-(2,6-dicloro-4-hidroxibencil)-3-isobutoxi-3-oxopropanamido)-2-metilpirrolidin-2-carboxilato de metilo obtenido (5,0 g, 10,5 mmoles), y se realizaron operaciones similares a las de la Tercera Etapa del Ejemplo de Referencia 1-1 para obtener éster 2-metilpropílico de ácido (4aR)-1-[(2,6-dicloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico.
LCMS: m/z 443 [M+H]+
Tiempo de retención de HPLC: 1,32 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
Se utilizaron éster 2-metilpropílico de ácido (4aR)-1-[(2,6-dicloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico y 2-(trifluorometil)-4-(6-(trifluorometil)piridin-3-il)pirimidin-5-amina (Ejemplo de Referencia 70), y se llevaron a cabo operaciones similares a las del Ejemplo 21 para obtener el compuesto del título.
LCMS: m/z 677 [M+H]+
Tiempo de retención de HPLC: 1,51 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 329> (referencia)
(4aR)-1 -[2,6-(-Dicloro-4-hidroxifenil]metil]-4-hidroxi-4a-metil-2-oxo-N-[6-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]piridin-3-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 209]
Se utilizaron éster 2-metilpropílico de ácido (4aR)-1-[(2,6-dicloro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxílico (segunda etapa del ejemplo 328) y 6,6'-bis(trifluorometil)-[2,3'-bipiridina]-3-amina (Ejemplo de Referencia 44), y se llevaron a cabo operaciones similares a las de la Tercera Etapa del Ejemplo 328 para obtener el compuesto del título.
LCMS: m/z 676 [M+H]+
Tiempo de retención de HPLC: 1,55 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 330> (referencia)
(4aR)-1 -[2,3-(Difluoro-4-hidroxifenil)metil]-4-hidroxi-4a-metil-2-oxo-N-[2-(trifluorometil)-4-[6-(trifluorometil)piridin-3-il]pirimidin-5-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 210]
Primera Etapa
[Fórmula 211]
Se utilizaron (4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxilato de metilo (Tercera Etapa del ejemplo 319) y 2-(trifluorometil)-4-(6-(trifluorometil)piridin-3-il)pirimidin-5-amina (Ejemplo de Referencia 70) y se llevaron a cabo operaciones similares a las de la Cuarta Etapa del Ejemplo 319 para sintetizar ((4aR)-1-[(2,3-difluoro-4-yodofenil)metil]-4-hidroxi-4a-metil-2-oxoN-[2-(trifluorometil)-4-[6-(trifluorometil)piridin-3-il]pirimidin-5-il]-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida.
LCMS: m/z 755 [M+H]+
Tiempo de retención de HPLC: 1,05 minutos (condiciones de análisis SMD-TFA50)
Segunda Etapa
Se utilizó el derivado de yoduro obtenido en la Primera Etapa, y se llevaron a cabo operaciones similares a las del ejemplo 324 para sintetizar el compuesto del título.
LCMS: m/z 645 [M+H]+
Tiempo de retención de HPLC: 1,43 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 331> (referencia)
(4aR)-N-(4-Bromo-2-yodofenil)-1 -[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxamida
[Fórmula 212]
Primera Etapa
[Fórmula 213]
Se utilizaron hidrocloruro de éster metílico de ácido (R)-2-metil-pirrolidin-2-carboxílico y 2,3-difluorobenzaldehído, y se llevaron a cabo operaciones similares a las de las Etapas Primera a Tercera del Ejemplo 319 para sintetizar (4aR)-1-[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxilato de metilo. Segunda Etapa
Se utilizaron (4aR)-1 -[(2,3-difluorofenil)metil]-4-hidroxi-4a-metil-2-oxo-6,7-dihidro-5H-pirrolo[1,2-b]piridazin-3-carboxilato de metilo y 4-bromo-2-yodoanilina como reactivos, y se realizaron operaciones similares a las del Ejemplo 21 para sintetizar el compuesto del título.
LCMS: m/z 618 [M+H]+
Tiempo de retención de HPLC: 1,16 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 104>
Hidrocloruro de 1-[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilamino]ciclobutano-1-carboxilato de metilo
[Fórmula 214]
Se disolvió 1-[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilamino]cicíobutano-1-carboxilato de metilo (Tercera Etapa del Ejemplo 13) (300 mg, 0,726 mmoles) en 2-butanona (1,50 mL), y se añadió hidrocloruro de piridina (84,0 mg, 0,727 mmoles) a 25°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadieron heptano (1,50 mL) y un cristal semilla (1,00 mg, 0,00222 mmoles) a la mezcla de reacción, y a continuación, la mezcla se agitó durante 1 hora. Se añadió heptano (3,00 mL) a la mezcla de reacción, la mezcla se agitó durante 16 horas y a continuación, el cristal depositado se recogió mediante filtración para obtener el compuesto del título (271 mg, 88%).
Punto de fusión: 108°C
RMN H1 (DMSO-D6) 5: 10,32 (1H, brs), 7,44 (1H, m), 7,29 (1H, s), 7,07 (1H, m), 4,49 (2H, t, J = 4,4 Hz), 3,72 (2H, t, J = 5,0 Hz), 3,63 (3H, s), 3,55-3,36 (4H, m), 3,44 (3H, s), 2,87 (3H, brs), 2,80 (3H, s), 2,48 (4H, m), 1,93 (2H, m).
El cristal semilla utilizado en el Ejemplo de Referencia 104 se obtuvo por medio del siguiente método.
Se disolvió 1 -[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilamino]ciclobutano-1 -carboxilato de metilo (75,3 mg, 0,182 mmoles) en dimetilsulfóxido (0,317 mL) y se añadió ácido clorhídrico 2 M (93,0 pL, 0,186 mmoles). La solución preparada (15,0 pL) se liofilizó, se añadieron 2-butanona (15,0 pL) y heptano (15,0 pL) al polvo obtenido a 25°C, y la mezcla se agitó durante 4 días para obtener un depósito.
<Ejemplo de Referencia 105>
Hidrocloruro de 1-1[(E)-[2.3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilaminolciclopentano-1-carboxilato de metilo
Se disolvió 1-[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilamino]ciclopentano-1-carboxilato de metilo (primer paso del ejemplo 14) (300 mg, 0,702 mmoles) en 2-butanona (3,00 mL), se añadió hidrocloruro de piridina (81,0 mg, 0,701 mmoles) a 25°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadieron heptano (1,00 mL) y un cristal semilla (1,00 mg, 0,00215 mmoles) a la mezcla de reacción, y a continuación, la mezcla se agitó durante 1 hora. Se añadió heptano (2,00 mL) a la mezcla de reacción, a
continuación, la mezcla se agitó durante 2 horas y el cristal depositado se recogió mediante filtración para obtener el compuesto del título (225 mg, 69%).
Punto de fusión: 97°C
RMN H1 (DMSO-D6) 5: 10,34 (1H, brs), 7,44 (1H, m), 7,26 (1H, s), 7,08 (1H, m), 4,50 (2H, t, J = 4,4 Hz), 3,72 (2H, t, J = 5,0 Hz), 3,60 (3H, s), 3,55-3,44 (4H, m), 3,35 (3H, s) 2,87 (3H, brs), 2,85 (3H, s), 2,25 (2H, m), 2,14 (2H, m), 1,70 (4H, m).
El cristal semilla utilizado en el Ejemplo de Referencia 105 se obtuvo por medio del siguiente método.
Se disolvió 1 -[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilamino]ciclopentano-1 -carboxilato de metilo (50,0 mg, 0,117 mmoles) en 2-butanona (0,500 mL), se añadió hidrocloruro de piridina (15,0 mg, 0,130 mmoles) a 25°C, y la mezcla se agitó en atmósfera de nitrógeno durante 30 minutos. Se añadieron heptano (0,500 mL) e hidrocloruro de 1-[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilamino]ciclobutano-1-carboxilato de metilo (1,00 mg, 0,00222 mmoles) a la mezcla de reacción, y la mezcla se agitó durante 1 hora. El cristal depositado se recogió mediante filtración para obtener un depósito (36,6 mg).
<Ejemplo 332>
4-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenilo]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]butanoato
[Fórmula 216]
Primera Etapa
Éster 2-metilpropílico de ácido 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-6,7-diazaespiro[4,5]dec-9-eno-9-carboxílico
[Fórmula 217]
Se utilizaron 2,3-difluoro-4-hidroxibenzaldehído e hidrocloruro de 1-(metilamino)ciclopentanocarboxilato de metilo (Ejemplo de Referencia 87) para sintetizar el compuesto del título mediante un método similar al del Ejemplo de Referencia 1-1.
LCMS: m/z 411 [M+H]+
Tiempo de retención de HPLC: 1,18 minutos (SMD-TFA05)
Segunda Etapa
[Fórmula 218]
Se utilizaron éster 2-metilpropílico de ácido 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-6,7diazaespiro[4,5]dec-9-eno-9-carboxílico y 4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilina (Ejemplo de Referencia 50) para sintetizar 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida con referencia al Ejemplo 21.
LCMS: m/z 658 [M+H]+
Tiempo de retención de HPLC: 1,57 minutos (SMD-TFA05)
Tercera Etapa
[Fórmula 219]
Se añadió carbonato de cesio (20,4 mg, 0,113 mmoles) a una solución de 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (24,7 mg, 0,038 mmoles) y 4-bromobutirato de metilo (24,48 mg, 0,075 mmoles) en acetonitrilo (0,4 mL), y la mezcla se agitó a 70°C durante 1 hora. La mezcla de reacción se enfrió a 0°C, se añadió una solución acuosa de ácido clorhídrico 1 N (0,063 mL, 0,375 mmoles), y la mezcla se agitó durante 10 minutos. El resultante se diluyó con N,N-dimetilformamida (0,6 mL) y se purificó mediante HPLC para obtener 4-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]butirato de metilo (10,6 mg, 37%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
YMC-Actus Triart C18 (50 * 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 758 [M+H]+
Tiempo de retención de HPLC: 1,72 minutos (SMD-FA05)
Cuarta Etapa
Se añadió trimetilsilanolato de potasio (5,38 mg, 0,042 mmoles) a una solución de 4-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]butirato de metilo (10,6 mg, 0,014 mmoles) en tetrahidrofurano (0,4 mL), y la mezcla se agitó a temperatura ambiente durante 2 horas. Después de que la mezcla de reacción se concentró, el producto resultante se diluyó con N,N-dimetilformamida (0,6 mL) y se purificó mediante HPLC para obtener el compuesto del título (6,2 mg, 60%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
YMC-Actus Triart C18 (50 * 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 744 [M+H]+
Tiempo de retención de HPLC: 1,60 minutos (SMD-FA05)
En los Ejemplos 333 a 335, se utilizaron los bromuros de alquilo apropiados, y se llevaron a cabo operaciones similares a las del Ejemplo 332 para sintetizar los compuestos descritos en la siguiente Tabla.
Tabla 31
<Ejemplo de Referencia 106>
Éster 2-metilpropílico de ácido 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-5,6-diazaespiro[3,5]non-8-eno-8-carboxílico
[Fórmula 220]
Se utilizó hidrocloruro de 1-(metilamino)ciclobutanocarboxilato de metilo como sustancia de partida (Ejemplo de Referencia 85) para sintetizar el compuesto del título mediante un método similar al del Ejemplo 332.
LCMS: m/z411 [M+H]+
Tiempo de retención de HPLC: 1,18 minutos (SMD-TFA05)
<Ejemplo de Referencia 107>
6-[(2,3-Difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 221]
Se utilizó hidrocloruro de 1-(metilamino)ciclobutano-1-carboxilato de metilo como sustancia de partida para sintetizar el compuesto del título mediante un método similar al del Ejemplo 332.
LCMS: m/z 658 [M+H]+
Tiempo de retención de HPLC: 1,48 minutos (SMD-TFA05)
<Ejemplo 336>
8-[[2,3-Difluoro-4-(2-morfolin-2-oxo-etoxi)fenil]metil]-5-hidroxi-9-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4il]fenil]-8,9-diazaespiro[3,5]non-5-eno-6-carboxamida
Fórmula 222
El compuesto del título se sintetizó a partir de 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida y 2-cloro-1-morfolin-4-il-etanona (Kapanda, Coco N. Journal of Medicinal Chemistry, 52 (22), 7310-7314; 2009) por medio de un método similar al de la Tercera Etapa del ejemplo 322.
LCMS: m/z 771 [M+H]+
Tiempo de retención de HPLC: 1,43 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 337>
8-[[2,3-Difluoro-4-[2-(2-oxomorfolin-4-il)etoxi]fenil]metil]1-5-hidroxi-9-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-8,9-diazaespiro[3,5]non-5-eno-6-carboxamida
[Fórmula 223]
El compuesto del título se obtuvo a partir de 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida y 4-(2-hidroxietil)morfolin-2-ona (Khromov-Borisov, N. V. y Remizov, A. L., Zhurnal Obshchei Khimii, 23, 598-605; 1953) realizando operaciones similares a las del Ejemplo 407.
LCMS: m/z 771 [M+H]+
Tiempo de retención de HPLC: 1,38 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 108>
6-[[4-(2-Bromoetoxi)-2,3-difluorofenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-ftrifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 224]
Se disolvió 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107) (3,00 g, 4,66 mmoles) en acetona (23,3 mL), a continuación, 1,2-dibromoetano (6,85 mL, 79,0 mmoles) y carbonato de potasio (1,29 g, 9,32 mmoles) y la mezcla se agitó bajo atmósfera de nitrógeno a 60°C durante 15 horas. Se añadió ácido clorhídrico 1 N a la mezcla de reacción a 0°C, y la mezcla se extrajo con acetato de etilo. La capa orgánica se lavó con salmuera, la capa acuosa se separó mediante un separador de fases, el producto resultante se concentró a presión reducida y el residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título (3,19 g, 91%).
LCMS: m/z 749 [M+H]+
Tiempo de retención de HPLC: 1,58 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 109>
7-[[4-(2-Bromoetoxi)-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-ftrifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 225]
El compuesto del título se sintetizó a partir de 7-[(2,3-difluoro-4-hidroxibencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (Ejemplo 332) de manera similar a la del Ejemplo de Referencia 106.
LCMS: m/z 764 [M+H]+
Tiempo de retención de HPLC: 1,62 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 338>
6-[[2,3-Difluoro-4-[2-[metil(oxolan-3-il)amino]etoxi]fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 226]
Se disolvieron 6-[[4-(2-bromoetoxi)-2,3-difluorofenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (10,0 mg, 13,0 pmoles) y N-metiltetrahidrofurano-3-amina (2,70 mg, 27,0 pmoles) en N,N-dimetilformamida (100 pL), a continuación, se añadieron N-etil-N-isopropilpropan-2-amina (4,6 pL, 27,0 pmoles) y yoduro de tetrabutilamonio (0,5 mg, 1,33 pmoles), y la mezcla se agitó a 80°C durante 1,5 horas. La mezcla de reacción se diluyó con N,N-dimetilformamida (0,5 mL) y se purificó mediante HPLC para obtener el compuesto del título (8,0 mg, 78%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (50 * 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 771 [M+H]+
Tiempo de retención de HPLC: 1,31 minutos (condiciones de análisis SMD-TFA05)
<Ejemplos 339 a 380>
Se utilizaron varias aminas que se conocían de la bibliografía o comercializadas, y se llevaron a cabo operaciones similares a las del Ejemplo 338 para sintetizar los compuestos descritos en la siguiente Tabla. Obsérvese que, si la amina era hidrocloruro, la amina no se utilizó directamente para la reacción y se utilizó para la reacción después de que se permitiera que actuara el ácido yodhídrico (57% en peso, 2 peso equivalente) y se formara el hidroyoduro correspondiente.
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (50 * 30 mm D.I., S-5 pm, 12 nm, 100 * 30 mm D.I., S-5 pm, 12 nm).
T l 2-1
T l 2-2
T l 2-
Tabla 32-4
Tabla 32-5
<Ejemplo 381>
(2S)-2-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]butanodioato
[Fórmula 227]
Se disolvió hidrocloruro de éster dimetílico de L-aspartato (142 mg, 0,72 mmoles) en metanol (1,00 mL), se añadió ácido yodhídrico (57% en peso, 95,0 gl) y la mezcla se agitó durante 1 minuto. Después de que la mezcla de reacción se concentró a presión reducida, se añadieron metanol y tolueno para la eliminación azeotrópica para obtener hidroyoduro de éster dimetílico de L-aspartato en forma de un producto bruto. El yoduro de amina resultante y 7-[[4-(2-bromoetoxi)-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (110 mg, 0,14 mmoles) (Ejemplo de Referencia 109) se disolvieron en N,N-dimetilformamida (480 gL), y a continuación, se añadieron fosfato de potasio (92,0 mg, 0,43 mmoles) y yoduro de tetrabutilamonio (5,3 mg, 14,0 gmoles), y la mezcla se agitó a 80°C durante 2 horas. Después de que la mezcla de reacción se diluyó con tetrahidrofurano (480 gL), se añadió trimetilsilanolato de potasio (92,0 mg, 0,72 mmoles) y la mezcla se agitó a 50°C durante 30 minutos y a 70°C durante 2 horas. La mezcla de reacción se diluyó con ácido fórmico y agua, y el producto resultante se purificó mediante HPLC para obtener el compuesto del título (71,5 mg, 61%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (100 x 30 mm D.I., S-5 gm, 12 nm)
LCMS: m/z 817 [M+H]+
Tiempo de retención de HPLC: 1,32 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 382>
3-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]pentanodioato
[Fórmula 228]
Primera Etapa
[Fórmula 229]
Se utilizaron 7-[[4-(2-bromoetoxi)-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (Ejemplo de Referencia 109) y 3-aminopentanodioato de dietilo como reactivos, y se llevaron a cabo operaciones similares a las del Ejemplo 337 para sintetizar 3-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]pentanodioato de dietilo.
Segunda Etapa
Se disolvió 3-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]pentanodioato de dietilo (48,0 mg, 54,0 gmoles) en tetrahidrofurano (200 gL), se añadió trimetilsilanolato de potasio (34,7 mg, 0,27 mmoles) y la mezcla se agitó a 50°C durante 30 minutos. La mezcla de reacción se diluyó con ácido fórmico y agua y se purificó mediante
HPLC para obtener el compuesto del título (32,4 mg, 72%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart Cis (50 x 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 831 [M+H]+
Tiempo de retención de HPLC: 1,32 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 383>
6-[[4-[3-[(2R)-2,3-Dihidroxipropoxi]propoxi]-2,3-difluorofenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piradin-3-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida [Fórmula 230]
Primera Etapa
[Fórmula 231]
Se utilizaron éster 2-metilpropílico de ácido 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-5,6-diazaespiro[3,5]non-8-eno-8-carboxílico (Ejemplo de Referencia 106) y 4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]anilina (Ejemplo de Referencia 13) como reactivos, y se llevaron a cabo operaciones similares a las de la Tercera Etapa del Ejemplo 149 para sintetizar 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida.
Segunda Etapa
[Fórmula 232]
Se disolvieron (S)-3-((2,2-dimetil-1,3-dioxolan-4-il)metoxi)propan-1-ol (300 mg, 1,58 mmoles) y trietilamina (0,33 mL, 2,37 mmoles) en tetrahidrofurano (7,88 mL), se añadió cloruro de metanosulfonilo (0,15 mL, 1,89 mmoles) a 0°C, y la mezcla se agitó a temperatura ambiente durante 3 horas. Después de que se añadió una solución acuosa 1 N de hidrogenofosfato de dipotasio a la mezcla de reacción y la mezcla se extrajo con acetato de etilo, la capa orgánica se lavó con una solución saturada de bicarbonato de sodio y salmuera. La capa orgánica se secó sobre sulfato de sodio anhidro, se filtró y se concentró a presión reducida. El residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo/hexano) para obtener metanosulfonato de 3-[[(4S)-2,2-dimetil-1,3-dioxolan-4-il]metoxi]propilo (316 mg, 75%).
LCMS: m/z 269 [M+H]+
Tiempo de retención de HPLC: 0,77 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
Se disolvieron 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piradin-3-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (15,0 mg, 23,0 pmoles) y metanosulfonato de 3-[[(4S)-2,2-dimetil-1,3-dioxolan-4-il]metoxi]propilo (8,77 mg, 33,0 pmoles) en acetonitrilo (117 pL), se añadió carbonato de cesio (22,8 mg, 233 pmoles), y la mezcla se agitó a 75°C durante 1,5 horas. Después de que la mezcla de reacción se enfrió a temperatura ambiente, se añadieron una solución acuosa de ácido clorhídrico (6N, 38,9 pL, 233 pmoles) y metanol (38,9 pL), y la mezcla se agitó a temperatura ambiente durante 1 hora. Se añadió una solución acuosa de hidróxido de sodio 6 N a la mezcla de reacción, y después de que la mezcla
se filtró y se concentró, el producto resultante se diluyó con N,N-dimetilformamida (0,5 mL) y se purificó mediante HPLC para obtener el compuesto del título (11,9 mg, 66%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (100 x 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 775 [M+H]+
Tiempo de retención de HPLC: 1,40 minutos (condiciones de análisis SMD-TFA05)
<Ejemplos 384 a 400>
Se utilizaron bromuros (2-[2-(3-bromopropoxi)etoxi]oxano, 2-[2-(4-bromobutoxi)etoxi]oxano, 2-[2-(5-bromopentoxi)etoxi]oxano, 2-[3-(3-bromopropoxi)propoxi]oxano, 2-[3-(4-bromobutoxi)propoxi]oxano, 2-[3-(5-bromopentoxi)propoxi]oxano sintetizados por medio de un método similar al de la Primera Etapa del Ejemplo 147 utilizando alcohol (2-(oxan-2-iloxi)etanol, 3-(oxan-2-iloxi)propan-1-ol) y dibromuros (1,3-dibromopropano, 1,4-dibromobutano, 1,5-dibromopentano) conocidos de la bibliografía o comercializados, y metanosulfonato de 3-[[(4S)-2,2-dimetil-1,3-dioxolan-4-il]metoxi]propilo (Ejemplo 383), (S)-4-((4-bromobutoxi)metil)-2,2-dimetil-1,3-dioxolano (Ejemplo de Referencia 74) y (S)-4-(((5-bromopentil)oxi)metil)-2,2-dimetil-1,3-dioxolano (Ejemplo de Referencia 78), 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-6.7- diazaespiro[4,5]dec-9-eno-9-carboxamida sintetizada por medio de un método similar al de la Primera Etapa del Ejemplo 383 utilizando éster 2-metilpropílico de ácido 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-6.7- diazaespiro[4,5]dec-9-eno-9-carboxílico (Ejemplo 332) y 4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]anilina (Ejemplo de Referencia 13), 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)piridin-3-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo 383), 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107), o 7-(2,3-difluoro-4-hidroxibencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (Ejemplo 332), y se llevaron a cabo operaciones similares a las del Ejemplo 383 para sintetizar los compuestos descritos en la siguiente Tabla.
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (50 x 30 mm D.I., S-5 pm, 12 nm, 100 x 30 mm D.I., S-5 pm, 12 nm)
Tabla 33-1
T l -2
<Ejemplo 401>
6-[[2,3-Difluoro-4-[2-(2-metoxietan)etoxifenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 233]
El compuesto del título se sintetizó a partir de 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107) y 1-bromo-2-(2-metoxietoxi)etano de manera similar al de la Tercera Etapa del Ejemplo de Referencia 383.
LCMS: m/z 746 [M+H]+
Tiempo de retención de HPLC: 1,66 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 402>
6-(2,3-Difluoro-4-(2-(metil(oxetan-3-il)amino)etoxi)bencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
Primera Etapa
[Fórmula 234]
Se disolvió 6-(4-(2-bromoetoxi)-2,3-difluorobencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (10,0 mg, 0,013 mmoles) (Ejemplo de Referencia 108) en 1,3-dimetil-2-imidazolidinona (100 pL), y a continuación, se añadieron una solución de metilamina-tetrahidrofurano 2,0 M (400 pL, 0,800 mmoles), N,N-diisopropiletilamina (4,6 pL, 0,027 mmoles), a continuación, yoduro de tetrabutilamonio (0,5 mg, 0,001 mmoles), y la mezcla se agitó a 80°C durante 3 horas. La mezcla de reacción se concentró a presión reducida, se añadió una solución 0,5 M de ácido clorhídrico-metanol (80 pL, 0,040 mmoles), y se añadieron n-butanol y tolueno para la eliminación azeotrópica para obtener hidrocloruro de 6-(2,3-difluoro-4-(2-(metilamino)etoxi)bencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida en forma de un producto bruto.
LCMS: m/z 701 [M+H]+
Tiempo de retención de HPLC: 1,27 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
[Fórmula 235]
Se disolvió el producto bruto de hidrocloruro de 6-(2,3-difluoro-4-(2-(metilamino)etoxi)bencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida en 1,2-dicloroetano (0,5 mL), a continuación, se añadieron oxetan-3-ona (6,25 pl, 0,104 mmoles), triacetoxi-borohidruro de sodio (16,5 mg, 0,078 mmoles) y ácido acético (10 pl, 0,175 mmoles), y la mezcla se agitó a temperatura ambiente durante 1 hora. Se añadieron nuevamente oxetan-3-ona (6,25 pl, 0,104 mmoles) y triacetoxi-borohidruro de sodio (16,5 mg, 0,078 mmoles), y la mezcla se agitó a temperatura ambiente durante 1 hora. Después de que la mezcla de reacción se concentró y se diluyó con N,N-dimetilformamida, el producto resultante se purificó mediante HPLC para obtener el compuesto del título (3,8 mg, rendimiento en dos etapas del 39%).
LCMS: m/z 757 [M+H]+
Tiempo de retención de HPLC: 1,25 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 403>
6-(2,3-Difluoro-4-(oxetan-3-iloxi)bencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
Se disolvió 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107) en acetonitrilo (200 pL), a continuación, se añadieron oxetan-3-il 4-metilbencenosulfonato (14,2 mg, 0,062 mmoles) y carbonato de cesio (30,4 mg, 0,093 mmoles), y la mezcla se agitó a 80°C durante la noche. Después de que la mezcla de reacción se diluyó con N,N-dimetilformamida y agua, el producto resultante se purificó mediante HpLC para obtener el compuesto del título (14,1 mg, 65%).
LCMS: m/z 700 [M+H]+
Tiempo de retención de HPLC: 1,62 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 404>
6-[[2,3-Difluoro-4-[[(2S)-1-(2-metoxietil)pirrolidin-2-il]metoxi]fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida [Fórmula 237]
Primera Etapa
[Fórmula 238]
Se disolvieron 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107) (100 mg, 0,16 mmoles) y 2-(hidroximetil)pirrolidin-1-carboxilato de (S)-terc-butilo (62,6 mg, 0,31 mmoles) en tetrahidrofurano (311 pL), a continuación, se añadió N,N,N’,N’-tetrametilazodicarboxamida (53,5 mg, 0,31 mmoles) y la mezcla se agitó a 70°C durante 1 hora. La mezcla de reacción se concentró a presión reducida, y el residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener (2S)-2-[[2,3-difluoro-4-[[9-hidroxi-5-metil-7-oxo-8-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-5,6-diazaespiro[3,5]no -8-en-6-il]metil]fenoxi]metil]pirrolidin-1-carboxilato de terc-butilo (115 mg, 90%).
LCMS: m/z 827 [M+H]+
Tiempo de retención de HPLC: 1,68 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
[Fórmula 239]
Se añadió ácido clorhídrico (una solución en dioxano, 4 N, 1,00 mL, 4,00 mmoles) a (2S)-2-[[2,3-difluoro-4-[[9-hidroxi-5-metil-7-oxo-8-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-5,6-diazaespiro[3,5]non-8-en-6-il]metil]fenoxi]metil]pirrolidin-1-carboxilato de terc-butilo (104 mg, 0,13 mmoles), y la mezcla se agitó a temperatura ambiente durante 1 hora. Después de que la mezcla de reacción se concentró a presión reducida, se añadió tolueno para la eliminación azeotrópica para obtener hidrocloruro de (S)-6-(2,3-difluoro-4-(pirrolidin-2-ilmetoxi)bencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (3,5) 96 mg, 100%).
LCMS: m/z 727 [M+H]+
Tiempo de retención de HPLC: 1,27 minutos (condiciones de análisis SMD-TFA05)
Tercera Etapa
Se disolvieron hidrocloruro de (S)-6-(2,3-difluoro-4-(pirrolidin-2-ilmetoxi)bencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (10,0 mg, 13,0 pmoles) y 1-bromo-2-metoxietano (3,64 mg, 26,0 pmoles) en N,N-dimetilformamida (100 pL), a continuación, se añadieron N-etil-N-isopropilpropan-2-amina (6,9 pL, 39,0 pmoles) y yoduro de tetrabutilamonio (0,5 mg, 1,31 pmoles), y la mezcla se agitó a 80°C durante 1,5 horas. La mezcla de reacción se diluyó con N,N-dimetilformamida
(0,5 mL) y se purificó mediante HPLC para obtener el compuesto del título (3,2 mg, 31%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (50 x 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 785 [M+H]+
Tiempo de retención de HPLC: 1,32 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 405>
6-[[2,3-Difluoro-4-[(3R)-1-(2-metoxietil)pirrolidin-3-il]oxifenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il)fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 240]
El compuesto del título se sintetizó a partir de 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107) y 3-hidroxipirrolidin-1-carboxilato de (S)-terc-butilo de una manera similar a la de la Primera a Tercera Etapas del Ejemplo 404.
LCMS: m/z 771 [M+H]+
Tiempo de retención de HPLC: 1,30 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 406>
6-[[2,3-Difluoro-4-[1-(2-metoxietil)azetidin-3-il]oxifenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 241]
El compuesto del título se sintetizó a partir de 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107) y 3-hidroxiazetidin-1-carboxilato de terc-butilo de una manera similar a la de la Primera a Tercera Etapas del Ejemplo 404.
LCMS: m/z 756 [M+H]+
Tiempo de retención de HPLC: 1,33 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 407>
6-[[2,3-Difluoro-4-(2-metil-1 -morfolin-4-ilpropan-2-il)oxifenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
Se añadió una solución en tetrahidrofurano (1 M) (0,109 mL, 0,109 mmoles) de trimetilfosfina durante 30 segundos a una solución de 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (10 mg, 0,016 mmoles), 2-metil-2-morfolinopropan-1-ol (17 mg, 0,106 mmoles) y N,N,N’,N’-tetrametilazodicarboxamida (18,7 mg, 0,106 mmoles) en tetrahidrofurano (0,3 mL) en un estado en el que se calentaron a 60°C. La mezcla de reacción se agitó a 60°C durante 16 horas. Después de que la mezcla de reacción se enfrió a temperatura ambiente, se insufló nitrógeno en el producto resultante para eliminar el disolvente. El residuo se disolvió en dimetilformamida y ácido fórmico, y el producto resultante se purificó mediante HPLC (agua con ácido fórmico al 0,1%/acetonitrilo de ácido fórmico al 0,1%) para obtener el compuesto del título (4,3 mg, 34%).
LCMS: m/z 785 [M+H]+
Tiempo de retención de HPLC: 1,30 minutos (SMD-TFA05)
<Ejemplos 408 a 411>
Se utilizaron los alcoholes alquílicos apropiados, y se llevaron a cabo operaciones similares a las del Ejemplo 407 para sintetizar los compuestos descritos en la siguiente Tabla.
T l 4
<Ejemplo 412>
7-(2,3-Difluoro-4-(2-(metil(oxetan-3-il)amino)etoxi)bencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
Primera Etapa
[Fórmula 243-1]
Se utilizó 7-[[4-(2-bromoetoxi)-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidina-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (20,0 mg, 0,026 mmoles) (Ejemplo de Referencia 109), y se llevaron a cabo operaciones similares a las de la Primera Etapa del Ejemplo 402 para obtener un producto bruto de hidrocloruro de 7-(2,3-difluoro-4-(2-(metilamino)etoxi)bencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida.
LCMS: m/z 715 [M+H]+
Tiempo de retención de HPLC: 1,29 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
[Fórmula 243-2]
Se utilizó hidrocloruro de 7-(2,3-difluoro-4-(2-(metilamino)etoxi)bencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida, y se realizaron operaciones similares a las de la segunda etapa del ejemplo 402 para obtener el compuesto del título (11,3 mg, rendimiento en dos etapas del 56%).
LCMS: m/z 771 [M+H]+
Tiempo de retención de HPLC: 1,19 minutos (condiciones de análisis SMD-TFA05)
RMN H1 (DMSO-D6) 5: 12,72 (1H, s), 9,59 (1H, s), 8,56 (1H, s), 8,42 (1H, d, J = 8,8 Hz), 8,24 (1H, s), 7,97 (1H, d, J = 7,3 Hz), 7,16 (1H, t, J = 7,3 Hz), 7,04 (1H, t, J = 7,6 Hz), 5,07 (1H, d, J = 13,7 Hz), 4,52 (2H, t, J = 6,6 Hz), 4,41 (2H, t, J = 6,1 Hz), 4,16 (3H, t, J = 5,4 Hz), 3,66 (1H, q, J = 6,5 Hz), 2,67 (2H, t, J = 5,4 Hz), 2,46 (3H, s), 2,18 (3H, s), 2,01 (1H, m), 1,59 (3H, m), 1,27 (3H, m), 1,07 (1H, m).
<Ejemplo 413>
6-[[2,3-Difluoro-4-[1-(2-metoxietil)azetidin-3-il]oxifenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 243-3]
El compuesto del título se sintetizó a partir de 6-[(2,3-difluoro-4-hidroxifenil)metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107) y 2-(clorometil)tetrahidrofurano de manera similar a la de la Tercera Etapa de Ejemplo 383.
LCMS: m/z 742 [M+H]+
Tiempo de retención de HPLC: 1,61 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 414>
7-(4-(3-(Dimetilamino)-2,2-dimetilpropoxi)-2,3-difluorobencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 243-4]
El compuesto del título se sintetizó a partir de 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida y 3-(dimetilamino)-2,2-dimetilpropan-1-ol por medio de un método similar al del Ejemplo 407.
LCMS: m/z 771 [M+H]+
Tiempo de retención de HPLC: 1,25 minutos (condiciones de análisis SQD-FA05)
RMN H1 (CDCb) 5: 16,47 (1H, s), 12,87 (1H, s), 9,60 (1H, s), 8,47 (1H, d, J = 8,4 Hz), 7,95 (1H, s), 7,93 (1H, s), 7,79 (1H, d, J = 8,4 Hz), 6,99 (1H, m), 6,72 (1H, m), 5,04 (1H, d, J = 14,4 Hz), 4,4,19 (1H, d, J = 14,4 Hz), 3,80 (2H, s), 2,48 (3H, s), 2,43-2,36 (8H, m), 1,85-1,32 (10H, m), 1,02 (6H, s).
<Ejemplo 415>
Formiato de 1-(2-(2,3-difluoro-4-((10-hidroxi-6-metil-8-oxo-9-((4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-ilo)fenil)carbamoil)-6,7-diazaespiro[4,5]dec-9-en-7-il)metil)fenoxi)etil)-1,4-diazabiciclo[2,2,2]octan-1 -io
[Fórmula 243-5]
Primera Etapa
[Fórmula 244]
Una solución de éster 2-metilpropílico de ácido 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-6,7-diazaespiro[4,5]dec-9-eno-9-carboxílico, 4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]anilina (100 mg, 0,152 mmoles), 1,2-dicloroetano (151 mg, 1,52 mmoles) y carbonato de potasio (42 mg, 0,304 mmoles) en N,N-dimetilformamida (1,01 mL) se calentó a 60°C durante 18 horas. El residuo se disolvió en N,N-dimetilformamida y ácido fórmico, y la mezcla de reacción se purificó mediante cromatografía en columna C-18 de fase inversa sobre gel de sílice (agua con ácido fórmico al 0,1%/acetonitrilo con ácido fórmico al 0,1%) para obtener 7-(4-(2-cloroetoxi)-2,3-difluorobencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-ilo)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (91 mg, 83%).
LCMS: m/z 720 [M+H]+
Tiempo de retención de HPLC: 1,697 minutos (SMD-TFA05)
Segunda Etapa
Una solución de 7-(4-(2-cloroetoxi)-2,3-difluorobencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (93 mg, 0,126 mmoles), 1,4-diazabiciclo[2,2,2]octano (142 mg, 1,26 mmoles) y carbonato de potasio (175 mg, 1,26 mmoles) en acetona (3,16 mL) se agitó a 60°C durante 4 días. Después de que la mezcla de reacción se enfrió a temperatura ambiente, se insufló gas nitrógeno en el producto resultante para eliminar el disolvente. El residuo se disolvió en N,N-dimetilformamida y ácido fórmico, y el producto resultante se purificó mediante HPLC (agua con ácido fórmico al 0,1%/acetonitrilo con ácido fórmico al 0,1%) para obtener el compuesto del título (78 mg, 73%).
LCMS: m/z 796 [M]+
Tiempo de retención de HPLC: 1,05 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 416>
6-[[2,3-Difluoro-4-[1-(2-metoxietil)azetidin-3-il]oxifenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida
[Fórmula 245]
Primera Etapa
[Fórmula 246]
se sintetizó éster 2-metilpropílico de ácido 7-[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-6,7-diazaespiro[4,5]dec-9-eno-9-carboxílico a partir del 1-[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil] hidrocloruro de]metilidenamino]-metilamino]ciclopentano-1-carboxilato de metilo (Ejemplo de Referencia 105) de una manera similar a la de la Cuarta Etapa del Ejemplo 237.
LCMS: m/z 540 [M+H]+
Tiempo de retención de HPLC: 1,11 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
El compuesto del título se sintetizó a partir de éster 2-metilpropílico de ácido 7-[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-6,7-diazaespiro[4,5]dec-9-eno-9-carboxílico y 2-(5-metil-6-(trifluorometil)pirimidin-4-il)-4-(trifluorometil)anilina (Ejemplo de Referencia 96) de manera similar a la de la Quinta Etapa del Ejemplo 237.
LCMS: m/z 787 [M+H]+
Tiempo de retención de HPLC: 1,41 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 417>
7-(2,3-Difluoro-4-((2-((2-metoxietil)(metil)amino)etil)amino)bencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida [Fórmula 247]
Primera Etapa
[Fórmula 248]
Se utilizaron 2,3-difluoro-4-yodobenzaldehído e hidrocloruro de metil 1-(metilamino)ciclopentano carboxilato de metilo, y se llevaron a cabo operaciones similares a las de la Tercera a Quinta Etapas del Ejemplo 13 para sintetizar el compuesto del título (2,69 g, rendimiento en tres etapas de 69%).
LCMS: m/z 768 [M+H]+
Tiempo de retención de HPLC: 0,99 minutos (condiciones de análisis SQD-FA50)
Segunda Etapa
[Fórmula 249]
Se añadió dimetilsulfóxido (1,07 mL) a una mezcla de 7-(2,3-difluoro-4-yodobencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (205 mg, 0,267 mmoles), yoduro de cobre(I) (10,2 mg, 0,053 mmoles), 2-((2,6-dimetilfenil)amino)-2-oxoacetato (20,6 mg, 0,107 mmoles), fosfato de potasio (284 mg, 1,336 mmoles) y N1-(2-metoxietil)-N1-metiletano-1,2-diamina (70,6 mg, 0,534 mmoles), y la mezcla se agitó en atmósfera de nitrógeno a 90°C durante 5 horas. Se añadió amoníaco acuoso a la mezcla de reacción, y la mezcla se extrajo con acetato de etilo. El residuo se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (210 mg, 95%).
LCMS: m/z 772 [M+H]+
Tiempo de retención de HPLC: 0,83 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 418>
7-[[2,3-Difluoro-4-[4-[metil-[(2S,3R,4R,5R)-2,3,4,5,6-pentahidroxihexil]amino]-4-oxobutoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
Se disolvió 4-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenilo]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]butanoato (40 mg, 0,054 mmoles) (Ejemplo 332) en N,N-dimetilformamida (1 mL), a continuación, se añadieron (2R,3R,4R,5S)-6-(metilamino)hexano-1,2,3,4,5-pentol (31,5 mg, 0,161 mmoles), hAt U (40,9 mg, 0,108 mmoles) y N-etil-N-isopropilpropan-2-amina (20,86 mg, 0,161 mmoles), y la mezcla se agitó a temperatura ambiente durante 15 horas. Se añadió agua a la mezcla de reacción (0,2 mL), y el producto resultante se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (32 mg, 65%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 921 [M+H]+
Tiempo de retención de HPLC: 1,01 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 419>
7-[[4-[2-[2-(2,3-Dihidroxipropilamino)etoxi]etoxi]-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
Primera Etapa
2-[2-(4-Metilfenil)sulfoniloxietoxi]-4-metilbencenosulfonato de etilo
[Fórmula 252]
• TsO'/^ ' ° ' ,^ v OTs
Se disolvieron 2,2'-oxidietanol (200 mg, 1,9 mmoles) y trietilamina (572 mg, 5,65 mmoles) en diclorometano (10 mL), a continuación, se añadió cloruro de tosilo (898 mg, 4,7 moles), y la mezcla se agitó a temperatura ambiente durante 15 horas La mezcla de reacción se purificó mediante cromatografía sobre gel de sílice (hexano: acetato de etilo = 2:1) para obtener el compuesto del título (620 mg, 79%) como un cristal blanco similar a una placa.
LCMS: m/z 415 [M+H]+
Tiempo de retención de HPLC: 0,88 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
4-Metilbencenosulfonato de 2-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etilo
Se disolvió 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (100 mg, 0,152 mmoles) en acetonitrilo (5 mL), a continuación, se añadieron oxibis(etano-2,1-diil)bis(4-metilbencenosulfonato) obtenidos en la primera etapa (252 mg, 0,61 mmoles) y carbonato de cesio (49,6 mg, 0,152 mmoles), y la mezcla se agitó a 50°C durante 4 horas. La mezcla de reacción se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (115 mg, 84%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 900 [M+H]+
Tiempo de retención de HPLC: 1,25 minutos (condiciones de análisis SQD-FA05)
Tercera Etapa
Se disolvieron 4-metilbencenosulfonato 2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etilo obtenido en la Segunda Etapa (30 mg, 0,033 mmoles) y 3-aminopropano-1,2-diol (9,11 mg, 0,1 mmoles) en acetonitrilo (1 mL), y la mezcla se agitó a 50°C durante 5 horas. La mezcla de reacción se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (18 mg, 66%) en forma de un sólido amorfo de color blanco. LCMS: m/z 819 [M+H]+
Tiempo de retención de HPLC: 0,82 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 420>
7-[[2,3-Difluoro-4-[2-[2-[metil-[(2S,3R,4R,5R)-2,3,4,5,6-pentahidroxihexil]amino]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 254]
Se utilizó (2R,3R,4R,5S)-6-(metilamino)hexano-1,2,3,4,5-pentol como materia prima, y se llevaron a cabo operaciones similares a las del Ejemplo 419 para sintetizar el compuesto del título.
LCMS: m/z 923 [M+H]+
Tiempo de retención de HPLC: 0,79 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 421>
7-[[2,3-Difluoro-4-[2-[2-[2-[2-[2-[metil-[(2R,3S,4S,5S)-2,3,4,5,6-pentahidroxihexil]amino]etoxi]etoxi]etoxi]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 255]
Se utilizó 2-[2-[2-[2-(2-hidroxietoxi)etoxi]etoxi]etoxi]etanol como materia prima, y se llevaron a cabo operaciones similares a las del Ejemplo 419 para sintetizar el compuesto del título.
LCMS: m/z 1055 [M+H]+
Tiempo de retención de HPLC: 0,81 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 422>
7-[[2,3-Difluoro-4-[2-[2-[3-metil-[(2S,3R,4R,5R)-2,3,4,5,6-pentahidroxihexil]amino]-3-oxopropoxi]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
Primera Etapa
3-[2-[2-(2-Hidroxietoxi)etoxi]etoxi]propanoato de terc-butilo
[Fórmula 257]
Se disolvió 2-[2-(2-hidroxietoxi)etoxi]etanol (2 g, 13,3 mmdl) en THF (5 mL) y se añadió NaH (8 mg, 0,2 moles). Después de que la mezcla se agitó a temperatura ambiente durante 10 minutos, se añadió lentamente prop-2-enoato de terc-butilo (0,5 g, 3,9 mmoles) y la mezcla se agitó a temperatura ambiente durante 15 horas. La mezcla de reacción se concentró y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (acetato de etilo) para obtener el compuesto del título objetivo (488 mg, 45%) en forma de un aceite transparente incoloro.
RMN H1 (CDCls) ó: 3,68-3,65 (4H, m), 3,62-3,55 (10H, m), 2,47 (2H, t, J = 6,4 Hz), 1,44 (9H, s).
Segunda Etapa
3-[2-[2-[2-(4-Metilfenil)sulfoniloxietoxi]etoxi]etoxi]propanoato de terc-butilo
[Fórmula 258]
Se disolvieron 3-[2-[2-(2-hidroxietoxi)etoxi]etoxi]propanoato de terc-butilo (488 mg, 1,75 mmoles) y trietilamina (532 mg, 5,26 mmoles) en diclorometano (15 mL) y se añadió cloruro de tosilo (435 mg, 2,28 mmoles). Después de agitar la mezcla a temperatura ambiente durante 17 horas, la mezcla de reacción se concentró y el residuo resultante se
purificó mediante cromatografía en columna sobre gel de sílice (hexano: acetato de etilo = 1: 2) para obtener el compuesto del título (550 mg, 73 %) en forma de aceite transparente incoloro.
LCMS: m/z450 [M+H2O]+
Tiempo de retención de HPLC: 0,90 minutos (condiciones de análisis SQD-FA05)
Tercera Etapa
3-[2-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etoxi]propanoato de terc-butilo
Después de disolver 3-[2-[2-[2-(4-metilfenil)sulfoniloxietoxi]etoxi]etoxi]propanoato de terc-butilo (70 mg, 0,18 mmoles) y 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (79 mg, 0,12 mmoles) en acetonitrilo (2 mL), se añadió carbonato de cesio (117 mg, 1,36 moles) y la mezcla se agitó a 70°C durante 2 horas. Después de añadir agua (0,1 mL) a la mezcla de reacción, el producto resultante se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (18 mg, 66%) en forma de un sólido amorfo de color blanco. LCMS: m/z 874 [M+H]+
Tiempo de retención de HPLC: 1,29 minutos (condiciones de análisis SQD-FA05)
Cuarta Etapa
3-[2-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etoxi]propanoato
[Fórmula 260]
Se disolvió 3-[2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etoxi]propanoato de terc-butilo (100 mg, 0,114 mmoles) en diclorometano (2 mL) y se añadió TFA (0,54 mL) a temperatura ambiente. Después de agitar la mezcla de reacción a temperatura ambiente durante 2 horas, el producto resultante se concentró para separar el TFA por destilación. El residuo resultante se utilizó directamente para la siguiente reacción.
LCMS: m/z 818 [M+H]+
Tiempo de retención de HPLC: 1,15 minutos (condiciones de análisis SQD-FA05)
Quinta etapa
Se disolvieron 3-[2-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etoxi]propanoato (40 mg, 0,05 mmoles), 3-aminopropano-1,2-diol (9 mg, 0,1 moles) y HATU (37,2 mg, 0,1 moles) en DMF (1 mL), a continuación, se añadió diisopropiletilamina (12,6 mg, 0,1 mmoles) y la mezcla se agitó a temperatura ambiente durante 15 horas. Se añadió agua (0,1 mL) a la mezcla de reacción, y el producto resultante se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (18 mg, 41%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 995 [M+H]+
Tiempo de retención de HPLC: 1,01 minutos (condiciones de análisis SQD-FA05)
<Ejemplos 423 y 424>
Los compuestos descritos en la siguiente Tabla se sintetizaron llevando a cabo Etapas similares a las del Ejemplo 422 utilizando 2-[2-(2-hidroxietoxi)etoxi]etanol como sustancia de partida.
Tabla 35
<Ejemplos 425 y 426>
Los compuestos descritos en la siguiente Tabla se sintetizaron realizando Etapas similares a las del Ejemplo 422 utilizando 2-[2-hidroxietil(metil)amino]etanol como sustancia de partida.
]+
<Ejemplo 427>
7-[[2,3-Difluoro-4-[2-[2-[[(2S,3R,4S,5S)-2,3,4,5,6-pentahidroxihexanoil]amino]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxoN-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 261]
Primera Etapa
N-[2-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-trifluorometil)pirimidin-4
il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etil]carbamato de terc-butilo [Fórmula 262]
Después de disolver N-[2-(2-hidroxietoxi)etil]carbamato de terc-butilo (28 mg, 0,137 mmoles), 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (30 mg, 0,046 mmoles) y TMAD (15,7 mg, 0,091 mmoles) en THF (1 mL), se añadió tributilfosfina (18,5 mg, 0,091 mmoles). Después de agitar la mezcla a temperatura ambiente durante 5 horas, el producto resultante se concentró y el residuo se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (28 mg, 74%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 845 [M+H]+
Tiempo de retención de HPLC: 1,25 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
7-[[4-[2-(2-Aminoetoxi)etoxi]-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 263]
Se disolvió N-[2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etil]carbamato de terc-butilo (30 mg, 0,036 mmoles) en acetato de etilo (0,3 mL), a continuación, se añadió acetato de etilo 4N-HCl (1 mL), y la mezcla se agitó a temperatura ambiente durante 15 horas. La mezcla de reacción se concentró y el residuo resultante se utilizó para la siguiente reacción sin purificación.
LCMS: m/z 745 [M+H]+
Tiempo de retención de HPLC: 0,81 minutos (condiciones de análisis SQD-FA05)
Tercera Etapa
Se disolvieron 7-[[4-[2-(2-Aminoetoxi)etoxi]-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (42 mg, 0,054 mmoles) y (3R,4S,5S,6R)-34,5-trihidroxi-6-(hidroximetil)oxan-2-ona (19,2 mg, 0,108 mmoles) en metanol (1 mL), y el producto resultante se agitó en un tubo sellado a 70°C durante 20 horas. Se añadió agua (0,1 mL) a la mezcla de reacción, y el producto resultante se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (30 mg, 61%) en forma de un sólido amorfo de color blanco.
LCMS: m/z 923 [M+H]+
Tiempo de retención de HPLC: 1,00 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 428>
7-[[2,3-Difluoro-4-[2-[2-[2-[2-[[(2S,3R,4S,5S)-2,3,4,5,6-pentahidroxihexanoil]amino]etoxi]etoxi]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]- 6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 264]
El compuesto del título se sintetizó llevando a cabo Etapas similares a las del Ejemplo 427 utilizando N-[2-[2-[2-(2-hidroxietoxi)etoxi]etoxi]etil]carbamato de terc-butilo como sustancia de partida.
LCMS: m/z 1011 [M+H]+
Tiempo de retención de HPLC: 1,01 minutos (condiciones de análisis SQD-FA05)
<Ejemplo 429>
7-[[2,3-Difluoro-4-[2-[2-[2-metoxietil(metil)amino]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 265]
Primera Etapa
[Fórmula 266]
Se añadieron 4-metilbencenosulfonato de 2-[2-(4-metilfenil)sulfoniloxietoxi]etilo (79 mg, 0,192 mmoles) y carbonato de cesio (15,6 mg, 0,048 mmoles) a una solución de 7-[(2,3-difluoro-4-hidroxifenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (segunda etapa del ejemplo 332) (31,5 mg, 0,048 mmoles) en acetonitrilo (1 mL), y la mezcla se agitó a 50°C durante 4 horas. Una vez completada la reacción, la mezcla de reacción se neutralizó con ácido fórmico y la mezcla de reacción se purificó mediante cromatografía en columna C18 de fase inversa para obtener 4-metilbencenosulfonato de 2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-es -7-il]metil]fenoxi]etoxi]etil (35,9 mg, 83%). LCMS: m/z 900 [M+H]+
Tiempo de retención de HPLC: 1,73 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
Se añadió 2-metoxi-N-metiletanamina (0,043 mL, 0,399 mmoles) a una solución de 4-metilbencenosulfonato de 2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etoxi]etilo (35,9 mg, 0,04 mmoles) en acetonitrilo (0,6 mL), y la mezcla se agitó a 50°C durante 6 horas. Una vez completada la reacción, la mezcla de reacción se purificó mediante cromatografía en columna C18 de fase inversa para obtener el compuesto del título (22,3 mg, 68%).
LCMS: m/z 817 [M+H]+
Tiempo de retención de HPLC: 1,43 minutos (condiciones de análisis SMD-TFA05)
<Ejemplos 430 a 434>
Se utilizaron agentes alquilantes apropiados y aminas comerciales para sintetizar los compuestos descritos en la siguiente Tabla llevando a cabo operaciones similares a las del Ejemplo 429.
T l 7
<Ejemplo 435>
Ácido 2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxiletilato]amino] etanosulfónico
[Fórmula 267]
Se disolvió 7-[[4-(2-bromoetoxi)-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (20 mg, 26,0 pmoles) (Ejemplo de Referencia 109) en N,N-dimetilformamida (200 pL), a continuación, se añadieron fosfato de potasio (27,8 mg, 0,13 mmoles) y yoduro de tetrabutilamonio (1,0 mg, 2,6 pmoles), y la mezcla se agitó a 80°C durante 3 horas. Después de que la mezcla de reacción se diluyó con ácido fórmico y agua y se filtró, el producto resultante se purificó mediante HPLC para obtener el compuesto del título (8,0 mg, 38%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (50 x 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 809,1 [M+H]+
Tiempo de retención de HPLC: 1,32 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 436>
2-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]etanosulfónico
[Fórmula 268]
Primera Etapa
Ácido (2R)-2-[2-[2,3-Difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi)etilamino)-3-metoxi-3-oxopropano-1-sulfónico
El ácido (2R)-2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]-3-metoxi-3-oxopropano-1-sulfónico se sintetizó a partir de 7-[[4-(2-bromoetoxi)-2,3-difluorofenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (Ejemplo de Referencia 109) e hidrocloruro de ácido (R)-2-amino-3-metoxi-3-oxopropano-1-sulfónico de manera similar a la del Ejemplo 381.
LCMS: m/z 867,0 [M+H]+
Tiempo de retención de HPLC: 1,37 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
El compuesto del título se sintetizó a partir de ácido (2R)-2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]fenoxi]etilamino]-3-metoxi-3-oxopropano- 1-sulfónico de manera similar a la del Ejemplo de Referencia 381.
LCMS: m/z 853,0 [M+H]+
Tiempo de retención de HPLC: 1,31 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 110>
Hidrocloruro de 2-cloro-N-(2-metoxiet¡l)-N-met¡letanam¡na
[Fórmula 270]
Primera Etapa
Se disolvió 2-metoxi-N-metiletanamina (17,0 g, 191 mmoles) en tolueno (381 mL), a continuación, se añadieron 2-bromoetanol (13,6 mL, 191 mmoles) y trietilamina (26,6 mL, 191 mmoles), y la mezcla se agitó a 100°C durante 2 horas. La mezcla de reacción se secó sobre sulfato de magnesio, y el producto resultante se filtró y se concentró a presión reducida para obtener 2-((2-metoxietil)(metil)amino)etanol (16,5 g) en forma de un producto bruto.
Segunda Etapa
Se disolvió 2-((2-metoxietil)(metil)amino)etanol (16,4 g, 124 mmoles) en acetato de etilo (124 mL), a continuación, se añadió cloruro de tionilo (13,4 mL, 186 mmoles) a 0°C, y la mezcla se agitó a temperatura ambiente durante 30 minutos. La mezcla de reacción se concentró a presión reducida para obtener el compuesto del título (20,5 g, 88%).
RMN H1 (DMSO-Da) 5: 10,36 (1H, brs), 4,00 (2H, t, J = 6,8 Hz), 3,70 (2H, t, J = 4,9 Hz), 3,51-3,43 (4H, m), 3,30 (3H, s), 2,81 (3 H, s).
<Ejemplo 437>
7-[[2,3-Difluoro-5-yodo-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida [Fórmula 271]
Primera Etapa
Se disolvió 6-[(2,3-difluoro-4-hidroxifenN)metil]-9-hidroxi-5-metN-7-oxo-N-[4-(trifluorometN)-2-[6-(trifluorometN)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida (Ejemplo de Referencia 107) (500 mg, 0,76 mmoles) en N,N-dimetilformamida (2,54 mL), a continuación, se añadió N-yodosuccinimida (222 mg, 0,99 mmoles) y la mezcla se agitó en atmósfera de nitrógeno a temperatura ambiente durante 2 horas. Se añadió metanol a la mezcla de reacción, y la mezcla se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener 7-[(2,3-difluoro-4-hidroxi-5-yodofenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno- 9-carboxamida (569 mg, 96%).
LCMS: m/z 784,1 [M+H]+
Tiempo de retención de HPLC: 1,67 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
Se disolvieron 7-[(2,3-difluoro-4-hidroxi-5-yodofenil)metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (341 mg, 0,43 mmoles), hidrocloruro de 2-cloro-N-(2-metoxietil)-N-metiletanamina (82,0 mg, 0,43 mmoles), carbonato de cesio (425 mg, 1,31 mmoles), yoduro de tetrabutilamonio (16,1 mg, 44,0 pmoles) y metanol (17,7 pL) en acetonitrilo (4,35 mL), y la mezcla se agitó en atmósfera de nitrógeno a 65°C durante 1,5 horas. Se añadió una solución acuosa de ácido fórmico a la mezcla de reacción, y el producto resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener el compuesto del título (341 mg, 87%).
LCMS: m/z 899,2 [M+H]+
Tiempo de retención de HPLC: 1,46 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 438>
7-[[2,3-Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]-5-[3-metoxipropil(metil)carbamoil]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
Primera Etapa
[Fórmula 274]
Se disolvieron 7-[[2,3-difluoro-5-yodo-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (140 mg, 156 pmoles), un complejo de tris(dibencilidenacetona)-dipaladio cloroformo (16,1 mg, 16,0 pmoles), xantfos (9,0 mg, 16,0 pmoles), cloruro de litio (39,6 mg, 0,94 mmoles), formiato de litio (40,5 mg, 0,78 mmoles) y trimetilsilanolato de potasio (60,0 mg, 0,47 mmoles) en N,N-dimetilformamida (1,04 mL), a continuación, se añadió anhídrido acético (58,5 pL, 0,62 mmoles) y la mezcla se agitó en atmósfera de nitrógeno a 85°C durante 30 minutos. Se añadieron N,N-dimetilformamida y metanol a la mezcla de reacción, y el producto resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener 3,4-difluoro-5-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]-2-[2-[2-metoxietil(metil)amino]etoxi] benzoato (98,4 mg, 77%).
LCMS: m/z 817,3 [M+H]+
Tiempo de retención de HPLC: 1,41 minutos (condiciones de análisis SMD-TFA05)
Segunda Etapa
Se disolvieron 3,4-difluoro-5-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-en-7-il]metil]-2-[2-[2-metoxietil(metil)amino]etoxi]benzoato (15,0 mg, 18,0 pmoles), 3-metoxi-N-metilpropan-1-amina (3,79 mg, 37,0 pmoles), hexafluorofosfato de 2-(3H-[1,2,3]triazolo[4,5-b]piridin-3-il)-1,1,3,3-tetrametilisouronio (10,5 mg, 28,0 pmoles) y N-etil-N-isopropilpropan-2-amina (9,6 pL, 55,0 pmoles) en N,N-dimetilformamida (100 pL), y la mezcla se agitó bajo atmósfera de nitrógeno a 40°C durante 2 horas. Se añadió una solución acuosa de ácido fórmico a la mezcla de reacción, y el producto resultante se purificó mediante HPLC para obtener el compuesto del título (8,0 mg, 38%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (50 * 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 902,1 [M+H]+
Tiempo de retención de HPLC: 1,17 minutos (condiciones de análisis SMD-FA05)
<Ejemplo de Referencia 111>
5-(2-Metoxietoxi)-2-[5-metil-6-(trifluorometil)pirimidin-4-il]-4-(trifluorometil)anilina
Primera Etapa
[Fórmula 276]
Se disolvieron 2-yodo-5-(2-metoxietoxi)-4-(trifluorometil)anilina (1,30 g, 3,60 mmoles) (Ejemplo de Referencia 13), 4,4,4’,4',5,5,5’,5'-octametil-2,2'-bi(1,3,2-dioxaborolano) (2,74 g, 10,8 mmoles), diciclohexil(2’,4',6'-triisopropil-[1,1'-bifenil]-2-il)fosfina (172 mg, 0,36 mmoles), acetato de potasio (1,06 g, 10,8 mmoles) y acetato de paladio (40,0 mg, 0,18 mmoles) en dioxano (12,0 mL), y la mezcla se agitó en atmósfera de nitrógeno a 110°C durante 4 horas. Se
añadió acetato de etilo a la mezcla de reacción, la mezcla se filtró, el producto resultante se concentró a presión reducida y el residuo resultante se purificó mediante cromatografía en columna C18 de fase inversa (acetonitrilo/agua) para obtener 5-(2-metoxietoxi)-2-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-4-(trifluorometil)anilina (183 mg, 14%).
LCMS: m/z 362,3 [M+H]+
Tiempo de retención de HPLC: 0,99 minutos (condiciones de análisis SQD-FA05)
Segunda Etapa
Se disolvieron 5-(2-metoxietoxi)-2-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-4-(trifluorometil)anilina (183 mg, 0,51 mmoles), 4-cloro-5-metil-6-(trifluorometil)pirimidina (Ejemplo de Referencia 91) (199 mg, 1,01 mmoles), un complejo de 1,1'-bis(difenilfosfino)ferroceno-dicloruro de paladio(II)-diclorometano (41,7 mg, 51,0 pmoles) y carbonato de potasio (210 mg, 1,52 moles) en dioxano (2,94 mL) y agua (0,44 mL), y la mezcla se agitó en atmósfera de nitrógeno a 90°C durante 1 hora. Se añadió agua a la mezcla de reacción, y el producto resultante se extrajo con acetato de etilo. La capa orgánica se lavó con agua y salmuera, la capa acuosa se separó mediante un separador de fases, el producto resultante se concentró a presión reducida y el residuo resultante se purificó mediante cromatografía en columna sobre gel de sílice (hexano/acetato de etilo) para obtener el compuesto del título (180 mg, 90%).
LCMS: m/z 396,1 [M+H]+
Tiempo de retención de HPLC: 1,24 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo de Referencia 112>
Éster 2-metilpropílico de ácido 7-[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-6,7-diazaespiro[4,5]dec-9-eno-9-carboxílico
[Fórmula 277]
Se utilizó hidrocloruro de 1-[[(E)-[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metilidenamino]-metilamino]ciclopentano-1-carboxilato de metilo (Ejemplo de Referencia 105) y se llevaron a cabo operaciones similares a las de la Cuarta Etapa del Ejemplo 237 para sintetizar el compuesto del título.
LCMS: m/z 540,2 [M+H]+
Tiempo de retención de HPLC: 1,11 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 439>
7-[[2,3-Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-N-[5-(2-metoxietoxi)-2-[5-metil-6-(trifluorometil)pirimidin-4-il]-4-(trifluorometil)fenil]-6-metil-8-oxo-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 278]
Se utilizaron éster 2-metilpropílico de ácido 7-[[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-6,7-diazaespiro[4,5]dec-9-eno-9-carboxílico y 5-(2-metoxietoxi)-2-[5-metil-6-(trifluorometil)pirimidin-4-il]-4-(trifluorometil)anilina, y se llevaron a cabo operaciones similares a las de la Quinta Etapa del Ejemplo 237 para sintetizar el compuesto del título.
LCMS: m/z 861,4 [M+H]+
Tiempo de retención de HPLC: 1,40 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 440>
9-[[2,3-Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]-5-(3-piridinil)fenil]metil]-6-hidroxi-10-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-9,10-diazaespiro[4,5]dec-6-eno-7-carboxamida
[Fórmula 279]
Se disolvió 7-[[2,3-difluoro-5-yodo-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida (10 mg, 11,0 pmoles) (Ejemplo 437) en 1,2-dimetoxietano (80 pL), etanol (80 pL) y agua (80 pL), a continuación, se añadieron borato de 3-piridinilo (2,1 mg, 17,0 pmoles), tetrakis(trifenilfosfina)paladio (3,9 mg, 3,3 pmoles), y carbonato de sodio (3,9 mg, 33 pmoles), y la mezcla se agitó a 80°C durante 16 horas. Después de que la mezcla de reacción se diluyó con ácido fórmico y agua y se filtró, el producto resultante se purificó mediante HPLC para obtener el compuesto del título (2,3 mg, 24%).
Condiciones de purificación: HPLC
Fase móvil: MeCN/agua (ácido fórmico al 0,1%)
Columna: YMC-Actus Triart C18 (50 x 30 mm D.I., S-5 pm, 12 nm)
LCMS: m/z 850 [M+H]+
Tiempo de retención de HPLC: 1,26 minutos (condiciones de análisis SMD-TFA05)
<Ejemplo 441>
7-[[2,3-Difluoro-4-[2-[2-[2-[2-[2-[metil-[(2S,3R,4R,5R)-2,3,4,5,6-pentahidroxihexil]amino]-2-oxoetoxi]etoxi]etoxi]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida
[Fórmula 280]
El compuesto del título se sintetizó llevando a cabo Etapas y operaciones similares a las del Ejemplo 422 utilizando 2-[2-[2-[2-(2-hidroxietoxi)etoxi]etoxi]etoxi]etanol y 2-bromoacetato de terc-butilo como sustancia de partida.
LCMS: m/z 1069 [M+H]+
Tiempo de retención de HPLC: 1,00 minutos (condiciones de análisis SQD-FA05)
<Ejemplos 442 a 445>
Se utilizaron el compuesto de anilina del Ejemplo 417 y los aldehidos o cetonas apropiados, y se llevaron a cabo las siguientes operaciones para sintetizar los compuestos descritos en la siguiente Tabla.
Se disolvieron 7-(2,3-difluoro-4-((2-((2-metoxietil)(metil)amino)etil)amino)bencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida y el correspondiente aldehido o cetona en tetrahidrofurano, y se añadió ácido sulfúrico 18 M de una cantidad equivalente a una quinta parte de la cantidad de tetrohidrofurano a 0°C. Posteriormente, se añadió tetrahidroborato de sodio en tres lotes, y la mezcla se agitó a 0°C o a temperatura ambiente durante 3 horas y más. Se añadieron trietilamina, agua y dimetilsulfóxido a la mezcla de reacción, y la solución resultante se purificó mediante cromatografía en columna C18 de fase inversa para sintetizar los compuestos de los Ejemplos descritos en la siguiente Tabla.
Tabla 38
<Ejemplos 446 y 447>
Se utilizó el derivado de yoduro apropiado del Ejemplo 417, 3-morfolinopropan-1-amina y 2-morfolinoetanamina, y se llevaron a cabo operaciones similares a las del Ejemplo 417 para sintetizar los compuestos descritos en la siguiente Tabla.
Tabla 39
<Ejemplo de Referencia 113>
1 -((Metilamino)ciclopentanocarboxilato 4-toluenosulfonato de metilo
Primera Etapa
1 -((terc-Butoxicarbonil)amino)ciclopentanocarboxilato de metilo
[Fórmula 281]
Se disolvió hidrocloruro de ácido 1-aminociclopentanocarboxílico (3,00 g, 18,1 mmoles) en metanol (18,0 mL), a continuación, se añadió cloruro de tionilo (1,32 mL, 18,1 mmoles) a 0°C, y la mezcla se agitó en atmósfera de nitrógeno a 50°C durante 3 horas. La mezcla de reacción se concentró a presión reducida, y se añadieron agua (6,00 mL) y trietilamina (7,55 mL, 54,3 mmoles) al residuo resultante. Se añadieron a esta solución dicarbonato de
di-terc-butilo (3,95 g, 18,1 mmoles) y éster terc-butil metílico (24,0 mL), y la mezcla se agitó a 50°C durante 1 hora. La capa acuosa se separó, se añadió tetrahidrofurano (9,00 mL) a la capa orgánica, y el producto resultante se concentró a presión reducida. Se añadió tetrahidrofurano (15,0 mL) al residuo resultante, y el producto resultante se concentró a presión reducida para obtener el compuesto del título en forma de un aceite de color amarillo pálido. RMN H1 (DMSO-D6 ) 5: 7,28 (1H, brs), 3,58 (3H, s), 2,10-1,80 (4H, m), 1,67-1,55 (4H, m), 1,36 (9H, s).
Segunda Etapa
1-((terc-Butoxicarbonil)metilamino)ciclopentanocarboxilato de metilo
[Fórmula 282]
H3C o
r V M J L 0'Bu
N / c o 2 c h 3
Se disolvió 1-((terc-butoxicarbonil)amino)ciclopentanocarboxilato de metilo obtenido en la Primera Etapa en 1-metil-2-pirrolidinona (24,0 mL), a continuación, se añadieron hidróxido de sodio (1,45 g, 36,2 mmoles) y yoduro de metilo (3,38 mL, 54,3 mmoles), y la mezcla se agitó a 50°C durante 7 horas. Se añadió agua (30,0 mL) a esta mezcla de reacción a temperatura ambiente, y el producto resultante se extrajo con acetato de isopropilo (15,0 mL) dos veces. La capa orgánica resultante se lavó sucesivamente con una solución acuosa de tiosulfato de sodio al 10% (15,0 mL) y una solución acuosa de cloruro de sodio al 10% (15,0 mL). La capa orgánica resultante se concentró a presión reducida para obtener el compuesto del título (5,88 g, 83%).
RMN H1 (DMSO-D6) 5: 3,60 (3H, s), 2,87 (3H, s), 2,20-2,10 (2H, m), 1,96-1,87 (2H, m), 1,75-1,60 (4H, m), 1,34 (9H, s).
Tercera Etapa
4-Toluenosulfonato de 1-(met¡lamino)c¡clopentanocarbox¡lato de metilo
[Fórmula 283]
,------- y . H 2
r y t n -ch3
TosO" CO2CH3
El compuesto del título se sintetizó a partir de ácido 1-((terc-butoxicarbonil)amino)ciclopentanocarboxílico de una manera similar a la de los Ejemplos de Referencia 87 y 8 8.
<Ejemplo de Referencia 114>
2.3-Difluoro-4-r2-r2-metoxietil(metil)aminoletoxil hidrocloruro de benzaldehído
[Fórmula 284]
Se disolvió 2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]benzaldehído (200 mg, 0,73 mmoles) en 1 mL de dimetoxietano. Se añadió hidrocloruro de piridina (85 mg, 0,73 mmoles) y la mezcla se agitó. El cristal generado se filtró y se secó a presión reducida para obtener el compuesto del título ( 68 mg, 30%).
RMN H1 (DMSO-D6) 5: 10,99 (1H, brs), 10,07 (1H, s), 7,73 (1H, m), 7,30 (1H, m), 4,67 (2H, t, J = 4,9 Hz), 3,75 (2H, t, J = 5,1 Hz), 3,30 (3H, s), 3,30-3,74 (4H, m), 2,87 (3H, brd, J = 3,7 Hz).
Prueba farmacológica
Ejemplo de Prueba 1: Efecto inhibidor sobre la captación de 33PO4 en vesículas de membrana del ribete en cepillo del intestino delgado de ratas
Se prepararon vesículas de membrana del ribete en cepillo (VMRC) utilizando la región superior del intestino delgado de cada rata hembra Wistar (4-5 semanas de edad). La preparación de las VMRC se realizó de acuerdo con
el método de Murer et al. (Murer H, Hopfer U, Kinne R. Sodium/proton antiport in brush-border-membrane vesicles isolated from rat small intestine and kidney. 1976. J Am Soc Nephrol. 1998 Jan; 9 (1): 143-50). La actividad de transporte de 33P de las VMRC del intestino delgado se determinó por el método de filtración rápida. Cada compuesto de prueba se añadió a una concentración final de 1 pM al tampón A (NaCl 110 mM, manitol 60 mM y HEPES 10 mM (pH 7,5)) que contenía 340 kBq/ml de 33PÜ4, o se añadió DMSO al tampón B (KCl 110 mM, manitol 60 mM y HEPES 10 mM (pH 7,5)) que contenía 340 kBq/ml de 33PO4 y cada solución resultante se añadió a la muestra de VMRC y reaccionó durante 60 segundos. A continuación, se añadió tampón C (NaCl 110 mM, KH2PO41 mM y se añadió HEPES 10 mM (pH 7,5)) helado a cada mezcla de reacción, que se filtró por succión inmediatamente a través de un filtro Millipore. El filtro se lavó con tampón C, y cada muestra se disolvió en un centelleador líquido. La cantidad de absorción de 33PO4 en las VMRC se midió utilizando un contador de centelleo líquido. La tasa de inhibición se determinó de acuerdo con la siguiente expresión:
Tasa (%) de inhibición = (1 -(Cantidad de captación de 33PO4 en las VMRC complementadas con el compuesto de ensayo y tratadas con tampón A - Cantidad de
captación de 33PO4 en las VMRC complementadas con DMSO y tratadas con tampón
B) / Cantidad de captación de 33PO4 en las VMRC complementadas con DMSO y tratadas
con tampón A - Cantidad de captación de 33PO4 en las VMRC complementadas con
DMSO y tratadas con tampón B)) x 100
La tasa de inhibición de la captación de 33PO4 en las vesículas de la membrana del ribete en cepillo del intestino delgado de la rata por 1 pM del compuesto de prueba (la tasa de inhibición de la absorción) se muestra en las Tablas 40-1 a 40-8.
T l 4 -1
T l 4-2
T l 4-
T l 4-4
[Tabla 40-5]
Núm. de Ejemplo Tasa de inhibición de la captación (%) (1 pM) 249 50
T l 4-
T l 4-7
T l 4 -
Ejemplo de prueba 2: Efecto inhibidor sobre la captación de 33PO4 en células que expresan NaPi-Iib humana
Las células CHO se transfectaron con plásmidos de expresión de NaPi-IIb humano, y se obtuvo una línea celular que expresaba NaPi-IIb humano estable utilizando G418. Las células que expresaban NaPi-IIb humano se inocularon en una placa de 96 pocillos y se incubaron durante la noche en una incubadora con CO2. El medio se
reemplazó por tampón A (cloruro de colina 145 mM, KCl 3 mM, CaCl21 mM, MgCÍ20,5 mM, Glucosa 5 mM y MES 5 mM (pH 6,5)) y a continuación, se reemplazó por tampón B (NaCl 145 mM, KCl 3 mM, CaCb 1 mM, MgCb 0,5 mM, Glucosa 5 mM y MES 5 mM (pH 6,5) complementado con cada compuesto de prueba a una concentración final de 1,3, 10 o 30 pM o tampón A complementado con DMSO. Después de un tiempo determinado, se añadió a esto un volumen 1/20 de Tampón A que contenía 33PO4 y se hizo reaccionar a temperatura ambiente. Después de lavar con tampón A helado, se añadió un centelleador líquido a cada mezcla de reacción, y la cantidad de captación de 33PO4 se midió utilizando TopCount. La tasa de inhibición se determinó de acuerdo con la siguiente expresión:
Tasa (%) de inhibición = (1 -(Cantidad de captación de 33PO4 en el pocillo
complementado con el compuesto de ensayo y tratado con tampón A - Cantidad de
captación de 33PO4 en el pocillo complementado con DMSO y tratado con tampón
B) / Cantidad de captación de 33PO4 en el pocillo complementado con DMSO y tratado
con tampón A - Cantidad de captación de 33PO4 en el pocillo complementado con
DMSO y tratado con tampón B)) x 100
Los valores de CI50 (pM) se calcularon a partir de una línea recta que une dos puntos que se cruzan con la tasa de inhibición del 50%. Los valores de CI50 de algunos compuestos contra la captación de 33PO4 en las células que expresan NaPi-IIb humano se muestran en las Tablas 41-1 a 41-7.
T l 41-1
T l 41-2
T l 41-
T l 41-4
T l 41-
Ejemplo de prueba 3: Efecto inhibidor sobre la captación de 33PO4 en la célula que expresa PiT-1 humano
Las células CHO se transfectaron con plásmidos de expresión de PiT-1 humanos o vectores vacíos para preparar células que expresaban PiT-1 humano y células que expresaban vectores vacíos. Las células que expresaban PiT-1 humano o las células que expresaban vectores vacíos se inocularon en una placa de 96 pocillos y se incubaron durante la noche en una incubadora con CO2. El medio se reemplazó por tampón A (cloruro de colina 145 mM, KCl 3 mM, CaCl2 1 mM, MgCl20,5 mM, Glucosa 5 mM y MES 5 mM (pH 6,5)) y a continuación, se reemplazó por tampón B (NaCl 145 mM, KCl 3 mM, CaCl2 1 mM, MgCl20,5 mM, Glucosa 5 mM y MES 5 mM (pH 6,5) complementado con cada compuesto a una concentración final de 0,24, 1,2, 6 o 30 pM o tampón B complementado con DMSO. Después de un tiempo determinado, se añadió a esto un volumen 1/20 de Tampón A que contenía 33PO4 y se hizo reaccionar a temperatura ambiente. Después de lavar con tampón helado A, se añadió un centelleador líquido a cada mezcla de reacción, y la cantidad de captación de 33PO4 se midió utilizando TopCount. La tasa de inhibición se determinó de acuerdo con la siguiente expresión:
Tasa (%) de inhibición = (1 -(Cantidad de captación de 33PO4 en el pocillo
complementado con compuesto que contiene células que expresan PiT-1
humano - Cantidad de captación de 33PO4 en el pocillo complementado con
compuesto que contiene células que expresan vectores vacíos) / Cantidad
de captación de 33PO4 en el pocillo complementado con DMSO que contiene
células que expresan PiT-1 humano - Cantidad de captación de 33PO4 en el
pocillo complementado con DMSO que contiene células que expresan
vectores vacíos)) x 100
Los valores de CI50 (pM) se calcularon a partir de una línea recta que une dos puntos que se cruzan con la tasa de inhibición del 50%. Los valores de CI50 de algunos compuestos contra la captación de PO334 en las células humanos que expresan PiT-1 se muestran en la Tabla 42.
T l 42
Ejemplo de prueba 4: Efecto inhibidor sobre la captación de 33PO4 en la célula que expresa PiT-2 humano
Las células CHO se transfectaron con plásmidos de expresión de PiT-2 humano o vectores vacíos para preparar células que expresan PiT-2 humano y células que expresan vectores vacíos. Las células que expresan PiT-2 humano o las células que expresan vectores vacíos se inocularon en una placa de 96 pocillos y se incubaron durante la noche en una incubadora con CO2. El medio se reemplazó por tampón A (cloruro de colina 145 mM, KCl 3 mM, CaCl2 1 mM, MgCl20,5 mM, Glucosa 5 mM y MES 5 mM (pH 6,5)) y a continuación, se reemplazó por tampón B (NaCl 145 mM, KCl 3 mM, CaCl2 1 mM, MgCl20,5 mM, Glucosa 5 mM y MES 5 mM (pH 6,5) complementado con cada compuesto a una concentración final de 0,24, 1,2, 6 o 30 pM o tampón B complementado con DMSO. Después de un tiempo determinado, se añadió a esto un volumen 1/20 de tampón A que contenía 33PO4 y se hizo reaccionar a temperatura ambiente. Después de lavar con tampón A helado, se añadió un centelleador líquido a cada mezcla de reacción, y la cantidad de captación de 33PO4 se midió utilizando TopCount. La tasa de inhibición se determinó de acuerdo con la siguiente expresión:
Tasa (%) de inhibición = (1 -(Cantidad de captación de 33PO4 en el pocillo
complementado con compuesto y que contiene células que expresan PiT-2
humano - Cantidad de captación de 33PO4 en el pocillo complementado con
compuesto y que contiene células que expresan vectores vacíos) / Cantidad
de captación de 33PO4 en el pocillo complementado con DMSO que contiene
células que expresan PiT-2 humano - Cantidad de captación de 33PO4 en el
pocillo complementado con DMSO y que contiene células que expresan
vectores vacíos)) x 100
Los valores de CI50 (pM) se calcularon a partir de una línea recta que une dos puntos que se cruzan con la tasa de inhibición del 50%. Los valores de CI50 de algunos compuestos contra la captación de 33PO4 en las células humanas que expresan PiT-2 se muestran en la Tabla 43.
T l 4
Ejemplo de prueba 5: Efecto supresor sobre el aumento de la concentración de fósforo en suero de rata con insuficiencia renal inducida por adenina
La adenina se administró por vía oral a cada rata macho Wistar (de 7 a 8 semanas de edad) para perjudicar las funciones renales y, por lo tanto, preparar un modelo de hiperfosfatemia (Katsumata K, Kusano K, Hirata M, Tsunemi K, Nagano N, Burke SK, Fukushima N. Sevelamer hydrochloride prevents ectopic calcification and renal osteodystrophy in chronic renal failure rats. Kidney Int. 2003 Aug; 64 (2): 441-50). Cada compuesto de prueba se mezcló a una razón de 0,1% de concentración en masa con el alimento. El animal fue alimentado con una cantidad dada de alimento durante 3 días. Se utilizó un grupo que recibió alimento no complementado con un compuesto de prueba como grupo patológico de referencia, y un grupo al que no se administró adenina que recibió alimento no complementado con un compuesto de prueba se utilizó como grupo normal. Tres días después del comienzo de la administración del compuesto de prueba, se recogió sangre de la vena yugular y se recogió suero. Las concentraciones séricas de fósforo se midieron por el método Fiske-Subbarow. La tasa de supresión de un aumento en la concentración de fósforo en suero se determinó de acuerdo con la siguiente expresión:
Tasa (%) de supresión del aumento de la concentración de fósforo en suero = (1 -[(Concentración de fósforo en suero del grupo patológico tratado con compuesto de
ensayo) -(Concentración de fósforo en suero del grupo normal)] / [(Concentración
de fósforo en suero del grupo patológico de referencia) -(Concentración de fósforo
en suero del grupo normal)]) x 100
Como resultado, se confirmó que cada compuesto de prueba tenía un efecto supresor sobre un aumento en la concentración de fósforo en suero. La Tabla 44 muestra la tasa (%) de supresión del aumento en la concentración de fósforo en suero por cada compuesto de prueba.
T l 44-1
Tabla 44-2
T l 44-
T l 44-4
Tabla 44-5
Ejemplo de prueba 6: Efecto supresor sobre el aumento de la concentración de fósforo en suero de rata con insuficiencia renal inducida por adenina
Cada rata con insuficiencia renal inducida por adenina se preparó de la misma manera que en el Ejemplo de Prueba 5. Cada compuesto de prueba se mezcló a una razón de 0,05% de concentración en masa con el alimento. El animal fue alimentado con una cantidad dada de alimento durante 8 días. Se utilizó un grupo que recibió alimento no complementado con un compuesto de prueba como grupo patológico de referencia, y un grupo al que no se administró adenina que recibió alimento no complementado con un compuesto de prueba se utilizó como grupo normal. Ocho días después del comienzo de la administración del compuesto de prueba, se recogió sangre de la vena yugular y se recogió suero. Las concentraciones séricas de fósforo se midieron por el método Fiske-Subbarow.
La tasa de supresión del aumento en la concentración de fósforo en suero se determinó de acuerdo con la siguiente expresión:
Tasa (%) de supresión del aumento de la concentración de fósforo en suero = (1 -[(Concentración de fósforo en suero del grupo patológico tratado con compuesto de
ensayo) -(Concentración de fósforo en suero del grupo normal)] / [(Concentración
de fósforo en suero del grupo patológico de referencia) -(Concentración de fósforo
en suero del grupo normal)]) x 100
Como resultado, se confirmó que cada compuesto de prueba tenía un efecto supresor sobre el aumento en la concentración de fósforo en suero. La Tabla 45 muestra la tasa (%) de supresión del aumento en la concentración de fósforo en suero por cada compuesto de prueba.
T l 4
Claims (1)
- REIVINDICACIONES1. Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal:en donde R1, R4 y R5 se definen como en cualquiera de los siguientes apartados (1) y (2):(1) R1 es un átomo de hidrógeno o alquilo C1-C10;R4 es un átomo de hidrógeno, alquilo C1-C4 opcionalmente sustituido con uno o más sustituyentes Rf, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg, (alquil C1-C6)carbonilo, (aril C6-C10)carbonilo, un grupo -C(O)NR37R38, cicloalquilo C3-C7, o heterocicloalquilo de 5 a 8 miembros; y R5 es un átomo de hidrógeno o alquilo C1-C4; y(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 ; yR4 se define como antes;R3 es alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes Rh o R3 es alquilo C1-C4 sustituido con Re;R37 y R38 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C3 ; cada Rh se selecciona independientemente entre un átomo de halógeno, (alcoxi C1-C4)carbonilo, y un grupo -(O(CH2)a)b-alcoxi C1-C4 , en donde a es un número entero seleccionado entre 2 a 4, y b es un número entero seleccionado entre 1 y 4;Re es arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Ra, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes Ra;cada Rf se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, carboxi, (alcoxi C1-C6)carbonilo, alcoxi C1-C6 y arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes Rg;cada Rg se selecciona independientemente entre un átomo de halógeno, alquilo C1-C6 , alquinilo C2-C6 y alcoxi C1-C6 , en donde los grupos alquilo, alquinilo y alcoxi están cada uno opcionalmente sustituidos con uno o más sustituyentes seleccionados entre hidroxi y ciano;cada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 10 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente susituido con alcoxi C1-C4), alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, un grupo -(O(CH2)q1)q2-NR41R42 (en donde q1 es un número entero seleccionado entre 1 y 4, y q2 es un número entero seleccionado entre 2 a 6), un grupo -(O(CH2)r1)r2-C(O)NR43R44 (en donde r1 es un número entero seleccionado entre 1 y 4, y r2 es un número entero seleccionado entre 1 y 4), un grupo -(O(CH2)s1)s2-NR45-C(O)R46 (en donde s1 y s2 son cada uno independientemente un número entero seleccionado entre 2 a 4), un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, y un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52 (en donde r1 es un número entero seleccionado entre 1 y 4, y r2 es un número entero seleccionado entre 1 y 4);R10, R11, R12, R13 y R15 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)alcoxi C1-C6 , (alcoxi C1-C4)carbonilo, un grupo -(O(CH2)o)pOH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 3 a 10 miembros, heteroarilo de 5 a 10 miembros y un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 10 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (en donde el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4 , (alcoxi C1-C4)carbonilo, (alquil C1 C4)tio, morfolino, (alquil Ci-C3)sulfonilo y -C(O)NR53R54;Ar1 es arilo C6-C10 o heteroarilo de 5 a 10 miembros, en donde cada uno de los grupos arilo y heteroarilo está opcionalmente sustituido con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;Rb, Rc y Rd se seleccionan cada uno independientemente entre alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 , un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, un grupo -SF5, ciano, hidroxi, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14;cada R14 se selecciona independientemente entre un átomo de halógeno, oxo, ciano, nitro, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, (alcoxi C1-C6)carbonilo, un grupo -NR27R28, un grupo -SO2NR35R36, (alquil C1-C4)tio y heterocicloalquilo de 5 a 10 miembros;R27 y R28 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 opcionalmente sustituido con (alcoxi C1-C4)carbonilo;R35 y R36 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 ;R39 es un átomo de hidrógeno, u alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6 ;R40 es un átomo de hidrógeno, alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6 , ((alcoxi C1-C4)carbonil)alquilo C1-C6 , alquilo C1-C6 sustituido con hidroxilo, un grupo -(CH2)u-NR55R56 (en donde u es un número entero seleccionado entre 1 y 4), un grupo -CH((CH2)v1COOR57)-(CH2)v2-COOR57 (en donde v1 es un número entero seleccionado entre 0 y 2, y v2 es un número entero seleccionado entre 1 y 3), un grupo -(CH2VSO 3H (en donde w es un número entero seleccionado entre 1 y 4), un grupo -(CH2)x1-CH(COOH)-(CH2)x2-SO3H (en donde x1 es un número entero seleccionado entre 0 y 2, y x2 es un número entero seleccionado entre 1 y 3), oxacicloalquilo de 3 a 6 miembros, o un grupo -(CH2)t1-O-(CH2)t2-C(O)NR58R59 (en donde t1 y t2 son cada uno independientemente un número entero seleccionado entre 1 y 3);R41 es un átomo de hidrógeno o alquilo C1-C3;R42 es alquilo C1-C8 sustituido con uno o más grupos hidroxi, o (alcoxi C1-C3)alquilo C1-C4;R43 es un átomo de hidrógeno o alquilo C1-C3;R44 es alquilo C1-C8 sustituido con uno o más grupos hidroxi, oR43 y R44 junto con el átomo de nitrógeno al que están anclados pueden formar morfolino;R45 es un átomo de hidrógeno o alquilo C1-C3;R46 es alquilo C1-C6 sustituido con uno o más grupos hidroxi;R47 es alquilo C1-C3;R48 es (alcoxi C1-C3)alquilo C1-C4 ;R49 es un átomo de hidrógeno y alquilo C1-C4 ;R50 es -(CH2)z-NR60R61 (z es un número entero seleccionado entre 1 y 4, R60 es un átomo de hidrógeno o alquilo C1-C4 y R61 es (alcoxi C1-C3)alquilo C1-C4 o R60 y R61 junto con el átomo de nitrógeno al que están anclados pueden formar morfolino);R51 es un átomo de hidrógeno o alquilo C1-C4;R52 es alquilo C1-C8 sustituido con uno o más grupos hidroxi;R53 y R54 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C4 ;R55 es un átomo de hidrógeno o alquilo C1-C4;R56 es (alquil C1-C4)carbonilo;R57 es un átomo de hidrógeno o alquilo C1-C4;R58 es un átomo de hidrógeno o alquilo C1-C3; yR59 es alquilo C1-C8 sustituido con uno o más grupos hidroxi.2. El compuesto de acuerdo con la reivindicación 1 o una sal del mismo, o un solvato del compuesto o la sal, en dondecada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;R10, R11, R12, R13 y R15 se seleccionan cada uno independientemente entre un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)carbonilo, un grupo -(O(CH2)o)p-OH (en donde o y p son cada uno independientemente un número entero seleccionado entre 2 a 4), cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, heterocicloalquilo de 3 a 10 miembros, heteroarilo de 5 a 10 miembros y un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 10 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno y alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi); yR39 y R40 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6.3. El compuesto de acuerdo con la reivindicación 1 o 2, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRb es alcoxi C1-C5 opcionalmente sustituido con alcoxi C1-C4 o un átomo de halógeno;Rc es un átomo de halógeno, alquilo C1-C10 opcionalmente sustituido con uno o más átomos de halógeno, o un grupo -SF5 ; yRd es ciano, hidroxi, un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, heterocicloalquilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14, arilo C6-C10 opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 a 10 miembros opcionalmente sustituido con uno o más sustituyentes R14.4. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 3, o una sal del mismo, o un solvato del compuesto o la sal, en dondecada Ra se selecciona independientemente entre un átomo de halógeno, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 6 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente susituido con alcoxi C1-C4), alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R6 *10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, un grupo -(O(CH2)q1)q2-NR41R42, un grupo -(O(C) H2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, y un grupo -(O(CH2)y1 )y2-O-CH2-NR51 R52;R10 es carboxi, heterocicloalquilo de 3 a 6 miembros, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, o un grupo -(O(CH2)o)p-OH;R11 es hidroxi, carboxi, heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH, cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi, o un grupo -NR39R40;R12 es un átomo de halógeno, hidroxi, carboxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C4)alcoxi C1-C6 , (alcoxi C1-C3)carbonilo, heterocicloalquilo de 3 a 6 miembros, heteroarilo de 5 o 6 miembros, o un grupo -NR39R40, en donde el grupo heterocicloalquilo de 3 a 6 miembros está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (en donde el grupo alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (en donde el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4, (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolino, (alquil C1-C3)sulfonilo y -C(O)NR53R54;R13 es heterocicloalquilo de 5 o 6 miembros; yo y p son cada uno independientemente un número entero seleccionado entre 2 a 4.5. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 4, o una sal del mismo, o un solvato del compuesto o la sal, en dondecada Ra se selecciona independientemente entre un átomo de halógeno, nitro, ciano, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 3 a 6 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, y (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13;cada R10 se selecciona independientemente entre carboxi, heterocicloalquilo de 3 a 6 miembros, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, y un grupo -(O(CH2)o)p-OH;cada R11 se selecciona independientemente entre hidroxi, carboxi, heterocicloalquilo de 5 o 6 miembros opcionalmente sustituido con uno o más grupos oxo, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, un grupo -(O(CH2)o)p-OH y cicloalquilo C3-C6 opcionalmente sustituido con uno o más grupos hidroxi;cada R12 se selecciona independientemente entre un átomo de halógeno, hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3)carbonilo, heterocicloalquilo de 3 a 6 miembros, heteroarilo de 5 o 6 miembros y un grupo -NR39R40;R13 es heterocicloalquilo de 5 o 6 miembros; yo y p son cada uno independientemente un número entero seleccionado entre 2 a 4.6. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 4, o una sal del mismo, o un solvato del compuesto o la sal, en dondecada Ra se selecciona entre un átomo de halógeno, hidroxi, nitro, ciano, alquilo C1-C6 , (carboxi)alquilo C1-C8, (morfolino)alquilo C1-C4 , [HO-((CH2)oO)p]alquilo C1-C6 , (alcoxi C1-C6)alquilo C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , alcoxi C1-C6 sustituido con uno o más grupos hidroxi, ((alcoxi C1 C3)carbonil)alcoxi C1-C3 , (alcoxi Ci-C6)alcoxi Ci-Cs opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi Ci-C3(alcoxi Ci-C4))alcoxi C1-C4, (carboxi)alcoxi Ci-Cs, (heterocicloalquil de 3 a 6 miembros)alcoxi C1-C6 (el radical heterocicloalquilo está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (el alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi Ci-C4)alquilo C1-C4 (el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxilo), alcoxi C1-C4 , (alcoxi Ci-C4)carbonilo, (alquil Ci-C4)tio, morfolino, (alquil Ci-C3)sulfonilo y (di(alquil Ci-C3)amino)carbonilo), alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)viCOOR57)-(CH2)v2-COOR57, [N-(oxacicloalquil de 3 a 6 miembros)-N-(alquil Ci-C3)amino]alcoxi C1-C4 , [N,N-di((hidroxi)alquil Ci-C4)-amino]alcoxi C1-C4 , [N-((alcoxi Ci-C3)carbonil)alquil C1-C3-N-(alquil Ci-C3)amino]alcoxi C1-C4 (piridinil)alcoxi Ci-C4(pirimidinil)alcoxi C1-C4 , (1,2,4-triazolil)alcoxi C1-C4, [N-(hidroxi)alquil Ci-C4-N-(alquil Ci-C3)amino]alcoxi C1-C4, [N,N-di((alcoxi Ci-C3)alquil Ci-C4)amino]alcoxi C1-C6 , [N,N-di(alquil C1-C3 )amino]alcoxi C1-C6, [N-[N-(alquil C1-C4)carbonil-N-(alquil C1-C3 )amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N-[N-(alquil Ci-C4)carbonil-amino] Ci-4alquil-N-(alquil Ci-C3)amino]alcoxi C1-C4 , un grupo -(O(CH2)ri)r2-C(O)NR43R44, un grupo -(O(CH2)qi)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)w-SO3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)xi-CH(COOH)-(CH2)x2-SO3H, un grupo -(O(CH2)si)s2-NR45-C(O)R46, un grupo -C(O)NR47R4S, piridinilo, un grupo -NR49R50, un grupo -(O(CH2)yi)y2-O-CH2-C(O)NR51R52, (carboxi)alquinilo C2-C6, (heterocicloalquilo de 3 a 6 miembros)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos oxo, alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8 , (alcoxi Ci-C6)alquinilo C2-Cs opcionalmente sustituido con uno o más grupos hidroxi, (cicloalquil C3-C6)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos hidroxi, [N-((alcoxi Ci-C3)alquil Ci-C4)-N-(alquil Ci-C3)amino]alquinilo C2-C6, (alcoxi Ci-C3)carbonilo, (morfolino)(alquil Ci-C4)tio opcionalmente sustituido con uno o más grupos oxo, oxacicloalquiloxi de 3 a 6 miembros y heterocicloalquiloxi que contiene nitrógeno de 4 a 6 miembros (el radical heterocicloalquilo que contiene nitrógeno está opcionalmente sustituido con un sustituyente seleccionado entre (alcoxi Ci-C3)alquilo C1-C4 y alquilo C1-C3)).7. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 6, o una sal del mismo, o un solvato del compuesto o la sal, en dondecada Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, alquilo C1-C6, (carboxi)alquilo Ci-Cs, (morfolino)alquilo C1-C4 , (alcoxi Ci-C6)alquilo Ci-Cs sustituido con uno o más grupos hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi Ci-C3)alquil Ci-C4)-N-(alquil Ci-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6 (el radical morfolino puede estar sustituido con uno o dos sustituyentes seleccionados entre oxo y alquilo C1-C3), (alcoxi Ci-C6)alcoxi Ci-Cs opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi Ci-C3(alcoxi Ci-C4))alcoxi C1-C4 , (carboxi)alcoxi Ci-Cs (pirrolidinil)alcoxi C1-C4 (el radical pirrolidinilo está opcionalmente sustituido con (alquil Ci-C3)alcoxi C1-C4), alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)vi-COOR57)-(CH2)v2-COOR57, [N-(oxetanil)-N-(alquil Ci-C3)amino]alcoxi C1-C4 , [N,N-di(alquil Ci-C3)amino]alcoxi C1-C6 , un grupo -(O(CH2)ri)r2-C(O)NR43R44, un grupo -(O(CH2)qi)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)w-sO3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)xi-CH(COOH)-(CH2)x2-SO3H, (carboxi)alquinilo C2-C6 , (morfolino)alquinilo C2-C6, alquinilo C2-Cs opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-Cs, (alcoxi Ci-C6)alquinilo C2-Cs sustituido con uno o más grupos hidroxi, y (alcoxi Ci-C3)carbonilo.s. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 7, o una sal del mismo, o un solvato del compuesto o la sal, en donde Ra se selecciona independientemente entre un átomo de halógeno, hidroxi, ciano, alquilo C1-C3, (carboxi)alquilo Ci-Cs, (alcoxi Ci-C6)alquilo Ci-Cs sustituido con uno o más grupos hidroxi, alcoxi C1-C3 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi Ci-C3)alquil Ci-C4)-N-(alquil Ci-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6, (alcoxi Ci-C6)alcoxi Ci-Cs sustituido con uno o más grupos hidroxi, (carboxi)alquinilo C2-C6 , (morfolino)alquinilo C2-C6, alquinilo C2-Cs opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-Cs, (alcoxi Ci-C6)alquinilo C2-Cs sustituido con uno o más grupos hidroxi, y (alcoxi Ci-C3)carbonilo.9. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a s, o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es metilo sustituido con Re.10. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a s o una sal del mismo, o un solvato del compuesto o la sal, en donde R3 es bencilo opcionalmente sustituido con uno a tres sustituyentes Ra en el anillo de benceno.11. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 5, 9 y 10, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRe es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;Ri es un átomo de halógeno o alcoxi C1-C3 ;Rj es un átomo de halógeno, nitro o ciano; yRk es hidroxi, un átomo de halógeno, (alcoxi Ci-C4)carbonilo, heterocicloalquiloxi de 5 a 10 miembros (el grupo heterocicloalquiloxi está opcionalmente sustituido con alquilo C1-C4 opcionalmente susituido con alcoxi C1-C4), alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R145, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12, (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13, un grupo -(O(CH2)q1)q2-NR41R42, un grupo -(O(CH2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, pirrolilo, un grupo -NR49R50, o un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R5212. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 5, y 9 a 11, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRe es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;Ri es un átomo de halógeno o alcoxi C1-C3 ;Rj es un átomo de halógeno, nitro o ciano; yRk es hidroxi, un átomo de halógeno, (alcoxi C1-C4)carbonilo, heterocicloalquiloxi de 5 a 10 miembros, alquilo C1-C10 opcionalmente sustituido con uno o más sustituyentes R10, alquenilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R15, alquinilo C2-C10 opcionalmente sustituido con uno o más sustituyentes R11, alcoxi C1-C8 opcionalmente sustituido con uno o más sustituyentes R12 o (alquil C1-C4)tio opcionalmente sustituido con uno o más sustituyentes R13.13. El compuesto de acuerdo con la reivindicación 11, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRk es un átomo de halógeno, hidroxi, alquilo C1-C6 , (carboxi)alquilo C1-C8 , (morfolino)alquilo C1-C4 , [HO-((CH2)oO)p]alquilo C1-C6 , (alcoxi C1-C6)alquilo C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , alcoxi C1-C6 sustituido con uno o más grupos hidroxi, ((alcoxi C1-C3)carbonil)alcoxi C1-C3, (alcoxi C1-C6)alcoxi C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3(alcoxi C1-C4))alcoxi C1-C4, (carboxi)alcoxi C1-C8 , (heterocicloalquil de 3 a 6 miembros)alcoxi C1-C6 (el radical heterocicloalquilo contiene uno a tres heteroátomos seleccionados entre O y N y está opcionalmente sustituido con uno o más sustituyentes seleccionados entre oxo, un átomo de halógeno, alquilo C1-C4 (el alquilo está opcionalmente sustituido con uno o más grupos hidroxi), (alcoxi C1-C4)alquilo C1-C4 (el radical alcoxi está opcionalmente sustituido con uno o más grupos hidroxi), alcoxi C1-C4 , (alcoxi C1-C4)carbonilo, (alquil C1-C4)tio, morfolino, (alquil C1-C3)sulfonilo y (di(alquil C1-C3)amino)carbonilo, alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(oxacicloalquil de 3 a 6 miembros)-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di((hidroxi)alquil C1-C4)-amino]alcoxi C1-C4, (N-((alcoxi C1-C3)carbonil)alquil C1-C3-N-(alquil C1-C3)amino]alcoxi C1-C4 (piridinil)alcoxi C1-C4(pirimidinil)alcoxi C1-C4, (1,2,4-triazolil)alcoxi C1-C4, [N-(hidroxi)alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4 , [N,N-di(alcoxi C1-C3(alquil C1-C3))amino]alcoxi C1-C6 , [N,N-di(alquil C1-C3)amino]alcoxi C1-C6 , [N-[N-(alquil C1-C4)carbonil-N-(alquil C1-C3)amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, [N-[N-(alquil C1-C4)carbonil-amino]alquil C1-C4-N-(alquil C1-C3)amino]alcoxi C1-C4, un grupo -(O(CH2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)q1)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)w-SO3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, un grupo -(O(CH2)s1)s2-NR45-C(O)R46, un grupo -C(O)NR47R48, piridinilo, un grupo -NR49R50, un grupo -(O(CH2)y1)y2-O-CH2-C(O)NR51R52, (carboxi) alquinilo C2-C8, (heterocicloalquilo de 3 a 6 miembros)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos oxo, alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8 , (alcoxi C1-C6)alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, (cicloalquil C3-C6)alquinilo C2-C6 opcionalmente sustituido con uno o más grupos hidroxi, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alquinilo C2-C6 , (alcoxi C1-C3)carbonilo, (morfolino)(alquil C1-C4)tio, oxacicloalquiloxi de 3 a 6 miembros o heterocicloalquiloxi que contiene nitrógeno de 3 a 6 miembros (el radical heterocicloalquilo está opcionalmente sustituido con un sustituyente seleccionado entre (alcoxi C1-C3)alquilo C1-C4 y alquilo C1-C3).14. El compuesto de acuerdo con la reivindicación 11 o 13, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRk es hidroxi, un átomo de halógeno, alquilo C1-C6, (carboxi)alquilo C1-C8, (morfolino)alquilo C1-C4, (alcoxi C1-C6)alquilo C1-C8 sustituido con uno o más grupos hidroxi, alcoxi C1-C6 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6 , (alcoxi C1-C6)alcoxi C1-C8 opcionalmente sustituido con uno o más grupos hidroxi, (alcoxi C1-C3(alcoxi C1-C4))alcoxi C1-C4, (carboxi)alcoxi C1-C8 (pirrolidinil)alcoxi C1-C4 (el radical pirrolidinilo está sustituido con (alquil C1-C3)alcoxi C1-C4), alcoxi C1-C4 sustituido con un grupo -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(oxetanil)-N-(alquil C1-C3)amino]alcoxi C1-C4, [N,N-di(alquil C1-C3)amino]alcoxi C1-C6 , un grupo -(O(CH2)r1)r2-C(O)NR43R44, un grupo -(O(CH2)q1)q2-NR41R42, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)w-SO3H, alcoxi C1-C4 sustituido con un grupo -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, (carboxi) alquinilo C2-C8 , (morfolino)alquinilo C2-C6 , alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8 , (alcoxi C1-C6)alquinilo C2-C8 sustituido con uno o más grupos hidroxi, o (alcoxi Ci-C3)carbonilo.15. El compuesto de acuerdo con una cualquiera de las reivindicaciones 11 a 14, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRk es hidroxi, un átomo de halógeno, alquilo C1-C6 , (carboxi)alquilo C1-C8 , (alcoxi C1-C6)alquilo C1-C8 sustituido con uno o más grupos hidroxi, alcoxi C1-C3 opcionalmente sustituido con uno o más átomos de halógeno, [N-((alcoxi C1-C3)alquil C1-C4)-N-(alquil C1-C3)amino]alcoxi C1-C4 , (morfolino)alcoxi C1-C6 , (alcoxi C1-C6)alcoxi C1-C8 sustituido con uno o más grupos hidroxi, (carboxi) alquinilo C2-C8 , (morfolino)alquinilo C2-C6 , alquinilo C2-C8 opcionalmente sustituido con uno o más grupos hidroxi, [HO-((CH2)oO)p]alquinilo C2-C8 , (alcoxi C1-C6)alquinilo C2-C8 sustituido con uno o más grupos hidroxi, o (alcoxi C1-C3)carbonilo.16. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 15, o una sal del mismo, o un solvato del compuesto o la sal, en dondeR1, R4 y R5 se definen como en cualquiera de los siguientes apartados (1) y (2):(1) R1 es un átomo de hidrógeno o alquilo C1-C6 ;R4 es alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno o fenilo; y R5 es un átomo de hidrógeno o alquilo C1-C4 ; y(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 ; yR4 se define como antes.17. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1, 2, 4, 6, 7, 9, 10 y 16, o una sal del mismo, o un solvato del compuesto o la sal, en dondeR1, R4 y R5 se definen como en los siguientes apartados (1) o (2):(1) R1 es alquilo C1-C6;R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o fenilo; yR5 es un átomo de hidrógeno o alquilo C1-C4 ; o(2) R1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6; yR4 se define como antes;R3 es alquilo C1-C4 sustituido con Re;Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;cada Ra se selecciona independientemente entre un átomo de halógeno, alquinilo C2-C6 opcionalmente sustituido con R11, y alcoxi C1-C6 opcionalmente sustituido con R12;R11 y R12 se seleccionan cada uno independientemente entre heterocicloalquilo de 5 o 6 miembros y -NR39R40;R39 y R40 se seleccionan cada uno independientemente entre un átomo de hidrógeno y alquilo C1-C6 opcionalmente sustituido con alcoxi C1-C6 ;Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo opcionalmente sustituido con uno o más sustituyentes R14 y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14; ycada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, alcoxi C1-C4, un grupo -SO2NR35R36 (en donde R35 y R36 se seleccionan cada uno independientemente entre alquilo C1-C4) y (alquil C1-C4)tio18. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 17, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRb es un átomo de halógeno;Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y Rd es un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo opcionalmente sustituido con uno o más sustituyentes R14, o heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R1419. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 4, 9, 10 y 16 a 18, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRe es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;R11 y R12 se seleccionan cada uno independientemente entre morfolinilo y un grupo -NR39R40;R4 es alquilo C1-C4 opcionalmente sustituido con un átomo de halógeno o fenilo;Ar1 es fenilo, piridinilo o pirimidinilo, en donde los grupos fenilo, piridinilo y pirimidinilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;Rb es un átomo de halógeno;Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y Rd es un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, fenilo, piridinilo o pirimidinilo, en donde los grupos fenilo, piridinilo y pirimidinilo están cada uno opcionalmente sustituidos con uno o más sustituyentes R1420. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 4, 9 a 12 y 16 a 19, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRe es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;Ri es un átomo de halógeno;Rj es un átomo de halógeno; yRk es hidroxi, alquinilo C2-C6 opcionalmente sustituido con un sustituyente R11o alcoxi C1-C6 opcionalmente sustituido con un sustituyente R1221. El compuesto de acuerdo con una cualquiera de las reivindicaciones 17 a 20, o una sal del mismo, o un solvato del compuesto o la sal, en donde R11 y R12 se seleccionan cada uno independientemente entre morfolinilo y [N-((metoxi)etil)-N-(metil)amino].22. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1, 2, 4, 5, 9, 10 y 16, o una sal del mismo, o un solvato del compuesto o la sal, en dondeR1 y R5 junto con el átomo de carbono al que están anclados forman un anillo carbocíclico saturado C3-C6 ; R4 es alquilo C1-C4 ;R3 es alquilo C1-C4 sustituido con Re;Re es fenilo opcionalmente sustituido con uno o más sustituyentes Ra;cada Ra se selecciona independientemente entre un átomo de halógeno y alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12;cada R12 se selecciona independientemente entre heterocicloalquilo de 5 o 6 miembros y -NR39R40;R39 y R40 se seleccionan cada uno independientemente entre un átomo de hidrógeno, y alquilo C1-C4 opcionalmente susituido con alcoxi C1-C4 ;Ar1 es fenilo o heteroarilo de 5 o 6 miembros, en donde los grupos fenilo y heteroarilo están cada uno opcionalmente sustituidos con uno a tres sustituyentes seleccionados entre Rb, Rc y Rd;Rb, Rc y Rd se seleccionan cada uno independientemente entre un átomo de halógeno, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14; ycada R14 se selecciona independientemente entre un átomo de halógeno, ciano, alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno, y (alquil C1-C4)tio23. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 22, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRb es un átomo de halógeno;Rc es un átomo de halógeno o alquilo C1-C4 opcionalmente sustituido con uno o más átomos de halógeno; y Rd es un átomo de halógeno o un heteroarilo de 5 o 6 miembros opcionalmente sustituido con uno o más sustituyentes R14.2424. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 3, 9 a 12, 16, 22 y 23, o una sal del mismo, o un solvato del compuesto o la sal, en dondeRe es fenilo opcionalmente sustituido con uno a tres sustituyentes Ra;los uno a tres sustituyentes Ra son un sustituyente seleccionado entre Ri, Rj y Rk, dos sustituyentes seleccionados entre combinaciones de Ri y Rj, Ri y Rk, y Rj y Rk, o tres sustituyentes Ri, Rj y Rk;Ri y Rj son cada uno independientemente un átomo de halógeno; yRk es alcoxi C1-C4 opcionalmente sustituido con uno o más sustituyentes R12.25. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 5, 9 a 12, 16 a 18, 20 y 22 a 24, o una sal del mismo, o un solvato del compuesto o la sal, en dondeAr1 es fenilo o piridinilo;Rd es piridinilo o pirimidinilo;R12 se selecciona entre morfolinilo, [N-((metoxi)etil)-N-(metil)amino] y [N,N-dimetilamino].26. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 25, o una sal del mismo, o un solvato del compuesto o la sal, en dondeAr1 es 4-(trifluorometil)-2-(6-metiltiopiridin-3-il)fenilo, 4-(trifluorometil)-2-(6-trifluorometilpiridin-3-il)fenilo, 4-(trifluorometil)-2-(4-trifluorometilpirimidin-5-il)fenilo, 4-(trifluorometil)-2-(6-trifluorometilpirimidin-4-il)fenilo, 4-(trifluorometil)-2-(6-ciano-5-metilpirimidin-4-il)fenilo, 4-(trifluorometil)-2-(2-cianopiridin-4-il)fenilo, 4-cloro-2-(6-metiltiopiridin-3-il)fenilo, 4-cloro-2-(6-trifluorometilpiridin-3-ilo)fenilo, 4-cloro-2-(4-trifluorometilpirimidin-5-il)fenilo, 4-cloro-2-(6-ciano-5-metilpirimidin-4-il)fenilo, 4-cloro-2-(6- trifluorometilpirimidin-4-il)fenilo o 4-cloro-2-(2-cianopiridin-4-il)fenilo.27. Un compuesto de acuerdo con la reivindicación 1 seleccionado entre:(3S)-3-terc-butil-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-3H-piridazin-5-carboxamida;(3S)-3-terc-butil-N-[4-cloro-2-[6-(trifluorometil)pirimidin-4-il]fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;(3S)-3-terc-butil-N-[4-cloro-2-[6-(trifluorometil)piridin-3-il]fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;(3S)-3-terc-butil-N-[4-cloro-2-(6-metilsulfanilpiridin-3-il)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;(3S)-3-terc-butil-N-[2-(6-ciano-5-metilpirimidin-4-il)-4-(trifluorometil)fenil]-1-[[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-4-hidroxi-2-metil-6-oxo-3H-piridazin-5-carboxamida;6- [[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida;7- [[2,3-difluoro-4-(2-morfolin-4-iletoxi)fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;6- [[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida;7- [[2,3-difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;ácido 4-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-eno-7-il]metil]fenoxi]butanoico;ácido 5-[2,3-[difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-eno-7-il]metil]fenoxi]pentanoico;ácido 6-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil] carbamoil]-6,7-diazaespiro[4,5]dec-9-eno-7-il)metil) fenoxi]hexanoico;ácido 7-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil] carbamoil]-6,7-diazaespiro[4,5]dec-9-eno-7-il]metil]fenoxi]heptanoico;7-[[2,3-difluoro-4-[2-[(2S)-2-(metoximetil)pirrolidin-1-il]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;ácido (2S)-2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-eno-7-il]metil]fenoxi]etilamino]butanodioico;ácido 3-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil)carbamoil]-6,7-diazaespiro[4,5]dec-9-eno-7-il]metil]fenoxi]etilamino]pentanodioico;6- (2,3-difluoro-4-(2-(metil(oxetan-3-il)amino)etoxi)bencil)-9-hidroxi-5-metil-7-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida;7- [[2,3-difluoro-4-[2-[metil(oxetan-3-il)amino]etoxifenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;7-(2,3-difluoro-4-(2-(metil(oxetan-3-il)amino)etoxi)bencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;7-(4-(3-(dimetilamino)-2,2-dimetilpropoxi)-2,3-difluorobencil)-10-hidroxi-6-metil-8-oxo-N-(4-(trifluorometil)-2-(6-(trifluorometil)pirimidin-4-il)fenil)-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;6-[[2,3-difluoro-4-[1-(2-metoxietil)azetidin-3-il]oxifenil]metil]-9-hidroxi-5-metil-7-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-5,6-diazaespiro[3,5]non-8-eno-8-carboxamida;7-[[2,3-difluoro-4-[4-[metil-[(2S,3R,4R,5R)-2,3,4,5,6-pentahidroxihexil]amino]-4-oxobutoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;7-[[2,3-difluoro-4-[2-[2-[metil-[(2S,3R,4R,5R)-2,3,4,5,6-pentahidroxihexil]amino]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida;7-[[2,3-difluoro-4-[2-[2-[2-[2-[2-metoxietil(metil)amino]etoxi]etoxi]etoxi]etoxi]fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida; ácido 2-[2-[2,3-difiuoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-eno-7-il)metil]fenoxi]etilamino]etanosulfónico; yácido 2-[2-[2,3-difluoro-4-[[10-hidroxi-6-metil-8-oxo-9-[[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]carbamoil]-6,7-diazaespiro[4,5]dec-9-eno-7-il]metil]fenoxi]etilamino]etanosulfónicoo una sal del mismo, o un solvato del compuesto o la sal.28. Un compuesto de acuerdo con la reivindicación 27: 7-[[2,3-Difluoro-4-[2-[2-metoxietil(metil)amino]etoxi]-fenil]metil]-10-hidroxi-6-metil-8-oxo-N-[4-(trifluorometil)-2-[6-(trifluorometil)pirimidin-4-il]fenil]-6,7-diazaespiro[4,5]dec-9-eno-9-carboxamida, o una sal del mismo, o un solvato del compuesto o la sal.29. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 28 o la sal del mismo, o el solvato del compuesto o la sal para uso en la prevención y/o tratamiento de una enfermedad seleccionada entre hiperfosfatemia, hiperparatiroidismo secundario e insuficiencia renal crónica.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2013051082 | 2013-03-13 | ||
| JP2013132889 | 2013-06-25 | ||
| PCT/JP2014/056778 WO2014142273A1 (ja) | 2013-03-13 | 2014-03-13 | ジヒドロピリダジン-3,5-ジオン誘導体 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2811126T3 true ES2811126T3 (es) | 2021-03-10 |
Family
ID=51536921
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES14765619T Active ES2811126T3 (es) | 2013-03-13 | 2014-03-13 | Derivado de dihidropiridazin-3,5-diona |
Country Status (29)
| Country | Link |
|---|---|
| EP (2) | EP2975030B1 (es) |
| JP (2) | JP5814488B2 (es) |
| KR (2) | KR101664460B1 (es) |
| CN (1) | CN105073715B (es) |
| AU (1) | AU2014230552B2 (es) |
| BR (1) | BR112015022092B1 (es) |
| CA (1) | CA2901868C (es) |
| CL (1) | CL2015002543A1 (es) |
| CR (1) | CR20150505A (es) |
| DK (1) | DK2975030T3 (es) |
| ES (1) | ES2811126T3 (es) |
| HR (1) | HRP20201211T1 (es) |
| HU (1) | HUE050577T2 (es) |
| IL (1) | IL240825B (es) |
| LT (1) | LT2975030T (es) |
| MX (1) | MX376532B (es) |
| MY (1) | MY174269A (es) |
| NZ (1) | NZ711182A (es) |
| PE (1) | PE20151535A1 (es) |
| PH (1) | PH12015501940A1 (es) |
| PL (1) | PL2975030T3 (es) |
| PT (1) | PT2975030T (es) |
| RS (1) | RS60911B1 (es) |
| RU (1) | RU2662832C2 (es) |
| SG (1) | SG11201507345RA (es) |
| SI (1) | SI2975030T1 (es) |
| TW (2) | TWI596095B (es) |
| UA (1) | UA118755C2 (es) |
| WO (1) | WO2014142273A1 (es) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SI2975030T1 (sl) * | 2013-03-13 | 2020-10-30 | Chugai Seiyaku Kabushiki Kaisha | Derivat dihidropiridazin-3,5-diona |
| WO2016039458A1 (ja) * | 2014-09-12 | 2016-03-17 | 中外製薬株式会社 | ナトリウム依存性リン酸トランスポーター阻害剤を含有する医薬 |
| WO2018019721A1 (en) | 2016-07-26 | 2018-02-01 | Basf Se | Herbicidal pyridine compounds |
| WO2018019755A1 (en) | 2016-07-26 | 2018-02-01 | Basf Se | Herbicidal pyridine compounds |
| CN110885290A (zh) * | 2019-12-16 | 2020-03-17 | 阿里生物新材料(常州)有限公司 | 一种3-氟-2-甲基-4-三氟甲基苯胺盐酸盐的合成方法 |
| AU2021296100A1 (en) * | 2020-06-26 | 2023-02-16 | Nihon Nohyaku Co., Ltd. | Aryltetrahydropyridazine derivative or salt thereof, insecticidal agent containing the compound, and method of use thereof |
| WO2022221182A1 (en) * | 2021-04-12 | 2022-10-20 | Jnana Therapeutics Inc. | Small molecule inhibitors of mammalian slc34a1 function |
| AR126060A1 (es) * | 2021-06-08 | 2023-09-06 | Chugai Pharmaceutical Co Ltd | Método para producir derivado de dihidropiridazin-3,5-diona |
| BR112023023708A2 (pt) * | 2021-06-08 | 2024-01-30 | Chugai Pharmaceutical Co Ltd | Formulação contendo derivado de di-hidropiridazino-3,5-diona |
| AU2022427156B2 (en) | 2021-12-28 | 2025-12-11 | Nihon Nohyaku Co., Ltd. | Aryltetrahydropyridazine derivative or salt thereof and insecticidal agent containing the compound and method for using same |
| US20250302833A1 (en) | 2022-05-11 | 2025-10-02 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition for treating or preventing cystic disease |
| CN116217862A (zh) * | 2023-03-21 | 2023-06-06 | 中国农业科学院农业环境与可持续发展研究所 | 一种可降解生物膜助剂的制备方法 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR100663147B1 (ko) * | 2002-02-19 | 2007-02-28 | 오노 야꾸힝 고교 가부시키가이샤 | 축합 피리다진 유도체 화합물 및 이를 유효 성분으로서함유하는 약제 |
| CN1662529A (zh) * | 2002-06-19 | 2005-08-31 | 默克专利有限公司 | 作为磷酸二酯酶iv抑制剂的噻唑衍生物 |
| KR20080019236A (ko) * | 2005-05-18 | 2008-03-03 | 어레이 바이오파마 인크. | Mek의 헤테로시클릭 억제제 및 그의 사용 방법 |
| GB0610680D0 (en) * | 2006-05-31 | 2006-07-12 | Istituto Di Ricerche D Biolog | Therapeutic compounds |
| EA017900B1 (ru) * | 2006-11-03 | 2013-04-30 | Басф Се | Способ получения дифторметилпиразолилкарбоксилатов |
| TW201006821A (en) * | 2008-07-16 | 2010-02-16 | Bristol Myers Squibb Co | Pyridone and pyridazone analogues as GPR119 modulators |
| EP2334682B1 (en) * | 2008-08-20 | 2017-10-04 | Fibrogen, Inc. | Pyrrolo [ 1, 2 -b] pyridazine derivatives and their use as hif modulators |
| WO2011048611A1 (en) * | 2009-10-07 | 2011-04-28 | Torrent Pharmaceuticals Limited | Novel fused pyridazine derivatives |
| MX2012012421A (es) * | 2010-04-28 | 2012-12-17 | Astellas Pharma Inc | Compuestos tetrahidrobenzotiofena. |
| EP2591354B1 (en) | 2010-07-07 | 2016-09-07 | Ardelyx, Inc. | Compounds and methods for inhibiting phosphate transport |
| WO2012006474A2 (en) * | 2010-07-07 | 2012-01-12 | Ardelyx, Inc. | Compounds and methods for inhibiting phosphate transport |
| JP2013107880A (ja) | 2011-10-27 | 2013-06-06 | Astellas Pharma Inc | N−チエニルベンズアミド誘導体 |
| SI2975030T1 (sl) * | 2013-03-13 | 2020-10-30 | Chugai Seiyaku Kabushiki Kaisha | Derivat dihidropiridazin-3,5-diona |
-
2014
- 2014-03-13 SI SI201431629T patent/SI2975030T1/sl unknown
- 2014-03-13 CN CN201480013485.6A patent/CN105073715B/zh active Active
- 2014-03-13 HR HRP20201211TT patent/HRP20201211T1/hr unknown
- 2014-03-13 NZ NZ711182A patent/NZ711182A/en unknown
- 2014-03-13 WO PCT/JP2014/056778 patent/WO2014142273A1/ja not_active Ceased
- 2014-03-13 KR KR1020157029079A patent/KR101664460B1/ko active Active
- 2014-03-13 RU RU2015143507A patent/RU2662832C2/ru active
- 2014-03-13 UA UAA201509770A patent/UA118755C2/uk unknown
- 2014-03-13 EP EP14765619.3A patent/EP2975030B1/en active Active
- 2014-03-13 LT LTEP14765619.3T patent/LT2975030T/lt unknown
- 2014-03-13 MY MYPI2015703054A patent/MY174269A/en unknown
- 2014-03-13 PL PL14765619T patent/PL2975030T3/pl unknown
- 2014-03-13 KR KR1020167027514A patent/KR102072268B1/ko active Active
- 2014-03-13 EP EP20185235.7A patent/EP3757093A1/en active Pending
- 2014-03-13 SG SG11201507345RA patent/SG11201507345RA/en unknown
- 2014-03-13 BR BR112015022092-4A patent/BR112015022092B1/pt active IP Right Grant
- 2014-03-13 MX MX2015012537A patent/MX376532B/es active IP Right Grant
- 2014-03-13 PE PE2015001917A patent/PE20151535A1/es unknown
- 2014-03-13 TW TW103109058A patent/TWI596095B/zh active
- 2014-03-13 TW TW106123450A patent/TWI683811B/zh active
- 2014-03-13 AU AU2014230552A patent/AU2014230552B2/en active Active
- 2014-03-13 JP JP2015505576A patent/JP5814488B2/ja active Active
- 2014-03-13 RS RS20201171A patent/RS60911B1/sr unknown
- 2014-03-13 DK DK14765619.3T patent/DK2975030T3/da active
- 2014-03-13 CA CA2901868A patent/CA2901868C/en active Active
- 2014-03-13 HU HUE14765619A patent/HUE050577T2/hu unknown
- 2014-03-13 ES ES14765619T patent/ES2811126T3/es active Active
- 2014-03-13 PT PT147656193T patent/PT2975030T/pt unknown
-
2015
- 2015-08-25 IL IL240825A patent/IL240825B/en active IP Right Grant
- 2015-09-03 PH PH12015501940A patent/PH12015501940A1/en unknown
- 2015-09-09 CL CL2015002543A patent/CL2015002543A1/es unknown
- 2015-09-16 JP JP2015182722A patent/JP6420738B2/ja active Active
- 2015-09-22 CR CR20150505A patent/CR20150505A/es unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2811126T3 (es) | Derivado de dihidropiridazin-3,5-diona | |
| ES2898069T3 (es) | Derivados de N-(piridin-2-il)piridinosulfonamida y su uso en el tratamiento de la enfermedad | |
| BR112021009880A2 (pt) | pirimidina e derivado de heterociclo de nitrogênio de cinco membros, método de preparação para os mesmos e usos médicos dos mesmos | |
| ES2975807T3 (es) | Compuesto farmacéutico que contiene inhibidor del transportador de fosfato dependiente de sodio y adsorbente de fósforo para uso en la prevención, tratamiento o supresión de enfermedad renal crónica, arteriosclerosis asociada con calcificación vascular o calcificación ectópica | |
| US9499553B2 (en) | Dihydropyridazine-3,5-dione derivative and pharmaceuticals containing the same | |
| RU2811864C1 (ru) | Фармацевтическое средство, содержащее ингибитор натрийзависимого переносчика фосфата | |
| HK1212700B (en) | Dihydropyridazine-3,5-dione derivative | |
| HK1235279A1 (en) | Pharmaceutical containing sodium-dependent phosphate transporter inhibitor |