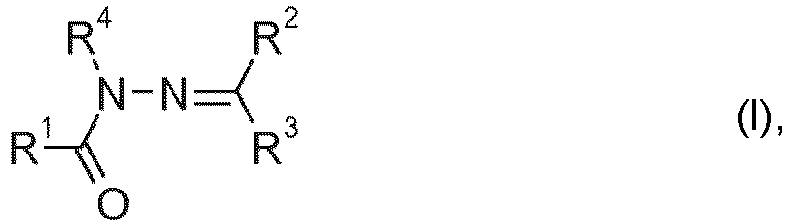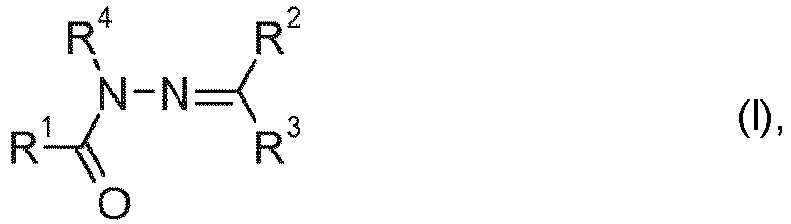EP3143115B2 - Wasch- und reinigungsmittel mit erhöhter bleichleistung - Google Patents
Wasch- und reinigungsmittel mit erhöhter bleichleistung Download PDFInfo
- Publication number
- EP3143115B2 EP3143115B2 EP15720976.8A EP15720976A EP3143115B2 EP 3143115 B2 EP3143115 B2 EP 3143115B2 EP 15720976 A EP15720976 A EP 15720976A EP 3143115 B2 EP3143115 B2 EP 3143115B2
- Authority
- EP
- European Patent Office
- Prior art keywords
- amino acid
- alkyl
- seq
- acid sequence
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/16—Organic compounds
- C11D3/38—Products with no well-defined composition, e.g. natural products
- C11D3/386—Preparations containing enzymes, e.g. protease or amylase
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/39—Organic or inorganic per-compounds
- C11D3/3902—Organic or inorganic per-compounds combined with specific additives
- C11D3/3905—Bleach activators or bleach catalysts
- C11D3/3907—Organic compounds
- C11D3/3917—Nitrogen-containing compounds
- C11D3/392—Heterocyclic compounds, e.g. cyclic imides or lactames
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/39—Organic or inorganic per-compounds
- C11D3/3902—Organic or inorganic per-compounds combined with specific additives
- C11D3/3905—Bleach activators or bleach catalysts
- C11D3/3907—Organic compounds
- C11D3/3917—Nitrogen-containing compounds
- C11D3/3927—Quarternary ammonium compounds
Definitions
- the present invention relates to the use of a specific protease for enhancing the bleaching performance of certain acylhydrazones when washing textiles or cleaning hard surfaces, and to washing and cleaning agents which contain such a protease and such acylhydrazone.
- the acylhydrazones may exist in E or Z configuration; when R 2 is hydrogen, the compound of general formula (I) may exist in one of its tautomeric forms or as a mixture thereof.
- R 2 is preferably hydrogen.
- R 1 and/or R 3 is preferably a methyl, phenyl or naphthyl group substituted by an electron-withdrawing group.
- R 4 is preferably hydrogen.
- the electron-withdrawing group is preferably an ammonium group which optionally carries alkyl or hydroxyalkyl groups or, including the N atom carrying an alkyl group, as optionally carrying further heterocycloalkyl groups.
- the anion A - is preferably carboxylate such as lactate, citrate, tartrate or succinate, perchlorate, tetrafluoroborate, hexafluorophosphate, alkylsulfonate, alkyl sulfate, hydrogen sulfate, sulfate, dihydrogen phosphate, hydrogen phosphate, phosphate, isocyanate, thiocyanate, nitrate, fluoride, chloride, bromide, hydrogen carbonate or carbonate, whereby in the case of polyvalent anions the charge balance can be achieved by the presence of additional cations such as sodium or ammonium ions.
- carboxylate such as lactate, citrate, tartrate or succinate, perchlorate, tetrafluoroborate, hexafluorophosphate, alkylsulfonate, alkyl sulfate, hydrogen sulfate, sulfate, dihydrogen phosphate, hydrogen phosphate, phosphate
- proteases are enzymes which catalyze the hydrolysis of amide bonds in protein substrates.
- the protease used according to the invention preferably has the amino acid V at position 193 in the numbering according to SEQ ID NO:1 and the amino acid L at position 211, or it has the amino acid R at position 9 in the numbering according to SEQ ID NO:2, the amino acid T at position 15, the amino acid A at position 66, the amino acid D at position 212 and/or the amino acid R at position 239, whereby several, for example 2, 3, 4 or 5, such proteases can also be used.
- those of the subtilisin type can also be used.
- subtilisins BPN' and Carlsberg examples of these are the subtilisins BPN' and Carlsberg, the protease PB92, the subtilisins 147 and 309, the alkaline protease from Bacillus lentus, subtilisin DY and the enzymes thermitase, proteinase K and the proteases TW3 and TW7, which are classified as subtilases but no longer as subtilisins in the narrower sense.
- Subtilisin Carlsberg is available in a further developed form under the trade name Alcalase ® from Novozymes A/S, Bagsvaerd, Denmark.
- the subtilisins 147 and 309 are sold under the trade names Esperase ® and Savinase ® by Novozymes.
- protease variants known under the name BLAP ® are derived from the protease from Bacillus lentus DSM 5483.
- Other useful proteases are, for example, those sold under the trade names Durazym ® , Relase ® , Everlase ® , Nafizym ® , Natalase ® and Kannase ® by Novozymes, those sold under the trade names Purafect ® , Purafect ® OxP, Purafect ® Prime, Excellase ® and Properase ® by Genencor, those sold under the trade name Biotouch ® ROC 250 L by AB-Enzymes, Darmstadt, those sold under the trade name Protosol ® by Advanced Biochemicals Ltd., Thane, India, those sold under the trade name Wuxi ® by Wuxi Snyder Bioproducts Ltd., China, those sold under the trade names Proleather ® and Protease P ® by Amano Pharmaceuticals Ltd., Nagoya, Japan, those sold
- proteases from Bacillus gibsonii and Bacillus pumilus which are disclosed in the international patent applications WO2008/086916 and WO2007/131656
- the effect of increasing the bleaching performance according to the invention is not observed when using the protease according to SEQ ID NO: 4.
- sequence comparison is based on the BLAST algorithm, which is established in the state of the art and is commonly used (see, for example, Altschul, SF, Gish, W., Miller, W., Myers, EW & Lipman, DJ (1990) "Basic local alignment search tool.” J Mol Biol 215:403-410 , and Altschul, Stephan F., Thomas L. Madden, Alejandro A. Schaffer, Jinghui Zhang, Hheng Zhang, Webb Miller, and David J.
- T-Coffee see for example Notredame et al. (2000): T-Coffee: A novel method for multiple sequence alignments. J. Mol. Biol. 302, 205-217 ) or programs based on these programs or algorithms.
- all sequence comparisons were created using the computer program Vector NTI ® Suite 10.3 (Invitrogen Corporation, 1600 Faraday Avenue, Carlsbad, California, USA) with the specified standard parameters, whose AlignX module for sequence comparisons is based on ClustalW.
- Such a comparison also allows a statement to be made about the similarity of the sequences being compared to one another. This is usually expressed as percent identity, i.e. the proportion of identical nucleotides or amino acid residues at the same positions or positions that correspond to one another in an alignment.
- the broader term homology includes conserved amino acid exchanges in amino acid sequences, i.e. amino acids with similar chemical activity, since these usually perform similar chemical activities within the protein. Therefore, the similarity of the sequences being compared can also be expressed as percent homology or percent similarity. Identity and/or homology statements can be made for entire polypeptides or genes or just for individual regions. Homologous or identical regions of different nucleic acid or amino acid sequences are therefore defined by similarities in the sequences.
- Such regions often have identical functions. They can be small and contain only a few nucleotides or amino acids. Such small regions often perform essential functions for the overall activity of the protein. It can therefore be useful to relate sequence similarities only to individual, possibly small regions. Unless otherwise stated, however, information on identity or homology in the present application refers to the total length of the respective nucleic acid or amino acid sequence indicated.
- the proportion of the protease by weight, based on active protein, in the total weight of washing or cleaning agents according to the invention is preferably 0.005 to 1.0% by weight, in particular 0.01 to 0.5% by weight and particularly preferably 0.02 to 0.2% by weight.
- the protein concentration can be determined using known methods, for example the BCA method (bicinchoninic acid; 2,2'-biquinolyl-4,4'-dicarboxylic acid) or the biuret method ( AG Gornall, CS Bardawill and MM David, J. Biol. Chem., 177 (1948), pp. 751-766 ).
- the active protein concentration was determined by titrating the active centers using a suitable irreversible inhibitor (for proteases, for example, phenylmethylsulfonyl fluoride (PMSF)) and determining the residual activity (cf. M. Bender et al., J. Am. Chem. Soc. 88, 24 (1966), pp. 5890-5913 ).
- a suitable irreversible inhibitor for proteases, for example, phenylmethylsulfonyl fluoride (PMSF)
- the cleaning effects of the protease are retained in the presence of the acylhydrazone present at the same time.
- the cleaning effects of the acylhydrazone are enhanced in the presence of the protease present at the same time if the protease is selected from the above-mentioned enzymes.
- the combined use of such a protease and acylhydrazone also results in a larger number of improved soilings being removed than the sum of improved soilings being removed when using each of the two active ingredients individually, particularly at low washing temperatures of, for example, 40 °C and below, and even at room temperature.
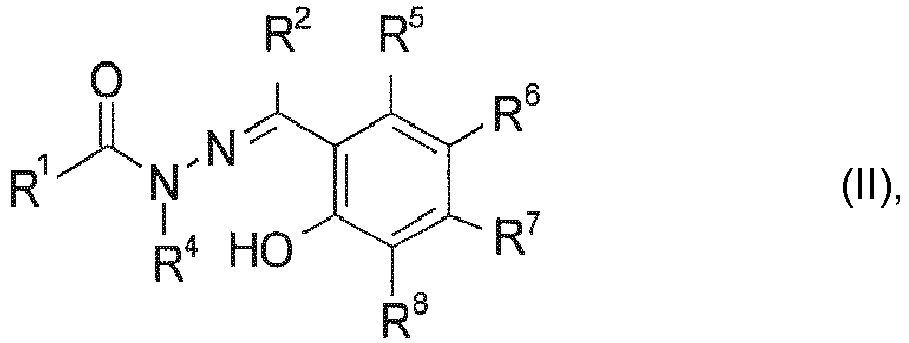
- the performance of compounds of general formula (I) may optionally be enhanced by the presence of Manganese, titanium, cobalt, nickel or copper ions, preferably Mn(II)-(III)-(IV)-(V), Cu(I)-(II)-(III), Fe(I)-(II)-(III)-(IV), Co(I)-(II)-(III), Ni(I)-(II)-(III), Ti(II)-(III)-(IV) and particularly preferably those selected from Mn(II)-(III)-(IV)-(V), Cu(I)-(II)-(III), Fe(I)-(II)-(III)-(IV) and Co(I)-(II)-(III); if desired, the acylhydrazone can also be used in the form of complex compounds of the said metal central atoms with ligands of the general formula (I) and in particular of the general formula (II).
- a bleach-enhancing complex which has a ligand with a framework according to formula (I) can have the corresponding ligand once or multiple times, in particular twice. It can be mono- or optionally di- or polynuclear. It can also have further neutral, anion or cation ligands, such as, for example, H 2 O, NH 3 , CH 3 OH, acetylacetone, terpyridine, organic anions, such as, for example, citrate, oxalate, tartrate, formate, a C 2-18 carboxylate, a C 1-18 alkyl sulfate, in particular methosulfate, or a corresponding alkanesulfonate, inorganic anions, such as, for example, halide, in particular chloride, perchlorate, tetrafluoroborate, hexafluorophosphate, nitrate, hydrogen sulfate, hydroxide or hydroperoxide. It can also have bridging ligands
- the concentration of the compound according to formula (I) in aqueous liquor is 0.5 ⁇ mol/l to 500 ⁇ mol/l, in particular 5 ⁇ mol/l to 100 ⁇ mol/l.
- the above-mentioned complex-forming metal ions are preferably not added intentionally, but they can be present from possible sources of such metal ions, which include in particular tap water, the washing machine itself, adhesions to textiles and soiling on the textiles. Metal ions introduced unintentionally with other detergent ingredients may also be considered.
- Preferred peroxygen concentrations (calculated as H 2 O 2 ) in the liquor are in the range from 0.001 g/l to 10 g/l, in particular from 0.1 g/l to 1 g/l and particularly preferably from 0.2 g/l to 0.5 g/l.
- the use according to the invention is preferably carried out at temperatures in the range from 10 °C to 95 °C, in particular 20 °C to 40 °C and particularly preferably at temperatures below 30 °C.
- the water hardness of the water used to prepare the aqueous liquor is preferably in the range from 0°dH to 21°dH, in particular 0°dH to 3°dH.
- the water hardness is preferably in the range from 0°dH to 16°dH, in particular 0°dH to 3°dH, which can be achieved, for example, by using conventional builder materials or water softeners.
- the use according to the invention is preferably carried out at pH values in the range from pH 5 to pH 12, in particular from pH 7 to pH 11.
- the use according to the invention is preferably carried out in such a way that a peroxygen compound and a detergent which contains an acylhydrazone of the general formula (I) and the above-mentioned protease are allowed to act on a contaminated textile during a machine or hand-washing process.
- the use according to the invention can be implemented particularly easily by using a detergent which contains a peroxygen compound, the above-mentioned protease and a compound of the formula (I) or, if desired, a bleach catalyst which can be obtained from this by complex formation with a transition metal ion mentioned, when washing textiles which require cleaning.
- the peroxygen compound and/or the compound of the formula (I) and/or a complex which can be obtained from this and/or the protease can also be added separately to a washing liquor which contains a detergent without the respective ingredient mentioned.
- a washing liquor which contains a detergent without the respective ingredient mentioned.
- a further subject matter of the invention is therefore a washing or cleaning agent containing a peroxygen-containing bleach, a compound of the formula (I) and a protease selected from a) proteases comprising an amino acid sequence which is at least 98.5% and preferably at least 99% identical to the amino acid sequence given in SEQ ID NO:1 over its entire length and has the amino acid V at position 193 and/or the amino acid L at position 211 in the numbering according to SEQ ID NO:1, b) proteases comprising an amino acid sequence which is at least 70% and increasingly preferably at least 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 90.5%, 91%, 91.5%, 92%, 92.5%, 93%, 93.5%, 94%, 94.5%, 95%, 95.5%, 96%, 96.5%, 97%, 97.5%, 98%, 98.5% and 99% identical and in the number
- lipases or cutinases particularly because of their triglyceride-cleaving activities, but also to produce peracids in situ from suitable precursors.
- lipases or cutinases include, for example, the lipases originally obtained from Humicola lanuginosa (Thermomyces lanuginosus) or further developed lipases, particularly those with the amino acid exchange D96L. Cutinases that were originally isolated from Fusarium solani pisi and Humicola insolens can also be used. Lipases or cutinases whose starting enzymes were originally isolated from Pseudomonas mendocina and Fusarium solanii can also be used.
- oxidoreductases for example oxidases, oxygenases, catalases, peroxidases such as halo-, chloro-, bromo-, lignin-, glucose- or manganese-peroxidases, dioxygenases or laccases (phenol oxidases, polyphenol oxidases) can be used to increase the bleaching effect. It is advantageous to also add organic, particularly aromatic, compounds that interact with the enzymes in order to increase the activity of the oxidoreductases in question (enhancers) or to ensure the flow of electrons when the redox potentials between the oxidizing enzymes and the soiling differ greatly (mediators).
- the cleaning agents according to the invention particularly preferably contain at least one amylase as a further enzyme.
- An amylase is an enzyme as described in the introduction. Synonymous terms can be used for amylases, for example 1,4-alpha-D-glucan glucanohydrolase or glycogenase.
- Amylases preferred according to the invention are ⁇ -amylases. The decisive factor as to whether an enzyme is an ⁇ -amylase within the meaning of the invention is its ability to hydrolyze ⁇ (1-4) glycoside bonds in the amylose of starch.
- amylases are the ⁇ -amylases from Bacillus licheniformis, from Bacillus amyloliquefaciens or from Bacillus stearothermophilus and in particular their further developments which have been improved for use in washing or cleaning agents.
- the enzyme from Bacillus licheniformis is available from Novozymes under the name Termamyl ® and from Danisco/Genencor under the name Purastar ® ST.
- this ⁇ -amylase is available from Novozymes under the trade names Duramyl ® and Termamy ® ultra, from Danisco/Genencor under the name Purastar ® OxAm and from Daiwa Seiko Inc., Tokyo, Japan, as Keistase ® .
- the ⁇ -amylase from Bacillus amyloliquefaciens is sold by the company Novozymes under the name BAN ® , and derived variants of the ⁇ -amylase from Bacillus stearothermophilus under the names BSG ® and Novamyl ® , also by the company Novozymes.
- Other products that are particularly suitable for this purpose are the ⁇ -amylase from Bacillus sp.
- a 7-7 (DSM 12368) and the cyclodextrin glucanotransferase (CGTase) from Bacillus agaradherens (DSM 9948). Fusion products of all of the molecules mentioned can also be used.
- CGTase cyclodextrin glucanotransferase
- DSM 9948 Bacillus agaradherens
- Fusion products of all of the molecules mentioned can also be used.
- the further developments of the ⁇ -amylase from Aspergillus niger and A. oryzae available under the trade name Fungamyl ® from the company Novozymes are suitable.
- Other commercial products that can be used advantageously are, for example, Amylase-LT ® and Stainzyme ® or Stainzyme ultra ® or Stainzyme plus ® , the latter also from the company Novozymes.
- Variants of these enzymes that can be obtained by point mutations can also be used according to the invention.
- Particularly preferred amylases are disclosed in the international publications WO 00/60060 , WO 03/002711 , WO 03/054177 and WO07/079938 .
- preferred cleaning agents are characterized in that at least one enzyme from the group of amylases, cellulases, hemicellulases, mannanases, tannases, xylanases, xanthanases, xyloglucanases, ⁇ -glucosidases, pectinases, carrageenases, perhydrolases, oxidases, oxidoreductases or a lipase, as well as mixtures thereof, preferably from the group of amylases, is used as the additional enzyme.
- the weight proportion of the additional enzymes based on active protein in the total weight of the washing and cleaning agents is preferably 0.0005 to 1.0% by weight, in particular 0.001 to 0.5% by weight and particularly preferably 0.002 to 0.2% by weight.
- Detergents or cleaning agents preferably contain 0.001% by weight to 5% by weight, in particular 0.05% by weight to 0.15% by weight and particularly preferably 0.03% by weight to 0.09% by weight of the compound according to formula (I).
- the agent additionally contains a manganese, titanium, cobalt, nickel or copper salt and/or a manganese, titanium, cobalt, nickel or copper complex without a ligand which corresponds to a compound according to formula (I).
- the molar ratio of the transition metal mentioned or the sum of the transition metals mentioned to the compound according to formula (I) is then preferably in the range from 0.001:1 to 2:1, in particular 0.01:1 to 1:1.
- they contain 0.05% by weight to 1% by weight, in particular 0.1% by weight to 0.5% by weight of bleach-enhancing complex which has a ligand according to formula (I).
- the preferred transition metal is Mn.
- the peroxygen compounds contained in the agents are in particular organic peracids or peracidic salts of organic acids, such as phthalimidopercaproic acid, perbenzoic acid or salts of diperoxododecanedioic acid, other peroxo acids or peroxo acid salts, such as alkali persulfates or peroxodisulfates or caroates, or diacyl peroxides or tetraacyl diperoxides, hydrogen peroxide and substances which release hydrogen peroxide under the washing conditions, such as alkali perborates, alkali percarbonates, alkali persilicates and urea perhydrate.
- organic peracids or peracidic salts of organic acids such as phthalimidopercaproic acid, perbenzoic acid or salts of diperoxododecanedioic acid, other peroxo acids or peroxo acid salts, such as alkali persulfates or peroxodisulf
- Hydrogen peroxide can also be produced with the aid of an enzymatic system, i.e. an oxidase and its substrate.
- an enzymatic system i.e. an oxidase and its substrate.
- solid peroxygen compounds are to be used, these can be used in the form of powders or granules, which can also be coated in a manner known in principle.
- peroxygen compounds are present in the agents in amounts of up to 50 wt.%, in particular from 2 wt.% to 45 wt.% and particularly preferably from 5 wt.% to 20 wt.%.
- a conventional bleach activator is used together with the acyl hydrazone of the general formula (I), the general formula (II) and in particular the formula (III), in particular in the presence of a peroxygen compound which releases H 2 O 2 .
- bleach activators are preferably contained in amounts of up to 10% by weight, in particular from 1.5% by weight to 5% by weight.
- the compound which forms peroxocarboxylic acid under perhydrolysis conditions and the acyl hydrazone are used in molar ratios in the range from 4:1 to 100:1, in particular from 25:1 to 50:1.
- Compounds which can be used as peroxocarboxylic acid-yielding compounds under perhydrolysis conditions are in particular compounds which, under perhydrolysis conditions, yield optionally substituted perbenzoic acid and/or aliphatic peroxocarboxylic acids having 1 to 12 carbon atoms, in particular 2 to 4 carbon atoms, alone or in mixtures.
- Suitable bleach activators are those which carry O- and/or N-acyl groups, in particular of the stated number of carbon atoms, and/or optionally substituted benzoyl groups.
- acylated alkylenediamines in particular tetraacetylethylenediamine (TAED), acylated glycolurils, in particular tetraacetylglycoluril (TAGU), acylated triazine derivatives, in particular 1,5-diacetyl-2,4-dioxohexahydro-1,3,5-triazine (DADHT), N-acylimides, in particular N-nonanoylsuccinimide (NOSI), acylated phenolsulfonates or carboxylates or the sulfonic or carboxylic acids thereof, in particular nonanoyl or isononanoyl or lauroyloxybenzenesulfonate (NOBS or iso-NOBS or LOBS) or decanoyloxybenzoate (DOBA), their formal carbonic acid ester derivatives such as 4-(2-decanoyloxyethoxycarbonyloxy)benz
- bleach-activating compounds such as nitriles from which perimidic acids are formed under perhydrolysis conditions
- nitriles from which perimidic acids are formed under perhydrolysis conditions include in particular aminoacetonitrile derivatives with a quaternized nitrogen atom according to the formula in which R 11 is -H, -CH 3 , a C 2-24 alkyl or alkenyl radical, a substituted C 1-24 alkyl or C 2-24 alkenyl radical with at least one substituent from the group -Cl, -Br, -OH, -NH 2 , -CN and -N (+) -CH 2 -CN, an alkyl or alkenylaryl radical with a C 1-24 alkyl group, or a substituted alkyl or alkenylaryl radical with at least one, preferably two, optionally substituted C 1-24 alkyl group(s) and optionally further substituents on the aromatic ring, R
- the bleach activators may be coated or granulated in a known manner with coating substances, whereby granulated tetraacetylethylenediamine with average grain sizes of 0.01 mm to 0.8 mm, granulated 1,5-diacetyl-2,4-dioxohexahydro-1,3,5-triazine, and/or trialkylammonium acetonitrile in particle form is particularly preferred.
- transition metal complexes can also be used. These are preferably selected from among the cobalt, iron, copper, titanium, vanadium, manganese and ruthenium complexes.
- Both inorganic and organic compounds can be used as ligands in such transition metal complexes, which include, in addition to carboxylates, in particular compounds with primary, secondary and/or tertiary amine and/or alcohol functions, such as pyridine, pyridazine, pyrimidine, pyrazine, imidazole, pyrazole, triazole, 2,2'-bispyridylamine, tris-(2-pyridylmethyl)amine, 1,4,7-triazacyclononane and its substituted derivatives such as 1,4,7-trimethyl-1,4,7-triazacyclononane, 1,5,9-triazacyclododecane and its substituted derivatives such as 1,5,9-trimethyl-1,5,9-tritri
- the inorganic neutral ligands include in particular ammonia and water. If not all coordination sites of the transition metal central atom are occupied by neutral ligands, the complex contains further, preferably anionic and among these in particular mono- or bidentate ligands. These include in particular the halides such as fluoride, chloride, bromide and iodide, and the (NO 2 ) - group, i.e. a nitro ligand or a nitrito ligand.
- the (NO 2 ) - group can also be bound to a transition metal in a chelate-forming manner, or it can bridge two transition metal atoms asymmetrically or ⁇ 1 -O.
- the transition metal complexes can also carry other, usually simpler ligands, in particular mono- or polyvalent anion ligands.
- examples of possible anions are nitrate, acetate, trifluoroacetate, formate, carbonate, citrate, oxalate, perchlorate and complex anions such as hexafluorophosphate.
- the anion ligands are intended to ensure charge balance between the transition metal central atom and the ligand system.
- the presence of oxo ligands, peroxo ligands and imino ligands is also possible. In particular, such ligands can also have a bridging effect, so that polynuclear complexes are formed.
- both metal atoms in the complex do not have to be the same.
- the use of binuclear complexes in which the two central transition metal atoms have different oxidation numbers is also possible. If anion ligands are missing or the presence of anion ligands does not lead to charge equalization in the complex, anionic counterions are present in the transition metal complex compounds to be used according to the invention, which neutralize the cationic transition metal complex.
- anionic counterions include in particular nitrate, hydroxide, hexafluorophosphate, sulfate, chlorate, perchlorate, the halides such as chloride or the anions of carboxylic acids such as formate, acetate, oxalate, benzoate or citrate.
- transition metal complex compounds are Mn(IV) 2 ( ⁇ -O) 3 (1,4,7-trimethyl-1,4,7-triazacyclononane)-di-hexafluorophosphate, [N,N'-bis[(2-hydroxy-5-vinylphenyl)-methylene]-1,2-diaminocyclohexane]-manganese-(III) chloride, [N,N'-bis[(2-hydroxy-5-nitrophenyl)-methylene]-1,2-diaminocyclohexane]-manganese-(III) acetate, [N,N'-bis[(2-hydroxyphenyl)-methylene]-1,2-phenylenediamine]-manganese-(III) acetate, [N,N'-bis[(2-hydroxyphenyl)-methylene]-1,2-diaminocyclohexane]-manganese-(III) chloride, [N ) chloride,
- Detergents containing peroxygen compounds which can be present in particular as powdered solids, in post-compacted particle form, as homogeneous solutions or suspensions, can in principle contain all known ingredients that are customary in such agents, in addition to the combination of protease and compound according to formula (I) to be used according to the invention and optionally the bleach activators and catalysts mentioned.
- the agents can in particular contain builder substances, surface-active surfactants, water-miscible organic solvents, other enzymes, sequestering agents, electrolytes, pH regulators, polymers with special effects, such as soil release polymers, color transfer inhibitors, graying inhibitors, crease-reducing polymeric active ingredients and shape-retaining polymeric active ingredients, and other auxiliary substances, such as optical brighteners, foam regulators, dyes and fragrances.
- an agent can additionally contain common antimicrobial agents, such as alcohols, aldehydes, acids, carboxylic acid esters, acid amides, phenols and phenol derivatives, diphenyls, diphenylalkanes, urea derivatives, O-acetates and O-formals bound to organic frameworks, benzamidines, isothiazolines, phthalimide derivatives, pyridine derivatives, amines, quaternary ammonium compounds, guanidines, amphoteric compounds, quinolines, benzimidazoles, IPBC, dithiocarbamates, metals and metal compounds, such as silver and silver salts, halogens, such as chlorine, iodine and their Compounds, other oxidizing agents and inorganic nitrogen compounds.
- antimicrobial additives are preferably contained in amounts of up to 10% by weight, in particular from 0.01% by weight to 5% by weight, in each case based on the
- the agents can contain one or more surfactants, whereby anionic surfactants, non-ionic surfactants and mixtures thereof are particularly suitable, but cationic and/or amphoteric surfactants can also be included.
- Suitable non-ionic surfactants are in particular alkyl glycosides and ethoxylation and/or propoxylation products of alkyl glycosides or linear or branched alcohols, each with 12 to 18 C atoms in the alkyl part and 3 to 20, preferably 4 to 10 alkyl ether groups.
- Suitable anionic surfactants are in particular soaps and those that contain sulfate or sulfonate groups with preferably alkali ions as cations.
- Soaps that can be used are preferably the alkali salts of saturated or unsaturated fatty acids with 12 to 18 carbon atoms. Such fatty acids can also be used in a form that is not completely neutralized.
- Useful sulfate-type surfactants include the salts of the sulfuric acid semiesters of fatty alcohols with 12 to 18 carbon atoms and the sulfation products of the nonionic surfactants mentioned with a low degree of ethoxylation.
- the sulfonate-type surfactants that can be used include linear alkylbenzenesulfonates with 9 to 14 C atoms in the alkyl part, alkanesulfonates with 12 to 18 C atoms, as well as olefinsulfonates with 12 to 18 C atoms, which are formed during the reaction of corresponding monoolefins with sulfur trioxide, as well as alpha-sulfofatty acid esters, which are formed during the sulfonation of fatty acid methyl or ethyl esters.
- Such surfactants are contained in detergents in amounts of preferably 5% by weight to 50% by weight, in particular 8% by weight to 30% by weight,
- a detergent preferably contains at least one water-soluble and/or water-insoluble, organic and/or inorganic builder.
- the water-soluble organic builder substances include polycarboxylic acids, in particular citric acid and sugar acids, monomeric and polymeric aminopolycarboxylic acids, in particular glycinediacetic acid, methylglycinediacetic acid, nitrilotriacetic acid, iminodisuccinates such as ethylenediamine-N,N'-disuccinic acid and hydroxyiminodisuccinates, ethylenediaminetetraacetic acid and polyaspartic acid, polyphosphonic acids, in particular aminotris(methylenephosphonic acid), ethylenediaminetetrakis(methylenephosphonic acid), lysinetetra(methylenephosphonic acid) and 1-hydroxyethane-1,1-diphosphonic acid, polymeric hydroxy compounds such as dextrin and polymeric (poly)carboxylic acids, in particular polycar
- the relative average molecular mass (here and hereinafter: weight average) of the homopolymers of unsaturated carboxylic acids is generally between 5,000 g/mol and 200,000 g/mol, that of the copolymers between 2,000 g/mol and 200,000 g/mol, preferably 50,000 g/mol to 120,000 g/mol, in each case based on the free acid.
- a particularly preferred acrylic acid-maleic acid copolymer has a relative average molecular mass of 50,000 to 100,000.
- Suitable, although less preferred, compounds of this class are copolymers of acrylic acid or methacrylic acid with vinyl ethers, such as vinyl methyl ethers, vinyl esters, ethylene, propylene and styrene, in which the proportion of acid is at least 50% by weight.
- vinyl ethers such as vinyl methyl ethers, vinyl esters, ethylene, propylene and styrene
- Terpolymers which contain two unsaturated acids and/or their salts as monomers and vinyl alcohol and/or a vinyl alcohol derivative or a carbohydrate as the third monomer can also be used as water-soluble organic builder substances.
- the first acidic monomer or its salt is derived from a monoethylenically unsaturated C 3 -C 8 carboxylic acid and preferably from a C 3 -C 4 monocarboxylic acid, in particular from (meth)acrylic acid.
- the second acidic monomer or its salt can be a derivative of a C 4 -C 8 dicarboxylic acid, with maleic acid being particularly preferred.
- the third monomeric unit is in this case formed from vinyl alcohol and/or preferably an esterified vinyl alcohol.
- Vinyl alcohol derivatives which are an ester of short-chain carboxylic acids, for example of C 1 -C 4 carboxylic acids, with vinyl alcohol are particularly preferred.
- Preferred polymers contain 60% by weight to 95% by weight, in particular 70% by weight to 90% by weight of (meth)acrylic acid or (meth)acrylate, particularly preferably acrylic acid or acrylate, and maleic acid or maleate, as well as 5% by weight to 40% by weight, preferably 10% by weight to 30% by weight, of vinyl alcohol and/or vinyl acetate.
- the second acidic monomer or its salt can also be a derivative of an allylsulfonic acid which is substituted in the 2-position with an alkyl radical, preferably with a C 1 -C 4 alkyl radical, or an aromatic radical which is preferably derived from benzene or benzene derivatives.
- Preferred terpolymers contain 40% by weight to 60% by weight, in particular 45 to 55% by weight of (meth)acrylic acid or (meth)acrylate, particularly preferably acrylic acid or acrylate, 10% by weight to 30% by weight, preferably 15% by weight to 25% by weight Methallylsulfonic acid or methallylsulfonate and as a third monomer 15 wt.% to 40 wt.%, preferably 20 wt.% to 40 wt.% of a carbohydrate.
- This carbohydrate can be, for example, a mono-, di-, oligo- or polysaccharide, with mono-, di- or oligosaccharides being preferred. Sucrose is particularly preferred.
- the use of the third monomer presumably builds predetermined breaking points into the polymer, which are responsible for the good biodegradability of the polymer.
- These terpolymers generally have a relative average molecular mass of between 1,000 g/mol and 200,000 g/mol, preferably between 200 g/mol and 50,000 g/mol.
- Other preferred copolymers are those which have acrolein and acrylic acid/acrylic acid salts or vinyl acetate as monomers.
- the organic builder substances can be used, particularly for the production of liquid agents, in the form of aqueous solutions, preferably in the form of 30 to 50 percent by weight aqueous solutions. All of the acids mentioned are generally used in the form of their water-soluble salts, particularly their alkali salts.
- Such organic builder substances can, if desired, be present in amounts of up to 40% by weight, in particular up to 25% by weight and preferably from 1% to 8% by weight. Amounts close to the upper limit mentioned are preferably used in paste-like or liquid, in particular water-containing, agents.
- Polyphosphates preferably sodium triphosphate, are particularly suitable as water-soluble inorganic builder materials.
- Crystalline or amorphous, water-dispersible alkali aluminosilicates are particularly used as water-insoluble inorganic builder materials, in amounts of not more than 25% by weight, preferably from 3% by weight to 20% by weight and in particular in amounts of from 5% by weight to 15% by weight.
- crystalline sodium aluminosilicates in detergent quality in particular zeolite A, zeolite P and zeolite MAP and optionally zeolite X, are preferred. Amounts close to the upper limit mentioned are preferably used in solid, particulate agents.
- Suitable aluminosilicates in particular have no particles with a grain size of more than 30 ⁇ m and preferably consist of at least 80% by weight of particles with a size of less than 10 ⁇ m.
- Their calcium binding capacity is generally in the range from 100 to 200 mg CaO per gram.
- water-soluble inorganic builder materials can be included.
- polyphosphates such as sodium triphosphate
- these include in particular the water-soluble crystalline and/or amorphous alkali silicate builders.
- Such water-soluble inorganic builder materials are preferably included in the agents in amounts of 1 wt.% to 20 wt.%, in particular 5 wt.% to 15 wt.%
- the alkali silicates that can be used as builder materials preferably have a molar ratio of alkali oxide to SiO 2 of less than 0.95, in particular of 1:1.1 to 1:12, and can be amorphous or crystalline.
- Preferred alkali silicates are the sodium silicates, in particular the amorphous sodium silicates, with a molar ratio Na 2 O:SiO 2 of 1:2 to 1:2.8.
- Crystalline silicates which can be present alone or in a mixture with amorphous silicates are preferably crystalline layered silicates of the general formula Na 2 Si x O 2x+1 ⁇ y H 2 O, in which x, the so-called modulus, is a number from 1.9 to 4 and y is a number from 0 to 20 and preferred values for x are 2, 3 or 4.
- Preferred crystalline layered silicates are those in which x in the general formula mentioned assumes the values 2 or 3.
- both ⁇ - and ⁇ -sodium disilicates are preferred.
- Virtually anhydrous crystalline alkali silicates of the above general formula, in which x is a number from 1.9 to 2.1, produced from amorphous alkali silicates, can also be used in the agents.
- a crystalline sodium layer silicate with a modulus of 2 to 3 is used, as can be produced from sand and soda.
- Sodium silicates with a modulus in the range of 1.9 to 3.5 are used in a further embodiment.
- a granular compound of alkali silicate and alkali carbonate is used, as is commercially available, for example, under the name Nabion ® 15.
- Enzymes that may be contained in the detergents are particularly those from the class of proteases, cutinases, amylases, pullulanases, xylanases, hemicellulases, cellulases, peroxidases and oxidases or mixtures thereof, with the use of protease, amylase and/or cellulase being particularly preferred.
- the proportion is preferably 0.2% by weight to 1.5% by weight, in particular 0.5% by weight to 1% by weight.
- the enzymes can be adsorbed in the usual way on carriers and/or embedded in coating substances or incorporated as concentrated, preferably water-free liquid formulations.
- Suitable graying inhibitors or soil-release agents are cellulose ethers such as carboxymethylcellulose, methylcellulose, hydroxyalkylcelluloses and cellulose mixed ethers such as methylhydroxyethylcellulose, methylhydroxypropylcellulose and methylcarboxymethylcellulose. Sodium carboxymethylcellulose and mixtures thereof with methylcellulose are preferably used.
- the soil-release agents commonly used include copolyesters containing dicarboxylic acid units, alkylene glycol units and polyalkylene glycol units.
- the proportion of graying inhibitors and/or soil-release agents in the agents is generally not more than 2% by weight and is preferably 0.5% to 1.5% by weight.
- Detergents can contain, for example, derivatives of diaminostilbenedisulfonic acid or its alkali metal salts as optical brighteners, particularly for textiles made of cellulose fibers (for example cotton).
- Suitable examples include salts of 4,4'-bis(2-anilino-4-morpholino-1,3,5-triazin-6-yl-amino)-stilbene-2,2'-disulfonic acid or similarly structured compounds which carry a diethanolamino group, a methylamino group or a 2-methoxyethylamino group instead of the morpholino group.
- Brighteners of the substituted 4,4'-distyryl-diphenyl type may also be present, for example 4,4'-bis-(4-chloro-3-sulfostyryl)-diphenyl. Mixtures of brighteners may also be used.
- Brighteners of the 1,3-diaryl-2-pyrazoline type for example 1-(p-sulfoamoylphenyl)-3-(p-chlorophenyl)-2-pyrazoline, and similarly structured compounds are particularly suitable for polyamide fibers.
- the content of optical brighteners or brightener mixtures in the agent is generally not more than 1% by weight and preferably in the range from 0.05% by weight to 0.5% by weight.
- the usual foam regulators that can be used in detergents include, for example, polysiloxane-silica mixtures, whereby the finely divided silica contained therein is preferably silanized or otherwise hydrophobized.
- the polysiloxanes can consist of linear compounds as well as of cross-linked polysiloxane resins and mixtures thereof.
- Other defoamers are paraffin hydrocarbons, in particular microparaffins and paraffin waxes, whose melting point is above 40 °C, saturated fatty acids or soaps with in particular 20 to 22 C atoms, for example sodium behenate, and alkali salts of phosphoric acid mono- and/or dialkyl esters, in which the alkyl chains each have 12 to 22 C atoms.
- sodium monoalkyl phosphate and/or dialkyl phosphate with C 16 to C 18 alkyl groups is preferably used.
- the proportion of foam regulators can preferably be 0.2% by weight to 2% by weight.
- the agents can contain water as a solvent.
- the organic solvents that can be used in the agents include alcohols with 1 to 4 carbon atoms, especially methanol, ethanol, isopropanol and tert-butanol, diols with 2 to 4 carbon atoms, especially ethylene glycol and propylene glycol, and mixtures thereof and the ethers that can be derived from the above-mentioned classes of compounds.
- Such water-miscible solvents are present in the agents in amounts of preferably not more than 20% by weight, especially from 1% to 15% by weight.
- the agents can contain system- and environmentally-compatible acids, in particular citric acid, acetic acid, tartaric acid, malic acid, lactic acid, glycolic acid, succinic acid, glutaric acid and/or adipic acid, but also mineral acids, in particular sulfuric acid or alkali hydrogen sulfates, or bases, in particular ammonium or alkali hydroxides.
- Such pH regulators are preferably contained in amounts of no more than 10% by weight, in particular from 0.5% by weight to 6% by weight.
- Agents in the form of aqueous solutions or solutions containing other conventional solvents are particularly advantageously prepared by simply mixing the ingredients, which can be added in bulk or as a solution into an automatic mixer.
- the agents are preferably in the form of powdered, granular or tablet-shaped preparations, which can be produced in a manner known per se, for example by mixing, granulating, roller compacting and/or spray drying the thermally resilient components and admixing the more sensitive components, which include in particular enzymes, bleaching agents and bleach-activating agents.
- a process comprising an extrusion step is preferred.
- the preferred procedure is to mix all the components together in a mixer and then compress the mixture using conventional tablet presses, for example eccentric presses or rotary presses, with pressures in the range from 200 ⁇ 10 5 Pa to 1 500 ⁇ 10 5 Pa.
- a tablet produced in this way preferably has a weight of 15 g to 40 g, in particular 20 g to 30 g, and a diameter of 35 mm to 40 mm.
- a protease-free and acylhydrazone-containing powder detergent V1 the protease-containing and acylhydrazone-free detergents V2, V3, V4 and V5, which are otherwise identical to V1
- the protease- and acylhydrazone-containing detergents E1 and E2 with the compositions given in Table 1 below (ingredients in % by weight) were tested at 20 °C in washing tests at a dosage of 67.5 g per 17 l of water in a Miele ® W1935 washing machine.
- agents V6 and V7 were used, which contained other proteases and otherwise corresponded in their composition to agents E1 and E2.
- the proteases were used in the agents with the same activity.
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Wood Science & Technology (AREA)
- Organic Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Detergent Compositions (AREA)
Description
- Die vorliegende Erfindung betrifft die Verwendung einer bestimmten Protease zur Verstärkung der Bleichleistung von bestimmten Acylhydrazonen, beim Waschen von Textilien oder Reinigen harter Oberfläche, und Wasch- und Reinigungsmittel, welche eine derartige Protease und derartiges Acylhydrazon enthalten.
- Herkömmliche Bleichmittel auf Basis von Aktivsauerstoff, auch in Gegenwart stöchiometrischer Aktivatoren (wie zum Beispiel TAED, NOBS, DECOBS, DOBA) zeigen eine gute Leistung bei Anwendungstemperaturen von 40°C und darüber. Bei niedrigen Temperaturen ist die Bleichleistung jedoch eingeschränkt.
- Eine Erhöhung der Bleichleistung durch Erhöhung der Bleichmittelmenge oder den Einsatz besonders wirksamer Bleichmittel führt häufig zu einer Verminderung der Leistung der eingesetzten Enzyme wie beispielsweise Protease und Lipase, was dann insbesondere zu einer reduzierten Entfernung von protein- und fetthaltigen Anschmutzungen führt.
- Aus den internationalen Patentanmeldungen
WO 2009/124855 A1 ,WO 2012/159944 undWO 2012/080088 A1 und der deutschen PatentanmeldungDE 10 2012 200 333 A1 ist die bleichverstärkende Wirkung von Acylhydrazonen bekannt.WO2012/171980 offenbart Geschirrspülmittel mit Bleichkatalysator und Protease. - Überraschendeweise wurde gefunden, dass durch die Anwesenheit bestimmter Proteasen die Bleichleistung derartiger Acylhydrazone noch verstärkt wird.
- Gegenstand der Erfindung ist die Verwendung einer Protease, ausgewählt aus
- a) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:1 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 98,5% und bevorzugt zu mindestens 99% identisch ist und in der Zählung gemäß SEQ ID NO:1 an der Position 193 die Aminosäure V und/oder an der Position 211 die Aminosäure L aufweist,
- b) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:2 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 70% und zunehmend bevorzugt zu mindestens 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 90,5%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5% und 99% identisch ist und in der Zählung gemäß SEQ ID NO:2 an der Position 9 die Aminosäure R und/oder an der Position 15 die Aminosäure T und/oder an der Position 66 die Aminosäure A und/oder an der Position 212 die Aminosäure D und/oder an der Position 239 die Aminosäure R aufweist, und
- c) deren Mischungen,
- zur Verstärkung der Bleichleistung von Acylhydrazonen der allgemeinen Formel (I),
- in der R1 für eine CF3 oder für eine C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, Phenyl-, Naphthyl-, C7-9-Aralkyl, C3-20-Heteroalkyl- oder C3-12-Cycloheteroalkylgruppe,
- R2 und R3 unabhängig voneinander für Wasserstoff oder eine gegebenenfalls substituierte C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-28-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkyl-, Phenyl-, Naphthyl- oder Heteroarylgruppe oder R2 und R3 zusammen mit dem sie verbindenden Kohlenstoffatom für einen gegebenenfalls substituierten 5-, 6-, 7-, 8- oder 9-gliedrigen Ring, der gegebenenfalls Heteroatome enthalten kann, und
- R4 für Wasserstoff oder eine C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-20-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkylgruppe oder eine gegebenenfalls substituierte Phenyl- oder Naphthyl- oder Heteroarylgruppe stehen, beim Waschen von Textilien oder der Reinigung harter Oberflächen in Gegenwart persauerstoffhaltiger Wasch- oder Reinigungsmittel.
- Die Acylhydrazone können in E- oder Z-Konfiguration vorliegen; wenn R2 Wasserstoff ist, kann die Verbindung der allgemeinen Formel (I) in einer ihrer tautomeren Formen oder als Mischung aus diesen vorliegen.
- In den Verbindungen der allgemeinen Formel (I) ist R2 vorzugsweise Wasserstoff. R1 und/oder R3 ist vorzugsweise eine mit einer elektronenziehenden Gruppe substituierte Methyl-, Phenyl- oder Naphthylgruppe. R4 ist vorzugsweise Wasserstoff. Als elektronenziehende Gruppe kommt vorzugsweise eine Ammoniumgruppe in Frage, die gegebenenfalls Alkyl- oder Hydroxyalkylgruppen trägt oder unter Einschluss des eine Alkylgruppe tragenden N-Atoms als gegebenenfalls weitere Heteroatome tragende Heterocyloalkylgruppe ausgebildet ist.
-
- in der R1 für eine C1-4-Alkylgruppe, die einen Substituenten ausgewählt aus
- R5, R6, R7 und R8 unabhängig voneinander für R1, Wasserstoff, Halogen, eine Hydroxy-, Amino-, eine gegebenenfalls substituierte N-mono-oder di-C1-4-alkyl- oder C2-4-hydroxyalkyl-amino-, N-Phenyl- oder N-Naphthyl-amino-, C1-28-Alkyl-, C1-28-Alkoxy-, Phenoxy-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-20-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkyl-, Phenyl- oder Naphthylgruppe stehen, wobei die Substituenten ausgewählt werden aus C1-4-Alkyl-, C1-4-Alkoxy-, Hydroxy-, Sulfo-, Sulfato-, Halogen-, Cyano-, Nitro-, Carboxy-, Phenyl- , Phenoxy-, Naphthoxy-, Amino-, N-mono-oder di-C1-4-alkyl- oder C2-4-hydroxyalkyl-amino-, N-Phenyl- oder N-Naphthyl-aminogruppen, oder
- R5 und R6 oder R6 und R7 oder R7 und R8 unter Ausbildung von 1, 2 oder 3 carbocyclischen oder O-, NR10- oder S-heterocyclischen, gegebenenfalls aromatischen und/oder gegebenenfalls C1-6-alkylsubstituierten Ringen miteinander verbunden sind.
- Das Anion A- ist vorzugsweise Carboxylat wie Lactat, Citrat, Tartrat oder Succinat, Perchlorat, Tetrafluoroborat, Hexafluorophosphat, Alkylsulfonat, Alkylsulfat, Hydrogensulfat, Sulfat, Dihydrogenphosphat, Hydrogenphosphat, Phosphat, Isocyanat, Rhodanid, Nitrat, Fluorid, Chlorid, Bromid, Hydrogencarbonat oder Carbonat, wobei bei mehrwertigen Anionen der Ladungsausgleich durch die Anwesenheit zusätzlicher Kationen wie Natrium- oder Ammoniumionen erreicht werden kann.
-
- Proteasen sind Enzyme, welche die Hydrolyse von Amidbindungen in Protein-Substraten, katalysieren. Die erfindungsgemäß eingesetzte Protease weist in der Zählung gemäß SEQ ID NO:1 an der Position 193 vorzugsweise die Aminosäure V und an der Position 211 vorzugsweise die Aminosäure L auf, oder sie weist in der Zählung gemäß SEQ ID NO:2 an der Position 9 die Aminosäure R, an der Position 15 die Aminosäure T, an der Position 66 die Aminosäure A, an der Position 212 die Aminosäure D und/oder an der Position 239 die Aminosäure R auf, wobei auch mehrere, zum Beispiel 2, 3, 4 oder 5, derartige Proteasen eingesetzt werden können. Zusätzlich zu den oben unter a) und b) genannten Proteasen können auch solche vom Subtilisin-Typ eingesetzt werden. Beispiele hierfür sind die Subtilisine BPN' und Carlsberg, die Protease PB92, die Subtilisine 147 und 309, die Alkalische Protease aus Bacillus lentus, Subtilisin DY und die den Subtilasen, nicht mehr jedoch den Subtilisinen im engeren Sinne zuzuordnenden Enzyme Thermitase, Proteinase K und die Proteasen TW3 und TW7. Subtilisin Carlsberg ist in weiterentwickelter Form unter dem Handelsnamen Alcalase® von der Firma Novozymes A/S, Bagsvaerd, Dänemark, erhältlich. Die Subtilisine 147 und 309 werden unter den Handelsnamen Esperase®, beziehungsweise Savinase® von der Firma Novozymes vertrieben. Von der Protease aus Bacillus lentus DSM 5483 leiten sich die unter der Bezeichnung BLAP® geführten Protease-Varianten ab. Weitere brauchbare Proteasen sind beispielsweise die unter den Handelsnamen Durazym®, Relase®, Everlase®, Nafizym®, Natalase® und Kannase® von der Firma Novozymes, die unter den Handelsnamen, Purafect®, Purafect® OxP, Purafect® Prime, Excellase® und Properase® von der Firma Genencor, das unter dem Handelsnamen Biotouch® ROC 250 L von der Firma AB-Enzymes, Darmstadt, das unter dem Handelsnamen Protosol® von der Firma Advanced Biochemicals Ltd., Thane, Indien, das unter dem Handelsnamen Wuxi® von der Firma Wuxi Snyder Bioproducts Ltd., China, die unter den Handelsnamen Proleather® und Protease P® von der Firma Amano Pharmaceuticals Ltd., Nagoya, Japan, das unter dem Handelsnamen Biogent® 900 G von der Firma Ishaan Bio Private Limited, Ahmedabad, Indien, und das unter der Bezeichnung Proteinase K-16 von der Firma Kao Corp., Tokyo, Japan, erhältlichen Enzyme. Besonders bevorzugt eingesetzt werden auch die Proteasen aus Bacillus gibsonii und Bacillus pumilus, die offenbart sind in den internationalen Patentanmeldungen
WO2008/086916 undWO2007/131656 . Der erfindungsgemäße Effekt der Steigerung der Bleichleistung wird nicht beobachtet beim Einsatz der Protease gemäß SEQ ID NO: 4. - Die Bestimmung der Identität von Nukleinsäure- oder Aminosäuresequenzen erfolgt durch einen Sequenzvergleich. Dieser Sequenzvergleich basiert auf dem im Stand der Technik etablierten und üblicherweise genutzten BLAST-Algorithmus (vgl. beispielsweise Altschul, S.F., Gish, W., Miller, W., Myers, E.W. & Lipman, D.J. (1990) "Basic local alignment search tool." J. Mol. Biol. 215:403-410, und Altschul, Stephan F., Thomas L. Madden, Alejandro A. Schaffer, Jinghui Zhang, Hheng Zhang, Webb Miller, and David J. Lipman (1997): "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs"; Nucleic Acids Res., 25, S.3389-3402) und geschieht prinzipiell dadurch, dass ähnliche Abfolgen von Nukleotiden oder Aminosäuren in den Nukleinsäure- oder Aminosäuresequenzen einander zugeordnet werden. Eine tabellarische Zuordnung der betreffenden Positionen wird als Alignment bezeichnet. Ein weiterer im Stand der Technik verfügbarer Algorithmus ist der FASTA-Algorithmus. Sequenzvergleiche (Alignments), insbesondere multiple Sequenzvergleiche, werden mit Computerprogrammen erstellt. Häufig genutzt werden beispielsweise die Clustal-Serie (vgl. beispielsweise Chenna et al. (2003): Multiple sequence alignment with the Clustal series of programs. Nucleic Acid Research 31, 3497-3500), T-Coffee (vgl. beispielsweise Notredame et al. (2000): T-Coffee: A novel method for multiple sequence alignments. J. Mol. Biol. 302, 205-217) oder Programme, die auf diesen Programmen beziehungsweise Algorithmen basieren. In der vorliegenden Patentanmeldung wurden alle Sequenzvergleiche (Alignments) mit dem Computer-Programm Vector NTI® Suite 10.3 (Invitrogen Corporation, 1600 Faraday Avenue, Carlsbad, Kalifornien, USA) mit den vorgegebenen Standardparametern erstellt, dessen AlignX-Modul für die Sequenzvergleiche auf ClustalW basiert.
- Solch ein Vergleich erlaubt auch eine Aussage über die Ähnlichkeit der verglichenen Sequenzen zueinander. Sie wird üblicherweise in Prozent Identität, das heißt dem Anteil der identischen Nukleotide oder Aminosäurereste an denselben oder in einem Alignment einander entsprechenden Positionen angegeben. Der weiter gefasste Begriff der Homologie bezieht bei Aminosäuresequenzen konservierte Aminosäure-Austausche in die Betrachtung mit ein, also Aminosäuren mit ähnlicher chemischer Aktivität, da diese innerhalb des Proteins meist ähnliche chemische Aktivitäten ausüben. Daher kann die Ähnlichkeit der verglichenen Sequenzen auch Prozent Homologie oder Prozent Ähnlichkeit angegeben sein. Identitäts- und/oder Homologieangaben können über ganze Polypeptide oder Gene oder nur über einzelne Bereiche getroffen werden. Homologe oder identische Bereiche von verschiedenen Nukleinsäure- oder Aminosäuresequenzen sind daher durch Übereinstimmungen in den Sequenzen definiert. Solche Bereiche weisen oftmals identische Funktionen auf. Sie können klein sein und nur wenige Nukleotide oder Aminosäuren umfassen. Oftmals üben solche kleinen Bereiche für die Gesamtaktivität des Proteins essentielle Funktionen aus. Es kann daher sinnvoll sein, Sequenzübereinstimmungen nur auf einzelne, gegebenenfalls kleine Bereiche zu beziehen. Soweit nicht anders angegeben beziehen sich Identitäts- oder Homologieangaben in der vorliegenden Anmeldung aber auf die Gesamtlänge der jeweils angegebenen Nukleinsäure- oder Aminosäuresäuresequenz.
- Der auf aktives Protein bezogene Gewichtsanteil der Protease am Gesamtgewicht erfindungsgemäßer Wasch- oder Reinigungsmittel beträgt vorzugsweise 0,005 bis 1,0 Gew.-%, insbesondere 0,01 bis 0,5 Gew.-% und besonders bevorzugt 0,02 bis 0,2 Gew.-%. Die Proteinkonzentration kann mit Hilfe bekannter Methoden, zum Beispiel dem BCA-Verfahren (Bicinchoninsäure; 2,2'-Bichinolyl-4,4'-dicarbonsäure) oder dem Biuret-Verfahren (A. G. Gornall, C. S. Bardawill und M.M. David, J. Biol. Chem., 177 (1948), S. 751-766) bestimmt werden. Die Bestimmung der Aktivproteinkonzentration erfolgte diesbezüglich über eine Titration der aktiven Zentren unter Verwendung eines geeigneten irreversiblen Inhibitors (für Proteasen beispielsweise Phenylmethylsulfonylfluorid (PMSF)) und Bestimmung der Restaktivität (vgl. M. Bender et al., J. Am. Chem. Soc. 88, 24 (1966), S. 5890-5913).
- Die reinigungsaktiven Effekte der Protease bleiben in Gegenwart des gleichzeitig anwesenden Acylhydrazons erhalten. Die reinigungsaktiven Effekte des Acylhydrazons werden jedoch in Gegenwart gleichzeitig anwesender Protease verstärkt, wenn man die Protease unter den oben genannten Enzymen auswählt. Der kombinierte Einsatz von derartiger Protease und Acylhydrazon resultiert außerdem in einer größeren Anzahl verbessert entfernter Anschmutzungen als die Summe verbessert entfernter Anschmutzungen bei Einsatz der einzelnen der beiden Wirkstoffe, insbesondere bei niedrigen Waschtemperaturen von zum Beispiel 40 °C und darunter, und schon bei Raumtemperatur.
- Die Leistung von Verbindungen der allgemeinen Formel (I) kann gegebenenfalls durch die Anwesenheit von Mangan-, Titan-, Cobalt-, Nickel- oder Kupferionen, vorzugsweise Mn(II)-(III)-(IV)-(V), Cu(I)-(II)-(III), Fe(I)-(II)-(III)-(IV), Co(I)-(II)-(III), Ni(I)-(II)-(III), Ti(II)-(III)-(IV) und besonders bevorzugt solchen ausgewählt aus Mn(II)-(III)-(IV)-(V), Cu(I)-(II)-(III), Fe(I)-(II)-(III)-(IV) und Co(I)-(II)-(III), weiter verstärkt werden; gewünschtenfalls kann das Acylhydrazon auch in Form von Komplexverbindungen der genannten Metallzentralatome mit Liganden der allgemeinen Formel (I) und insbesondere der allgemeinen Formel (II) eingesetzt werden. Ein bleichverstärkender Komplex, der einen Liganden mit einem Gerüst gemäß Formel (I) aufweist, kann den entsprechenden Liganden einmal oder auch mehrfach, insbesondere zweimal, aufweisen. Er kann ein- oder gegebenenfalls zwei- oder mehrkernig sein. Er kann außerdem weitere Neutral-, Anion- oder Kationliganden, wie beispielsweise H2O, NH3, CH3OH, Acetylaceton, Terpyridin, organische Anionen, wie beispielsweise Citrat, Oxalat, Tartrat, Formiat, ein C2-18-Carboxylat, ein C1-18-Alkylsulfat, insbesondere Methosulfat, oder ein entsprechendes Alkansulfonat, anorganische Anionen, wie beispielsweise Halogenid, insbesondere Chlorid, Perchlorat, Tetrafluoroborat, Hexafluorophosphat, Nitrat, Hydrogensulfat, Hydroxid oder Hydroperoxid. Er kann auch verbrückende Liganden, wie beispielsweise Alkylendiamine, aufweisen.
- Im Rahmen der erfindungsgemäßen Verwendung ist bevorzugt, wenn die Konzentration der Verbindung gemäß Formel (I) in wässriger Flotte, wie sie beispielsweise in Waschmaschinen oder Geschirrspülmaschinen zum Einsatz kommt, 0,5 µmol/l bis 500 µmol/l, insbesondere 5 µmol/l bis 100 µmol/l beträgt. Obengenannte komplexbildende Metallionen werden vorzugsweise nicht absichtlich hinzugefügt, sie können aber aus möglichen Quellen für derartige Metallionen, zu denen insbesondere das Leitungswasser, die Waschmaschine selbst, Anhaftungen an Textilien und Anschmutzungen auf den Textilien zu rechnen sind, anwesend sein. Gegebenenfalls kommen auch unabsichtlich mit anderen Waschmittelinhaltstoffen eingeschleppte Metallionen in Frage. Bevorzugte Persauerstoffkonzentrationen (berechnet als H2O2) in der Flotte liegen im Bereich von 0,001 g/l bis 10 g/l, insbesondere von 0,1 g/l bis 1 g/l und besonders bevorzugt von 0,2 g/l bis 0,5 g/l. Die erfindungsgemäße Verwendung wird vorzugsweise bei Temperaturen im Bereich von 10 °C bis 95 °C, insbesondere 20 °C bis 40 °C und besonders bevorzugt bei Temperaturen unterhalb von 30 °C durchgeführt. Die Wasserhärte des zur Zubereitung der wässrigen Flotte zum Einsatz kommenden Wassers liegt vorzugsweise im Bereich von 0°dH bis 21°dH, insbesondere 0°dH bis 3°dH. In der Waschflotte liegt die Wasserhärte vorzugsweise im Bereich von 0°dH bis 16°dH, insbesondere 0°dH bis 3°dH, was beispielsweise durch den Einsatz üblicher Buildermaterialien oder Wasserenthärter erreicht werden kann. Die erfindungsgemäße Verwendung wird vorzugsweise bei pH-Werten im Bereich von pH 5 bis pH 12, insbesondere von pH 7 bis pH 11 durchgeführt.
- Die erfindungsgemäße Verwendung erfolgt vorzugsweise derart, dass man eine Persauerstoffverbindung und ein Waschmittel, welches ein Acylhydrazon der allgemeinen Formel (I) und oben genannte Protease enthält, im Rahmen eines maschinellen oder mit der Hand ausgeführten Waschvorgangs auf ein verunreinigtes Textil einwirken lässt. Die erfindungsgemäße Verwendung kann besonders einfach durch den Einsatz eines Waschmittels, das Persauerstoffverbindung, die genannte Protease und eine Verbindung der Formel (I) oder gewünschtenfalls einen durch Komplexbildung mit einem genannten Übergangsmetallion aus dieser zugänglichen Bleichkatalysator enthält, bei der Wäsche reinigungsbedürftiger Textilien realisiert werden. Alternativ kann die Persauerstoffverbindung und/oder die Verbindung der Formel (I) und/oder ein aus dieser zugänglicher Komplex und/oder die Protease auch separat zu einer Waschflotte, welche ein Waschmittel ohne den jeweils genannten Inhaltstoff aufweist, zugesetzt werden. Analoges gilt für Reinigungsmittel für harte Oberflächen bei der erfindungsgemäßen Verwendung beispielsweise im Rahmen eines Geschirrspülverfahrens.
- Ein weiterer Gegenstand der Erfindung ist daher ein Wasch- oder Reinigungsmittel, enthaltend ein persauerstoffhaltiges Bleichmittel, eine Verbindung der Formel (I) und eine Protease, ausgewählt aus a) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:1 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 98,5% und bevorzugt zu mindestens 99% identisch ist und in der Zählung gemäß SEQ ID NO:1 an der Position 193 die Aminosäure V und/oder an der Position 211 die Aminosäure L aufweist, b) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:2 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 70% und zunehmend bevorzugt zu mindestens 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 90,5%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5% und 99% identisch ist und in der Zählung gemäß SEQ ID NO:2 an der Position 9 die Aminosäure R und/oder an der Position 15 die Aminosäure T und/oder an der Position 66 die Aminosäure A und/oder an der Position 212 die Aminosäure D und/oder an der Position 239 die Aminosäure R aufweist, und
c) deren Mischungen. Im Rahmen der Verwendung bevorzugte Ausführungsformen gelten auch für die Kategorie der Wasch- oder Reinigungsmittel; insbesondere kann die Verbindung der Formel (I) auch in der Form eines durch Komplexbildung mit einem genannten Übergangsmetallion aus dieser zugänglichen Bleichkatalysators in dem Mittel enthalten sein. - Als weitere Enzyme einsetzbar sind beispielsweise Lipasen oder Cutinasen, insbesondere wegen ihrer Triglycerid-spaltenden Aktivitäten, aber auch, um aus geeigneten Vorstufen in situ Persäuren zu erzeugen. Hierzu gehören beispielsweise die ursprünglich aus Humicola lanuginosa (Thermomyces lanuginosus) erhältlichen, beziehungsweise weiterentwickelten Lipasen, insbesondere solche mit dem Aminosäureaustausch D96L. Des Weiteren sind beispielsweise die Cutinasen einsetzbar, die ursprünglich aus Fusarium solani pisi und Humicola insolens isoliert worden sind. Einsetzbar sind weiterhin Lipasen, beziehungsweise Cutinasen, deren Ausgangsenzyme ursprünglich aus Pseudomonas mendocina und Fusarium solanii isoliert worden sind.
- Die erfindungsgemäßen Mittel können auch Cellulasen oder Hemicellulasen wie Mannanasen, Xanthanlyasen, Pektinlyasen (=Pektinasen), Pektinesterasen, Pektatlyasen, Xyloglucanasen (=Xylanasen), Pullulanasen oder β-Glucanasen enthalten.
- Zur Erhöhung der bleichenden Wirkung können gewünschtenfalls Oxidoreduktasen, beispielsweise Oxidasen, Oxygenasen, Katalasen, Peroxidasen, wie Halo-, Chloro-, Bromo-, Lignin-, Glucose- oder Mangan-peroxidasen, Dioxygenasen oder Laccasen (Phenoloxidasen, Polyphenoloxidasen) eingesetzt werden. Vorteilhafterweise werden zusätzlich vorzugsweise organische, besonders bevorzugt aromatische, mit den Enzymen wechselwirkende Verbindungen zugegeben, um die Aktivität der betreffenden Oxidoreduktasen zu verstärken (Enhancer) oder um bei stark unterschiedlichen Redoxpotentialen zwischen den oxidierenden Enzymen und den Anschmutzungen den Elektronenfluss zu gewährleisten (Mediatoren).
- Mit besonderem Vorzug enthalten die erfindungsgemäßen Reinigungsmittel als weiteres Enzym mindestens eine Amylase. Eine Amylase ist ein Enzym wie einleitend beschrieben. Für Amylasen können synonyme Begriffe verwendet werden, beispielsweise 1,4-alpha-D-Glucan-Glucanohydrolase oder Glycogenase. Erfindungsgemäß bevorzugte Amylasen sind α-Amylasen. Entscheidend dafür, ob ein Enzym eine α-Amylase im Sinne der Erfindung ist, ist deren Fähigkeit zur Hydrolyse von α(1-4)-Glykosidbindungen in der Amylose der Stärke.
- Beispielhafte Amylasen sind die α-Amylasen aus Bacillus licheniformis, aus Bacillus amyloliquefaciens oder aus Bacillus stearothermophilus sowie insbesondere auch deren für den Einsatz in Wasch- oder Reinigungsmitteln verbesserte Weiterentwicklungen. Das Enzym aus Bacillus licheniformis ist von dem Unternehmen Novozymes unter dem Namen Termamyl® und von dem Unternehmen Danisco/Genencor unter dem Namen Purastar®ST erhältlich. Weiterentwicklungsprodukte dieser α-Amylase sind von dem Unternehmen Novozymes unter den Handelsnamen Duramyl® und Termamy®ultra, von dem Unternehmen Danisco/Genencor unter dem Namen Purastar®OxAm und von dem Unternehmen Daiwa Seiko Inc., Tokyo, Japan, als Keistase® erhältlich. Die α-Amylase von Bacillus amyloliquefaciens wird von dem Unternehmen Novozymes unter dem Namen BAN® vertrieben, und abgeleitete Varianten von der α-Amylase aus Bacillus stearothermophilus unter den Namen BSG® und Novamyl®, ebenfalls von dem Unternehmen Novozymes. Desweiteren sind für diesen Zweck die α-Amylase aus Bacillus sp. A 7-7 (DSM 12368) und die Cyclodextrin-Glucanotransferase (CGTase) aus Bacillus agaradherens (DSM 9948) hervorzuheben. Ebenso sind Fusionsprodukte aller genannten Moleküle einsetzbar. Darüber hinaus sind die unter den Handelsnamen Fungamyl® von dem Unternehmen Novozymes erhältlichen Weiterentwicklungen der α-Amylase aus Aspergillus niger und A. oryzae geeignet. Weitere vorteilhaft einsetzbare Handelsprodukte sind beispielsweise die Amylase-LT® und Stainzyme® oder Stainzyme ultra® oder Stainzyme plus®, letztere ebenfalls von dem Unternehmen Novozymes. Auch durch Punktmutationen erhältliche Varianten dieser Enzyme können erfindungsgemäß eingesetzt werden. Besonders bevorzugte Amylasen sind offenbart in den internationalen Offenlegungsschriften
WO 00/60060 WO 03/002711 WO 03/054177 WO07/079938 - Zusammenfassend sind bevorzugte erfindungsgemäße Reinigungsmittel dadurch gekennzeichnet, dass als weiteres Enzym mindestens ein Enzym aus der Gruppe der Amylasen, Cellulasen, Hemicellulasen, Mannanasen, Tannasen, Xylanasen, Xanthanasen, Xyloglucanasen, β-Glucosidasen, Pektinasen, Carrageenasen, Perhydrolasen, Oxidasen, Oxidoreduktasen oder eine Lipase, sowie deren Gemische, vorzugsweise aus der Gruppe der Amylasen eingesetzt wird. Der auf aktives Protein bezogene Gewichtsanteil der weiteren Enzyme am Gesamtgewicht der Wasch- und Reinigungsmittel beträgt vorzugsweise 0,0005 bis 1,0 Gew.-%, insbesondere 0,001 bis 0,5 Gew.-% und besonders bevorzugt 0,002 bis 0,2 Gew.-%.
- Vorzugsweise ist in Wasch- oder Reinigungsmitteln 0,001 Gew.-% bis 5 Gew.-%, insbesondere 0,05 Gew.-% bis 0,15 Gew.-% und besonders bevorzugt 0,03 Gew.-% bis 0,09 Gew.-% der Verbindung gemäß Formel (I) enthalten. Insbesondere wenn eine Verbindung der Formel (I) enthalten ist, ist bevorzugt, dass das Mittel zusätzlich ein Mangan-, Titan-, Cobalt-, Nickel- oder Kupfer-Salz und/oder einen Mangan-, Titan-, Cobalt-, Nickel- oder Kupfer-Komplex ohne einen Liganden, welcher einer Verbindung gemäß Formel (I) entspricht, enthält. Dann liegt das Molverhältnis des genannten Übergangsmetalls oder der Summe der genannten Übergangsmetalle zu der Verbindung gemäß Formel (I) vorzugsweise im Bereich von 0,001:1 bis 2:1, insbesondere 0,01:1 bis 1:1. In einer weiteren bevorzugten Ausgestaltung der Mittel sind in diesen 0,05 Gew.-% bis 1 Gew.-%, insbesondere 0,1 Gew.-% bis 0,5 Gew.-% an bleichverstärkendem Komplex, der einen Liganden gemäß Formel (I) aufweist, enthalten. Bevorzugtes Übergangsmetall ist Mn.
- Als in den Mitteln enthaltene Persauerstoffverbindungen kommen insbesondere organische Persäuren beziehungsweise persaure Salze organischer Säuren, wie Phthalimidopercapronsäure, Perbenzoesäure oder Salze der Diperoxododecandisäure, andere Peroxo-Säuren oder peroxosaure Salze, wie Alkalipersulfate oder -peroxodisulfate oder Caroate, oder Diacylperoxide oder Tetraacyldiperoxide, Wasserstoffperoxid und unter den Waschbedingungen Wasserstoffperoxid freisetzende Substanzen, wie Alkaliperborate, Alkalipercarbonate, Alkalipersilikate und Harnstoffperhydrat, in Betracht. Wasserstoffperoxid kann dabei auch mit Hilfe eines enzymatischen Systems, das heißt einer Oxidase und ihres Substrats, erzeugt werden. Sofern feste Persauerstoffverbindungen eingesetzt werden sollen, können diese in Form von Pulvern oder Granulaten verwendet werden, die auch in im Prinzip bekannter Weise umhüllt sein können. Besonders bevorzugt wird Alkalipercarbonat, Alkaliperborat-Monohydrat, Alkaliperborat-Tetrahydrat oder Wasserstoffperoxid in Form wässriger Lösungen, die 3 Gew.-% bis 10 Gew.-% Wasserstoffperoxid enthalten, eingesetzt. Vorzugsweise sind Persauerstoffverbindungen in Mengen von bis zu 50 Gew.-%, insbesondere von 2 Gew.-% bis 45 Gew.-% und besonders bevorzugt von 5 Gew.-% bis 20 Gew.-%, in den Mitteln vorhanden.
- In einer weiteren bevorzugten Ausgestaltung der Erfindung wird, insbesondere in Gegenwart von H2O2 freisetzender Persauerstoffverbindung, ein üblicher Bleichaktivator zusammen mit dem Acylhydrazon der allgemeinen Formel (I), der allgemeinen Formel (II) und insbesondere der Formel (III) eingesetzt. In Waschmitteln sind derartige Bleichaktivatoren vorzugsweise in Mengen von bis zu 10 Gew.-%, insbesondere von 1,5 Gew.-% bis 5 Gew.-% enthalten. Vorzugsweise werden unter Perhydrolysebedingungen Peroxocarbonsäure ausbildende Verbindung und Acylhydrazon in Molverhältnissen im Bereich von 4:1 bis 100:1, insbesondere von 25:1 bis 50:1 eingesetzt.
- Als unter Perhydrolysebedingungen Peroxocarbonsäure-liefernde Verbindung können insbesondere Verbindungen, die unter Perhydrolysebedingungen gegebenenfalls substituierte Perbenzoesäure und/oder aliphatische Peroxocarbonsäuren mit 1 bis 12 C-Atomen, insbesondere 2 bis 4 C-Atomen ergeben, allein oder in Mischungen, eingesetzt werden. Geeignet sind Bleichaktivatoren, die O- und/oder N-Acylgruppen insbesondere der genannten C-Atomzahl und/oder gegebenenfalls substituierte Benzoylgruppen tragen. Bevorzugt sind mehrfach acylierte Alkylendiamine, insbesondere Tetraacetylethylendiamin (TAED), acylierte Glykolurile, insbesondere Tetraacetylglykoluril (TAGU), acylierte Triazinderivate, insbesondere 1,5-Diacetyl-2,4-dioxohexahydro-1,3,5-triazin (DADHT), N-Acylimide, insbesondere N-Nonanoylsuccinimid (NOSI), acylierte Phenolsulfonate oder -carboxylate beziehungsweise die Sulfon- oder Carbonsäuren von diesen, insbesondere Nonanoyl- oder Isononanoyl- oder Lauroyloxybenzolsulfonat (NOBS beziehungsweise iso-NOBS beziehungsweise LOBS) oder Decanoyloxybenzoat (DOBA), deren formale Kohlensäureesterderivate wie 4-(2-Decanoyloxyethoxycarbonyloxy)-benzolsulfonat (DECOBS), acylierte mehrwertige Alkohole, insbesondere Triacetin, Ethylenglykoldiacetat und 2,5-Diacetoxy-2,5-dihydrofuran sowie acetyliertes Sorbitol und Mannitol und deren Mischungen (SORMAN), acylierte Zuckerderivate, insbesondere Pentaacetylglukose (PAG), Pentaacetylfruktose, Tetraacetylxylose und Octaacetyllactose, acetyliertes, gegebenenfalls N-alkyliertes Glucamin und Gluconolacton, und/oder N-acylierte Lactame, beispielsweise N-Benzoylcaprolactam.
- Zusätzlich oder alternativ zu den Verbindungen, die unter Perhydrolysebedingungen Peroxocarbonsäuren bilden, können weitere bleichaktivierende Verbindungen, wie beispielsweise Nitrile, aus denen sich unter Perhydrolysebedingungen Perimidsäuren bilden, vorhanden sein. Dazu gehören insbesondere Aminoacetonitrilderivate mit quaterniertem Stickstoffatom gemäß der Formel
- Die Bleichaktivatoren können zur Vermeidung der Wechselwirkung mit den Persauerstoffverbindungen bei der Lagerung in bekannter Weise mit Hüllsubstanzen überzogen beziehungsweise granuliert worden sein, wobei mit Hilfe von Carboxymethylcellulose granuliertes Tetraacetylethylendiamin mit mittleren Korngrößen von 0,01 mm bis 0,8 mm, granuliertes 1,5-Diacetyl-2,4-dioxohexahydro-1,3,5-triazin, und/oder in Teilchenform konfektioniertes Trialkylammoniumacetonitril besonders bevorzugt ist.
- Zusätzlich zu der erfindungsgemäß zu verwendenden Kombination können auch übliche die Bleiche aktivierende Übergangsmetallkomplexe eingesetzt werden. Diese werden vorzugsweise unter den Cobalt-, Eisen-, Kupfer-, Titan-, Vanadium-, Mangan- und Rutheniumkomplexen ausgewählt. Als Liganden in derartigen Übergangsmetallkomplexen kommen sowohl anorganische als auch organische Verbindungen in Frage, zu denen neben Carboxylaten insbesondere Verbindungen mit primären, sekundären und/oder tertiären Amin- und/oder Alkohol-Funktionen, wie Pyridin, Pyridazin, Pyrimidin, Pyrazin, Imidazol, Pyrazol, Triazol, 2,2'-Bispyridylamin, Tris-(2-pyridylmethyl)amin, 1,4,7-Triazacyclononan und dessen substituierte Derivate wie 1,4,7-Trimethyl-1,4,7-triazacyclononan, 1,5,9-Triazacyclododecan und dessen substituierte Derivate wie 1,5,9-Trimethyl-1,5,9-triazacyclododecan 1,4,8,11-Tetraazacyclotetradecan und dessen substituierte Derivate wie 5,5,7,12,12,14-Hexamethyl-1,4,8,11-tetraazacyclotetradecan, 1,5,8,12-Tetraazabicyclo[6.6.2]hexadecan und dessen substituierte Derivate wie 5,12-Diethyl-1,5,8,12-tetraazabicyclo[6.6.2]hexadecan, (Bis-((1-methylimidazol-2-yl)-methyl))-(2-pyridylmethyl)-amin, N,N'-(Bis-(1-methylimidazol-2-yl)-methyl)-ethylendiamin, N-Bis-(2-benzimidazolylmethyl)-aminoethanol, 2,6-Bis-(bis-(2-benzimidazolylmethyl)aminomethyl)-4-methylphenol, N,N,N',N'-Tetrakis-(2-benzimidazolylmethyl)-2-hydroxy-1,3-diaminopropan, 2,6-Bis-(bis-(2-pyridylmethyl)aminomethyl)-4-methylphenol, 1,3-Bis-(bis-(2-benzimidazolylmethyl)aminomethyl)-benzol, Sorbitol, Mannitol, Erythritol, Adonitol, Inositol, Lactose, und gegebenenfalls substituierte Salene, Porphine und Porphyrine gehören. Zu den anorganischen Neutralliganden gehören insbesondere Ammoniak und Wasser. Falls nicht sämtliche Koordinationsstellen des Übergangsmetallzentralatoms durch Neutralliganden besetzt sind, enthält der Komplex weitere, vorzugsweise anionische und unter diesen insbesondere ein- oder zweizähnige Liganden. Zu diesen gehören insbesondere die Halogenide wie Fluorid, Chlorid, Bromid und lodid, und die (NO2)--Gruppe, das heißt ein Nitro-Ligand oder ein Nitrito-Ligand. Die (NO2)--Gruppe kann an ein Übergangsmetall auch chelatbildend gebunden sein oder sie kann zwei Übergangsmetallatome asymmetrisch oder η1-O-verbrücken. Außer den genannten Liganden können die Übergangsmetallkomplexe noch weitere, in der Regel einfacher aufgebaute Liganden, insbesondere ein- oder mehrwertige Anionliganden, tragen. In Frage kommen beispielsweise Nitrat, Acetat, Trifluoracetat, Formiat, Carbonat, Citrat, Oxalat, Perchlorat sowie komplexe Anionen wie Hexafluorophosphat. Die Anionliganden sollen für den Ladungsausgleich zwischen Übergangsmetall-Zentralatom und dem Ligandensystem sorgen. Auch die Anwesenheit von Oxo-Liganden, Peroxo-Liganden und Imino-Liganden ist möglich. Insbesondere derartige Liganden können auch verbrückend wirken, so daß mehrkernige Komplexe entstehen. Im Falle verbrückter, zweikerniger Komplexe müssen nicht beide Metallatome im Komplex gleich sein. Auch der Einsatz zweikerniger Komplexe, in denen die beiden Übergangsmetallzentralatome unterschiedliche Oxidationszahlen aufweisen, ist möglich. Falls Anionliganden fehlen oder die Anwesenheit von Anionliganden nicht zum Ladungsausgleich im Komplex führt, sind in den gemäß der Erfindung zu verwendenden Übergangsmetallkomplex-Verbindungen anionische Gegenionen anwesend, die den kationischen Übergangsmetall-Komplex neutralisieren. Zu diesen anionischen Gegenionen gehören insbesondere Nitrat, Hydroxid, Hexafluorophosphat, Sulfat, Chlorat, Perchlorat, die Halogenide wie Chlorid oder die Anionen von Carbonsäuren wie Formiat, Acetat, Oxalat, Benzoat oder Citrat. Beispiele für einsetzbare Übergangsmetallkomplex-Verbindungen sind Mn(IV)2(µ-O)3(1,4,7-trimethyl-1,4,7-triazacyclononan)-di-hexafluorophosphat, [N,N'-Bis[(2-hydroxy-5-vinylphenyl)-methylen]-1,2-diaminocyclohexan]-mangan-(III)-chlorid, [N,N'-Bis[(2-hydroxy-5-nitrophenyl)-methylen]-1,2-diaminocyclohexan]-mangan-(III)-acetat, [N,N'-Bis[(2-hydroxyphenyl)-methylen]-1,2-phenylendiamin]-mangan-(III)-acetat, [N,N'-Bis[(2-hydroxyphenyl)-methylen]-1,2-diaminocyclohexan]-mangan-(III)-chlorid, [N,N'-Bis[(2-hydroxyphenyl)-methylen]-1,2-diaminoethan]-mangan-(III)-chlorid, [N,N'-Bis[(2-hydroxy-5-sulfonatophenyl)-methylen]-1,2-diaminoethan]-mangan-(III)-chlorid, Mangan-oxalatokomplexe, Nitropentammin-cobalt(III)-chlorid, Nitritopentammin-cobalt(III)-chlorid, Hexammincobalt(III)-chlorid, Chloropentammin-cobalt(III)-chlorid sowie der Peroxo-Komplex [(NH3)5Co-O-O-Co(NH3)5]Cl4.
- Persauerstoffverbindungen enthaltende Waschmittel, die als insbesondere pulverförmige Feststoffe, in nachverdichteter Teilchenform, als homogene Lösungen oder Suspensionen vorliegen können, können außer der erfindungsgemäß zu verwendenden Kombination aus Protease und Verbindung gemäß Formel (I) sowie gegebenenfalls den genannten Bleichaktivatoren und - katalysatoren im Prinzip alle bekannten und in derartigen Mitteln üblichen Inhaltsstoffe enthalten. Die Mittel können insbesondere Buildersubstanzen, oberflächenaktive Tenside, wassermischbare organische Lösungsmittel, weitere Enzyme, Sequestrierungsmittel, Elektrolyte, pH-Regulatoren, Polymere mit Spezialeffekten, wie soil release-Polymere, Farbübertragungsinhibitoren, Vergrauungsinhibitoren, knitterreduzierende polymere Wirkstoffe und formerhaltende polymere Wirkstoffe, und weitere Hilfsstoffe, wie optische Aufheller, Schaumregulatoren, Farb- und Duftstoffe, enthalten.
- Ein Mittel kann zur weiteren Verstärkung der Desinfektionswirkung, beispielsweise gegenüber speziellen Keimen, zusätzlich übliche antimikrobielle Wirkstoffe, wie beispielsweise Alkohole, Aldehyde, Säuren, Carbonsäureester, Säureamide, Phenole und Phenolderivate, Diphenyle, Diphenylalkane, Harnstoffderivate, an organische Gerüste gebundene O-Acetate und O-Formale, Benzamidine, Isothiazoline, Phthalimidderivate, Pyridinderivate, Amine, quaternäre Ammoniumverbindungen, Guanidine, amphotere Verbindungen, Chinoline, Benzimidazole, IPBC, Dithiocarbamate, Metalle und Metallverbindungen, wie zum Beispiel Silber und Silbersalze, Halogene, wie zum Beispiel Chlor, Iod und deren Verbindungen, weitere Oxidationsmittel sowie anorganische Stickstoffverbindungen, enthalten. Derartige antimikrobielle Zusatzstoffe sind vorzugsweise in Mengen bis zu 10 Gew.-%, insbesondere von 0,01 Gew.-% bis 5 Gew.-%, jeweils bezogen auf gesamtes Mittel, enthalten; in bevorzugter Ausgestaltung sind sie jedoch frei von solchen zusätzlichen Desinfektionswirkstoffen.
- Die Mittel können ein oder mehrere Tenside enthalten, wobei insbesondere anionische Tenside, nichtionische Tenside und deren Gemische in Frage kommen, aber auch kationische und/oder amphotere Tenside enthalten sein können. Geeignete nichtionische Tenside sind insbesondere Alkylglykoside und Ethoxylierungs- und/oder Propoxylierungsprodukte von Alkylglykosiden oder linearen oder verzweigten Alkoholen mit jeweils 12 bis 18 C-Atomen im Alkylteil und 3 bis 20, vorzugsweise 4 bis 10 Alkylethergruppen. Weiterhin sind entsprechende Ethoxylierungs- und/oder Propoxylierungsprodukte von N-Alkyl-aminen, vicinalen Diolen, Fettsäureestern und Fettsäureamiden, die hinsichtlich des Alkylteils den genannten langkettigen Alkoholderivaten entsprechen, sowie von Alkylphenolen mit 5 bis 12 C-Atomen im Alkylrest brauchbar.
- Geeignete anionische Tenside sind insbesondere Seifen und solche, die Sulfat- oder SulfonatGruppen mit bevorzugt Alkaliionen als Kationen enthalten. Verwendbare Seifen sind bevorzugt die Alkalisalze der gesättigten oder ungesättigten Fettsäuren mit 12 bis 18 C-Atomen. Derartige Fettsäuren können auch in nicht vollständig neutralisierter Form eingesetzt werden. Zu den brauchbaren Tensiden des Sulfat-Typs gehören die Salze der Schwefelsäurehalbester von Fettalkoholen mit 12 bis 18 C-Atomen und die Sulfatierungsprodukte der genannten nichtionischen Tenside mit niedrigem Ethoxylierungsgrad. Zu den verwendbaren Tensiden vom Sulfonat-Typ gehören lineare Alkylbenzolsulfonate mit 9 bis 14 C-Atomen im Alkylteil, Alkansulfonate mit 12 bis 18 C-Atomen, sowie Olefinsulfonate mit 12 bis 18 C-Atomen, die bei der Umsetzung entsprechender Monoolefine mit Schwefeltrioxid entstehen, sowie alpha-Sulfofettsäureester, die bei der Sulfonierung von Fettsäuremethyl- oder -ethylestern entstehen.
- Derartige Tenside sind in Waschmitteln in Mengenanteilen von vorzugsweise 5 Gew.-% bis 50 Gew.-%, insbesondere von 8 Gew.-% bis 30 Gew.-%, enthalten,
- Ein Waschmittel enthält vorzugsweise mindestens einen wasserlöslichen und/oder wasserunlöslichen, organischen und/oder anorganischen Builder. Zu den wasserlöslichen organischen Buildersubstanzen gehören Polycarbonsäuren, insbesondere Citronensäure und Zuckersäuren, monomere und polymere Aminopolycarbonsäuren, insbesondere Glycindiessigsäure, Methylglycindiessigsäure, Nitrilotriessigsäure, Iminodisuccinate wie Ethylendiamin-N,N'-dibernsteinsäure und Hydroxyiminodisuccinate, Ethylendiamintetraessigsäure sowie Polyasparaginsäure, Polyphosphonsäuren, insbesondere Aminotris(methylenphosphonsäure), Ethylendiamintetrakis(methylenphosphonsäure), Lysintetra(methylenphosphosäure) und 1-Hydroxyethan-1,1-diphosphonsäure, polymere Hydroxyverbindungen wie Dextrin sowie polymere (Poly-)carbonsäuren, insbesondere durch Oxidation von Polysacchariden zugängliche Polycarboxylate, polymere Acrylsäuren, Methacrylsäuren, Maleinsäuren und Mischpolymere aus diesen, die auch geringe Anteile polymerisierbarer Substanzen ohne Carbonsäurefunktionalität einpolymerisiert enthalten können. Die relative mittlere Molekülmasse (hier und im Folgenden: Gewichtsmittel) der Homopolymeren ungesättigter Carbonsäuren liegt im allgemeinen zwischen 5 000 g/mol und 200 000 g/mol, die der Copolymeren zwischen 2 000 g/mol und 200 000 g/mol, vorzugsweise 50 000 g/mol bis 120 000 g/mol, jeweils bezogen auf freie Säure. Ein besonders bevorzugtes Acrylsäure-Maleinsäure-Copolymer weist eine relative mittlere Molekülmasse von 50 000 bis 100 000 auf. Geeignete, wenn auch weniger bevorzugte Verbindungen dieser Klasse sind Copolymere der Acrylsäure oder Methacrylsäure mit Vinylethern, wie Vinylmethylethern, Vinylester, Ethylen, Propylen und Styrol, in denen der Anteil der Säure mindestens 50 Gew.-% beträgt. Als wasserlösliche organische Buildersubstanzen können auch Terpolymere eingesetzt werden, die als Monomere zwei ungesättigte Säuren und/oder deren Salze sowie als drittes Monomer Vinylalkohol und/ oder ein Vinylalkohol-Derivat oder ein Kohlenhydrat enthalten. Das erste saure Monomer beziehungsweise dessen Salz leitet sich von einer monoethylenisch ungesättigten C3-C8-Carbonsäure und vorzugsweise von einer C3-C4-Monocarbonsäure, insbesondere von (Meth)-acrylsäure ab. Das zweite saure Monomer beziehungsweise dessen Salz kann ein Derivat einer C4-C8-Dicarbonsäure sein, wobei Maleinsäure besonders bevorzugt ist. Die dritte monomere Einheit wird in diesem Fall von Vinylalkohol und/oder vorzugsweise einem veresterten Vinylalkohol gebildet. Insbesondere sind Vinylalkohol-Derivate bevorzugt, welche einen Ester aus kurzkettigen Carbonsäuren, beispielsweise von C1-C4-Carbonsäuren, mit Vinylalkohol darstellen. Bevorzugte Polymere enthalten dabei 60 Gew.-% bis 95 Gew.-%, insbesondere 70 Gew.-% bis 90 Gew.-% (Meth)acrylsäure bzw. (Meth)acrylat, besonders bevorzugt Acrylsäure bzw. Acrylat, und Maleinsäure bzw. Maleinat sowie 5 Gew.-% bis 40 Gew.-%, vorzugsweise 10 Gew.-% bis 30 Gew.-% Vinylalkohol und/oder Vinylacetat. Ganz besonders bevorzugt sind dabei Polymere, in denen das Gewichtsverhältnis von (Meth)acrylsäure beziehungsweise (Meth)acrylat zu Maleinsäure beziehungsweise Maleinat zwischen 1:1 und 4:1, vorzugsweise zwischen 2:1 und 3:1 und insbesondere 2:1 und 2,5:1 liegt. Dabei sind sowohl die Mengen als auch die Gewichtsverhältnisse auf die Säuren bezogen. Das zweite saure Monomer beziehungsweise dessen Salz kann auch ein Derivat einer Allylsulfonsäure sein, die in 2-Stellung mit einem Alkylrest, vorzugsweise mit einem C1-C4-Alkylrest, oder einem aromatischen Rest, der sich vorzugsweise von Benzol oder Benzol-Derivaten ableitet, substituiert ist. Bevorzugte Terpolymere enthalten dabei 40 Gew.-% bis 60 Gew.-%, insbesondere 45 bis 55 Gew.-% (Meth)acrylsäure beziehungsweise (Meth)acrylat, besonders bevorzugt Acrylsäure beziehungsweise Acrylat, 10 Gew.-% bis 30 Gew.-%, vorzugsweise 15 Gew.-% bis 25 Gew.-% Methallylsulfonsäure bzw. Methallylsulfonat und als drittes Monomer 15 Gew.-% bis 40 Gew.-%, vorzugsweise 20 Gew.-% bis 40 Gew.-% eines Kohlenhydrats. Dieses Kohlenhydrat kann dabei beispielsweise ein Mono-, Di-, Oligo- oder Polysaccharid sein, wobei Mono-, Di- oder Oligosaccharide bevorzugt sind. Besonders bevorzugt ist Saccharose. Durch den Einsatz des dritten Monomers werden vermutlich Sollbruchstellen in das Polymer eingebaut, die für die gute biologische Abbaubarkeit des Polymers verantwortlich sind. Diese Terpolymere weisen im Allgemeinen eine relative mittlere Molekülmasse zwischen 1 000 g/mol und 200 000 g/mol, vorzugsweise zwischen 200 g/mol und 50 000 g/mol auf. Weitere bevorzugte Copolymere sind solche, die als Monomere Acrolein und Acrylsäure/Acrylsäuresalze beziehungsweise Vinylacetat aufweisen. Die organischen Buildersubstanzen können, insbesondere zur Herstellung flüssiger Mittel, in Form wässriger Lösungen, vorzugsweise in Form 30- bis 50-gewichtsprozentiger wässriger Lösungen eingesetzt werden. Alle genannten Säuren werden in der Regel in Form ihrer wasserlöslichen Salze, insbesondere ihre Alkalisalze, eingesetzt.
- Derartige organische Buildersubstanzen können gewünschtenfalls in Mengen bis zu 40 Gew.-%, insbesondere bis zu 25 Gew.-% und vorzugsweise von 1 Gew.-% bis 8 Gew.-% enthalten sein. Mengen nahe der genannten Obergrenze werden vorzugsweise in pastenförmigen oder flüssigen, insbesondere wasserhaltigen, Mitteln eingesetzt.
- Als wasserlösliche anorganische Buildermaterialien kommen insbesondere Polyphosphate, vorzugsweise Natriumtriphosphat, in Betracht. Als wasserunlösliche anorganische Buildermaterialien werden insbesondere kristalline oder amorphe, wasserdispergierbare Alkalialumosilikate, in Mengen nicht über 25 Gew.-%, vorzugsweise von 3 Gew.-% bis 20 Gew.-% und insbesondere in Mengen von 5 Gew.-% bis 15 Gew.-% eingesetzt. Unter diesen sind die kristallinen Natriumalumosilikate in Waschmittelqualität, insbesondere Zeolith A, Zeolith P sowie Zeolith MAP und gegebenenfalls Zeolith X, bevorzugt. Mengen nahe der genannten Obergrenze werden vorzugsweise in festen, teilchenförmigen Mitteln eingesetzt. Geeignete Alumosilikate weisen insbesondere keine Teilchen mit einer Korngröße über 30 µm auf und bestehen vorzugsweise zu wenigstens 80 Gew.-% aus Teilchen mit einer Größe unter 10 µm. Ihr Calciumbindevermögen liegt in der Regel im Bereich von 100 bis 200 mg CaO pro Gramm.
- Zusätzlich oder alternativ zum genannten wasserunlöslichen Alumosilikat und Alkalicarbonat können weitere wasserlösliche anorganische Buildermaterialien enthalten sein. Zu diesen gehören neben den Polyphosphaten wie Natriumtriphosphat insbesondere die wasserlöslichen kristallinen und/oder amorphen Alkalisilikat-Builder. Derartige wasserlösliche anorganische Buildermaterialien sind in den Mitteln vorzugsweise in Mengen von 1 Gew.-% bis 20 Gew.-%, insbesondere von 5 Gew.-% bis 15 Gew.-% enthalten. Die als Buildermaterialien brauchbaren Alkalisilikate weisen vorzugsweise ein molares Verhältnis von Alkalioxid zu SiO2 unter 0,95, insbesondere von 1:1,1 bis 1:12 auf und können amorph oder kristallin vorliegen. Bevorzugte Alkalisilikate sind die Natriumsilikate, insbesondere die amorphen Natriumsilikate, mit einem molaren Verhältnis Na2O:SiO2 von 1:2 bis 1:2,8. Als kristalline Silikate, die allein oder im Gemisch mit amorphen Silikaten vorliegen können, werden vorzugsweise kristalline Schichtsilikate der allgemeinen Formel Na2SixO2x+1 · y H2O eingesetzt, in der x, das sogenannte Modul, eine Zahl von 1,9 bis 4 und y eine Zahl von 0 bis 20 ist und bevorzugte Werte für x 2, 3 oder 4 sind. Bevorzugte kristalline Schichtsilikate sind solche, bei denen x in der genannten allgemeinen Formel die Werte 2 oder 3 annimmt. Insbesondere sind sowohl β- als auch δ-Natriumdisitikate (Na2Si2O5 · y H2O) bevorzugt. Auch aus amorphen Alkalisilikaten hergestellte, praktisch wasserfreie kristalline Alkalisilikate der obengenannten allgemeinen Formel, in der x eine Zahl von 1,9 bis 2,1 bedeutet, können in den Mitteln eingesetzt werden. In einer weiteren bevorzugten Ausführungsform wird ein kristallines Natriumschichtsilikat mit einem Modul von 2 bis 3 eingesetzt, wie es aus Sand und Soda hergestellt werden kann. Natriumsilikate mit einem Modul im Bereich von 1,9 bis 3,5 werden in einer weiteren Ausführungsform eingesetzt. In einer bevorzugten Ausgestaltung solcher Mittel setzt man ein granulares Compound aus Alkalisilikat und Alkalicarbonat ein, wie es zum Beispiel unter dem Namen Nabion® 15 im Handel erhältlich ist.
- Als in den Waschmitteln gegebenenfalls enthaltene Enzyme kommen insbesondere solche aus der Klasse der Proteasen, Cutinasen, Amylasen, Pullulanasen, Xylanasen, Hemicellulasen, Cellulasen, Peroxidasen sowie Oxidasen beziehungsweise deren Gemische in Frage, wobei der Einsatz von Protease, Amylase und/oder Cellulase besonders bevorzugt ist. Der Anteil beträgt vorzugsweise 0,2 Gew.-% bis 1,5 Gew.-%, insbesondere 0,5 Gew.-% bis 1 Gew.-%. Die Enzyme können in üblicher Weise an Trägerstoffen adsorbiert und/oder in Hüllsubstanzen eingebettet sein oder als konzentrierte, möglichst wasserfreie Flüssigformulierungen eingearbeitet werden.
- Geeignete Vergrauungsinhibitoren beziehungsweise soil-release-Wirkstoffe sind Celluloseether, wie Carboxymethylcellulose, Methylcellulose, Hydroxyalkylcellulosen und Cellulosemischether, wie Methylhydroxyethylcellulose, Methylhydroxypropylcellulose und Methyl-Carboxymethylcellulose. Vorzugsweise werden Natrium-Carboxymethylcellulose und deren Gemische mit Methylcellulose eingesetzt. Zu den üblicherweise eingesetzten Soil-release-Wirkstoffen gehören Copolyester, die Dicarbonsäureeinheiten, Alkylenglykoleinheiten und Polyalkylenglykoleinheiten enthalten. Der Anteil an Vergrauungsinhibitoren und/oder soil-release-Wirkstoffen in den Mitteln liegt im allgemeinen nicht über 2 Gew.-% und beträgt vorzugsweise 0,5 Gew.-% bis 1,5 Gew.-%.
- Als optische Aufheller für insbesondere Textilien aus Cellulosefasern (zum Beispiel Baumwolle) können in Waschmitteln beispielsweise Derivate der Diaminostilbendisulfonsäure beziehungsweise deren Alkalimetallsalze enthalten sein. Geeignet sind zum Beispiel Salze der 4,4'-Bis(2-anilino-4-morpholino-1,3,5-triazin-6-yl-amino)-stilben-2,2'-disulfonsäure oder gleichartig aufgebaute Verbindungen, die anstelle der Morpholinogruppe eine Diethanolaminogruppe, eine Methylaminogruppe oder eine 2-Methoxyethylaminogruppe tragen. Weiterhin können Aufheller vom Typ des substituierten 4,4'-Distyryl-diphenyl anwesend sein, zum Beispiel 4,4'-Bis-(4-chlor-3-sulfostyryl)-diphenyl. Auch Gemische von Aufhellern können verwendet werden. Für Polyamidfasern eignen sich besonders gut Aufheller vom Typ der 1,3-Diaryl-2-pyrazoline, beispielsweise 1-(p-Sulfoamoylphenyl)-3-(p-chlorphenyl)-2-pyrazolin sowie gleichartig aufgebaute Verbindungen. Der Gehalt des Mittels an optischen Aufhellern oder Aufhellergemischen liegt im allgemeinen nicht über 1 Gew.-% und vorzugsweise im Bereich von 0,05 Gew.-% bis 0,5 Gew.-%.
- Zu den in Waschmitteln einsetzbaren üblichen Schaumregulatoren gehören beispielsweise Polysiloxan-Kieselsäure-Gemische, wobei die darin enthaltene feinteilige Kieselsäure vorzugsweise silaniert oder anderweitig hydrophobiert ist. Die Polysiloxane können sowohl aus linearen Verbindungen wie auch aus vernetzten Polysiloxan-Harzen sowie aus deren Gemischen bestehen. Weitere Entschäumer sind Paraffinkohlenwasserstoffe, insbesondere Mikroparaffine und Paraffinwachse, deren Schmelzpunkt oberhalb 40 °C liegt, gesättigte Fettsäuren beziehungsweise Seifen mit insbesondere 20 bis 22 C-Atomen, zum Beispiel Natriumbehenat, und Alkalisalze von Phosphorsäuremono- und/oder -dialkylestern, in denen die Alkylketten jeweils 12 bis 22 C-Atome aufweisen. Unter diesen wird bevorzugt Natriummonoalkylphosphat und/oder -dialkylphosphat mit C16- bis C18-Alkylgruppen eingesetzt. Der Anteil der Schaumregulatoren kann vorzugsweise 0,2 Gew.-% bis 2 Gew.-% betragen.
- Die Mittel können Wasser als Lösungsmittel enthalten. Zu den in den Mitteln, insbesondere wenn sie in flüssiger oder pastöser Form vorliegen, verwendbaren organischen Lösungsmitteln gehören Alkohole mit 1 bis 4 C-Atomen, insbesondere Methanol, Ethanol, Isopropanol und tert.-Butanol, Diole mit 2 bis 4 C-Atomen, insbesondere Ethylenglykol und Propylenglykol, sowie deren Gemische und die aus den genannten Verbindungsklassen ableitbaren Ether. Derartige wassermischbare Lösungsmittel sind in den Mitteln in Mengen von vorzugsweise nicht über 20 Gew.-%, insbesondere von 1 Gew.-% bis 15 Gew.-%, vorhanden.
- Zur Einstellung eines gewünschten, sich durch die Mischung der übrigen Komponenten nicht von selbst ergebenden pH-Werts können die Mittel system- und umweltverträgliche Säuren, insbesondere Citronensäure, Essigsäure, Weinsäure, Äpfelsäure, Milchsäure, Glykolsäure, Bernsteinsäure, Glutarsäure und/oder Adipinsäure, aber auch Mineralsäuren, insbesondere Schwefelsäure oder Alkalihydrogensulfate, oder Basen, insbesondere Ammonium- oder Alkalihydroxide, enthalten. Derartige pH-Regulatoren sind vorzugsweise nicht über 10 Gew.-%, insbesondere von 0,5 Gew.-% bis 6 Gew.-%, enthalten.
- Die Herstellung fester Mittel bietet keine Schwierigkeiten und kann in im Prinzip bekannter Weise, zum Beispiel durch Sprühtrocknen oder Granulation, erfolgen, wobei thermisch empfindliche Inhaltsstoffe gegebenenfalls später getrennt zugesetzt werden.
- Mittel in Form wässriger oder sonstige übliche Lösungsmittel enthaltender Lösungen werden besonders vorteilhaft durch einfaches Mischen der Inhaltsstoffe, die in Substanz oder als Lösung in einen automatischen Mischer gegeben werden können, hergestellt.
- Die Mittel liegen vorzugsweise als pulverförmige, granulare oder tablettenförmige Präparate vor, die in an sich bekannter Weise, beispielsweise durch Mischen, Granulieren, Walzenkompaktieren und/oder durch Sprühtrocknung der thermisch belastbaren Komponenten und Zumischen der empfindlicheren Komponenten, zu denen insbesondere Enzyme, Bleichmittel und bleichaktivierende Wirkstoffe zu rechnen sind, hergestellt werden können. Zur Herstellung von Mitteln mit erhöhtem Schüttgewicht, insbesondere im Bereich von 650 g/l bis 950 g/l, ist ein einen Extrusionsschritt aufweisendes Verfahren bevorzugt.
- Zur Herstellung von Mitteln in Tablettenform geht man vorzugsweise derart vor, daß man alle Bestandteile in einem Mischer miteinander vermischt und das Gemisch mittels herkömmlicher Tablettenpressen, beispielsweise Exzenterpressen oder Rundläuferpressen, mit Preßdrucken im Bereich von 200 · 105 Pa bis 1 500 · 105 Pa verpresst. Man erhält so problemlos bruchfeste und dennoch unter Anwendungsbedingungen ausreichend schnell lösliche Tabletten mit Biegefestigkeit von normalerweise über 150 N. Vorzugsweise weist eine derart hergestellte Tablette ein Gewicht von 15 g bis 40 g, insbesondere von 20 g bis 30 g auf, bei einem Durchmesser von 35 mm bis 40 mm.
- Ein proteasefreies und Acylhydrazon-haltiges pulverförmiges Waschmittel V1, die ansonsten mit V1 identischen Protease-haltigen und acylhydrazonfreien Waschmittel V2, V3, V4 und V5 und die Protease- und Acylhydrazon-haltigen Waschmittel E1 und E2 mit den in der nachfolgenden Tabelle 1 angegebenen Zusammensetzungen (Inhaltsstoffe in Gew.-%) wurden bei 20 °C in Waschversuchen bei einer Dosierung von 67,5 g pro 17 l Wasser in einer Miele® W1935 Waschmaschine getestet. Zum Vergleich kamen Mittel V6 und V7 zum Einsatz, die andere Proteasen enthielten und ansonsten in ihrer Zusammensetzung den Mitteln E1 und E2 entsprachen. Die Proteasen wurden in den Mitteln jeweils aktivitätsgleich eingesetzt.
Tabelle 1: Waschmittelzusammensetzungen Inhaltsstoff V1 V2 V3 V4 V5 E1 E2 V6 V7 LAS - Na 12 12 12 12 12 12 12 12 12 Na-C12/18-Alkylsulfat 3 3 3 3 3 3 3 3 3 FA 7 EO 3 3 3 3 3 3 3 3 3 Na-C16/18-Seife 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 HEDP-Na4 1 1 1 1 1 1 1 1 1 Polyacrylat 2 2 2 2 2 2 2 2 2 Zeolith A 20 20 20 20 20 20 20 20 20 Na-Carboxymethylcellulose 2 2 2 2 2 2 2 2 2 Natriumpercarbonat 20 20 20 20 20 20 20 20 20 TAED 10 10 10 10 10 10 10 10 10 Acylhydrazon1) 0,1 - - - - 0,1 0,1 0,1 0,1 Enzyme2) 2 2 2 2 2 2 2 2 2 Protease I3) - 2 - - - 2 - - - Protease II4) - - 2 - - - 2 - - Protease III5) - - - 2 - - - 2 - Protease IV6) - - - - 2 - - - 2 Natriumsulfat, Wasser auf 100 1) Morpholinium-4-(2-(2-((2-Hydroxyphenylmethyl)-methylen)-hydrazinyl)-2-oxoethyl)-4-methylchlorid 2) Lipase/Amylase/Cellulase-Granulat 3) Granulat mit Protease BLAP X wie beschrieben in Abschnitt [0045] der EP 2 395 071 A1 4) Granulat mit einer Protease gemäß SEQ ID NO: 3 5) Granulat mit Protease BLAP R wie beschrieben in Abschnitt [0045] der EP 2 395 071 A1 6) Granulat mit einer Protease gemäß SEQ ID NO: 4 - Neben sauberer Füllwäsche kamen standardisierte Anschmutzungen von Tee auf Baumwolle (A1), schwarzem Johannisbeersaft auf Baumwolle (A2) und Heidelbeersaft auf Baumwolle (A3) zum Einsatz.
- Es ergaben sich nach Trocknen folgende Werte für die Unterschiede der Weißgrade (dY-Wert) im Vergleich der acylhydrazonfreien Mittel mit den entsprechenden acylhydrazonhaltigen Mitteln
Tabelle 2: Waschleistungsunterschiede Anschmutzung Y(E1) - Y(V2) Y (E2) - Y(V3) Y(V6) - Y(V4) Y(V7) - Y(V5) A1 2,0 1,5 1,0 1,1 A2 1,2 1,0 0,0 0,6 A3 1,1 0,6 0,4 0,1 -
- <110> Henkel AG & Co. KGaA
- <120> Wasch- und Reinigungsmittel mit erhöhter Bleichleistung
- <130> PT032614_PCT
- <150>
DE102014209241.8
<151> 2014-05-15 - <160> 4
- <170> PatentIn version 3.5
- <210> 1
<211> 269
<212> PRT
<213> Bacillus lentus - <400> 1
- <210> 2
<211> 269
<212> PRT
<213> artificial - <220>
<223> Subtilisin 309 - <400> 2
- <210> 3
<211> 269
<212> PRT
<213> artificial - <220>
<223> Subtilisin 309 mutant - <400> 3
- <210> 4
<211> 270
<212> PRT
<213> artificial - <220>
<223> Subtilisin 309 mutant - <400> 4
Claims (10)
- Verwendung einer Protease, ausgewählt ausa) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:1 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 98,5% identisch ist und in der Zählung gemäß SEQ ID NO:1 an der Position 193 die Aminosäure V und/oder an der Position 211 die Aminosäure L aufweist,b) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:2 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 70% identisch ist und in der Zählung gemäß SEQ ID NO:2 an der Position 9 die Aminosäure R und/oder an der Position 15 die Aminosäure T und/oder an der Position 66 die Aminosäure A und/oder an der Position 212 die Aminosäure D und/oder an der Position 239 die Aminosäure R aufweist, undc) deren Mischungen,in der R1 für eine CF3 oder für eine C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, Phenyl-, Naphthyl-, C7-9-Aralkyl, C3-20-Heteroalkyl- oder C3-12-Cycloheteroalkylgruppe,R2 und R3 unabhängig voneinander für Wasserstoff oder eine gegebenenfalls substituierte C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-28-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkyl-, Phenyl-, Naphthyl- oder Heteroarylgruppe oder R2 und R3 zusammen mit dem sie verbindenden Kohlenstoffatom für einen gegebenenfalls substituierten 5-, 6-, 7-, 8- oder 9-gliedrigen Ring, der gegebenenfalls Heteroatome enthalten kann, undR4 für Wasserstoff oder eine C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-20-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkylgruppe oder eine gegebenenfalls substituierte Phenyl- oder Naphthyl- oder Heteroarylgruppestehen, beim Waschen von Textilien oder der Reinigung harter Oberflächen in Gegenwart persauerstoffhaltiger Wasch- oder Reinigungsmittel.
- Verwendung nach Anspruch 1, dadurch gekennzeichnet, dass die Konzentration der Verbindung gemäß Formel (I) in wässriger Flotte 0,5 µmol/l bis 500 µmol/l, insbesondere 5 µmol/l bis 100 µmol/l beträgt.
- Verwendung nach Anspruch 1 oder 2, dadurch gekennzeichnet, dass die Persauerstoffkonzentration (berechnet als H2O2) in der Flotte im Bereich von 0,001 g/l bis 10 g/l, insbesondere von 0,1 g/l bis 1 g/l liegt.
- Wasch- oder Reinigungsmittel, enthaltend ein persauerstoffhaltiges Bleichmittel, eine Protease, ausgewählt ausa) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:1 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 98,5% identisch ist und in der Zählung gemäß SEQ ID NO:1 an der Position 193 die Aminosäure V und/oder an der Position 211 die Aminosäure L aufweist,b) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:2 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 70% identisch ist und in der Zählung gemäß SEQ ID NO:2 an der Position 9 die Aminosäure R und/oder an der Position 15 die Aminosäure T und/oder an der Position 66 die Aminosäure A und/oder an der Position 212 die Aminosäure D und/oder an der Position 239 die Aminosäure R aufweist, undc) deren Mischungen,in der R1 für eine CF3 oder für eine C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, Phenyl-, Naphthyl-, C7-9-Aralkyl, C3-20-Heteroalkyl- oder C3-12-Cycloheteroalkylgruppe,R2 und R3 unabhängig voneinander für Wasserstoff oder eine gegebenenfalls substituierte C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-28-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkyl-, Phenyl-, Naphthyl- oder Heteroarylgruppe oder R2 und R3 zusammen mit dem sie verbindenden Kohlenstoffatom für einen gegebenenfalls substituierten 5-, 6-, 7-, 8- oder 9-gliedrigen Ring, der gegebenenfalls Heteroatome enthalten kann, undR4 für Wasserstoff oder eine C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-20-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkylgruppe oder eine gegebenenfalls substituierte Phenyl- oder Naphthyl- oder Heteroarylgruppestehen.
- Mittel nach Anspruch 4, dadurch gekennzeichnet, dass es 0,001 Gew.-% bis 5 Gew.-%, insbesondere 0,05 Gew.-% bis 0,15 Gew.-% der Verbindung gemäß Formel (I) enthält.
- Mittel nach Anspruch 4 oder 5, dadurch gekennzeichnet, dass es Protease in Mengen von 0,005 Gew.-% bis 1,0 Gew.-%, insbesondere 0,01 Gew.-% bis 0,5 Gew.-%, jeweils bezogen auf aktives Protein, enthält.
- Mittel nach einem der Ansprüche 4 bis 6, dadurch gekennzeichnet, dass es Persauerstoffverbindungen in Mengen von bis zu 50 Gew.-%, insbesondere von 2 Gew.-% bis 45 Gew.-% enthält.
- Mittel nach einem der Ansprüche 4 bis 7, dadurch gekennzeichnet, dass es Bleichaktivatoren in Mengen von bis zu 10 Gew.-%, insbesondere von 1,5 Gew.-% bis 5 Gew.-% enthält.
- Verwendung nach einem der Ansprüche 1 bis 3 oder Mittel nach einem der Ansprüche 4 bis 8, dadurch gekennzeichnet, dass die Verbindung der allgemeinen Formel (I) der allgemeinen Formel (II) entspricht,trägt, in dem R10 für Wasserstoff oder eine C1-28-Alkyl-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-20-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkylgruppe und A- für das Anion einer organischen oder anorganischen Säure steht, R2 und R4 die für Formel (I) angegebenen Bedeutung haben undR5, R6, R7 und R8 unabhängig voneinander für R1, Wasserstoff, Halogen, eine Hydroxy-, Amino-, eine gegebenenfalls substituierte N-mono-oder di-C1-4-alkyl- oder C2-4-hydroxyalkyl-amino-, N-Phenyl- oder N-Naphthyl-amino-, C1-28-Alkyl-, C1-28-Alkoxy-, Phenoxy-, C2-28-Alkenyl-, C2-22-Alkinyl-, C3-12-Cycloalkyl-, C3-12-Cycloalkenyl-, C7-9-Aralkyl-, C3-20-Heteroalkyl-, C3-12-Cycloheteroalkyl-, C5-16-Heteroaralkyl-, Phenyl- oder Naphthylgruppe stehen, wobei die Substituenten ausgewählt werden aus C1-4-Alkyl-, C1-4-Alkoxy-, Hydroxy-, Sulfo-, Sulfato-, Halogen-, Cyano-, Nitro-, Carboxy-, Phenyl-, Phenoxy-, Naphthoxy-, Amino-, N-mono-oder di-C1-4-alkyl- oder C2-4-hydroxyalkyl-amino-, N-Phenyl- oder N-Naphthyl-aminogruppen, oderR5 und R6 oder R6 und R7 oder R7 und R8 unter Ausbildung von 1, 2 oder 3 carbocyclischen oder O-, NR10- oder S-heterocyclischen, gegebenenfalls aromatischen und/oder gegebenenfalls C1-6-alkylsubstituierten Ringen miteinander verbunden sind.
- Verwendung oder Mittel nach einem der voranstehenden Ansprüche, dadurch gekennzeichnet, dass die Protease ausgewählt wird ausa) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:1 angegebenen Aminosäuresequenz über deren Gesamtlänge zu mindestens 99% identisch ist,b) Proteasen umfassend eine Aminosäuresequenz, die zu der in SEQ ID NO:2 angegebenen Aminosäuresequenz über deren Gesamtlänge zunehmend bevorzugt zu mindestens 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 90,5%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5% und 99% identisch ist, undc) deren Mischungen.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PL15720976.8T PL3143115T5 (pl) | 2014-05-15 | 2015-05-05 | Środek piorący i czyszczący o zwiększonej mocy wybielającej |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102014209241.8A DE102014209241A1 (de) | 2014-05-15 | 2014-05-15 | Wasch- und Reinigungsmittel mit erhöhter Bleichleistung |
| PCT/EP2015/059766 WO2015173055A1 (de) | 2014-05-15 | 2015-05-05 | Wasch- und reinigungsmittel mit erhöhter bleichleistung |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| EP3143115A1 EP3143115A1 (de) | 2017-03-22 |
| EP3143115B1 EP3143115B1 (de) | 2020-02-19 |
| EP3143115B2 true EP3143115B2 (de) | 2024-08-14 |
Family
ID=53055045
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP15720976.8A Active EP3143115B2 (de) | 2014-05-15 | 2015-05-05 | Wasch- und reinigungsmittel mit erhöhter bleichleistung |
Country Status (4)
| Country | Link |
|---|---|
| EP (1) | EP3143115B2 (de) |
| DE (1) | DE102014209241A1 (de) |
| PL (1) | PL3143115T5 (de) |
| WO (1) | WO2015173055A1 (de) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102014220663A1 (de) * | 2014-10-13 | 2016-04-14 | Henkel Ag & Co. Kgaa | Farbschützende Waschmittel |
| DE102015210416A1 (de) * | 2015-06-08 | 2016-12-08 | Henkel Ag & Co. Kgaa | Acylhydrazone als Enzymstabilisatoren |
| DE102015225874A1 (de) * | 2015-12-18 | 2017-06-22 | Henkel Ag & Co. Kgaa | Flüssige Wasch- oder Reinigungsmittel enthaltend Acylhydrazon |
| DE102015225881A1 (de) * | 2015-12-18 | 2017-06-22 | Henkel Ag & Co. Kgaa | Flüssige Wasch- oder Reinigungsmittel enthaltend Acylhydrazon und Reduktionsmittel |
| EP3249032A1 (de) * | 2016-05-26 | 2017-11-29 | The Procter and Gamble Company | Waschmittelzusammensetzung mit einem bleichkatalysator und protease |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2144990T3 (es) | 1989-08-25 | 2000-07-01 | Henkel Of America Inc | Enzima proteolitica alcalina y metodo de produccion. |
| EP2889375B1 (de) | 1999-03-31 | 2019-03-20 | Novozymes A/S | Polypeptide mit alkalischer Alpha-Amylase-Aktivität und Nukleinsäuren zur Codierung davon |
| DE10131441A1 (de) | 2001-06-29 | 2003-01-30 | Henkel Kgaa | Eine neue Gruppe von alpha-Amylasen sowie ein Verfahren zur Identifizierung und Gewinnung neuer alpha-Amylasen |
| DE10163748A1 (de) | 2001-12-21 | 2003-07-17 | Henkel Kgaa | Neue Glykosylhydrolasen |
| DE102006038448A1 (de) | 2005-12-28 | 2008-02-21 | Henkel Kgaa | Enzym-haltiges Reinigungsmittel |
| DE102006022224A1 (de) | 2006-05-11 | 2007-11-15 | Henkel Kgaa | Subtilisin aus Bacillus pumilus und Wasch- und Reinigungsmittel enthaltend dieses neue Subtilisin |
| DE102007003143A1 (de) | 2007-01-16 | 2008-07-17 | Henkel Kgaa | Neue Alkalische Protease aus Bacillus gibsonii und Wasch- und Reinigungsmittel enthaltend diese neue Alkalische Protease |
| US8492324B2 (en) | 2008-04-09 | 2013-07-23 | Basf Se | Use of metal hydrazide complex compounds as oxidation catalysts |
| MX339581B (es) | 2009-09-25 | 2016-06-01 | Novozymes As | Variantes de subtilasa. |
| EP2395071A1 (de) | 2010-06-10 | 2011-12-14 | The Procter & Gamble Company | Feste Reinigungszusammensetzung mit Lipase bakterieller Herkunft |
| KR101912962B1 (ko) | 2010-12-13 | 2018-10-29 | 바스프 에스이 | 표백 촉매 |
| DE102011076417A1 (de) * | 2011-05-24 | 2012-11-29 | Henkel Ag & Co. Kgaa | Aktivatorsysteme für Persauerstoffverbindungen |
| DE102011118037A1 (de) * | 2011-06-16 | 2012-12-20 | Henkel Ag & Co. Kgaa | Geschirrspülmittel mit Bleichkatalysator und Protease |
| DE102012200333A1 (de) * | 2012-01-11 | 2013-07-11 | Henkel Ag & Co. Kgaa | Acylhydrazone als bleichverstärkende Wirkstoffe |
-
2014
- 2014-05-15 DE DE102014209241.8A patent/DE102014209241A1/de active Pending
-
2015
- 2015-05-05 PL PL15720976.8T patent/PL3143115T5/pl unknown
- 2015-05-05 EP EP15720976.8A patent/EP3143115B2/de active Active
- 2015-05-05 WO PCT/EP2015/059766 patent/WO2015173055A1/de not_active Ceased
Also Published As
| Publication number | Publication date |
|---|---|
| PL3143115T3 (pl) | 2020-08-10 |
| EP3143115A1 (de) | 2017-03-22 |
| PL3143115T5 (pl) | 2024-11-04 |
| EP3143115B1 (de) | 2020-02-19 |
| WO2015173055A1 (de) | 2015-11-19 |
| DE102014209241A1 (de) | 2015-11-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2912156B1 (de) | Verwendung von acylhydrazon in wasch- und reinigungsmitteln | |
| EP2714877B1 (de) | Aktivatorsysteme für persauerstoffverbindungen | |
| EP3143115B2 (de) | Wasch- und reinigungsmittel mit erhöhter bleichleistung | |
| DE102014221889B4 (de) | Waschmittel mit Mannosylerythritollipid, Verstärkung der Reinigungsleistung von Waschmitteln durch Mannosylerythritollipid, und Waschverfahren unter Einsatz von Mannosylerythritollipid | |
| EP3030642B1 (de) | Waschmittel mit erhöhter primärwaschkraft | |
| EP3406698A1 (de) | Bleichendes wasch- oder reinigungsmittel mit oxaziridin-vorläufer | |
| EP3152289A1 (de) | Waschmittel, enthaltend mindestens eine laccase als farbübertragungsinhibitor | |
| DE102014218507A1 (de) | Spinnenseidenproteine als Enzymstabilisatoren | |
| EP3303572B1 (de) | Waschmittel mit verbesserter waschleistung, enthaltend mindestens eine laccase | |
| EP4061918B1 (de) | Bleichaktivator mit kationischer gruppe und diesen enthaltendes wasch- oder reinigungsmittel | |
| DE102012219405A1 (de) | Katalytische Verstärkung der Bleichwirkung von Persauerstoffverbindungen | |
| EP3095847B1 (de) | Wasch- und reinigungsmittel mit verbesserter hygieneleistung | |
| DE102019217852A1 (de) | Bleichaktivator mit kationischer Gruppe und diesen enthaltendes Wasch- oder Reinigungsmittel IV | |
| DE102015210368A1 (de) | Waschmittel mit verbesserter Waschleistung, enthaltend mindestens eine Laccase | |
| EP2727987B1 (de) | Polymere zur antimikrobiellen Ausrüstung | |
| DE102015225882A1 (de) | Partikuläres Mittel zur Verstärkung der Bleichwirkung | |
| EP3075835A2 (de) | Partikuläres waschmittel mit bleichekatalysator | |
| EP3409756A1 (de) | Bleichendes wasch- oder reinigungsmittel | |
| DE102019217850A1 (de) | Bleichaktivator mit kationischer Gruppe und diesen enthaltendes Wasch- oder Reinigungsmittel II | |
| DE102015210369A1 (de) | Waschmittel mit verbesserter Waschleistung, enthaltend mindestens eine Laccase | |
| DE102015210367A1 (de) | Waschmittel mit verbesserter Waschleistung, enthaltend mindestens eine Laccase | |
| DE102015210370A1 (de) | Waschmittel mit verbesserter Waschleistung, enthaltend mindestens eine Laccase | |
| DE102017209332A1 (de) | Bleichendes Wasch- oder Reinigungsmittel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE INTERNATIONAL PUBLICATION HAS BEEN MADE |
|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: REQUEST FOR EXAMINATION WAS MADE |
|
| 17P | Request for examination filed |
Effective date: 20161109 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AL AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HR HU IE IS IT LI LT LU LV MC MK MT NL NO PL PT RO RS SE SI SK SM TR |
|
| AX | Request for extension of the european patent |
Extension state: BA ME |
|
| DAV | Request for validation of the european patent (deleted) | ||
| DAX | Request for extension of the european patent (deleted) | ||
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: EXAMINATION IS IN PROGRESS |
|
| 17Q | First examination report despatched |
Effective date: 20190108 |
|
| GRAP | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOSNIGR1 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: GRANT OF PATENT IS INTENDED |
|
| INTG | Intention to grant announced |
Effective date: 20191008 |
|
| GRAS | Grant fee paid |
Free format text: ORIGINAL CODE: EPIDOSNIGR3 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE PATENT HAS BEEN GRANTED |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AL AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HR HU IE IS IT LI LT LU LV MC MK MT NL NO PL PT RO RS SE SI SK SM TR |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: EP |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R096 Ref document number: 502015011773 Country of ref document: DE |
|
| REG | Reference to a national code |
Ref country code: AT Ref legal event code: REF Ref document number: 1234972 Country of ref document: AT Kind code of ref document: T Effective date: 20200315 |
|
| REG | Reference to a national code |
Ref country code: IE Ref legal event code: FG4D Free format text: LANGUAGE OF EP DOCUMENT: GERMAN |
|
| REG | Reference to a national code |
Ref country code: NL Ref legal event code: MP Effective date: 20200219 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FI Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: RS Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: NO Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200519 |
|
| REG | Reference to a national code |
Ref country code: LT Ref legal event code: MG4D |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: BG Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200519 Ref country code: IS Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200619 Ref country code: GR Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200520 Ref country code: LV Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: SE Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: HR Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: EE Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: SM Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: DK Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: PT Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200712 Ref country code: SK Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: RO Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: LT Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: CZ Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: ES Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R026 Ref document number: 502015011773 Country of ref document: DE |
|
| PLBI | Opposition filed |
Free format text: ORIGINAL CODE: 0009260 |
|
| PLAX | Notice of opposition and request to file observation + time limit sent |
Free format text: ORIGINAL CODE: EPIDOSNOBS2 |
|
| 26 | Opposition filed |
Opponent name: NOVOZYMES A/S Effective date: 20201117 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20200531 Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20200531 Ref country code: MC Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SI Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 |
|
| REG | Reference to a national code |
Ref country code: BE Ref legal event code: MM Effective date: 20200531 |
|
| PLBB | Reply of patent proprietor to notice(s) of opposition received |
Free format text: ORIGINAL CODE: EPIDOSNOBS3 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 20200519 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LU Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20200505 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20200505 Ref country code: GB Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20200519 Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20200531 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20200531 |
|
| REG | Reference to a national code |
Ref country code: AT Ref legal event code: MM01 Ref document number: 1234972 Country of ref document: AT Kind code of ref document: T Effective date: 20200505 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: AT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20200505 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: TR Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: MT Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: CY Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: MK Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 Ref country code: AL Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200219 |
|
| P01 | Opt-out of the competence of the unified patent court (upc) registered |
Effective date: 20230530 |
|
| PUAH | Patent maintained in amended form |
Free format text: ORIGINAL CODE: 0009272 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: PATENT MAINTAINED AS AMENDED |
|
| 27A | Patent maintained in amended form |
Effective date: 20240814 |
|
| AK | Designated contracting states |
Kind code of ref document: B2 Designated state(s): AL AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HR HU IE IS IT LI LT LU LV MC MK MT NL NO PL PT RO RS SE SI SK SM TR |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R102 Ref document number: 502015011773 Country of ref document: DE |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: PL Payment date: 20250425 Year of fee payment: 11 Ref country code: DE Payment date: 20250521 Year of fee payment: 11 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: IT Payment date: 20250527 Year of fee payment: 11 |