DK178233B1 - Fiskevaccine - Google Patents
Fiskevaccine Download PDFInfo
- Publication number
- DK178233B1 DK178233B1 DK201300530A DKPA201300530A DK178233B1 DK 178233 B1 DK178233 B1 DK 178233B1 DK 201300530 A DK201300530 A DK 201300530A DK PA201300530 A DKPA201300530 A DK PA201300530A DK 178233 B1 DK178233 B1 DK 178233B1
- Authority
- DK
- Denmark
- Prior art keywords
- nucleic acid
- salmon
- acid molecule
- vaccine
- sav
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/55—Medicinal preparations containing antigens or antibodies characterised by the host/recipient, e.g. newborn with maternal antibodies
- A61K2039/552—Veterinary vaccine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/36011—Togaviridae
- C12N2770/36111—Alphavirus, e.g. Sindbis virus, VEE, EEE, WEE, Semliki
- C12N2770/36122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/36011—Togaviridae
- C12N2770/36111—Alphavirus, e.g. Sindbis virus, VEE, EEE, WEE, Semliki
- C12N2770/36134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Virology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- Biophysics (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Mycology (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
Opfindelsens område
Denne opfindelse angår generelt nukleinsyrereagenser og deres anvendelse i metoder til forebyggelse, diagnosticering og sporing af sygdomme i forbindelse med lakse-alphavira.
Opfindelsens baggrund
Pankreassygdom (Pancreas Disease - PD) er en virussygdom, der rammer laks (atlantisk laks; Salmo salar) og regnbueørred (Oncorhynchus mykiss). Den er også kendt som laksepankreassygdom (SPD). Pankreassygdom har forårsaget omfattende produktionstab inden for irske, skotske og norske salmonid-akvakulturindustrier. Fremkalderen af PD i laks og regnbueørred er laksepankreassygdomsvirus (SPDV), almindelig kendt som salmonid-alphavirus (SAV). På grundlag af sekvensdata for strukturproteinet SAV E2 og ikke-strukturproteinet 3 (nsP3), kan SAV-stammer tilordnes seks forskellige undertyper: SAV-1, SAV-2, SAV-3, SAV-4, SAV-5 og SAV-6. Undertypen SAV-2 omfatter isolater, som indtil for nylig primært var ansvarlige for udbrud af sovesyge (SD) i ferskvandsregnbueørred (Oncorhynchus mykiss) i Europa. Medens alle til dato undersøgte udbrud af SD har været en følge af infektion med SAV-2, er udbrud af PD blevet tilskrevet SAV-1, -2, -3, -4, -5 og -6. Det er interessant, at norske SPD-udbrud hovedsagelig er blevet forårsaget af SAV-3, idet de resterende undertyper forekommer på de britiske øer. Imidlertid er udbrud af SAV-2 også for nylig blevet påvist i norske laksebestande. Horisontal overførsel af SPD er blevet påvist og menes at være den overvejende overførselsvej, støttet af den forlængede overlevelse af virus i havvand. Virusset synes at være endemisk i historisk inficerede områder på grundlag af den kendsgerning, at udbrud har vist sig at vende tilbage i efterfølgende generationer af laks, som indføres på stederne uanset omfattende brakperioder. Til støtte for spekulationer om, at der kunne eksistere et betydeligt infektionsforråd i havvandsmiljøet, har en ny undersøgelse fremvist evidens for påvisningen af SPDV-RNA i vilde havfisk, både i laksefarmområder og på steder, der ligger fjernt fra akvakulturaktivitet. Kliniske tegn i forbindelse med SPD omfatter abnorm svømme-adfærd og appetitløshed, medens karakteristiske histopatologiske tegn omfatter alvorlig degeneration af exokrin pankreas, kardiomyopati og skeletmyopati. I Irland har udbrud vist sig at forekomme i alle stadier af den marine produktionscyklus og indebærer dødelighed på op til 48%. I Norge alene er tabene som følge af SPD blevet skønnet til 100 millioner GBP (886 millioner DKK) pr. år med en forøgelse i produktionsomkostninger på 6,0 NOK (5,5 DKK) pr. kg eller 14,4 millioner NOK (13,5 millioner DKK) pr. 500.000 fisk. Tilsvarende skønnedes det for nylig, at SPD i Skotland kunne tilskrives 10% tab af hele produktionen. Idet sygdomsvækkerens tiltagende betydning og tilsyneladende allestedsnærværelse er givne, er der et klart behov for forstærket bekæmpelse af SPD. Indtil dato har fokus været rettet mod forbedring af avlsbetingelser og reduktion af stress i en bestræbelse på at minimere tab. Denne fremgangsmåde er blevet kompletteret med anvendelsen af en kommerciel inaktiveret helvirusvaccine af S AV-1-undertypen i Irland og Norge. Imidlertid har SPD uanset denne vaccines kommercielle tilgængelighed og anvendelse fortsat med at være et stort problem for den norske fiskeindustri.
Xu m.fl. har for nylig omtalt afprøvningen af vacciner på grundlag af SAV-3: en vaccine, der omfatter E2-proteinet, en vaccine, der omfatter E1-proteinet, en DNA-vaccine, der koder for E2-proteinet, en DNA-vaccine, der koder for E1-proteinet, og en inaktiveret helvirusvaccine. DNA-vaccinerne viste sig at være fuldstændig inaktive. Faktisk satte dødeligheden for de grupper, der fik en primær vaccination og derpå en boostvaccination med DNA-vaccinerne, ind 2 dage tidligere end for kontrolgruppen. Desuden fremkaldte denne vaccinationsplan med DNA-vaccinerne ikke en beskyttelse, der var forskellig fra de uvaccinerede kontroller. De grupper, der modtog en primær vaccination med E1-DNA eller E2-DNA, efterfulgt af boost med det pågældende antigen, udviste ikke et fra kontrollerne væsentlig forskelligt resultat. Det viste sig, at den inaktiverede vaccine fremkaldte den bedste beskyttelse i sammenligning med de afprøvede underenheds- og DNA-vacciner (Xu m.fl., Superior protection conferred by inactivated whole virus vaccine over subunit and DNA vaccines against salmonid alphavirus infection in Atlantic lakse-(Salmo salar L.) Vaccine 30, pp. 3918-3928 (2012)).
Imidlertid har det overraskende vist sig, at en DNA-vaccine ifølge opfindelsen ikke blot er effektiv, men giver langt bedre resultater i sammenligning med en inaktiveret helvirus-PD-vaccine. Således tilvejebringer den foreliggende opfindelse den første effektive nukleinsyrevaccine mod PD.
Kort beskrivelse af tegningerne Figur 1. Plasmid pUK21 -A2.
Figur 2. Konstruktion af plasmid pUK-SPDV-poly2#57.
Figur 3. Konstruktion af plasmid pUK-SPDV-poly2#1.
Figur 4. Kort over plasmid pUK-SPDV-poly2#1.
Figur 5. Nukleotidsekvens, der koder for His-mærket SPDV-strukturpolyprotein.
Figur 6. Nukleotidsekvens, der koder for SPDV-strukturpolyprotein.
Figur 7. Nukleotidsekvens, der koder for His-mærket SPDV-strukturpolyprotein plus vektorsekvens.
Figur 8. Aminosyresekvens for His-mærket SPDV-polyprotein.
Figur 9. Aminosyresekvens for SPDV-polyprotein.
Figur 10. Aminosyresekvens for capsid-polypeptid
Figur 11. Aminosyresekvens for E3-polypeptid.
Figur 12. Aminosyresekvens for E2-polypeptid.
Figur 13. Aminosyresekvens for 6K-polypeptid.
Figur 14. Aminosyresekvens for E1 -polypeptid.
Figur 15A-E. Histopatologiundersøgelser, der illustrerer udvalgte parametre for hjertehistopatologiindeks.
Figur 16. Hjertehistopatologiindeks svarende til forskellige vaccineportioner.
Figur 17A-B. Nekrosemålinger.
Figur 18A. Histopatologiindeks.
Figur 18B. qPCR-analyse.
Figur 19. Undersøgelse, der viser lokale reaktioner på injektionsstedet.
Figur 20. Undersøgelse, der viser persistens af plasmid ved injektionsstedet.
Figur 21-23. Dosiseffekter.
Resume af opfindelsen
Denne opfindelse angår generelt både nukleinsyremolekyler og vaccine, der omfatter nukleinsyremolekylerne, idet vaccinerne er rettede mod sygdomsvækkeren for pankreassygdom (PD) i fisk, et lakse-alphavirus (SAV).
Denne opfindelse angår nukleinsyremolekyler, polypeptider, ekspressionsvektorer og deres anvendelse til fremkaldelse af en immunreaktion i en vært i forbindelse med infektion med et lakse-alphavirus (f.eks. fremkalderen af pankreassygdom, såsom lakse-alphavirus-1 (SAV-1), lakse-alphavirus-2 (SAV-2), lakse-alphavirus-3 (SAV-3), lakse-alphavirus-4 (SAV-4), lakse-alphavirus-5 (SAV-5) eller lakse-alphavirus-6 (SAV-6) eller beslægtede varianter deraf; fortrinsvis lakse-alphavirus-1 (SAV-1), lakse-alphavirus-2 (SAV-2) eller lakse-alphavirus-3 (SAV-3) eller beslægtede varianter deraf; mere foretrukket lakse-alphavirus-3 (SAV-3) eller beslægtede varianter deraf og mest foretrukket lakse-alphavirus-3 (SAV-3)). Anvendelse af nukleinsyremolekyler, polypeptider eller ekspressionsvektorer til fremkaldelse af en immunreation i en vært mod infektion med og/eller vævsskade i forbindelse med infektion med et lakse-alphavirus kan omfatte indgivelse til værten (f.eks. en laks eller en regnbueørred og/eller en laks eller en regnbueørred, der er inficeret med et lakse-alphavirus) af et nukleinsyremolekyle, der deler identitet med SEQ ID NO: 2.
I en foretrukken udførelsesform er nukleinsyremolekylet SEQ ID NO: 1 eller SEQ ID NO: 2 (fortrinsvis SEQ ID NO: 2).
I en særlig foretrukken udførelsesform omfatter vaccinen et nukleinsyremolekyle, der deler identitet med SEQ ID NO: 1 eller SEQ ID NO: 2.
Særlig foretrukket omfatter vaccinen ifølge opfindelsen nukleinsyremolekylet SEQ ID NO: 2.
I en særlig foretrukken udførelsesform omfatter vaccinen ifølge opfindelsen nukleinsyremolekylet SEQ ID NO: 3.
I visse udførelsesformer kan nukleinsyremolekylet være et plasmid. Sammensætninger, der omfatter sådanne nukleinsyrer og/eller peptider og/eller polypeptider svarende til lakse-alphavira er også omfattet. Andre udførelsesformer tilvejebringes også som beskrevet her.
Fremgangsmåder til indgivelse af en vaccine og måling af enhver af fagfolk kendt parameter til angivelse af vævsskade er forekommet efter udsættelse for et smitstof, som vaccinen menes at bekæmpe (f.eks. profylaktisk eller terapeutisk) og sammenligning af den eller de parametre med de samme i en uvaccineret vært udsat for smitstoffet for at bestemme forskelle i den parameter, hvor en forskel angiver, at vaccinen er effektiv, omtales.
Andre udførelsesformer vil fremgå klart for en person med sædvanligt fagkundskab ud fra denne redegørelse.
Detaljeret beskrivelse
Denne redegørelse angår løsninger på det løbende og uopfyldte behov for behandling af sygdomme hos fisk, der forårsages af lakse-alphavirus (“SAV”) (f.eks. pankreas-sygdom). Nukleinsyresekvenser og aminosyresekvenser, der repræsenterer de samme, tilvejebringes også. Nukleinsyremolekyler, der omfatter sådanne nukleinsyresekvenser og/eller koder for sådanne aminosyresekvenser, tilvejebringes også. SAV-polypeptider, peptider, fragmenter og derivater deraf tilvejebringes også. Fremgangsmåde til behandling og/eller forebyggelse af sådanne sygdomme, fremkaldelse og/eller forstærkning af en immunreaktion mod SAV, påvisning og isolering af SAV tilvejebringes også.
I en foretrukken udførelsesform angår vaccinen ifølge opfindelsen til anvendelse mod én eller flere undertyper af laksepankreassygdomsvirus, hvor denne er valgt fra gruppen bestående af SAV-1, SAV-2, SAV-3, SAV-4, SAV-5 og SAV-6. Fortrinsvis er vaccinen ifølge opfindelsen til anvendelse mod SAV-1, SAV-2 eller SAV-3, mere foretrukket til anvendelse mod SAV-3.
Undertype 3 af laksepankreassygdomsvirus repræsenteres f.eks. af isolaterne Nor PD97-N3, Nor SavH20/03, Nor SavH 10/02, Nor SavSF21/03, NOR 04 170 og NOR 07 170. Disse tjener kun til illustration, og opfindelsen er ikke begrænset til anvendelse af disse isolater.
Et nukleinsyremolekyle, der koder for et polypeptid, som deler identitet med et SPDV-polypeptid (fortrinsvis SEQ ID NO: 5) til anvendelse til fremkaldelse af en immunreaktion i en vært mod infektion med og/eller vævsskade i forbindelse med infektion med et lakse-alphavirus (f.eks. sygdomsvækkeren for pankreassygdom, såsom lakse-alphavirus-1 (SAV-1), lakse-alphavirus-2 (SAV-2), lakse-alphavirus-3 (SAV-3) eller beslægtede varianter deraf) kan omfatte indgivelse til værten (f.eks. en laks eller en regnbueørred og/eller en laks eller en regnbueørred, der er inficeret med et lakse-alphavirus).
Derivat deraf angår substitutioner i den ved SEQ ID NO: 5 repræsenterede sekvens, som f.eks. kan indeholde mindst én substitution ved en vilkårlig eller flere aminosyrer valgt fra gruppen bestående af 21, 47, 116, 130, 141, 203, 205, 221, 269, 278, 321, 347, 351,362, 409, 512, 550, 551, 574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771,838, 839, 840, 841,842, 843, 844, 845, 846, 847, 848, 849, 850, 851, 852, 853, 854, 855, 856, 857, 858, 859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og/eller 1303 i SEQ ID NO: 5 (hver kombination af substitutioner og ikke-substitutioner i disse positioner udgør et SPDV-polypeptid), se de understregede aminosyrer i fig. 8 til 14).
Et eksempel på et SPDV-polyprotein (som f.eks. ligner SEQ ID NO: 4 eller 5, fortrinsvis SEQ ID NO: 4) eller et delprotein deraf (f.eks. capsid, E3, E2, 6K og/eller E1, som ligner som en vilkårlig af SEQ ID NO: 6-10) kan også omfatte en aminosyresekvens svarende til en vilkårlig af aminosyrerne 21,47, 116, 130, 141,203, 221, 269, 278, 321,347, 351,362, 409, 512, 550, 551,574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771,838, 839, 840, 841, 842, 843, 844, 845, 846, 847, 848, 849, 850, 851, 852, 853, 854, 855, 856, 857, 858, 859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og/eller 1303 i SEQ ID NO: 5; f.eks. de understregede aminosyrer i fig. 8 til 14).
I visse udførelsesformer kan nukleinsyremolekylet være et plasmid.
I en foretrukken udførelsesform angår opfindelsen et isoleret nukleinsyremolekyle, der koder for polypeptider med SEQ ID NO: 5.
Det isolerede nukleinsyremolekyle kan omfatte en sekvens valgt fra gruppen bestående af SEQ ID NO: 1, SEQ ID NO: 2 og SEQ ID NO: 3.
Fortrinsvis koder det isolerede nukleinsyremolekyle for et lakse-alphavirus (SAV) polyprotein, hvori SAV polyproteinet er mindst 98% identisk med SEQ ID NO: 5, mere foretrukket koder for polypeptidsekvensen SEQ ID NO: 5.
Endvidere foretrækkes det, at det isolerede nukleinsyremolekyle koder for SEQ ID NO: 5, som omfatter mindst én substitution ved en aminosyre valgt fra gruppen bestående af 21,47, 116, 130, 141, 203, 221, 269, 278, 321,347, 351, 362, 409, 512, 550, 551, 574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771, 838-859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og 1303.
I anden foretrukken udførelsesform angår opfindelsen et isoleret polypeptid med aminosyresekvensen SEQ ID NO: 5.
Det isolerede polypeptid kan have aminosyresekvensen SEQ ID NO: 5 omfattende mindst én substitution ved en aminosyre valgt fra gruppen bestående af 21, 47, 116, 130, 141,203, 221,269, 278, 321, 347, 351,362, 409, 512, 550, 551,574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771, 838-859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og 1303.
Mere foretrukket har det isolerede polypeptid aminosyresekvensen SEQ ID NO: 4.
I endnu en foretrukken udførelsesform angår opfindelsen et isoleret polypeptid, der deler mindst 98% identitet med SEQ ID NO: 5.
Det isolerede polypeptid eller peptid der deler mindst 98% identitet med SEQ ID NO: 5, omfatter mindst én af aminosyrerne 21,47, 116, 130, 141,203, 221, 269, 278, 321, 347, 351, 362, 409, 512, 550, 551,574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771, 838, 839, 840, 841, 842, 843, 844, 845, 846, 847, 848, 849, 850, 851, 852, 853, 854, 855, 856, 857, 858, 859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og/eller 1303 i SEQ ID NO: 5.
I endnu en foretrukken udførelsesform angår opfindelsen nukleinsyremolekyler til anvendelse til fremkaldelse af en immunreaktion i en vært mod lakse-alphavirus, ved hvilken et nukleinsyremolekyle som beskrevet ovenfor kan indgives til værten. Ved fremkaldelsen af en immunreaktion kan nukleinsyremolekylet være et plasmid, som indgives ved injektion i muskelvæv. Ved en sådan fremkaldelse af immunreaktion indgives fortrinsvis 2 til 20 pg nukleinsyremolekyle til værten, mere foretrukket indgives 5 til 10 pg nukleinsyremolekyle til værten.
I endnu en yderligere foretrukken udførelsesform angår opfindelsen anvendelse af polypeptider til fremkaldelse af en immunreaktion i en vært mod et lakse-alphavirus, hvor fremkaldelsen af immunreaktionen omfatter indgivelse til værten af et polypeptid eller peptid som beskrevet ovenfor.
I en anden foretrukken udførelsesform angår opfindelsen en vaccine, der omfatter nukleinsyremolekylet som beskrevet ovenfor.
I en anden foretrukken udførelsesform angår opfindelsen en vaccine til anvendelse mod lakse-alphavirus, som omfatter nukleinsyremolekylet som beskrevet ovenfor.
Henvisninger til en procentisk sekvensidentitet mellem to sekvenser betyder, at, når de er opstillet på række, procentdelen af monomere er den samme ved sammenligning af de to sekvenser. Denne opstilling og sekvenshomologien eller sekvensidentiteten kan bestemmes ved anvendelse af i og for sig kendte softwareprogrammer, f.eks. BLAST-algoritmen (nukleotidprogram: blastn, megablast eller tblastx, proteinprogram: blastp) eller ved anvendelse af Smith-Waterman-homologisøgealgoritmen.
Nukleinsyrer ifølge opfindelsen tilvejebringes fortrinsvis i renset eller væsentlig renset form, dvs. i det væsentlige fri for andre nukleinsyrer. Nukleinsyrer ifølge opfindelsen kan fremstilles på mange måder, f.eks. helt eller delvis ved kemisk syntese (f.eks. phosphoramiditsyntese af DNA), ved fordøjelse af længere nukleinsyrer under anvendelse af nucleaser (f.eks. restriktionsenzymer), ved at sammenkæde kortere nukleinsyrer eller nukleotider (f.eks. ved anvendelse af ligaser eller polymeraser) ud fra genomiske biblioteker eller cDNA-biblioteker osv.
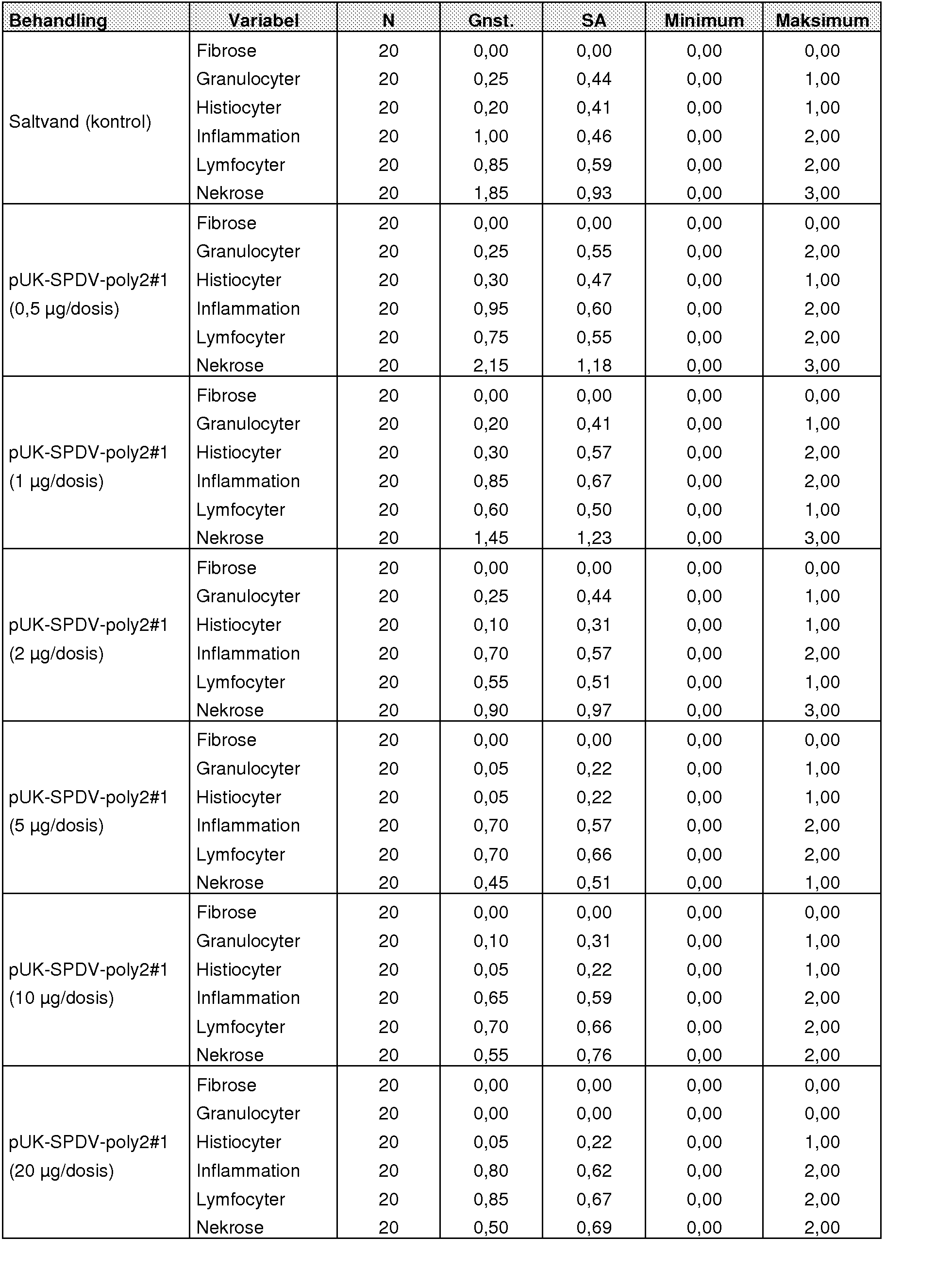
Eksemplerne viser, at skønnede normale (10 pg) og dobbelte doser (20 pg) af en PD-NAV-vaccine ikke forårsagede nogen dødelighed i vaccinerede individer i 18 dage efter vaccinationen. Vaccinens effektivitet bedømtes på grundlag af sværheden af pankreas- og hjertenekrose ved histopatologi og tilstedeværelse og belastning af viral RNA som bestemt ved kvantitativ realtids-PCR med omvendt transkription (RT-qPCR). Bedømmelsen af beskyttelsesniveauer 10 uger (731 graddage) og 28 uger (2050 graddage) efter vaccinationen afslørede en stærk og varig beskyttelsesreaktion mod SAV-infektion i begge tilfælde, uden at nogen betydelig forøgelse i beskyttelse opnåedes ved forøgelse af vaccinedosis. PD-nukleinsyrevaccinen var betydelig overlegen i forebyggelsen af udviklingen af vævsnekrose i målorganer og i nedsættelse af virussets forplantning i hjertevæv i sammenligning med en kommercielt tilgængelig inaktiveret og adjuveret PD-vaccine. Disse resultater antyder en vigtig rolle for vaccinen ifølge opfindelsen mod PD i at understøtte bekæmpelsespolitik målrettet mod denne signifikante sygdom. Disse og andre udførelsesformer samt deres fordele kan udledes af denne redegørelse.
Vævsskade kan bestemmes ved måling af en vilkårlig fagfolk bekendt parameter til angivelse af, at skade er forekommet. I visse udførelsesformer kan vævet f.eks. være skelet- eller hjertemuskelvæv. De målte parametre kan eksempelvis omfatte én eller flere blandt nekrose, inflammation, infiltration i væv med mononucleære celler, infiltration i væv med neutrofile granulocyter, infiltration i væv med ikke-lymfocytiske mononucleære celler, infiltration med lymfocyter, fibrose, myocytregenerering og infiltration med eosinofile granulocyter. Disse parametre kan sammenlignes mellem f.eks. en uvaccineret og en vaccineret vært eller en uinficeret og en inficeret vært eller kombinationer deraf. Eksempelvis kan en fremgangsmåde omfatte: a) måling af mindst én parameter valgt fra gruppen bestående af nekrose, inflammation, infiltration i væv med mononucleære celler, infiltration i væv med neutrofile granulocyter, infiltration i væv med ikke-lymfocytiske mononucleære celler, infiltration med lymfocyter, fibrose, myocytregenerering og infiltration med eosinofile granulocyter i en vært; b) efterfølgende indgivelse af vaccinen mod lakse-alphavirus til værten; og c) efterfølgende måling af mindst én parameter valgt fra gruppen bestående af nekrose, inflammation, infiltration i væv med mononucleære celler, infiltration i væv med neutrofile granulocyter, infiltration i væv med ikke-lymfocytiske mononucleære celler, infiltration med lymfocyter, fibrose, myocytregenerering og infiltration med eosinofile granulocyter i værten.
Værten kan udsættes (f.eks. forsætligt) eller kan være blevet udsat for et lakse-alphavirus før eller efter trin a) og/eller trin b). En signifikant ændring i den mindst ene i trin a) og c) målte parameter angiver typisk, at vaccinen er effektiv. Da tilstedeværelsen og/eller forøgelsen af en vilkårlig eller flere af disse parametre kan stå i forbindelse med vævsskade, vil ændringen typisk være fra fraværet af én eller flere af disse parametre (f.eks. en ’’score” på 0) til tilstedeværelsen af én eller flere af disse parametre (f.eks. en ’’score” på 1, 2 eller 3 (se eksemplerne)) efter infektion. Eksempelvis har det vist sig, at SAV-3-infektionen fremkalder en tidlig infektionsfase, en akut infektionsfase og en restitutionsinfektionsfase, og at vævsskaden ændres gennem de forskellige faser. Symptomer på vævsskade iagttages typisk begyndende i det akutte stadium, som f.eks. kan være ca. 15 til 36 dage efter infektion med en typisk maksimal virkning på vævsskade iagttaget omkring dag 26 efter infektion. Medens således eksempelvis én eller flere sådanne parametre kan måles ved et særligt niveau (f.eks. en ’’score” på 1,2 eller 3) i en uvaccineret vært på et særligt tidspunkt (f.eks. 26 dage) efter udsættelse for lakse-alphavirus, ville den parameter typisk være aftaget i en vaccineret vært (f.eks. ’’scoret” på 0) på samme (eller lignende) tidspunkt. Inden for en bestand af værter ville den gennemsnitlige score for medlemmerne af den vaccinerede bestand typisk være lavere end den gennemsnitlige score for medlemmerne af den uvaccinerede stand på det tidspunkt. Disse fremgangsmåder kan også anvendes til at følge forløbet af sygdom, som forårsages af eller står i forbindelse med tilstedeværelsen af lakse-alphavirus i værten.
Disse parametre kan måles ved en vilkårlig for en person med sædvanligt fagkundskab tilgængelig fremgangsmåde. Disse parameter kan sammenlignes som ’’scorer” (f.eks. som 0, 1, 2 eller 3) som nævnt ovenfor. Eksempelvis iagttages vævsskade ofte i hjertevæv. Følgelig kan laksehjerter indlejres i paraffin i overensstemmelse med histologiske rutinemetoder, skæres med en mikrotom, farves med hæmatoxylin og eosin og monteres på et objektglas med et dækglas. Hjertesnittene kan derpå bedømmes under anvendelse af lysfeltmikroskopi, hvor mikroskopiske ændringer betragtes for sværhedsgrad som følger: 1) Nekrose kan karakteriseres ved tilstedeværelsen af matte, blegrøde, individualiserede myocyter, der har afrundede uregelmæssige rande og utydelige kerner eller spøgelseskerner og/eller findes som individuelle myocyter med apoptotisk-lignende legemer eller karyorrhektisk kernemateriale. Diagnoser af nekrose ligger typisk området fra grad 1 til grad 3 som følger: Grad 1 (mild), når en enkelt ramt myocyt visualiseres i ét eller flere stærkt forstørrede (40 x objektiv) mikroskopfelter; grad 2 (moderat) nekrose, hvor ca. 2 til 4 nekrotiske celler forekommer i flere stærkt forstørrede felter (hpf); og grad 3 (svær), hvor mere end fire nekrotiske celler iagttages i flere hpf. Nekrotiske myocyter bør også skelnes fra hyperkontraktionsartifakt, som visualiseredes som let hypereosinofile, glasagtige fibre med fortættede, skrumpede kerner (f.eks. ofte placeret nær ventrikelrandene).
2) Inflammation kan karakteriseres ved tilstedeværelsen af lymfocytiske og ikke-lymfocytiske infiltrater af mononucleære celler (histiocytiske) langs hjertets (primært ventriklens) epikardiale overflade og mindre hyppigt inden for det ventrikulære eller atrielle myokardium. Diagnoser for inflammation ligger typisk i området grad 1, 2 eller 3. Grad 1 (mild) inflammation består typisk af fokale eller multifokale infiltrater af mononukleære celler, som kan være epikardiale. Grad 2 (moderat) inflammation scores, når epikardiale infiltrater generaliseres (dvs. at hele hjertets omkreds var mere eller mindre ramt). Grad 3 (svær) inflammation indbefatter typisk et generaliseret, tæt cellemønster af myokardiale og epikardiale infiltrater.
3) Infiltration af neutrofile granulocyter kan scores som følger: 0: ubetydeligt granulocytinfiltrat; 1: mildt granulocytinfiltrat; 2: moderat granulocytinfiltrat; og 3: svært granulocytinfiltrat.
4) Infiltration af ikke-lymfocytiske mononukleære celler kan scores som følger: 0: ubetydeligt histiocytinfiltrat; 1: mildt histiocytinfiltrat; 2: moderat histiocytinfiltrat; og 3: svært histiocytinfiltrat.
5) Lymfocytinfiltration kan scores som følger: 0: ubetydeligt lymfocytinfiltrat; 1: mildt lymfocytinfiltrat; 2: moderat lymfocytinfiltrat; og 3: svært lymfocytinfiltrat; 6) Fibrose kan scores som følger: 0: ubetydelig fibrose; 1: mild fibrose; 2: moderat fibrose; og 3: svær fibrose.
7) Myocytregenerering kan karakteriseres ved tilstedeværelsen af strømmende, pyramideformede eller stjerneformede myocyter med forstørrede enkelte eller flerdobbelte kerner og let basofilt cytoplasma. Ramte cellers kerner kan udvise klumpet chromatin med rand og prominente nucleoli, og mitotiske figurer kan også iagttages. Myocytregenerering, som i størstedelen af tilfældene rumligt forekom sammen med myocytnekrose, var sædvanligvis mest fremtrædende ved eller i nærheden af forbindelsen mellem stratum compactum og stratum spongiosum. Diagnoser af myocytregenerering lå i området fra grad 1, 2 eller 3. Grad 1 (mild) regenerering kan eksemplificeres ved en enkelt lille klynge ramte myocyter i ét eller flere hpf. Et større, spredt område for myocytregenerering kan scores som grad 2 (moderat). Når sådanne områder bliver sammenhængende, kan resultatet registreres som grad 3 (svær).
8) Eosinofile granulocyter er næsten udelukkende placeret ved den bulboventrikulære forbindelse, typisk inden for basis for selve bulbus arteriosus, ved den bulboventrikulære grænseflade og/eller inden for små arteriers vægge i den region. Eosinofile granulocyter kan karakteriseres ved tydelige sfæriske eller globulære, røde cytoplasmatiske korn og/eller kan være klumpede og mindre hyppigt under degranulering. Diagnoser af eosinofile granulocytiske infiltrater kan scores som grad 1 eller 2. Eosinofile granulocytiske infiltrater af grad 1 (mild) iagttages typisk som individuelle spredte celler eller små foci af celler, medens en diagnose som grad 2 (moderat) kan findes, når infiltraterne optager et større, spredt område.
Signifikansen af disse målinger kan bedømmes med passende software (f.eks. SAS/STAT® software). Hyppighederne af de talmæssige histopatologiscorer kan opnås og vægtes ved anvendelse af scorerne fra kontrolfisk under anvendelse af følgende formel:
hvor x = scoren for hver variabel y, beregnet særskilt, hvor y = eosinofil granulocyt, fibrose, granulocyt, inflammation, lymfocyt, myocytregenerering, nekrose og ikke-lymfocytisk mononukleær celle, * = gennemsnit af scorer for hver variabel y sx = standardafvigelse af scorer for hver variabel y og T = den totale sum af alle scorer.
De opnåede vægte kan derpå anvendes som koefficienter i et indeks til beregning af en score for hver prøve, og disse scorer analyseres ved variansanalyse (ANOVA, SAS PROC MIXED) for at bestemme, om der er forskelle mellem behandlinger og/eller portioner. Deskriptiv statistik (gennemsnit, standardafvigelse, minimum og maksimum) gengives for indeksscoren for alle behandlinger/portioner. Alle hypoteser afprøves typisk i et tosidigt signifikansniveau på 0,05, medmindre andet er angivet. Disse teknikker er blot eksempler, og andre kan også være egnede, som en person med sædvanligt fagkundskab vil forstå.
De heri beskrevne polypeptider kan modificeres til at indeholde substitutioner, der f.eks. kan betragtes som konservative eller ikke-konservative. En konservativ substitution kan f.eks. være substitution af én type aminosyrerest med en lignende type aminosyrerest. En ikke-konservativ substitution kan f.eks. være substitution af én type aminosyrerest med en afvigende type aminosyrerest. Aminosyrer kan ligne hinanden, f.eks. på grundlag af størrelse, hydrofobicitet, polaritet, alifaticitet (eller ikke), aromaticitet (eller mangel derpå), ladning (positiv eller negativ) eller andre attributter. Ikke-begrænsende, eksempelvise og foretrukne substitutioner er vist i tabel 1: TABEL 1
Oprindelige Eksempler på substitutioner Foretrukne rester substitutioner
Ala Val, Leu, Ile Val
Arg Lys, Gin, Asn, His Lys
Asn Gin Gin
Asp Glu Glu
Cys Ser, Ala Ser
Gin Asn Asn
Glu Asp Asp
Gly Pro, Ala Ala
His Asn, Gin, Lys, Arg Arg
Ile Leu, Val, Met, Ala, Phe, Norleucin Leu
Leu Norleucin, Ile, Val, Met, Ala, Phe lie
Lys Arg, 1,4-diaminosmørsyre, Gin, Asn Arg
Met Leu, Phe, lie Leu
Phe Leu, Val, Ile, Ala, Tyr Leu
Pro Ala Gly
Ser Thr, Ala, Cys Thr
Thr Ser Ser
Trp Tyr, Phe Tyr
Tyr Trp, Phe, Thr, Ser Phe
Val lie, Met, Leu, Phe, Ala, Norleucin Leu
Eksempelvis kan i nogle udførelsesformer substitutioner foretages ved en vilkårlig eller flere af aminosyrerne 21, 47, 116, 130, 141, 203, 221, 269, 278, 321, 347, 351, 362, 409, 512, 550, 551,574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771, 838, 839, 840, 841, 842, 843, 844, 845, 846, 847, 848, 849, 850, 851,852, 853, 854, 855, 856, 857, 858, 859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og/eller 1303 i SEQ ID NO.: 5 (herunder f.eks. de tilsvarende aminosyrer i en vilkårlig af SEQ ID NOS: 6, 7, 8, 9 eller 10). Alternativt kan substitutioner foretages ved en vilkårlig aminosyre undtagen en vilkårlig eller flere af resterne 21,47, 116, 130, 141,203, 221, 269, 278, 321, 347, 351,362, 409, 512, 550, 551, 574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771,838, 839, 840, 841,842, 843, 844, 845, 846, 847, 848, 849, 850, 851, 852, 853, 854, 855, 856, 857, 858, 859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og/eller 1303 i SEQ ID NO.: 5 (herunder f.eks. de tilsvarende aminosyrer i en vilkårlig af SEQ ID NOS: 6, 7, 8, 9 eller 10). Tilsvarende substitutioner kan også foretages på nukleinsyresekvenser, der koder for SEQ ID NO: 5 (f.eks. en vilkårlig af SEQ ID NOS: 1, 2 eller 3), således at substitutionerne derved kodes. Som beskrevet ovenfor kan substitutionerne være konservative eller ikke-konservative.
Nukleinsyremolekyler, der svarer til og/eller er afledt af og/eller koder for lakse-alphavirusproteiner (f.eks. SPDV-polypeptid(er)) og/eller ét eller flere antigener (og/eller immunogener) deraf, kan også være indeholdt i en vektor (f.eks. en rekombinant vektor), såsom én eller flere ikke-virale og/eller virale vektorer. ”lkke-virale” vektorer kan eksempelvis omfatte plasmidvektorer (f.eks. kompatible med bakterie-, insekt- og/eller pattedyrsværtsceller. Eksempler på vektorer kan f.eks. indeholde PCR-ii, PCR3 og pcDNA3.1 (Invitrogen, San Diego, CA), pBSii (Stratagene, La Jolla, CA), pet15 (Novagen, Madison, Wl), pGEX (Pharmacia Biotech, Piscataway, NJ), pEGFp-n2 (Clontech, Palo Alto, CA), pETI (Bluebacii, Invitrogen), pDSR-alpha (POT pub. No. WO 90/14363) og pFASTBACdual (Gibco-BRL, Grand island, NY) samt ®
Bluescript -plasmidderivater (et fagemid på grundlag af COLel i højt kopital,
Stratagene Cloning Systems, La Jolla, CA), PCR-kloningsplasmider udformet til kloning af TAQ-mangfoldiggjorte PCR-produkter (f.eks. TOPO™ TA cloning®-sæt, ® PCR2.1 "plasmidderivater, Invitrogen, Carlsbad, CA). Bakterievektorer kan også anvendes, herunder f.eks. Shigella, Salmonella (f.eks. til mucosal afgivelse), Vibrio cholerae, Lactobacillus, Bacille Calmette Guérin (BCG) og Streptococcus (se f.eks. WO 88/6626; WO 90/0594; WO 91/13157; WO 92/1796 og WO 92/21376). Vektorerne kan konstrueres ved anvendelse af for fagmanden almindelig tilgængelige rekombinante standardteknikker. Mange andre ikke-virale plasmidekspressions-vektorer og systemer kendes og kan anvendes. Forskellige virale vektorer, der med held er blevet udnyttet til at indføre en nukleinsyre i en vært, omfatter retrovirus, adenovirus, adeno-associeret virus (AAV), herpesvirus og koppevirus foruden andre. Virale vektorer kan konstrueres under anvendelse af for fagmanden almindeligt tilgængelige rekombinante standardteknikker.
I én udførelsesform kan en sådan vektor anvendes til at afgives sådanne nukleinsyremolekyler (f.eks. til en celle in vitro eller in vivo). Hvor sådanne vektorer anvendes til at fremkalde og/eller forstærke en immunreaktion, kan vektoren også kode for andre proteiner (f.eks. co-stimulerende molekyler, cytokiner eller chemokiner) og/eller være kombineret med andre faktorer (f.eks. exogene cytokiner) (Xiang m.fl., Immunity, 2:129-135, 1995; Kim m.fl., Eur. J. Immunol., 28:1089-1103, 1998; Iwasaki m.fl., J. Immunol. 158:4591-3601, 1997; Sheerlinck m.fl., Vaccine, 19:2647-2656, 2001). Andre strategier kan også anvendes til at forbedre effektiviteten af sådanne afgivelsessystemer, herunder f.eks. anvendelsen af selvreplicerende virale replika (Caley m.fl., Vaccine, 17:3124-2135, 1999; Dubensky m.fl., Mol. Med. 6:723-732, 2000; Leitner m.fl., Cancer Res. 60: 51-55, 2000), codonoptimering (Liu m.fl., Mol. Ther., 1:497-500, 2000; Dubensky, ovenfor, Huang m.fl., J. Virol. 75:4947-4951, 2001), in v/Vo-elektroporering (Widera m.fl., J. Immunol. 164:4635-3640, 2000), indarbejdning af stimulerende motiver, såsom CpG (Gurunathan, ovenfor, Leitner, ovenfor), sekvenser til målretning af den endocytiske eller den ubiquitin-forarbejdende vej (Thomson m.fl., J. Virol. 72:2246-2252, 1998; Velders m.fl., J. Immunol. 166:5366-5373, 2001), prime-boost-systemer (Gurunathan ovenfor, Sullivan m.fl., Nature 408:605-609, 2000; Hanke m.fl., Vaccine, 16:439-445, 1998; Amara m.fl., Science 292:69-74, 2001), proteasomfølsomme spaltningssteder og systemerne til mucosal afgivelse.
Afgivelsesteknikker kan eksempelvis omfatte DNA-ligand-komplekser, adenovirus-ligand-DNA-komplekser, direkte injektion af DNA, CaP04-fældning, genpistolteknikker, elektroporering og kolloide dispersionssystemer. Kolloide dispersionssystemer omfatter makromolekylekomplekser, nanokapsler, mikrokugler, perler og lipidbaserede systemer, herunder olie-i-vand-emulsioner, miceller, blandede miceller og liposomer. Det foretrukne kolloide system er et liposom, som er kunstige membranvesikler, der kan anvendes som afgivelsesbærere in vitro og in viro. RNA, DNA og intakte virioner kan indkapsles i det vandige indre og afgives til celler i en biologisk aktiv form (Fraley, R. m.fl., Trends Biochem. Sci., 6:77, 1981). Sammensætningen af liposomet er sædvanligvis en kombination af phospholipider, især phospholipider med høj faseovergangstemperatur, sædvanligvis i kombination med steroider, især cholesterol. Andre phospholipider eller andre lipider kan også anvendes. Liposomers fysiske egenskaber afhænger af pH, ionstyrke og tilstedeværelsen af divalente kationer. Eksempler på i liposomer anvendelige lipider omfatter f.eks. phosphatidylforbindelser, såsom phosphatidylglycerol, phosphatidylcholin, phosphatidylserin, phosphatidyletha-nolamin, sphingolipider, cerebrosider og gangliosider. Særlig anvendelige er diacylphosphatidylglyceroler, hvor lipiddelen indeholder fra 14-18 carbonatomer, især fra 16-18 carbonatomer og er mættet. Illustrerende eksempler på phospholipider omfatter æg-phosphatidylcholin, dipalmitoylphosphatidylcholin og distearoyl-phosphatidylcholin.
Som det vil forstås af personer med sædvanligt fagkundskab, er fremgangsmåder til fremstilling og anvendelse af sådanne ikke-virale vektorer, virale vektorer og variationer deraf tilgængelige. Eksempelvis kan anvendelige teknikker findes i almindelige lærebøger om molekylærbiologi som f.eks. Molecular Cloning: A Laboratory Manual (Sambrook m.fl., Cold Spring Harbor Laboratory Press, 1989), Gene Expression Technology {Methods in Enzymology, Vol. 185, red. af D. Goeddel, 1991. Academic Press, San Diego, CA) og PCR Protocols: A Guide to Methods and Applications (Innis m.fl., 1990. Academic Press, San Diego, CA).
En dyrket celle, der omfatter nukleinsyremolekyler svarende til og/eller afledt af og/eller kodende for SPDV-polypeptid(er) og/eller et antigen (eller immunogen) deraf, kan også tilvejebringes. Den dyrkede celle kan transformeres og/eller inficeres med en vektor eller en efterkommer deraf, således at den kan udtrykke et polypeptid (f.eks. et antigen). Egnede cellelinier er fagfolk bekendte og fås i handelen, f.eks. gennem etablerede cellekultursamlinger. Sådanne celler kan derpå anvendes til at producere virale partikler, polypeptider, reagenser til påvisning og/eller isolering af SPDV eller til andre anvendelser. Et eksempel på en fremgangsmåde kan omfatte dyrkning af en celle, der omfatter nukleinsyremolekylet (f.eks. eventuelt under kontrol af en ekspressionssekvens) under betingelser, som tillader produktion af viruspartikler eller ekspression af et polypeptid. Viruspartiklen, polypeptidet og/eller det andet reagens kan derpå isoleres fra cellen eller cellekulturmediet ved standardteknikker.
Bindingsmidler, der kan reagere med antigener mod lakse-alphavira, som er beskrevet her, tilvejebringes også. Eksempelvis kan et antigen indeholde et minimalt antal sammenhængende aminosyrerester fra SPDV-polypeptidet/peptiderne eller en vilkårlig delsekvens deraf. Bindingsmidlet kan derfor anvendes til at identificere, isolere og/eller fjerne lakse-alphavirus fra en prøve (f.eks. en biologisk prøve). Som beskrevet ovenfor kan bindingsmidler i nogle udførelsesformer være antistoffer. Udtrykket ’’antistof” eller ’’antistoffer” kan betegne hele eller fragmenterede antistoffer i urenset eller delvis renset form (f.eks. hybridomcentrifugat, ascitesvæske, polyklone antisera) eller i renset form eller derivater af antistoffer. Et renset antistof kan være ét, der er skilt fra mindst ca. 50%, 60%, 75%, 90% eller 95% af de proteiner, sammen med hvilke det oprindelig fandtes (f.eks. som del af et hybridomcentrifugat eller ascitespræparat). Antistofferne kan være af en vilkårlig egnet oprindelse eller form, herunder f.eks. fra mus (f.eks. produceret af murine hybridomceller) eller udtrykt som humaniserede antistoffer, kimære antistoffer, humane antistoffer og lignende. Antistoffer kan f.eks. være af en vilkårlig egnet type, f.eks. fra menneske (f.eks. IgG (lgG1, lgG2, lgG3, lgG4), IgM, IgA (lgA1 og lgA2), IgD og IgE), hund (f.eks. IgGA, IgGB, IgGC, IgGD), kylling (f.eks. IgA, IgD, IgE, IgG, IgM, IgY), ged (f.eks. IgG), mus (f.eks. IgG, IgD, IgE, IgG, IgM), svin (f.eks. IgG, IgD, IgE, IgG, IgM), rotte (f.eks. IgG, IgD, IgE, IgG, IgM) og/eller et fragment og/eller et derivat deraf (f.eks. som kimære antistoffer). Egnede derivater kan eksempelvis omfatte et enkeltkædet Fab-, F(ab’)2-, Fab’-antistof, Fv, enkeltdomæneantistof, monospecifikt antistof, bispecifikt antistof, trispecifikt antistof, multivalent antistof, kimært antistof, kimært hund-menneske-antistof, kimært hund-mus-antistof, antistof omfattende et hunde-Fc, humaniseret antistof, humant antistof, kaniniseret, CDR-podet antistof, haj-antistof, nanostof (f.eks. antistof bestående af et enkelt monomert variabelt domæne), camelid-antistof (f.eks. antistoffer fra medlemmer af familien Camelidaé), mikrostof, intrastof (f.eks. intracellulært antistof) eller mimetikum. Mimetika kan også eksempelvis omfatte organiske forbindelser, der specifikt binder lakse-alphavirus eller et antigen mod dette som f.eks. et affistof (Nygren m.fl., FEBS J. 275(11):2668-76, 2008), affilin (Ebersbach m.fl., J. Mol. Biol. 372 (1):172-85, 2007), affitin (Krehenbrink m.fl., J. Mol. Biol. 383(5):1058-68, 2008), anticalin (Skerra, A., FEBS J. 275(11):2677-83, 2008), avimer (Silverman m.fl., Nat. Biotechnol. 23(12): 1556-61, 2005), DARPin (Stumpp m.fl., Drug Discov. Today 13(15-16):695-701, 2008), Fynomer (Grabulovski m.fl., J. Biol. Chem. 282(5):3196-3204, 2007), Kunitz-domæne-peptid (Nixon m.fl., Curr. Opin. Drug Discov. Devel. 9(2):261-8, 2006) og/eller et monostof (Koide m.fl., Methods Mol. Biol. 352:95-109, 2007). Andre bindingsmidler tilvejebringes også her, som det vil forstås af en person med sædvanligt fagkundskab.
Fremgangsmåder til fremstilling og anvendelse af forskellige typer antistoffer er velkendte for fagfolk og ville være egnede til udøvelse af den foreliggende opfindelse (se f.eks. Harlow m.fl. Antibodies: A Laboratory Manual, Cold Spring Harbor
Laboratory, 1988; Harlow m.fl., Using Antibodies: A Laboratory Manual, Portable Protocol No. 1, 1998; Kohler og Milstein, Nature, 256:495, 1975; Jones m.fl., Nature, 321:522-525, 1986; Riechmann m.fl., Nature, 332:323-329, 1988; Presta, Curr. Op. Struct. Biol.,2:593-596, 1992; Verhoeyen m.fl., Science, 239:1534-1536, 1988; Hoogenboom m.fl., J. Mol. Biol., 227:381, 1991; Marks m.fl., J. Mol. Biol., 222:581, 1991; Cole m.fl., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77, 1985; Boerner m.fl., J. Immunol., 147(1):86-95, 1991; Marks m.fl., Bio/Technology 10, 779-783, 1992; Lonberg m.fl., Nature 368:856-859, 1994; Morrison, Nature 368:812-13, 1994; Fishwild m.fl., Nature Biotechnology 14, 845-51, 1996; Neuberger, Nature Biotechnology 14, 826, 1996; Lonberg og Huszar, Intern. Rev. Immunol. 13:65-93, 1995; samt USA-patentskrifterne nr. 4.816.567, 5.545.807, 5.545.806, 5.569.825, 5.625.126, 5.633.425 og 5.661.016). I visse anvendelser kan antistofferne være indeholdt i hybridomcentrifugat eller ascitesvæske og anvendes enten direkte som sådanne eller efter koncentrering ved anvendelse af standardteknikker. I andre anvendelser kan antistofferne renses yderligere, f.eks. ved saltfraktionering og ionbytterchromatografi eller affinitetschromatografi under anvendelse af protein A-, protein G-, protein A/G- og/eller protein L-ligander covalent koblet til en fast bærer, såsom agaroseperler, eller kombinationer af disse teknikker. Antistofferne kan opbevares i et vilkårligt egnet format, herunder som trosset apparat (f.eks. -20°C eller -70°C), i frysetørret form eller under normale kølebetingelser (f.eks. 4°C). Når de opbevares i flydende form, kan en egnet puffer, såsom Tris-pufret saltvand (TBS) eller phosphatpufret saltvand (PBS), anvendes.
Når bindingsmidlet er et antistof, kan det identificeres med henvisning til nukleotid-og/eller aminosyresekvensen svarende til dets variable og/eller komplementaritetsbestemmende regioner (“CDR’er”). Eksempelvis kan et bindingsmiddel, som er, er afledt fra eller er beslægtet med det monoklone antistof, som binder SPDV eller et antigen for dette, omfatte en tung og/eller en let kæde, som hver især omfatter én eller flere konstante og/eller variable regioner. De variable regioner omfatter typisk én eller flere CDR’er, som for en stor del bestemmer antistoffets bindingsspecificitet. Disse monoklone antistoffer kan identificeres ved analysen af de nukleotidsekvenser, der koder for de variable regioner. De monoklone antistoffer kan også identificeres ved analyse af aminosyresekvenserne for (f.eks. som kodes for af nukleotidsekvenserne) de variable regioner. Bindingsmidlet kan også være et derivat af et antistof som f.eks. et enkeltkædet Fab-, F(ab’)2-, Fab’-antistof, Fv, enkeltdomæneantistof, monospecifikt antistof, bispecifikt antistof, trispecifikt antistof, multivalent antistof, kimært antistof, kimært hund-menneske-antistof, kimært hund-mus-antistof, antistof omfattende et hunde-Fc, humaniseret antistof, humant antistof, kaniniseret, CDR-podet antistof, hajantistof, nanostof (f.eks. antistof bestående af et enkelt monomert variabelt domæne), camelid-antistof (f.eks. antistoffer fra medlemmer af familien Camelidaé), mikrostof, intrastof (f.eks. intracellulært antistof) og/eller defucosyleret antistof og/eller derivat deraf. Mimetika af bindingsmidler og/eller antistoffer tilvejebringes også. Bindingsmidlet kan også omfatte et påviseligt mærke og/eller en påviselig funktion/effektor-del fastgjort dertil. Funktion/effektor-dele kan eksempelvis omfatte cytotoksiske medikamenter eller toxiner eller aktive fragmenter deraf, såsom difteritis-A-kæde, exotoxin-A-kæde, ricin-A-kæde, abrin-A-kæde, curcin, crotin, phenomycin, enomycin og andre. Funktionelle dele kan også omfatte radiokemikalier. I én udførelsesform kan effektordelene være fastgjort til bindingsmidlerne. I ét eksempel er de påviselige mærker fastgjort til bindingsmidlerne med kemiske bindinger. I ét eksempel er de kemiske bindinger covalente kemiske bindinger. I ét eksempel er effektordelen konjugeret med bindingsmidlerne.
Fagmanden har mange egnede teknikker tilgængelige til anvendelse af de heri beskrevne bindingsmidler (f.eks. antistoffer) til identifikation af biologiske prøver, der indeholder proteiner, som binder sig dertil. Eksempelvis kan antistoffer anvendes til at isolere lakse-alphavirus og/eller et antigen deraf under anvendelse af f.eks. immunfældning eller en anden analyse af indfangningstypen. Denne velkendte teknik kan udføres ved at knytte antistoffet til en fast bærer eller chromatografisk materiale, (f.eks. en perle overtrukket med protein A, protein G og/eller protein L), idet en prøve (f.eks. en opløsning), der enten indeholder eller menes at indeholde lakse-alphavirusset og/eller et antigen deraf (f.eks. en biologisk prøve, såsom blod), bringes i kontakt med materialet, således at lakse-alphavirusset og/eller et antigen deraf binder sig til antistoffet, hvorved det skilles fra andre komponenter i prøven. Det bundne lakse-alphavirus og/eller et antigen deraf kan derpå skilles fra antistoffet og analyseres som ønsket. Lignende metoder til isolering af lakse-alphavirus og/eller et antigen deraf under anvendelse af et bindingsmiddel er velkendte. Bindingsmidlerne (f.eks. antistoffer) kan anvendes til at påvise, isolere og/eller fjerne lakse-alphavirus og/eller et antigen deraf i eller fra en biologisk prøve. Analyser som f.eks. strømningscytometrisk analyse, ELISA, immunoblotting (f.eks. western blot), in situ-påvisning, immunocytokemi og/eller immunohistokemi kan anvendes ved sådanne metoder. Andre anvendelser for de heri beskrevne bindingsmidler kan også være egnede ligesom også mange andre metoder og/eller analysesystemer.
I visse udførelsesformer tilvejebringes også præparater og/eller sammensætninger, der omfatter nukleinsyrerne ifølge opfindelsen. Eksempelvis kan et præparat eller en sammensætning omfatte et lakse-alphavirus, en nukleinsyre, som et delvis renset (f.eks. en vilkårlig blandt 50%, 60%, 75%, 90%, 95% renhed (f.eks. efter vægt)) eller renset (f.eks. ca. 98-100% (efter vægt)) præparat eller sammensætning. Typisk omfatter sådanne præparater en puffer, såsom phosphat- eller tris-pufret saltvand (PBS hhv. TBS). Præparaterne kan også formuleres til at indeholde excipienser som f.eks. stabilisatorer. Nukleinsyrerne ifølge opfindelsen kan også inden anvendelsen (f.eks. indgivelsen til en vært) kombineres med ét eller flere farmaceutisk acceptable bærestoffer. Et farmaceutisk acceptabelt bærestof kan være et materiale, som ikke biologisk eller på anden måde er uønsket, f.eks. kan materialet indgives til en celle og/eller et individ uden at forårsage betydelige uønskede biologiske virkninger eller vekselvirke på skadelig måde med nogen af de andre komponenter i den farmaceutiske sammensætning, i hvilken det er indeholdt. Bærestoffet vil naturligvis vælges, således at enhver nedbrydning af det aktive stof minimeres, og enhver skadelig bivirkning i individet minimeres, som det være velkendt for en fagmand.
Egnede farmaceutiske bærestoffer og deres præparater, som kan være egnede, er tilgængelige for personer med sædvanligt fagkundskab som f.eks. beskrevet i Remington’s: The Science and Practice of Pharmacy, 21st Edition, David B. Troy, ed., Lippicott Williams & Wilkins (2005). Typisk anvendes en passende mængde af et farmaceutisk acceptabelt salt i præparatet for at gøre præparatet isotonisk. Eksempler på farmaceutisk acceptable bærestoffer omfatter, men er ikke begrænset til sterilt vand, saltvand, pufrede opløsninger, såsom Ringer’s opløsning, og dextroseopløsning. Opløsningens pH-værdi ligger sædvanligvis fra ca. 5 til ca. 8 eller fra ca. 7 til ca. 7,5. Andre bærestoffer kan omfatte præparater med forhalet frigivelse, såsom semipermeable matricer af faste hydrofobe polymere, som indeholder polypeptider eller fragmenter deraf. Matricer kan være i form af formede genstande, f.eks. folier, liposomer eller mikropartikler. Det vil være klart for fagfolk, at visse bærestoffer kan være mere foretrukne afhængigt af f.eks. indgivelsesvejen og koncentrationen af den sammensætning, der indgives. Farmaceutiske sammensætninger kan også indeholde bærestoffer, fortykkelsesmidler, fortyndingsmidler, puffere, konserveringsmidler, overfladeaktive midler, adjuvanser, immunostimulanter foruden bindingsmidlet og/eller nukleinsyren. Farmaceutiske sammensætninger kan også indeholde ét eller flere aktive stoffer, såsom antimikrobielle midler, antiinflammatoriske midler og anæstetika. Adjuvanser kan også indgå i de immunstimulerende sammensætninger for at stimulere eller forstærke immunreaktionen. Ikke-begrænsende eksempler på egnede klasser adjuvanser omfatter sådanne af gel-typen (f.eks. aluminumhydroxid/phosphat ("alunadjuvanser"), calciumphosphat, mikrobiel oprindelse (muramyldipeptid (MDP)), bakterieexotoxiner (koleratoxin (CT)), underenhed B fra nativt koleratoxin (CTB), labilt toxin fra E. coli (LT), pertussistoxin (PT), CpG-oligonukleotider, BCG-sekvenser, tetanustoxoid, monophosphoryllipid A (MPL) fra f.eks. E. coli, Salmonella minnesota, Salmonella typhimurium eller Shigella exseri), partikelformige adjuvanser (bionedbrydelige, polymere mikrokugler), immunstimulerende komplekser (ISCOM’er)), adjuvanser på grundlag af olieemulsion og på grundlag af overfladeaktivt middel (Freund’s ufuldstændige adjuvans) (FIA), mikrofluidiserede emulsioner (MF59, SAF), saponiner (QS-21)), syntetiske (muramylpeptidderivater (murabutid, threony-MDP), ikke-ioniske blokcopolymere (L121), polyphosphazen (PCCP), syntetiske polynukleotider (poly-A:U, poly-l:C), thalidomidderivater (CC-4407/ACTIMID), RH3-ligand eller polylactid-glycolid (PLGA)-mikrokugler og andre. Metalsaltadjuvanser, såsom alunadjuvanser, er velkendte, da de tilvejebringer et sikkert excipiens med adjuvansaktivitet. Disse adjuvansers virkningsmekanisme menes at omfatte dannelsen af et antigendepot, således at antigenet kan forblive på injektionsstedet i op til 3 uger indgivelsen, og desuden dannelsen af antigen/metalsalt-komplekser, som lettere optages af antigenpræsenterende celler. Foruden aluminium er andre metalsalte blevet anvendt til at absorbere antigener, herunder salte af zink, calcium, cerium, chrom, jern og beryllium. Hydroxidet og phosphatsaltene af aluminium er de mest almindelige. Præparater eller sammensætninger, der indeholder aluminiumsalte, antigen og en yderligere immunostimulans, er kendte. Et eksempel på en immunostimulans er 3-de-O-acyleret monophosphoryllipid A (3D-MPL). Andre homologe og/eller derivater af vilkårlige af disse toxiner kan også være egnede, forudsat at de bevarer adjuvansvirkning.
Lakse-alphavirus, nukleinsyrer svarende dertil (f.eks. indeholdt i en vektor), polypeptider og/eller peptider svarende dertil og/eller bindingsmidler kan eksempelvis anvendes til at stimulere en immunreaktion mod det heri beskrevne lakse-alphavirus i en vært. I nogle udførelsesformer kan immunogene sammensætninger og vacciner, der indeholder SPDV-polypeptid(er) (f.eks. SEQ ID NO: 4 eller et fragment deraf) og/eller dertil svarende nukleinsyrer (f.eks. SEQ ID NO: 1 eller et fragment deraf) anvendes til at behandle sygdomme, der forårsages af eller står i forbindelse med tilstedeværelsen af lakse-alphavirus i laks. En immunologisk sammensætning er én, som efter indgivelse til en vært, såsom en laks, fremkalder eller forstærker en immunreaktion rettet mod antigenet eller immunogenet (f.eks. SPDV-polypeptid(er)), som er indeholdt i sammensætningen. Denne reaktion kan omfatte dannelsen af antistoffer (f.eks. ved stimulering af B-celler) eller en T-cellebaseret reaktion (f.eks. en cytolytisk reaktion). Disse reaktioner kan eventuelt være beskyttende eller neutraliserende. En beskyttende eller neutraliserende immunreaktion er én, som kan være ødelæggende for den celle, der indeholder eller udtrykker antigenet (f.eks. fra hvilken antigenet blev afledt), og gavnlig for værten (f.eks. ved at nedsætte eller hindre tumorvækst). Som anvendt her kan beskyttende eller neutraliserende antistoffer og/eller cellereaktioner være reaktionsdygtige med SPDV-polypeptid(er) og/eller et antigen deraf. En immunologisk sammensætning, som efter indgivelse til en vært fører til en beskyttende eller neutraliserende immunreaktion, kan anses som en vaccine. Immunologiske sammensætninger, der omfatter mindst ét SPDV-polypeptid, SPDV-nukleinsyremolekyle og/eller antigen deraf eller som kodes derved, kan også indeholde ét eller flere yderligere antigener.
Fremgangsmåder til behandling af sygdom, som forårsages af eller står i forbindelse med lakse-alphavirus, i en vært ved indgivelse til værten af mindst én eller flere effektive doser af én eller flere nukleinsyrer, polypeptider, peptider og/eller bindingsmidler som beskrevet heri tilvejebringes også. Eksempelvis kan et lakse-alphavirus (f.eks. inaktiveret) og/eller SPDV-polypeptid og/eller dertil svarende nukleinsyremolekyle (f.eks. som koder for et SPDV-polypeptid) indgives til en vært i en egnet dosis (f.eks. ca. 104, 105, 106, 107 eller 108 viruspartikler) og doseringsplan (f.eks. én, to eller tre gange om dagen/ugen/måneden), som det kan bestemmes af en person med sædvanligt fagkundskab. Et polypeptid og/eller peptid kan indgives til en vært i en egnet dosis (f.eks. 1-100 mg/kg legemsvægt eller 1-40 pg) og doseringsplan (f.eks. én, to eller tre gange om dagen/ugen/måneden), som det kan bestemmes af en person med sædvanligt fagkundskab. Et SPDV-polypeptid og/eller bindingsmiddel kan indgives i en egnet dosering (f.eks. ca. 1-50 mg/kg legemsvægt), ca. 1 til ca. 30 mg/kg eller ca. 1 til ca. 40 mg/kg (f.eks. ca. en vilkårlig af 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21,22, 23, 24, 25, 26, 27, 28, 29, 30, 35 eller 40 mg/kg). Et SPDV-polypeptid og/eller bindingsmiddel kan også indgives i en egnet dosering (f.eks. ca. 1-50 pg), ca. 1 til ca. 40 pg eller ca. 2 til ca. 30 pg (f.eks. ca. en vilkårlig af 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35 eller 40 pg). Fortrinsvis kan SPDV-polypeptidet og/eller bindingsmidlet indgives i en dosering mellem 5 og 20 pg, mere foretrukket mellem 5 og 10 pg. I visse udførelsesformer kan disse reagenser indgives ad en vilkårlig vej (f.eks. nedsænkning i bad, intraperitonealt, intradermalt, intravenøst, oralt eller intramuskulært) én eller flere gange. Fortrinsvis indgives dosis intramuskulært. Når flere doser indgives, kan doserne omfatte omtrent de samme eller forskellige typer og/eller mængder reagens (f.eks. i et prime-boost-format). Doserne kan også være tidsmæssigt adskilt fra hinanden med ens eller forskellige intervaller. F.eks. kan doserne være adskilt med omtrent en vilkårlig af 6, 12, 24, 36, 48, 60, 72, 84 eller 96 timer, én uge, 1,5 uger, to uger, 2,5 uger, tre uger, 3,5 uger, én måned, 1,5 måneder, to måneder, 2,5 måneder, tre måneder, 3,5 måneder, fire måneder, 4,5 måneder, fem måneder, 5,5 måneder, seks måneder, 6,5 måneder, syv måneder, 7,5 måneder, otte måneder, 8,5 måneder, ni måneder, 9,5 måneder, 10 måneder, 10,5 måneder, 11 måneder, 11,5 måneder, 12 måneder, 1,5 år, 2 år eller et vilkårligt tidsrum før, efter og/eller mellem et vilkårligt af disse tidsrum. Fortrinsvis indgives disse reagenser i en enkelt indgivelse. I en foretrukken udførelsesform i tilfælde af laks bør indgivelsen foregå én eller to gange i en ung alder, f.eks. når fisken vejer 10-30 g.
I nogle udførelsesformer kan bindingsmidlet indgives sammen med andre midler (f.eks. kemoterapeutiske midler) som beskrevet ovenfor. Sådanne andre midler kan indgives omtrent samtidig med bindingsmidlerne eller på et afvigende tidspunkt og/eller med en afvigende hyppighed. Andre udførelsesformer for sådanne metoder kan også være passende, hvilket let kan bestemmes af en person med sædvanligt fagkundskab. Sædvanligvis kaldes en dosis, som har den virkning at nedbringe antallet af lakse-alphavira eller virkningerne af infektion med lakse-alphavira (f.eks.
vævsskade) i en fisk, en effektiv dosis. Fremgangsmåder til fremstilling og/eller anvendelse af sådanne præparater er velkendte.
I nogle udførelsesformer tilvejebringes fremgangsmåder til påvisning af lakse-alphavirus og/eller antigener deraf ved anvendelse af bindingsmidler. I visse udførelsesformer kan celler, der udtrykker SPDV-polypeptid-antigen(er) i en fisk, påvises ved at bringe en biologisk prøve i kontakt med et bindingsmiddel og påvise dette bundet til cellerne (f.eks. ved anvendelse af strømningscytometri). I visse udførelsesformer kan fremgangsmåden omfatte sammenligning af mængden af binding til den biologiske prøve eller dens komponenter med mængden af binding til en biologisk kontrolprøve eller dens komponenter, idet forøget binding af den biologiske prøve eller dens komponenter i forhold til den biologiske kontrolprøve eller dens komponenter angiver tilstedeværelsen af en SPDV i den biologiske prøve. Sådanne fremgangsmåder tilvejebringes også i et in vivo- og/eller in vitro-format. I nogle udførelsesformer tilvejebringes også fremgangsmåder til nedsættelse af levedygtigheden og/eller antallet af lakse-alphavira i en vært ved anvendelse af de heri beskrevne nukleinsyrer og/eller bindingsmidler.
For at bistå fagmanden ved anvendelsen af de heri beskrevne nukleinsyrer og/eller bindingsmidler kan disse tilvejebringes som et sæt. Et sæt, der indeholder sådanne nukleinsyrer og/eller bindingsmidler (f.eks. antistoffer) og eventuelt andre komponenter, der er nødvendige til anvendelse af disse til at påvise, isolere og/eller fjerne lakse-alphavirus og/eller antigen i og/eller fra en biologisk prøve (f.eks. celle eller fluid) deraf tilvejebringes også her. Nukleinsyrerne og/eller bindingsmidlerne i sættet kan tilvejebringes i en vilkårlig egnet form, herunder frosne, frysetørrede eller i en farmaceutisk acceptabel puffer, såsom TBS eller PBS. Sættet kan også indeholde andre reagenser, der er nødvendige til anvendelse af antistofferne in vitro eller in vivo, såsom puffere (f.eks. TBS, PBS), blokeringsmidler (opløsninger, der indeholder skummetmælkpulver, normale sera, Tween-20 detergent, BSA eller casein) og/eller påvisningsreagenser (f.eks. gede-anti-muse-lgG-biotin, streptavidin-HRP-konjugater, allophycocyanin, B-phycoerythrin, R-phycoerythrin, peroxidase og/eller et påviseligt mærke) og andre mærker og/eller farvningssæt (f.eks. ABC Staining Kit, Pierce). Sættene kan også indeholde andre reagenser og/eller instruktioner til anvendelse af antistofferne i almindeligt anvendte analyser som beskrevet ovenfor som f.eks. strømningscytometrisk analyse, ELISA, immunblotting (f.eks. western blot), in situ-påvisning, immunocytokemi, immunohistokemi. I én udførelsesform kan de påviselige mærker fastgøres til bindingsmidlerne. I ét eksempel fastgøres de påviselige mærker til bindingsmidlerne med kemiske bindinger. I ét eksempel er de kemiske bindinger covalente kemiske bindinger. I ét eksempel er de påviselige mærker konjugeret til bindingsmidler.
I én udførelsesform tilvejebringer sættet et monoklont antistof mod SPDV-polypeptid(er) og/eller et antigen deraf i renset form. Det monoklone antistof kan tilvejebringes i biotinyleret form enten alene eller sammen med et avidinkonjugeret påvisningsreagens (f.eks. antistof). Sættet kan indeholde fluorescensmærkede antistoffer, der kan anvendes til direkte påvisning af lakse-alphavira og/eller et antigen deraf. Puffere og lignende, der er nødvendige til anvendelse af nogen af disse systemer, er velkendte og kan fremstilles af slutbrugeren eller tilvejebringes som en komponent i sættet. Sættet kan også omfatte en fast bærer, der indeholder protein til positiv og negativ kontrol og/eller vævsprøver. Eksempelvis kan sæt til udførelse af plet-analyser eller western-blot-analyser omfatte kontrolcelle- eller vævslysater til anvendelse i SDS-PAGE eller nylonmembraner eller andre membraner, der indeholder præfikserede kontrolprøver med yderligere plads til forsøgsprøver. Sæt til visualisering af lakse-alphavira og/eller et antigen deraf på objektglas kan omfatte præformaterede objektglas, der indeholder kontrolcelle- eller vævsprøver med yderligere plads til forsøgsprøver. Som nævnt ovenfor kan de her beskrevne bindingsmidler og/eller derivater deraf også være indarbejdede i sammensætninger til anvendelse in vitro eller in vivo. Andre udførelsesformer tilvejebringes også, som det vil forstås af en person med sædvanligt fagkundskab.
Således tilvejebringer denne opfindelse f.eks.: en isoleret nukleinsyresekvens, der koder for et lakse-alphavirus (SAV) polyprotein, hvori SAV polyproteinet er mindst 98% identisk med SEQ ID NO: 5; eller et polypeptid med aminosyresekvensen SEQ ID NO: 5 omfattende mindst én substitution ved en aminosyre valgt fra gruppen bestående af 21, 47, 116, 130, 141, 203, 221, 269, 278, 321, 347, 351, 362, 409, 512, 550, 551, 574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771, 838-859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og 1303 Et isoleret polypeptid skal have mindst 98% identitet med SEQ ID NO: 5. Til at dele identitet kan et polypeptid og/eller en nukleotidsekvens dele ca. 99% af ens eller lignende aminosyrer og/eller nukleotider. Polypeptiderne, peptiderne, fragmenterne og/eller derivaterne, der kodes for af sådanne nukleinsyresekvenser, tilvejebringes også. De her tilvejebragte nukleinsyrer, polypeptider, peptider, fragmenter og/eller derivater kan også kombineres på en vilkårlig måde.
Endvidere tilvejebringes ekspressionsvektorer, der omfatter eller koder for SPDV-polypeptiderne, og/eller en komplementær eller lignende nukleinsyresekvens og/eller en lignende aminosyresekvens; en værtscelle, der omfatter eller koder for en nukleinsyre, som koder for et SPDV-polypeptid og/eller en komplementær eller lignende nukleinsyresekvens og/eller en lignende aminosyresekvens; et oligonukleotid med en nukleinsyresekvens, der svarer til et fragment på mindst ni sammenhængende nukleotider ifølge en vilkårlig af SEQ ID NOS: 1-3, er komplementær med et fragment på mindst ni sammenhængende nukleotider ifølge en vilkårlig af SEQ ID NOS: 1-3, svarer til en nukleinsyresekvens, som koder for et fragment på mindst tre sammenhængende aminosyrer i et SPDV-polypeptid eller er komplementær med en nukleinsyresekvens, som koder for et fragment på mindst tre sammenhængende aminosyrer i et SPDV-polypeptid; et oligonukleotid, der svarer til eller er komplementært med mindst ni sammenhængende nukleotider ifølge en vilkårlig af SEQ ID NOS: 1-3; to eller flere oligonukleotider til mangfoldiggørelse af en nukleinsyresekvens, idet hvert oligonukleotid omfatter en nukleinsyresekvens svarende til et fragment af et SPDV-polypeptid (f.eks. mindst ni sammenhængende nukleotider ifølge en vilkårlig af SEQ ID NOS: 1-3 eller et komplement deraf) eller koder for et fragment på tre sammenhængende aminosyrer i et SPDV-polypeptid; fremgangsmåder til påvisning og/eller identifikation og/eller mængdebestemmelse af et virus i en prøve (f.eks. en biologisk prøve, såsom serum) under anvendelse af sådanne reagenser; et sæt til påvisning af nukleinsyre fra et virus i en prøve, idet sættet omfatter et oligonukleotid, oligonukleotider og/eller primerpar til påvisning og/eller identifikation og/eller mængdebestemmelse af et SPDV-polypeptid, idet sættet eventuelt yderligere omfatter en fast bærer og/eller ét eller flere mangfoldiggørelsesreagenser; en sammensætning, der omfatter et farmaceutisk acceptabelt bærestof og en nukleinsyre eller et komplement deraf og/eller et peptid og/eller polypeptid svarende til et SPDV-polypeptid (som kan være en immunogen sammensætning og/eller en vaccine); en fremgangsmåde til fremstilling af et nukleinsyremolekyle, et peptid og/eller et polypeptid svarende til et SPDV-polypeptid, idet fremgangsmåden omfatter transfektion af en værtscelle med en ekspressionsvektor, der koder for peptidet eller polypeptidet, dyrkning af værtscellen, således at nukleinsyremolekylet, peptidet og/eller polypeptidet udtrykkes, og isolering af peptidet eller polypeptidet; nukleinsyremolekylet og/eller peptidet til anvendelse til at fremkalde en immunreaktion i et pattedyr ved indgivelse til pattedyret af en farmaceutisk sammensætning, der omfatter et nukleinsyremolekyle, et peptid og/eller et polypeptid svarende til SPDV-polypeptidet/polypeptiderne og/eller en værtscelle, der omfatter eller udtrykker disse; en fremgangsmåde til at frembringe et bindingsmiddel (f.eks. et antistof) mod en nukleinsyre, et peptid og/eller et polypeptid svarende til SPDV-polypeptid(er) og det eller de derved fremstillede bindingsmidler (f.eks. reaktionsdygtige med et polypeptid, som kodes for af en vilkårlig af SEQ ID NOS: 1-3, såsom et fragment på mindst 9 nukleotider deraf). Andre udførelsesformer tilvejebringes også af denne redegørelse, som det vil anerkendes af en person med sædvanligt fagkundskab.
Enhver angivelse af, at et træk er eventuelt, tilsigtes at tilvejebringe tilstrækkelig støtte for krav, der indeholder lukket eller udelukkende eller negativt sprog med henvisning til det eventuelle træk. Udelukkende sprog udelukker specifikt det særlige opregnede træk fra at indeholde et vilkårligt yderligere emne. Hvis det f.eks. angives, at A kun kan være medikament X, tilsigtes sådant sprog at tilvejebringe støtte for et krav, der udtrykkeligt specificerer, at A består af X alene, eller at A ikke indeholder andre medikamenter foruden X. ’’Negativt” sprog udelukker udtrykkeligt det eventuelle træk selv fra kravenes omfang. Hvis det f.eks. angives, at element A kan indeholde X, tilsigtes sådant sprog at tilvejebringe støtte for et krav, som udtrykkeligt specificerer, at A ikke indeholder X. Ikke-begrænsende eksempler på udelukkende eller negative udtryk omfatter ”kun”, ’’blot”, ’’alene”, ’’bestående af”, ”i det væsentlige bestående af”, ’’uden”, ”i fravær af (f.eks. andre emner af samme type, struktur og/eller funktion)”, ’’udelukkende”, ’’ikke udelukkende”, ’’ikke”, ’’ikke kan” eller en vilkårlig kombination eller variation af sådant sprog.
Genbank-poster betegnet ved GID eller deponeringsnummer, især en vilkårlig polypeptidsekvens, polynukleotidsekvens eller kommentar derom, indarbejdes heri ved henvisningen. Citatet af et vilkårligt skrift angår dets redegørelse inden indleveringsdagen og bør ikke opfattes som en accept af, at den foreliggende opfindelse ikke er berettiget til at antedatere et sådant skrift i kraft af tidligere opfindelse.
Visse udførelsesformer beskrives endvidere i de følgende eksempler.
EKSEMPLER
Eksempel 1
Efter translation og spaltning producerer alphaviras polyproteinsekvens mindst seks forskellige proteiner, herunder capsidprotein, spyd-glycoproteiner (’’spike glycoproteins”) E3 og E1, kappeglycoprotein E2, et 6K-protein og p62-protein, en uspaltet kombination af glycoproteinerne E2 og E3 (Strauss og Strauss, 1994; Weston m.fl., 1999; Villoing m.fl., 2000). Capsidproteinet har en proteaseaktivitet som fører til dets autokatalytiske spaltning fra det nascerende polyprotein under translation. Capsidproteinet associeres derpå med viral RNA og samler sig selv til ikosaedriske kernepartikler. Glycoproteinet E1 er et viralt fusionsprotein klasse II, og glycoproteinet E2 er ansvarligt for viral tilknytning til mål-værtsceller. 6K-proteinet er et konstitutivt membranprotein, som er involveret i glycoproteinforarbejdning, membran-permeabilisering og knopskydning af viruspartikler. Glycoprotein E3’s funktion er for tiden ukendt. Som beskrevet nedenfor konstrueredes en ekspressionsvektor, der koder for hvert af disse proteiner fra lakse-alphavirus (SPDV).
Det oprindelige forældreplasmid (pUK21) er et syntetisk plasmid opnået fra Qiagen GmbH (Max-Volmer StraBe 4, Hilden, Tyskland) som kloningsvektor, der bærer kanamycinresistensgenet. Det blev modificeret i laboratoriet hos Dr. Heather L. Davis (Loeb Health Research Institute, Ottawa, ON, Canada) til at blive en eukaryot ekspressionvektor, som betegnes pUK21-A2, ved indsætning af den store mellemtidlige promotor fra humant cytomegalovirus (CMV) og oksevæksthormon-polyadenyleringssignalet (BGH-pA) (Krieg m.fl., 2004). Desoxyribonukleinsyre (DNA)-fragmenter, der koder for CMV-promotoren, og BGH-pA opnåedes fra pcDNA3-vektoren (Invitrogen Corporation, Carlsbad, CA, USA) og mangfoldiggjordes ud fra den oprindelige vektor ved polymerasekædereaktion (PCR) til indsætning i pUK21-vektoren. Den eneste fænotype, som bibringes værtsbakterieceller med pUK21-A2-vektoren (Fig. 1), er kanamycin (Kan)-resistens. Der er ingen sekvenser til plasmidoverførsel til andre bakterier ved konjugation. pUK21-A2-plasmidet indeholder ColE1-replikonet (Bolivar m.fl., 1977a, 1977b). Under normale vækstbetingelser opretholdes et minimum på 15-20 kopier af plasmider, der bærer dette replikon, i hver bakteriecelle (Covarrubias m.fl., 1981). Imidlertid har indføring af mutationer i replikonet forøget plasmidkopitallet (Scott 1984). ColE1-replikonet kræver værtsenzymer til replikation, men ikke plasmidkodede funktioner (Tomizawa m.fl., 1975). CMV-promotoren og BGH-pA-signalet tillader ekspression af det i det flerdobbelte kloningssted indsatte gen, når først plasmidet er indført i eukaryote celler.
pUK21-A2-vektoren er et syntetisk plasmid, og derfor har det ikke nogen naturlig vært. Under laboratoriebetingelser er Escherichia coli den eneste kendte og afprøvede vært. pUK21-A2-plasmidet har den modificerede ColE1-replikationsstart for at tillade replikation med højt kopital i bakterieceller. Foruden den til ekspression af kanamycinresistensgenet anvendte bakteriepromotor indeholder vektoren også lac-promotoren placeret umiddelbart opstrøms for de første 12 nukleotider, som koder for lac-Z-fragmentet til a-komplementering. Det fuldstændige lac-Z-a-fragment, som findes i forældre-pUK21-plasmidet, sprængtes ved indsætning af CMV-promotoren og BGH-pA-signalet og er ikke længere funktionelt. Plasmidet indeholder en region placeret mellem CMV-promotoren og Kan-resistensgenet, som har høj homologi med replikationsstarten i bakteriofag M13. Imidlertid er starten ufunktionel på grund af en deletering på 72 bp inde i regionen. T7-promotoren er til stede og findes opstrøms for CMV-promotoren. Den vil kun være aktiv i nærvær af T7-polymerase, og alle bakteriesporer blev afprøvet og var frie for bakteriofag. pUK21-A2-vektoren indeholder den store mellem-tidlige promotor/forstærker-region fra humant CMV til ekspression af de rekombinante proteiner. Den indeholder også BGH-pA-signalet til effektiv transkriptionsterminering og polyadenylering af messenger-ribonukleinsyre (mRNA). Ingen andre kendte kontrolelementer for eukaryote organismer findes i vektoren.
Det rekombinante plasmid pUK-SPDV-poly2#1 (Fig. 3) indeholder hele den åbne læseramme (ORF) fra strukturpolyproteinet i SPDV (Fig. 5-14). For at konstruere det rekombinante plasmid isoleredes viral RNA først fra delvis renset SPDV, isoleret fra væv fra atlantisk laks opsamlet under et udbrud i Skotland, og dyrkedes i vævskultur. Dette isolat viste høj homologi til SAV-2-referencesekvenser i Genbank (98% identitet på nukleotidniveau og 96% identitet på aminosyreniveau med sekvensen med Genbank nr. AJ238578; desuden 97% identitet på nukleotidniveau og 92% identitet på aminosyreniveau med sekvensen med genbank nr. AJ316246).
Det gen, der koder for strukturpolyproteinet blev derpå omvendt transkriberet og mangfoldiggjort ved PCR under anvendelse af specifikke primere udarbejdet fra nukleotidsekvenser, som er publiceret i Genbank. Nukleotidsekvensen for den fremadrettede primer SPDV-CAP-Notl-His(F2) er vist nedenfor: GGGCGGCCGCA 7~GC AT CAT CACC AT C ACC AT ATGTTT CCC AT GC AATTCACCAACTC (SEQ ID NO: 11).
Primeren indeholdt et Notl-restriktionssted (understreget), den kodende sekvens for seks histidiner eller His-tag-epitop (dobbeltunderstreget), en ATG, startcodon for ORF
(fed kursiv) samt den oprindelige ATG fra viruspolyproteinstartcodonet (kun fed). Nukleotidsekvensen forden omvendte primer SPDV-E1-EcoRI(R2) er vist nedenfor: AT G AATT CGC AATTT GT AT ACCGG AAT 7TAGCT CTT G A (SEQ ID NO: 12)
Primeren indeholder et EcoRI-restriktionssted (understreget) samt komplementet til stopcodonet til TTA (fed kursiv), som definerer enden af ORF. Amplikonet (herunder primere) på 4018 bp blev klonet ind i ekspressionsvektoren pUK21-A2. Både PCR-produktet og pUK21-A2-vektoren fordøjedes med restriktionsenzymer Notl og EcoRI. De fordøjede produkter ligeredes sammen under anvendelse af T4 DNA-ligase og transformeredes derpå i en E. coli DH5-a-kompetent vært. Én klon pUK-SPDV-poly2#57 (Fig. 2) udvalgtes og underkastedes sekvensanalyse. Opstilling af den fremkomne nukleotidsekvens over for referencen angav, at amplikonet var komplet bortset fra en deletering på 150 bp i glycoprotein-E1-sekvensen (nukleotidstilling 3434-3584 i ORF). Denne deletering blev afhjulpet ved subkloning af et PCR-fragment dannet ud fra viral komplementær DNA (cDNA) under anvendelse af den fremadrettede primer SPDV-E1-EcoRV (AACT AT GT C AAACCC AAT GAT CT GT ACG (SEQ ID NO: 13)), udformet til at anneale 2 bp opstrøms for et naturligt forekommende EcoRV-sted, og den omvendte primer SPDV-EcoRI(R2) som beskrevet ovenfor. PCR-amplikonet og plasmidet pUK-SPDV-poly2#57 fordøjedes individuelt med EcoRV og EcoRI, ligeredes og transformeredes ind i kompetente E. coli DH5-a-celler. Fremkomne kloner screenedes og sekvensbestemtes for at sikre, at nukleotidsekvensen i fuld længde (SEQ ID NO: 1; Fig. 5), som koder for SPDV-polyproteinet (SEQ ID NOS: 4, 5; Fig. 8 og 9), var til stede, og plasmidet pUK21-SPDV-poly2#1 (Fig. 3) udvalgtes som den endelige DNA-vaccineprototype. Det bemærkes, at en nukleotidsekvens, der koder for en række på seks histidinrester, indførtes i læseramme ved 5’-enden af den virale polyproteinsekvens for at lette identifikation af fusionsproteinet ved anvendelse af immunpåvisning og oprensning under anvendelse af nikkel-agarose-affinitetsharpikser eller spinsøjler. Desuden er CpG-motiver til stede (tre murine (GA/AA) CGTT-motiver og to humane/primat-GTCGTT-motiver, f.eks. indeholder kappeglycoproteinet E2 1 GACGTT-motiv i plasmidet pUK-SPDV-poly2#1) (Jørgensen m.fl., 2003; Strandskog m.fl., 2007). Under kloningsprocessen gik restriktionsenzymsteder, som var placeret mellem Notl-stedet og EcoRI-stedet inden for det flerdobbelte kloningssted (MOS), tabt som følge af indføring af strukturpolyproteinsekvensen. Ingen andre restriktionssteder blev tabt eller vundet andetsteds i plasmidskelettet eller i polyproteinets ORF. Polyproteinets ORF indsattes under kontrol af den store mellem-tidlige forstærker/promotor fra humant CMV og BGH pA-signalet til effektiv ekspression i eukaryote celler. Ingen alphavirus- kontrolsekvenser klonedes sammen med strukturpolyproteingenet på grundlag af nuværende kendskab til denne type virus.
Eksempel 2
Et velkendt symptom på infektion med lakse-alphavirus er vævsskade (f.eks. nekrose af hjertevæv). Selv om tidligere forsøg på at vaccinere laks under anvendelse af rekombinant protein eller rekombinante nukleinsyrer kan have tilvejebragt en vis grad af beskyttelse mod infektion, var disse vacciner ikke i stand til at forbedre vævsskade. Som beskrevet nedenfor viste det sig overraskende, at de her beskrevne ekspressionsvektorer (som f.eks. koder for SEQ ID NO: 3; pUK-SPDV-poly2#1-plasmid (også betegnet “PD-NAV”)) begge tilvejebringer begge en beskyttelse mod og en reduktion i vævsskade i forbindelse med infektion med SAV. Desuden beskrives også en fremgangsmåde til måling af vaccines virkningsfuldhed ved at sætte denne i forbindelse med målingen af én eller flere specifikke parametre. En undersøgelse udførtes for at påvise virkningsfuldheden af PD-NAV, når den indgaves intramuskulært (i.m.) til atlantisk laks (Salmo salar) i en særlig dosis under anvendelse af en ferskvandssamlivsudfordringsmodel og påvise konsistens i virkningsfuldhed blandt indbyrdes overensstemmende grupper under anvendelse af histopatologiske hjertescorer. Fisk med en gennemsnitlig vægt på 16,9 g (15,97-19,14 g) anvendtes. En enkelt dosis på 0,05 ml af vaccinen, som indeholdt mellem 10,5 og 12,5 pg DNA ialt i 0,05 ml PBS, indgaves ved intramuskulær (i.m.) injektion.
Undersøgelsen omfattede én tank med fisk tilfældigt fordelt i én af fire behandlingsportioner (én kontrolgruppe (saltvand) og tre portioner med PD-NAV) (100 fisk/gruppe). 396 graddage forløb inden udfordring med SAV3. Fisk udfordredes med SAV3 ved introduktion af trojansk laks som var intraperitonealt (i.p.) injiceret med 0,1 ml SAV3 (1,33 x 108 TCID50/ml), ved 20% tankbestand. Vaccinerede fisk holdtes ved 11,0±0,9°C. Efter udfordringen hævedes temperaturen til den for PD tilladelige temperatur, 14±2°C. 24 dage efter udfordringen udtoges histopatologiske prøver. Konserverede todelte laksehjerter sendtes af Novartis Animal Health (NAH) Canada, Inc., Victoria, PE og modtoges af Experimental Pathology Laboratories, Inc. (EPL®), Sterling, Virginia til histopatologisk forarbejdning og bedømmelse. Hjerteprøverne, som oprindelig konserveredes i 10% NBF, overførtes til individuelt mærkede friske beholdere med 10% NBF efter ankomst til EPL. Ingen yderligere trimning af prøverne var nødvendig. Hvert todelt hjerte orienteredes i en vævskassette til længdesnit og indlejredes i paraffin i overensstemmelse med histologiske rutinemetoder. Et enkelt snit på 4-6 mm mikrotomeredes fra hvert hjerte, farvedes med hæmatoxylin og eosin og monteredes på et objektglas med dækglas. Hjertesnittene bedømtes med lysfeltmikroskopi, og under disse bedømmelser var patologen ikke klar over behandlingsgruppestatus for enkelte fisk (blindforsøg). I overensstemmelse med protokollen klassificeredes mikroskopiske ændringer for sværhedsgrad som følger: 1) Nekrose forekom overvejende i det ventrikulære myocardium og karakteriseredes ved tilstedeværelsen af matte, blegrøde, individualiserede myocyter med afrundede uregelmæssige rande og utydelige kerner eller spøgelseskerner. Mindre sædvanligt viste nekrose sig som individuelle myocyter med apoptotisklignende legemer eller karyorrhektisk kernemateriale. Diagnoser for nekrose lå i området fra grad 1 til grad 3. Nekrose registreredes som grad 1 (mild) når en enkelt ramt myocyt blev synlig i ét eller flere mikroskopfelter med høj forstørrelse (40x objektiv). Grad 2 (moderat) nekrose bestod af ca. 2 til 4 nekrotiske celler i flere felter med høj forstørrelse (hpf) (Fig. 15A (pile = nekrotiske myocyter)). I nekrose af grad 3 (svær) iagttoges mere end 4 nekrotiske celler i flere hpf. Det var nødvendigt i denne undersøgelse at skelne nekrotiske myocyter fra hyperkontraktionsartifakt, som blev synlig som let hypereosinofile, glasagtige fibre med fortættede, indskrumpne kerner. Hyperkontraktionsartifakt var ofte placeret nær ventrikelrandene (Fig. 15B) og ofte til stede ved enhver skåren kant, men det var ikke usædvanligt yderligere at finde små pletter af hyperkontraktionsartifakt i midten af myocardieregioner. Traditionelt registreredes sådanne vævskollektionsartifakter ikke som diagnostiske fund.
2) Inflammation karakteriseredes ved tilstedeværelsen af lymfocytiske og ikke-lymfocytiske mononukleære (histiocytiske) celleinfiltrater langs hjertets (primært ventriklens) epicardiale overflade og mindre hyppigt i det ventrikulære eller det atrielle myocardium. Som protokol for undersøgelsen registreredes særskilte diagnoser for lymfocytisk og ikke-lymfocytisk infiltration med mononukleære celler uafhængigt af og foruden inflammationsdiagnoser; imidlertid var begge celletyper tilsyneladende altid åbenbare i forholdsvis sammenlignelige andele i hjerter med epicadial eller myocardial inflammation. Omvendt iagttoges aldrig aktiverede (epithelioide) makrofager som inflammationskomponent. Inflammationsdiagnoser (Fig. 15C) lå i området fra grad 1 til grad 2, men inflammation af grad 2 iagttoges næsten udelukkende i kontrolfisk. Grad 1 (mild) inflammation bestod i fokale eller multifokale infiltrater med mononukleære celler, som oftest var epicardiale. Inflammation ansås som værende af grad 2 (moderat) når epicardiale infiltrater var generaliseret (dvs. at hele hjertets omkreds var mere eller mindre ramt). Grad 3 (svær) inflammation diagnosticeredes ikke under denne undersøgelse, men ville være blevet registreret, hvis et generaliseret, tæt cellemønster af myocardiale og epicardiale infiltrater var blevet observeret.
3) Infiltration med neutrofile granulocyter scoredes som følger: 0 ubetydeligt granulocytinfiltrat, 1 mildt granulocytinfiltrat, 2 moderat granulocytinfiltrat, 3 svært granulocytinfiltrat; 4) Infiltration med ikke-lymfocytiske mononukleære celler scoredes som følger: 0 ubetydeligt histiocytinfiltrat, 1 mildt histiocytinfiltrat, 2 moderat histiocytinfiltrat, 3 svært histiocytinfiltrat; 5) Lymfocytinfiltration scoredes som følger: 0 ubetydeligt lymfocytinfiltrat, 1 mildt lymfocytinfiltrat, 2 moderat lymfocytinfiltrat, 3 svært lymfocytinfiltrat; 6) Fibrose scoredes som følger: 0 ubetydelig fibrose, 1 mild fibrose, 2 moderat fibrose, 3 svær fibrose; 7) Myocytregenerering karakteriseredes ved tilstedeværelsen af strømmende, pyramideformede eller stjerneformede myocyter med forstørrede enkelte eller flerdobbelte kerner og let basofilt cytoplasma (Fig. 15D). Ramte cellers kerner havde ofte klumpet chromatin med rande og prominente nucleoli, og mitotiske figurer var særlig almindelige ved højere grader af regenerering. Myocytregenerering, som i størstedelen af tilfældene rumligt forekom sammen med myocytnekrose, var sædvanligvis mest fremtrædende ved eller i nærheden af forbindelsen mellem stratum compactum og stratum spongiosum. Myocytregenerering diagnosticeredes i 89% af kontrolfiskene og kun sjældent I de andre farvegrupper. Diagnoser af myocytregenerering lå i området fra grad 1 til grad 3 og grad 3-regenerering. Grad 1 (mild) regenerering eksemplificeredes ved en enkelt lille klynge ramte myocyter i ét eller flere hpf. Et større, spredt område af myocytregenerering registreredes som grad 2 (moderat), og når sådanne områder blev sammenhængende, registreredes resultatet som grad 3 (svær).
8) Infiltration med eosinofile granulocyter medtoges ikke under paraplydiagnosen for inflammation, men deres tilstedeværelse dokumenteredes i stedet særskilt, fordi der ikke syntes at være noget rumligt eller samtidigt forhold mellem forekomsten af eosinofile granulocyter og inflammation med mononukleære celler. Eosinofile granulocytiske infiltrater var næsten udelukkende placeret ved den bulboventrikulære forbindelse, typisk inden for basis af bulbus arteriosus selv (Fig. 15E), ved den bulboventrikulære grænseflade og/eller inden for væggene på små arterier i den region. Eosinofile granulocyter karakteriseredes ved tydelige sfæriske eller globulære, røde cytoplasmatiske korn. Lejlighedsvise eosinofile granulocyter havde korn, som var klumpede, og mindre hyppigt syntes celler at befinde sig i en degranuleringsproces. Diagnoser af eosinofile granulocytiske infiltrater lå i området fra grad 1 til grad 2. Grad 1 (milde) eosinofile granulocytiske infiltrater iagttoges som enkelte spredte celler eller små foki af celler, medens en diagnose som grad 2 (moderat) registreredes, når infiltraterne besatte et større, spredt område. Det bør bemærkes, at tilstedeværelsen eller fraværet af dette strukturelement ville have tendens til at påvirke den gruppevise forekomst af eosinofile granulocytiske infiltrater, fordi eosinofile granulocyter primært iagttoges i histologiske snit, i hvilke basis for bulbus arteriosus var til stede i snittet.
En delmængde af den første patologs resultater blev fagfællebedømt ("peer-reviewed”) i blindform af en anden patolog. Som ved den oprindelige bedømmelse var forsøget også blindt over for fagfælle-patologen (dvs. at denne var uvidende om enkelte fisks behandlingsgruppestatus), selv om fagfælle-patologen havde adgang til de af den første patolog stillede oprindelige diagnoser.
Alle analyser udførtes under anvendelse af SAS/STAT^software (version 9 af SAS System for Windows, Copyright© 2002-2008 by SAS Institute Inc., Cary, NC, USA). De ordinale histopatologiscorers hyppigheder beregnedes for eosinofil granulocyt, fibrose, granulocyt, inflammation, lymfocyt, myocytregenerering, nekrose og ikke-lymfocytiske mononukleære celler for alle behandlinger/portioner. Et indeks konstrueredes under anvendelse af ordinale scorer fra data for eosinofil granulocyt, fibrose, granulocyt, inflammation, lymfocyt, myocytregenerering, nekrose og ikke-lymfocytiske mononukleære celler opnået fra hver fisk inden for hver behandling/portion. Vægte for hver variable opnåedes under anvendelse af scorerne fra kontrolfiskene under anvendelse af følgende formel: . T > _ V \
»'Slfiil·u, — ij. — I
hvor x = scoren for hver variabel y, beregnet særskilt, hvor y = infiltration med eosinofile granulocyter, fibrose, granulocytinfiltration, inflammation, lymfocytinfiltration, myocytregenerering, nekrose og infiltration med ikke-lymfocytiske mononukleære celler, i = gennemsnit af scorer for hver variabel y sx= standardafvigelse af scorer for hver variabel y og T = den totale sum af alle scorer.
De opnåede vægte anvendtes som koefficienter i et indeks til beregning af en score for hver fisk, og disse scorer analyseredes med variansanalyse (ANOVA, SAS PROC MIXED) for at bestemme, om der fandtes forskelle mellem behandlinger/portioner. Deskriptiv statistik (gennemsnit, standardafvigelse, minimum og maksimum) præsenteres for indeksscoren for alle behandlinger/portioner. Alle hypoteser afprøvedes ved et 2-sidet signifikansniveau på 0,05, medmindre andet er angivet. Resultaterne af disse undersøgelser fremgår af tabellerne 1 -4: TABEL 1
Hyppighedsfordeling: Histologiske scorer
1 - + = Scorer på 1, 2 eller 3 angiver sværhed af histopatologisk scoring positiv; - = score 0 angiver normal eller ikke påvirket histologisk effekt.
2 - Hyppigheden af hver af de klassificerede scorer opnået fra patologen (se protokol for beskrivelse af scoringssystem).
TABEL 2
Sammenfattende statistik for histologiske scorer efter behandling/portion
TABEL 3
Sammenfattende statistik for indeksscoren efter behandling/portion
TABEL 4 LSMEAN-differenser: Indeksscore blandt behandlinger/portioner
1 - LSMEAN: Mindste kvadraters gennemsnit ** Statistisk signifikant ved p < 0,01
En statistisk signifikant forskel i gennemsnitlig histologisk indeksscore fandtes mellem KO NT RO L/J80421 og alle PD-NAV-portioner (p<0,0001). Ingen statistisk signifikante forskelle fandtes i gennemsnitlige histologiske indeksscorer blandt PD-NAV-portionerne. Resultater af analysen af dataene fra PD-NAV-virkningsfuldhedsforsøget viser, at statistisk signifikante nedgange i hjertevævsabnormiteter iagttoges i hver af de vaccinerede grupper i sammenligning med kontrolgruppen af laks. Desuden viser forsøget ingen signifikante forskelle blandt indbyrdes overensstemmende portioner, hvilket bekræfter vaccineproduktionens konsistens.
Eksempel 3
En anden udfordringsundersøgelse udførtes også for yderligere at påvise vaccinens virkningsfuldhed under anvendelse af hjertehistopatologiindekset. Den heri beskrevne PD-NAV-vaccine (pUK-SPDV-poly2#1-plasmid) afprøvedes i 110 ubehandlede atlantiske laks tilordnet hver af tre behandlingsgrupper (som hver modtog 0,05 ml intramuskulær injektion indeholdende fra 5 til 10 pg PD-NAV). 330 fisk holdtes i en uvaccineret kontrolgruppe. De forskellige grupper mærkedes med henblik på identifikation. Fiskene havde en vægt på 10-20 g (gennemsnitligt 13 g) og holdtes ved 12±2°C (400 graddages immuniseringsperiode). Udfordringen udførtes i en samlivsmodel i ferskvand (14±2°C), i hvilken 20% af fiskene injiceredes intraperitonealt med SAV3 (f.eks. virkende som “Trojansk” fisk til at inficere andre, der ikke var injiceret med SAV3). Prøvetagning (100 hjerter fra hver gruppe ved histopatologi (blindforsøg)) udførtes 24 dage efter udfordringen, på hvilket tidsrum det er kendt, at der kan være opstået betydelig skade på hjertevæv.
Hjertehistopatologiindekset tilvejebringer mål for op til otte parametre, herunder infiltration med eosinofile granulocyter, fibrose, granulocytinfiltration, inflammation, lymfocytinfiltration, myocytregenerering, nekrose og infiltration med ikke-lymfocytiske mononuklære celler. Sammendrag af disse resultater er vist i fig. 16-18. Som vist der udviste saltvandsvaccinerede kontrolfisk (fig. 16, gruppe 1) betydelig forøgede målinger af hjertehistopatologiindeks i sammenligning med fisk vaccinerede med pUK-SPDV-poly2#1-plasmid (Fig. 16, gruppe 2-4, fejlsøjler viser standardafvigelse på gennemsnittet p<0,0001). På lignende måde tilvejebringer Fig. 17 billeder, der sammenligner ikke-nekrotiske (Fig. 17A) og nekrotiske væv (Fig. 17B). Fig. 18A og 18B illustrerer histopatologiindekset hhv. qPCR-resultaterne efter SAV-udfordring i fisk vaccinerede med saltvand eller pUK-SPDV-poly2#1-plasmid (ved 0,05, 0,1, 0,2, 0,5, 1,0 eller 2,0 gange normaliseret dosis). De i Fig. 18A og 18B gengivne data viser, at pUK-SPDV-poly2#1-plasmidet både nedsætter histopatologiindekset og mængden af cirkulerende SAV (udfordringsvirusset).
Eksempel 4
En anden undersøgelse udførtes under anvendelse af 150 ubehandlede atlantiske laks tilordnet hver af tre behandlingsgrupper (0,05 ml injektion af en 10X koncentreret pUK-SPDV-poly2#1-vaccine eller saltvand) og iagttoges i et tidsrum på 90 dage. Fiskene havde en vægt på 10-20 g (13 g i gennemsnit) og holdtes ved 12±2°C. 10 til 20 prøver fremstilledes på dag 4, 8, 21 og 90 efterfulgt af makroskopisk og mikroskopisk undersøgelse af injektionsstedet (muskel). Et formål med denne undersøgelse var at påvise sikkerheden af en 10X koncentreret vaccinesammensætning ved måling af histopatologi i forhold til saltvandskontrol. Som illustreret i Fig. 19 iagttoges marginale forøgelser i lokale reaktioner på injektionsstedet mellem undersøgelsesproduktet og saltvandskontroller på dag 4 og 21, som fuldstændigt var forsvundet på dag 90. (Fig. 19: søjle i hver gruppe med henblik på præsentation fra venstre til højre: saltvand, portion 1, portion 2, portion 3). Mindre behandlingsrelaterede lokale reaktioner iagttoges også på injektionsstedet, men var af forbigående natur. Det iagttoges også, at 75% af de pUK-SPDV-poly2#1-plasmid-vaccinerede fisk genoptog fødeindtagelse inden for én dag efter vaccination (idet 100% vendte tilbage til fuld fødeindtagelse efter 7 dage). Analyse af histopatologiske billeder angav moderat inflammation (score 2) efter indgivelse af den 10X koncentrerede vaccine.
Eksempel 5 PD-NAV’s farmakokinetik undersøgtes også. I denne undersøgelse tilordnedes 200 ubehandlede atlantiske laks én af tre behandlingsgrupper (2X pUK-SPDV-poly2#1, 10X pUK-SPDV-poly2#1 eller 10X APEX-IHN), og 200 tilordnedes en saltvandsvaccineret kontrolgruppe (mærket passende). Disse fisk vejede 9,0+1,4 g, og de holdtes i ferskvand ved 10-12°C. Fiskene vaccineredes ved en intramuskulær injektion på 0,05 ml. Tolv prøver udtoges på forskellige tidspunkter (ti fisk/prøve) i et tidsrum på 27 måneder. Forskellige organer og musklen ved injektionsstedet analyseredes for plasmid ved anvendelse af qPCR. Som vist i Fig. 20 var plasmidet hurtigt clearet fra injektionsstedet (f.eks. faldt plasmidniveauet ved injektionsstedet (2X koncentreret vaccine) i løbet 21 dage til mindre end 10% af den oprindelige mængde). Plasmidet var påviseligt i det mindste indtil dag 759 (<0,11% af oprindelige niveauer).
Eksempel 6
Der udførtes også undersøgelser for at bestemme den optimale dosiskoncentration af pUK-SPDV-poly2#1 med hensyn til nekrose (f.eks. målt ved hjertehistopatologiindeks af hjerteapeks i 10% pufret formalin; analyseret ved GLIMMIX-metoden (SAS/STAT®-software)) og den i hjertevæv tilstedeværende mængde virus (f.eks. målt ved RT-qPCR af RNA i hjerteapeks (målgen = nsP1 (96,22% effektivitet), referencegen = EF1-alpha (95,52% effektivitet); analyseret ved tovejs-ANOVA (signifikansniveau 0,05), SAS/STAT®-software). Prøver tilvejebragtes fra fiskene til afprøvning 19, 26 og 35 dage efter udfordring (DPC) med SAV-3. Doseringsgrupper (sammenlignet med saltvandskontrol) var 0,5 pg/dosis (dosis 1), 1 pg/dosis (dosis 2), 2 pg/dosis (dosis 3), 5 pg/dosis (dosis 4), 10 pg/dosis (dosis 5) og 20 pg/dosis (dosis 6). Som vist i Fig. 21-23 førte de højeste doser til de laveste gennemsnitlige hjertenekrosescorer (Fig. 21) hhv. den laveste i prøver påviste SAV3-RNA-koncentration (Fig. 22, 23). Eksempelvis viser Fig. 23C, at dosis 4 havde den største nedgang ved både 19 DPC (>149000) og 35 DPC (>32000) prøvetidspunkt, medens dosis 6 oversteg 51000 ganges reduktion ved 26 DPC, og dosis 5 var den tredjehøjst effektive behandling for alle tre prøvetagningsdage. Yderligere data er gengivet i tabellerne 5-23: TABEL 5
Hyppighedsfordeling af histologiske scorer for dag 19
1 - + = Scorer på 1, 2 eller 3 angiver sværhed af histopatologisk scoring positiv; - = score 0 angiver normal eller ikke påvirket histologisk effekt.
2 - Hyppigheden af hver af de klassificerede scorer opnået fra patologen (se protokol for beskrivelse af scoringssystem).
TABEL 6
Hyppighedsfordeling af histologiske scorer for dag 26
1 - + = Scorer på 1, 2 eller 3 angiver sværhed af histopatologisk scoring positiv; - = score 0 angiver normal eller ikke påvirket histologisk effekt.
2 - Hyppigheden af hver af de klassificerede scorer opnået fra patologen (se protokol for beskrivelse af scoringssystem).
TABEL 7
Hyppighedsfordeling af histologiske scorer for dag 35
1 - + = Scorer på 1, 2 eller 3 angiver sværhed af histopatologisk scoring positiv; - = score 0 angiver normal eller ikke påvirket histologisk effekt.
2 - Hyppigheden af hver af de klassificerede scorer opnået fra patologen (se protokol for beskrivelse af scoringssystem).
TABEL 8
Sammenfattende statistik for histologiske scorer ved behandling inden for dag 19
TABEL 9
Sammenfattende statistik for histologiske scorer ved behandling inden for dag 26
TABEL 10
Sammenfattende statistik for histologiske scorer ved behandling inden for dag 35
TABEL 11
Sammenfattende statistik for indeksscoren ved behandling fra dag 19 histologiske resultater
TABEL 12
Sammenfattende statistik for indeksscoren ved behandling fra dag 26 histologiske resultater
TABEL 13
Sammenfattende statistik for indeksscoren ved behandling fra dag 35 histologiske resultater
TABEL 14
Resultater fra en ANOVA på histologisk indeksscore blandt behandlinger inden for dag 19
1 - mindste kvadraters gennemsnit, * statistisk signifikant ved p <0,05 ** statistisk signifikant ved p <0,01
En statistisk signifikant differens fandtes i gennemsnitlig histologisk indeksscore inden for dag 19 mellem saltvand (kontrol) og alle vaccinegrupper med doseringsniveauer højere end 1 pg/dosis; mellem pUK-SPDV-poly2#1 (0,5 pg/dosis) og alle andre behandlinger med højere doseringsniveauer; og mellem pUK-SPDV-poly2#1 (1 pg/dosis) og alle andre behandlinger med højere doseringsniveauer end 2 pg/dosis.
Ingen statistisk signifikante forskelle fandtes mellem kontrollen og enten 0,5 eller 1 pg/dosis. Ingen statistisk signifikante forskelle fandtes mellem 1 pg/dosis og 2 mg/dosis. Ingen statistisk signifikante forskelle fandtes mellem 2 pg/dosis og alle højere dosisgrupper.
TABEL 15
Resultater fra en ANOVA på histologisk indeksscore blandt behandlinger inden for dag 26
* statistisk signifikant ved p <0,05 ** statistisk signifikant ved p <0,01
En statistisk signifikant forskel fandtes i gennemsnitlig histologisk indeksscore inden for dag 26 mellem saltvandsgruppen (kontrol) og alle vaccinegrupper; mellem pUK-SPDV-poly2#1 (0,5 pg/dosis) og alle andre behandlinger med doseringsniveauer højere end 1 pg/dosis; og mellem pUK-SPDV-poly2#1 (1 pg/dosis) og alle andre behandlinger med højere doseringsniveauer.
Ingen statistisk signifikante forskelle fandtes mellem 0,5 pg/dosis og 1 pg/dosis. Ingen statistiske signifikante forskelle fandtes mellem 2 mg/dosis og alle højere dosisgrupper.
TABEL 16
Resultater fra en ANOVA på histologisk indeksscore blandt behandlinger inden for dag 35
* statistisk signifikant ved p <0,05 ** statistisk signifikant ved p <0,01
En statistisk signifikant forskel fandtes i gennemsnitlig histologisk indeksscore inden for dag 35 mellem saltvandsgruppen (kontrol) og alle vaccinegrupper med doseringsniveauer højere end 0,5 pg/dosis; og mellem pUK-SPDV-poly2#1 (0,5 pg/dosis) og alle andre behandlinger med højere doseringsniveauer.
Ingen statistisk signifikante forskelle fandtes mellem kontrolgruppen og 0,5 pg/dosis.
Ingen statistisk signifikante forskelle fandtes mellem 1 pg/dosis og alle højere dosisgrupper.
TABEL 17
Sammenfattende statistik for Ct for gen af interesse, SAV-nsP1 og referencegen, Ef1a, efter dag og behandling 1 - antal tisk
TABEL 18
Sammenfattende statistik forACt efter dag og behandling 1 - antal fisk
TABEL 19
Resultater fra en ANOVA på ACt blandt behandlinger for dag 19
* statistisk signifikant ved p <0,05 ** statistisk signifikant ved p <0,01
Statistisk signifikante forskelle i gennemsnitlig ACt inden for dag 19 fandtes blandt alle behandlinger undtagen blandt pUK-SPDV-poly2#1 (5 pg/dosis), (10 pg/dosis) og (20 pg/dosis).
TABEL 20
Resultater fra en ANOVA på ACt blandt behandlinger for dag 26
* statistisk signifikant ved p <0,05 ** statistisk signifikant ved p <0,01
Statistisk signifikante forskelle i gennemsnitlig ACt inden for dag 26 fandtes blandt alle behandlinger undtagen blandt pUK-SPDV-poly2#1 (5 pg/dosis), (10 pg/dosis) og (20 pg/dosis).
TABEL 21
Resultater fra en ANOVA på ACt blandt behandlinger for dag 35
* statistisk signifikant ved p <0,05 ** statistisk signifikant ved p <0,01
Statistisk signifikante forskelle i gennemsnitlig ACt inden for dag 35 fandtes blandt alle behandlinger undtagen blandt pUK-SPDV-poly2#1 (5 pg/dosis), (10 pg/dosis) og (20 pg/dosis).
TABEL 22
Korrelation af histologisk indeksscore og ACt inden for én dag
**statistisk signifikant ved p>0,01
Statistisk signifikant korrelation fandtes mellem histologisk indeksscore og ACt for alle dage. Alle var negativt korrelerede. Den højeste korrelation i absolut værdi var for dag 26, efterfulgt af dag 19 og derpå dag 35.
TABEL 23
Skematisk illustration af statistisk signifikante forskelle blandt grupper inden for dage
Resultater fra analysen af dataene fra dag 19 angiver ingen statistisk signifikante forskelle i gennemsnitlig histologisk indeksscore blandt kontrolgruppen (0 pg/dosis) og grupperne med 0,5 pg/dosis og 1 pg/dosis; heller ikke mellem grupperne med 1 pg/dosis over 2 pg/dosis. Ingen statistisk signifikante forskelle fandtes blandt grupperne med 2 til 20 pg/dosis.
Dataene fra tabellerne 5-23 antyder, at den optimale beskyttelse på dag 19 tilvejebringes af en dosis på 10 pg, og at den minimale beskyttende dosis er 5 pg. Dataene antyder også, at optimal beskyttelse tilvejebringes på dag 26 og 35 af en dosis på 10 pg, og den minimale beskyttende dosis på dette tidspunkt er 2 pg.
Disse undersøgelser viser, at pUK-SPDV-poly2#1 er en højeffektiv vaccine (i sammenligning med saltvand som kontrol), udviser en udmærket sikkerhedsprofil med kun marginale og forbigående forøgelse i lokale reaktioner på injektionsstedet, hurtig clearance af plasmidet fra tarm, milt, kønskirtler, hoved, nyre og hjerte, således at intet plasmid var påviseligt i noget organ på dag 36 efter vaccinationen, hurtig clearance af plasmid fra musklen på injektionsstedet med plasmidniveauer faldende til under 5% af niveauerne fra dag 1 i løbet af 7 dage efter vaccination (undtagen for tarm: i løbet af 36 dage) og kun var påviseligt i meget små niveauer (<0,11% af niveauerne fra dag 1; 2x vaccine) op til dag 759 efter vaccinationen. Desuden er det blevet påvist, at hjertehistopatologiindekset tilvejebringer et højfølsomt mål for virkningsfuldhed og sikkerhed med udmærket analyserobusthed.
Eksempel 7
En undersøgelse udførte til sammenligning af virkningsfuldheden af en inaktiveret helvirusvaccine i sammenligning med en DNA-vaccine, der omfatter pUK-SPDV-poly2#1. DNA-vaccinen indgaves i en dosis på 10 pg og 20 pg, idet dosis pr. fisk var 0,05 ml intramuskulært. Den inaktiverede helvirusvaccine var den kommercielt tilgængelige Norvax®Compact PD (Intervet AS), anvendt som en intraperitoneal dosis på 0,1 ml/fisk.
2670 ubehandlede atlantiske laks anvendtes med en gennemsnitsvægt på 44,9 g ved forsøgets begyndelse. 2200 fisk fordeltes blandt fem forsøgsgrupper, 440 anvendtes som Trojanere (udkastere) til udfordring, og 30 fisk anvendtes på tidspunktet nul som ubehandlede kontrolprøver.
For at efterkomme det på etiketten på Norvax® Compact PD-vaccineproduktet skitserede anbefalede vaccinationsprogram deltes vaccinationssystemet i to faser adskilt af et tidsrum på 213 graddage som anbefalet på etiketten. Vaccinationsfase 1 omfattede indgivelsen af de forskellige PD-vaccinebehandlinger eller saltvand til de negative kontrolgrupper. Vaccinationsfase 2 omfattede enten indgivelse af saltvand eller en intraperitoneal dosis på 0,1 ml pr. fisk af en vaccine med et olieadjuvans, som ikke indeholdt antigener mod PD (Norvax® Minova 6, Intervet AS: indeholder inaktiverede stammer af Listonella (Vibrio) anguillarum serovar 01, Listonella (Vibrio) anguillarum serovar 02a, Aeromonas salmonicida subsp. salmonicida, Vibrio salmonicida og Moritella viscosa og overfladeprotein fra IPN-virus serotype Sp.). Begge vaccinationerne udførtes ved ca. 12°C.
De negative kontrolgrupper injiceredes intraperitonealt med 0,1 ml 0,9%’s NaCI-opløsning.
TABEL 24
Efter den anden vaccination fordeltes hver behandlingsgruppe ligeligt i fire tanke (110 fisk/gruppe/tank). Således bragtes de fem forskellige grupper til at leve sammen i resten af undersøgelsen. Fiskene udfordredes derpå ved 731 graddage og 2050 graddage med et SAV-3-isolat fra vævshomogenater fremstillet ud fra hjertet af fisk med kliniske symptomer fra et udbrud i Norge. Hver udfordring udførtes i tanke in duplo under anvendelse af en fuld samlivsmodel omfattende 20% udkastere pr. tank, som havde fået indgivet en intraperitoneal injektion på 0,1 ml af SAV-3-isolatet. Histologiprøver af hjerte og pankreas opsamledes på dag 18, 22 og 26 efter udfordringen. 30 fisk blev også udtaget som prøver inden vaccinationen som kontrol samt 5 fisk fra alle grupper fra begge replikater (i alt 50 fisk) inden udfordringen ved 731 graddage og 2050 graddage som en kontrol efter vaccination. Prøverne undergik en histopatologisk analyse samt qRT-PCR til bedømmelse af virusbelastning i hjertevævet. Dataene præsenteres som CT-værdier (CT-værdier et mål for antallet af mangfoldiggørelsescyklusser, som er nødvendige til at påvise virusset; følgelig angav højere CT-værdier lavere virusbelastning, og lavere CT-værdier angiver højere virusbelastninger). Analysen var udformet til specifikt at målrettes mod SAV-3-virus-subtypen. CT-værdierne normaliseredes derpå mod forlængelsesfaktoren alpha, referencegenet. Gennemsnit af de normaliserede værdier beregnedes derpå for hver gruppe. Den for den negative-negative (PBS) kontrolgruppe opnåede gennemsnitlige deltaCT-værdi subtraheredes derpå fra gruppens gennemsnitlige deltaCT, og resultaterne opløftedes til anden potens på grund af PCR-mangfoldiggørelsens eksponentielle natur. De endelige data gav en repræsentation for, hvor mange gange viruskoncentrationen i hjerteprøverne var gået ned i sammenligning med den negative kontrolgruppe.
DNA-vaccinens sikkerhed bedømte ved overvågning af dødeligheden af de vaccinerede atlantiske laks i et tidsrum på 18 dage. Ingen skadelig virkning eller dødelighed iagttoges i dette tidsrum for den ene eller den anden doseringsmængde.
TABEL 25: Histopatologiscorer for pankreasdegeneration/nekrose: 731 graddage udfordring, 22 dage efter udfordring
Sværheden af acinusnekrose bedømtes på en skala, der rækker fra niveau 0, som repræsenterer normalt væv, til niveau 3, som er tegn på markant degeneration og nekrose af vævene.
TABEL 26: Histopatologiscorer for pankreasdegeneration/nekrose: 2050 graddages udfordring, 26 dage efter udfordring
N obs.: antal observationer N: antal datapunkter
Ved 731 graddage efter vaccination og 22 dage efter udfordring scorede PD-NAV (både 10 og 20 pg) mindre end 0,3 for pankreasnekrose, en signifikant (p<0,001) reduktion i sammenligning med den negative-negative PBS-gruppe med en gennemsnitlig score på 2,4, den negative (olie-multivalent) kontrolgruppe med gennemsnit 1,9 samt den kommercielle inaktiverede vaccine (kompakt PD) med gennemsnit 1,5.
En lignende tendens iagttoges for dataene for 2050 graddage/26 dage efter udfordring, selv om infektionen i den negative kontrol var sværere. For dette udfordringstidspunkt scorede PD-NAV mindre end 0,8, hvilket giver en signifikant (p<0,001) reduktion fra den negative-negative (PBS) gruppe med en gennemsnitlig score på 3,0, den negative (olie-multivalent) kontrolgruppe med gennemsnit 2,6 og den kommercielle inaktiverede vaccine (kompakt PD) med gennemsnit 2,5.
Hjertehistopatologi
Sværheden af myocytnekrose bedømtes på en skala, der rakte fra niveau 0, som repræsenterer normalt væv, til niveau 3, der er tegn på en markant degeneration og nekrose af vævet.
TABEL 27: Histopatologiscorer for hjertenekrose: 731 graddages udfordring, 22 dage efter udfordring
TABEL 28: Histopatologiscorer for hjertenekrose: 2050 graddages udfordring, 26 dage efter udfordring
N obs.: antal observationer N: antal datapunkter
Ved 731 graddage efter vaccination og 22 dage efter udfordring scorede PD-NAV (både 10 og 20 pg) mindre end 0,1 for hjertehistopatologi, en signifikant (p<0,001) reduktion i sammenligning med den negative-negative PBS-gruppe med en gennemsnitlig score på 1,3, den negative (olie-multivalent) kontrol med gennemsnit 1,2 samt den kommercielle inaktiverede vaccine (kompakt PD) med gennemsnit 1,0.
For varighedsreaktionen 2050 graddage og 26 dage efter udfordring scorede PD-NAV (både 10 og 20 pg) mindre end 0,4 for hjertehistopatologi, en signifikant (p<0,001) reduktion i sammenligning med den negative-negative (PBS) gruppe med gennemsnitlig score 2,4, den negative (olie-multivalent) kontrol med gennemsnit 2,1 og den kommercielle inaktiverede vaccine (kompakt PD) med gennemsnit 1,9.
Udbredelse af SAV3-virus ifølge qRT-PCR
En qRT-PCR-metode anvendtes til at påvise SAV3-vira i hjertevæv. Analysen anvendtes til at bedømme sværheden af virusforplantning samt den procentiske infektion i hver behandlingsgruppe.
Sværhed af virusforplantning
Procentdelen af hjerteprøver med en positiv diagnostik for SAV3 beregnedes på grundlag af qRT-PCR-resultaterne. Prøver med en CT-værdi større end eller lig med 37 ansås som negative og scorede værdien 0, medens en CT-værdi mindre end 37 ansås for positiv og fik værdien 1. De beregnede gennemsnit og dermed forbundne standardafvigelser fremgår af den nedenstående tabel.
TABEL 29: Bedømmelse af tilstedeværelse eller fravær af SAV-3-virus i hjertevæv qRT-PCR-diagnostik 731 graddages udfordring/22 dage efter udfordring
TABEL 30: Bedømmelse af tilstedeværelse eller fravær af SAV-3-virus i hjertevæv qRT-PCR-diagnostik 2050 graddages udfordring/26 dage efter udfordring N obs.: antal observationer
N: antal datapunkter
Ved 731 graddage efter vaccination og 22 dage efter udfordring havde PD-NAV (både 10 og 20 pg) signifikant (p<0,001) lavere SAV3-påvisningsgrad (40,7%, hhv. 41,7%) i sammenligning med den negative-negative PBS-gruppe (100%), den negative (olie-multivalent) kontrol (96,7%) samt den kommercielle inaktiverede vaccine (kompakt PD) (83,3%).
For 2050 graddages udfordringen havde PD-NAV-vaccinerede fisk en signifikant lavere (p<0,001) SAV3-påvisningsgrad (58,3%, 57,4%) i sammenligning med den negative PBS-kontrol (100%), den multivalente olie-kontrol (100%) og den inaktiverede PD-vaccine (kompakt PD) (96,6%).
Relativ viruskoncentration i hjertevæv
Antallet af cyklusser (CT) til at opnå et positivt signal for tilstedeværelsen af SAV3-viruspartikler fundet i hjertevæv måltes ved qRT-PCR.
TABEL 31: Relativ viruskoncentration i hjertevæv 731 graddage udfordring/22 dage efter udfordring
TABEL 32: Relativ viruskoncentration i hjertevæv 2050 graddage udfordring/26 dage efter udfordring N obs.: antal observationer
N: antal datapunkter
Ved 518 graddage efter vaccinationen og efter en udfordring var SAV-3-koncentrationen 26400 til 31400 gange mindre i hjertevævet for PD-NAV-vaccinerede fisk, 3 gange mindre for olie-multivalent-gruppen og 22 gange mindre for gruppen med inaktiveret PD-vaccine end de i den negative kontrolgruppe med PBS påviste niveauer. For 2050 graddages udfordringen fra SAV3-koncentrationen 2300 til 9600 gange mindre i hjertevævet for PD-NAV-vaccinerede fisk, 1 gang mindre for olie-multivalent-kontrolgruppen og 2 mindre for gruppen med inaktiveret PD-vaccine end de i den negative kontrolgruppe med PBS påviste niveauer.
Som konklusion var pUK-SPDV-poly2#1-DNA-vaccinen overlegen i forebyggelse af udviklinger af vævsnekrose i målorganer samt nedsættelse af virusforplantning i hjertevæv, når den blev indgivet i enten en 10 eller 20 pg dosis i sammenligning med en inaktiveret helvirusvaccine og negative kontroller. Overlegenheden stemte overens ved både tidlig indsætning (731 graddage) og sen indsætning (2050 graddage) af immunitet, hvilket viser, at disse vacciner tilbyder varig beskyttelse.
Det må forstås, at enhver henvisning til et særligt område omfatter alle individuelle værdier og delområder inden for det område, som om de hver især individuelt var opregnet her. Selv om den foreliggende opfindelse er blevet beskrevet udtrykt ved foretrukne udførelsesformer, må det forstås, at variationer og modifikationer vil forekomme for fagfolk. Derfor tilsigtes det, at de vedføjede krav dækker alle sådanne ækvivalente variationer, som falder inden for opfindelsens omfang ifølge kravene.
REFERENCER
Bolivar m.fl. Construction and characterization of new cloning vehicles. I. Ampicillin-resistant derivatives of the plasmid pMB9. 1977a. Gene. 2:75-93.
Bolivar m.fl. 19775. Construction and characterization of new cloning vehicles. II. A multipurpose cloning system. Gene. 2:95-113.
Covarrubias et al. 1981. Construction and characterization of new cloning vehicles. V. Mobilization and coding properties of pBR322 and several deletion derivatives including pBR327 and pBR328. Gene. 13:25-35.
Jorgensen m.fl. 2003. CpG DNA induces protective antiviral immune responses in Atlantic salmon (Salmo salar L). J Virol. 77:11471-9.
Krieg m.fl. 2004. Vectors and methods for immunization or therapeutic protocols. United States Patent No. 6,821,957.
Scott JR. 1984. Regulation of plasmid replication. Microbiol Rev. 48:1-23.
Strandskog m.fl. 2007. Characterization of three distinct CpG oligonucleotide classes which differ in ability to induce IFN alpha/beta activity and cell proliferation in Atlantic salmon (Salmo salar L.) leukocytes. Dev Comp ImmunoL 31:39-51.
Strauss m.fl. 1994. The alphaviruses: gene expression, replication, and evolution. Microbiol Rev. 58:491-562.
Tomizawa m.fl. 1974. Replication of Colicin E1 Plasmid DNA in Ceil Extracts. Origin and Direction of Replication. PNAS. 71:2260-2264.
Villoing m.fl. 2000. Rainbow trout sleeping disease virus is an atypical alphavirus. J Virol. 74:173-83.
Weston m.fl. 1999. Salmon pancreas disease virus, an alphavirus infecting farmed Atlantic salmon, Salmo salar L. Virology. 256:188-95.
Xu m.fl. 2012. Superior protection conferred by inactivated whole virus vaccine over subunit and DNA vaccines against salmonid alphavirus infection in Atlantic salmon (Salmo salar L). Vaccine. 30: 3918-28.
Claims (15)
1. Isoleret nukleinsyremolekyle, der koder for et lakse-alphavirus (SAV) polyprotein, hvori SAV polyproteinet er mindst 98% identitisk med SEQ ID NO: 5.
2. Isoleret nukleinsyremolekyle ifølge krav 1 omfattende en sekvens valgt fra gruppen bestående af SEQ ID NO: 1, SEQ ID NO: 2 og SEQ ID NO: 3.
3. Isoleret nukleinsyremolekyle, som koder for et lakse-alphavirus (SAV) polyprotein der omfatter sekvensen SEQ ID NO: 5.
4. Isoleret nukleinsyremolekyle ifølge krav 1 hvori SAV polyproteinet omfatter mindst én substitution ved en aminosyre valgt fra gruppen bestående af 21, 47, 116, 130, 141, 203, 221, 269, 278, 321, 347, 351,362, 409, 512, 550, 551,574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771, 838-859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og 1303.
5. Ekspressionsvektor, der omfatter et isoleret nukleinsyremolekyle ifølge et hvilket som helst af kravene 1 - 4.
6. Isoleret polypeptid med aminosyresekvensen SEQ ID NO: 5.
7. Isoleret polypeptid, som deler mindst 98% identitet med SEQ ID NO: 5.
8. Isoleret polypeptid ifølge krav 7, hvori polypeptidet omfatter mindst én substitution ved aminosyre valgt fra gruppen bestående af aminosyrerne 21, 47, 116, 130, 141, 203, 221, 269, 278, 321,347, 351, 362, 409, 512, 550, 551, 574, 575, 583, 609, 696, 703, 726, 748, 752, 758, 765, 771, 838, 839, 840, 841, 842, 843, 844, 845, 846, 847, 848, 849, 850, 851, 852, 853, 854, 855, 856, 857, 858, 859, 892, 914, 930, 988, 1005, 1053, 1240, 1254, 1266, 1274 og/eller 1303.
9. Et nukleinsyremolekyle ifølge et hvilket som helst af kravene 1-4, eller en ekspressionsvektor ifølge krav 5 til anvendelse til fremkaldelse af en immunreaktion i en vært mod et lakse-alphavirus.
10. Et polypeptid ifølge et hvilket som helst af kravene 6-8 til anvendelse til fremkaldelse af en immunreaktion i en vært mod et lakse-alphavirus.
11. Nukleinsyremolekylet eller ekspressionsvektoren til anvendelse til fremkaldelse af en immunreaktion i en vært mod et lakse-alphavirus ifølge krav 9, ved hvilken ekspressionsvektoren eller nukleinsyremolekylet er et plasmid, som kan indgives ved injektion i muskelvæv.
12. Nukleinsyremolekylet til anvendelse til fremkaldelse af en immunreaktion i en vært mod et lakse-alphavirus ifølge krav 9 eller 11, ved hvilken 2 til 20 pg nukleinsyremolekyle kan indgives til værten.
13. Nukleinsyremolekylet til anvendelse til fremkaldelse af en immunreaktion i en vært mod et lakse-alphavirus ifølge krav 12, ved hvilken 5 til 10 pg nukleinsyremolekyle kan indgives til værten.
14. Vaccine omfattende nukleinsyremolekylet ifølge et hvilket som helst af kravene 1 til 4, hvor indgivelsen af vaccinen til fisk forebygger udviklingen af vævsnekrose som målt ved histopatologi.
15. Vaccine til anvendelse mod lakse-alphavirus omfattende nukleinsyremolekylet ifølge et hvilket som helst af kravene 1 til 4, hvor indgivelsen af vaccinen til fisk forebygger udviklingen af vævsnekrose som målt ved histopatologi, hvis fisken er smittet med SAV-3.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12184758 | 2012-09-17 | ||
| EP12184758 | 2012-09-17 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DK201300530A DK201300530A (en) | 2014-03-18 |
| DK178233B1 true DK178233B1 (en) | 2015-09-14 |
Family
ID=46851875
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DK201300530A DK178233B1 (en) | 2012-09-17 | 2013-09-17 | Fiskevaccine |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9303071B2 (da) |
| EP (1) | EP2895501B1 (da) |
| CA (1) | CA2884918C (da) |
| CL (1) | CL2015000642A1 (da) |
| DK (1) | DK178233B1 (da) |
| WO (1) | WO2014041189A1 (da) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9884103B2 (en) | 2013-05-28 | 2018-02-06 | Elanco Tiergesundheit Ag | Interactions of betanodaviruses in infection |
| EP3037823A1 (en) | 2014-12-22 | 2016-06-29 | BioMar Group A/S | Method for determining pathological tissue damage and diagnosing infectious disease in fish |
| CN107405393A (zh) * | 2015-01-29 | 2017-11-28 | 新加坡科技研究局 | 携带基孔肯亚相关肽的纳米胶囊 |
| NO344938B1 (en) * | 2018-12-13 | 2020-07-20 | Patogen As | Pancreas Disease Virus Markers |
| ES2827148B2 (es) | 2019-11-19 | 2021-10-19 | Instituto Nac De Investigacion Y Tecnologia Agraria Y Alimentaria Inia | Plásmido codificante para el receptor del factor de activación de células B (BAFF-R) y usos del mismo en el tratamiento y prevención de enfermedades inflamatorias en peces |
| EP4370151A1 (en) | 2021-07-13 | 2024-05-22 | Stonehaven Incubate AG | Composition and uses thereof |
| WO2024069549A1 (en) * | 2022-09-29 | 2024-04-04 | Touchlight Aquaculture Limited | Vaccine construct and uses thereof |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999058639A2 (en) * | 1998-05-08 | 1999-11-18 | Akzo Nobel N.V. | Structural proteins of fish pancreatic disease virus and uses thereof |
| US6339068B1 (en) * | 1997-05-20 | 2002-01-15 | University Of Iowa Research Foundation | Vectors and methods for immunization or therapeutic protocols |
| WO2004026338A1 (en) * | 2002-09-17 | 2004-04-01 | Novartis Ag | Ihnv g protein for immune stimulation |
| WO2007031572A1 (en) * | 2005-09-16 | 2007-03-22 | Intervet International B.V. | Fish vaccine |
| WO2010062396A2 (en) * | 2008-11-26 | 2010-06-03 | Government Of The United States Of America , As Represented By The Secretary, Department Of Health And Human Services | Virus like particle compositions and methods of use |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| EP0681026A1 (en) | 1987-03-02 | 1995-11-08 | Whitehead Institute For Biomedical Research | Recombinant mycobacterial vaccine |
| US5504005A (en) | 1987-03-02 | 1996-04-02 | Albert Einstein College Of Medicine Of Yeshiva University | Recombinant mycobacterial vaccine |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| AU648505B2 (en) | 1989-05-19 | 1994-04-28 | Amgen, Inc. | Metalloproteinase inhibitor |
| CA2076753A1 (en) | 1990-02-26 | 1991-08-27 | Anthony J. Radford | Shuttle plasmid for escherichia coli and mycobacteria |
| GB9015888D0 (en) | 1990-07-19 | 1990-09-05 | Smithkline Biolog | Vectors |
| EP0814159B1 (en) | 1990-08-29 | 2005-07-27 | GenPharm International, Inc. | Transgenic mice capable of producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| WO1992021376A1 (en) | 1991-06-06 | 1992-12-10 | Med Immune, Inc. | Induction of ctl responses to foreign antigens expressed in mycobacteria |
| NO333242B1 (no) | 2008-02-08 | 2013-04-15 | Pharmaq As | Sammensetning, medisinsk anvendelse og fremgangsmate som omfatter salmonid alfavirus |
-
2013
- 2013-09-17 CA CA2884918A patent/CA2884918C/en active Active
- 2013-09-17 EP EP13762842.6A patent/EP2895501B1/en active Active
- 2013-09-17 DK DK201300530A patent/DK178233B1/da active
- 2013-09-17 WO PCT/EP2013/069241 patent/WO2014041189A1/en active Application Filing
- 2013-09-17 US US14/421,276 patent/US9303071B2/en active Active
-
2015
- 2015-03-16 CL CL2015000642A patent/CL2015000642A1/es unknown
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6339068B1 (en) * | 1997-05-20 | 2002-01-15 | University Of Iowa Research Foundation | Vectors and methods for immunization or therapeutic protocols |
| WO1999058639A2 (en) * | 1998-05-08 | 1999-11-18 | Akzo Nobel N.V. | Structural proteins of fish pancreatic disease virus and uses thereof |
| WO2004026338A1 (en) * | 2002-09-17 | 2004-04-01 | Novartis Ag | Ihnv g protein for immune stimulation |
| WO2007031572A1 (en) * | 2005-09-16 | 2007-03-22 | Intervet International B.V. | Fish vaccine |
| WO2010062396A2 (en) * | 2008-11-26 | 2010-06-03 | Government Of The United States Of America , As Represented By The Secretary, Department Of Health And Human Services | Virus like particle compositions and methods of use |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2895501A1 (en) | 2015-07-22 |
| EP2895501B1 (en) | 2017-01-18 |
| DK201300530A (en) | 2014-03-18 |
| US20150232515A1 (en) | 2015-08-20 |
| CA2884918C (en) | 2019-01-08 |
| WO2014041189A1 (en) | 2014-03-20 |
| US9303071B2 (en) | 2016-04-05 |
| CL2015000642A1 (es) | 2015-08-28 |
| CA2884918A1 (en) | 2014-03-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DK178233B1 (en) | Fiskevaccine | |
| AU2002367594B2 (en) | Compositions and methods for the detection, diagnosis and therapy of hematological malignancies | |
| JP6605480B2 (ja) | ヘテロオリゴマーマイコバクテリア抗原の融合物 | |
| JP5053497B2 (ja) | 乳癌の治療および診断のための組成物および方法 | |
| KR20180026670A (ko) | 맞춤형 전달 벡터-기반의 면역 요법 및 이의 용도 | |
| KR101595234B1 (ko) | 면역원성 폴리펩타이드 및 단일클론 항체 | |
| US20210253650A1 (en) | Compositions and methods for treating secondary tuberculosis and nontuberculous mycobacterium infections | |
| US9180170B2 (en) | Brucella abortus proteins and methods of use thereof | |
| Mahmoud et al. | The multivalent adhesion molecule SSO1327 plays a key role in Shigella sonnei pathogenesis | |
| JP2013507103A (ja) | Gallibacteriumanatis由来の細胞溶解性RTX毒素 | |
| JP2015529677A (ja) | ワクチンとしてのClostridiumdifficileポリペプチド | |
| Bull et al. | A novel multi-antigen virally vectored vaccine against Mycobacterium avium subspecies paratuberculosis | |
| CA2893762A1 (en) | Ehrlichial invasin for immunization, diagnosis, and cell delivery | |
| Chung et al. | A 21.6 kDa tegumental protein of Clonorchis sinensis induces a Th1/Th2 mixed immune response in mice | |
| JP2021524485A (ja) | パラ結核症のための免疫原性組成物 | |
| CN104508120A (zh) | 编码肝素结合血凝素(hbha)融合蛋白质的重组分枝杆菌和其用途 | |
| Su et al. | Functional role of CD40 and CD154 costimulatory signals in IgZ-mediated immunity against bacterial infection | |
| CN117979992A (zh) | 钩端螺旋体毒力调节蛋白及其用途 | |
| WO2014189942A2 (en) | Compositions and methods for diagnosing, preventing, and treating salmonella typhi and salmonella paratyphi infection | |
| GAIGER et al. | Patent 2473746 Summary | |
| TW201529596A (zh) | 微生物之nme |