DE69725007T2 - Delta 1,6 bicyclo (4,4,0) basierte farbstoffe zur kontrastverstaerkung in der optischen bilderzeugung - Google Patents
Delta 1,6 bicyclo (4,4,0) basierte farbstoffe zur kontrastverstaerkung in der optischen bilderzeugung Download PDFInfo
- Publication number
- DE69725007T2 DE69725007T2 DE69725007T DE69725007T DE69725007T2 DE 69725007 T2 DE69725007 T2 DE 69725007T2 DE 69725007 T DE69725007 T DE 69725007T DE 69725007 T DE69725007 T DE 69725007T DE 69725007 T2 DE69725007 T2 DE 69725007T2
- Authority
- DE
- Germany
- Prior art keywords
- alkyl
- hydrogen
- hydroxyalkyl
- group
- methyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 230000003287 optical effect Effects 0.000 title description 8
- 239000001257 hydrogen Substances 0.000 claims abstract description 34
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 34
- 150000002431 hydrogen Chemical class 0.000 claims abstract description 29
- 125000002768 hydroxyalkyl group Chemical group 0.000 claims abstract description 22
- 125000004181 carboxyalkyl group Chemical group 0.000 claims abstract description 20
- 125000004183 alkoxy alkyl group Chemical group 0.000 claims abstract description 14
- 125000003118 aryl group Chemical group 0.000 claims abstract description 14
- 125000005358 mercaptoalkyl group Chemical group 0.000 claims abstract description 12
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims abstract description 11
- 125000004414 alkyl thio group Chemical group 0.000 claims abstract description 11
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 11
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 9
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 9
- 150000002367 halogens Chemical class 0.000 claims abstract description 9
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims abstract description 7
- 125000002252 acyl group Chemical group 0.000 claims abstract description 6
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims abstract description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 5
- 125000000027 (C1-C10) alkoxy group Chemical group 0.000 claims abstract description 4
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 claims abstract description 4
- 125000000217 alkyl group Chemical group 0.000 claims description 25
- 239000000203 mixture Substances 0.000 claims description 21
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 13
- 150000008052 alkyl sulfonates Chemical class 0.000 claims description 4
- 150000001875 compounds Chemical class 0.000 claims description 4
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 239000003814 drug Substances 0.000 claims description 2
- 238000004519 manufacturing process Methods 0.000 claims description 2
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 claims 4
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 claims 2
- IQZPDFORWZTSKT-UHFFFAOYSA-N nitrosulphonic acid Chemical compound OS(=O)(=O)[N+]([O-])=O IQZPDFORWZTSKT-UHFFFAOYSA-N 0.000 claims 2
- PXQLVRUNWNTZOS-UHFFFAOYSA-N sulfanyl Chemical class [SH] PXQLVRUNWNTZOS-UHFFFAOYSA-N 0.000 claims 2
- 239000000975 dye Substances 0.000 abstract description 40
- 238000000034 method Methods 0.000 abstract description 7
- 125000003396 thiol group Chemical class [H]S* 0.000 abstract description 4
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 abstract 5
- -1 n-carboxyanhydrides Chemical class 0.000 description 21
- ANRHNWWPFJCPAZ-UHFFFAOYSA-M thionine Chemical compound [Cl-].C1=CC(N)=CC2=[S+]C3=CC(N)=CC=C3N=C21 ANRHNWWPFJCPAZ-UHFFFAOYSA-M 0.000 description 12
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- MOFVSTNWEDAEEK-UHFFFAOYSA-M indocyanine green Chemical compound [Na+].[O-]S(=O)(=O)CCCCN1C2=CC=C3C=CC=CC3=C2C(C)(C)C1=CC=CC=CC=CC1=[N+](CCCCS([O-])(=O)=O)C2=CC=C(C=CC=C3)C3=C2C1(C)C MOFVSTNWEDAEEK-UHFFFAOYSA-M 0.000 description 8
- 229960004657 indocyanine green Drugs 0.000 description 8
- 238000010521 absorption reaction Methods 0.000 description 6
- 230000008685 targeting Effects 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 5
- 125000004122 cyclic group Chemical group 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 125000000623 heterocyclic group Chemical group 0.000 description 4
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 3
- SGNAVSTUZPHFPI-UHFFFAOYSA-M [I-].C[S+]1C(=NC2=C1C=CC=C2)C Chemical compound [I-].C[S+]1C(=NC2=C1C=CC=C2)C SGNAVSTUZPHFPI-UHFFFAOYSA-M 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 150000001298 alcohols Chemical class 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 125000004103 aminoalkyl group Chemical group 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000007795 chemical reaction product Substances 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 150000002019 disulfides Chemical class 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 150000002540 isothiocyanates Chemical class 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 125000006850 spacer group Chemical group 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 150000001336 alkenes Chemical group 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 150000008064 anhydrides Chemical class 0.000 description 2
- 239000007900 aqueous suspension Substances 0.000 description 2
- 150000001502 aryl halides Chemical class 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 150000001735 carboxylic acids Chemical class 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical class NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 230000000269 nucleophilic effect Effects 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 150000004291 polyenes Chemical class 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 229920002477 rna polymer Polymers 0.000 description 2
- 150000003839 salts Chemical group 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical class ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- INGWEZCOABYORO-UHFFFAOYSA-N 2-(furan-2-yl)-7-methyl-1h-1,8-naphthyridin-4-one Chemical compound N=1C2=NC(C)=CC=C2C(O)=CC=1C1=CC=CO1 INGWEZCOABYORO-UHFFFAOYSA-N 0.000 description 1
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 1
- 125000000022 2-aminoethyl group Chemical group [H]C([*])([H])C([H])([H])N([H])[H] 0.000 description 1
- JWUQFQYYMGMPKE-UHFFFAOYSA-N 2-chloro-3-(hydroxymethylidene)cyclohexene-1-carbaldehyde Chemical compound OC=C1CCCC(C=O)=C1Cl JWUQFQYYMGMPKE-UHFFFAOYSA-N 0.000 description 1
- KQIGMPWTAHJUMN-UHFFFAOYSA-N 3-aminopropane-1,2-diol Chemical compound NCC(O)CO KQIGMPWTAHJUMN-UHFFFAOYSA-N 0.000 description 1
- QMYGFTJCQFEDST-UHFFFAOYSA-N 3-methoxybutyl acetate Chemical group COC(C)CCOC(C)=O QMYGFTJCQFEDST-UHFFFAOYSA-N 0.000 description 1
- JLLYLQLDYORLBB-UHFFFAOYSA-N 5-bromo-n-methylthiophene-2-sulfonamide Chemical group CNS(=O)(=O)C1=CC=C(Br)S1 JLLYLQLDYORLBB-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- 0 CC=CC(C)=C(C)[*@@](*)C(*=C)=CC=C1C(CCCC2=Cc3*(*)c4ccccc4[s]3)=C2NCC1 Chemical compound CC=CC(C)=C(C)[*@@](*)C(*=C)=CC=C1C(CCCC2=Cc3*(*)c4ccccc4[s]3)=C2NCC1 0.000 description 1
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- WUGQZFFCHPXWKQ-UHFFFAOYSA-N Propanolamine Chemical compound NCCCO WUGQZFFCHPXWKQ-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- 150000001448 anilines Chemical class 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 210000000941 bile Anatomy 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- MSZJEPVVQWJCIF-UHFFFAOYSA-N butylazanide Chemical group CCCC[NH-] MSZJEPVVQWJCIF-UHFFFAOYSA-N 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 230000001268 conjugating effect Effects 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 229940097362 cyclodextrins Drugs 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 108010002255 deoxyhemoglobin Proteins 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 125000005594 diketone group Chemical group 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 150000002118 epoxides Chemical class 0.000 description 1
- 125000004494 ethyl ester group Chemical class 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 150000002429 hydrazines Chemical class 0.000 description 1
- 125000002349 hydroxyamino group Chemical group [H]ON([H])[*] 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 150000002463 imidates Chemical class 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000004026 insulin derivative Substances 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 239000012948 isocyanate Chemical class 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- MGJXBDMLVWIYOQ-UHFFFAOYSA-N methylazanide Chemical group [NH-]C MGJXBDMLVWIYOQ-UHFFFAOYSA-N 0.000 description 1
- GRVDJDISBSALJP-UHFFFAOYSA-N methyloxidanyl Chemical group [O]C GRVDJDISBSALJP-UHFFFAOYSA-N 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 238000007040 multi-step synthesis reaction Methods 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000012634 optical imaging Methods 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- QLNJFJADRCOGBJ-UHFFFAOYSA-N propionamide Chemical group CCC(N)=O QLNJFJADRCOGBJ-UHFFFAOYSA-N 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000013008 thixotropic agent Substances 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/0019—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules
- A61K49/0021—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules the fluorescent group being a small organic molecule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/0019—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules
- A61K49/0021—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules the fluorescent group being a small organic molecule
- A61K49/0032—Methine dyes, e.g. cyanine dyes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/52—Use of compounds or compositions for colorimetric, spectrophotometric or fluorometric investigation, e.g. use of reagent paper and including single- and multilayer analytical elements
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Urology & Nephrology (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Physics & Mathematics (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- General Physics & Mathematics (AREA)
- Microbiology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Developing Agents For Electrophotography (AREA)
- Indole Compounds (AREA)
- Non-Silver Salt Photosensitive Materials And Non-Silver Salt Photography (AREA)
- Apparatus For Radiation Diagnosis (AREA)
- Silver Salt Photography Or Processing Solution Therefor (AREA)
- Optical Filters (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Liquid Crystal (AREA)
Description
- GEBIET DER ERFINDUNG
- Die Erfindung liegt auf dem Gebiet der tomographischen Darstellung. Insbesondere liegt die Erfindung auf dem Gebiet der optischen Darstellung. Noch genauer stellt die Erfindung Farbstoffe zur Verwendung im Gebiet der optischen Darstellung bereit.
- HINTERGRUND DER ERFINDUNG
- Optische Darstellung mit Farbstoffen ermöglicht eine Visualisierung von biologischen Aktivitäten (Blasdel, G. G., Salama, G., Nature 1986, 321, 579; Grinvald, A., Frostig, E. L., Hildesheim, R., Physiological Reviews 1988, 68, 1285; Kauer, J. S., Nature 1988, 331, 166; Lieke, E. E., Frostig, R. D., Arieli, A., Ts'o, D. Y., Hildesheim, R. und Grinvald, A., Annu. Rev. Physiol. 1989, 51, 543). Farbstoffe, die gegenüber physikochemischen Umgebungen (wie etwa Druck, Zellmembranpotential, Ionenkonzentration, Acidität, Sauerstoftpartialdruck und etc.) sensitiv sind, unterliegen Veränderungen der Absorption oder Emission von Licht. Die resultierenden Veränderungen wirken als optische Sonden, um biologische Aktivitäten in optische Signale umzuwandeln, die zu optischen Darstellungen überführt werden können.
- Cyaninfarbstoffe mit intensiver Absorption und Emission im nahen IR-Bereich (600– 1300 nm) sind insbesondere geeignet, da biologische Gewebe in diesem Bereich optisch transparent sind. Indocyaningrün (ICG)(I), mit Absorptionsmaxima bei etwa 810 nm (dem isosbestischen Punkt von Hämoglobin/Desoxyhämoglobin), wurde beispielsweise verwendet um das Herzminutenvolumen, die Leberfunktion und den Leberblutfluss zu überwachen. Nach intravenöser Injektion wird ICG rasch von Plasmaproteinen gebunden und bleibt während eines Kreislaufs durch Herz und Lungen im Blut. ICG wird danach von Leberparenchymzellen aufgenommen und vollständig in die Galle sezerniert (Osol, A., Pratt, R., The United States Dispensatory, Philadelphia, Toronto: J. B. Lippincott Company, 1973, 615).
- Trotz der viel versprechenden Anwendung von ICG zersetzen sich wässrige Lösungen von Indocyaningrün rasch, wenn sie mit Glühlicht bestrahlt werden. ICG selbst reichert sich auch nicht in irgendeinem bestimmten Gewebe an.
- In Cyanin- und Indocyaninfarbstoffe können Targetinggruppen eingeführt werden, wenn essentielle Linker an einer günstigen Stelle vorhanden sind, welche die optische Aktivität nicht beeinträchtigen. Herkömmlicherweise wurden diese Abstandhalter am Stickstoffatom in der heterozyklischen Gruppe angefügt (Mujumdar, R. B., Ernst, L. A., Mujumdar, S. R., Lewis, C. J., Waggoner, A. S., Bioconjugate Chem. 1993, 4, 105). Um Targetinggruppen wirksam zu markieren, ist ein einziger Abstandhalter zwischen dem Farbstoff und der Targetinggruppe bevorzugt, und umfasst typischerweise eine Mehrschrittsynthese (Mujumdar, R. B., Ernst, L. A., Mujumdar, S. R., Lewis, C. J., Waggoner, A. S., Bioconjugate Chem. 1993, 4, 105).
- Zusätzliche Probleme entstehen auch aus der Photoinstabilität der langen Olefinkette (Matsuoka, M., in Infrared Absorbing Dyes, Plenum, New York, 1990, Kapitel 3). Cyaninfarbstoffe mit kürzeren Olefinketten sind relativ stabil, aber ihre Absorption und Emission fallen nicht in das für eine optische Darstellung erforderliche optische Fenster (600–1300 nm).
- Es besteht ein Bedarf, stabile Farbstoffe zu entwerfen, welche gewünschte photophysikalische Eigenschaften haben, stabil sind, und die Fähigkeit zum Targeting haben. Die vorliegende Erfindung überwindet die früher geäußerten technischen Probleme durch Einbau eines bifunktionellen Abstandhalters, und indem sie dem Polyen-Anteil der Cyanin- und Indocyaninfarbstoffe Steifheit vermittelt.
- ZUSAMMENFASSUNG DER ERFINDUNG
- Diese Erfindung stellt funktionelle Farbstoffe der allgemeinen Formel: bereit, worin R1, R2 und R5 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus Wasserstoff, C1-C10 Alkyl, C1-C10 Alkoxyl, Hydroxyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, Carboxyl, C1-C10 Carboxylalkyl, Halogen, Nitro, C1-C10 Alkoxycarbonyl, Mercapto, C1-C10 Mercaptoalkyl, C1-C10 Alkylthio, Sulfonat und -(CH2)m-N(R6)(R7), worin R6 und R7 unabhängig voneinander Wasserstoff oder C1-C10 Alkyl, C1-C10 Acyl sind, und R6 und R7 5-, 6- oder 7-gliedrige Ringe bilden können, die gegebenenfalls mit -O-, -NR8 oder -S- substituiert sein können; R3 und R4 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, C1-C10 Carboxylalkyl, C1-C10 Alkylsulfonat, Mercaptoalkyl und -(CH2)m-N(R6)(R7); W1 und W2 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus -S-, -O-, -Se-, -Te-, -NR8 und C(R9)(R10); und m etwa 0– 10 ist; R8, R9 und R10 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, C1-C10 Alkoxy, C1-C10 Mercaptoalkyl, Hydroxyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, C1-C10 Carboxylalkyl, C1-C10 Alkoxycarbonyl, C1-C10 Alkylthio und -(CH2)m-N(R6)(R7) sind; und A ausgewählt ist aus der Gruppe, bestehend aus -(CH2), -O-, -Soder -NR8. Es werden auch Verfahren einer Verwendung der erfindungsgemäßen Farbstoffe zur Herstellung eines Arzneimittels für diagnostische Anwendung und Sichtbarmachung des Farbstoffs bereitgestellt.
- Cyaninfarbstoffe sind symmetrische Moleküle mit zwei heterozyklischen Basegruppen, die über eine konjugierte Kohlenstoffkette miteinander verbunden sind. Diese Farbstoffe absorbieren intensiv vom sichtbaren bis zum nahen Infrarot-Bereich (NIR, near-infrared), in starker Abhängigkeit von der Länge der Kohlenstoffkette. Bei wachsender Anzahl an C=C-Einheiten wird oft eine bathochrome Verschiebung festgestellt (Matsuoka, M., in Infrared Absorbing Dyes, Plenum, New York, 1990, Kapitel 2 & 3). Andere strukturelle Variationen, die eine bathochrome Verschiebung verursachen, können ebenfalls in diese Farbstoffe eingeführt werden. Typischerweise können Elektronen-spendende oder Elektronenabziehende funktionelle Gruppen wie etwa Alkyl, Alkoxyl, Alkylthio, Halogen, Cyan, Alkoxycarbonyl und Nitro an den entsprechenden Elektronen-reichen oder Elektronen-defizienten Zentren am Polyenabschnitt des Moleküls substutuiert sein.
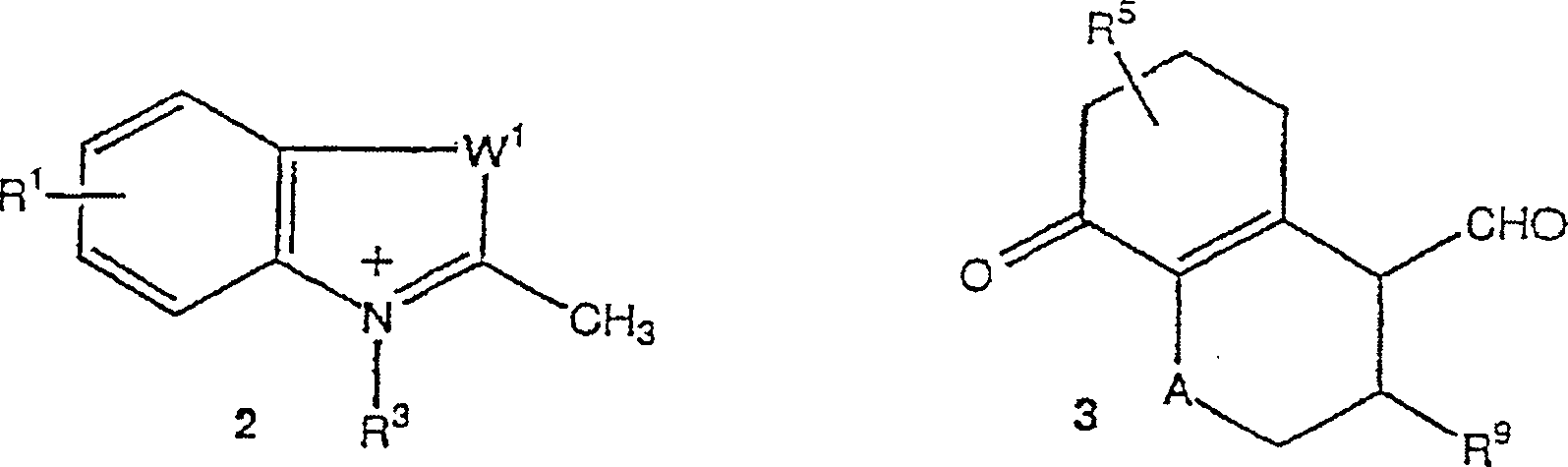
- Die Cyaninfarbstoffe werden im Allgemeinen mittels Kondensationsreaktion zwischen quaternären Salzen einer heterozyklischen Base und dem Ketoaldehyd hergestellt (Keyes, G. H., US Patent Nr. 2,251,286, 1941; Heseltine, D. W., Brooker, L. G. S., US Patent Nr. 2,895,955, 1959; Reynolds, G. A., Drexhage, K. H., J. Org. Chem. 1977, 42, 885). Die bizyklischen Cyaninfarbstoffe der vorliegenden Erfindung können durch die Kondensation von Thiazolium (2) mit dem Diketon (3) hergestellt werden. Asymmetrische Farbstoffe mit Verbindungsgruppen können in ähnlicher Weise mit zusätzlichen Syntheseschritten hergestellt werden (Mujumdar, R. B., Ernst, L. A., Mujumdar, S. R., Lewis, C. J., Waggoner, A. S., Bioconjugate Chem. 1993, 4, 105).
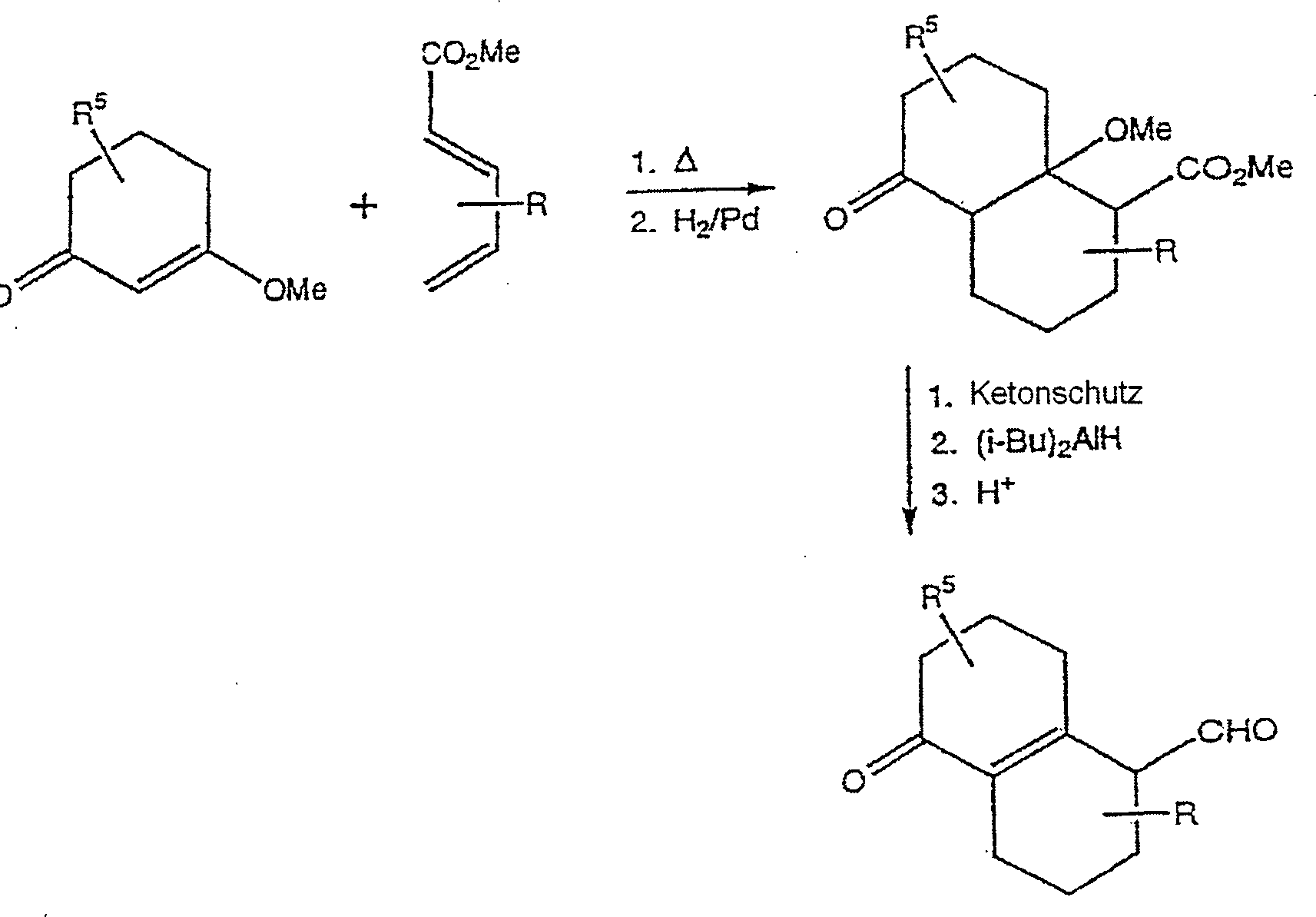
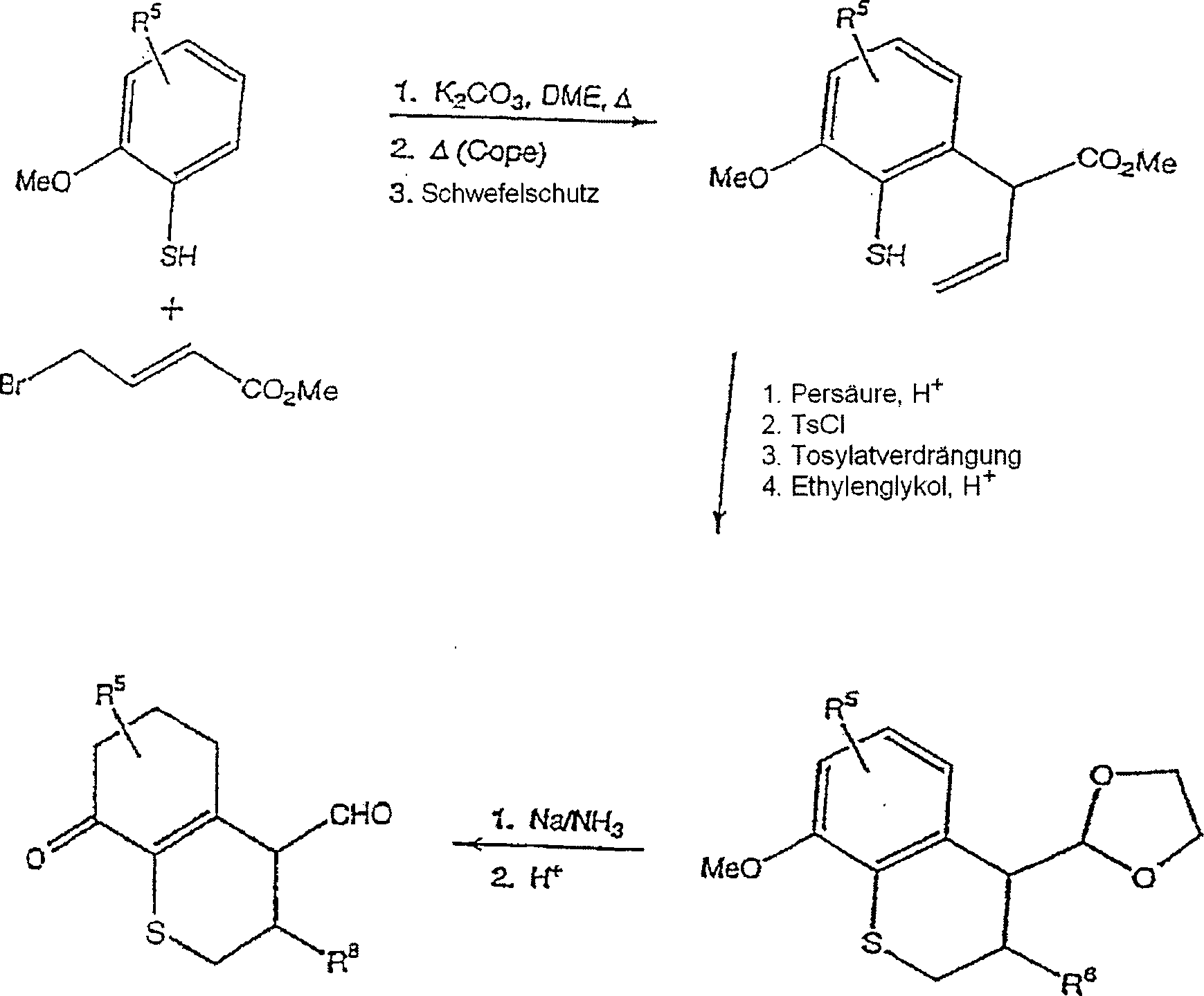
- Die bizyklischen Schlüsselintermediate, wie etwa 4, 5 und 6 können durch die gut bekannten Vorgehensweisen, die in den Schemata 1–3 beispielhaft ausgeführt sind, hergestellt werden.
- Vor kurzem haben Narayanan und Patonay die Synthese von neuen Cyaninfarbstoffen unter Verwendung von 2-Chlor-1-formyl-3-(hydroxymethylen)cyclohex-1-en als einem Templat gezeigt (Narayanan, N, Patonay, G., J. Org. Chem. 1995, 60, 2391). Verschiedene symmetrische Farbstoffe wurden in hohen Ausbeuten hergestellt. Wie Croconiumfarbstoffe enthält der zentrale Abschnitt dieser Farbstoffe einen zyklischen Ring mit einer C=C-Bindung und einem Chloratom. Ihre Ergebnisse zeigen, dass das Einführen einer Crocongruppe in die konjugierende Brücke die Absorption hin zu höheren Wellenlängen signifikant verschiebt.
- Die vorliegende Erfindung beschreibt die Verwendung einer Ring-Templat-Strategie, um stabile Cyaninfarbstoffe mit gewünschten photophysikalischen und Targeting-Eigenschaften zu synthetisieren. Eine einfache Kondensation zwischen einem quaternären Salz einer heterozyklischen Base und den zyklischen 1,5-Dicarbonylverbindungen ergibt erwünschte Farbstoffprodukte, die von der Konformation her steif sind. Das ausgedehnte konjugierte n-System über den bzw. die zentral angeordneten Ringe ergibt intensiv gefärbte Materialien. Mit geeigneten Kopplungsgruppen wie etwa Säurehalogeniden, Aktivestern, Alkoholen, Aldehyden, Aminen, Arylhalogeniden, Carbonsäuren, n-Carboxyanhydriden, Disulfiden, Hydraziden, Jodacetamiden, Isothiocyanaten, Imadaten, Maleimiden, Sulfonylchloriden und so weiter, kann die Farbstoffgruppe biologische Materialien wirksam markieren. Das Ringystem kann mindestens eine C=C-Bindung aufweisen. Das Ringsystem kann auch Elemente der Gruppe IV, V oder VI enthalten, um die Absorptionsmaxima weiter zu längeren Wellenlängen hin zu verschieben. Das Ringsystem kann auch eine fusionierte Ringstruktur mit fünf-, sechs- oder siebengliedrigen Ringen sein. Die Ringstruktur kann auch mit Säurehalogeniden, Aktivestern, Alkoholen, Aldehyden, Aminen, Arylhalogeniden, Carbonsäuren, n-Carboxyanhydriden, Disulfiden, Hydraziden, Jodacetamiden, Isothiocyanaten, Imadaten, Maleimiden, Nitrenen, Sulfonylchlorid und so weiter, die für eine Konjugation mit Targetinggruppen (Biomolekülen) essentiell sind, substituiert sein.
- Biomoleküle zur Verwendung mit den Farbstoffen bezeichnen alle natürlichen und synthetischen Moleküle, die in biologischen Systemen eine Rolle spielen. Biomoleküle umfassen Hormone, Aminosäuren, Peptide, Peptidmimetika, Glykomimetika, Vitamine, Kohlehydrate, Proteine, Desoxyribonukleinsäure (DNA), Ribonukleinsäure (RNA), Lipide, Albumine, polyklonale Antikörper, Rezeptormoleküle, Rezeptor-bindende Moleküle, monoklonale Antikörper und Aptamere. Spezifische Beispiele von Biomolekülen umfassen Insuline, Prostaglandine, Wachstumsfaktoren, Liposomen und Nukleinsäuresonden. Beispiele von synthetischen Polymeren umfassen Polylysin, Aborole, Dendrimere und Cyclodextrine. Die Vorteile einer Verwendung von Biomolekülen umfassen ein verbessertes Gewebetargeting durch Spezifität und zielgerichteten Transport. Eine Kopplung der Farbstoff an Biomoleküle kann durch mehrere bekannte Methoden bewirkt werden (z. B. Krejcarek and Tucker, Biochem. Biophys. Res. Comm. 30, 581 (1977); Hnatowich et al., Science 220, 613(1983)). Typischerweise wird eine nukleophile Gruppe mit einer elektrophilen Gruppe umgesetzt, wobei eine kovalente Bindung zwischen dem Biomolekül und dem Farbstoff gebildet wird. Beispiele von nukleophilen Gruppen umfassen Amine, Aniline, Alkohole, Phenole, Thiole und Hydrazine. Beispiele für elektrophile Gruppen umfassen Halogene, Disulfide, Epoxide, Maleimide, Säurechloride, Anhydride, gemischte Anhydride, aktivierte Ester, Imidate, Isocyanate und Isothiocyanate.
- Beispiele von geeigneten Alkylgruppen zur Verwendung mit der Erfindung umfassen Methyl, Ethyl, Propyl, Isopropyl, Butyl, Cyclohexyl, Heptyl und Octyl. Geeignete Alkoxygruppen umfassen Methoxyl, Ethoxyl, Propoxyl, Butoxyl, Pentoxyl, Hexoxyl, Heptoxyl und Octoxyl. Zur Verwendung mit der Erfindung geeignete Hydroxyalkylgruppen umfassen sowohl Mono- als auch Polyhydroxyalkyle wie etwa Hydroxyethyl, 2-Hydroxypropyl, 2,3-Dihydroxypropyl, 2,3,4-Trihydroxybutyl, Tris(hydroxymethyl)methyl und 2-Hydroxy-1-hydroxymethyl-ethyl. Geeignete Alkoxyalkylgruppen umfassen Methoxymethyl, 2,3-Dimethoxypropyl, Tris(methoxymethyl)methyl und 2-Methoxy-1-methoxymethyl-ethyl. Zur Verwendung mit der Erfindung geeignete Amingruppen umfassen Aminoalkyl wie etwa Aminomethyl, Aminoethyl, Aminopropyl, Hydroxyamino wie etwa 1-Amino-2,3-propandiol, 1-Amino-2-ethanol und 1-Amino-3-propanol, und Aminosäuren wie etwa Alanin, Asparaginsäure, Glycin und Lysin. Carboxyalkyle umfassen Acetat, Hexanoat, Propionat und Butyrat. Kohlehydrate, Monosaccharide und Polysaccharide, wie etwa Glucose, Maltose, Lactose und Amylose. Arylgruppen umfassen Phenyl und Naphthyl, Alkoxycarbonyl umfasst Methylester, Ethylester, Propylester und Butylethylester. Halogengruppen umfassen Chlor, Fluor, Brom und Jod. Alkylamidogruppen umfassen Gruppen wie etwa Methylamid, Ethylamid, Propylamid und Butylamid. Alkylthiogruppen umfassen Methylthio, Ethylthio, Propylthio und Butylthio. Aminoalkyle umfassen NR6R7, wobei R6 und R7 Wasserstoff oder C1-C10 Alkyl sein können, und wobei R6 und R7 5-, 6- oder 7-gliedrige Ringe bilden können, die weiter durch ein Heteroatom wie etwa O, -NR8 oder S substituiert sein können, wobei R8 Wasserstoff, Alkyl, Alkoxyl, Hydroxyl, Hydroxyalkyl, Aminoalkyl, Alkoxyalkyl, Alkylamido, Aryl, Carboxyl, Carboxyalkyl, Halogen, Nitro, Alkoxycarbonyl, Mercapto, Alkylthio und Alkylsulfonat ist.
- Die erfindungsgemäßen Zusammensetzungen können zu diagnostischen Zusammensetzungen für enterale oder parenterale Verabreichung formuliert werden. Diese Zusammensetzungen enthalten eine wirksame Menge des Farbstoffs zusammen mit herkömmlichen pharmazeutischen Trägern und Arzneimittelträgern, welche für den vorgesehen Verabreichungstyp geeignet sind. Beispielsweise enthalten parenterale Formulierungen vorteilhaft eine sterile wässrige Lösung oder Suspension des erfindungsgemäßen Farbstoffs. Parenterale Zusammensetzungen können direkt injiziert werden oder mit einem großen Volumen einer parenteralen Zusammensetzung für systemische Verabreichung gemischt werden. Derartige Lösungen können auch pharmazeutisch akzeptable Puffer und gegebenenfalls Elektrolyte wie etwa Natriumchlorid enthalten.
- Formulierungen für enterale Verabreichung können, wie in der Technik bekannt ist, stark variieren. Im Allgemeinen sind derartige Formulierungen Flüssigkeiten, die eine wirksame Menge des Farbstoffs in wässriger Lösung oder Suspension umfassen. Derartige enterale Zusammensetzungen können gegebenenfalls Puffer, oberflächenaktive Mittel, thixotrope Mittel und dergleichen umfassen. Zusammensetzungen zur oralen Verabreichung können auch Geschmacksstoffe und andere Inhaltsstoffe zur Verbesserung der organoleptischen Qualitäten enthalten.
- Die diagnostischen Zusammensetzungen werden in Dosen verabreicht, welche wirksam sind um die gewünschte Verstärkung zu erreichen. Derartige Dosen können über einen breiten Bereich variieren, in Abhängigkeit von dem besonderen verwendeten Farbstoff, den Organen oder Geweben, die dem Darstellungsverfahren unterzogen werden sollen, dem Darstellungsverfahren, der verwendeten Darstellungsvorrichtung und dergleichen.
- Die erfindungsgemäßen diagnostischen Zusammensetzungen werden auf herkömmliche Weise verwendet. Die Zusammensetzungen können einem Patienten, typischerweise einem warmblütigen Lebewesen, entweder systemisch oder dem darzustellenden Organ oder Gewebe lokal verabreicht werden, und der Patient kann danach dem Darstellungsverfahren unterzogen werden.
- Die nachfolgenden Beispiele veranschaulichen die spezifischen Ausführungsformen der in diesem Dokument beschriebenen Erfindung. Wie für den Fachmann ersichtlich sein würde, sind verschiedene Veränderungen und Modifikationen möglich und werden als im Schutzumfang der beschriebenen Erfindung umfasst erachtet.
- BEISPIELE
- Beispiel 1
- Synthese eines bizyklischen Cyaninfarbstoffs, worin A eine -CH2- Gruppe ist und R5 und R9 Wasserstoffe sind.
- Zu einem Gemisch von Verbindung 4 (2,2 g, 10 mMol) und 2 ml Triethylamin in 10 ml Acetonitril wird 1,2-Dimethylbenzothiazoliumjodid (3,0 g, 10,3 mMol) zugegeben. Das Reaktionsgemisch wird langsam auf Rückfluss während 16 Stunden erwärmt. Das Endprodukt wird mittels Umkristallisation oder Chromatographie gereinigt.
- Beispiel II
- Synthese eines bizyklischen Cyaninfarbstoffs, worin A gleich -O- ist, und R5 und R9 Wasserstoffe sind.
- Zu einem Gemisch von Verbindung 5 (2,2 g, 10 mMol) und 2 ml Triethylamin in 10 ml Acetonitril wird 1,2-Dimethylbenzothiazoliumjodid (3,0 g, 10,3 mMol) zugegeben. Das Reaktionsgemisch wird langsam auf Rückfluss während 16 Stunden erwärmt. Das Endprodukt wird mittels Umkristallisation oder Chromatographie gereinigt.
- Beispiel III
- Synthese eines Cyaninfarbstoffs, worin A gleich -N ist, R5 gleich -H ist und R8 eine – (CH2)CO2CH3 Gruppe ist.
- Zu einem Gemisch von Verbindung 6 (2,4 g, 10 mMol) und 2 ml Triethylamin in 10 ml Acetonitril wird 1,2-Dimethylbenzothiazoliumjodid (2,9 g, 10,3 mMol) zugegeben. Das Reaktionsgemisch wird langsam auf Rückfluss während 16 Stunden erwärmt. Das Endprodukt wird mittels Umkristallisation oder Chromatographie gereinigt.
- Obwohl die Erfindung in Bezug auf spezifische Modifikationen beschrieben worden ist, sind deren Details nicht als Einschränkungen auszulegen, da offensichtlich sein wird, dass verschiedene Äquivalente, Veränderungen und Modifikationen vorgenommen werden können ohne vom Grundgedanken und dem Schutzumfang davon abzuweichen, und es wird verstanden, dass derartige äquivalente Ausführungsformen darin umfasst sein sollen.
Claims (10)
- Diagnostische Zusammensetzung, umfassend eine Verbindung der Formel: worin R1, R2 und R5 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus Wasserstoff, C1-C10 Alkyl, C1-C10 Alkoxyl, Hydroxyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, Carboxyl, C1-C10 Carboxylalkyl, Halogen, Nitro, C1-C10 Alkoxycarbonyl, Mercapto, C1-C10 Mercaptoalkyl, C1-C10 Alkylthio, Sulfonat und -(CH2)m-N(R6)(R7), worin R6 und R7 unabhängig voneinander Wasserstoff oder C1-C10 Alkyl, C1-C10 Acyl sind, und R6 und R7 5-, 6- oder 7-gliedrige Ringe bilden können, die gegebenenfalls mit – O-, -NR8 oder -S- substituiert sein können; R3 und R4 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, C1-C10 Carboxylalkyl, C1-C10 Alkylsulfonat, Mercaptoalkyl und -(CH2)m-N(R6)(R7); W1 und W2 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus -S-, -O-, -Se-, -Te-, -NR8 und C(R9)(R10); und m etwa 0–10 ist; R8, R9 und R10 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, C1-C10 Alkoxy, C1-C10 Mercaptoalkyl, Hydroxyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, C1-C10 Carboxylalkyl, C1-C10 Alkoxycarbonyl, C1-C10 Alkylthio und -(CH2)m- N(R6)(R7) sind; und A ausgewählt ist aus der Gruppe, bestehend aus -(CH2)m, – O-, -S- oder -NR8, worin n gleich 0, 1 oder 2 ist.
- Zusammensetzung nach Anspruch 1, worin R1, R2 und R5 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, Hydroxyl, C1-C10 Alkoxyl, Carboxyl, Halogen, Nitro, Sulfonat oder -(CH2)m-N(R6)(R7) sind; worin m etwa 0–10 ist; R3 und R4 unabhängig voneinander C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Carboxyalkyl oder -(CH2)m-N(R6)(R7) sind; R6 und R7 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, C1-C10 Acyl und Hydroxyalkyl sind; W1 und W2 unabhängig voneinander -S- oder -C(R9)(R10) sind; worin R9 und R10 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Carboxyalkyl oder-(CH2)m-N(R6)(R7) sind; m etwa 1–10 ist; R8 Wasserstoff, C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Carboxyalkyl oder -(CH2)m-N(R6)(R7) ist; und A gleich -(CH2)m, -O-, -S- oder -NR8 sein kann, worin n gleich 0, 1 oder 2 ist.
- Zusammensetzung nach Anspruch 1, worin R1 Wasserstoff ist, R2 Wasserstoff ist, R3 Methyl ist, R4 Methyl ist, R5 Methoxycarbonyl ist, W1 gleich -S- ist, W2 gleich -S- ist, und A gleich -CH2 ist.
- Zusammensetzung nach Anspruch 1, worin R1 Wasserstoff ist, R2 Wasserstoff ist, R3 Methyl ist, R4 Methyl ist, R5 Methoxycarbonyl ist, W1 gleich -S- ist, W2 gleich -S- ist, und A gleich -O- ist.
- Zusammensetzung nach Anspruch 1, worin R1 Wasserstoff ist, R2 Wasserstoff ist, R3 Methyl ist, R4 Methyl ist, W1 gleich -S- ist, W2 gleich -S- ist, und A gleich – NR8 ist, worin R8 Carboxymethyl ist.
- Verwendung einer Verbindung der Formel: worin R1, R2 und R5 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus Wasserstoff, C1-C10 Alkyl, C1-C10 Alkoxyl, Hydroxyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, Carboxyl, C1-C10 Carboxylalkyl, Halogen, Nitro, C1-C10 Alkoxycarbonyl, Mercapto, C1-C10 Mercaptoalkyl, C1-C10 Alkylthio, Sulfonat und -(CH2)m-N(R6)(R7), worin R6 und R7 unabhängig voneinander Wasserstoff oder C1-C10 Alkyl, C1-C10 Acyl sind, und R6 und R7 5-, 6- oder 7-gliedrige Ringe bilden können, die gegebenenfalls mit – O-, -NR8 oder -S- substituiert sein können; R3 und R4 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, C1-C10 Carboxylalkyl, C1-C10 Alkylsulfonat, Mercaptoalkyl und -(CH2)m-N(R6)(R7); W1 und W2 gleich oder verschieden sein können und ausgewählt sind aus der Gruppe, bestehend aus -S-, -O-, -Se-, -Te-, -NR8 und C(R9)(R10); und m etwa 0–10 ist; R8, R9 und R10 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, C1-C10 Alkoxy, C1-C10 Mercaptoalkyl, Hydroxyl, C1-C10 Hydroxyalkyl, C1-C10 Alkoxyalkyl, C1-C10 Aryl, C1-C10 Carboxylalkyl, C1-C10 Alkoxycarbonyl, C1-C10 Alkylthio und -(CH2)m N(R6)(R7) sind; und A ausgewählt ist aus der Gruppe, bestehend aus -(CH2)m, – O-, -S- oder -NR8, worin n gleich 0, 1 oder 2 ist, zur Herstellung eines Arzneimittels zur diagnostischen Anwendung.
- Verwendung nach Anspruch 6, worin R1, R2 und R5 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, Hydroxyl, C1-C10 Alkoxyl, Carboxyl, Halogen, Nitro, Sulfonat oder -(CH2)m-N(R6)(R7) sind; worin m etwa 0–10 ist; R3 und R4 unabhängig voneinander C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Carboxyalkyl oder -(CH2)m-N(R6)(R7) sind; R6 und R7 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, C1-C10 Acyl und Hydroxyalkyl sind; W1 und W2 unabhängig voneinander -S- oder -C(R9)(R10) sind; worin R9 und R10 unabhängig voneinander Wasserstoff, C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Carboxyalkyl oder -(CH2)m-N(R6)(R7) sind; m etwa 1–10 ist; R8 Wasserstoff, C1-C10 Alkyl, C1-C10 Hydroxyalkyl, C1-C10 Carboxyalkyl oder -(CH2)m-N(R6)(R7) ist; und A gleich – (CH2)n, -O-, -S- oder -NR8 sein kann, worin n gleich 0, 1 oder 2 ist.
- Verwendung nach Anspruch 6, worin R1 Wasserstoff ist, R2 Wasserstoft ist, R3 Methyl ist, R4 Methyl ist, R5 Methoxycarbonyl ist, W1 gleich -S- ist, W2 gleich -Sist, und A gleich -CH2- ist.
- Verwendung nach Anspruch 6, worin R1 Wasserstoff ist, R2 Wasserstoff ist, R3 Methyl ist, R4 Methyl ist, R5 Methoxycarbonyl ist, W1 gleich -S- ist, W2 gleich -Sist, und A gleich -O- ist.
- Verwendung nach Anspruch 6, worin R1 Wasserstoff ist, R2 Wasserstoff ist, R3 Methyl ist, R4 Methyl ist, W1 gleich -S- ist, W2 gleich -S- ist, und A gleich -NR8 ist, worin R8 Carboxymethyl ist.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US649850 | 1996-05-13 | ||
| US08/649,850 US5672333A (en) | 1996-05-13 | 1996-05-13 | Delta1,6 bicyclo 4,4,0! functional dyes for contrast enhancement in optical imaging |
| PCT/US1997/007864 WO1997042977A1 (en) | 1996-05-13 | 1997-05-09 | Δ1,6 bicyclo [4,4,0] functional dyes for contrast enhancement in optical imaging |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69725007D1 DE69725007D1 (de) | 2003-10-23 |
| DE69725007T2 true DE69725007T2 (de) | 2004-07-08 |
Family
ID=24606485
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69725007T Expired - Lifetime DE69725007T2 (de) | 1996-05-13 | 1997-05-09 | Delta 1,6 bicyclo (4,4,0) basierte farbstoffe zur kontrastverstaerkung in der optischen bilderzeugung |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US5672333A (de) |
| EP (1) | EP0959906B1 (de) |
| JP (1) | JP2000510147A (de) |
| AT (1) | ATE249843T1 (de) |
| CA (1) | CA2254900A1 (de) |
| DE (1) | DE69725007T2 (de) |
| DK (1) | DK0959906T3 (de) |
| ES (1) | ES2202619T3 (de) |
| PT (1) | PT959906E (de) |
| WO (1) | WO1997042977A1 (de) |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030180221A1 (en) * | 1998-09-18 | 2003-09-25 | Schering Ag | Near infrared fluorescent contrast agent and fluorescence imaging |
| JP2000095758A (ja) | 1998-09-18 | 2000-04-04 | Schering Ag | 近赤外蛍光造影剤および蛍光造影方法 |
| US7547721B1 (en) | 1998-09-18 | 2009-06-16 | Bayer Schering Pharma Ag | Near infrared fluorescent contrast agent and fluorescence imaging |
| US6167297A (en) * | 1999-05-05 | 2000-12-26 | Benaron; David A. | Detecting, localizing, and targeting internal sites in vivo using optical contrast agents |
| US7790144B2 (en) * | 2000-01-18 | 2010-09-07 | Mallinckrodt Inc. | Receptor-avid exogenous optical contrast and therapeutic agents |
| US6180087B1 (en) | 2000-01-18 | 2001-01-30 | Mallinckrodt Inc. | Tunable indocyanine dyes for biomedical applications |
| US6939532B2 (en) * | 2000-01-18 | 2005-09-06 | Mallinckrodt, Inc. | Versatile hydrophilic dyes |
| US7198778B2 (en) * | 2000-01-18 | 2007-04-03 | Mallinckrodt Inc. | Tumor-targeted optical contrast agents |
| US6395257B1 (en) * | 2000-01-18 | 2002-05-28 | Mallinckrodt Inc. | Dendrimer precursor dyes for imaging |
| US20080233050A1 (en) * | 2000-01-18 | 2008-09-25 | Mallinckrodt Inc. | Diagnostic and therapeutic optical agents |
| US6180086B1 (en) | 2000-01-18 | 2001-01-30 | Mallinckrodt Inc. | Hydrophilic cyanine dyes |
| US6748259B1 (en) * | 2000-06-15 | 2004-06-08 | Spectros Corporation | Optical imaging of induced signals in vivo under ambient light conditions |
| US20040180809A1 (en) * | 2000-10-16 | 2004-09-16 | Mallinckrodt Inc. | Tissue-specific exogenous optical agents |
| US20070092450A1 (en) * | 2000-10-16 | 2007-04-26 | Mallinckrodt Inc. | Tissue-specific exogenous optical agents |
| US20040143190A1 (en) * | 2003-01-22 | 2004-07-22 | Schnitzer Mark J. | Mapping neural and muscular electrical activity |
| US20100022449A1 (en) * | 2006-03-09 | 2010-01-28 | Mallinckrodt Inc. | Receptor-avid exogenous optical contrast and therapeutic agents |
| RU2312063C1 (ru) * | 2006-04-12 | 2007-12-10 | Общество с ограниченной ответственностью "Томскнефтехим" (ООО "Томскнефтехим") | Синтетический пористый кристаллический материал и способ его получения |
| RU2313486C1 (ru) * | 2006-04-12 | 2007-12-27 | Общество с ограниченной ответственностью "Томскнефтехим" (ООО "Томскнефтехим") | Синтетический цеолит и способ его получения |
| RU2313487C1 (ru) * | 2006-04-24 | 2007-12-27 | Общество с ограниченной ответственностью "Томскнефтехим" (ООО "Томскнефтехим") | Высококремнеземный цеолит и способ его получения |
| RU2313488C1 (ru) * | 2006-04-24 | 2007-12-27 | Общество с ограниченной ответственностью "Томскнефтехим" (ООО "Томскнефтехим") | Синтетический цеолит и способ его получения |
| EP2350205A2 (de) * | 2008-09-29 | 2011-08-03 | Mallinckrodt Inc. | Dithienofuranfarbstoffe für bildgebung und therapie |
| WO2010037067A1 (en) * | 2008-09-29 | 2010-04-01 | Mallinckrodt Inc. | Fused ring thiophene dyes for imaging and therapy |
| CA2738035A1 (en) * | 2008-09-29 | 2010-04-01 | Mallinckrodt Inc. | Dithienopyrrole dyes for imaging and therapy |
| US8628751B2 (en) | 2009-04-16 | 2014-01-14 | Medi Beacon Development, LLC | Pyrazine derivatives for optical imaging and therapy |
| US8731655B2 (en) | 2009-05-12 | 2014-05-20 | Mallinckrodt Llc | Compounds containing acyclic N-N bonds for phototherapy |
| US9186349B2 (en) | 2009-05-12 | 2015-11-17 | Mallinckrodt Llc | Diaza heterocyclic compounds for phototherapy |
| WO2011031955A2 (en) | 2009-09-11 | 2011-03-17 | Mallinckrodt Inc. | Optical monitoring of leukemia |
| WO2011035140A1 (en) | 2009-09-18 | 2011-03-24 | Paka Pulmonary Pharmaceuticals, Inc. | Methods and compositions for delivery of contrast moieties to the lungs |
| WO2011060113A1 (en) | 2009-11-11 | 2011-05-19 | Mallinckrodt Inc. | Sulfenamide compounds for phototherapy |
| WO2011084571A2 (en) | 2009-12-16 | 2011-07-14 | Mallinckrodt Inc. | Azide derivatives for phototherapy |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4762701A (en) * | 1986-10-31 | 1988-08-09 | Smithkline Beckman Corporation | In vivo cellular tracking |
| FR2682498A1 (fr) * | 1991-10-15 | 1993-04-16 | Kodak Pathe | Colorants comprenant des macrocycles thioethers. |
| US5397693A (en) * | 1992-04-09 | 1995-03-14 | Fuji Photo Film Co., Ltd. | Silver halide photographic light-sensitive material |
| DE4301106A1 (de) * | 1993-01-18 | 1994-07-21 | Agfa Gevaert Ag | Farbfotografisches Aufzeichnungsmaterial |
| BR9506899A (pt) * | 1994-02-28 | 1997-09-09 | Imation Corp | Elemento fototermográfico revelável a quente |
-
1996
- 1996-05-13 US US08/649,850 patent/US5672333A/en not_active Expired - Lifetime
-
1997
- 1997-05-09 DE DE69725007T patent/DE69725007T2/de not_active Expired - Lifetime
- 1997-05-09 PT PT97924641T patent/PT959906E/pt unknown
- 1997-05-09 EP EP97924641A patent/EP0959906B1/de not_active Expired - Lifetime
- 1997-05-09 DK DK97924641T patent/DK0959906T3/da active
- 1997-05-09 WO PCT/US1997/007864 patent/WO1997042977A1/en not_active Ceased
- 1997-05-09 ES ES97924641T patent/ES2202619T3/es not_active Expired - Lifetime
- 1997-05-09 JP JP09540962A patent/JP2000510147A/ja not_active Withdrawn
- 1997-05-09 CA CA002254900A patent/CA2254900A1/en not_active Abandoned
- 1997-05-09 AT AT97924641T patent/ATE249843T1/de not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| ATE249843T1 (de) | 2003-10-15 |
| WO1997042977A1 (en) | 1997-11-20 |
| JP2000510147A (ja) | 2000-08-08 |
| EP0959906B1 (de) | 2003-09-17 |
| DE69725007D1 (de) | 2003-10-23 |
| US5672333A (en) | 1997-09-30 |
| ES2202619T3 (es) | 2004-04-01 |
| PT959906E (pt) | 2004-01-30 |
| EP0959906A1 (de) | 1999-12-01 |
| EP0959906A4 (de) | 1999-12-22 |
| DK0959906T3 (da) | 2003-12-08 |
| CA2254900A1 (en) | 1997-11-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69725007T2 (de) | Delta 1,6 bicyclo (4,4,0) basierte farbstoffe zur kontrastverstaerkung in der optischen bilderzeugung | |
| DE69714287T2 (de) | Trizyklische funktional farbstoffe zur verbesserung von kontrast und optische bilderzeugung | |
| EP0796111B1 (de) | Verfahren zur in-vivo-diagnostik mittels nir-strahlung unter verwendung von cyaninfarbstoffen | |
| US8697033B2 (en) | Modified pyrazine derivatives and uses thereof | |
| DE202014008232U1 (de) | Eine doppelt markierte Sonde für die molekulare Bildgebung und deren Verwendung | |
| WO1998047538A2 (de) | Säurelabile und enzymatisch spaltbare farbstoffkonstrukte zur diagnostik mit nahinfrarotlicht und zur therapie | |
| JP2009534396A (ja) | ピラジン誘導体および腎臓の監視におけるその使用 | |
| JP2008231113A (ja) | 致命的な病気の患者における生理機能測定のための親水性吸光組成物 | |
| DE69723880T2 (de) | Delta 1,2 bicyclo 4,4,0] basierte farbstoffe zur kontrastverstärkung in der optischen bilderzeugung | |
| US5723104A (en) | Monocyclic functional dyes for contrast enhancement in optical imaging | |
| EP1214099A1 (de) | Antikörper-farbstoffkonjugate gegen zielstrukturen der angiogenese zur intraoperativen tumorranddarstellung | |
| CN116731708A (zh) | 一种花青染料和白蛋白的组合物及其制备方法和应用 | |
| Class et al. | Patent application title: Pyrazine Derivatives and Uses Thereof in Renal Monitoring Inventors: Raghavan Rajagopalan (St. Peters, MO, US) Raghavan Rajagopalan (St. Peters, MO, US) Richard B. Dorshow (Saint Charles, MO, US) William L. Neumann (St. Louis, MO, US) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |