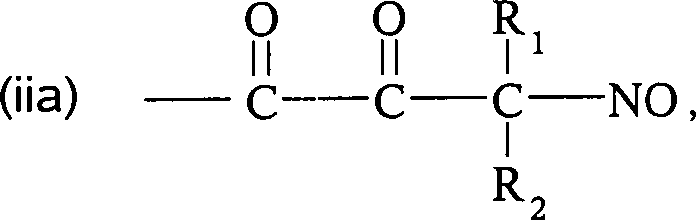-
Die
Erfindung betrifft C-Nitroso-Verbindungen, die bei niedrigen Konzentrationen
als NO-Donoren therapeutisch wirksam sind.
-
NO-Donoren
sind dafür
bekannt, für
eine therapeutische Nutzbarmachung brauchbar zu sein, z. B. zur Verhinderung
von Restenose nach einer Angioplastik (Groves, P., et al., Cardiovascular
Research 26, 615-619 (1992)), zur Hemmung von Blutplättchen,
um Koagulation und Thrombusbildung zu verhindern (Groves, P., et al.,
Circulation 87, 590-597 (1993)) und zur Behandlung von Angina (Knight,
et al., Circulation 95, 125-132 (1997)). Man geht davon aus, dass
NO-Donoren außerdem
bei Krebs, beim Abtöten
von Mikroben und Viren, beim Entspannen der Luftwege und des glatten,
unwillkürlichen
Darmmuskelgewebes (z. B. zur Behandlung von Asthma und Speiseröhrenkrämpfen),
bei der Förderung
der Erektionsfunktion und bei der Behandlung von Herzinsuffizienz
und Harninkontinenz therapeutische Anwendung haben.
-
NO-Donoren
werden in "Methods
in Nitric Oxide Research",
herausgegeben von Feelisch, M., und Stamler, J.S., John Wiley & Sons, New York,
1996, auf den Seiten 71-115 beschrieben. Diese NO-Donoren sind O-Nitroso-
und S-Nitroso-Verbindungen, und C-Nitroso-Verbindungen, die von
der Erfindung hierin ausgeschlossen sind.
-
Zweiundzwanzig
zusätzliche
C-Nitroso-Verbindungen sind in Rehse, K., et a., Arch. Pharm. Pharm. Med.
Chem. 331, 104-110 (1998) beschrieben. Diese Verbindungen sind von
niedrigem Molekulargewicht und sind nicht wasserlöslich und
es wurde gezeigt, dass sie schwach wirksam sind. Andere C-Nitroso-Verbindungen
sind in Rehse, K., et al., Arch. Pharm. Pharm Med. Chem. 331, 79-84 (1998)
beschrieben; diese sind Nitro-nitroso-Verbindungen und die speziellen
erwähnten
Verbindungen sind von der Erfindung hierin ausgeschlossen.
-
Andere
C-Nitroso-Verbindungen, die alt sind, sind 3-Methyl-3-nitroso-2,4-pentandion
und 3-Ethyl-3-nitroso-2,4-pentandion. Diese Verbindungen und ihre
Synthese sind in Sklyar, Yu. E., et al., Khimiya Geterotsiklicheskikh
Soedinenii 5, 70-73 (1969) beschrieben. Diese Verbindungen sind
von niedrigem Molekulargewicht und erfüllen nicht die hierin nachstehend
dargelegte Definition der Wasserlöslichkeit.
-
In
einer ersten Ausführungsform
hierin wurde herausgefunden, dass bestimmte C-Nitroso-Verbindungen
von höherem
Molekulargewicht als sie früher
hergestellt wurden, insbesondere jene, die wasserlöslich sind,
in nanomolaren Konzentrationen als NO-Donoren therapeutisch wirksam
sind, in manchen Fällen,
wenn sie alleine verwendet werden, und in manchen Fällen in
Anwesenheit von Glutathion.
-
Die
C-Nitroso-Verbindungen der ersten Ausführungsform hierin sind so wie
in Anspruch 1 definiert. Sie haben eine an ein tertiäres Kohlenstoffatom
gebundene Nitrosogruppe, wobei das tertiäre Kohlenstoffatom kovalent
an eine cyclische Baueinheit gebunden ist mittels einer Ketten-Baueinheit,
die 1 bis 12 Kettenatome enthält,
die aus 1 bis 10 Kohlenstoffatomen, 0 bis 2 Stickstoffatomen und
0 bis 2 Sauerstoffatomen bestehen, wobei die cyclische Baueinheit
monocyclisch, bicyclisch, tricyclisch, tetracyclisch oder pentacyclisch
ist und 5 bis 24 Ringatome enthält,
die aus 2 bis 20 Kohlenstoffatomen, 0 bis 4 Stickstoffatomen, 0
bis 1 Sauerstoffatomen und 0 bis 1 Schwefelatomen bestehen, wobei
die Ringatome gezählt
werden durch Zählen
der den Ring (die Ringe) bildenden Atome, und Wasserstoff oder andere
Substituenten an dem Ring ausschließen. Ohne ein tertiäres Kohlenstoffatom
gibt es eine im wesentlichen irreversible Tautomerisierung zu dem
entsprechenden Oxim, das im allgemeinen nicht aktiv bzw. wirksam
ist. Es wurde hierin herausgefunden, dass es für eine gute Wirksamkeit wichtig
ist, dass die Nitrosogruppe an einen tertiären Kohlenstoff gebunden ist.
-
Die
C-Nitroso-Verbindungen der ersten Ausführungsform hierin haben ein
Molekulargewicht im Bereich von 225-1000 auf Monomerbasis. Die hohe
Wirksamkeit, die für
Verbindungen dieses Molekulargewichts erhalten wird, wird als überraschend
betrachtet und bedeutet, dass viele Arzneimittel, die jetzt verwendet
werden, zu C-Nitroso-Verbindungen umgewandelt werden können, wobei
sie nicht nur den therapeutischen Effekt des Ausgangsarzneimittels,
sondern auch Vorteile, die von der Nitrosogruppe geschaffen werden,
einschließlich
dem Entspannungseffekt und anderen später beschriebenen Vorteilen,
bereitstellen.
-
Die
C-Nitroso-Verbindungen der ersten Ausführungsform hierin werden durch
Nitrosylierung einer Kohlenstoffsäure mit einem pKa von weniger
als 25 erhalten. Von Kohlenstoffsäuren mit niedrigeren Aciditäten (höheren pKa-Werten)
abgeleitete C-Nitroso-Verbindungen wirken nicht als brauchbare NO-Donoren.
-
Daher
betrifft die Erfindung in ihren breiten Aspekten eine C-Nitroso-Verbindung
mit einem Molekulargewicht im Bereich von 225 bis 1000 auf Monomerbasis,
worin eine Nitrosogruppe an einen tertiären Kohlenstoff gebunden ist,
wobei das tertiäre
Kohlenstoffatom als einen Substituenten Q eine Ketten-Baueinheit
hat, die 1 bis 12 Kettenatome enthält, die aus 1 bis 10 Kohlenstoffatomen,
0 bis 2 Stickstoffatomen und 0 bis 2 Sauerstoffatomen bestehen,
die kovalent an eine zyklische Baueinheit gebunden ist; wobei die
zyklische Baueinheit monocyclisch, bicyclisch, tricyclisch, tetracyclisch
oder pentacyclisch ist und 5 bis 24 Ringatome enthält, die
aus 2 bis 20 Kohlenstoffatomen, 0 bis 4 Stickstoffatomen, 0 bis
1 Sauerstoffatomen und 0 bis 1 Schwefelatomen bestehen, und wobei
die Nitroso-Verbindung durch Nitrosylierung einer Kohlenstoffsäure mit
einem pKa von weniger als 25 erhalten wird.
-
Die
C-Nitroso-Verbindung ist bevorzugt wasserlöslich und enthält bevorzugt
Kohlenstoff in alpha-Stellung zu nitrosyliertem Kohlenstoff, der
Teil einer Ketongruppe ist.
-
In
einer Unterart wird die C-Nitroso-Verbindung durch Nitrosylierung
einer Kohlenstoffsäure
mit einem pKa von weniger als 10 erhalten. Verbindungen dieser Unterart
haben, wenn sie alleine verwendet werden eine NO-spendende und Entspannung
schaffende Wirkung, wenn sie in mikromolaren Konzentrationen verwendet werden.
Es wurde hierin jedoch herausgefunden, dass diese Wirkung durch
Gluthation potenziert wird, so dass Verbindungen dieser Unterart,
wenn sie mit oder zur Reaktion mit Gluthation verabreicht werden,
therapeutisch wirksam sind (um NO-spendende und entspannende Effekte
zu schaffen), wenn sie in nanomolaren Konzentrationen verwendet
werden. Daher betrifft eine Ausführungsform
hierin die Verwendung einer derartigen C-Nitroso-Verbindung in nanomolaren
(z. B. von 0,1 bis 900 nanomolar) Konzentrationen bei der Herstellung eines
Arzneimittels zur Verwendung zusammen mit Gluthation, um einen NO-spendenden
und entspannenden Effekt bereitzustellen.
-
In
einer anderen Unterart wird die C-Nitroso-Verbindung durch Nitrosylierung
einer Kohlenstoffsäure mit
einem pKa im Bereich von 15 bis 20 erhalten. In diesem Fall wurde
gefunden, dass die Verbindung therapeutisch wirksam ist und eine
nitrosylierende Wirksamkeit und einen entspannenden Effekt bereitstellt,
wenn sie ohne Potenzierung in nanomolaren Konzentrationen verwendet
wird, und dass Gluthation die Wirksamkeit der Verbindung hemmt.
-
Es
wurde hierin herausgefunden, dass C-Nitroso-Verbindungen der Erfindung
hierin erhalten werden können
durch Nitrosylierung des tertiären
Kohlenstoffatoms eines konventionellen Arzneimittels, wenn das Arzneimittel
eine Kohlenstoffsäure
mit einem pKa von weniger als 25 darstellt oder in eine Kohlenstoffsäure mit
einem pKa von weniger als 25 umgewandelt werden kann, und eine C-Nitroso-Verbindung
ergibt, die die vorher beschriebenen Molekulargewichts-Beschränkungen
erfüllt.
Die sich ergebenden C-Nitroso-Verbindungen behalten die Wirksamkeit
des Arzneimittels und ergeben zusätzlich den mit NO verbundenen
Effekt und können
andere vorteilhafte Effekte ergeben, wie unten beschrieben. Zu den
konventionellen Arzneimitteln gehören beispielsweise nichtsteroidale
antiinflammatorisch wirkende Arzneimittel, COX-2-Inhibitoren, analgetische
Arzneimittel, Arzneimittel gegen Angina, blutdrucksenkende Arzneimittel,
diuretische Arzneimittel, ACE-Inhibitoren, Arzneimittel gegen Hypercholesterinämie/Hyperlipoproteinämie, Calciumkanal-Blocker,
säureneutralisierende
Arzneimittel, Bronchodilatatoren, NMDA-antagonistische/skelettmuskelentspannende
Arzneimittel, Arzneimittel gegen Proliferation/tubulinbindende Arz neimittel,
Mittel gegen Tuberkeln, CETP-Inhibitoren, SOD-Mimetika und Xanthinoxidase-Inhibitoren.
-
Es
wurde hierin herausgefunden, dass, wenn das konventionelle Arzneimittel
ein nicht-steroidales antiinflammatorisch wirkendes Arzneimittel
ist, das ein COX-1- und ein COX-2-Inhibitor ist, die sich ergebende C-Nitroso-Verbindung
als ein COX-1- und COX-2-Inhibitor wirkt, ohne die schädlichen
Effekte, die mit COX-1-Hemmung verbunden sind, aber mit den Vorteilen,
die mit COX-1- und COX-2-Hemmung verbunden sind. Insbesondere vermittelt
COX-1 die Produktion von Thromboxan, das die Plättchenaggregation vermittelt, wodurch
es einen schädlichen
Effekt schafft; die Hemmung von COX-1 kehrt diesen Effekt um. Diese
Umkehrung wird verstärkt
durch die nicht-steroidalen antiinflammatorisch wirkenden C-Nitroso-Arzneimittel
hierin. Andererseits hemmen COX-1-Inhibitoren die Produktion von Prostaglandinen,
die gegen Geschwüre
schützen; das
mit den nicht-steroidalen antiinflammatorisch wirkenden Arzneimitteln
hierin verbundene NO schützt
gegen diese schädliche
Nebenwirkung. Während
der COX-1-hemmende Effekt, der Magenangriffe vermittelt, teilweise
mit einem Mangel an NO in Verbindung steht, gibt es einen nützlichen
NO-Effekt, der COX-1-unabhängig
sein kann, der den schädlichen
Effekt der Hemmung der COX-1-Produktion von Prostaglandinen mehr als
aufhebt. Daher schaffen die nicht-steroidalen antiinflammatorisch
wirkenden C-Nitroso-COX-1/COX-2-Inhibitoren hierin einen Vorteil
gegenüber
selektiven COX-2-Inhibitoren insofern, als sie auch die vorteilhaften mit
der COX-1-Hemmung verbundenen Effekte und andere nützliche
NO-Effekte bereitstellen. Außerdem
stellen selektive C-Nitroso-COX-2-Inhibitoren nicht nur die Vorteile
der COX-2-Hemmung, sondern auch einige der Vorteile, die mit der
COX-1-Hemmung verbunden sind, bereit. Darüber hinaus potenziert das NO
in C-Nitroso-COX-Inhibitoren den lindernden Effekt von COX-Inhibitoren
auf Harninkontinenz.
-
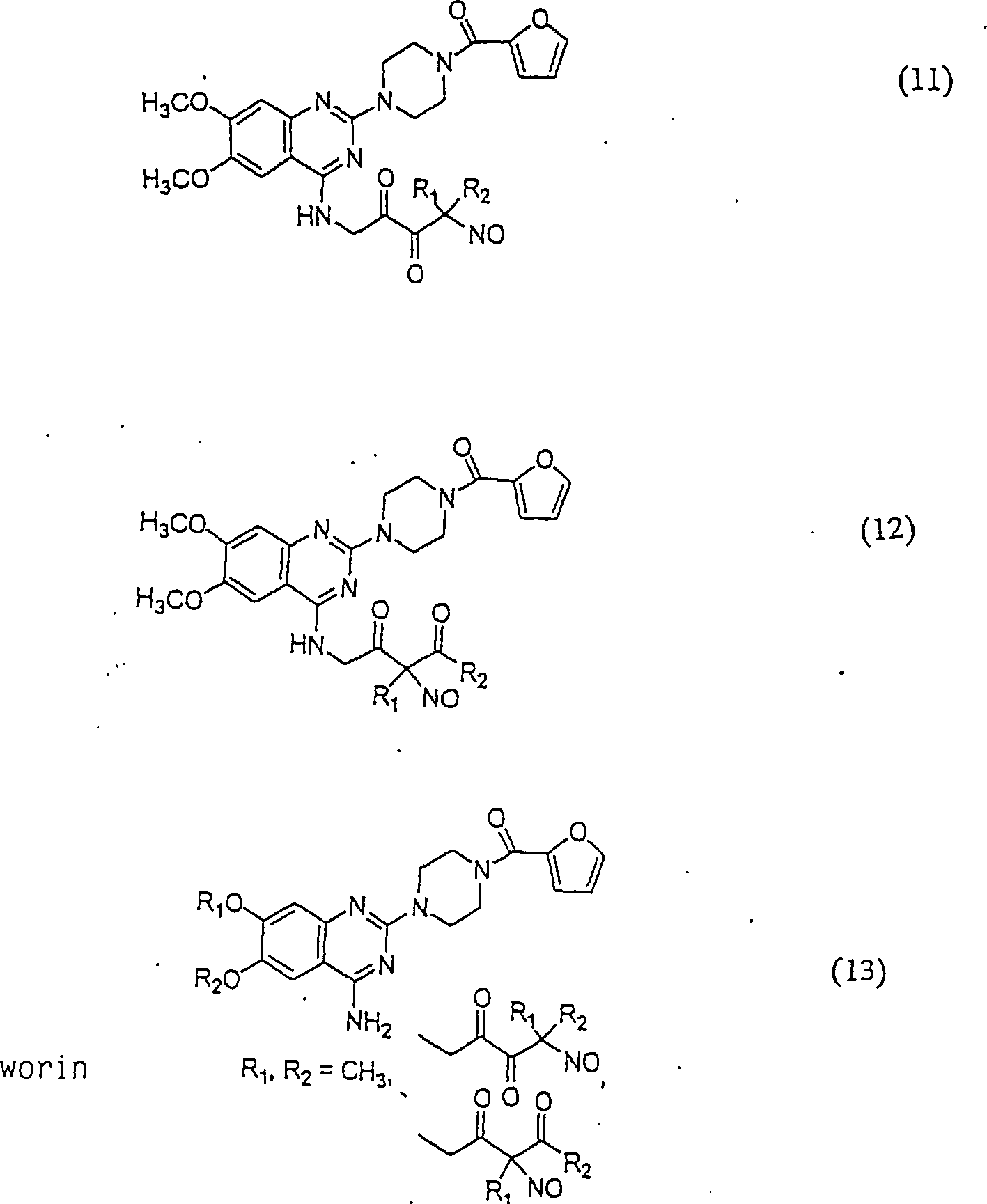
Dimere
2-[4'-(α-Nitrosoisobutyrylphenyl]propionsäure wurde
hierin synthetisiert und wird erhalten durch C-Nitrosylierung von
Ibuprofen, das modifiziert wurde, um einen niedrigeren Kohlenstoffsäure-pKa
zu haben. Sie stellt eine C-Nitroso-Verbindung hierin dar, die erhalten
wird durch Nitrosylierung einer Kohlenstoffsäure mit einem pKa im Bereich
von 15 bis 25 und ist ohne Glutathion therapeutisch wirksam, wenn
sie in nanomolaren Konzentrationen verwendet wird.
-
Daher
betrifft eine Ausführungsform
hierin die Verwendung einer C-Nitroso-Verbindung der gegenwärtigen Erfindung,
die erhalten wir durch Nitrosylierung des tertiären Kohlenstoffs eines konventionellen nicht-steroidalen
antiinflamatorisch wirkenden Arzneimittels, das einen Kohlenstoffsäure-pKa
im Bereich von 15 bis 25, z. B. 15 bis 20, hat oder so modifiziert
ist, dass es diesen Kohlenstoffsäure-pKa
hat, wobei die C-Nitroso-Verbindung bevorzugt dimere 2-[4'-(α-itroso)isobutyrylphenyl]propionsäure oder
eine wässrige
Lösung davon
ist, bei der Herstellung eines Arzneimittels zur Behandlung einer
entzündlichen
oder schmerzhaften Erkrankung.
-
Es
wurde hierin auch herausgefunden, dass der pKa einer Kohlenstoffsäure einer
Verbindung verwendet werden kann, um eine NO-Gruppe anzupeilen,
um eine nitrosylierte Verbindung bereitzustellen. Dies ist nicht
der Fall bei der Herstellung anderer Klassen von NO-Donoren, z.
B. -ONO- und -SNO-NO-Donoren.
-
Shinmura,
K., et al., PNAS 97, 10197-10202 (2000) zeigt, dass COX-2 die herzschützenden
Effekte einer ischämischen
Vorbehandlung, insbesondere der Spätphase der ischämischen
Vorbehandlung (in diesem Fall wird das Herz kurz ischämisch gemacht,
um gegen eine nachfolgende Ischämie,
die viel schwerer ist, zu schützen),
vermittelt. Daher greifen COX-2-Inhibitoren in diesen herzschützenden
Effekt ein. In dem Fall von C-Nitroso-COX-2-Inhibitoren hierin ersetzt
das NO jedoch die COX-2-Vermittlung, die verloren geht, so dass ein
spezieller Nutzen besteht.
-
Andere
Ausführungsformen
hierin betreffen biologisch verträgliche Polymere, in die eine
C-Nitroso-Verbindung der Erfindung eingebaut ist und die eine massegemittelte
Molekülmasse
(bestimmt durch Lichtstreuung) im Bereich von 50.000 bis 500.000
haben, mit diesem Polymer beschichtete medizinische Vorrichtungen,
ein Arzneimittel zur Prophylaxe eines Patienten, bei dem ein Risiko
einer Koagulierung oder ein Thrombusbildung oder einer mikrobiellen
oder virilen Infektion besteht, z. B. eines Patienten mit einer
Restenose oder bei dem das Risiko einer Restenose besteht, aufweisend
das in Berührung
bringen von Gewebe in dem Bereich, bei dem das Risiko besteht, mit
diesem Polymer.
-
Der
Begriff "Kohlenstoffsäure", wie er hierin verwendet
wird, bedeutet eine Verbindung, die eine CH-Gruppe enthält, die
zu C– und
H+ dissoziiert.
-
Der
Begriff "wasserlöslich", wie er hierin verwendet
wird, bedeutet, löst
sich in Wasser mindestens soweit, um eine Konzentration von 1 mikromolar
zu schaffen.
-
Der
Begriff "konventionelle
Arzneimittel", wie
er hierin verwendet wird, bedeutet therapeutisches Mittel ohne NO-Donoreffekt.
-
Der
Begriff "Keton-Gruppe" wie er hierin verwendet
wird, bedeutet Carbonylgruppe.
-
Der
Begriff "Elektronen
ziehender Substituent",
wie er hierin verwendet wird, bedeutet Atom oder Gruppe, wobei das
Verbindungsatom oder die Verbindungsgruppe elektronegativer ist
als Wasserstoff.
-
In den begleitenden Zeichnungen:
-
1 bis 10 sind
Aufzeichnungen der Spannung (Kraft) gegen die Zeit, wobei für bestimmte
Zeiten auch Verbindungskonzentrationen gezeigt sind, und zeigen
Ergebnisse von Beispiel II;
-
1 betrifft
Ergebnisse mit der hierin im folgenden beschriebenen Verbindung
(129a);
-
2 betrifft
Ergebnisse mit C-Nitroso-methylmalonsäure;
-
3 betrifft
Ergebnisse mit C-Nitrosobenzol;
-
4 betrifft
Ergebnisse mit C-Nitrosophenol;
-
5 betrifft
Ergebnisse mit in Beispiel 1 synthetisiertem C-Nitrosoketoibuprofen;
-
6 ist ähnlich 5,
aber mit Hinweisen auf die Anwesenheit von Dimer und mehr Konzentrationsangaben;
-
7 betrifft
Ergebnisse für
die Kombination von C-Nitrosoketoibuprofen und 100 μM Glutathion;
-
8 ist ähnlich 5,
aber mit einer anderen angegebenen Konzentration;
-
9 betrifft
Ergebnisse für
3-Methyl-3-nitroso-2,4-pentandion, einschließlich Potenzierung mit Glutathion
(GSH); und
-
10 betrifft Ergebnisse für 2-Methyl-2-nitrosopropan.
-
Die 2, 3, 4, 9 und 10 betreffen
Ergebnisse mit Referenzverbindungen, wenn auch 9 dazu
dient, den Potenzierungseffekt zu zeigen, der bei einer Ausführungsform
der Erfindung auftritt. Die 1 und 5 bis 8 betreffen
Ergebnisse mit der C-Nitroso-Verbindung von Ausführungsformen der Erfindung.
-
Wir
kommen nun zu der Unterart, bei der die C-Nitroso-Verbindung durch
Nitrosylierung einer Kohlenstoffsäure mit einem pKa von weniger
als 10 erhalten wird. Bei alleiniger Verwendung zeigt diese Verbindung Wirkung
(NO spendende und/oder entspannende Wirkung), wenn sie in mikromolaren
Konzentrationen verwendet wird, und sie nitrosyliert das mäßig nucleophile
Thiol eines Cystein-Rests oder eines Derivats mit niedrigem Molekulargewicht
(z. B. Glutathion). Die natürliche
Wirkung wird vermutlich durch Nitrit vermittelt, das aus der Nitrosylierung
von Wasser stammt. Diese Wirkungsweise zeigt wenig, falls überhaupt,
Spezifizität
und ist sehr schwach. Wie oben angegeben, wurde im Verlauf dieser
Erfindung herausgefunden, dass diese Wirkung durch die Anwesenheit
von Glutathion potenziert wird. Diese Potenzierung ist grob 1000-fach.
-
Wir
kommen nun zu der Unterart, bei der die C-Nitroso-Verbindung durch
Nitrosylierung einer Kohlenstoffsäure mit einem pKa im Bereich
von 15 bis 20 erhalten wird. Diese C-Nitrosothiole nitrosylieren
Glutathion nicht, nitrosylieren aber selektiv hochgradig nucleophile
Thiole, die in Protein-Zielen zu finden sind. Daher können durch
die Verwendung dieser C-Nitroso-Verbindungen hochgradig nucleophile
Thiole angepeilt werden.
-
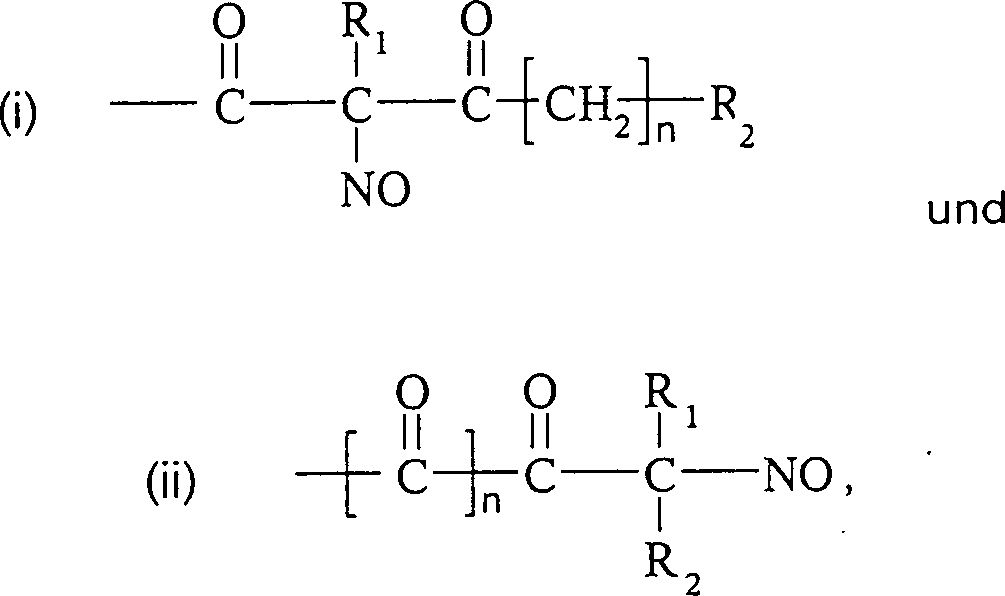
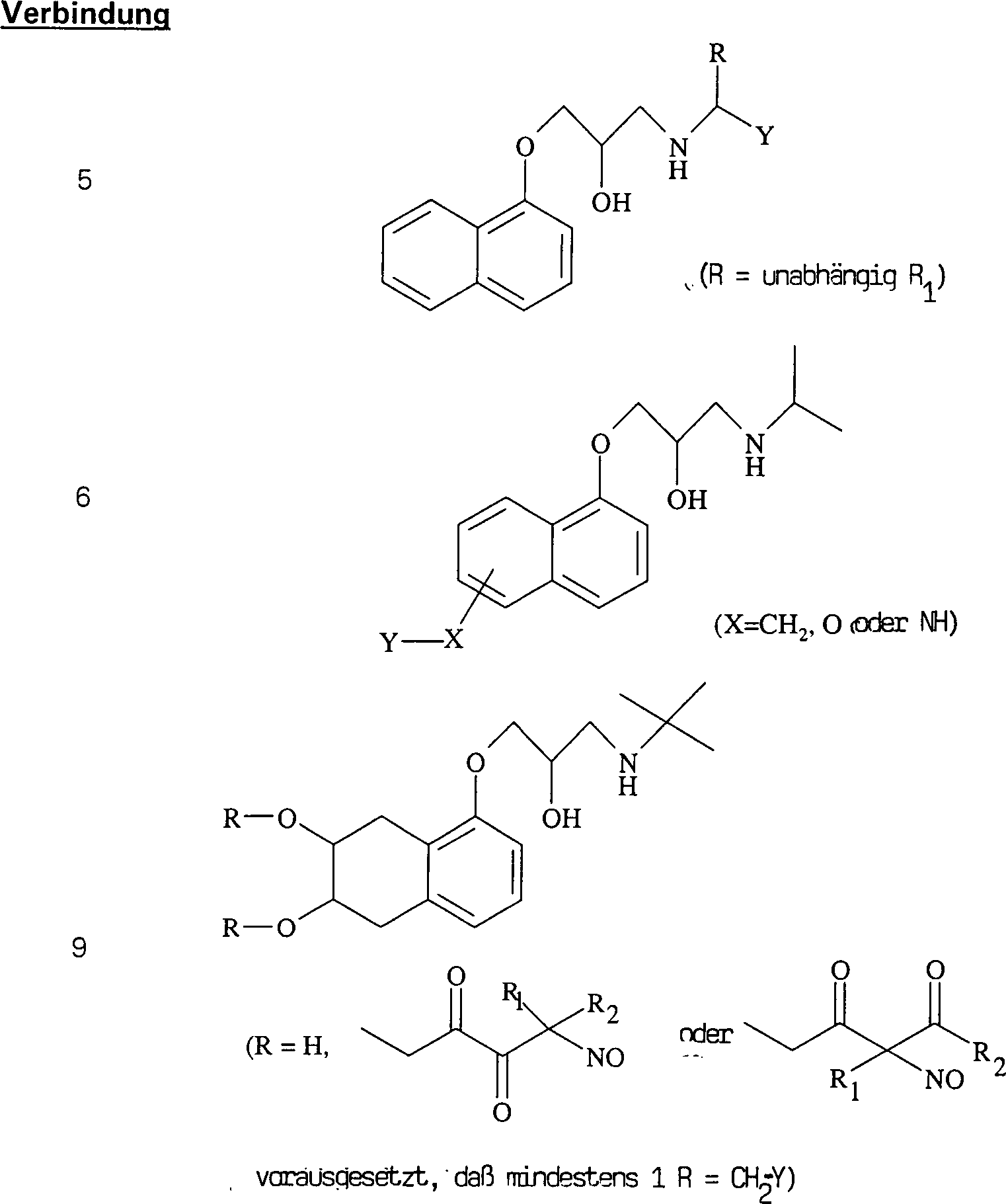
Die
C-Nitroso-Verbindungen der Erfindung haben einen Substituenten Q,
der an den tertiären
Kohlenstoff gebunden ist und aus einer Ketten-Baueinheit besteht,
die 1 bis 12 Kettenatome enthält,
die aus 1 bis 10 Kohlenstoffatomen, 0 bis 2 Stickstoffatomen und
0 bis 2 Sauerstoffatomen bestehen, die kovalent an eine cyclische
Baueinheit gebunden ist, die monocyclisch, bicyclisch, tricyclisch,
tetracyclisch oder pentacyclisch ist und 5 bis 24 Ringatome enthält, die
aus 2 bis 20 Kohlenstoffatomen, 0 bis 4 Stickstoffatomen, 0 bis
1 Sauerstoffatomen und 0 bis 1 Schwefelatomen bestehen. Die "Kettenatome" werden gezählt durch
Zählen
der Atome, die das tertiäre
Kohlenstoffatom und die cyclische Baueinheit verbinden, und schließen Wasserstoff
und andere Substituenten an der Kette aus. Die "Ringatome" werden gezählt durch Zählen der Atome, die den Ring (die
Ringe) bilden, und schließen
Wasserstoff oder andere Substituenten an dem Ring aus. Außer an den
Substituenten Q ist der tertiäre
Kohlenstoff an die Substituenten Q und Q'' gebunden.
Wenn Q keine elektronenziehende Gruppe an einem direkt an den tertiären Kohlenstoff
gebundenen Kohlenstoff oder die einen direkt an den tertiären Kohlenstoff
gebundenen Kohlenstoff aufweist, enthält, oder selbst wenn er es
tut, enthält
mindestens eine der Gruppen Q' und
Q'' bevorzugt ein elektronenziehendes
Atom oder eine elektronenziehende Gruppe an einem direkt an den
tertiären
Kohlenstoff gebundenen Kohlenstoff oder die einen direkt an den
tertiären
Kohlenstoff gebundenen Kohlenstoff aufweist, z. B. ein Fluoratom,
eine Carbonylgruppe per se oder als Teil einer Estergruppe, Nitro,
Cyanid, CF3 oder SO2R,
worin R C1 bis C6-Alkyl
oder C6 bis C20-Aryl
umfasst. Was Q' und
Q'' betrifft, sind jegliche
Atome stromab von dem Kohlenstoff in alpha-Stellung zu dem tertiären Kohlenstoff
unkritisch. Beispiele für
Q' und Q'' sind R1, R2, R1C(O)-, R2C(O)-, R1CH2C(O)-, R2CH2C(O)-, C(O)COOH, Methyl, -CO2Me,
-CF3 und -CN, worin R1 und
R2 ausgewählt sind aus der Gruppe, die
aus C1 bis C6-Alkyl
und C6 bis C20-Aryl
und substituierten Derivaten davon besteht, z. B. substituiert mit
Amino, Hydroxyl und/oder Carboxy und/oder die sulfatiert sind, d.
h. mit Sulfat substituiert sind, und/oder die phosphoryliert sind,
d. h. mit Phosphat substituiert sind.
-
Die
C-nitrosylierten Verbindungen hierin bilden, wenn sie isoliert werden,
Dimere, die fest und sehr stabil sind, und daher haben die Verbindungen
hierin lange Lagerfähigkeiten
und können
monatelang bei Umgebungstemperaturen in Anwesenheit von Sauerstoff
und Licht gelagert werden. Während
die Dimere unwirksam sind, bilden sie in Wasser Monomere, die wirksam
sind. Sie können
für augenblickliche
Wirksamkeit als wässrige
Lösungen
verabreicht werden. Sie können
auch als Dimere verabreicht werden, um einen Depoteffekt zu schaffen,
wenn sich das Dimer im Körper
auflöst.
So wurde hierin herausgefunden, dass die Dimere die Lebensdauer
der Verbindungen fördern
und die biologische Wirksamkeit der Verbindungen modulieren, und
die Freisetzungsraten stehen nicht in direkter Beziehung zur Wirksamkeit
dieser Verbindungen. Die Dimerisierung und die größere Stabilität sind stark
begünstigt
für α-Acyl-C-nitroso-Verbindungen; daher
die obige Bevorzugung von C-Nitroso-Verbindungen, bei denen Kohlenstoff
in alpha-Stellung zum nitrosylierten Kohlenstoff Teil einer Keton-Gruppe
ist.
-
Wie
oben angegeben, kann die C-Nitroso-Verbindung hierin erhalten werden
durch Nitrosylieren eines tertiären
Kohlenstoffatoms eines konventionellen Arzneimittels oder eines
konventionellen Arzneimittels, das modifiziert wurde, um seinen
Kohlenstoffsäure-pKa
zu modifizieren. Der Kohlenstoffsäure-pKa kann verringert werden,
beispielsweise durch Umwandeln eines Kohlenstoffs in alpha-Stellung
zu dem zu nitrosylierenden tertiären
Kohlenstoff in eine Keton-Gruppe,
oder durch die Hinzufügung
eines anderen elektronenziehenden Substituenten (z. B. Fluor, Nitro,
Cyanid, CF3 oder SO2R,
worin R wie oben definiert ist).
-
Verschiedene
Ausführungsformen,
bei denen die C-Nitroso-Verbindung hierin erhalten wird durch Nitrosylieren
des tertiären
Kohlenstoffatoms eines konventionellen Arzneimittels oder eines
konventionellen Arzneimittels, das modifiziert wurde, um seinen
Kohlenstoffsäure-pKa
zu modifizieren, umfassen eine C-Nitroso-Verbindung mit einem Molekulargewicht
im Bereich von 225 bis 600 auf Monomerbasis, wobei eine Nitrosogruppe
an einen tertiären
Kohlenstoff gebunden ist, die erhalten wird durch Nitrosylierung
des konventionellen Arzneimittels (z. B. eines nicht-steroidalen
anti-inflammatorisch wirkenden Arzneimittels, eines COX-2-Inhibitors,
eines analgetischen Arzneimittels, eines Arzneimit tels gegen Angina,
eines blutdrucksenkenden Arzneimittels, eines diuretischen Arzneimittels,
eines ACE-Inhibitors, eines Arzneimittels gegen Hypercholesterinämie/Hyperlipoproteinämie, eines
Calciumkanals-Blockers, eines säureneutralisierenden
Arzneimittels, eines Bronchodilators, eines NMDA-antagonistischen/skelettmuskelentspannenden
Arzneimittels, eines Arzneimittels gegen Proliferation/tubulinbindenden
Arzneimittels, eines CETP-Inhibitors und eines SOD-Mimetikums oder
eines Xanthinoxidase-Inhibitors) mit einem Kohlenstoffsäure-pKa
im Bereich von 15 bis 25 z.B. 15 bis 20, oder des Arzneimittels
das modifiziert wurde, um einen Kohlenstoffsäure-pKa im Bereich von 15 bis
25, z. B. 15 bis 20, zu haben.
-
Wenn
die C-Nitroso-Verbindung aus einem konventionellen Arzneimittel
erhalten wird, behält
sie die Funktionalität
des Arzneimittels und liefert auch den NO spendenden Entspannungseffekt.
Manchmal führt dies
zu einem synergistischen Effekt. Wenn beispielsweise die C-Nitroso-Verbindung
von einem nicht-steroidalen
antiinflammatorisch wirkenden Arzneimittel abgeleitet ist, das sowohl
COX-1 als auch COX-2 hemmt, ist das Ergebnis ein COX-1-Inhibitor
mit den Vorteilen, aber nicht den Nachteilen der COX-1-Hemmung durch konventionelle
NSAIDS, und auch ein COX-2-Inhibitor mit dessen Vorteilen und bei
dem bestimmte vorteilhafte Effekte (z. B. Besserung von Harninkontinenz
oder Vermittlung der Präkonditionierung)
potentiert oder neu geschaffen werden können. Eine hierin synthetisierte
Verbindung war von Ibuprofen abgeleitet, das COX-1 sowie COX-2 hemmt.
Bei der Synthese wurde das Ibuprofen zuerst in Ketoibuprofen umgewandelt,
um den pKa zu senken, damit er innerhalb von 15 bis 20 war. Die
nitrosylierte Verbindung, ein Nitrosoketoibuprofen, isoliert als
dimere 2-[4'-(α-Nitroso)isobutylphenyl]propionsäure, liefert
die Vorteile der COX-1- und COX-2-Hemmung ohne die pathologischen
Effekte, die typischerweise mit der COX-1-Hemmung verbunden sind.
-
Unten
sind konventionelle Arzneimittel und davon abgeleitete C-Nitroso-Verbindungen
der ersten Ausführungsform
der Erfindung aufgelistet. In der Beschreibung der Verbindungen
unten wird oft der Begriff "substituiert
mit Amino, Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder
phosphoryliert sind" verwendet; diese
Formulierung bedeutet substituiert mit Amino, Hydroxyl, Carboxy,
Sulfat und/oder Phosphat. Wann immer ein Anion ohne Angabe eines
ausgleichenden Kations dargelegt wird, ist das ausgleichende Kation
vorhanden und ausgewählt
aus der Gruppe, die aus H+, Na+,
K+, Li+, Ca++ und Tetraalkylammonium besteht.
-
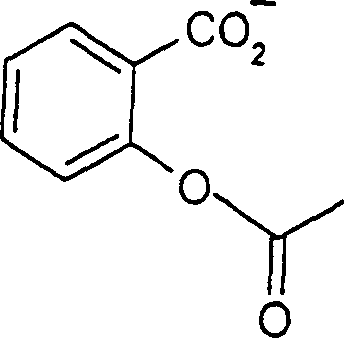
Die
analgetische Acetylsalicylsäure
hat die Formel
-
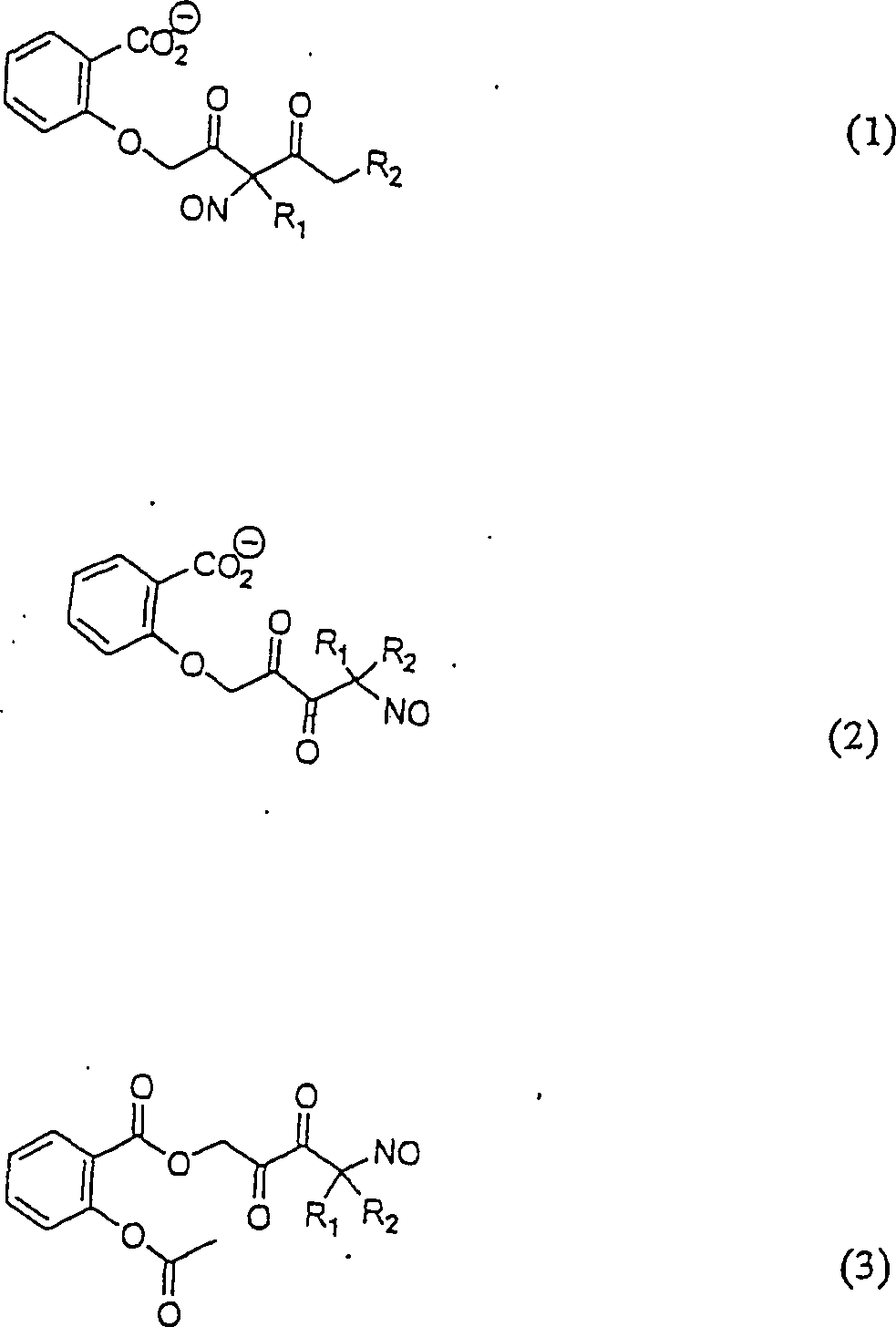
-
C-Nitroso-Verbindungen
der Erfindung, die von Acetylsalicylsäure abgeleitet sind, umfassen
beispielsweise:
-
In
(1), (2) und (3) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C5-C20-Aryl
und substituierten Derivaten von diesen, z. B. substituiertem Amino-Hydroxyl
und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
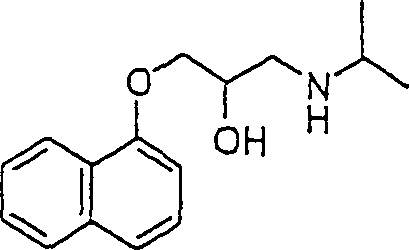
Das
gegen Angina wirksame Propanalol hat die Formel:
-
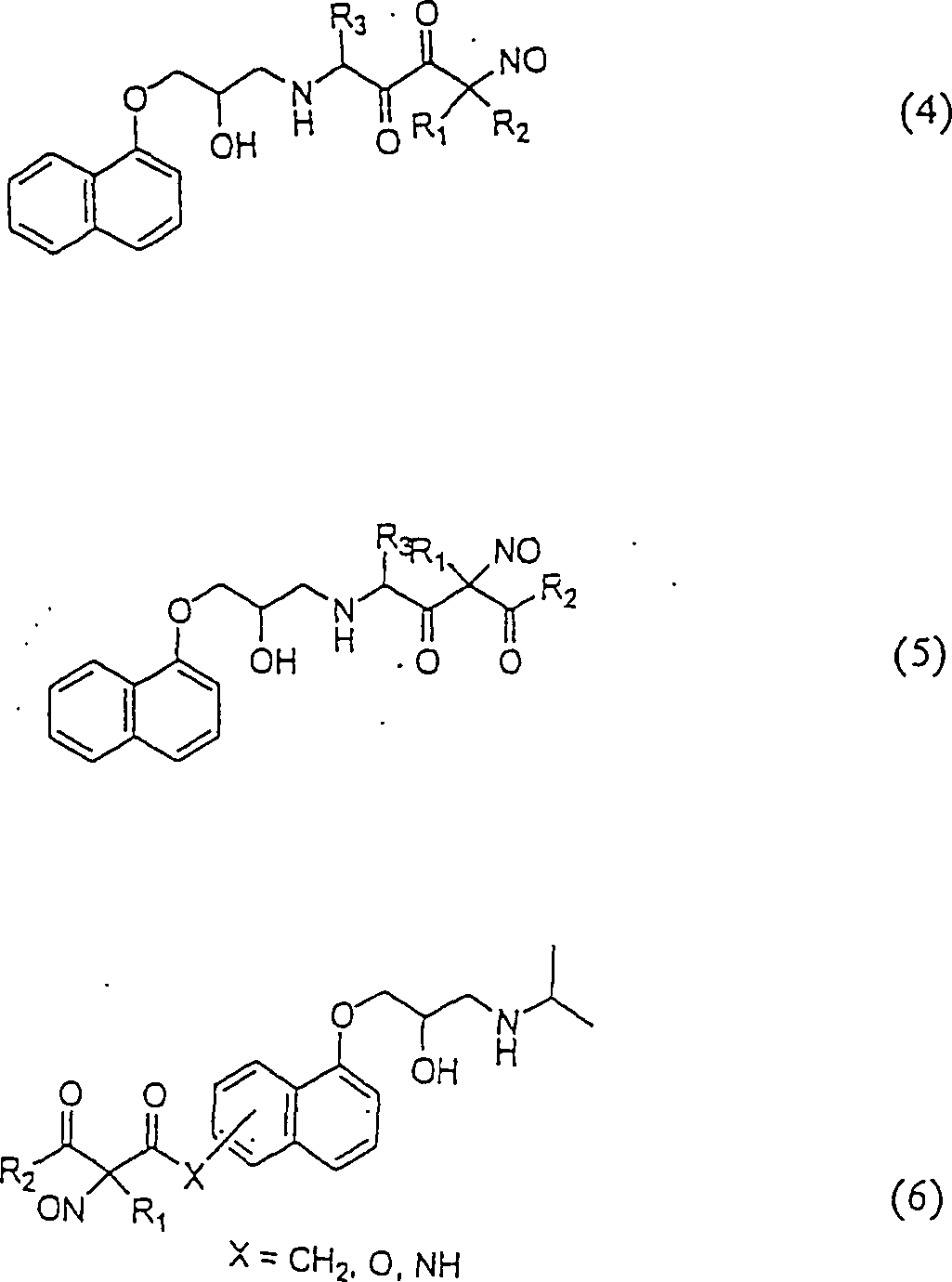
C-Nitroso-Verbindungen
der Erfindung, die von Propanalol abgeleitet sind, umfassen beispielsweise:
-
In
(4), (5) und (6) sind R1, R2 und
R3 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20-Aryl und substituierte
Derivaten von diesen, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
Das
gegen Angina wirksame Nadolol hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung, die von Nadolol abgeleitet sind, umfassen beispielsweise:
-
In
(7), (8) und (9) sind R1, R2,
R3, R4 und R5 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
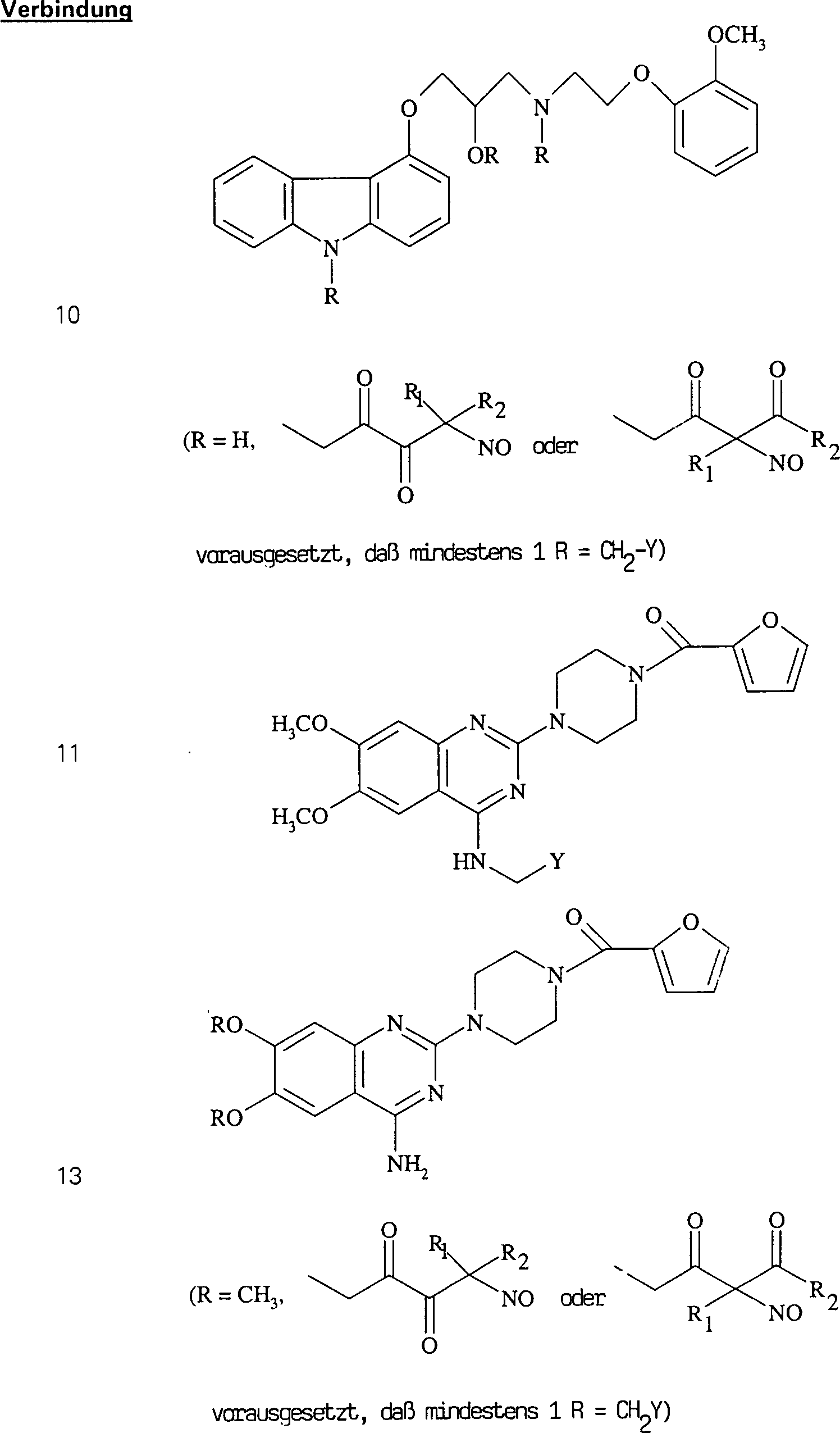
Das
gegen Angina wirksame und gegen Herzinsuffizienz schützende Carvedilol
hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung, die von Carvedilol abgeleitet sind, umfassen beispielsweise:
-
In
(10) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl und substituierte Derivaten davon,
z. B. substituiert mit Amino, Hydroxyl und/oder Carboxy und/oder
die sulfatiert und/oder phosphoryliert sind. besteht.
-
Das
blutdrucksenkende Prazosin hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung, die von Prazosin abgeleitet sind, die beispielhaft
sind für
alpha-adrenerge Rezeptor-Agonisten, brauchbar zur Behandlung von
erektiler Dysfunktion, umfassen beispielsweise:
-
In
(11), (12) und (13) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
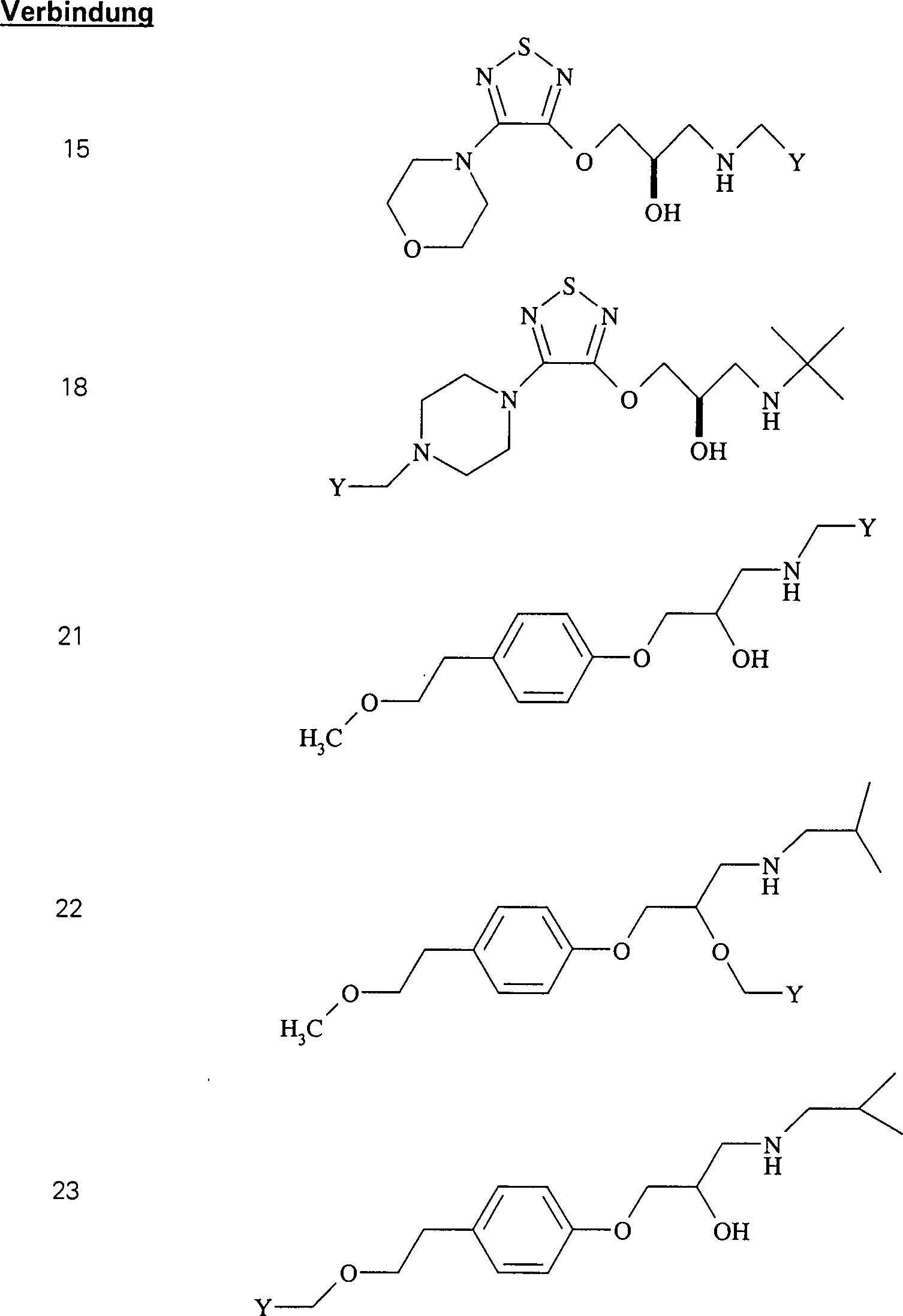
Das
blutdrucksenkende Tinolol hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung, die von Tinolol abgeleitet sind, umfassen beispielsweise:
-
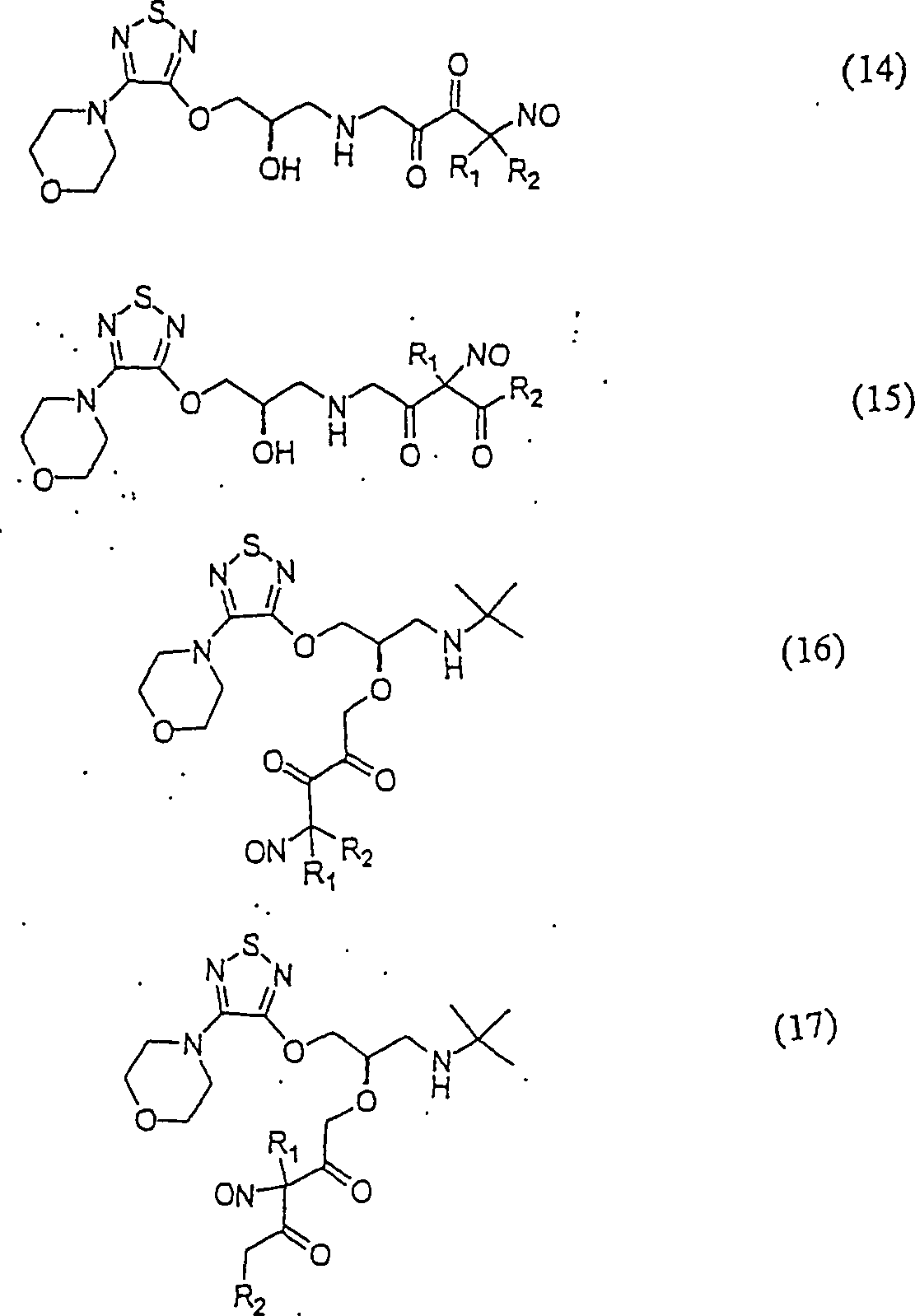
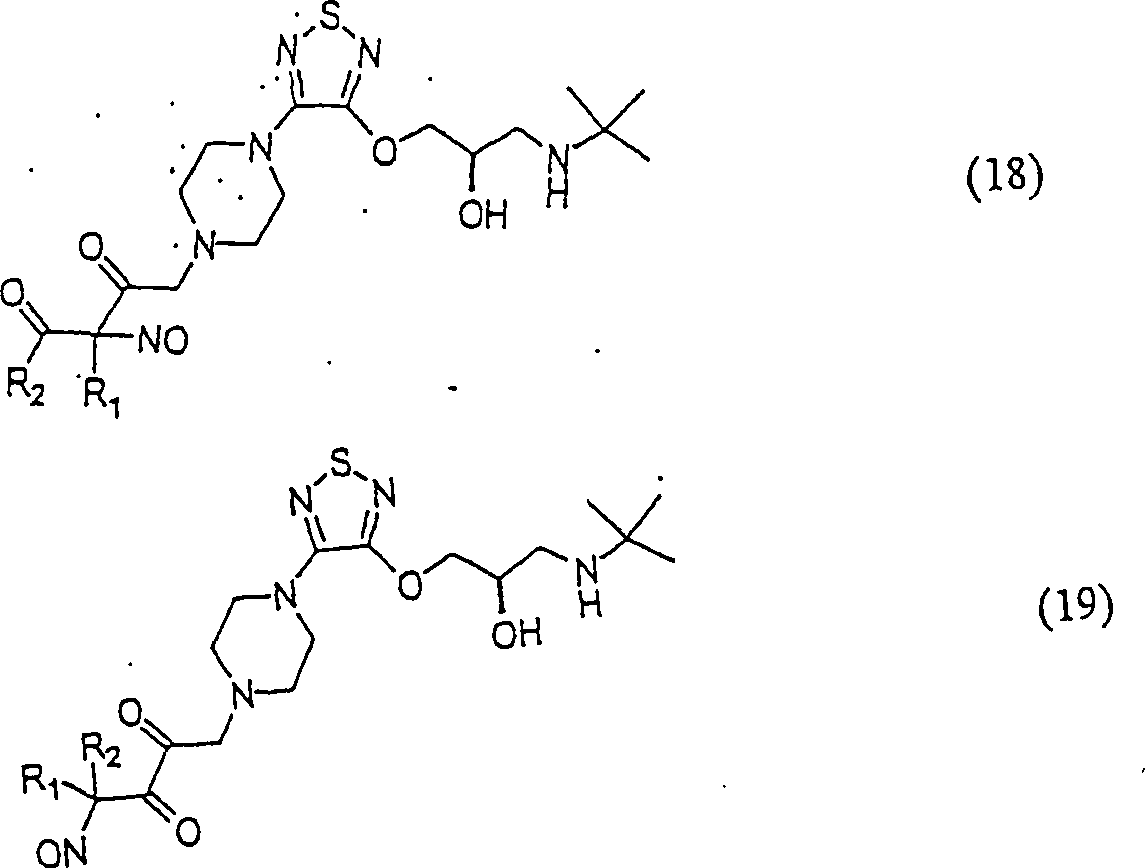
In
den Verbindungen (14), (15), (16), (17), (18) und (19) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxy und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
Das
blutdrucksenkende Metoprolol hat die Formel:
-
C-Nitroso-Verbindungen
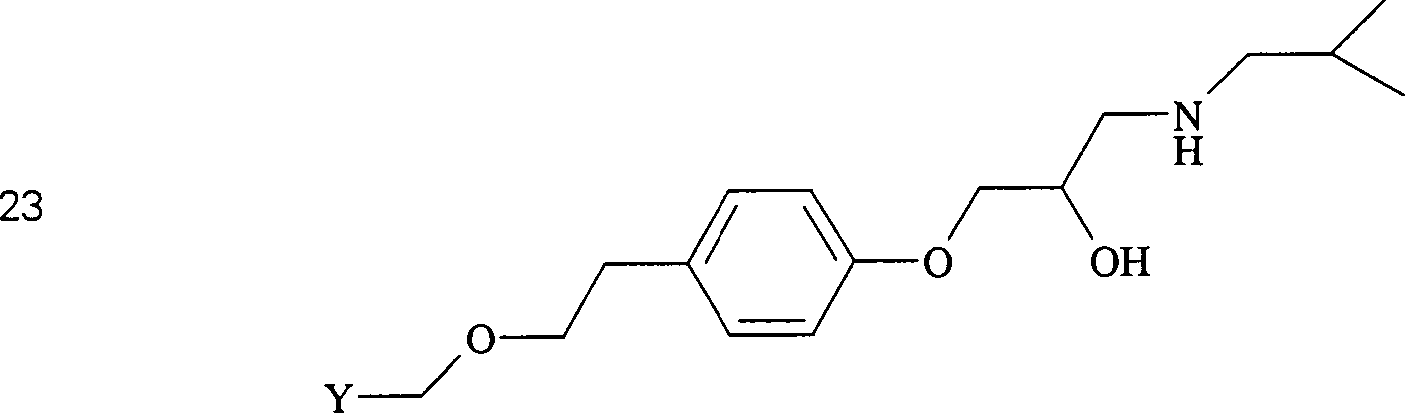
der Erfindung, die von Metoprolol abgeleitet sind, umfassen beispielsweise:
-
In
den Verbindungen (20), (21), (22) und (23) sind R1 und
R2 ausgewählt aus der Gruppe, die aus C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder Carboxy
und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
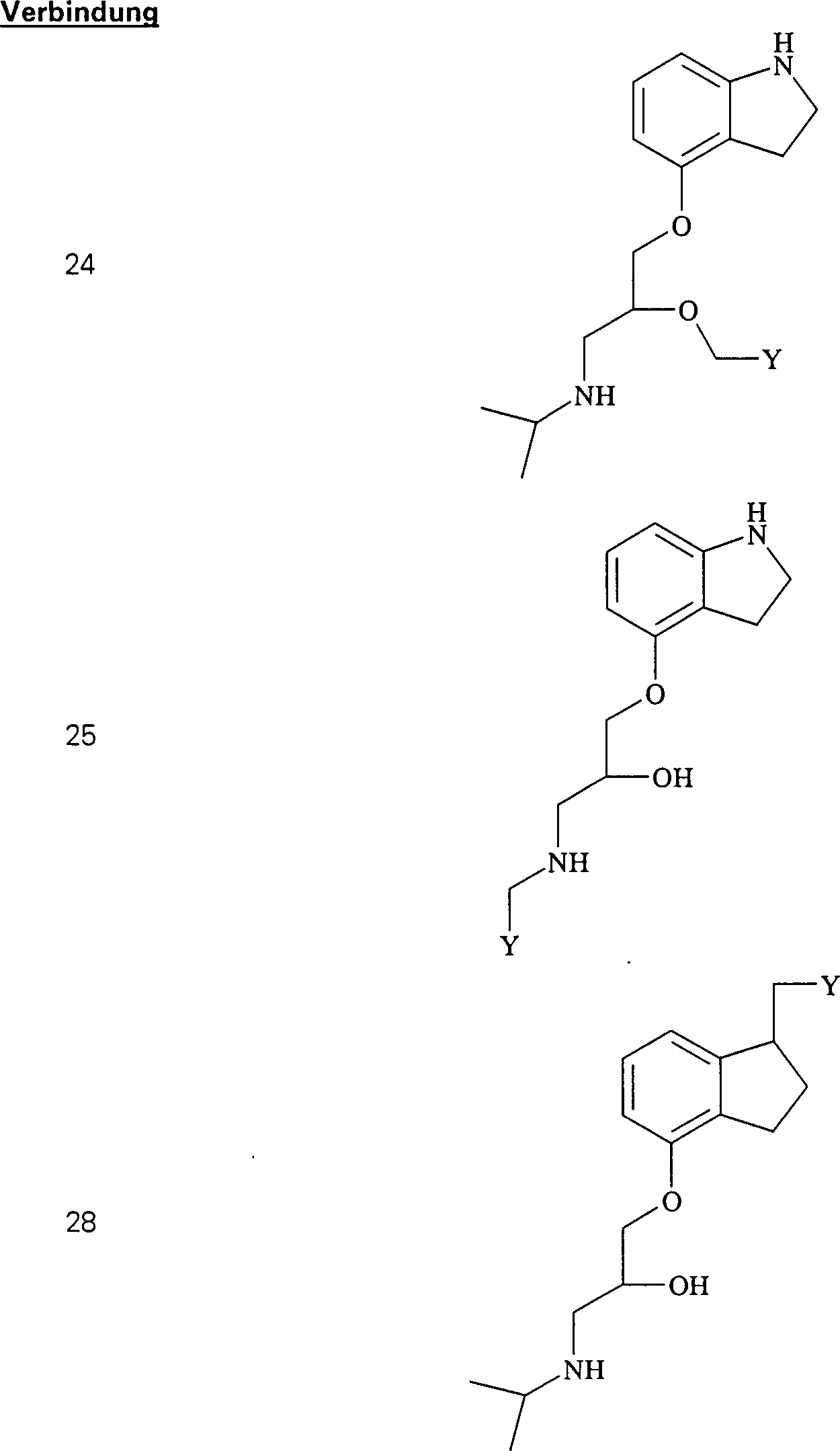
Das
blutdrucksenkende Pindalol hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung, die von Pindalol abgeleitet sind, umfassen beispielsweise:
-
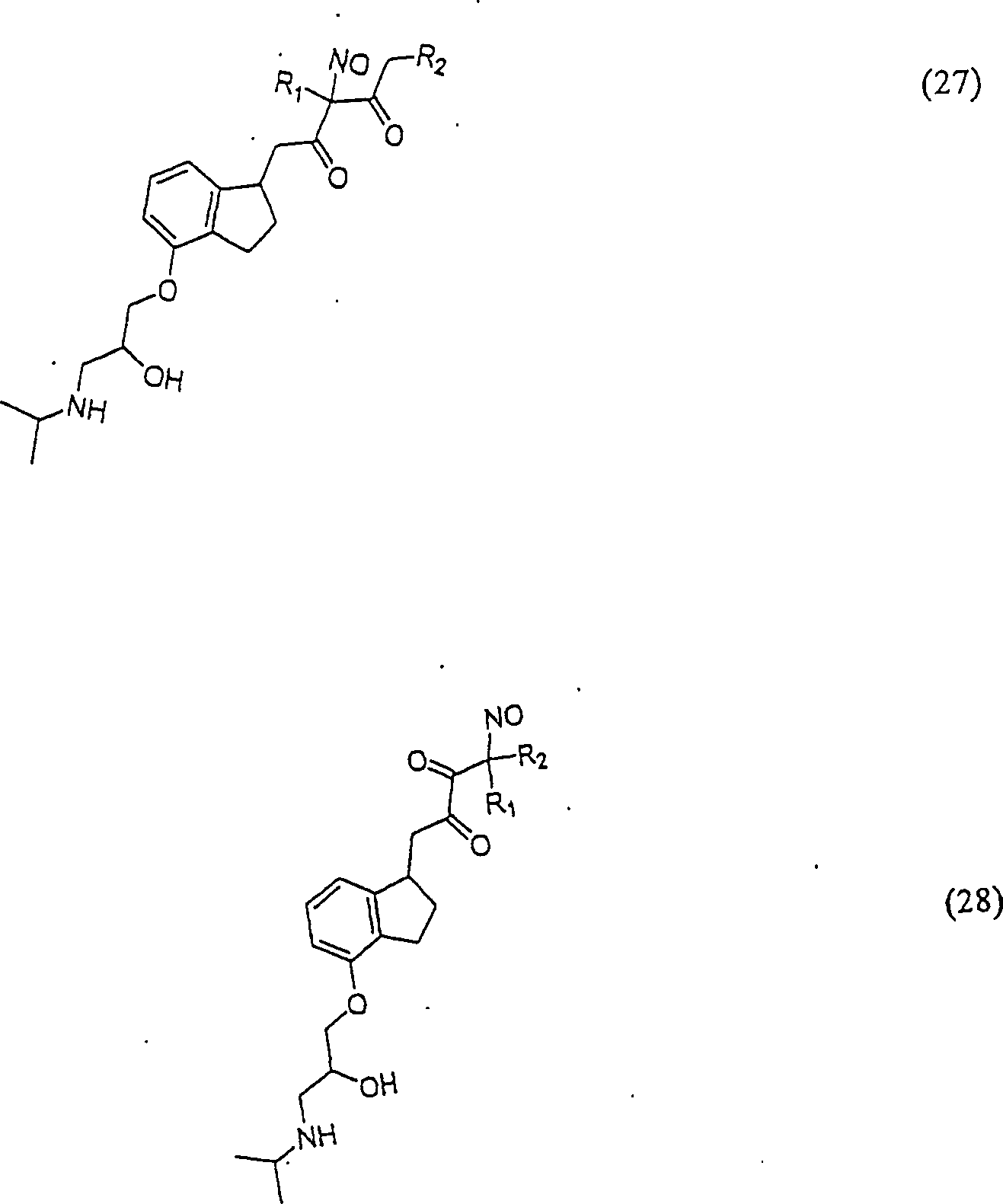
In
(24), (25), (26), (27) und (28) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
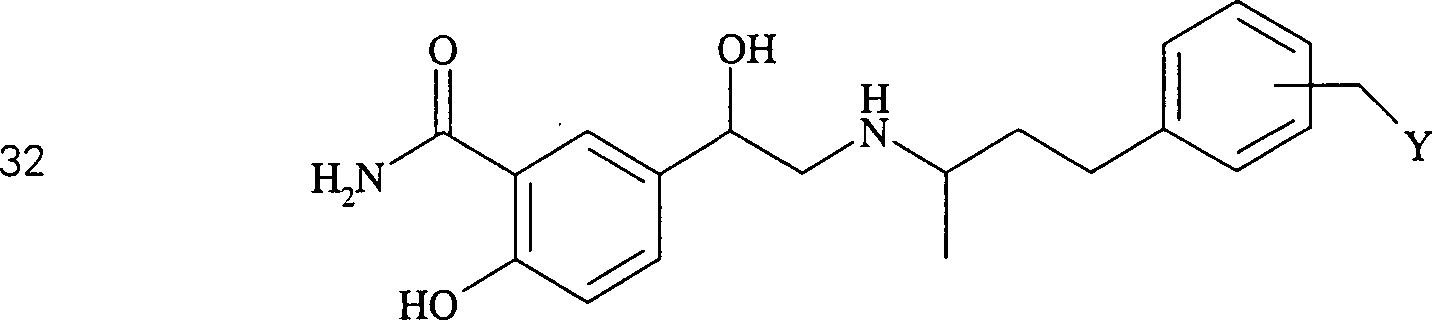
Das
blutdrucksenkende Labetalol hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung, die von Labetalol abgeleitet sind, umfassen beispielsweise:
-
In
(29), (30), (31) und (32) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
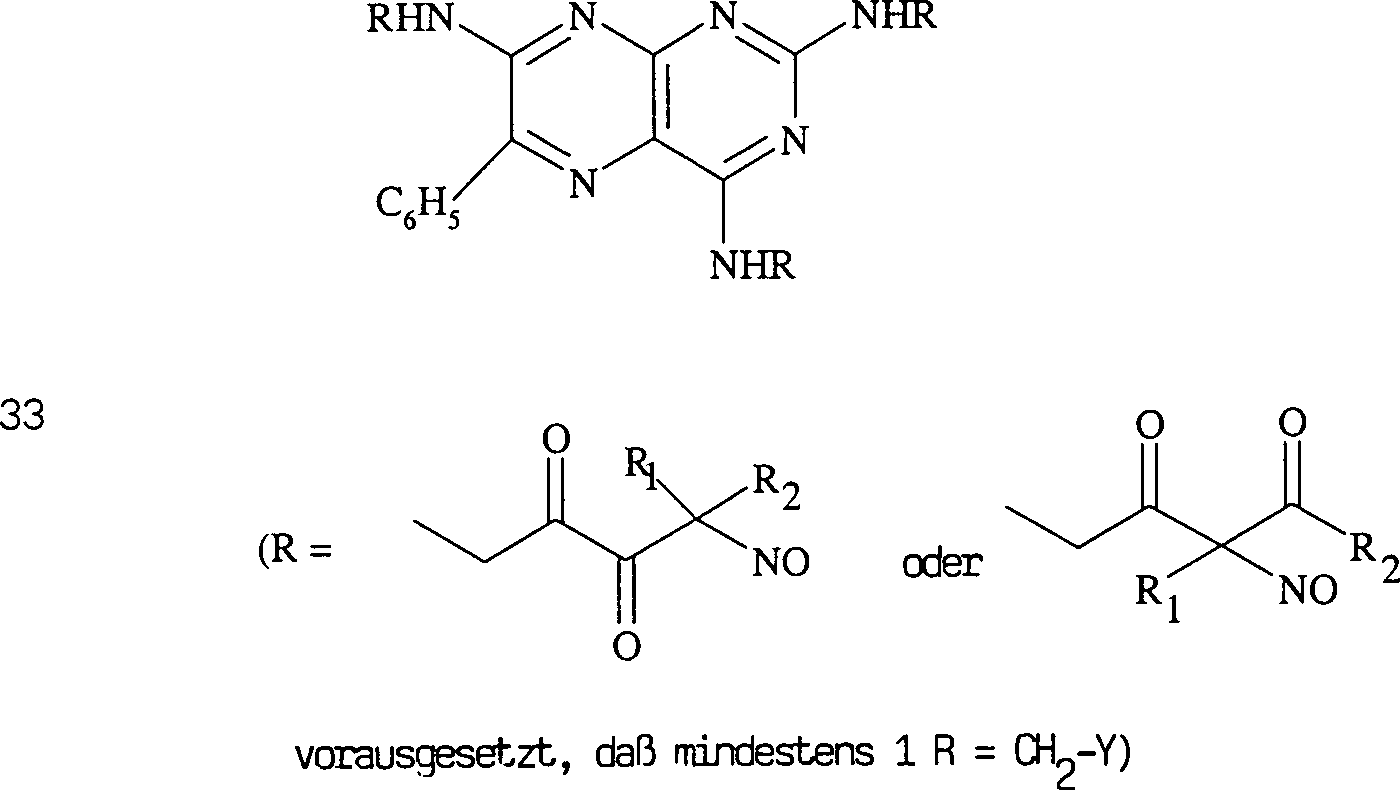
Das
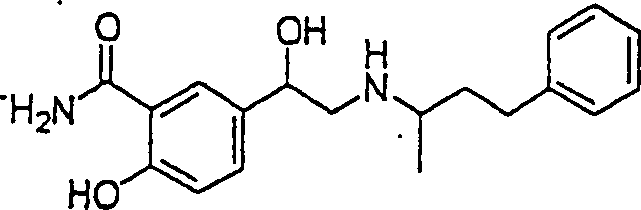
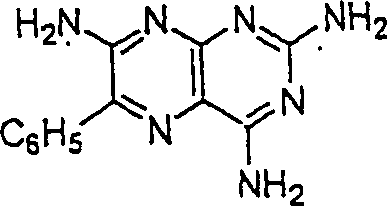
diuretische Triamteren hat die Formel:
-
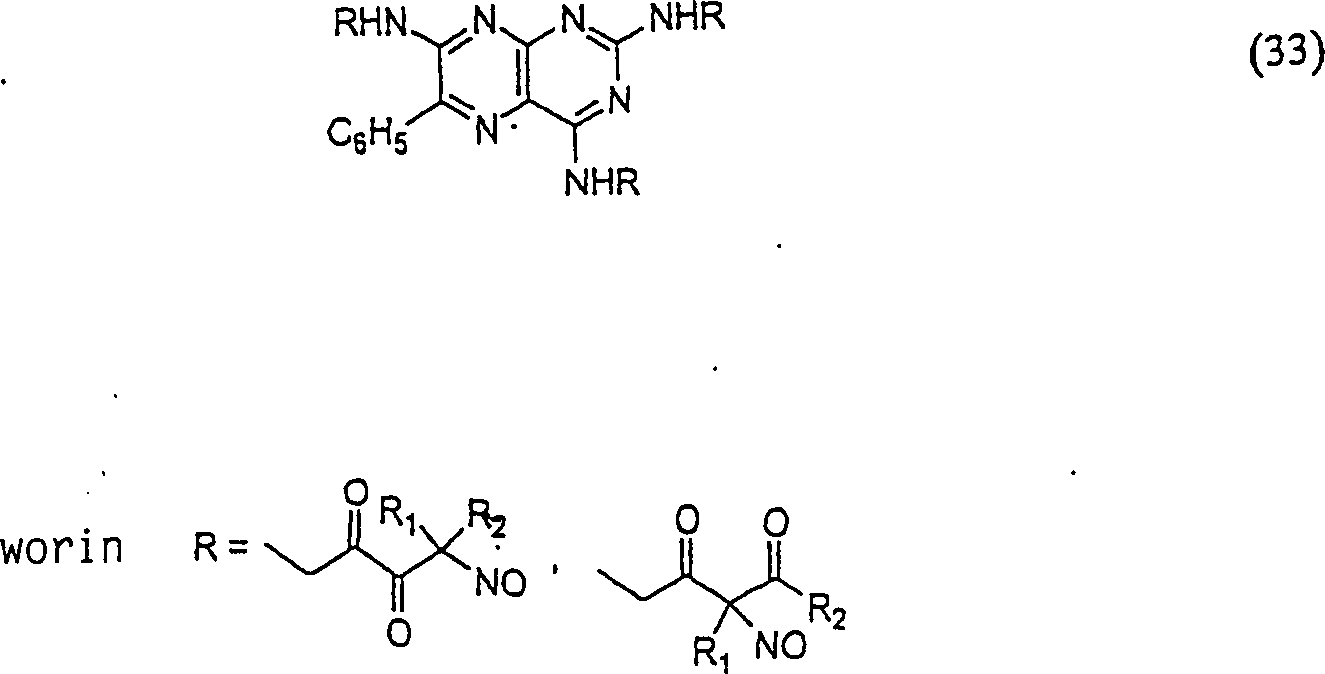
C-Nitroso-Verbindungen
der Erfindung, die von Triamteren abgeleitet sind, umfassen beispielsweise:
-
In
(33) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl und substituierten Derivaten davon,
z. B. substituiert mit Amino, Hydroxyl und/oder Carboxy und/oder
die sulfatiert und/oder phosphoryliert sind, besteht.
-
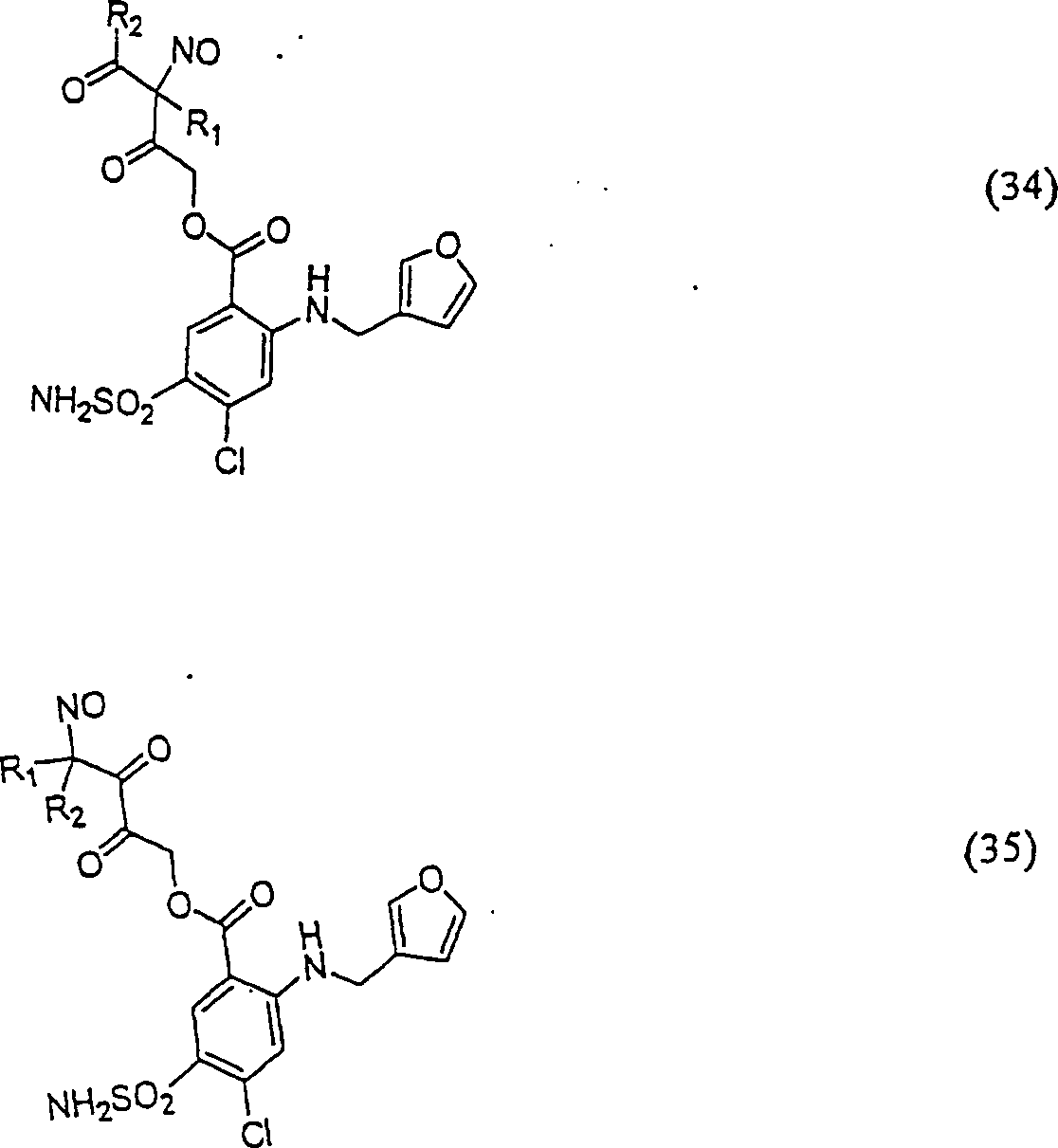
Das
diuretische Furosemid hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung, die von Furosemid abgeleitet sind, sind in einzigartiger
Weise nützlich
bei der Behandlung von Herzinsuffizienz, da sie diuretische und
vasodilatorische Funktionen vereinigen, und umfassen beispielsweise:
-
In
(34), (35), (36) und (37) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
Der
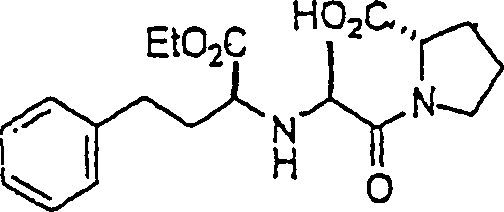
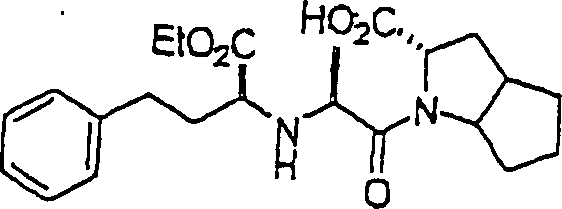
ACE-Inhibitor Enalapril hat die Formal:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Enalapril abgeleitet sind, haben eine
verbesserte Wirkung gegen Angina, wenn sie bei niedrigem Blutdruck
verwendet werden, und eine verbesserte gegen Blutblättchen gerichtete
Wirksamkeit, und sie umfassen beispielsweise:
-
In
(38), (39), (40) und (41) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
Der
ACE-Inhibitor Rampiril hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Rampiril abgeleitet sind, umfassen
beispielsweise
-
In
(42), (43), (44) und (45) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
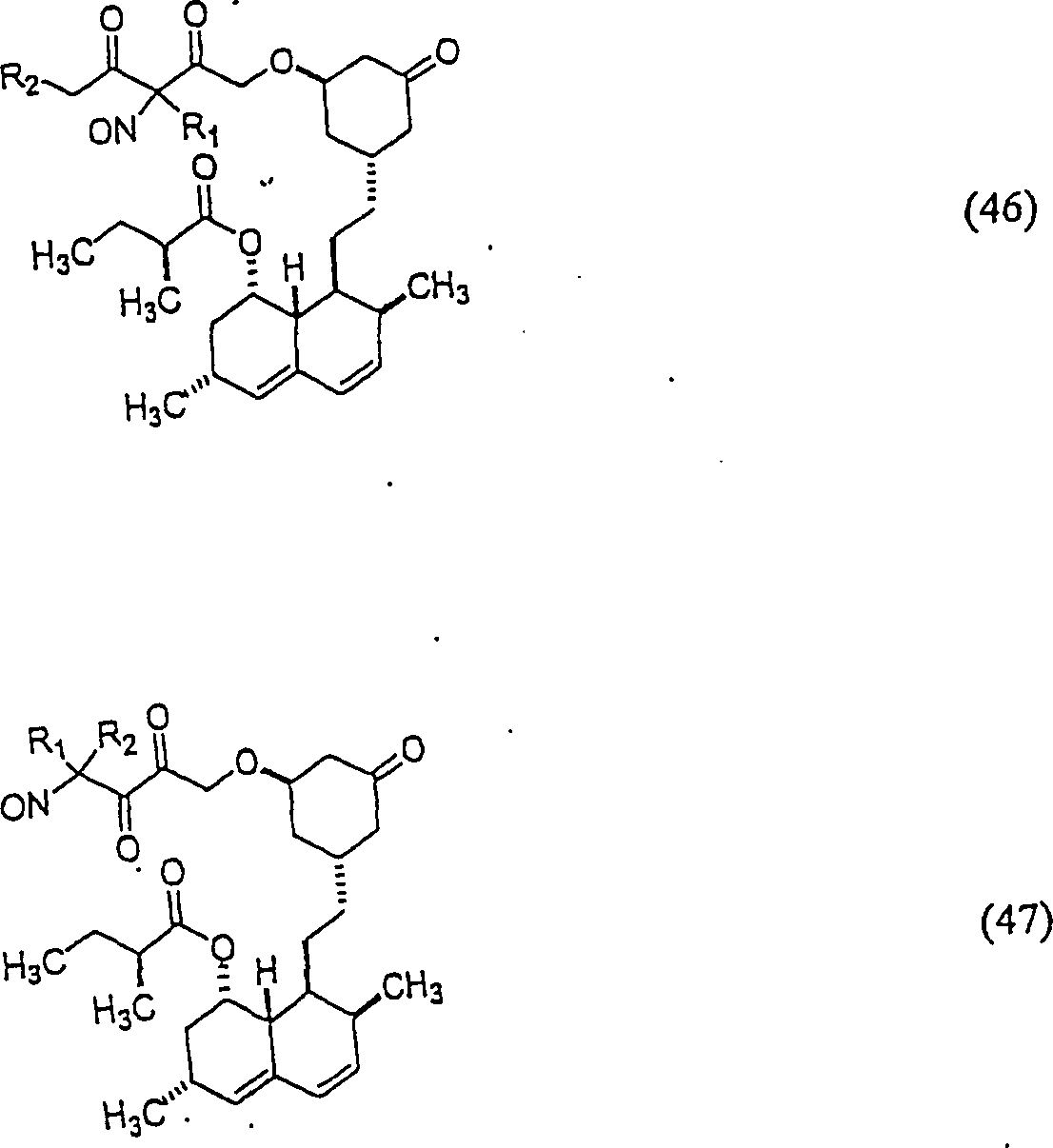
Das
gegen Hypercholestrenämie/Hyperlipoproteinämie wirkende
Lovastatin hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Lovastatin abgeleitet sind, umfassen
beispielsweise:
-
In
(46), (47), (48) und (49) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
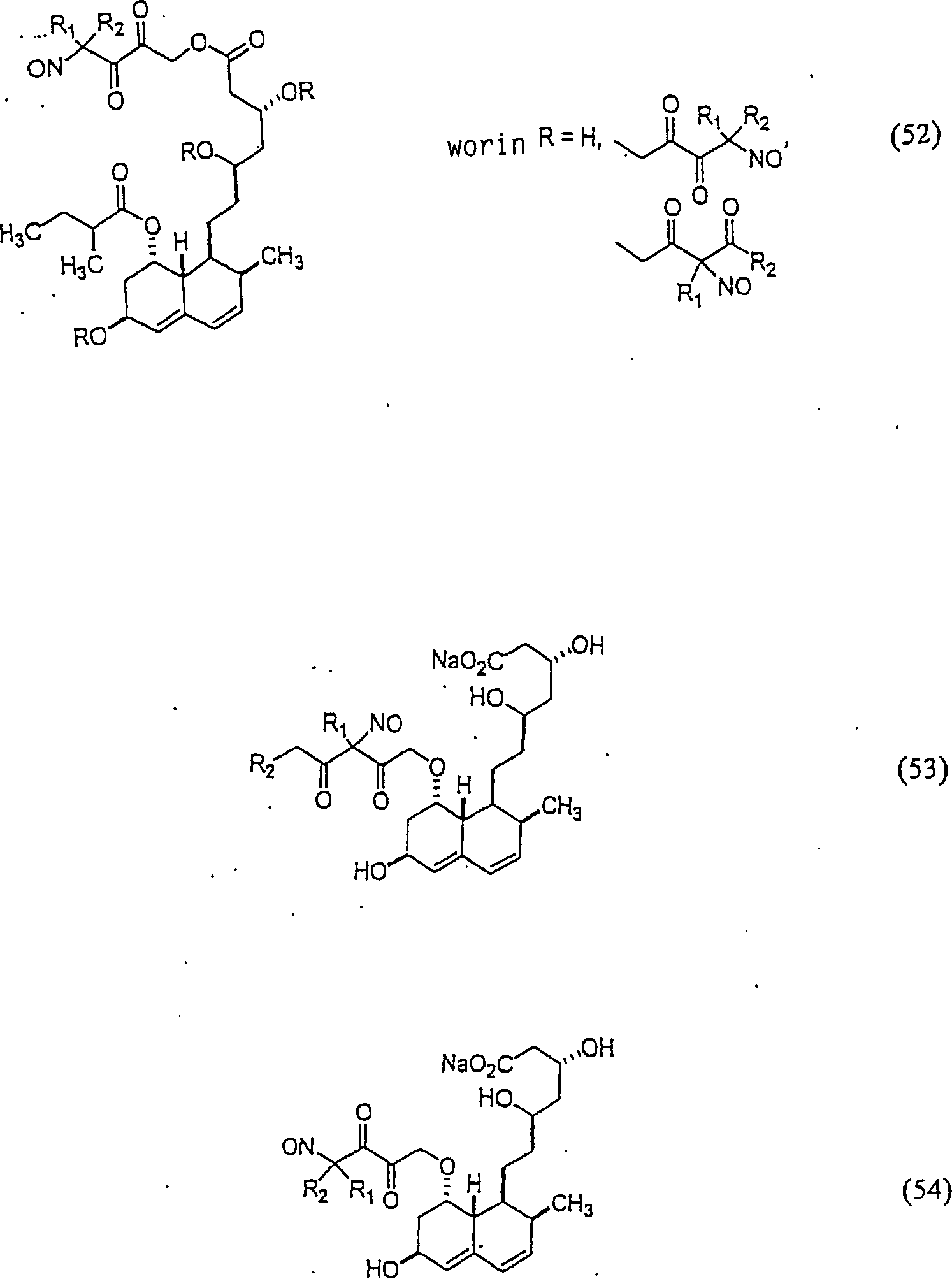
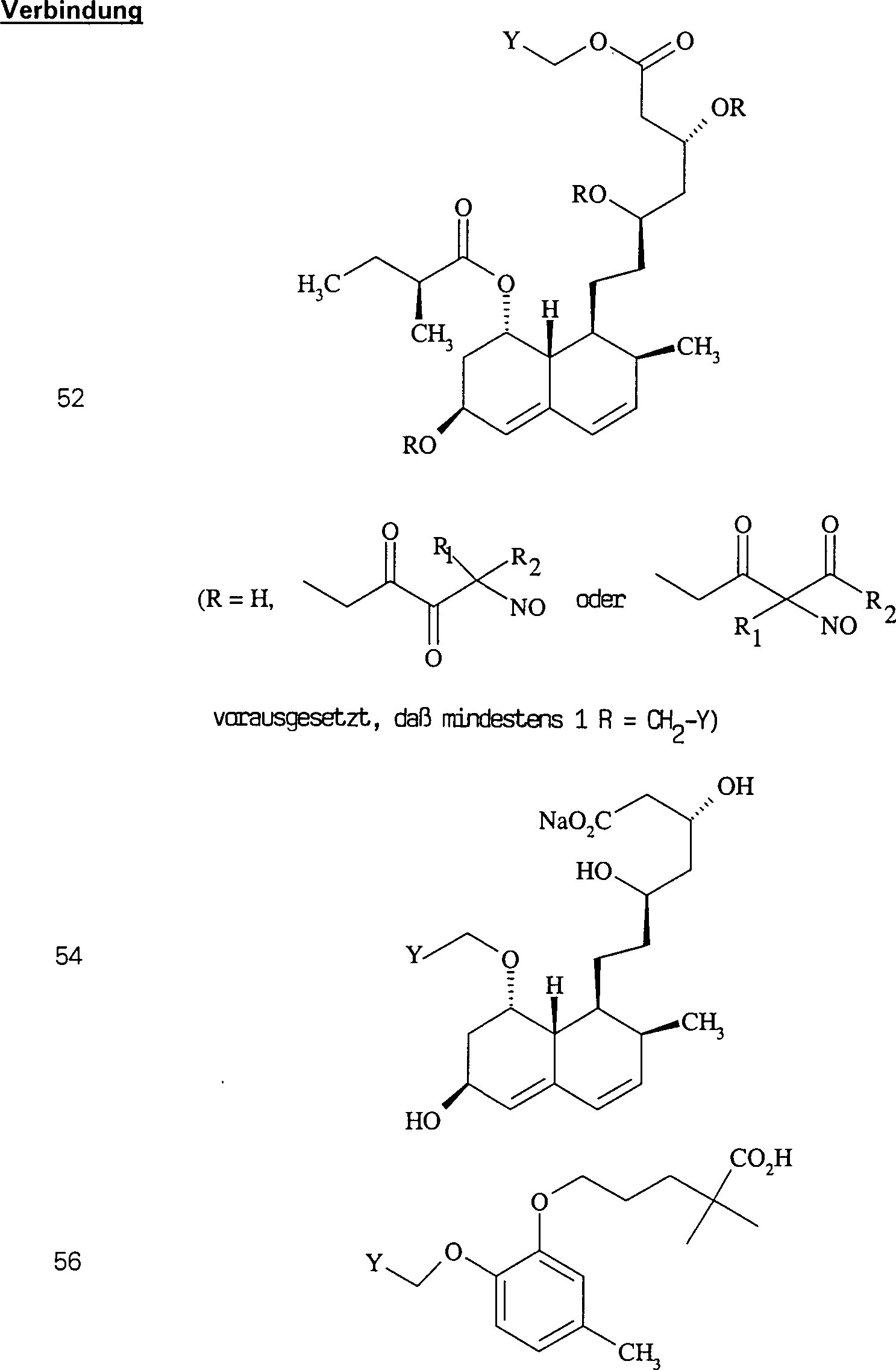
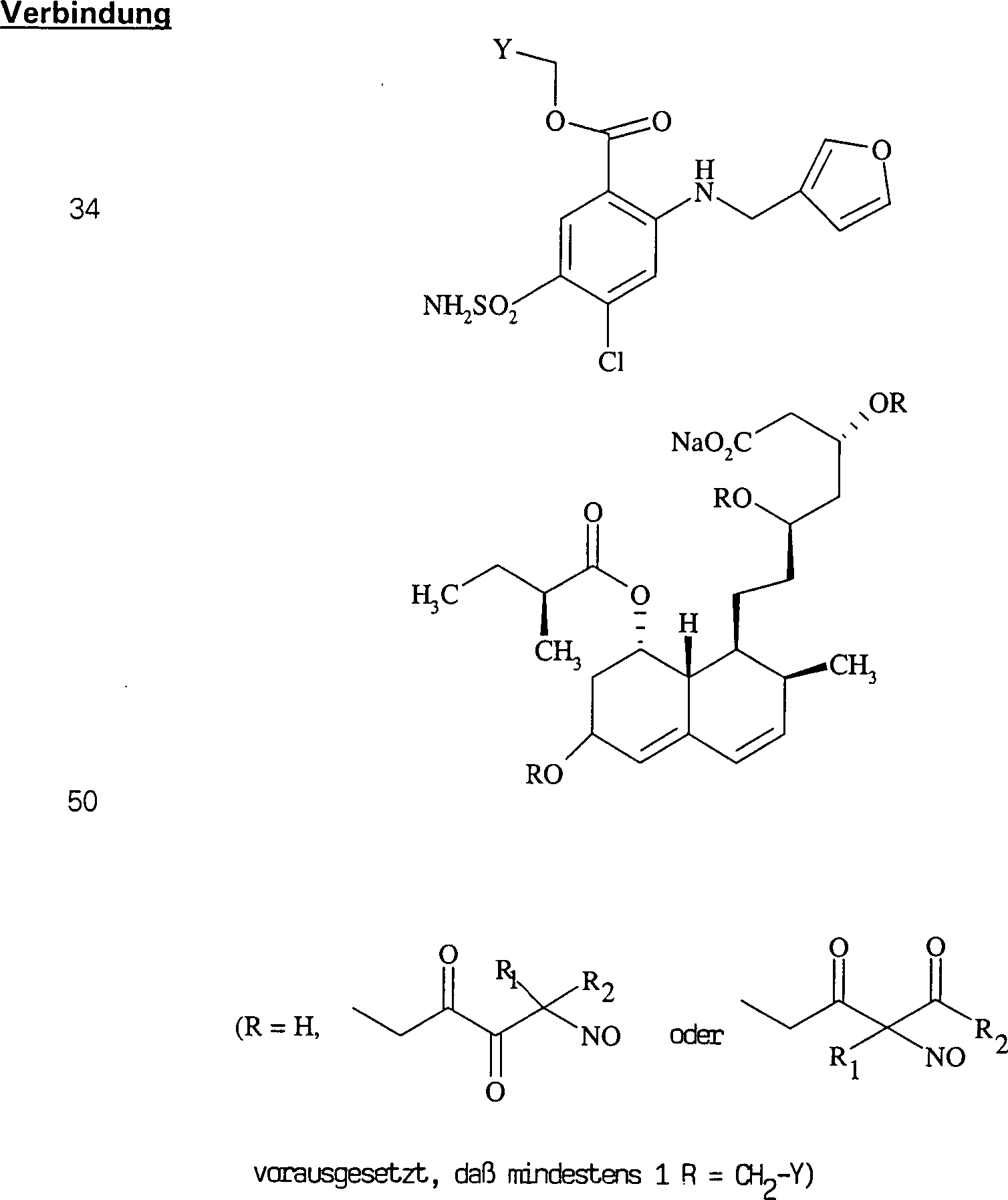
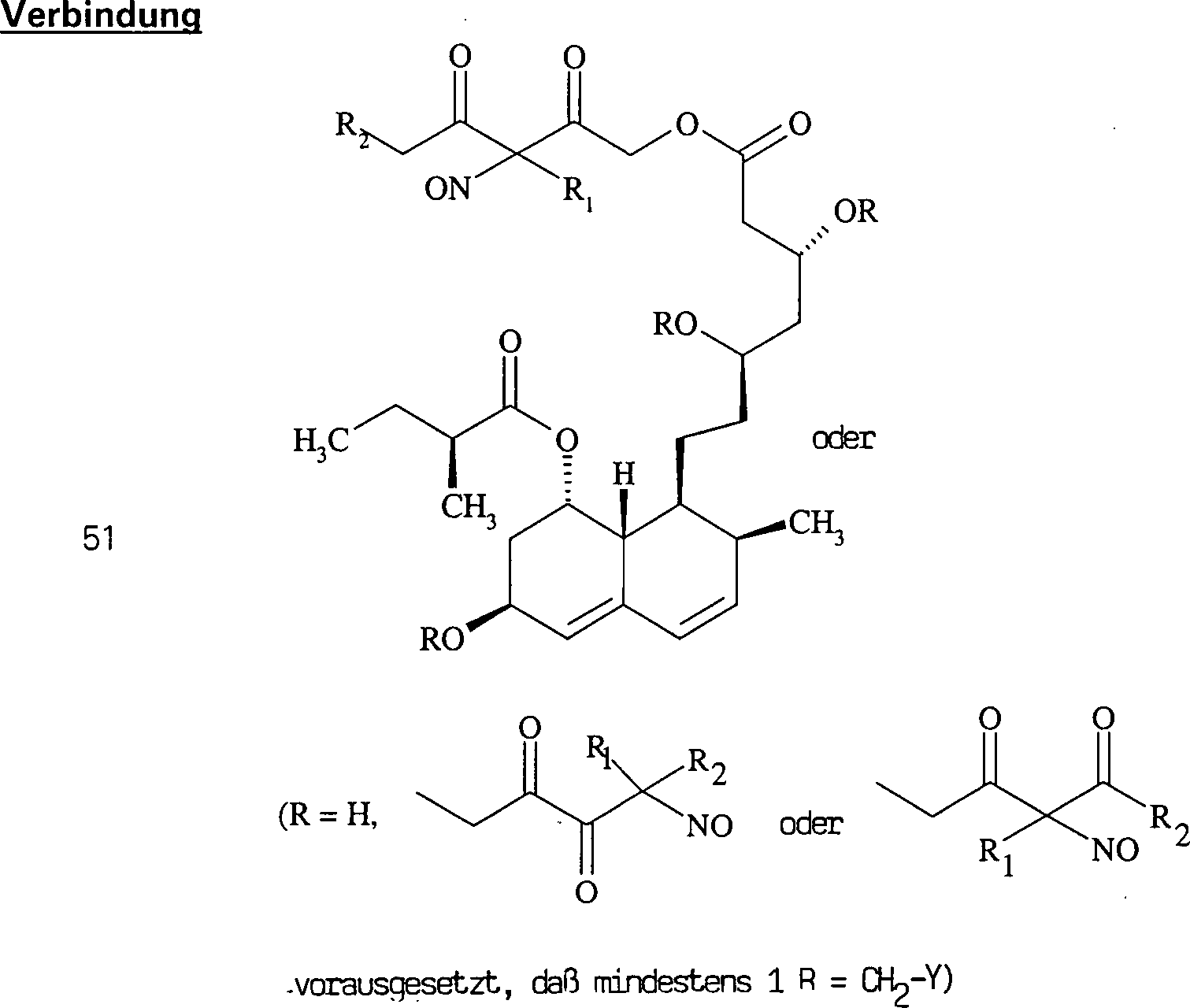
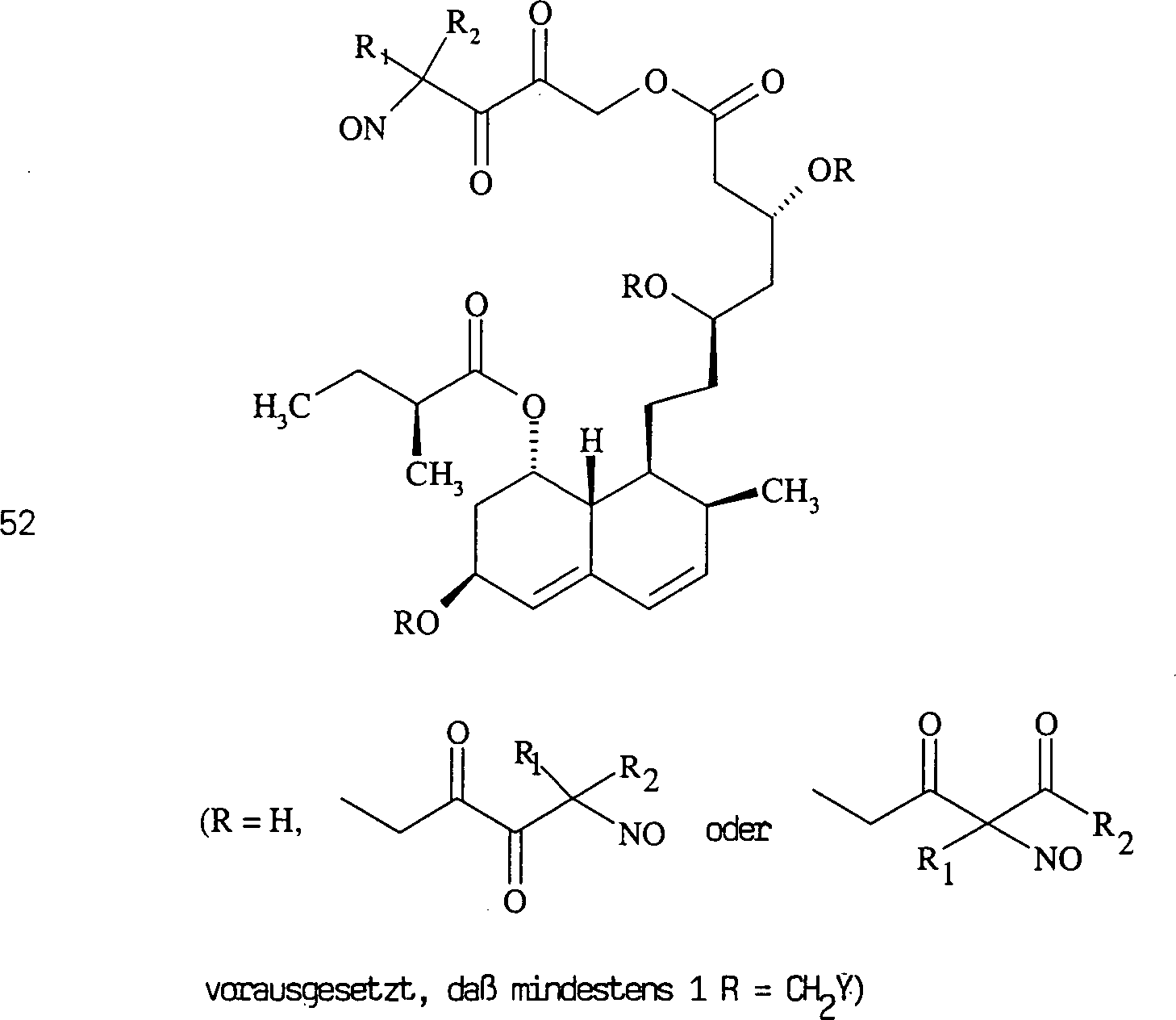
Das
gegen Hypercholesterinämie/Hyperlipoproteinämie wirkende
Pravastatin hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Pravastatin abgeleitet sind, umfassen
beispielsweise:
-
In
(50), (51), (52), (53) und (54) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
Das
gegen Hypercholesterinämie/Hyperlipoproteinämie wirkende
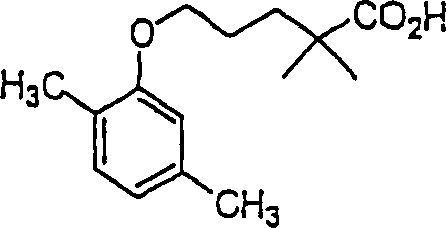
Gemibrozil hat die Formel:
-
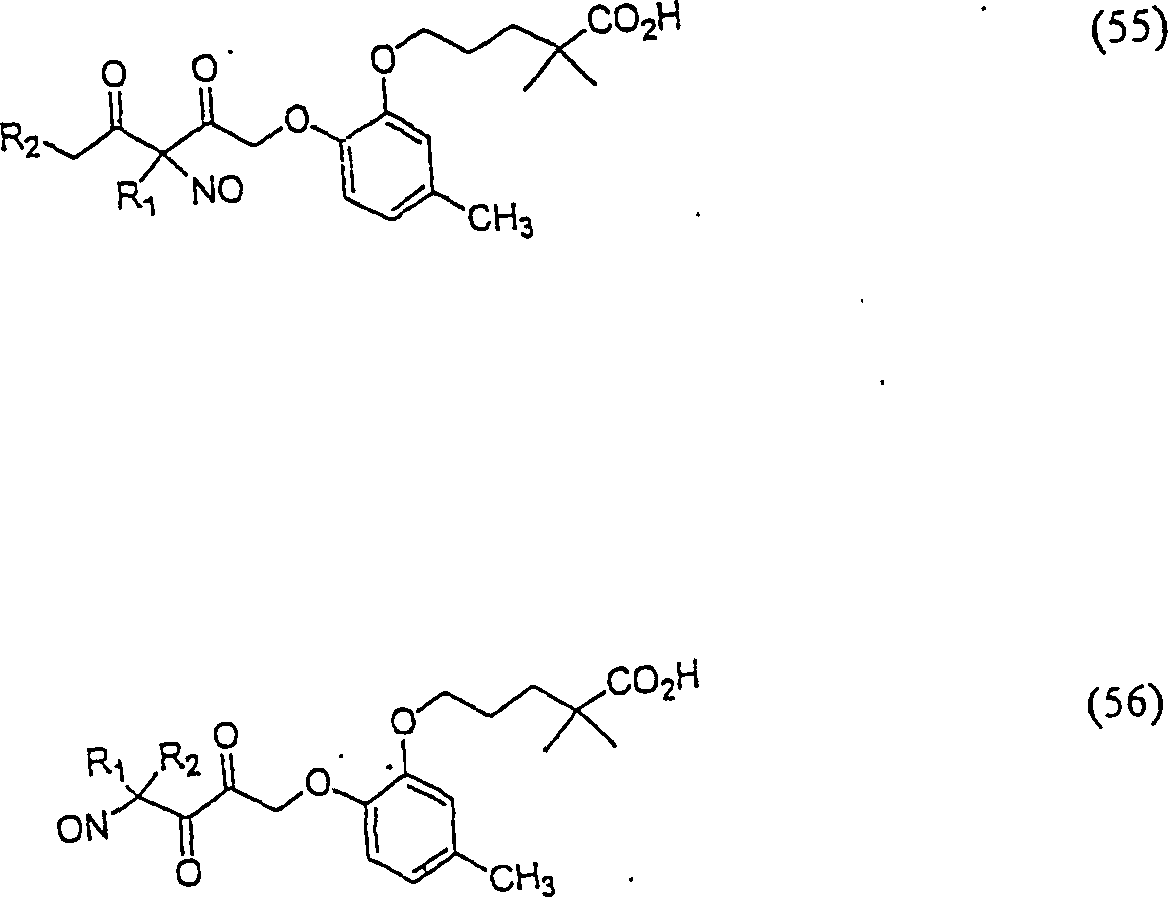
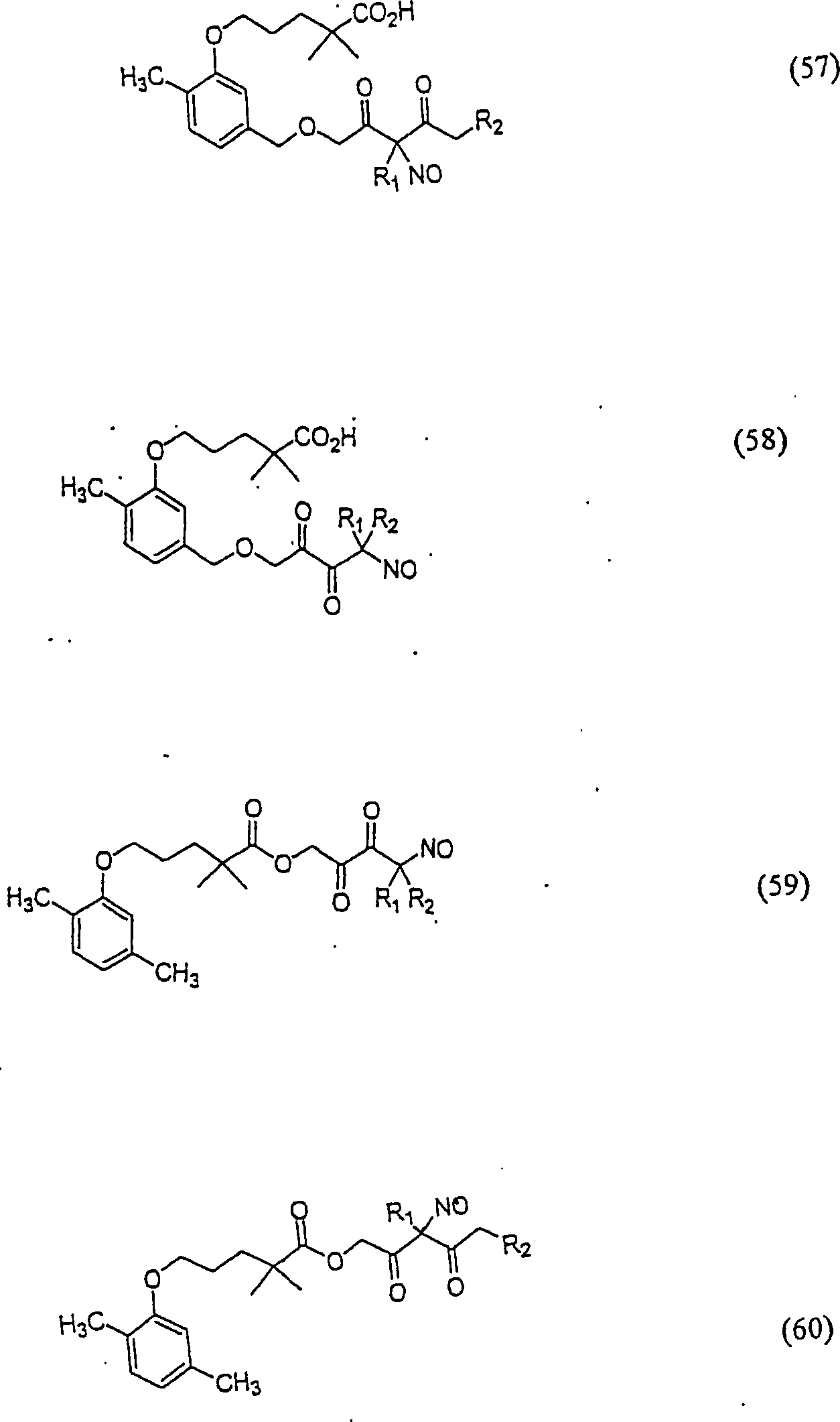
C-Nitroso-Verbindungen
der Erfindung hierin, die von Gemfibrozil abgeleitet sind, umfassen
beispielsweise:
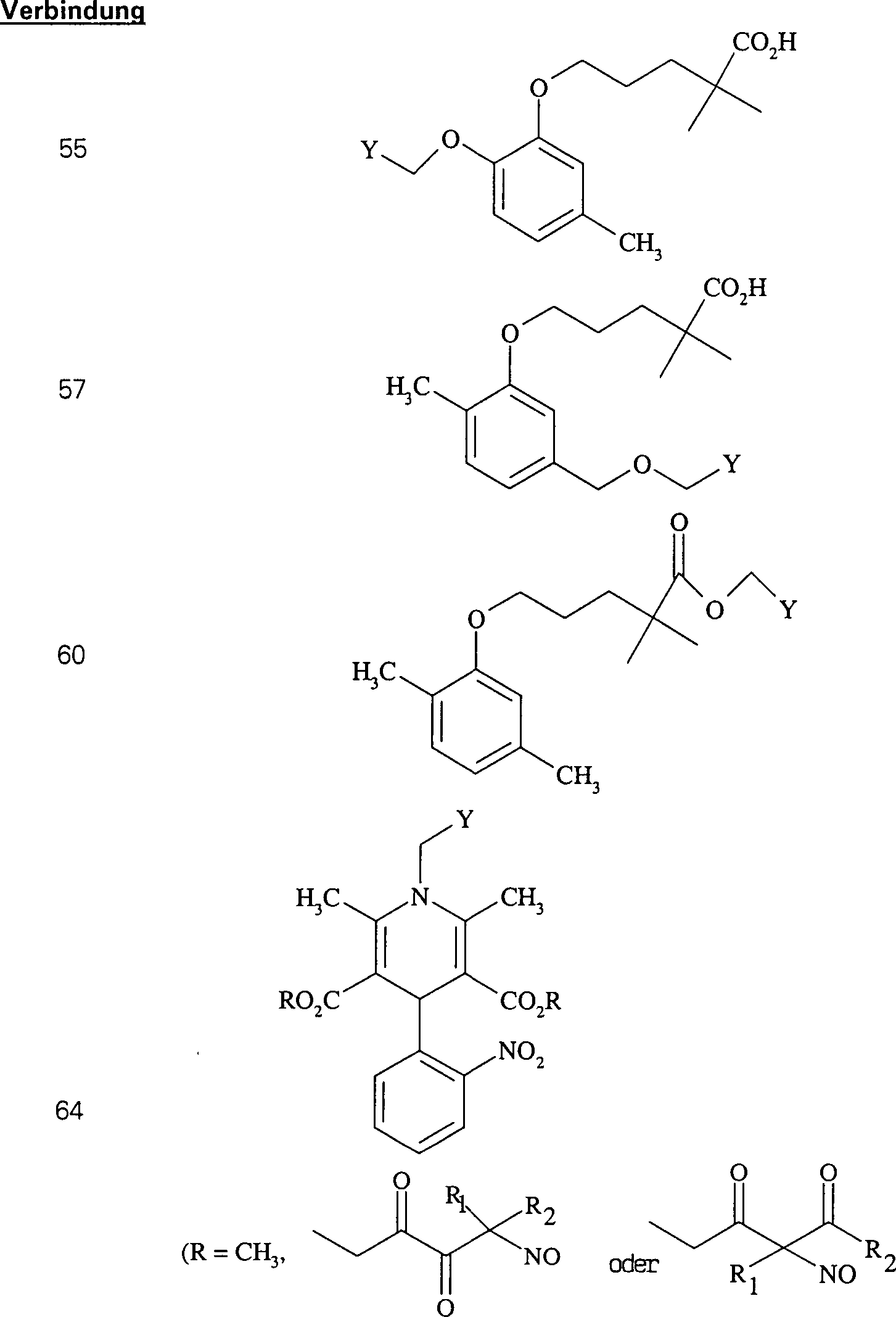
-
In
(55), (56), (57), (58), (59) und (60) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und
C6-C20-Aryl und
substituierten Derivaten davon, z. B. substituiert mit Amino, Hydroxyl
und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
Das
gegen Hypercholesterinämie/Hyperlipoproteinämie wirkende
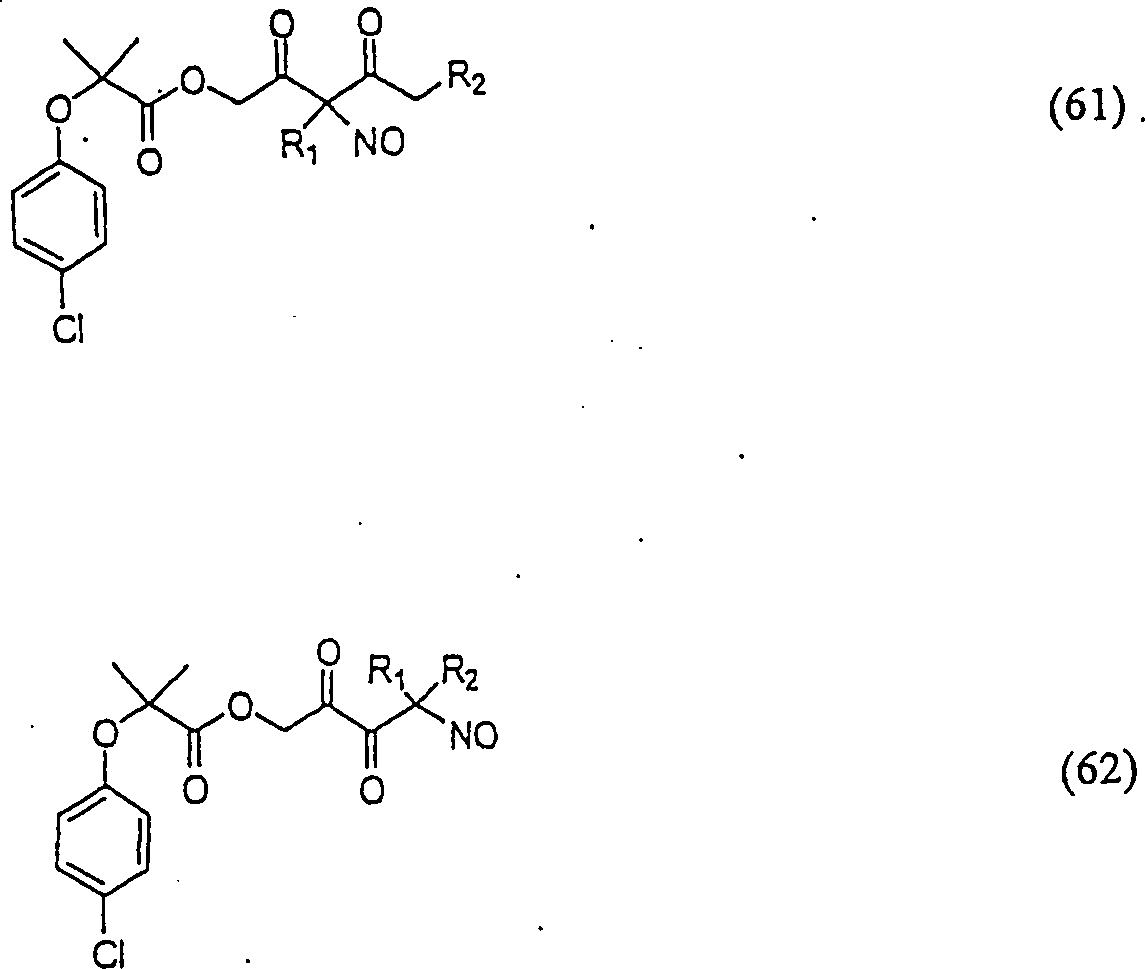
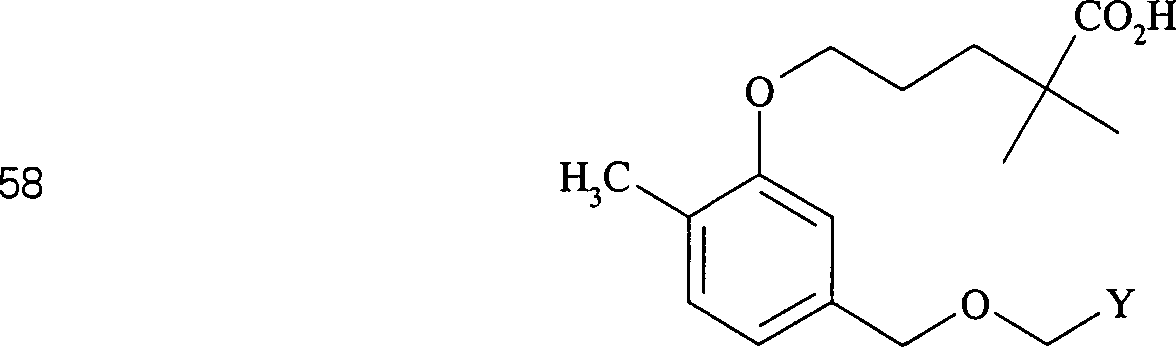
Clofibrat hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Clofibrat abgeleitet sind, umfassen
beispielsweise:
-
In
(61) und (62) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
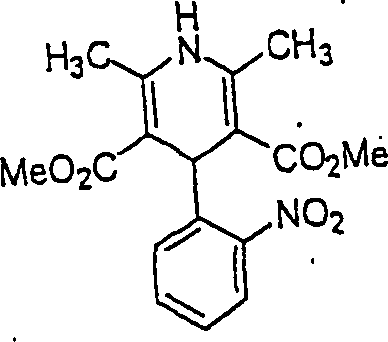
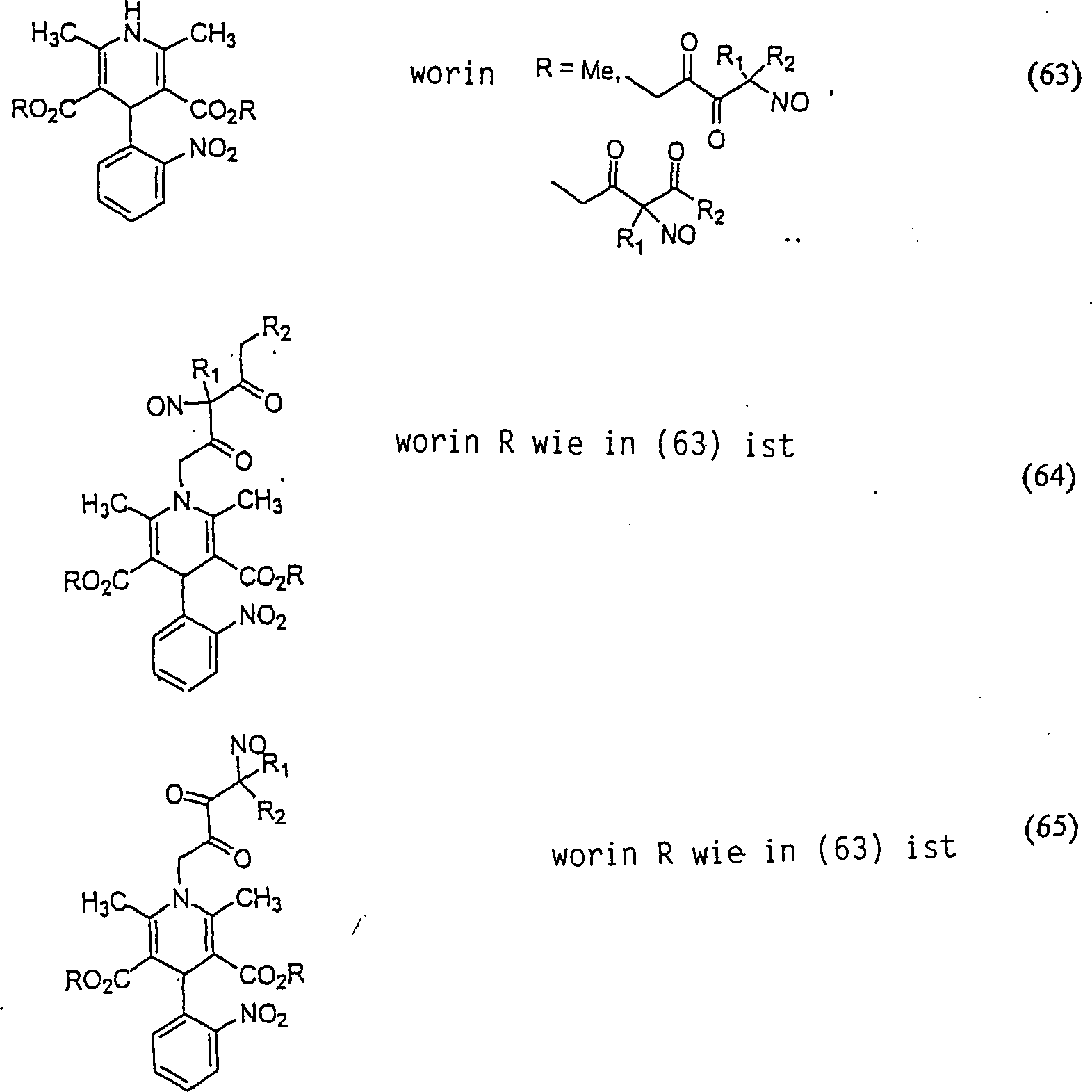
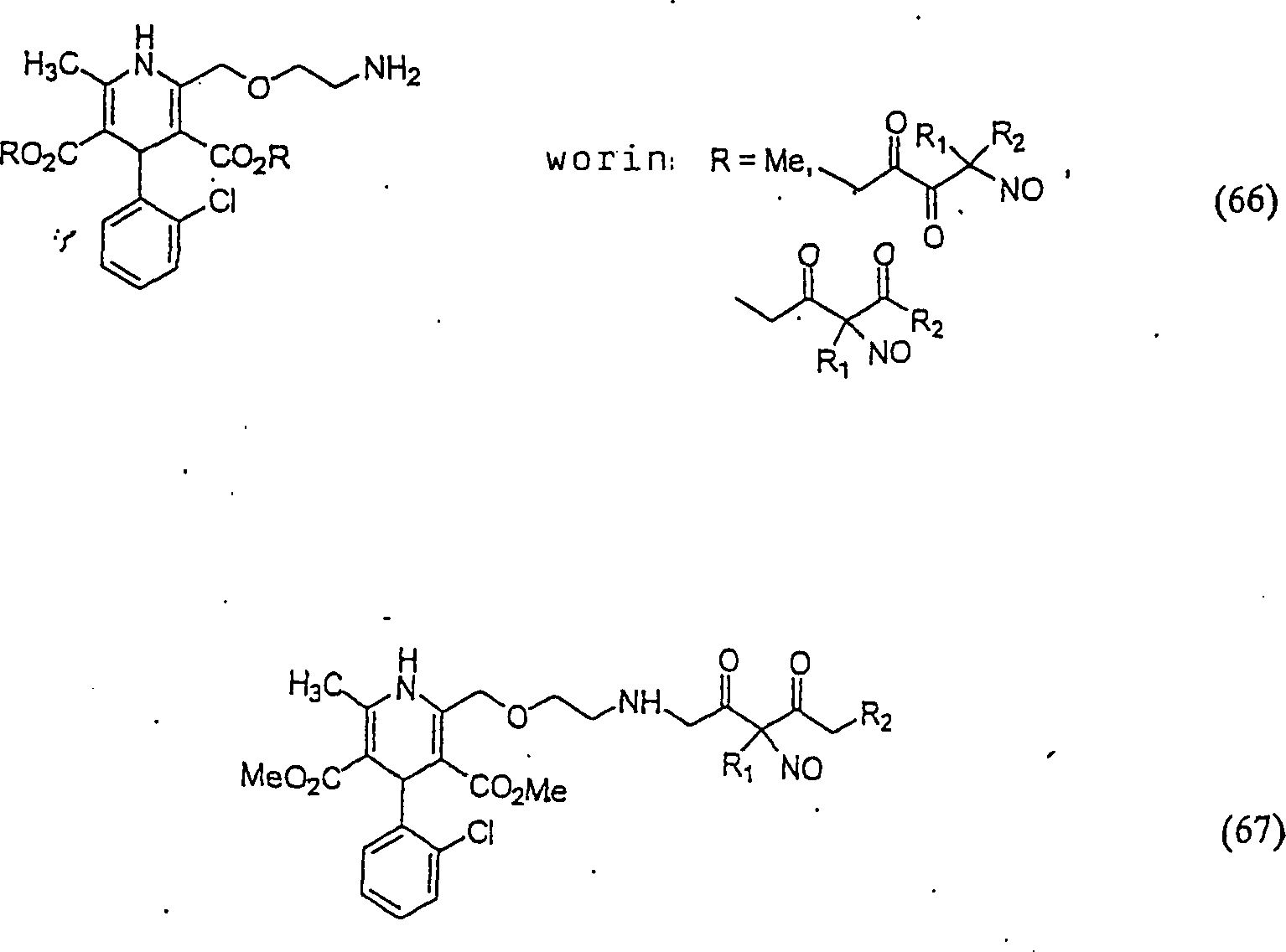
Der
Calciumkanal-Blocker Nifedipin hat die Formel:
-
C-Nitroso-Verbindungen,
die von Nifedipin abgeleitet sind, umfassen beispielsweise:
-
In
(63), (64) und (65) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
Der
Calciumkanal-Blocker Amlodipin hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Amlodipin abgeleitet sind, umfassen
beispielsweise:
-
In
(66), (67), (68), (69) und (70) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
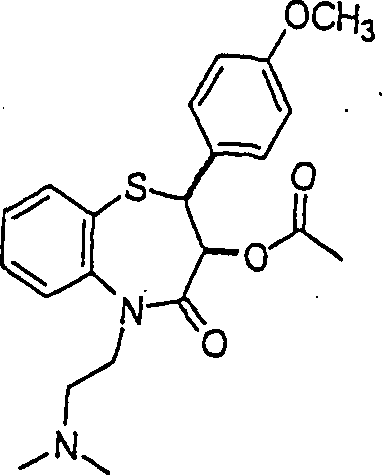
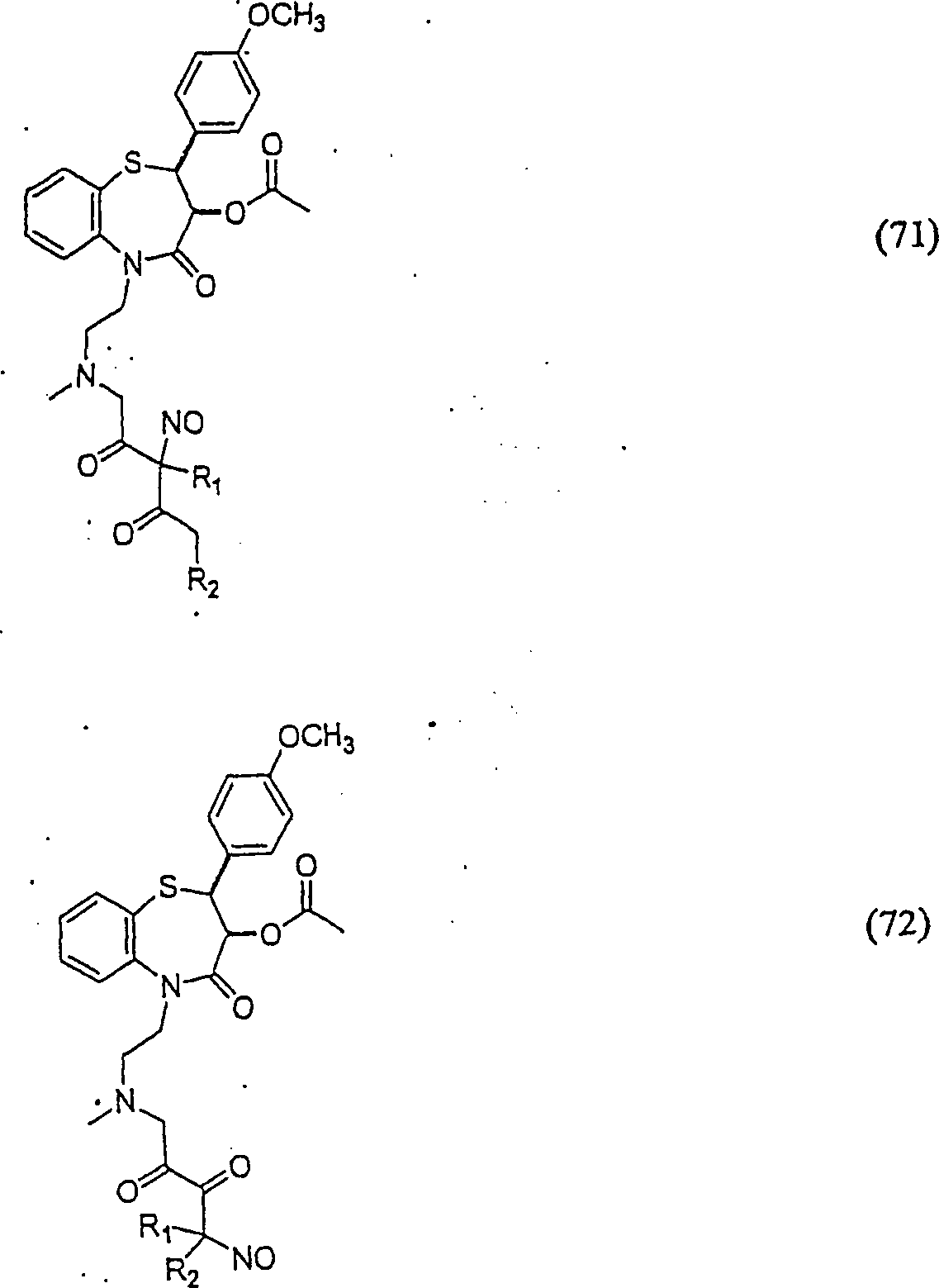
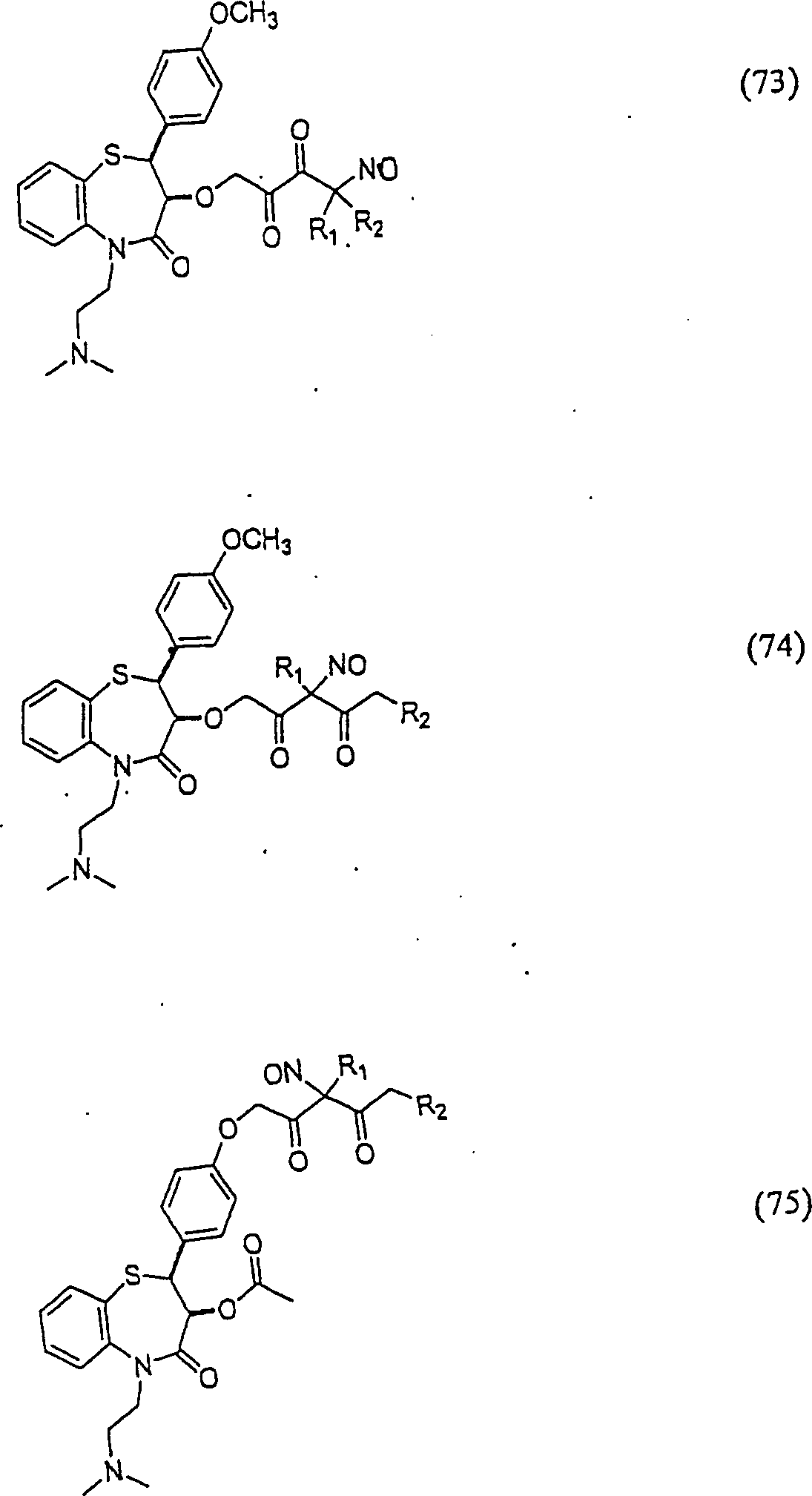
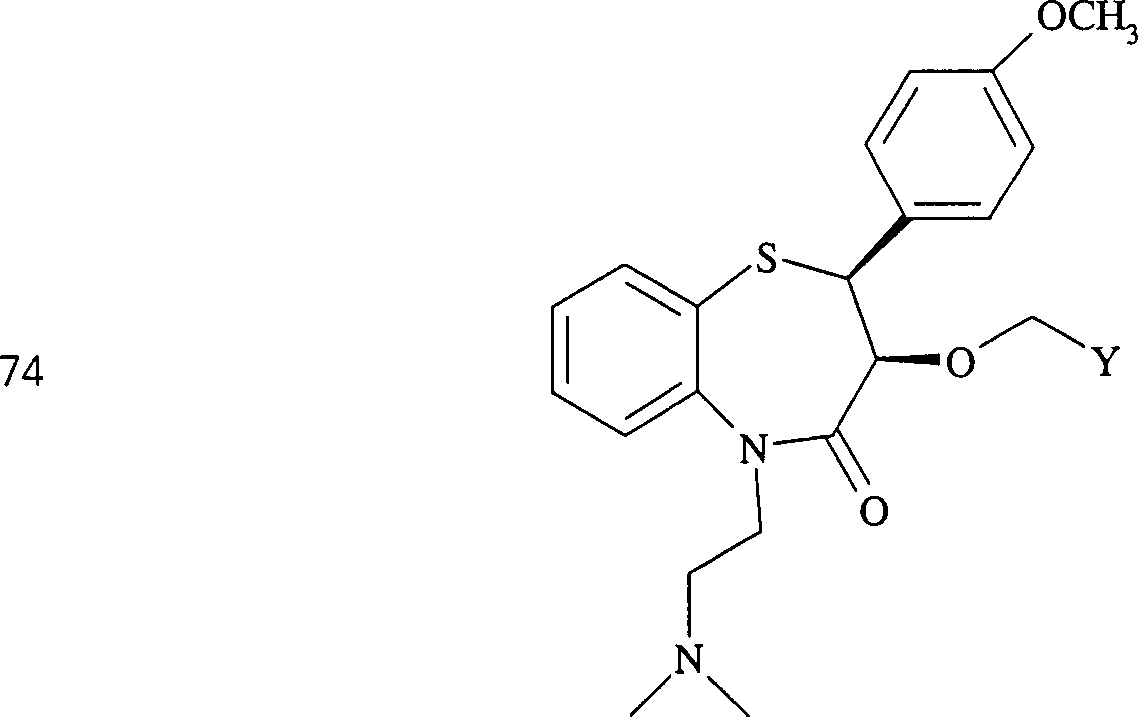
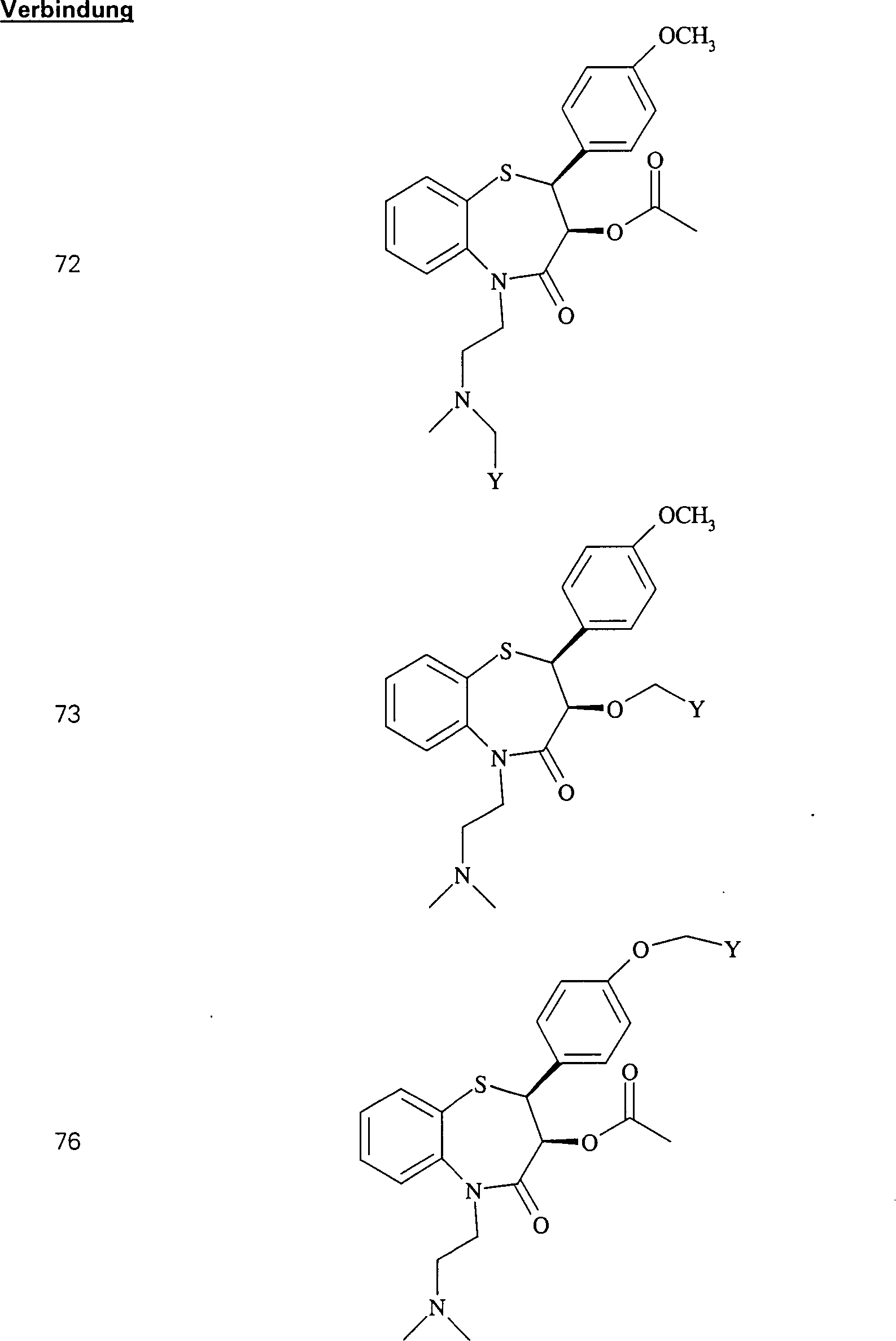
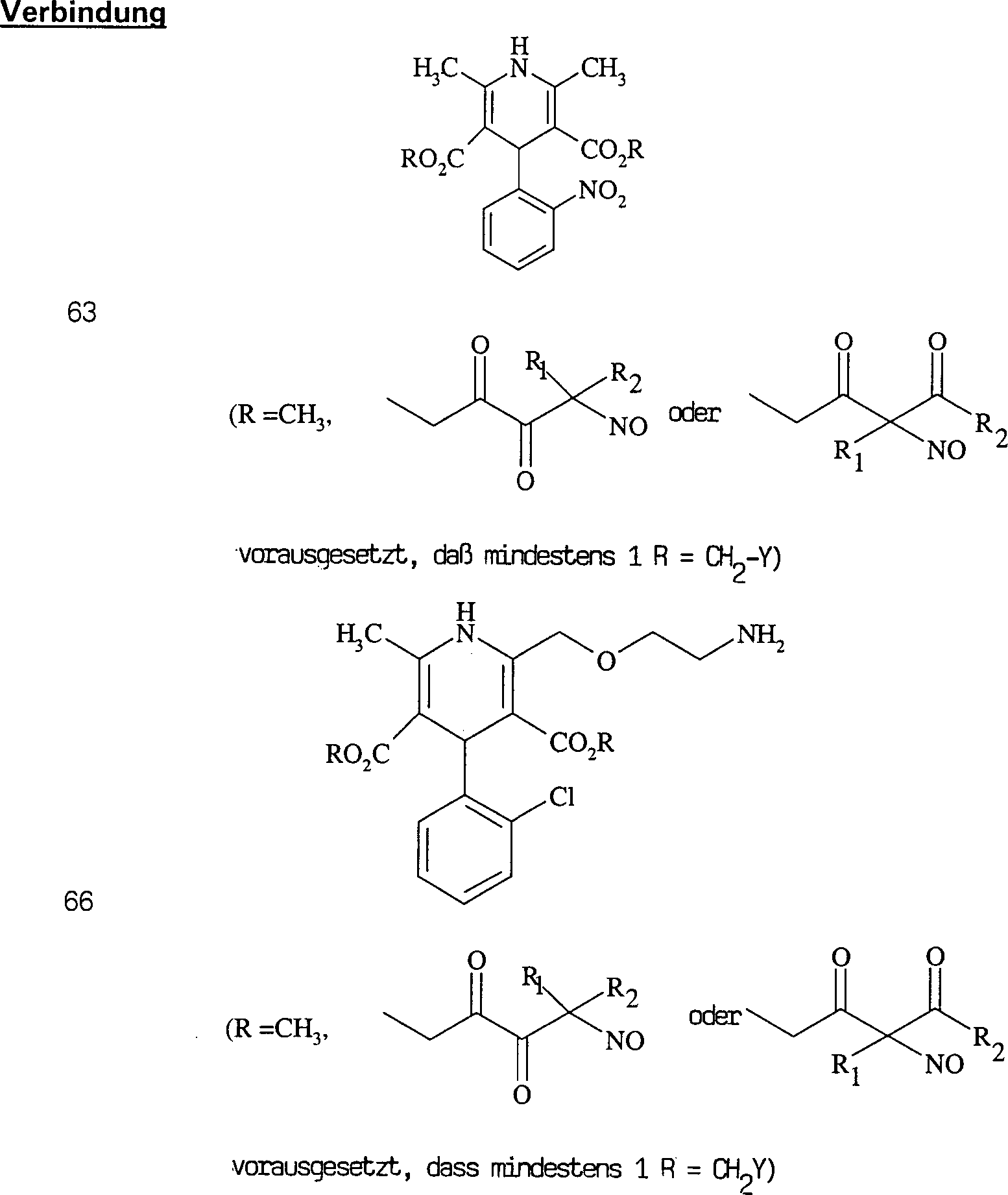
Der
Calciumkanal-Blocker Diltiazem hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Diltiazem abgeleitet sind, umfassen
beispielsweise:
-
In
(71), (72), (73), (74), (75) und (76) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und
C6-C20-Aryl und
substituierten Derivaten davon, z. B. substituiert mit Amino, Hydroxyl
und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
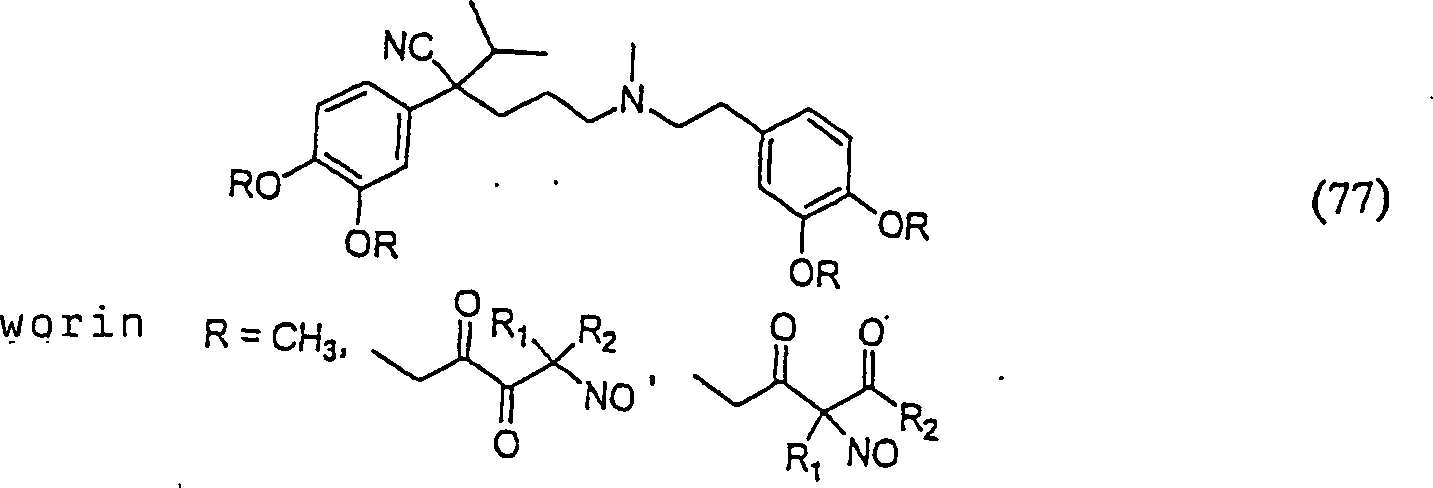
Der
Calciumkanal-Blocker Verapamil hat die Formel:
-
C-Nitroso-Verbindungen,
der Erfindung hierin, die von Verapamil abgeleitet sind, umfassen
beispielsweise:
Worin
R derselbe wie für
(77) ist
worin
R derselbe wie für
(77) ist
-
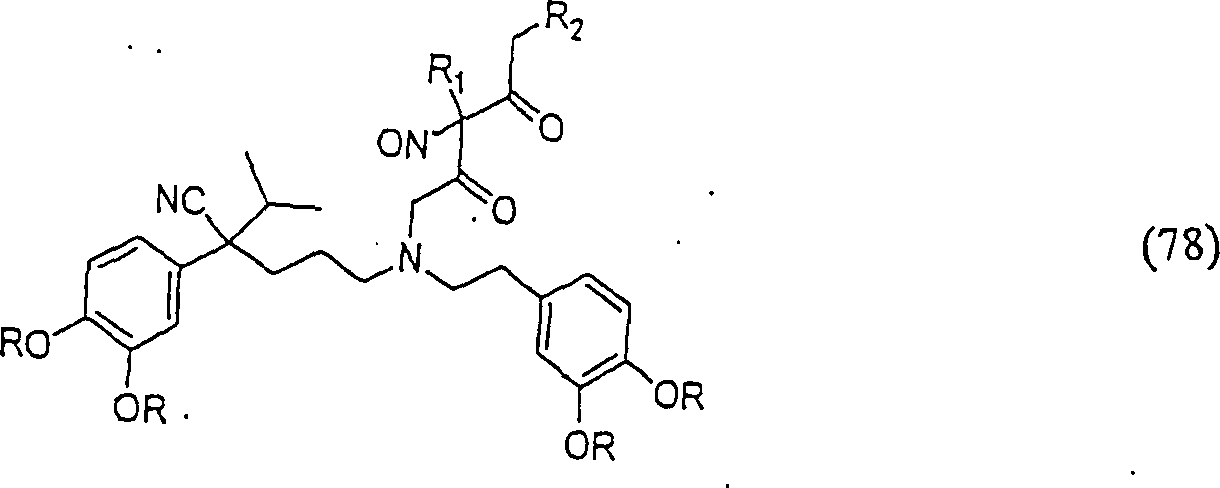
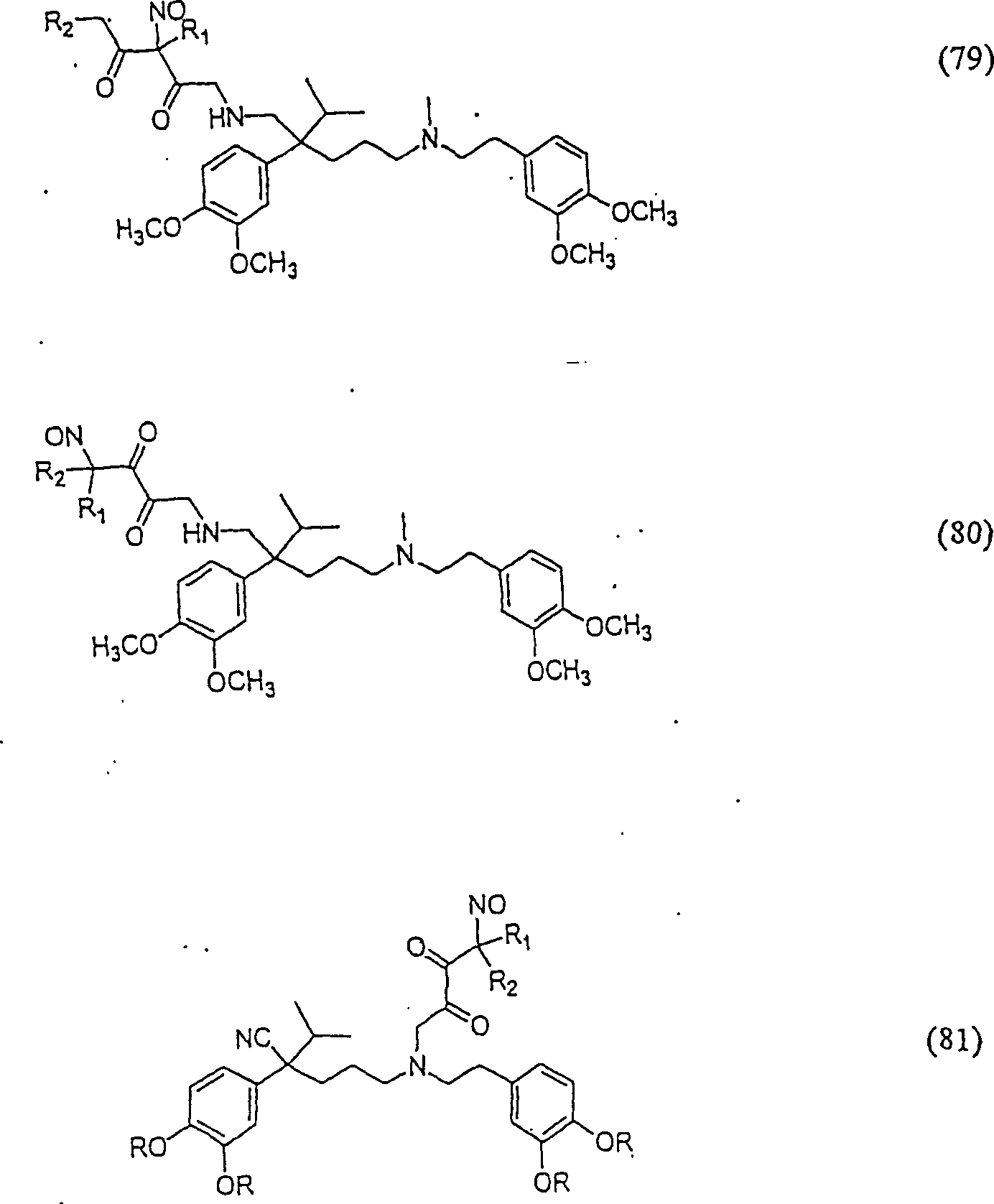
In
(77), (78), (79), (80) und (81) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
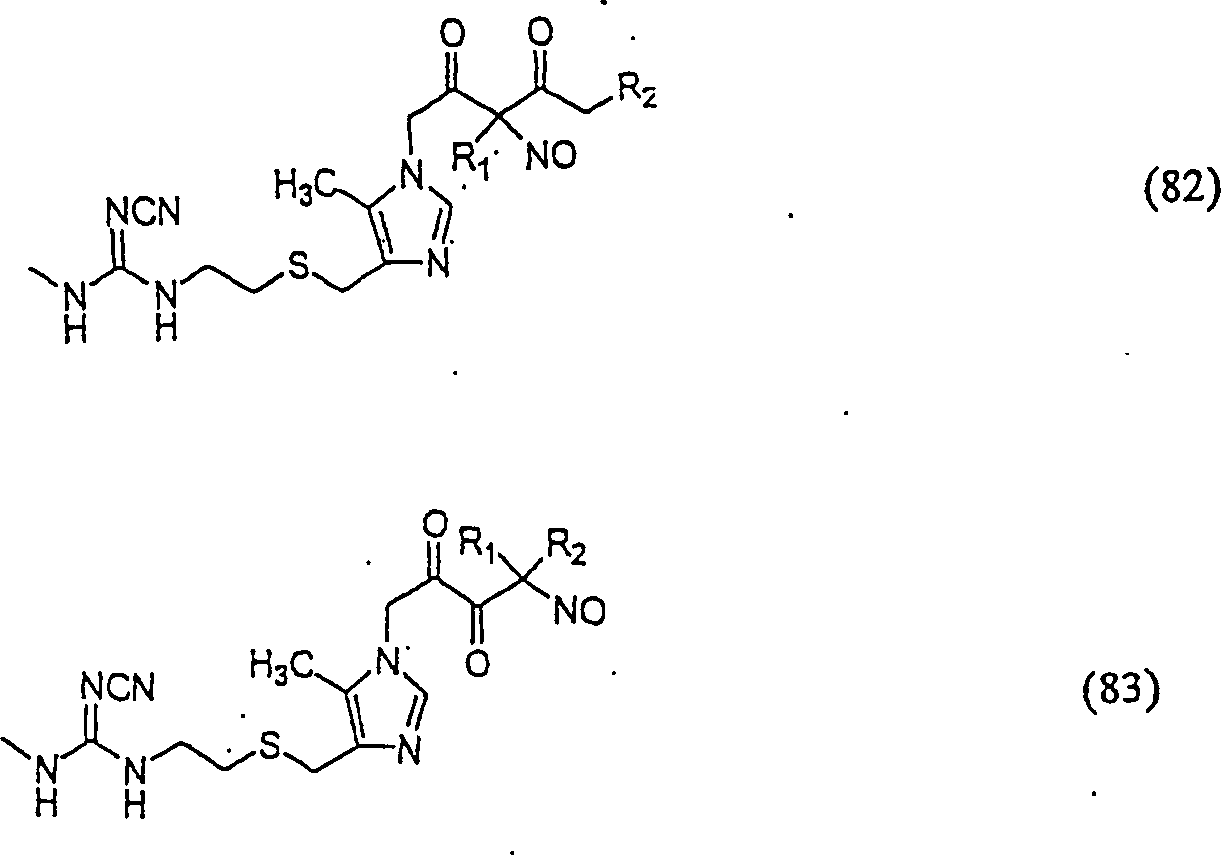
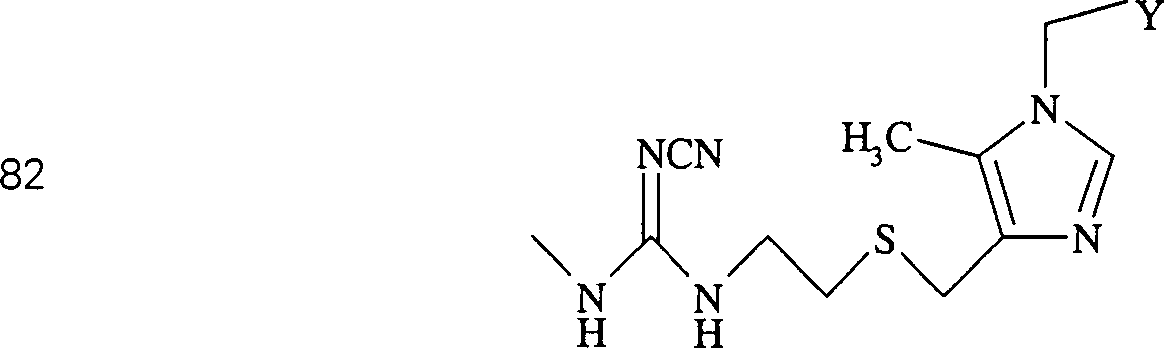
Das
säureneutralisierende
Cimetidin hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Cimetidin abgeleitet sind, umfassen
beispielsweise:
-
In
(82) und (83) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
Das
säureneutralisierende
Ranitidin hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Ranitidin abgeleitet sind, umfassen
beispielsweise:
-
In
(84) und (85) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
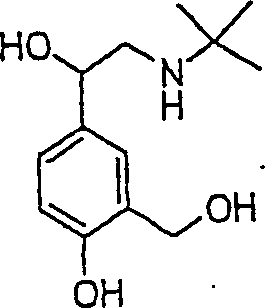
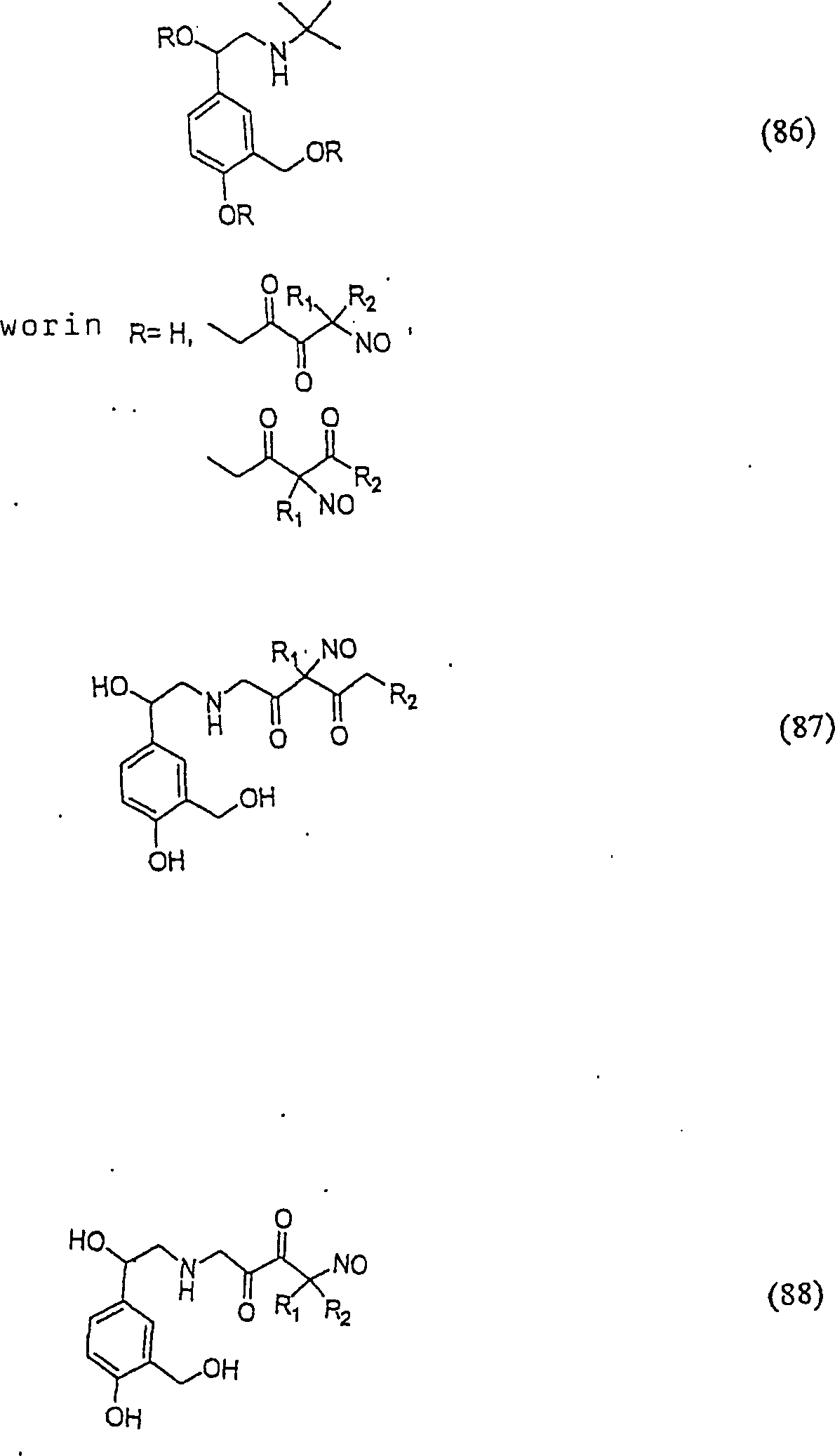
Der
Bronchodilatatoral Abuterol hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Albuterol abgeleitet sind, umfassen
beispielsweise:
-
In
(86), (87) und (88) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
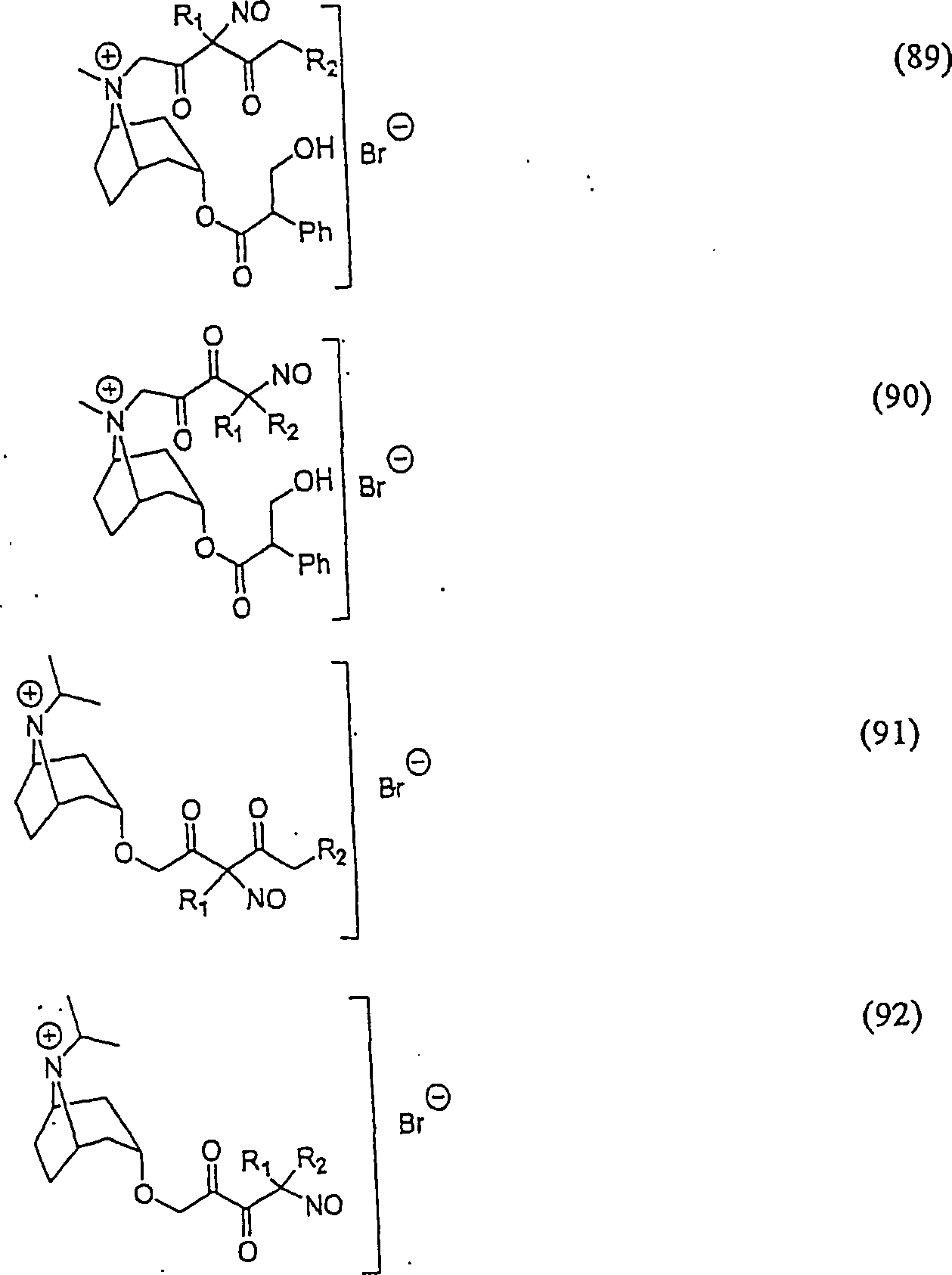
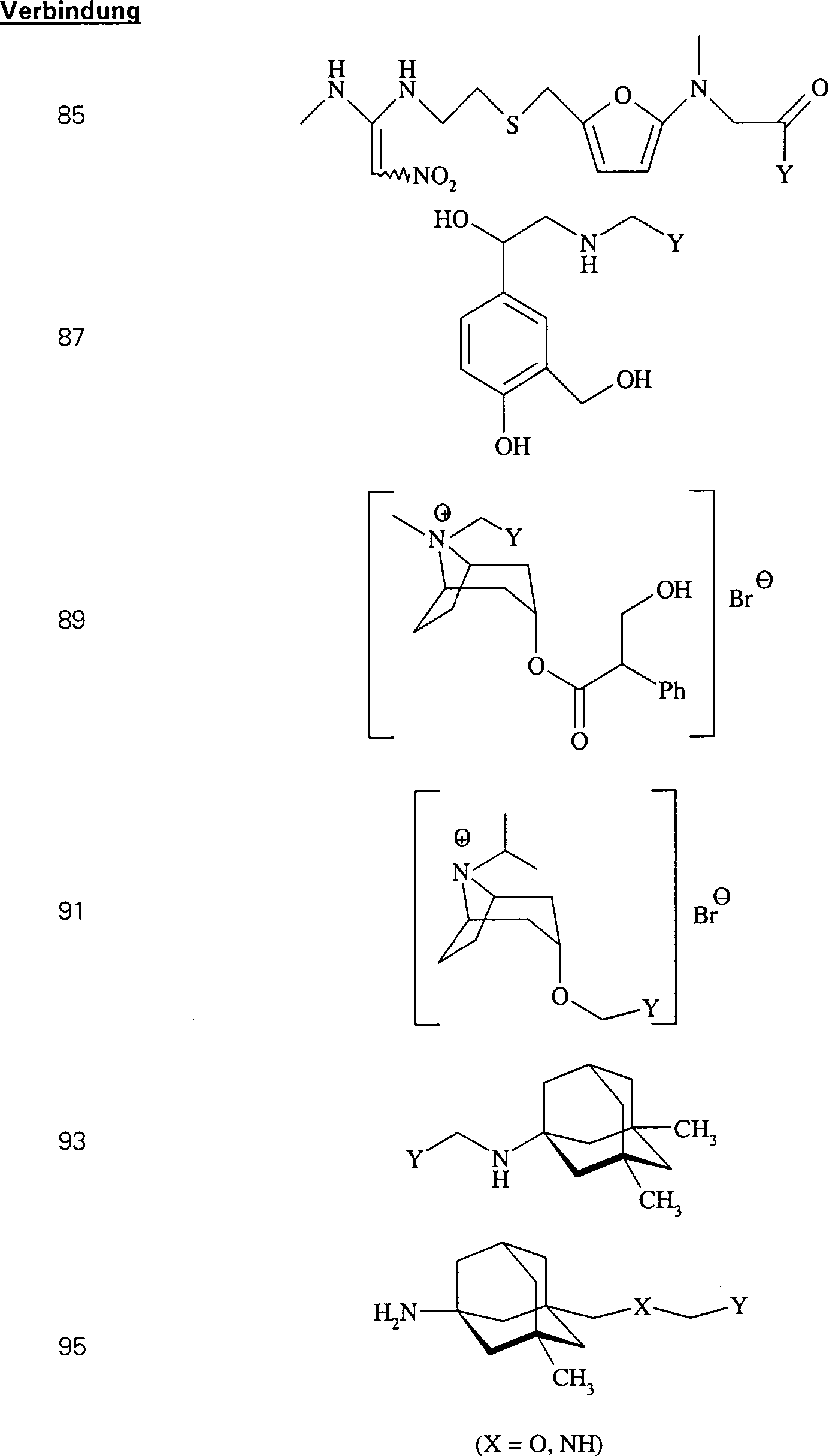
Der
Bronchodilatator Ipratropiumbromid hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von Ipratropiumbromid abgeleitet sind,
umfassen beispielsweise:
-
In
(89), (90), (91) und (92) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
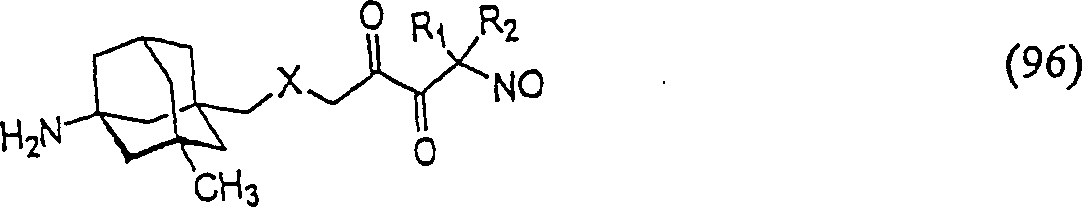
Das
NMDA-antagonistische/skelettmuskelentspannende Memantin hat die
Formel:
-
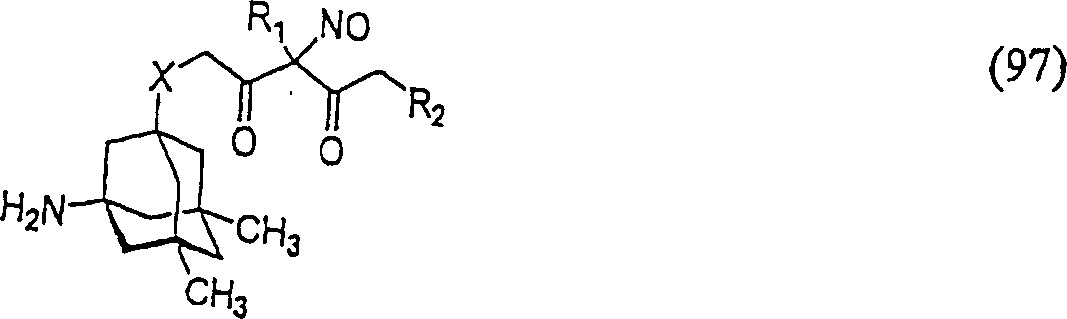
C-Nitroso-Verbindungen
der Erfindung hierin, die von Memantin abgeleitet sind, umfassen
beispielsweise:
worin X wie in (95) ist
worin X wie in (95) ist
-
In
(93), (94), (95), (96) und (97) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
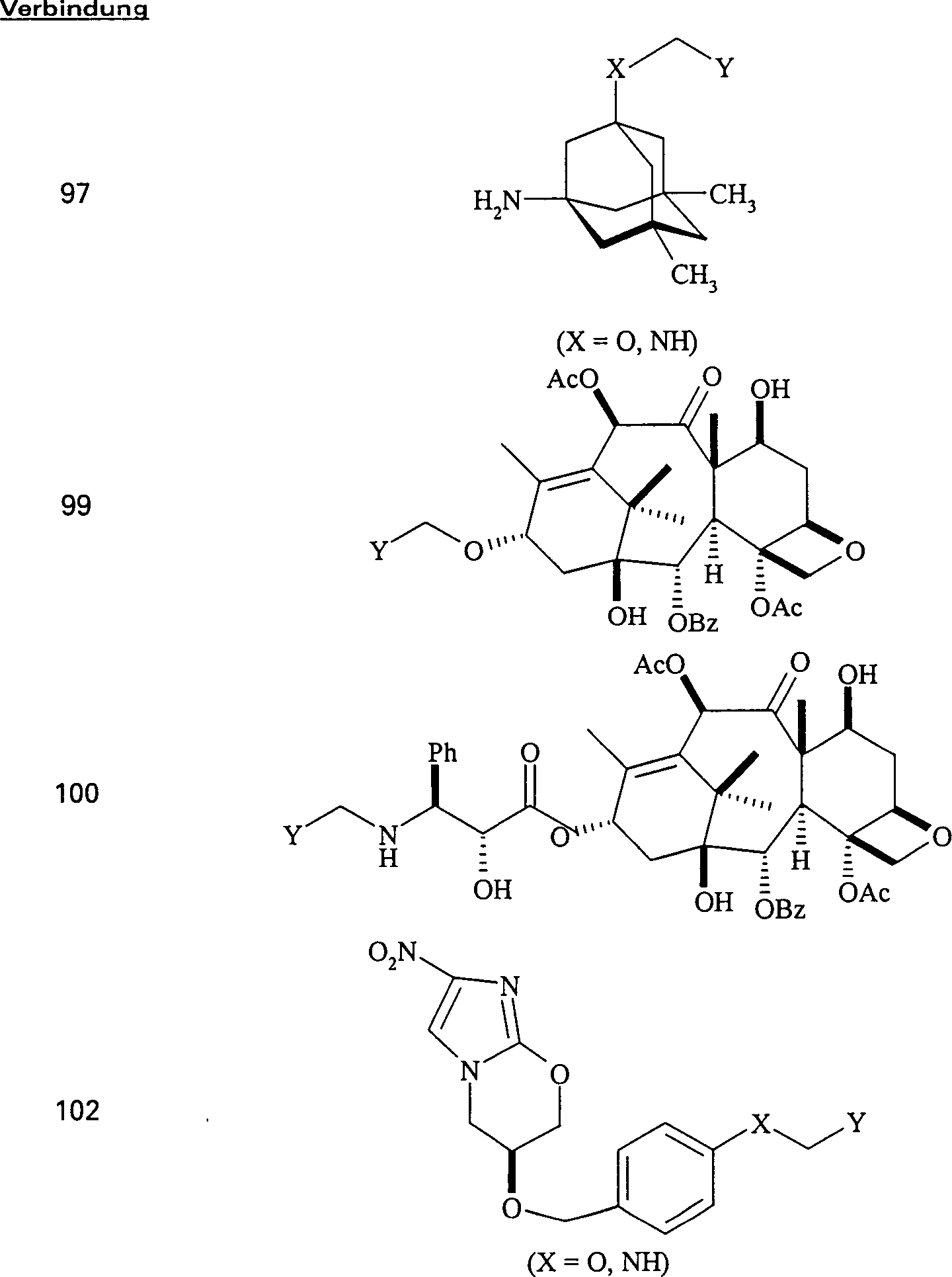
C-Nitroso-Derivate
von Mitteln gegen Proliferation sind besonders nützlich, da die NO-Gruppe eine Wirkung
gegen Proliferation hat und diejenige des Mittels vor der NO-Derivatisierung
erhöht.
-
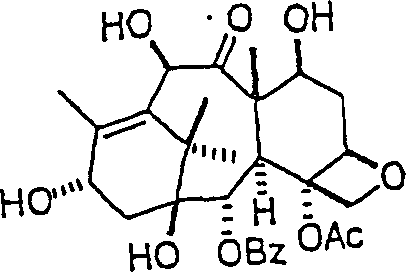
Das
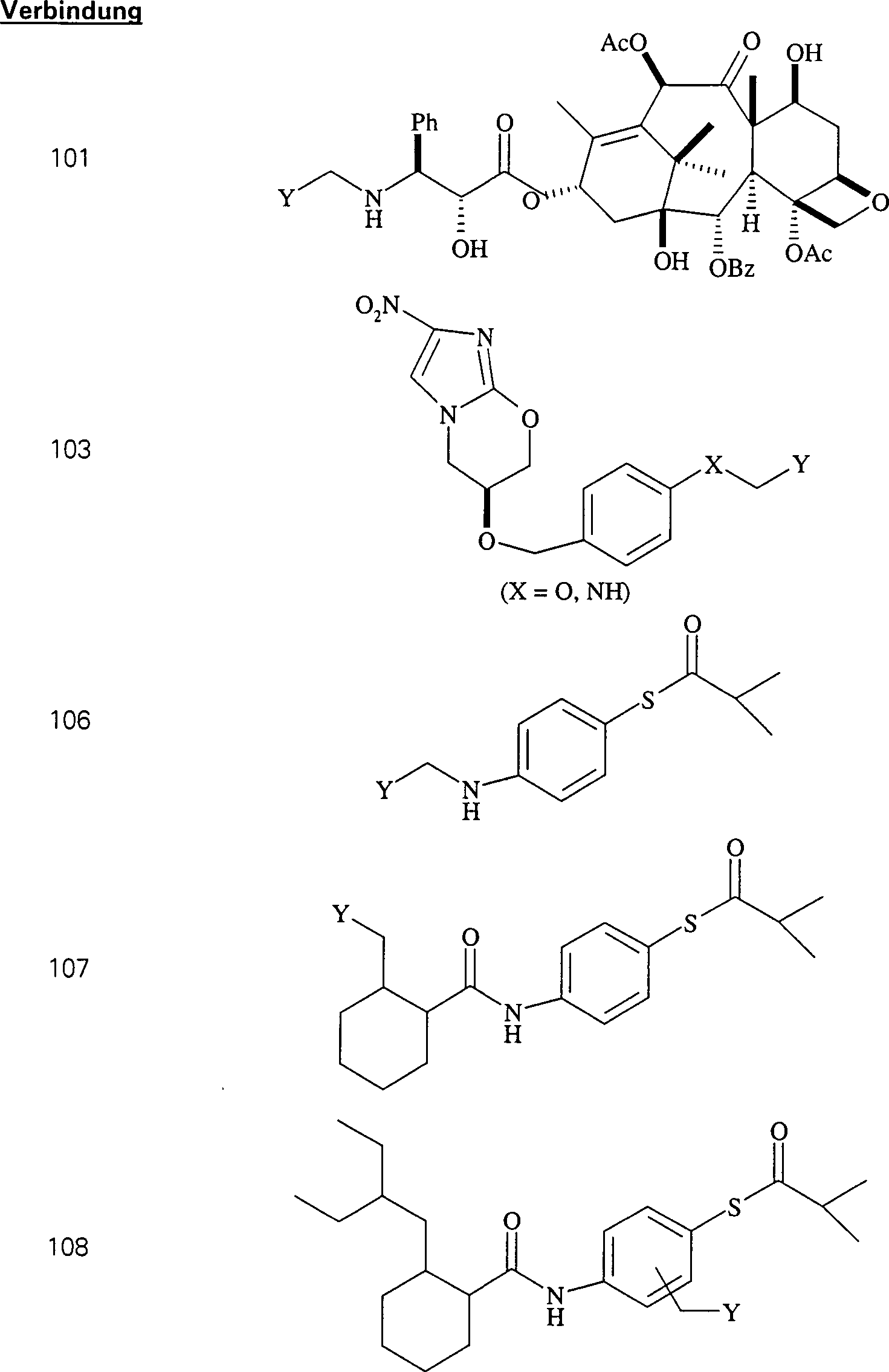
gegen Proliferation wirkende/Tubulin bindende Mittel 10-Deacetylbaccatin
III hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die Derivate von 10-Deacetylbaccatin III sind,
umfassen beispielsweise:
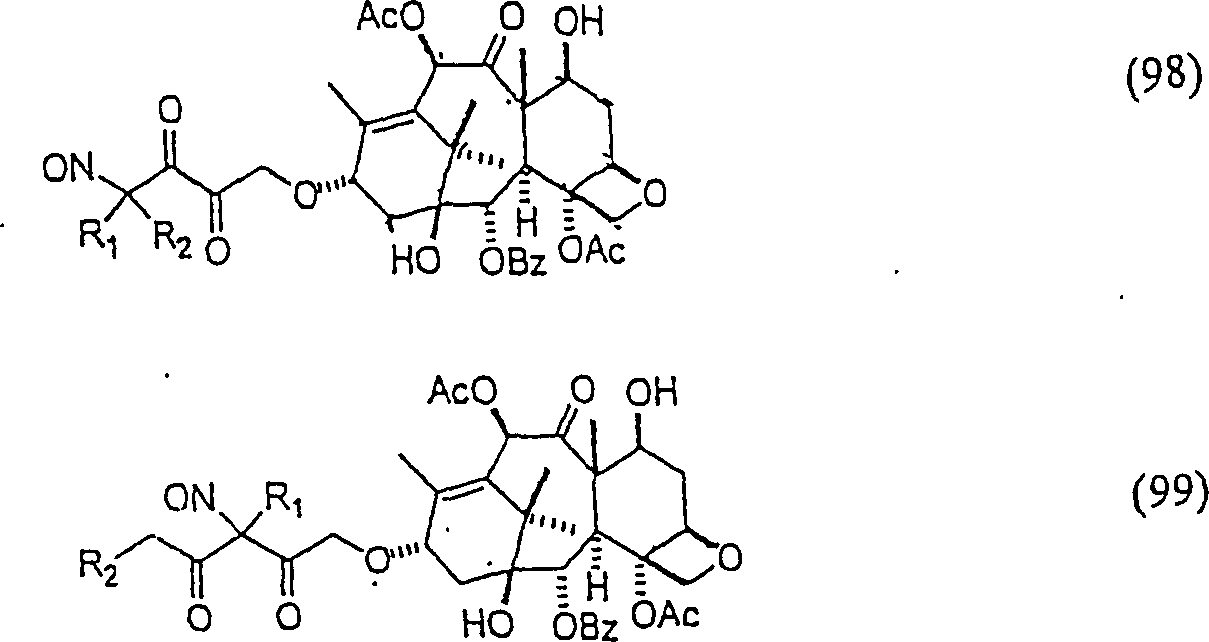
-
In
(98) und (99) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
Das
gegen Proliferation wirkende/Tubulin bindende Mittel Taxol hat die
Formel:
-
C-Nitroso-Verbindungen
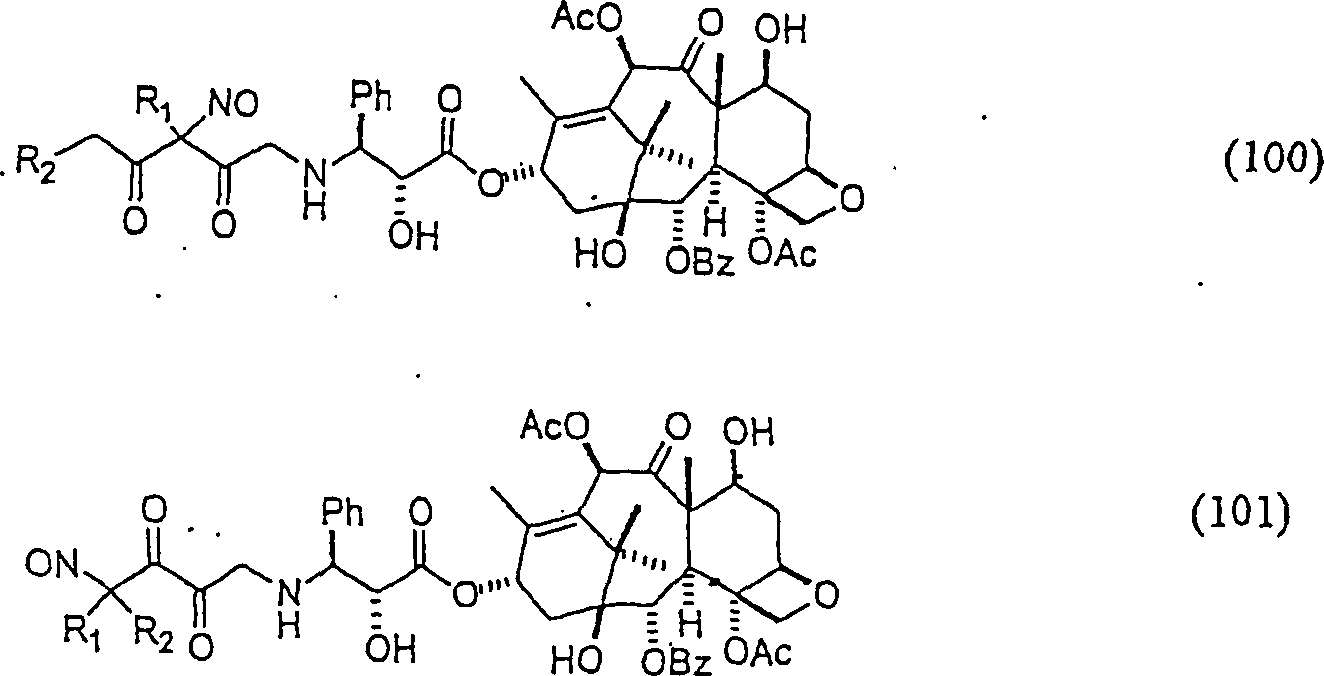
der Erfindung hierin, die von Taxol abgeleitet sind, umfassen beispielsweise:
-
In
(100) und (101) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
Das
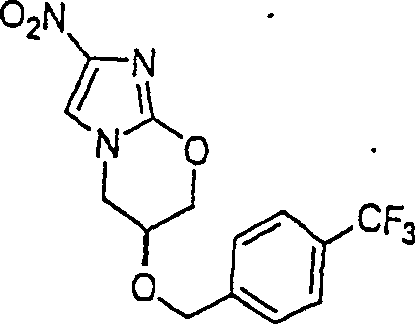
gegen Tuberkeln wirkende PA-824 hat die Formel:
-
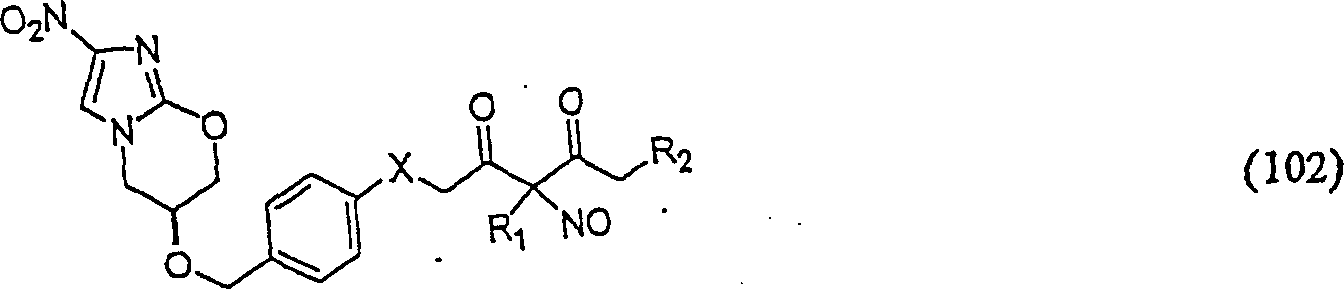
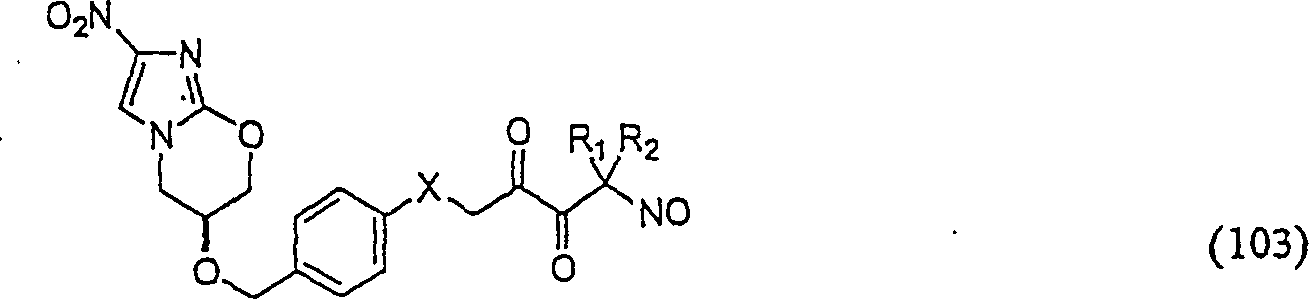
C-Nitroso-Verbindungen
der Erfindung hierin, die von PA-824 abgeleitet sind, umfassen beispielsweise:
X = O,
NH
X = O,
NH
-
In
(102) und (103) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
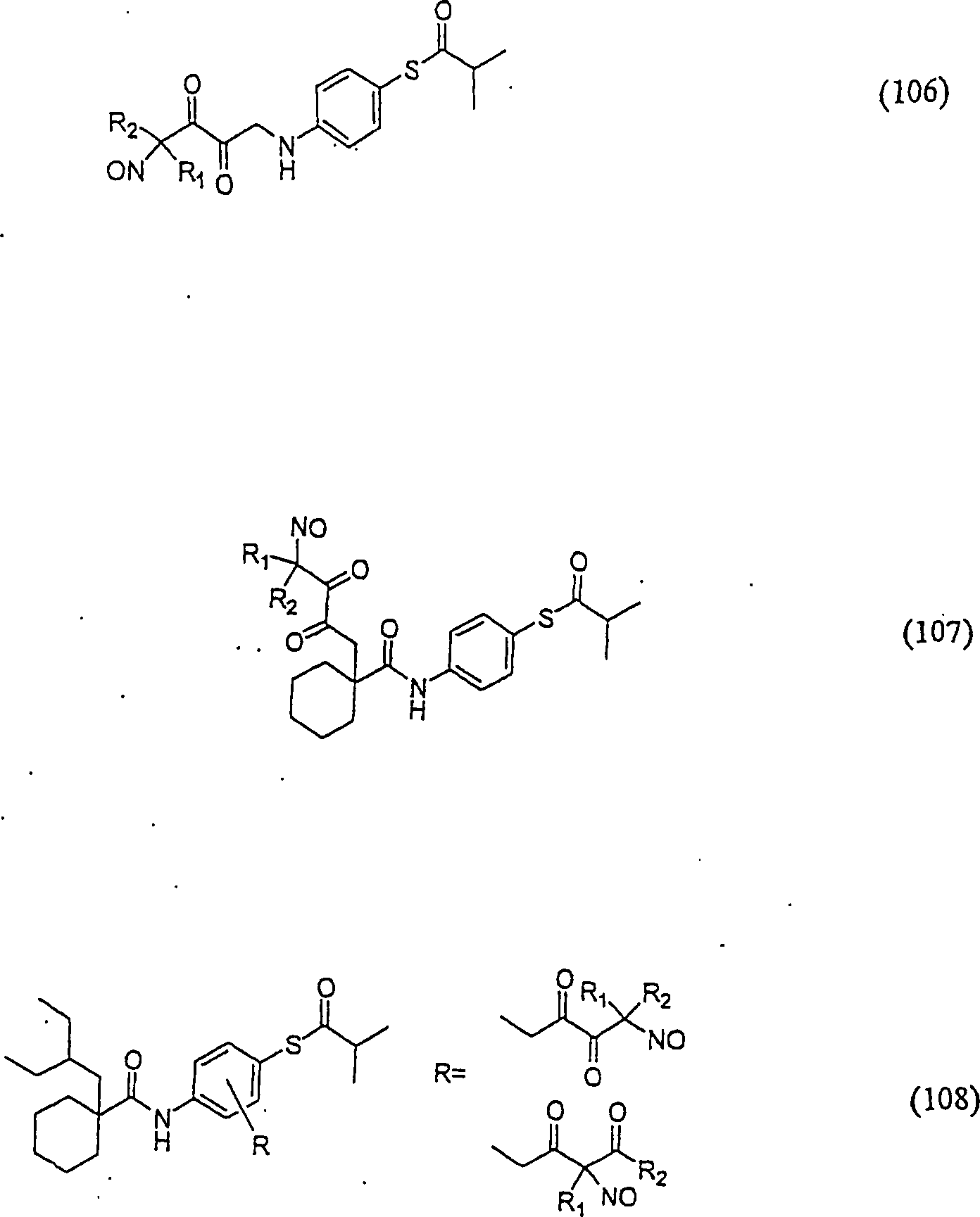
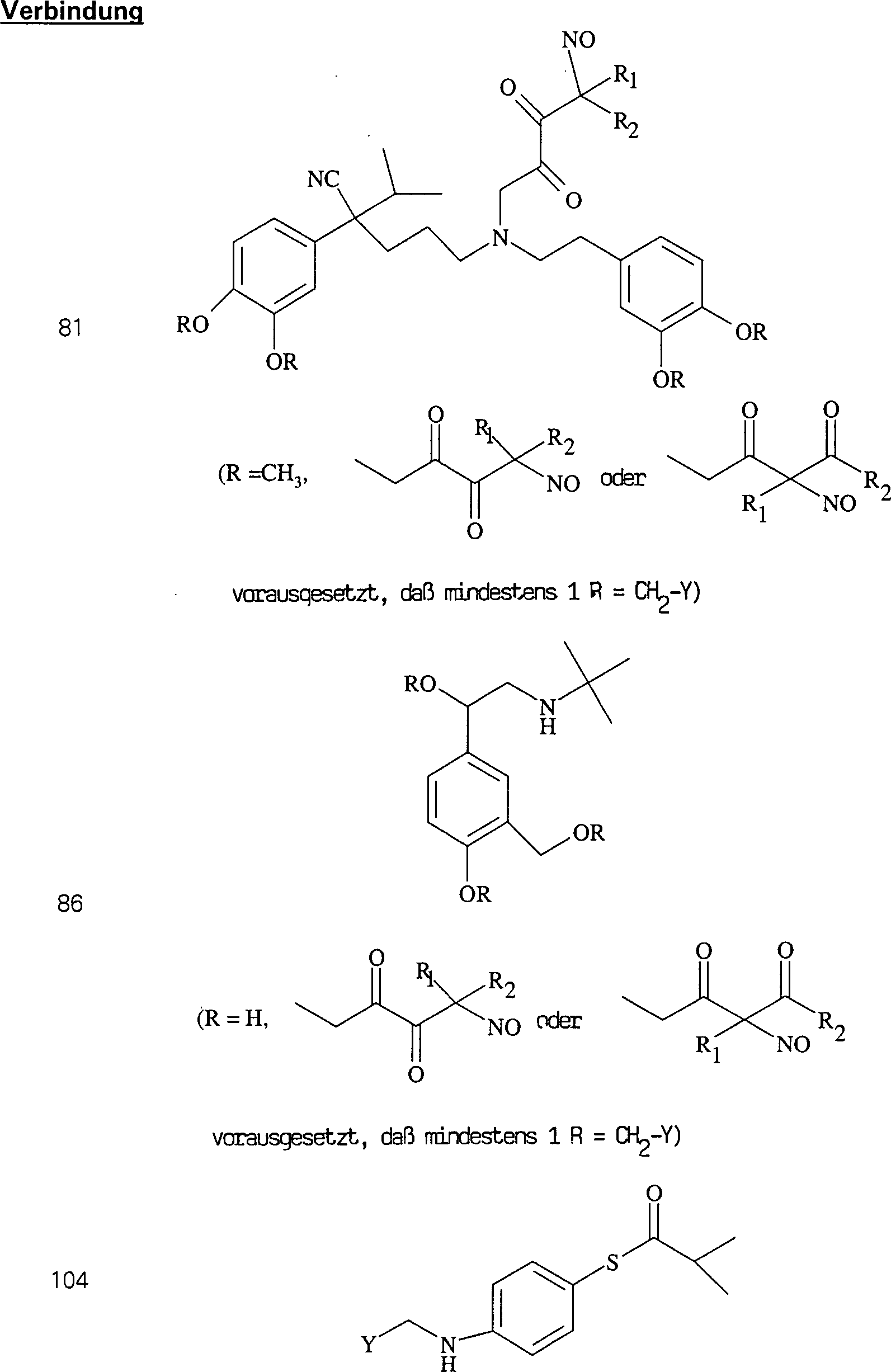
Der
CETP-Inhibitor JTT-705 (Okamoto et al., Nature 406, 203 (2000))
hat die Formel:
-
C-Nitroso-Verbindungen
der Erfindung hierin, die von JTT-705 abgeleitet sind, umfassen
beispielsweise:
-
In
(104), (105), (106), (107) und (108) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und
C6-C20-Aryl und
substituierten Derivaten davon, z. B. substituiert mit Amino, Hydroxyl
und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
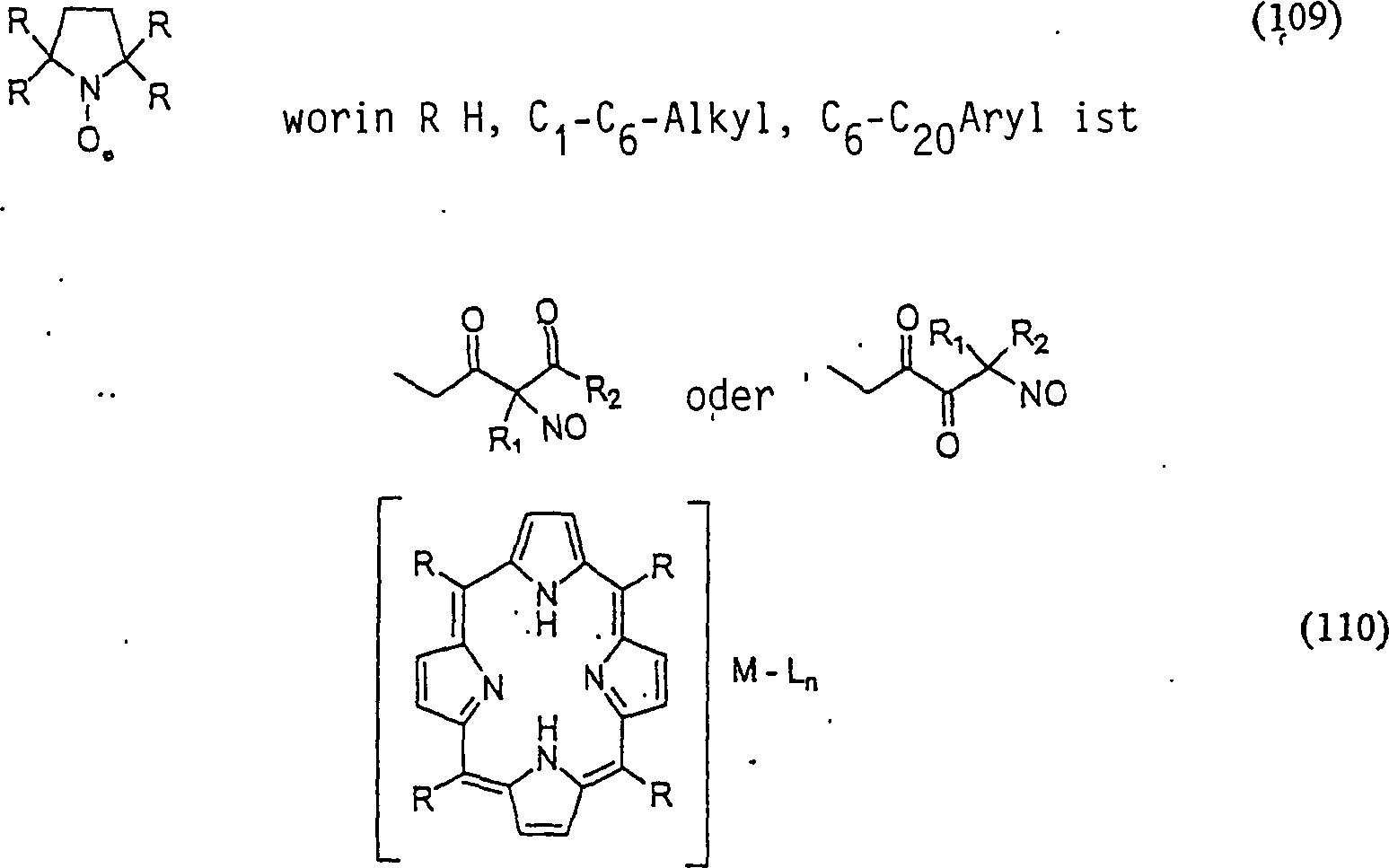
C-Nitroso-Verbindungen,
die von SOD-Mimetika abgeleitet sind, umfassen beispielsweise:
worin
M beispielsweise Mangan, Eisen oder Kobalt ist, L Halogenid ist,
n in Abhängigkeit
von der Wertigkeit von M im Bereich von 0 bis 4 liegt, und R wie
in (109) ist.
-
In
(109) und (110) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
Der
Xanthinoxidase-Inhibitor Allopurinol hat die Formel:
-
C-Nitroso-Verbindungen,
die von Allopurinol geleitet sind, umfassen beispielsweise:
-
In
(111), (112), (113) und (114) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
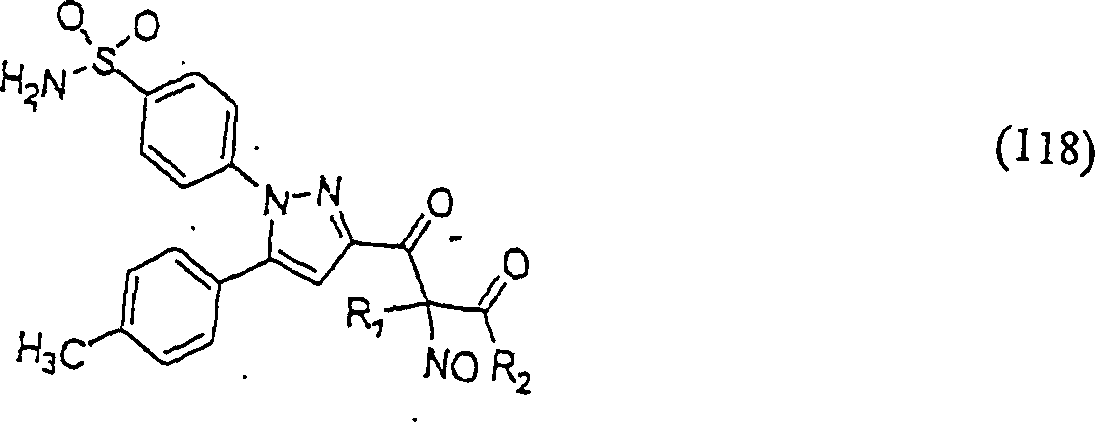
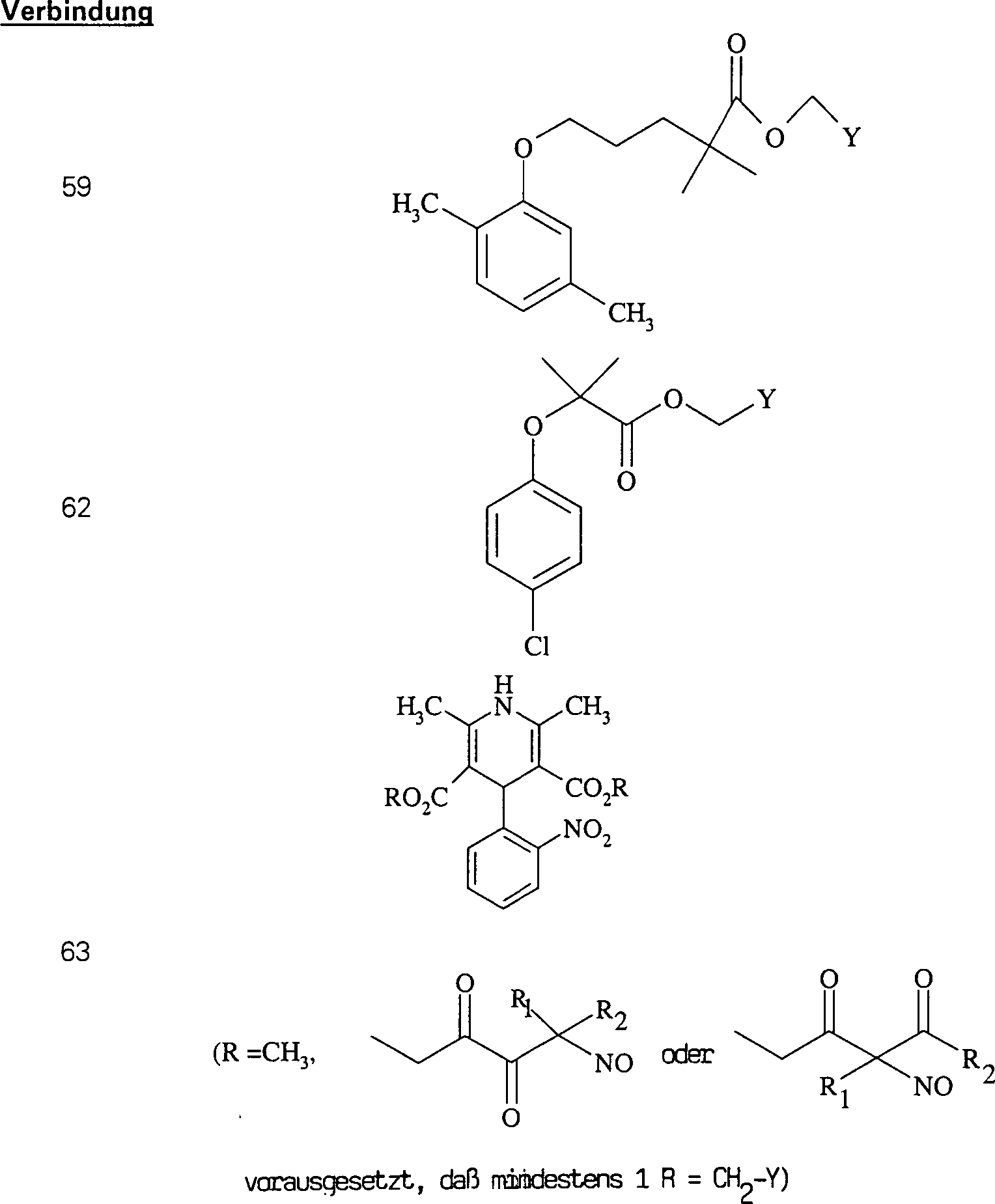
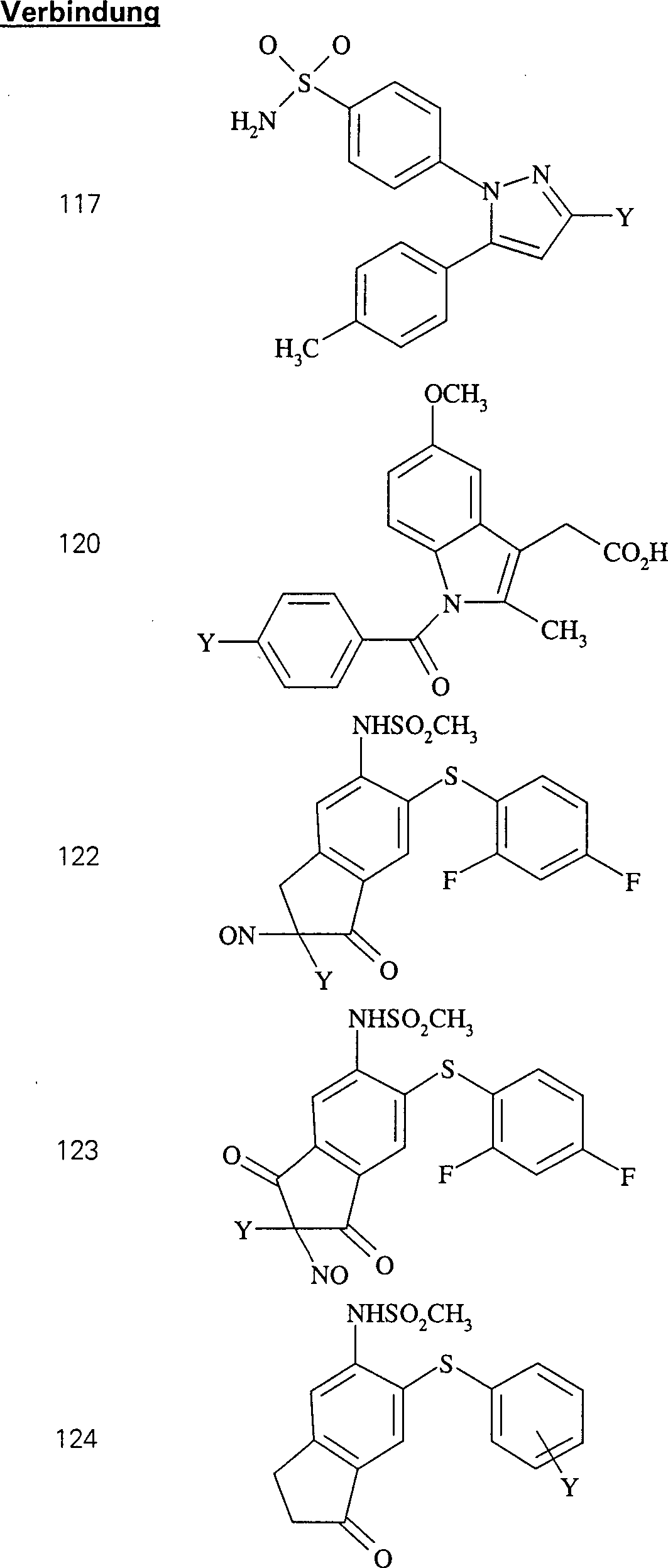
Der
COX-2-Inhibitor Celebrex hat die Formel:
-
C-Nitroso-Verbindungen,
die von Celebrex abgeleitet sind, umfassen beispielsweise:
-
In
(115), (116), (117) und (118) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
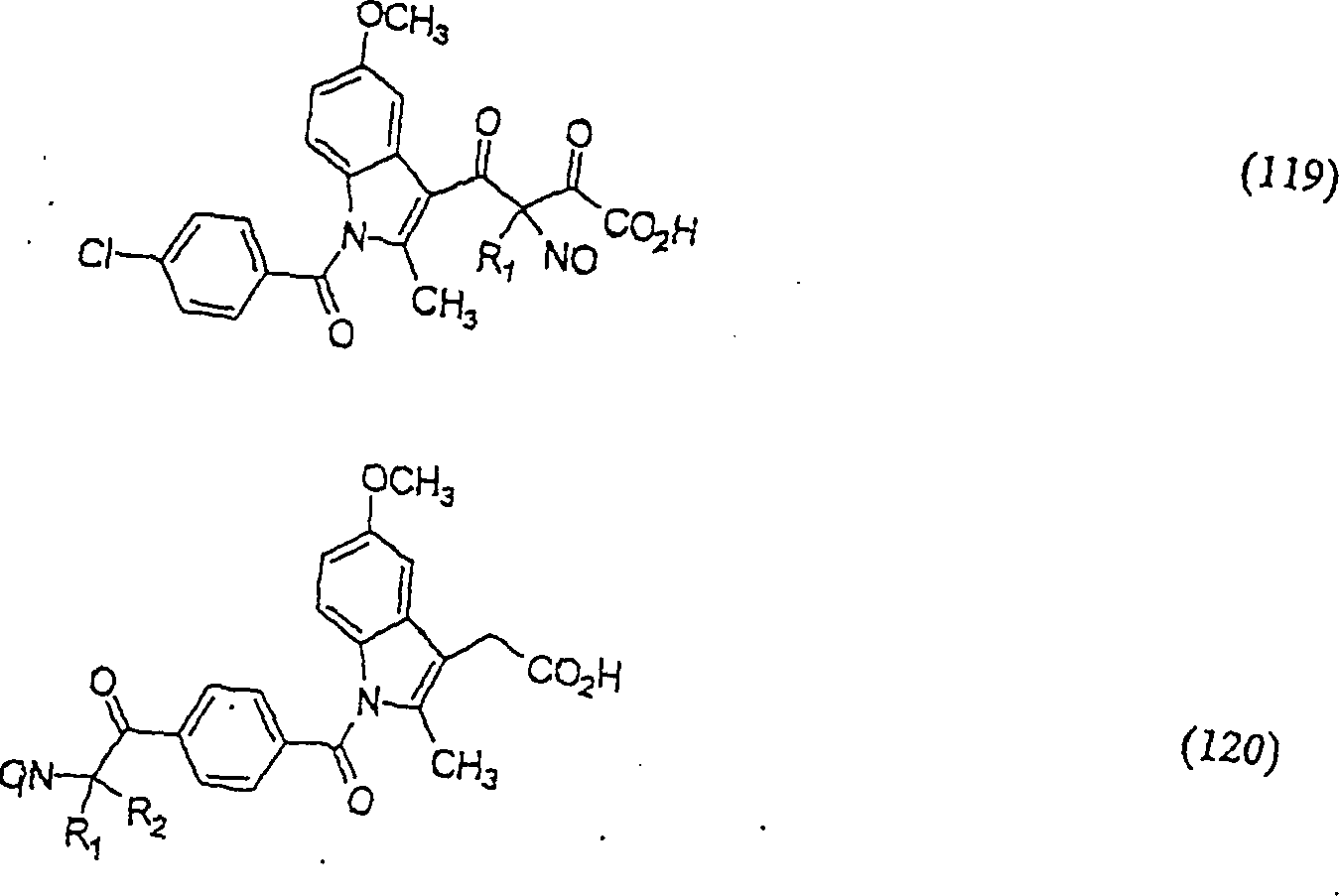
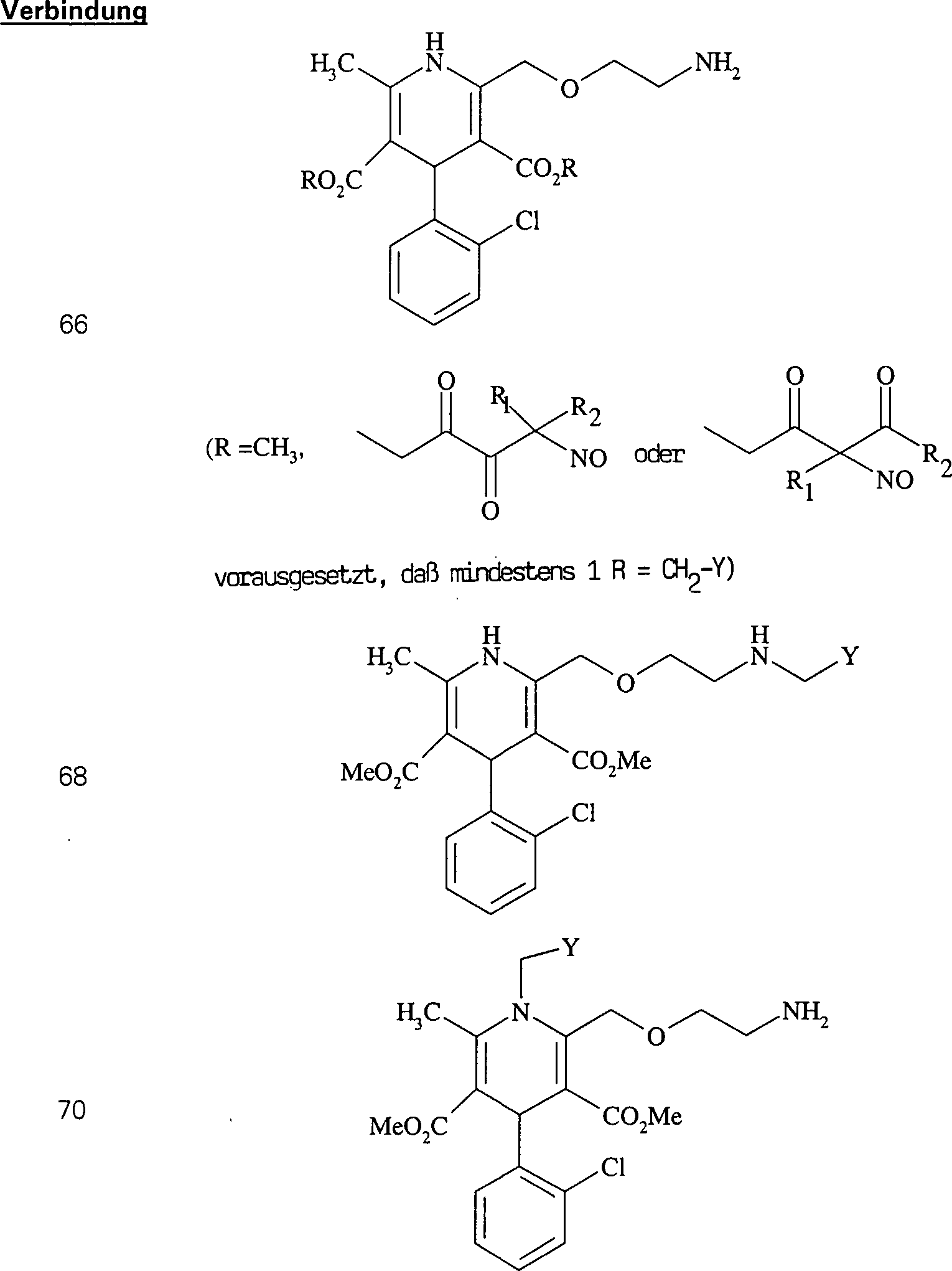
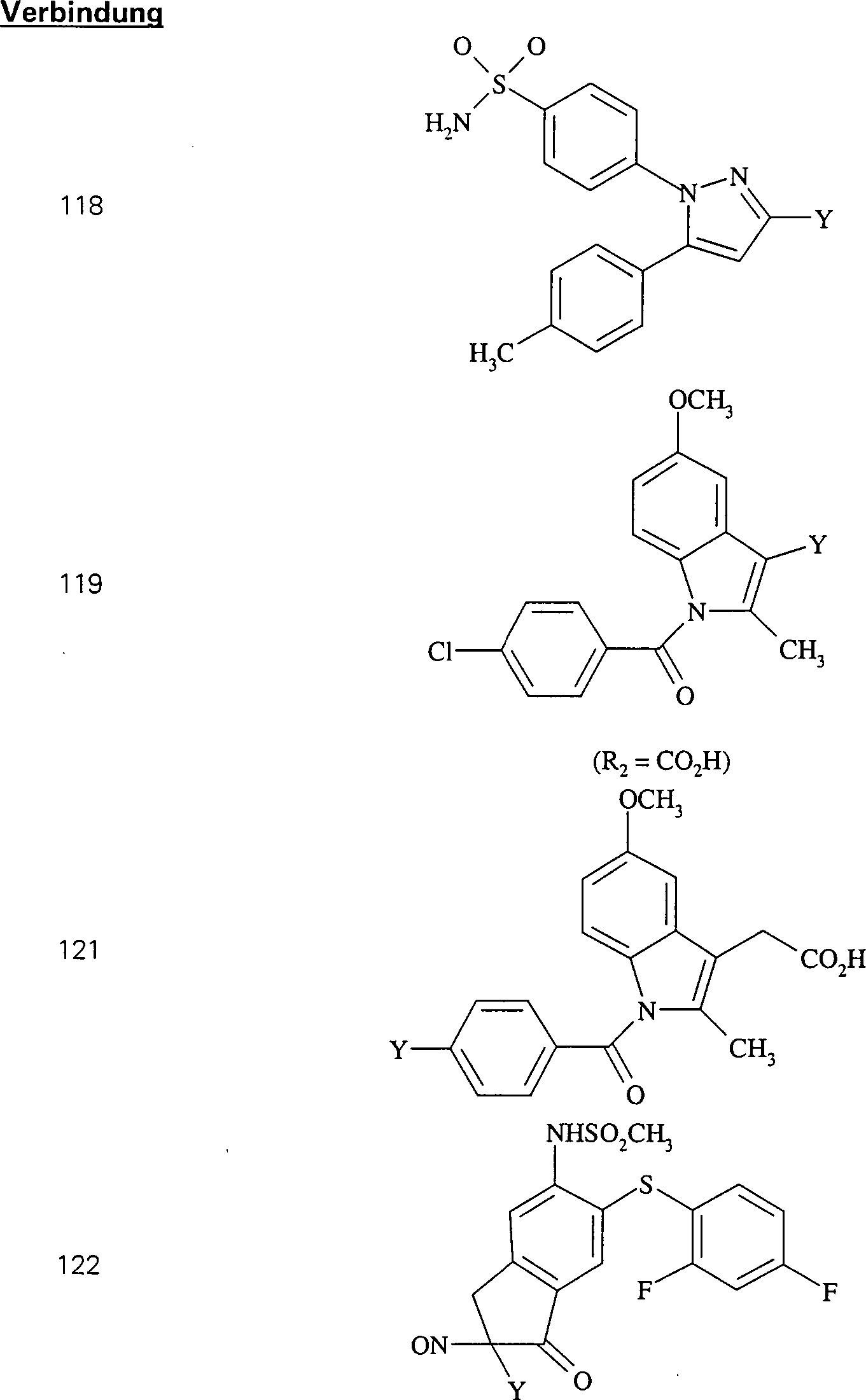
Der
COX-2-Inhibitor Indomethacin hat die Formel:
-
C-Nitroso-Verbindungen,
die von Indomethacin abgeleitet sind, umfassen beispielsweise:
-
In
(119), (120) und (121) sind R1 und R2 ausgewählt
aus der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht.
-
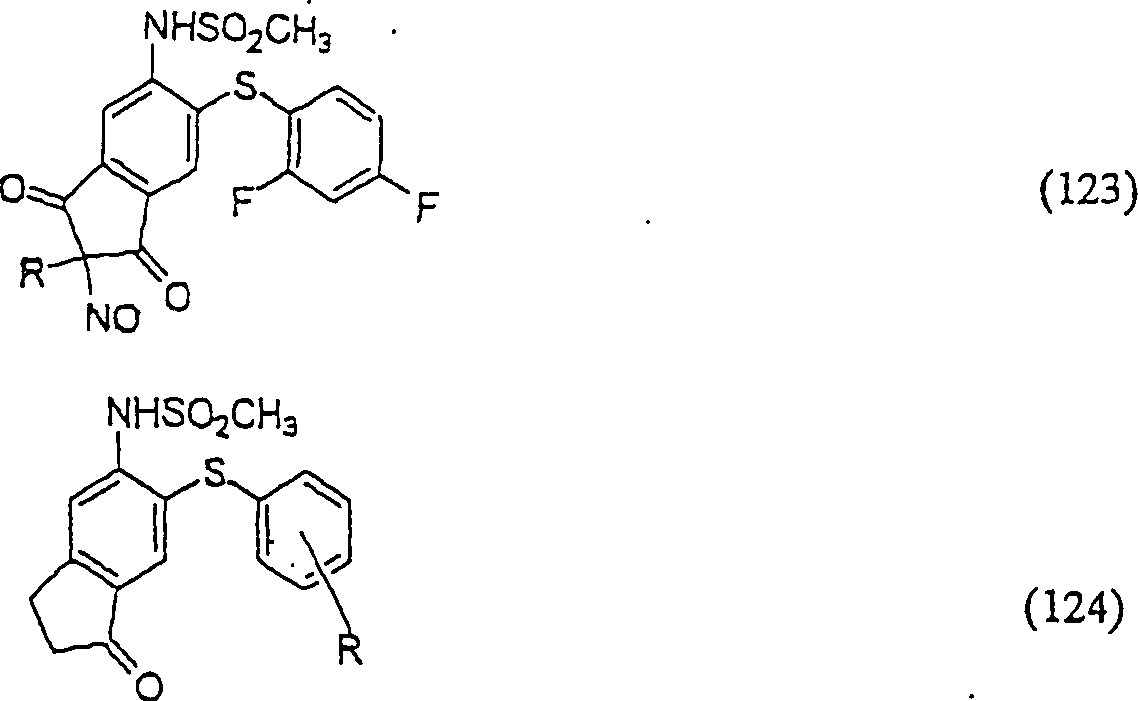
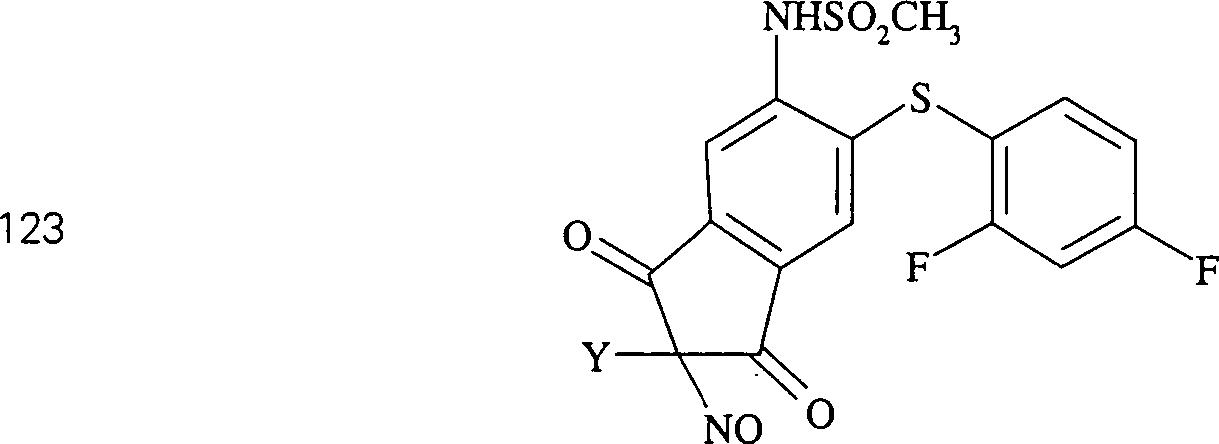
Der
COX-2-Inhibitor L-745 337 hat die Formel:
-
C-Nitroso-Verbindungen,
die von L-745 337 abgeleitet sind, umfassen beispielsweise:
-
In
(122), (123) und (124):
und R
1 und
R
2 sind ausgewählt aus der Gruppe, die aus
C
1-C
6-Alkyl und
C
6-C
20-Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
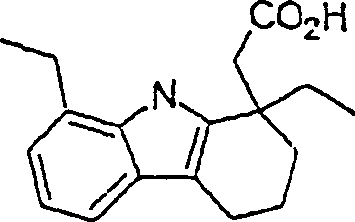
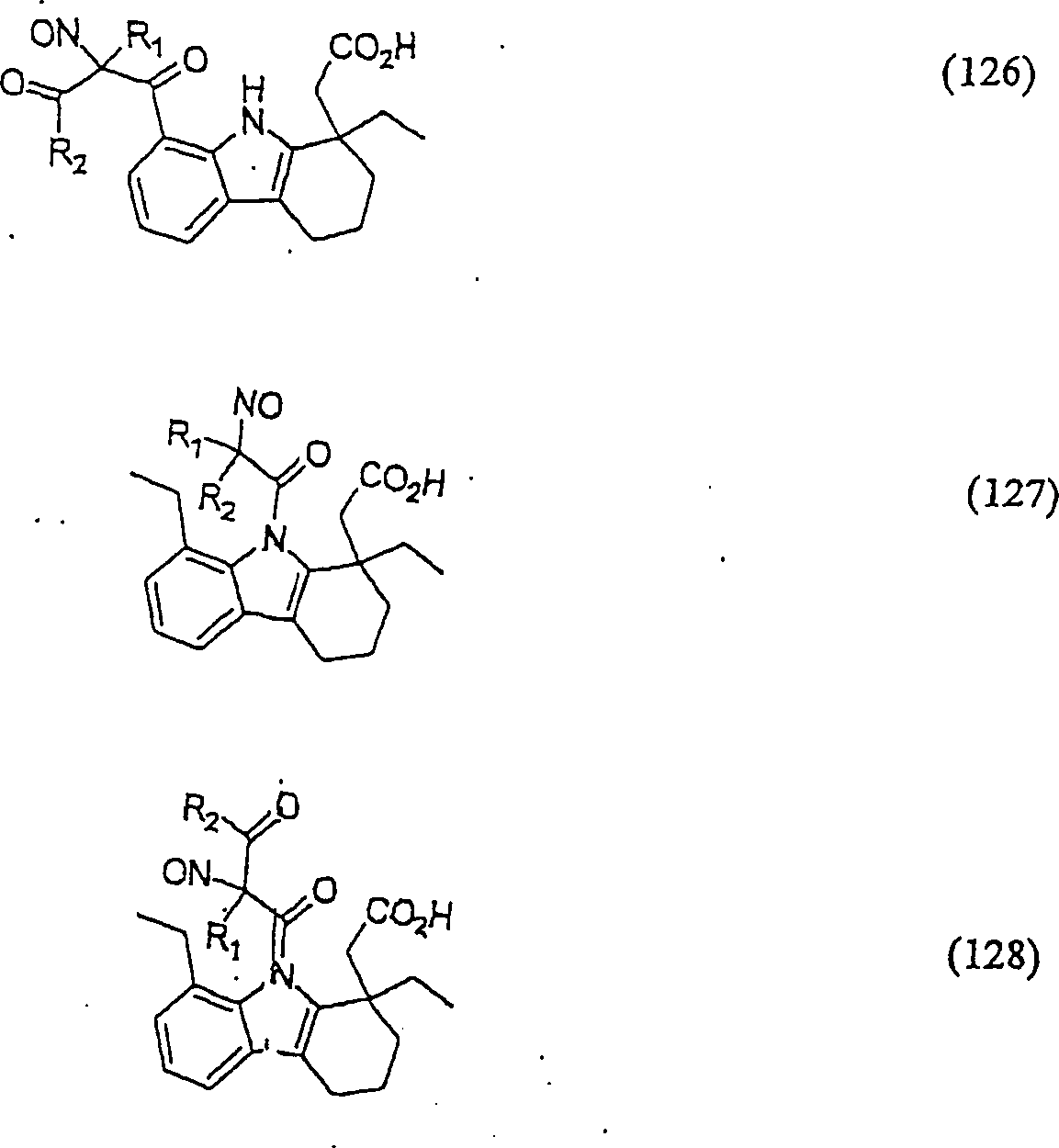
Der
COX-2-Inhibitor Etudolac hat die Formel:
-
C-Nitroso-Verbindungen,
die von Etudolac abgeleitet sind, umfassen beispielsweise:
-
In
(125), (126), (127) und (128) sind R1 und
R2 ausgewählt aus der Gruppe, die aus
C1-C6-Alkyl und C6-C20Aryl und substituierten
Derivaten davon, z. B. substituiert mit Amino, Hydroxyl und/oder
Carboxy und/oder die sulfatiert und/oder phosphoryliert sind, besteht.
-
In
allen Fällen,
in denen R1, R2,
R3, R4 oder R5 oben definiert sind, wobei H nicht eine
der genannten Gruppen ist, können
R1, R2, R3, R4 und R5 auch H sein, vorausgesetzt, dass das NO
an einen tertiären
Kohlenstoff gebunden ist, d. h. so, dass ein Definieren von R1, R2, R3,
R4 und/oder R5 als
H nicht bewirkt, dass NO an einen Kohlenstoff gebunden ist, der
kein tertiärer
Kohlenstoff ist.
-
Die
Verbindungen (1)-(128) sind beispielhaft gemeint, und in vielen
Fällen
kann sich die Kette, die mit NO substituiert ist, auch an einer
anderen Stelle als der dargestellten befinden, wie es von einem
Fachmann verstanden wird.
-
In
vielen der beispielhaft veranschaulichten Verbindungen ist das Stickstoffoxid-tragende
Fragment durch eine Ether- oder Amino-Verknüpfung verknüpft. Die Ether-Verknüpfung hat
den Vorteil der in vivo-Stabilität.
Alternativ kann es in manchen Fällen
vorteilhaft sein, das NO-tragende Fragment durch eine Ester-Verknüpfung zu
verknüpfen.
-
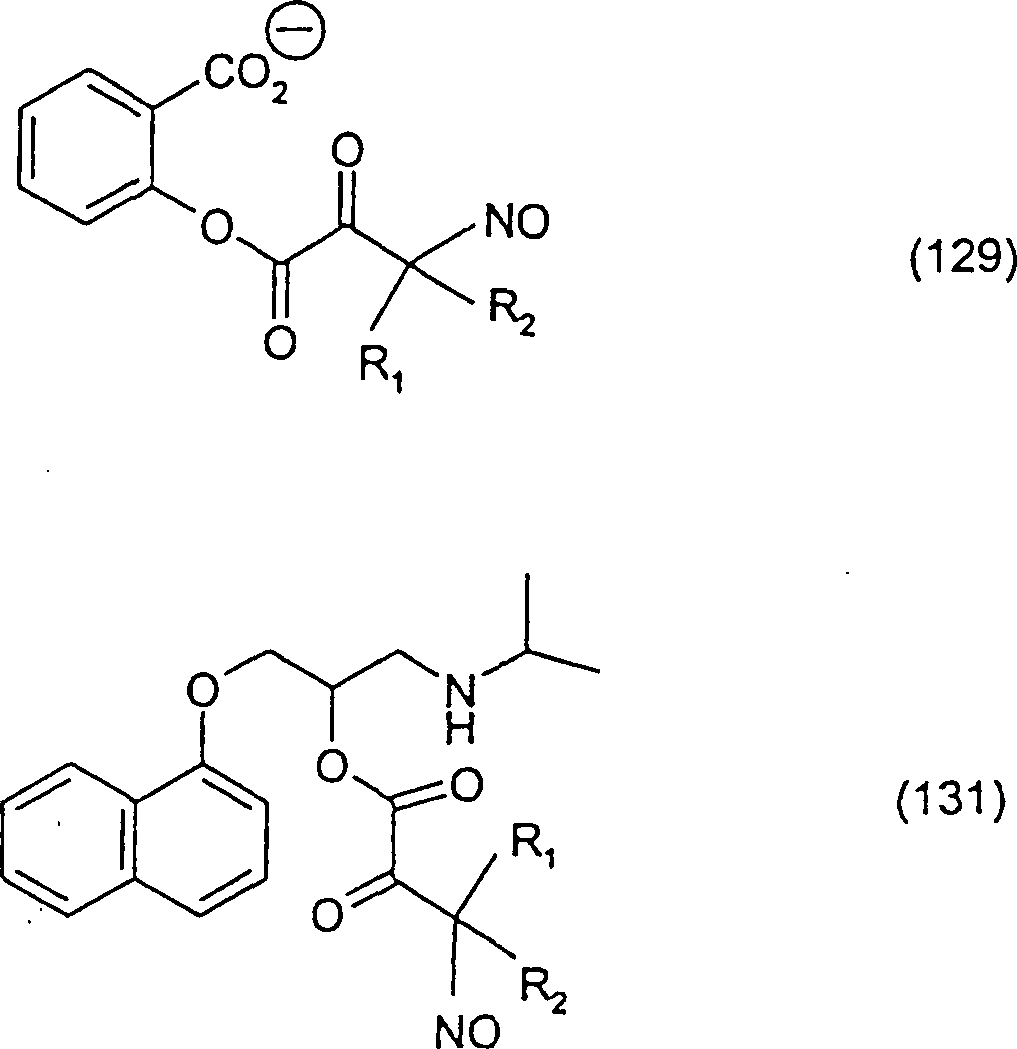
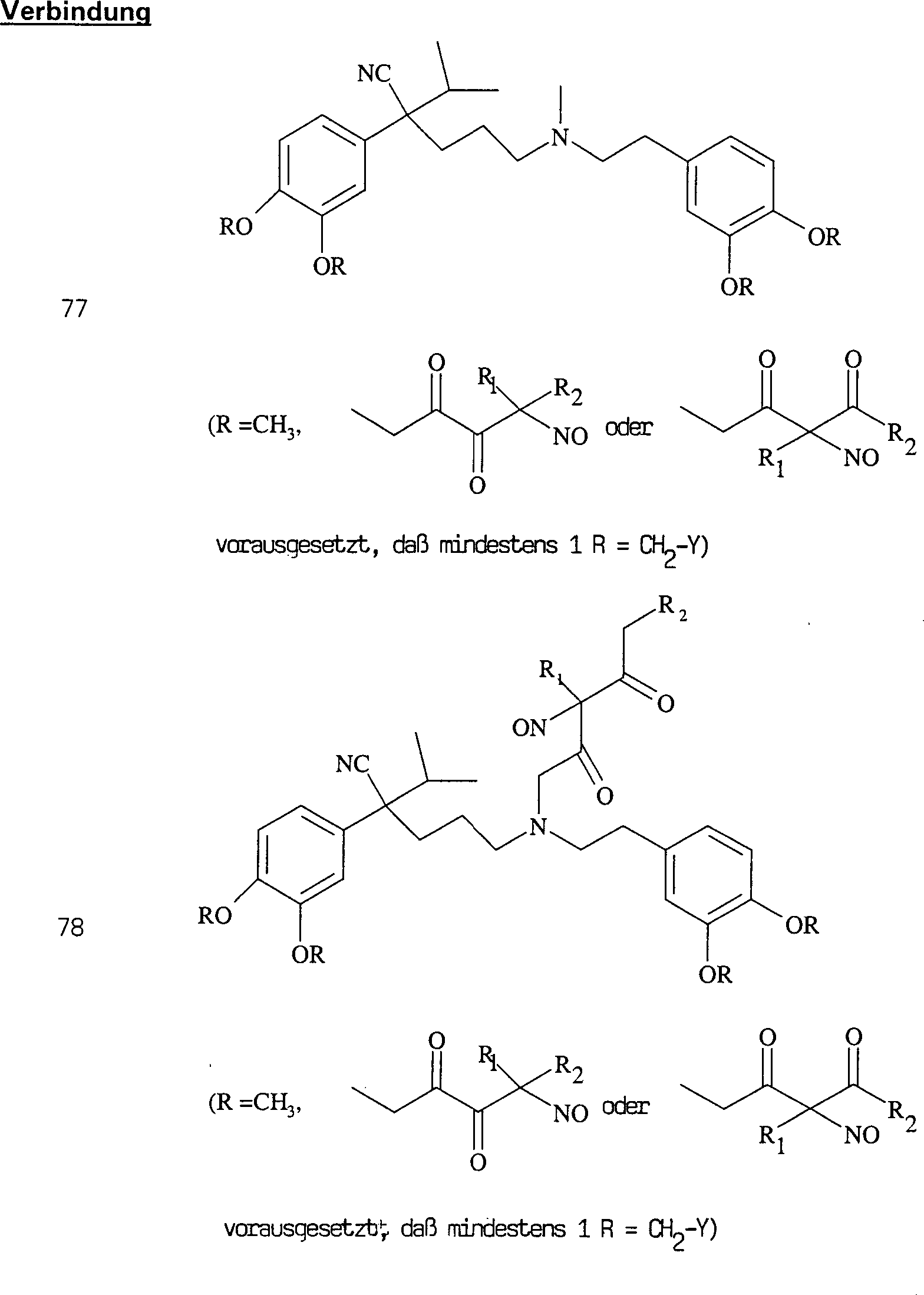
Beispiele
für C-Nitroso-Verbindungen
der Erfindung hierin, in denen das Notragende Fragment durch eine
Ester-Verknüpfung
verknüpft
ist, sind unten angegeben:
-
In
(129) und (131) sind R1 und R2 ausgewählt aus
der Gruppe, die aus C1-C6-Alkyl
und C6-C20-Aryl
und substituierten Derivaten davon, z. B. substituiert mit Amino,
Hydroxyl und/oder Carboxy und/oder die sulfatiert und/oder phosphoryliert
sind, besteht, oder können
H sein, vorausgesetzt, dass das Definieren von R1 und
R2 als H nicht dazu führt, dass NO an einen Kohlenstoff
gebunden ist, der kein tertiärer
Kohlenstoff ist. Die Verbindungen (129) und (131) sind beispielhaft
gedacht, und in Kenntnis des obigen würde ein Fachmann sich viele andere
C-Nitroso-Verbindungen der Erfindung hierin, in denen das Notragende
Fragment durch eine Ester-Verknüpfung
verknüpft
ist, vorstellen können.
-
Ein
Beispiel für
eine Verbindung (129) ist:
-
Verbindung
(129a) wird erhalten durch Nitrosylierung eines Kohlenstoffatoms
mit einem pKa von weniger als 10.
-
Wir
kommen nun zur Synthese der C-Nitroso-Verbindungen der ersten Ausführungsform
hierin.
-
Mehrere
Verfahren, die zur Synthese von C-Nitroso-Verbindungen anwendbar
sind, sind offenbart in Boyer, J. H., "Methods of Formation of the Nitroso
Group and its Reactions" in
The Chemistry of the Nitro and Nitroso Groups, Teil1, Feuer, H.,
Herausgeber, John Wiley & Sons,
New York (1969) auf den Seiten 215-299, und in Touster, O. in Organic Reactions,
Vol. 7, John Wiley & Sons,
New York (1955) auf den Seiten 327-377, die hierin durch Bezugnahme
aufgenommen werden.
-
In
einem Verfahren, das zur Nitrosylierung von Kohlenstoffsäuren mit
pKa's von weniger
als 15 anwendbar ist, können
die Kohlenstoffsäuren
direkt mit Natriumnitrit und einer Säure wie Eisessig nach dem Verfahren
von Sklyar, Yu. E., et al., Khimiya Geterotsiklicheskikh Soedinenii,
5, 70-73 (1969) nitrosyliert werden. Dieses Verfahren ist brauchbar
zur Herstellung der Unterart von Verbindungen hierin, die durch
Nitrosylierung einer Kohlenstoffsäure mit einem pKa von weniger
als 10 erhalten werden.
-
In
einem Verfahren, das zur Nitrosylierung von Kohlenstoffsäuren mit
pKa's zwischen 15
und 30 anwendbar ist, wird die Nitrosylierung durch Bildung des
Enolats und Abfangen des Enolats durch ein Nitrosonium-Äquivalent
ausgeführt.
Das Enolat kann direkt abgefangen oder als der Silyl-enol-ether
oder ein Äquivalent isoliert
werden. Dieses Verfahren ist brauchbar zur Herstellung der Unterart
von Verbindungen hierin, die durch Nitrosylierung einer Kohlenstoffsäure mit
einem pKa im Bereich von 15-20 erhalten werden. Es ist das Verfahren,
das in Beispiel I hierin nachfolgend zur Herstellung von dimerer
2-[4'-(α-Nitroso)isobutyrylphenyl]propionsäure) verwendet
wird.
-
In
einem Verfahren, das unabhängig
von der Acidität
zur Synthese von C-Nitroso-Verbindungen brauchbar ist, wird die
Kohlenstoffsäure
in das entsprechende Hydroxylamin umgewandelt, das oxidiert wird, beispielsweise
unter Verwendung von Silbercarbonat auf Celite.
-
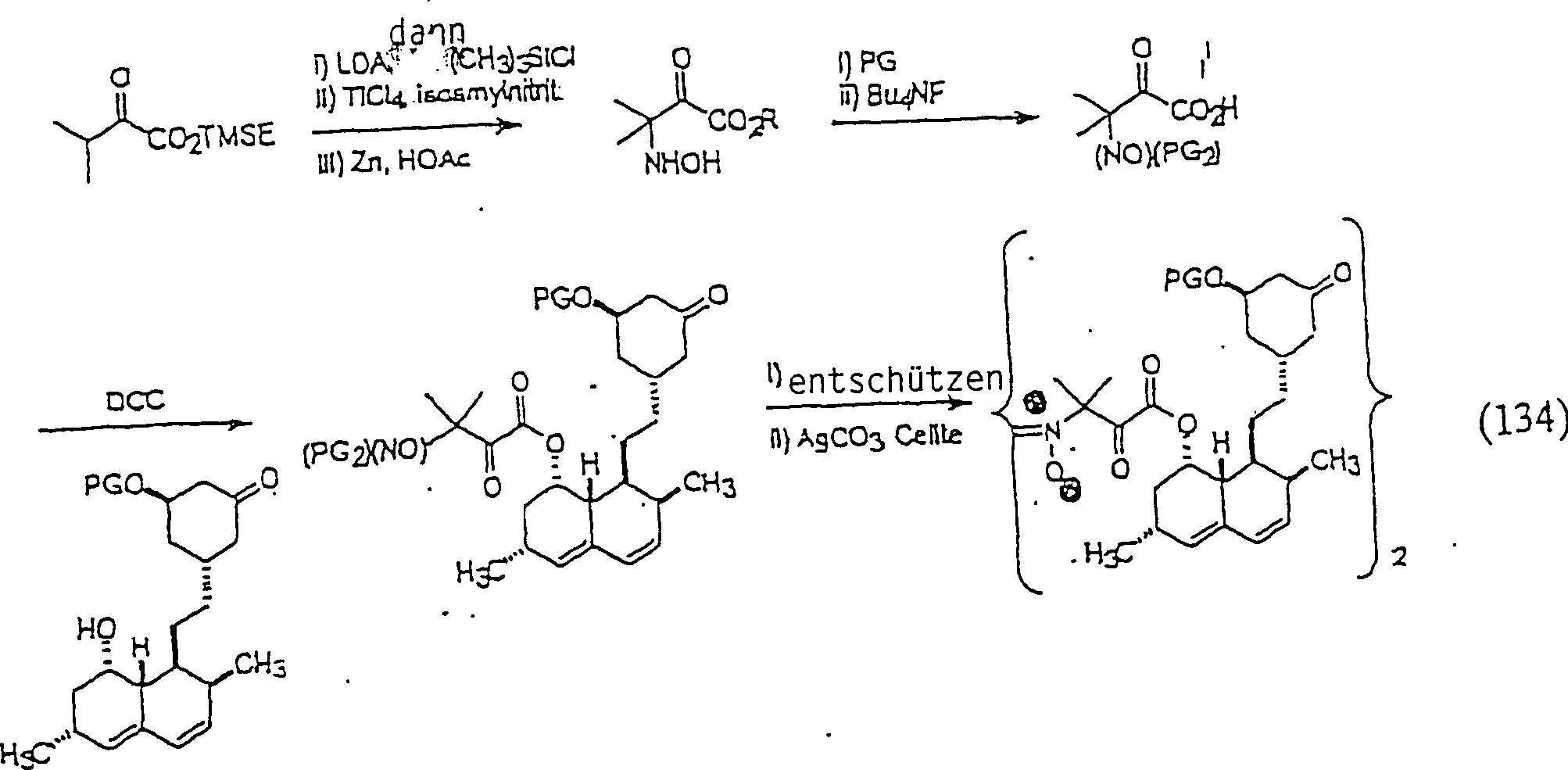
In
dem Fall instabiler C-Nitroso-Verbindungen kann es wünschenswert
sein, das C-Nitroso-Fragment erst in dem abschließenden Schritt
der Synthese, oder so spät
in der Synthese wie möglich,
einzuführen
oder zu demaskieren. Bei einem solchen Weg wird bei der Synthese
des C-Nitroso-Arzneimittels zuerst ein geeignetes Fragment eingebaut,
und die Nitrosylierung wird erst ausgeführt, nachdem die Synthese vollendet
ist. Ein Beispiel für
diesen Weg ist unten dargelegt:
-
In
dem obigen Reaktionsschema kann R
1 ausgewählt werden
aus der Gruppe, die aus C
1-C
6-Alkyl
und C
6-C
20-Aryl
und substituierten Derivaten davon (wie oben für R
1 und
R
2 definiert) besteht, und X ist Chlor oder Brom
und PPTS ist Pyridinium-paratoluol-sulfonsäure und "pyr" ist
Pyridin. Dieser Weg ist besonders geeignet zur Herstellung von Verbindungen,
die von Ausgangs-Kohlenstoffsäuren
mit besonders niedrigen pKa-Werten, typischerweise weniger als 15
und bevorzugt weniger als 10, abgeleitet sind. Für Verbindungen, die von Ausgangs-Kohlenstoffsäuren mit
höheren
pKa-Werten abgeleitet sind, ist es bevorzugt, die C-Nitroso-Baueinheit als
das bis-geschützte
Hydroxylamin maskiert mitzuführen;
die C-Nitroso-Funktionalität
wird, beispielsweise, spät
in der Synthese, nach der Bindung an ein konventionelles Arzneimittel,
durch milde Oxidation mit, beispielsweise, Silbercarbonat auf Celite
demaskiert; ein Beispiel für
diese Syntheseart ist unten dargelegt:
-
In
dieser Reaktion bedeutet LDA-Lithium-diisopropyl-amid, TMSE bedeutet
Trimethylsilylethyl, R ist TMSE, PG ist eine Schutzgruppe und DCC
ist Dicyclohexylcarbodiimid.
-
Derivatisierte
Verbindungen können
unter Verwendung eines Brommethylketon-Derivats von entweder 3-Nitroso-2,4-pentan-dion
oder 4-Nitroso-2,3-butadion als Nitrosylierungsmittel hergestellt
werden.
-
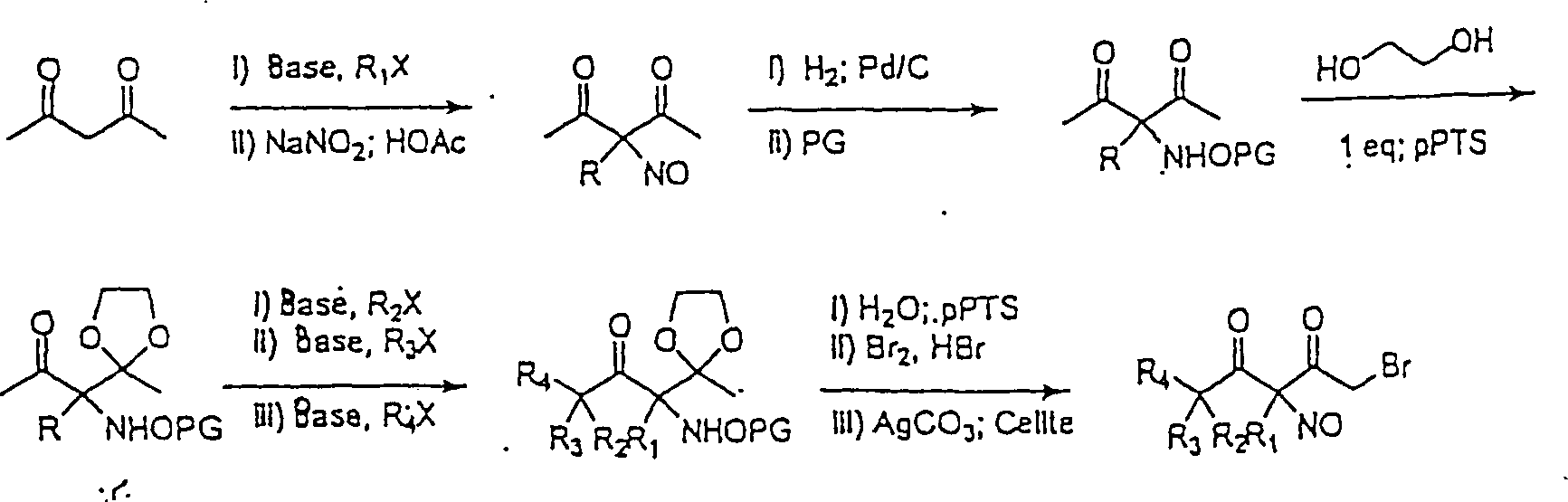
Substituierte
3-Nitroso-2,4-pentadione können
nach dem folgenden Reaktionsschema hergestellt werden:
-
In
dem obigen Reaktionsschema steht "PG" für Schutzgruppe
und "pPTS" steht für Pyridinium-paratoluol-sulfonsäure, R1, R2, R3 und
R4 sind gleich oder verschieden und können dieselben
sein wie R1 für die obigen Reaktionsschemas
definiert ist, und X ist Chlor oder Brom. Die Herstellung wird kurz
wie folgt beschrieben: eine Gruppe wird auf eine übliche Weise
durch nucleophile Substitution an der acidesten Position eingeführt. Die
Einführung
dieser Gruppe verhindert die Bildung des Oxims nach der Nitrosylierung.
Die genaue Identität
der Gruppe wird gewählt,
um die Reaktivität
des C-Nitroso-Derivats zu kontrollieren. Der elektrophilen Nitrosylierung
mit Nitrosonium folgt die Reduktion zum Hydroxylamin und der Schutz
als das Bisacyl-Derivat, wie beschrieben in "Bisprotected hydroxylamines as reagents
in organic synthesis. A review:" in
Romine, J. L., Org. Prep. Proced. Int. 28, 249-288 (1996). Der Unterscheidung
des Dions durch Monoschutz als das Ketal folgt die Einführung von
ein, zwei oder drei Gruppen durch nucleophile Substution auf Standardart.
Der Entschützung
des Ketals und des Hydroxylamins folgt die milde Oxidation zur C-Nitroso-Verbindung
mit, beispielsweise, auf Celite immobilisierten Silber (1)-Salzen.
Schließlich
liefert die Umwandlung zum Brommethyl-Keton mit Brom und Bromwasserstoffsäure das
Derivatisierungsmittel.
-
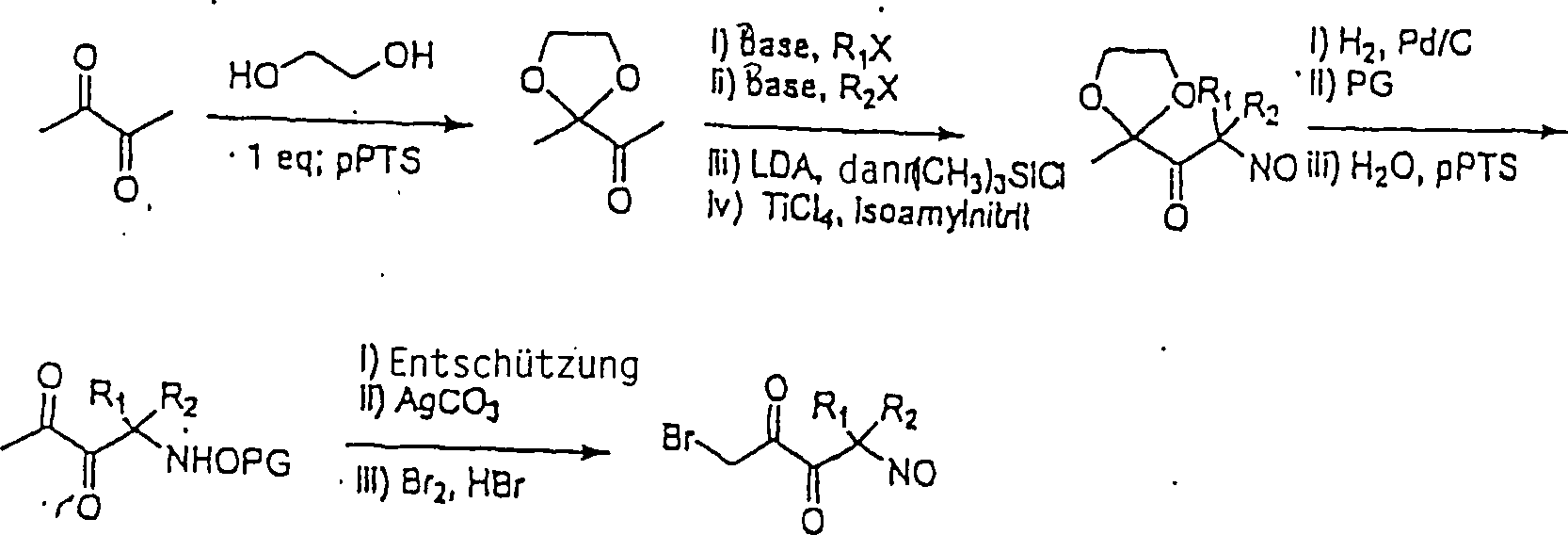
Substituierte
4-Nitroso-2,3-butadione können
nach dem folgenden Reaktionsschema hergestellt werden:
-
In
dem obigen Reaktionsschema ist "pPTS" Pyridinium-paratoluol-sulfonsäure, "LDA" ist Lithium-diisopropyl-amid
und "PG" bedeutet Schutzgruppe,
R1 und R2 können gleich
oder verschieden sein und können
dieselben sein wie für
die oben dargelegten Reaktionsschemata, und X ist Chlor oder Brom.
Die Herstellung wird kurz wie folgt beschrieben: das Dion von 2,3-Butadion
wird als das Monoketal unterschieden und wird dann in der üblichen
Weise durch nucleophile Substitution substituiert. Nitrosiyierung
durch den Silyl-enol-ether, gefolgt von Schützen der C-Nitroso-Gruppe als
das diacylierte Hydroxylamin geht der Entschützung des Ketals, der Wiederherstellung
der C-Nitroso-Funktionalität
und der Bromierung zum reaktiven α-Bromketon
voraus.
-
Bei
der Synthese von Verbindungen der ersten Ausführungsform hierin kann der
Kohlenstoffsäure-pKa
des Ausgangsmaterials nach unten reguliert werden, indem darin ein
elektronenziehendes Atom oder eine elektronenziehende Gruppe vorgesehen
wird, und der Kohlenstoffsäure-pKa
kann nach oben reguliert werden, indem darin eine elektronenfreisetzende
Gruppe vorgesehen wird.
-
Beispielsweise
kann ein acides Zentrum eingeführt
werden, z. B. Bildung einer Ketongruppe aus dem Kohlenstoff, der
dem zu nitrosylierenden Kohlenstoff benachbart ist, um die Acidität zu erhöhen und
ein Ausgangsmaterial mit niedrigerem Kohlenstoffsäure-pKa
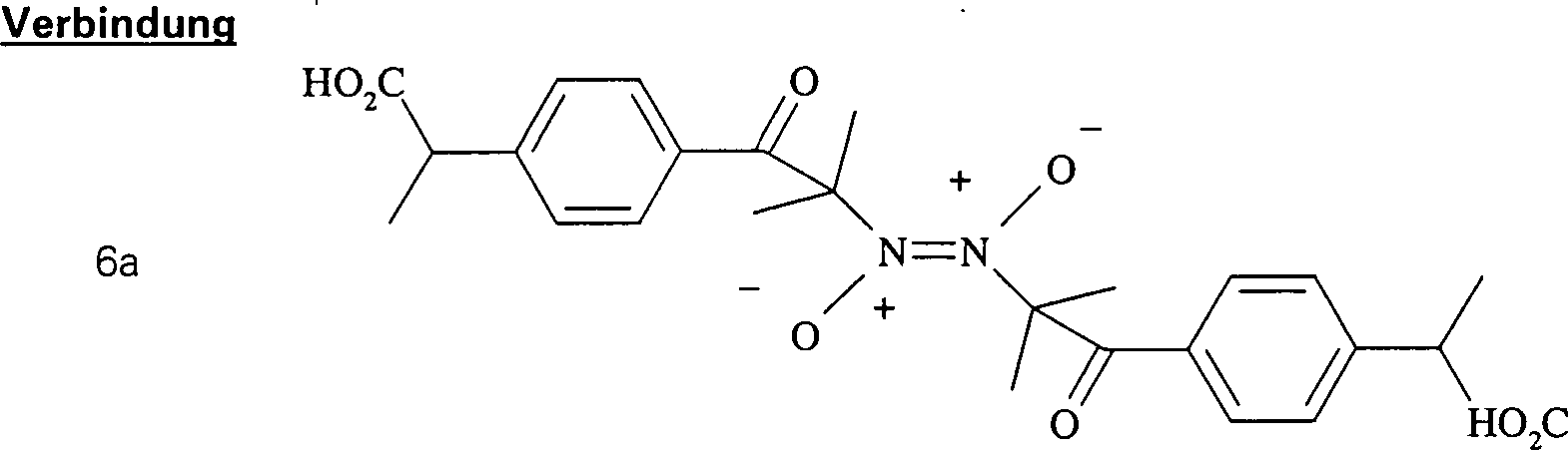
zu schaffen. Dieser Weg wurde bei der Synthese von dimerer 2-[4'-(α-Nitroso)isobutyrylphenyl]propionsäure aus
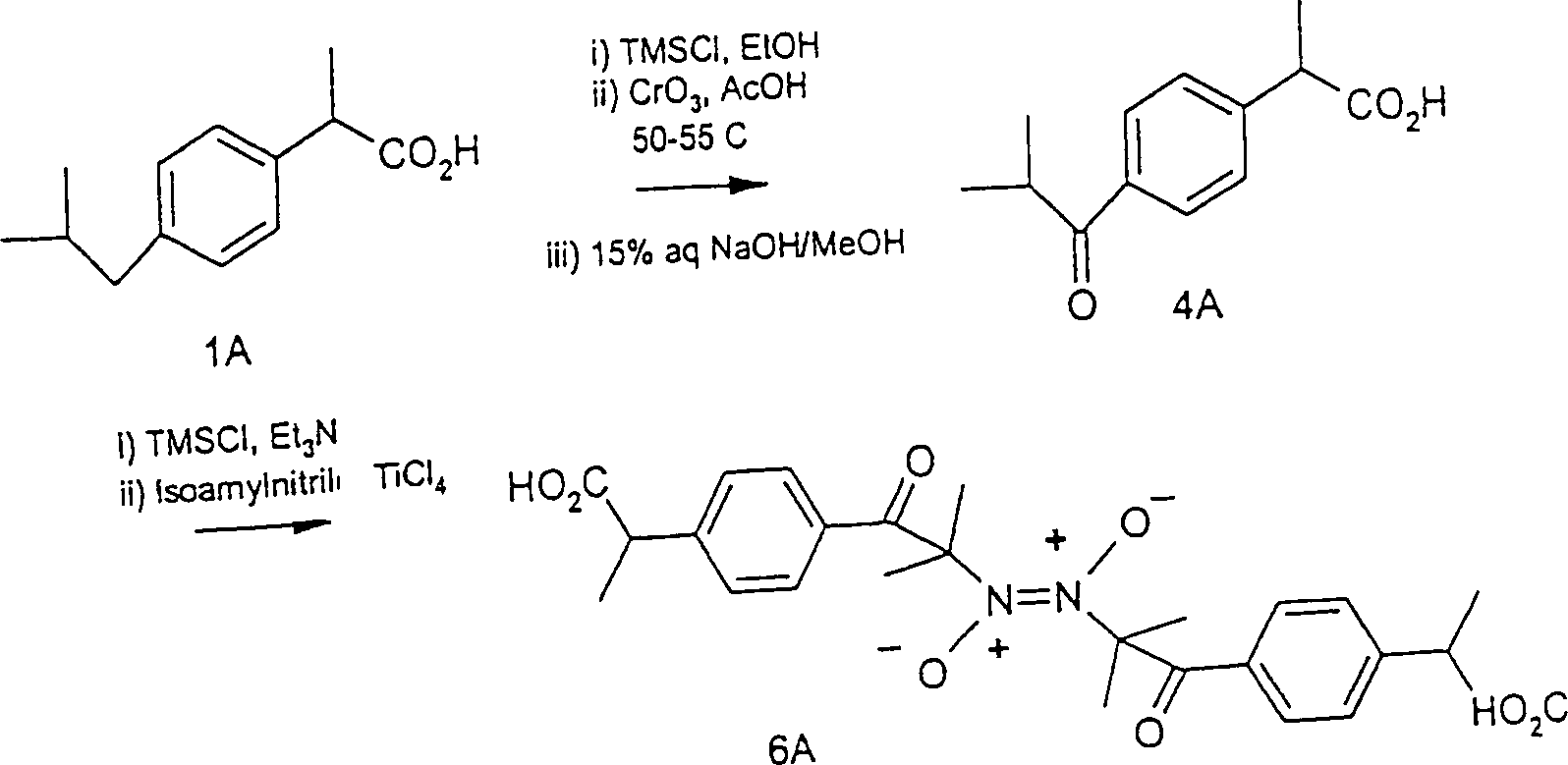
Ibuprofen, die in Beispiel I unten dargelegt ist, verwendet. In
der Synthese von Beispiel I wurde Ibuprofen (Kohlenstoffsäure-pKa
von näherungsweise
50-55) auf diesem Weg in 2-(4'-Isobutyrylphenyl)propionsäure (Kohlenstoffsäure-pKa
von etwa 20) umgewandelt, und die letztere wurde durch das oben
beschriebene Verfahren der Nitrosylierung von Kohlenstoffsäuren mit
pKa's zwischen 15
und 30 in das Endprodukt umgewandelt. Das Reaktionsschema, das in
Beispiel I zur Umwandlung von Ibuprofen in dimere 2-[4'-(α-Nitroso)isobutyrylphenyl]propionsäure verwendet
wurde, ist unten dargelegt, worin 1A Ibuprofen ist, 4A 2-(4'-Isobutyrylphenyl)propionsäure ist
und 6A das dimere Produkt ist.
-
-
In
dem obigen Reaktionsschema steht "TMSCI" für
Chlortrimethylsilan.
-
Zusammengefasst
gibt es im Grunde mindestens zwei unterschiedliche Wege zur Herstellung
der Verbindungen hierin. Einer davon ist, das Ausgangs-Arzneimittel
zu modifizieren, um bei der ersten Ausführungsform hierin eine Funktionalität (Keton
oder Dion), die eine C-Nitrosylierung erlaubt, einzuführen. Nach
diesem Verfahren wird das Nitrosoketoibuprofen hierin gemacht. Der
andere davon ist, an das Arzneimittel ein Teil oder Fragment, das
die Bildung von -CNO erlaubt, zu binden. Ein Verfahren zur Ausführung des
letzteren ist über ein
Bromketon, um über
Ether, Amin oder Ester zu verknüpfen.
Anstelle der Verwendung eines Bromketons kann ein Carbonsäure-Derivat
mit einer Hydroxygruppe oder einer Amingruppe eines konventionellen
Arzneimittels zur Reaktion gebracht werden, um eine Amid- oder Ester-Verknüpfung zu
erhalten.
-
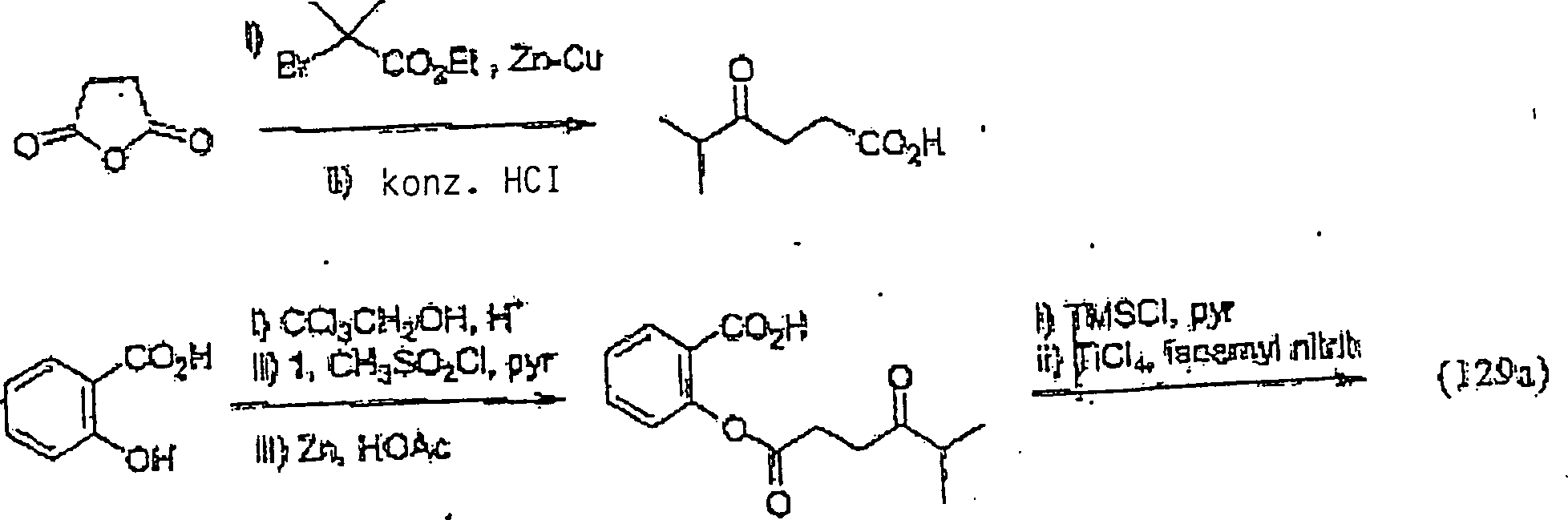
Die
Verbindung (129a) kann auf dem folgenden Syntheseweg hergestellt
werden:
-
Wir
kommen nun zur Anwendung der C-Nitroso-Verbindungen der ersten Ausführungsform
hierin.
-
Die
C-Nitroso-Verbindungen der ersten Ausführungsform hierin finden Anwendung
als NO-Donoren, und in einer solchen Funktion schaffen sie einen
Entspannungseffekt und einen plättchenhemmenden
Effekt. So sind C-Nitroso-Verbindungen der ersten Ausführungsform
hierin brauchbar, um Restenose nach einer Angioplastik bei Patienten,
bei denen nach einer Angioplastik ein Restenoserisiko besteht, zu
verhindern und um Plättchen
zur Verhinderung von Koagulation zu hemmen und um Angina zu behandeln
bei Patienten, bei denen ein Koagulations- und Thrombusbildungs-Risiko
besteht. Die NO-Donorfunktion liefert auch die folgenden therapeutischen
Effekte: Hemmung von Mikroben und Behandlung von Impotenz, Asthma,
Herzinsuffizienz, Schlaganfall, Arthritis, ARDS, Krebs und jeglicher
pathologischer Proliferation von Zellen und jeglicher Schädigung im
Zusammenhang mit NMDA.
-
Wie
oben angegeben, zeigen die C-Nitroso-Verbindungen der ersten Ausführungsform
hierin mit hoher NO-Donatorkapazität (von Kohlenstoffsäuren mit
pKa's von weniger
als den 10) schwache (mikromolare Konzentration) Effekte, wahrscheinlich
durch Nitrit, und werden durch hinzugegebenes Gluthation oder ähnliche
Thiole mit niedrigem Molekulargewicht verstärkt bzw. potenziert. Diese
Verbindungen bewirken die Bildung von Nitrosogluthation und sind
daher besonders nützlich
zur Behandlung von Patienten, die Nitrosoglutathion brauchen, z.
B. Patienten mit zystischer Fibrose, Asthma, Hypoxie und ischämischen
Erkrankungen.
-
Wie
oben angegeben zeigen die C-Nitroso-Verbindungen der ersten Ausführungsform
hierin mit schwachen NO-Donatorfähigkeiten
(von Kohlenstoffsäuren
mit pKa's im Bereich
von 15-20) hohe Wirksamkeiten durch spezifische Nitrosylierung stark
nucleophiler Ziele und sind daher brauchbar, um Thiole in Proteinen in
hochgradig nucleophilen Milieus zu nitrosylieren, und daher sind
sie brauchbar zur Behandlung von Patienten, die nitrosilierten Proteine
brauchen, z. B. Patienten mit Bluthochdruck, Neurodegenerierung
und schmerzhafter Sichelzellenerkrankungs-Krise.
-
Wenn
C-Nitroso-Verbindungen der ersten Ausführungsform hierin von nicht-steroidalen antiinflammatorisch
wirkenden Arzneimitteln, die sowohl COX-1 als auch COX-2 hemmen,
abgeleitet sind, sind die C-Nitroso-Verbindungen brauchbar zur Behandlung
entzündlicher
oder schmerzhafter Erkrankungen einschließlich Arthritis, koronarer
Herzerkrankung und Harninkontinenz, und Verbessern das Profil selektiver
Inhibitoren von COX-2, z. B. bei der Behandlung von Angina. Das
hierin hergestellte Nitrosoketoibuprofen hat diese Anwendungen.
-
Wie
oben angegeben und wie bei der Beschreibung von Vorteilen unten
tiefergehend diskutiert wird, verbessert die Stabilität der dimeren
Form isolierter C-Nitroso-Verbindungen
der ersten Ausführungsform
hierin die Verbindung-Lebensdauer und sorgt für eine modulierte biologische
Aktivität.
Diese Eigenschaft erlaubt ihre Verwendung als Depot-Arzneimittel.
Eine derartige Stabilität
bringt auch eine Anwendung als Prodrugs mit sich. Weil die spontane
Freisetzung von NO sowohl kontrollierbar als auch klein ist, sind
viele C-Nitroso-Verbindungen nur in Anwesenheit von Aktivatoren
mit kleinen Molekülen
wirksam, z. B. von Thiolen mit niedrigem Molekulargewicht, die als
Träger
von NO (in einer geeigneten Redoxform) von der C-Nitroso-Verbindung
zu einem biologischen Ziel wirken.
-
Wir
kommen nun zu Dosierungen und Verabreichungsverfahren für die C-Nitroso-Verbindungen
der ersten Ausführungsform
hierin, wenn sie für
eine therapeutische Anwendung verwendet werden.
-
Im
allgemeinen liegen die Dosierungen im Bereich von 1 μg/kg bis
1000 mg/kg und variieren in Abhängigkeit
von der spezifischen C-Nitroso-Verbindung. Dosierungen für spezifische
Verbindungen werden durch Standardverfahren zur Dosisfestlegung
leicht festgelegt. Die normale Dosis des Ausgangsarzneimittels kann beibehalten
werden, indem man nur einen Teil davon als das C-Nitroso-Derivat verwendet.
Der Grund für
den breiten Bereich ist, dass viele Verbindungen von der Erfindung
umfasst werden.
-
Verabreichungswege
umfassen beispielsweise oral, parenteral einschließlich intravenös, inhaliert, zerstäubt und
topisch.
-
Wenn
die C-Nitroso-Verbindung der ersten Ausführungsform hierin von einem
konventionellen Arzneimittel abgeleitet ist, sind die verwendeten
Dosierungen jene, die für
das konventionelle Arzneimittel in Gebrauch sind, und die Anwendungsverfahren
sind jene für
das konventionelle Arzneimittel, aber wie oben angegeben wird nur
ein Teil des Arzneimittels als die C-Nitroso-Verbindung verabreicht,
wobei der Rest, falls erforderlich, als das konventionelle Arzneimittel
verabreicht wird.
-
Wenn
die C-Nitroso-Verbindung eine ist, die durch Nitrosylierung einer
Kohlenstoffsäure
mit einem pKa von weniger als 10 erhalten wurde, wird sie bevorzugt
in einer Konzentration im Bereich von 1 nanomolar bis 100 mikromolar
als eine wässrige
Lösung
verabreicht, außer
wenn durch Glutation oder ein anderes Thiol mit niedrigem Molekulargewicht
eine Potentierung geschaffen wird, worauf die C-Nitroso-Verbindung
bevorzugt in einer Konzentration im Bereich von 1 bis 900 nanomolar
verabreicht wird und das Glutathion in einer Konzentration im Bereich
von 1 mikromolar bis 100 Millimolar verabreicht wird.
-
Wenn
die C-Nitroso-Verbindung eine ist, die aus einer Kohlenstoffsäure mit
einem pKa im Bereich von 15-25, z. B. 15-20, erhalten wird, wird
die C-Nitroso-Verbindung
bevorzugt in einer Konzentration im Bereich von 1 nanomolar bis
100 mikromolar verabreicht.
-
Wir
kommen nun zu dem Ibuprofen-Derivat, d. h. dimerer 2-[4'-(α-Nitroso)isobutyrylphenyl]propionsäure. Sie
wird bevorzugt als eine Pille, Tablette oder Kapsel verabreicht,
wobei nur ein Teil des Ibuprofens als das C-Nitroso-Derivat, z.
B. ein Gewichtsteil Ibuprofen-Derivat zu 1000 Gewichtsteilen underivatisiertem Ibuprofen,
um 400 mg auf Ibuprofen-Basis zu liefern, drei- bis viermal am Tag
und in einer Konzentration der C-Nitroso-Verbindung von 1 nanomolar
bis 100 mikromolar verabreicht wird.
-
Die
Verbindungen der ersten Ausführungsform
hierin sind gegenüber
den bisher bekannten C-Nitroso-Verbindungen vorteilhaft hinsichtlich
Wirksamkeit und/oder Löslichkeit.
-
Wir
kommen nun zu den Vorteilen der C-Nitroso-Verbindungen der ersten
Ausführungsform
hierin gegenüber
O-Nitroso-Verbindungen und S-Nitroso-Verbindungen als NO-Donoren.
-
Eine
Hauptbarriere gegen die Verwendung organischer Nitrite und Nitrosothiole
als NO (oder Nitrosonium)-Donoren ist ihre Instabilität. Nitrosothiole
beispielsweise unterliegen einer raschen Zersetzung, um inter alia
ein Stickstoffoxid-Radikal und ein Schwefel-Radikal zu ergeben.
Im Gegensatz dazu gehen C-Nitroso-Verbindungen der ersten Ausführungsform
eine Dimerisierungsreaktion ein, um ein festes, stabiles Dimer zu
erzeugen. Wie oben angegeben, läuft
diese Dimerisierungsreaktion während
der Isolierung von C-Nitroso-Verbindungen spontan ab, und die Dimerisierung
ist für α-Acyl-C-nitroso-Verbindungen
stark begünstigt.
Im allgemeinen sind die Dimere fest und stabil, bei Umgebungstemperatur
in Anwesenheit von Sauerstoff und Licht monatelang lagerfähig. Die
C-Nitroso-Verbindungen hierin haben vom Standpunkt der Lagerstabilität her einen signifikanten
Vorteil gegenüber
O-Nitroso- und S-Nitroso-Verbindungen der ersten Ausführungsform.
-
Die
C-Nitroso-Verbindungen der ersten Ausführungsform hierin sind auch
insofern gegenüber
O-Nitroso- und S-Nitroso-Verbindungen als NO-Donoren vorteilhaft,
als ihre Funktionalität,
d. h. NO-Donatorpotential und Reaktivität, maßgeschneidert werden kann,
während
dies für
O-Nitroso- und S-Nitroso-Verbindungen nicht der Fall ist.
-
Wir
kommen zuerst zum Maßschneidern
des NO-Donatorpotentials der C-Nitroso-Verbindung der ersten Ausführungsform
hierin. Dies kann auf drei Arten gemacht werden. Erstens ist die Übertragungsrate
des Nitrosonium-Äquivalents
direkt proportional zur Acidität.
Daher wird das NO-Donatorpotential erhöht, indem man die C-Nitroso-Verbindung
aus Ausgangsmaterial mit niedrigerem pKa erhält. Zweitens steht das NO-Donatorpotential
in Beziehung zur Lage (Gleichgewichtskonstante) des Dimer-Monomer-Gleichgewichts
(Thermodynamik). Diese Eigenschaft liegt daran, dass, wie oben angegeben,
das Dimer stabil und unwirksam ist, während das Monomer wirksam ist.
Drittens wird das NO-Donatorpotential durch die Umwandlungsrate
von Dimer und Monomer ineinander (Kinetic) beeinflusst. Dieses Merkmal
kann benutzt werden, beispielsweise in dem man ein Acyl alpha zu
dem Nitroso-Kohlenstoff positioniert, um die Umwandlungsrate zum
Monomer zu verlangsamen. Andererseits ist die NO-Donatorfähigkeit
organischer Nitrite und Nitrosothiole im großen Umfang eine Funktion des
Heteroatoms (Sauerstoff oder Schwefel); es gibt wenig in der Art
einer Beziehung zwischen Struktur und Wirksamkeit.
-
Wir
kommen nun zum Maßschneidern
der Reaktivität
der C-Nitroso-Verbindungen. Dies kann sterisch oder elektronisch
erreicht werden. Wir kommen nun zum sterischen Maßschneidern
der Reaktivität.
Die Hinzufügung
einer sterischen Masse am α-Kohlenstoff
verlangsamt die Übertragung
eines Nitrosonium-Äquivalents.
So können
beispielsweise hochgradig gehinderte Protein-Sulphydryl-Rezeptoren
durch Verwendung hochgradig gehinderter C-Nitroso-Donoren gegen
S-Nitrosylierung geschützt
werden. Wir kommen nun zum elektronischen Maßschneidern der Reaktivität. Erstens
ist die Übertragungsrate
eines Nitrosonium-Äquivalents
direkt proportional zur Acidität
der Ausgangs-Kohlenstoffsäure.
Zweitens kann die Reaktivität
durch Wählen
von Ausgangsmaterial mit Gruppen, die das Donatorpotential maßschneidern
können,
maßgeschneidert werden.
Beispielsweise erniedrigt die Hinzufügung von Gruppen wie Acyl und
von elektronegativen Substituenten die Acidität der Kohlenstoffsäure und
steigert in der Folge die NO+-Donatorkapazität der C-Nitroso-Verbindung.
Darüber
hinaus verändert
die Abänderung
von Gruppen die Form von freigesetztem Stickstoffoxid. Die Abänderung
von Gruppen kann die Acidität
um bis zu 1040 verändern, was den Bereich, der
mit Konjugaten auf Schwefel- oder Sauerstoff-Basis verfügbar ist,
stark überschreitet.
-
Verfahren
zur Bereitstellung unterschiedlicher Gruppen in C-Nitroso-Verbindungen
sind in den oben beschriebenen Syntheseverfahren verfügbar, wo
Brommethylketon-Derivate von entweder 3-Nitroso-2,4-pentandion oder
von 4-Nitroso-2,3-butadion verwendet werden, und diese Gruppen können die
Monomer-Dimer-Eigenschaften
und das NO-Donatorpotential des Endprodukts beeinflussen.
-
Wie
oben angegeben, können
die C-Nitroso-Verbindungen der ersten Ausführungsform, wenn sie von konventionellen
Arzneimitteln abgeleitet sind, anstelle des konventionellen Arzneimittels
verwendet werden, und die Verwendungs verfahren sind jene für das konventionelle
Arzneimittel, wenn auch die Dosierung variiert werden kann, um eine
therapeutisch wirksame Menge bereitzustellen. So kann in einem Fall
ein Patient mit einer entzündlichen
oder schmerzhaften Erkrankung behandelt werden, indem dem Patienten
eine therapeutisch wirksame Menge einer C-Nitroso-Verbindung mit
einem Molekulargewicht im Bereich von 225-600 auf Monomerbasis,
bei der eine Nitrosogruppe an einen tertiären Kohlenstoff gebunden wird,
die durch Nitrosylierung eines nicht-steroidalen antiinflammatorisch
wirkenden Arzneimittels mit einem Kohlenstoffsäure-pKa im Bereich von 15-25,
z. B. 15-20, oder eines nicht-steroidalen antiinflammatorisch wirkenden
Arzneimittels, das modifiziert wurde, um einen Kohlenstoffsäure-pKa
im Bereich von 15-25, z. B. 15-20, zu haben, erhalten wird, verabreicht
wird. In einem anderen Fall kann ein Patient mit einer Erkrankung,
die mit einem analgetischen Arzneimittel behandelbar ist, behandelt
werden durch Verabreichen einer therapeutisch wirksamen Menge einer
C-Nitroso-Verbindung, wie in dem obigen Satz beschrieben, mit der
Ausnahme, dass das Behandlungsmittel ein nitrosyliertes analgetisches
Arzneimittel mit einem Kohlenstoffsäure-pKa im Bereich von 15-25,
z. B. 15-20, oder ein analgetisches Arzneimittel, das modifiziert
wurde, um einen Kohlenstoffsäure-pKa
im Bereich von 15-25, z. B. 15-20, zu haben, und dann nitrosyliert
wurde, ist. In noch einem anderen Fall kann ein Patient mit Angina
behandelt werden durch Verabreichen einer C-Nitroso-Verbindung,
wie in diesem Abschnitt beschrieben, mit der Ausnahme, dass das
Behandlungsmittel ein nitrosyliertes, gegen Angina wirksames Arzneimittel
mit einem Kohlenstoff und pKa im Bereich von 15-25, z. B. 15-20, oder ein gegen
Angina wirksames Arzneimittel, das modifiziert wurde, um den Kohlenstoffsäure-pKa
zu haben, und dann nitrosyliert wurde, ist. In noch anderen Fällen werden
blutdrucksenkende Arzneimittel, diuretische Arzneimittel, ACE-Inhibitoren,
Arzneimittel gegen Hypercholesterinämie/Lipoproteinämie, Calciumkanal-Blocker,
Antacide, Bronchodilatatoren, NMDA-antagonistische/Skelettmuskel
entspannende Arzneimittel, Arzneimittel gegen Proliferation/tubulinbindende
Arzneimittel, Mittel gegen Tuberkeln, CETP-Inhibitoren, SOD-Mimetika
oder Xanthinoxidase-Inhibitoren, die einen Kohlenstoffsäure-pKa im Bereich von
15-25, z. B. 15-20, haben, nitrosyliert oder modifiziert, um einen
Kohlenstoffsäure-pKa
von weniger als 25 zu haben, und dann nitrosyliert, um eine Verbindung
der ersten Ausführungsform
hierin zu liefern, und in einer therapeutisch wirksamen Menge an
einen Patienten, für
den das Arzneimittel indiziert ist, verabreicht.
-
Darüber hinaus
können
C-Nitroso-Verbindungen der ersten Ausführungsform hierin in Polymere
für Beschichtungen
auf medizinischen Vorrichtungen eingebaut werden. Im Fall solcher
Beschichtungen können polymerisierbare
C-Nitroso-Verbindungen mit geeigneten Monomeren copolymerisiert
werden, um Kunststoffe oder Elastomere, wie sie gewünscht werden,
zu ergeben.
-
Die
Polymere, in die C-Nitroso-Verbindungen der ersten Ausführungsform
hierin und andere C-Nitroso-Verbindungen mit pKa-Werten von weniger
als 25 eingebaut werden können,
umfassen alle biologisch verträglichen
Polymere, einschließlich
PVP- und PVP-Urethan-Copolymere; Hydrogele; Polylactide und Polylactid-co-Polyethylenglycol;
Polyacrylnitrile, Polyacrylnitril/Polyacrylamid/Polyacrylssäure-Copolymere;
Polyurethane, Polycarbonate, Polyether und Copolymere der drei;
Silicon-Polymere und Copolymere; Kohlehydrat-Polymere, einschließlich Stärken und
modifizierten Stärken,
Cellulose und Cellulosematerialien, Chitin und Chitosan, Glycosamin-glycane,
einschließlich
Hyaluronsäure,
Chondroitin und Chondroitinsulfat, worin das Polymer modifiziert
wurde, dass es von Kohlenstoffsäuren
mit pKa-Werten von weniger als 25 abgeleitete C-Nitroso-Baueinheiten
eingebaut enthält.
Die C-Nitroso-Baueinheiten können
als Ester oder Ether an anhängende
Hydroxylgruppen, als Ester an anhängende Carbonsäure oder
als Amine oder Amide an anhängende Amino-Baueinheiten
gebunden werden. Das nitrosilierte Polymer selbst kann auf eine
Vielfalt von Arten hergestellt werden. Nitrosylierte Monomere können in
ein wachsendes Polymer entweder während einer radikalischen,
ionischen, Metathese- oder lebenden Polymerisation eingebaut werden.
Alternativ kann ein fertiges Polymer nach der Synthese derivatisiert
werden, um die oben aufgelisteten Reste einzubauen, indem man beispielsweise
hydroxylierte oder Amin enthaltende Polymere mit Carbonsäurechloriden
oder Alkylhalogeniden, Carboxylat enthaltende Polymere mit Alkylhalogenid
behandelt. Schließlich
kann ein C-Nitroso-Vorläufer,
beispielsweise ein Monomer, das ein Dion oder ein Vinylsilan enthält, in eine
wachsende Polymerkette durch radikalische, ionische, metatese- oder
lebende Polymerisation einpolymerisiert und dann nach der Polymerisation
nitrosyliert werden, indem er einer Nitrosonium-Quelle, beispielsweise
angesäuer tem
Nitrit, Titantetrachlorid bzw. einem Alkylnitrit ausgesetzt wird.
Jene Polymere können
massegemittelte Molekülmassen
(bestimmt durch Lichtstreuung) im Bereich von, beispielsweise, 50.000-500.000
haben.
-
Wie
oben angegeben, betrifft eine Ausführungsform hierin Polymere,
in die eine von einer Kohlenstoffsäure mit einem pKa von weniger
als 25 abgeleitete C-Nitroso-Baueinheit eingebaut ist, die eine
massegemittelte Molekülmasse
(wie durch Lichtstreuung bestimmt) im Bereich von 50.000-500.000
haben. Der Begriff "C-Nitroso-Baueinheit" bedeutet, dass irgendein
Teil des Polymers C-Nitroso enthält,
das von einer Kohlenstoffsäure
mit einem pKa von weniger als 25 abgeleitet ist. Diese Art von Polymer
ist oben beschrieben und umfasst, beispielsweise, ein hydroxyliertes,
Amin enthaltendes oder Carboxylat enthaltendes Polymer, das eine
von einer Kohlenstoffsäure
mit einem pKa-Wert von weniger als 25 abgeleitete C-Nitroso-Baueinheit
eingebaut enthält,
z. B. ein mit einem Carbonsäurechlorid
oder Alkylhalognid derivatisiertes, hydroxyliertes oder Amin enthaltendes
Polymer, das eine C-Nitroso-Baueinheit enthält, die von einem Kohlenstoff
und mit einem pKa-Wert von weniger als 25 abgeleitet ist, oder ein
mit einem Alkylhalogenid derivatisiertes, Carboxylat enthaltendes
Polymer, das eine C-Nitroso-Baueinheit enthält, die von einer Kohlenstoffsäure mit
einem pKa-Wert von weniger als 25 abgeleitet ist.
-
Wie
oben angegeben, betrifft eine andere Ausführungsform hierin eine medizinische
Vorrichtung mit einer therapeutisch wirksamen Beschichtung aus Polymer,
in das eine C-Nitroso-Baueinheit eingebaut ist, wie in dem obigen
Abschnitt beschrieben. Diese Ausführungsform umfasst Stents,
die mit einem Polymer, das eine C-Nitroso-Baueinheit enthält, wie
oben beschrieben, beschichtet sind, um eine Koagulation zu verhindern,
einem Katheter, der mit einem Polymer, das eine C-Nitroso-Baueinheit
enthält,
wie oben beschrieben, beschichtet ist, um eine Infektion zu verhindern,
und eine Drainage, die mit einem Polymer, das eine C-Nitroso-Baueinheit
enthält,
wie oben beschrieben, beschichtet ist, um eine Infektion und Koagulation
zu verhindern.
-
Wir
kommen nun zu Verfahren zur Verwendung der Polymere hierin, die
eine C-Nitroso-Baueinheit enthalten. Diese Verfahren umfassen, beispielsweise,
die Prophylaxe eines Patienten, bei dem ein Risiko einer Koagulation
oder Throm busbildung oder einer mikrobiellen oder viralen Infektion
besteht, aufweisend das in Berührung
bringen von Gewebe in dem Gebiet, in dem das Risiko besteht, mit
Polymer hierin, das eine C-Nitroso-Baueinheit enthält, z. B.
durch Einsetzen eines Stents, der mit dem Polymer beschichtet ist,
in einen Patienten, bei dem Restenose vorliegt oder ein Restenoserisiko
besteht.
-
Beispiele
für Inhibitoren
von COX-2, bei denen ein tertiärer
Kohlenstoff nitrosyliert ist, sind die oben angegebenen Verbindungen
(115)-(129).
-
Die
Dosierung auf COX-2-Inhibitor-Basis ist dieselbe wie die Dosierung
für den
underivatisierten COX-2-Inhibitor. Um dies zu bewirken, kann nur
ein Teil des COX-2-Inhibitors in der Form einer nitrosylierten Verbindung
verabreicht werden. Der Verabreichungsweg ist derselbe wie für den underivatisierten
COX-2-Inhibitor.
-
Die
Erfindung wird durch die folgenden Arbeitsbeispiele veranschaulicht.
-
Beispiel I
-
Synthese
von dimerer 2-[4'-(α-Nitroso)isobutyrylphenyl]propionsäure Die
Synthese von dimerer-2-[4'-(α-Nitroso)isobutyrylphenyl]propionsäure wurde
nach dem oben dafür
dargelegten Reaktionsschema wie folgt ausgeführt: Zu einer Lösung von
Ibuprofen 1A (9,89 g, 48 mmol) in wasserfreiem EtOH (35 mL) wurde Chlortrimethylsilan
(18,27 mL, 144 mmol) bei Raumtemperatur zugegeben, und das Gemisch
wurde 2h lang bei derselben Temperatur gerührt. Nach der Entfernung des überschüssigen EtOH
und Chlortrimethylsilans unter verringertem Druck wurde der ölige Rückstand
mit eiskaltem, gesättigtem
NaHCO3 (150 mL) behandelt, und das sich
ergebende Gemisch wurde mit Hexanen (450 mL) extrahiert. Die Hexanlösung wurde
mit Salzlösung
(3×50
mL) gewaschen und über
wasserfreiem Na2SO2 getrocknet.
Verdampfung des Lösungsmittels lieferte
Ethyl-2-(4'-Isobutylphenyl)propionat
2A (11,24 g in 100%iger Ausbeute) als ein farbloses Öl.
-
Ester
2A (11,23 g, 48 mmol) wurde tropfenweise innerhalb von 30 Min. zu
einer gerührten
Suspension von CrO3 (20,8 g, 208 mmol) in
Essigsäure
(AcOH) (34 mL) und H2O (1,1 mL) zugegeben,
wobei die Reaktionstemperatur bei 45-55° C gehalten wurde. Nach Vollendung
der Zugabe wurde das Gemisch 20 Min. lang gerührt, und dann wurde das Gemisch
unter Rühren
für zusätzliche
85 Min. bei 50-55° C
erhitzt, was eine blauschwarze Suspension ergab. Die AcOH wurde
unter verringertem Druck entfernt, und der feste Rückstand
wurde in eiskaltem H2O (400 mL) suspendiert
und mit EtOAc (450 mL) extrahiert. Der Extrakt wurde mit Salzlösung (5×50 mL)
gewaschen und getrocknet (Na2SO4).
Die Rohprodukte wurden durch Flashchromatographie (Elution mit 7%
EtOAc in Hexanen) gereinigt, um unreagierten Ester 2A, (2,78 g)
zu ergeben, gefolgt von Ethyl-2-(4'isobutyrylphenyl)propionat
3a (4,3 g, 48% Ausbeute auf der Basis von verbrauchtem 2A) als ein
hellgelbes Öl.
-
15%ige
wässrige
NaOH (10 mL) wurde zu einer Lösung
von 3A (3,2 g, 12,9 mmol) in MeOH (150 mL) zugegeben und 2h lang
bei Raumtemperatur gerührt.
Nach der Entfernung des MeOH mittels Verdampfer wurde der dunkelbraune
Rückstand
mit eiskalter 2M HCl (100 mL) behandelt, und die sich ergebende
grauweiße Suspension
wurde mit EtOAc (400 mL) extrahiert und schließlich getrocknet (Na2SO4). Flachchromatographische
Reinigung der Rohprodukte (Elution mit 60% EtOAc in Hexanen) lieferte
2-(4'-Isobutyrylphenyl)propionsäure 4a (2,5
g, 88% Ausbeute) als einen amorphen Feststoff.
-
Zu
einem gerührten
Gemisch von 4A (1,59 g, 7,2 mmol) und Triethylamin (3,03 mL, 21,7
mmol) wurde Chlortrimethylsilan (2,75 mL, 21,7 mmol) bei Raumtemperatur
zugegeben, und dann wurde eine Lösung
von Natriumiodid (3,26 g, 21,7 mmol), gelöst in wasserfreiem Acetonitril
(25 mL), auf einmal hinein gegeben. Das Gemisch wurde bei Raumtemperatur
8h lang gerührt,
dann mit Hexanen (400 mL) extrahiert. Der Hexan-Extrakt wurde mit
eiskalter Salzlösung
(2×30
mL) gewaschen und getrocknet (Na2SO4). Einengung des Lösungsmittels lieferte Trimethylsilyl-2-[4'-(2-trimethylsiloxy-1-isobutenyl)phenyl]propionat
5A (2,08 g, 79% Ausbeute) als ein viskoses Öl, das ohne weitere Reinigung
verwendet wurde.
-
Eine
Lösung
von 5A (2,1 g, 5,7 mmol), gelöst
in wasserfreiem CH2Cl2 (25
mL), wurde auf –10° C abgekühlt. Isoamylnitrit
(2,4 mL, 17,6 mmol) wurde auf einmal zugegeben, dann wurde 1M TiCl4 CH2Cl2-Lösung (13,0
mL, 13,0 mmol) innerhalb einer Zeitspanne von 20 Min. bei –10° C tropfenweise
zugegeben. Nach Rühren
bei derselben Temperatur für
zusätzliche
60 Min. wurde das sich ergebende tiefgrüne Gemisch in eiskaltes H2O (100 mL) gegossen und für 5-10 Min.
gerührt,
dann mit EtOAc (400 mL) extrahiert und schließlich getrocknet (Na2SO4). Verdampfung
des Lösungsmittels
unter verringertem Druck ergab einen amorphen Feststoff, der in
CH2Cl2 (50 mL) suspendiert
und durch Filtration gesammelt wurde. Der weiße Feststoff wurde mit zusätzlichem
CH2Cl2 (3×10 mL)
gewaschen, um dimere 2-[4'-(α-Nitroso)isobutyrylphenyl]propionsäure 6A (0,75
g, 53% Ausbeute) zu ergeben.
-
Beispiel II
-
Die
Fähigkeit
verschiedener C-Nitroso-Verbindungen, wie unten beschrieben, einen
Kaninchen-Aortenring (glattes, unwillkürliches Muskelgewebe) zu entspannen,
wurde ausgeführt,
wie beschrieben in Stamler, J., et al., PNAS, Vol. 89, 44-448 (1992).
-
Die
Ergebnisse sind in den 1 bis 10 gezeigt,
die Aufzeichnungen der Kraft (Spannung) in der Y-Richtung gegen
die Zeit in der X-Richtung sind, wobei die Richtung nach unten Entspannung
anzeigt und die Richtung nach oben Zusammenziehen anzeigt. Die Konzentrationen
an C-Nitroso-Verbindung, die zu einer Zeit in der X-Richtung angewendet
wurden, sind als 10–9 (1 nanomolar), 10–6 (1
mikromolar), 10– 3 (1
millimolar), etc., angegeben. "PE" in den Figuren bedeutet
die Anwendung von Phenylephrin, einem Konstriktionsmittel.
-
1 zeigt
Ergebnisse für
Verbindung (129a), die eine C-Nitroso-Verbindung ist, die durch
Nitrosylieren einer Kohlenstoffsäure
mit einem pH von weniger als 10 erhalten wurde. Der Entspannungseffekt
ist in 1 bei einer Konzentration von
10 μm, d.
h. bei mikromolaren Konzentrationen, gezeigt.
-
2 zeigt
Ergebnisse für
C-Nitroso-methylmalonsäure.
Sie wird aus einer Kohlenstoffsäure
mit einem pKa von 30-35 erhalten. Wie in 2 gezeigt,
weist sie einen Entspannungseffekt bei 10 mikromolarer Konzentration
auf (sehr schwache Wirksamkeit).
-
3 zeigt
Ergebnisse für
C-Nitrosobenzol. Es wird aus einer Kohlenstoffsäure mit einem pKa von etwa
45 erhalten. Wie in 3 gezeigt, weist es bei mikromolarer
Konzentration keine Wirksamkeit auf.
-
4 zeigt
Ergebnisse für
C-Nitrosophenol. C-Nitrosophenol wird aus einer Kohlenstoffsäure mit
einem pKa von größer als
25 erhalten. Wie in 4 gezeigt, weist es bei mikromolaren
Konzentrationen keine Wirksamkeit auf.
-
5 zeigt
Ergebnisse für
das in Beispiel 1 synthetisierte Nitrosoketoibuprofen. Wie in 5 gezeigt, weist
es bei 10 nanomolarer Konzentration einen Entspannungseffekt auf.
-
6 zeigt
weitere Ergebnisse für
das in Beispiel 1 synthetisierte Nitrosoketoibuprofen. 6 zeigt denselben
Entspannungseffekt bei 10 nanomolarer Konzentration, wie es 7 tut,
aber keine viel höhere Wirksamkeit
bei höherer
Konzentration (da sich das Gleichgewicht bei höheren Konzentrationen in die
Richtung des unwirksamen Dimers verschiebt).
-
7 zeigt
Ergebnisse für
das in Beispiel I synthetisierte Nitrosoketoibuprofen, das in Verbindung
mit 100 μM
Glutathion verwendet wird. Wie in 7 gezeigt,
gibt es keine Wirksamkeit, weil Glutathion die Wirksamkeit des Nitrosoketoibuprofens
blockiert, indem es einen Komplex damit bildet, um die NO-Gruppe
zu binden (dasselbe Vorkommnis wie bei dem Dimer); dies ist eine
Widerspiegelung der C-N(O)R-Gruppe, die oben beschrieben wurde.
-
8 zeigt
mehr Ergebnisse für
das in Beispiel I synthetisierte Nitrosoketoibuprofen. Entspannung
ist bei einer Konzentration von 1 und 10 nM gezeigt. Dies unterscheidet
sich wegen der natürlichen
Unterschiedlichkeit von Blutgefäßen etwas
von dem, was in den 5 und 6 gezeigt
ist.
-
9 zeigt
Ergebnisse für
3-Methyl-3-nitroso-2,4-pentandion, das aus einer Kohlenstoffsäure mit
einem pKa von weniger als 10 erhalten wird. Diese Verbindung ist
nicht wasserlöslich.
Sie weist einen Entspannungseffekt bei einer Konzentration von größer als
10 mikromolar und einen weiteren Effekt bei einer Konzentration
von größer als
100 mikromolar auf, aber wenn 100 μM Glutathion zugegeben werden,
weist sie einen Entspannungseffekt bei einer Konzentration zwischen
1 und 10 nanomolar auf. Der Potenzierungseffekt tritt auf, weil
das C-Nitrosodion mit Glutathion unter Bildung von S-Nitrosoglutathion
reagiert.
-
10 zeigt Ergebnisse für 2-Methyl-2-nitrosopropan.
Es wird aus einer Kohlenstoffsäure
mit einem pKa von etwa 55 erhalten und ist nicht wasserlöslich. Es
weist bei keiner der verwendeten Konzentrationen eine Entspannungseffekt-Wirkung auf.
-
Beispiel III
-
Ein
60 Jahre alter weißer
Mann mit Arthritis, Speiseröhrenkrampf,
koronarer Herzerkrankung, kongestiver Herzinsuffizienz, Impotenz
und nächtlicher
Harninkontinenz entwickelt eine gastrointestinale Verstimmung, wenn
ihm Ibuprofen (400 mg, dreimal täglich)
verabreicht wird. Wenn das Arzneimittel gewechselt wird, so dass
0,1 Gew.% des Arzneimittels als das dimere Nitrosoketoibuprofen
von Beispiel I verabreicht werden, werden alle Symptome gelindert.
-
Beispiel IV
-
Ein
65 Jahre alter Mann mit Angina, der mit Nitroglycerin behandelt
wird, entwickelt Nitrat-Toleranz. Die Verabreichung von Nitroglycerin
wird beendet, und Verbindung (135a) wird kontinuierlich mit 20 μg/min gegeben,
wobei die Angina gelindert wird.
-
Beispiel V
-
Ein
62 Jahre alter weißer
Mann mit schwerer rheumatoider Arthritis stellt sich mit einem Herzinfarkt vor.
Sein nicht-steroidales anti-inflammatorisch wirkendes Arzneimittel
wird abgesetzt wegen Bedenken eines erhöhten kardiovaskulären Risikos.
Seine Gelenkschmerzen werden entkräftend. Celebrex wird zweimal
am Tag in einer Menge von 200 mg oral verabreicht mit der Ausnahme,
dass 0,1 Gew.% des Arzneimittels als Verbindung (115), worin R1 und R2 Methyl sind,
verabreicht werden, wobei sowohl die Gelenkschmerzen als auch die
Angina gelindert werden.
-
Wenn
die Verbindung (115) durch Verbindung (200), worin R1 und
R2 H sind und X -CH2-
ist, und Y S oder O ist, in gleicher Menge ersetzt wird, wird ebenfalls
eine Linderung von sowohl Gelenkschmerzen als auch Angina erhalten.
-
In der Beschreibung zitierte
Literaturstellen
-
Diese
Liste von Literaturstellen, die vom Anmelder zitiert wurden, ist
nur für
die Bequemlichkeit des Lesers gedacht. Sie ist nicht Teil der europäischen Patentschrift.
Bei der Zusammenstellung der Literaturstellen wurde zwar mit großer Sorgfalt
vorgegangen, aber Irrtümer
oder Auslassungen können
nicht ausgeschlossen werden, und das EPA schließt in dieser Hinsicht jede
Haftung aus.
-
In der Beschreibung zitierte Nicht-Patentliteratur
-
- • GROVES,
P. et al. Cardiovascular Research, 1992, vol. 26, 615-619 [0002]
- • GROVES,
P et al. Circulation, 1993, vol. 87, 590-597 [0002]
- • KNIGHT
et al. Circulation, 1997, vol. 95, 125-132 [0002]
- • Methods
in Nitric Oxide Research. John Wiley & Sons, 1996, 71-115 [0003]
- • REHSE,
K. et al. Arch. Pharm. Pharm. Med. Chem, 1998, vol. 331, 104-110
[0004]
- • REHSE,
K. et al. Arch. Pharm. Pharm Med. Chem, 1998, vol. 331, 79-84 [0004]
- • SKLYAR;
YU. E. et al. Khimiya Geterotsiklicheskikh Soedinenii, 1969, vol.
5, 70-73 [0005] [0153]
- • SHINMURA,
K. et al. PNAS, 2000, vol. 97, 10197-10202 [0019]
- • OKAMOTO
et al. Nature, 2000, vol. 406 [0124]
- • Methods
of Formation of the Nitroso Group and its Reactions. BOYER, J. H.
The Chemistry of the Nitro and Nitroso Groups. John Wiley & Sons, 1969, 215-299
[0152]
- • TOUSTER,
O. Organic Reactions. John Wiley & Sons,
1955, vol. 7, 327-377 [0152]
- • ROMINE,
J. L. Bis-protected hydroxylamines as reagents in organic synthesis.
A review. Org. Prep. Proced. Int., 1996, vol. 28, 249-288 [0158]
- • STAMLER,
J. et al. PNAS, 1992, vol. 89, 444-448 [0200]