利用O6-烷基鸟嘌呤-DNA烷基转移酶的方法
技术领域
本发明涉及将标记从底物转移至含有目的蛋白和O6-烷基鸟嘌呤-DNA烷基转移酶(AGT)的融合蛋白中,具体是涉及进一步包括检测和/或操作该标记的融合蛋白的方法。
背景技术
对复杂的生物系统认识的进展依赖于对基本的生物分子,尤其是蛋白的相互作用的鉴定。尽管越来越多的生物体的DNA测序确定了其开放读框(ORF),但研究活细胞中相应蛋白的性能,以及鉴定多种蛋白在体内和体外的相互作用的可能性受到限制。大多数针对于实现这种目的的策略是基于融合蛋白的构建,当该偶联蛋白的环境改变时,该融合蛋白会引起物理、生理或化学的反答。这种例子包括酵母-双杂交系统、断裂泛素和绿色荧光蛋白(GFP)融合蛋白。但是,所有这些技术都有不同的限制或缺点。
德国专利申请No:19903895A(KaiJohnsson)描述了一种ELISA测定方法,用于检测O6-烷基鸟嘌呤-DNA烷基转移酶(AGT)。亲电体,例如N-甲基-N-亚硝基脲的诱变和致癌作用主要是由于DNA中的鸟嘌呤的O6-烷基化。为了防止基DNA烷基化,哺乳动物和细菌具有一种蛋白,即O6-烷基鸟嘌呤-DNA烷基转移酶(AGT),该酶可修复这种病变〔Pegg等,1995〕。在SN2反应中,AGT将烷基转移到其自身的一个半胱氨酸中,产生不可逆的烷基化的酶。由于AGT在肿瘤细胞中的高表达使其能获得药物抗性,尤其是对烷基化药物,例如,西卡巴肼、达卡巴嗪、泰莫佐罗和双-2-氯乙基-N-亚硝基脲的抗性,AGT的抑制剂已被建议用作化学治疗中的致敏剂〔Pegg等,1995〕。DE 19903895A公开了一种测定AGT水平的分析方法,该方法依赖于生物素化的O6-烷基鸟嘌呤衍生物和AGT之间的反应,该反应导致AGT的生物素化。该反应随后也能使AGT在包被链霉抗生素蛋白的平板上分离出来并对其检测,例如在ELISA测定中。该测定方法已被建议用于监测肿瘤组织中的AGT水平,在化学治疗中用AGT抑制剂作为致敏剂进行调节治疗,以及用于筛选AGT抑制剂。Damoiseaux、Keppler和Johnsson(Chem Biochem,4:285-287,2001)公开了掺入寡脱氧核糖核苷酸中的修饰的O6-烷基化的鸟嘌呤衍生物,用作标记AGT的化学探针,更方便了对该酶在癌细胞中水平的检测,以有助于研究和化学治疗。两种类型的各种AGT底物和对生物素标记的AGT的测定已公开(与DE19903895A中所述相同)。此外,还建议在AGT的直接进化中使用这些O6-烷基化衍生物。
发明简述
广义地说,本发明涉及O6-烷基鸟嘌呤-DNA烷基转移酶(AGT)在标记以及任选随后操作和/或检测系统中蛋白或肽的方法中的进一步用途,在该系统中,蛋白或肽和AGT的融合物与标记的底物接触,使AGT将标记从底物转移至AGT融合物,从而依赖于转移的标记使标记的AGT-蛋白融合物能被操作和检测。这与现有技术的测定方法相反,该测定方法测量不以融合蛋白形式存在的AGT水平。
因此,本发明的第一个方面是提供一种方法,该方法包括使含有目的蛋白和O6-烷基鸟嘌呤-DNA烷基转移酶(AGT)的融合蛋白与带有标记的底物接触,从而使AGT将标记转移而使其与融合蛋白共价结合。将标记转移至融合蛋白后,该方法可以另外包括进一步检测和操作该标记的融合蛋白的步骤。
在一个实施方案中,本发明提供一种标记含有目的蛋白和O6-烷基鸟嘌呤-DNA烷基转移酶(AGT)融合蛋白的方法,该方法包括使融合蛋白与带有标记的底物接触,从而使AGT将标记转移而使其与融合蛋白共价结合。
在一些实施方案中,该方法包括一个或多个其它步骤,例如检测和/或操作标记的融合蛋白。
再一个方面,本发明提供一种检测含有目的蛋白和O6-烷基鸟嘌呤-DNA烷基转移酶(AGT)的融合蛋白的方法,该方法包括使该融合蛋白与带有标记的底物接触,从而使AGT将标记转移而使其与融合蛋白共价结合,并利用该标记检测该蛋白构建体。
还有一个方面,本发明提供一种操作包含目的蛋白和O6-烷基鸟嘌呤-DNA烷基转移酶(AGT)的融合蛋白的方法,该方法包括使该融合蛋白与带有标记的底物接触,从而使AGT将标记转移而使其与融合蛋白共价结合,并利用由标记引入融合蛋白的物理和化学性质而对该融合蛋白加以操作。
在本发明该方面的一些实施方案中,上述方法可包括用标记检测蛋白构建体。
另一个方面,本发明提供一种将含有目的蛋白和烷基鸟嘌呤-DNA烷基转移酶(AGT)的融合蛋白固定在固体支持物上的方法,该方法包括使该融合蛋白与带有标记的底物接触,该标记连接或可连接在固体支持物上,其中AGT将标记转移而使其与融合蛋白共价结合,该融合蛋白从而连接或随后可连接到固体支持物上。在本发明的实施方案中,其中标记在开始不是连接在固体支持物上时,该方法可进一步包括使标记的融合蛋白与固体支持物接触的步骤,从而使其固定在固体支持物上。在本发明这个方面的此优选方案中,标记可以在其被转移,或在随后的反应中与固体支持物共价连接;或者标记可以是特异结合对的成员之一,该特异结合对中的另一成员,通过共价或其他方式(例如,用生物素和抗生素蛋白或链霉素抗生物素蛋白的特异结合对)连接或可连接在固体支持物上。
在还有一个方面,本发明提供一种在体内以及在体外标记AGT融合蛋白的方法。术语AGT融合蛋白的体内标记包括在细胞的所有区室,以及指向细胞外空间的AGT融合蛋白中进行标记。如果AGT融合蛋白的标记在体内进行,而且与AGT融合的蛋白是质膜蛋白,则融合蛋白的AGT部分可以与细胞质或质膜的胞外侧连接。如果标记在体外进行,融合蛋白的标记可以在细胞提取物中进行,或用AGT融合蛋白的纯化或富集形式进行。
此外,本发明提供一种在体内细胞中标记AGT融合蛋白的方法,进一步包括用表达载体转化细胞的起始步骤,该表达载体包含编码融合蛋白、与控制序列连接以指导其表达的核酸。
在另一个方面,本发明提供一种测定候选化合物或候选化合物库和靶物质或靶物质库中的相互关系的方法。所说的化合物或物质的例子包括配体和蛋白、药物和该药物的靶、或小分子和蛋白。在所述方法中,与AGT融合的目的蛋白包含转录因子的DNA结合域或激活域,靶物质或靶物质的库与转录因子的另一个DNA结合域或激活域结合,标记是怀疑与靶物质相互作用的候选化合物或候选化合物库。
在优选的实施方案中,该方法可以进一步包括将候选化合物或候选化合物的库转至AGT融合蛋白,并使候选化合物标记的AGT融合蛋白与靶物质接触,从而使与AGT融合蛋白连接的候选化合物与靶物质的相互作用激活转录因子。激活的转录因子然后可驱动报道分子的表达,如果该方法在细胞中进行,可以检测该报道分子的表达是否赋予细胞选择性的优点。在某些实施方案中,该方法可进一步包括一个或多个步骤,例如对候选化合物或靶物质进行检测、分离、鉴定或表征的步骤。
在本申请中,O6-烷基鸟嘌呤-DNA烷基转移酶或’AGT’具有将底物上存在的标记转移至AGT的半胱氨酸残基之一上而形成融合蛋白的一部分的性质。因此,在本发明的一种优选实施方案中,标记与融合蛋白的半胱氨酸残基共价结合。
在优选的实施方案中,AGT是O6-烷基鸟嘌呤-DNA烷基转移酶,例如人的O6-烷基鸟嘌呤-DNA烷基转移酶,该酶在Pegg等,1995及其参考文献中有描述。但是,其他烷基鸟嘌呤-DNA烷基转移酶是已知的,如Rog等,1995中所述的鼠科动物或大鼠形式的酶,只要这些酶具有以上定义的性质,则可以用于本发明中。在本发明中,O6-烷基鸟嘌呤-DNA烷基转移酶也包括各种野生型的AGT,它们可能由于1个或多个氨基酸取代、缺失或添加而与人、大鼠、或鼠科动物的O6-烷基鸟嘌呤-DNA烷基转移酶不同,但它们仍然保留将底物上存在的标记转移到AGT或与其形成融合物的蛋白或肽上的性质。其他AGT的变体也可采用本领域技术人员所熟知的技术进行化学修饰。AGT变体可以用技术人员所熟知的蛋白质工程技术来生产和/或用分子进化来产生并选择新的O6-烷基鸟嘌呤-DNA烷基转移酶。
在本发明中,含有AGT的融合蛋白中的蛋白部分包括有和没有二级、三级、四级结构的蛋白、多肽和任何长度的肽。例如,目的蛋白可以融合到AGT的N-或C-端。本发明应用的例子在以下提供。
在本发明中,标记的底物优选是标记的苄基鸟嘌呤底物,更优选的是O6-苄基鸟嘌呤衍生物。这种衍生物的一个例子是O6-苄基鸟嘌呤衍生物,该衍生物是在苄基环的4-位衍生的衍生物,具有以下通式:
其中:
R1是质子,β-D-2’-脱氧核糖基,或是作为寡脱氧核糖核苷酸的一部分的β-D-2’-脱氧核糖基,所述寡脱氧核糖核苷酸的优选长度为2-99个核苷酸;
R2是接头基团,例如是柔性的接头,如取代或未取代的烷基链,聚乙二醇;以及
标记是负责这里所述的融合蛋白的检测和/或操作的分子。
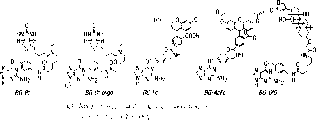
适合于本发明使用的修饰的O6-苄基鸟嘌呤衍生物的例子在图1中提供。此外,本发明人发现AGT在底物的相同性方面,耐受相当大程度的变动,因此可以使用以下通式的范围广的底物:
其中:R1是被AGT接受的基团,允许AGT将标记转移至AGT-蛋白融合物,例如取代或未取代的烷基链,环大小为3-10个碳的取代或未取代的环烷基,环大小为3-10个碳的取代或未取代的杂环,环大小为3-10个碳的取代或未取代的芳香杂环;
R2是接头基团,例如不同长度的柔性接头,如取代或未取代的烷基链或聚乙二醇;和
R3是质子,β-D-2’-脱氧核糖基,或是作为寡脱氧核糖核苷酸的一部分的β-D-2’-脱氧核糖基,所述寡脱氧核糖核苷酸的优选长度为2-99个核苷酸;以及,
标记是负责这里所述的融合蛋白的检测和/或操作的分子。
底物的标记部分可以由本领域的熟练技术人员根据融合蛋白的应用来选择。标记的例子包括:
(1)光谱探针,例如荧光团,发色团,磁性探针或造影剂;
(2)放射性活性的标记分子;
(3)作为特异结合对中的一部分的分子,该分子能与其配偶体特异结合。这种特异结合对在本领域是众所周知的,例如包括生物素,它可与抗生物素蛋白或链霉抗生物素蛋白结合;
(4)推测可与其他生物分子相互作用的分子;
(5)推测可与其他生物分子相互作用的分子的库;
(6)本领域技术人员所熟知的能与其他生物分子交联的分子(Nadeau等,2002);
(7)暴露于H2O2和抗坏血酸时能够产生羟基自由基的分子,例如束缚的(tethered)金属螯合物(Hori等,2002);
(8)用光照射时能够产生活性基团的分子,例如孔雀绿(Jay等,1999);
(9)与固体支持物共价连接的分子,其中的支持物可以是玻璃片,微量滴定板或本领域专家通常熟知的任何聚合物;
(10)能够与其互补链进行碱基配对的核酸或其衍生物;
(11)具有膜插入特性的脂或其他疏水分子;
(12)具有所需的酶、化学或物理特性的生物分子;
(13)具有上述任意特性的组合的分子。
现将本发明的实施方案作为例子,参照附图作更详细的描述。
附图简述
图1:A)O6-烷基鸟嘌呤-DNA烷基转移酶的机制;B)O6-苄基鸟嘌呤的结构;C)实施例中使用的O6-苄基鸟嘌呤衍生物的一般结构;D)标记AGT融合蛋白的一般方案,X为与AGT融合的蛋白;E)实施例中使用的AGT底物的结构。寡核苷酸(22聚体)的序列为:5’-GTGGTGGGCGCTGXAGGCGTGG-3’,其中X=BG-Bt。
图2:AGT融合蛋白在体内标记后的蛋白印迹分析。A)在含有和不含BG-Bt的培养基中表达Pep-hAGT的大肠杆菌总细胞提取物的蛋白印迹。用链霉抗生物素蛋白-过氧化酶偶联物检测生物素化的蛋白。20KD的条带相应于BG-Bt不存在时,大肠杆菌中的生物素化的蛋白。B)在含有和不含BG-DIG的培养基中表达hAGT-DHFR-HA融合蛋白的酵母总细胞提取物的蛋白印迹。用抗洋地黄毒苷-过氧化物酶偶联物检测地高辛基配基标记的蛋白。
图3:用BG-AcFc温育的HEK293细胞和通过荧光及光学显微镜分析的HEK293细胞。由图可见荧光在细胞核内的积累。这是预期的结果,因为已知hAGT是位于核内的(Ali等,1998)。第3张照片是由荧光和光学显微镜所得的图象重叠。
发明详述
以下本发明的应用是作为例子而提供,但不受其限制。这里所公开的方法一般可用于某一范围的用途中,并能特异地和共价地用下述物质标记融合蛋白:(1)能感觉和诱导标记的融合蛋白的环境改变的标记,和/或(2)借助于通过对融合蛋白的标记而特异引入的物理和/或化学性质,而有助于对融合蛋白的操作的标记。这里所公开的方法可以用于在体内和体外标记AGT融合蛋白。
本发明基于以下目的的实现:通过构建目的蛋白和利用O6-烷基鸟嘌呤-DNA烷基转移酶,例如人的DNA修复酶O6-烷基鸟嘌呤-DNA转移酶(hAGT)之间的融合蛋白,使标记与所需的融合蛋白特异连接。该酶不可逆地将烷基从其底物,O6-烷基鸟嘌呤-DNA,转移至它的半胱氨酸残基中的一个上(图1)。与hAGT迅速反应的底物类似物是O6-苄基鸟嘌呤,其二级速度常数为大约103/Sec-1.M-1(图1)。我们已证明O6-苄基鸟嘌呤在苄基环C4位的取代对于hAGT对O6-苄基鸣呤衍生物的反应性没有明显的影响。这样就能够使用在苄基环C4位上连接了标记的O6-苄基鸟嘌呤衍生物,在体内或体外共价和特异地连接标记AGT融合蛋白(图1D)。该标记与融合蛋白的性质无关。
如果在体内或细胞提取物中进行标记,考虑将宿主的内源AGT进行标记是有利的。如果宿主的内源AGT不接受O6-苄基鸟嘌呤衍生物或相关的化合物作为底物,则融合蛋白的标记是特异的。在哺乳动物(人、鼠科动物、大鼠)细胞中,对内源AGT的标记是有可能的。在内源AGT以及AGT融合蛋白同时标记而造成问题的实验中,可以采用前面描述的AGT缺陷的细胞系(Kaina等,1991)。一般,本发明可以用于下述技术的所有用途中:借助于引入的标记,利用标记与AGT融合蛋白的共价和特异连接,监测或影响AGT融合蛋白的特性,或者对该AGT融合蛋白进行操作。使用该技术的应用例子如下:
1)作为光谱探针或报道基团的标记
标记的AGT底物,例如O6-苄基鸟嘌呤衍生物的使用,使本发明能用于在细胞内,在细胞的表面(在体内)或在体外,将可检测的标记特异并共价地连接到AGT融合蛋白上,其中所说的底物携带可以转移至AGT的可检测标记,例如荧光团,发色团,磁性探针,放射活性标记的分子或任何其他的光谱探针。这样,便可以在体内或体外对AGT融合蛋白进行检测和表征。术语在细胞的所有区室和指向胞外空间的AGT融合蛋白体中进行标记。该方法可以与绿色荧光蛋白(GFP)的应用相比,GFP也是通过基因工程方法与目的蛋白融合,并可以在活细胞中对其进行研究。GFP及其突变体的缺点是它基本上只限于使用天然存在的荧光团。
2)作为检测并分离AGT融合蛋白的标记物的标记
使用AGT底物,例如用亲和标记物(如生物素)标记的O6-苄基鸟嘌呤衍生物,使本发明可以用来将亲和标记物转移至AGT-蛋白融合物,由此使融合蛋白能被亲和标记物的结合配偶体所结合。作为实例,将亲和标记物(如生物素)标记的底物加入表达AGT融合蛋白的细胞(细菌或真核细胞)中,或加入这类细胞的细胞提取物或纯化的AGT融合蛋白中,会使融合蛋白与亲和标记物之间产生共价修饰。然后,这种共价修饰又可以利用亲和标记物与其结合配偶体(例如,在亲和标记物为生物素的场合,其结合配偶体是固定化的抗生物素蛋白或链霉抗生物素蛋白)之间的相互作用而使融合蛋白分离。如果标记是通过含有可裂解的链例如二硫桥的接头而与AGT-蛋白融合物连接的,或者,如果该接头是光可裂解的,则AGT融合蛋白在其分离出来后可以从亲和标记物释放。
3)作为活性自由基来源的标记
AGT底物,例如O6-苄基鸟嘌呤衍生物,可以用来将标记导入AGT-蛋白融合物,该融合物在受到外界刺激时能产生活性自由基,例如羟基自由基。然后产生的自由基能使AGT融合蛋白以及那些紧密邻近AGT融合蛋白的蛋白失活,从而能对这些蛋白的功能进行研究。这种标记的例子是在暴露于H2O2和抗坏血酸盐时产生羟基自由基的束缚的金属螯合络合物,和发色团,例如在激光辐射下产生羟基自由基的孔雀绿。用发色团和激光产生羟基自由基在本领域也是熟知的,如发色团辅助的激光诱导的失活(CALI)(Jay等,1998)。CALI是一种用来使细胞内某些蛋白以时间控制和空间分辨的方式特异失活的方法,该方法基于发色团和蛋白的空间近邻。在激光的辐射下,发色团产生羟基自由基,该自由基可以使在发色团0.1nm内,且只有在发色团0.1nm内的所有蛋白失活。迄今为止,使发色团与目的蛋白空间相邻的方法是,通过微量注射发色团标记的目的蛋白的特异抗体。在本发明中,用发色团,例如孔雀绿标记AGT融合蛋白,随后用激光辐射,可使AGT融合蛋白以及与AGT融合蛋白相互作用的蛋白以时间控制和空间分级的方式失活。该方法可用于体内和体外。
以类似的方式,AGT融合蛋白可以用束缚的金属螯合物标记,而且该AGT融合蛋白和与AGT融合蛋白相互作用的蛋白可以通过暴露于H2O2和抗坏血酸盐,以特定的方式失活。该方法不仅可以用于研究AGT融合蛋白或与AGT融合蛋白紧密邻近的蛋白的功能,而且可以用于鉴定与AGT融合蛋白紧密邻近的蛋白。这里,与AGT融合蛋白紧密邻近的蛋白可以用以下方法鉴定:通过用特异性抗体检测该蛋白的片段,通过这些蛋白在高分辨率的2D-电泳凝胶中的消失,或者通过分离和测序技术鉴定裂解的蛋白片段,例如用质谱法或通过N末端降解的测序法。
4)作为介导蛋白-蛋白相互作用的配体的标记
使用标记的AGT底物,例如O6-苄基鸟嘌呤衍生物,可以用来将配体转移至AGT-蛋白融合物。这样就可以使配体的结合配偶体,例如蛋白与AGT-蛋白融合物结合。例如,当标记是能与结合配偶体结合的配体时,使上述底物与AGT融合蛋白接触会导致该配体与融合蛋白的特异性连接。如果该配体与另一蛋白Y结合,而且该蛋白Y与标记的AGT融合蛋白的二聚化产生了一种生物功能或可测量的信号,则该生物功能或测量的信号取决于携带该标记的AGT底物的加入。特定的例子是Ho等,1996所述的AGT底物和AGT融合蛋白在所谓三-杂交体系中的使用,以达到用小分子来调节基因的表达。在这种情况下,AGT与转录因子的DNA结合域融合。蛋白Y,例如结合配体如FK506的FKBP与转录因子的激活域融合。将携带配体(在此实施例中为FK506)的AGT底物提供给细胞会导致功能转录因子的形成和基因的表达。
5)作为靶点未知的药物或生物活性分子的标记
使用O6-苄基鸟嘌呤衍生物或相关的携带标记的AGT底物,而且其中的标记是与尚未鉴定的蛋白Y结合的药物或生物活性小分子。这里的目标应是鉴定该生物活性分子的靶蛋白Y。在这种情况下,AGT与转录因子的DNA结合域融合。表达未知靶蛋白Y的生物的COHA库与转录因子的激活域融合。加入O6-苄基鸟嘌呤衍生物或相关的携带标记的AGT底物,其中的标记是药物或生物活性小分子,只有在该分子也与cDNA文库中的其靶蛋白Y结合并融合到激活域时,才会导致功能转录因子的形成和基因的表达。如果基因的表达与选择性优点联系起来,则可鉴定出携带含有该药物或生物活性分子的靶基因Y的质粒的相应宿主。
6)作为鉴定与蛋白Y结合的分子的小分子文库的标记
使用O6-苄基鸟嘌呤或携带标记的相关的AGT底物,其中的标记是化学分子的库:此时的目标应是鉴定在体内的条件下与蛋白Y结合的小分子,该蛋白Y有可能是药物的靶。在这种情况下,AGT与转录因子的DNA结合域融合。靶蛋白与转录因子的激活域融合。加入作为标记与O6-苄基鸟嘌呤衍生物连接的小分子库,只有在标记(即小分子)与融合到激活域的其靶蛋白Y结合时,才会导致功能转录因子的形成和基因的表达。如果基因的表达与选择的优点联系起来,则可以鉴定出文库的这些导致该宿主生长的分子。
7)使用BG衍生物使AGT融合蛋白固定化和/或产生AGT融合蛋白的蛋白阵列
使用O6-苄基鸟嘌呤衍生物或相关的携带标记的AGT底物,其中的标记与载体的表面共价连接,或其中的标记是一种分子,该分子能够与连接在表面上的另一分子非共价结合。后一种方法的例子是其中的标记是生物素,连接在表面的是链霉抗生物素蛋白或抗生物素蛋白。可用作载体的例子是玻璃片、微量滴定板,或任何功能化的聚合物。AGT底物通过其标记的固定化使AGT融合蛋白随后能够通过将标记转移至融合蛋白,从而使AGT融合蛋白固定在载体上。将AGT融合蛋白按空间分辨的方式在载体上点滴,即可以产生蛋白阵列。
8)作为交联剂检测与AGT融合蛋白相互作用的蛋白的标记
使用O6-苄基鸟嘌呤衍生物或携带标记的相关AGT底物,其中的标记是可以与其他蛋白交联的分子。这种交联剂的例子包括含有功能性基团的分子,例如马来酰亚胺、活性酯或叠氮化物,以及其他本领域专家所知的以及Nadeau等,2002所描述功能基团。使这种AGT底物与和其他蛋白(在体内或体外)相互作用的AGT融合蛋白接触,可以通过该标记而使AGT融合蛋白与它的相互作用蛋白产生共价交联。这样便可鉴定出与AGT融合蛋白相互作用的蛋白。
实施例
对以下实施例进行陈述,以便向本领域的普通技术人员提供关于如何实践本发明的完全的公开和说明,但不限制本发明的范围。
实施例A:AGT融合蛋白在大肠杆菌中的共价标记
下述用BG-Bt在大肠杆菌中标记Pep-hAGT的实施例证实了在大肠杆菌中共价标记hAGT融合蛋白的可行性。融合到hAGT的N末端的肽(产生Pep-hAGT)的序列为(单字母密码子)MHHHHHHSSA,随后是hAGT的第一个氨基酸,即蛋氨酸。含有基于pET-15b(Novagen)的表达载体的XL-1Blue大肠杆菌细胞的液体培养物生长到光密度OD600nm为0.6,该表达载体编码含有N端融合肽的hAGT,即Pep-hAGT。加入IPTG至终浓度为1mM,诱导Pep-hAGT的表达。同时加入BG-Bt至终浓度为10μM,然后使该细菌在37℃下温育2小时。离心收集细胞后,将沉淀洗涤两次,以除去过量的BG-Bt。取一份重新悬浮的细胞等分物进行蛋白印迹分析。用链霉抗生物素蛋白-过氧化物酶偶联物(NEN)和化学发光的过氧化物酶底物(Renaissance reagent plus,NEN)检测生物素化的蛋白(图2)。
实施例B:AGT融合蛋白在酵母中的共价标记
以下实施例证实在酵母中共价标记hAGT融合蛋白的可行性。在此实施例中,用BG-Bt在酵母中使hAGT-DHFR-HA融合蛋白生物素化。融合蛋白采用标准的分子生物学方法在DNA水平上构建。简而言之,用氨基酸RSGI的密码子取代hAGT的终止密码子,随后是鼠的DHFR的第一个氨基酸,即蛋氨酸的密码子(Nunberg等,1980)。hAGT和DHFR之间的接头的密码子也编码BglII位点,其DNA序列为AGATCT。为了构建DHFR和HA标记物的融合物,用HA-标记物的第一个氨基酸的密码子取代DHFR的终止密码子。HA-标记物之后是终止密码子。使含有表达载体p314Ak1的L40酵母细胞的培养物生长至OD600为0.6,其中的p314AK1中,hAGT-DHFR-HA蛋白是在Pcup1启动子的控制之下。加入CuSO4至终浓度为100μM,诱导hAGT-DHFR-HA的表达,同时加入BG-Bt至终浓度为10μM。2.5小时后和5小时后去除等分物,离心收集细胞。将细胞沉淀洗涤两次,以除去残留的BG-Bt。通过反复冻融使酵母细胞裂解后,用ELISA分析细胞提取物中的生物素化的hAGT-DHFR-HA融合蛋白的存在。简要地说,将生物素化的hAGT-DHFR-HA在链霉抗生物素蛋白包被的微量滴定孔中固定化,然后用抗HA抗体(Babco)为第一抗体,以及用抗小鼠-HRP偶联物(Sigma)为第二抗体进行检测(图1)(Kolodziej,1991)。用过氧化物酶底物显示ELISA的结果,其信号(吸收)在OD405nm测定。体内生物素化的hAGT-DHFR-HA融合蛋白的信号至少为本底的5倍以上。本底信号定义为完全按上述方法处理,但不加入BG-Bt所得细胞的细胞裂解物的OD405nm。
实施例C:hAGT融合蛋白在酵母中的共价标记
下述实施例证实了在酵母中共价标记hAGT融合蛋白的可行性。这里,在酵母中使用BG-DIG,将hAGT-DHFR-HA融合蛋白用洋地黄毒苷标记。hAGT-DHFR-HA融合物的构建如实施例B所述。使含有表达载体p314AK1的L40酵母细胞培养物生长至OD600nm为1.2,其中p314AK1中的hAGT-DHFR融合蛋白的基因在Pcup1启动子的控制之下。加入CuSO4至终浓度100μM诱导hAGT-HDFR融合蛋白的表达,并同时加入BG-DIG至终浓度为20μM。2小时后,取1ml摇瓶培养物,离心收集细胞。用培养基将细胞沉淀洗涤三次,以除去残留的BG-DIG。通过反复冻/融裂解酵母细胞后,用蛋白印迹分析细胞提取物中的洋地黄毒苷化的hAGT-DHFR融合蛋白的存在。洋地黄毒苷化的蛋白用抗洋地黄毒苷-过氧化物酶偶联物(Roche)和化学发光过氧化物酶底物(Renaissance reagant plus,NEN)检测(图2)。
实施例D:hAGT融合蛋白在人细胞系中的共价标记
下述实施例证实了在哺乳动物细胞中标记AGT融合蛋白的可行性。这里,采用BG-AcFc将人细胞(HEK293)的内源hAGT用荧光标记。HEK293与5μM BG-AcFc在PBS中温育5分钟。乙酰化的荧光素衍生物BG-AcFc是可透过细胞的非荧光物质,但预期在细胞内可迅速水解而产生荧光的BG-Fc。然后更换PBS洗涤细胞以除去任何过量的底物BG-AcFc并在PBS中温育20分钟。用共聚焦荧光显微镜(Ext.492nm;EM.510nm)拍摄图像。作为对照试验,将293细胞按上述方法处理,但在加入BG-AcFc之前,与O6-苄基鸟嘌呤(1μM)一起温育过夜。该试验应使内源hAGT失活,从而防止荧光在核内的积累。如所预见,当细胞与O6-苄基鸟嘌呤预温育时未观察到荧光在核内积累。为了独立地确定hAGT接受BG-Fc为底物,重组的Pep-hAGT(10μM,如实施例A中所述)与100μM BG-Fc在25℃下,在50mM Tris-Cl、10mM DTT、1mM EDTA、200μg/ml BSA、10%甘油、pH7.4的溶液中温育10分钟,随后加入900μl PBS(磷酸缓冲的盐水:137mM NaCl、2.7mM KCl、10mM Na2HPO4、1.8mM KH2PO4,pH7.4)。按照供应商的说明,通过在NATTM-10柱(Pharmacia)上进行凝胶过滤,分离过量的底物BG-Fc。然后在标准的荧光分光光度计中测定Pep-hAGT的特性。分别在222、238和249nm激发样品,在波长523nm显示出最大发射光,证实该蛋白已标记了荧光素。对20nM BG-Fc的PBS溶液进行测量作为参照。底物的发射波长为519nm(分别在237、323和490nm激发)。
实施例E:AGT融合蛋白在细胞提取物中的共价标记
为了证实具有AGT的融合蛋白可以在细胞提取物中直接标记和操作(这里是固定化),通过标准的分子克隆步骤,构建了具有hAGT蛋白的以下N-和C-末端融合蛋白,并克隆到酵母表达载体中:
(i)V5-NLS-B425-hAGT,其中V5代表V5表位;NLS代表SV40大T抗原核定位序列,以及B42代表人工转录激活剂B42(Ma等,1987)。B42反式激活域的最后一个密码子之后是21个氨基酸的序列ASKKGTELGSTTSNGRQCAGIL。最后三个密码子包括EcoRI位点,用来将hAGT克隆到B42的C末端。Not I位点是hAGT的C末端限制性酶位点,其序列中包括终止密码子。
(ii)hAGT-HA-Ura3,其中Ura3代表酵母酶乳清酸脱羧酶,HA代表Ha抗原表位。这里,hAGT的终止密码子被RS接头所取代,随后是HA-标记物的第一个氨基酸。HA-标记物之后直接与Ura3基因连接;
(iii)hAGT-DHFR-HA,其中DHFR代表小鼠的二氢叶酸还原酶,HA代表Ha表位。构建参见实施例B;以及
(iv)SSN6-hAGT,其中SSN6代表酵母DNA转录的阻遇物(Sahu ltz等,1987)。这时hAGT的终止密码子被氨基酸RSGSG的密码子所取代,这些氨基酸之后是酵母SSN6的第一个氨基酸,蛋氨酸。
所有的基因表达都由Pcup1启动子控制。使含有编码上述融合蛋白之一的表达载体的L40酵母生长至OD为0.6,并加入CuSO4至终浓度为100μM,诱导该融合蛋白的表达。5小时后取出等份物(2ml)离心收集细胞。通过反复冻/融使细胞裂解后,将酵母提取物与BG-Bt-oligo(10pmol)一起在室温下温育20分钟,使融合蛋白生物素化。随后,将此悬浮液转移至链霉抗生物素蛋白包被的微量滴定板(Rochemolecular biochemicals)中,温育1小时。用PBS将孔充分洗涤后,用抗HA抗体(Babco)或抗hAGT抗体(在SSN6-hAGT融合蛋白的场合)作为第一抗体,以及用抗小鼠过氧化物酶偶联物(Sigma,A4416)作为第二抗体,随后用标准的生物化学方法与过氧化物酶底物ABTS温育,检测固定化的融合蛋白。在所有的场合,作为OD405nm测量的信号至少为本底信号的5倍以上。每种融合蛋白的本底信号的测定方法是省略在细胞提取物中添加BG-Bt-oligo的步骤。
参考文献
特别在此引入所有参考文献作为参考。参考文献按字母顺序排列。
RB Ali et al.,Molecular and Cellular Biology,18,1660-1669.(1998)
R Damoiseaux,A Keppler and K Johnsson,ChemBiochem,4,285-287(2001)
SN Ho et al.Nature 382,822-6(1996)
R Hori and N Baichoo in Protein-Protein interactions:amolecular cloning manual;Ed.E Golemis,Cold SpringHarbor Laboratory Press;pp.288-311(2002)
DG Jay and T Sakurai Biochim.Biophys.Acta M39-48(1999)Kaina et al.Carcinogenesis 12,1857-67 1991.
PA Kolodziej and RA Young Methods Enzymol.194,508-19,(1991)
J Ma,M Ptashne Cell 51,113-9,(1987)
OW Nadeau and GM Carlson in Protein-Protein interactions:a molecular cloning manual;Ed.E Golemis,Cold SpringHarbor Laboratory Press;pp.75-92(2002)
JH Nunberg et al.,Cell 19,355-364(1980).
AE Pegg et al.,Prog Nucleic Acid Res Mol Biol.51,167-223(1995)
J Schultz,M Carlson Mol Cell Biol 7,3637-45,(1987)