CN1285836A - 3′-差向异构的K-252a衍生物 - Google Patents
3′-差向异构的K-252a衍生物 Download PDFInfo
- Publication number
- CN1285836A CN1285836A CN98812812A CN98812812A CN1285836A CN 1285836 A CN1285836 A CN 1285836A CN 98812812 A CN98812812 A CN 98812812A CN 98812812 A CN98812812 A CN 98812812A CN 1285836 A CN1285836 A CN 1285836A
- Authority
- CN
- China
- Prior art keywords
- hydrogen
- unsubstituted
- replacement
- aryl
- alkyl group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- KOZFSFOOLUUIGY-IYYJOCMQSA-N k-252a, nocardiopsis sp. Chemical compound C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1[C@@H]1C[C@](C(=O)OC)(O)[C@@]4(C)O1 KOZFSFOOLUUIGY-IYYJOCMQSA-N 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 70
- 230000000694 effects Effects 0.000 claims abstract description 36
- 210000002932 cholinergic neuron Anatomy 0.000 claims abstract description 18
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 claims abstract description 13
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 claims abstract description 13
- 125000000217 alkyl group Chemical group 0.000 claims description 73
- 229910052739 hydrogen Inorganic materials 0.000 claims description 58
- 239000001257 hydrogen Substances 0.000 claims description 58
- 125000003118 aryl group Chemical group 0.000 claims description 46
- 238000000034 method Methods 0.000 claims description 43
- 150000002431 hydrogen Chemical class 0.000 claims description 39
- 125000001072 heteroaryl group Chemical group 0.000 claims description 33
- -1 formamyl Chemical group 0.000 claims description 31
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 19
- 150000003839 salts Chemical class 0.000 claims description 17
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 16
- 108091000080 Phosphotransferase Proteins 0.000 claims description 12
- 102000020233 phosphotransferase Human genes 0.000 claims description 12
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 11
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 11
- 230000014509 gene expression Effects 0.000 claims description 10
- 229910052736 halogen Inorganic materials 0.000 claims description 10
- 150000002367 halogens Chemical class 0.000 claims description 10
- 101100222854 Bacillus subtilis (strain 168) czcO gene Proteins 0.000 claims description 9
- 101100537961 Methanosarcina mazei (strain ATCC BAA-159 / DSM 3647 / Goe1 / Go1 / JCM 11833 / OCM 88) trkA2 gene Proteins 0.000 claims description 9
- 102000003923 Protein Kinase C Human genes 0.000 claims description 9
- 108090000315 Protein Kinase C Proteins 0.000 claims description 9
- 101150025395 trkA gene Proteins 0.000 claims description 9
- 101150113435 trkA1 gene Proteins 0.000 claims description 9
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 8
- 125000003545 alkoxy group Chemical group 0.000 claims description 7
- 125000003282 alkyl amino group Chemical group 0.000 claims description 7
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 7
- 238000006366 phosphorylation reaction Methods 0.000 claims description 7
- 230000015572 biosynthetic process Effects 0.000 claims description 6
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 6
- 230000026731 phosphorylation Effects 0.000 claims description 6
- 125000002252 acyl group Chemical group 0.000 claims description 5
- 239000008194 pharmaceutical composition Substances 0.000 claims description 5
- CHJJGSNFBQVOTG-UHFFFAOYSA-N N-methyl-guanidine Natural products CNC(N)=N CHJJGSNFBQVOTG-UHFFFAOYSA-N 0.000 claims description 4
- 150000001335 aliphatic alkanes Chemical class 0.000 claims description 4
- ZRALSGWEFCBTJO-UHFFFAOYSA-N anhydrous guanidine Natural products NC(N)=N ZRALSGWEFCBTJO-UHFFFAOYSA-N 0.000 claims description 4
- SWSQBOPZIKWTGO-UHFFFAOYSA-N dimethylaminoamidine Natural products CN(C)C(N)=N SWSQBOPZIKWTGO-UHFFFAOYSA-N 0.000 claims description 4
- 125000000623 heterocyclic group Chemical group 0.000 claims description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 4
- CFHIDWOYWUOIHU-UHFFFAOYSA-N oxomethyl Chemical compound O=[CH] CFHIDWOYWUOIHU-UHFFFAOYSA-N 0.000 claims description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 claims description 3
- 230000032405 negative regulation of neuron apoptotic process Effects 0.000 claims description 3
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 claims description 2
- 125000003342 alkenyl group Chemical group 0.000 claims description 2
- 125000004171 alkoxy aryl group Chemical group 0.000 claims description 2
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 claims description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 2
- 239000004202 carbamide Substances 0.000 claims description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 2
- 125000002883 imidazolyl group Chemical group 0.000 claims description 2
- IQZPDFORWZTSKT-UHFFFAOYSA-N nitrosulphonic acid Chemical compound OS(=O)(=O)[N+]([O-])=O IQZPDFORWZTSKT-UHFFFAOYSA-N 0.000 claims description 2
- 125000006239 protecting group Chemical group 0.000 claims description 2
- 125000002769 thiazolinyl group Chemical group 0.000 claims description 2
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 claims description 2
- 125000000837 carbohydrate group Chemical group 0.000 claims 1
- 230000001713 cholinergic effect Effects 0.000 claims 1
- 210000005036 nerve Anatomy 0.000 claims 1
- 210000004027 cell Anatomy 0.000 abstract description 26
- 230000004083 survival effect Effects 0.000 abstract description 8
- 230000001228 trophic effect Effects 0.000 abstract description 7
- 230000005764 inhibitory process Effects 0.000 abstract description 6
- 230000000144 pharmacologic effect Effects 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 60
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 33
- 239000011541 reaction mixture Substances 0.000 description 33
- KOZFSFOOLUUIGY-SOLYNIJKSA-N K-252a Chemical class C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1[C@H]1C[C@@](C(=O)OC)(O)[C@]4(C)O1 KOZFSFOOLUUIGY-SOLYNIJKSA-N 0.000 description 31
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 31
- 239000000243 solution Substances 0.000 description 29
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 28
- 102100023460 Choline O-acetyltransferase Human genes 0.000 description 17
- 108010058699 Choline O-acetyltransferase Proteins 0.000 description 17
- 238000002360 preparation method Methods 0.000 description 17
- 239000000203 mixture Substances 0.000 description 16
- 238000006243 chemical reaction Methods 0.000 description 14
- 230000000452 restraining effect Effects 0.000 description 14
- 239000007787 solid Substances 0.000 description 14
- 238000012360 testing method Methods 0.000 description 14
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 12
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 12
- 239000012299 nitrogen atmosphere Substances 0.000 description 12
- 239000000741 silica gel Substances 0.000 description 12
- 229910002027 silica gel Inorganic materials 0.000 description 12
- 210000000278 spinal cord Anatomy 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- 150000002118 epoxides Chemical class 0.000 description 11
- 239000000047 product Substances 0.000 description 11
- 238000003818 flash chromatography Methods 0.000 description 10
- VVVPGLRKXQSQSZ-UHFFFAOYSA-N indolo[3,2-c]carbazole Chemical compound C1=CC=CC2=NC3=C4C5=CC=CC=C5N=C4C=CC3=C21 VVVPGLRKXQSQSZ-UHFFFAOYSA-N 0.000 description 10
- 229960005544 indolocarbazole Drugs 0.000 description 10
- 150000002576 ketones Chemical class 0.000 description 10
- 238000003756 stirring Methods 0.000 description 10
- 238000005160 1H NMR spectroscopy Methods 0.000 description 9
- 239000003153 chemical reaction reagent Substances 0.000 description 9
- 239000013067 intermediate product Substances 0.000 description 9
- 210000002569 neuron Anatomy 0.000 description 9
- 150000001336 alkenes Chemical class 0.000 description 8
- 108010025020 Nerve Growth Factor Proteins 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 125000002485 formyl group Chemical class [H]C(*)=O 0.000 description 7
- 230000006870 function Effects 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 102000015336 Nerve Growth Factor Human genes 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 108091008605 VEGF receptors Proteins 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 238000003786 synthesis reaction Methods 0.000 description 6
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 5
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 5
- 238000005481 NMR spectroscopy Methods 0.000 description 5
- 229940098773 bovine serum albumin Drugs 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 239000012044 organic layer Substances 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- FCSKOFQQCWLGMV-UHFFFAOYSA-N 5-{5-[2-chloro-4-(4,5-dihydro-1,3-oxazol-2-yl)phenoxy]pentyl}-3-methylisoxazole Chemical compound O1N=C(C)C=C1CCCCCOC1=CC=C(C=2OCCN=2)C=C1Cl FCSKOFQQCWLGMV-UHFFFAOYSA-N 0.000 description 4
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 4
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 4
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 4
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 4
- 150000001408 amides Chemical class 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 150000002148 esters Chemical class 0.000 description 4
- 239000007789 gas Substances 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 210000002161 motor neuron Anatomy 0.000 description 4
- 235000015097 nutrients Nutrition 0.000 description 4
- DCWXELXMIBXGTH-QMMMGPOBSA-N phosphonotyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(OP(O)(O)=O)C=C1 DCWXELXMIBXGTH-QMMMGPOBSA-N 0.000 description 4
- 210000001044 sensory neuron Anatomy 0.000 description 4
- 229910052938 sodium sulfate Inorganic materials 0.000 description 4
- 235000011152 sodium sulphate Nutrition 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 3
- 239000012591 Dulbecco’s Phosphate Buffered Saline Substances 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- 102000004422 Phospholipase C gamma Human genes 0.000 description 3
- 108010056751 Phospholipase C gamma Proteins 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 239000003513 alkali Substances 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 150000003863 ammonium salts Chemical class 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- DEGAKNSWVGKMLS-UHFFFAOYSA-N calcein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC(CN(CC(O)=O)CC(O)=O)=C(O)C=C1OC1=C2C=C(CN(CC(O)=O)CC(=O)O)C(O)=C1 DEGAKNSWVGKMLS-UHFFFAOYSA-N 0.000 description 3
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 3
- 239000013068 control sample Substances 0.000 description 3
- 238000006345 epimerization reaction Methods 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 229960002378 oftasceine Drugs 0.000 description 3
- JUJWROOIHBZHMG-UHFFFAOYSA-N pyridine Substances C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 239000012312 sodium hydride Substances 0.000 description 3
- 229910000104 sodium hydride Inorganic materials 0.000 description 3
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical group C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 description 3
- 150000003509 tertiary alcohols Chemical class 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 3
- DBGVGMSCBYYSLD-UHFFFAOYSA-N tributylstannane Chemical compound CCCC[SnH](CCCC)CCCC DBGVGMSCBYYSLD-UHFFFAOYSA-N 0.000 description 3
- 230000035899 viability Effects 0.000 description 3
- 238000010792 warming Methods 0.000 description 3
- PTXVSDKCUJCCLC-UHFFFAOYSA-N 1-hydroxyindole Chemical compound C1=CC=C2N(O)C=CC2=C1 PTXVSDKCUJCCLC-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- 102000003916 Arrestin Human genes 0.000 description 2
- 108090000328 Arrestin Proteins 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 241001597008 Nomeidae Species 0.000 description 2
- 241001416149 Ovis ammon Species 0.000 description 2
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 2
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 2
- 239000012346 acetyl chloride Substances 0.000 description 2
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 description 2
- 229960004373 acetylcholine Drugs 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000006229 amino acid addition Effects 0.000 description 2
- 235000019270 ammonium chloride Nutrition 0.000 description 2
- 150000008064 anhydrides Chemical class 0.000 description 2
- 210000003050 axon Anatomy 0.000 description 2
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical compound B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 150000001721 carbon Chemical group 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 150000004678 hydrides Chemical class 0.000 description 2
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 2
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 2
- FUKUFMFMCZIRNT-UHFFFAOYSA-N hydron;methanol;chloride Chemical compound Cl.OC FUKUFMFMCZIRNT-UHFFFAOYSA-N 0.000 description 2
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 2
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- DGVNWNYQSOYWKZ-UHFFFAOYSA-N methyl dihydrogen phosphite Chemical compound COP(O)O DGVNWNYQSOYWKZ-UHFFFAOYSA-N 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 108010055896 polyornithine Proteins 0.000 description 2
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 2
- 210000004129 prosencephalon Anatomy 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- APSBXTVYXVQYAB-UHFFFAOYSA-M sodium docusate Chemical compound [Na+].CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC APSBXTVYXVQYAB-UHFFFAOYSA-M 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000001131 transforming effect Effects 0.000 description 2
- 241000701447 unidentified baculovirus Species 0.000 description 2
- IYLGZMTXKJYONK-ACLXAEORSA-N (12s,15r)-15-hydroxy-11,16-dioxo-15,20-dihydrosenecionan-12-yl acetate Chemical compound O1C(=O)[C@](CC)(O)C[C@@H](C)[C@](C)(OC(C)=O)C(=O)OCC2=CCN3[C@H]2[C@H]1CC3 IYLGZMTXKJYONK-ACLXAEORSA-N 0.000 description 1
- BQCIDUSAKPWEOX-UHFFFAOYSA-N 1,1-Difluoroethene Chemical compound FC(F)=C BQCIDUSAKPWEOX-UHFFFAOYSA-N 0.000 description 1
- AFSHUZFNMVJNKX-UHFFFAOYSA-N 1,2-di-(9Z-octadecenoyl)glycerol Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC(CO)OC(=O)CCCCCCCC=CCCCCCCCC AFSHUZFNMVJNKX-UHFFFAOYSA-N 0.000 description 1
- AFSHUZFNMVJNKX-LLWMBOQKSA-N 1,2-dioleoyl-sn-glycerol Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](CO)OC(=O)CCCCCCC\C=C/CCCCCCCC AFSHUZFNMVJNKX-LLWMBOQKSA-N 0.000 description 1
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 1
- IMLSAISZLJGWPP-UHFFFAOYSA-N 1,3-dithiolane Chemical compound C1CSCS1 IMLSAISZLJGWPP-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- KAESVJOAVNADME-UHFFFAOYSA-N 1H-pyrrole Natural products C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 101710153593 Albumin A Proteins 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 206010008190 Cerebrovascular accident Diseases 0.000 description 1
- 206010008748 Chorea Diseases 0.000 description 1
- 238000007445 Chromatographic isolation Methods 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- FKLJPTJMIBLJAV-UHFFFAOYSA-N Compound IV Chemical compound O1N=C(C)C=C1CCCCCCCOC1=CC=C(C=2OCCN=2)C=C1 FKLJPTJMIBLJAV-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 102000005720 Glutathione transferase Human genes 0.000 description 1
- 108010070675 Glutathione transferase Proteins 0.000 description 1
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010033040 Histones Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108010044467 Isoenzymes Proteins 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- BAQCROVBDNBEEB-UBYUBLNFSA-N Metrizamide Chemical compound CC(=O)N(C)C1=C(I)C(NC(C)=O)=C(I)C(C(=O)N[C@@H]2[C@H]([C@H](O)[C@@H](CO)OC2O)O)=C1I BAQCROVBDNBEEB-UBYUBLNFSA-N 0.000 description 1
- 208000026072 Motor neurone disease Diseases 0.000 description 1
- 102100035044 Myosin light chain kinase, smooth muscle Human genes 0.000 description 1
- 101710198035 Myosin light chain kinase, smooth muscle Proteins 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 102000007339 Nerve Growth Factor Receptors Human genes 0.000 description 1
- 108010032605 Nerve Growth Factor Receptors Proteins 0.000 description 1
- 102000007072 Nerve Growth Factors Human genes 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 241001417524 Pomacanthidae Species 0.000 description 1
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 241000700157 Rattus norvegicus Species 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 1
- IOEJYZSZYUROLN-UHFFFAOYSA-M Sodium diethyldithiocarbamate Chemical compound [Na+].CCN(CC)C([S-])=S IOEJYZSZYUROLN-UHFFFAOYSA-M 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 239000005864 Sulphur Substances 0.000 description 1
- 244000297179 Syringa vulgaris Species 0.000 description 1
- 235000004338 Syringa vulgaris Nutrition 0.000 description 1
- 229910052770 Uranium Inorganic materials 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 159000000013 aluminium salts Chemical class 0.000 description 1
- 229910000329 aluminium sulfate Inorganic materials 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 238000004176 ammonification Methods 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 229940045719 antineoplastic alkylating agent nitrosoureas Drugs 0.000 description 1
- 125000005129 aryl carbonyl group Chemical group 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 229910000085 borane Inorganic materials 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- BQRGNLJZBFXNCZ-UHFFFAOYSA-N calcein am Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC(CN(CC(=O)OCOC(C)=O)CC(=O)OCOC(C)=O)=C(OC(C)=O)C=C1OC1=C2C=C(CN(CC(=O)OCOC(C)=O)CC(=O)OCOC(=O)C)C(OC(C)=O)=C1 BQRGNLJZBFXNCZ-UHFFFAOYSA-N 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 150000001720 carbohydrates Chemical group 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- WORJEOGGNQDSOE-UHFFFAOYSA-N chloroform;methanol Chemical compound OC.ClC(Cl)Cl WORJEOGGNQDSOE-UHFFFAOYSA-N 0.000 description 1
- 208000012601 choreatic disease Diseases 0.000 description 1
- 238000011097 chromatography purification Methods 0.000 description 1
- 230000009514 concussion Effects 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- XLJMAIOERFSOGZ-UHFFFAOYSA-M cyanate Chemical compound [O-]C#N XLJMAIOERFSOGZ-UHFFFAOYSA-M 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 210000003104 cytoplasmic structure Anatomy 0.000 description 1
- 238000013016 damping Methods 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 150000004862 dioxolanes Chemical class 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- RCFKEIREOSXLET-UHFFFAOYSA-N disulfamide Chemical compound CC1=CC(Cl)=C(S(N)(=O)=O)C=C1S(N)(=O)=O RCFKEIREOSXLET-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 238000003810 ethyl acetate extraction Methods 0.000 description 1
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 1
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000002461 excitatory amino acid Effects 0.000 description 1
- 239000003257 excitatory amino acid Substances 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 239000002223 garnet Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 235000003642 hunger Nutrition 0.000 description 1
- 238000006197 hydroboration reaction Methods 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229910003002 lithium salt Inorganic materials 0.000 description 1
- 159000000002 lithium salts Chemical class 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- VXWPONVCMVLXBW-UHFFFAOYSA-M magnesium;carbanide;iodide Chemical compound [CH3-].[Mg+2].[I-] VXWPONVCMVLXBW-UHFFFAOYSA-M 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- RUZLIIJDZBWWSA-INIZCTEOSA-N methyl 2-[[(1s)-1-(7-methyl-2-morpholin-4-yl-4-oxopyrido[1,2-a]pyrimidin-9-yl)ethyl]amino]benzoate Chemical group COC(=O)C1=CC=CC=C1N[C@@H](C)C1=CC(C)=CN2C(=O)C=C(N3CCOCC3)N=C12 RUZLIIJDZBWWSA-INIZCTEOSA-N 0.000 description 1
- 150000003956 methylamines Chemical class 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- 229960000554 metrizamide Drugs 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 208000005264 motor neuron disease Diseases 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 230000006576 neuronal survival Effects 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 239000012285 osmium tetroxide Substances 0.000 description 1
- 229910000489 osmium tetroxide Inorganic materials 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- XYFCBTPGUUZFHI-UHFFFAOYSA-O phosphonium Chemical compound [PH4+] XYFCBTPGUUZFHI-UHFFFAOYSA-O 0.000 description 1
- 150000003053 piperidines Chemical class 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- NNFCIKHAZHQZJG-UHFFFAOYSA-N potassium cyanide Chemical compound [K+].N#[C-] NNFCIKHAZHQZJG-UHFFFAOYSA-N 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 238000012797 qualification Methods 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000007142 ring opening reaction Methods 0.000 description 1
- IYLGZMTXKJYONK-UHFFFAOYSA-N ruwenine Natural products O1C(=O)C(CC)(O)CC(C)C(C)(OC(C)=O)C(=O)OCC2=CCN3C2C1CC3 IYLGZMTXKJYONK-UHFFFAOYSA-N 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 150000003333 secondary alcohols Chemical class 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 229910000077 silane Inorganic materials 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- 230000016160 smooth muscle contraction Effects 0.000 description 1
- MNWBNISUBARLIT-UHFFFAOYSA-N sodium cyanide Chemical compound [Na+].N#[C-] MNWBNISUBARLIT-UHFFFAOYSA-N 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 210000003594 spinal ganglia Anatomy 0.000 description 1
- 210000005250 spinal neuron Anatomy 0.000 description 1
- 230000037351 starvation Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000005728 strengthening Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229910052714 tellurium Inorganic materials 0.000 description 1
- PORWMNRCUJJQNO-UHFFFAOYSA-N tellurium atom Chemical compound [Te] PORWMNRCUJJQNO-UHFFFAOYSA-N 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical compound C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- CYTQBVOFDCPGCX-UHFFFAOYSA-N trimethyl phosphite Chemical compound COP(OC)OC CYTQBVOFDCPGCX-UHFFFAOYSA-N 0.000 description 1
- LEIMLDGFXIOXMT-UHFFFAOYSA-N trimethylsilyl cyanide Chemical compound C[Si](C)(C)C#N LEIMLDGFXIOXMT-UHFFFAOYSA-N 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 239000002023 wood Substances 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/22—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains four or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H5/00—Compounds containing saccharide radicals in which the hetero bonds to oxygen have been replaced by the same number of hetero bonds to halogen, nitrogen, sulfur, selenium, or tellurium
- C07H5/04—Compounds containing saccharide radicals in which the hetero bonds to oxygen have been replaced by the same number of hetero bonds to halogen, nitrogen, sulfur, selenium, or tellurium to nitrogen
- C07H5/06—Aminosugars
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Pain & Pain Management (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Psychology (AREA)
- Physical Education & Sports Medicine (AREA)
- Cardiology (AREA)
- Vascular Medicine (AREA)
- Heart & Thoracic Surgery (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
本文公开了通式结构(Ⅱ)定义的化合物,这些化合物显示出药物活性,包括抑制酪氨酸激酶的活性以及增强营养因子应答细胞(如胆碱能细胞)的功能和/或存活。
Description
本申请要求享受申请日为1997年12月31日、序号为No.60/070263的临时申请的利益。
发明领域
本发明属于药物化学领域。
发明背景
K-252a是一种吲哚并咔唑,其立体化学如下所示(式Ⅰ):
K-252a能抑制蛋白激酶C(PKC),后者在调整细胞功能方面具有作用。K-252a具有各种各样的活性,例如,抑制平滑肌收缩(Jap.J.Pharmacol.43(suppl):248,1987);抑制5-羟色胺分泌(Biochem.Biophys.Res.Commun.144:35,1987);抑制轴索(neuraxone)的伸长(J.Neurosci.8:715,1988);抑制组胺释放(Allergy 43:100,1988);抑制平滑肌MLCK(J.Biol.Chem.263:6215,1988);抗炎作用(Acta Physiol.Hung.80:423,1992),以及促进细胞存活(J.Neurochem.64:1502,1995)。K-252a还抑制IL-2的产生(Exper.Cell Res.193:175-182,1991)。现已经实现了K-252a的天然(+)异构体及其对映(-)异构体(糖部分的三个手性碳都反转)的全合成(Wood等人,J.Am.Chem.Soc.117:10413,1995;和WO 97/07081)。
发明概要
我们已经发现,K-252a的一些3′-差向异构衍生物具有生物活性,这些化合物具有下面的通式(式Ⅱ):其中:R1和R2各自独立地是
氢、低级烷基、卤素、酰基、硝基、磺酸;
-CH=NR4,其中R4是胍基、杂环或-NR5R6,其中是R5或R6
是氢或低级烷基,而另一个是氢、低级烷基、酰基、芳
基、杂环、氨基甲酰基或低级烷基氨基羰基;
-NR5R6;
-CH(SR7)2,其中R7是低级烷基或链烯基;
-(CH2)jR8,其中j是1-6,R8是
卤素、取代的芳基、未取代的芳基、取代的杂芳基、未
取代的杂芳基、N3;
-CO2R9,其中R9是氢、取代的低级烷基、未取代的低级
烷基、取代的芳基、未取代的芳基、取代的杂芳基
或未取代的杂芳基;
-C(=O)NR10R11,其中R10和R11各自独立地是氢、取代
的低级烷基、未取代的低级烷基、取代的芳基、未
取代的芳基、取代的杂芳基、未取代的杂芳基、取
代的芳烷基、未取代的芳烷基、低级烷基氨基羰基
或低级烷氧羰基,或者R10和R11与氮原子结合形成
杂环基;
-OR12,其中R12是氢、取代的低级烷基、未取代的低级
烷基、取代的芳基、未取代的芳基,或者是
-C(=O)R13,其中R13是氢、NR10R11、取代的低级烷
基、未取代的低级烷基、取代的芳基、未取代的芳
基、取代的杂芳基、未取代的杂芳基、取代的芳烷
基或未取代的芳烷基;
-NR10R11;
-C(=O)R14,其中R14是氢、低级烷基、取代的芳基、未
取代的芳基、取代的杂芳基或未取代的杂芳基,
-S(=O)rR15,其中r为0-2,R15是氢、取代的低级烷基、
未取代的低级烷基、取代的芳基、未取代的芳基、
取代的杂芳基、未取代的杂芳基、取代的芳烷基、
未取代的芳烷基、噻唑啉基、(CH2)aCO2R16(其中a
为1或2,而R16是氢或低级烷基)、或
(CH2)aC(=O)NR10R11;-OR17,其中R17是氢、低级烷基或-C(=O)R18,其中R18是取
代的低级烷基、未取代的低级烷基、取代的芳基或未取
代的芳基;-C(=O)(CH2)jR19,其中R19是氢、卤素、NR10R11、N3、SR15
或OR20,其中R20是氢、取代的低级烷基、未取代的低
级烷基或C(=O)R14;-CH(OH)(CH2)jR19;-(CH2)dCHR21CO2R16A,其中d为0-5,R21是氢、CONR10R11
或CO2R16A,其中R16A同R16;-(CH2)dCHR21CONR10R11;-CH=CH(CH2)mR22,其中m为0-4,R22是氢、低级烷基、
CO2R9、取代的芳基、未取代的芳基、取代的杂芳基、
未取代的杂芳基、OR12或NR10R11;-CH=CH(CO2R16A)2;-C≡C(CH2)mR22;-SO2NR23R24,其中R23和R24各自独立地是氢、低级烷基,或
者是与连接的氮原子所形成的杂环基;
-OCO2R13A,其中R13A同R13;或
-OC(=O)NR10R11;R3是氢、低级烷基、氨基甲酰基、氨基、四氢吡喃基、羟基、
C(=O)H、芳烷基、低级烷酰基或CH2CH2R25,其中R25是卤素、氨基、二-低级烷基氨基、羟基或羟基取代的低级烷基氨基;X是氢、甲酰基、羧基、低级烷氧羰基、低级烷基肼基羰基、-CN、
低级烷基;
-C(=O)NR26R27,其中R26和R27各自独立地是氢、未取代的低
级烷基或未取代的芳基,或者R26和R27与氮原子结合形
成杂环基;
-CH(R34)W,其中R34是氢或低级烷基,W是-N=CHN(烷基)2、
胍基、N3、NR28R29,其中R28或R29是氢或低级烷基,
另一个是氢、烯丙基、烷酰基、芳氧羰基、未取代的烷
基、或羧基基团的羟基被除去的氨基酸残基、-CO2R9、
-C(=O)NR10R11、-S(=O)rR30(其中R30是取代或未取代的
低级烷基、芳基或杂芳基)、或OR31(其中R31是氢、
取代或未取代的烷基、取代或未取代的烷酰基);
-CH=N-R32,其中R32是羟基、低级烷氧基、氨基、胍基、脲
基、咪唑基氨基、氨基甲酰基氨基或NR26AR27A(其中
R26A同R26,其中R27A同R27);或
-CH2Q,其中Q是由
表示的糖残基,其中V表示氢、甲基、乙基、苄基、乙酰基
或三氟乙酰基;Y是氢、-OH、-OC(=O)R33(其中R33是烷基、芳基或氨基)、
OCH2O-烷基、-O-烷基、芳基烷氧基,或者X和Y结合为-
X-Y-,形成-CH2OCO2-、或-CH2N(R16B)CO2-(其中R16B同R16);
A1和A2为氢或两者结合表示O;
B1和B2为氢或两者结合表示O;
或者它们的可药用盐;
其前提条件是,A1、A2或B1、B2至少一组表示O,并且X和Y不同时为氢。
优选X是-C(=O)NR26R27、羧基、低级烷氧羰基、甲酰基、低级烷基、-CH2OR31、-CH2NR28R29或-CH2S(=O)rR30。优选R1和R2为H。优选R3为氢或保护基。特别优选的是化合物Ⅵ、Ⅶ、Ⅷ、Ⅹ、Ⅻ、ⅩⅣ、ⅩⅤ、ⅩⅥ、ⅩⅥ、ⅩⅧ、ⅩⅨ、ⅩⅩⅤ和ⅩⅩⅦ,如下所示:
在本发明的一些实施方案中,3′-差向异构的K252a衍生物被制成药物组合物。
本发明还提供了抑制酪氨酸激酶,如蛋白激酶C(PKC)活性的方法,该方法包括将酪氨酸激酶与权利要求1的化合物相接触。所述酪氨酸激酶可以在体外或体内。
本发明还提供了通过第二种激酶抑制酪氨酸激酶磷酰化的方法,该方法包括将第二种激酶与权利要求1的化合物相接触。所述酪氨酸激酶可以在体外或体内。
本发明还提供了增强胆碱能神经元机能的方法,该方法包括将胆碱能神经元与权利要求1的化合物相接触。所述胆碱能神经元可以在体外或体内。
本发明还提供了增强胆碱能神经元存活的方法,该方法包括将胆碱能神经元与权利要求1的化合物相接触。所述胆碱能神经元可以在体外或体内。
除非有另外定义,本文使用的所有技术和科学术语的含义与本发明所属技术领域普通技术人员的一般理解相同。在有冲突的情况下,以本申请为准,包括定义。本文提及的所有出版物、专利申请、专利和其它参考文献均引作参考。
尽管与本文所述相似或等价的方法和物质均可用于本发明的实施和试验,但下述方法和物质是优选的,这些物质、方法和实施例仅仅是说明性的,而不是用来限定的。从说明书详述部分和权利要求,本发明的其它特征和优点是显而易见的。
附图的简要说明
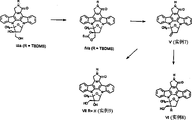
附图1是从已知的吲哚并咔唑Ⅲa合成3′-差向异构的吲哚并咔唑Ⅵ和Ⅶ的线路图。
附图2所示是,由按照附图1所示制备的3′-差向异构的吲哚并咔唑Ⅶ合成3′-差向异构的吲哚并咔唑Ⅹ的线路图。
附图3所示是,由中间产物酮Ⅺa合成3′-差向异构的吲哚并咔唑Ⅻa、ⅩⅣ、ⅩⅤ、ⅩⅥ、ⅩⅦ和ⅩⅧ的线路图。
附图4所示是,由中间产物环氧化物Ⅺa合成3′-差向异构的吲哚并咔唑ⅩⅨ的线路图。
附图5所示是,由中间产物酮Ⅺ合成3′-差向异构的吲哚并咔唑ⅩⅨ另一种线路。
附图6所示是,由中间产物酮Ⅺ,或者通过已知的3′-羟基吲哚并咔唑ⅩⅩⅥ的差向异构化来合成差向异构的3′-羟基吲哚并咔唑ⅩⅩⅦ的线路。
附图7所示是,由相应的3′-差向异构的吲哚并咔唑ⅩⅣ合成环-溴代的3′-差向异构的吲哚并咔唑ⅩⅩⅤ的线路图。
附图8表示测定化合物ⅩⅣ对富含运动神经元的培养物中的神经元存活作用的试验数据的一览图。以细胞存活力(用相对于对照样的百分比表示)对化合物ⅩⅣ在细胞培养基中的浓度作图。
本发明差向异构的K-252a衍生物显示出药物活性,包括对酪氨酸激酶活性的抑制作用,例如抑制PKC或trk酪氨酸激酶,这种抑制作用可用于治疗疾病,包括癌症。本发明的化合物能用于提高营养因子应答细胞(如胆碱能神经元)的功能和/或存活,对神经元的作用可以通过以下试验证明:(1)培养脊髓的胆碱乙酰基转移酶(“ChAT”)试验;(2)培养基础前脑神经元(“BFN’)的ChAT活性试验。
ChAT是得到乙酰胆碱的生物合成途径中的一种酶,ChAT的活性与胆碱能神经元有关,并显示该神经元的功能。神经元的存活可以通过测定神经元对染料(如,钙黄绿素AM)的吸收和酶转化来进行分析。
各种神经疾病可表征为神经元细胞的损伤、功能构成、进行性轴索退化、死亡或有死亡的危险。这些疾病包括:阿尔茨海默疾病,运动神经元疾病如肌萎缩性侧索硬化、帕金森氏疾病,脑血管疾病如中风或局部缺血、亨廷顿氏舞蹈病、AIDS痴呆、癫痫、多发性硬化,外周神经疾病,兴奋性氨基酸诱发的疾病,与大脑或脊髓的震荡性或穿透性损伤相关的疾病。
由于本发明化合物能提高营养因子应答细胞的营养因子诱发的活性,所以它们可用作治疗剂,以增强哺乳动物(如,人)的神经元系细胞的功能和/或存活。它们特别适用于治疗与ChAT活性降低或脊髓运动神经元损伤有关的疾病。化学合成
本发明的化合物可以按照下述(附图1-7)方法制备,化合物的制备可以从适当保护的K-252a衍生物开始,K-252a可以在其内酰胺氮原子上进行保护,如以乙酸盐或以甲硅烷基衍生物形式。
硫羰基碳酸酯Ⅳa(附图1)可以采用如美国专利号US 4923986所述的方法从二醇Ⅲa制备,将Ⅳa用亚磷酸三甲酯处理,得到外向环(exocyclic)烯烃Ⅴ,可以使用硼氢化条件将烯烃Ⅴ转化为(S)-甲醇衍生物Ⅵ,或者在四氢呋喃(THF)中使用四氧化锇将其转化为(R)-二醇Ⅶ。在化合物Ⅶ中,糖3′-位的构型与美国专利号US 4923986报道的(S)-二醇Ⅲ的构型相反。
(R)-环氧化物Ⅸa(附图2)的制备可以通过将(R)-二醇Ⅶ转化为甲苯磺酰基中间产物Ⅷ,然后与碱如氢化钠或氢氧化钠作用。(R)-环氧化物Ⅸa与氢化物还原剂如三乙基硼氢化锂相作用,脱去叔丁基二甲基甲硅烷基(TBDMS)保护基后,得到(S)-叔醇Ⅹ。手性醇衍生物如化合物Ⅵ、Ⅶ或Ⅹ可以采用常规技术,与碱和卤化物或甲苯磺酰基化合物一起反应而转化为醚衍生物,这些醇衍生物还可以通过已知方法,与酰氯或酸酐反应转化为酯衍生物,或者与适当的异氰酸酯反应转化为氨基甲酸酯。例如,化合物Ⅵ或Ⅶ的卤化物或磺酸酯衍生物可以用各种不同的O、S、N或C亲核试剂替换以制备适当的衍生物。
3′-(R)-K-252a ⅩⅣ(附图3)的制备由酮Ⅺ开始。化合物ⅩⅣ与天然K-252a异构体的不同仅仅在于3′糖位。酮Ⅺa与氰酸盐(氰化钠、氰化钾、四丁基铵氰化物或TMSCN)作用,得到氰醇Ⅻ和ⅩⅢ的混合物。该氰醇异构体的混合物可以通过色谱分离,或者在甲醇中用HCl直接转化为酯ⅩⅣ和酰胺ⅩⅤ。3′-表位-K-252a ⅩⅣ可以采用适于天然K-252a的方法(参见如,J.Antibiot.39:1072,1980),将其水解为羟基酸ⅩⅥ。采用适于与所述K-252a的描述相似的方法(参见如,美国专利号US 4923986、5461164和5654427),可将酸ⅩⅥ转化为不同的酯或酰胺衍生物。可以采用适于转化天然K-252a的所述方法,将酰胺ⅩⅤ还原为相应的甲胺衍生物ⅩⅦ,而ⅩⅦ可用于制备诸多甲基酰胺和甲基脲衍生物,参见,如美国专利号US 4923986、5461164和5654427。3′-表位-K-252a可以还原为醛ⅩⅧ而与各种不同的胺、肼或羟氨缩合形成相应的类似物。醛ⅩⅧ可以与各种不同的烷基、芳烷基、芳基或杂芳基烷基金属试剂,如锂、镁、锌或铜试剂相作用,形成相应的醇加成物。醛ⅩⅧ可以与鏻内鎓盐(Quart Rev.17:406,1963;AngewInt.16:423,1977)、膦酸酯(Homer-Wadsworth-Emmons试剂:Chem.Ber.91:61,1958;J.Am.Chem.Soc.83:1733,1961;Org.React.25:73,1977)、硅烷(J.Org.Chem.33:780,1968;Synthesis 384,1984)、碲试剂(Tetrahedron Lett.28:801,1987)或硼试剂(TetrahedronLett.24:635,1983)作用转化为官能化的烯烃,然后通过烯烃的还原,如催化氢化,得到它们的还原产物。由醛ⅩⅧ衍生的烯烃可以转化为环氧化物,并可再与所述的适于环氧化物Ⅸ的亲核试剂作用。
环氧化物Ⅸ(附图4)可以和各种不同的亲核试剂作用,形成结构如ⅩⅨ的叔醇,所述亲核试剂可以是取代的。另一种制备环氧化物和3′-表-OH构型叔醇的方法(附图5)是采用常规成烯反应,例如,所述的适于醛ⅩⅧ的方法,将酮Ⅺ转化为结构如ⅩⅩ的烯烃。
结构如ⅩⅪ的环氧化物可采用已知方法进行不对称合成制备(参见,如J.Org.Chem.32:1363,Synthesis 89,1986;1967;J.Org.Chem.60:3693,1995;J.Am.Chem.Soc.112:2801,1990;J.Am.Chem.Soc.116:6937,1994;J.Org.Chem.58:7615,1993)。按照对环氧化物Ⅸ所用的相似方法,进行环氧化物的亲核开环,得到具有3′-表位构型羟基的取代叔醇。
采用反转仲醇构型的常规方法,可以将已知的(R)-醇ⅩⅩⅥ(附图6)转化为(S)-醇ⅩⅩⅦ,(参见,如Tetrahedron Lett.34:6145,1996;Synthesis Letters,1995,336)。另外,ⅩⅩⅦ可以通过环氧化物ⅩⅩⅣ与氢化物试剂如三乙基硼氢化锂作用进行制备。酮Ⅺ(附图6)可以转化为三氟甲磺酸酯ⅩⅫ,然后与三丁基锡氢化物作用得到烯烃ⅩⅩⅢ。
用于制备在位置R1和R2具有取代基的K252a衍生物的已知方法,可用以在3′-表位-K-252a上获得相应的R1和R2取代基,参见,如美国专利号US 4923986、5461164和5654427。例如ⅩⅣ(附图7)与一当量的N-溴代丁二酰亚胺(NBS)作用得到衍生物ⅩⅩⅤ,其中的R1是溴。用二当量的NBS得到的衍生物中R1和R2均为溴。
由(S)-甲醇Ⅵ生成醛或羧酸衍生物的氧化反应可以使用适当的氧化剂(如“有机化学中的氧化反应”,美国化学协会专刊186,ACSWashington DC 1990所述)进行,还可以采用制备衍生物ⅩⅥ和ⅩⅧ(附图3)所述的方法,使醛或羧酸衍生物实现进一步转化。药物组合物
本发明化合物可以作为单独的活性成分或者与其它治疗剂结合,对哺乳动物,如病人给药。本发明化合物可以与药学上可接受的的赋型剂和载体混合制成药物组合物。这些药物组合物可以制成适于任何给药途径的制剂,如非肠道给药、口服、鼻部或局部给药,组合物可以通过常规方法制备,以单位剂量形式给药,参见,如“Remington’sPharmaceutical Science”(Mack出版公司,Easton,PA)。活性成分的浓度和剂量是可以变化的,所述浓度取决于如下因素如活性成分的总剂量、所用化合物的化学性质(如疏水性)、给药途径、病人的年龄、病人的体重以及所治疗的疾病状况。
本发明化合物可以以,例如含有0.1-10%w/v化合物的生理缓冲溶液的形式提供,用于非肠道给药。一般剂量范围为约每天1μg/kg-约1g/kg体重;优选的剂量范围是约每天0.01mg/kg-约100mg/kg体重;优选约0.1-20mg/kg,每天1-4次。
本发明包括3′-差向异构的K252a衍生物的可药用盐。可药用盐包括药学上可接受的酸加成盐、金属盐、铵盐、有机胺加成盐和氨基酸加成盐。酸加成盐包括无机酸加成盐(如盐酸盐、硫酸盐和磷酸盐)和有机酸加成盐(如乙酸盐、马来酸盐、富马酸盐、酒石酸盐、柠檬酸盐和乳酸盐);金属盐的例子是碱金属盐如锂盐、钠盐和钾盐,碱土金属盐如镁盐和钙盐,铝盐和锌盐;铵盐的例子是铵盐和四甲基铵盐;有机胺加成盐的例子是与吗啉和哌啶所形成的盐;氨基酸加成盐的例子是与甘氨酸、苯丙氨酸、谷氨酸和赖氨酸所形成的盐。
本文所用的‘低级烷基’是指1-6个碳原子的烷基。本文所用的‘芳基’(单独使用或在术语如芳基羰基和芳基氨基羰基所使用的)是指具有6-12个碳原子的、单环或两个稠合环形式的基团,芳基的例子是苯基、联苯基和萘基。杂芳基至少含有一个杂原子,优选的杂原子是O、S或N,杂芳基的例子是吡啶基、嘧啶基、吡咯基、呋喃基、噻吩基、咪唑基、三唑基、四唑基、喹啉基、异喹啉基、苯并咪唑基、噻唑基和苯并噻唑基。取代的烷基具有1-3个独立选择的取代基,烷基的优选取代基是羟基、低级烷氧基、取代或未取代的芳基烷氧基-低级烷氧基、取代或未取代的杂芳基烷氧基-低级烷氧基、卤素、羧基、低级烷氧羰基、硝基、氨基、一或二低级烷基氨基、二氧戊环、二氧六环、二硫戊环和二硫六环。取代的芳基、杂芳基或芳烷基具有1-3个独立选择的取代基,优选取代基是低级烷基、羟基、低级烷氧基、羧基、低级烷氧羰基、硝基、氨基、一或二低级烷基氨基和卤素。
本文所用的‘胆碱能神经元’是指以乙酰胆碱作为神经递质的神经元,胆碱能神经元的例子是基础前脑神经元、纹状体神经元和脊髓神经元。本文所用的‘感觉神经元’是指对环境刺激如温度或运动产生应答的神经元,可找到感觉神经元的组织包括皮肤、肌肉和关节。脊神经节神经元是一个感觉神经元的例子。本文所用的‘营养因子应答细胞’是指与营养因子结合的细胞,营养因子应答细胞包括胆碱能神经元、感觉神经元、单核细胞和肿瘤细胞。
本发明提供以下实施例进一步阐明,决不能将这些实施例决看成是对本发明范围或内容的限定。试验实施例对酪氨酸激酶活性的抑制作用
采用Angeles等人(Anal.Biochem.263:49-55,1996)所述的以酶联吸附测定为基础的(ELISA-Based)试验,测定差向异构的K252a衍生物对杆状病毒表达的人trkA胞质结构域的激酶活性的抑制作用。在96-孔的微量滴定板上,涂以底物溶液(重组人磷脂酶C-γ/谷胱甘肽S-转移酶融合蛋白;Rotin等人,EMBO J.,11:559-567,1992),测量抑制作用所用的100ml试验混合物中含有50mM的Hepes(pH7.4)、40μM的ATP、10mM的MnCl2、0.1%BSA、2%DMSO和不同浓度的抑制剂;加入trkA激酶以引发反应,然后使其在37℃(进行反应15分钟,然后加入磷酸酪氨酸(UBI)抗体,随后加入次级酶结合抗体,碱性磷酸酶标记的山羊抗鼠IgG(Bio-Rad)。
使用放大探测系统(Gibco-BRL)测量结合酶的活性,以GraphPadPrism的剂量-响应(斜率为可变参数)S型曲线(sigmoidal)方程对抑制作用数据进行解析,激酶活性受到50%抑制的浓度称为IC50,结果列于表1中。
表13′-差向异构的K-252a衍生物对trkA激酶活性的抑制作用
对NGF-激活的trk磷酸化作用的抑制
| 化合物 | trkIC50(nM) |
| Ⅵ | 2 |
| Ⅶ | 2 |
| Ⅹ | 2 |
| ⅩⅣ | 1.4 |
| ⅩⅤ | 21 |
| ⅩⅩⅨ(对照) | 7 |
采用经改进的、美国专利号5516771所述方法,测量所选用的差向异构K-252a衍生物对NGF-激活的trk的磷酸化作用的抑制。用trkA转染的NIH3T3细胞在100 mm培养皿中进行培养,在37℃用含有化合物(1-100 nM)或DMSO(加入到对照试样)的、无血清0.05%BSA-DMEM替换培养液,使分会合的细胞(subconfluent cells)受到血清饥饿(serum-starved)1小时,然后以10ng/ml的浓度向细胞中加入NGF(Harlan/Bioproducts for Science)5分钟,将细胞溶解于含有去污剂和蛋白酶抑制剂的缓冲液中,用BCA方法将澄清的细胞溶解液进行蛋白归一化,并用抗-trk抗体进行免疫沉淀。
针于与trk羧基端的14个氨基酸相应的肽,制备多克隆抗-trk抗体(Martin-Zanca等人,Mol.Cell.Boil.9:24-33,1989)。将免疫复合物收集到蛋白A琼脂糖凝胶珠(Sigma)上,通过SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,并转移到聚偏二氟乙烯(PVDF)膜上。该膜用抗磷酸酪氨酸抗体(UBI)进行免疫印迹,然后与辣根过氧化物酶偶合的山羊抗鼠IgG(Bio-Rad)进行温育,用ECL(Amersham)目测检验磷酸化的蛋白。
测量trk蛋白带的面积,并与NGF激活的对照试样相比较,根据trk蛋白带减少百分比,采用如下的抑制作用记分系统:0=不减少,1=1-25%;2=26-49%,3=50-75%,4=76-100%。
trk抑制数据(表2)表明3′-表-OH异构体在全细胞制品中对trk的抑制作用比相应的天然异构体更强。3′-表-K-252a(ⅩⅣ)给出的IC50<10 nM,而K-252a给出的IC50约为50 nM。化合物X在<50 nM浓度时已表现出对trkA的完全抑制,且在细胞中的IC50<10nM,天然异构体ⅩⅩⅨ在100 nM浓度仍未显示完全抑制;二醇Ⅶ对NIH3T3细胞中的trkA抑制作用比天然异构体Ⅲ显示出更强的效力。
表2
3′-差向异构的K-252衍生物对NIH3T3细胞中
NGF-激活的trkA磷酸化作用的影响对VEGF受体激酶活性的抑制作用
采用上述方法,测定3′-差向异构的K252a衍生物对杆状病毒表达的VEGF受体激酶功能域的激酶活性的抑制作用。激酶反应混合物中含有50mM的Hepes(pH7.4)、40μM的ATP、10mM的MnCl2、0.1%BSA、2%DMSO和不同浓度的抑制剂,将其转移至涂有PLC-γ/GST的滴定板上,加入VEGFR激酶,使反应在37℃进行15分钟,用磷酸酪氨酸(UBI)抗体检测磷酸化产物,用次级酶结合的抗体捕获抗体-磷酸化PLC-γ/GST复合物。使用放大探测系统(Gibco-BRL)测量结合酶的活性,以GraphPad Prism的剂量-响应(斜率为可变参数)S型曲线方程对抑制作用数据进行解析,结果列于表3中。
表3
3′-差向异构的K-252a衍生物
对VEGF受体激酶活性的抑制作用
对蛋白激酶C活性的抑制作用
| 化合物 | VEGFR激酶IC50(nM) |
| Ⅵ | 7 |
| Ⅶ | 8 |
| Ⅹ | 17 |
| ⅩⅣ | 19 |
| ⅩⅩⅨ(对照) | 146 |
采用Millipore Multiscreen TCA平板内试验,测量蛋白激酶C的活性(Pitt等人,J.Biomol Screening,1:47-51,1996)。试验在96-孔Multiscreen-DP板(Millipore)上进行,每40-ml测定混合物中含有20mM的Hepes(pH7.4)、10mM的MgCl2、2.5mM的EGTA、2.5mM的氯化钙、80mg/ml的磷脂酰基丝氨酸、3.2mg/ml的甘油二油酸酯、200mg/ml的组蛋白H-1(Fluka)、5mM的[γ-32p]ATP、1.5ng的蛋白激酶C(UBI;混合的同功酶a、b、g)、0.1%BSA、2%DMSO和3′-差向异构的K-252a衍生物。让反应在37℃进行10分钟,加入冰冷的50%三氯乙酸(TCA)以终止反应,将滴定板于4℃下平衡30分钟,然后用冰冷的25%三氯乙酸洗涤,将闪烁混合物加至板上,用WallacMicroBeta 1450 PLUS闪烁计数器测定放射性。将数据代入GraphPadPrism的剂量-响应(斜率为可变参数)S型曲线方程,计算出IC50值,结果列于表4中。
表43′-差向异构的K-252a衍生物对蛋白激酶C活性的抑制作用
对脊髓ChAT活性的增强作用
| 化合物 | PKCIC50(nM) |
| Ⅵ | 95 |
| Ⅶ | 79 |
| Ⅹ | >1000 |
| ⅩⅣ | 114 |
| ⅩⅩⅨ(对照) | 310 |
ChAT被用作有功能的胆碱能神经元的生物化学标志,ChAT的活性已经被用来研究神经营养蛋白(如NGF或NT-3)对胆碱能神经元存活和/或功能的影响。ChAT的测定还被用来指示胆碱能神经元中的ChAT浓度的调节。
在离体的鼠胚胎脊髓培养试验中,3′-差向异构的K-252a衍生物能增强ChAT活性(表5)。在细胞经过2-3小时的平板培养,使其附着并占据组织培养皿后,化合物ⅩⅦ增强ChAT活性为对照培养(不用3′-差向异构的K-252a衍生物处理)的195%。在这些试验中,化合物直接加到离体的鼠胚胎脊髓培养物上。增强ChAT的活性至少是为对照试样的120%的化合物,才视为是具有活性的。单独使用所选择的3′-差向异构的K-252a衍生物,即可观察到增强ChAT活性。结果列于表5中。
表53′-差向异构的K-252a衍生物对脊髓ChAT活性的增强作用
| 脊髓ChAT(%对照) | ||
| 化合物 | 50nM时的活性 | 最大活性 |
| Ⅵ | <120 | 125 |
| Ⅶ | <120 | 122 |
| Ⅹ | <120 | 127 |
| ⅩⅣ | 147 | 195 |
| ⅩⅤ | - | 129 |
基本上按照Smith等人(J.Cell Biology 101:1608-1621,1985)和Glicksman等人(J.Neurochem.61:210-221,1993)所述的方法进行胎鼠脊髓细胞的分离和进行试验。用常规的胰蛋白酶解离技术,从大鼠(胎龄14-15天)中解剖下来的脊髓制备分离的细胞。用加有0.05%的牛血清白蛋白(BSA)的无血清N2培养液(Bottenstein等人,Proc.Natl.Acad.Sci.USA 76:514-517,1979),将细胞以6×105细胞/cm2铺板于涂有聚-L-鸟氨酸的塑料的组织培养皿中。培养物在37℃、5%二氧化碳和95%空气的湿润气氛下温育48小时,2天后进行ChAT活性的体外测定,所用的方法是根据McManaman等人(Developmental Biology 125:311-320,1988)和Glicksman等人(同上)对Fonnum方法(Fonnum等人,J.Neurochem.24:407-409,1975)改进后的方法。用大鼠脊髓运动神经元进行的存活试验
对所选的3′-差向异构的K-252a衍生物,用大鼠脊髓运动神经元进行了增强存活性的试验。化合物ⅩⅥ显著提高了脊髓运动神经元的存活(附图8)。
从胎龄(E)为14.5-15天的Sprague-Dawley大鼠胎儿(Charles River实验室,Wilmington,MA)剖割出脊髓,只从脊髓的腹侧部分剥离细胞,进一步以6.5%节距的甲泛葡胺梯度通过离心富集运动神经元,用低亲和性的神经营养蛋白受体抗体(IgG-192,Boehringer-Mannheim)着色,进行纯度分析。采用以化学方法确定的无血清N2培养液(Bottenstein和Sato,1979),将细胞以6×104细胞/cm2的密度,接种于预先涂有聚-L-鸟氨酸和层粘连蛋白(各为5μg/ml)的96-孔滴定板中。为了将附着作用与影响存活的作用加以区别,在开始附着1-3小时后,将3,9-二[(乙硫基)甲基]-K-252a(Kaneko等人,J.Med.Chem.40:1863-1869,1997)加入到培养物中。
4天后,用钙黄绿素AM(Molecular Probes,Eugene,OR)进行荧光生存力试验(Bozyczko-Coyne等人,J.Neuosci.Meth.50:205-216,1993),以确定神经元的存活力。培养液连续用Dulbeccos磷酸盐缓冲生理盐水(DPBS)稀释,将终浓度为6μM的钙黄绿素AM储液加入到各个孔,滴定板于37℃温育30分钟,然后用DPBS连续稀释液洗涤,用读板荧光计(Cytofluor 2350)(激发波长=485 nm,发射波长=538nm)读出荧光信号强度。对每一块板,从所有试验值中扣除掉从加有钙黄绿素但不含细胞的试样所得到的平均背景值,在上述细胞密度范围内,证明荧光强度对浓度和温育时间是线性的。神经元的显微计数与相关的荧光值直接相关。化合物Ⅴ的制备
将化合物Ⅳb(US专利4,923,986)溶解于亚磷酸三甲基酯(2ml),加热回流3小时。将反应混合物冷至室温,通过闪式硅胶柱用氯仿-甲醇(20∶1)冲洗以除去亚磷酸三甲基酯,用闪式色谱(硅胶,乙酸乙酯∶己烷,1∶1)纯化产物,得到浅黄色固体化合物Ⅴ(15mg,95%产率)。Ms(ESI+):m/e 406(M+H)+,1H NMR(CDCl3,300 MHz):δ2.62(s,3H),2.85(d,1H),3.37-3.45(m,1H),4.95(s,1H),5.00(s,2H),5.09(s,1H),6.29(s,1H),6.90(d,1H),7.33-7.53(m,5H),7.91(d,1H),9.41(d,1H).化合物Ⅵ的制备
在0℃、氮气气氛下,往化合物Ⅴ(161mg,0.397mmol)的THF(80mL)搅拌溶液中加入BH3的THF溶液(1.59mL的1M溶液,1.59mmo),将反应混合物于0℃搅拌30分钟,然后温热到室温过夜,将混合物再冷却至0℃,加入10%氢氧化钠(0.1 mL),剧烈释放出气体。然后滴加过氧化氢(80mL),于0℃搅拌30分钟后,以乙酸乙酯(15mL)稀释反应物并用水洗涤(3×10mL),有机层用硫酸钠干燥,过滤,真空浓缩得到浅绿色固体,该产物以色谱法提纯(硅胶;己烷∶乙酸乙酯;1∶1),得到白色固体化合物Ⅵ(0.12g,产率71%)。MS(ESI+):m/e 424(M+H)+;1H NMR(CDCl3,300 MHz):δ2.54(s,3H),2.51(m,1H),2.99-3.01(m,2H),3.47(m,1H),3.8(m,1H),5.049(s,2H),6.21(broad 2,1H),6.98(m,1H),7.13-7.49(m,6H),7.94-8.02(m,2H),9.34(d,1H).化合物Ⅶ的制备
在室温、氮气气氛下,往化合物Ⅴa(TBDMS-V)(350mg,0.673mmol)的THF(10mL)搅拌溶液中加入吡啶(0.435mL,5.39mmol),然后加入四氧化锇(6.73mL,0.673mmol,0.1M四氯化碳溶液),将反应混合物于室温下搅拌36小时,在此期间反应混合物由黄色变为暗橙红色,将亚硫酸钠水溶液(30mL)加入到反应混合物中,搅拌反应物30分钟,反应混合物以乙酸乙酯萃取(2×20mL),硫酸钠干燥,过滤,真空浓缩得到浅棕色膜状物,该混合物用乙酸乙酯在硅胶上通过闪式色谱提纯,得到黄色固体化合物Ⅶa(TBDMS-Ⅶ)(280mg,产率76%)。
MS(ESI+):m/e 544(M+H)+,1H NMR(CDCl3,300MHz):δ0.56(d,6H),1.079(s,9H),2.04(dd,1H),2.12(broad s,1H),2.40(s,3H),2.86(dd,1H),3.52(broad s,3H),4.99(s,2H),6.98(dd,1H),7.32(t,1H),7.39-7.46(m,4H),7.97(dd,2H),9.35(d,1H).
在0℃、氮气气氛下,往盛有甲醇(2mL)的烧瓶中加入乙酰氯(4滴),将化合物Ⅶa(40mg,0.072mmol)的甲醇(1mL)溶液滴加到上述HCl甲醇溶液中。将反应混合物于0℃搅拌1小时,然后温热到室温过夜,真空除去溶剂,得到黄褐色固体化合物Ⅶ(21mg,产率66%)。MS(ESI+):m/e 440(M+H)+;1H NMR(CDCl3,300 MHz):δ2.052(dd,1H),2.43(s,3H),2.90(dd,1H),3.57(s,1H),3.61(s,2H),5.04(s,2H),6.28(s,1H),7.02(dd,1H),7.33-7.54(m,6H),7.95(d,1H),8.02(d,1H),9.32(d,1H).化合物Ⅹ的制备
在0℃、氮气气氛下,往中间产物Ⅶa(附图2,0.23g,0.415mmol)的THF(10mL)搅拌溶液中,加入三乙胺(57.9mL,0.415mmol)、DMAP(25.4mg,0.208mmol)和对甲苯磺酰氯(71.9mg,0.415mmol),将反应混合物于0℃搅拌1小时,然后缓慢温热至室温过夜。将反应混合物温热1小时,同时用薄层色谱(己烷∶乙酸乙酯,2∶1)监测,以乙酸乙酯(30mL)稀释反应混合物并用水洗涤(3×15mL),有机层用硫酸钠干燥,过滤,真空浓缩得到黄色膜状物甲苯磺酰基中间产物Ⅷa,该反应混合物用己烷∶乙酸乙酯(2∶1)在硅胶上通过闪式色谱进一步提纯,得到浅黄色膜状物(0.16g,产率55%)。MS(APCI):m/e 708(M+H)+;1H NMR(CDCl3,300 MHz):δ0.57(d,6 H),1.08(s,9H),2.01(dd,1H),2.33(s,3H),2.42(s,3H),3.88(dd,1H),3.86(dd,2H),4.98(s,2H),6.97(dd,1H),7.14(d,2H),7.24-7.49(m,7H),7.75(d,1H),7.91(d,1H),9.35(d,1H).
在0℃、氮气气氛下,往中间产物Ⅷa(0.14g,0.198mmol)的THF(5mL)搅拌溶液中,加入氢化钠(15.8mg,0.395mmol),可观察到气体剧烈地放出,反应混合物变得浑浊,另外加入氢化钠(2当量),将烧瓶中的反应物再搅拌2小时,然后轻轻温热4小时,将反应混合物再冷至0℃,用水终止反应,以乙酸乙酯稀释反应混合物,并用水和盐水洗涤。有机层用硫酸镁干燥,过滤,真空浓缩得到黄色膜状物化合物Ⅸa(100.2mg,产率95%)。MS(APCI):m/e 536(M+H)+;1HNMR(CDCl3,300 MHz)∶δ0.56(d,6H),1.08 s,9H),2.32-2.38(m,4H),2.57(d,2 H),3.01(dd,1H),4.99(s,2H),7.01(d,1H),7.33-7.56(m,5H),7.73(d,1H),7.94(d,1H),9.46(d,1M).
在0℃、氮气气氛下,往化合物Ⅸa(100mg,0.187mmol)的THF(5mL)搅拌溶液中,滴加入三乙基硼氢化锂(0.37mL的1M THF溶液,0.374mmol),并有气体放出,于0℃加入另外的三乙基硼氢化锂(2当量),并在0℃搅拌反应30分钟,然后温热至室温;将反应混合物冷至0℃,用水终止反应,以乙酸乙酯稀释反应混合物,并用水和盐水洗涤。有机层用硫酸镁干燥,过滤,真空浓缩;该反应混合物用己烷∶乙酸乙酯(1∶1)在硅胶上通过闪式色谱提纯,得到浅黄色膜状物Ⅹa(R=TBDMS)。在0℃、氮气气氛下,往化合物Ⅹa的甲醇搅拌溶液中,加入由乙酰氯(5滴)在甲醇中制成的溶液,将反应混合物于0℃搅拌30分钟,然后温热到室温过夜,真空除去溶剂得到黄色固体,该固体经硅胶色谱(己烷∶乙酸乙酯,1∶1)纯化得到化合物Ⅹ(30mg,产率42%)。
MS(ESI+):m/e 424(M+H)+,1H NMR(CDCl3,300 MHz):δ1.39
(s,3H),2.29(dd,1H),2.37(s,3H),2.91(dd,1H),5.05
(g,2H),6.19(s,1H),6.97(t,1H),7.32-7.50(m,5H),7.78
(d,1H),7.95(d,1H),9.33(d,1H).化合物ⅩⅣ和ⅩⅤ的制备
于室温在氮气气氛下,往酮Ⅺ(US 4923986)(附图5,451mg,1.11mmol)于二氯甲烷-二噁烷混合物(6mL;5∶1)的搅拌溶液中,加入四丁基铵氰化物(740mg,2.77 mmol)和乙酸(95mL,1.66mmol),将黑色的反应混合物搅拌24小时,然后进行真空浓缩,将黑色油状物溶解于乙酸乙酯(20mL)和二噁烷(2mL)中,并用水(3×10mL)和盐水(1×10mL)洗涤,有机层用硫酸镁干燥,过滤,真空浓缩得到棕色固体,HPLC分析表明,存在两种氰醇中间产物,Ⅻa和ⅩⅢb。
往盛有甲醇(4mL)的烧瓶中,通入氯化氢气体10分钟,在0℃,将步骤1的氰醇混合物(450mg,1.04mmol)于甲醇∶二噁烷(2∶1,3mL)的溶液加入到上述氯化氢甲醇溶液中,将反应混合物密封,并于0℃搅拌2小时,然后置于冰箱中48小时。将烧瓶温热至室温,小心加入6NHCl,将混合物搅拌30分钟,浓缩至干,将残留物溶解于50%的甲醇∶水中,室温下搅拌过夜,形成沉淀物,将反应混合物浓缩至干,在硅胶上用己烷∶乙酸乙酯(1∶1)通过闪式色谱纯化残留物,得到灰白色固体化合物ⅩⅣ。MS(ESI+):m/e 468(M+H)+;1H NMR(CDCl3,300 MHz)δ2.416(s,3H,2.77(dd,1H),2.91(s,3H),2.952(dd,1H),4.99(s,2H),7.13(dd,1H),7.33(t,1H),7.44(dd,2H),7.64(t,2H),7.98(d,1H),9.16(d,1H).用乙酸乙酯洗脱色谱柱得到浅橙色产物,酰胺ⅩⅤ(13mg)。MS(EsI):m/e 453(M+H)+;1HNMR(DMSO-d6,300 MHz)δ2.33(s,3H),2.37(m,2H),4.94(s,2H),6.58(s,1H),7.19-7.64(m,6H),7.81(m,3H),7.96(d,1H),8.59(s,1H),9.17(d,1H).化合物XXIII的制备
在-78℃、氮气气氛下,往酮XIa(附图6;R=TBDMS)(95.4mg,0.183mmol)的THF(5mL)搅拌溶液中,加入二乙基氨化锂(0.12mg,1.5M环己烷溶液),将反应混合物于-78℃搅拌30分钟,向反应混合物中滴加入N-苯基三氟甲磺酰胺(71.9mg,0.201mmol)的THF(1.5mL)溶液,并于-78℃搅拌该混合物30分钟。使反应混合物温热至0℃,搅拌1小时,然后温热至室温过夜,用氯化铵(饱和水溶液2mL)终止反应,以乙酸乙酯稀释并用水洗涤。混合物在硅胶上用己烷∶乙酸乙酯(2∶1)通过闪式色谱纯化,得到灰白色固体化合物XXIIa(R=TBDMS)(66mg,产率61%)Ms(ESI+):m/e 654(M+H)+,1H NMR(CDCl3,300 MHz):δ 0.58(g,6H),1.12(s,9H),2.66(s,3H),5.02(dd,2H),6.14(s,1H),7.31-7.62(m,6H),7.83(d,1H),7.98(d,1H),9.44(d,1H),
往步骤1的所得产物(化合物ⅩⅫa)(75mg,0.115mmol)的THF(10mL)搅拌溶液中,加入氯化锂(14.6mg,0.115mmol)和四(三苯基膦)钯(0)(2.6mg,0.0023mmol),滴加三丁基氢化锡(37mL,0.139mmol),将该混合物加热至60℃。继续加热反应混合物4小时,在此期间反应物的颜色由黄色变为暗红色。真空浓缩反应混合物,并在硅胶上用己烷∶乙酸乙酯(2∶1)通过闪式色谱纯化,分离出两种产物:被三丁基锡污染的、TBDMS-保护的产物ⅩⅩⅢa(60mg)和脱保护的产物ⅩⅩⅢ(10mg,产率22%)。
MS(ESI):m/e 392(M+H)+,1H NMR(CDCl3,300 MHz):δ2.65(s,3H),4.978(s,2H),6.19(d,1H),6.28(d,1H),6.41(s,1H),7.26-7.62(m,5H),7.65-7.69(m,1H),7.87(dd,2H),9.3 9(d,1H).
在上述试验中,化合物ⅩⅩⅢ显示出如下的IC50值:抑制trkA激酶,4nM;抑制VEGF受体激酶,25nM;抑制蛋白激酶C,>1000nM。化合物ⅩⅩⅤ的制备
在室温、氮气气氛下,往化合物ⅩⅣ(30.4mg,0.065mmol)的THF(5mL)搅拌溶液中,一次性加入N-溴代丁二酰亚胺(11.6mg,0.065mmol),反应混合物逐渐由开始的浅橙色变为浅紫色,将反应混合物于室温搅拌过夜,真空除去溶剂,所得固体在硅胶上用己烷-乙酸乙酯(2∶1)通过闪式色谱纯化,得到灰白色固体化合物ⅩⅩⅤ(31.2mg,产率88%)。MS(ESI):m/e 547(M+H)+,1H NMR(CDCl3,300 MHz):δ2.42(s,3H),2.77-2.83(m,1H),2.86(3H,s),31.66(dd,1H),4.105(s,1H),5.07(s,2H),6.39(s,1H),7.01(dd,1H),7.95(d,1H),7.58(d,1H),7.34-7.57(m,4H),9.50(s,1H).化合物ⅩⅩⅨ的制备方法A
在0℃、氮气气氛下,往环氧化物ⅩⅩⅧ(US 4,923,980,化合物I-27)(90.1mg,0.152mmol)的THF(4mL)搅拌溶液中,滴加三乙基硼氢化锂(0.455mL的1M THF溶液,0.455mmol),将反应混合物于0℃搅拌1小时,然后使其温热至室温过夜;将反应混合物冷至0℃,缓慢加入甲醇以终止反应,0℃下继续搅拌15分钟后将反应混合物温热至室温,真空除去溶剂,得到黄色油状物,该油状物在硅胶上用乙酸乙酯∶己烷(1∶1)通过闪式色谱纯化,得到白色固体化合物ⅩⅩⅨ(75mg,产率83%)。MS(ESI):m/e 424 (M+H)+;1H NMR(CDCl3,300MHz):δ1.69(s,3H),1.99(g,3H),2.86(dd,1H),3.03(dd,1H),4.37(m,3H),4.93(s,2H),6.43(t,1H),6.95(d,1H),7.03(t,1H),7.18(t,1H),7.44(t,1H),7.79(d,1H),7.99(d,1H),8.69(d,1H).
方法B
在0℃、氮气气氛下,往酮Ⅺ(附图3,R=H)(212mg,0.41mmol)的THF(6mL)搅拌溶液中,滴加甲基碘化镁(0.27mL,0.82mmol),将反应混合物于0℃搅拌1小时,然后温热至室温过夜;将反应混合物加热回流24小时,然后冷却至室温,加入氯化铵(饱和水溶液)以终止反应,以乙酸乙酯(20mL)稀释并用水洗涤(3×10mL),有机相以硫酸钠干燥,过滤,真空浓缩得到黄色残留物,该产物在硅胶上用己烷∶乙酸乙酯(1∶1)通过闪式色谱纯化,得到黄褐色固体化合物ⅩⅩⅨ(0.11g,产率50%),其1HNMR和质谱数据与方法A所得产物相一致。
其它实施方案在下面的权利要求中。
Claims (12)
1.下式表示的化合物或其可药用盐:
其中:
R1和R2各自独立地是
氢、低级烷基、卤素、酰基、硝基、磺酸,
-CH=NR4,其中R4是胍基、杂环或-NR5R6,其中是R5或R6
是氢或低级烷基,而另一个是氢、低级烷基、酰基、芳
基、杂环、氨基甲酰基或低级烷基氨基羰基,
-NR5R6,
-CH(SR7)2,其中R7是低级烷基或链烯基,
-(CH2)jR8,其中j是1-6,R8是
卤素、取代的芳基、未取代的芳基、取代的杂芳基、
未取代的杂芳基、N3,
-CO2R9,其中R9是氢、取代的低级烷基、未取代的低
级烷基、取代的芳基、未取代的芳基、取代的杂
芳基或未取代的杂芳基,
-C(=O)NR10R11,其中R10和R11各自独立地是氢、取代
的低级烷基、未取代的低级烷基、取代的芳基、未
取代的芳基、取代的杂芳基、未取代的杂芳基、取
代的芳烷基、未取代的芳烷基、低级烷基氨基羰基
或低级烷氧羰基,或者R10和R11与氮原子结合形成
杂环基,
-OR12,其中R12是氢、取代的低级烷基、未取代的低级
烷基、取代的芳基、未取代的芳基,或者是
-C(=O)R13,其中R13是氢、NR10R11、取代的低级烷
基、未取代的低级烷基、取代的芳基、未取代的芳
基、取代的杂芳基、未取代的杂芳基、取代的芳烷
基或未取代的芳烷基,
-NR10R11,
-C(=O)R14,其中R14是氢、低级烷基、取代的芳基、未
取代的芳基、取代的杂芳基或未取代的杂芳基,
-S(=O)rR15,其中r为0-2,R15是氢、取代的低级烷基、
未取代的低级烷基、取代的芳基、未取代的芳基、
取代的杂芳基、未取代的杂芳基、取代的芳烷基、
未取代的芳烷基、噻唑啉基、(CH2)aC(=O)NR10R11
或(CH2)aCO2R16,其中a为1或2,而R16是氢或低
级烷基,-OR17,其中R17是氢、低级烷基或-C(=O)R18,其中R18是取
代的低级烷基、未取代的低级烷基、取代的芳基或未取
代的芳基,-C(=O)(CH2)jR19,其中R19是氢、卤素、NR10R11、N3、SR15
或OR20,其中R20是氢、取代的低级烷基、未取代的低
级烷基或C(=O)R14,-CH(OH)(CH2)jR19,-(CH2)dCHR21CO2R16A,其中d为0-5,R21是氢、CONR10R11
或CO2R16A,其中R16A同R16,-(CH2)dCHR21CONR10R11,-CH=CH(CH2)mR22,其中m为0-4,R22是氢、低级烷基、
CO2R9、取代的芳基、未取代的芳基、取代的杂芳基、
未取代的杂芳基、OR12或NR10R11,-CH=C(CO2R16A)2,-C≡C(CH2)mR22,
-SO2NR23R24,其中R23和R24各自独立地是氢、低级烷基,或
者是与连接的氮原子所形成的杂环基,
-OCO2R13A,其中R13A同R13,或
-OC(=O)NR10R11;R3是氢、低级烷基、氨基甲酰基、氨基、四氢吡喃基、羟基、
C(=O)H、芳烷基、低级烷酰基,或者是CH2CH2R25,其中R25
是卤素、氨基、二-低级烷基氨基、羟基或羟基取代的低级烷
基氨基;X是氢、甲酰基、羧基、低级烷氧羰基、低级烷基肼基羰基、-CN、低级烷基,-C(=O)NR26R27,其中R26和R27各自独立地是氢、未取代的低
级烷基或未取代的芳基,或者R26和R27与氮原子结合形
成杂环基,
-CH(=R34)W,其中R34是氢或低级烷基,W是-N=CHN(烷
基)2、胍基、N3或NR28R29,其中R28或R29是氢或低级
烷基,另一个是氢、烯丙基、烷酰基、芳氧羰基、未取
代的烷基、或羧基基团的羟基被除去了的α-氨基酸残
基、-CO2R9、-C(=O)NR10R11、-S(=O)rR30或OR31,其中
R30是取代或未取代的低级烷基、芳基或杂芳基,R31是
氢、取代或未取代的烷基、取代或未取代的烷酰基,-CH=N-R32,其中R32是羟基、低级烷氧基、氨基、胍基、脲
基、咪唑基氨基、氨基甲酰基氨基或NR26AR27A,其中
R26A同R26,其中R27A同R27,或
表示的糖残基,其中V表示氢、甲基、乙基、苄基、乙
酰基或三氟乙酰基;Y是氢、-OH、-OC(=O)R33(其中R33是烷基、芳基或氨基)、
OCH2O-烷基、-O-烷基、芳基烷氧基;或者X和Y结合为-
X-Y-,形成-CH2OCO2-或-CH2N(R16B)CO2-,其中R16B同R16;
A1和A2为氢或两者结合表示O;
B1和B2为氢或两者结合表示O;
其前提条件是,A1、A2或B1、B2至少之一表示O,并且X和Y
不同时为氢。
2.权利要求1的化合物,其中X是-C(=O)NR26R27、羧基、低级烷氧羰基、甲酰基、低级烷基、-CH2OR31、-CH2NR28R29或-CH2S(=O)rR30。
3.权利要求1的化合物,其中R1和R2为H。
4.权利要求1的化合物,其中R3为氢或保护基。
6.一种含有权利要求1化合物的药物组合物。
7.一种抑制酪氨酸激酶活性的方法,包括将权利要求1的化合物与酪氨酸激酶接触。
8.权利要求7的方法,其中的酪氨酸激酶是蛋白激酶C。
9.权利要求7的方法,其中的酪氨酸激酶是trkA。
10.一种抑制酪氨酸激酶通过第二种激酶的磷酸化作用的方法,包括将第二种激酶与权利要求1的化合物接触。
11.一种增强胆碱能神经元功能的方法,包括将胆碱能神经元与权利要求1的化合物接触。
12.一种通提高胆碱能神经元存活的方法,包括将胆碱能神经元与权利要求1的化合物接触。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US7026397P | 1997-12-31 | 1997-12-31 | |
| US60/070,263 | 1997-12-31 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1285836A true CN1285836A (zh) | 2001-02-28 |
Family
ID=22094212
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN98812812A Pending CN1285836A (zh) | 1997-12-31 | 1998-12-30 | 3′-差向异构的K-252a衍生物 |
Country Status (15)
| Country | Link |
|---|---|
| US (2) | US6093713A (zh) |
| EP (1) | EP1044203B1 (zh) |
| JP (1) | JP4405667B2 (zh) |
| KR (1) | KR20010033737A (zh) |
| CN (1) | CN1285836A (zh) |
| AT (1) | ATE234308T1 (zh) |
| AU (1) | AU1947499A (zh) |
| BR (1) | BR9814543A (zh) |
| CA (1) | CA2315953C (zh) |
| DE (1) | DE69812177T2 (zh) |
| DK (1) | DK1044203T3 (zh) |
| ES (1) | ES2194385T3 (zh) |
| NO (1) | NO20003397L (zh) |
| PT (1) | PT1044203E (zh) |
| WO (1) | WO1999033836A1 (zh) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE60112611T2 (de) * | 2000-12-08 | 2006-06-14 | Ortho Mcneil Pharm Inc | Makroheterocyclische verbindungen als kinase inhibitoren |
| CA2446939C (en) * | 2001-05-16 | 2005-08-02 | Matthias Stein-Gerlach | Pyridylpyrimidine derivatives as effective compounds against prion diseases |
| US7018999B2 (en) | 2001-05-16 | 2006-03-28 | Cephalon, Inc. | Methods for the treatment and prevention of pain |
| DE10161940A1 (de) * | 2001-12-17 | 2003-07-03 | Nad Ag | N-Carbacyclus-monosubstitutierte Indolocarbazole als Proteinkinase-inhibitoren |
| US6723844B1 (en) * | 2003-02-27 | 2004-04-20 | Abbott Laboratories | Preparation of K-252a |
| DE102004025726B4 (de) * | 2004-05-26 | 2006-07-06 | Roder, Hanno, Dr. | Verwendung eines spezifischen K252a-Derivats zur Verhinderung oder Behandlung der Alzheimerschen Krankheit |
| US20060058250A1 (en) * | 2004-09-10 | 2006-03-16 | Cephalon, Inc. | Methods of treating proliferative skin diseases using carbazole derivatives |
| US20080021013A1 (en) * | 2006-07-21 | 2008-01-24 | Cephalon, Inc. | JAK inhibitors for treatment of myeloproliferative disorders |
| WO2008076394A1 (en) * | 2006-12-14 | 2008-06-26 | Tautatis, Inc. | Compositions and methods for the treatment of cancer |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS62155284A (ja) * | 1985-12-27 | 1987-07-10 | Kyowa Hakko Kogyo Co Ltd | 生理活性物質k−252の誘導体 |
| JPH0826036B2 (ja) | 1987-01-22 | 1996-03-13 | 協和醗酵工業株式会社 | 生理活性物質k−252の誘導体 |
| US4923986A (en) * | 1987-03-09 | 1990-05-08 | Kyowa Hakko Kogyo Co., Ltd. | Derivatives of physiologically active substance K-252 |
| US5461146A (en) * | 1992-07-24 | 1995-10-24 | Cephalon, Inc. | Selected protein kinase inhibitors for the treatment of neurological disorders |
| US5621100A (en) * | 1992-07-24 | 1997-04-15 | Cephalon, Inc. | K-252a derivatives for treatment of neurological disorders |
| ATE165097T1 (de) | 1993-05-28 | 1998-05-15 | Cephalon Inc | Anwendung von indolocarbazol-derivaten zur behandlung von prostataerkrankungen |
| US5468872A (en) * | 1993-09-16 | 1995-11-21 | Cephalon, Inc. | K-252a functional derivatives potentiate neurotrophin-3 for the treatment of neurological disorders |
| ATE200290T1 (de) * | 1994-07-04 | 2001-04-15 | Kyowa Hakko Kogyo Kk | Verfahren zur herstellung von indolocarbazol- derivaten |
| AU6657596A (en) | 1995-07-31 | 1997-02-26 | Ciba-Geigy Ag | Trindene compounds |
| WO1997007081A2 (en) | 1995-08-11 | 1997-02-27 | Yale University | Glycosylated indolocarbazole synthesis |
-
1998
- 1998-12-30 DK DK98964309T patent/DK1044203T3/da active
- 1998-12-30 CN CN98812812A patent/CN1285836A/zh active Pending
- 1998-12-30 ES ES98964309T patent/ES2194385T3/es not_active Expired - Lifetime
- 1998-12-30 JP JP2000526515A patent/JP4405667B2/ja not_active Expired - Fee Related
- 1998-12-30 WO PCT/US1998/027644 patent/WO1999033836A1/en not_active Application Discontinuation
- 1998-12-30 PT PT98964309T patent/PT1044203E/pt unknown
- 1998-12-30 AU AU19474/99A patent/AU1947499A/en not_active Abandoned
- 1998-12-30 KR KR1020007007260A patent/KR20010033737A/ko not_active Application Discontinuation
- 1998-12-30 EP EP98964309A patent/EP1044203B1/en not_active Expired - Lifetime
- 1998-12-30 DE DE69812177T patent/DE69812177T2/de not_active Expired - Lifetime
- 1998-12-30 AT AT98964309T patent/ATE234308T1/de not_active IP Right Cessation
- 1998-12-30 US US09/223,518 patent/US6093713A/en not_active Expired - Lifetime
- 1998-12-30 CA CA2315953A patent/CA2315953C/en not_active Expired - Fee Related
- 1998-12-30 BR BR9814543-6A patent/BR9814543A/pt not_active Application Discontinuation
-
2000
- 2000-02-15 US US09/503,812 patent/US6451786B1/en not_active Expired - Fee Related
- 2000-06-29 NO NO20003397A patent/NO20003397L/no not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| PT1044203E (pt) | 2003-07-31 |
| JP4405667B2 (ja) | 2010-01-27 |
| DE69812177T2 (de) | 2004-01-15 |
| EP1044203B1 (en) | 2003-03-12 |
| EP1044203A1 (en) | 2000-10-18 |
| BR9814543A (pt) | 2000-10-10 |
| KR20010033737A (ko) | 2001-04-25 |
| ATE234308T1 (de) | 2003-03-15 |
| US6093713A (en) | 2000-07-25 |
| JP2001527079A (ja) | 2001-12-25 |
| US6451786B1 (en) | 2002-09-17 |
| AU1947499A (en) | 1999-07-19 |
| DK1044203T3 (da) | 2003-07-14 |
| WO1999033836A9 (en) | 2000-09-14 |
| NO20003397L (no) | 2000-08-31 |
| DE69812177D1 (de) | 2003-04-17 |
| WO1999033836A1 (en) | 1999-07-08 |
| ES2194385T3 (es) | 2003-11-16 |
| CA2315953C (en) | 2010-11-09 |
| CA2315953A1 (en) | 1999-07-08 |
| NO20003397D0 (no) | 2000-06-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2033654B1 (en) | Process for resolving a mixture of alkyl ester enantiomers using an enzyme | |
| US7655686B2 (en) | Certain substituted spirocyclic lactams and use thereof as pharmaceuticals | |
| CN1097054C (zh) | 三环类吡唑衍生物及其组合物 | |
| CN1449287A (zh) | 具有抗炎作用的稠合吡咯并咔唑 | |
| ES2390732T3 (es) | Compuestos para el tratamiento de la hepatitis C | |
| JP2001519412A (ja) | Cc−1065およびデュオカルマイシンのイソ−cbiおよびイソ−ci類似体 | |
| CN103339138A (zh) | 选择性糖苷酶抑制剂及其用途 | |
| CN1285836A (zh) | 3′-差向异构的K-252a衍生物 | |
| EP2380892B1 (en) | Imidazothiazole derivative having proline ring structure | |
| EA013182B1 (ru) | Новые конденсированные пирролокарбазолы | |
| CN1301255C (zh) | αLβ2整合素介导的细胞粘附抑制剂 | |
| JPWO2006070780A1 (ja) | Par−2アゴニスト | |
| KR20220080133A (ko) | 골수퍼옥시다제 저해제의 전구약물 | |
| CN1592748A (zh) | 金属酞菁区域异构体的分离 | |
| EP1654241B1 (en) | Macrocyclic compounds having aspartic protease inhibiting activity and pharmaceutical uses thereof | |
| EP0772615A1 (fr) | DERIVES D'ACIDE IMIDAZO 1,2-a]INDENO 1,2-e]PYRAZINE-2-CARBOXYLIQUE, LEUR PREPARATION ET LES MEDICAMENTS LES CONTENANT | |
| MXPA00006500A (en) | 3'-epimeric k-252a derivatives | |
| FR2738821A1 (fr) | Indeno[1,2-e]pyrazin-4-ones, leur preparation et les medicaments les contenant | |
| CN1202901A (zh) | 具有金属肽酶抑制活性的膦酸衍生物 | |
| US20240083875A1 (en) | Dihydroisoquinolinyl derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |