CN113563243A - 一种2,5-吡咯烷二甲醇及其衍生物的合成方法 - Google Patents
一种2,5-吡咯烷二甲醇及其衍生物的合成方法 Download PDFInfo
- Publication number
- CN113563243A CN113563243A CN202110856335.3A CN202110856335A CN113563243A CN 113563243 A CN113563243 A CN 113563243A CN 202110856335 A CN202110856335 A CN 202110856335A CN 113563243 A CN113563243 A CN 113563243A
- Authority
- CN
- China
- Prior art keywords
- aqueous solution
- synthesizing
- pyrrolidine
- reaction
- dimethanol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- ITNFYTQOVXXQNN-UHFFFAOYSA-N [5-(hydroxymethyl)pyrrolidin-2-yl]methanol Chemical compound OCC1CCC(CO)N1 ITNFYTQOVXXQNN-UHFFFAOYSA-N 0.000 title claims abstract description 54
- 238000001308 synthesis method Methods 0.000 title description 20
- 238000006243 chemical reaction Methods 0.000 claims abstract description 60
- 239000003054 catalyst Substances 0.000 claims abstract description 42
- 238000000034 method Methods 0.000 claims abstract description 31
- 238000005984 hydrogenation reaction Methods 0.000 claims abstract description 26
- 230000002194 synthesizing effect Effects 0.000 claims abstract description 23
- 229940125782 compound 2 Drugs 0.000 claims abstract description 6
- -1 p-methoxybenzyl Chemical group 0.000 claims abstract description 5
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims abstract description 3
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 claims abstract description 3
- 229940125904 compound 1 Drugs 0.000 claims abstract description 3
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 claims abstract description 3
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims abstract description 3
- 239000007864 aqueous solution Substances 0.000 claims description 72
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 48
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 claims description 36
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 30
- 239000000654 additive Substances 0.000 claims description 30
- 230000000996 additive effect Effects 0.000 claims description 30
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 claims description 25
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 claims description 24
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 claims description 24
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical group [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 24
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 claims description 18
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 claims description 18
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 claims description 18
- 235000019253 formic acid Nutrition 0.000 claims description 18
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 claims description 14
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 claims description 14
- NPXOKRUENSOPAO-UHFFFAOYSA-N Raney nickel Chemical compound [Al].[Ni] NPXOKRUENSOPAO-UHFFFAOYSA-N 0.000 claims description 12
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 claims description 12
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 claims description 12
- 229910000029 sodium carbonate Inorganic materials 0.000 claims description 10
- 229920006395 saturated elastomer Polymers 0.000 claims description 9
- 150000001875 compounds Chemical class 0.000 claims description 8
- 229910052979 sodium sulfide Inorganic materials 0.000 claims description 8
- GRVFOGOEDUUMBP-UHFFFAOYSA-N sodium sulfide (anhydrous) Chemical compound [Na+].[Na+].[S-2] GRVFOGOEDUUMBP-UHFFFAOYSA-N 0.000 claims description 8
- 229910052961 molybdenite Inorganic materials 0.000 claims description 7
- 229910052982 molybdenum disulfide Inorganic materials 0.000 claims description 7
- 239000012429 reaction media Substances 0.000 claims description 7
- 150000001298 alcohols Chemical class 0.000 claims description 6
- 235000015497 potassium bicarbonate Nutrition 0.000 claims description 6
- 229910000028 potassium bicarbonate Inorganic materials 0.000 claims description 6
- 239000011736 potassium bicarbonate Substances 0.000 claims description 6
- 229910000027 potassium carbonate Inorganic materials 0.000 claims description 6
- 235000011181 potassium carbonates Nutrition 0.000 claims description 6
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 claims description 6
- DPLVEEXVKBWGHE-UHFFFAOYSA-N potassium sulfide Chemical compound [S-2].[K+].[K+] DPLVEEXVKBWGHE-UHFFFAOYSA-N 0.000 claims description 6
- 229910000030 sodium bicarbonate Inorganic materials 0.000 claims description 6
- 235000017557 sodium bicarbonate Nutrition 0.000 claims description 6
- 229940126214 compound 3 Drugs 0.000 claims description 2
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 claims description 2
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 claims description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 2
- 238000004519 manufacturing process Methods 0.000 abstract description 9
- 239000002994 raw material Substances 0.000 abstract description 4
- 238000003786 synthesis reaction Methods 0.000 abstract description 4
- MKVBQBLIGAFRIY-UHFFFAOYSA-N 1h-pyrrole-2,5-dicarbaldehyde Chemical compound O=CC1=CC=C(C=O)N1 MKVBQBLIGAFRIY-UHFFFAOYSA-N 0.000 abstract description 2
- 238000010189 synthetic method Methods 0.000 abstract description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 20
- 239000000243 solution Substances 0.000 description 16
- 238000003756 stirring Methods 0.000 description 11
- 150000002500 ions Chemical class 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- KAESVJOAVNADME-UHFFFAOYSA-N 1H-pyrrole Natural products C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 6
- 238000001914 filtration Methods 0.000 description 5
- BBMCTIGTTCKYKF-UHFFFAOYSA-N 1-heptanol Chemical compound CCCCCCCO BBMCTIGTTCKYKF-UHFFFAOYSA-N 0.000 description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 4
- AMQJEAYHLZJPGS-UHFFFAOYSA-N N-Pentanol Chemical compound CCCCCO AMQJEAYHLZJPGS-UHFFFAOYSA-N 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 4
- KBPLFHHGFOOTCA-UHFFFAOYSA-N caprylic alcohol Natural products CCCCCCCCO KBPLFHHGFOOTCA-UHFFFAOYSA-N 0.000 description 4
- 239000007805 chemical reaction reactant Substances 0.000 description 4
- MWKFXSUHUHTGQN-UHFFFAOYSA-N decan-1-ol Chemical compound CCCCCCCCCCO MWKFXSUHUHTGQN-UHFFFAOYSA-N 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical compound CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 description 4
- ZWRUINPWMLAQRD-UHFFFAOYSA-N nonan-1-ol Chemical compound CCCCCCCCCO ZWRUINPWMLAQRD-UHFFFAOYSA-N 0.000 description 4
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 4
- 238000012216 screening Methods 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 239000006227 byproduct Substances 0.000 description 3
- 238000004440 column chromatography Methods 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 238000011049 filling Methods 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 239000000376 reactant Substances 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- LSDPWZHWYPCBBB-UHFFFAOYSA-N Methanethiol Chemical compound SC LSDPWZHWYPCBBB-UHFFFAOYSA-N 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- YLEIFZAVNWDOBM-ZTNXSLBXSA-N ac1l9hc7 Chemical compound C([C@H]12)C[C@@H](C([C@@H](O)CC3)(C)C)[C@@]43C[C@@]14CC[C@@]1(C)[C@@]2(C)C[C@@H]2O[C@]3(O)[C@H](O)C(C)(C)O[C@@H]3[C@@H](C)[C@H]12 YLEIFZAVNWDOBM-ZTNXSLBXSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 230000006837 decompression Effects 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- DNJIEGIFACGWOD-UHFFFAOYSA-N ethanethiol Chemical compound CCS DNJIEGIFACGWOD-UHFFFAOYSA-N 0.000 description 2
- 239000008098 formaldehyde solution Substances 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- TVMXDCGIABBOFY-UHFFFAOYSA-N n-Octanol Natural products CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 238000007142 ring opening reaction Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000002351 wastewater Substances 0.000 description 2
- FANCTJAFZSYTIS-IQUVVAJASA-N (1r,3s,5z)-5-[(2e)-2-[(1r,3as,7ar)-7a-methyl-1-[(2r)-4-(phenylsulfonimidoyl)butan-2-yl]-2,3,3a,5,6,7-hexahydro-1h-inden-4-ylidene]ethylidene]-4-methylidenecyclohexane-1,3-diol Chemical compound C([C@@H](C)[C@@H]1[C@]2(CCCC(/[C@@H]2CC1)=C\C=C\1C([C@@H](O)C[C@H](O)C/1)=C)C)CS(=N)(=O)C1=CC=CC=C1 FANCTJAFZSYTIS-IQUVVAJASA-N 0.000 description 1
- GHKCSRZBNZQHKW-UHFFFAOYSA-N 1-sulfanylethanol Chemical compound CC(O)S GHKCSRZBNZQHKW-UHFFFAOYSA-N 0.000 description 1
- DKIDEFUBRARXTE-UHFFFAOYSA-N 3-mercaptopropanoic acid Chemical compound OC(=O)CCS DKIDEFUBRARXTE-UHFFFAOYSA-N 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- DRSHXJFUUPIBHX-UHFFFAOYSA-N COc1ccc(cc1)N1N=CC2C=NC(Nc3cc(OC)c(OC)c(OCCCN4CCN(C)CC4)c3)=NC12 Chemical compound COc1ccc(cc1)N1N=CC2C=NC(Nc3cc(OC)c(OC)c(OCCCN4CCN(C)CC4)c3)=NC12 DRSHXJFUUPIBHX-UHFFFAOYSA-N 0.000 description 1
- QMMFVYPAHWMCMS-UHFFFAOYSA-N Dimethyl sulfide Chemical compound CSC QMMFVYPAHWMCMS-UHFFFAOYSA-N 0.000 description 1
- 241000194032 Enterococcus faecalis Species 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 229930189077 Rifamycin Natural products 0.000 description 1
- 239000002262 Schiff base Substances 0.000 description 1
- 150000004753 Schiff bases Chemical class 0.000 description 1
- 241000193996 Streptococcus pyogenes Species 0.000 description 1
- JOXFRTIMRUMHML-UHFFFAOYSA-N [1-(hydroxymethyl)pyrrolidin-2-yl]methanol Chemical compound OCC1CCCN1CO JOXFRTIMRUMHML-UHFFFAOYSA-N 0.000 description 1
- 150000008065 acid anhydrides Chemical class 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- KCXMKQUNVWSEMD-UHFFFAOYSA-N benzyl chloride Chemical compound ClCC1=CC=CC=C1 KCXMKQUNVWSEMD-UHFFFAOYSA-N 0.000 description 1
- 229940073608 benzyl chloride Drugs 0.000 description 1
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- ZKKLPDLKUGTPME-UHFFFAOYSA-N diazanium;bis(sulfanylidene)molybdenum;sulfanide Chemical compound [NH4+].[NH4+].[SH-].[SH-].S=[Mo]=S ZKKLPDLKUGTPME-UHFFFAOYSA-N 0.000 description 1
- LJSQFQKUNVCTIA-UHFFFAOYSA-N diethyl sulfide Chemical compound CCSCC LJSQFQKUNVCTIA-UHFFFAOYSA-N 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 238000010907 mechanical stirring Methods 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- GVOISEJVFFIGQE-YCZSINBZSA-N n-[(1r,2s,5r)-5-[methyl(propan-2-yl)amino]-2-[(3s)-2-oxo-3-[[6-(trifluoromethyl)quinazolin-4-yl]amino]pyrrolidin-1-yl]cyclohexyl]acetamide Chemical compound CC(=O)N[C@@H]1C[C@H](N(C)C(C)C)CC[C@@H]1N1C(=O)[C@@H](NC=2C3=CC(=CC=C3N=CN=2)C(F)(F)F)CC1 GVOISEJVFFIGQE-YCZSINBZSA-N 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 150000003233 pyrroles Chemical class 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000001453 quaternary ammonium group Chemical group 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 229960003292 rifamycin Drugs 0.000 description 1
- HJYYPODYNSCCOU-ODRIEIDWSA-N rifamycin SV Chemical compound OC1=C(C(O)=C2C)C3=C(O)C=C1NC(=O)\C(C)=C/C=C/[C@H](C)[C@H](O)[C@@H](C)[C@@H](O)[C@@H](C)[C@H](OC(C)=O)[C@H](C)[C@@H](OC)\C=C\O[C@@]1(C)OC2=C3C1=O HJYYPODYNSCCOU-ODRIEIDWSA-N 0.000 description 1
- 238000002791 soaking Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- VBQFMICMBHKUSL-UHFFFAOYSA-N tert-butyl 2,5-bis(hydroxymethyl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1C(CO)CCC1CO VBQFMICMBHKUSL-UHFFFAOYSA-N 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- YODZTKMDCQEPHD-UHFFFAOYSA-N thiodiglycol Chemical compound OCCSCCO YODZTKMDCQEPHD-UHFFFAOYSA-N 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- ZEMGGZBWXRYJHK-UHFFFAOYSA-N thiouracil Chemical compound O=C1C=CNC(=S)N1 ZEMGGZBWXRYJHK-UHFFFAOYSA-N 0.000 description 1
- 229950000329 thiouracil Drugs 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
- 229910003158 γ-Al2O3 Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/08—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon radicals, substituted by hetero atoms, attached to ring carbon atoms
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pyrrole Compounds (AREA)
Abstract
Description
技术领域
本发明涉及有机合成领域,具体涉及一种2,5-吡咯烷二甲醇及其衍生物的合成方法。
背景技术
2,5-吡咯烷二甲醇及其衍生物是一种常见的药物分子片段,可以在多种药物的合成及衍生化中得到应用。如根据文献报道,2,5-吡咯烷二甲醇可以在对利福霉素进行修饰得到一种对溶血链球菌(Streptococus faecalis)以及金黄色微球菌(Micrococcusaureus)均有良好杀灭效果的药物(化合物I);美国惠氏公司开发出一种含有2,5-吡咯烷二甲醇片段的高活性、选择性的ATP竞争性的mTOR抑制剂(化合物II),该抑制剂可以被用于治疗包括乳腺癌在内的多种癌症。
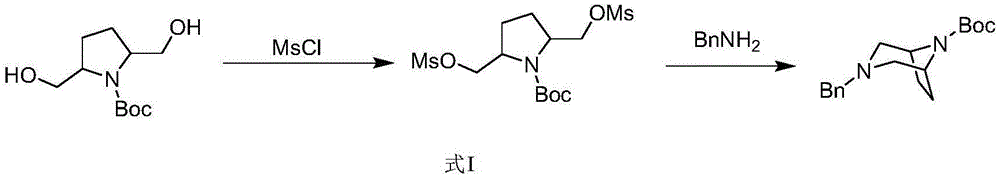
此外,2,5-吡咯烷二甲醇也是一种合成桥环化合物的重要中间体,通常可以通过式I所示的方法来合成一系列的二氮杂桥环化合物:
在现有技术中,2,5-吡咯烷二甲醇一般通过式II或式III所示的方法合成:
式II所示的方法一方面会由于起始原料难以获得而增加生产成本,另一方面,通过分步法还原,不仅会使得工艺化路线的变长增加生产时间,并且还会产生更多的含有还原试剂的废水,而含有还原试剂的废水往往需要特殊手段进行处理后再排放,这会进一步增加生产成本。
式III所示的方法也需要分步还原,这是由于吡咯N原子孤对电子参与形成大π键,碱性微弱,稳定性较差,使用还原性稍弱的催化剂无法对吡咯环实现催化加氢,使用还原性较强的催化剂,则可能会使得羟基被直接还原成甲基甚至吡咯环开环,从而产生大量的副产物。
发明内容
本发明是为了解决上述问题而进行的,目的在于提供一种高效地产生较少副产物的一种2,5-吡咯烷二甲醇及其衍生物的合成方法。
除非另外指明,否则如本文所使用,以下定义应适用。
在本文中所使用的术语“接触”应做广义理解,其可以是任何能够使得至少两种反应物发生化学反应的方式,例如可以是将两种反应物在适当的条件下进行混合。根据需要,可以在搅拌下,将需要进行接触的反应物进行混合,由此,搅拌的类型并不受特别限制,例如可以为机械搅拌,即在机械力的作用下进行搅拌。
在本文中所涉及的硫化Pt/C为一种部分硫中毒的Pt/C催化剂,其优选的制备方法如下:将活性炭将入到硝酸溶液中,搅拌一定时间,再加入含有Pt离子的溶液(如PtCl2溶液),继续搅拌一定时间,加入硫化试剂(如甲基硫醚、乙基硫醚、甲基硫醇、乙基硫醇、羟乙基硫醇、硫代双乙醇、巯基丙酸、噻吩及其衍生物或硫脲嘧啶及其衍生物),继续搅拌一定时间,再加入甲醛溶液,搅拌一定时间后调节pH值至8-10,过滤,取固体即得。
在本文中所涉及的硫化Pd/C为一种部分硫中毒的Pd/C催化剂,其优选的制备方法与硫化Pt/C相类似,区别仅在于使用含有Pd离子的溶液替代含有Pt离子的溶液。
在本文中所涉及的硫化Ru/C为一种部分硫中毒的Ru/C催化剂,其优选的制备方法与硫化Pt/C相类似,区别仅在于使用含有Ru离子的溶液替代含有Pt离子的溶液。
在本文中所涉及的硫化Rh/C为一种部分硫中毒的Rh/C催化剂,其优选的制备方法与硫化Pt/C相类似,区别仅在于使用含有Rh离子的溶液替代含有Pt离子的溶液。
本发明提供了一种2,5-吡咯烷二甲醇的合成方法,具有这样的特征,反应方程式为:
式中,PG1选自H、苄基、苄氧羰基、三苯基甲基或对甲氧基苄基中的任意一种,Cat.为加氢催化剂,
反应步骤如下:
步骤1,使化合物1、加氢催化剂以及H2相互接触,即得化合物2。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,加氢催化剂为Pt/C、Pd/C、Raney Ni、Rh/C、Ru/C、硫化Pt/C、硫化Pd/C、硫化Rh/C、硫化Ru/C、负载型MoS2或负载型Ni-Mo-S中的任意一种或多种。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,步骤1在反应媒介中进行,反应媒介为一种或多种饱和醇,优选为C1-C10的饱和醇,更优选地为甲醇、乙醇、正丙醇、异丙醇、正丁醇、叔丁醇、正戊醇、正己醇、正庚醇、正辛醇、正壬醇或正癸醇中的任意一种或多种。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,在步骤1中,还添加有添加剂,添加剂为硫化钠水溶液、硫化钾水溶液、碳酸钠水溶液、碳酸钾水溶液、碳酸氢钠水溶液、碳酸氢钾水溶液、三乙胺、DMSO、氢氧化钠水溶液、氢氧化钾水溶液、甲酸水溶液、乙酸水溶液、甲酸或乙酸中的任意一种。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,在步骤1中,添加剂的添加量为反应媒介体积的0.5%-5%。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,步骤1的反应温度为50℃-200℃。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,步骤1中H2的起始分压为0.1Mpa-1Mpa。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,在步骤1中,加氢催化剂为Pt/C、Pd/C、Rh/C、Ru/C中的任意一种,反应温度为50℃-120℃,H2的起始分压为0.1Mpa-0.5Mpa,添加剂为硫化钠水溶液、硫化钾水溶液、DMSO、甲酸水溶液、乙酸水溶液、甲酸或乙酸中的任意一种。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,在步骤1中,加氢催化剂为硫化Pt/C、硫化Pd/C、硫化Rh/C、硫化Ru/C、负载型MoS2或负载型Ni-Mo-S中的任意一种,反应温度为50℃-150℃,H2的起始分压为0.1Mpa-0.6Mpa,添加剂为甲酸水溶液、乙酸水溶液、甲酸或乙酸中的任意一种。
在本发明提供的2,5-吡咯烷二甲醇的合成方法中,还可以具有这样的特征:其中,在步骤1中,加氢催化剂为Raney Ni,反应温度为50℃-180℃,H2的起始分压为0.1Mpa-0.9Mpa,添加剂为碳酸钠水溶液、碳酸钾水溶液、碳酸氢钠水溶液、碳酸氢钾水溶液、三乙胺、氢氧化钠水溶液、氢氧化钾水溶液中的任意一种。
本发明还提供了一种2,5-吡咯烷二甲醇衍生物的合成方法中,可以具有这样的特征,反应方程式为:
式中,PG2选自叔丁氧羰基、甲氧羰基或乙氧羰基中的任意一种,Cat.为加氢催化剂,
反应步骤如下:
步骤a,使化合物3、加氢催化剂以及H2相互接触,即得化合物4。
在本发明提供的2,5-吡咯烷二甲醇衍生物的合成方法中,还可以具有这样的特征:其中,加氢催化剂为Pt/C、Pd/C、Raney Ni、Rh/C、Ru/C、硫化Pt/C、硫化Pd/C、硫化Rh/C、硫化Ru/C、负载型MoS2或负载型Ni-Mo-S中的任意一种或多种。
在本发明提供的2,5-吡咯烷二甲醇衍生物的合成方法中,还可以具有这样的特征:其中,步骤a在反应媒介中进行,反应媒介为一种或多种饱和醇,优选为C1-C10的饱和醇,更优选地为甲醇、乙醇、正丙醇、异丙醇、正丁醇、叔丁醇、正戊醇、正己醇、正庚醇、正辛醇、正壬醇或正癸醇中的任意一种或多种。
在本发明提供的2,5-吡咯烷二甲醇衍生物的合成方法中,还可以具有这样的特征:其中,在步骤a中,还添加有添加剂,添加剂为硫化钠水溶液、硫化钾水溶液、碳酸钠水溶液、碳酸钾水溶液、碳酸氢钠水溶液、碳酸氢钾水溶液、三乙胺、DMSO、氢氧化钠水溶液、氢氧化钾水溶液、甲酸水溶液、乙酸水溶液、甲酸或乙酸中的任意一种。
在本发明提供的2,5-吡咯烷二甲醇衍生物的合成方法中,还可以具有这样的特征:其中,步骤a的反应温度为50℃-200℃。
在本发明提供的2,5-吡咯烷二甲醇衍生物的合成方法中,还可以具有这样的特征:其中,步骤1中H2的起始分压为0.1Mpa-1Mpa。
在本发明提供的2,5-吡咯烷二甲醇衍生物的合成方法中,还可以具有这样的特征:其中,在步骤a中,加氢催化剂为Pt/C、Pd/C、Rh/C、Ru/C中的任意一种,反应温度为50℃-120℃,H2的起始分压为0.1Mpa-0.5Mpa,添加剂为硫化钠水溶液、硫化钾水溶液、DMSO、甲酸水溶液、乙酸水溶液、甲酸或乙酸中的任意一种。
在本发明提供的2,5-吡咯烷二甲醇衍生物的合成方法中,还可以具有这样的特征:其中,在步骤a中,加氢催化剂为硫化Pt/C、硫化Pd/C、硫化Rh/C、硫化Ru/C、负载型MoS2或负载型Ni-Mo-S中的任意一种,反应温度为50℃-150℃,H2的起始分压为0.1Mpa-0.6Mpa,添加剂为甲酸水溶液、乙酸水溶液、甲酸或乙酸中的任意一种。
在本发明提供的2,5-吡咯烷二甲醇衍生物的合成方法中,还可以具有这样的特征:其中,在步骤a中,加氢催化剂为Raney Ni,反应温度为50℃-180℃,H2的起始分压为0.1Mpa-0.9Mpa,添加剂为碳酸钠水溶液、碳酸钾水溶液、碳酸氢钠水溶液、碳酸氢钾水溶液、三乙胺、氢氧化钠水溶液、氢氧化钾水溶液中的任意一种。
发明的作用与效果
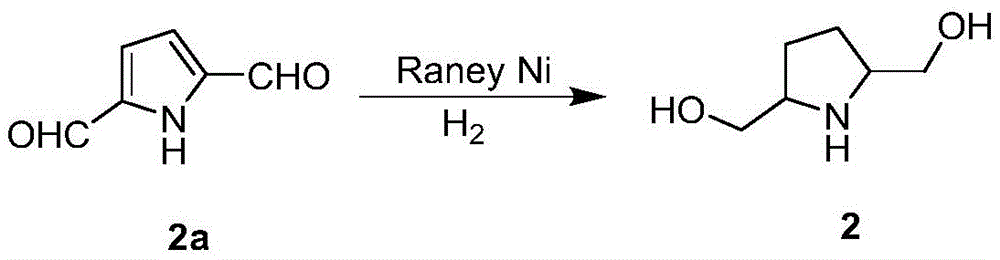
根据本发明所涉及的2,5-吡咯烷二甲醇的合成方法,因为选用了2,5-二甲醛吡咯为反应起始原料,选用了特定的加氢催化剂,所以,本发明可以一步还原高收率地得到2,5-吡咯烷二甲醇,有效降低了生产成本。
根据本发明所涉及的2,5-吡咯烷二甲醇衍生物的合成方法,因为选用了N上有保护基的2,5-二甲醛吡咯衍生物为反应起始原料,选用了特定的加氢催化剂,所以,本发明可以一步还原高收率地得到2,5-吡咯烷二甲醇类衍生物,有效降低了生产成本。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,以下结合实施例对本发明作具体阐述。
在下述实施例中,所涉及的各原料除另有注明外均为市售产品。
在下述实施例中,硫化Pt/C的制备方法如下:
将15g活性炭加入到120mL的2mol/L的硝酸溶液中,在80℃下搅拌1h,加入20mL0.015g/mL的PtCl2水溶液,继续搅拌3h后降温至40℃,加入1mL羟基乙硫醇,搅拌10min后,加入15mL36%的甲醛溶液,搅拌30min,滴加1mol/L的NaOH水溶液至体系pH值在8-9之间,升温至80℃,加热搅拌2h,过滤,取固体,去离子水洗涤,80℃下干燥,即得。
在下述实施例中,负载型MoS2的制备方法如下:采用等体积浸渍法,将四硫代钼酸铵溶解在乙醇中,将γ-Al2O3加入到溶液中,室温下浸渍12h,在300℃的氮气气氛下焙烧4h即得。
在下述实施例中,Pt/C催化剂的含Pt量为5%,市售。
在下述实施例中,Pd/C催化剂的含Pd量为5%,市售。
在下述实施例中,化合物1a和3a分别是通过化合物2a与苄氯以及Boc
酸酐反应制备得到,具体的反应方法与后处理方法均为本领域常用的技术手段。
在下述实施例中,饱和碳酸钠水溶液为在25℃下配置的饱和碳酸钠水溶液。
<实施例1>
一种2,5-吡咯烷二甲醇的合成方法
本实施例提供了一种2,5-吡咯烷二甲醇的合成方法,反应方程式如下:
具体反应步骤如下:
将10g化合物1a溶解在400mL乙醇中,加入到高压反应釜中,再依次加入3g RaneyNi和10mL饱和碳酸钠水溶液,置换气,将高压反应釜内抽成真空后,充入H2至高压反应釜内H2的分压为0.3Mpa,110℃下搅拌反应5h,使用硅藻土过滤,取滤液,水洗,减压浓缩,快速柱层析,即得5.93g化合物2,分离收率96.4%。
<实施例2>
一种2,5-吡咯烷二甲醇的合成方法
本实施例提供了一种2,5-吡咯烷二甲醇的合成方法,反应方程式如下:
具体反应步骤如下:
将10g化合物2a溶解在400mL乙醇中,加入到高压反应釜中,再依次加入3g RaneyNi和10mL饱和碳酸钠水溶液,置换气,将高压反应釜内抽成真空后,充入H2至高压反应釜内H2的分压为0.3MPa,110℃下搅拌反应5h,使用硅藻土过滤,取滤液,水洗,减压浓缩,快速柱层析,即得10.1g化合物2,分离收率94.8%。
<实施例3>
反应条件筛选
在本实施例中,以实施例1为参照,对反应条件进行了筛选,表中各技术方案中除注明外的反应条件外,其余反应原料及反应条件均与实施例1相同,添加物的添加量均为3mL,筛选的结果如表1所示。
表1 2,5-吡咯烷二甲醇反应条件筛选表
由上表可知,当使用Pt/C为催化剂且没有添加任何添加剂时,收率较低,尤其是在高温高压下,收率更低,这是由于在高温高压下吡咯被过度还原开环,形成一系列链状化合物;在降低温度和压强后,收率有了一定的提升,但是反应体系内也出现了一定量的原料中的醛基与目标产物形成席夫碱然后在被还原成叔胺的副产物。
当选用Pt/C为催化剂且同时以甲酸为添加物时,收率反而下降了,这可能是因为甲酸使得目标产物的胺基质子化形成季胺离子化合物,这会使得C-N键断裂并且进一步发生Hoffman消除从而使得整个吡咯烷分解,具体的原因还需要进一步实验的论证。
当选用Pt/C为催化剂且同时以硫化钠或者DMSO为添加物时,收率较不使用添加剂时稍有提升,这可能是因为硫化钠或DMSO均能使Pt/C催化剂部分中毒,从而降低其反应活性,因此也使得还原产物更多地停留在吡咯烷这一步而没有进一步开环。
当选用Raney Ni为催化剂且同时以氢氧化钠或碳酸钠为添加物时,目标产物会有较好的收率,这可能是适当的碱性环境可以适当增强Raney Ni的还原性,并且碱性体系可以避免目标产物形成季铵离子化合物,也在一定程度上避免生成开环产物,从而提升了反应的收率。
<实施例4>
一种N-Boc-2,5-吡咯烷二甲醇的合成方法
本实施例提供了一种N-Boc-2,5-吡咯烷二甲醇的合成方法,反应方程式如下:
具体反应步骤如下:
将10g化合物3a溶解在400mL乙醇中,加入到高压反应釜中,再依次加入3g RaneyNi和10mL饱和碳酸钠水溶液,置换气,将高压反应釜内抽成真空后,充入H2至高压反应釜内H2的分压为0.2Mpa,100℃下搅拌反应5h,使用硅藻土过滤,取滤液,水洗,减压浓缩,快速柱层析,即得10.1g化合物2,分离收率97.5%。
<实施例5>
反应条件筛选
在本实施例中,以实施例4为参照,对反应条件进行了筛选,表中各技术方案中除注明外的反应条件外,其余反应原料及反应条件均与实施例1相同,添加物的添加量均为3mL,筛选的结果如表2所示。
表2N-Boc-2,5-吡咯烷二甲醇反应条件筛选表
由表2可知,与2,5-吡咯烷二甲醇的催化加氢反应相类似,在以Raney Ni为催化剂,饱和碳酸钠水溶液为添加剂的情况下收率最佳,并且与实施例4中的试验相比,适当地降低反应压强和降低反应温度是有利于N上带有保护基的吡咯化合物的加氢还原的。
实施例的作用与效果
根据本发明所涉及的2,5-吡咯烷二甲醇的合成方法,因为选用了2,5-二甲醛吡咯为反应起始原料,选用了Ranry Ni加氢催化剂,饱和碳酸钠水溶液为添加剂,所以,本发明可以一步还原高收率地得到2,5-吡咯烷二甲醇,有效降低了生产成本。
根据本发明所涉及的2,5-吡咯烷二甲醇衍生物的合成方法,因为选用了N上有保护基的2,5-二甲醛吡咯衍生物为反应起始原料,选用了Ranry Ni加氢催化剂,饱和碳酸钠水溶液为添加剂,所以,本发明可以一步还原高收率地得到2,5-吡咯烷二甲醇类衍生物,有效降低了生产成本。
上述实施方式为本发明的优选案例,并不用来限制本发明的保护范围。
Claims (10)
2.根据权利要求1所述的2,5-吡咯烷二甲醇的合成方法,其特征在于:
其中,所述加氢催化剂为Pt/C、Pd/C、Raney Ni、Rh/C、Ru/C、硫化Pt/C、硫化Pd/C、硫化Rh/C、硫化Ru/C、负载型MoS2或负载型Ni-Mo-S中的任意一种或多种。
3.根据权利要求1所述的2,5-吡咯烷二甲醇的合成方法,其特征在于:
其中,步骤1在反应媒介中进行,所述反应媒介为一种或多种饱和醇。
4.根据权利要求1所述的2,5-吡咯烷二甲醇的合成方法,其特征在于:
其中,在步骤1中,还添加有添加剂,所述添加剂为硫化钠水溶液、硫化钾水溶液、碳酸钠水溶液、碳酸钾水溶液、碳酸氢钠水溶液、碳酸氢钾水溶液、三乙胺、DMSO、氢氧化钠水溶液、氢氧化钾水溶液、甲酸水溶液、乙酸水溶液、甲酸或乙酸中的任意一种。
5.根据权利要求1所述的2,5-吡咯烷二甲醇的合成方法,其特征在于:
其中,步骤1的反应温度为50℃-200℃。
6.根据权利要求1所述的2,5-吡咯烷二甲醇的合成方法,其特征在于,
其中,步骤1中H2的起始分压为0.1Mpa-1Mpa。
8.根据权利要求7所述的2,5-吡咯烷二甲醇衍生物的合成方法,其特征在于,
其中,所述加氢催化剂为Pt/C、Pd/C、Raney Ni、Rh/C、Ru/C、硫化Pt/C、硫化Pd/C、硫化Rh/C、硫化Ru/C、负载型MoS2或负载型Ni-Mo-S中的任意一种或多种。
9.根据权利要求7所述的2,5-吡咯烷二甲醇衍生物的合成方法,其特征在于,
其中,步骤a在反应媒介中进行,所述反应媒介为一种或多种饱和醇。
10.根据权利要求7所述的2,5-吡咯烷二甲醇衍生物的合成方法,其特征在于,
其中,在步骤a中,还添加有添加剂,所述添加剂为硫化钠水溶液、硫化钾水溶液、碳酸钠水溶液、碳酸钾水溶液、碳酸氢钠水溶液、碳酸氢钾水溶液、三乙胺、DMSO、氢氧化钠水溶液、氢氧化钾水溶液、甲酸水溶液、乙酸水溶液、甲酸或乙酸中的任意一种。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110856335.3A CN113563243B (zh) | 2021-07-28 | 2021-07-28 | 一种2,5-吡咯烷二甲醇及其衍生物的合成方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110856335.3A CN113563243B (zh) | 2021-07-28 | 2021-07-28 | 一种2,5-吡咯烷二甲醇及其衍生物的合成方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN113563243A true CN113563243A (zh) | 2021-10-29 |
| CN113563243B CN113563243B (zh) | 2023-05-02 |
Family
ID=78168357
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110856335.3A Active CN113563243B (zh) | 2021-07-28 | 2021-07-28 | 一种2,5-吡咯烷二甲醇及其衍生物的合成方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN113563243B (zh) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105061282A (zh) * | 2015-07-28 | 2015-11-18 | 黑龙江省科学院石油化学研究院 | 氢解合成α,α-二苯基-2-吡咯烷甲醇的方法 |
-
2021
- 2021-07-28 CN CN202110856335.3A patent/CN113563243B/zh active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105061282A (zh) * | 2015-07-28 | 2015-11-18 | 黑龙江省科学院石油化学研究院 | 氢解合成α,α-二苯基-2-吡咯烷甲醇的方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN113563243B (zh) | 2023-05-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2649040B1 (de) | Verfahren zur homogen-katalysierten, hochselektiven direkten aminierung von primären alkoholen mit ammoniak zu primären aminen bei hohem volumenverhältnis von flüssig- zu gasphase und/oder hohen drücken | |
| CN109467535B (zh) | 一种芬苯达唑的制备方法 | |
| CN105503613A (zh) | 一种多羟基化合物直接氨化制备多元胺的方法 | |
| CN115093386A (zh) | 一种无色无味无硼酸盐的玻色因的生产方法 | |
| TW201024322A (en) | Preparation method for nitrogen containing heterocyclic hexapeptide with high conversion rate | |
| CN114308027B (zh) | 一种负载型碳包裹双金属催化剂及其应用 | |
| CN107698697B (zh) | 一种爪型1,4-三氮唑多连环糊精分子及其制备方法与应用 | |
| CN120943886B (zh) | 一种三肽Fmoc-Pro-Pro-Pro-OH的合成方法 | |
| CN113563243A (zh) | 一种2,5-吡咯烷二甲醇及其衍生物的合成方法 | |
| CN114044756B (zh) | 一种乙酰甲喹的制备方法 | |
| CN101735073A (zh) | 催化加氢制备氯代苯胺的方法 | |
| EP2524909A2 (en) | Preparation method of 4-aminomethylbenzoic acid | |
| KR20010057570A (ko) | 수소화 촉매의 개질방법 | |
| CN117299207B (zh) | 负载型催化剂及其制备方法、GalNAc中间体及其制备方法和应用 | |
| CN103111323A (zh) | 手性n,n-二烷基-1,2-环己二胺催化剂及其制备方法和应用 | |
| CS203958B2 (en) | Method of producing asymetric n-phenyl-n'-substituted p-phenylene diamines | |
| EP2134470B1 (en) | Supported palladium catalyst and process for producing it | |
| CN101920196B (zh) | 一种合成纽甜用氢化催化剂及其制备方法 | |
| CN104892427A (zh) | 一种对氨基苯乙胺的制备方法 | |
| CZ281735B6 (cs) | Palladiový katalyzátor a jeho použití při přípra vě směsi popřípadě substituovaného cyklohexylami nu a popřípadě substituovaného dicyklohexylaminu | |
| WO2005085180A1 (ja) | アミドカルボニル化反応方法 | |
| Effenberger et al. | Amino acids; 13: Investigations on the synthesis of dl-serine from α-haloacrylic acid derivatives | |
| CN105418438A (zh) | 一种制备对苯二胺的方法 | |
| CN108409651B (zh) | 利用氯喹那多废渣制备8-羟基-2-甲基喹啉的方法 | |
| WO2010060390A1 (en) | A method of preparation of desvenlafaxine and its salts |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |