CN111281890A - 移植来自实体组织的细胞的方法 - Google Patents
移植来自实体组织的细胞的方法 Download PDFInfo
- Publication number
- CN111281890A CN111281890A CN202010091523.7A CN202010091523A CN111281890A CN 111281890 A CN111281890 A CN 111281890A CN 202010091523 A CN202010091523 A CN 202010091523A CN 111281890 A CN111281890 A CN 111281890A
- Authority
- CN
- China
- Prior art keywords
- cells
- liver
- cell
- hepatocytes
- hydrogel
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000000034 method Methods 0.000 title abstract description 57
- 239000007787 solid Substances 0.000 title description 11
- 210000004027 cell Anatomy 0.000 claims abstract description 235
- 210000001519 tissue Anatomy 0.000 claims abstract description 72
- 239000012620 biological material Substances 0.000 claims abstract description 34
- 238000002054 transplantation Methods 0.000 claims abstract description 27
- 230000011664 signaling Effects 0.000 claims abstract description 20
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 claims abstract description 13
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 claims abstract description 13
- 235000015097 nutrients Nutrition 0.000 claims abstract description 6
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 claims description 94
- 229920002674 hyaluronan Polymers 0.000 claims description 86
- 229960003160 hyaluronic acid Drugs 0.000 claims description 86
- 210000004185 liver Anatomy 0.000 claims description 79
- 239000000203 mixture Substances 0.000 claims description 71
- 239000000017 hydrogel Substances 0.000 claims description 70
- 210000003494 hepatocyte Anatomy 0.000 claims description 45
- 210000001835 viscera Anatomy 0.000 claims description 45
- 210000000130 stem cell Anatomy 0.000 claims description 41
- 239000002609 medium Substances 0.000 claims description 30
- 238000009472 formulation Methods 0.000 claims description 29
- 210000003897 hepatic stem cell Anatomy 0.000 claims description 28
- 239000000243 solution Substances 0.000 claims description 27
- 239000002243 precursor Substances 0.000 claims description 24
- 210000003999 epithelial cell of bile duct Anatomy 0.000 claims description 22
- 239000003102 growth factor Substances 0.000 claims description 22
- 238000001727 in vivo Methods 0.000 claims description 20
- 238000002156 mixing Methods 0.000 claims description 16
- 210000003566 hemangioblast Anatomy 0.000 claims description 15
- 239000003431 cross linking reagent Substances 0.000 claims description 13
- 239000006285 cell suspension Substances 0.000 claims description 12
- 210000002889 endothelial cell Anatomy 0.000 claims description 12
- 210000004500 stellate cell Anatomy 0.000 claims description 12
- 102000004338 Transferrin Human genes 0.000 claims description 11
- 108090000901 Transferrin Proteins 0.000 claims description 11
- 239000012581 transferrin Substances 0.000 claims description 11
- 102000004127 Cytokines Human genes 0.000 claims description 10
- 108090000695 Cytokines Proteins 0.000 claims description 10
- 238000002347 injection Methods 0.000 claims description 10
- 239000007924 injection Substances 0.000 claims description 10
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 claims description 10
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 claims description 9
- 229920001223 polyethylene glycol Polymers 0.000 claims description 8
- 108090000581 Leukemia inhibitory factor Proteins 0.000 claims description 6
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 claims description 6
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 claims description 6
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 claims description 6
- 210000005229 liver cell Anatomy 0.000 claims description 6
- 210000004738 parenchymal cell Anatomy 0.000 claims description 6
- 210000002536 stromal cell Anatomy 0.000 claims description 6
- 239000004971 Cross linker Substances 0.000 claims description 5
- 102000018233 Fibroblast Growth Factor Human genes 0.000 claims description 5
- 108050007372 Fibroblast Growth Factor Proteins 0.000 claims description 5
- 102000004877 Insulin Human genes 0.000 claims description 5
- 108090001061 Insulin Proteins 0.000 claims description 5
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 claims description 5
- 102000048143 Insulin-Like Growth Factor II Human genes 0.000 claims description 5
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 claims description 5
- 210000000648 angioblast Anatomy 0.000 claims description 5
- 229940126864 fibroblast growth factor Drugs 0.000 claims description 5
- 239000000122 growth hormone Substances 0.000 claims description 5
- 238000000338 in vitro Methods 0.000 claims description 5
- 229940125396 insulin Drugs 0.000 claims description 5
- 238000002360 preparation method Methods 0.000 claims description 5
- 206010028980 Neoplasm Diseases 0.000 claims description 4
- 241000700605 Viruses Species 0.000 claims description 4
- 201000011510 cancer Diseases 0.000 claims description 4
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 claims description 4
- 210000002747 omentum Anatomy 0.000 claims description 4
- 239000000725 suspension Substances 0.000 claims description 4
- 210000004881 tumor cell Anatomy 0.000 claims description 4
- 102000018997 Growth Hormone Human genes 0.000 claims description 3
- 108010051696 Growth Hormone Proteins 0.000 claims description 3
- 102000015696 Interleukins Human genes 0.000 claims description 3
- 108010063738 Interleukins Proteins 0.000 claims description 3
- 102000004140 Oncostatin M Human genes 0.000 claims description 3
- 108090000630 Oncostatin M Proteins 0.000 claims description 3
- 239000003098 androgen Substances 0.000 claims description 3
- 239000011575 calcium Substances 0.000 claims description 3
- 229910052791 calcium Inorganic materials 0.000 claims description 3
- 229940011871 estrogen Drugs 0.000 claims description 3
- 239000000262 estrogen Substances 0.000 claims description 3
- 210000003754 fetus Anatomy 0.000 claims description 3
- 239000003862 glucocorticoid Substances 0.000 claims description 3
- 238000011065 in-situ storage Methods 0.000 claims description 3
- 229940036555 thyroid hormone Drugs 0.000 claims description 3
- 239000005495 thyroid hormone Substances 0.000 claims description 3
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 claims description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims description 2
- 102000003815 Interleukin-11 Human genes 0.000 claims description 2
- 108090000177 Interleukin-11 Proteins 0.000 claims description 2
- 108090001005 Interleukin-6 Proteins 0.000 claims description 2
- 229920001872 Spider silk Polymers 0.000 claims description 2
- 239000012679 serum free medium Substances 0.000 claims description 2
- 102100021866 Hepatocyte growth factor Human genes 0.000 claims 2
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical compound IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 claims 2
- 241000894006 Bacteria Species 0.000 claims 1
- 102400001368 Epidermal growth factor Human genes 0.000 claims 1
- 101800003838 Epidermal growth factor Proteins 0.000 claims 1
- 102400000321 Glucagon Human genes 0.000 claims 1
- 108060003199 Glucagon Proteins 0.000 claims 1
- 241000238631 Hexapoda Species 0.000 claims 1
- 101000898034 Homo sapiens Hepatocyte growth factor Proteins 0.000 claims 1
- 102100037852 Insulin-like growth factor I Human genes 0.000 claims 1
- 102000003816 Interleukin-13 Human genes 0.000 claims 1
- 108090000176 Interleukin-13 Proteins 0.000 claims 1
- 102100026019 Interleukin-6 Human genes 0.000 claims 1
- 102100032352 Leukemia inhibitory factor Human genes 0.000 claims 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 claims 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 claims 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 claims 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 claims 1
- 229940116977 epidermal growth factor Drugs 0.000 claims 1
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 claims 1
- 229960004666 glucagon Drugs 0.000 claims 1
- 229940074383 interleukin-11 Drugs 0.000 claims 1
- 229940100601 interleukin-6 Drugs 0.000 claims 1
- 150000002632 lipids Chemical class 0.000 claims 1
- 201000004792 malaria Diseases 0.000 claims 1
- 244000052769 pathogen Species 0.000 claims 1
- 230000001717 pathogenic effect Effects 0.000 claims 1
- 239000011669 selenium Substances 0.000 claims 1
- 229910052711 selenium Inorganic materials 0.000 claims 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 claims 1
- 229940035722 triiodothyronine Drugs 0.000 claims 1
- 239000011701 zinc Substances 0.000 claims 1
- 229910052725 zinc Inorganic materials 0.000 claims 1
- 210000000056 organ Anatomy 0.000 abstract description 28
- 201000010099 disease Diseases 0.000 abstract description 14
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 14
- 210000002744 extracellular matrix Anatomy 0.000 abstract description 12
- 230000003278 mimic effect Effects 0.000 abstract description 4
- 230000014509 gene expression Effects 0.000 description 50
- 239000011159 matrix material Substances 0.000 description 30
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 20
- 239000000463 material Substances 0.000 description 19
- 108090000623 proteins and genes Proteins 0.000 description 17
- 108010035532 Collagen Proteins 0.000 description 16
- 102000008186 Collagen Human genes 0.000 description 16
- 229920001436 collagen Polymers 0.000 description 16
- 102000000905 Cadherin Human genes 0.000 description 15
- 108050007957 Cadherin Proteins 0.000 description 15
- 108010085895 Laminin Proteins 0.000 description 15
- 102000007547 Laminin Human genes 0.000 description 15
- 241000699670 Mus sp. Species 0.000 description 15
- 238000004132 cross linking Methods 0.000 description 15
- 230000002440 hepatic effect Effects 0.000 description 15
- 102000009027 Albumins Human genes 0.000 description 13
- -1 MDR1 Proteins 0.000 description 13
- 230000004069 differentiation Effects 0.000 description 13
- 230000009278 visceral effect Effects 0.000 description 13
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 12
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 12
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 12
- 229920002683 Glycosaminoglycan Polymers 0.000 description 12
- 108010069196 Neural Cell Adhesion Molecules Proteins 0.000 description 12
- 102000001068 Neural Cell Adhesion Molecules Human genes 0.000 description 12
- 102000013529 alpha-Fetoproteins Human genes 0.000 description 11
- 108010026331 alpha-Fetoproteins Proteins 0.000 description 11
- 238000005138 cryopreservation Methods 0.000 description 11
- 108020004999 messenger RNA Proteins 0.000 description 11
- 102100032912 CD44 antigen Human genes 0.000 description 10
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 10
- 239000004202 carbamide Substances 0.000 description 10
- 108010088751 Albumins Proteins 0.000 description 9
- 108010067787 Proteoglycans Proteins 0.000 description 9
- 102000016611 Proteoglycans Human genes 0.000 description 9
- 230000001413 cellular effect Effects 0.000 description 9
- 238000005259 measurement Methods 0.000 description 9
- 102000004169 proteins and genes Human genes 0.000 description 9
- 239000000523 sample Substances 0.000 description 9
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 210000000496 pancreas Anatomy 0.000 description 8
- 230000028327 secretion Effects 0.000 description 8
- 108010059480 Chondroitin Sulfate Proteoglycans Proteins 0.000 description 7
- 102000005598 Chondroitin Sulfate Proteoglycans Human genes 0.000 description 7
- 108091006905 Human Serum Albumin Proteins 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 7
- 239000000499 gel Substances 0.000 description 7
- 229940088597 hormone Drugs 0.000 description 7
- 230000002503 metabolic effect Effects 0.000 description 7
- 235000018102 proteins Nutrition 0.000 description 7
- 230000004083 survival effect Effects 0.000 description 7
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 6
- 102100037362 Fibronectin Human genes 0.000 description 6
- 108010067306 Fibronectins Proteins 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 239000003153 chemical reaction reagent Substances 0.000 description 6
- 230000001605 fetal effect Effects 0.000 description 6
- 230000008014 freezing Effects 0.000 description 6
- 210000004024 hepatic stellate cell Anatomy 0.000 description 6
- 230000003076 paracrine Effects 0.000 description 6
- 210000000603 stem cell niche Anatomy 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 230000035899 viability Effects 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- 229920001661 Chitosan Polymers 0.000 description 5
- 229920002971 Heparan sulfate Polymers 0.000 description 5
- 101000848653 Homo sapiens Tripartite motif-containing protein 26 Proteins 0.000 description 5
- 102000008100 Human Serum Albumin Human genes 0.000 description 5
- 102000004058 Leukemia inhibitory factor Human genes 0.000 description 5
- 108060001084 Luciferase Proteins 0.000 description 5
- 239000005089 Luciferase Substances 0.000 description 5
- 229920000615 alginic acid Polymers 0.000 description 5
- 235000010443 alginic acid Nutrition 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 230000003247 decreasing effect Effects 0.000 description 5
- 125000004386 diacrylate group Chemical group 0.000 description 5
- 238000007710 freezing Methods 0.000 description 5
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 5
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 5
- 239000005556 hormone Substances 0.000 description 5
- 102000046101 human AFP Human genes 0.000 description 5
- 210000004072 lung Anatomy 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000002792 vascular Effects 0.000 description 5
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 4
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 4
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- 102000016289 Cell Adhesion Molecules Human genes 0.000 description 4
- 108010067225 Cell Adhesion Molecules Proteins 0.000 description 4
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 4
- 238000002965 ELISA Methods 0.000 description 4
- 102000012673 Follicle Stimulating Hormone Human genes 0.000 description 4
- 108010079345 Follicle Stimulating Hormone Proteins 0.000 description 4
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- 108010029485 Protein Isoforms Proteins 0.000 description 4
- 102000001708 Protein Isoforms Human genes 0.000 description 4
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 4
- 230000002776 aggregation Effects 0.000 description 4
- 229940072056 alginate Drugs 0.000 description 4
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 4
- 210000000013 bile duct Anatomy 0.000 description 4
- 229920000249 biocompatible polymer Polymers 0.000 description 4
- 210000000988 bone and bone Anatomy 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 210000002782 epithelial mesenchymal cell Anatomy 0.000 description 4
- 229940028334 follicle stimulating hormone Drugs 0.000 description 4
- 210000005161 hepatic lobe Anatomy 0.000 description 4
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 4
- 238000003384 imaging method Methods 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 108010008217 nidogen Proteins 0.000 description 4
- 229920001184 polypeptide Polymers 0.000 description 4
- 102000004196 processed proteins & peptides Human genes 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 4
- 238000010257 thawing Methods 0.000 description 4
- 230000007704 transition Effects 0.000 description 4
- 235000019155 vitamin A Nutrition 0.000 description 4
- 239000011719 vitamin A Substances 0.000 description 4
- 229940045997 vitamin a Drugs 0.000 description 4
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 3
- 108091006146 Channels Proteins 0.000 description 3
- 241000252203 Clupea harengus Species 0.000 description 3
- 102000001187 Collagen Type III Human genes 0.000 description 3
- 108010069502 Collagen Type III Proteins 0.000 description 3
- 102000016942 Elastin Human genes 0.000 description 3
- 108010014258 Elastin Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 102000003693 Hedgehog Proteins Human genes 0.000 description 3
- 108090000031 Hedgehog Proteins Proteins 0.000 description 3
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 3
- 102000012355 Integrin beta1 Human genes 0.000 description 3
- 108010022222 Integrin beta1 Proteins 0.000 description 3
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 3
- PLXBWHJQWKZRKG-UHFFFAOYSA-N Resazurin Chemical compound C1=CC(=O)C=C2OC3=CC(O)=CC=C3[N+]([O-])=C21 PLXBWHJQWKZRKG-UHFFFAOYSA-N 0.000 description 3
- 210000001015 abdomen Anatomy 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 210000003445 biliary tract Anatomy 0.000 description 3
- 229920002988 biodegradable polymer Polymers 0.000 description 3
- 210000000481 breast Anatomy 0.000 description 3
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 3
- 229960001736 buprenorphine Drugs 0.000 description 3
- 150000001720 carbohydrates Chemical class 0.000 description 3
- 230000010261 cell growth Effects 0.000 description 3
- 230000030570 cellular localization Effects 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 238000009792 diffusion process Methods 0.000 description 3
- 229920002549 elastin Polymers 0.000 description 3
- 230000007613 environmental effect Effects 0.000 description 3
- 210000002950 fibroblast Anatomy 0.000 description 3
- 210000001035 gastrointestinal tract Anatomy 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 229960002442 glucosamine Drugs 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 210000002216 heart Anatomy 0.000 description 3
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 3
- 229960002897 heparin Drugs 0.000 description 3
- 238000002513 implantation Methods 0.000 description 3
- 210000000936 intestine Anatomy 0.000 description 3
- 229960003299 ketamine Drugs 0.000 description 3
- 230000003908 liver function Effects 0.000 description 3
- 210000005228 liver tissue Anatomy 0.000 description 3
- 230000035800 maturation Effects 0.000 description 3
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 3
- 239000002207 metabolite Substances 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 238000012809 post-inoculation Methods 0.000 description 3
- 238000004321 preservation Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 210000002307 prostate Anatomy 0.000 description 3
- 238000011084 recovery Methods 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000000518 rheometry Methods 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 230000019635 sulfation Effects 0.000 description 3
- 238000005670 sulfation reaction Methods 0.000 description 3
- 239000013589 supplement Substances 0.000 description 3
- 230000009469 supplementation Effects 0.000 description 3
- 238000001356 surgical procedure Methods 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 210000001685 thyroid gland Anatomy 0.000 description 3
- 210000004291 uterus Anatomy 0.000 description 3
- BPICBUSOMSTKRF-UHFFFAOYSA-N xylazine Chemical compound CC1=CC=CC(C)=C1NC1=NCCCS1 BPICBUSOMSTKRF-UHFFFAOYSA-N 0.000 description 3
- 229960001600 xylazine Drugs 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 102000007350 Bone Morphogenetic Proteins Human genes 0.000 description 2
- 108010007726 Bone Morphogenetic Proteins Proteins 0.000 description 2
- 229920001287 Chondroitin sulfate Polymers 0.000 description 2
- 102000012422 Collagen Type I Human genes 0.000 description 2
- 108010022452 Collagen Type I Proteins 0.000 description 2
- 102000004266 Collagen Type IV Human genes 0.000 description 2
- 108010042086 Collagen Type IV Proteins 0.000 description 2
- 229920000045 Dermatan sulfate Polymers 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 108010080379 Fibrin Tissue Adhesive Proteins 0.000 description 2
- 102100028412 Fibroblast growth factor 10 Human genes 0.000 description 2
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 2
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 2
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 2
- 102000008055 Heparan Sulfate Proteoglycans Human genes 0.000 description 2
- 101000917237 Homo sapiens Fibroblast growth factor 10 Proteins 0.000 description 2
- 102000005755 Intercellular Signaling Peptides and Proteins Human genes 0.000 description 2
- 108010070716 Intercellular Signaling Peptides and Proteins Proteins 0.000 description 2
- 206010067125 Liver injury Diseases 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- ATHHXGZTWNVVOU-UHFFFAOYSA-N N-methylformamide Chemical compound CNC=O ATHHXGZTWNVVOU-UHFFFAOYSA-N 0.000 description 2
- 229930040373 Paraformaldehyde Natural products 0.000 description 2
- 108010047386 Pituitary Hormones Proteins 0.000 description 2
- 102000006877 Pituitary Hormones Human genes 0.000 description 2
- 108010071390 Serum Albumin Proteins 0.000 description 2
- 102000007562 Serum Albumin Human genes 0.000 description 2
- 108050001286 Somatostatin Receptor Proteins 0.000 description 2
- 108090000054 Syndecan-2 Proteins 0.000 description 2
- 208000035199 Tetraploidy Diseases 0.000 description 2
- 230000010062 adhesion mechanism Effects 0.000 description 2
- 108010090535 alpha-albumin Proteins 0.000 description 2
- 229940030486 androgens Drugs 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 210000001130 astrocyte Anatomy 0.000 description 2
- 239000007640 basal medium Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 229940112869 bone morphogenetic protein Drugs 0.000 description 2
- BQRGNLJZBFXNCZ-UHFFFAOYSA-N calcein am Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC(CN(CC(=O)OCOC(C)=O)CC(=O)OCOC(C)=O)=C(OC(C)=O)C=C1OC1=C2C=C(CN(CC(=O)OCOC(C)=O)CC(=O)OCOC(=O)C)C(OC(C)=O)=C1 BQRGNLJZBFXNCZ-UHFFFAOYSA-N 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 238000010382 chemical cross-linking Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 229940059329 chondroitin sulfate Drugs 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- 230000035614 depigmentation Effects 0.000 description 2
- 125000000600 disaccharide group Chemical group 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 238000005538 encapsulation Methods 0.000 description 2
- 210000003890 endocrine cell Anatomy 0.000 description 2
- 230000003511 endothelial effect Effects 0.000 description 2
- 230000008472 epithelial growth Effects 0.000 description 2
- 238000000855 fermentation Methods 0.000 description 2
- 230000004151 fermentation Effects 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 238000002376 fluorescence recovery after photobleaching Methods 0.000 description 2
- 238000001879 gelation Methods 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 238000011194 good manufacturing practice Methods 0.000 description 2
- 239000005090 green fluorescent protein Substances 0.000 description 2
- 229920000669 heparin Polymers 0.000 description 2
- 231100000753 hepatic injury Toxicity 0.000 description 2
- 235000019514 herring Nutrition 0.000 description 2
- 229960000890 hydrocortisone Drugs 0.000 description 2
- 239000000960 hypophysis hormone Substances 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 208000028867 ischemia Diseases 0.000 description 2
- 210000004153 islets of langerhan Anatomy 0.000 description 2
- 108010028309 kalinin Proteins 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 230000031142 liver development Effects 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 239000003068 molecular probe Substances 0.000 description 2
- 210000000651 myofibroblast Anatomy 0.000 description 2
- 229920002866 paraformaldehyde Polymers 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000001172 regenerating effect Effects 0.000 description 2
- 108700027603 secretin receptor Proteins 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- YWIVKILSMZOHHF-QJZPQSOGSA-N sodium;(2s,3s,4s,5r,6r)-6-[(2s,3r,4r,5s,6r)-3-acetamido-2-[(2s,3s,4r,5r,6r)-6-[(2r,3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2- Chemical class [Na+].CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 YWIVKILSMZOHHF-QJZPQSOGSA-N 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000003894 surgical glue Substances 0.000 description 2
- 229940037128 systemic glucocorticoids Drugs 0.000 description 2
- 238000001248 thermal gelation Methods 0.000 description 2
- 150000003573 thiols Chemical group 0.000 description 2
- 210000003954 umbilical cord Anatomy 0.000 description 2
- 208000037911 visceral disease Diseases 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- OEANUJAFZLQYOD-CXAZCLJRSA-N (2r,3s,4r,5r,6r)-6-[(2r,3r,4r,5r,6r)-5-acetamido-3-hydroxy-2-(hydroxymethyl)-6-methoxyoxan-4-yl]oxy-4,5-dihydroxy-3-methoxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](OC)O[C@H](CO)[C@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](OC)[C@H](C(O)=O)O1 OEANUJAFZLQYOD-CXAZCLJRSA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- VUIWJRYTWUGOOF-UHFFFAOYSA-N 2-ethenoxyethanol Chemical compound OCCOC=C VUIWJRYTWUGOOF-UHFFFAOYSA-N 0.000 description 1
- CQVWXNBVRLKXPE-UHFFFAOYSA-N 2-octyl cyanoacrylate Chemical compound CCCCCCC(C)OC(=O)C(=C)C#N CQVWXNBVRLKXPE-UHFFFAOYSA-N 0.000 description 1
- PSJBSUHYCGQTHZ-UHFFFAOYSA-N 3-Methoxy-1,2-propanediol Chemical compound COCC(O)CO PSJBSUHYCGQTHZ-UHFFFAOYSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- 101710085003 Alpha-tubulin N-acetyltransferase Proteins 0.000 description 1
- 101710085461 Alpha-tubulin N-acetyltransferase 1 Proteins 0.000 description 1
- 229940088872 Apoptosis inhibitor Drugs 0.000 description 1
- 102000004888 Aquaporin 1 Human genes 0.000 description 1
- 108090001004 Aquaporin 1 Proteins 0.000 description 1
- 102000012002 Aquaporin 4 Human genes 0.000 description 1
- 108010036280 Aquaporin 4 Proteins 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 229920002567 Chondroitin Polymers 0.000 description 1
- 101000764817 Chromohalobacter salexigens (strain ATCC BAA-138 / DSM 3043 / CIP 106854 / NCIMB 13768 / 1H11) Oxygen-dependent choline dehydrogenase 1 Proteins 0.000 description 1
- 102000002029 Claudin Human genes 0.000 description 1
- 108050009302 Claudin Proteins 0.000 description 1
- 102000010970 Connexin Human genes 0.000 description 1
- 108050001175 Connexin Proteins 0.000 description 1
- 108010069156 Connexin 26 Proteins 0.000 description 1
- 229920001651 Cyanoacrylate Polymers 0.000 description 1
- 108010079245 Cystic Fibrosis Transmembrane Conductance Regulator Proteins 0.000 description 1
- 102100023419 Cystic fibrosis transmembrane conductance regulator Human genes 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- 108090000371 Esterases Proteins 0.000 description 1
- 101150021185 FGF gene Proteins 0.000 description 1
- 108010073385 Fibrin Proteins 0.000 description 1
- 102000009123 Fibrin Human genes 0.000 description 1
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Chemical group O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 1
- 102100037260 Gap junction beta-1 protein Human genes 0.000 description 1
- 102100037156 Gap junction beta-2 protein Human genes 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 241000711549 Hepacivirus C Species 0.000 description 1
- 101000827785 Homo sapiens Alpha-fetoprotein Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 102000026633 IL6 Human genes 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 108010030506 Integrin alpha6beta4 Proteins 0.000 description 1
- 229920000288 Keratan sulfate Polymers 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- 206010048723 Multiple-drug resistance Diseases 0.000 description 1
- 108010088225 Nestin Proteins 0.000 description 1
- 102000008730 Nestin Human genes 0.000 description 1
- 241001631646 Papillomaviridae Species 0.000 description 1
- 208000010378 Pulmonary Embolism Diseases 0.000 description 1
- LCTONWCANYUPML-UHFFFAOYSA-M Pyruvate Chemical compound CC(=O)C([O-])=O LCTONWCANYUPML-UHFFFAOYSA-M 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- 102100028927 Secretin receptor Human genes 0.000 description 1
- 102000011096 Somatostatin receptor Human genes 0.000 description 1
- 241000187747 Streptomyces Species 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 1
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 102100021869 Tyrosine aminotransferase Human genes 0.000 description 1
- 101710175714 Tyrosine aminotransferase Proteins 0.000 description 1
- 108010042606 Tyrosine transaminase Proteins 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 108010031318 Vitronectin Proteins 0.000 description 1
- 102100035140 Vitronectin Human genes 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- PNNCWTXUWKENPE-UHFFFAOYSA-N [N].NC(N)=O Chemical compound [N].NC(N)=O PNNCWTXUWKENPE-UHFFFAOYSA-N 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 238000004026 adhesive bonding Methods 0.000 description 1
- 238000005054 agglomeration Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- IAJILQKETJEXLJ-QTBDOELSSA-N aldehydo-D-glucuronic acid Chemical group O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-QTBDOELSSA-N 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- OENHQHLEOONYIE-UKMVMLAPSA-N all-trans beta-carotene Natural products CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C OENHQHLEOONYIE-UKMVMLAPSA-N 0.000 description 1
- 238000011316 allogeneic transplantation Methods 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 239000000158 apoptosis inhibitor Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- TUPZEYHYWIEDIH-WAIFQNFQSA-N beta-carotene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2=CCCCC2(C)C TUPZEYHYWIEDIH-WAIFQNFQSA-N 0.000 description 1
- 235000013734 beta-carotene Nutrition 0.000 description 1
- 239000011648 beta-carotene Substances 0.000 description 1
- 229960002747 betacarotene Drugs 0.000 description 1
- 210000000941 bile Anatomy 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- WTLYWPNEAZECAM-UHFFFAOYSA-N but-1-ene-2,3-diol Chemical compound CC(O)C(O)=C WTLYWPNEAZECAM-UHFFFAOYSA-N 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000017455 cell-cell adhesion Effects 0.000 description 1
- 230000035289 cell-matrix adhesion Effects 0.000 description 1
- 210000003570 cell-matrix junction Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 229940045110 chitosan Drugs 0.000 description 1
- DLGJWSVWTWEWBJ-HGGSSLSASA-N chondroitin Chemical compound CC(O)=N[C@@H]1[C@H](O)O[C@H](CO)[C@H](O)[C@@H]1OC1[C@H](O)[C@H](O)C=C(C(O)=O)O1 DLGJWSVWTWEWBJ-HGGSSLSASA-N 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 229940096422 collagen type i Drugs 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000004624 confocal microscopy Methods 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 108010015416 connexin 32 Proteins 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 239000002577 cryoprotective agent Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000021953 cytokinesis Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 210000004292 cytoskeleton Anatomy 0.000 description 1
- 238000013016 damping Methods 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- AVJBPWGFOQAPRH-FWMKGIEWSA-L dermatan sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@H](OS([O-])(=O)=O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](C([O-])=O)O1 AVJBPWGFOQAPRH-FWMKGIEWSA-L 0.000 description 1
- 229940051593 dermatan sulfate Drugs 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000003073 embolic effect Effects 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 229950003499 fibrin Drugs 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 230000004110 gluconeogenesis Effects 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N glucosamine group Chemical group OC1[C@H](N)[C@@H](O)[C@H](O)[C@H](O1)CO MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 150000002337 glycosamines Chemical class 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 230000002706 hydrostatic effect Effects 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011503 in vivo imaging Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 210000002372 intrahepatic bile duct epithelial cell Anatomy 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000012977 invasive surgical procedure Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- KXCLCNHUUKTANI-RBIYJLQWSA-N keratan Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@H](COS(O)(=O)=O)O[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@H](O[C@@H](O[C@H]3[C@H]([C@@H](COS(O)(=O)=O)O[C@@H](O)[C@@H]3O)O)[C@H](NC(C)=O)[C@H]2O)COS(O)(=O)=O)O[C@H](COS(O)(=O)=O)[C@@H]1O KXCLCNHUUKTANI-RBIYJLQWSA-N 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000007762 localization of cell Effects 0.000 description 1
- 230000005923 long-lasting effect Effects 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000013028 medium composition Substances 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000003716 mesoderm Anatomy 0.000 description 1
- 230000007102 metabolic function Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- DNIAPMSPPWPWGF-UHFFFAOYSA-N monopropylene glycol Natural products CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 102000004233 multidrug resistance protein 3 Human genes 0.000 description 1
- 108090000743 multidrug resistance protein 3 Proteins 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- 210000005055 nestin Anatomy 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 210000004923 pancreatic tissue Anatomy 0.000 description 1
- 230000014306 paracrine signaling Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 210000003668 pericyte Anatomy 0.000 description 1
- 229930029653 phosphoenolpyruvate Natural products 0.000 description 1
- DTBNBXWJWCWCIK-UHFFFAOYSA-N phosphoenolpyruvic acid Chemical compound OC(=O)C(=C)OP(O)(O)=O DTBNBXWJWCWCIK-UHFFFAOYSA-N 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 238000012805 post-processing Methods 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000037390 scarring Effects 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000008054 signal transmission Effects 0.000 description 1
- 238000004088 simulation Methods 0.000 description 1
- 229910001415 sodium ion Inorganic materials 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000011476 stem cell transplantation Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 210000001179 synovial fluid Anatomy 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 210000001578 tight junction Anatomy 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 125000000647 trehalose group Chemical group 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- OENHQHLEOONYIE-JLTXGRSLSA-N β-Carotene Chemical compound CC=1CCCC(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C OENHQHLEOONYIE-JLTXGRSLSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/37—Digestive system
- A61K35/407—Liver; Hepatocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/734—Alginic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/37—Digestive system
- A61K35/39—Pancreas; Islets of Langerhans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/42—Respiratory system, e.g. lungs, bronchi or lung cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/38—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix containing added animal cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/52—Hydrogels or hydrocolloids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/067—Hepatocytes
- C12N5/0672—Stem cells; Progenitor cells; Precursor cells; Oval cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
- A61L2300/414—Growth factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/28—Materials or treatment for tissue regeneration for liver reconstruction
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2533/00—Supports or coatings for cell culture, characterised by material
- C12N2533/70—Polysaccharides
- C12N2533/80—Hyaluronan
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2537/00—Supports and/or coatings for cell culture characterised by physical or chemical treatment
- C12N2537/10—Cross-linking
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Zoology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Developmental Biology & Embryology (AREA)
- Dermatology (AREA)
- Immunology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Virology (AREA)
- Physiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Transplantation (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Nutrition Science (AREA)
- Gastroenterology & Hepatology (AREA)
- Inorganic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Dispersion Chemistry (AREA)
- Neurosurgery (AREA)
- Botany (AREA)
Abstract
提供了一种修复患病器官或功能失调器官的方法、或者建立疾病状态的模型系统的方法。对于修复患病器官,所述方法包括移植来自所述患病器官或功能失调的器官的健康组织的细胞,该细胞与形成凝胶的生物材料、营养培养基、信号分子和胞外基质组分混合,使得移植时能够快速不溶以形成移植物。以此方式,所述移植物以最小量的组分模拟自然微环境的复杂性,该最小数量的组分允许细胞成功地移植、扩展并接着重建患病器官或功能失调器官的部分或全部。在使用用于建立疾病模型的移植方法情况下,患病的细胞可被植入到生物材料中进而植入到试验的受体中。
Description
本申请为2013年01月06日进入中国国家阶段、申请号为201180033514.1、申请日为2011年05月06日、发明名称为“移植来自实体组织的细胞的方法”的发明专利申请的分案申请。
发明人:雷琪儿·特讷,大卫·戈伯,奥斯瓦杜·罗佐亚,洛拉·M·里德
相关专利申请的交叉引用
本申请要求2010年5月7日递交的第61/332,441号美国临时专利申请的权益,该美国临时专利申请的全部内容通过引入方式并入本文。
技术领域
本发明总体上针对组织移植领域。更具体地,本发明涉及用于细胞移植的组合物和方法。
背景技术
当前细胞移植疗法的方法通过血管路径将供体细胞引入受体中,这是一种模仿造血疗法的疗法。然而,由于造血细胞已经形成为悬浮态且具有支持其导向至特定目标组织的内在特征,因此执行造血细胞疗法相对容易。因此,关于造血细胞亚群移植的大量研究与实体器官的细胞移植的相关性很小,所述实体器官例如为皮肤或内脏(例如肝脏、肺、心脏)。事实上,当通过血管路径移植来自实体器官的细胞时,由于移植效率低、细胞存活差和倾向形成威胁生命的栓塞,因此作用较弱。因此,如果尝试用于移植的替代方法,则大多数实体器官的疾病会尽可能成功地得到治疗。
因此,本发明针对通过使用有效的多种策略的移植方案移植实体器官的细胞的方法。
发明内容
在本发明的一个实施方式中,提供了一种在具有处于患病状态或功能失调状态的内脏的对象中移植内脏的组织的方法。该方法包括:(a)从供体获取内脏的离体细胞;(b)使该细胞包埋在包括胞外基质组分的生物材料中,可选地,混合营养培养基和/或信号分子(生长因子、细胞因子、激素);和(c)将该细胞引入到目标器官中,其中,细胞和生物材料的混合物在内脏中或在内脏表面上、或者内脏中和在内脏表面上的合适位置体内形成胶体或固化。内脏可为肝脏、胆道系统(biliary tree)、胰脏、肺、肠、甲状腺、前列腺、乳房、子宫或心脏。合适的信号分子为生长因子和细胞因子,且可包括例如上皮生长因子(EGF)、肝细胞生长因子(HGF)、基质细胞衍生的生长因子(SGF)、类维生素A(例如维生素A)、成纤维细胞生长因子(FGF,例如FGF2、FGF10)、血管内皮细胞生长因子(VEGF)、胰岛素样生长因子I(IGF-I)、胰岛素样生长因子II(IGF-II)、制瘤素M、白血病抑制因子(LIF)、转铁蛋白、胰岛素、糖皮质激素(例如氢化可的松)、生长激素、任何一种垂体激素(例如促卵泡激素(FSH))、雌激素、雄激素和甲状腺激素(例如T3或T4)。
为了治疗患病器官或功能失调的器官,细胞的供体可以与受体不同(同种异体移植),或者也可为具有该处于患病或者功能失调的状态的内脏的对象(自体同源),条件是,从该内脏中的未患病或者未功能失调的一部分获取正常细胞。为了建立模型系统以研究疾病,供体细胞可为具有疾病且被移植到试验性受体的正常组织上或者正常组织中的细胞。
细胞可包括干细胞、成熟细胞、成血管细胞、内皮细胞、间充质干细胞(来自任何来源)、星状细胞、成纤维细胞或其混合物。此外,生物材料可包括胶原、粘附分子(层粘连蛋白、纤连蛋白、巢蛋白)、弹性蛋白、蛋白聚糖、透明质酸(HA)、粘多糖链、壳聚糖、海藻酸盐、以及合成的且可生物降解的并可生物相容的聚合物。透明质酸为优选材料之一。
在将内脏的离体细胞引入到受体中之前,可在生物材料内体外固化该离体细胞,或者在替选方案中,将内脏的离体细胞作为流体物质注射且允许在体内进行固化。优选地,将细胞引入至患病组织或功能失调的组织处或临近患病组织或功能失调的组织,并且,可通过注射、可生物降解覆盖物或海绵状物引入。
在本发明的另一实施方式中,提供了一种修复患内脏疾病或内脏功能失调的对象中的内脏的组织的方法。该方法包括:(a)从供体获取内脏的正常细胞;(b)使该细胞与一种或多种生物材料混合;(c)可选地,使细胞悬浮液与信号分子(生长因子、细胞因子)、其他细胞或其组合混合;和(d)将混合物(b)引入到所述对象中,其中,所述混合物变得不可溶且体内形成内脏上或者内脏中的移植物。
在本发明的另一实施方式中,提供了一种将内脏细胞定位至目标内脏的表面上、或目标内脏的内部中、或者目标内脏的表面上和目标内脏的内部中的方法,该方法包括:在有效量的交联剂存在下,将包含内脏细胞和一种或多种形成水凝胶的前体的溶液的制剂体内引入到目标内脏的表面上、目标内脏的内部中、或者目标内脏的表面上和目标内脏的内部中,该制剂在目标内脏的表面上、目标内脏的内部中、或者目标内脏的表面上和目标内脏的内部中形成含有内脏细胞的水凝胶。混合物还可包括营养培养基、胞外基质分子和信号分子。所固化的混合物(例如水凝胶)提供了进入目标内脏的的表面上、目标内脏的内部中、或者目标内脏的表面上和内部中的移植物。
细胞可在至少12小时、至少24小时、至少约48小时或至少约72小时的时间段定位至目标内脏中/目标内脏上,该目标内脏可为肝脏、胰脏、胆道系统、肺、甲状腺、肠、乳房、前列腺、子宫、骨或肾。在治疗患者时,内脏的供体细胞不应当为患病细胞(例如肿瘤细胞或癌细胞)。然而,当尝试建立一种疾病的试验模型系统时,移植物中可考虑患病细胞。
可形成水凝胶或类似的不溶性复合物的生物材料可包括粘多糖、蛋白聚糖、胶原、层粘连蛋白、巢蛋白、透明质酸、硫醇改性的透明质酸钠、上述物质的变性形式(例如明胶)或其组合。用于固化的触发剂可为诱发基质组分交联或诱发可形成凝胶的基质组分凝胶化的任何因子。交联剂可包括聚乙二醇二丙烯酸酯或其含有二硫化物的衍生物。优选地,细胞和生物材料的不溶性复合物具有在约0.1kPa至约100kPa范围内的粘度,优选地在约1kPa至约10kPa范围内的粘度、更优选地在约2kPa至约4kPa范围内的粘度,并且最优选地具有从约11Pa至约3500Pa的刚度。
在本发明的另一实施方式中,提供了一种冷冻保存细胞的方法,该方法包括:(a)获取离体细胞;(b)使该细胞与形成凝胶的生物材料、以及可选地一种或多种等渗基础培养基、信号分子(细胞因子、生长因子、激素)和胞外基质组分(例如透明质酸)混合;以及冷冻细胞混合物以使其保存在-90℃或-180℃的冷藏柜中。等渗培养基可为CS10(biolife)或等效的等渗冷冻保存缓冲剂。信号分子可为合适的信号分子。信号分子可为生长因子和细胞因子以及例如包括表皮生长因子(EGF)、肝细胞生长因子(HGF)、间质细胞-衍病,供体细胞可为具有疾病且被移植到试验性受体的正常组织上或者正常组织中的细胞。
细胞可包括干细胞、成熟细胞、成血管细胞、内皮细胞、间充质干细胞(来自任何来源)、星状细胞、成纤维细胞或其混合物。此外,生物材料可包括胶原、粘附分子(层粘连蛋白、纤连蛋白、巢蛋白)、弹性蛋白、蛋白聚糖、透明质酸(HA)、粘多糖链、壳聚糖、海藻酸盐、以及合成的且可生物降解的并可生物相容的聚合物。透明质酸为优选材料之一。
在将内脏的离体细胞引入到受体中之前,可在生物材料内体外固化该离体细胞,或者在替选方案中,将内脏的离体细胞作为流体物质注射且允许在体内进行固化。优选地,将细胞引入至患病组织或功能失调的组织处或临近患病组织或功能失调的组织,并且,可通过注射、可生物降解覆盖物或海绵状物引入。
在本发明的另一实施方式中,提供了一种修复患内脏疾病或内脏功能失调的对象中的内脏的组织的方法。该方法包括:(a)从供体获取内脏的正常细胞;(b)使该细胞与一种或多种生物材料混合;(c)可选地,使细胞悬浮液与信号分子(生长因子、细胞因子)、其他细胞或其组合混合;和(d)将混合物(b)引入到所述对象中,其中,所述混合物变得不可溶且体内形成内脏上或者内脏中的移植物。
在本发明的另一实施方式中,提供了一种将内脏细胞定位至目标内脏的表面上、或目标内脏的内部中、或者目标内脏的表面上和目标内脏的内部中的方法,该方法包括:在有效量的交联剂存在下,将包含内脏细胞和一种或多种形成水凝胶的前体的溶液的制剂体内引入到目标内脏的表面上、目标内脏的内部中、或者目标内脏的表面上和目标内脏的内部中,该制剂在目标内脏的表面上、目标内脏的内部中、或者目标内脏的表面上和目标内脏的内部中形成含有内脏细胞的水凝胶。混合物还可包括营养培养基、胞外基质分子和信号分子。所固化的混合物(例如水凝胶)提供了进入目标内脏的的表面上、目标内脏的内部中、或者目标内脏的表面上和内部中的移植物。
细胞可在至少12小时、至少24小时、至少约48小时或至少约72小时的时间段定位至目标内脏中/目标内脏上,该目标内脏可为肝脏、胰脏、胆道系统、肺、甲状腺、肠、乳房、前列腺、子宫、骨或肾。在治疗患者时,内脏的供体细胞不应当为患病细胞(例如肿瘤细胞或癌细胞)。然而,当尝试建立一种疾病的试验模型系统时,移植物中可考虑患病细胞。
可形成水凝胶或类似的不溶性复合物的生物材料可包括粘多糖、蛋白聚糖、胶原、层粘连蛋白、巢蛋白、透明质酸、硫醇改性的透明质酸钠、上述物质的变性形式(例如明胶)或其组合。用于固化的触发剂可为诱发基质组分交联或诱发可形成凝胶的基质组分凝胶化的任何因子。交联剂可包括聚乙二醇二丙烯酸酯或其含有二硫化物的衍生物。优选地,细胞和生物材料的不溶性复合物具有在约0.1kPa至约100kPa范围内的粘度,优选地在约1kPa至约10kPa范围内的粘度、更优选地在约2kPa至约4kPa范围内的粘度,并且最优选地具有从约11Pa至约3500Pa的刚度。
在本发明的另一实施方式中,提供了一种冷冻保存细胞的方法,该方法包括:(a)获取离体细胞;(b)使该细胞与形成凝胶的生物材料、以及可选地一种或多种等渗基础培养基、信号分子(细胞因子、生长因子、激素)和胞外基质组分(例如透明质酸)混合;以及冷冻细胞混合物以使其保存在-90℃或-180℃的冷藏柜中。等渗培养基可为CS10(biolife)或等效的等渗冷冻保存缓冲剂。信号分子可为合适的信号分子。信号分子可为生长因子和细胞因子以及例如包括表皮生长因子(EGF)、肝细胞生长因子(HGF)、间质细胞-衍生的生长因子(SGF)、类维生素A(例如维生素A)、成纤维细胞生长因子(FGF,例如FGF2、FGF10)、血管内皮细胞生长因子(VEGF)、胰岛素样生长因子I(IGF-I)、胰岛素样生长因子II(IGF-II)、制瘤素M、白血病抑制因子(LIF)、转铁蛋白、胰岛素、糖皮质激素(例如氢化可的松)、生长激素、任何一种垂体激素(例如促卵泡激素(FSH))、雌激素、雄激素和甲状腺激素(例如T3或T4)。胞外基质组分可为粘多糖、透明质酸、胶原、粘附分子(层粘连蛋白、纤连蛋白)、蛋白聚糖、壳聚糖、海藻酸盐、以及合成的且可生物降解的并可生物相容的聚合物或其组合。
对于细胞和生物材料的混合物的冷冻保存,混合物可进一步与以下物质混合:(i)冷冻防护剂,其选自二甲基亚砜(DMSO)、甘油、乙二醇、乙烯基二醇乙二醇(ethylenediolethalenediol)、1,2-丙二醇、2,3-丁烯二醇、甲酰胺、N-甲基甲酰胺、3-甲氧基-1,2-丙二醇及其组合;和/或(ii)添加剂,其选自糖、甘氨酸、丙氨酸、聚乙烯吡咯烷酮、丙酮酸酯、细胞凋亡抑制剂、钙、乳糖醛酸酯、棉子糖、地塞米松、被还原的钠离子、胆碱、抗氧化剂、激素或其组合。糖可为海藻糖、果糖、葡萄糖或其组合,以及抗氧化剂可为维生素E、维生素A、β-胡萝卜素或其组合。
附图说明
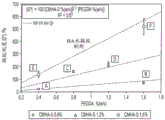
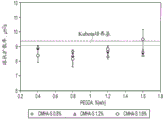
图1为将细胞移植到各种目标组织的根据本发明的方法的示意图。这些方法包括可植入的移植物、可注射的移植物和可附着在目标器官表面上的移植物(“创可贴式移植物”)。
图2提供了对用Kubota培养基(KM-HAs)制备的透明质酸的流变学测量。a)对于所测量的每一制剂,在0.1Hz-10Hz的施力频率范围内,KM-HAs的剪切模量|G*|,即机械凝胶刚度的测量,保持恒定,而粘弹性阻尼|G”/G’|,即于外力的变形响应延迟的测量,是可以忽略的;误差棒:在每一测量频率下测量的95%置信区间;b)KM-HAs显示出剪切稀化,即在实验的0.61/s–601/s剪切速率范围[0.1Hz至10Hz的施力频率]内,粘度随着施力频率增加而降低;上限和下限:基于幂律模型的95%置信区间(Cox-Merz定律假设,对于在0.31/s–301/s剪切速率范围[0.05Hz至5Hz施力频率]内的所有制剂,R2>0.993)。仅对表3中示出的标有字母的制剂进行了流变学测量。
图3示出在KM-HAs中的人肝干细胞(hHpSCs)的尺寸、形态学和增殖数据。当接种在KM-HAs中时,hHpSCs群实现了三维构型且呈现出a)球状团聚(左下角)或叠合(中间、右上角)[图像帧:900μm×1200μm]。培养一周后,对接种有hHpSCs的KM-HAs的组织切片的共聚焦显微镜观察显示了混合的细胞形态学表型,在实质细胞中,细胞尺寸为b)约7μm,或者c)高达10μm-15μm[根据DAPI对比染色法,细胞核为蓝色,对于b)和c),上皮细胞粘附分子(EpCAM)均为红色,b)CD44或者c)CDH1为绿色;图像帧:b)和c):150μm×150μm;b)和c)中的白色亮区:15μm×15μm]。d)通过AlamarBlue代谢还原测量的KM-HAs中的hHpSCs的存活率示出了在具有1.6%的CMHA-S和0.4%的PEGDA(制剂E,表3)的KM-HA水凝胶中培养1周期间,hHpSCs功能恢复和增殖;培养24小时后进行的AlamarBlue还原测量,相对于在接种后第2-3天时的测量值进行标准化;所述记录的数据为平均值±标准误差。
图4提供了在KM-HA中接种的hHpSCs培养一周后的分化标记物的蛋白表达。在取决于KM-HAs的性质的翻译水平下,对于hHpSCs中的分化标记物,hHpSCs群表现出不同的表达水平。在所有的KM-HA制剂中,人甲胎蛋白(AFP)的代谢分泌速率与mRNA表达水平相关。在所有的KM-HAs中,神经细胞粘附分子(NCAM)表达为阳性,而在具有1.2%或更小的CMHA-S含量的KM-HAs中,CD44表达最丰富(标有字母的制剂A、制剂B、制剂C、制剂D,表3)。对于|G*|<200Pa的KM-HA水凝胶,CDH1表达为阳性,而对于|G*|>200Pa的KM-HA水凝胶,CDH1表达为阴性。用于人AFP分泌速率的数据记录为平均值±标准误差。在15μm至20μm(约2至3个hHpSCs的厚度;hHpSC直径:5μm至7μm)的切片上进行EpCAM、NCAM、CD44和CDH1的免疫组织化学染色且通过荧光显微镜术进行成像[图像帧:100μm×100μm]。根据递增刚度对KM-HA制剂排序(对于A,|G*|=25Pa;对于B,|G*|=73Pa;对于E,|G*|=140Pa;对于C,|G*|=165Pa;对于D,|G*|=220Pa;和对于F,|G*|=520Pa)。
图5提供了通过qRT-PCR对培养1周后的在KM-HA中生长的hHpSCs中的肝祖细胞标记物测量的基因表达水平。对hHpSCs和其直接后代hHBs的标记物的mRNA表达水平(肝特异性AFP、EpCAM、NCAM、CD44和CDH1)之间的比较表明,在被动培养一周后,在KM-HA中生长的hHpSCs获取了在转录水平的早期hHB特征。对于CD44,在hHpSCs和最新分离的hHBs中的表达幅度是类似的;对于剩余标记物的表达水平在统计学上是明显的,当hHpSCs分化成hHBs时,EpCAM大约减少了二分之一,CDH1大约减少了三分之一,NCAM几乎消失以及AFP富集。在培养一周后,在所有的KM-HAs中,所接种的hHpSCs的AFP、NCAM和CDH1的平均表达水平移到hHpSC范围外并靠向hHB范围,而EpCAM表达一直在富集。按照递增的刚度对KM-HA制剂排序(对于A,|G*|=25Pa;对于B,|G*|=73Pa;对于E,|G*|=140Pa;对于C,|G*|=165Pa;对于D,|G*|=220Pa;和对于F,|G*|=520Pa)。根据GAPDH(3-磷酸甘油醛脱氢酶),标准化表达水平(平均值±标准误差)。标有字母的KM-HA制剂(表3)的测量与hHpSC群、(绿色)和刚分离的hHBs(红色)进行了显著性比较(Student t检验)。
图6为所公开的冷冻保存方法和解冻方法的一个实施方式的示意图。
图7示出利用透明质酸移植的产生荧光素的细胞对比作为细胞悬浮物注射的产生荧光素的细胞所产生的发光信号的体内即时成像的结果。
图8提供了在健康模型和CC14肝脏损伤模型中移植后第7天时相对于细胞悬浮液的人血清白蛋白的对比。
图9示出肝干细胞表型标记物的基因表达。表达水平根据GAPDH表达标准化,且倍数变化根据群体的初始表达标准化。*表示p<0.05%,试验条件和初始群体表达之间的显著性。**表示p<0.05%,试验条件和初始群体表达之间的显著性以及在两个试验条件之间的显著性表达。
图10提供了肝功能的功能性测量的随着时间变化的数据。在三维透明质酸培养物中随着时间变化的A)白蛋白、B)转铁蛋白、和C)脲的水平对每个细胞标准化。
图11提供了KM-HAs的机械特征的数据。a)KM-HAs的刚度是可控制的且取决于CMHA-S含量和PEGDA含量。平均剪切模量|G*|按照幂定律行为随CMHA-S含量和PEGDA含量增大而增大,从而提供了在初始水凝胶混合期间对KM-HAs的最终机械特性的直接控制;仅对表3中示出的标有字母的制剂进行流变学测量。误差棒:对于0.05Hz至5Hz的施力频率内的测量,标准偏差为±1。b)KM-HAs中的扩散。利用光脱色荧光恢复(FRAP)(70kDa的荧光素标记的葡聚糖)对KM-HAs内的扩散性进行的测量与单独的Kubota培养基相比没有显著差异;仅对表3中示出的标有字母的制剂进行扩散性测量。误差棒:测量的95%置信区间。
图12示出了接种到KM-HAs中的hHpSCs分泌的人AFP、白蛋白和脲。到接种后第7天时为止,KM-HAs中的hHpSCs群具有一定的肝功能,培养基(KM)中的人AFP和白蛋白的浓度增大以及脲合成平衡。到接种后第7天时为止,在KM-HA制剂中,人AFP、人白蛋白和脲的代谢分泌速率是有区别的,在具有1.6%的CMHA-S和0.4%的PEGDA的KM-HAs(制剂E,表3)中,AFP、白蛋白的速率最小且脲合成减少。左列:对于每一标有字母的制剂(表3),每天培养24小时后收集的培养基中的代谢产物浓度。右列:培养24小时后,培养基中每个hHpSC群的代谢物分泌速率;在每一时间间隔,利用AlamarBlue还原进行的活性检测所计算的培养基中全部代谢产物质量被标准化成功能性hHpSC群的数目(每个样本所接种的群数大约为12)。所有的数据记录为平均值±标准误差。
图13示出受控速率冷冻程序使防止内部冰损伤的液体-冰相熵最小化且允许重复冷冻。A)图示出与样本温度(10%DMSO)相关的室温度。B)用于Cryomed1010系统的冷冻程序速率。
图14提供了(A)冷冻保存的胎肝细胞解冻后的细胞存活率%;和(B)对于每一条件培养3周后的群体计数,根据新鲜样本标准化。结果记录为平均值±均值的标准误差。KM=具有10%DMSO和10%FBS的Kubotas培养基。CS10=cryostor,CS10+sup=具有KM添加物的cryostor10。0.05%和0.10%指在每一样本中补充的HA百分含量。
图15示出根据GAPDH表达标准化的相对的mRNA表达。平均值±均值的标准误差。显著性,相对于新鲜样本*p>0.05。KM=10%DMSO和10%FBS的Kubotas培养基。CS10=cryostor,CS10+sup=具有KM添加物的cryostor10。0.05%和0.10%指在每一样本中补充的HA百分含量。
具体实施方式
目前,通常通过血管路径执行涉及取自实体器官的细胞的细胞移植,且结果通常提供低效移植的压倒性证明,对于成熟细胞而言,效率通常约为20%-30%,对于干细胞而言,效率通常小于5%。由于在肝脏中,干细胞尺寸小(通常小于10μm)而成熟细胞的尺寸较大(通常>18μm),因此存在差异化的移植。本发明的研究已经证实了该发现。例如,在一个研究中,将人肝干细胞(hHpSCs)和人成肝细胞(hHBs)注射进免疫功能低下的小鼠中,这是通过将所述细胞注射进脾中实现的。由于脾直接与肝脏连接,因此所述细胞流入期望植入所述细胞的肝脏中。然而,大多数所述细胞在移植之前死亡或进入与预定目标不同的组织(异位位点)中。
即使当细胞正确地到达其目的地时,因血管形成不足、生长不足(当移植成熟细胞时)、使用成熟细胞时所述细胞的高度免疫原特性和需要长期免疫抑制,也会阻碍细胞转变成完全功能性的细胞。其他障碍包括寻求临床级的高质量的细胞的来源以及由于冷冻保存存在困难因此需要使用刚刚分离的细胞。
除了指出的低效和困难外,通过血管路径对来自实体器官的细胞进行移植也存在危险。来自实体器官的细胞具有可使细胞彼此快速连接并增强聚集的表面分子(细胞粘着分子,紧密连接蛋白)。该聚集现象可导致威胁生命的肺栓塞。
为了解决一些这样的障碍和有关问题,本发明针对涉及以下内容的移植技术:将移植细胞作为在支架上或支架中的聚集体的形式递送,该支架能够被定位至患病组织以促进必要的增殖和移植的。因此,本发明不仅考虑待移植的细胞类型,还考虑与合适生物材料结合的细胞类型以及用于最有效的且最成功的移植疗法的移植方法。本发明的移植技术可解译为对患者的治疗用途,并为用以重建患病组织或功能失调的组织的再生医学提供了可替选的治疗方法。
细胞源
根据本发明,可从具有“正常的”“健康的”组织和/或细胞的供体直接获取所需的细胞群,“正常的”“健康的”组织和/或细胞是指没有患病或没患有功能失调的任何组织和/或细胞。当然,这样的细胞群可取自器官患有疾病或患有功能失调的人,但是是取自该器官的未处于这样的病症状态中的一部分。细胞可来源于任何合适的哺乳动物组织,不必考虑年龄,包括胎儿的组织、新生儿的组织、小儿的组织和成人的组织。如果要建立疾病状态的试验模型,则可以在要植入到合适的试验受体中的移植物中采用患病细胞。
更具体地,基于治疗需要,针对不同的疗法,细胞可来源于不同“谱系(lineage)-阶段”的群体。例如,在需要快速获取仅由后期谱系细胞提供的功能的情况下,或者如果受体具有优先感染干细胞和/或祖细胞(例如丙型肝炎病毒或乳头瘤病毒所发生的)的谱系依赖性病毒,则较后期的“成熟”细胞可以是优选的。在任何情况下,“祖细胞”可用于建立其相应组织的任何谱系阶段。
关于谱系-阶段的肝细胞群及其分离方法的讨论,参见第11/560,049号美国专利申请和第12/213100号美国专利申请,所述美国专利申请的公开内容全部通过引用方式并入本文。简要地,存在至少八个肝内的成熟谱系阶段。下文给出了这些阶段和关于它们的简要叙述:
谱系阶段1:人肝干细胞(hHpSCs)为多潜能细胞,其位于胎儿肝脏和新生儿肝脏的管板内以及小儿肝脏和成人肝脏的赫林管(canals of Hering)内。这些细胞的直径通常在7μm至10μm的范围内,且具有高的细胞核/细胞质比。这些细胞可忍受局部缺血,在心脏收缩死亡后超过48小时时仍可在尸体肝脏中发现且可形成能够分化成成熟细胞的hHpSCs的群。这些细胞大约占所有年龄的供体的肝主质的0.5%至2%。
谱系阶段2:成肝细胞(hHB)为hHpSCs的直接后代且为肝脏的可能的过渡放大细胞。成肝细胞刚好完全位于干细胞龛外。这些细胞较大(10μm至12μm),具有较高量的细胞质,且体内分布在胎儿肝脏和新生儿肝脏的整个主质内以及在接近小儿肝脏和成人肝脏中的赫林管的端部的位置或临近该赫林管的位置。随着年龄的增加,成肝细胞数量下降至小于初生婴儿肝脏中的实质细胞的0.01%。已经表明,在再生过程期间,尤其是与某些疾病(例如肝硬化)有关的再生过程期间,该细胞群扩大。成肝细胞成长为肝细胞(H)或胆管细胞,也称为胆管上皮细胞(B)。
谱系阶段3H和3B:在肝脏内发现了定向的(单能)肝细胞祖细胞(3H)和胆管细胞祖细胞-胆管祖细胞(3B)。这些单能前体细胞仅产生一个成体细胞类型,且不再表达某些干细胞基因(例如,对于CD133/1、Hedgehog蛋白(音猬因子/印度刺猬因子),表达水平低或不表达),但表达对于胎儿组织中的细胞典型的基因。
谱系阶段4H和4B:门静脉周成体实质细胞包括相对小的肝细胞(4H)和肝内胆管上皮细胞(4B)。肝细胞为二倍体,其直径大约为18μm,且表达与糖原异生有关的多个因子/酶,例如磷酸烯醇丙酮酸羧激酶(PEPCK)、连接蛋白26和连接蛋白32。
该阶段(4B)的胆管细胞为二倍体,其直径大约为6μm-7μm,沿着赫林管的一部分排列,且表达各种基因,包括水通道蛋白1基因和水通道蛋白4基因、多药抗性蛋白1(MDR1)基因、分泌素受体基因、但不表达Cl-/HCO3 -交换蛋白基因或生长素抑制素受体基因。
谱系阶段5H和5B:该阶段的细胞包括相对较大的肝细胞(5H)和胆管细胞(5B),两者都为二倍体。肝细胞的直径尺寸大约为22μm-25μm,且它们分布于腺泡中部区域。该腺泡中部的肝细胞表达高水平的白蛋白和酪氨酸转氨酶(TAT);特别的特征在于该腺泡中部的肝细胞将转铁蛋白表达为蛋白(与之相比,谱系阶段1-4仅将转铁蛋白表达为mRNA)。
谱系阶段5B:胆管细胞的直径大约为14μm,且位于小叶内导管内,且表达囊性纤维化跨膜电导调节子CFTR、分泌素受体、生长素抑制素受体、MDR1、MDR3和Cl-/HCO3 -交换蛋白。
谱系阶段6H:阶段6的二倍体围轴肝细胞在培养物中可形成群体,但是具有有限的扩展能力以及基本上不具有继代培养的能力。这些细胞的百分数随着年龄增加而下降(同时,四倍体围轴细胞的百分数增加)。除了表达白蛋白、TAT和转铁蛋白外,该细胞还强烈表达一定数目的P450(例如P450-3A)、谷氨酰胺合成酶(GT)、肝素蛋白聚糖以及与脲生成有关的基因。
谱系阶段7H:该阶段包括不再能够进行完全的细胞分裂的四倍体围轴实质细胞。该细胞可进行DNA合成,但具有有限的胞质分裂能力。该细胞为更大型的细胞(直径>30μm),且表达高水平的在谱系阶段5-6中出现的基因。
谱系阶段8:凋亡细胞表达凋亡的各种标记物且证实DNA断裂。
除了提供患病内脏或功能失调内脏的自身“功能”所需的细胞外,移植物优选地还包括其他的细胞组分,该其他的细胞组分优选地模拟包含上皮细胞-间充质细胞的关系(所有组织的细胞基础)的细胞种类。各个成长谱系阶段的上皮细胞-间充质细胞关系是不同的。上皮干细胞与间充质干细胞合作,随着它们成长为组织内的所有各种成体细胞类型,它们彼此协调地发育成熟。这两者之间的相互作用通过旁分泌信号介导,该旁分泌信号包括可溶性信号(例如生长因子)和细胞外基质成分。
例如,在肝脏中,肝干细胞(HpSC)产生肝细胞和胆管细胞。用于HpSC的间充质合作者为成血管细胞。有证据表明,成血管细胞产生内皮细胞前体和肝星状细胞前体,它们为肝内谱系阶段2的实质(成肝细胞(HB))的间充质细胞合作者。内皮细胞前体在后续的谱系阶段中发育成熟成为内皮细胞,内皮细胞成为肝细胞的谱系阶段的间充质细胞合作者。星状细胞前体细胞产生星状细胞,然后产生基质细胞,然后再产生成肌纤维细胞,成肌纤维细胞为用于胆管细胞的间充质细胞合作者。
肝脏的形成,称作肝脏发生,通过来自与心脏有关的胚胎间充质中的成血管细胞的信号得以调节。在肝脏发育的初始阶段中,前-心脏中胚层分泌成纤维细胞生长因子(FGF),同时间充质释放骨形体生成蛋白(BMP)。然后,这些刚列举的肝细胞离开原位且迁移到周围的间充质中,且与内皮和基质的前体相互作用。间充质细胞在整个肝脏发育期间与肝细胞保持接触。
人肝干细胞(hHpSCs)为了存活需要与间充质细胞接触。当在成血管细胞的饲养层上时,人肝干细胞将自我复制,即保持为hHpSCs。如果在肝星状细胞的饲养层上培养,则其谱系限于成肝细胞。如果在成熟的内皮上培养,则人肝干细胞成长为成体肝细胞,如果在成熟的基质(例如成熟的星状细胞或成肌纤维细胞)上培养,则人肝干细胞成长为胆管细胞。已经证明,饲养层对干细胞的命运进行控制是由于谱系中的每种上皮-间充质细胞关系所产生的旁分泌信号的确切结合引起的。
根据本发明的一个实施方式,根据需要,将离体的细胞群与已知的旁分泌信号(下文讨论)和“天生的”上皮-间充质合作者混合,以优化移植物。因此,移植物将包括上皮干细胞、肝干细胞,所述上皮干细胞和肝干细胞与其天生的间充质细胞合作者(成血管细胞)混合在一起。对于过渡放大细胞龛移植物,成肝细胞可与肝星状细胞前体和内皮细胞前体结成合作者。在一些移植物中,可混合两组:肝干细胞、成肝细胞、成血管细胞、内皮细胞前体、肝星状细胞前体细胞,以优化受体组织中的肝细胞建立。接种有细胞的移植物的微环境可由旁分泌信号、基质信号和可溶信号组成,这些信号在用于该移植物的相关谱系阶段中产生。
也可为了控制疾病状态而制作移植物。例如,为了使感染早期谱系阶段且然后协同受体细胞一起生长成熟的谱系依赖性病毒(例如,某些肝炎病毒)的作用最小化,可以制备不容许病毒感染的较后期的谱系阶段(例如肝细胞及其天生合作者—肝窦内皮细胞)的移植物。通过在移植物中使用患病细胞,移植物还可用来建立疾病模型,将该移植物移植到试验性的动物模型中的目标器官中/目标器官上。
使用肝细胞疗法作为模型,干细胞移植物的示例将包括肝干细胞、成血管细胞和肝星状细胞前体。相反,“成熟的”肝细胞移植物将包括成肝细胞、成熟的内皮细胞和周细胞,所述周细胞为成熟的星状细胞。关于肝的上皮-间充质细胞关系的讨论,参见第11/753,326号美国专利申请,该美国专利申请的公开内容全部通过引用方式并入文中。
血管形成的问题对于所有移植物而言是重要的,因此,应当将移植物植入到有助于血管形成的位置(例如肝)中。对于大多数的病症,考虑到干细胞的扩展潜力、其成长为所有成体细胞类型的能力、其对局部缺血的耐性(这能够使其来源于尸体组织)以及其最小的(如果有的化)免疫原性,优选干细胞移植物。
移植材料
根据本发明的形成凝胶的生物材料的使用为细胞支撑和有助于成功移植和再生过程的信号提供了支架。由于有机体中的实体器官的组织经历不断的不变的重构,因此,解离的细胞趋向于在合适的环境条件下重新形成其天然结构。该细胞可与营养培养基(例如,RPM1640)、信号分子(例如,胰岛素、转铁蛋白、VEGF)和一种或多种胞外基质组分(例如透明质酸、胶原、巢蛋白、蛋白聚糖)中的一种或多种结合。
在所有的组织中,旁分泌信号包括可溶的信号(大量的生长因子和激素)和不可溶的信号(胞外基质(ECM))。可溶的因子和(不可溶的)基质因子之间的协同效应可对所移植的细胞的生长和分化响应有决定性影响。基质组分为粘附、存活、细胞形状(以及细胞骨架的组织)和必须的细胞表面受体的稳定化的主要决定因素,该细胞表面受体响应于特定的胞外信号刺激细胞。
已知ECM用来调节细胞形态、细胞生长和细胞基因表达。通过使用纯化的ECM组分可体外获得与体内的组织特异性化学现象类似的组织特异性化学现象。许多这些可从市场上获得且有助于进行体内细胞行为模拟。
合适的基质组分包括胶原、粘附分子(例如细胞粘附分子(CAM))、紧密连接(钙粘素)、基本粘附分子(层粘连蛋白、纤连蛋白)、间隙连接蛋白(间接蛋白)、弹性蛋白和形成蛋白聚糖(PG)和粘多糖(GAG)的硫化碳水化合物。这些种类中的每一种类限定分子的种类。例如,现在至少有25种胶原类型,每一种胶原类型由不同的基因编码且具有独特的调节和功能。其他的生物材料包括无机的天然材料(例如壳聚糖、藻酸盐)以及许多合成的且可生物降解的并可生物相容的聚合物。这些材料经常通过多种方法而“固化”(例如制成凝胶或不溶材料),所述方法包括热凝胶化、光交联或化学交联或暴露在引发材料不溶性的微环境(例如高盐)中。然而,利用每一方法,必须考虑细胞损害(例如由过度的温度范围、紫外线暴露引起)。关于生物材料的更详细的讨论,尤其是透明质酸水凝胶的使用,参见第12/073,420号美国专利申请,该美国专利申请的公开内容全部通过引用方式并入文中。
具体选择哪些基质组分可通过体内梯度来指导,例如,从与干细胞区室相关的组分到与后期谱系阶段细胞相关的组分的转变。移植物生物材料优选地模拟移植物所需的特定谱系阶段的基质化学成分。所选择的基质组分的混合物的功效可在体外研究中使用纯化的基质组分和可溶信号而进行分析,根据优良制造标准(GMP)协议,这些基质组分和可溶信号很多可从市场上获得。所选择的用于移植物的生物材料优选地激发细胞所需的合适的生长和分化响应,以实现成功移植。
关于肝器官,与肝实质细胞相关的、以及在干细胞的外部和过渡放大细胞龛的外部的基质化学成分存在于狄氏间隙中,该狄氏间隙为位于实质细胞和内皮细胞或其他形式的间充质细胞之间的区域。在肝的不同区域内,除了细胞成熟度的变化外,还观察到基质化学成分的变化。区域1中的门静脉周围的基质化学成分类似于在胎儿肝脏中发现的基质化学成分且由III型胶原、IV型胶原、透明质酸(HA)、层粘连蛋白和各种形式的硫酸软骨素蛋白聚糖组成。该区域在中心周围区域3中转变为不同的基质化学成分,包括I型胶原、纤连蛋白、独特形式的肝素和硫酸乙酰肝素蛋白聚糖。
肝的干细胞龛已经部分特征化且发现其包含透明质酸、与α6-β4整联蛋白结合的层粘连蛋白形式(例如,层粘连蛋白5)、III型胶原、和独特形式的最低限度硫酸化的硫酸软骨素蛋白聚糖(CS-PG)。在该龛中存在有限量的IV型胶原,且不存在I型胶原。
该龛的基质化学成分转变为与过渡放大细胞区室有关的基质化学成分,与过渡放大细胞区室有关的该基质化学成分由IV胶原、与其它整联蛋白(αβ1)结合的各种形式的层粘连蛋白和各种形式的GAG和PG组成,该各种形式的GAG和PG包括各种形式的具有较高硫酸化作用的CS-PG、硫酸皮肤素-PG和特定形式的硫酸乙酰肝素-PG(HS-PG)。
过渡放大细胞区室向后期谱系阶段转变,并且,随着每个连续阶段,基质化学成分变得更加稳定(例如,更加高度稳定的胶原)、转换较少、且包含更高度硫酸化的各种形式的GAG和PG。最成熟的细胞与各种形式的肝素-PG(HP-PG)有关,这意味着大量的蛋白(例如,生长因子和激素、凝固蛋白、各种酶)可与所述基质结合且可通过与GAG中的独立的且特定的硫酸化型式结合而稳定地保持。因此,基质化学成分从其在具有与高转换和最小硫酸化作用(且因此靠近细胞的以稳定方式的信号结合最少)有关的不稳定基质化学成分的干细胞龛中的起点转变为硫酸化作用的量增加(且因此越来越高水平的信号结合且保持临近细胞)的稳定的基质化学成分。
因此,本发明考虑到,基质分子的化学成分随着成熟阶段、受体年龄和疾病状态变化。利用合适材料进行移植应当优化植入细胞在组织中的移植,防止细胞扩散至异位位点,使栓塞问题最小化,且增强细胞的能力以尽可能快地结合在组织内。此外,还可选择移植物内的因子以使免疫原性问题最小化。
就人肝脏而言,可在无血清条件下培养细胞。人肝干细胞或人成肝细胞(hHpSC或hHB)可单独被移植,或与成血管细胞/内皮细胞前体和星状细胞前体组合移植。可使细胞悬浮在含有硫醇化的且化学改性的HA(CMHA-S,或Glycosil,Glycosan BioSystems,盐湖城,犹他州)的培养基(HA-M)中和KM(Kubota培养基)中,并装入到一套成对的注射器中的一个注射器中。另一个注射器可装有在KM中(或者在引起生物材料不溶所需的条件下)制备的交联剂,例如聚(乙二醇)二丙烯酸酯或PEGDA。这两个注射器通过一针头连接,该针头逐渐张开进入两个鲁尔接口锁定连接件中。因此,水凝胶中的细胞和交联剂可通过一个针头涌出以使得CMHA-S在注射时快速交联成凝胶(或通过替选的方式实现生物材料的不溶)。
可使用网膜组织将CMHA-S中的细胞悬浮液和交联剂直接注射到或移植至肝脏以形成袋状。可替选地,通过使悬浮液在空气中静置过夜,,导致二硫键交联成柔软的粘性水凝胶,细胞可被包封在Glycosil中而不使用PEGDA交联剂。另外,可添加其它的硫醇改性的大分子单体,例如明胶-联硫二丙酰二肼(DTPH)、肝素-DTPH、硫酸软骨素-DTPH,以得到模拟体内特定龛的基质化学成分的共价网。在另一表现形式中,在将PEGDA添加到Glycosil中之前,含有半胱氨酸残基或硫醇残基的多肽可与PEGDA偶联,从而允许特异性多肽信号并入水凝胶中。可替选地,在交联之前,任何多肽、生长因子或基质组分(例如胶原异形体、层粘连蛋白异形体、玻连蛋白异形体、纤连蛋白异形体等)可被添加到Glycosil和细胞溶液中,使得被动捕获水凝胶中的重要多肽成分。
透明质酸:透明质酸(HA)为碳水化合物六大粘多糖(GAG)家族之一的成员,该六大粘多糖家族均为糖醛酸和氨基糖[1-3]的聚合物。其它家族包括硫酸软骨素(CS,[葡萄糖醛酸-半乳糖胺]X)、硫酸皮肤素(DS,更高度硫酸化的[葡萄糖醛酸-半乳糖胺]X)、硫酸乙酰肝素(HS,[葡萄糖醛酸-葡糖胺]X)、肝素(HP,更高度硫酸化的[葡萄糖醛酸-葡糖胺]X)和硫酸角质素(KS,[半乳糖-N-乙酰葡糖胺]X)。
HA是由通过β1-4键、β1-3键连接的葡糖胺和葡萄糖醛酸的二糖单位组成的。生物学上,聚合的多糖由几百个至多达2000或多于2000的二糖单位的线性重复组成。HA具有通常为100,000Da(在血清中)至多达2,000,000Da(在滑液中)、至多达8,000,000Da(在脐带和玻璃体中)的分子量。由于其负电荷密度高,HA吸引阳离子,吸水。这种水合作用允许HA支持非常压缩的载荷。HA位于所有的组织和体液中,且在软结缔组织中最为丰富,并且,天然的载水能力有助于推测其他作用,包括组织形式和功能的影响。其分布于胞外基质中、细胞表面上和细胞内部。
天然形式的HA的化学性质是多样的。最常见的变量为链长。由于具有长的碳水化合物链(例如,在鹑鸡类的鸡冠中和在脐带中的碳水化合物链),一些HA具有高分子量;另外一些由于具有短链而具有低分子量(例如来自细菌培养物)。HA的链长在所引发的生物功能中发挥着关键作用。低分子量的HA(低于3.5×104kDa)可包括与基质代谢有关的细胞因子活性且已被证实与组织中炎症有关。高分子量(大于2×105kDa)可抑制细胞增殖。介于1kDa至4kDa之间的小的HA片段已被证实增加血管生成。
天然形式的HA已经被改性以引入所需的特性(例如,使HA改性以具有硫醇基,使硫醇用于结合其他基质组分或激素或用于新的交联形式)。此外,存在自然发生的交联形式(例如通过氧调节)和通过利用某些试剂(例如酰基化试剂)处理天然的的HA和改性的HA或者如上文提到的通过建立改性HA并且该改性HA允许进行独特形式的交联(例如在硫醇改性的HA中形成二硫桥键)而人工引入的其他交联形式。
根据本发明,硫醇改性的HA和用于硫醇改性的HA的原位可聚合技术为优选的。这些技术包括硫醇化的羧甲基化HA(称为CMHA-S或Glycosil)的二硫化物交联。对于体内研究,可使用具有较低分子量(例如70kDa至250kDa)的HA,因为交联,无论是二硫化物还是PEGDA,都形成非常高分子大小的水凝胶,因此。硫醇-反应性连接剂—聚乙二醇二丙烯酸酯(PEGDA)交联剂适合于细胞包封和体内注射。该组合的Glycosil-PEGDA材料通过共价反应且在几分钟内交联,是生物相容的且允许细胞生长和增殖。
水凝胶材料Glycosil考虑了有助于体内干细胞的组织工程的凝胶性质。Glycosil为从美国犹他州盐湖城的Glycosan Biosciences公司得到的半合成胞外基质(sECM)技术的一部分。Extracel和HyStem的产品线中的多种产品可从市场上购买到。这些材料为可生物相容的、可生物降解的且非免疫原的。
另外,Glycosil和Extralink可容易地与其它ECM材料组合用于组织工程应用。HA可从许多商业来源获得,优选地是在ISO9001:2000方法中使用链霉菌(Streptomyces)菌株(例如Genzyme、LifeCore、NovaMatrix和其它)进行的细菌发酵或使用枯草杆菌(Bacillussubtilis)作为受体进行的细菌发酵过程(专属Novozymes)。
细胞群的理想比率应当复制在体内和在组织的细胞悬浮物中发现的比率。细胞混合物允许祖细胞成熟和/或维持成体细胞类型,同时伴随有必需的血管形成的建立。以此方式,实现了这样的复合微环境:使用透明质酸作为用于含有多种基质组分和可溶信号因子的复合物的基本成分,且被设计成模拟特定的微环境龛,该微环境龛由特定的成熟谱系阶段的内皮细胞和间充质细胞产生的特定组的旁分泌信号组成。下面为实施例:
表1:用于祖细胞的代表性龛移植物
表2:用于成熟实质细胞的代表性龛移植物
肝中的干细胞龛的微环境包括肝干细胞和成血管细胞之间的旁分泌信号。该微环境由透明质酸、III型胶原、特定形式的层粘连蛋白(层粘连蛋白5)、几乎不具有硫酸化的独特形式的硫酸软骨素蛋白多糖(CS-PG)和接近于或确切为“Kubota培养基”(用于肝祖细胞的培养基)的组合物的可溶信号/培养基组合物组成。其他因子并非是严格需要的,尽管可通过补充干细胞因子、白血病抑制因子(LIF)和/或某些白细胞介素(例如IL6、IL11和TGF-β1)观察效果。CS-PG的干细胞龛形式还是不可获得的。
肝中的过渡放大细胞微环境在形态学上介于成肝细胞微环境和肝星状细胞微环境之间。该微环境的组分包括透明质酸、IV型胶原、与β1整联蛋白连接的特定形式的层粘连蛋白、更硫酸化的CS-PG、各种形式的硫酸乙酰肝素蛋白聚糖(HS-PG)和可溶的信号,该可溶的信号包括进一步补充有上皮生长因子(EGF)、肝细胞生长因子(HGF)、基质细胞-衍生的生长因子(SGF)和类维生素A(例如维生素A)的Kubota培养基。
移植方法
根据组织类型,可选择合适的移植方法。对于其中移植物将取代患病组织或缺失组织(例如,骨头)的组织而言,可植入的移植物是合适的。然后,根据所选择的方法,可选择合适的生物材料以迎合该方法。将需要不同的方法。例如,在骨示例中,固体基质允许细胞连同必要的生长因子一起接种进入基质、培养、然后被移植到患者中。图1。
可注射的移植物的优点在于,其可填充任何缺少的形状或空间(例如,受损的器官或组织)。根据该方法,共培养细胞并将其以包埋在可形成胶体的生物材料中的细胞悬浮液的形式进行注射,使用各种交联方法原位固化该细胞悬浮液。混合物可被直接注射到受体组织或受体器官(例如肝脏)中;在器官囊下注射,该器官囊为包围器官或组织的任意膜;注射到袋状物中,该袋状物是通过使网膜的一部分折叠网膜到自身上并粘合该部分而形成的;或者通过使用外科胶剂以将另一种材料(例如蜘蛛丝(spider silk))粘附到器官的表面形成袋状物并将混合物注射到该袋状物中。
直接注射可包括在肝的格利森囊下注射且进入到多个位点处的实质中,但尽可能少以避免来自水凝胶的静水压力,静水压力可导致对肝组织造成损害。如上文所描述,使用双管注射器将肝干细胞龛移植物注射到肝中。简言之,将细胞-基质-培养基混合物装入注射器的一侧,针头连接至含有交联剂聚乙二醇二丙烯酸酯(PEGDA)的另一注射器。可通过25gauge的针头将混合物直接注射到肝中且立即交联以形成水凝胶。由于根据交联剂的浓度,交联反应在几分钟内或者多达10-20分钟的时间段内发生,因此在pH7.4下,使用PEGDA和CMHA-S允许细胞包囊以及体内注射。
无机的天然材料(例如壳聚糖、藻酸盐、透明质酸、纤维蛋白、明胶)以及许多合成的聚合物可足够作为用于注射的生物材料。这些材料通常通过包括热凝胶化、光交联或化学交联的方法进行固化。该细胞悬浮液还可补充有可溶信号或特异性基质组分。由于这些移植物可相对容易地注射到目标区域,因此不(或最小限度的)需要入侵性外科手术,这降低了费用、患者不适、感染风险和疤痕形成。由于CMHA的长久性效应且同时维持生物相容性,其也可用于组织工程学的可注射材料。交联方法也维持材料的生物相容性,且CMHA在再生的或干细胞/祖细胞龛的广泛区域中存在使其成为受关注的可注射材料。
在一些实施方式中,移植物可被设计成置于器官或组织的表面上,在该情况下,该移植物可利用可生物相容的且可生物降解的覆盖物(创可贴)而保持于合适的位置。对于一些腹部器官,该覆盖物可来自于自体组织。例如,通过使用受体网膜形成注射袋状物,可进行将肝细胞(例如,肝祖细胞)移植到肝表面上。自网膜在腹腔内的位置提拉该网膜且使用外科胶剂(例如,纤维蛋白胶、多抹棒(dermabond))将其粘合到肝上以形成用于移植材料的袋状物。同样可使用双管注射器以将基质材料注射到肝的外表上的袋状物内。
同样,可在与目标组织无关的网膜袋状物内形成移植物。例如,代替将移植体移植到目标组织中或目标组织上,可使用用于异位位点的移植方法。移植物可在网膜袋状物内建立,该网膜袋状物将通过纤维蛋白胶(或者等同物)形成。当受体肝脏的伤痕太多或者具有一些会阻碍移植物成功进入肝的组织的其它参数时,该方法可尤其适合于肝移植。另一示例为内分泌细胞(例如,胰岛),该内分泌细胞具有能够利用血管供给的基本要求。内分泌细胞(例如,胰岛)的移植物可被制成网膜袋状物。
本发明人已经得知,KM-HA水凝胶的刚度、粘弹性质和粘度可取决于CMHA-S的含量和PEGDA的含量。例如,KM-HA水凝胶在宽的施力频率范围内维持恒定的刚度,同时显示出完全弹性的行为(图2a)和剪切稀化,其中该水凝胶的粘度随着施力频率的增大而降低(图2b)。当PEGDA和CMHA-S在缓冲的蒸馏水中混合时,随着不同的PEGDA浓度和CMHA-S浓度,这些KM-HA水凝胶可产生在11Pa至3500Pa范围内的剪切模量,但是这些值可通过使用不同的基本培养基(如Kubota培养基)而被调整(图2和图11)。
ECM(将待移植的细胞接种到该ECM中)的机械性能对于信号转导、传输以及细胞对使用机械结构的机械力作出响应(统称为机械力转导)的能力可具有深远的作用。例如,当人肝祖细胞(例如,肝干细胞)被接种在机械刚性的移植物中时,例如接种在浓稠的HA水凝胶内部中时,其可分化,其中,该浓稠的HA水凝胶随着PEGDA和CMHA-S混合在缓冲的蒸馏水中时具有的不同的PEGDA浓度和CMHA-S浓度,而具有产生的在11Pa至3500Pa范围内的剪切模量(图2)。
根据接收肝干细胞群的KM-HA水凝胶的组成,该肝干细胞群具有不同的代谢活性。关于肝功能的指标(AFP、白蛋白和脲),整个培养过程中KM-HA制剂中的绝对分泌是可比较的;然而,绝对分泌结合代谢效率示出了取决于HA含量的选择方法(图12)。在该方法中,对于具有小于1.2%的CMHA-S含量的KM-HA水凝胶,代谢强制下的分泌速率增大;相反,在具有较多CMHA-S(1.6%)的KM-HA水凝胶中,分泌速率相对较小,代谢功能较高,甚至存活率较大,如在制剂E中(图3d)。因为hHpSCs和hHBs具有不同的代谢能力,因此可针对肝祖细胞的扩展或分化来选择KM-HA水凝胶。
肝祖细胞中的分化标记物的表达分析证实KM-HA水凝胶内发生分化,如下证明:EpCAM的增多的全部基因表达超出了在塑料板上的hHpSC群体的建立水平(图5),以及在群体中的异质NCAM表达靠向外部细胞的外边界且位于外部细胞的顶端表面上(图4)。发现CD44在hHpSCs和hHBs上以mRNA表达水平表达(图5)。与NCAM不同,在CMHA-S含量为1.2%或更小的KM-HA水凝胶中观察到较多的CD44表达(图4)。
mRNA表达水平取决于KM-HA水凝胶的刚性(图5),该对刚性的依赖性限制了两种状态(一种状态为在低的移植物刚性下,基因表达随着刚性增加而减少,另一种状态为在高移植物刚性(|G*|>200Pa)下基因表达恢复)。该效应对于E-钙粘蛋白(E-cadherin)来讲是更强烈的:在经过大约|G*|=200Pa的分叉点时不存在蛋白表达,尽管有着与较软的水凝胶(其中有E-钙粘蛋白的蛋白表达)中的mRNA表达水平相匹配的强的mRNA表达水平(图4)。因此,直接暴露在外部机械力下的细胞被认为能够将信号传递给在群体的外表面处的临近细胞。
以此方式,通过表明E-钙粘蛋白表达的翻译控制取决于环境刚性,可连接hHpSCs中的信号机构,其能够全部适应其底物的刚性。因此,hHpSCs中的基因到蛋白的转化过程遵守依赖刚性的分叉标准。
在KM-HA水凝胶中培养的hHpSC群体的基因表达的变化表明这些3D环境内的逐渐分化。最为显著的是,本发明的培养模型中的分化可在生物化学补充物不存在的情况下发生。这些结果表明,包埋在各种KM-HA水凝胶中的hHpSCs在静置培养一周内分化成中间的hHB谱系。
冷冻保存
在本发明的另一实施方式中,HA凝胶可与常规的冷冻保存法一起使用,以得到良好的保存和解冻时有良好的生存能力。在图6中示出本过程的概括。不被理论限制或约束,认为包括HA能通过刺激粘合机制(例如整联蛋白β1的表达)而改善保存,该粘合机制促进细胞的培养和解冻后的功能的保存。优选地,HA浓度在0.01%至1%的重量百分比的范围内,优选地,在0.5%至0.1%的重量百分比范围内。
除非另有限定,否则本文中使用的所有科技术语具有本发明所属领域的技术人员通常理解的相同涵义。在文中所提到的所有的出版物、专利申请、专利和其他参考文献通过引用方式全部并入文中。如果出现冲突,本发明(包括定义)将起作用。此外,材料、方法和实施例仅用于说明且目的不在于限制。
通过下面说明性的实施例,将具体地描述本发明;然而,本发明的范围不是且不限于下面举例的实施方式。
实施例1
根据所述的方案,从受体C57/BL6小鼠(4-5周大)中分离出小鼠肝祖细胞。为了“移植”研究,将GFP(绿色荧光蛋白)报告分子引入到该肝祖细胞中。然后,使细胞与透明质酸(HA)水凝胶混合,且在将HA引入到对象小鼠中之前,使HA与聚(乙二醇)-二丙烯酸酯(PEG-DA)交联。为了引入/植入,用氯胺酮(90mg/kg-120mg/kg)和甲苯噻嗪(10mg/kg)麻醉小鼠,且打开小鼠腹部。然后,将具有HA或不具有HA的细胞缓慢注射到前肝叶中。闭合切割位点,且每12小时给予动物0.1mg/kg的丁丙诺啡,持续48小时。48小时后,对动物实施安乐死,且将组织去除、固定和切片以用于组织学。
为了确定鼠科动物模型内的细胞定位,在50POI,在37℃下,使“对照”肝祖细胞感染表达荧光素酶的腺病毒载体4小时。如上文所述进行存活手术,且将细胞(1-1.5E6)直接注射到具有HA或不具有HA的肝叶中。在即将成像之前,将荧光素皮下注射到小鼠中,通过植入的细胞产生发光信号。利用IVIS动态光学成像仪,确定细胞在小鼠内的定位。
结果
在24小时时,在肝和肺中发现了在没有HA的情况下进行移植而注射的“对照”细胞。然而,在72小时时,无法定位到大多数细胞,只有少数可识别的细胞保留在肝中。相反,在24小时时和72小时时,观察到根据本发明的移植细胞成为成功并入肝中的细胞群,且甚至在两周后仍存在。还发现通过该干细胞龛移植物植入的细胞几乎全部定位在肝组织,且通过对随机的组织学样本进行分析,在其他组织中没有发现所述细胞(图7)。
实施例2
根据所述的方案,从胎儿肝组织(16-20周)中分离出人肝祖细胞。将表达荧光素酶的腺病毒载体引入到该肝祖细胞中。然后,在将该细胞引入到对象小鼠中之前,在交联剂聚(乙二醇)-二丙烯酸酯(PEG-DA)的存在下,使该细胞与硫醇-改性的羧甲基HA(CMHA-S)混合。更具体地,通过在KM中溶解HA干试剂以得到2.0%(重量/体积)的溶液来形成水凝胶,且将交联剂溶解在KM中以得到4.0%重量/体积的溶液。然后,在37℃的水浴中培养样本以完全溶解样本。以1.0mg/ml的浓度制备胶原III和层粘连蛋白,且以1:4的比率将其与交联剂/水凝胶混合。
为了引入/植入,利用氯胺酮(90-120mg/kg)和甲苯噻嗪(10mg/kg)对小鼠进行麻醉,且打开小鼠腹部。然后,将具有HA或不具有HA的细胞缓慢注射到前肝叶中。闭合切割位点,且每12小时给予动物0.1mg/kg的丁丙诺啡,持续48小时。对于肝损伤模型,以一次剂量0.6ul/g腹腔给药四氯化碳(CCl4)。48小时后,对动物实施安乐死,且将组织去除、固定和切片以用于组织学。
为了确定鼠科动物模型内的细胞定位,在50POI,在37℃下,使“对照”肝祖细胞感染表达荧光素酶的腺病毒载体4小时。如上文所述进行存活手术,且将细胞(1-1.5E6)直接注射到具有HA或不具有HA的肝叶中。刚好在成像之前,对小鼠进行腹腔注射荧光素K盐(150mg/kg),植入的细胞产生发光信号。10-15分钟后,利用IVIS动态光学成像仪,确定细胞在小鼠内的定位(图7)。
在第7天时,评估小鼠血清中的分泌的人白蛋白的浓度水平,以确定所植入的人肝祖细胞的功能。利用结合有辣根过氧化物酶的荧光探针和450nm的比色吸收度,通过酶联免疫吸附测定(ELISA)来测量白蛋白产生(图8)。在第7天时,从小鼠中去除组织样本且使其固定在4%的多聚甲醛(PFA)中2天,然后保存在70%的乙醇中。对5μm厚的切片进行染色,用于组织学检查。
结果
在第7天时,采集血液样本且去除并固定组织以用于组织学。在与健康模型相对的损伤模型中,观察到血清白蛋白微略增加,且当与来自缺乏HA的细胞悬浮物的结果比较时,HA-移植方法也示出血清白蛋白增加(图8)。
针对人白蛋白,对经CCl4处理的小鼠的组织进行染色。发现通过使用HA的移植方法所植入的细胞在受体细胞内成群且保持植入细胞的大型细胞团。然而,通过细胞悬浮物植入的细胞产生了遍布肝脏分散的小聚集体。
实施例3
从胰腺组织中分离出人胰腺祖细胞。将表达荧光素酶的腺病毒载体引入到该祖细胞中。如实施例2中所描述的,在交联剂聚(乙二醇)-二丙烯酸酯(PEG-DA)存在下,使该细胞与硫醇-改性的羧甲基HA(CMHA-S)混合。
为了引入/植入,利用氯胺酮(90mg/kg-120mg/kg)和甲苯噻嗪(10mg/g)对小鼠进行麻醉,且打开小鼠腹部。然后,将具有HA或不具有HA的细胞缓慢注射到胰腺中。闭合切割位点,且每12小时给予动物0.1mg/kg的丁丙诺啡,持续48小时。48小时后,对动物实施安乐死,且将组织去除、固定和切片以用于组织学。
为了确定鼠科动物模型内的细胞定位,在50POI,在37℃下,使“对照”祖细胞感染表达荧光素酶的腺病毒载体4小时。如上文所述进行存活手术,且将细胞(1-1.5E6)直接注射到具有HA或不具有HA的胰腺中。刚好在成像之前,对小鼠进行腹腔注射荧光素K盐(150mg/kg),植入的细胞产生发光信号。10-15分钟后,利用IVIS动态光学成像仪,确定细胞在小鼠内的定位。
结果
在24小时时,除了别的器官外,在胰腺中发现了在没有HA的移植的情况下注射的“对照”细胞。然而,在72小时时,无法定位到大多数细胞,只有少数几个可识别的细胞保留在胰腺中。相反,在24小时和72小时时,观察到根据本发明的移植细胞作为细胞群成功地并入到胰腺中,且甚至在两周后仍存在。
实施例4
进行研究以评估接种在水凝胶中的肝干细胞的成活力和功能。使用分子探针钙黄绿素AM活细胞成活力试剂盒(Molecular Probes公司,俄勒冈州尤金市)来在培养物中评估成活力。膜透过性钙黄绿素AM通过活细胞中的酯酶分裂,产生细胞质绿色荧光。在1周的培养期间,测量培养基中的所分泌的白蛋白、转铁蛋白和脲的浓度水平。简单地讲,采集培养基上清液且在分析之前,将其在-20℃下进行冷冻保存。使用人白蛋白ELISA定量装置,通过ELISA测量白蛋白产量。利用血脲氮比色试剂,分析脲的产量。采用cytofluor Spectramax250多孔板读取仪,单独地测量所有的被分析物。
结果
图9和图10提供了结果。培养3周后,针对基因表达分析细胞。将mRNA表达水平标准化成GAPDH。所有的测量表示为与在透明质酸水凝胶中进行三维培养之前的初始肝干细胞群体相比的倍数变化。在两个试验性的透明质酸培养条件(HA和HA+胶原III+层粘连蛋白)下,当与初始群体表达相比时,EpCAM(7.72±1.42,9.04±1.82)和白蛋白(5.57±0.73,4.84±0.84)显著增加。在这两种条件下,成肝细胞分化标记物AFP也出现显著的减少(0.55±0.11,0.17±0.03)。此外,当与基本HA培养物相比时,HA+胶原III+层粘连蛋白在AFP表达上呈现出显著的减少。
实施例5
对具有不同浓度的HA和PEGDA的HA水凝胶的机械性能对在无血清培养基中培养的包埋hHpSCs的影响进行评估。使用的制剂汇总在下面的表3中:
通过按照4:1的比例混合硫醇-改性的羧甲基HA(CMHA-S)和聚(乙二醇)-二-丙烯酸酯(PEGDA)溶液,来得到用于每一制剂的最终KM-HA水凝胶组合物。在pH7.4下以特定的CMHA-S浓度和PEGDA浓度将特定浓度的CMHA-S和PEGDA干试剂分别在混合在KM中,且在37℃下温热30分钟以增强干试剂的溶解。在培养箱中,在37℃和5%二氧化碳/空气混合物条件下,在无菌条件下且在没有另外的介质的情况下,发生最大限度的水凝胶交联作用,持续1小时。此后,在测试之前,使水凝胶被供给有2.5毫升的HK介质且培养过夜。
对于扩散性分析,通过涡旋均质化水凝胶制剂且将其呈板状铺成约1毫米厚。在5%二氧化碳/空气的混合物下且在37℃下,在培养箱中,在无菌条件下且没有另外的介质的情况下,培养水凝胶1小时以在混合后进行最大限度的交联。然后,使样本补充有等体积的另外的KM,其中KM中具有2.5mg/ml(0.036mM)的与荧光素结合的70kDa的葡聚糖分子,在测试之前,使KM在整夜培养期间扩散至样本中。
使用光脱色荧光恢复(FRAP)系统测量HA水凝胶的扩散系数。出于成像目的,在样本平衡至室温后,对样本进行“孔中(In-well)”测试,而不必预先吸入D70-补充的KM。每个样本测试总计5个单独的30秒的光脱色斑(13.5-mW458/488nm激发氩激光器,脱色形状:直径为35um的圆),且通过单通道(LP505nm,绿色发射通道)获得单个的单向扫描预脱色图像、紧接着在光脱色结束后的单个的单向扫描图像、和此后28个单向扫描的延迟间隔为4.0秒的时间序列图像(256x256像素帧大小,0.9um/像素分辨率)以用于后处理。
结果
KM-HA水凝胶的刚度、粘弹性性质和粘度取决于CMHA-S的含量和PEGDA的含量。由于KM-HA水凝胶的粘度随着施力频率增大而减小,因此在较宽的施力频率范围内,KM-HA水凝胶保持了恒定的刚度同时具有完全弹性行为,并且具有剪切稀化。CMHA-S的含量和PEGDA的含量支配着KM-HA水凝胶的机械性能(图11a)。相反,由于KM-HA水凝胶的扩散特性类似于单独的Kubota培养基,因此KM-HA水凝胶的扩散特性为最佳的(图11b)。
肝干细胞群体与KM-HA水凝胶混合,且开始放弃其平面构造以有利于聚集成球状结构或折叠成复杂的3D结构,该两种结构都是分化的标记。培养1周后,细胞形态变得多样化且一些细胞尺寸上扩大至约15um,这是hHBs的特征。利用抗体对hHpSCs和hHBs的细胞表面标记物如EpCAM、CD44和CDH1进行的免疫染色证实分化。
在整个培养期间,用于KM-HA水凝胶的所有测试组合物中的hHpSCs以增加的浓度分泌AFP和白蛋白,而到第7天时为止,所有的KM-HA水凝胶中的脲合成平衡至类似水平(图12)。在培养1周后,在KM-HA水凝胶中接种的hHpSC群体细胞中的EpCAM的mRNA表达水平显著地高于2D-培养的hHpSC群体或新分离的hHBs的EpCAM的mRNA表达水平。在KM-HA水凝胶中,对于hHpSCs的NCAM的mRNA表达水平、AFP的mRNA表达水平和E-钙粘蛋白(CDH1)的mRNA表达水平也与2D-培养的hHpSC群体显著不同(图5)。
随着KM-HA水凝胶刚性增大(|G*|<200Pa),hHpSCs的分化标记物(NCAM,AFP,CDH1)和hHpSCs和hHBs共有的标记物的基因表达的定量测量逐渐减少且后来恢复(图5)。来自所有的水凝胶制剂的细胞表达EpCAM蛋白、NCAM蛋白和CD44蛋白;然而,CD44在具有1.2%CMHA-S或小于1.2%的CMHA-S的KM-HA制剂中出现富集,而NCAM在所有的KM-HA水凝胶中富集(图4)。
实施例6
评估HA在改善粘附机制的保留中的作用,其中该粘附机制可有助于培养细胞和解冻后保留功能。从胎肝分离出新鲜离体hHpSCs和成肝细胞,并将其冷冻保存在许多不同的冷冻保存缓冲液的一种冷冻保存缓冲液中,该种冷冻保存缓冲液补充有或未补充有0.5%或0.10%的透明质酸(HA)。更具体地,在冷冻保存溶液中以2×106个细胞/毫升冷冻样本,该冷冻保存溶液按重量计包含补充有10%的DMSO或10%的CryoStorTM-CS10(Biolife溶液)以及补充有0、0.05%或0.10%的HA水凝胶的培养基。如图13所示,在以控制方式在未交联的HA中冷冻细胞前,允许细胞在4℃下在冷冻保存溶液中平衡10分钟。
解冻时,将细胞制呈板状铺在覆盖有胶原III(1ug/cm2)的组织培养板上以促进干细胞附着。
结果
所测试的所有缓冲液在解冻时产生了高的存活率(80%-90%)(图14)。然而,补充HA显示出保存的细胞在附着到组织培养物表面的能力和被培养的能力上有了相当大的改善。对于在补充有少量透明质酸(0.05%或0.10%)的CS10等渗培养基中冷冻的细胞,观察到最佳结果。这些研究揭示了在无血清条件下冷冻保存新鲜离体的人肝祖细胞的改进方法,这提供了在科研和潜在的治疗应用中进行干细胞储存的更有效方法。
确定了细胞-细胞和细胞-基质粘附因子的表达。在冷冻保存样本中的细胞粘附分子的基因表达数据图的总结参见图15。观察到,冷冻在CS10+0.05%HA中的样本中的整联蛋白β1有最高表达(0.130±0.028,n=28)。当与新鲜样本中观察到的表达比较时,这为显著差异(0.069±0.007,n=24,p<0.01)。此外,与新鲜样本相比,冷冻在CS10+0.1%HA(0.049±0.006,n=20)和CS10+0.05%HA(0.064±0.003,n=16)中的细胞的CDH-1(E-钙粘蛋白)表达示出显著的增加(0.037±0.005,n=36,p<0.05)。
尽管已经结合本发明的具体实施方式描述了本发明,但是应理解,本发明还可进行改动且本申请旨在涵盖本发明的任何变化、用途或替换。总体来讲,本发明的原理包括这种偏离本发明公开内容的在本发明所属领域范围内的已知做法或惯例的内容以及可应用于上文提出的必要特征和下文的所附权利要求中的内容。
Claims (28)
1.一种混合物在制备治疗具有处于患病状态或功能失调状态的肝的对象的组织移植物中的用途,所述用途包括:
a.来自供体的肝细胞,所述肝细胞包括肝干细胞、成肝细胞、肝细胞的定向祖细胞和/或成熟的肝细胞;
b.将所述肝细胞与成血管细胞和/或星状细胞前体和一种或多种形成凝胶的生物材料混合以形成作为组织移植物的所述混合物,其中所述混合物包括至少下列细胞组合之一:成血管细胞和肝干细胞,成血管细胞和成肝细胞,或星状细胞前体和成肝细胞;其中,所述一种或多种生物材料中的至少一种衍生自硫醇-改性的羧甲基HA(CMHA-S),其中,所述混合物通过混合CMHA-S初始溶液,聚(乙二醇)-二-丙烯酸酯(PEG-DA)初始溶液和经过PEG-DA交联的细胞被制备成含有细胞的水凝胶溶液用于移植进入所述对象;其中CMHA-S初始溶液与PEG-DA初始溶液以4:1的比例混合, CMHA-S在水凝胶溶液中的浓度介于0.8%至1.6%(w/v)以及PEG-DA在水凝胶溶液的浓度介于0.4%至1.6%(w/v);
c.其中,所述治疗是通过将所述组织移植物直接引入到所述对象的肝上或肝中,其中,所述引入的细胞的基本上全部体内定位在所述肝的至少一部分中或所述肝的至少一部分上。
2.如权利要求1所述的用途,其中,所述用途还包括将所述组织移植物与营养培养基、信号分子、胞外基质蛋白或其组合混合。
3.如权利要求1或2所述的用途,其中,在步骤c中所述引入的细胞的基本上全部体内72小时后定位在所述肝的至少一部分中或所述肝的至少一部分上。
4.如权利要求1或2所述的用途,其中,所述供体为具有处于患病状态或功能失调状态中的肝的所述对象,且所述肝细胞自所述肝的未患病或者未功能失调的部分获取。
5.如权利要求1或2所述的用途,其中,所述供体为非自体同源的供体。
6.如权利要求1或2所述的用途,其中,所述供体为胎儿、新生儿、儿童或成人。
7.如权利要求1或2所述的用途,还包括另外的细胞,其中,所述另外的细胞包括内皮细胞、星状细胞、基质细胞、上皮干细胞、成熟实质细胞或其组合。
8.如权利要求2所述的用途,其中,所述信号分子包括成纤维细胞生长因子、肝细胞生长因子、表皮生长因子、血管内皮细胞生长因子VEGF、胰岛素样生长因子I、胰岛素样生长因子II IGF-II、制瘤素-M、白血病抑制因子LIF、白介素、转化生长因子-β TGF-β、肝细胞生长因子HGF、转铁蛋白、胰岛素、转铁蛋白/fe、三碘甲腺原氨酸、T3、胰高血糖素、糖皮质激素、生长激素、雌激素、雄激素、甲状腺激素类及其组合。
9.如利要求8所述的用途,其中,所述白介素为白介素6、白介素11、白介素13或其组合。
10.如权利要求1或2所述的用途,其中,所述组织移植物被培养在无血清培养基中。
11.如权利要求10所述的用途,其中,所述培养基包含胰岛素、转铁蛋白、脂类、钙、锌和硒。
12.如权利要求1或2所述的用途,其中,在将所述肝细胞引入到所述对象中之前,将所述肝细胞的悬浮液在所述生物材料内进行体外固化。
13.如权利要求1或2所述的用途,其中,所述组织移植物通过注射、能生物降解的覆盖物或海绵状物被引入。
14.一种或多种生物材料在制备治疗内脏处于患病状态或功能失调状态对象的组织移植物中的用途,所述用途包括:a.来自供体的肝细胞的悬浮液,所述肝细胞包括肝干细胞、成肝细胞、肝细胞的定向祖细胞和/或成熟的肝细胞;
b.将所述细胞悬浮液与成血管细胞和/或星状细胞前体和所述一种或多种生物材料混合以形成组织移植物,其中所述组织移植物包括至少下列细胞组合之一:成血管细胞和肝干细胞,成血管细胞和成肝细胞,或星状细胞前体和成肝细胞,其中,所述一种或多种生物材料中的至少一种衍生自硫醇-改性的羧甲基HA(CMHA-S),其中,所述组织移植物通过混合CMHA-S初始溶液,聚(乙二醇)-二-丙烯酸酯(PEG-DA)初始溶液和经过PEG-DA交联的细胞被制备成含有细胞的水凝胶溶液用于移植进入所述对象;其中CMHA-S初始溶液与PEG-DA初始溶液以4:1的比例混合, CMHA-S在水凝胶溶液中的浓度介于0.8%至1.6%(w/v)以及PEG-DA在水凝胶溶液的浓度介于0.4%至1.6%(w/v);
和
c.其中,所述治疗是通过将所述组织移植物直接引入到所述对象的肝上或肝中,
其中,所述引入的细胞的基本上全部体内定位在所述内脏的至少一部分中或所述内脏的至少一部分上。
15.如权利要求14所述的用途,其中所述用途还包括将所述细胞悬浮液与生长因子、细胞因子、另外的细胞或其组合混合以形成组织移植物。
16.肝细胞和成血管细胞和/或星状细胞前体和一种或多种形成水凝胶的前体的溶液的移植混合物在制备将所述肝细胞定位在肝的表面上、肝的内部中、或肝的表面上以及肝的内部中的制剂中的用途,其中,所述定位是通过在有效量的交联剂存在下,将含有所述肝细胞和所述溶液的制剂体内引入到肝的表面上、肝的内部中、或肝的表面上和肝的内部中,该制剂形成位于肝的表面上、肝的内部、或肝的表面上和肝的内部中的包含肝细胞的水凝胶,其中所述肝细胞包括肝干细胞、成肝细胞、肝细胞的定向祖细胞和/或成熟的肝细胞;其中所述形成水凝胶的前体为硫醇-改性的羧甲基HA(CMHA-S)和其中所述交联剂为聚(乙二醇)-二-丙烯酸酯(PEG-DA),其中CMHA-S的初始溶液与PEG-DA的初始溶液在移植混合物中以4:1的比例混合;其中CMHA-S在移植混合物中的浓度介于0.8%至1.6%(w/v)以及PEG-DA在移植混合物中的溶度介于0.4%至1.6%(w/v);其中所述移植混合物包括至少下列细胞组合之一:成血管细胞和肝干细胞,成血管细胞和成肝细胞,或星状细胞前体和成肝细胞。
17.如权利要求16所述的用途,其中,在至少12小时的时间段中,将所述肝细胞定位在肝的表面上、肝的内部中、或肝的表面上和肝的内部中。
18.如权利要求17所述的用途,其中,在至少24小时的时间段中,将所述肝细胞定位在肝的表面上、肝的内部中、或肝的表面上和肝的内部中。
19.如权利要求18所述的用途,其中,在至少48小时的时间段中,将所述肝细胞定位在肝的表面上、肝的内部中、或肝的表面上和肝的内部中。
20.如权利要求18所述的用途,其中,在至少72小时的时间段中,将所述肝细胞定位在肝的表面上、肝的内部中、或肝的表面上和肝的内部中。
21.如权利要求16所述的用途,其中,所述肝细胞不是肿瘤细胞、癌细胞或患病细胞。
22.如权利要求16所述的用途,其中,所述肝细胞为正常细胞、肿瘤细胞或癌细胞、或感染病原体的细胞,所述病原体选自病毒、细菌和疟疾。
23.如权利要求16所述的用途,其中,所述水凝胶具有的粘度在25Pa至520Pa的范围内。
24.如权利要求23所述的用途,其中,所述水凝胶具有的粘度在25Pa至165Pa的范围内。
25.如权利要求16所述的用途,其中,在有效量的交联剂存在下,将所述制剂引入到在肝的表面上形成的袋状物中。
26.如权利要求25所述的用途,其中,所述袋状物是由网膜、蜘蛛丝和/或昆虫丝制备的。
27.如权利要求26所述的用途,其中,所述水凝胶原位形成。
28.如权利要求16所述的用途,其中,
(i)所述水凝胶的前体包括透明质酸;
(ii)所述肝细胞选自肝干细胞、成肝细胞、肝细胞的定向祖细胞或成熟的肝细胞;
(iii)所述引入的细胞的基本上全部体内72小时后并入肝中。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US33244110P | 2010-05-07 | 2010-05-07 | |
| US61/332,441 | 2010-05-07 | ||
| CN2011800335141A CN102985130A (zh) | 2010-05-07 | 2011-05-06 | 移植来自实体组织的细胞的方法 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800335141A Division CN102985130A (zh) | 2010-05-07 | 2011-05-06 | 移植来自实体组织的细胞的方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN111281890A true CN111281890A (zh) | 2020-06-16 |
Family
ID=44902076
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800335141A Pending CN102985130A (zh) | 2010-05-07 | 2011-05-06 | 移植来自实体组织的细胞的方法 |
| CN202010091523.7A Pending CN111281890A (zh) | 2010-05-07 | 2011-05-06 | 移植来自实体组织的细胞的方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800335141A Pending CN102985130A (zh) | 2010-05-07 | 2011-05-06 | 移植来自实体组织的细胞的方法 |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US20110274666A1 (zh) |
| EP (1) | EP2566567A4 (zh) |
| JP (4) | JP6177687B2 (zh) |
| KR (4) | KR102289168B1 (zh) |
| CN (2) | CN102985130A (zh) |
| AR (1) | AR081906A1 (zh) |
| AU (1) | AU2011247984B2 (zh) |
| BR (1) | BR112012028265B1 (zh) |
| CA (2) | CA3146949A1 (zh) |
| CL (1) | CL2012003085A1 (zh) |
| CR (1) | CR20120603A (zh) |
| IL (3) | IL222857A (zh) |
| MX (3) | MX359678B (zh) |
| NZ (2) | NZ603913A (zh) |
| PH (1) | PH12012502176A1 (zh) |
| RU (1) | RU2736955C2 (zh) |
| SG (2) | SG185425A1 (zh) |
| TW (3) | TWI687518B (zh) |
| WO (1) | WO2011140428A1 (zh) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013010045A1 (en) | 2011-07-12 | 2013-01-17 | Biotime Inc. | Novel methods and formulations for orthopedic cell therapy |
| US8961617B2 (en) * | 2012-03-08 | 2015-02-24 | Liventa Bioscience, Inc. | Amnion and chorion constructs and uses thereof in abdominal surgery |
| US9533013B2 (en) * | 2013-03-13 | 2017-01-03 | University Of North Carolina At Chapel Hill | Method of treating pancreatic and liver conditions by endoscopic-mediated (or laparoscopic-mediated) transplantation of stem cells into/onto bile duct walls of particular regions of the biliary tree |
| EP2886644A1 (en) | 2013-12-20 | 2015-06-24 | Kallistem | Process for implementing in vitro spermatogenesis and associated device |
| US10765705B2 (en) | 2014-11-24 | 2020-09-08 | Prime Merger Sub, Llc | Visco-supplement compositions, and methods of use thereof |
| US20160213714A1 (en) * | 2015-01-23 | 2016-07-28 | Everon Biosciences, Inc. | Induction of cellular senescence for tissue therapies |
| CN106148266A (zh) * | 2015-04-20 | 2016-11-23 | 烟台赛泽生物技术有限公司 | 一种免疫细胞用培养基及该培养基的添加剂 |
| JP2016209303A (ja) * | 2015-05-08 | 2016-12-15 | レジエンス株式会社 | 肝組織を再生するための製剤 |
| US20170369849A1 (en) * | 2016-05-11 | 2017-12-28 | The University Of North Carolina At Chapel Hill | Compositions and methods for bioengineered tissues |
| US11160271B2 (en) | 2016-09-30 | 2021-11-02 | Taipei Veterans General Hospital | Anti-freezing agent for protecting biological tissue during freezing treatment and preparation method therefor |
| SG10202111093PA (en) * | 2017-04-06 | 2021-11-29 | Univ North Carolina Chapel Hill | Cryopreservation method |
| JP7539832B2 (ja) * | 2017-06-12 | 2024-08-26 | ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル | 細胞生着のためのパッチグラフト組成物 |
| EP4446363A3 (en) | 2018-05-03 | 2025-01-15 | CollPlant Ltd. | Dermal fillers and applications thereof |
| JP2020050625A (ja) | 2018-09-27 | 2020-04-02 | 株式会社北里コーポレーション | 卵巣組織の移植方法および卵胞活性化方法 |
| JP7350505B2 (ja) * | 2019-02-15 | 2023-09-26 | イビデン株式会社 | 生体試料を含む固化体 |
| WO2023042875A1 (ja) * | 2021-09-16 | 2023-03-23 | 富士フイルム株式会社 | ゲル形成キット及びその利用 |
| JP7440987B2 (ja) * | 2021-12-28 | 2024-02-29 | 株式会社ポル・メド・テック | 移植材料の製造方法、及び移植材料 |
| WO2024043306A1 (ja) * | 2022-08-24 | 2024-02-29 | 株式会社ヴィータ | 蛍光標識用組成物、蛍光プローブ、注入剤、シリンジ充填物、医療器具、医療用繊維素材、蛍光標識用組成物の製造方法、及び医療用繊維素材の製造方法 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5885829A (en) * | 1996-05-28 | 1999-03-23 | The Regents Of The University Of Michigan | Engineering oral tissues |
| US20020098559A1 (en) * | 1999-03-22 | 2002-07-25 | Opara Emmanuel C. | Methods of encapsulating cells |
| CN101384705A (zh) * | 2005-11-16 | 2009-03-11 | 北卡罗来纳大学教堂山分校 | 用于肝祖细胞扩增或分化的细胞外基质组分 |
| US20090130756A1 (en) * | 2007-11-20 | 2009-05-21 | Pioneer Surgical Orthobiologics,Inc. | Cryopreservation of cells using cross-linked bioactive hydrogel matrix particles |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6231881B1 (en) * | 1992-02-24 | 2001-05-15 | Anton-Lewis Usala | Medium and matrix for long-term proliferation of cells |
| US20040138329A1 (en) * | 1992-04-20 | 2004-07-15 | Board Of Regents Of The University Of Texas System | Gels for encapsulation of biological materials |
| EP0655910A4 (en) * | 1992-07-29 | 1996-02-28 | Univ Washington | USE OF A BAG FOR IMPLANTING LIVING CELLS. |
| US5709854A (en) * | 1993-04-30 | 1998-01-20 | Massachusetts Institute Of Technology | Tissue formation by injecting a cell-polymeric solution that gels in vivo |
| US5681587A (en) * | 1995-10-06 | 1997-10-28 | Desmos, Inc. | Growth of adult pancreatic islet cells |
| US6482231B1 (en) * | 1995-11-20 | 2002-11-19 | Giovanni Abatangelo | Biological material for the repair of connective tissue defects comprising mesenchymal stem cells and hyaluronic acid derivative |
| US6224893B1 (en) * | 1997-04-11 | 2001-05-01 | Massachusetts Institute Of Technology | Semi-interpenetrating or interpenetrating polymer networks for drug delivery and tissue engineering |
| JP3014343B2 (ja) * | 1997-06-06 | 2000-02-28 | 科学技術振興事業団 | 肝細胞の培養方法 |
| IT1293484B1 (it) * | 1997-06-11 | 1999-03-01 | Fidia Advanced Biopolymers Srl | Materiale biologico comprendente una efficiente coltura di cellule e una matrice tridimensionale biocompatibile e biodegradabile |
| US6129911A (en) * | 1998-07-10 | 2000-10-10 | Rhode Island Hospital, A Lifespan Partner | Liver stem cell |
| AU779706B2 (en) * | 1999-01-19 | 2005-02-10 | University Of North Carolina At Chapel Hill, The | Human liver progenitors |
| US6592623B1 (en) * | 1999-08-31 | 2003-07-15 | Virginia Commonwealth University Intellectual Property Foundation | Engineered muscle |
| JP2002542883A (ja) * | 1999-04-30 | 2002-12-17 | マサチューセッツ ジェネラル ホスピタル | 微細加工した2次元鋳型を用いる血管新生組織の加工 |
| AU6092900A (en) * | 1999-07-14 | 2001-02-05 | Board Of Trustees Of The Leland Stanford Junior University | Animals comprising human hepatocellular tissue |
| US6960576B2 (en) | 1999-09-13 | 2005-11-01 | Bristol-Myers Squibb Pharma Company | Hydroxyalkanoylaminolactams and related structures as inhibitors of Aβ protein production |
| RU2165263C1 (ru) * | 2000-06-23 | 2001-04-20 | Зыбин Дмитрий Владимирович | Способ лечения сахарного диабета |
| US7291673B2 (en) * | 2000-06-02 | 2007-11-06 | Eidgenossiche Technische Hochschule Zurich | Conjugate addition reactions for the controlled delivery of pharmaceutically active compounds |
| US6435190B1 (en) * | 2000-06-14 | 2002-08-20 | Syde A. Taheri | Autogenous cell patch cardio myoplasty and advanced muscle graft implantation system |
| MY130475A (en) * | 2000-08-25 | 2007-06-29 | Contura As | Polyacrylamide hydrogel and its use as an endoprosthesis |
| WO2002044276A2 (en) * | 2000-11-28 | 2002-06-06 | Focal, Inc. | Polyalkylene glycol viscosity-enhancing polymeric formulations |
| US20030077566A1 (en) * | 2001-09-10 | 2003-04-24 | Palasz Andrzej T. | Method for cryopreserving mammalian cells and tissues |
| CA2494316A1 (en) * | 2002-08-06 | 2004-02-12 | Genvec, Inc. | Improved injection system |
| WO2004034890A2 (en) * | 2002-10-17 | 2004-04-29 | Vacanti, Joseph, P. | Biological scaffolding material |
| WO2004098285A2 (en) * | 2003-05-08 | 2004-11-18 | Cellartis Ab | Cryopreservation of human blastocyst-derived stem cells by use of a closed straw vitrification method |
| BRPI0413207A (pt) * | 2003-09-02 | 2006-10-03 | Univ North Carolina | conjugados de polìmero biodegradável - ligante e o uso dos mesmos no isolamento de subpopulações celulares e na criopreservação, cultura e transplante de células |
| WO2005028640A1 (en) * | 2003-09-19 | 2005-03-31 | Newsouth Innovations Pty Limited | Method for isolating hepatocytes |
| WO2005056763A2 (en) * | 2003-12-04 | 2005-06-23 | University Of Utah Research Foundation | Process and formulation to improve viability of stored cells and tissue |
| US7884185B2 (en) * | 2004-07-28 | 2011-02-08 | University Of Delaware | Hydrogels and uses thereof |
| US8828433B2 (en) * | 2005-04-19 | 2014-09-09 | Advanced Cardiovascular Systems, Inc. | Hydrogel bioscaffoldings and biomedical device coatings |
| EP2033513A1 (en) * | 2006-05-30 | 2009-03-11 | Instituto Nacional De Investigacion y Tecnologia agraria y Alimentaria (INIA) | Procedure for the preparation of unilamellar vesicles for cryopreservation and the culture of stem cells and embryos |
| TW200817019A (en) * | 2006-07-10 | 2008-04-16 | Univ Columbia | De novo formation and regeneration of vascularized tissue from tissue progenitor cells and vascular progenitor cells |
| CA2663722C (en) * | 2006-09-21 | 2014-12-09 | Purdue Research Foundation | Collagen preparation and method of isolation |
| WO2008101215A1 (en) * | 2007-02-16 | 2008-08-21 | Varian Medical Systems Technologies, Inc. | Preparative regimen for engraftment, growth and differentiation of non-hematopoeitic cells in vivo |
| BRPI0808696A2 (pt) * | 2007-03-06 | 2015-06-23 | Univ North Carolina | Complexos de hiluronanas, outros componentes de matriz, hormônios e fatores de crescimento para manutenção, expansão e/ou diferenciação de células |
| US20080299177A1 (en) * | 2007-06-06 | 2008-12-04 | Biovaluation & Analysis, Inc. | Supramolecular Complexes for Use in Acoustically Mediated Intracellular Drug Delivery in vivo |
| JP2010529855A (ja) * | 2007-06-15 | 2010-09-02 | ユニバーシティ オブ ノース カロライナ アット チャペル ヒル | 間葉系フィーダー細胞由来のパラ分泌シグナルならびにそれを用いる肝前駆体の増加および分化の調整 |
| GB0713079D0 (en) * | 2007-07-05 | 2007-08-15 | Ucl Business Plc | biomaterial scaffolds with defined stiffness |
| EP2185575B1 (en) * | 2007-08-15 | 2013-03-13 | Ramot at Tel-Aviv University Ltd. | Polypeptides, matrices, hydrogels and methods of using same for tissue regeneration and repair |
| EP2190562A2 (en) * | 2007-08-20 | 2010-06-02 | Do-Coop Technologies Ltd | Enriched nanostructure composition |
| CN101618235A (zh) * | 2008-07-01 | 2010-01-06 | 中国人民解放军军事医学科学院基础医学研究所 | 一种基于opf水凝胶为液态支架的可注射性心肌组织工程产品 |
| US9216188B2 (en) * | 2008-09-04 | 2015-12-22 | The General Hospital Corporation | Hydrogels for vocal cord and soft tissue augmentation and repair |
| US20100092533A1 (en) * | 2008-10-15 | 2010-04-15 | Joshua Stopek | Bioabsorbable Surgical Composition |
| EP2221362A1 (en) * | 2009-02-19 | 2010-08-25 | Naturin GmbH & Co | Method for the cryopreservation of cells, artificial cell constructs or three-dimensional complex tissues assemblies |
-
2011
- 2011-05-06 MX MX2012012836A patent/MX359678B/es active IP Right Grant
- 2011-05-06 RU RU2015155133A patent/RU2736955C2/ru active
- 2011-05-06 BR BR112012028265-4A patent/BR112012028265B1/pt active IP Right Grant
- 2011-05-06 NZ NZ603913A patent/NZ603913A/en not_active IP Right Cessation
- 2011-05-06 NZ NZ630598A patent/NZ630598A/en not_active IP Right Cessation
- 2011-05-06 AR ARP110101582A patent/AR081906A1/es not_active Application Discontinuation
- 2011-05-06 KR KR1020197033328A patent/KR102289168B1/ko active IP Right Grant
- 2011-05-06 SG SG2012081444A patent/SG185425A1/en unknown
- 2011-05-06 CA CA3146949A patent/CA3146949A1/en active Pending
- 2011-05-06 WO PCT/US2011/035498 patent/WO2011140428A1/en active Application Filing
- 2011-05-06 SG SG10201503582YA patent/SG10201503582YA/en unknown
- 2011-05-06 CN CN2011800335141A patent/CN102985130A/zh active Pending
- 2011-05-06 TW TW106139014A patent/TWI687518B/zh not_active IP Right Cessation
- 2011-05-06 PH PH1/2012/502176A patent/PH12012502176A1/en unknown
- 2011-05-06 KR KR1020217024885A patent/KR102493613B1/ko active IP Right Grant
- 2011-05-06 CN CN202010091523.7A patent/CN111281890A/zh active Pending
- 2011-05-06 CA CA2798458A patent/CA2798458C/en active Active
- 2011-05-06 AU AU2011247984A patent/AU2011247984B2/en not_active Ceased
- 2011-05-06 KR KR1020197002829A patent/KR102230864B1/ko active IP Right Grant
- 2011-05-06 TW TW108133407A patent/TW202006136A/zh unknown
- 2011-05-06 TW TW100115984A patent/TW201202424A/zh unknown
- 2011-05-06 JP JP2013509287A patent/JP6177687B2/ja active Active
- 2011-05-06 EP EP11778410.8A patent/EP2566567A4/en not_active Withdrawn
- 2011-05-06 US US13/102,939 patent/US20110274666A1/en not_active Abandoned
- 2011-05-06 KR KR1020127032025A patent/KR20130108996A/ko active Application Filing
-
2012
- 2012-11-05 IL IL222857A patent/IL222857A/en active IP Right Grant
- 2012-11-05 MX MX2019009549A patent/MX2019009549A/es unknown
- 2012-11-05 CL CL2012003085A patent/CL2012003085A1/es unknown
- 2012-11-05 MX MX2020002474A patent/MX2020002474A/es unknown
- 2012-11-29 CR CR20120603A patent/CR20120603A/es unknown
-
2016
- 2016-05-08 IL IL245535A patent/IL245535B/en active IP Right Grant
-
2017
- 2017-03-15 JP JP2017050041A patent/JP6891010B2/ja not_active Expired - Fee Related
-
2019
- 2019-06-19 JP JP2019113597A patent/JP6987811B2/ja active Active
-
2020
- 2020-09-07 IL IL277184A patent/IL277184A/en unknown
-
2021
- 2021-11-30 JP JP2021194048A patent/JP7358441B2/ja active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5885829A (en) * | 1996-05-28 | 1999-03-23 | The Regents Of The University Of Michigan | Engineering oral tissues |
| US20020098559A1 (en) * | 1999-03-22 | 2002-07-25 | Opara Emmanuel C. | Methods of encapsulating cells |
| CN101384705A (zh) * | 2005-11-16 | 2009-03-11 | 北卡罗来纳大学教堂山分校 | 用于肝祖细胞扩增或分化的细胞外基质组分 |
| US20090130756A1 (en) * | 2007-11-20 | 2009-05-21 | Pioneer Surgical Orthobiologics,Inc. | Cryopreservation of cells using cross-linked bioactive hydrogel matrix particles |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7358441B2 (ja) | 膵臓に細胞を移植するための薬剤の製造のための混合物の使用 | |
| US9750770B2 (en) | Method of treating pancreatic and liver conditions by endoscopic-mediated (or laparoscopic-mediated) transplantation of stem cells into/onto bile duct walls of particular regions of the biliary tree | |
| AU2019271995B2 (en) | Method of engrafting cells from solid tissues | |
| RU2574364C2 (ru) | Способ трансплантации клеток из плотных тканей | |
| BR122021002798B1 (pt) | Método de criopreservação de células |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| RJ01 | Rejection of invention patent application after publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20200616 |