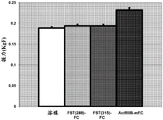
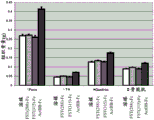
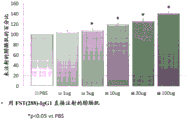
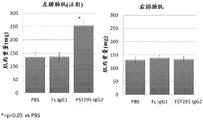
CN106795224B - 用促滤泡素抑制素多肽治疗病症的方法和组合物 - Google Patents
用促滤泡素抑制素多肽治疗病症的方法和组合物 Download PDFInfo
- Publication number
- CN106795224B CN106795224B CN201580041740.2A CN201580041740A CN106795224B CN 106795224 B CN106795224 B CN 106795224B CN 201580041740 A CN201580041740 A CN 201580041740A CN 106795224 B CN106795224 B CN 106795224B
- Authority
- CN
- China
- Prior art keywords
- follistatin
- fst
- muscle
- polypeptides
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 225
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 222
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 221
- 239000000203 mixture Substances 0.000 title claims description 34
- 108010014612 Follistatin Proteins 0.000 title abstract description 400
- 102000016970 Follistatin Human genes 0.000 title abstract description 400
- 238000000034 method Methods 0.000 title description 30
- 210000003205 muscle Anatomy 0.000 claims description 117
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 49
- 150000007523 nucleic acids Chemical class 0.000 claims description 27
- 206010013801 Duchenne Muscular Dystrophy Diseases 0.000 claims description 24
- 230000001965 increasing effect Effects 0.000 claims description 24
- 108020004707 nucleic acids Proteins 0.000 claims description 21
- 102000039446 nucleic acids Human genes 0.000 claims description 21
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 15
- 239000008194 pharmaceutical composition Substances 0.000 claims description 7
- 239000000539 dimer Substances 0.000 claims description 6
- 230000000694 effects Effects 0.000 abstract description 62
- 108020001507 fusion proteins Proteins 0.000 abstract description 33
- 102000037865 fusion proteins Human genes 0.000 abstract description 33
- 230000009885 systemic effect Effects 0.000 abstract description 18
- 101000931668 Homo sapiens Follistatin Proteins 0.000 abstract description 9
- 102000050536 human FST Human genes 0.000 abstract description 9
- 230000014759 maintenance of location Effects 0.000 abstract description 3
- 230000002035 prolonged effect Effects 0.000 abstract description 3
- 108090000623 proteins and genes Proteins 0.000 description 94
- 235000018102 proteins Nutrition 0.000 description 75
- 102000004169 proteins and genes Human genes 0.000 description 75
- 210000004027 cell Anatomy 0.000 description 53
- 235000001014 amino acid Nutrition 0.000 description 50
- 229940024606 amino acid Drugs 0.000 description 46
- 150000001413 amino acids Chemical class 0.000 description 44
- 241000699670 Mus sp. Species 0.000 description 43
- 108010059616 Activins Proteins 0.000 description 37
- 102000005606 Activins Human genes 0.000 description 37
- 239000000488 activin Substances 0.000 description 37
- 230000027455 binding Effects 0.000 description 37
- 230000014509 gene expression Effects 0.000 description 32
- 239000003446 ligand Substances 0.000 description 30
- 210000001519 tissue Anatomy 0.000 description 29
- 238000011282 treatment Methods 0.000 description 29
- 108060003951 Immunoglobulin Proteins 0.000 description 28
- 102000018358 immunoglobulin Human genes 0.000 description 28
- 230000004927 fusion Effects 0.000 description 27
- 210000002027 skeletal muscle Anatomy 0.000 description 25
- 239000013598 vector Substances 0.000 description 24
- 102000012673 Follicle Stimulating Hormone Human genes 0.000 description 22
- 108010079345 Follicle Stimulating Hormone Proteins 0.000 description 22
- 229940028334 follicle stimulating hormone Drugs 0.000 description 22
- 239000003981 vehicle Substances 0.000 description 22
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 20
- 229920000669 heparin Polymers 0.000 description 20
- 229960002897 heparin Drugs 0.000 description 20
- 102100039939 Growth/differentiation factor 8 Human genes 0.000 description 16
- 108010056852 Myostatin Proteins 0.000 description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 16
- 150000001875 compounds Chemical class 0.000 description 15
- 230000035772 mutation Effects 0.000 description 15
- 230000002829 reductive effect Effects 0.000 description 14
- 230000013595 glycosylation Effects 0.000 description 13
- 238000006206 glycosylation reaction Methods 0.000 description 13
- 210000002966 serum Anatomy 0.000 description 12
- 239000003656 tris buffered saline Substances 0.000 description 12
- 238000011870 unpaired t-test Methods 0.000 description 12
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 11
- 239000013612 plasmid Substances 0.000 description 11
- -1 GDF8 Proteins 0.000 description 10
- 108010076504 Protein Sorting Signals Proteins 0.000 description 10
- 210000000577 adipose tissue Anatomy 0.000 description 10
- 230000001105 regulatory effect Effects 0.000 description 10
- 235000000346 sugar Nutrition 0.000 description 10
- 230000001225 therapeutic effect Effects 0.000 description 10
- 201000006935 Becker muscular dystrophy Diseases 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 9
- 206010028289 Muscle atrophy Diseases 0.000 description 9
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- 108010023079 activin B Proteins 0.000 description 9
- 230000000875 corresponding effect Effects 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- 239000013604 expression vector Substances 0.000 description 9
- 230000006870 function Effects 0.000 description 9
- 238000001727 in vivo Methods 0.000 description 9
- 239000002502 liposome Substances 0.000 description 9
- 238000004519 manufacturing process Methods 0.000 description 9
- 230000004048 modification Effects 0.000 description 9
- 238000012986 modification Methods 0.000 description 9
- 201000006938 muscular dystrophy Diseases 0.000 description 9
- 230000001177 retroviral effect Effects 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 238000007910 systemic administration Methods 0.000 description 9
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 8
- 235000018417 cysteine Nutrition 0.000 description 8
- 238000012217 deletion Methods 0.000 description 8
- 230000037430 deletion Effects 0.000 description 8
- 210000003527 eukaryotic cell Anatomy 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 230000037257 muscle growth Effects 0.000 description 8
- 201000000585 muscular atrophy Diseases 0.000 description 8
- UBWXUGDQUBIEIZ-UHFFFAOYSA-N (13-methyl-3-oxo-2,6,7,8,9,10,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-17-yl) 3-phenylpropanoate Chemical compound CC12CCC(C3CCC(=O)C=C3CC3)C3C1CCC2OC(=O)CCC1=CC=CC=C1 UBWXUGDQUBIEIZ-UHFFFAOYSA-N 0.000 description 7
- 108020004414 DNA Proteins 0.000 description 7
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 7
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 7
- 210000004899 c-terminal region Anatomy 0.000 description 7
- 238000003776 cleavage reaction Methods 0.000 description 7
- 230000005764 inhibitory process Effects 0.000 description 7
- 239000002773 nucleotide Substances 0.000 description 7
- 125000003729 nucleotide group Chemical group 0.000 description 7
- 229920001223 polyethylene glycol Polymers 0.000 description 7
- 230000007017 scission Effects 0.000 description 7
- 230000003442 weekly effect Effects 0.000 description 7
- 102100040898 Growth/differentiation factor 11 Human genes 0.000 description 6
- 230000010556 Heparin Binding Activity Effects 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- 230000004071 biological effect Effects 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 208000035475 disorder Diseases 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 230000012010 growth Effects 0.000 description 6
- 108091033319 polynucleotide Proteins 0.000 description 6
- 102000040430 polynucleotide Human genes 0.000 description 6
- 239000002157 polynucleotide Substances 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 210000001236 prokaryotic cell Anatomy 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 108010069091 Dystrophin Proteins 0.000 description 5
- 241000588724 Escherichia coli Species 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 5
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 5
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 5
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 5
- 208000029578 Muscle disease Diseases 0.000 description 5
- 208000021642 Muscular disease Diseases 0.000 description 5
- 230000009471 action Effects 0.000 description 5
- 238000007792 addition Methods 0.000 description 5
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 5
- 230000006378 damage Effects 0.000 description 5
- 238000006471 dimerization reaction Methods 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 238000007918 intramuscular administration Methods 0.000 description 5
- 238000010255 intramuscular injection Methods 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000011159 matrix material Substances 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 239000011347 resin Substances 0.000 description 5
- 229920005989 resin Polymers 0.000 description 5
- 230000011664 signaling Effects 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 241000894007 species Species 0.000 description 5
- 239000003381 stabilizer Substances 0.000 description 5
- 238000010254 subcutaneous injection Methods 0.000 description 5
- 239000007929 subcutaneous injection Substances 0.000 description 5
- 241000701447 unidentified baculovirus Species 0.000 description 5
- 238000011740 C57BL/6 mouse Methods 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 241000238631 Hexapoda Species 0.000 description 4
- 101000893545 Homo sapiens Growth/differentiation factor 11 Proteins 0.000 description 4
- 206010028372 Muscular weakness Diseases 0.000 description 4
- 238000005481 NMR spectroscopy Methods 0.000 description 4
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 4
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- 102000003978 Tissue Plasminogen Activator Human genes 0.000 description 4
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 239000001506 calcium phosphate Substances 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 230000000295 complement effect Effects 0.000 description 4
- 230000004069 differentiation Effects 0.000 description 4
- 201000009338 distal myopathy Diseases 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 238000001415 gene therapy Methods 0.000 description 4
- 235000011187 glycerol Nutrition 0.000 description 4
- 229940072221 immunoglobulins Drugs 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 239000007927 intramuscular injection Substances 0.000 description 4
- 150000002632 lipids Chemical class 0.000 description 4
- VDXZNPDIRNWWCW-JFTDCZMZSA-N melittin Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(N)=O)CC1=CNC2=CC=CC=C12 VDXZNPDIRNWWCW-JFTDCZMZSA-N 0.000 description 4
- 210000002161 motor neuron Anatomy 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 239000003755 preservative agent Substances 0.000 description 4
- 230000000750 progressive effect Effects 0.000 description 4
- 230000028327 secretion Effects 0.000 description 4
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 229960000187 tissue plasminogen activator Drugs 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 3
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 3
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 3
- 208000030507 AIDS Diseases 0.000 description 3
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 3
- 241000416162 Astragalus gummifer Species 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 208000037149 Facioscapulohumeral dystrophy Diseases 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 102000005720 Glutathione transferase Human genes 0.000 description 3
- 108010070675 Glutathione transferase Proteins 0.000 description 3
- 206010020880 Hypertrophy Diseases 0.000 description 3
- 208000026350 Inborn Genetic disease Diseases 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- 240000007472 Leucaena leucocephala Species 0.000 description 3
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 208000010428 Muscle Weakness Diseases 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 230000004988 N-glycosylation Effects 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- 239000004365 Protease Substances 0.000 description 3
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 3
- 241000714474 Rous sarcoma virus Species 0.000 description 3
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 102000043168 TGF-beta family Human genes 0.000 description 3
- 108091085018 TGF-beta family Proteins 0.000 description 3
- 239000004473 Threonine Substances 0.000 description 3
- 229920001615 Tragacanth Polymers 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 108010023082 activin A Proteins 0.000 description 3
- 230000004075 alteration Effects 0.000 description 3
- 238000005571 anion exchange chromatography Methods 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 235000012216 bentonite Nutrition 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 210000000988 bone and bone Anatomy 0.000 description 3
- 244000309466 calf Species 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 238000001246 colloidal dispersion Methods 0.000 description 3
- 239000003636 conditioned culture medium Substances 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 239000006185 dispersion Substances 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 239000003623 enhancer Substances 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- 235000019441 ethanol Nutrition 0.000 description 3
- 208000008570 facioscapulohumeral muscular dystrophy Diseases 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 101150004578 gdf-8 gene Proteins 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 238000002523 gelfiltration Methods 0.000 description 3
- 208000016361 genetic disease Diseases 0.000 description 3
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 3
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 210000002414 leg Anatomy 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 230000020763 muscle atrophy Effects 0.000 description 3
- 210000002569 neuron Anatomy 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 239000006072 paste Substances 0.000 description 3
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 3
- 150000003904 phospholipids Chemical class 0.000 description 3
- 239000006187 pill Substances 0.000 description 3
- 230000001817 pituitary effect Effects 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 230000004952 protein activity Effects 0.000 description 3
- 230000017854 proteolysis Effects 0.000 description 3
- 230000000717 retained effect Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 235000012239 silicon dioxide Nutrition 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 239000000375 suspending agent Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- 239000000454 talc Substances 0.000 description 3
- 235000012222 talc Nutrition 0.000 description 3
- 229910052623 talc Inorganic materials 0.000 description 3
- 238000011200 topical administration Methods 0.000 description 3
- 235000010487 tragacanth Nutrition 0.000 description 3
- 239000000196 tragacanth Substances 0.000 description 3
- 229940116362 tragacanth Drugs 0.000 description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 3
- 230000003313 weakening effect Effects 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 108010016587 288-amino acid isoform follistatin Proteins 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- 241000701822 Bovine papillomavirus Species 0.000 description 2
- 206010006895 Cachexia Diseases 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 2
- 102000008186 Collagen Human genes 0.000 description 2
- 108010035532 Collagen Proteins 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- 102000001039 Dystrophin Human genes 0.000 description 2
- 108010013369 Enteropeptidase Proteins 0.000 description 2
- 102100029727 Enteropeptidase Human genes 0.000 description 2
- 102000009109 Fc receptors Human genes 0.000 description 2
- 108010087819 Fc receptors Proteins 0.000 description 2
- 102000019203 Follistatin-Related Proteins Human genes 0.000 description 2
- 108010012820 Follistatin-Related Proteins Proteins 0.000 description 2
- 208000024412 Friedreich ataxia Diseases 0.000 description 2
- 241000206672 Gelidium Species 0.000 description 2
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 2
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 2
- 101710194452 Growth/differentiation factor 11 Proteins 0.000 description 2
- 241000713858 Harvey murine sarcoma virus Species 0.000 description 2
- 101710154606 Hemagglutinin Proteins 0.000 description 2
- 102000008100 Human Serum Albumin Human genes 0.000 description 2
- 108091006905 Human Serum Albumin Proteins 0.000 description 2
- 102000002746 Inhibins Human genes 0.000 description 2
- 108010004250 Inhibins Proteins 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- 102100022745 Laminin subunit alpha-2 Human genes 0.000 description 2
- 201000009342 Limb-girdle muscular dystrophy Diseases 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 2
- 108010036176 Melitten Proteins 0.000 description 2
- 241000713869 Moloney murine leukemia virus Species 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 206010068871 Myotonic dystrophy Diseases 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 230000004989 O-glycosylation Effects 0.000 description 2
- 201000009110 Oculopharyngeal muscular dystrophy Diseases 0.000 description 2
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 2
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- 101710176177 Protein A56 Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 210000001766 X chromosome Anatomy 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- 230000001594 aberrant effect Effects 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 235000010419 agar Nutrition 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 230000003042 antagnostic effect Effects 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000000440 bentonite Substances 0.000 description 2
- 229910000278 bentonite Inorganic materials 0.000 description 2
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 210000000845 cartilage Anatomy 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 229920001436 collagen Polymers 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 201000006815 congenital muscular dystrophy Diseases 0.000 description 2
- 239000013068 control sample Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 230000022811 deglycosylation Effects 0.000 description 2
- 201000001981 dermatomyositis Diseases 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 230000001804 emulsifying effect Effects 0.000 description 2
- 210000003414 extremity Anatomy 0.000 description 2
- 239000003925 fat Substances 0.000 description 2
- 235000019197 fats Nutrition 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 239000000185 hemagglutinin Substances 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 238000009396 hybridization Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 239000003701 inert diluent Substances 0.000 description 2
- 239000000893 inhibin Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000008297 liquid dosage form Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 239000000693 micelle Substances 0.000 description 2
- 206010028417 myasthenia gravis Diseases 0.000 description 2
- 208000018360 neuromuscular disease Diseases 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 239000004006 olive oil Substances 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 239000000816 peptidomimetic Substances 0.000 description 2
- 210000000578 peripheral nerve Anatomy 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 239000004626 polylactic acid Substances 0.000 description 2
- 102000054765 polymorphisms of proteins Human genes 0.000 description 2
- 208000005987 polymyositis Diseases 0.000 description 2
- 230000001323 posttranslational effect Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000003380 propellant Substances 0.000 description 2
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 208000001076 sarcopenia Diseases 0.000 description 2
- 238000002864 sequence alignment Methods 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 208000002320 spinal muscular atrophy Diseases 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 230000008467 tissue growth Effects 0.000 description 2
- 230000017423 tissue regeneration Effects 0.000 description 2
- 238000011883 total knee arthroplasty Methods 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- 229910000391 tricalcium phosphate Inorganic materials 0.000 description 2
- 229940078499 tricalcium phosphate Drugs 0.000 description 2
- 235000019731 tricalcium phosphate Nutrition 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- 210000005253 yeast cell Anatomy 0.000 description 2
- SBKVPJHMSUXZTA-MEJXFZFPSA-N (2S)-2-[[(2S)-2-[[(2S)-1-[(2S)-5-amino-2-[[2-[[(2S)-1-[(2S)-6-amino-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-3-(1H-indol-3-yl)propanoyl]amino]-3-(1H-imidazol-4-yl)propanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-4-methylpentanoyl]amino]-5-oxopentanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]acetyl]amino]-5-oxopentanoyl]pyrrolidine-2-carbonyl]amino]-4-methylsulfanylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoic acid Chemical compound C([C@@H](C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)C1=CNC=N1 SBKVPJHMSUXZTA-MEJXFZFPSA-N 0.000 description 1
- KILNVBDSWZSGLL-KXQOOQHDSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCC KILNVBDSWZSGLL-KXQOOQHDSA-N 0.000 description 1
- NRJAVPSFFCBXDT-HUESYALOSA-N 1,2-distearoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCCCC NRJAVPSFFCBXDT-HUESYALOSA-N 0.000 description 1
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 1
- 229940058015 1,3-butylene glycol Drugs 0.000 description 1
- AXTGDCSMTYGJND-UHFFFAOYSA-N 1-dodecylazepan-2-one Chemical compound CCCCCCCCCCCCN1CCCCCC1=O AXTGDCSMTYGJND-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- GZCWLCBFPRFLKL-UHFFFAOYSA-N 1-prop-2-ynoxypropan-2-ol Chemical compound CC(O)COCC#C GZCWLCBFPRFLKL-UHFFFAOYSA-N 0.000 description 1
- DJQYYYCQOZMCRC-UHFFFAOYSA-N 2-aminopropane-1,3-dithiol Chemical compound SCC(N)CS DJQYYYCQOZMCRC-UHFFFAOYSA-N 0.000 description 1
- HVCOBJNICQPDBP-UHFFFAOYSA-N 3-[3-[3,5-dihydroxy-6-methyl-4-(3,4,5-trihydroxy-6-methyloxan-2-yl)oxyoxan-2-yl]oxydecanoyloxy]decanoic acid;hydrate Chemical compound O.OC1C(OC(CC(=O)OC(CCCCCCC)CC(O)=O)CCCCCCC)OC(C)C(O)C1OC1C(O)C(O)C(O)C(C)O1 HVCOBJNICQPDBP-UHFFFAOYSA-N 0.000 description 1
- OSJPPGNTCRNQQC-UWTATZPHSA-N 3-phospho-D-glyceric acid Chemical compound OC(=O)[C@H](O)COP(O)(O)=O OSJPPGNTCRNQQC-UWTATZPHSA-N 0.000 description 1
- 208000037415 AIDS wasting syndrome Diseases 0.000 description 1
- 102000013563 Acid Phosphatase Human genes 0.000 description 1
- 108010051457 Acid Phosphatase Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 239000004382 Amylase Substances 0.000 description 1
- 102000013142 Amylases Human genes 0.000 description 1
- 108010065511 Amylases Proteins 0.000 description 1
- 235000003276 Apios tuberosa Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000010744 Arachis villosulicarpa Nutrition 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 206010003694 Atrophy Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000714235 Avian retrovirus Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 208000037088 Chromosome Breakage Diseases 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 108090000317 Chymotrypsin Proteins 0.000 description 1
- 101710094648 Coat protein Proteins 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 102000004420 Creatine Kinase Human genes 0.000 description 1
- 108010042126 Creatine kinase Proteins 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 108700034637 EC 3.2.-.- Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 102000002322 Egg Proteins Human genes 0.000 description 1
- 108010000912 Egg Proteins Proteins 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 241000701959 Escherichia virus Lambda Species 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010054218 Factor VIII Proteins 0.000 description 1
- 102000001690 Factor VIII Human genes 0.000 description 1
- 108010074860 Factor Xa Proteins 0.000 description 1
- 101150050927 Fcgrt gene Proteins 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- 206010061159 Foot deformity Diseases 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- KOSRFJWDECSPRO-WDSKDSINSA-N Glu-Glu Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(O)=O KOSRFJWDECSPRO-WDSKDSINSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 1
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 1
- 229930186217 Glycolipid Natural products 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 208000003577 HIV wasting syndrome Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 1
- 206010020100 Hip fracture Diseases 0.000 description 1
- 102000009331 Homeodomain Proteins Human genes 0.000 description 1
- 108010048671 Homeodomain Proteins Proteins 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 206010024305 Leukaemia monocytic Diseases 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 102000043129 MHC class I family Human genes 0.000 description 1
- 108091054437 MHC class I family Proteins 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 108010038049 Mating Factor Proteins 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 201000002169 Mitochondrial myopathy Diseases 0.000 description 1
- 208000034819 Mobility Limitation Diseases 0.000 description 1
- 208000026072 Motor neurone disease Diseases 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 208000029549 Muscle injury Diseases 0.000 description 1
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 1
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 1
- 201000009623 Myopathy Diseases 0.000 description 1
- 206010028643 Myopathy endocrine Diseases 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 1
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 1
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 1
- 238000011887 Necropsy Methods 0.000 description 1
- 101710141454 Nucleoprotein Proteins 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 208000011623 Obstructive Lung disease Diseases 0.000 description 1
- 240000007817 Olea europaea Species 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 101150012394 PHO5 gene Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 241000288049 Perdix perdix Species 0.000 description 1
- 206010034701 Peroneal nerve palsy Diseases 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 101710182846 Polyhedrin Proteins 0.000 description 1
- 101710083689 Probable capsid protein Proteins 0.000 description 1
- 101100437153 Rattus norvegicus Acvr2b gene Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 208000004756 Respiratory Insufficiency Diseases 0.000 description 1
- 235000004443 Ricinus communis Nutrition 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- SSZBUIDZHHWXNJ-UHFFFAOYSA-N Stearinsaeure-hexadecylester Natural products CCCCCCCCCCCCCCCCCC(=O)OCCCCCCCCCCCCCCCC SSZBUIDZHHWXNJ-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 101710137500 T7 RNA polymerase Proteins 0.000 description 1
- 108090001109 Thermolysin Proteins 0.000 description 1
- 102000002933 Thioredoxin Human genes 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 108010003533 Viral Envelope Proteins Proteins 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- 239000001089 [(2R)-oxolan-2-yl]methanol Substances 0.000 description 1
- ATBOMIWRCZXYSZ-XZBBILGWSA-N [1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC ATBOMIWRCZXYSZ-XZBBILGWSA-N 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000003655 absorption accelerator Substances 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 230000011759 adipose tissue development Effects 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 150000004645 aluminates Chemical class 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 238000003277 amino acid sequence analysis Methods 0.000 description 1
- 235000019418 amylase Nutrition 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 210000004198 anterior pituitary gland Anatomy 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 238000011882 arthroplasty Methods 0.000 description 1
- 239000000823 artificial membrane Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 208000020538 atrophic muscular disease Diseases 0.000 description 1
- 230000037444 atrophy Effects 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- WQZGKKKJIJFFOK-FPRJBGLDSA-N beta-D-galactose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-FPRJBGLDSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000003462 bioceramic Substances 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 239000005312 bioglass Substances 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000036983 biotransformation Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000002449 bone cell Anatomy 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- 235000019437 butane-1,3-diol Nutrition 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 239000001175 calcium sulphate Substances 0.000 description 1
- 235000011132 calcium sulphate Nutrition 0.000 description 1
- 238000004422 calculation algorithm Methods 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 230000021523 carboxylation Effects 0.000 description 1
- 238000006473 carboxylation reaction Methods 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 210000003321 cartilage cell Anatomy 0.000 description 1
- 230000022159 cartilage development Effects 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000006369 cell cycle progression Effects 0.000 description 1
- 230000033077 cellular process Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 229930183167 cerebroside Natural products 0.000 description 1
- 150000001784 cerebrosides Chemical class 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 150000005827 chlorofluoro hydrocarbons Chemical class 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 238000013375 chromatographic separation Methods 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 229960002376 chymotrypsin Drugs 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 235000013345 egg yolk Nutrition 0.000 description 1
- 210000002969 egg yolk Anatomy 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000001976 enzyme digestion Methods 0.000 description 1
- 230000009786 epithelial differentiation Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 230000010437 erythropoiesis Effects 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 229940093499 ethyl acetate Drugs 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 210000001733 follicular fluid Anatomy 0.000 description 1
- 210000003194 forelimb Anatomy 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 108010055341 glutamyl-glutamic acid Proteins 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 230000002414 glycolytic effect Effects 0.000 description 1
- 229930182470 glycoside Natural products 0.000 description 1
- 150000002338 glycosides Chemical class 0.000 description 1
- 230000001456 gonadotroph Effects 0.000 description 1
- 238000005534 hematocrit Methods 0.000 description 1
- 230000011132 hemopoiesis Effects 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 1
- 239000000710 homodimer Substances 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 239000000960 hypophysis hormone Substances 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 208000023692 inborn mitochondrial myopathy Diseases 0.000 description 1
- 201000008319 inclusion body myositis Diseases 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 239000003410 keratolytic agent Substances 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 125000001909 leucine group Chemical class [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000029226 lipidation Effects 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 230000004777 loss-of-function mutation Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000001071 malnutrition Effects 0.000 description 1
- 235000000824 malnutrition Nutrition 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000012900 molecular simulation Methods 0.000 description 1
- 201000006894 monocytic leukemia Diseases 0.000 description 1
- CQDGTJPVBWZJAZ-UHFFFAOYSA-N monoethyl carbonate Chemical compound CCOC(O)=O CQDGTJPVBWZJAZ-UHFFFAOYSA-N 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 208000005264 motor neuron disease Diseases 0.000 description 1
- 239000002324 mouth wash Substances 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 210000000663 muscle cell Anatomy 0.000 description 1
- 230000015604 muscle hyperplasia Effects 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 230000036473 myasthenia Effects 0.000 description 1
- 210000003098 myoblast Anatomy 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 210000001087 myotubule Anatomy 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 230000004766 neurogenesis Effects 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 231100000862 numbness Toxicity 0.000 description 1
- 208000015380 nutritional deficiency disease Diseases 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 230000003076 paracrine Effects 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 235000010603 pastilles Nutrition 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 239000002304 perfume Substances 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 125000001095 phosphatidyl group Chemical group 0.000 description 1
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 1
- 150000003014 phosphoric acid esters Chemical class 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000003169 placental effect Effects 0.000 description 1
- 238000013492 plasmid preparation Methods 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920002704 polyhistidine Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 150000004804 polysaccharides Chemical class 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 229960004063 propylene glycol Drugs 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 230000009145 protein modification Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000007261 regionalization Effects 0.000 description 1
- 238000009877 rendering Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 230000027272 reproductive process Effects 0.000 description 1
- 210000004994 reproductive system Anatomy 0.000 description 1
- 201000004193 respiratory failure Diseases 0.000 description 1
- 210000003019 respiratory muscle Anatomy 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 239000003340 retarding agent Substances 0.000 description 1
- 210000001995 reticulocyte Anatomy 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 210000000513 rotator cuff Anatomy 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000036301 sexual development Effects 0.000 description 1
- 108091006024 signal transducing proteins Proteins 0.000 description 1
- 102000034285 signal transducing proteins Human genes 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 230000025175 skeletal muscle hypertrophy Effects 0.000 description 1
- 230000022379 skeletal muscle tissue development Effects 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 150000003408 sphingolipids Chemical class 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 210000000434 stratum corneum Anatomy 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- BSYVTEYKTMYBMK-UHFFFAOYSA-N tetrahydrofurfuryl alcohol Chemical compound OCC1CCCO1 BSYVTEYKTMYBMK-UHFFFAOYSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 235000019871 vegetable fat Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 230000003519 ventilatory effect Effects 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- 208000016261 weight loss Diseases 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
- 235000014692 zinc oxide Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
- C07K14/4703—Inhibitors; Suppressors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/06—Anabolic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4707—Muscular dystrophy
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Zoology (AREA)
- Physical Education & Sports Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurology (AREA)
- Toxicology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Endocrinology (AREA)
- Marine Sciences & Fisheries (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
本发明涉及在给药的组织(例如注射的组织)中具有作用而非全身作用的促滤泡素抑制素‑Fc融合蛋白。Fc结构域导致促滤泡素抑制素‑Fc融合蛋白二聚化,并提供延长的组织滞留。本说明书包括包含由FST288、FST291(一种非天然的截短促滤泡素抑制素)或FST315组成的人促滤泡素抑制素多肽和人IgGl或IgG2 Fc结构域的融合蛋白。
Description
相关申请的交叉引用
本申请要求2014年6月4日提交的美国临时申请顺序号62/007,908的优先权的权益。前述申请的说明书以其整体结合到本文中。
发明背景
转化生长因子-β (TGF-β)超家族含有多种具有共同的序列元件和结构基序的生长因子。已知这些蛋白质对脊椎动物和无脊椎动物两者中的多种细胞类型发挥生物作用。超家族的成员在胚胎发育期间在图式形成和组织特化中执行重要功能,并可影响多种分化过程,包括脂肪形成、肌生成、软骨发生、心脏发生、血细胞生成、神经发生和上皮细胞分化。该家族被分成2个总分支:BMP/GDF和TGF-β/激活素/BMP10分支,其成员具有不同的、通常互补的作用。通过操控TGF-β家族成员的活性,常常可在生物体中引起重要的生理变化。例如,皮埃蒙特牛和比利时蓝牛品种在GDF8 (亦称肌生成抑制蛋白(myostatin))基因中携带功能失去突变,引起肌肉质量显著增加。Grobet等, Nat. Genet. 1997, 17(1):71-4。此外,在人类中,无活性的GDF8等位基因与肌肉质量增加有关,并且据报告与异常强度有关。Schuelke等, N Engl J Med 2004, 350:2682-8。
肌肉、骨、软骨和其它组织的改变可通过激发(agonizing)或拮抗由适合的TGF-β家族成员介导的信号传导来实现。然而,由于该家族的成员可影响一种以上的组织,因此在一些患者护理情况下,需要以局部而非全身的方式实现该家族成员的治疗性抑制。因此,存在对起TGF-β信号传导的强效调节剂的作用并且适于局部给药的药剂的需要。
发明概述
某些方面,本公开内容提供促滤泡素抑制素多肽,其经设计在其中给予所述促滤泡素抑制素多肽的组织的附近抑制促滤泡素抑制素配体(例如激活素A、激活素B、GDF8和GDF11),同时对患者几乎没有或没有全身作用。
本文所述促滤泡素抑制素多肽包括包含是SEQ ID NO: 1-4、7-16和26-43任一个的至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的氨基酸序列的多肽。任选促滤泡素抑制素多肽经设计以二聚化或形成更高级次的多聚体。这可通过使促滤泡素抑制素多肽的促滤泡素抑制素序列与赋予二聚化或多聚化的结构域融合来实现。这类结构域的实例是免疫球蛋白的恒定结构域,包括例如免疫球蛋白的Fc部分。任选促滤泡素抑制素部分与异源部分直接连接,或可使用间插序列,例如接头。接头的实例是序列TGGG。任选促滤泡素抑制素多肽可按人促滤泡素抑制素-288具有肝素结合活性的方式,显示肝素结合活性。或者,促滤泡素抑制素可按人促滤泡素抑制素-315的方式,具有被掩蔽的肝素结合结构域。某些方面,本公开内容提供治疗上优化的促滤泡素抑制素多肽,其包含来自与天然人IgG1相比ADCC或CDC活性降低的人IgG的免疫球蛋白恒定结构域的一部分。实例包括IgG2、IgG3、IgG4、杂合IgG2/4和IgG1、IgG2、IgG3和IgG4的变体。某些方面,本公开内容提供促滤泡素抑制素的最佳活性形式,其包含SEQ ID NO:15或16的氨基酸序列或基本由其组成或由其组成,特别在二聚融合蛋白(例如促滤泡素抑制素-Fc蛋白)的情况下,提供比天然FST(288)和FST(315)形式优越的蛋白质品质和活性。
在某些方面,本公开内容提供包含第一氨基酸序列和第二氨基酸序列的多肽,其中第一氨基酸序列由选自SEQ ID NO:15和16的氨基酸序列组成,且其中第二氨基酸序列包含免疫球蛋白的恒定结构域。任选存在位于第一氨基酸序列和第二氨基酸序列之间的接头多肽。任选接头多肽包含序列TGGG或基本由其组成或由其组成。任选第二氨基酸序列包含IgG免疫球蛋白的恒定结构域、基本由其组成或由其组成。任选第二氨基酸序列包含与人IgG1相比ADCC活性降低的IgG免疫球蛋白的恒定结构域、基本由其组成或由其组成。任选第二氨基酸序列包含与人IgG1相比CDC活性降低的IgG免疫球蛋白的恒定结构域、基本由其组成或由其组成。任选第二氨基酸序列包含选自IgG1、IgG2和IgG4的IgG免疫球蛋白的恒定结构域、基本由其组成或由其组成。任选第二氨基酸序列包含免疫球蛋白(例如IgG免疫球蛋白)的Fc部分或由其组成,所述免疫球蛋白可为与人IgG1相比ADCC、CDC或两者降低的免疫球蛋白,其实例包括IgG2、IgG4和IgG2/4杂合体或IgG1、IgG2、IgG3或IgG4的任一个的各种突变。在某些方面,本公开内容提供促滤泡素抑制素多肽,其包含与选自SEQ ID NO: 38-43的序列有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列、基本由其组成或由其组成。在某些方面,本公开内容提供促滤泡素抑制素多肽,其包含与选自SEQ ID NO: 26-28和32-34的序列有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列、基本由其组成或由其组成。在某些方面,本公开内容提供促滤泡素抑制素多肽,其包含与选自SEQ ID NO: 29-31和35-37的序列有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列、基本由其组成或由其组成。合乎需要的促滤泡素抑制素多肽可以小于1nM、100pM、50pM或10pM的KD与选自以下的一种或多种配体结合:肌生成抑制蛋白、GDF-11、激活素A和激活素B。在某些方面,上述多肽的任一个可以是二聚体,包括异二聚体或同二聚体,或更高级次多聚体。上述多肽的任一个可掺入药物制剂中。
在某些方面,本公开内容提供编码本文所述任何促滤泡素抑制素多肽的核酸和包含所述核酸的细胞,所述细胞可用来产生促滤泡素抑制素多肽。
在某些方面,本公开内容提供通过将促滤泡素抑制素多肽直接给予组织以治疗所述组织或器官的方法。例如,本公开内容提供增加患者的肌肉大小或强度的方法,所述方法包括通过肌内给药途径将有效量的促滤泡素抑制素多肽给予有需要的患者的目标肌肉,其中肌肉大小或强度的增加发生在目标肌肉中,且其中促滤泡素抑制素多肽对肌肉大小或强度不具有实质性的全身作用。目标肌肉可能受损、衰弱或有缺陷,正如在包括以下的多种肌肉病症中的情况:肌营养不良(例如杜兴肌营养不良(Duchenne muscular dystrophy)、贝克尔肌营养不良(Becker’s muscular dystrophy)和面肩肱型肌营养不良(fascioscapulohumeral muscular dystrophy))、炎症性肌肉病症(例如包涵体肌炎)、肌肉损伤或创伤、肌肉废用(如在长期卧床休息或肢体制动之后会发生的一样)和由于衰老、癌症或不同类型的慢性疾病的结果肌肉萎缩或弱化。所述方法还可适用于健康的但需要增加目标肌肉的肌肉大小或强度的肌肉。另外,将促滤泡素抑制素多肽给予肌肉可引起体脂肪的总体降低,因此可用于治疗肥胖症或其它与过量体脂肪有关的疾病,任选可将促滤泡素抑制素直接给予脂肪组织。可将促滤泡素抑制素多肽给予唯一一个目标肌肉或给予一个以上目标肌肉。所述方法和促滤泡素抑制素多肽可用来实现对目标组织(例如肌肉)的作用,而对其它组织(例如非目标肌肉或其它器官)无实质性作用。因此,未观察到促滤泡素抑制素的全身作用。例如,目标肌肉对侧的肌肉大小或强度不会被实质性地增加,或者对患者中选自以下的度量没有实质性作用:血清FSH水平、肝大小、血细胞比容、血红蛋白和网织红细胞水平。
附图简述
图1显示人促滤泡素抑制素315的完整、未加工的氨基酸序列(SEQ ID NO: 3)。前导序列用粗体的斜体字表示,促滤泡素抑制素N-端区(FSN)用单下划线表示,3个促滤泡素抑制素结构域(FSD)用双下划线表示。具体地说,促滤泡素抑制素结构域I (FSDI)用红色字体表示,促滤泡素抑制素结构域II (FSDII)用蓝色字体表示,促滤泡素抑制素结构域III(FSDIII)用绿色字体表示。
图2显示通过用FST(288)-Fc、FST(315)-Fc或ActRIIB-Fc皮下注射的4周治疗对小鼠的无脂肪组织质量的作用。溶媒是Tris缓冲盐水。数据为均值± SEM。*,通过非配对t检验相对于TBS的P < 0.05。#,通过非配对t检验相对于FST组的P < 0.05。与溶媒对照小鼠相比,FST(288)-Fc、FST(315)-Fc和ActRIIB-Fc治疗导致无脂肪组织质量显著增加。ActRIIB-Fc治疗小鼠无脂肪组织质量的增加显著大于FST(288)-Fc或FST(315)-Fc治疗小鼠中观察到无脂肪组织质量的增加。
图3显示用FST(288)-Fc、FST(315)-Fc或ActRIIB-Fc皮下注射每周两次的4周治疗对小鼠握力的作用。溶媒是Tris缓冲盐水。数据为均值± SEM。*,通过非配对t检验相对于TBS的P < 0.05。#,通过非配对t检验相对于FST组的P < 0.05。ActRIIB-Fc治疗提高小鼠握力。在FST(288)-Fc或FST(315)-Fc治疗小鼠中未观察到握力提高。
图4显示用FST(288)-IgG1、FST(315)-IgG1或ActRIIB-Fc皮下注射每周两次的4周治疗对小鼠胸肌(Pecs)、胫骨前肌(TA)、腓肠肌(Gastroc)和骨股肌质量的作用。溶媒是Tris缓冲盐水。数据为均值± SEM。*,通过非配对t检验相对于TBS的P < 0.05。#,通过非配对t检验相对于FST组的P < 0.05。ActRIIB-Fc治疗显著增加小鼠的胸肌、胫骨前肌、腓肠肌和骨股肌质量,但在FST(288)-IgG1或FST(315)-IgG1治疗小鼠中几乎没有或没有观察到肌肉质量增加。
图5显示通过用FST(288)-IgG1或FST(315)-IgG1皮下注射的4周治疗对促卵泡激素(FSH)的血清水平的作用。溶媒是Tris缓冲盐水。数据为均值± SEM。*,通过非配对t检验相对于TBS的P < 0.05。与溶媒对照小鼠相比,FST(315)-IgG1治疗导致血清FSH水平显著降低。相比之下,FST(288)-IgG1治疗对血清FSH水平没有作用。
图6显示通过用FST(288)-IgG1、FST(315)-IgG1或ActRIIB-mFc皮下注射每周两次的4周治疗对小鼠的无脂肪组织质量的作用。溶媒是Tris缓冲盐水。数据为均值± SEM。*,通过非配对t检验相对于TBS的P < 0.05。与溶媒对照小鼠相比,ActRIIB-mFc治疗导致无脂肪组织质量显著增加。在FST(288)-IgG1或FST(315)-IgG1治疗小鼠中没有观察到无脂肪组织质量增加。
图7显示通过用FST(288)-IgG1、FST(315)-IgG1或ActRIIB-mFc肌内注射入右腓肠肌每周两次的4周治疗对小鼠腓肠肌质量的作用。溶媒是Tris缓冲盐水。数据为均值±SEM。*,通过非配对t检验相对于TBS的P < 0.05。#,通过非配对t检验注射右腓肠肌相对于未注射左腓肠肌的P < 0.05。FST(288)-IgG1、FST(315)-IgG1和ActRIIB-mFc治疗显著增加注射的右腓肠肌的肌肉质量。ActRIIB-mFc治疗还显著增加未注射的左腓肠肌的肌肉质量。相比之下,在FST(288)-IgG1或FST(315)-IgG1治疗小鼠中在未注射左腓肠肌中未观察到增加。
图8显示通过用不同剂量的FST(288)-IgG1肌内注射入右腓肠肌每周两次的3周治疗对小鼠的腓肠肌质量的作用,表示为相对于未注射左腓肠肌的比率。溶媒为磷酸盐缓冲盐水。数据为均值± SEM。*,通过非配对t检验相对于PBS的P < 0.05。相对于未注射肌肉,递增剂量的FST(288)-IgG1引起经注射腓肠肌肥大增加。
图9显示通过用FST(291)-IgG1肌内注射入左腓肠肌每周两次的4周治疗的作用。溶媒为磷酸盐缓冲盐水。数据为均值± SEM。*,通过非配对t检验相对于PBS的P < 0.05。相对于未注射肌肉和相对于对照,肌内给予FST(291)-IgG2在注射的腓肠肌中引起肌肉质量显著增加。
发明详述
1. 概述
在某些方面,本公开内容涉及促滤泡素抑制素多肽。本文所用术语“促滤泡素抑制素”是指来源于任何物种的促滤泡素抑制素(FST)蛋白和促滤泡素抑制素相关蛋白的家族。促滤泡素抑制素是一种在高级动物的几乎所有组织中表达的自分泌糖蛋白。它最初从滤泡液中分离,并鉴定为抑制促卵泡激素(FSH)从垂体前叶中分泌的蛋白质部分,因此命名为FSH抑制蛋白(FSP)。随后,确定其主要功能为结合并中和TGF-β超家族成员,包括例如激活素,一种提高垂体前叶中FSH分泌的旁分泌激素。
术语“促滤泡素抑制素多肽”用来指包含保持有用活性包括例如配体结合(例如肌生成抑制蛋白、GDF-11、激活素A、激活素B)或肝素结合的促滤泡素抑制素家族的任何天然存在的多肽以及其任何变体(包括突变体、片段、融合物和肽模拟物形式)的多肽。例如,促滤泡素抑制素多肽包括这样的多肽,其包含来源于与促滤泡素抑制素多肽的序列具有至少约80%同一性、优选至少85%、90%、95%、97%、99%或更大同一性的序列的任何已知促滤泡素抑制素序列的氨基酸序列。术语“促滤泡素抑制素多肽”可指包含上述多肽的任一个以及异源(非促滤泡素抑制素)部分的融合蛋白。如果不是唯一存在于SEQ ID NO: 3所示的长(315个氨基酸)形式的人促滤泡素抑制素,则氨基酸序列被视为对促滤泡素抑制素是异源的。本文提供异源部分的许多实例,所述异源部分可通过氨基酸序列紧接融合蛋白的促滤泡素抑制素多肽部分,或被间插氨基酸序列(例如接头或其它序列)分隔开来。
根据可变mRNA剪接和蛋白质的可变糖基化,促滤泡素抑制素是分子量范围为31-49 kDa的单链多肽。可变剪接的mRNA编码315个氨基酸(即FST315)和288个氨基酸(即FST288)的2种蛋白质;促滤泡素抑制素315可被进一步蛋白水解性降解为促滤泡素抑制素303 (FST303)。氨基酸序列分析显示,天然人促滤泡素抑制素多肽包含5个结构域(自N端侧起):信号序列肽(SEQ ID NO: 1的氨基酸1-29)、N端结构域(FSN) (SEQ ID NO: 1的氨基酸30-94)、促滤泡素抑制素结构域I (FSDI) (SEQ ID NO: 1的氨基酸95-164)、促滤泡素抑制素结构域II (FSDII) (SEQ ID NO: 1的氨基酸168-239)和促滤泡素抑制素结构域III(FSDIII) (SEQ ID NO: 1的氨基酸245-316)。参见PNAS, U.S.A., 1988, 第85卷, 第12期, 第4218-4222页。
人促滤泡素抑制素-288 (FST288)前体具有下列氨基酸序列,其中用黑体字表示的信号肽、用单下划线表示的N端结构域(FSN)和用双下划线表示的促滤泡素抑制素结构域I-III (FSI、FSII、FSIII)。
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEE DVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECA LLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHL RKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECA MKEAACSSGVLLEVKHSGSCN (SEQ ID NO: 1)
加工的(成熟的)人促滤泡素抑制素变体FST(288)具有下列氨基酸序列,其中有用单下划线表示的N端结构域和用双下划线表示的促滤泡素抑制素结构域I-III。此外,应认识到,可通过加工或有意去除第一半胱氨酸之前的起始氨基酸G或N的任一个而无任何后果,并且进一步包括包含所述略较小多肽的多肽。
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCEN VDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFC PGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQ CTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCN (SEQ IDNO: 2)
人促滤泡素抑制素-315 (FST315)前体具有下列氨基酸序列,其中有用黑体字表示的信号肽、用单下划线表示的N端结构域(FSN)和用双下划线表示的促滤泡素抑制素结构域I-III (FSI、FSII、FSIII) (NCBI登记号AAH04107.1;344个氨基酸)。
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEE DVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECA LLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHL RKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECA MKEAACSSGVLLEVKHSGSCNSISEDTEEEEEDEDQDYSFPISSILEW (SEQ ID NO: 3)
加工的(成熟的)人FST(315)具有下列氨基酸序列,其中有用单下划线表示的N端结构域和用双下划线表示的促滤泡素抑制素结构域I-III。此外,应认识到,可通过加工或有意去除第一半胱氨酸之前的起始氨基酸G或N的任一个而无任何后果,并且进一步包括包含所述略较小多肽的多肽。
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCEN VDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFC PGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQ CTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISEDTEEEEEDEDQDYSFPISSILEW (SEQ ID NO: 4)
本公开内容的促滤泡素抑制素多肽可包括任何天然存在的促滤泡素抑制素蛋白的结构域及其保持有用活性的变体(例如突变体、片段和肽模拟物形式)。例如,众所周知,FST(315)和FST(288)对激活素(激活素A和激活素B)和肌生成抑制蛋白(和密切相关的GDF11)两者具有高亲和力,并且促滤泡素抑制素结构域(例如FSN和FSD I-III)被视为参与所述TGF-β配体的结合。然而,据信,这3个结构域各自针对这些TGF-β配体可具有不同的亲和力。例如,最新研究表明,只包含N端结构域(FSN)和串联的2个FSDI结构域的多肽构建体保持对肌生成抑制蛋白的高亲和力,当通过基因表达引入小鼠中时显示对激活素几乎没有或没有亲和力,并促进全身肌肉生长(Nakatani等,The FASEB Journal,第22477-487卷(2008))。
另外,FSDI结构域含有人促滤泡素抑制素的肝素结合结构域,其具有KKCRMNKKNKPR (SEQ ID NO: 5)的氨基酸序列。该肝素结合结构域可表示为BBXBXXBBXBXB(SEQ ID NO: 6),其中“B”意指碱性氨基酸,具体为赖氨酸(K)或精氨酸(R)。因此,某些方面,本公开内容包括相对于天然存在的FST蛋白显示对指定TGF-β配体的选择性结合和/或抑制(例如保持对肌生成抑制蛋白的高亲和力同时对激活素的亲和力显著降低)的变体促滤泡素抑制素蛋白。
在某些方面,本公开内容包括包含下文列出的FSN结构域和例如一个或多个异源多肽的多肽,此外,应认识到,第一半胱氨酸之前的起始氨基酸G或N的任一个可缺失,如下文所述实例(SEQ ID NO: 8)。
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKET(SEQ ID NO: 7)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKET (SEQID NO: 8)
在某些方面,本公开内容包括这样的多肽,其包含含有下文所示肌生成抑制蛋白(和/或GDF11)结合连同肝素结合的最小核心活性的FSDI结构域和例如一个或多个异源多肽。
CENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRC (SEQ ID NO: 9)
FSDI序列可通过表达为另包含FSN结构域的多肽有利地保持在结构环境中。因此,本公开内容包括包含以下列出的FSN-FSDI序列(SEQ ID NO: 10)和例如一个或多个异源多肽的多肽,此外,应认识到,可通过加工或有意去除第一半胱氨酸之前的起始氨基酸G或N的任一个而无任何后果,并且进一步包括包含所述略较小多肽的多肽。
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRC (SEQ ID NO:10)
Nakani等人表明,当在小鼠中遗传表达时,FSN-FSDI-FSDI构建体足以赋予全身肌肉生长,因此本公开内容包括包含以下氨基酸序列和例如一个或多个异源多肽的多肽。
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRC (SEQ ID NO:11)
虽然FSDI序列赋予肌生成抑制蛋白和GDF11结合,但已证实激活素,特别是激活素A和激活素B,还是肌肉的负调节剂,因此抑制肌生成抑制蛋白/GDF11组和激活素A/激活素B组两者的促滤泡素抑制素多肽可提供更强的肌肉作用。此外,鉴于表明的某些促滤泡素抑制素多肽、特别是包含肝素结合结构域、更特别是呈同二聚体形式的多肽(例如Fc融合物)的全身可获得性低的本文研究结果,减轻了激活素抑制对生殖轴和其它组织的已知作用有关的安全顾虑。考虑到FSDII赋予激活素A和B结合,本公开内容提供包含FSDI和FSDII (SEQID NO: 12)以及FSN-FSDI-FSDII构建体(SEQ ID NO: 13)和例如一个或多个异源多肽的多肽。
CENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKC(SEQ ID NO: 12)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKC (SEQ ID NO:13)
如实施例中所述,291个氨基酸(表示天然存在的FST-315的截短)的促滤泡素抑制素多肽具有有利性质。因此,未加工的(SEQ ID NO: 14)和成熟的FST(291) (SEQ ID NO:15)多肽包括在本公开内容中,并可与异源蛋白结合。此外,应认识到,可通过加工或有意去除第一半胱氨酸之前的起始氨基酸G或N的任一个而无任何后果,并且进一步包括包含所述略较小多肽的多肽,例如下文所示实例(SEQ ID NO: 16)。
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSIS (SEQ ID NO: 14)
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSIS (SEQID NO: 15)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSIS (SEQ IDNO: 16)
在某些实施方案中,本发明涉及用主题促滤泡素抑制素多肽(例如FST-IgG融合多肽)拮抗促滤泡素抑制素的配体(亦称为促滤泡素抑制素配体)。因此,本公开内容的组合物和方法可用于治疗与促滤泡素抑制素的一种或多种配体的异常活性有关的病症。促滤泡素抑制素的示例性配体包括一些TGF-β家族成员,例如激活素A、激活素B、肌生成抑制蛋白(GDF8)和GDF11。
促滤泡素抑制素蛋白在本文可称为FST。如果后面是数字,例如FST(288),则这表明蛋白质是促滤泡素抑制素的288形式。如果作为FST(288)-Fc存在,则这表明FST(288)的C端Fc融合物,这可包括或不包括间插接头。在这种情况下,Fc可以是任何免疫球蛋白Fc部分,正如本文定义的该术语。如果作为FST(288)-IgG2存在,则这表明人IgG2的Fc部分与FST(288)的C端Fc融合物。
激活素是二聚体多肽生长因子,属于TGF-β超家族。有3种激活素(A、B和AB),其是2个密切相关的β亚基的同/异二聚体(βAβA、βBβB和βAβB)。已鉴定出另外的激活素C和E,虽然不了解这些蛋白质的功能。在TGF-β超家族中,激活素是独特的多功能因子,可刺激卵巢和胎盘细胞中的激素产生、支持神经元细胞存活、根据细胞类型积极或消极影响细胞周期进程,并且至少在两栖动物胚胎中诱导中胚层分化(DePaolo等, 1991, Proc Soc Ep Biol Med.198:500-512;Dyson等, 1997, Curr Biol. 7:81-84;Woodruff, 1998, BiochemPharmacol. 55:953-963)。此外,发现自经刺激的人单核细胞白血病细胞分离的红细胞分化因子(EDF)与激活素A相同(Murata等,1988,PNAS,85:2434)。已经表明,激活素A在骨髓中起红细胞生成的天然调节剂的作用。在几种组织中,激活素信号传导被其相关的异二聚体(抑制素)拮抗。例如在从垂体释放促卵泡激素(FSH)期间,激活素促进FSH分泌和合成,而抑制素阻止FSH分泌和合成。激活素还涉及作为肌肉质量和功能的负调节剂,且激活素拮抗剂可促进肌肉生长或对抗体内肌肉丧失。Link和Nishi, Exp Cell Res. 1997年6月15日;233(2):350-62;He等, Anat Embryol (Berl). 2005年6月;209(5):401-7;Souza等, MolEndocrinol. 2008年12月;22(12):2689-702;Am J Physiol Endocrinol Metab. 2009年7月;297(1):E157-64;Gilson等, Zhou等, Cell. 2010年8月20;142(4):531-43。
生长和分化因子-8 (GDF8)亦称为肌生成抑制蛋白。GDF8是骨骼肌质量的负调节剂。GDF8在发育的和成熟的骨骼肌中高表达。转基因小鼠中的GDF8无效突变的特征在于明显的骨骼肌肥大和增生(McPherron等,Nature,1997,387:83-90)。在牛中(Ashmore等,1974, Growth, 38:501-507;Swatland和Kieffer, J. Anim. Sci., 1994, 38:752-757;McPherron和Lee, Proc. Natl. Acad. Sci. USA, 1997, 94:12457-12461;以及Kambadur等, Genome Res., 1997, 7:910-915)和引人侧目地在人类中(Schuelke等,N Engl J Med2004;350:2682-8),骨骼肌质量的类似增加在天然存在的GDF8突变中是明显的。研究还显示与人类HIV感染有关的肌肉消耗伴有GDF8蛋白质表达的增加(Gonzalez-Cadavid等,PNAS,1998,95:14938-43)。另外,GDF8可调节肌肉特异性酶(例如肌酸激酶)的产生,并调节成肌细胞增殖(WO 00/43781)。GDF8前肽可与成熟的GDF8结构域二聚体非共价结合,使其失去生物活性(Miyazono等, (1988) J. Biol. Chem., 263: 6407-6415;Wakefield等,(1988) J. Biol. Chem., 263;7646-7654;以及Brown等, (1990) Growth Factors, 3:35-43)。与GDF8或结构上相关的蛋白质结合并抑制其生物活性的其它蛋白质包括促滤泡素抑制素,并可能包括促滤泡素抑制素相关蛋白(Gamer等, (1999) Dev. Biol., 208: 222-232)。
本说明书所用术语通常具有其在本领域、在本发明的情况下和在使用各个术语的具体情况下的普通含义。下文或本说明书其它部分论述了某些术语以提供,为从业人员在描述本发明的组合物和方法及如何制备和使用它们时提供额外的指导。从术语使用的具体情况看,术语的任何应用范围或含义都将是显而易见的。
“约”和“大约”总的来讲可意指鉴于测量的性质或精确度,对所测定的量的可接受的误差度。通常,示例性误差度通常在给定值或值的范围的百分之20 (20%)、优选10%、更优选5%内。
或者,特别是在生物系统中,术语“约”和“大约”可意指在给定值的数量级以内、优选5倍以内、更优选2倍以内的值。本文给出的数值的量是近似值,除非另有说明,意指在未明确表示时,可被推测为术语“约”或“大约”。
本发明的方法可包括将序列彼此进行比较的步骤,包括野生型序列与一个或多个突变型(序列变体)比较。这类比较通常包括多聚体序列的比对,例如应用本领域众所周知的序列比对程序和/或算法(例如BLAST、FASTA和MEGALIGN等)。技术人员可容易理解的是,在其中突变含有残基插入或缺失的所述比对中,序列比对可在不含插入残基或缺失残基的多聚体序列中引入“空位” (通常用破折号或“A”表示)。
在所有其语法形式和拼法变化中,“同源的”是指具有“共同进化起源”的两种蛋白质之间的关系,包括来源于同一生物物种超家族的蛋白质以及来源于不同生物物种的同源蛋白质。所述蛋白质(及其编码核酸)具有序列同源性,正如其序列相似性所反映的一样,不论就百分比同一性而言,还是就特定残基或基序和保守位置的存在情况而论。然而,在普通用法中以及在本申请中,术语“同源的”当用副词(例如“高度地”)修饰时,可以是指序列相似性,并且可能与共同进化起源有关或无关。
在所有其全部语法形式中,术语“序列相似性”是指可能有或没有共同进化起源的核酸或氨基酸序列之间的同一性或一致性程度。
2. 促滤泡素抑制素多肽
在某些方面,本公开内容涉及促滤泡素抑制素多肽(例如FST-Fc多肽),和特别是通过包含SEQ ID NO: 2、7、8、9、10、11、12、13、14、15或16的多肽例示的截短形式及其变体。任选片段、功能变体和修饰形式具有其相应野生型促滤泡素抑制素多肽相似、相同或改进的生物活性。例如,本公开内容的促滤泡素抑制素变体可与促滤泡素抑制素配体(例如激活素A、激活素AB、激活素B和GDF8)结合并抑制其功能。任选促滤泡素抑制素多肽调节组织(特别是肌肉)的生长。促滤泡素抑制素多肽的实例包括包含SEQ ID No: 1-16和26-43任一个的氨基酸序列、基本由其组成或由其组成的多肽,以及包含与SEQ ID No: 1-16和26-43任一个的氨基酸序列有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列、基本由其组成或由其组成的多肽。可按照下面的指导制备这些多肽的变化。促滤泡素抑制素多肽的氨基酸的编号以SEQ ID NO: 1的序列为基础,不论是否使用天然前导序列。
如上所述,促滤泡素抑制素的特征在于3个富含半胱氨酸的区域(即FS结构域I-III),其被认为介导促滤泡素抑制素配体结合。此外,研究人员证实,仅包含3个FS-结合结构域之一(例如FSDI)的多肽构建体保持对某些促滤泡素抑制素配体(例如肌生成抑制蛋白)的强亲和力,并且体内是有活性的。参见Nakatani等,FASEB Journal,第22477-487卷(2008)。因此,本公开内容的变体促滤泡素抑制素多肽可包含促滤泡素抑制素蛋白的一个或多个活性部分。例如,本公开内容的构建体可始于相当于SEQ ID NO: 1的氨基酸30-95的残基并终于相当于SEQ ID NO: 1的氨基酸316-344的位置。其它实例包括始于SEQ ID NO:1的30-95位置并终于相当于氨基酸164-167或238-244的位置的构建体。其它实例可包括SEQ ID No: 7-16的任一个。
本文所述促滤泡素抑制素变化可以不同方式彼此或与异源氨基酸序列结合。例如,本公开内容的变体促滤泡素抑制素蛋白包括包含选自FSDI (SEQ ID NO: 1的氨基酸95-164 (即SEQ ID NO: 2)、FSDII (SEQ ID NO: 1的氨基酸168-239)或FSDIII (SEQ IDNO: 1的氨基酸245-316)的一个或多个FS结构域的多肽以及包含选自与FSDI (SEQ ID NO:1的氨基酸95-164 (即SEQ ID NO: 2)、FSDII (SEQ ID NO: 1的氨基酸168-239)或FSDIII(SEQ ID NO: 1的氨基酸245-316)有至少80%、85%、90%、92%、95%、96%、97%、98%或99%同一性的序列的一个或多个FS结构域的蛋白质。这些FS结构域可以任何顺序在本公开内容的变体促滤泡素抑制素多肽内结合,条件是所述重组蛋白保持所需活性,包括例如促滤泡素抑制素配体结合活性(例如肌生成抑制蛋白)和生物活性(例如诱导肌肉质量和/或强度)。所述促滤泡素抑制素变体多肽的实例包括例如具有例如FSDI-FSDII-FSDIII、FSDI-FSDIII、FSDI-FSDI-FSDIII、FSDI-FSDII、FSDI-FSDI、FSN-FSDI-FSDII-FSDIII、FSN-FSDI-FSDII、FSN-FSDI-FSDI、FSN-FSDI-FSDIII、FSN-FSDI-FSDI-FSDIII等结构域结构的多肽和使其它异源多肽与这些多肽的N端或C端融合所得到的多肽。这些结构域可直接连接或通过接头多肽连接。任选多肽接头可为任何序列,并可包含1-50、优选1-10、更优选1-5个氨基酸。在某些方面,优选的接头不含半胱氨酸氨基酸。
在一些实施方案中,本公开内容的促滤泡素抑制素变体对一种或多种促滤泡素抑制素配体的结合亲和力降低或消除。在某些方面,本公开内容提供对激活素的结合亲和力降低或消除的促滤泡素抑制素变体。在某些方面,本公开内容提供对激活素结合亲和力降低或消除但保持对肌生成抑制蛋白的高亲和力的促滤泡素抑制素变体。
在某些方面,本公开内容提供不包含相当于FSDII结构域或功能活性FSDII结构域的序列的促滤泡素抑制素变体。例如,本公开内容的促滤泡素抑制素多肽可包括通过FSDII结构域的部分或完全缺失获得的部分或完全缺失的变体。在某些方面,所述促滤泡素抑制素变体包括FSDII区内一个或多个半胱氨酸残基的缺失或用非半胱氨酸氨基酸的取代。
本公开内容的促滤泡素抑制素蛋白可包含信号序列。信号序列可以是促滤泡素抑制素蛋白的天然信号序列(例如SEQ ID NO: 1的氨基酸1-29)或来自其它蛋白质的信号序列,例如组织纤溶酶原激活物(TPA)信号序列或蜂毒肽(honey bee melatin, HBM)信号序列。
此外可将N联糖基化位点(N-X-S/T)加至促滤泡素抑制素多肽上,并且可延长FST-Fc融合蛋白的血清半寿期。一般可在配体结合袋外的位置上引入N-X-S/T序列。可在促滤泡素抑制素序列和Fc或其它融合物组分之间的接头中引入N-X-S/T序列。可通过在相对于先存在的S或T的正确位置中引入N,或通过相当于先存在的N的位置上引入S或T,以最小的努力引入所述位点。可将预测待被糖基化的任何S变成T而不产生免疫原性位点,这是因为糖基化提供的保护。同样,可将预测待被糖基化的任何T变成S。因此,促滤泡素抑制素变体可包括一个或多个额外的非内源N联糖基化共有序列。
在某些实施方案中,本公开内容考虑了通过修饰促滤泡素抑制素多肽的结构制备功能变体用于提高治疗功效或稳定性(例如离体保存限期和对体内蛋白水解性降解的抗性)的目的。还可例如通过氨基酸取代、缺失或添加,产生修饰的促滤泡素抑制素多肽。例如,有理由预期,亮氨酸被异亮氨酸或缬氨酸单独置换、天冬氨酸被谷氨酸单独置换、苏氨酸被丝氨酸单独置换,或者氨基酸被结构上相关的氨基酸进行类似置换(例如保守突变)将不会对所得分子的生物活性产生重大影响。保守置换是发生在其侧链上是相关的氨基酸家族内的置换。通过评价变体促滤泡素抑制素多肽以类似于野生型促滤泡素抑制素多肽的方式在细胞中产生反应,或以类似于野生型促滤泡素抑制素的方式与一种或多种配体(例如激活素或肌生成抑制蛋白)结合的能力,可容易地确定促滤泡素抑制素多肽的氨基酸序列的变化是否产生功能同系物。
在某些实施方案中,本发明考虑了促滤泡素抑制素多肽的特异性突变以改变多肽的糖基化。可选择所述突变以引入或消除一个或多个糖基化位点,例如O联或N联糖基化位点。天冬酰胺联糖基化识别位点一般包含三肽序列天冬酰胺-X-苏氨酸(其中“X”是任何氨基酸),其被合适的细胞糖基化酶特异性识别。还可通过将一个或多个丝氨酸或苏氨酸残基序列添加至野生型促滤泡素抑制素多肽的序列中(对于O联糖基化位点)或用一个或多个丝氨酸或苏氨酸残基置换,来进行改变。在糖基化识别位点的第一或第三氨基酸位置的一个或两个处的各种氨基酸取代或缺失(和/或第二位置的氨基酸缺失)在修饰的三肽序列上导致非糖基化。在促滤泡素抑制素多肽中增加糖部分的数目的另一种方法是通过糖苷与促滤泡素抑制素多肽的化学或酶促偶联。根据所采用的偶联方式,可将糖连接至:(a)精氨酸和组氨酸;(b)游离羧基;(c)游离巯基,例如半胱氨酸的巯基;(d)游离羟基,例如丝氨酸、苏氨酸或羟脯氨酸的羟基;(e)芳族残基,例如苯丙氨酸、酪氨酸或色氨酸的芳族残基;或(f)谷氨酰胺的酰胺基。这些方法描述于1987年9月11日公布的WO 87/05330以及Aplin和Wriston(1981) CRC Crit. Rev. Biochem., 第259-306页,通过引用结合到本文中。可用化学方法和/或酶方法实现ActRIIB多肽上存在的一个或多个糖部分的脱去。化学去糖基化可包括例如将促滤泡素抑制素多肽暴露于化合物三氟甲烷磺酸或等同化合物中。这种处理导致除连接糖(N-乙酰氨基葡萄糖或N-乙酰半乳糖胺)以外的大部分或所有糖被切割,同时保持氨基酸序列完整。化学去糖基化另描述于Hakimuddin等(1987) Arch. Biochem. Biophys.259:52和Edge等(1981) Anal. Biochem. 118:131。可按Thotakura等(1987) Meth.Enzymol. 138:350所述,通过使用各种内切糖苷酶和外切糖苷酶完成促滤泡素抑制素多肽上的糖部分的酶促切割。适当时,可根据所采用的表达系统类型,调整促滤泡素抑制素多肽的序列,因为哺乳动物、酵母、昆虫和植物细胞均可引入可受所述肽的氨基酸序列影响的不同糖基化模式。一般而言,用于人的促滤泡素抑制素蛋白可在提供适当糖基化的哺乳动物细胞系(例如HEK293或CHO细胞系)中表达,虽然预期其它哺乳动物表达细胞系、具有工程改造的糖基化酶的酵母细胞系以及昆虫细胞也是有用的。
本公开内容还考虑产生变体、特别是数套促滤泡素抑制素多肽的组合变体(任选包括截短变体)的方法;组合突变型库尤其可用于鉴定功能变体序列。筛选所述组合文库的目的可以是产生例如具有改变的性质(例如具有改变的药代动力学或改变的配体结合)的促滤泡素抑制素多肽变体。下面提供各种筛选测定法,所述测定法可用来评价变体。例如,可针对与促滤泡素抑制素多肽结合的能力筛选促滤泡素抑制素多肽变体,以防止促滤泡素抑制素配体与促滤泡素抑制素多肽结合。
还可以在基于细胞的测定法或体内测定法中测试促滤泡素抑制素多肽或其变体的活性。例如,可评价促滤泡素抑制素多肽变体对参与肌肉产生的基因表达的作用。这可根据需要在一种或多种重组促滤泡素抑制素配体蛋白(例如激活素A)存在下进行,可以转染细胞以产生促滤泡素抑制素多肽和/或其变体,任选促滤泡素抑制素配体。同样,可将促滤泡素抑制素多肽给予小鼠或其它动物,并可评价一个或多个肌肉性质,例如肌肉质量或强度。所述测定法是本领域众所周知的和常规的。易起反应的报道基因可用于所述细胞系以监测对下游信号传导的作用。
可以制备具有相对于天然存在的促滤泡素抑制素多肽选择性功效普遍提高的组合衍生的变体。所述变体蛋白,当自重组DNA构建体表达时,可用于基因治疗方案。同样,诱变可产生与相应的野生型促滤泡素抑制素多肽相比胞内半寿期十分不同的变体。例如,对于蛋白水解性降解或者导致天然促滤泡素抑制素多肽破坏或以其它方式失活的其它细胞过程,可使经改变的蛋白质更稳定或更不稳定。可利用所述变体和编码所述变体的基因,以通过调节促滤泡素抑制素多肽的半寿期,改变促滤泡素抑制素多肽水平。例如,短的半寿期可产生更短暂的生物作用,并且当为诱导型表达系统的一部分时,可允许更密切地控制细胞内的重组促滤泡素抑制素多肽水平。
在某些实施方案中,除天然存在于促滤泡素抑制素多肽中的任何修饰以外,本公开内容的促滤泡素抑制素多肽还可包含翻译后修饰。所述修饰包括但不限于乙酰化、羧化、糖基化、磷酸化、脂化和酰化。因此,修饰的促滤泡素抑制素多肽可含有非氨基酸成分,例如聚乙二醇、脂质、多糖或单糖和磷酸酯。可按照本文有关其它促滤泡素抑制素多肽变体方面所述,测试所述非氨基酸成分对促滤泡素抑制素多肽的功能性的作用。如果促滤泡素抑制素多肽在细胞中通过切割促滤泡素抑制素多肽的新生形式产生,则翻译后加工对于蛋白质的正确折叠和/或功能也可能是重要的。对于所述翻译后活性,不同的细胞(例如CHO、HeLa、MDCK、293、WI38、NIH-3T3或HEK293)具有特定的细胞机器和特有机制,可选择不同的细胞以确保促滤泡素抑制素多肽的正确修饰和加工。
在某些方面,促滤泡素抑制素多肽的功能变体或修饰形式包括具有促滤泡素抑制素多肽的至少一部分和一个或多个融合结构域的融合蛋白。所述融合结构域的众所周知的实例包括但不限于聚组氨酸、Glu-Glu、谷胱甘肽S转移酶(GST)、硫氧还蛋白、A蛋白、G蛋白、免疫球蛋白重链恒定区(Fc)、麦芽糖结合蛋白(MBP)或人血清白蛋白。可选择融合结构域以提供所需要的性质。例如,一些融合结构域特别可用于通过亲和层析法分离融合蛋白。为了亲和纯化的目的,使用用于亲和层析法的相关基质,例如谷胱甘肽缀合树脂、淀粉酶缀合树脂和镍缀合树脂或钴缀合树脂。所述基质的许多种可以“试剂盒”形式获得,例如PharmaciaGST纯化系统和可与(HIS6)融合配偶体一起使用的QIAexpressTM系统(Qiagen)。作为另一个实例,可选择融合结构域以促进促滤泡素抑制素多肽的检测。所述检测结构域的实例包括各种荧光蛋白(例如GFP)以及“表位标签”,其通常是短肽序列,可获得其特异性抗体。易获得其特异性单克隆抗体的众所周知的表位标签包括FLAG、流感病毒血凝素(HA)和c-myc标签。在一些情况下,融合结构域具有蛋白酶切割位点(例如因子Xa或凝血酶的切割位点),其允许相关蛋白酶部分消化融合蛋白,从而从中释放重组蛋白。然后,可通过随后的层析分离,从融合结构域分离出释放的蛋白质。在某些优选的实施方案中,促滤泡素抑制素多肽与体内稳定促滤泡素抑制素多肽的结构域(“稳定剂”结构域)融合。所谓“稳定”意指延长血清半寿期的任何事物,不论这是否是因为破坏减少、肾清除率降低还是其它药代动力学的作用。已知与免疫球蛋白的Fc部分的融合物赋予多种蛋白质所需要的药代动力学性质。同样,与人血清白蛋白的融合物可赋予所需要的性质。可选择的融合结构域的其它类型包括多聚化(例如二聚化、四聚化)结构域和功能结构域(其提供额外的生物功能,例如肌肉生长的进一步刺激)。
作为具体实例,本公开内容提供含有包含与免疫球蛋白的恒定结构域(例如免疫球蛋白的CH1、CH2或CH3结构域)的多肽或Fc融合的促滤泡素抑制素多肽的融合蛋白。下面提供来源于人IgG1和IgG2的Fc结构域(分别为SEQ ID NO: 17和SEQ ID NO: 18)。如本文所述,IgG2、IgG4或IgG2/4 Fc结构域对与保持肝素结合活性的促滤泡素抑制素多肽融合是特别有利的,因为这些Fc物类的CDC和/或ADCC活性(这对这些肝素结合多肽可与之附着的细胞是有害的)降低。已知降低CDC或ADCC活性的其它突变,总的来说,这些变体的任一种都包括在本公开内容中,并可用作促滤泡素抑制素融合蛋白的有利组分。任选SEQ ID NO: 17的Fc结构域在例如Asp-265、Lys-322和Asn-434 (按照相应的全长IgG1编号)等残基处具有一个或多个突变。在某些情况下,相对于野生型Fc结构域,具有这些突变的一个或多个(例如Asp-265突变)的突变体Fc结构域与Fcγ受体结合的能力降低。在其它情况下,相对于野生型Fc结构域,这些突变的一个或多个(例如Asn-434突变)的突变体Fc结构域与MHC I类相关Fc受体(FcRN)结合的能力提高。
可使用的人IgG1和IgG2氨基酸序列的实例见下:
IgG1
THTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 17)
IgG2
VECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 18)
要了解,融合蛋白的不同成分可以与所需功能性一致的任何方式排列。例如,可将促滤泡素抑制素多肽置于异源结构域的C端,或者,可将异源结构域置于促滤泡素抑制素多肽的C端。促滤泡素抑制素多肽结构域和异源结构域在融合蛋白中不必邻接,并且任一结构域的C端或N端或在结构域之间可包括其它结构域或氨基酸序列。
本文所用术语“免疫球蛋白Fc结构域”或简称“Fc”要理解为是指免疫球蛋白链恒定区、优选免疫球蛋白重链恒定区的羧基端部分或其部分。例如,免疫球蛋白Fc区可包含1)CH1结构域、CH2结构域和CH3结构域,2) CH1结构域和CH2结构域,3) CH1结构域和CH3结构域,4) CH2结构域和CH3结构域,或5)两个或更多个结构域和免疫球蛋白铰链区的组合。在一个优选的实施方案中,免疫球蛋白Fc区包含至少免疫球蛋白铰链区CH2结构域和CH3结构域,并优选缺乏CH1结构域。还要了解,促滤泡素抑制素多肽可只包含免疫球蛋白的一个结构域,例如CH1结构域、CH2结构域或CH3结构域。这些结构域的多个提供所需药代动力学性质以及二聚化或高级次多聚化。
在一个实施方案中,重链恒定区来源于其中的免疫球蛋白类别为IgG (Igγ) (γ亚类1、2、3或4)。可使用免疫球蛋白的其它类别IgA (Igα)、IgD (Igδ)、IgE (Igε)和IgM(Igμ)。合适免疫球蛋白重链恒定区的选择详细论述于美国专利号5,541,087和5,726,044。为获得特定结果的来自某些免疫球蛋白类别和亚类的具体免疫球蛋白重链恒定区序列的选择被视为在本领域的技术水平内。编码免疫球蛋白Fc区的DNA构建体的部分优选包含铰链结构域的至少一部分,优选Fc γ的CH3结构域或IgA、IgD、IgE或IgM任一种的同源结构域的至少一部分。
此外,预期免疫球蛋白重链恒定区内氨基酸的取代或缺失可用于实施本文公开的方法和组合物。一个实例可为将氨基酸取代引入上部CH2区以产生对Fc受体的亲和力降低的Fc变体(Cole等(1997) J. Immunol. 159:3613)。另外,在许多情况下,可脱去C端赖氨酸或K,因此本文所述任何多肽可省略存在于Fc结构域中的C端K,例如SEQ ID NO: 17或SEQID NO: 18所示那些。
在某些实施方案中,本公开内容的促滤泡素抑制素多肽含有能够稳定促滤泡素抑制素多肽的一个或多个修饰。例如,所述修饰延长促滤泡素抑制素多肽的体外半寿期、延长促滤泡素抑制素多肽的循环半寿期或降低促滤泡素抑制素多肽的蛋白水解性降解。所述稳定修饰包括但不限于融合蛋白(包括例如包含促滤泡素抑制素多肽和稳定剂结构域的融合蛋白)、糖基化位点的修饰(包括例如糖基化位点加至促滤泡素抑制素多肽上)和糖部分的修饰(包括例如从促滤泡素抑制素多肽中脱去糖部分)。在融合蛋白的情况下,促滤泡素抑制素多肽与稳定剂结构域(例如IgG分子(例如Fc结构域))融合。本文使用的术语“稳定剂结构域”不仅仅是指融合蛋白的情况下的融合结构域(例如Fc),而且还包括非蛋白质修饰(例如糖部分)或非蛋白质聚合物(例如聚乙二醇)。
在某些实施方案中,本发明可获得促滤泡素抑制素多肽的分离和/或纯化形式,其分离自其它蛋白质或以别的方式基本不含其它蛋白质。
在某些实施方案中,本公开内容的促滤泡素抑制素多肽(未修饰的或修饰的)可通过多种本领域已知技术产生。例如,所述促滤泡素抑制素多肽可采用标准蛋白质化学技术例如描述于以下文献的技术合成:Bodansky, M. Principles of Peptide Synthesis,Springer Verlag, Berlin (1993)和Grant G. A. (编辑), Synthetic Peptides: AUser's Guide, W. H. Freeman and Company, New York (1992)。另外,自动化肽合成仪是市购可获得的(例如Advanced ChemTech Model 396;Milligen/Biosearch 9600)。或者,促滤泡素抑制素多肽、其片段或变体可采用本领域众所周知的各种表达系统(例如大肠杆菌(E. coli)、中国仓鼠卵巢细胞、COS细胞、杆状病毒)重组产生(另见下文)。在又一个实施方案中,可通过使用例如蛋白酶(例如胰蛋白酶、嗜热菌蛋白酶、胰凝乳蛋白酶、胃蛋白酶或成对碱性氨基酸转化酶(PACE))消化天然存在的或重组产生的全长促滤泡素抑制素多肽,来产生修饰或未修饰的促滤泡素抑制素多肽。可应用计算机分析(应用市购可获得的软件,例如MacVector,Omega,PCGene,Molecular Simulation,Inc.)鉴定蛋白酶水解性切割位点。或者,可通过例如本领域已知的标准技术,例如通过化学切割(例如溴化氰、羟胺)从天然存在的或重组产生的全长促滤泡素抑制素多肽产生所述促滤泡素抑制素多肽。
3. 核酸编码促滤泡素抑制素多肽
在某些方面,本发明提供编码本文公开的任何促滤泡素抑制素多肽的分离核酸和/或重组核酸。主题核酸可为单链的或双链的。所述核酸可为DNA或RNA分子。这些核酸可用于例如制备促滤泡素抑制素多肽的方法。
例如,下列序列编码天然存在的人促滤泡素抑制素前体多肽(SEQ ID NO: 19)(NCBI登记号BC004107.2,1032 bp):
atggtccgcgcgaggcaccagccgggtgggctttgcctcctgctgctgctgctctgccagttcatggaggaccgcagtgcccaggctgggaactgctggctccgtcaagcgaagaacggccgctgccaggtcctgtacaagaccgaactgagcaaggaggagtgctgcagcaccggccggctgagcacctcgtggaccgaggaggacgtgaatgacaacacactcttcaagtggatgattttcaacgggggcgcccccaactgcatcccctgtaaagaaacgtgtgagaacgtggactgtggacctgggaaaaaatgccgaatgaacaagaagaacaaaccccgctgcgtctgcgccccggattgttccaacatcacctggaagggtccagtctgcgggctggatgggaaaacctaccgcaatgaatgtgcactcctaaaggcaagatgtaaagagcagccagaactggaagtccagtaccaaggcagatgtaaaaagacttgtcgggatgttttctgtccaggcagctccacatgtgtggtggaccagaccaataatgcctactgtgtgacctgtaatcggatttgcccagagcctgcttcctctgagcaatatctctgtgggaatgatggagtcacctactccagtgcctgccacctgagaaaggctacctgcctgctgggcagatctattggattagcctatgagggaaagtgtatcaaagcaaagtcctgtgaagatatccagtgcactggtgggaaaaaatgtttatgggatttcaaggttgggagaggccggtgttccctctgtgatgagctgtgccctgacagtaagtcggatgagcctgtctgtgccagtgacaatgccacttatgccagcgagtgtgccatgaaggaagctgcctgctcctcaggtgtgctactggaagtaaagcactccggatcttgcaactccatttcggaagacaccgaggaagaggaggaagatgaagaccaggactacagctttcctatatcttctattctagagtgg
下列序列编码成熟的FST(315)多肽(SEQ ID NO: 20)。
gggaactgctggctccgtcaagcgaagaacggccgctgccaggtcctgtacaagaccgaactgagcaaggaggagtgctgcagcaccggccggctgagcacctcgtggaccgaggaggacgtgaatgacaacacactcttcaagtggatgattttcaacgggggcgcccccaactgcatcccctgtaaagaaacgtgtgagaacgtggactgtggacctgggaaaaaatgccgaatgaacaagaagaacaaaccccgctgcgtctgcgccccggattgttccaacatcacctggaagggtccagtctgcgggctggatgggaaaacctaccgcaatgaatgtgcactcctaaaggcaagatgtaaagagcagccagaactggaagtccagtaccaaggcagatgtaaaaagacttgtcgggatgttttctgtccaggcagctccacatgtgtggtggaccagaccaataatgcctactgtgtgacctgtaatcggatttgcccagagcctgcttcctctgagcaatatctctgtgggaatgatggagtcacctactccagtgcctgccacctgagaaaggctacctgcctgctgggcagatctattggattagcctatgagggaaagtgtatcaaagcaaagtcctgtgaagatatccagtgcactggtgggaaaaaatgtttatgggatttcaaggttgggagaggccggtgttccctctgtgatgagctgtgccctgacagtaagtcggatgagcctgtctgtgccagtgacaatgccacttatgccagcgagtgtgccatgaaggaagctgcctgctcctcaggtgtgctactggaagtaaagcactccggatcttgcaactccatttcggaagacaccgaggaagaggaggaagatgaagaccaggactacagctttcctatatcttctattctagagtgg
下列序列编码FST(288)多肽(SEQ ID NO: 21)。
gggaactgctggctccgtcaagcgaagaacggccgctgccaggtcctgtacaagaccgaactgagcaaggaggagtgctgcagcaccggccggctgagcacctcgtggaccgaggaggacgtgaatgacaacacactcttcaagtggatgattttcaacgggggcgcccccaactgcatcccctgtaaagaaacgtgtgagaacgtggactgtggacctgggaaaaaatgccgaatgaacaagaagaacaaaccccgctgcgtctgcgccccggattgttccaacatcacctggaagggtccagtctgcgggctggatgggaaaacctaccgcaatgaatgtgcactcctaaaggcaagatgtaaagagcagccagaactggaagtccagtaccaaggcagatgtaaaaagacttgtcgggatgttttctgtccaggcagctccacatgtgtggtggaccagaccaataatgcctactgtgtgacctgtaatcggatttgcccagagcctgcttcctctgagcaatatctctgtgggaatgatggagtcacctactccagtgcctgccacctgagaaaggctacctgcctgctgggcagatctattggattagcctatgagggaaagtgtatcaaagcaaagtcctgtgaagatatccagtgcactggtgggaaaaaatgtttatgggatttcaaggttgggagaggccggtgttccctctgtgatgagctgtgccctgacagtaagtcggatgagcctgtctgtgccagtgacaatgccacttatgccagcgagtgtgccatgaaggaagctgcctgctcctcaggtgtgctactggaagtaaagcactccggatcttgcaac
下列序列编码成熟的FST(291)多肽(SEQ ID NO: 22)。
gggaactgctggctccgtcaagcgaagaacggccgctgccaggtcctgtacaagaccgaactgagcaaggaggagtgctgcagcaccggccggctgagcacctcgtggaccgaggaggacgtgaatgacaacacactcttcaagtggatgattttcaacgggggcgcccccaactgcatcccctgtaaagaaacgtgtgagaacgtggactgtggacctgggaaaaaatgccgaatgaacaagaagaacaaaccccgctgcgtctgcgccccggattgttccaacatcacctggaagggtccagtctgcgggctggatgggaaaacctaccgcaatgaatgtgcactcctaaaggcaagatgtaaagagcagccagaactggaagtccagtaccaaggcagatgtaaaaagacttgtcgggatgttttctgtccaggcagctccacatgtgtggtggaccagaccaataatgcctactgtgtgacctgtaatcggatttgcccagagcctgcttcctctgagcaatatctctgtgggaatgatggagtcacctactccagtgcctgccacctgagaaaggctacctgcctgctgggcagatctattggattagcctatgagggaaagtgtatcaaagcaaagtcctgtgaagatatccagtgcactggtgggaaaaaatgtttatgggatttcaaggttgggagaggccggtgttccctctgtgatgagctgtgccctgacagtaagtcggatgagcctgtctgtgccagtgacaatgccacttatgccagcgagtgtgccatgaaggaagctgcctgctcctcaggtgtgctactggaagtaaagcactccggatcttgcaactccatttcgtgg
在某些方面,要进一步了解,编码促滤泡素抑制素多肽的主题核酸包括是SEQ IDNO: 19-22的变体的核酸。变体核苷酸序列包括因一个或多个核苷酸取代、添加或缺失而不同的序列,例如等位基因变体;因此,可包括不同于SEQ ID NO: 19-22指定的编码序列的核苷酸序列的编码序列。
在某些实施方案中,本公开内容提供与SEQ ID NO: 19-22有至少80%、85%、90%、95%、96% 97%、98%、99%或100%同一性的分离核酸序列或重组核酸序列和特别其来源于促滤泡素抑制素的那些部分(相当于SEQ ID NO: 1的氨基酸95-164的核苷酸)。本领域普通技术人员应认识到,与SEQ ID NO: 19-22互补的核酸序列和SEQ ID NO: 19-22的变体也在本公开内容的范围内。在又一个实施方案中,本公开内容的核酸序列可以是分离的、重组的和/或与异源核苷酸序列融合,或在DNA文库中。
在其它实施方案中,本发明的核酸还包括在严格条件下与SEQ ID NO: 19-22指定的核苷酸序列、SEQ ID NO: 19-22的互补序列或其片段(例如核苷酸19-22)杂交的核苷酸序列。
本领域技术人员还应容易地了解,可以改变促进DNA杂交的合适的严格性条件。例如,可在6.0 x氯化钠/柠檬酸钠(SSC)中于约45℃进行杂交,接着2.0 x SSC于50℃洗涤。例如,可从约2.0 x SSC于50℃的低严格性到约0.2 x SSC于50℃的高严格性,选择洗涤步骤的盐浓度。另外,可从室温(约22℃)下的低严格性条件提高洗涤步骤的温度到约65℃下的高严格性条件。温度和盐两者均可改变,或者可保持温度或盐浓度恒定,而改变另一个变量。在一些实施方案中,本发明提供在6 x SSC于室温的低严格性条件下杂交接着2 x SSC于室温洗涤的核酸。
由于遗传密码的简并性所致不同于SEQ ID NO: 19-22所示核酸的分离核酸也在本公开内容的范围内。例如,多种氨基酸用不只一个三联体指定。指定同一氨基酸的密码子或同义密码子(例如CAU和CAC是组氨酸的同义密码子),可导致不影响蛋白质的氨基酸序列的“沉默”突变。然而,预期在哺乳动物细胞中可存在确实引起主题蛋白质氨基酸序列改变的DNA序列多态性。本领域技术人员应认识到,由于天然等位基因变化所致,在给定物种的个体之间,这些变化可存在编码特定蛋白质的核酸的一个或多个核苷酸(多至约3-5%的核苷酸)中。任何和所有所述核苷酸变化和所得氨基酸多态性也在本公开内容的范围内。
在某些实施方案中,在表达构建体中,本公开内容的重组核酸可与一个或多个调节核苷酸序列有效连接。调节核苷酸序列一般可适于用于表达的宿主细胞。本领域已知用于各种宿主细胞的合适表达载体和合适调节序列的许多类型。通常,所述一个或多个调节核苷酸序列可包括但不限于启动子序列、前导序列或信号序列、核糖体结合位点、转录起始序列和终止序列、翻译起始序列和终止序列及增强子或激活物序列。本公开内容考虑本领域已知的组成型启动子或诱导型启动子。启动子可以是天然存在的启动子或将不止一种启动子的元件组合的杂合启动子。表达构建体可存在于细胞的附加体(例如质粒)上,或者表达构建体可插入染色体中。在一个优选的实施方案中,表达载体含有选择标记基因以供转化宿主细胞的选择。选择标记基因是本领域众所周知的,并可随所采用的宿主细胞而改变。
在某些方面,在包含编码促滤泡素抑制素多肽并与至少一个调节序列有效连接的核苷酸序列的表达载体中提供主题核酸。调节序列是本领域公认的,并被选择来指导表达促滤泡素抑制素多肽。因此,术语调节序列包括启动子、增强子和其它表达调控元件。示例性的调节序列描述于Goeddel;Gene Expression Technology: Methods in Enzymology,Academic Press, San Diego, CA (1990)。例如,当与DNA序列有效连接时控制DNA序列表达的各种表达调控序列的任一种,可被用于这些载体以表达编码促滤泡素抑制素多肽的DNA序列。这类有用的表达调控序列包括例如SV40的早期启动子和晚期启动子、tet启动子、腺病毒或巨细胞病毒立即早期启动子、RSV启动子、lac系统、trp系统、TAC或TRC系统、其表达受T7 RNA聚合酶指导的T7启动子、噬菌体λ的主要操纵基因和启动子区、fd外壳蛋白的调控区、3-磷酸甘油酸激酶或其它糖酵解酶的启动子、酸性磷酸酶启动子(例如Pho5)、酵母α-交配因子启动子、杆状病毒系统的多角体启动子和已知控制原核细胞或真核细胞或其病毒的基因表达的其它序列及其各种组合。应当了解,表达载体的设计可取决于以下这类因素,例如待转化的宿主细胞的选择和/或欲表达的蛋白质类型。此外,还应考虑载体拷贝数、控制该拷贝数的能力和由该载体编码的任何其它蛋白质(例如抗生素标记)的表达。
可通过将克隆的基因或其部分连接至适于在原核细胞、真核细胞(酵母、禽、昆虫或哺乳动物)或两者中表达的载体中来产生本公开内容的重组核酸。用于产生重组促滤泡素抑制素多肽的表达载体包括质粒和其它载体。例如,合适的载体包括用于在原核细胞(例如大肠杆菌)中表达的以下类型的质粒:pBR322衍生质粒、pEMBL衍生质粒、pEX衍生质粒、pBTac衍生质粒和pUC衍生质粒。
一些哺乳动物表达载体既含有利于载体在细菌中增殖的原核序列,又含有在真核细胞中表达的一个或多个真核转录单位。pcDNAI/amp、pcDNAI/neo、pRc/CMV、pSV2gpt、pSV2neo、pSV2-dhfr、pTk2、pRSVneo、pMSG、pSVT7、pko-neo和pHyg衍生载体是适于转染真核细胞的哺乳动物表达载体的实例。这些载体的一些用来源于细菌质粒(例如pBR322)的序列修饰,以利于在原核细胞和真核细胞两者中复制和进行药物抗性选择。或者,可使用诸如牛乳头瘤病毒(BPV-1)或埃巴病毒(pHEBo、pREP衍生物和p205)等病毒衍生物在真核细胞中瞬时表达蛋白质。其它病毒(包括反转录病毒)表达系统的实例可参见下面基因疗法递送系统的描述。用于质粒制备和宿主生物转化中的各种方法是本领域众所周知的。对于原核和真核细胞两者的其它合适的表达系统以及通用重组方法,参见MolecularCloning A Laboratory Manual, 第2版, 编辑Sambrook, Fritsch和Maniatis (Cold Spring HarborLaboratory Press, 2001)第16和17章。在某些情况下,可能需要通过利用杆状病毒表达系统来表达重组多肽。这类杆状病毒表达系统的实例包括pVL衍生载体(例如pVL1392、pVL1393和pVL941)、pAcUW衍生载体(例如pAcUW1)和pBlueBac衍生载体(例如含β-gal的pBlueBac III)。
在某些实施方案中,可设计在CHO细胞中产生主题促滤泡素抑制素多肽的载体,例如Pcmv-Script载体(Stratagene,La Jolla,Calif.)、pcDNA4载体(Invitrogen,Carlsbad,Calif.)和pCI-neo载体(Promega,Madison,Wisc.)。显然,可使用主题基因构建体于在培养基中繁殖的细胞中使主题促滤泡素抑制素多肽表达,例如产生蛋白质(包括融合蛋白或变体蛋白)以便纯化。
本公开内容另涉及包括主题促滤泡素抑制素多肽的一个或多个的编码序列(例如SEQ ID NO: 19-22)的重组基因转染的宿主细胞。宿主细胞可以是任何原核细胞或真核细胞。例如,本公开内容的促滤泡素抑制素多肽可在细菌细胞(例如大肠杆菌)、昆虫细胞(例如使用杆状病毒表达系统)、酵母或哺乳动物细胞中表达。其它合适的宿主细胞是本领域技术人员已知的。
因此,本公开内容进一步涉及产生主题促滤泡素抑制素多肽的方法。例如,可将用编码促滤泡素抑制素多肽的表达载体转染的宿主细胞在允许促滤泡素抑制素多肽表达发生的合适条件下培养。可使促滤泡素抑制素多肽分泌并从细胞和含有促滤泡素抑制素多肽的培养基的混合物中分离出来。或者,可使促滤泡素抑制素多肽保持在胞质或在膜部分中,然后收获、裂解细胞并分离蛋白质。细胞培养物包括宿主细胞、培养基和其它副产物。用于细胞培养的合适培养基是本领域众所周知的。可采用本领域已知的用于纯化蛋白质的技术,包括离子交换层析法、凝胶过滤层析法、超滤法、电泳、使用对促滤泡素抑制素多肽的特定表位有特异性的抗体进行的免疫亲和纯化,将主题促滤泡素抑制素多肽从细胞培养基、宿主细胞或两者中分离出来。在一个优选的实施方案中,促滤泡素抑制素多肽是含有促进其纯化的结构域的融合蛋白。
在另一个实施方案中,编码纯化前导序列(例如重组促滤泡素抑制素多肽的所需部分的N端上的聚-(His)/肠激酶切割位点序列)的融合基因,可允许使用Ni2+金属树脂通过亲和层析法对表达的融合蛋白进行纯化。然后,纯化前导序列随后可通过用肠激酶处理除去,得到纯化的促滤泡素抑制素多肽(例如参见Hochuli等(1987) J. Chromatography411:177;以及Janknecht等,PNAS USA 88:8972)。
制备融合基因的技术是众所周知的。基本上,编码不同多肽序列的各种DNA片段的连接按照常规技术进行,采用用于连接的平端或交错端,限制性内切酶消化以提供合适末端,适当时补平黏性末端,碱性磷酸酶处理以避免不需要的连接,并进行酶促连接。在另一个实施方案中,融合基因可通过常规技术合成,包括自动DNA合成仪。或者,可使用在两个连续基因片段之间产生互补突出端的锚定引物进行基因片段的PCR扩增,所述基因片段随后可退火得到嵌合基因序列(参见例如Current Protocols in Molecular Biology,编辑Ausubel等,John Wiley & Sons:1992)。
4. 示例性治疗应用
在某些实施方案中,本公开内容的组合物,包括例如FST(288)-IgG1、FST(288)-IgG2、FST(291)-IgG1、FST(291)-IgG2、FST(315)-IgG1、FST(315)-IgG2和本文公开的其它促滤泡素抑制素多肽的任一种可用于治疗或预防本节描述的疾病或病况,包括与促滤泡素抑制素多肽和/或促滤泡素抑制素配体(例如GDF8)的异常活性有关的疾病或病症。这些疾病、病症或病况在本文一般称为“促滤泡素抑制素相关病况”。在某些实施方案中,本公开内容提供通过给予个体治疗有效量的上述促滤泡素抑制素多肽来治疗或预防有需要的个体的方法。这些方法的目的特别在于动物、更特别是人的治疗性和预防性治疗。
本文使用的“预防”病症或病况的治疗药是指以下化合物,其在统计样本中,与未治疗对照样品相比,减少治疗样品中的病症或病况的发生,或者与未治疗对照样品相比,延缓病症或病况的一个或多个症状发作或者降低病症或病况的一个或多个症状的严重程度。本文使用的术语“治疗”包括病况一旦确立便改善或根除病况。
促滤泡素抑制素配体复合物在组织生长以及早期发育过程(例如不同结构的正确形成)中或在一个或多个发育后能力(包括性发育、垂体激素产生和肌肉产生)中起重要作用。因此,促滤泡素抑制素相关病况包括异常组织生长和发育缺陷。
治疗的示例性病况包括神经肌肉病症(例如肌营养不良和肌肉萎缩)、充血性阻塞性肺病(和与COPD相关的肌肉消耗)、肌肉消耗综合征、肌肉衰减综合征(sarcopenia)和恶病质。其它示例性病况包括肌肉变性病症和神经肌肉病症、组织修复(例如伤口愈合)和神经变性性疾病(例如肌萎缩性侧索硬化)。
在某些实施方案中,本发明的组合物(例如FST-Fc多肽)用作肌营养不良治疗的组成部分。术语“肌营养不良”是指一类变性性肌肉疾病,其特征在于骨骼肌以及有时为心肌和呼吸肌逐渐弱化和衰退。肌营养不良是遗传病症,其特征在于以微观肌肉变化开始的进行性肌肉消耗和衰弱。当肌肉随时间退化时,人的肌肉强度下降。可用包括主题促滤泡素抑制素多肽的方案治疗的示例性肌营养不良包括:杜兴肌营养不良(DMD)、贝克尔肌营养不良(BMD)、埃-德肌营养不良(EDMD)、肢带肌营养不良(LGMD)、面肩胛肱骨肌营养不良(FSH或FSHD) (亦称为Landouzy-Dejerine)、强直性肌营养不良(MMD) (亦称为斯坦内特病(Steinert's Disease))、眼咽肌营养不良(OPMD)、远端肌营养不良(DD)、先天性肌营养不良(CMD)。
法国神经学家Guillaume Benjamin Amand Duchenne最早在1860年代描述了杜兴肌营养不良(DMD)。贝克尔肌营养不良(BMD)以德国医生Peter Emil Becker命名,他最早在1950年代描述了这种DMD的变体。DMD是男性中最常见的遗传疾病之一,累及1/3,500的男孩。当位于X染色体短臂的肌养蛋白基因断裂时,即发生DMD。由于男性只携带一个拷贝的X染色体,因此只有一个拷贝的肌养蛋白基因。在无肌养蛋白的情况下,在收缩和松弛循环期间,肌肉容易受损。虽然在疾病早期肌肉被再生补偿,但以后肌肉祖细胞无法跟上不断进行的损害,而且健康肌肉被无功能的纤维脂肪组织代替。
BMD由肌养蛋白基因的不同突变引起。BMD患者具有一些肌养蛋白,但或是量不足够,或是品质低下。具有一些肌养蛋白保护BMD患者的肌肉不像患有DMD的人的肌肉那些严重或快速地变性。
例如,最新研究表明,体内阻断或消除GDF8 (一种促滤泡素抑制素配体)的功能可有效治疗DMD和BMD患者中的至少某些症状。因此,主题促滤泡素抑制素拮抗剂可用作GDF8抑制剂(拮抗剂),并在DMD和BMD患者中构成体内阻断GDF8的功能的备选方法。
类似地,在需要肌肉生长的其它疾病状况中,主题促滤泡素抑制素多肽提供增加肌肉质量的有效方法。例如ALS,亦称Lou Gehrig病(运动神经元病)是一种慢性的无法治愈和无法停止的攻击运动神经元(连接脑与骨骼肌的CNS组分)的CNS病症。在ALS中,运动神经元恶化,最终死亡,尽管人脑正常地保持完整功能和警觉,但运动指令从不达到肌肉。患上ALS的大多数人年龄介于40和70岁。最早弱化的运动神经元是通向臂或腿的运动神经元。ALS患者可能行走困难,他们可能掉东西,摔倒,言语含糊,并且控制不住地笑或哭。最终四肢肌肉因废用而萎缩。这种肌肉衰弱会使人变得衰弱,将需要轮椅或变得不能下床行动。大多数ALS患者从发病起3-5年内死于呼吸衰竭或死于呼吸机辅助并发症如肺炎。
通过局部给予本文所述促滤泡素抑制素多肽,可治疗进行性神经病性腓骨肌萎缩(Charcot-Marie-Tooth Disease, CMT)。CMT是一类累及外周神经并导致进行性且常常局部肌肉衰弱和变性的遗传病症。可治疗的疾病的方面包括足畸形(极高弓足);足下垂(无法保持足与地面平行);“拍击(Slapping)”步态(由于足下垂,在步行时足部拍打地面);小腿肌肉丢失;足麻木;平衡困难或臂和手衰弱。
可用本文公开的促滤泡素抑制素多肽治疗患有包括以下多种全身肌肉病症的患者的肌肉:Lambert-Eaton肌无力综合征(LEMS);代谢营养不良;脊髓性肌萎缩(SMA);皮肌炎(DM);远端肌营养不良(DD);埃-德肌营养不良(EDMD);内分泌肌病;弗里德赖希共济失调(Friedreich’s Ataxia,FA);遗传性肌病;线粒体肌病;重症肌无力(MG);多肌炎(PM)。
可用本文公开的促滤泡素抑制素多肽治疗患有一个或多个肌肉的手术后或失用性萎缩(包括以下情况之后)的患者的肌肉:髋骨折;全髋关节成形术(THA);全膝关节成形术(TKA)或肌腱套手术。
可用本文公开的促滤泡素抑制素多肽治疗患有引起肌肉丢失或弱化的多种其它疾病的患者的肌肉,包括患有下列疾病的患者的肌肉:肌肉衰减综合征、恶病质、不同类型的癌症包括肺癌、结肠癌和卵巢癌、依赖长期通气辅助的患者、糖尿病、慢性阻塞性肺病、肾衰竭、心力衰竭、外周神经的创伤和病症。
促滤泡素抑制素多肽诱导的肌肉质量增加也可有益于患有肌肉消耗疾病的人。GDF8表达与人的无脂质量负相关,且GDF8基因的表达增加与患有AIDS消耗综合征的男性的体重减轻有关。通过抑制GDF8在AIDS患者中的功能,即使不完全消除,也可缓解AIDS的至少某些症状,因此明显改善AIDS患者的生命质量。
5. 药物组合物
在某些实施方案中,将本发明的化合物(例如促滤泡素抑制素多肽)与药学上可接受的载体一起配制。例如,促滤泡素抑制素多肽可单独给予或作为药物制剂(治疗组合物)的组分给予。可以用于人或兽药的任何适宜的方式配制主题化合物用于给药。
在某些实施方案中,本发明的治疗方法包括局部、全身或者以植入物或装置局部给予组合物。当给药时,用于本发明的治疗组合物当然呈无致热原的生理学上可接受的形式。此外,组合物可适宜地以粘性形式包封或注射以递送至靶组织部位(例如骨、软骨、肌肉、脂肪或神经元),例如具有组织损害的部位。局部给药可适于伤口愈合和组织修复。也可任选包含在上述组合物中的促滤泡素抑制素多肽以外的治疗有用物质,在本发明的方法中可备选或另外与主题化合物(例如促滤泡素抑制素多肽)同时或序贯给予。
在某些实施方案中,本发明的组合物可包含基质,其能够将一种或多种治疗化合物(例如促滤泡素抑制素多肽)递送到靶组织部位,为发育组织提供结构,并且最好能够被吸收进体内。例如,基质可提供慢释的促滤泡素抑制素多肽。所述基质可由目前用于其它植入医学应用的材料形成。
基质材料的选择取决于生物相容性、生物降解能力、机械性能、美容外观和界面性质。主题组合物的具体应用将界定适当的制剂。用于组合物的可能基质可以是生物可降解的和化学成分确定的硫酸钙、磷酸三钙、羟磷灰石、聚乳酸和聚酐。其它可能的材料是生物可降解的和生物学成分充分确定的,例如骨或真皮胶原。其它基质由纯的蛋白质或胞外基质组分组成。其它可能的基质是非生物可降解的和化学成分确定的,例如烧结羟磷灰石、生物玻璃、铝酸盐或其它陶瓷。基质可由任何上述类型的材料的组合组成,例如聚乳酸和羟磷灰石或胶原和磷酸三钙。生物陶瓷可在组成方面改变,例如呈钙-铝酸盐-磷酸盐,并进行加工以改变孔径、颗粒大小、颗粒形状和生物降解能力。
在某些实施方案中,本发明的方法可以例如以下形式口服给予:胶囊剂、扁囊剂、丸剂、片剂、锭剂(使用调味基料,一般为蔗糖和阿拉伯胶或西黄蓍胶)、散剂、颗粒剂,或者作为水性液体或非水性液体中的溶液剂或混悬剂、或作为水包油或油包水液体乳剂、或作为酏剂或糖浆剂、或作为软锭剂(使用惰性基料,例如明胶和甘油或蔗糖和阿拉伯胶)和/或作为漱口剂等,各自含有预定量的物质作为活性成分。药剂还可作为大丸剂、药糖剂或糊剂给予。
在口服给药的固体剂型(胶囊剂、片剂、丸剂、糖衣丸、散剂、颗粒剂等)中,可将一种或多种本发明的治疗化合物与一种或多种药学上可接受的载体例如柠檬酸钠或磷酸二钙和/或以下的任一种混合:(1)填充剂或增充剂,例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和/或硅酸;(2)粘合剂,例如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和/或阿拉伯胶;(3)湿润剂,例如甘油;(4)崩解剂,例如琼脂、碳酸钙、马铃薯或木薯淀粉、藻酸、某些硅酸盐和碳酸钠;(5)溶液阻滞剂,例如石蜡;(6)吸收促进剂,例如季铵化合物;(7)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(8)吸收剂,例如高岭土和膨润土;(9)润滑剂,例如滑石粉、硬脂酸钙、硬脂酸镁、固态聚乙二醇、十二烷基硫酸钠及其混合物;和(10)着色剂。在胶囊剂、片剂和丸剂的情况下,药物组合物还可包含缓冲剂。在使用诸如乳糖以及高分子量聚乙二醇等赋形剂的软充填和硬充填明胶胶囊剂中,相似类型的固体组合物也可用作填充剂。
用于口服给药的液体剂型包括药学上可接受的乳剂、微乳剂、溶液剂、混悬剂、糖浆剂和酏剂。除活性成分以外,液体剂型可含有常用于本领域的惰性稀释剂,例如水或其它溶剂、增溶剂和乳化剂,例如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、油(具体地说为棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和失水山梨糖醇的脂肪酸酯及其混合物。除惰性稀释剂以外,口服组合物还可包含辅料,例如润湿剂、乳化剂和助悬剂、甜味剂、矫味剂、着色剂、芳香剂和防腐剂。
除活性化合物以外,混悬剂可含有助悬剂,例如乙氧基化异十八醇、聚氧乙烯山梨糖醇和失水山梨糖醇酯、微晶纤维素、偏氢氧化铝(aluminum metahydroxide)、膨润土、琼脂和西黄蓍胶及其混合物。
本文公开的某些组合物可局部给予皮肤或粘膜。局部制剂可另包括已知作为皮肤或角质层渗透促进剂是有效的各种作用剂的一种或多种。这些的实例为2-吡咯烷酮、N-甲基-2-吡咯烷酮、二甲基乙酰胺、二甲基甲酰胺、丙二醇、甲醇或异丙醇、二甲亚砜和氮酮。可另包括其它作用剂以制备美容上可接受的制剂。这些的实例为脂肪、蜡、油、染料、香料、防腐剂、稳定剂和表面活性剂。还包括角质层分离剂例如本领域已知的那些。实例为水杨酸和硫。
用于局部或经皮给药的剂型包括散剂、喷雾剂、软膏剂、糊剂、乳膏剂、洗剂、凝胶剂、溶液剂、贴剂和吸入剂。可在无菌条件下将活性化合物与药学上可接受的载体和可能需要的任何防腐剂、缓冲剂或抛射剂一起混合。除本发明的主题化合物(例如促滤泡素抑制素多肽)以外,软膏剂、糊剂、乳膏剂和凝胶剂可含有赋形剂,例如动物脂和植物脂、油、蜡、石蜡、淀粉、西黄蓍胶、纤维素衍生物、聚乙二醇、硅酮、膨润土、硅酸、滑石粉和氧化锌或其混合物。
除主题化合物以外,散剂和喷雾剂可含有赋形剂,例如乳糖、滑石粉、硅酸、氢氧化铝、硅酸钙和聚酰胺粉或这些物质的混合物。喷雾剂可另含有常规抛射剂,例如氯氟烃和挥发性未取代的烃,例如丁烷和丙烷。
在某些实施方案中,适于胃肠外给药的药物组合物可包含一种或多种促滤泡素抑制素多肽以及一种或多种药学上可接受的无菌等渗水性溶液或非水性溶液、分散体、混悬液或乳液或者无菌粉剂(所述粉剂可在临用前重构成无菌注射溶液剂或分散剂),其可含有抗氧化剂、缓冲剂、抑菌剂、使制剂与预期接受者血液等渗的溶质或者助悬剂或增稠剂。可用于本发明药物组合物的合适水性载体和非水性载体的实例包括水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等)及其合适的混合物、植物油(例如橄榄油)和注射用有机酯(例如油酸乙酯)。可通过例如使用包衣材料(例如卵磷脂),在分散剂的情况下通过保持所需要的粒径,以及通过使用表面活性剂,来保持适当的流动性。
本发明的组合物还可含有辅料,例如防腐剂、润湿剂、乳化剂和分散剂。可通过加入多种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、三氯叔丁醇、苯酚、山梨酸等,来确保防止微生物的作用。组合物中还可能需要包含等渗剂(例如糖、氯化钠等)。另外,可通过加入延迟吸收的物质(例如单硬脂酸铝和明胶),使可注射药物形式的吸收延长。
要了解,主治医师可在考虑修正本发明的主题化合物(例如促滤泡素抑制素多肽)的作用的各种因素后,确定剂量方案。各种因素将取决于待治疗的疾病。
在某些实施方案中,本发明还提供用于体内产生促滤泡素抑制素多肽或本文公开的其它化合物的基因疗法。这类疗法可通过将促滤泡素抑制素多核苷酸序列引入受累于上文所列病症的细胞或组织中,来达到其治疗效果。可使用重组表达载体(例如嵌合病毒或胶体分散系统)实现促滤泡素抑制素多核苷酸序列的递送。优选的促滤泡素抑制素多核苷酸序列的治疗递送是使用靶向脂质体。
可用于本文教导的基因疗法的各种病毒载体包括腺病毒、疱疹病毒、痘苗病毒或优选RNA病毒(例如反转录病毒)。优选反转录病毒载体是鼠或禽反转录病毒的衍生物。其中可插入单一外源基因的反转录病毒载体的实例包括但不限于:莫洛尼鼠白血病病毒(MoMuLV)、Harvey鼠肉瘤病毒(HaMuSV)、鼠乳腺肿瘤病毒(MuMTV)和劳斯肉瘤病毒(Roussarcoma virus, RSV)。许多其它的反转录病毒载体可掺入多个基因。所有的这些载体可转移或整合选择标记的基因,使得可鉴定和产生转导细胞。可通过连接例如糖、糖脂或蛋白质,使反转录病毒载体具有靶标特异性。通过使用抗体来完成优选的打靶。本领域的技术人员应认识到,可将特异性多核苷酸序列插入反转录病毒基因组或与病毒包膜连接,以供含有促滤泡素抑制素多核苷酸的反转录病毒载体的靶标特异性递送。在一个优选的实施方案中,载体靶向骨、软骨、肌肉或神经元细胞/组织。
或者,可通过常规磷酸钙转染,将组织培养细胞用编码反转录病毒结构基因gag、pol和env的质粒直接转染。然后将这些细胞用含有目标基因的载体质粒转染。所得细胞释放反转录病毒载体到培养基中。
促滤泡素抑制素多核苷酸的另一种靶定递送系统是胶体分散系统。胶体分散系统包括大分子复合体、纳米囊、微球、珠粒和脂质型系统,其包括水包油乳液、微团、混合微团和脂质体。优选的本发明的胶体系统是脂质体。脂质体是可体外和体内用作递送载体的人工膜囊泡。RNA、DNA和完整病毒体可包封在水性内部,并以生物活性形式递送至细胞(参见例如Fraley等, Trends Biochem. Sci., 6:77,1981)。使用脂质体载体的有效基因转移方法是本领域已知的,参见例如Mannino等, Biotechniques, 6:682, 1988。脂质体的组成一般是磷脂的组合,一般与类固醇(尤其是胆固醇)组合。也可以使用其它磷脂或其它脂质。脂质体的物理特性取决于pH、离子强度和二价阳离子的存在情况。
可用于产生脂质体的脂质的实例包括磷脂酰化合物,例如磷脂酰甘油、磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、鞘脂、脑苷脂和神经节苷脂。说明性的磷脂包括蛋黄磷脂酰胆碱(egg phosphatidylcholine)、二棕榈酰磷脂酰胆碱和二硬脂酰磷脂酰胆碱。根据例如器官特异性、细胞特异性和细胞器特异性靶定脂质体也是可行的,并且是本领域已知的。
实例
现对本发明进行了大致描述,通过参照下列实施例可更容易地理解本发明,包括所述实施例仅用于说明本发明的某些实施方案和实施方案的目的,并无意限制本发明。
实施例1:促滤泡素抑制素-Fc蛋白的产生
已知促滤泡素抑制素(FST)具有复杂的药代动力学特性。据报道,缩短形式FST(288)在阻断配体时更有效,并且部分由于其未掩蔽的肝素结合结构域所致与细胞表面结合。由于富含酸性的C端氨基酸序列(其中和肝素结合结构域)所致,FST(315)被视为除较少被细胞表面吸引以外,也不太有效。在文献中,促滤泡素抑制素一般被报道为具有全身作用。申请人寻求确定是否可设计可趋于在给药组织(例如注射肌肉)中具有作用的促滤泡素抑制素构建体,以及促滤泡素抑制素的二聚化是否可提供升高的组织滞留。已知免疫球蛋白的Fc结构域形成二聚体。为了研究促滤泡素抑制素-Fc融合蛋白对肌肉和其它组织的作用,且为了评价Fc介导的二聚化对促滤泡素抑制素多肽的药代动力学性质的作用,申请人生产了含有与IgG1的Fc部分融合的FST(288)或FST(315)的融合蛋白。选择TGGG接头序列以使各促滤泡素抑制素多肽与Fc部分连接。
对于各FST-IgG1构建体,考虑下列3个前导序列:
(1) 促滤泡素抑制素前导序列:mvrarhqpgglcllllllcqfmedrsaqa (SEQ ID NO:23)
(2) 组织纤溶酶原激活物(TPA):MDAMKRGLCCVLLLCGAVFVSP (SEQ ID NO: 24)
(3) 蜜蜂蜂毒肽(HBML):MKFLVNVALVFMVVYISYIYA (SEQ ID NO: 25)
所选择的FST-Fc蛋白并入促滤泡素抑制素前导序列。FST(288)-IgG1融合物具有下文所示未加工的氨基酸序列和成熟的氨基酸序列。
未加工的FST(288)-IgG1 (SEQ ID NO: 26)
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
成熟的FST(288)-IgG1 (SEQ ID NO: 27)
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
可脱去起始的“GN”序列,得到下列多肽。(SEQ ID NO: 28)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
FST(315)-IgG1融合物具有下文所示未加工的氨基酸序列和成熟的氨基酸序列。
未加工的FST(315)-IgG1 (SEQ ID NO: 29)
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISEDTEEEEEDEDQDYSFPISSILEWTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
成熟的FST(315)-IgG1 (SEQ ID NO: 30)
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISEDTEEEEEDEDQDYSFPISSILEWTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
可脱去起始的“GN”序列,得到下列多肽。(SEQ ID NO: 31)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISEDTEEEEEDEDQDYSFPISSILEWTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
使蛋白质在HEK-293细胞或CHO细胞中表达,并且通过过滤和A蛋白层析法从条件培养基中纯化。在某些情况下,还采用阴离子交换和疏水性相互作用层析法和/或凝胶过滤。
通过与激活素A或GDF11结合,来评价蛋白质活性。在各种情况下,蛋白质以小于10pM的KD结合。
实施例2:促滤泡素抑制素-Fc蛋白的全身给药对小鼠的肌肉质量和强度的作用
申请人测定了在全身给药后野生型小鼠中促滤泡素抑制素-Fc蛋白增加肌肉质量和强度的能力。众所周知的刺激无脂肪肌肉质量的基本上全身增加的ActRIIB-Fc融合蛋白用作阳性对照。
用FST(288)-IgG1蛋白、人FST(315)-IgG1蛋白或人ActRIIB-Fc蛋白给予C57BL/6小鼠(10 mg/kg;皮下(s.c.))两次/周持续4周。对小鼠进行全身核磁共振(NMR)扫描以测定全身无脂肪组织质量的百分比变化。当与溶媒对照组相比时,ActRIIB-Fc治疗小鼠显示无脂肪组织显著(约35%)增加。与对照组相比,用FST(288)-IgG1或FST(315)-IgG1蛋白的小鼠显示无脂肪组织质量几乎没有增加。参见图2。在研究结束时,切下胸肌、胫骨前肌(TA)、腓肠肌和骨股肌并称重。如图4所示,ActRIIB-Fc治疗显示增加这些肌群每个中的肌肉质量。相比之下,在FST(288)-IgG1或FST(315)-IgG1治疗组中观察到肌肉质量几乎没有增加或未增加。参见图2。
在该研究过程中,还查检了小鼠肌肉强度的变化。测量当牵拉测力传感器时小鼠发挥的力来确定前肢握力。申请人观察到用ActRIIB-Fc蛋白治疗的小鼠显示肌肉强度提高。相比之下,在FST(288)-IgG1或FST(315)-IgG1治疗组中未观察到握力提升。参见图3。
总起来,结果证实当与溶媒对照动物相比时,全身给予ActRIIB-Fc显著增加小鼠的肌肉质量和强度两者。相比之下,在用促滤泡素抑制素-Fc融合蛋白FST(288)-IgG1或FST(315)-IgG1任一种治疗的小鼠中几乎没有或没有观察到肌肉质量或强度的增加。因此,看来当全身给予时,促滤泡素抑制素-Fc融合蛋白体内对肌肉质量或强度几乎没作用或没有作用。
实施例3:全身给予促滤泡素抑制素-Fc蛋白对FSH水平的作用。
促滤泡素抑制素的主要特征在于其结合并抑制信号传导蛋白质的TGF-β超家族成员的能力。具体地说,已知促滤泡素抑制素是激活素活性的有效抑制剂。激活素是促卵泡激素(FSH)产生的有效诱导物。FSH由垂体前叶腺的促性腺激素细胞合成和分泌,并在机体青春期成熟和不同生殖过程期间调节生长和发育。为了评价促滤泡素抑制素-Fc多肽的全身作用,评价了对FSH水平的作用。
用FST(288)-IgG1治疗(10 mg/kg;皮下(s.c.)两次/周)导致3.836 (± 5.22) μg/mL的药物循环水平。用FST(315)-IgG1的类似治疗导致19.31 (± 1.85) μg/mL的显著较高的药物血清水平。如图5所示,FST(288)-IgG1对FSH对血清水平没有任何显著作用,表明了这种FST(288)-IgG1治疗方案不显著影响全身激活素活性。相比之下,FST(315)-IgG1治疗导致FSH的循环水平降低,表明了全身给予FST(315)-IgG1对全身激活素信号传导产生作用。总的来说,这些数据表明使用具有介导二聚化的Fc结构域融合的未掩蔽的肝素结合结构域的促滤泡素抑制素多肽(例如FST(288)-IgG1),产生几乎没有或没有全身活性的蛋白质,而具有掩蔽的肝素结合结构域的FST(315)-IgG1可用来获得全身作用。
实施例4:局部给予促滤泡素抑制素-Fc蛋白对小鼠的肌肉质量和强度的作用
虽然在全身给药后没有显著作用,申请人采用类似的实验方法以测定在肌内(i.m.)给予后,促滤泡素抑制素是否可用来局部增加野生型小鼠的肌肉质量和强度。
用FST(288)-Fc蛋白、FST(315)-Fc蛋白或人ActRIIB-Fc蛋白给予C57BL/6小鼠(50微克;i.m.进入右腓肠肌)两次/周持续4周。在初治后不同的时间点,对小鼠进行全身核磁共振(NMR)扫描以测定全身无脂肪组织质量的百分比变化。当与溶媒对照组相比时,ActRIIB-Fc治疗小鼠显示无脂肪组织显著增加。相比之下,与对照组相比,用FST(288)-Fc或FST(315)-Fc蛋白治疗的小鼠都不显示无脂肪组织质量显著增加。在研究结束时,切离注射的右腓肠肌和对侧的左腓肠肌,并称重。如图6所示,与溶媒治疗小鼠相比,ActRIIB-Fc治疗显示右和左腓肠肌两者肌肉质量显著增加。因此,甚至当局限于单块肌肉的局部给药时,ActRIIB-Fc对增加肌肉质量产生全身作用。相比之下,FST(288)-Fc和FST(315)-Fc两者导致右腓肠肌的肌肉质量显示增加,但对对侧肌肉的质量没有作用。因此,与在全身给药后观察到的作用相反,看来当直接给予肌肉时,促滤泡素抑制素蛋白是肌肉质量的有效刺激物。此外,促滤泡素抑制素显得具有相对于像ActRIIB-Fc等其它作用剂的明显优势,因为其对肌肉质量的作用限于给药部位,表明了促滤泡素抑制素可用于选择肌肉或肌群的靶定疗法,而不影响周围的非目标肌肉的正常生长/活性。
申请人还严密监测了在i.m.给予后促滤泡素抑制素-Fc融合蛋白的血清水平。用FST(288)-IgG1治疗导致0.156 (± 0.245) μg/mL的药物循环水平。用FST(315)-IgG1的类似治疗导致3.58 (± 1.73) μg/mL的略微较高的药物血清水平,但这些水平显著低于在全身给予FST(315)-IgG1后观察到的水平。由于FST(288)-IgG1和FST(315)-IgG1两者在i.m.注射后以比在全身给予FST(288)-IgG1 (即3.836 (± 5.22) μg/mL)后观察到低的水平在患者血清中循环,因此可预期FST(288)-IgG1或FST(315)-IgG1对FSH的血清水平都没有显著作用,正如FST(288)-IgG1在s.c.给予后没有这类作用一样。参见图5。因此,这些数据表明FST(288)-IgG1和FST(315)-IgG1两者将特别适于促进在生殖上活跃的或希望使对生殖系统的作用降到最小的患者的目标肌肉生长。
进行了类似实验以建立FST(288)-IgG1对肌肉质量和品质的作用的剂量反应曲线。用不同的量(1-100微克) i.m.给予C57BL/6小鼠的右腓肠肌两次/周持续4周。如图8所示,用较大剂量的FST(288)-IgG1,注射肌肉相对于对侧肌肉的肌肉质量的选择性增加较大。切断面的肌肉显示肌肉质量增加是肌纤维肥大而非发育不全(hypoplasia)的结果。
实施例5:局部起作用的促滤泡素抑制素-Fc融合蛋白的Fc最优化
如前述实施例中所述,促滤泡素抑制素-Fc融合蛋白例如FST(288)-IgG1和FST(315)-IgG1在肌肉和其它组织中具有微不足道的全身作用,特别是蛋白质的FST(288)形式在注射部位有活性。申请人和其他人证实了FST(288)通过肝素结合结构域与细胞结合,这种结合可通过外源肝素消除。因此,申请人确定了已知介导对靶定细胞的CDC和ADCC作用的免疫球蛋白结构域可引起对用结合肝素的促滤泡素抑制素构建体处理的细胞的损害。所述损害可表现为目标组织中或目标组织生长减慢中的免疫反应。因此申请人使用人IgG2的Fc部分(其是已知消除刺激CDC和ADCC活性的能力的IgG恒定结构域的实例)产生不同形式的促滤泡素抑制素多肽。进行了该实验以确定使用备选Fc结构域的促滤泡素抑制素-Fc融合蛋白是否可保留活性。
申请人制备了含有与IgG2的Fc部分融合的FST(288)或FST(315)的融合蛋白。选择TGGG接头序列使各促滤泡素抑制素多肽与Fc部分连接。
对于各FST-IgG2构建体,使用促滤泡素抑制素前导序列。
FST(288)-IgG2融合物具有下文所示未加工的氨基酸序列和成熟的氨基酸序列。
未加工的FST(288)-IgG2 (SEQ ID NO: 32)
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
其由下列核酸序列(SEQ ID NO: 44)编码
atggtccgcgcgaggcaccagccgggtgggctttgcctcctgctgctgctgctctgccagttcatggaggaccgcagtgcccaggctgggaactgctggctccgtcaagcgaagaacggccgctgccaggtcctgtacaagaccgaactgagcaaggaggagtgctgcagcaccggccggctgagcacctcgtggaccgaggaggacgtgaatgacaacacactcttcaagtggatgattttcaacgggggcgcccccaactgcatcccctgtaaagaaacgtgtgagaacgtggactgtggacctgggaaaaaatgccgaatgaacaagaagaacaaaccccgctgcgtctgcgccccggattgttccaacatcacctggaagggtccagtctgcgggctggatgggaaaacctaccgcaatgaatgtgcactcctaaaggcaagatgtaaagagcagccagaactggaagtccagtaccaaggcagatgtaaaaagacttgtcgggatgttttctgtccaggcagctccacatgtgtggtggaccagaccaataatgcctactgtgtgacctgtaatcggatttgcccagagcctgcttcctctgagcaatatctctgtgggaatgatggagtcacctactccagtgcctgccacctgagaaaggctacctgcctgctgggcagatctattggattagcctatgagggaaagtgtatcaaagcaaagtcctgtgaagatatccagtgcactggtgggaaaaaatgtttatgggatttcaaggttgggagaggccggtgttccctctgtgatgagctgtgccctgacagtaagtcggatgagcctgtctgtgccagtgacaatgccacttatgccagcgagtgtgccatgaaggaagctgcctgctcctcaggtgtgctactggaagtaaagcactccggatcttgcaacaccggtggtggagtcgagtgcccaccgtgcccagcaccacctgtggcaggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacgtgcgtggtggtggacgtgagccacgaagaccccgaggtccagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccacgggaggagcagttcaacagcacgttccgtgtggtcagcgtcctcaccgtcgtgcaccaggactggctgaacggcaaggagtacaagtgcaaggtctccaacaaaggcctcccagcccccatcgagaaaaccatctccaaaaccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctaccccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacacctcccatgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatgagaattc
成熟的FST(288)-IgG2 (SEQ ID NO: 33)
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
可脱去起始的“GN”序列,得到下列多肽。(SEQ ID NO: 34)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
FST(315)-IgG2融合物具有下文所示未加工的氨基酸序列和成熟的氨基酸序列。
未加工的FST(315)-IgG2 (SEQ ID NO: 35)
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISEDTEEEEEDEDQDYSFPISSILEWTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
其由下列核酸序列(SEQ ID NO: 45)编码
atggtccgcgcgaggcaccagccgggtgggctttgcctcctgctgctgctgctctgccagttcatggaggaccgcagtgcccaggctgggaactgctggctccgtcaagcgaagaacggccgctgccaggtcctgtacaagaccgaactgagcaaggaggagtgctgcagcaccggccggctgagcacctcgtggaccgaggaggacgtgaatgacaacacactcttcaagtggatgattttcaacgggggtgcccccaactgcatcccctgtaaagaaacgtgtgagaacgtggactgtggacctgggaaaaaatgccgaatgaacaagaagaacaaaccccgctgcgtctgcgccccggattgttccaacatcacctggaagggtccagtctgcgggctggatgggaaaacctaccgcaatgaatgtgcactcctaaaggcaagatgtaaagagcagccagaactggaagtccagtaccaaggcagatgtaaaaagacttgtcgggatgttttctgtccaggcagctccacatgtgtggtggaccagaccaataatgcctactgtgtgacctgtaatcggatttgcccagagcctgcttcctctgagcaatatctctgtgggaatgatggagtcacctactccagtgcctgccacctgagaaaggctacctgcctgctgggcagatctattggattagcctatgagggaaagtgtatcaaagcaaagtcctgtgaagatatccagtgcactggtgggaaaaaatgtttatgggatttcaaggttgggagaggccggtgttccctctgtgatgagctgtgccctgacagtaagtcggatgagcctgtctgtgccagtgacaatgccacttatgccagcgagtgtgccatgaaggaagctgcctgctcctcaggtgtgctactggaagtaaagcactccggatcttgcaactccatttcggaagacaccgaggaagaggaggaagatgaagaccaggactacagctttcctatatcttctattctagagtggaccggtggtggagtcgagtgcccaccgtgcccagcaccacctgtggcaggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacgtgcgtggtggtggacgtgagccacgaagaccccgaggtccagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccacgggaggagcagttcaacagcacgttccgtgtggtcagcgtcctcaccgtcgtgcaccaggactggctgaacggcaaggagtacaagtgcaaggtctccaacaaaggcctcccagcccccatcgagaaaaccatctccaaaaccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctaccccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacacctcccatgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatgagaattc
成熟的FST(315)-IgG2 (SEQ ID NO: 36)
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISEDTEEEEEDEDQDYSFPISSILEWTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
可脱去起始的“GN”序列,得到下列多肽。(SEQ ID NO: 37)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISEDTEEEEEDEDQDYSFPISSILEWTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
使蛋白质在HEK-293细胞或CHO细胞中表达,并且通过过滤和A蛋白层析法从条件培养基中纯化。在某些情况下,还采用阴离子交换和疏水性相互作用层析法和/或凝胶过滤。
通过与激活素A或GDF11结合,来评价蛋白质活性。在各种情况下,蛋白质以小于10pM的KD结合。这些数据表明,可制备和表达促滤泡素抑制素-IgG2融合蛋白,并保留微微摩尔配体结合活性。
实施例6:优化的局部起作用的促滤泡素抑制素-Fc融合蛋白
为了评价是否可制备最优的促滤泡素抑制素-Fc融合蛋白,产生了FST(288)和FST(315)的C端间的多种截短。与其它形式相比,这些截短之一,以氨基酸291结束并称为FST(291),显示优良的表达性质,并保留所需肝素结合活性,尽管含有FST(315)的小部分掩蔽结构域。使这种形式与人IgG1和IgG2的Fc部分融合,得到FST(291)-IgG1和FST(291)-IgG2。
选择TGGG接头序列使各促滤泡素抑制素多肽与Fc部分连接。
对于各个FST-IgG1构建体,使用促滤泡素抑制素前导序列。
FST(291)-IgG1融合物具有下文所示未加工的氨基酸序列和成熟的氨基酸序列。
未加工的FST(291)-IgG1 (SEQ ID NO: 38)
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
成熟的FST(291)-IgG1 (SEQ ID NO: 39)
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
可脱去起始的“GN”序列,得到下列多肽。(SEQ ID NO: 40)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISTGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
FST(291)-IgG2融合物具有下文所示未加工的氨基酸序列和成熟的氨基酸序列。
未加工的FST(291)-IgG2 (SEQ ID NO: 41)
MVRARHQPGGLCLLLLLLCQFMEDRSAQAGNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
成熟的FST(291)-IgG2 (SEQ ID NO: 42)
GNCWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
可脱去起始的“GN”序列,得到下列多肽。(SEQ ID NO: 43)
CWLRQAKNGRCQVLYKTELSKEECCSTGRLSTSWTEEDVNDNTLFKWMIFNGGAPNCIPCKETCENVDCGPGKKCRMNKKNKPRCVCAPDCSNITWKGPVCGLDGKTYRNECALLKARCKEQPELEVQYQGRCKKTCRDVFCPGSSTCVVDQTNNAYCVTCNRICPEPASSEQYLCGNDGVTYSSACHLRKATCLLGRSIGLAYEGKCIKAKSCEDIQCTGGKKCLWDFKVGRGRCSLCDELCPDSKSDEPVCASDNATYASECAMKEAACSSGVLLEVKHSGSCNSISTGGGVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
使蛋白质在HEK-293细胞或CHO细胞中表达,并且通过过滤和A蛋白层析法从条件培养基中纯化。在某些情况下,还采用阴离子交换和疏水性相互作用层析法和/或凝胶过滤。
通过与激活素A或GDF11结合,来评价蛋白质活性。在各种情况下,蛋白质以小于10pM的KD结合。
进行了其它的截短实验以鉴定促滤泡素抑制素-IgG2构建体,在TGGG接头的情况下,显示了最优配体和肝素结合活性,以得到具有高效能、有助于在受治疗组织中滞留的强大趋势和在受治疗组织中产生炎性反应或免疫反应的低趋势的多肽。为此,制备一系列构建体,称为FST(278)-IgG2、FST(284)-IgG2,FST(291)-IgG2和FST(303)-IgG2,并彼此比较且与FST(288)-IgG2和FST-(315)-IgG2比较。如下评价肝素结合,通过测量在肝素存在或不存在时从细胞回收的蛋白质,通过ELISA量化,并表示为在肝素存在时回收的蛋白质与在肝素不存在时回收的蛋白质的比率。如下表所示,FST(278)-IgG2、FST(284)-IgG2、FST(288)-IgG2和FST(291)-IgG2均显示3.00-4.00的相似比率,而FST(303)-IgG2和FST(315)-IgG2分别显示1.50和0.97的比率。这表明由于在291和303位之间包括较多氨基酸,因此肝素结合活性急剧降低。
进行了基于细胞的报道基因测定法(A-204报道基因测定法,描述于WO/2006/012627),以评价激活素和GDF11的抑制。如下表所示,延伸至288位以外的构建体提供提高的配体抑制。
将肝素结合和配体抑制数据合起来看,显然在本文所用TGGG接头或类似大小的接头(例如接头大小为1-10个氨基酸,任选3-8个氨基酸)的情况下,以291-302位结束的FST-IgG2构建体,相对于FST(288)-IgG2配体抑制增强,且相对于FST(315)-IgG2肝素结合增加,而且FST(291)-IgG2表示局部给药和作用的最优蛋白质。
实施例7:局部给予FST(291)-IgG2蛋白质对小鼠的肌肉质量和强度的作用
申请人评价了在肌内(i.m.)给予后野生型小鼠中优化的FST(291)-IgG2蛋白用来局部增加肌肉质量和强度的活性。
用溶媒(PBS)、FST(291)-IgG2或来自IgG1的对照Fc给予C57BL/6小鼠(100微克在50微升中;i.m.进入左腓肠肌)两次/周持续4周。在研究结束时,切离注射的左腓肠肌和对侧右腓肠肌两者,并称重。如图9所示,与溶媒治疗小鼠相比,FST(291)-IgG2治疗显示在注射左腓肠肌中增加肌肉质量到实质的程度,未观察到对对侧肌肉的作用。另外,对胸肌和骨股肌称重,由于给予溶媒或FST(291)-IgG2的结果显示无变化。因此,FST(291)-IgG2对注射肌群具有有限的作用,几乎没有或没有全身作用。进行了类似实验,但注射不同的肌群,包括三头肌和胫骨前肌。在各种情况下,观察到注射肌肉的选择性肥大。
进行了其它实验以直接比较FST(288)-IgG1和FST(291)-IgG2对肌肉生长的作用。虽然两个构建体促进注射肌肉(腓肠肌)中肌肉质量显著增加,但FST(291)-IgG2引起注射肌肉相对于对侧肌肉约42%增加,而FST(288)-IgG1引起注射肌肉相对于对侧肌肉约22%增加。
因此,这些数据表明FST(291)-IgG2是在有需要的患者中促进目标肌肉生长的最佳化合物。
实施例8:杜兴肌营养不良小鼠模型中局部给予FST(291)-IgG2蛋白对肌肉的作用
在杜兴肌营养不良小鼠模型中评价了FST(291)-IgG2对肌肉质量的作用。小鼠C57BL/10ScCN-Dmdmdx/J (mdx)品系是充分确立的人杜兴肌营养不良的模型(Bulfield,Siller等, 1984;Partridge 2013)。
用mdx小鼠和野生型背景品系C57BL/10SnJ (WT)进行了两个独立研究。在第一个研究中,当小鼠达到6周龄进开始治疗(FST(291)-IgG2或溶媒对照)。在第二个研究中,当小鼠达到4周龄时开始治疗。在两项研究中,小鼠在左腓肠肌中肌内接受100 μg FST(291)-IgG2,每周两次,每次注射50 μL的固定体积。治疗4周龄小鼠持续4周,治疗6周龄小鼠持续6周。
在尸体剖检时,切离来自注射(左)和对侧未注射(右)腿的腓肠肌并称重。在两个研究中,与对侧腿以及溶媒对照相比,来自用FST(291)-IgG2治疗的WT动物的注射腓肠肌的大小显著较大(P<0.001)。在两个研究中,在WT和mdx小鼠两者中,与对侧肌肉和与溶媒治疗动物相比,用FST(291)-IgG2治疗的归一化至体重的腓肠肌的大小显著较大。肌肉质量的增加在较年轻的动物中比在较年老的动物中稍稍更显著。就相对于对侧肌肉的百分比增加而言,在6周龄WT和mdx小鼠中,FST(291)-IgG2增加肌肉质量分别达34.2%和16.4%。在4周龄WT和mdx小鼠中分别观察到62.8%和41.8%的肌肉质量增加。
这些数据表明,使用每周两次肌内给予FST(291)-IgG2阻断激活素/肌生成抑制蛋白信号传导增加肌营养不良小鼠模型的肌肉质量。肌肉质量的增加仅局部出现在注射肌肉中。
通过引用予以结合
本文提及的所有出版物和专利均通过引用以其整体结合到本文中,就像每个独立出版物或专利具体而单独指明通过引用结合一样。
虽然论述了主题的具体实施方案,但上述说明书是说明性的而非限制性的。当回顾本说明书和随附权利要求书时,许多变动对本领域技术人员而言将变得显而易见。应参照权利要求书及其等同内容的整个范围和说明书及这类变化来确定本发明的整个范围。
Claims (7)
1.多肽,其由SEQ ID NO: 42的氨基酸序列组成。
2.一种二聚体,其包含两个权利要求1的多肽。
3.一种药物制剂,其包含权利要求2的二聚体。
4.一种核酸,其由编码权利要求1的多肽的核酸序列组成。
5.一种细胞,其包含权利要求4的核酸。
6.一种用于增加患者的肌肉大小或强度的组合物,其中所述组合物包含权利要求1的多肽或权利要求2的二聚体。
7.权利要求6的组合物,其中所述患者具有杜兴肌营养不良。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110533308.2A CN113583104A (zh) | 2014-06-04 | 2015-06-04 | 促滤泡素抑制素多肽、其组合物及其使用方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462007908P | 2014-06-04 | 2014-06-04 | |
| US62/007908 | 2014-06-04 | ||
| PCT/US2015/034245 WO2015187977A1 (en) | 2014-06-04 | 2015-06-04 | Methods and compositions for treatment of disorders with follistatin polypeptides |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110533308.2A Division CN113583104A (zh) | 2014-06-04 | 2015-06-04 | 促滤泡素抑制素多肽、其组合物及其使用方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN106795224A CN106795224A (zh) | 2017-05-31 |
| CN106795224B true CN106795224B (zh) | 2021-05-18 |
Family
ID=54767384
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580041740.2A Active CN106795224B (zh) | 2014-06-04 | 2015-06-04 | 用促滤泡素抑制素多肽治疗病症的方法和组合物 |
| CN202110533308.2A Pending CN113583104A (zh) | 2014-06-04 | 2015-06-04 | 促滤泡素抑制素多肽、其组合物及其使用方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110533308.2A Pending CN113583104A (zh) | 2014-06-04 | 2015-06-04 | 促滤泡素抑制素多肽、其组合物及其使用方法 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US10023621B2 (zh) |
| EP (2) | EP3152237B1 (zh) |
| JP (3) | JP6568110B2 (zh) |
| KR (4) | KR102077286B1 (zh) |
| CN (2) | CN106795224B (zh) |
| AU (2) | AU2015269333B2 (zh) |
| BR (1) | BR112016028520A2 (zh) |
| CA (1) | CA2950754C (zh) |
| EA (2) | EA202090632A1 (zh) |
| MA (2) | MA51075A (zh) |
| MX (2) | MX2016015868A (zh) |
| WO (1) | WO2015187977A1 (zh) |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150115961A (ko) | 2005-11-23 | 2015-10-14 | 악셀레론 파마 인코포레이티드 | 액티빈-actrⅱa 길항제 및 골 성장을 촉진하기 위한 이들의 용도 |
| EP2315602A4 (en) | 2008-06-26 | 2011-11-02 | Acceleron Pharma Inc | METHOD OF DOSING AN ACTRIIB ANTAGONIST AND MONITORING TREATED PATIENTS |
| MX362105B (es) | 2013-01-25 | 2019-01-04 | Shire Human Genetic Therapies | Folistatina en el tratamiento de distrofia muscular de duchenne. |
| US10010498B2 (en) * | 2014-06-04 | 2018-07-03 | Acceleron Pharma Inc. | Methods for treatment of amyotrophic lateral sclerosis with follistatin fusion proteins |
| CN106795224B (zh) | 2014-06-04 | 2021-05-18 | 阿塞勒隆制药公司 | 用促滤泡素抑制素多肽治疗病症的方法和组合物 |
| TN2016000553A1 (en) | 2014-06-13 | 2018-04-04 | Acceleron Pharma Inc | Methods and compositions for treating ulcers |
| EP3274457A4 (en) * | 2015-03-26 | 2018-08-08 | Acceleron Pharma Inc. | Follistatin-related fusion proteins and uses thereof |
| US20200247856A1 (en) * | 2016-03-04 | 2020-08-06 | Shire Human Genetic Therapies, Inc. | Recombinant follistatin-fc fusion proteins and use in treating duchenne muscular dystrophy |
| WO2018176065A1 (en) * | 2017-03-23 | 2018-09-27 | Oregon State University | Therapeutic compositions and methods for treatment of muscle wasting diseases |
| KR101822633B1 (ko) * | 2017-08-22 | 2018-01-26 | (주)진셀팜 | 폴리스타틴 유래 생리활성 펩타이드, 및 이의 용도 |
| WO2019046903A1 (en) * | 2017-09-08 | 2019-03-14 | Baker Heart and Diabetes Institute | THERAPEUTIC METHOD FOR INCREASING MUSCLE MASS IN A SUBJECT |
| CN108218985B (zh) * | 2017-12-12 | 2021-04-30 | 山西农业大学 | 一种利用特征多肽制备fst蛋白特异性抗体的方法及其应用 |
| CA3093716A1 (en) * | 2018-03-16 | 2019-09-19 | Immusoft Corporation | B cells genetically engineered to secrete follistatin and methods of using the same to treat follistatin-related diseases, conditions, disorders and to enhance muscle growth and strength |
| JP7183291B2 (ja) * | 2018-03-21 | 2022-12-05 | 松陽生技股▲分▼有限公司 | 局部の筋肉増加を促進し、若しくは局部の筋萎縮を抑制又は防止する組成物及び当該組成物を使用して製造された薬物 |
| WO2019191204A1 (en) * | 2018-03-28 | 2019-10-03 | Acceleron Pharma Inc. | Follistatin polypeptides for the treatment of muscle contracture |
| US20210207135A1 (en) * | 2018-05-17 | 2021-07-08 | Housey Pharmaceutical Research Laboratories, L.L.C. | Inhibition of follistatin |
| US20200069742A1 (en) * | 2018-08-29 | 2020-03-05 | Myos Rens Technology Inc. | Methods for alleviating, inhibiting or reversing muscle disuse atrophy in mammals |
| WO2023242251A1 (en) | 2022-06-15 | 2023-12-21 | UCB Biopharma SRL | Follistatin-fc fusion proteins |
| WO2023242271A1 (en) | 2022-06-15 | 2023-12-21 | UCB Biopharma SRL | Fusion protein for the prevention, treatment or amelioration of kidney diseases |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1993048A (zh) * | 2002-02-21 | 2007-07-04 | 惠氏公司 | 包含促滤泡素抑制素结构域的蛋白质 |
| WO2009158035A3 (en) * | 2008-06-26 | 2010-06-03 | Acceleron Pharma Inc. | Methods for dosing an activin-actriia antagonist and monitoring of treated patients |
Family Cites Families (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1987005330A1 (en) | 1986-03-07 | 1987-09-11 | Michel Louis Eugene Bergh | Method for enhancing glycoprotein stability |
| US5041538A (en) | 1987-08-28 | 1991-08-20 | The Salk Institute For Biological Studies | Mammalian follistatin |
| US5182375A (en) | 1987-08-28 | 1993-01-26 | The Salk Institute For Biological Studies | DNA encoding follistatin |
| EP0528011A4 (en) * | 1991-02-08 | 1993-06-30 | Progenics Pharmaceuticals, Inc. | Cd4-gamma2 and cd4-igg2 chimeras |
| JPH08501314A (ja) | 1992-09-16 | 1996-02-13 | ジェネンテク,インコーポレイテッド | Hgfによる肝臓障害に対する保護 |
| US6686198B1 (en) | 1993-10-14 | 2004-02-03 | President And Fellows Of Harvard College | Method of inducing and maintaining neuronal cells |
| CA2174098C (en) | 1993-10-14 | 2011-01-25 | Douglas A. Melton | Method of inducing and maintaining neuronal cells |
| US5541087A (en) | 1994-09-14 | 1996-07-30 | Fuji Immunopharmaceuticals Corporation | Expression and export technology of proteins as immunofusins |
| US5545616A (en) | 1994-09-22 | 1996-08-13 | Genentech, Inc. | Method for predicting and/or preventing preterm labor |
| GB2306481A (en) | 1995-10-21 | 1997-05-07 | Univ Manchester | Pharmaceutical comprising a stimulator of activin and/or inhibin |
| US6656475B1 (en) | 1997-08-01 | 2003-12-02 | The Johns Hopkins University School Of Medicine | Growth differentiation factor receptors, agonists and antagonists thereof, and methods of using same |
| AU8666398A (en) | 1997-08-01 | 1999-02-22 | Johns Hopkins University School Of Medicine, The | Methods to identify growth differentiation factor (gdf) receptors |
| US6891082B2 (en) | 1997-08-01 | 2005-05-10 | The Johns Hopkins University School Of Medicine | Transgenic non-human animals expressing a truncated activintype II receptor |
| US6004937A (en) | 1998-03-09 | 1999-12-21 | Genetics Institute, Inc. | Use of follistatin to modulate growth and differentiation factor 8 [GDF-8] and bone morphogenic protein 11 [BMP-11] |
| MXPA01007366A (es) | 1999-01-21 | 2002-06-04 | Metamorphix Inc | Inhibidores de factores de crecimiento y diferenciacion y usos de los mismos. |
| AU777783B2 (en) | 1999-04-19 | 2004-10-28 | Kyowa Hakko Kogyo Co. Ltd. | Proliferation inhibitor for androgen-independent tumor |
| WO2001009368A1 (en) | 1999-07-30 | 2001-02-08 | The General Hospital Corporation | Follistatin antagonists |
| JP4487376B2 (ja) | 2000-03-31 | 2010-06-23 | 味の素株式会社 | 腎疾患治療剤 |
| AUPR638101A0 (en) | 2001-07-13 | 2001-08-09 | Bioa Pty Limited | Composition and method for treatment of disease |
| BR0307907A2 (pt) | 2002-02-21 | 2011-07-05 | Wyeth Corp | gasp1: proteìna contendo domìnio de folistatina |
| AU2003216345A1 (en) | 2002-02-21 | 2003-09-09 | Wyeth | Follistatin domain containing proteins |
| EP1646400B1 (en) | 2003-03-21 | 2010-07-21 | Celldex Therapeutics Limited | Treatment of allergic diseases using a modulator of the notch signaling pathway |
| JP5110877B2 (ja) | 2003-06-02 | 2012-12-26 | ワイス・エルエルシー | 神経筋障害を処置するための、コルチコステロイドと組み合わせたミオスタチン(gdf8)インヒビターの使用 |
| US20070135336A1 (en) | 2003-09-15 | 2007-06-14 | De Kretser David | Follistatin isoforms and uses thereof |
| WO2005033134A2 (en) * | 2003-09-30 | 2005-04-14 | Regeneron Pharmaceuticals, Inc. | Secreted protein therapeutics and uses thereof |
| WO2005032578A1 (en) | 2003-10-06 | 2005-04-14 | Monash University | Therapeutic method |
| JP4688483B2 (ja) | 2004-04-15 | 2011-05-25 | 株式会社テクノネットワーク四国 | フォリスタチン変異体ポリペプチド |
| JP2008507288A (ja) * | 2004-07-23 | 2008-03-13 | アクセルロン ファーマ インコーポレーテッド | ActRII受容体ポリペプチド、方法、および組成物 |
| AU2005272646A1 (en) | 2004-08-12 | 2006-02-23 | Wyeth | Combination therapy for diabetes, obesity, and cardiovascular diseases using GDF-8 inhibitors |
| NZ538097A (en) | 2005-02-07 | 2006-07-28 | Ovita Ltd | Method and compositions for improving wound healing |
| PT2407486T (pt) | 2005-08-19 | 2018-02-21 | Univ Pennsylvania | Anticorpos antagonistas contra gdf-8 e utilizações no tratamento de ela e outros distúrbios associados a gdf-8 |
| US20070149458A1 (en) * | 2005-12-06 | 2007-06-28 | Amgen Inc. | Uses of myostatin antagonists |
| WO2008030367A2 (en) | 2006-09-01 | 2008-03-13 | The General Hospital Corporation | Selective myostatin inhibitors |
| EP2097095B1 (en) | 2006-11-29 | 2016-01-27 | Nationwide Children's Hospital | Myostatin inhibition for enhancing muscle and/or improving muscle function |
| US20100028332A1 (en) | 2006-12-18 | 2010-02-04 | Acceleron Pharma Inc. | Antagonists of actriib and uses for increasing red blood cell levels |
| EA202091230A3 (ru) | 2006-12-18 | 2021-01-29 | Акселерон Фарма Инк. | Антагонисты активин-actrii и их применения для повышения уровней эритроцитов |
| US8895016B2 (en) | 2006-12-18 | 2014-11-25 | Acceleron Pharma, Inc. | Antagonists of activin-actriia and uses for increasing red blood cell levels |
| PT2235064E (pt) | 2008-01-07 | 2016-03-01 | Amgen Inc | Método de preparação de moléculas heterodiméricas de fc de anticorpos utilizando efeitos de indução eletrostática |
| CN107252486B (zh) * | 2008-06-26 | 2021-10-22 | 阿塞勒隆制药公司 | 激活素-actrii的拮抗剂及在提高红细胞水平中的用途 |
| KR102133683B1 (ko) * | 2009-09-09 | 2020-07-14 | 악셀레론 파마 인코포레이티드 | ActRIIb 길항제들와 이의 투약 및 용도 |
| JP5813114B2 (ja) | 2010-08-25 | 2015-11-17 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Il−18r1に対する抗体およびその使用 |
| MX352929B (es) | 2010-11-05 | 2017-12-13 | Zymeworks Inc | DISEÑO DE ANTICUERPOS HETERODIMÉRICOS ESTABLES CON MUTACIONES EN EL DOMINIO Fc. |
| CA2868996A1 (en) * | 2012-04-02 | 2013-10-10 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of proteins |
| EP2844271B1 (en) | 2012-05-17 | 2018-02-28 | Paranta Biosciences Limited | Use of follistatin or of an activin inhibitor for preventing or treating tissue graft dysfunction |
| AU2013281328B2 (en) * | 2012-06-27 | 2017-11-23 | Meiragtx Uk Ii Limited | Combination for treating an inflammatory disorder |
| MX362105B (es) * | 2013-01-25 | 2019-01-04 | Shire Human Genetic Therapies | Folistatina en el tratamiento de distrofia muscular de duchenne. |
| WO2014187807A1 (en) | 2013-05-21 | 2014-11-27 | Arcarios B.V. | Follistatin derivatives |
| CN106795224B (zh) | 2014-06-04 | 2021-05-18 | 阿塞勒隆制药公司 | 用促滤泡素抑制素多肽治疗病症的方法和组合物 |
| US10010498B2 (en) | 2014-06-04 | 2018-07-03 | Acceleron Pharma Inc. | Methods for treatment of amyotrophic lateral sclerosis with follistatin fusion proteins |
| EP3274457A4 (en) * | 2015-03-26 | 2018-08-08 | Acceleron Pharma Inc. | Follistatin-related fusion proteins and uses thereof |
| MX2019013523A (es) | 2017-05-12 | 2020-07-14 | Takeda Pharmaceuticals Co | Proteínas de fusión de folistatina-fc recombinante y uso en el tratamiento de la distrofia muscular de duchenne. |
-
2015
- 2015-06-04 CN CN201580041740.2A patent/CN106795224B/zh active Active
- 2015-06-04 EA EA202090632A patent/EA202090632A1/ru unknown
- 2015-06-04 BR BR112016028520A patent/BR112016028520A2/pt not_active Application Discontinuation
- 2015-06-04 CN CN202110533308.2A patent/CN113583104A/zh active Pending
- 2015-06-04 US US14/731,009 patent/US10023621B2/en active Active
- 2015-06-04 WO PCT/US2015/034245 patent/WO2015187977A1/en active Application Filing
- 2015-06-04 JP JP2016570806A patent/JP6568110B2/ja active Active
- 2015-06-04 EA EA201692529A patent/EA035455B1/ru not_active IP Right Cessation
- 2015-06-04 KR KR1020177000297A patent/KR102077286B1/ko active IP Right Grant
- 2015-06-04 MX MX2016015868A patent/MX2016015868A/es unknown
- 2015-06-04 MA MA051075A patent/MA51075A/fr unknown
- 2015-06-04 KR KR1020207018965A patent/KR102305109B1/ko active IP Right Grant
- 2015-06-04 KR KR1020207003791A patent/KR102132144B1/ko active IP Right Grant
- 2015-06-04 EP EP15802909.0A patent/EP3152237B1/en active Active
- 2015-06-04 EP EP20160287.7A patent/EP3721892B1/en active Active
- 2015-06-04 MA MA051074A patent/MA51074A/fr unknown
- 2015-06-04 CA CA2950754A patent/CA2950754C/en active Active
- 2015-06-04 AU AU2015269333A patent/AU2015269333B2/en active Active
- 2015-06-04 KR KR1020217029755A patent/KR20210119546A/ko not_active Application Discontinuation
-
2016
- 2016-12-01 MX MX2021006017A patent/MX2021006017A/es unknown
-
2018
- 2018-06-12 US US16/006,025 patent/US10954279B2/en active Active
-
2019
- 2019-08-01 JP JP2019142333A patent/JP6856716B2/ja active Active
-
2020
- 2020-08-03 AU AU2020210315A patent/AU2020210315A1/en not_active Abandoned
-
2021
- 2021-03-18 JP JP2021044545A patent/JP2021095416A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1993048A (zh) * | 2002-02-21 | 2007-07-04 | 惠氏公司 | 包含促滤泡素抑制素结构域的蛋白质 |
| WO2009158035A3 (en) * | 2008-06-26 | 2010-06-03 | Acceleron Pharma Inc. | Methods for dosing an activin-actriia antagonist and monitoring of treated patients |
Non-Patent Citations (3)
| Title |
|---|
| Amita Datta-Mannan et al.An Engineered Human Follistatin Variant: Insights into the Pharmacokinetic and Pharmocodynamic Relationships of a Novel Molecule with Broad Therapeutic Potential.《Journal of Pharmacology and Experimental Therapeutics》.2013,第344卷(第3期),第616-623页. * |
| An Engineered Human Follistatin Variant: Insights into the Pharmacokinetic and Pharmocodynamic Relationships of a Novel Molecule with Broad Therapeutic Potential;Amita Datta-Mannan et al;《Journal of Pharmacology and Experimental Therapeutics》;20130301;第344卷(第3期);第616-623页 * |
| Follistatin: A Novel Therapeutic for the Improvement of Muscle Regenerations;Benjamin C.Yaden et al;《Journal of Pharmacology and Experimental Therapeutics》;20140313;第349卷(第2期);第355-371页 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN106795224B (zh) | 用促滤泡素抑制素多肽治疗病症的方法和组合物 | |
| US11497792B2 (en) | Methods for treatment of Duchenne muscular dystrophy with follistatin polypeptides | |
| JP2020073604A (ja) | ActRII受容体ポリペプチド、方法、および組成物 | |
| EP3290439B1 (en) | Truncated actriib-fc fusion proteins | |
| TW202021980A (zh) | 衍生自ActRIIB的變體與其用途 | |
| WO2019191204A1 (en) | Follistatin polypeptides for the treatment of muscle contracture |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1238658 Country of ref document: HK |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |