CN104968801B - 用于治疗贫血症的生物标志物 - Google Patents
用于治疗贫血症的生物标志物 Download PDFInfo
- Publication number
- CN104968801B CN104968801B CN201380067792.8A CN201380067792A CN104968801B CN 104968801 B CN104968801 B CN 104968801B CN 201380067792 A CN201380067792 A CN 201380067792A CN 104968801 B CN104968801 B CN 104968801B
- Authority
- CN
- China
- Prior art keywords
- gdf11
- activity
- level
- seq
- polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/74—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving hormones or other non-cytokine intercellular protein regulatory factors such as growth factors, including receptors to hormones and growth factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/179—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/72—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving blood pigments, e.g. haemoglobin, bilirubin or other porphyrins; involving occult blood
- G01N33/721—Haemoglobin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/475—Assays involving growth factors
- G01N2333/51—Bone morphogenetic factor; Osteogenins; Osteogenic factor; Bone-inducing factor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Hematology (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Cell Biology (AREA)
- Biochemistry (AREA)
- Analytical Chemistry (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pathology (AREA)
- Physics & Mathematics (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Genetics & Genomics (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Diabetes (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Toxicology (AREA)
- Wood Science & Technology (AREA)
- Epidemiology (AREA)
- Endocrinology (AREA)
- General Engineering & Computer Science (AREA)
Abstract
本文提供了通过使用活化素受体的配体,尤其是生长分化因子11(GDF11)的水平和/或活性来治疗与贫血症或无效性红细胞生成有关的疾病的方法,所述生长分化因子11是患者对治疗的反应、治疗效力或使用活化素II型受体抑制剂治疗的适当剂量的指征。
Description
本发明申请主张2012年10月24日提交的美国临时专利申请No.61/718126的优先权,该专利申请的公开内容以其全部内容作为参考并入本文。
1.引言
本文提供了通过使用活化素II型受体的配体,具体地,生长分化因子11(GDF11)的水平和/或活性治疗与贫血症或无效性红细胞生成有关的疾病的方法,所述生长分化因子11是患者对治疗的反应、治疗效力或使用活化素II型受体抑制剂治疗的适当剂量的指征。例如,本文提供了用于确定GDF11的水平和/或活性,选择GDF11水平和/或活性升高的患者,和使用活化素II型受体抑制剂治疗GDF11水平和/或活性升高的患者的方法。本文还提供了包括确定用活化素II型受体抑制剂处理的患者中GDF11的水平和/或活性,和根据所述患者中GDF11的水平和/或活性以剂量的量施用活化素II型受体抑制剂的方法。这种活化素II型受体抑制剂可以是ActRIIA和/或ActRIIB信号转导的抑制剂(例如,由活化素-IIA型受体的胞外域和人IgG1Fc结构域构成的人源化融合蛋白)。
2.发明背景
贫血症是红细胞个数减少或比血液中血红蛋白的正常数量少的病况。贫血症还可以由血红蛋白的氧结合能力降低引起。贫血症是最常见的血液病症。
贫血症可以由无效性红细胞生成引起。如果发生活性红细胞生成但是不能以正确的比例发育成熟红细胞,则存在无效性红细胞生成。在达到成熟红细胞阶段前,祖细胞经历细胞凋亡。
地中海贫血症是无效性红细胞生成的一种形式。在地中海贫血症中,无效性红细胞生成的特征在于成熟成核红细胞样细胞的细胞凋亡。具体地,β地中海贫血是以血红蛋白(或Hgb)合成缺陷,从而导致红血球成熟和生产损害的疾病。认为减少主要是由于异常加速的红细胞分化和在红细胞分化的晚期嗜碱性/多染性成红细胞阶段的细胞凋亡所引起的,从而导致成熟红细胞产生的整体减少。β地中海贫血症的特征在于骨髓隔室(bone marrowcompartment)细胞过多,在此异常成红细胞积累并经历细胞凋亡,从而导致全身性贫血症。
包括TGF-β、活化素、骨形态发生蛋白(BMP)以及生长和分化因子(GDF)在内的转化生长因子β(TGF-β)家族是已知在发育和组织体内平衡期间调控多种细胞代谢过程的分泌蛋白。TGF-β1、活化素A、BMP-2和BMP-4均与多种模型系统中红细胞生成的调控有关。基于上下文,TGF-beta1抑制和促进红细胞分化,活化素A显示是前红细胞分化试剂(pro-erythroid differentiation agent),而BMP-4与鼠科模型中急性贫血症的应激红细胞生成和恢复有关。BMP-2对早期红细胞样细胞起作用以提高得自动员的周围血液或者骨髓CD34+细胞的样品中的集落形成。这些生长因子中一些的异常高水平与多种血液疾病有关。例如,GDF-15的高水平通常不是正常红细胞生成的特征,但是在无效性红细胞生成的情况下,GDF-15的表达升高。
TGF-β超家族由超过30种蛋白组成,并且它们仅通过有限的受体和信号通路进行信号转导,表明了它们的动作中固有的杂乱和冗余。此外,在任何给定组织中,可以存在几种不同的配体,并且据推测,信号转导是通过受体亚组的重叠发生的,这使将特定配体与它们的功能之间相关联的能力复杂化。GDF11是GDF亚家族成员并且与GDF8(也称为肌肉生成抑制素)共有约90%的氨基酸同源性。两者可以结合活化素IA型和B型受体并激活Smad 2/3信号通路。GDF11在发育中起重要作用,其参与肌肉、软骨、骨、肾和神经系统的形成,同时在成年组织中,在胰腺、肠、肾、骨骼肌、脑和牙髓中检测到GDF11。在循环系统中也可以存在少量的GDF-11。然而,到目前为止,尚无描述红细胞生成中GDF-11作用的证据。
活化素II型受体也可以结合GDF11。已鉴别了两个相关II型受体ActRIIa和ActRIIb(Mathews and Vale,1991,Cell 65:973-982;Attisano等人,1992,Cell 68:97-108)。除GDF11之外,ActRIIa和ActRIIb可以与几种其他TGF-β家族蛋白生物化学地相互作用,包括BMP7、Nodal、GDF8和活化素(Yamashita等人,1995,J.Cell Biol.130:217-226;Leeand McPherron,2001,Proc.Natl.Acad.Sci.98:9306-9311;Yeo and Whitman,2001,Mol.Cell 7:949-957;Oh等人,2002,Genes Dev.16:2749-54)。ALK4是活化素,特别是活化素A的主要I型受体,并且ALK-7也可以用作活化素,具体地活化素B的受体。
目前,正在临床II期试验中对贫血症和与晚期肾病(ESRD)有关的骨病症患者的治疗以及对那些β地中海贫血症患者评价由活化素IIA型受体(ActRIIA)和人IgG1Fc构成的人源化融合蛋白(ActRIIA-hFc)。在健康绝经后妇女中,ActRIIA-hFc显示出显著提高的血细胞比容(Hct)和血红蛋白(Hgb)以及骨矿物密度。然而,血流中ActRIIA-hFc螯合的ActRIIA配体的身份仍是未知的。
3.发明概述
在一个方面,本文提供了使用GDF11作为患者对治疗的反应、治疗效力或使用活化素II型受体抑制剂对患者治疗的适当剂量的指标,治疗贫血症或与贫血症或无效性红细胞生成有关的血液病症的方法。
在某些实施方式中,本文提供了确定患有贫血症或病症,例如,与贫血症或无效性红细胞生成有关的血液病症的患者的组织样品中GDF11的水平和/或活性的方法。在一些实施方式中,本文提供了确定患有贫血症或病症(例如,与贫血症或无效性红细胞生成有关的血液病症)的患者的组织样品中GDF11的水平和/或活性,并将其与GDF11的正常水平和/或活性(例如,来自健康受试者相同组织的样品中的GDF11的平均水平和/或活性)相比较的方法。在一些实施方式中,本文提供了确定患有贫血症或病症(例如,与贫血症或无效性红细胞生成有关的血液病症)的患者的组织样品(例如,血清/血浆、血液、骨髓、脾或肝)中GDF11的水平和/或活性,并将其与来自所述受试者不同组织(如其中患有贫血症的患者中GDF11的水平不升高的组织)的样品中的GDF11的水平和/或活性相比较的方法。
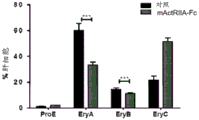
在某些实施方式中,本文提供了治疗贫血症或与贫血症或无效性红细胞生成有关的血液病症的方法,其中所述方法包括:(a)评价所述受试者的组织样品中GDF11的水平和/或活性,和(b)如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则向所述受试者施用活化素II型受体抑制剂。在一些实施方式中,本文提供了治疗贫血症或与贫血症或无效性红细胞生成有关的血液病症的方法,其中所述方法包括:(a)施用活化素II型受体抑制剂,和(b)监测受试者组织样品中GDF11的水平和/或活性。在某些实施方式中,本文提供了治疗贫血症或与贫血症或无效性红细胞生成有关的血液病症的方法,其中所述方法包括:(a)施用一定剂量的活化素II型受体抑制剂,(b)评价受试者组织样品中GDF11的水平和/或活性,和(c)调节活化素II型受体抑制剂的剂量,其中如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则提高活化素II型受体抑制剂的剂量,并且其中,如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低,则减少活化素II型受体抑制剂的剂量。根据本文所述的方法治疗的与贫血症或无效性红细胞生成有关的血液病症无限制地包括地中海贫血(例如,β地中海贫血)、脊髓发育不良综合征、慢性恶性贫血症、镰刀形红细胞贫血症、戴-布二氏贫血症、红细胞水平降低或嗜酸性成红细胞(Ery-C)减少。在优选的实施方式中,根据本文所述的方法治疗的受试者为人。
在某些实施方式中,本文提供了治疗需要治疗的受试者中贫血症的方法,其中所述方法包括:(a)评价所述受试者组织样品中GDF11的水平和/或活性,和(b)如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则向所述受试者施用活化素II型受体抑制剂。
另外,在一些实施方式中,本文提供了治疗需要治疗的受试者中地中海贫血(例如,β地中海贫血)的方法,其中所述方法包括:(a)评价所述受试者组织样品中GDF11的水平和/或活性,和(b)如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则向所述受试者施用活化素II型受体抑制剂。在具体的实施方式中,本文提供了治疗需要治疗的受试者中地中海贫血(例如,β地中海贫血)的方法,其中所述方法包括:(a)施用一定剂量的活化素II型受体抑制剂,(b)评价受试者组织样品中GDF11的水平和/或活性,和(c)调节活化素II型受体抑制剂的剂量,其中如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则提高活化素II型受体抑制剂的剂量,并且其中,如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低,则减少活化素II型受体抑制剂的剂量。
在一些实施方式中,本文提供了提高对其有需要的受试者中红细胞水平或嗜酸性成红细胞(Ery-C)水平的方法,其中所述方法包括:(a)评价受试者组织样品中GDF11的水平和/或活性,和(b)如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则向所述受试者施用活化素II型受体抑制剂。在其他实施方式中,本文提供了提高对其有需要的受试者中红细胞水平或嗜酸性成红细胞(Ery-C)水平的方法,其中所述方法包括:(a)施用一定剂量的活化素II型受体抑制剂,(b)评价受试者组织样品中GDF11的水平和/或活性,和(c)调节活化素II型受体抑制剂的剂量,其中如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则提高活化素II型受体抑制剂的剂量,并且其中,如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低,则减少活化素II型受体抑制剂的剂量。
在具体的实施方式中,根据本文所述的方法的活化素II型受体抑制剂的施用导致患者中晚期嗜碱性和多染性成红细胞(Ery-B)的细胞计数减少。在一些实施方式中,所述施用导致患者中骨髓和/或脾细胞减少。在一些实施方式中,所述施用导致患者中网织红细胞计数减少。在一些实施方式中,所述施用导致患者中转铁蛋白饱和度降低和/或全身铁含量降低。在优选的实施方式中,根据本文所述的方法的活化素II型受体抑制剂的施用导致患者中红细胞计数升高、血细胞比容水平升高和/或血红蛋白水平升高。在具体的实施方式中,根据本文所述的方法的活化素II型受体抑制剂的施用导致患者中平均红血球容积(MCV)、红细胞平均血红蛋白(MCH)和/或MCH浓度升高。在某些实施方式中,除了评价受试者中的GDF11的水平和/或活性外,还评价了受试者中的这些结果。
在某些实施方式中,可以在本文所提供的方法中使用的ActRII抑制剂是包含下列氨基酸序列的多肽,所述氨基酸序列选自:与SEQ ID NO:2具有90%的同一性;与SEQ IDNO:2具有95%的同一性;与SEQ ID NO:2具有98%的同一性;SEQ ID NO:2;与SEQ ID NO:3具有90%的同一性;与SEQ ID NO:3具有95%的同一性;与SEQ ID NO:3具有98%的同一性;SEQ ID NO:3;与SEQ ID NO:6具有90%的同一性;与SEQ ID NO:6具有95%的同一性;与SEQID NO:6具有98%的同一性;SEQ ID NO:6;与SEQ ID NO:7具有90%的同一性;与SEQ IDNO:7具有95%的同一性;与SEQ ID NO:7具有98%的同一性;SEQ ID NO:7;与SEQ ID NO:12具有90%的同一性;与SEQ ID NO:12具有95%的同一性;与SEQ ID NO:12具有98%的同一性;SEQ ID NO:12;与SEQ ID NO:17具有90%的同一性;与SEQ ID NO:17具有95%的同一性;与SEQ ID NO:17具有98%的同一性;SEQ ID NO:17;与SEQ ID NO:20具有90%的同一性;与SEQ ID NO:20具有95%的同一性;与SEQ ID NO:20具有98%的同一性;SEQ ID NO:20;与SEQ ID NO:21具有90%的同一性;与SEQ ID NO:21具有95%的同一性;与SEQ ID NO:21具有98%的同一性;SEQ ID NO:21.在一些实施方式中,ActRII抑制剂是由ActRIIA的胞外域和人IgG1Fc结构域组成的人源化融合蛋白。在更具体的实施方式中,ActRII抑制剂是包含SEQ ID NO:7的氨基酸序列的多肽。在一种实施方式中,ActRII抑制剂是肠胃外施用的。
在某些实施方式中,GDF11的正常水平和/或活性是一个或多个健康受试者(例如,相同年龄组别和/或相同性别的健康受试者)的组织样品中的GDF11的平均水平和/或活性。在一些实施方式中,将治疗受试者的组织样品中的GDF11的水平和/或活性与来自一个或多个健康受试者的相同组织的样品中的GDF11的水平和/或活性相比较。在一些实施方式中,其中评价GDF11的水平和/或活性的组织是全血、血液血清/血浆、骨髓、肝或脾。在一种实施方式中,其中评价GDF11的水平和/或活性的组织是血清。
可以通过本领域中已知的或本文所述的任何方法测量GDF11的水平和/或活性。在一种实施方式中,GDF11的水平和/或活性为GDF11的蛋白水平。在一种实施方式中,GDF11的水平和/或活性为GDF11的mRNA水平。
在某些实施方式中,当相对于GDF11的正常水平和/或活性升高至少10%、至少25%、至少30%、至少40%、至少50%、至少60%、至少75%、至少80%、至少90%、至少100%、至少200%、至少300%或至少500%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高。在某些实施方式中,当相对于GDF11的正常水平和/或活性升高至少25%、至少50%、至少75%、至少100%或至少200%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高。在具体的实施方式中,当相对于GDF11的正常水平和/或活性升高至少50%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高。在具体的实施方式中,当相对于GDF11的正常水平和/或活性升高至少100%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高。在具体的实施方式中,当相对于GDF11的正常水平和/或活性升高至少200%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高。在一种实施方式中,当相对于GDF11的正常水平和/或活性升高至少1.5或2倍时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高。在一些实施方式中,当相对于GDF11的正常水平和/或活性降低至少10%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少90%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低。在一些实施方式中,当相对于GDF11的正常水平和/或活性降低至少25%、至少50%、至少75%或至少90%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低。在一种实施方式中,当相对于GDF11的正常水平和/或活性降低至少25%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低。在一种实施方式中,当相对于GDF11的正常水平和/或活性降低至少50%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低。在一种实施方式中,当相对于GDF11的正常水平和/或活性降低至少75%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低。在一种实施方式中,当相对于GDF11的正常水平和/或活性降低至少1.5或2倍时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低。
4.附图说明
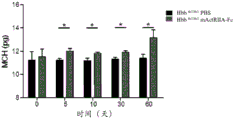
图1示出了在b-地中海贫血症小鼠中,SEQ ID NO 7(mActRIIA-Fc)的鼠科对应物改善了血液学参数。用PBS或mActRIIA-Fc(10mg/kg体重,每周两次)处理Hbbth1/th1小鼠(Skow LC等人,Cell 34:1043-52,1983)60天。在第5、10、30和60天评价血液学参数。(A)红细胞计数、(B)血细胞比容和(c)血红蛋白的评价与(D)网状细胞增多的减少有关。循环红细胞(RBC)参数的分析还显示在用mActRIIA-Fc处理的小鼠中(E)平均红血球容积(MCV)、(F)红细胞平均血红蛋白(MCH)和(G)MCH浓度(MCHC)增加。(H)总抗氧化状态。(I)形态分析显示红细胞不均、红细胞异形和靶细胞减少。还对地中海贫血症小鼠评价了(J)全身铁含量、(K)转铁蛋白合成、(L)转铁蛋白和(M)铁蛋白饱和度水平。还评价了(N)炎性细胞计数。通过(O)脾重量和总细胞数目评价了mActRIIA-Fc对地中海贫血症小鼠中的脾肿大的影响。(P)在用mActRIIA-Fc处理的小鼠中,骨髓成红细胞数目和扩增(曙红/苏木精染色)也减少。(Q)通过TER119染色,通过流式细胞术定量骨髓和脾成红细胞。对于每个独立的实验,*p<0.05,N=3-5。
图2示出了mActRIIA-Fc降低地中海贫血症小鼠中无效性红细胞生成。(A-C)收获骨髓和脾并通过CD71/TER119染色和FSC/SSC分布,通过流式细胞术评价成红细胞分化。(D)总胆红素水平和直接胆红素水平的分析。(E)使用二氯双氢荧光素,通过流式细胞术评价原代原红细胞分化的活性氧(ROS)生成。(F)用mActRIIA-Fc或PBS处理48小时的原代地中海贫血的原红细胞的血红蛋白溶解度的分析。对每个独立实验,*p<0.05,**p<0.01,***p<0.005,N=3-5。
图3示出了mActRIIA-Fc对地中海贫血症小鼠的成红细胞的细胞凋亡的影响。mActRIIA-Fc或PBS处理的小鼠的骨髓(A)和脾(B)成红细胞上Fas-L的表达。(c)在mActRIIA-Fc处理的小鼠中,成红细胞的Tunel染色增加。
图4示出了地中海贫血症小鼠的脾中ActRIIA配体的表达。(A)mActRIIA-Fc处理的动物中,ActRII、活化素A、活化素B和GDF11的mRNA表达水平增加。(B)GDF11蛋白水平的免疫印迹分析,其在mActRIIA-Fc处理的动物中降低。(c)针对GDF11的骨髓的免疫组织化学染色显示野生型和用mActRIIA-Fc处理的小鼠之间无变化。
图5示出了在原代地中海贫血的原成红细胞中mActRIIA-Fc对GDF11表达的影响。(A)用PBS或mActRIIA-Fc处理30天的地中海贫血症小鼠的活化素/GDF信号通路的免疫组织化学分析,其显示地中海贫血症小鼠的GDF11、ActRII和p-Smad2水平提高。(B)与其他贫血症模型相比,地中海贫血症小鼠的活化素A、活化素B和GDF11的免疫组织化学分析。(c)使用抗活化素A、活化素B、GDF11前肽和GDF8/GDF11切割肽的特异性抗体,用PBS或mActRIIA-Fc处理48小时的原代地中海贫血的原红细胞的FACS分析。图中线条显示了GDF11染色的定量。(D)用PBS或mActRIIA-Fc处理的地中海贫血症小鼠的脾中GDF11前体形式(proform)表达的免疫组织化学分析。*p<0.05,N=4。
图6示出了GDF11的抑制降低地中海贫血症小鼠中无效性红细胞生成。(A)收获骨髓和脾并通过CD71/TER119染色和FSC/SSC分布,通过流式细胞术评价原代原红细胞的分化。(B)使用二氯双氢荧光素,通过流式细胞术评价原代原红细胞分化的活性氧生成。*p<0.05,N=4。
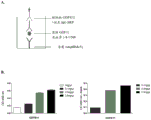
图7示出了检测血清中GDF11的夹心ELISA测定。(A)测定的简图。(B)用5mg/mLmActRIIA-Fc涂覆板,并将重组GDF11的提高的剂量(0ng/mL、0.1ng/mL、0.5ng/mL、2.5ng/mL)或者对照血清(1/4至1/500稀释)加入到用mActRIIA-Fc涂覆的板中,清洗板,用抗GDF8/11抗体检测结合的蛋白质,然后使用偶联了辣根过氧化物酶的抗兔IgG进行检测。GDF11蛋白以剂量依赖的方式结合板。
图8示出了b-地中海贫血症患者血清中GDF11水平提高的检测。从表现出地中海贫血的患者和健康对照获得血清。
图9示出了检测血清中活化素A的夹心ELISA测定。(A)测定的简图。(B)用5mg/mLActRIIA-Fc(SEQ ID NO.7)涂覆板,并将重组活化素A的提高的剂量(0ng/mL、0.1ng/mL、0.5ng/mL、2.5ng/mL)或者对照血清(1/4至1/500稀释)加入到ActRIIA-Fc板中,清洗板,用抗活化素A抗体检测结合的蛋白质,然后使用偶联了辣根过氧化物酶的抗兔IgG进行检测。活化素A蛋白以剂量依赖的方式结合板。(c)b-地中海贫血症患者血清中活化素A水平的检测。从表现出地中海贫血的患者和健康对照获得血清。地中海贫血症患者中活化素A的血清水平无变化。
图10示出了检测血清中活化素B的夹心ELISA测定。(A)测定的简图。(B)用5mg/mLActRIIA-Fc涂覆板,并将重组活化素B的提高的剂量(0ng/mL、0.1ng/mL、0.5ng/mL、2.5ng/mL)或者对照血清(1/4至1/500稀释)加入到ActRIIA-Fc板中,清洗板,用抗活化素B抗体检测结合的蛋白质,然后使用偶联了辣根过氧化物酶的抗兔IgG进行检测。活化素B蛋白以剂量依赖的方式结合板。(c)b-地中海贫血症患者血清中活化素B水平的检测。从表现出地中海贫血的患者和健康对照获得血清。地中海贫血症患者中活化素B的血清水平无变化。
图11示出了向C57BL/6野生型小鼠施用mActRIIA-Fc不会改变它们的血液学参数。(A)红细胞计数、(B)血细胞比容、(C)血红蛋白的评价显示与mActRIIA-Fc无结合。(D)网状细胞增多稍微减少。mActRIIA-Fc不会改变红细胞(RBC)参数,如(E)平均红血球容积(MCV)、(F)红细胞平均血红蛋白(MCH)或(G)MCH浓度(MCHC)。对于每个独立的实验,*p<0.05,N=3-5。
图12示出了向C57BL/6野生型小鼠施用mActRIIA-Fc对小鼠的脾和骨髓细胞数目无影响。
图13示出了通过GDF11的抑制,mActRIIA-Fc刺激红细胞分化。(A-C)通过在含有EPO、+/-50μg/mL mActRIIA-Fc的培养基中培养,进行CD34+/CD36+细胞的红细胞分化;分析了(A)红系祖细胞、(B)细胞增殖和(C)红细胞前体。(D-F)当在含有EPO、+/-50μg/mLmActRIIA-Fc的培养基中与骨髓(BM)细胞共培养时,分析CD34+/CD36+细胞的红细胞分化;(D)红系祖细胞、(E)细胞增殖和(F)红细胞前体。(G-H)通过在含有EPO、+/-200ng/mLGDF11、+/-100ug/mL mActRIIA-Fc的培养基中培养,进行CD36+细胞的红细胞分化;分析了(G)细胞增殖和(H)红细胞前体GPA+的百分比。
5.发明详述
5.1.概述
本文提供了通过使用GDF11的水平和/或活性治疗贫血症或与贫血症或无效性红细胞生成有关的疾病或病况的方法,所述GDF11的水平和/或活性是患者对使用活化素II型受体抑制剂治疗的反应、使用活化素II型受体抑制剂治疗的效力或使用活化素II型受体抑制剂治疗的适当剂量的指征。根据本文所述的方法可以治疗的与贫血症或无效性红细胞生成有关的疾病无限制地包括地中海贫血(例如,β地中海贫血)、脊髓发育不良综合征、慢性恶性贫血症、镰刀形红细胞贫血症和戴-布二氏贫血症。根据本文所述的方法可以治疗的与贫血症或无效性红细胞生成有关的病况无限制地包括红细胞水平降低、血红蛋白水平降低、血细胞比容水平降低和嗜酸性成红细胞(Ery-C)减少。在一种实施方式中,本文提供了治疗贫血症的方法。在一种实施方式中,本文提供了治疗地中海贫血(例如,β地中海贫血)的方法。在一种实施方式中,本文提供了治疗红细胞水平降低的方法或提高红细胞水平的方法。在本文所述的方法中使用的活化素II型受体抑制剂可以是ActRIIA和/或ActRIIB的抑制剂,如本文所述的或本领域中已知的任何抑制剂。在优选的实施方式中,活化素II型受体抑制剂是由ActRIIA的胞外域和人IgG1Fc结构域构成的人源化融合蛋白(“ActRIIA-Fc”,SEQ SEQ ID NO:7)。
本文所提供的方法部分基于以下发现:β地中海贫血人患者的血液中和β地中海贫血的小鼠模型中GDF11水平升高并且ActRIIA-mFc(融合至鼠IgG的ActRIIA)降低了β地中海贫血的小鼠模型中GDF11水平升高(参见实施例)。此外,不受理论的限制,ActRIIA-mFc捕获的配体纠正了无效性红细胞生成并且改善了中间型地中海贫血实验小鼠模型(Hbbth1/th1小鼠)中的贫血症。如本文所提供的实施例中所示,用ActRIIA-mFc治疗地中海贫血症小鼠(Hbbth1/th1)提高了红细胞计数、血细胞比容、血红蛋白、平均细胞体积(MCV)和平均细胞血红蛋白,增加了嗜酸性成红细胞(Ery-C),减少了骨髓和脾细胞结构,减少了晚期嗜碱性/多染性成红细胞(Ery-B),在脾和骨髓中,降低了胆红素水平(红细胞破坏减少的指征)和减少了凋亡细胞。此外,本文所提供的方法部分基于以下发现:在体外培养系统中,GDF-11抑制人骨髓源红细胞先体细胞的生长并且ActRIIA-mFc挽救了这种抑制作用(参见实施例)。综合地,本文所提供的数据表明GDF-11水平,例如,GDF11的血液和/或血清水平,可以鉴别哪些患者可以对ActRIIA-Fc起反应并且可以用于监测对药物的临床反应。本文所提供的数据还表明ActRIIA-Fc(例如,ActRIIA-mFc或ActRIIA-hFc,如SEQ ID NO:7)在治疗与无效性红细胞生成有关的贫血症中是有用的。
在实施例中说明的本文所述的发现表明GDF11的水平和/或活性的检测可以(i)用作患者中无效性红细胞生成程度的标志物(例如,血清生物标志物),(ii)用作测量患者对活化素II型受体抑制剂(如ActRIIA-Fc)的反应的标志物,或(iii)用于评价治疗后,患者中活化素II型受体抑制剂(如ActRIIA-Fc)的药效作用,其中所述患者是患有贫血症或与贫血症或无效性红细胞生成有关的疾病(如地中海贫血,例如,β地中海贫血)患者。因此,在某些实施方式中,可以在本文所述的方法中将GDF11用作ActRIIA-Fc(例如,ActRIIA-hFc,如SEQID NO:7)治疗效力的指标和/或对使用ActRIIA-Fc(例如,ActRIIA-hFc,如SEQ ID NO:7)的治疗没有反应的指标。另外,如本文所述,GDF11可以用作可靠的分子标志物以评价ActRIIA-Fc(例如,ActRIIA-hFc,如SEQ ID NO:7)的时间过程治疗效力。另外,在具体的实施方式中,本文提供了方法,其包括检测血液中的GDF11的水平和/或活性(例如,检测与无效性红细胞生成有关的疾病中的异常表达)和以依赖于GDF11的水平和活性的剂量施用活化素II型受体抑制剂,如ActRIIA-Fc。
5.2诊断/预后/治疗方法
在一个方面,本文所提供的方法包括确定受试者组织样品(例如,血清或血液)中的GDF11的水平和/或活性,选择相对于GDF11的正常水平和/或活性,GDF11的水平和/或活性升高的受试者,和用活化素II型受体抑制剂治疗GDF11的水平和/或活性升高的受试者。受试者的组织样品(例如,血清或血液)中GDF11的水平和/或活性的升高可以表明患者可以对使用活化素II型受体抑制剂的治疗起反应。在本文所述的方法的一种实施方式中,活化素II型受体抑制剂为ActRIIA-Fc,如ActRIIA-hFc(例如,SEQ ID NO:7)。
GDF11水平和/或活性还可以用于评价作为用活化素II型受体抑制剂治疗的候选的受试者的适当剂量,评价治疗期间是否调节活化素II型受体抑制剂的剂量,和/或评价活化素II型受体抑制剂的适当维持剂量。如果GDF11的水平和/或活性在正常水平和/或活性之外,则可以根据GDF11的水平和/或活性开始、提高、降低、延迟或终止活化素II型受体抑制剂的剂量施用。如果相对于正常水平和/或活性,GDF11的水平和/或活性升高,则可以起始或提高活化素II型受体抑制剂的剂量施用,并且如果相对于正常水平和/或活性,GDF11的水平和/或活性降低,则可以降低、延迟或终止活化素II型受体抑制剂的剂量施用。
在一个方面,本文所述的方法包括向受试者施用活化素II型受体抑制剂,和监测所述受试者中GDF11的水平和/或活性。施用活化素II型受体抑制剂后,GDF11的水平和/或活性的降低(相对于活化素II型抑制剂施用前的水平和/或活性)可以表明受试者对使用活化素II型受体抑制剂的治疗起反应和/或使用活化素II型受体抑制剂的治疗是有效的。施用活化素II型受体抑制剂后,GDF11的水平或者活性无变化或升高(相对于活化素II型抑制剂施用前的水平或者活性)可以表明受试者对使用活化素II型受体抑制剂的治疗不起反应或者出于效力,受试者需要更高剂量的活化素II型受体抑制剂。
在其他方面,施用活化素II型受体抑制剂后,GDF11的水平和/或活性的变化程度(相对于活化素II型抑制剂施用前的水平和/或活性或者相对于GDF11的正常水平和/或活性)可以表明活化素II型受体抑制剂适当的剂量或剂量方案。例如,活化素II型受体抑制剂的剂量施用后,GDF11的水平和/或活性不降低或降低较小(例如,小于5%、小于10%、小于15%、小于20%或小于25%或小于30%的降低)(相对于活化素II型抑制剂施用前的水平和/或活性)可以表明出于效力,需要或期望更高剂量的活化素II型受体抑制剂。因此,在一些实施方式中,当GDF11的水平和/或活性的评价显示向患者施用活化素II型受体抑制剂剂量后,GDF11的水平和/或活性不降低或不期望地降低较小(例如,小于5%、小于10%、小于15%、小于20%或小于25%或小于30%的降低)时,向患者施用更高剂量的活化素II型受体抑制剂(例如,20%、25%、30%、50%、75%、100%、200%、300%、400%、500%、600%、700%、800%、900%或1000%更高的剂量)。
在其他实施方式中,活化素II型受体抑制剂的剂量施用后,GDF11的水平和/或活性降低(例如,轻微或平均降低,如小于10%、小于15%、小于20%或小于25%、小于30%、小于50%或小于75%的降低,或者10%至75%的降低,或者25%至50%的降低)(相对于活化素II型抑制剂施用前的水平和/或活性)可以表明在给定剂量和/或剂量方案,使用活化素II型受体抑制剂的治疗是有效的。因此,在一些实施方式中,当在向患者施用活化素II型受体抑制剂剂量后,GDF11的水平和/或活性的评价显示出GDF11的水平和/或活性降低(例如,轻微或平均降低,如小于10%、小于15%、小于20%或小于25%、小于30%、小于50%或小于75%的降低,或者10%至75%的降低,或者25%至50%的降低),则向所述患者施用相同剂量的活化素II型受体抑制剂。在具体的实施方式中,当在向患者施用活化素II型受体抑制剂剂量后,GDF11的水平和/或活性的评价显示出GDF11的水平和/或活性平均或期望的降低(例如,20%至75%之间,25%至75%之间或30%至60%之间的降低),则向所述患者施用相同剂量的活化素II型受体抑制剂。在施用活化素II型受体抑制剂剂量后,GDF11的水平和/或活性较大(或期望较大)的降低(例如,大于50%、大于60%、大于70%、大于75%、大于80%、大于90%、大于95%的降低)(相对于活化素II型抑制剂施用前的水平和/或活性)可以表明较低剂量的活化素II型受体抑制剂是期望的(例如,避免治疗的副作用,如高血压)。因此,在一些实施方式中,当在向患者施用活化素II型受体抑制剂剂量后,GDF11的水平和/或活性的评价显示出GDF11的水平和/或活性较大(或期望较大)的降低(例如,大于50%、大于60%、大于70%、大于75%、大于80%、大于90%、大于95%的降低)时,向所述患者施用较低剂量的活化素II型受体抑制剂(例如,20%、25%、30%、40%、50%、60%、75%、80%、90%或95%较低的剂量)。
可以在向所述患者施用活化素II型受体抑制剂后1天、1周、2周、3周、4周、5周、6周、7周、8周、3个月、4个月、5个月、6个月或1年,通过评价GDF11的水平和/或活性来进行GDF11的水平和/或活性监测。向患者施用活化素II型受体抑制剂后,GDF11的水平和/或活性还可以用作向患者施用活化素II型受体抑制剂的适当或期望频率的指标。例如,如果在活化素II型受体抑制剂施用后,GDF11的水平和/或活性的降低维持一段时间(例如,1天、1周、2周、3周、4周、5周、6周、7周、8周、10周、3个月、4个月、5个月、6个月或1年),那么在所述一段时间内可以施用活化素II型受体抑制剂一次(例如,1天一次、1周一次、2周一次、3周一次、4周一次、5周一次、6周一次、7周一次、8周一次、3个月一次、4个月一次、5个月一次、6个月一次或1年一次)。在具体的实施方式中,如果在活化素II型受体抑制剂施用后,GDF11的水平和/或活性的降低维持(例如)1个月、2个月或3个月以上,则可以分别每1个月、每2个月或每3个月施用活化素II型受体抑制剂一次。
在具体的实施方式中,本文提供了方法,其包括(i)评价受试者(例如,患有贫血症的受试者)的组织(例如,血液、血清、血浆、肝、骨髓和/或脾)中GDF11的水平;(ii)向所述受试者施用活化素II型受体抑制剂;和(iii)在活化素II型受体抑制剂施用后,评价受试者(例如,患有贫血症的受试者)的组织(例如,血液、血清、血浆、肝、骨髓和/或脾)中GDF11的水平。步骤(ii)的施用可以包括活化素II型受体抑制剂的一次施用(即,一次向所述受试者施用单一剂量)或活化素II型受体抑制剂的多次施用(例如,施用可以包括完整的施用方案)。步骤(iii)的评价可以在步骤(ii)的施用后的任何点进行。例如,步骤(iii)的评价可以在步骤(ii)的施用后1天、2天、3天、4天、5天、6天、1周、2周、3周、4周、5周、6周、7周、8周、10周、3个月、4个月、5个月、6个月或1年进行。如另一个实例,步骤(iii)的评价可以在步骤(ii)的施用后1-3天、2-4天、3-5天、5-7天、1-2周、2-3周、3-4周、1-2个月、2-3个月、3-4个月、4-5个月、5-6个月或6-12个月进行。基于步骤(i)和(iii)中评价的结局,可以调整治疗方案。例如,如果相对于在步骤(iii)的评价中确定的受试者组织中GDF11的水平,步骤(i)的评价中确定的受试者的组织中GDF11的水平降低,则可以维持或减少施用于受试者的活化素II型受体抑制剂的剂量。相反,如果相对于在步骤(iii)的评价中确定的受试者组织中GDF11的水平,步骤(i)的评价中确定的受试者的组织中GDF11的水平提供,则可以提高施用于受试者的活化素II型受体抑制剂的剂量。根据需要,可以重复/改变上述方法的步骤以确定适合于经历治疗的受试者的适当的剂量/治疗方案。
在另一个方面,本文提供了方法,其包括(a)向患者施用活化素II型受体抑制剂的第一剂量,(b)确定患者组织样品(例如,血清)中GDF11的水平和/或活性,和(c)施用活化素II型受体抑制剂的第二剂量,其中如果GDF11的水平和/或活性相对于正常值升高,则活化素II型受体抑制剂的第二剂量高于第一剂量(例如,20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%、500%、600%、700%、800%、900%或1000%更高),并且其中如果GDF11的水平和/或活性相对于正常值降低,则活化素II型受体抑制剂的第二剂量低于第一剂量(例如,20%、30%、40%、50%、60%、70%、80%或90%更低)。在该实施方式中,将组织样品中GDF11的水平和/或活性与GDF11的正常水平和/或活性(例如,来自健康受试者(如未患贫血症的相同年龄组中的受试者)相同组织的样品中GDF11的平均水平和/或活性)相比较。在某些实施方式中,当相对于GDF11的正常水平和/或活性升高至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少200%、至少300%或至少500%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高。在某些实施方式中,当相对于GDF11的正常水平和/或活性升高至少25%、至少50%、至少75%、至少100%或至少200%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高。在一些实施方式中,当相对于GDF11的正常水平和/或活性降低至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低。在一些实施方式中,当相对于GDF11的正常水平和/或活性降低至少25%、至少50%、至少75%或至少90%时,认为GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低。
本文所述的方法部分基于以下发现:GDF11抑制红细胞前体的生长,并因此GDF11的水平可以与红细胞的水平相关。期望在患者中维持最佳红细胞水平,因为尽管红细胞、血红蛋白或血细胞比容水平的降低与无效性红细胞生成和贫血症有关,但是红细胞、血红蛋白或血细胞比容水平的过度升高与血压及其他不希望的副作用有关(其可以由高于最佳活化素II型受体抑制剂剂量的治疗所引起)。因此,以将患者中GDF11的水平和/或活性维持在GDF11的正常水平和/或活性或附近(例如,5%、10%、15%、20%、25%、30%、40%、50%、60%或75%内)的剂量方案施用活化素II型受体抑制剂可以是期望的。
在某些实施方式中,如果确定GDF11的水平和/或活性降低至GDF11的正常水平和/或活性以下,则相应调整活化素II型受体抑制剂的施用,例如,延迟直至GDF11的水平和/或活性恢复正常或恢复至GDF11的正常水平和/或活性的5%、10%、15%、20%、25%、30%、40%、50%、60%或75%内,或者暂时或永久停止。在其中确定GDF11的水平和/或活性降低至GDF11的正常水平和/或活性以下的其他实施方式中,不延迟活化素II型受体抑制剂的施用,但是将抑制剂的剂量或剂量施用频率设置在将降低红细胞、血红蛋白或血细胞比容的不可接受的增加的风险的量,或可替代地,对患者开发将抑制剂的使用与应对红细胞、血红蛋白或血细胞比容不可接受的增加的试剂(例如,降压剂)结合的治疗方案。
在某些实施方式中,本文提供了治疗对其有需要的个体中贫血症的方法,所述方法通过确定所述个体中的GDF11的水平和/或活性,并且如果所述GDF11的水平和/或活性升高,则向所述个体施用治疗有效量的活化素II型受体抑制剂,具体地ActRII多肽(例如,ActRIIa-hFc),并且任选地,进一步监测(或确定)GDF11的水平和/或活性,并调整活化素II型受体抑制剂的剂量(其中,例如,如果GDF11相对于正常水平和/或活性升高,则提高活化素II型受体抑制剂的剂量,并且如果GDF11的水平和/或活性相对于正常水平和/或活性降低,则降低活化素II型受体抑制剂的剂量)。
在某些实施方式中,本文提供了治疗对其有需要的个体中β地中海贫血的方法,所述方法通过确定所述个体中的GDF11的水平和/或活性,并且如果所述GDF11的水平和/或活性升高,则向所述个体施用治疗有效量的活化素II型受体抑制剂,具体地ActRII多肽(例如,ActRIIa-hFc),并且任选地,进一步监测(或确定)GDF11的水平和/或活性,并调整活化素II型受体抑制剂的剂量(其中,例如,如果GDF11的水平和/或活性相对于正常值升高,则提高活化素II型受体抑制剂的剂量,并且如果GDF11的水平和/或活性低于正常值,则降低活化素II型受体抑制剂的剂量)。
在某些实施方式中,本文提供了提高对其有需要的个体中红细胞、血红蛋白、血细胞比容或Ery-C水平的方法,所述方法通过确定所述个体中GDF11的水平和/或活性,并且如果所述GDF11的水平和/或活性升高,则向所述个体施用治疗有效量的活化素II型受体抑制剂,具体地ActRII多肽(例如,ActRIIa-hFc),并且任选地,进一步监测(或确定)GDF11的水平和/或活性,并调整活化素II型受体抑制剂的剂量(其中,例如,如果GDF11的水平和/或活性相对于正常值升高,则提高活化素受体拮抗剂的剂量,并且如果GDF11的水平和/或活性低于正常值,则降低活化素II型受体抑制剂的剂量)。
在某些实施方式中,结合治疗或改善贫血症、无效性红细胞生成、红细胞水平降低或本文所述的任何其他血液病症的方法使用本文所提供的方法。在某些实施方式中,结合提高患有贫血症、无效性红细胞生成、红细胞水平降低或本文所述的任何其他血液病症的患者中红细胞水平、血红蛋白水平、血细胞比容水平或集落形成单位水平的方法使用本文所提供的方法。在某些实施方式中,红细胞水平提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、175%、200%、250%、300%、350%、400%、450%或至少500%。在某些实施方式中,血红蛋白水平提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、175%、200%、250%、300%、350%、400%、450%或至少500%。在某些实施方式中,血细胞比容水平提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、175%、200%、250%、300%、350%、400%、450%或至少500%。在某些实施方式中,集落形成单位水平提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、175%、200%、250%、300%、350%、400%、450%或至少500%。在某些实施方式中,结合降低红系祖细胞和前体细胞的细胞凋亡水平的方法使用本文所提供的方法。
5.3患者群体
根据本文所述的方法治疗的受试者可以是任何哺乳动物,如啮齿类和灵长类,并且在优选的实施方式中,是人。在某些实施方式中,本文所述的方法可以用于治疗任何哺乳动物,如啮齿类和灵长类,并且在优选的实施方式中,人患者中的贫血症或无效性红细胞生成,或者监测和/或提高红细胞、血红蛋白、血细胞比容或Ery-C水平。
在一个方面,结合治疗方法使用本文所提供的方法。在一些实施方式中,本文提供了治疗贫血症(例如,由无效性红细胞生成所引起的贫血症)的方法。在某些实施方式中,本文提供了治疗与无效性红细胞生成有关的疾病(例如,地中海贫血、脊髓发育不良综合征、慢性恶性贫血症或镰刀形红细胞贫血症)的方法。在某些实施方式中,本文提供了治疗遗传性骨髓衰竭综合征(如,但不限于,无巨核细胞性血小板减少、戴-布二氏贫血症、先天性角化不良、范科尼贫血症、皮尔森综合征、先天性中性白细胞减少症、舒-戴二氏综合征、血小板减少-桡骨缺失综合症)的方法。在具体的实施方式中,本文提供了治疗特异地影响红细胞的遗传性骨髓衰竭综合征的方法。在某些实施方式中,本文提供了治疗贫血症和/或与晚期肾病有关的骨病症的方法。在一些实施方式中,本文提供了治疗地中海贫血(例如,β-地中海贫血症)、脊髓发育不良综合征、慢性恶性贫血症、镰刀形红细胞贫血症或戴-布二氏贫血症的方法。在一种实施方式中,本文提供了治疗β-地中海贫血的方法。在一种实施方式中,本文提供了治疗戴-布二氏贫血症的方法。
在某些实施方式中,本文提供了治疗患有贫血症(例如,确诊为贫血症)的患者的方法。在一些实施方式中,本文提供了治疗患有(例如,确诊为)与无效性红细胞生成有关的疾病,如地中海贫血症、脊髓发育不良综合征、慢性恶性贫血症或镰刀形红细胞贫血症的患者的方法。在某些实施方式中,本文提供了治疗患有(例如,确诊为)遗传性骨髓衰竭综合征,如无巨核细胞性血小板减少、戴-布二氏贫血症、先天性角化不良、范科尼贫血症、皮尔森综合征、先天性中性白细胞减少症、舒-戴二氏综合征、血小板减少-桡骨缺失综合症或骨髓衰竭综合征的患者的方法,所述病症特异地影响红细胞。在具体的实施方式中,本文提供了治疗患有(例如,确诊为)贫血症和/或与晚期肾病有关的骨病症的患者的方法。在具体的实施方式中,本文提供了治疗患有(例如,确诊为)地中海贫血(例如,β-地中海贫血)、脊髓发育不良综合征、慢性恶性贫血症、镰刀形红细胞贫血症或戴-布二氏贫血症的患者的方法。在一种实施方式中,本文提供了治疗患有(例如,确诊为)β-地中海贫血的患者的方法。
贫血症与多种病症和病况有关,其无限制地包括:慢性肾衰竭、脊髓发育不良综合征、类风湿性关节炎、骨髓移植、实体瘤(例如,乳腺癌、肺癌、结肠癌)、淋巴系统肿瘤(例如,慢性淋巴细胞白血病、非霍奇金和霍奇金淋巴瘤)、造血系统肿瘤(例如,白血病、脊髓发育不良综合征、多发性骨髓瘤)、放射疗法、化疗(例如,含铂治疗方案)、炎性和自体免疫疾病(包括(但不限于)类风湿性关节炎、其他炎性关节炎性皮疹、全身性红斑狼疮(SLE)、急性或慢性皮肤疾病(例如,银屑病)、炎症性肠病(例如,克罗恩氏病和溃疡性结肠炎))、急性或慢性肾脏疾病或衰竭,其包括特发性或先天性病况,急性或慢性肝病、急性或者慢性出血,其中由于患者异体抗体或自体抗体和/或出于宗教原因,不可能红细胞输注的病况、感染(例如,疟疾、骨髓炎)、血红蛋白病(包括,例如,镰刀形红细胞病、地中海贫血)、毒品使用或滥用(例如,酒精误用;出于任何原因而避免输血的贫血症儿科患者)和其中由于循环过载的问题,具有潜在心肺疾病和贫血症的老年患者不能接受输血的情况。在某些实施方式中,本文所述的方法用于治疗患有上述病症或病况中的一种或多种的任何患者中的贫血症,或监测和/或提高红细胞、血红蛋白、血细胞比容或Ery-C水平。
在某些实施方式中,本文提供了治疗贫血症的方法,其中所述受试者对促红细胞生成素的施用不起反应。在某些实施方式中,本文提供了治疗贫血症的方法,其中所述受试者对铁、维生素B-12和/或叶酸的施用不起反应。在某些实施方式中,本文提供了治疗由对细胞凋亡所引起的死亡高度敏感的红系祖细胞和前体所引起的贫血症的方法。
在某些实施方式中,根据本文所述的方法治疗(例如,选择用于治疗)的受试者的GDF11的水平和/或活性相对于GDF11的正常水平升高。例如,相对于相同年龄组别中健康受试者的相同组织中的GDF11的平均水平和/或活性,根据本文所述的方法治疗(例如,选择用于治疗)的受试者的组织中具有升高的GDF11的水平和/或活性。可以通过本领域中已知的或本文所述的任何方法评价GDF11的水平和/或活性。在一些实施方式中,根据本文所述的方法治疗的受试者的GDF11的水平和/或活性为GDF11的正常水平和/或活性(例如,健康受试者中的平均水平)的至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、175%、200%、250%、300%、350%、400%、450%、500%或1000%。在具体的实施方式中,根据本文所述的方法治疗的受试者的GDF11的水平和/或活性为GDF11的正常水平和/或活性的至少50%、至少75%、至少100%、至少200%或至少500%。在一些实施方式中,本文所述的方法用于监测、调节或提高已确定具有提高的GDF11水平的受试者中的红细胞、血红蛋白、血细胞比容或Ery-C水平。
在某些实施方式中,根据本文所述的方法治疗(例如,选择用于治疗)的受试者具有(i)相对于(例如,血清、骨髓、肝和/或脾中)GDF11的正常水平,GDF11的水平和/或活性升高,和(ii)贫血症或者与贫血症或无效性红细胞生成有关的疾病或病况(例如,确诊为贫血症的受试者)。在某些实施方式中,相对于GDF11的正常水平,根据本文所述的方法治疗(例如,选择用于治疗)的人患者具有升高的GDF11的血清水平和/或活性,并患有贫血症(例如,已确诊为贫血症)。
在一些实施方式中,根据本文所述的方法治疗的受试者具有不期望地低的红细胞计数、不期望地低的血红蛋白水平、不期望地低的血细胞比容水平和/或不期望地低的Ery-C水平。本文所述的方法可以用于监测、调节和/或提高所选患者群体中红细胞、血红蛋白、血细胞比容或Ery-C水平。在其他实施方式中,本文提供了治疗具有发展不期望地低的红细胞或血红蛋白水平的风险的患者的方法,如将要经历可能导致大量失血的大外科手术或其他程序的那些患者。在一些实施方式中,根据本文所述的方法治疗的受试者将经历可能导致大量失血的大外科手术或另一个程序。
当确定血红蛋白的水平是否是不期望地低的时,小于对适当年龄和性别组别为正常的水平可以指示贫血症,尽管考虑了个体变化。例如,通常认为12g/dl的血红蛋白水平是成年人中正常的下限。血红蛋白低水平的可能原因包括失血、营养不良、药物治疗反应、骨髓的多种问题和多种疾病。可以用旨在将患者恢复至目标血红蛋白水平的剂量方案治疗患者,所述目标血红蛋白水平通常在约10g/dl至约12.5g/dl之间,并且通常为约11.0g/dl(参见Jacobs等人,(2000)Nephrol Dial Transplant 15,15-19),尽管较低的目标水平可能会导致较少的心血管副作用。最佳地,可以对每位患者个别考虑目标血红蛋白水平。在某些实施方式中,用本文所述的方法治疗的患者的血红蛋白水平小于13g/dl、小于12.5g/dl、小于12g/dl、小于11.5g/dl、小于11g/dl、小于10.5g/dl、小于10g/dl、小于9.5g/dl或小于9g/dl。
当确定红细胞水平是否是不期望地低的时,血细胞比容水平(细胞所占血液样品体积的百分比)可以用于评价红细胞的状况。对于成年男性,健康个体的血细胞比容水平在41至51%的范围内,对于成年女性,在35至45%的范围内。目标血细胞比容水平通常在约30-33%,尽管人与人之间血细胞比容水平是不同的。最佳地,可以对每位患者个别考虑目标血细胞比容水平。
在一些实施方式中,本文所述的方法用于治疗当施用高于最佳剂量的活化素II型受体抑制剂,具体地ActRII多肽(例如,ActRIIa-hFc)时,对副作用敏感的患者中的贫血症或者与贫血症或无效性红细胞生成有关的疾病或病况。可能与高于最佳剂量的活化素II型受体抑制剂的施用有关的副作用无限制地包括红细胞水平、血细胞比容水平或血红蛋白水平的过度增加、铁存储过度增加和骨髓或脾细胞过多。反过来,红细胞水平、血红蛋白水平或血细胞比容水平的过度增加可能会导致血压升高和/或其他不希望的副作用。在具体的实施方式中,根据本文所述的方法治疗的患者对高血压(例如,收缩压、舒张压和/或平均动脉血压升高)或者可能与红细胞水平过度增加有关的另一种病况(例如,头疼、流感样综合征或血管血栓形成)敏感。在具体的实施方式中,当用活化素II型受体抑制剂(例如,ActRIIA-hFc,如SEQ ID NO:7)治疗时,根据本文所述的方法治疗的患者对高血压或可能与红细胞水平过度增加有关的另一种病况敏感。
根据本文所述的方法可以治疗任何年龄的受试者。在一些实施方式中,根据本文所述的方法治疗的受试者为55岁以上。在一些实施方式中,根据本文所述的方法治疗的受试者小于3或10岁。在其他实施方式中,根据本文所述的方法治疗的受试者小于18岁。在其他实施方式中,根据本文所述的方法治疗的受试者为18至55岁。
5.4评价GDF11水平和/或活性
可以通过本领域中已知的或本文所述的任何方法确定GDF11的水平或活性。例如,通过使用(例如)RNA印迹、PCR分析、实时PCR分析或本领域中已知的或本文所述的任何其他技术评价(例如,定量)GDF11的反转录的RNA来确定组织样品中GDF11的水平。在一种实施方式中,可以通过评价(例如,定量)样品中GDF11的mRNA来确定组织样品中GDF11的水平。
还可以通过使用(例如)免疫组织化学分析、免疫印迹、ELISA、免疫沉淀、流式细胞术分析或本领域中已知的或本文所述的任何其他技术评价(例如,定量)样品中GDF11的蛋白表达水平来确定组织样品中GDF11的水平。在具体的实施方式中,通过在使用活化素II型受体抑制剂治疗后能够定量患者组织样品中(例如,人血清中)GDF11的量和/或能够检测GDF11水平修正的方法确定GDF11的水平。在一种实施方式中,通过使用ELISA评价(例如,定量)样品中GDF11的蛋白表达来确定组织样品中GDF11的水平。例如,可以使用实施例中所述的夹心ELISA法鉴别和定量人血清中的GDF11。在确定组织样品中GDF11的水平中使用的夹心ELISA法可以包括ELISA板的ActRIIA-Fc涂层(使用,例如,ActRIIA-mFc或ActRIIA-hFc,如SEQ ID NO:7),将所述板与组织样品(例如,人血清)接触,并检测通过特异性抗体结合至ActRIIA-Fc的组织样品(例如,人血清)中的ActRIIA配体(如GDF11)。在一些实施方式中,在确定如本文所述的GDF11的水平和/或活性中使用的方法(例如,夹心ELISA)能够检测100pg/ml的结合至ActRIIA的重组GDF11、活化素A和/或活化素B。
在测量样品(例如,组织样品,例如,血液、血清、血浆、肝、脾和/或骨髓的样品中)中GDF11的水平的测定中使用的抗体是本领域中已知的并且可以使用本领域技术人员已知的方法容易地发展。可以在测量样品中GDF11的水平的测定中使用的单克隆抗体的实例包括来自LifeSpan Biosciences Inc.,Seattle WA的抗体,其产品目录号为LS-C121127、LS-C138772、LS-C105098;得自Santa Cruz Biotechnology,Inc.,Santa Cruz,CA的抗体,其产品目录号(X-19)为:sc-81952;和得自Sigma-Aldrich Co.LLC的抗体,其产品目录号:WH0010220M3。
可以通过本领域中已知的任何测定测量GDF11的活性,其无限制地包括集落形成测定、报道子基因测定(例如,含有GDF11-反应性报道子基因构件)、碱性磷酸酶测定或任何其他生物活性测定。可以用于测量GDF11的活性的示例性测定在Souza等人,2008,Mol.Endocrinology22(12):2689-2702;和Bessa等人,2009,Protein Expression andPurification63:89-94中有述。
可以在得自根据本文所述的方法治疗的患者的任何组织样品中评价GDF11的水平和/或活性。在某些实施方式中,在得自根据本文所述的方法治疗的患者的血清、肝、脾或骨髓的样品中评价GDF11的水平和/或活性。在一种实施方式中,在得自根据本文所述的方法治疗的患者的血清的样品中评价GDF11的水平和/或活性。在另一种实施方式中,在得自根据本文所述的方法治疗的患者的脾的样品中评价GDF11的水平和/或活性。在另一种实施方式中,在得自根据本文所述的方法治疗的患者的骨髓的样品中评价GDF11的水平和/或活性。
在一些实施方式中,将患者组织样品中的GDF11的水平和/或活性与健康受试者(例如,未患贫血症的受试者),如相同年龄组和(任选地)相同性别的受试者的组织样品(例如,来自相同组织的样品)中的GDF11的平均水平和/或活性相比较。在一些实施方式中,将患者组织样品中的GDF11的水平和/或活性与受试者较早时间点(例如,疾病发生前、治疗开始前或治疗期间)的组织样品(例如,来自相同组织的样品)中的GDF11的水平和/或活性相比较。在一些实施方式中,将患者组织样品(例如,血清、脾、肝或血液骨髓)中的GDF11的水平和/或活性与患者另一个组织样品中的GDF11的水平和/或活性相比较。在一些实施方式中,将患者组织样品中的GDF11的水平和/或活性与患者组织样品中的另一个基因产物(例如,b-肌动蛋白、活化素A、活化素B)的水平和/或活性相比较。
在一些实施方式中,将患者组织样品中的GDF11的水平和/或活性与组织样品中的GDF11的正常水平和/或活性相比较。组织样品中的GDF11的正常水平和/或活性可以是一个或多个健康受试者(例如,未患贫血症的受试者),如相同年龄组和(任选地)相同性别的受试者的组织样品(例如,来自相同组织的样品)中的GDF11的平均水平和/或活性。在一些实施方式中,与GDF11的正常水平和/或活性相比,GDF11的水平和/或活性升高的检测是在活化素受体抑制剂(如本文所述的一种或多种活化素受体抑制剂)的施用后进行的。在一些实施方式中,活化素受体抑制剂(如本文所述的一种或多种活化素受体抑制剂)的施用是在GDF11的水平和/或活性的监测和(任选地)将GDF11的水平和/或活性与GDF11的正常水平和/或活性相比较之后进行的。在一些实施方式中,活化素II型受体抑制剂的第一剂量的施用(例如,ActRIIA-hFc,如SEQ ID NO:7)是在确定GDF11的水平和/或活性后进行的,并且如果相对于正常水平和/或活性,GDF11的水平和/或活性升高,则施用比第一剂量更高(例如,1.25、1.5、1.75、2、2.5、3、4、5、6、7、8、9或10倍高)的活化素II型受体抑制剂的第二剂量,并且如果相对于正常水平和/或活性,GDF11的水平和/或活性降低,则施用比第一剂量更低(例如,1.25、1.5、1.75、2、2.5、3、4、5、6、7、8、9或10倍低)的活化素II型受体抑制剂的第二剂量。
如本文所使用的,在某些实施方式中,GDF11的正常水平和/或活性是一个或多个健康受试者(例如,相同年龄组别和/或相同性别的健康受试者)的组织样品中的GDF11的平均水平和/或活性。在一些实施方式中,将治疗受试者的组织样品中的GDF11的水平和/或活性与来自一个或多个健康受试者的相同组织的样品中的GDF11的水平和/或活性相比较。在一些实施方式中,其中评价GDF11的水平和/或活性的组织是血清、骨髓、肝或脾。在一种实施方式中,其中评价GDF11的水平和/或活性的组织是血清。
5.5治疗性使用
在某些实施方式中,在本文所述的方法中,活化素II型受体抑制剂用于治疗患有贫血症或与贫血症或无效性红细胞生成有关的疾病或病况的患者。在一些实施方式中,将活化素II型受体抑制剂施用于患有贫血症或与贫血症或无效性红细胞生成有关的疾病或病况的患者。在一些实施方式中,将活化素II型受体抑制剂施用于患有贫血症或与贫血症或无效性红细胞生成有关的疾病或病况并且(例如,患者血清、骨髓、肝和/或脾中)GDF11的水平和/或活性升高的患者。可以在本文所提供的方法中使用在本节中所述的和在本领域中已知的活化素II型受体抑制剂。在某些实施方式中,可以在本文所提供的方法中使用在本节中所述的活化素II型受体抑制剂。
本文所涵盖的ActRII受体抑制剂包括ActRIIA抑制剂和ActRIIB抑制剂(参见下文)。在某些实施方式中,ActRII受体抑制剂对ActRIIA特异。在其他实施方式中,ActRII受体抑制剂对ActRIIB特异。在某些实施方式中,ActRII受体抑制剂优选地抑制ActRIIA。在其他实施方式中,ActRII受体抑制剂优选地抑制ActRIIB。在某些实施方式中,ActRII受体抑制剂抑制ActRIIA和ActRIIB两者。
在某些实施方式中,ActRII受体的抑制剂可以是包含ActRII的活化素结合域的多肽。不受理论束缚,这种包含活化素结合域的多肽螯合活化素并借此防止活化素信号转导。这些包含活化素结合域的多肽可以包含ActRII受体胞外域的全部或部分(即,ActRIIA胞外域的全部或部分或者ActRIIB胞外域的全部或部分)。在具体的实施方式中,ActRII受体胞外域是可溶的。
在某些实施方式中,包含活化素结合域的多肽被连接到抗体的Fc部分(即生成包含ActRII受体的包含活化素结合域的多肽和抗体的Fc部分的结合物)。不受理论束缚,抗体部分赋予结合物提高的稳定性。在某些实施方式中,所述活化素结合域通过接头(例如,肽接头)连接到抗体的Fc部分。
在本文所述的组合物和方法中使用的ActRII受体抑制剂包括直接或间接胞外或胞内抑制ActRIIA和/或ActRIIB的分子。在一些实施方式中,在本文所述的组合物和方法中使用的ActRIIA和/或ActRIIB的抑制剂通过与受体本身的相互作用抑制ActRIIA和/或ActRIIB。在其他实施方式中,在本文所述的组合物和方法中使用的ActRIIA和/或ActRIIB的抑制剂通过与ActRIIA和/或ActRIIB配体,例如,活化素的相互作用抑制ActRIIA和/或ActRIIB。
5.5.1 ACTRIIA的抑制剂
如本文所使用的,术语“ActRIIA”是指来自任何物种的活化素IIa型受体(ActRIIA)蛋白和通过突变或其他修饰衍生自该ActRIIA蛋白的变体的家族。在本文中,对ActRIIA的提及应理解为对任一种目前所鉴别的形式的提及。ActRIIA家族成员通常为跨膜蛋白,其由具有富半胱氨酸区的配体结合胞外域、跨膜域、具有预测丝氨酸/苏氨酸激酶活性的胞质域组成。
在本文所述的组合物和方法中使用的ActRIIA抑制剂无限制地包括活化素结合可溶性ActRIIA多肽;结合至活化素(具体地,活化素A或B亚单位,也称为βA或βB)并破坏ActRIIA结合的抗体;结合至ActRIIA并破坏活化素结合的抗体;选择用于活化素或ActRIIA结合的非抗体蛋白质(参见,例如,WO/2002/088171、WO/2006/055689、WO/2002/032925、WO/2005/037989、US 2003/0133939和US 2005/0238646,以上每篇专利以其全部内容作为参考并入本文,例如,对于相同抑制剂的设计和选择的这些蛋白和方法);和选择用于活化素或ActRIIA结合的随机肽,其可以结合至Fc结构域。
在某些实施方式中,可以将具有活化素或ActRIIA结合活性的两种或更多种不同蛋白(或其他部分),特别地,分别阻断I型(例如,可溶性I型活化素受体)和II型(例如,可溶性II型活化素受体)结合位点的活化素结合剂连接在一起以产生抑制ActRIIA并因此可以在本文所述的组合物和方法中使用的双功能或多功能结合分子。在某些实施方式中,抑制ActRIIA的活化素-ActRIIA信号轴拮抗剂包括在本文所述的组合物和方法中使用的核酸适体、小分子及其他试剂。
(a)包含ACTRIIA多肽的ACTRIIA抑制剂
术语“ActRIIA多肽”包括包含ActRIIA家族成员中任何天然存在的多肽以及保留有用活性的其任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。例如,ActRIIA多肽包括衍生自与ActRIIA多肽序列具有至少约80%同一性,并且任选地至少85%、90%、95%、97%、98%、99%或更大的同一性的序列的任何已知的ActRIIA的序列的多肽。例如,ActRIIA多肽可以结合至并抑制ActRIIA蛋白质和/或活化素的功能。可以出于其促进骨生长和骨盐沉积的能力选择ActRIIB多肽。ActRIIA多肽的实例包括人ActRIIA前体多肽(SEQID NO:1)和可溶性人ActRIIA多肽(例如,SEQ ID NO:2、3、7和12)。对于其氨基酸序列以SEQID NO:1显示的ActRIIA前体多肽,人ActRIIA前体多肽的信号肽位于氨基酸位置1至20;胞外域位于氨基酸位置21至135并且人ActRIIA前体多肽(SEQ ID NO:1)的N-连接的糖基化位点位于SEQ ID NO:1的氨基酸位置43至56。以SEQ ID NO:4公开了编码SEQ ID NO:1所示的人ActRIIB前体多肽的核酸序列(Genbank登录号NM_001616的核苷酸164-1705)。以SEQ IDNO:5公开了编码SEQ ID NO:2所示的可溶性人ActRIIA多肽的核酸序列。序列说明参见表1。
在具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIA多肽是可溶性ActRIIA多肽。ActRIIA蛋白的胞外域可以结合至活化素并且通常是可溶的,并因此可以称为可溶性活化素结合ActRIIA多肽。因此,如本文所使用的,术语“可溶性ActRIIA多肽”通常是指包含ActRIIA蛋白的胞外域的多肽,其包括ActRIIA蛋白的任何天然存在的胞外域及其任何变体(包括突变体、片段和拟肽形式)。可溶性ActRIIA多肽可以结合至活化素;然而,野生型ActRIIA蛋白相对于GDF8/11未在与活化素的结合中显示出显著的选择性。天然或改变的ActRIIA蛋白质可以通过将其与第二活化素选择性结合剂偶联来赋予活化素额外的特异性。可溶性活化素结合ActRIIA多肽的实例包括SEQ ID NO:2、3、7、12和13中所示的可溶性多肽。可溶性活化素结合ActRIIA多肽的其他实例包括除ActRIIA蛋白的胞外域之外的信号序列,例如,蜜蜂蜂毒肽前导序列(SEQ ID NO:8)、组织纤维蛋白溶酶原活化因子(TPA)前导序列(SEQ ID NO:9)或天然ActRIIA前导序列(SEQ ID NO:10)。SEQ ID NO:13中所示的ActRIIA-hFc多肽使用TPA前导序列。
在某些实施方式中,在本文所述的组合物和方法中使用的ACTRIIA的抑制剂包括结合/融合蛋白,其包含连接至抗体Fc部分的ActRIIA的活化素结合域。在某些实施方式中,所述活化素结合域通过接头(例如,肽接头)连接到抗体的Fc部分。任选地,Fc结构域在残基,如Asp-265、赖氨酸322和Asn-434处具有一个或多个突变。在某些情况下,具有这些突变中的一个或多个(例如,Asp-265突变)的突变Fc结构域结合至Fcγ受体的能力比野生型Fc结构域降低。在其他情况下,具有这些突变中的一个或多个(例如,Asn-434突变)的突变Fc结构域结合至MHC I类相关Fc-受体(FcRN)的能力比野生型Fc结构域提高。在SEQ ID NO:6、7、12和13中示出了包含融合至Fc结构域的ActRIIA的可溶性胞外域的示例性融合蛋白。
在具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIA抑制剂包括连接至抗体Fc部分的ActRIIA的胞外域或其部分,其中所述ActRIIA抑制剂包含与选自SEQID NO:6、7、12和13的氨基酸序列具有至少75%同一性的氨基酸序列。在另一个具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIA抑制剂包括连接至抗体Fc部分的ActRIIA的胞外域或其部分,其中所述ActRIIA抑制剂包含与选自SEQ ID NO:6、7、12和13的氨基酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的同一性的氨基酸序列。
在某些实施方式中,在本文所述的组合物和方法中使用的ACTRIIA的抑制剂包括ActRIIA胞外域的截短形式。截短可以位于ActRIIA多肽的羧基末端和/或氨基末端。在某些实施方式中,相对于成熟ActRIIB多肽胞外域,截短可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸长。在某些实施方式中,截短可以是成熟ActRIIA多肽胞外域的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个N末端氨基酸。在某些实施方式中,截短可以是成熟ActRIIA多肽胞外域的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个C末端氨基酸。例如,ActRIIA的截短形式包括具有氨基酸20-119;20-128;20-129;20-130;20-131;20-132;20-133;20-134;20-131;21-131;22-131;23-131;24-131;和25-131的多肽,其中氨基酸位置表示SEQ ID NO:1中的氨基酸位置。
在某些实施方式中,在本文所述的组合物和方法中使用的ACTRIIA的抑制剂包括具有一个或多个氨基酸取代的ActRIIA的胞外域。在某些实施方式中,在本文所述的组合物和方法中使用的ACTRIIA的抑制剂包括也具有氨基酸取代的ActRIIA胞外域的截短形式。
在具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIA抑制剂是在人ActRIIA受体胞外域和IgG1的Fc部分之间的融合蛋白。在另一个具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIA抑制剂是在人ActRIIA受体的截短的胞外域和IgG1的Fc部分之间的融合蛋白。在另一个具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIA抑制剂是在人ActRIIA受体的截短的胞外域和IgG1的Fc部分之间的融合蛋白,其中人ActRIIA受体的截短的胞外域具有一个或多个氨基酸取代。
可以(例如)通过筛选从编码ActRIIA多肽的核酸的相应片段重组产生的多肽来获得ActRIIA多肽的功能活性片段。另外,可以使用本领域中已知的技术,如常规Merrifield固相f-Moc或t-Boc化学来化学合成片段。可以产生(重组或化学合成)并测试所述片段以鉴别可以用作ActRIIA蛋白的或活化素介导的信号转导的拮抗剂(抑制剂)的那些肽基片段。
另外,可以(例如)通过筛选从编码ActRIIA多肽的相应诱变的核酸重组产生的修饰多肽库来获得ActRIIA多肽的功能活性变体。可以产生并测试所述变体以鉴别可以用作ActRIIA蛋白的或活化素介导的信号转导的拮抗剂(抑制剂)的那些。在某些实施方式中,ActRIIA多肽的功能性变体包含与选自SEQ ID NO:2或3的氨基酸序列具有至少75%的同一性的氨基酸序列。在某些情况下,所述功能性变体具有与选自SEQ ID NO:2或3的氨基酸序列具有至少80%、85%、90%、95%、97%、98%、99%或100%的同一性的氨基酸序列。
出于提高治疗效力或稳定性(例如,离体储存期限和对体内蛋白水解降解作用的耐受性)的目的,可以(例如)通过修饰ActRIIA多肽的结构来产生功能性变体。当选择以保留活化素结合时,这些修饰的ActRIIA多肽可以认为是天然存在的ActRIIA多肽的功能等价物。还可以(例如)通过氨基酸取代、缺失或添加来产生修饰的ActRIIA多肽。例如,合理地预计用异亮氨酸或缬氨酸单独取代亮氨酸、用谷氨酸单独取代天冬氨酸、用丝氨酸单独取代苏氨酸或用结构相关氨基酸类似地取代氨基酸(例如,保守突变)将不会对所得分子的生物活性具有较大影响。保守取代是在它们的侧链中相关的氨基酸家族内发生的那些。可以通过评价变体ActRIIA多肽以类似于野生型ActRIIA多肽的方式在细胞中产生反应的能力来容易地确定ActRIIA多肽的氨基酸序列中的改变是否会导致产生功能性同源物。
在某些实施方式中,在本文所述的和本文所提供的组合物和方法中使用的ActRIIA抑制剂可以包括具有一个或多个可以改变所述多肽的糖基化的特定突变的ActRIIA多肽。这些突变可以引入或消除一个或多个糖基化位点,如O-连接或N-连接的糖基化位点。天门冬酰胺-连接的糖基化识别位点通常包含三肽序列,天门冬酰胺-X-苏氨酸(或者天门冬酰胺-X-丝氨酸)(其中“X”是任何氨基酸),其被适当的细胞糖基化酶特异性识别。还可以通过一个或多个丝氨酸或苏氨酸残基对野生型ActRIIA多肽序列的添加或取代来进行改变(对于O-连接的糖基化位点)。在糖基化识别位点的第一或第三氨基酸位置中的一处或两处的多种氨基酸取代或缺失(和/或第二位置的氨基酸缺失)导致在修饰的三肽序列产生了非糖基化作用。提高ActRIIA多肽上碳水化合物部分数目的另一种方法是通过糖苷与ActRIIA多肽的化学或酶促连接。根据所使用的偶联形式,可以将糖连接到(a)精氨酸和组氨酸;(b)游离羧基;(c)游离巯基,如半胱氨酸的那些;(d)游离羟基,如丝氨酸、苏氨酸或羟脯氨酸的那些;(e)芳香族残基,如苯丙氨酸、酪氨酸或色氨酸的那些;或者(f)谷氨酰胺的酰胺基。这些方法在1987年9月11日公开的WO 87/05330和Aplin and Wriston(1981)CRCCrit.Rev.Biochem.,第259-306页中有述,其作为参考并入本文。可以通过化学和/或酶促反应实现ActRIIA多肽上存在的一个或多个碳水化合物部分的除去。化学去糖基化可以包括(例如)ActRIIA多肽对化合物三氟甲磺酸或等价化合物的暴露。该处理导致除连接糖(N-乙酰葡萄糖胺或N-乙酰半乳糖胺)之外大部分或全部的糖的切割,同时留下了完整的氨基酸序列。化学去糖基化通过Hakimuddin等人,(1987)Arch.Biochem.Biophys.259:52和Edge等人(1981)Anal.Biochem.118:131进一步描述。可以通过使用多种内切和外切糖苷酶实现ActRIIA多肽上碳水化合物部分的酶促切割,如通过Thotakura等人(1987)Meth.Enzymol.138:350中所述。根据所使用的表达系统类型,可以根据情况调整ActRIIA多肽的序列,这是因为哺乳动物、酵母、昆虫和植物细胞均可以引入不同的糖基化类型,这可以受所述肽的氨基酸序列所影响。一般地,在人中使用的ActRIIA蛋白可以在提供正确糖基化作用的哺乳动物细胞系中表达,如HEK293或CHO细胞系,尽管预期其他表达系统,如其他哺乳动物表达细胞系、具有工程设计的糖基化酶的酵母细胞系和昆虫细胞也是有用的。
本文还提供了产生ActRIIA多肽的突变体,具体地,组合突变体组,以及截短突变体的方法;组合突变体的混合对于鉴别功能性变体序列是特别有用的。筛选这些组合文库的目的可以是产生(例如)可以起激动剂或拮抗剂作用,或者可替代地,一起具有新的活性的ActRIIA多肽变体。以下提供了多种筛选测定,并且这些测定可以用于评价变体。例如,可以筛选ActRIIA多肽变体结合至ActRIIA配体的能力,以防止ActRIIA配体与ActRIIA多肽结合或干扰由ActRIIA配体所引起的信号转导。
可以产生通过组合获得的变体,其相对于天然存在的ActRIIA多肽具有选择性或通常提高的效力。同样地,突变可以导致产生胞内半衰期显著不同于相应野生型ActRIIA多肽的变体。例如,改变的蛋白可以使得对蛋白水解降解或其他细胞代谢过程更稳定或不太稳定,所述蛋白水解降解或其他细胞代谢过程导致天然ActRIIA多肽的破坏,或否则的话,失活。可以使用这些变体和编码它们的基因通过调节ActRIIA多肽的半衰期来改变ActRIIA多肽水平。例如,短半衰期可以导致更多的瞬时生物作用并且可以使得能够更密切地控制患者内的重组ActRIIA多肽水平。在Fc融合蛋白中,可以在接头(如果有的话)和/或Fc部分中进行突变以改变蛋白质的半衰期。
可以通过编码多肽文库(其分别包括潜在的ActRIIA多肽序列的至少一部分)的基因的简并文库产生组合文库。例如,可以将合成寡核苷酸的混合物通过酶促反应连接至基因序列,从而潜在的ActRIIA多肽的核苷酸序列的简并组是作为单个多肽可表达的,或者可替代地,作为较大的融合蛋白组是可表达的(例如,用于噬菌体展示)。
可以从简并寡核苷酸序列产生可能的同源物文库的方法众多。可以在自动DNA合成仪中进行简并基因序列的化学合成,并且然后,将合成基因连接至适当的载体用于表达。简并寡核苷酸的合成在本领域中是熟知的(参见,例如,Narang,S A(1983)Tetrahedron39:3;Itakura等人,(1981)Recombinant DNA,Proc.3rd ClevelandSympos.Macromolecules,AG Walton主编,Amsterdam:Elsevier第273-289页;Itakura等人,(1984)Annu.Rev.Biochem.53:323;Itakura等人,(1984)Science 198:1056;Ike等人,(1983)Nucleic Acid Res.11:477)。这些技术已在其他蛋白的定向进化中使用(参见,例如,Scott等人,(1990)Science 249:386-390;Roberts等人,(1992)PNAS USA 89:2429-2433;Devlin等人,(1990)Science 249:404-406;Cwirla等人,(1990)PNAS USA 87:6378-6382;以及美国专利No.5223409、5198346和5096815)。
可替代地,可以使用其他形式的突变来产生组合文库。例如,可以产生ActRIIA多肽变体并通过使用(例如)丙氨酸扫描突变等(Ruf等人,(1994)Biochemistry 33:1565-1572;Wang等人,(1994)J.Biol.Chem.269:3095-3099;Balint等人,(1993)Gene 137:109-118;Grodberg等人,(1993)Eur.J.Biochem.218:597-601;Nagashima等人,(1993)J.Biol.Chem.268:2888-2892;Lowman等人,(1991)Biochemistry30:10832-10838;和Cunningham等人,(1989)Science 244:1081-1085),通过接头扫描突变(Gustin等人,(1993)Virology 193:653-660;Brown等人,(1992)Mol.Cell Biol.12:2644-2652;McKnight等人,(1982)Science232:316);通过饱和突变(Meyers等人,(1986)Science 232:613);通过PCR突变(Leung等人,(1989)Method Cell Mol Biol 1:11-19);或者通过随机突变,包括化学物诱变作用等(Miller等人,(1992)A Short Course in BacterialGenetics,CSHL Press,Cold Spring Harbor,N.Y.;和Greener等人,(1994)Strategies inMol Biol 7:32-34)筛选从文库中分离。接头扫描突变,具体地,在组合环境中,是鉴别ActRIIA多肽截短(生物活性)形式的有吸引力的方法。
在本领域中,用于筛选通过点突变和截短产生的组合文库的基因产物的大量技术是已知的,并且对此而言,对筛选cDNA文库中具有某些性质的基因产物来说是已知的。这些技术通常将可适应于通过ActRIIA多肽的组合突变所产生的基因文库的快速筛选。用于筛选大基因文库的最广泛使用的技术通常包括将基因文库克隆到可复制的表达载体中,用所得载体文库转化适当的细胞,并在其中所需活性的检测有利于相对容易地分离编码将检测其产物的基因的载体的情况下表达组合基因。优选的测定包括活化素结合测定和活化素介导的细胞信号转导测定。
在某些实施方式中,除了ActRIIA多肽中天然存在的任何修饰外,在本文所述的方法和组合物的抑制剂中使用的ActRIIA多肽还可以包含翻译后修饰。这些修饰可以包括(但不限于)乙酰化、羧化、糖基化、磷酸化、脂化和酰基化。因此,修饰的ActRIIA多肽可以含有非氨基酸元素,如聚乙二醇、脂质、聚糖或单糖和磷酸酯。可以通过技术人员已知的任何方法测试这些非氨基酸元素对ActRIIA多肽功能性的影响。当通过切割ActRIIA多肽的新生形式在细胞中产生ActRIIA多肽时,翻译后加工也可以对蛋白质的正确折叠和/或功能是重要的。不同细胞(如CHO、HeLa、MDCK、293、W138、NIH-3T3或HEK293)对这些翻译后活性具有特定细胞机制和特征机制,并且可以对其进行选择以确保ActRIIA多肽的正确修饰和加工。
在某些方面,在本文所述的方法和组合物的抑制剂中使用的ActRIIA多肽的功能性变体或修饰形式包括具有ActRIIA多肽的至少一部分和一个或多个融合结构域的融合蛋白。这些融合结构域的熟知实例包括(但不限于)多组氨酸、Glu-Glu、谷胱甘肽S转移酶(GST)、硫氧还蛋白、蛋白A、蛋白G、免疫球蛋白重链恒定区(Fc)、麦芽糖结合蛋白(MBP)或人血清白蛋白。可以选择融合结构域以赋予所需性质。例如,一些融合结构域对通过亲和色谱法分离融合蛋白是特别有用的。出于亲合纯化的目的,使用了用于亲和色谱法的相关基质,如谷胱甘肽-、淀粉酶-和镍-或钴-结合树脂。多种这些基质是以“试剂盒”形式获得的,如Pharmacia GST纯化系统和与(HIS6)融合伴侣使用的QIAexpress.TM.系统(Qiagen)。作为另一个实例,可以选择融合结构域以有利于ActRIIA多肽的检测。这些检测域的实例包括多种荧光蛋白(例如,GFP)以及“表位标记”,其通常是特异性抗体可用的短肽序列。对其来说,特异性单克隆抗体是易于获得的熟知的表位标记包括FLAG、流感病毒血球凝集素(HA)和c-myc标记。在一些情况下,融合结构域具有蛋白酶切割位点,如对于因子Xa或凝血酶,其使得相关蛋白酶能够部分消化融合蛋白并借此从中释放重组蛋白。然后,可以通过后续色谱分离,从融合结构域分离释放的蛋白。在某些优选的实施方式中,将ActRIIA多肽与体内稳定ActRIIA多肽的域融合(“稳定剂”域)。“稳定”是指不考虑是否是由破坏减少、肾清除减少或其他药物动力学作用所引起的,提高血清半衰期的任何情况。已知与免疫球蛋白的Fc部分融合会赋予多种蛋白所期望的药物动力学性质。同样地,与人血清白蛋白融合可以赋予所期望的性质。可以选择的其他类型的融合结构域包括多聚(例如,二聚、四聚)结构域和功能结构域(赋予额外的生物学功能,如根据需要,进一步刺激骨生长或肌肉生长)。
应理解可以根据所需的功能性以任何方式设置融合蛋白的不同元素。例如,ActRIIA多肽可以位于异源域的C末端,或可替代地,异源结构域可以位于ActRIIA多肽的C末端。在融合蛋白中,ActRIIA多肽域和异源域不必需是相邻的,并且可以在任一个域的C或N末端或在结构域之间包含其他结构域或氨基酸序列。
在某些实施方式中,在本文所述的方法和组合物的抑制剂中使用的ActRIIA多肽可以含有能够稳定ActRIIA多肽的一个或多个修饰。例如,这些修饰可以提高ActRIIA多肽的体外半衰期,提高ActRIIA多肽的循环半衰期或降低ActRIIA多肽的蛋白水解降解。这些稳定修饰可以包括(但不限于)融合蛋白(包括,例如,包含ActRIIA多肽和稳定剂域的融合蛋白),糖基化位点的修饰(包括,例如,向ActRIIA多肽添加糖基化位点)和碳水化物部分的修饰(包括,例如,从ActRIIA多肽除去碳水化合物部分)。就融合蛋白来说,将ActRIIA多肽融合至稳定剂域,如IgG分子(例如,Fc结构域)。如本文所使用的,术语“稳定剂域”不仅是指融合蛋白情况下的融合结构域(例如,Fc),而且还包括非蛋白修饰,如碳水化物部分,或非蛋白聚合物,如聚乙二醇。
在某些实施方式中,可以与本文所述的方法和组合物一起使用ActRIIA多肽的分离和/或纯化形式,它是与其他蛋白分离的,或基本不含其他蛋白。通常可以通过从重组核酸表达来产生ActRIIA多肽。
在某些方面,使用编码任何ActRIIA多肽(例如,可溶性ActRIIA多肽)的分离和/或重组核酸产生在本文所述的组合物和方法中使用的ActRIIA多肽,包括本文所公开的片段、功能性变体和融合蛋白。例如,SEQ ID NO:4编码天然存在的人ActRIIA前体多肽,而SEQ IDNO:5编码ActRIIA加工的胞外域。这些核酸可以是单链或双链的。这些核酸可以是DNA或RNA分子。可以(例如)在制备ActRIIA多肽的方法中使用这些核酸,或者可以作为直接治疗剂(例如,在基因疗法)中使用。
在某些方面,编码ActRIIA多肽的核酸可以包括作为SEQ ID NO:4或5所示的变体的核酸。变体核苷酸序列包括相差一个或多个核苷酸取代、添加或缺失的序列,如等位变体。
在某些实施方式中,编码ActRIIA多肽的分离或重组核酸序列可以是与SEQ IDNO:4或5至少80%、85%、90%、95%、97%、98%、99%或100%同一。本领域的技术人员将理解可以在适合在本文所述的方法和组合物中使用的ActRIIA多肽的生产中使用与SEQ IDNO:4或5和SEQ ID NO:4或5的变体互补的核酸序列。在其他实施方式中,这些核酸序列可以是分离的、重组的和/或融合至异源核苷酸序列,或来自DNA文库。
在其他实施方式中,在适合在本文所述的方法和组合物中使用的ActRIIA多肽的生产中使用的核酸可以包括在高度严格条件下与SEQ ID NO:4或5所表示的核苷酸序列、SEQ ID NO:4或5的互补序列或其片段杂交的核苷酸序列。本领域的技术人员将理解可以改变促进DNA杂交的适当的严格条件。例如,可以在约45℃,在6.0倍氯化钠/柠檬酸钠(SSC)条件下进行杂交,然后在50℃,以2.0倍SSC清洗。例如,清洗步骤中的盐浓度可以从50℃,约2.0倍SSC的低严格性值50℃,约0.2倍SSC的高严格性进行选择。另外,清洗步骤中的温度可以从室温(约22℃)下的低严格性条件提高至约65℃的高严格性条件。温度和盐两者均可以改变,或者温度或盐浓度可以保持不变,而另一个变量改变。在一种实施方式中,可以与本文所述的方法和组合物一起使用在室温下6倍SSC的低严格性条件下杂交,然后在室温下以2倍SSC清洗的核酸。
由于遗传密码子中的简并度,不同于SEQ ID NO:4或5中所示核酸的分离核酸也可以在适合于在本文所述的方法和组合物中使用的ActRIIA多肽的生产中使用。例如,一些氨基酸是由不只一个三联体表示的。指明相同氨基酸的密码子或同义密码子(例如,CAU和CAC对组氨酸是同义密码子)可能导致不影响蛋白质的氨基酸序列的“沉默”突变。然而,预期确实导致受试者蛋白的氨基酸序列变化的DNA序列多态性将在哺乳动物细胞中存在。本领域技术人员将理解由于天然等位变化,编码特定蛋白的核酸的一个或多个核苷酸(多达核苷酸的约3-5%)中的这些变化可以在给定物种的个体中存在。
在某些实施方式中,重组核酸可以操作性地连接至表达构件中的一个或多个调控核苷酸序列。调控的核苷酸序列通常将适合于用于表达的宿主细胞。对于多种宿主细胞,多种类型的适合的表达载体和适合的调控序列在本领域中是已知的。通常,所述一种或多种调控核苷酸序列可以包括(但不限于)启动子序列、前导序列或信号序列、核糖体结合位点,转录起始和终止序列、翻译起始和终止序列和增强子或活化子序列。在本文中考虑了如本领域中已知的组成型或诱导型启动子。启动子可以是天然存在的启动子,或将不止一个启动子的元素合并的杂合启动子。表达构件可以存在于细胞中的附加体(如质粒)上,或者可以将表达构件插入到染色体中。在优选的实施方式中,表达载体含有可选择的标志物基因以使得能够选择转化的宿主细胞。可选择的标志物基因在本领域中是熟知的并且将随所使用的宿主细胞而改变。
在某些方面,可以在包含编码ActRIIA多肽的核苷酸序列的表达载体中提供在适合在本文所述的方法和组合物中使用的ActRIIA多肽的生产中使用的核酸并将其操作性连接至至少一个调控序列。调控序列是本领域所认识的,并且选择以指导ActRIIA多肽的表达。因此,术语调控序列包括启动子、增强子及其他表达调控元件。示例性调控序列描述于Goeddel;Gene Expression Technology:Methods in Enzymology,Academic Press,SanDiego,Calif.(1990)。例如,当操作性地与之连接时,可以在这些载体中使用控制DNA序列表达的任何多种表达控制序列以表达编码ActRIIA多肽的DNA序列。这些有用的表达控制序列包括(例如)SV40的早期和晚期启动子、tet启动子、腺病毒或巨细胞病毒即时早期启动子、RSV启动子、lac系统、trp系统、TAC或TRC系统、表达受T7RNA聚合酶指导的T7启动子、λ噬菌体的主要操纵子和启动子区域、fd包被蛋白的调控区域、3-磷酸甘油酸激酶或其他糖酵解酶的启动子、酸性磷酸酶的启动子,例如Pho5、酵母α交配因子的启动子、杆状病毒系统的多角体启动子和已知调控原核细胞或真核细胞或其病毒的基因表达的其他序列和它们的不同组合。应理解表达载体的设计可以取决于以下因素,如要转化的宿主细胞的选择和/或期望表达的蛋白质类型。此外,还应考虑载体的拷贝数、控制拷贝数的能力和载体编码的任何其他蛋白(如抗生素标志物)的表达。
可以通过将克隆基因或其部分连接至适合在原核细胞、真核细胞(酵母、鸟类、昆虫或者哺乳动物)或两者中表达的载体中来产生在适合在本文所述的方法和组合物中使用的ActRIIA多肽的生产中使用的重组核酸。用于重组ActRIIA多肽生产的表达运载体(Expression vehicle)包括质粒及其他载体。例如,适合的载体包括用于在原核细胞(如大肠杆菌(E.coli))中表达的以下类型的质粒:pBR322-衍生的质粒、pEMBL-衍生的质粒、pEX-衍生的质粒、pBTac-衍生的质粒和pUC-衍生的质粒。
一些哺乳动物表达载体含有原核序列以有利于载体在细菌中增殖,和在真核细胞中表达的一种或多种真核转录单元。pcDNAI/amp、pcDNAI/neo、pRc/CMV、pSV2gpt、pSV2neo、pSV2-dhfr、pTk2、pRSVneo、pMSG、pSVT7、pko-neo和pHyg衍生的载体是适合于真核细胞转染的哺乳动物表达载体的实例。用来自细菌质粒(如pBR322)的序列修饰这些载体中的一些以有利于在原核和真核细胞中的复制和耐药性选择。可替代地,病毒,如牛乳头状瘤病毒(BPV-1)或埃-巴二氏病毒(pHEBo,pREP衍生的和p205)的衍生物可以用于真核细胞中蛋白质的瞬时表达。可以在以下基因疗法递送系统的描述中找到其他病毒(包括反转录病毒)表达系统的实例。在质粒制备和宿主生物转化中使用的多种方法在本领域中是熟知的。对于对原核和真核细胞两者均适合的其他表达系统以及一般重组程序,参见MolecularCloning A Laboratory Manual,第3版,Sambrook主编,Fritsch and Maniatis(ColdSpring Harbor Laboratory Press,2001)。在一些情况下,可以期望通过使用杆状病毒表达系统表达重组多肽。这些杆状病毒表达系统的实例包括pVL-衍生的载体(如pVL1392、pVL1393和pVL941)、pAcUW-衍生的载体(如pAcUW1)和pBlueBac-衍生的载体(如含有β-gal的pBlueBac III)。
载体可以设计用于在CHO细胞中生产受试者ActRIIA多肽,如Pcmv-Script载体(Stratagene,La Jolla,Calif.)、pcDNA4载体(Invitrogen,Carlsbad,Calif.)和pCI-neo载体(Promega,Madison,Wis.)。如将显而易见的,受试者基因构件可以用于导致受试者ActRIIA多肽在培养中增殖的细胞中表达,例如,以产生用于纯化的蛋白质,包括融合蛋白或变体蛋白。
可以在适合在本文所述的方法和组合物中使用的ActRIIA多肽的生产中使用用重组基因,包括受试者ActRIIA多肽中的一种或多种的编码序列(例如,SEQ ID NO:4或5)转染的宿主细胞。宿主细胞可以是任何原核或真核细胞。例如,本文所提供的ActRIIA多肽可以在细菌细胞,如大肠杆菌(E.coli)、昆虫细胞(例如,使用杆状病毒表达系统)、酵母或哺乳动物细胞中表达。其他适合的宿主细胞是本领域技术人员已知的。
因此,本文提供了生产ActRIIA多肽的方法。例如,可以在适当条件下培养用编码ActRIIA多肽的表达载体转染的宿主细胞以使得能够发生ActRIIA多肽的表达。可以分泌ActRIIA多肽,并从含有ActRIIA多肽的细胞和培养基的混合物中分离。可替代地,ActRIIA多肽可以保留在细胞质中或膜部分中,并收获细胞、裂解并分离蛋白。细胞培养物包括宿主细胞、培养基及其他副产物。用于细胞培养的适合的培养基在本领域中是熟知的。使用本领域中已知用于纯化蛋白质的技术,包括离子交换色谱、凝胶过滤色谱、超滤、电泳、使用对ActRIIA多肽的特定表位特异的抗体的免疫亲合纯化和使用结合至融合到ActRIIA多肽的域的试剂的亲合纯化(例如,可以使用蛋白A柱纯化ActRIIA-Fc融合蛋白),受试者ActRIIA多肽可以分离自细胞培养基、宿主细胞或两者。在优选的实施方式中,ActRIIA多肽是含有有利于其纯化的域的融合蛋白。在一种实施方式中,通过任何顺序的一系列柱色谱步骤,包括,例如,以下中的三种或更多种:蛋白A色谱、Q琼脂糖色谱、苯基-琼脂糖色谱、尺寸排阻色谱和阳离子交换色谱实现纯化。可以通过病毒过滤和缓冲液交换完成纯化。如本文所示,将ActRIIA-hFc蛋白纯化至纯度>98%,如通过尺寸排阻色谱所确定的,和>95%,如通过SDSPAGE确定的。这种纯度水平足以对小鼠骨骼实现所期望的影响并且在小鼠、大鼠和非人灵长类中实现可接受的安全谱。
在另一种实施方式中,编码纯化前导序列,如重组ActRIIA多肽所需部分N-末端的聚(His)/肠激酶切割位点序列的融合基因可以使得能够使用Ni2+金属树脂通过亲和色谱法纯化表达的融合蛋白。然后,可以随后通过用肠激酶处理除去纯化前导序列以提供纯化的ActRIIA多肽(例如,参见Hochuli等人,(1987)J.Chromatography 411:177;和Janknecht等人,PNAS USA 88:8972)。
制备融合基因的技术是熟知的。基本上,使用用于连接的平端(blunt ended)或交错端(stagger ended)末端,限制酶消化以提供适合的末端,根据情况补齐粘性末端,碱性磷酸酶处理以避免不希望的连接和酶促连接,根据常规方法进行编码不同多肽序列的多个DNA片段的连接。在另一种实施方式中,可以通过常规方法,包括自动DNA合成仪来合成融合基因。可替代地,可以使用导致两个连续基因片段之间产生互补突出的锚定引物进行基因片段的PCR扩增,所述两个连续基因片段随后可以退火以产生嵌合基因序列(参见,例如,Current Protocols in Molecular Biology,Ausubel等人主编,John Wiley&Sons:1992)。
可以使用SEQ ID NO:9的组织纤溶酶原前导序列,在来自pAID4载体(SV40ori/增强子,CMV启动子)的稳定转染的CHO-DUKX Bl 1细胞中表达ActRIIA-Fc融合蛋白。人IgGlFc序列的Fc部分如SEQ ID NO:7所示。在某些实施方式中,一旦表达,所包含的蛋白平均每分子ActRIIA-Fc融合蛋白具有约1.5至2.5摩尔的唾液酸。
在某些实施方式中,在人患者中,ActRIIA-Fc融合蛋白的长血清半衰期可以为25-32天。另外,CHO细胞表达的材料可以对活化素B配体具有比对人293细胞中表达的ActRIIA-hFc融合蛋白所报告的更高的亲合力(del Re等人,J Biol Chem.2004Dec 17;279(51):53126-35)。另外,不受理论束缚,TPA前导序列的使用提供了比其他前导序列更大的产量,并且与所表达的具有天然前导序列的ActRIIA-Fc不同,它可以提供高纯度的N末端序列。天然前导序列的使用可以导致产生两种主要的ActRIIA-Fc种类,其分别具有不同的N末端序列。
5.5.2 ACTRIIB的抑制剂
如本文所使用的,术语“ActRIIB”是指来自任何物种的活化素IIB型受体(ActRIIB)蛋白和通过突变或其他修饰衍生自该ActRIIB蛋白的变体的家族。在本文中,对ActRIIB的提及应理解为对任一种目前所鉴别的受体形式的提及。ActRIIB家族成员通常为跨膜蛋白,其由具有富半胱氨酸区的配体结合胞外域、跨膜域和具有预测丝氨酸/苏氨酸激酶活性的胞质域组成。
在本文所述的组合物和方法中使用的ActRIIB抑制剂无限制地包括活化素结合可溶性ActRIIB多肽;结合至活化素(具体地,活化素A或B亚单位,也称为βA或βB)并破坏ActRIIB结合的抗体;结合至ActRIIB并破坏活化素结合的抗体;选择用于活化素或ActRIIB结合的非抗体蛋白质;和选择用于活化素或ActRIIB结合的随机肽,其可以结合至Fc结构域。
在某些实施方式中,可以将具有活化素或ActRIIB结合活性的两种或更多种不同蛋白(或其他部分),特别地,分别阻断I型(例如,可溶性I型活化素受体)和II型(例如,可溶性II型活化素受体)结合位点的活化素结合剂连接在一起以产生抑制ActRIIB并因此可以在本文所述的组合物和方法中使用的双功能或多功能结合分子。在某些实施方式中,抑制ActRIIB的活化素-ActRIIB信号轴拮抗剂包括在本文所述的组合物和方法中使用的核酸适体、小分子及其他试剂。
(a)包含ACTRIIB多肽的ACTRIIB抑制剂
如本文所使用的,术语“ActRIIB多肽”是指包含ActRIIB家族成员的任何天然存在的多肽及其保留了有用活性的任何变体(包括突变体、片段、融合形式和拟肽形式)的多肽。例如,ActRIIB多肽包括衍生自具有与ActRIIB多肽序列具有至少约80%同一性,并且任选地至少85%、90%、95%、96%、97%、98%、99%或更大的同一性的序列的任何已知的ActRIIB受体序列的多肽。例如,ActRIIB多肽可以结合至并抑制ActRIIB蛋白和/或活化素的功能。ActRIIB多肽的实例包括人ActRIIB前体多肽(SEQ ID NO:16或SEQ ID NO:28)。对于氨基酸序列描述为SEQ ID NO:16或SEQ ID NO:28的ActRIIB前体多肽(即,人ActRIIB前体多肽),ActRIIB前体多肽的信号肽位于氨基酸1至18;胞外域位于氨基酸19至134,并且可能的N-连接糖基化位点位于氨基酸位置42和65。编码SEQ ID NO:16的人ActRIIB前体多肽的核酸序列作为SEQ ID NO:19公开(SEQ ID NO:19在对应于氨基酸位置64的密码子位置提供了丙氨酸,但是本领域技术人员可以使用本领域中已知的方法容易地进行修饰以在对应于氨基酸位置64的密码子位置提供精氨酸)。序列说明参见表1。
除非另外具体说明,否则本文所述的所有ActRIIB相关多肽的氨基酸编号基于SEQID NO:16和SEQ ID NO:28的氨基酸编号(其仅在位置64处表达的氨基酸有差别)。例如,如果将ActRIIB多肽描述为在氨基酸位置79具有取代/突变,则将理解位置79是指ActRIIB多肽所来源的SEQ ID NO:16或SEQ ID NO:28的第79个氨基酸。同样地,如果将ActRIIB多肽描述为在氨基酸位置64具有丙氨酸或精氨酸,则将理解位置64是指ActRIIB多肽所来源的SEQID NO:16或SEQ ID NO:28的第64个氨基酸。
在某些实施方式中,在本文所述的组合物和方法中使用的ACTRIIB的抑制剂包含多肽,所述多肽包含ActRIIB的活化素结合域。在一些实施方式中,ActRIIB的活化素结合域包含ActRIIB的胞外域或其部分。在具体的实施方式中,ActRIIB的胞外域或其部分是可溶的。在美国专利申请公开No.20090005308和20100068215中公开了示例性的ActRIIB多肽的修饰形式,以上专利的公开内容以其全部内容作为参考并入本文。
在具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIB多肽是可溶性ActRIIB多肽。因此,术语“可溶性ActRIIB多肽”通常是指包含ActRIIB蛋白的胞外域的多肽,其包括ActRIIB蛋白的任何天然存在的胞外域及其任何变体(包括突变体、片段和拟肽形式)。可溶性ActRIIB多肽可以结合至活化素;然而,野生型ActRIIB蛋白相对于GDF8/11在与活化素的结合中未显示出显著的选择性。在某些实施方式中,可以在本文所提供的方法中使用具有不同结合性质的ActRIIB的改变形式。例如,在国际专利申请公开No.WO 2006/012627和WO 2010/019261中公开了这些改变形式,以上专利的公开内容以其全部内容作为参考并入本文。通过将其与第二活化素选择性结合剂连接,可以赋予天然或改变的ActRIIB蛋白对活化素额外的特异性。示例性可溶性ActRIIB多肽包括人ActRIIB多肽的胞外域(例如,SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43)。
已表明Hilden等人(Blood,1994,83(8):2163-70)所公开的具有ActRIIB胞外序列的Fc融合蛋白(在对应于ActRIIB前体氨基酸序列,即SEQ ID NO:16(本文中称为“A64”)的氨基酸64的位置处具有丙氨酸)对活化素和GDF-11具有相对低的亲合力。相比之下,在ActRIIB前体氨基酸序列(本文中称为“R64”)位置64处具有精氨酸的Fc融合蛋白对活化素和GDF-11具有低纳摩尔至高皮摩尔范围的亲合力(参见,例如,美国专利申请公开No.20100068215,该专利的公开内容以其全部内容并入本文)。位置64处为精氨酸的ActRIIB前体氨基酸序列以SEQ ID NO:28提供。照此,在某些实施方式中,根据本文所述的组合物和方法使用的ActRIIB多肽可以包括(i)在对应于ActRIIB前体氨基酸序列的氨基酸64的位置处为丙氨酸,即,SEQ ID NO:16;或者(ii)在对应于ActRIIB前体氨基酸序列的氨基酸64的位置处为精氨酸,即,SEQ ID NO:28。在其他实施方式中,根据本文所述的组合物和方法使用的ActRIIB多肽可以包括在对应于ActRIIB前体氨基酸序列的氨基酸64的位置处不是丙氨酸或精氨酸(即,SEQ ID NO:16或SEQ ID NO:28)的氨基酸。
已显示ActRIIB胞外域C末端处脯氨酸结的缺失降低了受体对活化素的亲合力(参见,例如,Attisano等人,Cell,1992,68(1):97-108)。相对于含有SEQ ID NO:28的氨基酸20-134的ActRIIB-Fc融合蛋白(即,SEQ ID NO:31),“ActRIIB(20-134)-Fc”(其包含脯氨酸结区和完整的近膜域),含有SEQ ID NO:28的氨基酸20-119的ActRIIB-Fc融合蛋白(即,SEQID NO:32),“ActRIIB(20-119)-Fc”对GDF-11和活化素的结合降低。然而,相对于ActRIIB非截短胞外域,即使脯氨酸结区断裂,含有SEQ ID NO:28的氨基酸20-129的ActRIIB-Fc融合蛋白“ActRIIB(20-129)-Fc”保留了类似但稍微降低的活性。因此,预计包含在SEQ ID NO:28(或者SEQ ID NO:16)的氨基酸134、133、132、131、130和129处终止的胞外域的ActRIIB多肽均将是有活性的,但是在氨基酸134或133处终止的构件可以是最有活性的。类似地,预计在任何残基129-134处的突变将不能大幅度改变配体结合亲合力,如SEQ ID NO:28的P129和P130的突变不能显著降低配体结合的事实所示。因此,根据本文所述的方法和组合物使用的ActRIIB多肽可以早在SEQ ID NO:28(或者SEQ ID NO:16)的氨基酸109处终止(即,最终的半胱氨酸),然而,预计在SEQ ID NO:28(或者SEQ ID NO:16)的氨基酸位置109至119处或之间终止的形式将具有降低的配体结合能力。
SEQ ID NO:16和SEQ ID NO:28的氨基酸29代表ActRIIB前体序列中初始的半胱氨酸。预计在SEQ ID NO:16或者SEQ ID NO:28的N-末端的氨基酸29或在这些氨基酸位置之前开始的ActRIIB多肽将保留配体结合活性。SEQ ID NO:16或者SEQ ID NO:28位置24处丙氨酸向天门冬酰胺的突变引入了N-连接的糖基化序列,而基本不影响配体结合。这确认了信号切割肽和半胱氨酸交联区之间的区域(对应于SEQ ID NO:16或者SEQ ID NO:28的氨基酸20-29)中的突变是良好耐受的。具体地,在SEQ ID NO:16或者SEQ ID NO:28的氨基酸位置20、21、22、23和24开始的ActRIIB多肽将保留活性,并且预期在SEQ ID NO:16或者SEQ IDNO:28的氨基酸位置25、26、27、28和29开始的ActRIIB多肽也将保留活性。在SEQ ID NO:16或者SEQ ID NO:28的氨基酸位置22、23、24或25开始的ActRIIB多肽将具有最大的活性。
总的来说,根据本文所述的方法和组合物使用的ActRIIB前体蛋白(即,SEQ IDNO:16或者SEQ ID NO:28)的活性部分(即,ActRIIB多肽)通常将包含SEQ ID NO:16或者SEQID NO:28的氨基酸29-109,并且这些ActRIIB多肽可以(例如)在对应于SEQ ID NO:16或者SEQ ID NO:28的氨基酸19-29的任一个的残基处开始并在对应于SEQ ID NO:16或者SEQ IDNO:28的氨基酸109-134的任一个的位置处终止。本文所涵盖的ActRIIB多肽的具体实例包括在SEQ ID NO:16或SEQ ID NO:28的氨基酸位置19-29、20-29或21-29处开始并在SEQ IDNO:16或者SEQ ID NO:28的氨基酸位置119-134、119-133或129-134、129-133终止的那些。本文所涵盖的ActRIIB多肽的其他具体实例包括在SEQ ID NO:16或SEQ ID NO:28的氨基酸位置20-24(或21-24或22-25)处开始并在SEQ ID NO:16或者SEQ ID NO:28的氨基酸位置109-134(或109-133)、119-134(或119-133)或者129-134(或129-133)终止的那些。还考虑了这些范围内的变体ActRIIB多肽,具体地与SEQ ID NO:16或者SEQ ID NO:28的对应部分具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性或序列同源性的那些。
在某些实施方式中,在本文所述的组合物和方法中使用的ACTRIIB的抑制剂包括ActRIIB胞外域的截短形式。截短可以位于ActRIIB多肽的羧基末端和/或氨基末端。在某些实施方式中,相对于成熟ActRIIB多肽胞外域,截短可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸长。在某些实施方式中,截短可以是成熟ActRIIB多肽胞外域的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个N末端氨基酸。在某些实施方式中,截短可以是成熟ActRIIB多肽胞外域的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个C末端氨基酸。例如,ActRIIB的截短形式包括具有氨基酸20-119;20-128;20-129;20-130;20-131;20-132;20-133;20-134;20-131;21-131;22-131;23-131;24-131;和25-131的多肽,其中氨基酸位置表示SEQ ID NO:16或者SEQ ID NO:28中的氨基酸位置。
ActRIIB的其他示例性截短形式包括(i)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸21-29处的氨基酸开始(任选地,在SEQ ID NO:16或者SEQ ID NO:28的22-25处开始)并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸109-134处终止的多肽;(ii)在SEQID NO:16或者SEQ ID NO:28的任何氨基酸20-29处开始(任选地,在SEQ ID NO:16或者SEQID NO:28的22-25处开始)并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸109-133处终止的多肽;(iii)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸20-24处开始(任选地,在SEQ ID NO:16或者SEQ ID NO:28的22-25处开始)并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸109-133处终止的多肽;(iv)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸21-24处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸109-134处终止的多肽;(v)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸20-24处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸118-133处终止的多肽;(vi)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸21-24处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸118-134处终止的多肽;(vii)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸20-24处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸128-133处终止的多肽;(viii)在SEQ IDNO:16或者SEQ ID NO:28的任何氨基酸20-24处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸128-133处终止的多肽;(ix)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸21-29处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸118-134处终止的多肽;(x)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸20-29处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸118-133处终止的多肽;(xi)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸21-29处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸128-134处终止的多肽;和(xii)在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸20-29处开始并在SEQ ID NO:16或者SEQ ID NO:28的任何氨基酸128-133处终止的多肽。在具体的实施方式中,ActRIIB多肽包含在SEQ ID NO:16或者SEQ ID NO:28的氨基酸位置25处开始并在SEQID NO:16或者SEQ ID NO:28的氨基酸位置131处终止的氨基酸序列,或者基本由它们或它们组成。在另一个具体的实施方式中,ActRIIB多肽由或基本由SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42或43的氨基酸序列组成。
可以作为同型二聚体产生在本文所述的组合物和方法中使用的任何ActRIIB多肽。可以将在本文所述的组合物和方法中使用的任何ActRIIB多肽配制为具有包含来自IgG重链的恒定区,如Fc结构域的异源部分的融合蛋白。在本文所述的组合物和方法中使用的任何ActRIIB多肽可以在对应于SEQ ID NO:16或者SEQ ID NO:28的位置79的位置处包含酸性氨基酸,任选地与相对于SEQ ID NO:16或者SEQ ID NO:28的一个或多个额外的氨基酸取代、缺失或插入相结合。
在具体的实施方式中,在本文所述的组合物和方法中使用的ACTRIIB的抑制剂包括具有一个或多个氨基酸取代/突变的ActRIIB的胞外域。这种氨基酸取代/突变可以是(例如)在SEQ ID NO:16或者SEQ ID NO:28的氨基酸位置79处亮氨酸交换为酸性氨基酸,如门冬氨酸或谷氨酸。例如,在ActRIIB胞外域多肽中,可以改变SEQ ID NO:16或者SEQ ID NO:28的位置L79以赋予改变的活化素-肌肉生成抑制素(GDF-11)结合性质。L79A和L79P突变对GDF-11结合程度的降低比对活化素结合程度的降低更大。L79E和L79D突变保留了GDF-11结合,同时表明极大地降低了活化素结合。
在某些实施方式中,在本文所述的组合物和方法中使用的ACTRIIB的抑制剂包含ActRIIB胞外域的截短形式,其还具有氨基酸取代,例如,SEQ ID NO:16或者SEQ ID NO:28氨基酸位置79处从亮氨酸交换为酸性氨基酸,如门冬氨酸或谷氨酸。在具体的实施方式中,在本文所述的组合物和方法中使用的还具有氨基酸取代的ActRIIB多肽的胞外域的截短形式为SEQ ID NO:23。截短和/或具有一个或多个氨基酸取代的ActRIIB形式可以与如以上所讨论的抗体的Fc结构域连接。
可以(例如)通过筛选从编码ActRIIB多肽的核酸的相应片段重组产生的多肽来获得ActRIIB多肽的功能活性片段。另外,可以使用本领域中已知的技术,如常规Merrifield固相f-Moc或t-Boc化学来化学合成片段。可以产生(重组或化学合成)并测试所述片段以鉴别可以用作ActRIIB蛋白的或活化素介导的信号转导的拮抗剂(抑制剂)的那些肽基片段。
另外,可以(例如)通过筛选从编码ActRIIB多肽的相应诱变的核酸重组产生的修饰多肽库来获得ActRIIB多肽的功能活性变体。可以产生并测试所述变体以鉴别可以用作ActRIIB蛋白的或活化素介导的信号转导的拮抗剂(抑制剂)的那些。在某些实施方式中,ActRIIB多肽的功能变体包含与选自SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的氨基酸序列具有至少75%的同一性的氨基酸序列。在某些实施方式中,所述功能变体具有与选自SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的氨基酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的同一性的氨基酸序列。
出于提高治疗效力或稳定性(例如,离体储存期限和对体内蛋白水解降解作用的耐受性)的目的,可以(例如)通过修饰ActRIIB多肽的结构来产生功能性变体。当选择以保留活化素结合时,这些修饰的ActRIIB多肽被认为是天然存在的ActRIIB多肽的功能等价物。还可以(例如)通过氨基酸取代、缺失或添加来产生修饰的ActRIIB多肽。例如,合理地预计用异亮氨酸或缬氨酸单独取代亮氨酸、用谷氨酸单独取代天冬氨酸、用丝氨酸单独取代苏氨酸或用结构相关氨基酸类似地取代氨基酸(例如,保守突变)将不会对所得分子的生物活性具有较大影响。保守取代是在它们的侧链中相关的氨基酸家族内发生的那些。可以通过评价变体ActRIIB多肽以类似于野生型ActRIIB多肽的方式在细胞中产生反应的能力来容易地确定ActRIIB多肽的氨基酸序列中的改变是否会导致产生功能性同源物。
可以在本文所述的方法和组合物中使用ActRIIB多肽突变体,具体地,ActRIIB多肽的组合突变体组,以及截短突变体;组合突变体的混合对于鉴别功能性变体序列是特别有用的。筛选这些组合文库的目的可以是产生(例如)可以起激动剂或拮抗剂作用,或者可替代地,一起具有新的活性的ActRIIB多肽变体。
已表明SEQ ID NO:16或者SEQ ID NO:28的残基Y31、N33、N35、L38至T41、E47、E50、Q53至K55、L57、H58、Y60、S62、K74、W78至N83、Y85、R87、A92和E94至F101限定了ActRIIB的配体结合口袋(ligand binding pocket)。在这些位置,预计保守突变将是容许的,尽管K74A突变是良好容许的,R40A、K55A、F82A和位置L79处的突变也是一样。R40是非洲蟾蜍属(Xenopus)中的K,表明在该位置碱性氨基酸将是允许的。Q53在牛ActRIIB中是R,在非洲蟾蜍属ActRIIB中是K,并因此在该位置包括R、K、Q、N和H在内的氨基酸将是容许的。因此,在本文所述的方法和组合物中使用的ActRIIB多肽的通式为包含SEQ ID NO:16或者SEQ ID NO:28的氨基酸29-109,但任选地在SEQ ID NO:16或者SEQ ID NO:28的20-24或22-25的氨基酸位置范围内开始并在SEQ ID NO:16或者SEQ ID NO:28的129-134的氨基酸位置范围内终止,并且在配体结合口袋中包含不超过1、2、5或15个保守氨基酸变化,并在配体结合口袋中在SEQ ID NO:16或者SEQ ID NO:28的氨基酸位置40、53、55、74、79和/或82包含0、一个或多个非保守变化的多肽。这种ActRIIB多肽可以保留与SEQ ID NO:16或者SEQ ID NO:28的氨基酸29-109的序列的大于80%、90%、95%或99%的序列同一性或序列同源性。可以特别良好地容许变化的结合口袋外的位点包括ActRIIB胞外域的氨基和羧基末端以及位置42-46和65-73。SEQ ID NO:16或者SEQ ID NO:28的位置65处天门冬酰胺向丙氨酸的变化(N65A)实际上改善了A64背景中的配体结合,并因此预期在R64背景中对配体结合无不利影响。该变化可能会消除A64背景中N65处的糖基化作用,因此表明在该区域内显著的变化可能是容许的。尽管R64A变化是不太容许的,但是R64K是良好容许的,并因此另一个碱性残基,如H在位置64可以是容许的。
作为在配体结合域中具有突变的ActRIIB多肽的具体实例,ActRIIB的配体结合域的带正电的氨基酸残基Asp(D80)可以突变为不同的氨基酸残基,从而变体ActRIIB多肽优先结合至GDF8,而不是活化素。在具体的实施方式中,D80残基改变下列氨基酸残基,其选自:不带电的氨基酸残基、带负电的氨基酸残基和疏水性氨基酸残基。作为其他具体实例,疏水性残基L79可以改变为酸性氨基酸门冬氨酸或谷氨酸,以大大降低活化素结合,同时保留GDF11结合。如本领域技术人员将认识的,可以在核酸水平上,或者在一些情况下,通过翻译后修饰或化学合成来进行大部分所述突变、变体或修饰。这些技术在本领域中是熟知的。
在具体的实施方式中,在本文所述的组合物和方法中使用的ACTRIIB的抑制剂包括结合/融合蛋白,其包含连接至抗体Fc部分的ActRIIB受体的胞外域(例如,活化素结合域)。这些结合/融合蛋白可以包含本文所公开的任何ActRIIB多肽(例如,任何SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42或43),本领域中已知的任何ActRIIB多肽或使用本领域中已知的和/或本文所提供的方法产生的任何ActRIIB多肽。
在某些实施方式中,所述胞外域通过接头(例如,肽接头)连接到抗体的Fc部分。示例性的接头包括短多肽序列,如2-10、2-5、2-4、2-3个氨基酸残基(例如,甘氨酸残基),如,例如:Gly-Gly-Gly接头。在具体的实施方式中,所述接头包含氨基酸序列Gly-Gly-Gly(GGG)。在另一个具体的实施方式中,所述接头包含氨基酸序列Thr-Gly-Gly-Gly(TGGG)。任选地,Fc结构域在残基,如Asp-265、赖氨酸322和Asn-434处具有一个或多个突变。在某些情况下,相对于野生型Fc结构域,具有一个或多个这些突变(例如,Asp-265突变)的突变体Fc结构域结合至Fcγ受体的能力降低。在其他情况下,具有这些突变中的一个或多个(例如,Asn-434突变)的突变Fc结构域结合至MHC I类相关Fc-受体(FcRN)的能力比野生型Fc结构域提高。在SEQ ID NO:20、21、24、25、34、35、38、39、40、41、44、46和47中描述了包含融合至Fc结构域的ActRIIB的可溶性胞外域的示例性融合蛋白。
在具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIB抑制剂包括连接至抗体Fc部分的ActRIIB的胞外域或其部分,其中所述ActRIIB抑制剂包含与选自SEQID NO:20、21、24、25、34、35、38、39、40、41、44、46和47的氨基酸序列具有至少75%同一性的氨基酸序列。在另一个具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIB抑制剂包括连接至抗体Fc部分的ActRIIB的胞外域或其部分,其中所述ActRIIB抑制剂包含与选自SEQ ID NO:20、21、24、25、34、35、38、39、40、41、44、46和47的氨基酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的同一性的氨基酸序列。
在具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIB抑制剂是在人ActRIIB受体胞外域和IgG1的Fc部分之间的融合蛋白。在另一个具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIB抑制剂是在人ActRIIB受体的截短的胞外域和IgG1的Fc部分之间的融合蛋白。在另一个具体的实施方式中,在本文所述的组合物和方法中使用的ActRIIB抑制剂是在人ActRIIB受体的截短的胞外域和IgG1的Fc部分之间的融合蛋白,其中人ActRIIB受体的截短的胞外域在对应于SEQ ID NO:16或者SEQ ID NO:28的氨基酸79的氨基酸位置处具有氨基酸取代。在一种实施方式中,对应于SEQ ID NO:16或者SEQID NO:28的氨基酸79的氨基酸位置处的氨基酸取代是用门冬氨酸取代亮氨酸(即,L79D突变)。
在具体的实施方式中,在SEQ ID NO:24或25中描述了在本文所述的组合物和方法中使用的ActRIIB抑制剂,其代表人ActRIIB受体胞外域和IgG1的Fc部分之间的融合蛋白,其中所述ActRIIB胞外域包含具有L79D突变的SEQ ID NO:28的氨基酸25-131。在SEQ IDNO:45中提供了编码SEQ ID NO:24的ActRIIB-Fc融合蛋白的核酸序列。
在另一个具体的实施方式中,在SEQ ID NO:34或35中描述了在本文所述的组合物和方法中使用的ActRIIB抑制剂,其代表人ActRIIB受体胞外域和IgG1的Fc部分之间的融合蛋白,其中所述ActRIIB胞外域包含具有L79D突变的SEQ ID NO:16的氨基酸25-131。
天门冬酰胺-连接的糖基化识别位点通常包含三肽序列,天门冬酰胺-X-苏氨酸(或者天门冬酰胺-X-丝氨酸)(其中“X”是任何氨基酸),其被适当的细胞糖基化酶特异性识别。还可以通过一个或多个丝氨酸或苏氨酸残基对野生型ActRIIB多肽序列的添加或取代来进行改变(对于O-连接的糖基化位点)。在糖基化识别位点的第一或第三氨基酸位置中的一处或两处的多种氨基酸取代或缺失(和/或第二位置的氨基酸缺失)导致在修饰的三肽序列产生了非糖基化作用。提高ActRIIB多肽上碳水化合物部分数目的另一种方法是通过糖苷与ActRIIB多肽的化学或酶促连接。根据所使用的偶联形式,可以将糖连接到(a)精氨酸和组氨酸;(b)游离羧基;(c)游离巯基,如半胱氨酸的那些;(d)游离羟基,如丝氨酸、苏氨酸或羟脯氨酸的那些;(e)芳香族残基,如苯丙氨酸、酪氨酸或色氨酸的那些;或者(f)谷氨酰胺的酰胺基。这些方法在1987年9月11日公开的国际专利申请No.WO 87/05330和Aplin andWriston(1981)CRC Crit.Rev.Biochem.,第259-306页中有述,以上文献作为参考并入本文。可以通过化学和/或酶促反应实现ActRIIB多肽上存在的一个或多个碳水化合物部分的除去。化学去糖基化可以包括(例如)ActRIIB多肽对化合物三氟甲磺酸或等价化合物的暴露。该处理导致除连接糖(N-乙酰葡萄糖胺或N-乙酰半乳糖胺)之外大部分或全部的糖的切割,同时留下了完整的氨基酸序列。化学去糖基化通过Hakimuddin等人,(1987)Arch.Biochem.Biophys.259:52和Edge等人(1981)Anal.Biochem.118:131得到进一步描述。可以通过使用多种内切和外切糖苷酶实现ActRIIB多肽上碳水化合物部分的酶促切割,如通过Thotakura等人(1987)Meth.Enzymol.138:350中所述。根据所使用的表达系统类型,可以根据情况调整ActRIIB多肽的序列,这是因为哺乳动物、酵母、昆虫和植物细胞均可以引入不同的糖基化类型,这可以受所述肽的氨基酸序列所影响。一般地,在人中使用的ActRIIB蛋白将在提供正确糖基化作用的哺乳动物细胞系中表达,如HEK293或CHO细胞系,尽管预期其他表达系统,如其他哺乳动物表达细胞系、具有工程设计的糖基化酶的酵母细胞系和昆虫细胞也是有用的。
在具体的实施方式中,可以在本文所述的方法和组合物中使用突变ActRIIB多肽,其包含相对于ActRIIB(R64)-Fc形式,提高ActRIIB-Fc融合蛋白的血清半衰期的其他N-连接的糖基化位点(N-X-S/T)的添加。在具体的实施方式中,SEQ ID NO:16或者SEQ ID NO:28的位置24处天门冬酰胺的引入(A24N)导致产生了赋予更长半衰期的NXT序列。其他NX(T/S)序列可以存在于42-44(NQS)和65-67(NSS)中,尽管后者可能不能在位置64处被R有效糖基化(即,在R64多肽中)。通常,可以在ActRIIB的配体结合口袋外的位置处引入N-X-S/T序列,这在上文中有详细说明。特别适合于非内源N-X-S/T序列引入的位点包括SEQ ID NO:16或SEQ ID NO:28的氨基酸20-29、20-24、22-25、109-134、120-134或129-134。还可以将N-X-S/T序列引入ActRIIB序列和Fc或其他融合组分之间的接头。通过在相对于预先存在的S或T的正确位置引入N,或者通过在对应于预先存在的N的位置处引入S或T,可以轻松地引入该位点。因此,将产生N-连接糖基化位点的所期望的变化为:A24N、R64N、S67N(可能与N65A改变合并)、E106N、R112N、G120N、E123N、P129N、A132N、R112S和R112T(其中所有氨基酸位置对应于它们在SEQ ID NO:16或者SEQ ID NO:28中可以存在的位置)。由于糖基化作用所提供的保护,可以将预期会被糖基化的任何S改变为T而不会产生免疫原性位点。同样地,可以将预期会被糖基化的任何T改变为S。因此,在本文中涵盖了变化S67T和S44T。同样地,在A24N变体中,可以使用S26T变化。因此,ActRIIB多肽可以包括一个或多个其他、非内源N-连接的糖基化共有序列。
可以使用多种筛选测定来评价ActRIIB多肽变体。例如,可以筛选ActRIIB多肽变体结合至ActRIIB配体的能力,以防止ActRIIB配体与ActRIIB多肽结合或干扰由ActRIIB配体所引起的信号转导。还可以在基于细胞的测定或体内测定中测试ActRIIB多肽或其变体的活性。
可以产生通过组合获得的变体,其相对于天然存在的ActRIIB多肽具有选择性或通常提高的效力。同样地,突变可以导致产生胞内半衰期显著不同于相应野生型ActRIIB多肽的变体。例如,改变的蛋白可以使得对蛋白水解降解或其他细胞代谢过程更稳定或不太稳定,所述蛋白水解降解或其他细胞代谢过程导致天然ActRIIB多肽的破坏,或否则的话,失活。可以使用这些变体和编码它们的基因通过调节ActRIIB多肽的半衰期来改变ActRIIB多肽水平。例如,短半衰期可以导致更多的瞬时生物作用并且可以使得能够更密切地控制患者内的重组ActRIIB多肽水平。在Fc融合蛋白中,可以在接头(如果有的话)和/或Fc部分中进行突变以改变蛋白质的半衰期。
可以通过编码多肽文库(其分别包括潜在的ActRIIB多肽序列的至少一部分)的基因的简并文库产生组合文库。例如,可以将合成寡核苷酸的混合物通过酶促反应连接至基因序列,从而潜在的ActRIIB多肽的核苷酸序列的简并组是作为单个多肽可表达的,或者可替代地,作为较大的融合蛋白组是可表达的(例如,用于噬菌体展示)。
可以从简并寡核苷酸序列产生可能的同源物文库的方法众多。可以在自动DNA合成仪中进行简并基因序列的化学合成,并且然后,将合成基因连接至适当的载体用于表达。简并寡核苷酸的合成在本领域中是熟知的(参见,例如,Narang,S A(1983)Tetrahedron39:3;Itakura等人,(1981)Recombinant DNA,Proc.3rd ClevelandSympos.Macromolecules,AG Walton主编,Amsterdam:Elsevier第273-289页;Itakura等人,(1984)Annu.Rev.Biochem.53:323;Itakura等人,(1984)Science 198:1056;Ike等人,(1983)Nucleic Acid Res.11:477)。这些技术已在其他蛋白的定向进化中使用(参见,例如,Scott等人,(1990)Science 249:386-390;Roberts等人,(1992)PNAS USA 89:2429-2433;Devlin等人,(1990)Science 249:404-406;Cwirla等人,(1990)PNAS USA 87:6378-6382;以及美国专利No.5223409、5198346和5096815)。
可替代地,可以使用其他形式的突变来产生组合文库。例如,可以产生ActRIIB多肽变体并通过使用(例如)丙氨酸扫描突变等(Ruf等人,(1994)Biochemistry 33:1565-1572;Wang等人,(1994)J.Biol.Chem.269:3095-3099;Balint等人,(1993)Gene 137:109-118;Grodberg等人,(1993)Eur.J.Biochem.218:597-601;Nagashima等人,(1993)J.Biol.Chem.268:2888-2892;Lowman等人,(1991)Biochemistry30:10832-10838;和Cunningham等人,(1989)Science 244:1081-1085),通过接头扫描突变(Gustin等人,(1993)Virology 193:653-660;Brown等人,(1992)Mol.Cell Biol.12:2644-2652;McKnight等人,(1982)Science232:316);通过饱和突变(Meyers等人,(1986)Science 232:613);通过PCR突变(Leung等人,(1989)Method Cell Mol Biol 1:11-19);或者通过随机突变,包括化学物诱变作用等(Miller et al.,(1992)A Short Course in BacterialGenetics,CSHL Press,Cold Spring Harbor,N.Y.;和Greener等人,(1994)Strategies inMol Biol 7:32-34)筛选来从文库中分离。接头扫描突变,具体地,在组合环境中,是鉴别ActRIIB多肽截短(生物活性)形式的有吸引力的方法。
在本领域中,用于筛选通过点突变和截短产生的组合文库的基因产物的大量技术是已知的,并且对此而言,对筛选cDNA文库中具有某些性质的基因产物来说是已知的。这些技术通常将可适应于通过ActRIIB多肽的组合突变所产生的基因文库的快速筛选。用于筛选大基因文库的最广泛使用的技术通常包括将基因文库克隆到可复制的表达载体中,用所得载体文库转化适当的细胞,并在其中所需活性的检测有利于相对容易地分离编码将检测其产物的基因的载体的情况下表达组合基因。优选的测定包括活化素结合测定和活化素介导的细胞信号转导测定。
在某些实施方式中,除了ActRIIB多肽中天然存在的任何修饰外,在本文所述的方法和组合物中使用的ActRIIB多肽还可以包含翻译后修饰。这些修饰包括(但不限于)乙酰化、羧化、糖基化、磷酸化、脂化和酰基化。因此,修饰的ActRIIB多肽可以含有非氨基酸元素,如聚乙二醇、脂质、聚糖或单糖和磷酸酯。可以通过技术人员已知的任何方法测试这些非氨基酸元素对ActRIIB多肽功能性的影响。当通过切割ActRIIB多肽的新生形式在细胞中产生ActRIIB多肽时,翻译后加工也可以对蛋白质的正确折叠和/或功能是重要的。不同细胞(如CHO、HeLa、MDCK、293、W138、NIH-3T3或HEK293)对这些翻译后活性具有特定细胞机制和特征机制,并且可以对其进行选择以确保ActRIIB多肽的正确修饰和加工。
在某些方面,ActRIIB多肽的功能性变体或修饰形式包括具有ActRIIB多肽的至少一部分和一个或多个融合结构域的融合蛋白。这些融合结构域的熟知实例包括(但不限于)多组氨酸、Glu-Glu、谷胱甘肽S转移酶(GST)、硫氧还蛋白、蛋白A、蛋白G、免疫球蛋白重链恒定区(Fc)、麦芽糖结合蛋白(MBP)或人血清白蛋白。可以选择融合结构域以赋予所需性质。例如,一些融合结构域对通过亲和色谱法分离融合蛋白是特别有用的。出于亲合纯化的目的,使用了用于亲和色谱法的相关基质,如谷胱甘肽-、淀粉酶-和镍-或钴-结合树脂。多种这些基质是以“试剂盒”形式获得的,如Pharmacia GST纯化系统和与(HIS6)融合伴侣使用的QIAexpressTM系统(Qiagen)。作为另一个实例,可以选择融合结构域以有利于ActRIIB多肽的检测。这些检测域的实例包括多种荧光蛋白(例如,GFP)以及“表位标记”,其通常是特异性抗体可用的短肽序列。对其来说,特异性单克隆抗体是易于获得的熟知的表位标记包括FLAG、流感病毒血球凝集素(HA)和c-myc标记。在一些情况下,融合结构域具有蛋白酶切割位点,如对于因子Xa或凝血酶,其使得相关蛋白酶能够部分消化融合蛋白并借此从中释放重组蛋白。然后,可以通过后续色谱分离,从融合结构域分离释放的蛋白。在某些优选的实施方式中,将ActRIIB多肽与体内稳定ActRIIB多肽的域融合(“稳定剂”域)。“稳定”是指不考虑是否是由破坏减少、肾清除减少或其他药物动力学作用所引起的,提高血清半衰期的任何情况。已知与免疫球蛋白的Fc部分融合会赋予多种蛋白所期望的药物动力学性质。同样地,与人血清白蛋白融合可以赋予所期望的性质。可以选择的其他类型的融合结构域包括多聚(例如,二聚、四聚)域和功能域(赋予额外的生物学功能,如根据需要,进一步刺激骨生长或肌肉生长)。
应理解可以根据所需的功能性以任何方式布置融合蛋白的不同元素。例如,ActRIIB多肽可以位于异源域的C末端,或可替代地,异源域可以位于ActRIIB多肽的C末端。在融合蛋白中,ActRIIB多肽域和异源域不必需是相邻的,并且可以在任一个域的C或N末端或在域之间包含其他域或氨基酸序列。
在某些实施方式中,在本文所述的方法和组合物中使用的ActRIIB多肽含有能够稳定ActRIIB多肽的一个或多个修饰。例如,这些修饰可以提高ActRIIB多肽的体外半衰期,提高ActRIIB多肽的循环半衰期或降低ActRIIB多肽的蛋白水解降解。这些稳定修饰包括(但不限于)融合蛋白(包括,例如,包含ActRIIB多肽和稳定剂域的融合蛋白),糖基化位点的修饰(包括,例如,向ActRIIB多肽添加糖基化位点)和碳水化物部分的修饰(包括,例如,从ActRIIB多肽除去碳水化合物部分)。就融合蛋白来说,将ActRIIB多肽融合至稳定剂域,如IgG分子(例如,Fc结构域)。如本文所使用的,术语“稳定剂域”不仅是指融合蛋白情况下的融合结构域(例如,Fc),而且还包括非蛋白修饰,如碳水化物部分,或非蛋白聚合物,如聚乙二醇。
在某些实施方式中,本文所述的方法和组合物使用分离或纯化的ActRIIB多肽,即可以与本文所述的方法和组合物一起使用从其他蛋白分离或基本不含其他蛋白的ActRIIB多肽。通常将通过从重组核酸表达来产生ActRIIB多肽。
在某些方面,在本文所述的方法和组合物中使用的ActRIIB多肽是通过分离和/或重组核酸编码的,包括本文所公开的片段、功能性变体和融合蛋白。例如,SEQ ID NO:19编码天然存在的人ActRIIB前体多肽。受试者核酸可以是单链或双链的。这些核酸可以是DNA或RNA分子。可以(例如)在制备ActRIIB多肽的方法中使用这些核酸,或者可以作为直接治疗剂(例如,在基因疗法)中使用。
在某些方面,进一步理解可以用于产生适合在本文所述的方法和组合物中使用的ActRIIB多肽的核酸包括SEQ ID NO:19的变体以及编码可溶性ActRIIB多肽的那些核酸序列(例如,编码SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的核酸)的变体的核酸。变体核苷酸序列包括相差一个或多个核苷酸取代、添加或缺失的序列,如等位变体。
在某些实施方式中,可以用于产生适合在本文所述的方法和组合物中使用的ActRIIB多肽的分离或重组核酸序列与SEQ ID NO:19或者编码可溶性ActRIIB多肽的那些核酸序列(例如,编码SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的核酸)具有至少80%、85%、90%、95%、97%、98%、99%或100%的同一性。本领域的技术人员将理解可以与本文所述的方法和组合物一起使用与SEQ ID NO:19或者编码可溶性ActRIIB多肽的那些核酸序列(例如,编码SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的核酸)以及SEQ ID NO:19或者编码可溶性ActRIIB多肽的那些核酸序列(例如,编码SEQID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的核酸)的变体互补的核酸序列。在其他实施方式中,所述核酸序列可以是分离的、重组的和/或与异源核苷酸序列融合的,或是DNA文库中的。
在其他实施方式中,可以用于产生适合在本文所述的方法和组合物中使用的ActRIIB多肽的核酸包括在高度严格条件下与SEQ ID NO:19中所示的核苷酸序列或编码可溶性ActRIIB多肽的那些核酸序列(例如,编码SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的核酸)、SEQ ID NO:19或编码可溶性ActRIIB多肽的那些核酸序列(例如,编码SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的核酸)的互补序列或其片段杂交的核苷酸序列。本领域的技术人员将理解可以改变促进DNA杂交的适当的严格条件。例如,可以在约45℃,在6.0倍氯化钠/柠檬酸钠(SSC)条件下进行杂交,然后在50℃,以2.0倍SSC清洗。例如,清洗步骤中的盐浓度可以从50℃,约2.0倍SSC的低严格性值50℃,约0.2倍SSC的高严格性进行选择。另外,清洗步骤中的温度可以从室温(约22℃)下的低严格性条件提高至约65℃的高严格性条件。温度和盐两者均可以改变,或者温度或盐浓度可以保持不变,而另一个变量改变。在一种实施方式中,可以与本文所述的方法和组合物一起使用在室温下6倍SSC的低严格性条件下杂交,然后在室温下以2倍SSC清洗的核酸。
由于遗传密码的简并度,不同于SEQ ID NO:19所示的核酸或编码可溶性ActRIIB多肽的那些核酸序列(例如,编码SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的核酸)的分离的核酸也可以用于产生适合于在本文所述的方法和组合物中使用的ActRIIB多肽。例如,一些氨基酸是由不只一个三联体表示的。指明相同氨基酸的密码子或同义密码子(例如,CAU和CAC对组氨酸是同义密码子)可能导致不影响蛋白质的氨基酸序列的“沉默”突变。然而,预期确实导致受试者蛋白的氨基酸序列变化的DNA序列多态性将在哺乳动物细胞中存在。本领域技术人员将理解由于天然等位变化,编码特定蛋白的核酸的一个或多个核苷酸(多达核苷酸的约3-5%)中的这些变化可以在给定物种的个体中存在。可以与本文所述的方法和组合物一起使用任何和所有这些核苷酸变化和所得的氨基酸多态性。
在某些实施方式中,可以用于产生适合在本文所述的方法和组合物中使用的ActRIIB多肽的重组核酸可以在表达构件中操作性地连接至一个或多个调控核苷酸序列。调控的核苷酸序列通常将适合于用于表达的宿主细胞。对于多种宿主细胞,多种类型的适合的表达载体和适合的调控序列在本领域中是已知的。通常,所述一种或多种调控核苷酸序列可以包括(但不限于)启动子序列、前导序列或信号序列、核糖体结合位点,转录起始和终止序列、翻译起始和终止序列和增强子或活化子序列。可以与本文所述的方法和组合物一起使用如本领域中已知的组成型或诱导型启动子。启动子可以是天然存在的启动子,或将不止一个启动子的元素合并的杂合启动子。表达构件可以存在于细胞中的附加体(如质粒)上,或者可以将表达构件插入到染色体中。在优选的实施方式中,表达载体含有可选择的标志物基因以使得能够选择转化的宿主细胞。可选择的标志物基因在本领域中是熟知的并且将随所使用的宿主细胞而改变。
在某些方面,在包含编码ActRIIB多肽并操作性地连接至至少一个调控序列的核苷酸序列的表达载体中提供了可以用于产生适合在本文所述的方法和组合物中使用的ActRIIB多肽的核酸。调控序列是本领域所认识的,并且选择以指导ActRIIB多肽的表达。因此,术语调控序列包括启动子、增强子及其他表达调控元件。示例性调控序列描述于Goeddel;Gene Expression Technology:Methods in Enzymology,Academic Press,SanDiego,Calif.(1990)。例如,当操作性地与之连接时,可以在这些载体中使用控制DNA序列表达的任何多种表达控制序列以表达编码ActRIIB多肽的DNA序列。这些有用的表达控制序列包括(例如)SV40的早期和晚期启动子、tet启动子、腺病毒或巨细胞病毒即时早期启动子、RSV启动子、lac系统、trp系统、TAC或TRC系统、表达受T7RNA聚合酶指导的T7启动子、λ噬菌体的主要操纵子和启动子区域、fd包被蛋白的调控区域、3-磷酸甘油酸激酶或其他糖酵解酶的启动子、酸性磷酸酶的启动子,例如Pho5、酵母α交配因子的启动子、杆状病毒系统的多角体启动子和已知调控原核细胞或真核细胞或其病毒的基因表达的其他序列和它们的不同组合。应理解表达载体的设计可以取决于以下因素,如要转化的宿主细胞的选择和/或期望表达的蛋白质类型。此外,还应考虑载体的拷贝数、控制拷贝数的能力和载体编码的任何其他蛋白(如抗生素标志物)的表达。
可以通过将克隆基因或其部分连接至适合在原核细胞、真核细胞(酵母、鸟类、昆虫或者哺乳动物)或两者中表达的载体中来产生重组核酸。用于重组ActRIIB多肽生产的表达运载体(Expression vehicle)包括质粒及其他载体。例如,适合的载体包括用于在原核细胞(如大肠杆菌(E.coli))中表达的以下类型的质粒:pBR322-衍生的质粒、pEMBL-衍生的质粒、pEX-衍生的质粒、pBTac-衍生的质粒和pUC-衍生的质粒。
一些哺乳动物表达载体含有原核序列以有利于载体在细菌中增殖,和在真核细胞中表达的一种或多种真核转录单元。pcDNAI/amp、pcDNAI/neo、pRc/CMV、pSV2gpt、pSV2neo、pSV2-dhfr、pTk2、pRSVneo、pMSG、pSVT7、pko-neo和pHyg衍生的载体是适合于真核细胞转染的哺乳动物表达载体的实例。用来自细菌质粒(如pBR322)的序列修饰这些载体中的一些以有利于在原核和真核细胞中的复制和耐药性选择。可替代地,病毒,如牛乳头状瘤病毒(BPV-1)或埃-巴二氏病毒(pHEBo,pREP衍生的和p205)的衍生物可以用于真核细胞中蛋白质的瞬时表达。可以在以下基因疗法递送系统的描述中找到其他病毒(包括反转录病毒)表达系统的实例。在质粒制备和宿主生物转化中使用的多种方法在本领域中是熟知的。对于对原核和真核细胞两者均适合的其他表达系统以及一般重组程序,参见MolecularCloning A Laboratory Manual,第3版,Sambrook主编,Fritsch and Maniatis(ColdSpring Harbor Laboratory Press,2001)。在一些情况下,可以期望通过使用杆状病毒表达系统表达重组多肽。这些杆状病毒表达系统的实例包括pVL-衍生的载体(如pVL1392、pVL1393和pVL941)、pAcUW-衍生的载体(如pAcUW1)和pBlueBac-衍生的载体(如含有β-gal的pBlueBac III)。
在一种实施方式中,载体可以设计用于在CHO细胞中生产在本文所述的方法和组合物中使用的ActRIIB多肽,如Pcmv-Script载体(Stratagene,La Jolla,Calif.)、pcDNA4载体(Invitrogen,Carlsbad,Calif.)和pCI-neo载体(Promega,Madison,Wis.)。如将显而易见的,受试者基因构件可以用于导致受试者ActRIIB多肽在培养中增殖的细胞中表达,例如,以产生用于纯化的蛋白质,包括融合蛋白或变体蛋白。
用包含一种或多种受试者ActRIIB多肽的编码序列(例如,SEQ ID NO:19或编码可溶性ActRIIB多肽的那些核酸序列(例如,编码SEQ ID NO:17、18、23、26、27、29、30、31、32、33、36、37、42和43的核酸)的重组基因转染的宿主细胞可以用于产生适合在本文所述的方法和组合物中使用的ActRIIB多肽。宿主细胞可以是任何原核或真核细胞。例如,ActRIIB多肽可以在细菌细胞,如大肠杆菌(E.coli)、昆虫细胞(例如,使用杆状病毒表达系统)、酵母或哺乳动物细胞中表达。其他适合的宿主细胞是本领域技术人员已知的。
因此,本文提供了生产在本文所述的方法和组合物中使用的ActRIIB多肽的方法。例如,可以在适当条件下培养用编码ActRIIB多肽的表达载体转染的宿主细胞以使得能够发生ActRIIB多肽的表达。可以分泌ActRIIB多肽,并从含有ActRIIB多肽的细胞和培养基的混合物中分离。可替代地,ActRIIB多肽可以保留在细胞质中或膜部分中,收获细胞、裂解并分离蛋白。细胞培养物包括宿主细胞、培养基及其他副产物。用于细胞培养的适合的培养基在本领域中是熟知的。使用本领域中已知用于纯化蛋白质的技术,包括离子交换色谱、凝胶过滤色谱、超滤、电泳、使用对ActRIIB多肽的特定表位特异的抗体的免疫亲合纯化和使用结合至融合到ActRIIB多肽的域的试剂的亲合纯化(例如,可以使用蛋白A柱纯化ActRIIB-Fc融合蛋白),受试者ActRIIB多肽可以分离自细胞培养基、宿主细胞或两者。在优选的实施方式中,ActRIIB多肽是含有有利于其纯化的域的融合蛋白。在优选的实施方式中,通过任何顺序的一系列柱色谱步骤,包括,例如,以下中的三种或更多种:蛋白A色谱、Q琼脂糖色谱、苯基-琼脂糖色谱、尺寸排阻色谱和阳离子交换色谱实现纯化。可以通过病毒过滤和缓冲液交换完成纯化。如本文所示,将ActRIIB-hFc蛋白纯化至纯度>98%,如通过尺寸排阻色谱所确定的,和>95%,如通过SDS PAGE确定的。这种纯度水平足以对小鼠骨骼实现所期望的影响并且在小鼠、大鼠和非人灵长类中实现可接受的安全谱。
在另一种实施方式中,编码纯化前导序列,如重组ActRIIB多肽所需部分N-末端的聚(His)/肠激酶切割位点序列的融合基因可以使得能够使用Ni2+金属树脂通过亲和色谱法纯化表达的融合蛋白。然后,可以随后通过用肠激酶处理除去纯化前导序列以提供纯化的ActRIIB多肽(例如,参见Hochuli等人,(1987)J.Chromatography 411:177;和Janknecht等人,PNAS USA 88:8972)。
制备融合基因的技术是熟知的。基本上,使用用于连接的平端(blunt ended)或交错端(stagger ended)末端,限制酶消化以提供适合的末端,根据情况补齐粘性末端,碱性磷酸酶处理以避免不希望的连接和酶促连接,根据常规方法进行编码不同多肽序列的多个DNA片段的连接。在另一种实施方式中,可以通过常规方法,包括自动DNA合成仪来合成融合基因。可替代地,可以使用导致两个连续基因片段之间产生互补突出的锚定引物进行基因片段的PCR扩增,所述两个连续基因片段随后可以退火以产生嵌合基因序列(参见,例如,Current Protocols in Molecular Biology,Ausubel等人,John Wiley&Sons:1992)。
可以使用SEQ ID NO:8的组织纤溶酶原前导序列,在来自pAID4载体(SV40ori/增强子,CMV启动子)的稳定转染的CHO-DUKX Bl 1细胞中表达ActRIIB-Fc融合蛋白。Fc部分可以包含人IgGl Fc序列,如SEQ ID NO:7所示。在某些实施方式中,一旦表达,所包含的蛋白平均每分子ActRIIB-Fc融合蛋白具有约1.5至2.5摩尔的唾液酸。
在某些实施方式中,在人患者中,ActRIIB-Fc融合蛋白的长血清半衰期可以为25-32天。另外,CHO细胞表达的材料可以对活化素B配体具有比对人293细胞中表达的ActRIIB-hFc融合蛋白所报告的更高的亲合力(del Re等人,J Biol Chem.2004Dec 17;279(51):53126-35)。另外,不受理论束缚,TPA前导序列的使用提供了比其他前导序列更大的产量,并且与所表达的具有天然前导序列的ActRIIB-Fc不同,它可以提供高纯度的N末端序列。天然前导序列的使用可以导致产生两种主要的ActRIIB-Fc种类,其分别具有不同的N末端序列。
5.5.3其他ACTRII受体抑制剂
在某些实施方式中,在本文所述的组合物和方法中使用的ActRII受体的抑制剂为核酸化合物。
抑制ActRII受体的核酸化合物种类的实例包括反义核酸、siRNA或RNAi构件和催化性核酸构件。核酸化合物可以是单链或双链的。双链化合物还可以包括突出或非互补性区域,其中链中一个或另一个是单链的。单链化合物可以包括自互补性区域,其表示化合物可以形成所谓的“发夹”或“茎环”结构,具有双链结构的区域。
在某些实施方式中,抑制ActRII受体的核酸化合物可以包含与由不超过1000、不超过500、不超过250、不超过100或不超过50、35、30、25、22、20或18个全长ActRII受体核酸序列或活化素核酸序列(例如,活化素A或活化素B亚单位的核酸序列,还称为βA或βB)的核苷酸组成的区域互补的核苷酸序列。在具体的实施方式中,具有互补性的区域将为至少8个核苷酸,并且任选地至少10或至少15个核苷酸,并且任选地在15至25个核苷酸之间。具有互补性的区域可以位于内含子、编码序列或目标转录本的非编码序列,如编码序列部分内。通常,抑制ActRII受体的核酸化合物将具有约8至约500个核苷酸或碱基对长度,并且任选地所述长度将为约14至约50个核苷酸。抑制ActRII受体的核酸化合物可以是DNA(具体地,作为反义DNA使用)、RNA或RNA:DNA杂交物。任何一条链均可以包含DNA和RNA的混合物,和不能容易地分为DNA或RNA的修饰形式。同样地,双链核酸化合物可以是DNA:DNA、DNA:RNA或RNA:RNA,并且任一条链还可以包含DNA和RNA的混合物,和不能容易地分为DNA或RNA的修饰形式。
抑制ActRII受体的核酸化合物可以包含任何多种修饰,其包括对主链(天然核酸中糖-磷酸酯部分,包括核苷酸间键)或者碱基部分(天然核酸的嘌呤或嘧啶部分)的一种修饰。在某些实施方式中,反义核酸化合物将具有约15至约30个核苷酸的长度,并且通常将含有一个或多个修饰以改善某些特性,如血清中的稳定性、细胞中的稳定性或在化合物可能递送的位置处的稳定性,如,例如,对口服递送的化合物来说的胃和对吸入化合物来说的肺。就RNAi构件来说,与目标转录本互补的链通常将是RNA或其修饰。另一条链可以是RNA、DNA或任何其他变化。在某些实施方式中,只要用作Dicer底物,则双链或单链“发夹”RNAi构件的双螺旋部分可以具有18至40个核苷酸的长度并且任选地约21至23个核苷酸的长度。催化或酶促核酸可以是核糖酶或DNA酶并且还可以含有修饰形式。在某些实施方式中,在无义或有义控制几乎没有作用的生理条件和浓度下,抑制ActRII受体的核酸化合物可以将它们目标的表达抑制约50%、60%、70%、75%、80%、85%、90%、95%、99%或更多。测试核酸化合物作用的浓度包括1、5、10微摩尔或以上。
在其他实施方式中,在本文所述的组合物和方法中使用的ActRII受体的抑制剂是抗体。这些抗体包括结合至活化素(具体地,活化素A或B亚单位,也称为βA或βB)并破坏ActRII受体结合的抗体;结合至ActRII受体多肽(例如,可溶性ActRIIA或可溶性ActRIIB多肽)并破坏活化素结合的抗体。
通过使用衍生自ActRII受体多肽或活化素多肽的免疫原,可以通过标准规程制备抗蛋白质/抗肽抗血清或单克隆抗体(参见,例如,Antibodies:A Laboratory Manual,Harlow and Lane主编(Cold Spring Harbor Press:1988))。可以用ActRII受体多肽的免疫原性形式、能够引起抗体应答的抗原片段或融合蛋白使哺乳动物,如小鼠、仓鼠或兔免疫。赋予蛋白质或肽免疫原性的技术包括与载体结合或本领域中熟知的其他技术。可以在存在佐剂的情况下施用ActRII受体或活化素多肽的免疫原性部分。可以通过检测血浆或血清中抗体滴度来监测免疫进展。可以将免疫原作为抗原,使用标准ELISA或其他免疫测定来评价抗体水平。
用ActRII受体多肽的抗原制剂使动物免疫后,可以获得抗血清,并且如果需要,可以从血清分离多克隆抗体。为了产生单克隆抗体,可以从免疫动物收获抗体产生细胞(淋巴细胞)并通过标准体细胞融合程序与无限增殖化细胞,如骨髓瘤细胞融合以获得杂交瘤细胞。这些技术在本领域中是熟知的,并且包括(例如)杂交瘤技术(最初由Kohler andMilstein,(1975)Nature,256:495-497发展)、人B细胞杂交瘤技术(Kozbar等人,(1983)Immunology Today,4:72),和EBV-杂交瘤技术以产生人单克隆抗体(Cole等人,(1985)Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,Inc.第77-96页)。可以通过免疫化学筛选用于与ActRII受体多肽具有特异反应性的抗体的产生的杂交瘤细胞,并从包含这些杂交瘤细胞的培养中分离单克隆抗体。
如本文所使用的,术语“抗体”旨在包括与受试者多肽也具有特异反应性的它的片段。可以使用常规方法使抗体断裂,并且以如上对完整抗体所述的相同方式筛选片段的应用。例如,可以通过用胃蛋白酶处理抗体来产生F(ab)2片段。可以处理所得F(ab)2片段以减少二硫键,从而产生Fab片段。抗体还旨在包括通过抗体的至少一个CDR区域所赋予的对ActRII受体或活化素多肽具有亲合力的双重特异性、单链、嵌合、人源化和完全人分子。抗体还可以包含与之连接并且能够被检测的标记物(例如,所述标记物可以是放射性同位素、荧光化合物、酶或酶辅因子)。
在某些实施方式中,所述抗体为重组抗体,该术语涵盖了部分通过分子生物学技术产生的任何抗体,其包括CDR-接枝或嵌合抗体、从文库选择的抗体域组装的人或其他抗体、单链抗体和单域抗体(例如,人VH蛋白或骆驼VHH蛋白)。在某些实施方式中,抗体可以是单克隆抗体,并且在某些实施方式中。例如,产生与ActRII受体多肽或活化素多肽特异性结合的单克隆抗体的方法可以包括向小鼠施用对刺激可检测的免疫应答有效的量的包含抗原多肽的免疫原性组合物,从小鼠获得抗体产生细胞(例如,来自脾的细胞)并将抗体产生细胞与骨髓瘤细胞融合以获得抗体产生杂交瘤,并测试抗体产生杂交瘤以鉴别出产生特异性结合至抗原的单克隆抗体的杂交瘤。一旦获得,杂交瘤可以在细胞培养中增殖,任选地在其中杂交瘤来源的细胞产生特异性结合至抗原的单克隆抗体的培养条件下培养。可以从细胞培养物中纯化单克隆抗体。
如在提及抗体时所使用的,形容词“与……特异性反应的”旨在表示如本领域中通常理解的,抗体在所关心的抗原(例如,ActRII受体多肽)和不关心的其他抗原之间具有足够的选择性,从而对于以最小值检测生物样品的特定类型中所关心的抗原的存在是有用的。在使用所述抗体的某些方法中,如在治疗应用中,更高的结合特异性程度可以是所期望的。单克隆抗体通常在有效区分所需抗原和交叉反应多肽中具有更大的趋势(与多克隆抗体相比)。影响抗体:抗原相互作用的特异性的一个特征是抗体对抗原的亲合力。尽管可以在不同亲合力范围内达到所需的特异性,但是通常优选的抗体将具有约10-6、10-7、10-8、10-9或更小的亲合力(解离常数)。考虑到活化素和ActRII受体之间非常紧密的结合,预期中和抗活化素或抗ActRII受体抗体通常将具有10-10或更小的解离常数。
另外,为了鉴别所期望的抗体,用于筛选抗体的技术可以影响所得抗体的性质。例如,如果抗体将用于结合溶液中的抗原,则测试溶液的结合可能是所期望的。对于测试抗体和抗原之间相互作用以鉴别特别期望的抗体来说,多种不同的技术是可用的。这些技术包括ELISA、表面等离子共振结合测定(例如,Biacore.TM.结合测定,Biacore AB,Uppsala,Sweden)、夹心测定(例如,IGEN International,Inc.,Gaithersburg,Md.的顺磁珠系统)、免疫印迹、免疫沉淀测定和免疫组织化学。
在某些实施方式中,在本文所述的组合物和方法中使用的ActRII受体抑制剂包括活化素的替代形式,具体地,在I型受体结合域中具有变化的那些可以结合至II型受体并且不能形成活性三元络合物。在某些实施方式中,在本文所述的组合物和方法中可以使用抑制活化素A、B、C或E,或者具体地,ActRII受体表达的核酸,如反义分子、siRNA或核糖酶。在某些实施方式中,相对于TGF-β家族的其他成员,具体地相对于GDF8和活化素,在本文所述的组合物和方法中使用的ActRII受体抑制剂对抑制GDF11介导的信号转导显示出选择性。
在其他实施方式中,在本文所述的组合物和方法中使用的ActRII受体的抑制剂为具有ActRII受体拮抗剂活性的非抗体蛋白,其包括抑制素(即抑制素α亚单位)、卵泡抑素(例如,卵泡抑素-288和卵泡抑素-315)、Cerberus、卵泡抑素相关蛋白(“FSRP”)、内皮素(endoglin)、活化素C、α(2)-巨球蛋白和M108A(位置108处蛋氨酸变化为丙氨酸)突变体活化素A。
在具体的实施方式中,在本文所述的组合物和方法中使用的ActRII受体抑制剂是拮抗活化素生物活性和/或结合至活化素的卵泡抑素多肽。术语“卵泡抑素多肽”包括包含卵泡抑素的任何天然存在的多肽以及保留有用活性的其任何变体(包括突变体、片段、融合物和拟肽形式)的多肽,并且还包括卵泡抑素的任何功能性单体或多聚体。可以基于涉及卵泡抑素和活化素相互作用的上述研究鉴别保留活化素结合性质的卵泡抑素多肽的变体。例如,WO2008/030367公开了显示对活化素结合重要的特定卵泡抑素域(“FSD”),该专利以其全部内容作为参考并入本文。卵泡抑素多肽包括衍生自任何已知卵泡抑素序列的多肽,所述多肽具有与卵泡抑素多肽序列具有至少约80%的同一性,并且任选地至少85%、90%、95%、96%、97%、98%、99%或更大的同一性的序列。卵泡抑素多肽的实例包括成熟卵泡抑素多肽或短的同工型或人卵泡抑素前体多肽的其他变体,如(例如)WO2005/025601中所述,该专利以其全部内容作为参考并入本文。
在具体的实施方式中,在本文所述的组合物和方法中使用的ActRII受体抑制剂是拮抗活化素生物活性和/或结合至活化素的卵泡抑素样相关基因(FLRG)。术语“FLRG多肽”包括包含FLRG的任何天然存在的多肽以及保留有用活性的其任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。可以使用测定FLRG和活化素相互作用的常规方法鉴别保留活化素结合性质的FLRG多肽的变体。参见,例如,美国专利No.6537966,该专利以其全部内容作为参考包括本文。FLRG多肽包括衍生自任何已知FLRG序列的多肽,所述多肽具有与FLRG多肽序列具有至少约80%的同一性,并且任选地至少85%、90%、95%、96%、97%、98%、99%或更大的同一性的序列。
在某些实施方式中,卵泡抑素多肽和FLRG多肽的功能性变体或修饰形式包括具有至少一部分卵泡抑素多肽或FLRG多肽和一个或多个融合结构域(如,例如,有利于所述多肽的分离、检测、稳定或多聚化的域)的融合蛋白。参考ActRIIA和ActRIIB多肽,在上文中详细讨论了适合的融合结构域。在一种实施方式中,ActRII受体抑制剂是融合蛋白,其包含融合至Fc结构域的卵泡抑素多肽的活化素结合部分。在另一种实施方式中,ActRII受体抑制剂是融合蛋白,其包含融合至Fc结构域的FLRG多肽的活化素结合部分。
5.6测定
可以测试多种ActRII多肽变体或可溶性ActRII多肽变体抑制ActRII的能力。另外,可以测试化合物抑制ActRII的能力。一旦确认ActRII活性的抑制剂,可以与本文所提供的方法一起使用这些化合物。ActRII可以是ActRIIa或ActRIIb。以下测定是对ActRIIa描述的,但是可以类似地用于ActRIIb。
5.6.1红细胞水平
RBC计数是单位体积血液中真实红细胞数目的计数,并且它可以作为标准全部血球数的一部分被包含在内。通常,男性的RBC计数在每微升4.7至6.1百万个细胞之间,女性的RBC计数在每微升4.2至5.4百万个细胞之间。然而,地中海贫血患者可以具有低于常见的计数的RBC计数。因此,根据本文所提供的方法治疗的贫血症(例如,地中海贫血)患者中RBC计数的确定使得能够确定该治疗的效力。
5.6.2幼红细胞集落形成单位(CFU-E)
可以(例如)在集落形成测定中,通过细胞数目和形态并且通过某些细胞表面标志物是否存在来测定和鉴别CFU-e。可以使用(例如)抗体染色,然后通过流式细胞术分析(FACs)评价标志物的表达来测量幼红细胞集落形成单位的水平,所述标志物如分化状态标志物,例如,Epo受体、c-Kit(干细胞因子受体)、转移受体(CD71+)、CD36和Ter119(血型糖蛋白-A相关抗原)(CFU-e细胞是Ter119(血型糖蛋白-A相关抗原)-阴性的)(参见,例如,Terszowsky等人,2005)。CFU-e阶段的细胞表达促红细胞生成素受体(EpoR)并且可以在培养基中仅存在促红细胞生成素的情况下,在2-3天内,诱导进行体外末期分化。可以将CFU-e细胞在甲基纤维素上铺板,并用二氨基联苯胺试剂对血红蛋白染色,然后可以对CFU-e集落计数。在从铺板开始的第2天,每个CFU-e集落可以获得8至64个血红蛋白化细胞(hemoglobinized cell),它们中的大部分处于红细胞分化的末期。
集落形成单位测定在本领域中是已知(例如,MesenCultTM medium,Stem CellTechnologies Inc.,Vancouver British Columbia;还参见Wu等人(Wu H,Liu X,JaenischR,Lodish HF(1995)."Generation of committed erythroid BFU-E and CFU-Eprogenitors does not require erythropoietin or the erythropoietin receptor".Cell 83(1):59–67;Marley SB,Lewis JL,Goldman JM,Gordon MY(1996))。
5.6.3幼红细胞爆式集落形成单位(BFU-E)
与CFU-e类似,可以(例如)在集落形成测定中,通过细胞数目和形态并且通过某些细胞表面标志物是否存在来测定和鉴别BFU-e。具体地,可以通过几种细胞表面标志物(如CD33、CD34和HLA-DR)的表达和血型糖蛋白-A的缺少表达来鉴别BFU-e。例如,可以使用Wu等人中描述的BFU-e测定(Wu H,Liu X,Jaenisch R,Lodish HF(1995)."Generation ofcommitted erythroid BFU-E and CFU-E progenitors does not requireerythropoietin or the erythropoietin receptor".Cell 83(1):59–67)。
5.6.4血细胞比容
血细胞比容测量给定体积的全血中红细胞的百分比,并且它可以作为标准全部血球数的一部分包括在内。对于男性,血细胞比容通常为约45%,对于女性为约40%。然而,地中海贫血患者通常具有低于常见的血细胞比容。因此,根据本文所提供的方法治疗的地中海贫血患者中血细胞比容的确定使得能够确定该治疗的效力。
5.6.5尿N-端肽(uNTX)
可以使用(例如)自动免疫测定测量1型胶原蛋白的尿N-端肽(NTx)(Vitros ECi;Ortho Clinical.,Rochester,NT,USA)。
5.6.6血清骨特异性碱性磷酸酶(BSAP)
可以使用(例如)酶免疫测定测量血清骨特异性碱性磷酸酶(BSAP)水平。
5.6.7红系祖细胞的细胞凋亡
可以(例如)通过使用脱氧核糖核苷酸末端转移酶介导的dUTP缺口末端标记(TUNEL)染色来确定红系祖细胞的细胞凋亡。可以使用原位细胞凋亡检测试剂盒(TakaraBio,Otsu,Japan)进行TUNEL染色。
5.6.8红细胞共培养系统
为了测试与体内环境更类似的体外环境中试剂对红细胞分化的影响,可以使用骨髓细胞和人CD36+细胞的共培养系统。在添加促红细胞生成素-(EPO)的培养基(2U/mL)中,将高度富含红系祖细胞的人CD36+细胞于与长期骨髓培养一起共培养。6天后,可以通过(例如)流式细胞术(例如,FACS)分析评价培养的细胞输出(例如,细胞类型)。不同红细胞分化水平的红细胞样细胞的数目(例如,原成红细胞、嗜碱细胞、晚期嗜碱性/多染性成红细胞、正染性成红细胞/网织红细胞、糖蛋白A+细胞)表明测试试剂调节红细胞分化的能力。
5.6.9转录反应测定
在某些实施方式中,转录反应测定可以用于测试活化素II型受体抑制剂或GDF11活性。一旦ActRII和GDF11信号转导,则上调或下调某些基因的转录。可以测量所使用的细胞培养系统和转录反应(例如,通过RT-PCR)。试剂对转录反应的影响是其有效性或活性的量度。在某些实施方式中,可以在报告基因上游克隆已知对ActRII或GDF11信号转导起反应的启动子区域。以这种方法,可以简化测定,从而仅需要测定报告基因的活性。
5.7活化素II型受体抑制剂的剂量
在某些实施方式中,ActRII抑制剂是如5.5.1节中所述的ActRIIa的抑制剂。在其他实施方式中,ActRII抑制剂是如5.5.2节中所述的ActRIIb的抑制剂。在某些实施方式中,ActRII抑制剂是ActRIIa抑制剂和ActRIIb抑制剂的组合。
在某些实施方式中,治疗有效量的ActRII抑制剂足以改善贫血症的一个症状。在某些实施方式中,治疗有效量的ActRII抑制剂足以防止贫血症的至少一个症状恶化。在某些实施方式中,治疗有效量的ActRII抑制剂提高患者中红细胞水平、血红蛋白水平、血细胞比容水平和/或Ery-C。
在某些实施方式中,以足以实现0.2μg/kg或更大的血清浓度的时间间隔和量剂量施用ActRII抑制剂,并且1μg/kg或2μg/kg或更大的血清水平对于对骨密度和强度实现显著作用来说是所期望的。可以设计剂量施用方案以使血清浓度达到0.2至15μg/kg之间,并且任选地1至5μg/kg之间。在人中,可以通过0.1mg/kg或更大的单一剂量实现0.2μg/kg的血清水平,并且可以通过0.3mg/kg或更大的单一剂量实现1μg/kg的血清水平。所观察的分子血清半衰期在约20至30天之间,比大部份Fc融合蛋白明显更长,并因此可以(例如)通过每周或每两周剂量施用0.2-0.4mg/kg来实现持续有效的血清水平,或者可以使用更高的剂量,同时剂量施用之间的间隔更长。例如,以每月或每两个月施用为基础,可以使用1-3mg/kg的剂量,并且对骨的影响可以是足够持久的,从而剂量施用仅需每3、4、5、6、9、12或更多个月一次。可以通过技术人员已知的任何方式测量ActRII抑制剂的血清水平。例如,使用(例如)ELISA,抗ActRII抑制剂的抗体可以用于确定ActRII抑制剂的血清水平。
在某些实施方式中,ActRII抑制剂的剂量在0.01至3.0mg/kg的范围内(静脉内)或者0.03至0.1mg/kg的范围内(皮下)。在某些实施方式中,ActRII抑制剂的剂量为约0.01mg/kg、约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.4mg/kg、约0.5mg/kg、约1.0mg/kg、约1.5mg/kg、约2.0mg/kg、约2.5mg/kg、约3.0mg/kg、约3.5mg/kg、约4.0mg/kg、约4.5mg/kg或约5.0mg/kg。在某些实施方式中,ActRII抑制剂的剂量为约10.0mg/kg、约15.0mg/kg、约20.0mg/kg、约25.0mg/kg或约30.0mg/kg。在某些实施方式中,ActRII抑制剂的剂量为0.01mg/kg至0.1mg/kg、0.1mg/kg至0.3mg/kg、0.3mg/kg至0.5mg/kg、0.5mg/kg至1.0mg/kg、1.0mg/kg至2.0mg/kg、1.0mg/kg至3.0mg/kg、2.0mg/kg至3.0mg/kg、2.0mg/kg至4.0mg/kg、3.0mg/kg至5.0mg/kg、5.0mg/kg至10.0mg/kg、10.0mg/kg至15.0mg/kg、10.0mg/kg至20.0mg/kg、15.0mg/kg至20.0mg/kg或20.0mg/kg至30.0mg/kg。当与本文所提供的剂量(例如,ActRII抑制剂的剂量或第二活性剂的剂量)结合使用时,单词“约”是指所提及数字的1、5或10%内的任何数字。
5.8药物组合物
在某些实施方式中,将活化素-ActRII拮抗剂(例如,ActRII多肽)与可药用载体一起配制以用于和本文所述的方法一起使用。例如,可以单独施用或作为药物制剂(治疗组合物)的组分施用ActRII多肽。可以配制受试者化合物以用于以在人或兽医学中使用的任何适合的方式施用。ActRII可以是ActRIIa或ActRIIb。
在某些实施方式中,本文所提供的治疗方法包括全身或作为植入物或装置局部施用所述组合物(包含ActRII抑制剂)。施用时,用于本文所提供的用途的治疗组合物处于无热原、生理学可用的形式。可以与受试化合物(例如,ActRII多肽,如ActRIIA和/或ActRIIB多肽(参见5.2节))同时或顺序施用还可以任选地包含在如上所述的组合物中的除ActRII拮抗剂外的治疗有用的试剂。
通常,将肠胃外施用ActRII拮抗剂。适合于肠胃外施用的药物组合物可以包含一种或多种ActRII多肽,并结合一种或多种药物可用的无菌等渗水溶液或非水溶液、分散体系、混悬液或乳液、或可以在使用前复原至无菌注射溶液或分散体系中的无菌粉剂结,其可以含有抗氧化剂、缓冲剂、抑菌剂、赋予制剂与预期受试者血液具有等渗性的溶质,或者悬浮剂或增稠剂。可以在本文所述的方法中使用的药物组合物中使用的适合的水性和非水性载体的实例包括水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等)及其适合的混合物、植物油,如橄榄油和可注射的有机酯,如油酸乙酯。可以(例如)通过使用涂层材料(如卵磷脂)、在分散体系的情况下通过保持所需粒度以及通过使用表面活性剂来保持合适的流动性。
此外,组合物可以以递送至靶标组织位点(例如,骨)的形式包封或注射。在某些实施方式中,在本文所述的方法中使用的组合物可以包括能够将一种或多种治疗化合物(例如,ActRIIA多肽)递送至靶标组织位点(例如,骨)的基质,从而提供用于发展出组织并且最佳地能够再吸收到体内的结构。例如,所述基质可以提供ActRIIA多肽的缓释。这些基质可以由目前在其他植入医学应用中使用的材料形成。
基质材料的选择基于生物相容性、生物降解性、机械性能、美容外形和界面性质。受试组合物的具体应用将限定适合的制剂。所述组合物可能的基质可以是生物可降解的并且在化学性质上限定了硫酸钙、磷酸三钙、羟基磷灰石、聚乳酸和聚酐。其他潜在的材料是生物可降解的并且是在生物学上明确限定的,如骨或皮肤胶原蛋白。其他基质由纯蛋白或胞外基质成分组成。其他潜在的基质是不能生物降解的并且是在化学性质上限定的,如烧结的羟基磷灰石、生物玻璃、铝酸盐或其他陶瓷。基质可以由任何上述类型材料的组合组成,如聚乳酸和羟基磷灰石或胶原蛋白和磷酸三钙。在组合物中(如在钙-铝酸盐-磷酸盐中),生物陶瓷是可以改变的,并且加工以改变孔径、粒径、颗粒形状和生物降解能力。
在某些实施方式中,可以口服施用在本文所述的方法中使用的组合物(包含ActRII抑制剂),例如,以胶囊、扁囊剂、丸剂、片剂、糖锭(使用调味基料,通常为蔗糖和阿拉伯胶或黄芪胶)、粉剂、颗粒剂的形式,或者作为水性或非水性液体中的溶液或混悬液,或者作为水包油或油包水液体乳液,或者作为酏剂或糖浆,或者作为锭剂(使用惰性基料,如明胶和甘油,或蔗糖和阿拉伯胶)和/或作为漱口剂等,其分别含有作为活性成分的预定量的试剂。还可以作为丸剂、药糖剂或糊剂施用试剂。
在用于口服的固体剂型(胶囊、片剂、丸剂、糖锭、粉剂、颗粒剂等)中,可以将本文所述的一个或多个治疗化合物与一种或多种药物可用的载体混合,如柠檬酸钠或磷酸二钙,和/或下列中的任一种:(1)填充剂或补充剂,如淀粉、乳糖、蔗糖、葡萄糖、甘露糖醇和/或硅酸;(2)粘结剂,如,例如,羧甲基纤维素、海藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和/或阿拉伯胶;(3)润湿剂,如甘油;(4)崩解剂,如琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、某些硅酸盐和碳酸钠;(5)溶液阻滞剂,如石蜡;(6)吸收加速剂,如季铵化合物;(7)润湿剂,如,例如,鲸蜡醇和单硬脂酸甘油酯;(8)吸收剂,如白陶土和班脱土;(9)润滑剂,如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠及其混合物;和(10)着色剂。就胶囊、片剂和丸剂来说,药物组合物还可以包含缓冲剂。使用如乳糖(lactose)或乳糖(milk sugars)的这类赋形剂以及高分子量的聚乙二醇,还可以将类似类型的固体组合物用作软填充和硬填充胶囊中的填充剂。
用于口服施用的液体剂型包括药物可用的乳液、微乳剂、溶液、混悬液、糖浆和酏剂。除所述活性成分之外,液体剂型可以含有在本领域中常用的惰性稀释剂,如水或其他溶剂、增溶剂和乳化剂,如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇,油剂(具体地,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢呋喃基醇、聚乙二醇和脱水山梨醇的脂肪酸酯及其混合物。除惰性稀释剂之外,口服组合物还可以包含佐剂,如润湿剂、乳化剂和助悬剂、甜味剂、调味剂、着色剂、香味剂和防腐剂。
除所述活性化合物之外,混悬液可以含有助悬剂,如乙氧基化的异硬脂基醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄芪胶及其混合物。
本文所述的组合物还可以含有佐剂,如防腐剂、润湿剂、乳化剂和分散剂。可以通过包含多种抗菌剂和抗真菌剂来确保防止微生物的作用,例如,对羟苯甲酸、氯代丁醇、苯酚山梨酸等。还可以期望在所述组合物中包含等张剂,如糖、氯化钠等。另外,可以通过包含延缓吸收的试剂,如单硬脂酸铝和明胶来达到可注射药物形式的延长吸收。
应理解将通过主治医师考虑将改变本文所述的化合物(例如,ActRII多肽,如ActRIIA和/或ActRIIB多肽(参见5.2节))的作用的多种因素来确定剂量方案。所述多种因素包括(但不限于)期望形成的骨重量的量、骨密度下降程度、骨损伤位点、损伤骨的状况、患者年龄、性别和饮食、可能有助于骨质流失的任何疾病的严重程度、施用时间及其他临床因素。任选地,所述剂量可以根据复原中使用的基质类型和组合物中使用的化合物类型而改变。向最终组合物中加入其他已知的生长因子也可能影响剂量。通过定期评价骨生长和/或修复来监测进展,例如,X射线(包括DEXA)、组织形态测定和四环素标记。
在某些实施方式中,本文提供了体内产生ActRII多肽的基因疗法。该疗法将通过将ActRII多核苷酸序列引入对患有上述病症的细胞或组织中来实现其治疗效果。可以使用重组表达载体,如嵌合病毒或胶体分散系统来实现ActRII多核苷酸序列的递送。对于ActRII多核苷酸序列的治疗递送,靶标脂质体的使用是优选的。ActRII多肽可以是ActRIIA和/或ActRIIB多肽(参见5.2节))。
如本文所教导的,可以用于基因疗法的多种病毒载体包括腺病毒、疱疹病毒、牛痘病毒,或优选地,RNA病毒,如反转录病毒。优选地,反转录病毒载体是鼠科或鸟类反转录病毒的衍生物。其中可以插入单一外源基因的反转录病毒载体的实例包括(但不限于):莫洛尼小鼠白血病病毒(MoMuLV)、Harvey鼠科肉瘤病毒(HaMuSV)、鼠类乳腺肿瘤病毒(MuMTV)和劳氏肉瘤病毒(RSV)。一些其他反转录病毒载体可以引入多个基因。所有这些载体可以转移或引入可选择标志物的基因,从而可以鉴别并产生转导的细胞。可以通过连接(例如)糖、糖脂或蛋白质将反转录病毒载体制备为靶标特异的。通过使用抗体实现优选的靶向。本领域技术人员将认识到可以将特定多核苷酸序列插入到反转录病毒基因组中或连接到病毒包膜上以使得含有ActRII多核苷酸的反转录病毒载体能够靶标特异性地递送。在优选的实施方式中,所述载体靶向骨或软骨。
可替代地,可以通过常规磷酸钙转染直接用编码反转录病毒结构基因gag、pol和env的质粒转染组织培养细胞。然后,用含有所关心基因的载体质粒转染这些细胞。所得细胞将反转录病毒载体释放到培养基中。
ActRII多核苷酸的另一个靶标递送系统是胶体分散系统。胶体分散系统包括大分子复合物、纳米胶囊、微球体、珠和脂质基系统,其包括水包油乳剂、胶束、混合胶束和脂质体。在本文所述方法中使用的优选的胶体系统是脂质体。脂质体是作为体外和体内递送载体有用的人工膜囊。可以将RNA、DNA和完整病毒颗粒包封在水性内部中,并以生物活性形式递送至细胞(参见,例如,Fraley等人,Trends Biochem.Sci.,6:77,1981)。使用脂质体载体有效基因转移的方法在本领域中是已知的,参见,例如,Mannino等人,Biotechniques,6:682,1988。脂质体组成通常是磷脂,通常与类固醇,特别是胆固醇结合的组合。还可以使用其他磷脂或其他脂质。脂质体的物理性质取决于pH、离子强度和二价阳离子的存在性。
在脂质体生产中有用的脂质的实例包括磷脂酰基化合物,如磷脂酰甘油、磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、鞘脂类、脑苷脂类和神经节糖苷。示例性磷脂包括卵磷脂酰胆碱、二棕榈酰磷脂酰胆碱和二硬脂酰磷脂酰胆碱。脂质体靶向还可能基于(例如)器官特异性、细胞特异性和细胞器特异性,并且这在本领域中是已知的。
在某些实施方式中,ActRII抑制剂在药物组合物中是基本纯的。具体地,所述药物组合物中至多20%、10%、5%、2.5%、1%、0.1%或至多0.05%的化合物是除了ActRII抑制剂和药物可用的载体外的化合物。
6.实施例
本文提供的实施例表明GDF11蛋白水平在地中海贫血中升高并且GDF11的抑制可以治疗β地中海贫血小鼠模型中的贫血症。因此,本文所提供的实施例表明GDF11可以用作地中海贫血的生物标志物,并且可以评价治疗贫血症(如地中海贫血)的方法。
6.1ACTRIIA诱导(DECOY)治疗β地中海贫血
β地中海贫血与无效性红细胞生成、红细胞加速分化和细胞凋亡有关,从而导致了贫血症和铁过量。无效性红细胞生成作用的潜在分子机制尚未完全理解。尽管TGF-β超家族的成员参与红系祖细胞的增殖和分化,但是在β地中海贫血中所见的无效性红细胞生成中多个TGF-β家族成员的作用仍是未知的。
为了评价β地中海贫血的无效性红细胞生成中TGF-β家族成员的作用,在人β地中海贫血的小鼠模型中使用了与一些TGF-β超家族配体结合的重组融合蛋白。ActRIIA-Fc融合蛋白(即,SEQ ID NO:7的鼠科对应物)由与人免疫球蛋白1(IgG1)的Fc结构域连接的活化素IIA受体(ActRIIA)的胞外域组成,并且所述蛋白用作TGF-β家族成员,如活化素A、活化素B、生长分化因子-11(GDF11)和骨形态生成蛋白-10(BMP-10)的配体捕获(ligand trap)。Hbbth1/th1是人β地中海贫血的小鼠模型,所述小鼠具有天然存在的β-主要基因缺失(Skow等人,1983)。Hbbth1/th1小鼠具有异常低的血红蛋白(Hgb)、血细胞比容(Hct)和平均细胞体积(MCV)以及骨髓(BM)细胞过多和异常高水平的胆红素(表示广泛的红细胞破坏的血红蛋白破环的副产物)。
6.2材料和方法
6.2.1小鼠
C57BL/6饲养并放置在不含病原体的INSERM U699研究室中。所有规程经过INSERM的动物保护委员会(Animal Care Committee)的批准。Hbbth1/th1模型来源于β-主要基因的天然存在的缺失(Skow LC等人;Cell1983)。Hbbth1/th1小鼠构成β-中间型地中海贫血模型。这些小鼠具有模拟人β-地中海贫血症的几种临床参数,如无效性骨髓红细胞生成、前体细胞凋亡、实质细胞铁分布(parenchymal iron distribution)、肝抗菌肽表达减少和较低的骨髓铁水平,同时肝和脾中的铁水平升高。
6.2.2全部血球数
在EDTA-涂覆的管中采集血液样品,并根据生产商的说明在MS9-5血液分析仪(Melet Schloesing Laboratories)上测量全部血球数。所选参数为红细胞(RBC)、血细胞比容(Ht)、平均红血球容积(MCV)、血红蛋白(Hb)。用retic-count试剂(BD BiosciencesRetic-CountTM试剂盒)确定网织红细胞数目。
6.2.3实时定量RT-PCR
使用RNeasy Plus Mini试剂盒(Qiagen)从红系祖细胞提取RNA。在42℃,在30分钟内,使用iScript reverse transcription Supermix(Bio-rad)将1微克总RNA用于反转录。然后,在85℃,将酶钝化5分钟。对于qPCR,在CFX96PCR系统(Bio-rad)中扩增cDNA样品。使用SsoFast EvaGreen Supermix(Bio-rad)定量PCR产物。
6.2.4体外成红细胞培养
将来自每种组织的细胞在不含血清的“红细胞扩增培养基”中再悬浮,所述培养基为StemPro34plus营养补充剂(Life Technologies Gibco-BRL),其添加了2U/mL的人重组Epo(Roche)、100ng/mL SCF(PeproTech)、10-6M地塞米松(D2915;Sigma)、40和青霉素/链霉素(Pen/Strep;Invitrogen)。培养5天后,在2至3天期间,将非贴壁细胞转移到添加或未添加10μg/ml mActRIIA-Fc的分化培养基(StemPro-34,其添加了1U/ml Epo和1mg/ml亚铁-转铁蛋白(Sigma))。通过台盼蓝(Gibco/BRL)拒染法每天确定活细胞和死细胞数目,并且每天通过部分培养基改变,将细胞浓度调节为总计2×106个细胞/mL。
6.2.5甲基纤维素测定
将成年小鼠BM或脾的单细胞混悬液与methocult M3434培养基(Stem CellTechnologies)混合,在35mm盘中铺板,并在37℃,在5%CO2的加湿气氛下培养。在第10天对BFU-E集落评分(在一些实验中,从第7天开始至第10天,对小鼠BFU-E评分,并且第7天和第10天的集落数目间无差异)。
6.2.6统计分析
使用GraphPad Prism(5.0版;GraphPad Software)进行统计分析。除非另外说明,否则数据表示为N个确定值的平均值±SEM。将学生氏t检验或曼-惠特尼检验用于比较两个组,而使用双向方差分析检验,然后进行post-hoc分析(Bonferroni检验)进行多组比较。P值小于0.05(*),小于0.01(**)或小于0.001(***)时,认为差异显著。
6.2.7通过流式细胞术的免疫荧光分析
对于来自小鼠的骨髓(BM)和脾细胞混悬液,使用抗FcgammaR mAb2.4G2进行IgG受体的阻断。然后,用抗-TER-119抗体和抗小鼠TfR1抗体对细胞(1×106)染色。使用FlowJo软件(Tree Star),通过流式细胞术(FACScalibur;Becton Dickinson)对染色细胞进行进一步分析。
6.2.8组织采集和组织学
采集骨髓和脾,并在10%福尔马林中固定,石蜡包埋,并且以3-6μm切片进行苏木精和伊红(H&E)染色。
6.2.9铁、铁蛋白、胆红素和转铁蛋白的定量分析。
将血液吸入到肝素化管中并离心(5min,4℃,1100g)。将血浆再次离心(5min,4℃,1100g)以除去污染的红细胞。根据生产商的说明,使用Olympus AU400automat定量生化参数。
6.3结果
6.3.1 mActRIIA-Fc改善地中海贫血症小鼠中的血液学参数
β地中海贫血是以导致红血球成熟和产生受损的血红蛋白合成中的缺陷为特征的疾病。认为红血球的减少主要是由于异常加速的红细胞分化和导致成熟红细胞产生整体减少的红细胞分化的晚期嗜碱性/多染性成红细胞阶段的细胞凋亡所引起的。该疾病的特征在于骨髓格室细胞过多,其中异常成红细胞积累并经历细胞凋亡,从而导致全身性贫血症。
为了检验β地中海贫血的疾病机制中TGF-β配体的作用,用mActRIIA-Fc(SEQIDNO:7的鼠科对应物)或PBS皮下处理Hbbth1/th1小鼠0、5、10、30或60天(10mg/kg体重),每周两次(对于每个独立实验,*p<0.05,N=3-5)。与PBS处理的动物相比,mActRIIA-Fc的处理显著提高了红细胞计数(图1A)和血细胞比容(图1B)和血红蛋白(图1C)水平,同时伴有网织红细胞计数减少(图1D)(处理后10天至60天)。循环红细胞(RBC)参数分析还显示在mActRIIA-Fc处理的所有小鼠中,平均红血球容积(MCV)(图1E)、红细胞平均血红蛋白(MCH)(图1F)和MCH浓度(MCHC)(图1G)均提高,表明mActRIIA-Fc改善了地中海贫血的小红细胞性贫血并且恢复了每个RBC的血红蛋白含量。另外,mActRIIA-Fc处理后,骨髓和脾的细胞性和晚期嗜碱性/多染性成红细胞显著降低。通过May-Grünwald(MGG)染色评价了红血球的形态分析,并且显示红细胞不均、红细胞异形和靶细胞减少(图1I)。为了确定mActRIIA-Fc对与β地中海贫血有关的贫血症的影响,对地中海贫血症小鼠评价了全身性铁水平(图1J)、转铁蛋白合成(图1K)、转铁蛋白饱和度(图1L)和铁蛋白水平(图1M)。通过转铁蛋白合成的诱导或全身性铁水平的降低,降低了转铁蛋白饱和度(图1L)。还评价了血小板、单核细胞、淋巴细胞和中性粒细胞水平(图1N)。
通过脾重量和测量总脾细胞数评价mActRIIA-Fc对地中海贫血症小鼠中脾肿大的影响。与PBS处理的地中海贫血症小鼠相比,mActRIIA-Fc处理的动物中脾细胞数和脾重量降低(图10)。类似地,在mActRIIA-Fc处理的小鼠中,骨髓成红细胞数目和扩增(如通过伊红/苏木精染色所确定的)(图1P)也降低。收获骨髓和脾,通过TER119染色,通过流式细胞术定量成红细胞。mActRIIA-Fc处理显著降低了地中海贫血症小鼠中红血球的数目(图1Q),表明其修正了小鼠中的无效性红细胞生成。
6.3.2 mActRIIA-Fc降低地中海贫血症小鼠中无效性红细胞生成。
为了进一步研究TGF-β超家族配体在β地中海贫血中的无效性红细胞生成中的作用,收获脾(图2A,图2C)和骨髓(图2B,图2C),并通过CD71/TER119染色,通过流式细胞术和通过前向散射/侧散射(FSC/SSC)分布评价成红细胞分化。红细胞生成分化中进展期的细胞(原成红细胞(Pro-E)、嗜碱性成红细胞(Ery-A)、晚期嗜碱性(Ery-B)和多染性成红细胞和嗜酸性成红细胞(Ery-C))百分比的时间过程分析显示mActRIIA-Fc处理的小鼠在脾中显示出显著降低的未成熟TER119/CD71细胞(晚期嗜碱性和多染性成红细胞,Ery-B),同时伴随嗜酸性成红细胞(Ery-C)百分比的增加(图2A)。这些结果与无效性红细胞生成的mActRIIA-Fc减小一致。尽管来自mActRIIA-Fc处理的小鼠骨髓中TER-199+成红细胞和Ery-B数目降低,但是成熟成红细胞的量未增加,表明地中海贫血症小鼠骨髓中无效性红细胞生成未被使用mActRIIA-Fc对小鼠的治疗所修正。
地中海贫血的慢性贫血症引起应激红细胞生成补偿反应。然而,由于无效性红细胞生成,这些反应是没有结果的。无效性红细胞生成的特征在于需要RBC的产生,由于成熟细胞的细胞凋亡所造成的过早细胞死亡,其不能通过未成熟的成红细胞的加速增殖和分化来补偿。因此,不平衡的未成熟/成熟成红细胞的比值是地中海贫血的无效性红细胞生成的特征。为了进一步研究mActRIIA-Fc对红细胞分化和无效性红细胞生成的影响,将来自mActRIIA-Fc处理小鼠以及它们各自对照的细胞悬液用抗TfR1和TER119抗体标记。通过在如前所述的TER119high gate中,通过流式细胞术分析红细胞先体细胞分化(Liu等人,Blood 2006)。因此,mActRIIA-Fc处理小鼠显示脾中未成熟/成熟成红细胞比值减小,表明了对无效性应激红细胞生成的修正。在骨髓中,对照和mActRIIA-Fc处理小鼠之间未成熟/成熟成红细胞比值没有差别,这进一步表明地中海贫血症小鼠骨髓中无效性红细胞生成未被mActRIIA-Fc处理修正。这些结果表明ActRIIa配体有助于成红细胞分化,并且还有助于β-地中海贫血中无效性脾红细胞生成。
胆红素是血红蛋白降解产物,并且由溶血所引起的血浆胆红素的提高是β-地中海贫血18中无效性红细胞生成的特征。在时间-过程分析中,在mActRIIA-Fc处理5天的地中海贫血症小鼠中,总胆红素和直接胆红素的血清水平减低,这表明由无效性红细胞生成所引起的溶血受mActRIIA-Fc施用的影响(图2D)。根据胆红素的值,在处理60天后,与对照相比,mActRIIA-Fc处理的动物中,血清乳酸脱氢酶(LDH)的水平也降低(图2D),这进一步确认了mActRIIA-Fc处理小鼠中组织溶血减少。
晚期红细胞生成很大程度是定型的(committed)以产生氧载体血红蛋白(Hb),它是两个α-球蛋白和两个β-球蛋白亚单位组成的四聚体蛋白。β-地中海贫血是常见的遗传性血红蛋白病,其特征在于β-球蛋白基因产生受损或缺失,从而后续积累了不成对的α-亚单位。成熟红细胞样细胞中过量的未结合游离α-球蛋白沉淀并导致产生了活性氧(ROS)和细胞氧胁迫损害,从而引起红细胞前体的过早死亡。进一步研究了mActRIIA-Fc对球蛋白沉淀产生的影响。使用二氯双氢荧光素,通过流式细胞术评价原代原红细胞分化时ROS的产生(图2E)。用mActRIIA-Fc或PBS处理48小时的原代地中海贫血症原红细胞的血红蛋白溶解度分析(图2F)。
为了深入了解与mActRIIA-Fc处理有关的细胞机制,在存在或不存在mActRIIA-Fc的情况下培养脾来源的原红细胞并从Hbbth1/th1小鼠中回收。使用公认的体外原红细胞分化模型(在添加有小鼠干细胞因子、Epo和地塞米松的无血清干细胞扩增培养基中培养脾前体5天)。然后,在存在1U/ml Epo和1mg/ml Fe-Tf的情况下,将这些富含原红细胞的培养物分化3天。与体内观察类似,mActRIIA-Fc处理提高了地中海贫血症成红细胞中血红蛋白的总量。然而,当与对照处理的细胞相比时,那些细胞显示膜相关沉淀血红蛋白的量减少(图2F)。因此,在mActRIIA-Fc处理的细胞中,对那些细胞所检测的活性氧(ROS)的量减少(图2E)。因此,mActRIIA-Fc处理导致细胞毒性球蛋白沉淀及其相关ROS产生的减少,这有助于无效性红细胞生成。总的来说,这些数据表明靶标ActRIIa信号转导调节成红细胞分化并且通过促进成熟成红细胞形成和降低膜相关血红蛋白沉淀,mActRIIA-Fc对ActRIIa配体的捕获修正了无效性红细胞生成。
6.3.3 mActRIIA-Fc调节地中海贫血症小鼠中的细胞凋亡
通过使用流式细胞术分析红血球中促凋亡蛋白的表达研究了β地中海贫血相关无效性红细胞生成中TGF-β家族成员对凋亡过程的参与。尽管骨髓成红细胞中凋亡蛋白的表达无显著变化(图3A),但是脾成红细胞的分析显示Ery-B细胞群体中Fas-L增加(图3B)。对PBS和mActRIIA-Fc处理的小鼠脾细胞的多参数流式细胞术比较分析显示未成熟的晚期嗜碱性和多染性成红细胞(Ery-B)中Fas-L的表达提高,而嗜酸性成红细胞(Ery-C)中降低(图3B)。相反,BM成红细胞中Fas-L的表达不受调节(图3A)。总的来说,这些结果显示ActRIIa信号转导调节成熟成红细胞中Fas/Fas-L途径。总体而言,这些数据表明ActRIIa信号转导引起定型为无效性红细胞生成的成熟成红细胞的过早细胞死亡。意外地,Ery-A和Ery-C细胞亚型中Fas-L表达减少,这表明ActRIIa信号转导对成熟成红细胞的影响更显著(图3B)。在mActRIIA-Fc处理的动物中,tunel阳性细胞的数目也增加(图3C)。地中海贫血的无效性红细胞生成的特征在于成熟成红细胞的大量细胞凋亡。研究mActRIIA-Fc处理对细胞凋亡的影响表明用mActRIIA-Fc对小鼠进行处理显示与它们各自的对照相比,tunnel阳性细胞数目减少(图3C),这表明通过Smad-2,3活化的ActRIIa信号转导可以通过调节成熟成红细胞的细胞凋亡水平来控制无效性红细胞生成。
6.3.4活化素/GDF11配体在地中海贫血症小鼠的脾中过表达。
通过qPCR在野生型和地中海贫血症小鼠的脾中评价ActRII、活化素A、活化素B和GDF11的RNA(mRNA)表达水平。ActRII、活化素A、活化素B和GDF11的mRNA水平均提高,这表明在对无效性红细胞生成的改善中,mActRIIA-Fc可以通过其配体中的一个起作用(图4A)。得自mActRIIA-Fc处理的地中海贫血症小鼠的脾的蛋白质的免疫印迹分析显示与PBS处理的小鼠相比,GDF11蛋白水平显著降低(图4B),这进一步表明GDF11作为ActRIIA配体对无效性红细胞生成负责。进一步的免疫组织化学分析显示地中海贫血症小鼠的脾活组织检查中GDF11蛋白水平(和小得多的程度上,活化素A或活化素B)大大提高,而在mActRIIA-Fc处理的动物中停止(图3A)。通过免疫印迹法进一步确认了这些结果(图4B)。与脾切片相反,BM的ActRIIa配体分析显示地中海贫血症小鼠中GDF11无积累(图4B)。因此,地中海贫血症小鼠的脾切片中GDF11的过表达可以是与无效性红细胞生成有关的。
6.3.5 mActRIIA-Fc降低了原代地中海贫血症原红细胞中所观察到的提高的GDF11表达水平。
为了确定哪些TGF-β家族成员可能会参与mActRIIA-Fc对β地中海贫血的治疗,对活化素/GDF信号通路中的蛋白质进行免疫组织化学分析。用PBS或mActRIIA-Fc处理地中海贫血症小鼠30天,收获脾,固定并对活化素A、活化素B、GDF8、GDF11、ActRII和p-Smad2染色。免疫组织化学染色显示地中海贫血症小鼠中GDF11、ActRII和p-Smad2的水平升高。为了研究其他贫血症小鼠模型中活化素/GDF信号通路中蛋白质是否过表达,将地中海贫血症小鼠中的活化素A、活化素B和GDF11的表达与氧正常、缺氧和αRBC小鼠相比较(图5B)。用PBS或mActRIIA-Fc处理48小时,然后与抗活化素A、活化素B、GDF11前肽和GDF8/GDF11切割肽的特异性抗体培育的原代地中海贫血症原红细胞的FACS分析表明mActRIIA-Fc处理使GDF11表达正常化。GDF11染色的定量显示mActRIIA-Fc对小鼠的处理显著降低了GDF11水平(图5C)。通过小鼠脾的免疫组织化学分析确认了用mActRIIA-Fc处理的地中海贫血症小鼠的这种GDF11表达的降低(图5D)。*p<0.05,N=4。因此,mActRIIA-Fc降低地中海贫血症组织中GDF11过表达的事实是mActRIIA-Fc通过靶向GDF11修正无效性红细胞生成的其他证据。
6.3.6 GDF11的中和恢复了成红细胞分化。
为了确定GDF11表达提高是否导致无效性红细胞生成,在存在抗活化素A和B和GDF11的阻断抗体的情况下培养地中海贫血症原红细胞。抗GDF11抗体(但不是活化素A和B抗体)促进红细胞生成,进一步确认GDF11通过引起无效性红细胞生成来负调节红细胞生成,如通过CD71/TER119染色后的流式细胞术所定量的(图6A)。使用二氯双氢荧光素,通过流式细胞术评价原代原红细胞分化时ROS的产生(图6B)。*p<0.05,N=4。因此,在地中海贫血症成红细胞中,抗GDF11阻断抗体恢复细胞分化并减少血红蛋白聚集。
6.3.7 ActRIIA配体检测测定
开发了测定以检测、鉴别和定量血清中存在的ActRIIA配体,并且具体地,与无效性红细胞生成有关的疾病(例如,地中海贫血、脊髓发育不良综合征、慢性恶性贫血症和镰刀形红细胞贫血症)中它们的异常表达。所述测定包括基于ActRIIA-Fc涂层的夹心ELISA,和随后对血清中存在的ActRIIA配体进行检测。可以在实验中(用于(例如)动物)或在临床上(用于(例如)人患者)使用ActRIIA ELISA测定以鉴别、检测和/或定量血液血清中配体或受体水平,以帮助治疗决策和/或确定设计调节TGF-β配体或受体水平的治疗的有效性。
6.3.8地中海贫血患者血清中GDF11水平升高。
开发上述夹心ELISA测定来测量血清中GDF11的水平。ELISA板涂覆了5μg/mL的mActRIIA-Fc(图7A)。向板中加入重组GDF11的提高的剂量(0.1ng/μl、0.5ng/μl、2.5ng/μl)。用PBS 0.1%吐温清洗板,并使用抗GDF8/11抗体检测结合的蛋白质,然后使用偶联了辣根过氧化物酶的抗兔IgG进行检测。GDF11以剂量依赖性方式结合mActRIIA-Fc涂覆的板,表明测定可以有效地用于检测和定量GDF11水平(图7B)。使用mActRIIA-Fc的ELISA检测低至100pg/mL的重组GDF11。
使用mActRIIA-Fc,通过夹心ELISA,对来自患有地中海贫血的患者的血清测试GDF11表达。如图8所示,与健康对照中的水平相比,地中海贫血患者中GDF11水平提高3倍。
为了确定地中海贫血患者中其他ActRIIA配体水平是否也升高,还测量了那些患者血清中的活化素A和活化素B的表达水平。还开发了ELISA测定以检测活化素A和活化素B。用5μg/mL的ActRIIA-Fc涂覆ELISA板。向板中加入重组活化素A和活化素B的提高的剂量(0.1ng/ml、0.5ng/ml、2.5ng/ml)。用PBS 0.1%吐温清洗板,并用抗活化素A(图9A)和抗活化素B(图10A)抗体(R&D systems)检测结合的蛋白质,然后使用偶联了辣根过氧化物酶的抗兔IgG进行检测。活化素A(图9B)和活化素B(图10B)以剂量依赖性方式结合ActRIIA-Fc涂覆的板,表明该测定可以有效地用于检测和定量两种蛋白。像GDF11一样,也在低至100pg/mL的水平检测到了活化素A和活化素B。
将ActRIIA-Fc ELISA用于确定地中海贫血患者血清中活化素A和活化素B的表达水平。与GDF11相反,在地中海贫血症患者中,活化素A(图9C)和活化素B(图10C)的蛋白水平均不升高,表明在地中海贫血过程中仅涉及ActRIIA配体GDF11。
6.3.9 mActRIIA-Fc不改变野生型小鼠中的血液学参数。
用mActRIIA-Fc(10mg/kg BW,每周两次)或PBS处理野生型C57BL/6小鼠30天。作为mActRIIA-Fc对小鼠处理的结果,红细胞计数(图11A)、血细胞比容(图11B)、血红蛋白(图11C)的评价表明参数水平无变化。仅观察到网状细胞增多稍微降低(图11D)。mActRIIA-Fc也不改变红细胞(RBC)参数,如MCV(图11E)、MCH(图11F)和MCHC(图12G)。对于每个独立实验,*p<0.05,N=3-5。
还在野生型C57BL/6小鼠中评价了mActRIIA-Fc对脾和骨髓的影响。mActRIIA-Fc提高了野生型小鼠中的脾重量,但是对脾细胞数目没有显著影响。mActRIIA-Fc对骨髓细胞数目也无影响(图12)。
6.3.10 mActRIIA-Fc通过GDF11的抑制刺激红细胞生成分化
为了研究mActRIIA-Fc提高红细胞参数的细胞机制,进行了一系列体外实验,其中未发现支持如在集落形成测定中(图13A)和在液体培养的红细胞分化中(图13B和13C)所评价的mActRIIA-Fc对人CD34+细胞的直接影响的证据。由于临床和药理学发现均指明了mActRIIA-Fc在刺激RBC参数中清楚的作用,假定可以通过骨髓(BM)微环境中的辅助细胞(accessory cells)调节mActRIIA-Fc的影响。将高度富含红系祖细胞的人CD36+细胞与长期BM培养物一起共培养,然后在添加EPO(2U/mL)的培养基中培养6天后,评价它们的红细胞分化。第6天,培养物的输出主要表现为EryA(嗜碱性成红细胞),但是添加mActRIIA-Fc后(50μM),大量CD36+细胞成熟为EryB/C细胞(多染性/正染性成红细胞),表明通过BM辅助细胞产生的因子调节mActRIIA-Fc的红细胞生成作用,并且与EPO相反,mActRIIA-Fc可以在晚期或成红细胞成熟中发挥作用(图13D-13F)。为了鉴别可以调节mActRIIA-Fc的作用的细胞因子,用几种ActRIIA配体处理CD36+细胞。在分化过程中,GDF11处理显著降低了糖蛋白A阳性(GPA+)细胞的增殖,并且mActRIIA-Fc有效逆转了该作用,并且对未处理的细胞无影响(图13G和13H)。这些数据显示GDF11的抑制调节mActRIIA-Fc的红细胞生成刺激作用。
6.4结论
总的来说,数据表明活化素/BMP信号转导控制了成红细胞分化,并且靶向BMP II型/活化素II型受体可以减少无效性红细胞生成和改善β地中海贫血中的贫血症。具体地,数据显示GDF11参与β地中海贫血相关贫血症并且表明作为生物标志物,GDF11水平在患有贫血症的受试者中是重要的。
8.等同替代
尽管参考其具体实施方式详细描述了本发明,但是将理解功能等效的改变也在本发明的范围内。的确,根据以上说明和附图,除本文所示和所述那些外,本发明的多种改变对于那些本领域技术人员将是显而易见的。这些改变旨在处于所附权利要求的范围内。仅使用常规试验方法,本领域技术人员就将识别或能够确定本文所述的本发明的具体实施方式的多种等价形式。这些等价实施方式旨在涵盖在随后的权利要求中。
在本说明书中提及的所有专利公开、专利和专利申请以好像具体并且单独指明每个专利公开、专利或专利申请以其全部内容作为参考并入本文的相同程度,作为参考并入到本说明书中。
Claims (19)
1.活化素II型受体抑制剂在制备用于治疗受试者中β地中海贫血症的药物中的用途,其中,所述治疗包括:(a)施用所述药物,和(b)监测所述受试者组织样品中GDF11的水平和/或活性,所述活化素II型受体抑制剂为多肽,其中所述多肽的氨基酸序列是SEQ ID NO:7的氨基酸序列。
2.根据权利要求1所述的用途,其中,所述施用使得患者中晚期嗜碱性和多染性成红细胞的细胞计数减少。
3.活化素II型受体抑制剂在制备用于治疗受试者中β地中海贫血症的药物中的用途,其中,所述治疗包括:(a)评价所述受试者组织样品中GDF11的水平和/或活性,和(b)如果所述GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则向所述受试者施用所述药物,所述活化素II型受体抑制剂为多肽,其中所述多肽的氨基酸序列是SEQ ID NO:7的氨基酸序列。
4.根据权利要求3所述的用途,其中,所述施用使得患者中晚期嗜碱性和多染性成红细胞的细胞计数减少。
5.活化素II型受体抑制剂在制备用于治疗受试者中β地中海贫血症的药物中的用途,其中,所述治疗包括:(a)施用一定剂量的所述药物,(b)评价所述受试者组织样品中的GDF11的水平和/或活性,和(c)调整所述药物的剂量,其中如果所述GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则提高所述药物的剂量,并且其中,如果所述GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低,则减少所述药物的剂量,所述活化素II型受体抑制剂为多肽,其中所述多肽的氨基酸序列是SEQ ID NO:7的氨基酸序列。
6.根据权利要求5所述的用途,其中,所述施用使得患者中晚期嗜碱性和多染性成红细胞的细胞计数减少。
7.活化素II型受体抑制剂在制备用于提高对其有需要的受试者中红细胞水平或嗜酸性成红细胞(Ery-C)水平的药物中的用途,其中,所述用途包括:(a)评价所述受试者组织样品中GDF11的水平和/或活性,和(b)如果GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则向所述受试者施用所述药物,所述活化素II型受体抑制剂为多肽,其中所述多肽的氨基酸序列是SEQ ID NO:7的氨基酸序列。
8.根据权利要求7所述的用途,其中,所述施用使得患者中晚期嗜碱性和多染性成红细胞的细胞计数减少。
9.活化素II型受体抑制剂在制备用于提高对其有需要的受试者中红细胞水平或嗜酸性成红细胞(Ery-C)水平的药物中的用途,其中,用途包括:(a)施用一定剂量的所述药物,(b)评价所述受试者组织样品中GDF11的水平和/或活性,和(c)调整所述药物的剂量,其中如果所述GDF11的水平和/或活性相对于GDF11的正常水平和/或活性升高,则提高所述药物的剂量,并且其中,如果所述GDF11的水平和/或活性相对于GDF11的正常水平和/或活性降低,则减少所述药物的剂量,所述活化素II型受体抑制剂为多肽,其中所述多肽的氨基酸序列是SEQ ID NO:7的氨基酸序列。
10.根据权利要求9所述的用途,其中,所述施用使得患者中晚期嗜碱性和多染性成红细胞的细胞计数减少。
11.根据权利要求1-10中任一项所述的用途,其中,所述GDF11的水平和/或活性是GDF11的蛋白水平。
12.根据权利要求1-10中任一项所述的用途,其中,所述GDF11的水平和/或活性是GDF11的mRNA水平。
13.根据权利要求1-10中任一项所述的用途,其中,当相对于所述GDF11的正常水平和/或活性升高至少25%、至少50%、至少75%、至少100%或至少200%时,所述GDF11的水平和/或活性相对于所述GDF11的正常水平和/或活性升高。
14.根据权利要求1-10中任一项所述的用途,其中,当相对于所述GDF11的正常水平和/或活性升高至少2倍时,所述GDF11的水平和/或活性相对于所述GDF11的正常水平和/或活性升高。
15.根据权利要求5或9所述的用途,其中,当相对于所述GDF11的正常水平和/或活性降低至少25%、至少50%、至少75%或至少90%时,所述GDF11的水平和/或活性相对于所述GDF11的正常水平和/或活性降低。
16.根据权利要求5或9所述的用途,其中,当相对于所述GDF11的正常水平和/或活性降低至少2倍时,所述GDF11的水平和/或活性相对于所述GDF11的正常水平和/或活性降低。
17.根据权利要求1-10中任一项所述的用途,其中,所述GDF11的正常水平和/或活性是来自相同年龄组别的一位或多位健康受试者的相同组织的样品中GDF11的平均水平和/或活性。
18.根据权利要求1-10中任一项所述的用途,其中,所述组织是血清、骨髓、肝或脾。
19.根据权利要求1-10中任一项所述的用途,其中,所述受试者是人。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110622231.6A CN113604550A (zh) | 2012-10-24 | 2013-10-23 | 用于治疗贫血症的生物标志物 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261718126P | 2012-10-24 | 2012-10-24 | |
| US61/718,126 | 2012-10-24 | ||
| PCT/US2013/066350 WO2014066486A2 (en) | 2012-10-24 | 2013-10-23 | Biomarker for use in treating anemia |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110622231.6A Division CN113604550A (zh) | 2012-10-24 | 2013-10-23 | 用于治疗贫血症的生物标志物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN104968801A CN104968801A (zh) | 2015-10-07 |
| CN104968801B true CN104968801B (zh) | 2021-06-15 |
Family
ID=50545462
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201380067792.8A Active CN104968801B (zh) | 2012-10-24 | 2013-10-23 | 用于治疗贫血症的生物标志物 |
| CN202110622231.6A Pending CN113604550A (zh) | 2012-10-24 | 2013-10-23 | 用于治疗贫血症的生物标志物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110622231.6A Pending CN113604550A (zh) | 2012-10-24 | 2013-10-23 | 用于治疗贫血症的生物标志物 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US20150276766A1 (zh) |
| EP (2) | EP3608419A1 (zh) |
| JP (3) | JP6401171B2 (zh) |
| CN (2) | CN104968801B (zh) |
| AU (3) | AU2013334659B2 (zh) |
| CA (1) | CA2889209C (zh) |
| ES (1) | ES2753811T3 (zh) |
| HK (1) | HK1213948A1 (zh) |
| IL (3) | IL267663B (zh) |
| SA (1) | SA515360337B1 (zh) |
| WO (1) | WO2014066486A2 (zh) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8128933B2 (en) | 2005-11-23 | 2012-03-06 | Acceleron Pharma, Inc. | Method of promoting bone growth by an anti-activin B antibody |
| AU2006318449B2 (en) | 2005-11-23 | 2012-07-05 | Acceleron Pharma Inc. | Activin-actRIIa antagonists and uses for promoting bone growth |
| US8895016B2 (en) | 2006-12-18 | 2014-11-25 | Acceleron Pharma, Inc. | Antagonists of activin-actriia and uses for increasing red blood cell levels |
| CA2677007A1 (en) | 2007-02-01 | 2008-08-07 | Acceleron Pharma Inc. | Activin-actriia antagonists and uses for treating or preventing breast cancer |
| TWI782836B (zh) | 2007-02-02 | 2022-11-01 | 美商艾瑟勒朗法瑪公司 | 衍生自ActRIIB的變體與其用途 |
| TWI667038B (zh) | 2007-02-09 | 2019-08-01 | 美商艾瑟勒朗法瑪公司 | 包含ActRIIa-Fc融合蛋白的醫藥組合物;ActRIIa-Fc融合蛋白於治療或預防與癌症相關的骨質流失之用途;ActRIIa-Fc融合蛋白於治療或預防多發性骨髓瘤之用途 |
| US7960343B2 (en) | 2007-09-18 | 2011-06-14 | Acceleron Pharma Inc. | Activin-ActRIIa antagonists and uses for decreasing or inhibiting FSH secretion |
| SI3750552T1 (sl) | 2008-08-14 | 2023-10-30 | Acceleron Pharma Inc. | GDF pasti |
| US8216997B2 (en) | 2008-08-14 | 2012-07-10 | Acceleron Pharma, Inc. | Methods for increasing red blood cell levels and treating anemia using a combination of GDF traps and erythropoietin receptor activators |
| CN107267520A (zh) | 2009-06-12 | 2017-10-20 | 阿塞勒隆制药公司 | 截短的actriib‑fc融合蛋白 |
| US8710016B2 (en) | 2009-11-17 | 2014-04-29 | Acceleron Pharma, Inc. | ActRIIB proteins and variants and uses therefore relating to utrophin induction for muscular dystrophy therapy |
| CN103298832A (zh) | 2010-11-08 | 2013-09-11 | 阿塞勒隆制药公司 | Actriia结合剂及其用途 |
| CA2890217C (en) | 2012-11-02 | 2021-07-20 | Yifu FANG | Activin-actrii antagonists and uses for treating bone and other disorders |
| EP3131931B1 (en) * | 2014-04-18 | 2020-10-21 | Acceleron Pharma Inc. | Methods for increasing red blood cell levels and treating sickle-cell disease |
| WO2015192111A1 (en) | 2014-06-13 | 2015-12-17 | Acceleron Pharma, Inc. | Methods and compositions for treating ulcers |
| MA41052A (fr) * | 2014-10-09 | 2017-08-15 | Celgene Corp | Traitement d'une maladie cardiovasculaire à l'aide de pièges de ligands d'actrii |
| TWI695068B (zh) | 2014-11-24 | 2020-06-01 | 美商身體邏輯股份有限公司 | 用於結合生長分化因子11的核酸化合物 |
| BR112017011722A2 (pt) * | 2014-12-03 | 2018-02-27 | Acceleron Pharma Inc | antagonistas de activina-actrii e usos para o tratamento de anemia |
| PL3286206T3 (pl) | 2015-04-22 | 2021-09-13 | Biogen Ma Inc. | Nowe hybrydowe białka pułapki na ligand actriib do leczenia chorób powodujących zanik mięśni |
| EP3294320A4 (en) * | 2015-05-13 | 2018-12-26 | Celgene Corporation | Treatment of beta-thalassemia using actrii ligand traps |
| JP2018522579A (ja) * | 2015-05-20 | 2018-08-16 | セルジーン コーポレイション | アクチビンII型受容体リガンドトラップを使用するβ−サラセミアのインビトロ細胞培養法 |
| EP3370754A4 (en) | 2015-11-04 | 2019-10-23 | Acceleron Pharma Inc. | METHODS FOR INCREASING ERYTHROCYTE RATES AND TREATING INEFFECTIVE ERYTHROPOISIS |
| CN105738614B (zh) * | 2016-02-23 | 2017-12-05 | 山东大学 | 一种应用流式细胞仪分析评价小鼠骨髓红细胞生成功能的方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102655872A (zh) * | 2009-08-13 | 2012-09-05 | 阿塞勒隆制药公司 | Gdf捕获物和促红细胞生成素受体激活剂联合应用以增加红细胞水平 |
Family Cites Families (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS63502716A (ja) | 1986-03-07 | 1988-10-13 | マサチューセッツ・インステチュート・オブ・テクノロジー | 糖タンパク安定性の強化方法 |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| US5096815A (en) | 1989-01-06 | 1992-03-17 | Protein Engineering Corporation | Generation and selection of novel dna-binding proteins and polypeptides |
| US5198346A (en) | 1989-01-06 | 1993-03-30 | Protein Engineering Corp. | Generation and selection of novel DNA-binding proteins and polypeptides |
| WO1996001845A1 (en) * | 1994-07-08 | 1996-01-25 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-11 |
| US6891082B2 (en) * | 1997-08-01 | 2005-05-10 | The Johns Hopkins University School Of Medicine | Transgenic non-human animals expressing a truncated activintype II receptor |
| JP2001513982A (ja) | 1997-08-29 | 2001-09-11 | ヒューマン ジノーム サイエンシーズ, インコーポレイテッド | フォリスタチン−3 |
| CA2418835A1 (en) | 2000-10-16 | 2002-04-25 | Phylos, Inc. | Protein scaffolds for antibody mimics and other binding proteins |
| US20030133939A1 (en) | 2001-01-17 | 2003-07-17 | Genecraft, Inc. | Binding domain-immunoglobulin fusion proteins |
| US7754208B2 (en) | 2001-01-17 | 2010-07-13 | Trubion Pharmaceuticals, Inc. | Binding domain-immunoglobulin fusion proteins |
| TWI329129B (en) * | 2001-02-08 | 2010-08-21 | Wyeth Corp | Modified and stabilized gdf propeptides and uses thereof |
| AU2002256371B2 (en) | 2001-04-26 | 2008-01-10 | Amgen Mountain View Inc. | Combinatorial libraries of monomer domains |
| BR0307871A (pt) * | 2002-02-21 | 2005-04-12 | Wyeth Corp | Proteìnas contendo domìnio de folistatina |
| WO2005025601A1 (en) | 2003-09-15 | 2005-03-24 | Monash University | Follistatin isoforms and uses thereof |
| ES2426005T3 (es) | 2004-07-23 | 2013-10-18 | Acceleron Pharma Inc. | Polipéptidos del receptor ACTRII, procedimientos y composiciones |
| US20060234299A1 (en) | 2004-11-16 | 2006-10-19 | Avidia Research Institute | Protein scaffolds and uses thereof |
| US8067562B2 (en) * | 2005-11-01 | 2011-11-29 | Amgen Inc. | Isolated nucleic acid molecule comprising the amino acid sequence of SEQ ID NO:1 |
| WO2008030367A2 (en) | 2006-09-01 | 2008-03-13 | The General Hospital Corporation | Selective myostatin inhibitors |
| CN104524548A (zh) * | 2006-12-18 | 2015-04-22 | 阿塞勒隆制药公司 | 活化素-actrii拮抗剂及在提高红细胞水平中的用途 |
| TWI782836B (zh) | 2007-02-02 | 2022-11-01 | 美商艾瑟勒朗法瑪公司 | 衍生自ActRIIB的變體與其用途 |
| KR20220002710A (ko) * | 2008-06-26 | 2022-01-06 | 악셀레론 파마 인코포레이티드 | 액티빈-actriia 길항물질을 투약하는 방법 및 치료된 환자의 모니터링 |
| US8216997B2 (en) * | 2008-08-14 | 2012-07-10 | Acceleron Pharma, Inc. | Methods for increasing red blood cell levels and treating anemia using a combination of GDF traps and erythropoietin receptor activators |
| SI3750552T1 (sl) * | 2008-08-14 | 2023-10-30 | Acceleron Pharma Inc. | GDF pasti |
| EA027071B1 (ru) * | 2009-04-27 | 2017-06-30 | Новартис Аг | АНТИТЕЛО К ActRIIB И СОДЕРЖАЩАЯ ЕГО КОМПОЗИЦИЯ |
| CN103298832A (zh) * | 2010-11-08 | 2013-09-11 | 阿塞勒隆制药公司 | Actriia结合剂及其用途 |
-
2013
- 2013-10-23 IL IL267663A patent/IL267663B/en unknown
- 2013-10-23 EP EP19184182.4A patent/EP3608419A1/en active Pending
- 2013-10-23 AU AU2013334659A patent/AU2013334659B2/en active Active
- 2013-10-23 CN CN201380067792.8A patent/CN104968801B/zh active Active
- 2013-10-23 CN CN202110622231.6A patent/CN113604550A/zh active Pending
- 2013-10-23 ES ES13848471T patent/ES2753811T3/es active Active
- 2013-10-23 CA CA2889209A patent/CA2889209C/en active Active
- 2013-10-23 WO PCT/US2013/066350 patent/WO2014066486A2/en active Application Filing
- 2013-10-23 JP JP2015539750A patent/JP6401171B2/ja active Active
- 2013-10-23 EP EP13848471.2A patent/EP2912462B1/en active Active
- 2013-10-23 US US14/438,120 patent/US20150276766A1/en not_active Abandoned
-
2015
- 2015-04-21 IL IL238414A patent/IL238414B/en active IP Right Grant
- 2015-04-23 SA SA515360337A patent/SA515360337B1/ar unknown
-
2016
- 2016-02-22 HK HK16101948.3A patent/HK1213948A1/zh unknown
-
2018
- 2018-03-09 US US15/916,634 patent/US20190049469A1/en not_active Abandoned
- 2018-07-11 JP JP2018131226A patent/JP2018184428A/ja active Pending
-
2019
- 2019-06-12 AU AU2019204098A patent/AU2019204098B2/en active Active
-
2020
- 2020-06-24 JP JP2020108569A patent/JP7146850B2/ja active Active
-
2021
- 2021-09-21 AU AU2021236465A patent/AU2021236465A1/en active Pending
-
2022
- 2022-02-15 IL IL290653A patent/IL290653A/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102655872A (zh) * | 2009-08-13 | 2012-09-05 | 阿塞勒隆制药公司 | Gdf捕获物和促红细胞生成素受体激活剂联合应用以增加红细胞水平 |
Also Published As
| Publication number | Publication date |
|---|---|
| IL238414A0 (en) | 2015-06-30 |
| US20190049469A1 (en) | 2019-02-14 |
| CA2889209C (en) | 2023-08-22 |
| IL267663A (en) | 2019-08-29 |
| AU2013334659A1 (en) | 2015-05-14 |
| CN104968801A (zh) | 2015-10-07 |
| AU2021236465A1 (en) | 2021-10-21 |
| EP3608419A1 (en) | 2020-02-12 |
| IL290653A (en) | 2022-04-01 |
| HK1213948A1 (zh) | 2016-07-15 |
| EP2912462A4 (en) | 2016-06-15 |
| CA2889209A1 (en) | 2014-05-01 |
| JP7146850B2 (ja) | 2022-10-04 |
| AU2013334659B2 (en) | 2019-07-11 |
| JP6401171B2 (ja) | 2018-10-03 |
| EP2912462A2 (en) | 2015-09-02 |
| JP2018184428A (ja) | 2018-11-22 |
| EP2912462B1 (en) | 2019-08-07 |
| JP2020183389A (ja) | 2020-11-12 |
| ES2753811T3 (es) | 2020-04-14 |
| US20150276766A1 (en) | 2015-10-01 |
| CN113604550A (zh) | 2021-11-05 |
| JP2016500698A (ja) | 2016-01-14 |
| IL238414B (en) | 2019-07-31 |
| WO2014066486A2 (en) | 2014-05-01 |
| WO2014066486A3 (en) | 2015-07-16 |
| IL267663B (en) | 2022-09-01 |
| AU2019204098A1 (en) | 2019-07-04 |
| AU2019204098B2 (en) | 2021-07-22 |
| SA515360337B1 (ar) | 2019-09-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN104968801B (zh) | 用于治疗贫血症的生物标志物 | |
| US20210355191A1 (en) | Activin-actrii antagonists and uses for increasing red blood cell levels | |
| US20210355181A1 (en) | Antagonists of activin-actriia and uses for increasing red blood cell levels | |
| AU2016203098B2 (en) | Antagonists of activin-ActRIIa and uses for increasing red blood cell levels | |
| AU2020203198A1 (en) | Methods for treating anemia | |
| EP3415161A1 (en) | The use of an actriib antagonist for the treatment of anemia | |
| NZ743635B2 (en) | Biomarker for use in treating anemia | |
| NZ743635A (en) | Biomarker for use in treating anemia |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |