CN103314003A - 通过特异性内源miRNA 激活表达的组合物和方法 - Google Patents
通过特异性内源miRNA 激活表达的组合物和方法 Download PDFInfo
- Publication number
- CN103314003A CN103314003A CN2011800631535A CN201180063153A CN103314003A CN 103314003 A CN103314003 A CN 103314003A CN 2011800631535 A CN2011800631535 A CN 2011800631535A CN 201180063153 A CN201180063153 A CN 201180063153A CN 103314003 A CN103314003 A CN 103314003A
- Authority
- CN
- China
- Prior art keywords
- mir
- sequence
- exogenous
- composition
- rna molecule
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
- A61K48/0066—Manipulation of the nucleic acid to modify its expression pattern, e.g. enhance its duration of expression, achieved by the presence of particular introns in the delivered nucleic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/635—Externally inducible repressor mediated regulation of gene expression, e.g. tetR inducible by tetracyline
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
- C12N2310/141—MicroRNAs, miRNAs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
提供了用于仅在细胞中存在特异性内源miRNA时激活外源目的多核苷酸表达的组合物和方法。还提供了这些组合物通过例如,选择性地仅在靶细胞群中激活毒素表达在治疗和诊断多种病症和疾患中的用途。
Description
发明领域
本发明涉及用于仅在细胞内存在特异性内源miRNA时激活外源目的多核苷酸表达的组合物。如通过仅在靶细胞群中选择性激活毒素表达所例示的,本发明还涉及这些组合物在治疗和诊断各种病症和疾患中的用途。
发明背景
病毒是地球上最为丰富的生物实体类型且病毒呈现为人类癌症发展的第二重要的风险因素。WHO(世界卫生组织)国际癌症研究局估计,在2002年,~15%的人类癌症是由7种不同的病毒引起的。由于其基因组中的癌基因,病毒可能是致癌的。由于将基因截短或将基因置于强的病毒顺式作用调控元件的控制之下的位点处的整合,逆转录病毒也可能是致癌的。根据WHO,在2006年,全球存在约3950万患HIV的人。包括HIV的许多病毒表现出休眠期或潜伏期,在所述休眠期或潜伏期期间进行极少的蛋白质合成或不进行蛋白质合成。在这些阶段期间,病毒感染对于免疫系统基本上是不可见的。目前的抗病毒治疗方案在消除潜伏病毒的细胞贮量方面大部分是无效的[1]。
根据美国癌症协会,2007年期间,世界上760万人死于癌症。每种肿瘤包含平均90种突变基因[2],其中每种肿瘤起源于单独的生成细胞[33]。癌症治疗的性质和基本方法不断地变化。例如放射治疗、手术和抑制血管形成的癌症治疗的方法对于许多小的转移灶是无用的。例如抑制细胞分裂以及破坏分裂中的细胞的癌症治疗的方法没有特异性且因此产生可使患者致死的有害副作用。例如诱导肿瘤组织分化、抑制癌基因、包含针对癌细胞所特有的膜受体蛋白的配体的病毒、操纵免疫系统和免疫毒素治疗的癌症治疗的方法,具有窄的治疗指数且通常不足够有效。使用肿瘤抑制基因的癌症治疗的方法和使用在癌细胞中被独特地激活的启动子下的毒素的癌症治疗的方法具窄的治疗指数、产生有害副作用的大的可能性并且通常不足够有效。
核糖体灭活蛋白(RIP)是植物或微生物来源的蛋白质毒素。RIP通过使核糖体失活抑制蛋白质合成。最近的研究表明RIP还能够通过凋亡诱导细胞死亡。II型RIP包含通过二硫键连接在一起的毒素A链和凝集素样亚基(B链)。B链在催化上无活性,而是用来调节A-B蛋白复合物进入细胞溶胶。蓖麻毒素、相思豆毒素和白喉毒素是非常强效的II型RIP。已经报道到达细胞溶胶的单分子蓖麻毒素或相思豆毒素可杀死该细胞[3,4]。另外,引入到细胞中的单分子白喉毒素片段A可杀死该细胞[5]。
在哺乳动物细胞中,向mRNA的5′端添加帽子(7-甲基鸟苷帽子)使mRNA翻译增加到35-50倍。另外,向mRNA的3′端添加多聚(A)尾巴使mRNA翻译增加到114-155倍[6]。哺乳动物细胞中的多聚(A)尾巴仅使功能性mRNA的半衰期增加到2.6倍而帽子仅使功能性mRNA的半衰期增加到1.7倍[6]。人HIST1H2AC(H2ac)基因编码组蛋白H2A家族的一个成员。来自该基因的转录物缺乏多聚(A)尾巴,而是替代地包含回文终止元件(5′-GGCUCUUUUCAGAGCC-3′),该元件在3′-UTR处形成在mRNA加工和稳定性方面起重要作用的保守茎-环结构[7]。
RNA干扰(RNAi)是其中由与功能待被抑制的靶基因的特定区域同源的有义RNA和反义RNA构成的dsRNA影响所述靶基因的转录物的同源区域的裂解的一种现象。在哺乳动物中,dsRNA应短于31个碱基对以避免引发可通过凋亡导致细胞死亡的干扰素反应。2006年的医学和生理学诺贝尔奖授予了RNAi领域,因为这项技术拥有巨大的治疗潜力。然而,RNAi技术基于利用微小RNA(miRNA)调节转录后基因表达的天然机制[8]。miRNA是长度约21个核苷酸的非常小的RNA分子,其显示衍生自形成预测的RNA茎-环结构的70-90个核苷酸(nt)的前体。miRNA在不同的生物体例如线虫、果蝇、人和植物中表达。
在哺乳动物中,miRNA通常由RNA聚合酶II转录且所得的初级转录物(初级-miRNA)包含被Drosha-DGCR8复合物裂解的局部茎-环结构。该裂解的产物是一种或多种(在簇集的情形下)前体miRNA(前-miRNA)。前-miRNA通常长度为70-90个核苷酸,具有牢固的茎-环结构,且其通常在3′端包含2个核苷酸的突出端[9]。前-miRNA被输出蛋白-5运输到细胞质中。在细胞质中,为RNA酶III家族的核糖核酸内切酶的Dicer酶将前-miRNA中的茎识别为dsRNA并从前-miRNA的3′和5′端裂解和释放21bp的dsRNA(miRNA双链体)。Dicer-TRBP复合物将双链体的两条链彼此分离且具有热动力学上较弱的5′端的链被掺入到RNA诱导性沉默复合物(RISC)中[10]。该链是成熟的miRNA。未被掺入到RISC中的链称为miRNA*链并且其被降解[8]。成熟miRNA将RISC引导到mRNA内的靶位点。如果靶位点与成熟miRNA几乎完全互补的话,则该mRNA将在位于靶位点3′端上游约10个核苷酸的位置处被裂解[10]。在裂解后,RISC-成熟miRNA链复合物被回收用于另一活性[11]。如果靶位点与成熟miRNA具有较低的互补性,则mRNA将不在靶位点处裂解但是该mRNA的翻译将被抑制。虽然迄今已在人类中鉴定到约530种miRNA,但是估计脊椎动物的基因组编码多达1,000种独特的miRNA,预测这些miRNA调节至少30%的基因的表达[12],和图1。
微小RNA在人类癌症的始发和进展方面似乎起到至关重要的作用,并且在癌症中起作用的微小RNA被命名为致癌性miRNA(oncomiR)[12]。在为经济发达国家的成年人中最普遍的癌症之一的肺癌中,miRNA簇miR-17-92的表达被强烈上调;miR-17-92的预测靶是PTEN和RB2,两种已知的肿瘤抑制基因[8]。在乳头状甲状腺癌(PTC)中,三种miRNA:miR-221、miR-222和miR-146以比在匹配的健康组织中高得多的水平累积[8]。在最常见形式的脑癌多形性成胶质细胞瘤(GBM)中,miR-221和miR-21以比在正常组织中高得多的水平累积[8]。在淋巴细胞癌B-细胞来源的淋巴瘤中,miR-155以比在正常淋巴细胞中高得多的水平累积[8]。与健康或非转移性致瘤细胞相比,在转移性乳腺癌中,转录因子Twist上调miR-10b表达;miR-10b的靶是HOXD10,并且降低HOXD10的水平导致更高水平的RHOC,RHOC刺激癌细胞的运动性[8]。
因计算机方法和高通量验证变得可行的全基因组筛选已经发现了约141种由病毒编码的微小RNA前体[34,35],这些微小RNA中的较大部分由包括多种人致癌病毒如单纯疱疹病毒、卡波西肉瘤疱疹病毒或爱泼斯坦巴尔病毒的疱疹病毒家族编码[13]。许多病毒miRNA位于与潜伏性转录有关的基因组区域中或该区域周围的簇内[20]。已表明三种α-疱疹病毒单纯疱疹病毒-1(HSV-1)和马立克病病毒-1和2(MDV-1和MDV-2)编码靠近少量潜伏有关的转录物(minor latency-associated transcript)的miRNA和在所述转录物内的miRNA,一种在所有三种病毒的潜伏感染期间检测到的非编码RNA[20]。在γ-疱疹病毒爱泼斯坦巴尔病毒的两个基因组区域内鉴定到多种miRNA并且它们在转化的B细胞系的潜伏感染期间表达[20]。在鼠γ-疱疹病毒-68(MHV-68)中,发现之前被鉴定为潜伏期标志的tRNA-样转录物编码多种miRNA,而由卡波西肉瘤相关的疱疹病毒(KSHV)表达的大多数miRNA是从也与潜伏基因表达有关的单一转录物加工得到的[20]。其他研究表明了HIV-编码的微小RNA在影响和/或维持潜伏感染中的作用[1,14]。
导致癌症的许多病毒编码miRNA且能够引起潜伏感染。例如,KSHV病毒导致卡波西肉瘤癌且编码13种miRNA[13]。例如,SV40(猿猴空泡病毒40)具有导致肿瘤的潜力,但是最经常以潜伏感染持续存在,SV40通过直接编码的与基因反义的两种miRNA调节其大T抗原的表达,这些miRNA的表达导致大T抗原转录物的裂解[20]。例如,EBV编码23种miRNA并在B细胞伯基特淋巴瘤、感染了EBV的鼻咽癌细胞和EBV-有关的胃癌(EBVaGC)中观察到EBV miRNA的表达[13,21]。例如,HCMV编码15种miRNA且最近的研究表明了HCMV的基因组和抗原在大于90%的患特定恶性肿瘤,例如结肠癌、恶性胶质瘤、前列腺癌和乳腺癌的患者的肿瘤细胞(而不是在相邻的正常组织中)的存在[36]。此外,在不同组织学类型的胶质瘤中检测到HCMV表明,与更低级的肿瘤中的48%相比,多形性成胶质细胞瘤中的HCMV阳性细胞为79%[36]。HCMV可增加肿瘤细胞的恶性,因为这些肿瘤细胞共有许多利益(例如,核苷酸合成、DNA复制、逃避免疫系统以及逃避凋亡)。目前的抗病毒治疗方案在消除潜伏病毒的细胞贮量方面大部分是无效的。
一些病毒miRNA是oncomiR(已知参与癌症的miRNA)的直向同源物(不同物种中的彼此相似的基因,因为其源自共同的祖先)[35]。直向同源的病毒miRNA的实例是为hsa-miR-155的直向同源物的KSHV的KSHV-miR-K12-11,其在:B细胞淋巴瘤、白血病、胰腺癌和乳腺癌中过表达[35]。另一个实例是为hsa-miR-18a/b的直向同源物的EBV的EBV-miR-BART5。hsa-miR-18a/b由在:肺癌、未分化甲状腺癌细胞和人B细胞淋巴瘤中过表达的hsa-miR-17-92簇编码[35]。
人疱疹病毒6(HHV6)已被鉴定为多发性硬化、心肌炎、脑炎和高热惊厥中可能的病原物质。对颞叶切除术标本的研究表明了活性HHV6B在约三分之二的患MTS(颞叶内侧硬化)的患者的海马星形胶质细胞中复制的迹象[37]。HHV6是β疱疹病毒科(疱疹病毒科的亚科)的成员,β疱疹病毒科还包括HCMV(其包含15种miRNA)且因此HHV6也可包含许多miRNA。
已提出了miRNA的多种治疗潜力。一种方法是逻辑地构建针对病毒转录物中或靶细胞的癌基因转录物中极为保守区域的微小RNA或短发夹RNA(shRNA)[8];然而在该方法中,病毒转录物或癌基因转录物的裂解通常不会杀死靶细胞。其他方法是通过抗-miRNA寡核苷酸(AMO)阻断致癌性miRNA或病毒miRNA。AMO具有与miRNA互补的序列且包含实现强的结合的化学修饰,所述化学修饰可滴定(titrate away)所述miRNA,一种类型的修饰是RNA核苷酸的2′-O-甲基化且其他类型的修饰是锁核酸(LNA)DNA核苷酸[8]。然而,这种方法具有至少两个问题:第一,AMO对癌基因或病毒miRNA的阻断通常不会杀死靶细胞,而且第二,AMO不能在细胞中转录且因此AMO需要以用于滴定大部分miRNA拷贝数的巨大量被插入到每个靶细胞中。例如,如WO07/00068中公开的另一种方法涉及包含miRNA序列靶的基因载体及其阻止或减少包含相应的miRNA的细胞中转基因的表达的用途。例如,WO2010/055413中还公开了适于在外周器官细胞中暂时表达转基因的包含可操作连接到转基因的调控序列的基因载体,其中所述调控序列阻止或减少血管形成谱系细胞中所述转基因的表达。
因此存在对于发展强效、可靠、特异且使用安全并能够选择性地表达和/或激活仅包含特异性内源miRNA的特定靶细胞而不是任何其他细胞中的外源目的蛋白的新型组合物的需要,该组合物不包含所述特异性内源miRNA。这些组合物应优选地能够选择性地杀死包含所述特异性内源miRNA的靶细胞,而对不包含所述特异性内源miRNA的其他细胞没有任何作用。
发明概述
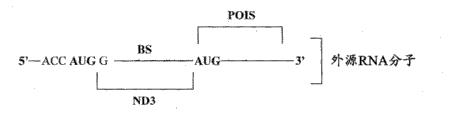
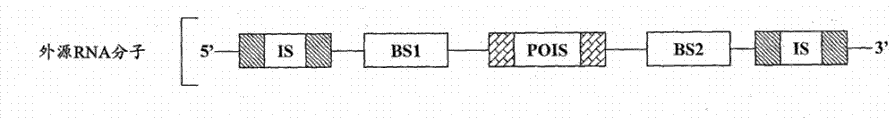
根据某些实施方案,提供了用于响应细胞中特异性内源细胞miRNA或病毒miRNA的存在而表达外源目的蛋白的组合物。这些组合物包含或转录外源RNA分子,所述外源RNA分子是包含下列的RNA分子:
(a)编码外源目的蛋白的序列;
(b)能够抑制所述外源目的蛋白表达的抑制序列;和
(c)与所述特异性内源miRNA的成熟miRNA链具有指导所述外源RNA分子在裂解位点处裂解的足够的互补性的结合位点。预定的靶裂解位点被设计为位于抑制序列和编码该外源目的蛋白的序列之间。
因此,在细胞中存在特异性内源miRNA时,外源RNA分子在该裂解位点处被所述特异性内源miRNA裂解并且抑制序列与编码外源目的蛋白的序列分离,使得外源目的蛋白能够被表达。
在某些实施方案中,外源目的蛋白可选自,但不限于:蛋白质毒素蓖麻毒素、相思豆毒素和白喉毒素,包含蛋白质毒素的融合蛋白及类似蛋白。所述特异性内源miRNA可选自细胞中表达的任何miRNA,诸如,例如但不限于细胞miRNA、致癌性miRNA、病毒miRNA以及类似miRNA或其任何组合。抑制序列可位于裂解位点的下游或上游。
根据某些实施方案,位于裂解位点上游的抑制序列可以是例如,但不限于多个起始密码子(initiation codon),其中每个起始密码子可位于Kozak共有序列(或任何其他翻译起始元件)内且其中每个起始密码子和编码外源目的蛋白的序列不在同一读码框内。在该情形下,这些起始密码子抑制外源目的蛋白的表达。在本发明的另一实施方案中,位于裂解位点上游的抑制序列可以是例如,但不限于:分选信号、用于亚细胞定位的RNA定位信号、泛素降解信号、富含AU的元件(ARE)、翻译阻遏物(translationrepressor)的识别位点、足以阻碍核糖体扫描的二级结构以及类似序列或其组合。在一个示例性实施方案中,外源RNA分子包含紧邻裂解位点上游定位的抑制序列区域处的第一序列,其中所述第一序列能够结合紧邻裂解位点下游定位的第二序列。因此,在完整的外源RNA分子中,第一和第二序列形成可阻碍核糖体扫描的二级结构,且特别地,在被裂解的外源RNA分子中,第二序列可形成内部核糖体进入位点(IRES)结构。
根据另外的实施方案,具有位于裂解位点上游的抑制序列的外源RNA分子的序列还可包括能够直接或间接地实现在抑制序列上游的位置处裂解所述外源RNA分子的序列或组分。因此这可降低完整外源RNA分子的翻译效率。
根据另外的实施方案,本发明的组合物还可包含可增加在5’端可被裂解的外源RNA分子的翻译效率的一种或多种另外的结构。所述一种或多种另外的结构可以是例如,但不限于:能够使所述外源RNA分子形成环(circularization)的核苷酸序列,因此所述核苷酸序列可增加被裂解的外源RNA分子的翻译效率。
根据某些实施方案,本发明的组合物可用于各种应用、方法和技术中,诸如,例如,但不限于:调控基因表达,治疗各种病症和疾患、包括各种病症和疾患诸如,例如健康相关的病症的各种疾病诊断学,转基因生物体的形成,用于治疗增生性疾患诸如,例如癌症的自杀基因疗法;用于治疗:遗传病、传染病例如HIV及类似疾病的自杀基因疗法。
根据某些实施方案,提供了包含用于仅在表达特异性内源miRNA的细胞中指导外源目的蛋白表达的一种或多种多核苷酸的组合物,所述一种或多种多核苷酸编码外源RNA分子,所述外源RNA分子包含:编码外源目的蛋白的序列;能够抑制所述外源目的蛋白的表达的抑制序列;和针对所述特异性内源miRNA的结合位点,其中仅在所述特异性内源miRNA的存在下,所述外源RNA分子在裂解位点处被裂解,从而从编码外源目的蛋白的序列中释放抑制序列,所述外源目的蛋白借以能被表达。在某些实施方案中,足够的互补性为至少30%的互补性。在其他实施方案中,足够的互补性为至少90%的互补性。
根据某些实施方案,所述裂解位点位于所述结合位点内且所述裂解位点位于所述抑制序列和编码所述外源目的蛋白的序列之间。
在某些实施方案中,针对特异性内源miRNA的结合位点与所述特异性内源miRNA内的序列具有使所述特异性内源miRNA指导所述外源RNA分子在所述裂解位点被裂解的足够的互补性。
根据另外的实施方案,特异性内源miRNA是细胞的微小RNA、病毒微小RNA或二者。在某些实施方案中,细胞的微小RNA仅在赘生性细胞中表达。在某些实施方案中,病毒微小RNA由选自由下列组成的组的病毒表达:双链DNA病毒、单链DNA病毒、双链RNA病毒、双链RNA病毒、单链(正链)病毒、单链(负链)病毒和逆转录病毒。
根据某些实施方案,所述外源目的蛋白是毒素。所述毒素可选自由下列组成的组:蓖麻毒素、蓖麻毒素A链、相思豆毒素、相思豆毒素A链、白喉毒素A链及其修饰形式。在某些实施方案中,所述毒素选自由下列组成的组:α毒素、皂草素、玉蜀黍RIP(maize RIP)、大麦RIP、小麦RIP、玉米RIP(corn RIP)、黑麦RIP、亚麻RIP、志贺毒素、志贺样RIP、木鳖子甙、胸苷激酶、美洲商陆抗病毒蛋白、多花白树毒蛋白、假单胞菌外毒素、假单胞菌外毒素A、大肠杆菌胞嘧啶脱氨酶及其修饰形式。
在某些另外的实施方案中,抑制序列可位于裂解位点的上游且抑制序列可直接或间接地降低自外源RNA分子的外源目的蛋白的翻译效率。
在某些实施方案中,抑制序列包含多个起始密码子。在另外的实施方案中,每个起始密码子和编码外源目的蛋白的序列不在同一读码框内。在某些实施方案中,每个所述起始密码子主要由5′-AUG-3′组成。在某些实施方案中,每个起始密码子可位于Kozak共有序列中。
根据另外的实施方案,抑制序列能够结合多肽,其中所述多肽可直接或间接地降低所述外源RNA分子中所述外源目的蛋白的翻译效率。所述多肽可以是翻译阻遏蛋白(translation repressor protein),其中所述翻译阻遏蛋白是内源性翻译阻遏蛋白或由所述组合物的一种或多种多核苷酸编码。
在某些实施方案中,抑制序列包含用于亚细胞定位的RNA定位信号或内源性miRNA结合位点。
根据某些实施方案,所述组合物的一种或多种多核苷酸还可包含编码能够直接或间接地抑制内源性核酸外切酶的表达的功能性RNA的多核苷酸序列。
在某些实施方案中,针对特异性内源miRNA的结合位点是针对相同或不同的内源性miRNA的多个结合位点且其中所述裂解位点是多个裂解位点。
在某些实施方案中,特异性内源miRNA选自由下列组成的组:hsv1-miR-H1、hsv1-miR-H2、hsv1-miR-H3、hsv1-miR-H4、hsv1-miR-H5、hsv1-miR-H6、hsv2-miR-I、hcmv-miR-UL22A、hcmv-miR-UL36、hcmv-miR-UL70、hcmv-miR-UL112、hcmv-miR-UL148D、hcmv-miR-US4、hcmv-miR-US5-1、hcmv-miR-US5-2、hcmv-miR-US25-1、hcmv-miR-US25-2、hcmv-miR-US33、kshv-miR-K12-1、kshv-miR-K12-2、kshv-miR-K12-3、kshv-miR-K12-4、kshv-miR-K12-5、kshv-miR-K12-6、kshv-miR-K12-7、kshv-miR-K12-8、kshv-miR-K12-9、kshv-miR-K12-10a、kshv-miR-K12-10b、kshv-miR-K12-11、kshv-miR-K12-12、ebv-miR-BART1、ebv-miR-BART2、ebv-miR-BART3、ebv-miR-BART4、ebv-miR-BART5、ebv-miR-BART6、ebv-miR-BART7、ebv-miR-BART8、ebv-miR-BART9、ebv-miR-BART10、ebv-miR-BART11、ebv-miR-BART12、ebv-miR-BART13、ebv-miR-BART14、ebv-miR-BART15、ebv-miR-BART16、ebv-miR-BART17、ebv-miR-BART18、ebv-miR-BART19、ebv-miR-BART20、ebv-miR-BHRF1-1、ebv-miR-BHRF1-2、ebv-miR-BHRF1-3、bkv-miR-B1、jcv-miR-J1、hiv1-miR-H1、hiv1-miR-N367、hiv1-miR-TAR、sv40-miR-S1、MCPyV-miR-M1、hsv1-miR-LAT、hsv1-miR-LAT-ICP34.5、hsv2-miR-II、hsv2-miR-III、hcmv-miR-UL23、hcmv-miR-UL36-1、hcmv-miR-UL54-1、hcmv-miR-UL70-1、hcmv-miR-UL22A-1、hcmv-miR-UL112-1、hcmv-miR-UL148D-1、hcmv-miR-US4-1、hcmv-miR-US24、hcmv-miR-US33-1、hcmv-RNAβ2.7、ebv-miR-BART1-1、ebv-miR-BART1-2、ebv-miR-BART1-3、ebv-miR-BHFR1、ebv-miR-BHFR2、ebv-miR-BHFR3、hiv1-miR-TAR-5p、hiv1-miR-TAR-p、hiv1-HAAmiRNA、hiv1-VmiRNA1、hiv1-VmiRNA2、hiv1-VmiRNA3、hiv1-VmiRNA4、mir-675、hiv1-VmiRNA5、hiv2-miR-TAR2-5p、hiv2-miR-TAR2-3p、mdv1-miR-M1、mdv1-miR-M2、mdv1-miR-M3、mdv1-miR-M4、mdv1-miR-M5、mdv1-miR-M6、mdv1-miR-M7、mdv1-miR-M8、mdv1-miR-M9、mdv1-miR-M10、mdv1-miR-M11、mdv1-miR-M12、mdv1-miR-M13、mdv2-miR-M14、mdv2-miR-M15、mdv2-miR-M16、mdv2-miR-M17、mdv2-miR-M18、mdv2-miR-M19、mdv2-miR-M20、mdv2-miR-M21、mdv2-miR-M22、mdv2-miR-M23、mdv2-miR-M24、mdv2-miR-M25、mdv2-miR-M26、mdv2-miR-M27、mdv2-miR-M28、mdv2-miR-M29、mdv2-miR-M30、mcmv-miR-M23-1、mcmv-miR-M23-2、mcmv-miR-M44-1、mcmv-miR-M55-1、mcmv-miR-M87-1、mcmv-miR-M95-1、mcmv-miR-m01-1、mcmv-miR-m01-2、mcmv-miR-m01-3、mcmv-miR-m01-4、mcmv-miR-m21-1、mcmv-miR-m22-1、mcmv-miR-m59-1、mcmv-miR-m59-2、mcmv-miR-m88-1、mcmv-miR-m107-1、mcmv-miR-m108-1、mcmv-miR-m108-2、rlcv-miR-rL1-1、rlcv-miR-rL1-2、rlcv-miR-rL1-3、rlcv-miR-rL1-4、rlcv-miR-rL1-5、rlcv-miR-rL1-6、rlcv-miR-rL1-7、rlcv-miR-rL1-8、rlcv-miR-rL1-9、rlcv-miR-rL1-10、rlcv-miR-rL1-11、rlcv-miR-rL1-12、rlcv-miR-rL1-13、rlcv-miR-rL1-14、rlcv-miR-rL1-15、rlcv-miR-rL1-16、rrv-miR-rR1-1、rrv-miR-rR1-2、rrv-miR-rR1-3、rrv-miR-rR1-4、rrv-miR-rR1-5、rrv-miR-rR1-6、rrv-miR-rR1-7、mghv-miR-M1-1、mghv-miR-M1-2、mghv-miR-M1-3、mghv-miR-M1-4、mghv-miR-M1-5、mghv-miR-M1-6、mghv-miR-M1-7、mghv-miR-M1-8、mghv-miR-M1-9和sv40-miR-S1。其命名和序列如数据库http://www.mirbase.org/.所定义的。
在某些实施方案中,外源RNA分子还包含位于起始密码子和编码目的蛋白的所述序列的起译密码子(start codon)之间的终止密码子,其中所述终止密码子和所述起始密码子处于同一读码框内且其中所述终止密码子选自由下列组成的组:5′-UAA-3′,5′-UAG-3′和5′-UGA-3′。
在另外的实施方案中,抑制序列位于编码外源目的蛋白的序列上游,其中所述抑制序列能够形成具有低于-30kcal/mol的折叠自由能的二级结构,其中所述二级结构足以阻碍扫描核糖体到达所述外源目的蛋白的起译密码子。
在另外的实施方案中,所述组合物的一种或多种多核苷酸包含一种或多种DNA分子,一种或多种RNA分子或其组合。
在另外的实施方案中,细胞选自由下列组成的组:人细胞、动物细胞、培养的细胞和植物细胞。在某些实施方案中,所述细胞是赘生性细胞。在另外的实施方案中,所述细胞存在于生物体内。
在某些实施方案中,所述组合物被引入到细胞中。所述细胞可以是赘生性细胞且其可存在于生物体内。
在某些实施方案中,还提供了包含所述组合物的诊断试剂盒。
在另外的实施方案中,提供了包含所述组合物的药物组合物,所述药物组合物包含所述一种或多种多核苷酸,以及一种或多种赋形剂。
在另外的实施方案中,提供了用于靶向杀死包含特异性内源miRNA的靶细胞的方法,所述方法包括向所述靶细胞中引入包含所述一种或多种多核苷酸的组合物。
根据某些实施方案,提供了包含编码外源RNA分子的多核苷酸序列的载体,其中所述外源RNA分子包含编码外源目的蛋白的序列;能够抑制所述外源目的蛋白的表达的抑制序列;以及针对特异性内源miRNA的结合位点。所述载体可以是病毒载体。所述载体可以是非病毒载体。在某些实施方案中,针对所述特异性内源miRNA的结合位点与特异性内源miRNA内的序列具有在把所述载体引入到包含所述特异性内源miRNA的细胞中后使所述特异性内源miRNA指导在所述裂解位点裂解所述外源RNA分子的足够的互补性。在另外的实施方案中,裂解位点可位于针对特异性内源miRNA的结合位点内,且裂解位点可位于抑制序列和编码所述外源目的蛋白的序列之间。在另外的实施方案中,特异性内源miRNA是细胞的微小RNA、病毒微小RNA或二者。细胞的微小RNA仅可在赘生性细胞中表达。病毒微小RNA可由选自由下列组成的组的病毒表达:双链DNA病毒、单链DNA病毒、双链RNA病毒、双链RNA病毒、单链(正链)病毒、单链(负链)病毒和逆转录病毒。
根据另外的实施方案,外源目的蛋白是毒素。所述毒素可选自由下列组成的组:蓖麻毒素、蓖麻毒素A链、相思豆毒素、相思豆毒素A链、白喉毒素A链以及其修饰形式。在另外的实施方案中,所述毒素可选自由下列组成的组:α毒素、皂草素、玉蜀黍RIP、大麦RIP、小麦RIP、玉米RIP、黑麦RIP、亚麻RIP、志贺毒素、志贺样RIP、木鳖子甙、胸苷激酶、美洲商陆抗病毒蛋白、多花白树毒蛋白、假单胞菌外毒素、假单胞菌外毒素A、大肠杆菌胞嘧啶脱氨酶及其修饰形式。
从随后的说明书中,本发明的目的和优点将是明显的。
附图简述
示例性而非限制性地提供了下列图。
图1是对于微小RNA(miRNA)的生物发生和活性的模型的示意图。
图2是根据某些实施方案示出了外源RNA分子被内源性miRNA活化的示意图,其中外源RNA分子中的抑制序列位于该外源RNA分子的裂解位点上游。
图3是根据某些实施方案示出了外源RNA分子被内源性miRNA活化的示意图,其中外源RNA分子中的抑制序列位于该外源RNA分子的裂解位点下游。
图4A是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含不与编码外源目的蛋白的序列位于同一读码框的AUG。
图4B是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含不与编码外源目的蛋白的序列位于同一读码框的Kozak共有序列(5′-ACCAUGG-3′-SEQ IDNO.25)。
图4C是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含不与编码外源目的蛋白的序列位于同一读码框的2个Kozak共有序列。
图5A是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含位于同一读码框内的AUG和下游终止密码子。
图5B是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含AUG和用于亚细胞定位的下游分选信号或蛋白降解信号。
图5C是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含AUG和编码能够抑制下游外源目的蛋白的生物功能的氨基酸的下游序列。
图5D是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含AUG、与AUG位于同一读码框内的下游终止密码子以及下游内含子,其中该外源RNA分子是无义介导的衰变(nonsense-mediated decay,NMD)的靶。
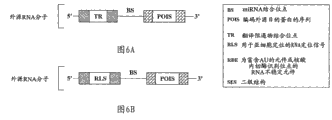
图6A是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含针对翻译阻遏物的结合位点。
图6B是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含用于亚细胞定位的RNA定位信号。
图6C是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含为富含AU的元件或核酸内切酶识别位点的RNA不稳定元件(RNA destabilizing element)。
图6D是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的上游且包含二级结构。
图7是根据某些实施方案示出了外源RNA分子被内源性miRNA活化的实例的示意图,其中抑制序列产生阻碍翻译的二级结构且其中通过miRNA的裂解产生IRES(内部核糖体进入位点)。
图8A是根据某些实施方案示出了增加在5′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中另外的结构是IRES(内部核糖体进入位点)。
图8B是根据某些实施方案示出了增加在5′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中另外的结构是茎-环结构。
图8C是根据某些实施方案示出了增加在5′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中另外的结构是细胞质多腺苷酸化元件。
图8D是根据某些实施方案示出了增加在5′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是彼此结合并促使所述外源RNA分子形成环状结构的核苷酸序列,特别是当外源RNA分子在裂解位点被裂解时。
图9A是根据某些实施方案示出了增加在5′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是由本发明的组合物编码的多肽,其中该多肽能够结合多聚A并结合外源RNA内的序列且因此促使所述外源RNA分子形成环状结构,特别是当外源RNA分子在裂解位点被裂解时。
图9B是根据某些实施方案示出了增加在5′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是由本发明的组合物编码并能够结合外源RNA分子的另外的RNA分子,并且当外源RNA分子在裂解位点被裂解时,通过该另外的RNA分子为其提供帽子。
图9C是根据某些实施方案示出了降低完整外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是去除完整外源RNA分子中的帽子结构的顺式作用型核酶。
图10A是示出了非常有效的顺式作用型锤头状核酶-snorbozyme(SEQID NO.63)[15]的序列的示意图。
图10B是示出了非常有效的顺式作用型锤头状核酶-N117(SEQ IDNO.64)[16]的序列的示意图。
图11A是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点下游且包含内含子,其中所述外源RNA分子是无义介导的衰变(NMD)的靶。
图11B是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点下游且包含针对翻译阻遏物的结合位点。
图11C是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点下游且包含用于亚细胞定位的RNA定位信号。
图11D是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的下游且包含为富含AU的元件或核酸内切酶识别位点的RNA不稳定元件。
图11E是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点的下游且包含二级结构。
图12A是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于编码外源目的蛋白的序列下游,其中所述抑制序列产生阻碍翻译的二级结构。
图12B是根据某些实施方案示出了增加在3′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是IRES(内部核糖体进入位点)。
图12C是根据某些实施方案示出了增加在3′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是茎环结构。
图12D是根据某些实施方案示出了增加在3′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是细胞质多腺苷酸化元件。
图13A是根据某些实施方案示出了增加在3′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是当外源RNA分子在裂解位点被裂解时可彼此结合并促使所述外源RNA分子形成环状结构的核苷酸序列。
图13B是根据某些实施方案示出了增加在3′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是由组合物编码的多肽,其中所述多肽能够结合帽子并结合所述外源RNA内的序列并促使所述外源RNA分子形成环状结构,特别是当外源RNA分子在裂解位点被裂解时。
图13C是根据某些实施方案示出了增加在3′端被裂解的外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是由本发明的组合物编码并能够结合外源RNA分子并因此为其提供多聚A的另外的RNA分子,特别是当外源RNA分子在裂解位点被裂解时。
图13D是根据某些实施方案示出了降低完整外源RNA分子的翻译效率的另外的结构的实例的示意图,其中所述另外的结构是去除完整外源RNA分子中的多聚A的顺式作用型核酶。
图14A是根据某些实施方案示出了外源RNA分子的实例的示意图,所述外源RNA分子包括针对不同的内源性miRNA的两个结合位点,其中抑制序列位于所述裂解位点的上游。
图14B是根据某些实施方案示出了外源RNA分子的实例的示意图,所述外源RNA分子包括针对相同的内源性miRNA的两个结合位点,其中抑制序列位于所述裂解位点的上游。
图14C是根据某些实施方案示出了外源RNA分子的实例的示意图,所述外源RNA分子包括针对不同的内源性miRNA的两个结合位点,其中抑制序列位于所述裂解位点的下游。
图14D是根据某些实施方案示出了外源RNA分子的实例的示意图,所述外源RNA分子包含针对相同的内源性miRNA的两个结合位点,其中抑制序列位于所述裂解位点的下游。
图15A是根据某些实施方案示出了外源RNA分子的实例的示意图,所述外源RNA分子具有位于编码外源目的蛋白的序列下游的抑制序列,其中所述外源RNA分子还包含编码外源目的蛋白的序列上游的针对miRNA的另外的结合位点和所述另外的结合位点上游的起始密码子,其中所述起始密码子不与编码外源目的蛋白的序列位于同一读码框内。
图15B是根据某些实施方案示出了外源RNA分子的实例的示意图,所述外源RNA分子具有位于编码外源目的蛋白的序列下游的抑制序列,且所述外源RNA分子还包含编码外源目的蛋白的序列上游的针对miRNA的另外的结合位点和所述另外的结合位点上游的起始密码子,其中所述起始密码子不与编码外源目的蛋白的序列位于同一读码框内且其中所述外源RNA分子还包含位于5′端的顺式作用型核酶。
图15C是根据某些实施方案示出了外源RNA分子的实例的示意图,所述外源RNA分子在两个miRNA结合位点之间包括编码外源目的蛋白的序列,且还包括两个抑制序列,一个在5′端且另一个在3′端。
图15D是根据某些实施方案示出了外源RNA分子的实例的示意图,所述外源RNA分子在两个不同的miRNA结合位点之间包含编码外源目的蛋白的序列,且还包含2个抑制序列,一个在5′端且另一个在3′端。
图16A是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点下游且能够抑制用于亚细胞定位的RNA定位信号的功能。
图16B是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点上游且能够抑制用于亚细胞定位的RNA定位信号的功能。
图16C是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于裂解位点上游且包含AUG和编码能够抑制用于外源目的蛋白的亚细胞定位的分选信号的功能的氨基酸的下游序列。
图16D是根据某些实施方案示出了外源RNA分子中的抑制序列的实例的示意图,所述抑制序列位于miRNA结合位点下游,其中所述外源RNA分子不包括编码外源目的蛋白的序列的起译密码子下游的终止密码子。抑制序列编码能够抑制上游编码的肽序列的裂解的氨基酸序列,其中该肽序列能够被靶细胞中的蛋白酶裂解。
图17是根据某些实施方案示出了本发明的组合物杀死包含内源性miR-BART1的伯基特淋巴瘤癌细胞、EBV-相关的胃癌癌细胞和鼻咽癌癌细胞的用途的示意图。
图18是根据某些实施方案示出了使用本发明的组合物杀死包含内源性hiv1-miR-N367的HIV-1感染的细胞的实例的示意图。
图19是根据某些实施方案示出了使用本发明的组合物杀死包含内源性miR-10b的转移性乳腺癌细胞的实例的示意图。
图20是根据某些实施方案示出了使用本发明的组合物杀死包含内源性miR-LAT的细胞的实例的示意图。
发明详述
在本发明的下列详细描述中,当使用指代术语,例如:所述、该、最后一个和前者时,其指上文提到的确切的术语(例如,当表述“该核酸序列”,其指上文提到的核酸序列而不是指上文提到的核苷酸序列)。此外,在本发明的下列详细描述中,称为其他实施方案的每个实施方案通过其被定义为单独的单元。
下面是遍布本说明书使用并应根据各种实施方案如下理解的术语:
如本文所指的,术语“多核苷酸分子”、“寡核苷酸”、“多核苷酸”、“核酸”和“核苷酸”序列在本文中可互换地使用。这些术语指以单独片段的形式或作为较大的构建体的组分的直链或支链、单链、双链、三链的脱氧核糖核苷酸(DNA)、核糖核苷酸(RNA)或其修饰形式的聚合物或其杂合体(hybrid)。该术语还包括RNA/DNA杂合体。多核苷酸可以是例如DNA或RNA的有义和反义寡核苷酸或多核苷酸序列。DNA或RNA分子可以是例如但不限于:互补DNA(cDNA)、基因组DNA、合成DNA、重组DNA或其杂合体或RNA分子诸如,例如mRNA、shRNA、siRNA、miRNA及类似分子。因此,如本文所用的,术语“多核苷酸分子”、“寡核苷酸”、“多核苷酸”、“核酸”和“核苷酸”序列意在指DNA和RNA分子二者。这些术语还包括由天然存在的碱基、糖和核苷间共价键构成的寡核苷酸,以及具有与各自的天然存在的部分相似地发挥作用的非天然存在的部分的寡核苷酸。
术语“多肽”、“肽”和“蛋白质”被本文互换地用来指氨基酸残基的聚合物。这些术语应用于其中一个或多个氨基酸残基是相应的天然存在的氨基酸的人工化学类似物的氨基酸聚合物,以及天然存在的氨基酸聚合物。
如本文所指的,术语“互补性”指核酸链之间的碱基配对。如本领域已知的,因为这些链间的碱基对通过两个或三个氢键非共价连接,所以核酸的每条链可与另一条链互补。相对的互补核酸链上的通过氢键连接的两个核苷酸称为碱基对。根据沃森-克里克DNA的碱基配对,腺嘌呤(A)与胸腺嘧啶(T)且鸟嘌呤(G)与胞嘧啶(C)形成碱基对。在RNA中,胸腺嘧啶被尿嘧啶(U)替代。核酸两条链之间的互补性可根据在这些链之间形成碱基对的核苷酸的数目(或百分比)改变。例如,“100%的互补性”表示每条链中的所有核苷酸与互补链形成碱基对。例如,“95%的互补性”表示每条链中的95%的核苷酸与互补链形成碱基对。术语足够的互补性可包括从约30%至约100%的任何互补性百分比。
如本文所用的术语“构建体”指可由一种或多种核酸序列构成的人工组装或分离的核酸分子,其中这些核酸序列可以是编码序列(也就是,编码终产物的序列)、调控序列、非编码序列或其任何组合。术语构建体包括例如载体但不应视为局限于此。
“表达载体”指具有将异源性核酸片段(例如,DNA)掺入到外源细胞中并在所述外源细胞中表达所述异源性核酸片段的能力的载体。换句话说,表达载体包含能够被转录的核酸序列/片段(例如,DNA、mRNA、tRNA、rRNA)。许多病毒、原核和真核表达载体是已知的和/或市售的。合适的表达载体的选择是本领域技术人员的知识范围内的。
如本文所用的术语“上游”和“下游”指在核苷酸序列诸如,例如DNA序列或RNA序列中的相对位置。如众所周知的,核苷酸序列具有所谓的针对核苷酸骨架上的糖(脱氧核糖或核糖)环的碳的5′端和3′端。因此,相对于在核苷酸序列上的位置,术语下游指朝向序列的3′端的区域。术语上游指朝向链的5′端的区域。
如本文所用的术语“启动子元件”、“启动子”或“启动子序列”指通常位于编码序列的5′端(也就是,在其之前、位于其上游)并充当开关,激活编码序列表达的核苷酸序列。如果编码序列被活化,则其应被表述为被转录。转录通常包括从编码序列合成RNA分子(诸如,例如mRNA)。因此,启动子用作转录调控元件且还提供了用于启动编码序列转录成mRNA的位点。启动子可完全来源于天然来源,或由来源于自然界中发现的不同启动子的不同元件构成,或甚至包含合成的核苷酸区段。本领域技术人员应理解,不同的启动子可指导基因在不同组织或细胞类型中,或在不同的发育阶段,或响应于不同的环境条件或以不同的表达水平表达。在大多数时候导致基因在大多数细胞类型中表达的启动子通常被称为“组成性启动子”。驱动基因在特定组织中表达的启动子被称为“组织特异性启动子”。
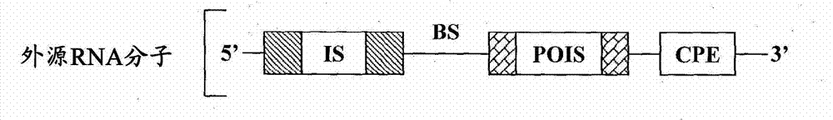
如本文所指的,术语“外源RNA分子”指被引入到靶细胞中和/或在靶细胞中表达的重组RNA分子。外源RNA分子可以是完整的(也就是,全长分子)或在细胞内可在一个或多个裂解位点被裂解。
如本文所用的,术语“目的蛋白”和“外源目的蛋白”可互换地使用。这些术语指细胞内由外源RNA分子翻译的肽序列。在某些实施方案中,所述肽序列可以是一种或多种不同的蛋白质或融合蛋白。
如本文所用的,术语“特异性内源miRNA”和“特异性miRNA”可互换地使用。这些术语指细胞内的微小RNA(miRNA)分子/序列。特异性内源miRNA可由细胞的基因组编码(细胞miRNA),和/或由细胞内驻留的外源基因组,诸如例如,由细胞内驻留的病毒编码(病毒miRNA)。特异性miRNA在外源RNA分子被引入靶细胞之前/被表达之前存在于靶细胞内。
如本文所用的术语“表达”指在靶细胞内产生期望的终产物分子。终产物分子可以是例如RNA分子;肽或蛋白质;及类似分子;或其组合。
如本文所指的,术语“开放读码框”(“ORF”)指包含起译密码子和终止密码子的编码区。
如本文所指的,术语“Kozak序列”是本领域熟知的且指mRNA分子上被核糖体作为翻译起始位点识别的序列。术语“Kozak共有序列”、“Kozak共有区”或“Kozak序列”是存在于真核mRNA上且具有共有区(gcc)gccRccAUGG(SEQ ID NO.24)的序列,其中,R是嘌呤(腺嘌呤或鸟嘌呤),位于起译密码子(AUG)上游三个碱基处,起译密码子(AUG)之后为另一个‘G’。在某些实施方案中,Kozak序列具有序列RNNAUGG(SEQ IDNO.83)。
如本文所用的,术语“引入”和“转染”可互换地使用且指将分子诸如例如核酸、多核苷酸分子、载体及类似分子转移到靶细胞中,且更特别地转移到靶细胞的膜围封的空间的内部。这些分子可通过本领域技术人员已知的任何方法被“引入”到靶细胞中,例如,由Sambrook等人,MolecularCloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,NewYork(2001)教导的方法,该文献的内容被通过引用并入本文。将分子“引入”到细胞内的方法包括例如,但不限于:热激、磷酸钙转染、PEI转染、电穿孔、脂质转染法、转染试剂、病毒介导的转移以及类似方法或其组合。细胞的转染可在任何类型的任何来源的细胞例如诸如人细胞、动物细胞、植物细胞及类似细胞上进行。这些细胞可以是分离的细胞、组织培养的细胞、细胞系、生物体内存在的细胞以及类似的细胞。
关于细胞/细胞群的术语“杀死”指包括将导致细胞/细胞群的死亡的任何类型的操作。
如本文所指的,术语“治疗疾病”或“治疗病症”指施用一种组合物,所述组合物包含有效地减轻与疾病有关的症状以降低疾病的严重度或治愈所述疾病或以预防所述疾病发生的至少一种试剂(其可以是例如,一种或多种多核苷酸分子、一种或多种载体、一种或多种物质/成分以及类似试剂)。施用可包括任何施用途径。
术语“检测”、“诊断”指检测疾病、症状、疾患、病理学状况或正常状况(pathological or normal condition)的检测;对疾病、症状、疾患、病理学状况分类;确定疾病、症状、疾患、病理学状况的严重性;监测疾病、症状、疾患、病理学状况的进展;预测其结果和/或恢复的前景的方法。
1.本发明的组合物的基本结构
根据某些实施方案,提供了用于仅在包含特异性内源miRNA的细胞中表达外源目的蛋白的组合物。内源性miRNA可以是细胞的miRNA、病毒miRNA和/或细胞内存在的任何类型的miRNA。外源目的蛋白可以是任何类型的肽或蛋白质,例如诸如毒素。
根据某些实施方案,本发明的组合物可包含一种或多种多核苷酸分子,例如诸如DNA分子、RNA分子或二者。
在某些实施方案中,所述组合物包含外源RNA分子或编码该分子,所述外源RNA分子是包括至少下列序列的RNA分子:
a)编码外源目的蛋白的序列;
b)能够抑制该外源目的蛋白表达的抑制序列;和
c)被设计为与特异性内源miRNA的成熟miRNA链具有使所述特异性内源miRNA指导所述外源RNA分子在裂解位点裂解的足够的互补性的结合位点。该裂解位点被设计为位于抑制序列和编码该外源目的蛋白的序列之间。
因此,仅在细胞中存在特异性内源miRNA下,外源RNA分子在该裂解位点被所述特异性内源miRNA裂解并且抑制序列与编码外源目的蛋白的序列分离,并且所述外源目的蛋白能够被表达。例如,这被示出在图2和3中。
根据某些实施方案,选择特异性内源miRNA可能与其在为靶细胞的特定细胞类型中的表达有关和/或根据所述表达来确定。因此,选择在特定细胞类型中表达的特异性内源miRNA由此可提供用于在所选选择的细胞类型中(靶细胞)靶向表达所述外源目的蛋白的机制。所述特定的细胞可选自例如,但不限于:被病毒或其他致病物质感染的细胞;良性或恶性细胞、表达免疫系统的组分的细胞。特异性可通过将所述组合物的外源RNA分子的结合位点修饰为与特异性内源miRNA的成熟miRNA链具有使所述特异性内源miRNA指导外源mRNA分子在靶细胞内裂解的足够的互补性实现。
本领域已知的是,不含帽子或多聚A尾巴的mRNA仍能够翻译蛋白质。在哺乳动物细胞中,添加帽子使mRNA翻译增加到35-50倍而添加多聚(A)尾巴使mRNA翻译增加到114-155倍[6]。哺乳动物细胞中的多聚(A)尾仅使功能性mRNA的半衰期增加到2.6倍而帽子仅使功能性mRNA半衰期增加到1.7倍[6]。
本领域中还已知的是,某些蛋白质可以以甚至每个细胞一个蛋白质的浓度对细胞发挥生物学作用。例如,已报道到达细胞的细胞溶胶的单个蓖麻毒素或相思豆毒素的蛋白可杀死细胞[3,4]。另外,引入到细胞中的单个白喉毒素片段A(DTA)的蛋白可杀死细胞[5]。在某些实施方案中,外源目的蛋白可以是任何蛋白质或肽,诸如例如但不限于蓖麻毒素、相思豆毒素、白喉毒素及类似毒素或其组合。
根据某些实施方案,外源目的蛋白可以是为两种蛋白质的融合体的多肽,所述多肽可在两种蛋白质间具有裂解位点,允许两种蛋白质在细胞内分离。例如,外源目的蛋白可以是蓖麻毒素和DTA的融合蛋白,其中该融合蛋白通过例如特异性蛋白酶的裂解可导致在细胞内形成分开的DTA和蓖麻毒素的蛋白质。在某些实施方案中,所述外源目的蛋白可以是可被所述组合物表达的两种不同的蛋白质。例如,外源目的RNA可编码两种不同的外源目的蛋白,诸如,例如蓖麻毒素和DTA。
2.具有位于裂解位点上游的抑制序列的外源RNA分子的结构
2.1.位于裂解位点上游的抑制序列的结构
根据某些实施方案,外源RNA分子中的抑制序列可位于裂解位点的下游或上游。本部分描述了位于外源RNA分子中裂解位点上游的抑制序列的结构。这被示出在例如图2中。
根据某些实施方案,位于裂解位点上游的抑制序列可以是例如,起始密码子。所述起始密码子和编码所述外源目的蛋白的序列不处于同一读码框内,使得所述起始密码子可引起针对所述外源目的蛋白的移码突变,所述外源目的蛋白的编码序列位于下游。这被示出在例如,图4A中。在一个实施方案中,起始密码子可位于Kozak共有序列内。另外,还可使用保持充当翻译起始物(initiator)的能力的被修饰的Kozak共有序列。例如,参见图4B。在某些实施方案中,人的Kozak共有序列是5′-ACCAUGG-3′(SEQ ID NO.25)且起始密码子是5′-AUG-3′。
在某些实施方案中,起始密码子可位于TISU基序内或具有一个或多个TISU基序。TISU(短5′UTR的翻译起始物)基序因其独特的指导具有非常短的5′UTR的mRNA有效且准确地开始翻译的能力而不同于Kozak共有区[38]。
在另一个实施方案中,位于裂解位点上游的抑制序列可具有多个起始密码子,其中每个起始密码子和编码外源目的蛋白的序列不在同一读码框内。这些起始密码子可引起外源目的蛋白的移码突变,所述外源目的蛋白的编码序列位于下游。另外,每个起始密码子可位于Kozak共有序列内或保持充当翻译起始物的能力的修饰的Kozak共有序列内。例如,参见图4C。
在另一个实施方案中,位于裂解位点上游的抑制序列可包含起始密码子。外源RNA分子还可在起始密码子和编码外源目的蛋白的序列的起译密码子之间包含终止密码子,其中所述终止密码子和起始密码子处于同一读码框中。在该实施方案中,产生了可降低编码所述外源目的蛋白的下游序列的翻译效率的上游开放读码框(uORF)。例如,参见图5A。在某些实施方案中,终止密码子可以是,例如5′-UAA-3′或5′-UAG-3′或5′-UGA-3′。
在某些实施方案中,强的茎和环结构可位于ORF的上游或下游,在为miRNA的靶序列(裂解位点)的上游或下游的位置处。这些茎和环的产生可在以下情况下有帮助:其中尽管已到达终止密码子,核糖体的小亚基不与mRNA上分离,继续扫描mRNA。核糖体的小亚基不能打开牢固的RNA二级结构。另外,当这些茎和环位于靶序列的下游时,其还可阻断例如由XRN1核糖核酸外切酶进行的对被裂解的mRNA的降解。
在另一个实施方案中,位于裂解位点上游的抑制序列可包含起始密码子和编码用于亚细胞定位的分选信号的核苷酸序列。所述核苷酸序列可位于起始密码子的下游且所述核苷酸序列和起始密码子位于同一读码框中。在某些实施方案中,由分选信号指导的外源目的蛋白的亚细胞定位可抑制目的蛋白的生物学功能。用于亚细胞定位的分选信号可以是例如但不限于:线粒体分选信号、核分选信号、内体分选信号、溶酶体分选信号、过氧化物酶体分选信号、ER分选信号及类似的分选信号。用于亚细胞定位的分选信号可以是例如(人烷基磷酸二羟基丙酮(alkyldihydroxyacetonephosphate)合酶的)过氧化物酶体靶向信号2[(R/K)(L/V/I)X5(Q/H)(L/A)](SEQ ID NO.26)或H2N----RLRVLSGHL(SEQID NO.27)[28]。这被示出在例如,图5B中。
在本发明的另一个实施方案中,位于裂解位点上游的抑制序列可包含起始密码子和编码蛋白降解信号的核苷酸序列。所述核苷酸序列位于起始密码子的下游,其中所述核苷酸序列和起始密码子位于同一读码框内。蛋白降解信号可以是例如,但不限于泛素降解信号。例如,参见图5B。
在本发明的另一个实施方案中,位于裂解位点上游的抑制序列可被设计为包括起始密码子和位于所述起始密码子下游的核苷酸序列,所述核苷酸序列与所述起始密码子以及与编码外源目的蛋白的序列位于同一读码框内,其中当所述核苷酸序列编码的氨基酸序列被融合到外源目的蛋白时,所述外源目的蛋白的生物学功能被抑制。例如,参见图5C。
在本发明的另一个实施方案中,位于裂解位点上游的抑制序列可包含起始密码子,且外源RNA分子还可包含所述起始密码子下游的终止密码子,其中所述终止密码子和所述起始密码子在同一读码框内。另外,所述外源RNA分子还可包含所述终止密码子下游的内含子,其中所述外源RNA分子是可降解所述外源RNA分子的无义介导的衰变(NMD)的靶[29]。例如,参见图5D。
在另一个实施方案中,位于裂解位点上游的抑制序列可包含能够结合翻译阻遏蛋白的序列。在某些实施方案中,翻译阻遏蛋白是内源性翻译阻遏蛋白。在某些实施方案中,翻译阻遏蛋白可由所述组合物编码。所述翻译阻遏蛋白可直接或间接地降低外源目的蛋白的翻译效率[24]。例如,能够结合翻译阻遏蛋白的序列包括但不限于结合SMAUG阻遏蛋白的序列(5′-UGGAGCAGAGGCUCUGGCAGCUUUUGCAGCG-3′)(SEQ IDNO.28)[25]。例如,参见图6A。
在另一个实施方案中,位于裂解位点上游的抑制序列可包含用于亚细胞定位的RNA定位信号(包括,例如,共翻译输入(co-translational import))或内源性miRNA结合位点,其中外源RNA分子的亚细胞定位可抑制外源目的蛋白的翻译且可缩短外源RNA分子的半衰期。RNA定位信号可以是例如但不限于,用于下列的RNA定位信号:髓鞘化外周(myelinatingperiphery)、髓磷脂区室(myelin compartment)、线粒体、薄板前缘(leadingedge of the lamella)、核周细胞质[22]或类似的部位。例如,RNA定位信号可以是用于髓鞘化外周的RNA定位信号5′-GCCAAGGAGCCAGAGAGCAUG-3′(SEQ ID NO.29)或5′-GCCAAGGAGCC-3′(SEQ IDNO.30)[27]。例如,参见图6B。
在另一个实施方案中,位于裂解位点上游的抑制序列可包含可刺激外源RNA分子降解的RNA不稳定元件。RNA不稳定元件可以是例如,富含AU的元件(ARE)、核酸内切酶识别位点或类似的。富含AU的元件可以是例如长度为至少约35个核苷酸的富含AU的元件。例如,富含AU的元件可以是5′-AUUUA-3′(SEQ ID NO.31)、5′-UUAUUUA(U/A)(U/A)-3′(SEQ ID NO.32)或5′-AUUU-3′(SEQ IDNO.33)[26]。例如,参见图6C。
在另一个实施方案中,位于裂解位点上游的抑制序列可包含能够形成可降低下游外源目的蛋白的翻译效率的二级结构。在某些实施方案中,二级结构的折叠自由能可低于-30kcal/mol(例如,-50kcal/mol、-80kcal/mol)且因此该二级结构足以阻碍扫描核糖体到达编码外源目的蛋白的下游区域的起译密码子。例如,参见图6D。
在另外的实施方案中,位于裂解位点上游的抑制序列可包含紧邻裂解位点上游定位的核苷酸序列,其中所述核苷酸序列能够结合紧邻裂解位点下游定位的核苷酸序列以形成二级结构,其中所述二级结构可直接或间接地降低下游外源目的蛋白的翻译效率。
二级结构的折叠自由能可低于-30kcal/mol(例如,-50kcal/mol、-80kcal/mol)且因此该二级结构足以阻碍扫描核糖体到达外源目的蛋白的起译密码子。在另一个实施方案中,所述裂解位点可位于单链区域内或二级结构中的环区域内,其中所述单链区域或所述环区域可以是例如但不限于长度为至少约15个核苷酸的区域。在另一个实施方案中,外源RNA分子还可包含裂解位点下游和编码外源目的蛋白的序列上游的内部核糖体进入位点(IRES)的序列,其中所述IRES序列在裂解的外源RNA分子内比在完整的外源RNA分子内功能更强。在另一个实施方案中,IRES序列的至少一部分可位于紧邻裂解位点的下游定位的核苷酸序列内。例如,参见图7。
IRES序列可选自,例如但不限于微小核糖核酸病毒的IRES、口蹄疫(foot-and-mouth disease)病毒的IRES、脑心肌炎病毒的IRES、甲型肝炎病毒的IRES、丙型肝炎病毒的IRES、人类鼻病毒的IRES、脊髓灰质炎病毒的IRES、猪水疱病病毒的IRES、马铃薯Y病毒组的芜菁花叶病毒(turnipmosaic potyvirus)的IRES、人成纤维细胞生长因子2mRNA的IRES、鼠疫病毒的IRES、利什曼原虫RNA病毒的IRES、莫洛尼鼠白血病病毒的IRES、人鼻病毒14的IRES、口蹄疫病毒(aphthovirus)的IRES、人免疫球蛋白重链结合蛋白mRNA的IRES、果蝇控制触角的基因的mRNA的IRES(Drosophila Antennapedia mRNA IRES)、人成纤维细胞生长因子2mRNA的IRES、庚型肝炎病毒的IRES、烟草花叶病毒的IRES、血管内皮生长因子mRNA的IRES、B组柯萨奇病毒的IRES、c-myc原癌基因mRNA的IRES、人MYT2mRNA的IRES、人双埃可病毒1型病毒的IRES、人双埃可病毒2型病毒的IRES、真核起始因子4GI mRNA的IRES、小珀椿象(Plautia stali)肠病毒IRES、鼠泰勒氏脑脊髓炎病毒IRES、牛肠道病毒IRES、连接蛋白43mRNA的IRES、同源结构域蛋白Gtx mRNA的IRES、AML1转录因子mRNA的IRES、NF-κB抑制因子mRNA的IRES、X连锁凋亡抑制因子mRNA的IRES、蟋蟀麻痹病毒RNA的IRES、p58(PITSLRE)蛋白激酶mRNA的IRES、鸟氨酸脱羧酶mRNA的IRES、连接蛋白32mRNA的IRES、牛病毒性腹泻病毒IRES、胰岛素样生长因子I受体mRNA的IRES、人类1型免疫缺陷病毒gag基因的IRES、经典型猪瘟病毒IRES、卡波西肉瘤相关疱疹病毒的IRES、选自随机寡核苷酸文库的短IRES、Jembrana病的病毒IRES、凋亡蛋白酶活化因子1mRNA的IRES、禾谷缢管蚜(Rhopalosiphum padi)病毒的IRES、阳离子型氨基酸转运蛋白mRNA的IRES、人胰岛素样生长因子II前导因子2mRNA的IRES(human insulin-like growth factor II leader 2 mRNA IRES)、鞭毛虫病毒的IRES、Smad5 mRNA的IRES、猪捷申病毒-1talfan的IRES、果蝇无毛mRNA的IRES、hSNM1 mRNA的IRES、Cbfa1/Runx2mRNA的IRES、爱泼斯坦巴尔病毒的IRES、芙蓉枯黄环斑病毒的IRES、大鼠垂体后叶加压素V1b受体mRNA的IRES或人hsp70mRNA的IRES。
2.2.可增加在5′端被裂解的外源RNA分子的翻译效率的另外的结构
本部分详述了可增加裂解的外源RNA分子的翻译效率的结构的另外的实施方案,其中所述裂解的外源RNA分子在5′端处的裂解位点被裂解。
根据某些实施方案,外源RNA分子可包含含有紧邻编码外源目的蛋白的序列上游的独特的内部核糖体进入位点(IRES)序列的序列,其中所述独特的IRES序列增加了裂解的外源RNA分子中外源目的蛋白的翻译效率。例如,参见图8A。
在另一个实施方案中,外源RNA分子可包含紧邻编码外源目的蛋白的序列下游的独特的核苷酸序列,其中所述独特的核苷酸序列包含独特的茎-环结构且其中所述独特的茎-环结构可直接或间接地增加裂解的外源RNA分子中外源目的蛋白的翻译效率和外源RNA分子的半衰期。所述独特的茎-环结构可以是,例如但不限于人组蛋白基因3′-UTR的保守茎环结构或其功能性衍生物。人组蛋白基因3′-UTR的保守茎环结构可以是例如,为5′-GGCUCUUUUCAGAGCC-3′(SEQ ID NO.34)。例如,参见图8B。
在另外的实施方案中,外源RNA分子可包含紧邻编码外源目的蛋白的序列的下游的独特的核苷酸序列,其中所述独特的核苷酸序列包含可直接或间接地增加裂解的外源RNA分子中外源目的蛋白的翻译效率和外源RNA分子的半衰期的细胞质多腺苷酸化元件。细胞质多腺苷酸化元件可以是例如,但不限于:5′-UUUUAU-3′(SEQ ID NO.35)、5′-UUUUUAU-3′(SEQ ID NO.36)、5′-UUUUAAU-3′(SEQ ID NO.37)、5’-UUUUUUAUU-3’(SEQ ID NO.38)、5’-UUUUAUU-3’(SEQ ID NO.39)或5′-UUUUUAUAAAG-3′(SEQ ID NO.40)[23]。
在某些实施方案中,本发明的组合物还包含编码人细胞质多腺苷酸化元件结合蛋白(hCPEB)的多核苷酸序列或其用于在任何细胞中表达hCPEB的同源物。例如,参见图8C。
在另外的实施方案中,外源RNA分子可包含位于裂解位点下游和编码外源目的蛋白的序列上游的独特的核苷酸序列,其中所述独特的核苷酸序列能够结合位于编码外源目的蛋白的序列下游的序列。在该实施方案中,裂解的外源RNA分子可产生可增加裂解的所述外源RNA分子中外源目的蛋白的翻译效率的环形结构。例如,参见图8D。
在另一个实施方案中,外源RNA分子可包含位于裂解位点下游和编码外源目的蛋白的序列上游的独特的核苷酸序列。所述独特的核苷酸序列可能够结合能够直接或间接地结合裂解的外源RNA分子中的多聚(A)尾巴的独特多肽。所述独特多肽还可由本发明的组合物编码。在该实施方案中,所述独特多肽和裂解的外源RNA分子可产生可增加裂解的外源RNA分子中所述外源目的蛋白的翻译效率的环形结构。例如,参见图9A。
在另一个实施方案中,本发明的组合物还可包含另外的多核苷酸序列,该另外的多核苷酸序列编码在5′端包含能够结合位于裂解位点下游和编码外源目的蛋白的序列上游的独特的核苷酸序列的另外的RNA分子。该另外的多核苷酸序列的表达可由例如基于聚合酶II的启动子驱动。在某些实施方案中,本发明的组合物还可包含能够直接或间接地影响该另外的RNA分子在所述独特的核苷酸序列下游的位置处的裂解的裂解组分。所述裂解组分可以是例如:
(a)位于所述另外的RNA分子内的独特的核酸序列,其中所述独特的核酸序列可以是但不限于:核酸内切酶识别位点、内源性miRNA结合位点、顺式作用型核酶、回文终止元件或miRNA序列;或
(b)由本发明的组合物编码的独特的抑制性RNA,其中所述独特的抑制性RNA可以是但不限于:微小RNA(miRNA)、套索形式的RNA、短发夹RNA(shRNA)、siRNA表达结构域、反义RNA、双链RNA(dsRNA)、小干扰RNA(siRNA)或核酶。
在该实施方案中,所述另外的RNA分子能可能够结合裂解的外源RNA分子且为其提供可增加裂解的外源RNA分子中所述外源目的蛋白的翻译效率的帽子结构。例如,参见图9B。
在某些实施方案中,可引入vpg识别序列,其中在裂解后,5′裂解端包含vpg识别位点。vpg蛋白可结合vpg识别序列,从而取代帽子。vpg蛋白可由本发明的组合物或由抑制序列的第一ORF编码。
在某些实施方案中,并且不期望被理论或机制束缚地,使用顺式作用型核酶是有利的,因为包含其的另外的RNA分子可自身裂解[15]。顺式作用型核酶可以是例如,但不限于非常有效的顺式作用型锤头状核酶:snorbozyme[15]或N117[16]。参见图10A、10B。
在另一个实施方案中,外源RNA分子还可包含紧邻编码外源目的蛋白的序列上游的核苷酸序列,其中所述核苷酸序列包括可增加裂解的外源RNA分子的降解的茎环结构。在一个实施方案中,所述茎环结构是人组蛋白基因3′-UTR的保守茎环结构(5′-GGCUCUUUUCAGAGCC-3′-SEQID NO.34)或其功能性衍生物。
2.3.可降低完整的外源RNA分子的翻译效率的另外的结构
本部分描述了另外的结构的多种实施方案,其中这些另外的结构可降低完整的外源RNA分子的翻译效率(也就是,在所述外源RNA分子被裂解之前)。
在某些实施方案中,所述组合物还可包含能够直接或间接地实现外源RNA分子在位于抑制序列上游的位置处的裂解的特定裂解组分,其中所述抑制序列位于裂解位点上游。所述特定的裂解组分可以是例如:
(a)位于外源RNA分子内的特定核酸序列,其中所述特定核酸序列可以是例如但不限于:核酸内切酶识别位点、内源性miRNA结合位点、顺式作用型核酶或miRNA序列;或者
(b)由本发明的组合物编码的特定抑制性RNA,其中所述特定抑制性RNA可以是例如但不限于:微小RNA(miRNA)、套索形式的RNA、短发夹RNA(shRNA)、siRNA表达结构域、反义RNA、双链RNA(dsRNA)、小干扰RNA(siRNA)或核酶。
在该实施方案中,所述特定裂解组分可去除完整的外源RNA分子中的帽子结构,以降低完整外源RNA分子中外源目的蛋白的翻译效率。例如,参见图9C。
在另一个实施方案中,位于裂解位点上游的抑制序列还可包含一个或多个起始密码子,其中每个起始密码子和编码外源目的蛋白的序列不在同一读码框内并且其中这些起始密码子中的每一个位于Kozak共有序列内。
3.具有位于裂解位点下游的抑制序列的外源RNA分子的结构
3.1.位于裂解位点下游的抑制序列的结构
根据某些实施方案,外源RNA分子中的抑制序列可位于裂解位点的下游或上游。本部分描述了其中抑制序列位于外源RNA分子中的裂解位点下游的实施方案。例如,参见图3。
在某些实施方案中,位于裂解位点下游的抑制序列可包含例如内含子。外源RNA分子因此可成为降解外源RNA分子的无义介导的衰变(NMD)的靶[29]。例如,参见图11A。
在一个实施方案中,位于裂解位点下游的抑制序列可包含能够结合翻译阻遏蛋白的序列,其中所述翻译阻遏蛋白是内源性翻译阻遏蛋白或由所述组合物编码,并且其中所述翻译阻遏蛋白可直接或间接地降低外源RNA分子内外源目的蛋白的翻译效率[24]。能够结合翻译阻遏蛋白的序列可以是例如包括但不限于结合smaug阻遏蛋白的序列(5′-UGGAGCAGAGGCUCUGGCAGCUUUUGCAGCG-3′)(SEQ ID NO.28)[25]。例如,参见图11B。
在另一个实施方案中,位于裂解位点下游的抑制序列可包含用于亚细胞定位的RNA定位信号(包括,共翻译输入)或内源性miRNA结合位点,其中所述外源RNA分子的亚细胞定位可抑制外源目的蛋白的翻译且可减少外源RNA分子的半衰期。RNA定位信号可包含例如但不限于用于下列的RNA定位信号:髓鞘化外周、髓磷脂区室、线粒体、薄板前缘或核周细胞质[22]。RNA定位信号可以是例如但不限于用于髓鞘化外周的RNA定位信号5′-GCCAAGGAGCCAGAGAGCAUG-3′(SEQ ID NO.29)或5′-GCCAAGGAGCC-3′(SEQ ID NO.30)[27]。例如,参见图11C。
在另一个实施方案中,位于裂解位点下游的抑制序列可包含可刺激外源RNA分子降解的RNA不稳定元件,其中RNA不稳定元件为富含AU的元件(ARE)或核酸内切酶识别位点。富含AU的元件可以是例如,但不限于长度为至少约35个核苷酸的富含AU的元件。富含AU的元件可以是例如,5′-AUUUA-3′(SEQ ID NO.31)、5′-UUAUUUA(U/A)(U/A)-3′(SEQID NO.32)或5′-AUUU-3′(SEQ ID NO.33)[26]。例如,参见图11D。
在另一个实施方案中,位于裂解位点下游的抑制序列可包含能够形成可降低上游外源目的蛋白的翻译效率的二级结构的序列。例如,参见图11E。
在另一个实施方案中,位于裂解位点下游的抑制序列可包含紧邻裂解位点下游的能够结合紧邻裂解位点上游定位的核苷酸序列以形成二级结构的序列。所述二级结构可直接或间接地降低上游外源蛋白的翻译效率。在某些实施方案中,二级结构的折叠自由能可低于-30kcal/mol(例如,-50kcal/mol、-80kcal/mol)且因此该二级结构足以阻碍扫描核糖体到达外源目的蛋白的终止密码子。在另一个实施方案中,所述裂解位点位于单链区域内或二级结构中的环区域内,其中所述单链区域或所述环区域可以是例如,但不限于长度为至少约15个核苷酸的区域。例如,参见图12A。
3.2.可增加在3′端处的裂解位点处被裂解的外源RNA分子的翻译效 率的另外的结构
本部分描述了另外的结构的实施方案,其中这些另外的结构可增加裂解的外源RNA分子的翻译效率,其中所述裂解的外源RNA分子在3′端处的裂解位点处被裂解。
在某些实施方案中,外源RNA分子可包含具有紧邻编码外源目的蛋白的序列上游的独特的内部核糖体进入位点(IRES)序列的序列,其中所述独特的IRES序列可增加裂解的外源RNA分子中外源目的蛋白的翻译效率。例如,参见图12B。
在本发明的另一个实施方案中,外源RNA分子可包含紧邻编码外源目的蛋白的序列下游的独特的核苷酸序列,其中所述独特的核苷酸序列包含独特的茎环结构且其中所述独特的茎-环结构可直接或间接地增加裂解的外源RNA分子的外源目的蛋白的翻译效率和外源RNA分子的半衰期。所述独特的茎环结构可以是例如,但不限于人组蛋白基因3′-UTR的保守茎环结构或其功能性衍生物。人组蛋白基因3′-UTR的保守茎环结构为5′-GGCUCUUUUCAGAGCC-3′(SEQ ID NO.34)。例如,参见图12C。
在本发明的一个实施方案中,在3.1或1部分描述的外源RNA分子可包含紧邻编码外源目的蛋白的序列的下游的独特的核苷酸序列,其中所述独特的核苷酸序列包括可直接或间接地增加裂解的外源RNA分子中外源目的蛋白的翻译效率和外源RNA分子的半衰期的细胞质多腺苷酸化元件。细胞质多腺苷酸化元件可以是例如,但不限于5′-UUUUAU-3′(SEQ IDNO.35)、5′-UUUUUAU-3′(SEQ ID NO.36)、5′-UUUUAAU-3′(SEQ IDNO.37)、5’-UUUUUUAUU-3’(SEQ ID NO.38)、5’-UUUUAUU-3’(SEQ IDNO.39)或5′-UUUUUAUAAAG-3′(SEQ ID NO.40)[23]。本发明的组合物还可包含编码人细胞质多腺苷酸化元件结合蛋白(hCPEB)的多核苷酸序列或其用于在任何细胞中表达hCPEB的同源物。例如,参见图12D。
在某些实施方案中,外源RNA分子可包含位于裂解位点上游和编码外源目的蛋白的序列下游的独特的核苷酸序列,其中所述独特的核苷酸序列能够结合位于编码外源目的蛋白的序列上游的序列。在该实施方案中,裂解的外源RNA分子可产生可增加裂解的外源RNA分子中外源目的蛋白的翻译效率的环形结构。例如,参见图13A。
在另一个实施方案中,外源RNA分子可包含位于裂解位点上游和编码外源目的蛋白的序列下游的独特的核苷酸序列。所述独特的核苷酸序列可能够结合能够直接或间接地结合裂解的外源RNA分子中的帽子结构的独特多肽。所述独特多肽还可由本发明的组合物编码。在该实施方案中,所述独特多肽和裂解的外源RNA分子可产生可增加裂解的外源RNA分子中外源目的蛋白的翻译效率的环形结构。例如,参见图13B。
在另外的实施方案中,本发明的组合物可包含另外的多核苷酸序列,该另外的多核苷酸序列可编码在3′端具有能够结合位于裂解位点上游和编码外源目的蛋白的序列下游的核苷酸序列的另外的RNA分子。所述另外的多核苷酸序列的表达可由基于聚合酶II的启动子驱动。在该实施方案中,所述另外的RNA分子可能够结合裂解的外源RNA分子并为其提供可增加自裂解的外源RNA分子的外源目的蛋白的翻译效率的多聚-A尾巴。例如,参见图13C。
3.3.可降低完整的外源RNA分子的翻译效率的另外的结构
本部分描述了可降低完整的外源RNA分子在其被裂解之前的翻译效率的另外的结构的实施方案。
在某些实施方案中,所述组合物还可包含能够直接或间接地实现外源RNA分子在位于抑制序列下游的位置处的裂解的特定裂解组分,其中所述抑制序列位于裂解位点下游。所述特定的裂解组分可包含例如:
(a)位于所述外源RNA分子内的特定核酸序列,其中所述特定核酸序列可选自,但不限于:核酸内切酶识别位点、内源性miRNA结合位点、顺式作用型核酶或miRNA序列;或者
(b)由本发明的组合物编码的特定抑制性RNA,其中所述特定抑制性RNA可选自例如但不限于:微小RNA(miRNA)、套索形式的RNA、短发夹RNA(shRNA)、siRNA表达结构域、反义RNA、双链RNA(dsRNA)、小干扰RNA(siRNA)或核酶。
在该实施方案中,所述特定裂解组分可去除完整的外源RNA分子中的多聚A尾巴,以降低完整外源RNA分子中外源目的蛋白的翻译效率。例如,参见图13D。
4.阐述以及另外的实施方案
术语“足够的互补性”可包括但不限于能够结合或至少部分地互补。在某些实施方案中,术语足够的互补性在约30-100%的范围内。例如,在某些实施方案中,术语足够的互补性为至少30%的互补性。例如,在某些实施方案中,术语足够的互补性为至少50%的互补性。例如,在某些实施方案中,术语足够的互补性为至少70%的互补性。例如,在某些实施方案中,术语足够的互补性为至少90%的互补性。例如,在某些实施方案中,术语足够的互补性为约100%的互补性。
根据某些实施方案,可插入/引入本发明的组合物的细胞可以是例如但不限于:人细胞、动物细胞、培养的细胞、植物细胞、原代细胞、存在于生物体内的细胞。
在某些实施方案中,裂解外源RNA分子的特异性内源RNA分子可以是例如但不限于:特定细胞类型所特有的微小RNA、赘生性细胞所特有的miRNA、病毒微小RNA或类似RNA。编码病毒miRNA的病毒可选自例如但不限于:双链DNA病毒、单链DNA病毒、双链RNA病毒、双链RNA病毒、单链(正链)病毒、单链(负链)病毒或逆转录病毒。
在某些示例性实施方案中,裂解外源RNA分子的特异性内源miRNA可选自例如,但不限于:miR-17-92、miR-221、miR-222、miR-146、miR-221、miR-21、miR-155、mir675、miR-10b、hsv1-miR-H1、hsv1-miR-H2、hsv1-miR-H3、hsv1-miR-H4、hsv1-miR-H5、hsv1-miR-H6、hsv2-miR-I、hcmv-miR-UL22A、hcmv-miR-UL36、hcmv-miR-UL70、hcmv-miR-UL112、hcmv-miR-UL148D、hcmv-miR-US4、hcmv-miR-US5-1、hcmv-miR-US5-2、hcmv-miR-US25-1、hcmv-miR-US25-2、hcmv-miR-US33、kshv-miR-K12-1、kshv-miR-K12-2、kshv-miR-K12-3、kshv-miR-K12-4、kshv-miR-K12-5、kshv-miR-K12-6、kshv-miR-K12-7、kshv-miR-K12-8、kshv-miR-K12-9、kshv-miR-K12-10a、kshv-miR-K12-10b、kshv-miR-K12-11、kshv-miR-K12-12、ebv-miR-BART1、ebv-miR-BART2、ebv-miR-BART3、ebv-miR-BART4、ebv-miR-BART5、ebv-miR-BART6、ebv-miR-BART7、ebv-miR-BART8、ebv-miR-BART9、ebv-miR-BART10、ebv-miR-BART11、ebv-miR-BART12、ebv-miR-BART13、ebv-miR-BART14、ebv-miR-BART15、ebv-miR-BART16、ebv-miR-BART17、ebv-miR-BART18、ebv-miR-BART19、ebv-miR-BART20、ebv-miR-BHRF1-1、ebv-miR-BHRF1-2、ebv-miR-BHRF1-3、bkv-miR-B1、jcv-miR-J1、hiv1-miR-H1、hiv1-miR-N367、hiv1-miR-TAR、sv40-miR-S1、MCPyV-miR-M1、hsv1-miR-LAT、hsv1-miR-LAT-ICP34.5、hsv2-miR-II、hsv2-miR-III、hcmv-miR-UL23、hcmv-miR-UL36-1、hcmv-miR-UL54-1、hcmv-miR-UL70-1、hcmv-miR-UL22A-1、hcmv-miR-UL112-1、hcmv-miR-UL148D-1、hcmv-miR-US4-1、hcmv-miR-US24、hcmv-miR-US33-1、hcmv-RNAβ2.7、ebv-miR-BART1-1、ebv-miR-BART1-2、ebv-miR-BART1-3、ebv-miR-BHFR1、ebv-miR-BHFR2、ebv-miR-BHFR3、hiv1-miR-TAR-5p、hiv1-miR-TAR-p、hiv1-HAAmiRNA、hiv1-VmiRNA1、hiv1-VmiRNA2、hiv1-VmiRNA3、hiv1-VmiRNA4、hiv1-VmiRNA5、hiv2-miR-TAR2-5p、hiv2-miR-TAR2-3p、mdv1-miR-M1、mdv1-miR-M2、mdv1-miR-M3、mdv1-miR-M4、mdv1-miR-M5、mdv1-miR-M6、mdv1-miR-M7、mdv1-miR-M8、mdv1-miR-M9、mdv1-miR-M10、mdv1-miR-M11、mdv1-miR-M12、mdv1-miR-M13、mdv2-miR-M14、mdv2-miR-M15、mdv2-miR-M16、mdv2-miR-M17、mdv2-miR-M18、mdv2-miR-M19、mdv2-miR-M20、mdv2-miR-M21、mdv2-miR-M22、mdv2-miR-M23、mdv2-miR-M24、mdv2-miR-M25、mdv2-miR-M26、mdv2-miR-M27、mdv2-miR-M28、mdv2-miR-M29、mdv2-miR-M30、mcmv-miR-M23-1、mcmv-miR-M23-2、mcmv-miR-M44-1、mcmv-miR-M55-1、mcmv-miR-M87-1、mcmv-miR-M95-1、mcmv-miR-m01-1、mcmv-miR-m01-2、mcmv-miR-m01-3、mcmv-miR-m01-4、mcmv-miR-m21-1、mcmv-miR-m22-1、mcmv-miR-m59-1、mcmv-miR-m59-2、mcmv-miR-m88-1、mcmv-miR-m107-1、mcmv-miR-m108-1、mcmv-miR-m108-2、rlcv-miR-rL1-1、rlcv-miR-rL1-2、rlcv-miR-rL1-3、rlcv-miR-rL1-4、rlcv-miR-rL1-5、rlcv-miR-rL1-6、rlcv-miR-rL1-7、rlcv-miR-rL1-8、rlcv-miR-rL1-9、rlcv-miR-rL1-10、rlcv-miR-rL1-11、rlcv-miR-rL1-12、rlcv-miR-rL1-13、rlcv-miR-rL1-14、rlcv-miR-rL1-15、rlcv-miR-rL1-16、rrv-miR-rR1-1、rrv-miR-rR1-2、rrv-miR-rR1-3、rrv-miR-rR1-4、rrv-miR-rR1-5、rrv-miR-rR1-6、rrv-miR-rR1-7、mghv-miR-M1-1、mghv-miR-M1-2、mghv-miR-M1-3、mghv-miR-M1-4、mghv-miR-M1-5、mghv-miR-M1-6、mghv-miR-M1-7、mghv-miR-M1-8、mghv-miR-M1-9或sv40-miR-S1[34、35]。各种miRNA分子的命名和序列如数据库http://www.mirbase.org/.所定义的。
根据某些实施方案,由外源RNA分子编码的外源目的蛋白可以是任何类型的蛋白质。例如,外源目的蛋白可选自但不限于:α毒素、皂草素、玉蜀黍RIP、大麦RIP、小麦RIP、玉米RIP、黑麦RIP、亚麻RIP、志贺毒素、志贺样RIP、木鳖子甙、胸苷激酶、美洲商陆抗病毒蛋白、多花白树毒蛋白、假单胞菌外毒素、假单胞菌外毒素A或其修饰形式、蓖麻毒素A链、相思豆毒素A链、白喉毒素片段A或其修饰形式、荧光蛋白、酶(诸如例如,萤光素酶)、结构蛋白或类似蛋白。
在某些实施方案中,所述外源目的蛋白可以是还可影响相邻细胞的毒素。例如,所述毒素可选自但不限于下列的完整形式:蓖麻毒素、相思豆毒素、白喉毒素或其修饰形式。在某些实施方案中,所述外源目的蛋白可以是例如酶,所述酶的产物也可杀死相邻细胞。该酶可以是例如,但不限于:HSV1胸苷激酶。在某些实施方案中,本发明的组合物还可包含前药-更昔洛韦,更昔洛韦是HSV1胸苷激酶的底物。在某些示例性实施方案中,所述酶可以是大肠杆菌胞嘧啶脱氨酶,且所述组合物还可包含前药-5-氟胞嘧啶(5-FC)。
在某些实施方案中,除了所述外源目的蛋白的编码区,编码外源目的蛋白的序列可包含可增加目的蛋白的表达的一个多个内含子。在某些实施方案中,内含子可以是为编码目的蛋白的天然基因的一部分的内含子。在某些实施方案中,内含子可以是无关基因的内含子。在某些实施方案中,外源RNA分子可由任何表达载体编码。例如,所述外源RNA分子可由病毒载体编码且所述外源目的蛋白可以是病毒载体复制所必需的基因的产物,其中所述病毒载体响应于细胞内特异性内源miRNA的存在而复制并在复制过程中杀死所述细胞。病毒载体还可包含,例如,当特定分子(例如,TetR-VP16/多西环素)存在于细胞内时能够终止病毒载体复制的基因。其中当推测病毒载体获得了足以在不包括特异性内源miRNA的细胞中复制的突变时,可施用所述特定分子以终止体内的所有病毒载体复制并然后在体内的大部分病毒载体降解后,可再次施用新的病毒载体。病毒载体还可包括例如,当存在特定前药(例如,胸苷激酶/更昔洛韦)时能够杀死细胞的基因,其中当推测病毒载体获得了足以在不包括特异性内源miRNA的细胞中复制的突变时,可施用该特定前药以杀死体内的所有病毒载体并然后可再次施用新的病毒载体。
在某些示例性实施方案中,外源RNA分子可由能够在复制过程中能够以杀死细胞的方式复制的病毒载体编码。在该实施方案中,特异性内源miRNA不存在于患者的靶细胞(例如,癌细胞)中,而是该特异性内源miRNA存在于患者的大多数正常细胞或非转移性致肿瘤细胞中。在该实例中,外源目的蛋白是毒素例如诸如蓖麻毒素A链、相思豆毒素A链、白喉毒素片段A或其修饰形式。当病毒载体进入正常细胞或非转移性致肿瘤细胞其杀死该细胞,且当病毒载体进入靶细胞(癌细胞)时,其在病毒载体复制过程中杀死癌细胞,因此病毒载体的较大浓度存在于肿瘤区域。该病毒载体还可包括,当特定分子(例如,TetR-VP16/多西环素)存在于细胞内时能够终止病毒载体复制的基因。其中当推测病毒载体获得了足以在包含特异性内源miRNA的细胞中复制的突变时,可施用所述特定分子以终止体内的所有病毒载体的复制并然后在体细胞内的大部分病毒载体降解后,可再次施用新的病毒载体。该病毒载体可包括,当存在特定前药(例如,胸苷激酶/更昔洛韦)时能够杀死细胞的基因,其中当推测病毒载体获得了足以在包含特异性内源miRNA的细胞中复制的突变时,可施用该特定前药以杀死体内的所有病毒载体并然后可再次施用新的病毒载体。
根据某些实施方案,抑制序列可以是一旦与编码外源目的蛋白的序列分离后,则所述外源目的蛋白能够被表达的序列或该序列的一部分。当抑制序列未与编码外源目的蛋白的序列分离时,当其处于其在外源RNA分子中的特定背景时,其能够抑制外源目的蛋白的表达。抑制序列还可只包括上述任何抑制序列的位于其特定环境中的一部分。例如,在分别为--UG-3′或--G-3′的背景下,抑制序列可以是单独的A或5′-AU-3′部分,而不是不符合读码框的(out of reading frame)5’-AUG-3’的抑制序列(也就是,外源RNA分子在5′端包含不符合读码框的5’-AUG-3’,但是将分离的序列只是5′-AU-3′部分)。
在本发明的另一个实施方案中,本发明的组合物还可包含编码能够直接或间接地抑制内源性核酸外切酶表达的特定功能性RNA的多核苷酸序列。所述特定功能性RNA可以是例如但不限于:微小RNA(miRNA)、套索形式的RNA、短发夹RNA(shRNA)、siRNA表达结构域、反义RNA、双链RNA(dsRNA)、小干扰RNA(siRNA)或核酶。
在本发明的另一个实施方案中,上述结合位点可以是针对相同或不同miRNA的多个结合位点,使得其中所述“裂解位点上游”还包括“所有裂解位点上游”。同样地,其中所述“裂解位点下游”还包括“所有裂解位点下游”。在某些实施方案中,当所述多个结合位点针对不同的内源性miRNA时,即使细胞内仅存在一种miRNA,外源目的蛋白可被表达。例如,参见图14A、14B、14C、14D。
在本发明的某些实施方案中,外源RNA分子还可包含针对特异性内源miRNA的一个或多个另外的结合位点,其中所述一个或多个另外的结合位点具有通过RNA干扰使特异性内源miRNA指导外源RNA分子在独特的裂解位点处裂解的足够的互补性。每一个独特的裂解位点可位于每一个另外的结合位点内且每一个独特的裂解位点可位于编码所述外源目的蛋白的序列上游。外源RNA分子还可包含所有独特的裂解位点上游的一个或多个起始密码子,其中每一个起始密码子和编码外源目的蛋白的序列不在同一读码框内。例如,起始密码子可主要由5′-AUG-3′组成,其中至少一个起始密码子位于Kozak共有序列或任何其他翻译起始元件内。起始密码子可以是例如TISU元件[38]。根据某些实施方案,在将所述组合物引入到包含特异性内源miRNA的细胞中后,外源RNA分子可被转录并被所述特异性内源miRNA在裂解位点和每一个独特的裂解位点处裂解,使得编码外源目的蛋白的序列与抑制序列分离,并与每一个起始密码子分离,并且外源目的蛋白能够被表达。例如,参见图15A。
在某些实施方案中,本发明的组合物还可包含能够直接或间接地实现位于外源RNA分子在每一个起始密码子上游的位置处的裂解的裂解组分,其中所述裂解组分是例如:
(a)位于所述外源RNA分子内的核酸序列,其中所述核酸序列为:核酸内切酶识别位点、内源性miRNA结合位点、顺式作用型核酶或miRNA序列;或者
(b)由所述组合物编码的抑制性RNA,其中所述抑制性RNA是:微小RNA(miRNA)、套索形式的RNA、短发夹RNA(shRNA)、siRNA表达结构域、反义RNA、双链RNA(dsRNA)、小干扰RNA(siRNA)或核酶。例如,参见图15B。
根据某些实施方案,本发明的组合物可包含一种或多种多核苷酸分子,诸如例如DNA分子、RNA分子或二者。在一个实施方案中,所述组合物可包含用于仅在细胞内存在特异性内源miRNA分子时在细胞内表达外源目的蛋白的DNA分子,其中所述特异性内源miRNA可以是例如细胞的miRNA、病毒miRNA或类似miRNA。所述DNA分子可包含编码外源RNA分子的多核苷酸序列,所述外源RNA分子是包含下列的RNA分子:编码外源目的蛋白的序列、编码外源目的蛋白的序列的上游的针对特异性内源miRNA的结合位点、编码外源目的蛋白的序列的下游的针对特异性内源miRNA的另外的结合位点、和至少两个抑制序列-一个位于所述外源RNA分子的5′端而另一个位于所述外源RNA分子的3′端,其中每一个抑制序列能够抑制外源目的蛋白的表达。因此,仅在细胞中存在特异性内源miRNA时,所述两个抑制序列可与编码外源目的蛋白的序列分离,并且外源目的蛋白能够在细胞内表达。这些抑制序列可以是上述序列中的任何一种。例如,参见图15C。
根据另外的实施方案,所述组合物可包含用于仅在细胞内存在两种特异性内源miRNA时在所述细胞中表达外源目的蛋白的DNA分子。所述DNA分子可包含编码外源RNA分子的多核苷酸序列,所述外源RNA分子是包含下列的RNA分子:编码外源目的蛋白的序列、编码外源目的蛋白的序列上游的针对第一特异性内源miRNA的结合位点、编码外源目的蛋白的序列下游的针对第二特异性内源miRNA的另一个结合位点和至少两个抑制序列-一个位于所述外源RNA分子的5′端而另一个位于所述外源RNA分子的3′端。每一个抑制序列可能够抑制外源目的蛋白的表达,使得当细胞中存在两种特异性内源miRNA时,所述两个抑制序列可与编码外源目的蛋白的序列分离,并且外源目的蛋白可能够在细胞内表达。这些抑制序列可以是上述序列中的任何一种。例如,参见图15D。
根据另外的实施方案,当需要仅在细胞中同时存在多种不同的miRNA时才表达外源目的蛋白时,本发明的组合物可包含或编码多种外源RNA分子,其中每一种外源RNA分子的结构可为如上所述的。所述外源RNA分子可相似或不同。这些外源RNA分子中的每一个可包含不同的miRNA结合位点和编码不同的目的蛋白的不同序列,其中所有这些不同的目的蛋白可一起在细胞中产生新的功能。例如,当所述多种不同的miRNA包括三种不同的miRNA时,由三种不同的外源RNA分子表达的三种不同的目的蛋白可选自:保护性抗原(PA)、水肿因子(EF)和致死因子(LF),其中当细胞中同时存在所述三种不同的miRNA时,这3种蛋白:保护性抗原(PA)、水肿因子(EF)和致死因子(LF)表达并且一起产生可引起细胞死亡的炭疽毒素。
在另一个实施方案中,外源RNA分子还可在裂解位点和编码外源目的蛋白的序列之间具有用于亚细胞定位(包括共翻译输入)的RNA定位信号,其中抑制序列能够抑制用于亚细胞定位的RNA定位信号的功能并且其中所述外源RNA分子的亚细胞定位是外源目的蛋白的正确表达所必需的。例如,参见图16A、16B。
在另外的实施方案中,抑制序列可包含裂解位点上游的起始密码子,其中所述起始密码子主要由5′-AUG-3′组成。抑制序列还可包含编码紧邻起始密码子下游的氨基酸序列的核苷酸序列,其中所述核苷酸序列和编码外源目的蛋白的序列处于同一读码框内。所述氨基酸序列可能够抑制用于外源目的蛋白的亚细胞定位的分选信号的功能,其中外源目的蛋白的亚细胞定位是其正确表达所必需的,例如,参见图16C。
在本发明的另一个实施方案中,外源RNA分子不包括编码外源目的蛋白的序列下游的终止密码子。所述抑制序列可位于编码外源目的蛋白的序列下游,其中所述抑制序列和编码外源目的蛋白的序列在同一读码框内,且所述抑制序列编码选自由下列组成的组的氨基酸序列:
(a)能够抑制外源目的蛋白的功能的氨基酸序列;
(b)为用于亚细胞定位的分选信号的氨基酸序列;
(c)为蛋白降解信号的氨基酸序列;
(d)能够抑制用于外源目的蛋白的亚细胞定位的分选信号的功能的氨基酸序列;和
(e)能够抑制由位于裂解位点和编码外源目的蛋白的序列的起译密码子之间的核苷酸序列编码的肽序列的裂解的氨基酸序列,其中所述核苷酸序列和编码外源目的蛋白的序列处于同一读码框内并且其中所述肽序列能够被哺乳动物细胞中的蛋白酶裂解。(还已报道在人细胞中,在翻译不含终止密码子的截短的mRNA期间,核糖体停在终止密码子处而相关tRNA分子仍保持与多肽链和核糖体结合,但是,在翻译过程的中间,肽基-tRNA物质被内质网信号肽酶加工是可能的[32])。例如,参见图16D。
5.本发明的组合物的合成
根据某些实施方案,且如上文详述的,所述组合物可包含包括或编码外源RNA分子的一种或多种多核苷酸分子。所述多核苷酸分子可以是一种或多种DNA分子、一种或多种RNA分子、或其组合。在某些示例性实施方案中,所述组合物可包含编码外源RNA分子的一种或多种DNA分子。编码外源RNA分子的DNA分子可被重组构建成还可提供DNA的大规模复制且包含指导外源RNA分子的转录所必需的元件的多种宿主载体系统/构建体。将这些载体引入靶细胞中导致细胞内足量外源RNA分子的转录。例如,可将载体引入体内使得其被细胞所吸收并指导外源RNA分子的转录。该载体可保持为游离的或被染色体整合,只要其可转录产生期望的外源RNA分子。这些载体可通过本领域熟知的重组DNA技术方法构建或可通过本领域已知的用于合成DNA分子的任何方法制备。
根据某些实施方案,编码外源RNA分子的重组DNA构建体可包括例如质粒、黏端质粒、病毒载体或本领域已知的用于在期望的靶细胞(诸如,例如哺乳动物细胞(例如,人细胞、鼠细胞)、鸟类细胞、植物细胞及类似的细胞)中复制和表达的任何其他载体。外源RNA分子的表达可通过本领域已知的在期望的靶细胞中发挥作用的任何启动子调节。这些启动子可以是诱导性或组成性的。这些启动子包括,例如但不限于:SV40早期启动子区域、劳斯肉瘤病毒的3′长末端重复区中包含的启动子、疱疹胸苷激酶的启动子、金属硫蛋白基因的调控序列、病毒CMV启动子、人绒毛膜促性腺素-β启动子等。在某些实施方案中,启动子可以是RNA聚合酶I的启动子(即,被RNA Pol.I识别的启动子)诸如,例如核糖体DNA(rDNA)基因的启动子。在这些实施方案中,外源目的RNA分子的终止信号可以是RNA Pol.I终止信号或RNA聚合酶II终止信号(诸如例如,多聚A信号)。任何类型的质粒、黏端质粒、YAC或病毒载体可用来制备可被直接引入靶细胞/细胞群或组织部位的重组DNA构建体。可选择地,可以使用选择性地感染期望的靶细胞的病毒载体。
根据某些实施方案,对于抵抗病毒感染或癌症的转基因生物体的形成,期望编码外源RNA分子的载体将具有选择标志。可使用几种选择系统,包括但不限于对单纯疱疹病毒胸苷激酶、次黄嘌呤-鸟嘌呤磷酸核糖基转移酶和腺嘌呤磷酸核糖基转移酶蛋白质分别在tk-、hgprt-或aprt-缺陷型细胞中的表达的选择。另外,抗代谢物抗性可用作提供对氨甲喋呤的抗性的二氢叶酸转移酶(dhfr)、提供对霉酚酸的抗性的黄嘌呤-鸟嘌呤磷酸核糖基转移酶(gpt)、提供对氨基糖苷G-418的抗性的新霉素(neo)和提供对潮霉素的抗性的潮霉素B磷酸转移酶(hygro)的选择的基础。
根据某些实施方案,用于本发明的实践中的载体可以是任何表达载体。在某些示例性实施方案中,外源RNA分子由病毒表达载体编码。病毒表达载体可选自,但不限于:疱疹病毒科(Herpesviridae)、痘病毒科(Poxyiridae)、腺病毒科(Adenoviridae)、乳头瘤病毒科(Papillomaviridae)、微小病毒科(Parvoviridae)、肝脱氧核糖核酸病毒科(Hepadnoviridae)、逆转录病毒科(Retroviridae)、呼肠孤病毒科(Reoviridae)、纤丝病毒科(Filoviridae)、副粘病毒科(Paramyxoviridae)、肺病毒科(Pneumoviridae)、弹状病毒科(Rhabdoviridae)、正粘病毒科(Orthomyxoviridae)、本扬病毒科(Bunyaviridae)、汉坦病毒科(Hantaviridae)、小核糖核酸病毒科(Picornaviridae)、杯状病毒科(Caliciviridae)、披膜病毒科(Togaviridae)、黄病毒科(Flaviviridae)、沙粒病毒科(Arenaviridae)、冠状病毒科(Coronaviridae)、或丙型肝炎病毒属(Hepaciviridae)。病毒表达载体还可包括但不限于其细胞趋向性已通过取代被暴露于纤维表面的纤维蛋白的腺病毒末端结状结构域(HI环)而被改变的腺病毒载体。
在某些实施方案中,本发明的组合物可包含一种或多种RNA分子,所述一种或多种RNA分子可以是例如单链或双链的内源性RNA分子本身或其衍生物或修饰形式。外源RNA分子可具有诸如但不限于以下的核苷酸:脱氧核糖核苷酸、核糖核苷酸、磷酸二酯键、修饰的键或除了五种生物学上存在的碱基(腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶和尿嘧啶)以外的碱基。
根据某些实施方案,外源RNA分子可通过本领域已知的用于合成RNA分子的任何方法制备。例如,外源RNA分子可使用市售的试剂和合成仪通过本领域熟知的方法化学合成。可选择地,外源RNA分子可通过体外和体内转录编码外源RNA分子的DNA序列产生。这些DNA序列可被整合到整合了合适的RNA聚合酶启动子例如T7或SP6聚合酶启动子的各种各样的载体中。外源RNA分子可通过使用质粒例如SPS65体外转录高产量地产生。另外,RNA扩增方法例如Q-β扩增可用来产生外源RNA分子。
在某些实施方案中,外源RNA分子或编码外源RNA分子的DNA分子可在例如碱基部分、糖部分或磷酸骨架处被修饰,以改善分子的稳定性、杂交、向细胞内的运输以及类似的特征。另外,可进行修饰以减少对核酸酶降解的易感性。外源RNA分子或编码该外源RNA分子的DNA分子可具有其他侧基例如肽(例如,用于体内靶向宿主细胞受体)或有助于穿过细胞膜或血脑屏障运输的剂、杂交触发的裂解剂或嵌入剂。可引入多种其他熟知的修饰作为增加细胞内稳定性和半衰期的手段。可能的修饰包括但不限于,向分子的5′和/或3′端添加核糖核苷酸或脱氧核糖核苷酸的侧翼序列。在其中期望增加的稳定性的一些情况下,可优选具有修饰的核苷酸间键例如2′-O-甲基化的核酸。包含修饰的核苷酸间键的核酸可使用本领域熟知的试剂和方法合成。
根据另外的实施方案,外源RNA分子或编码外源RNA分子的DNA分子可通过如本领域熟知的任何合适的手段(诸如,例如反相色谱或凝胶电泳)纯化。
在某些实施方案中,产生编码外源RNA的病毒载体的细胞也可用于被移植到患者体内以持续治疗。这些细胞可携带可在血液中存在特定分子(例如,HSV1胸苷激酶/更昔洛韦)时引发其死亡的特定基因。
在某些实施方案中,外源RNA分子可以是RNA分子或复制性RNA分子。复制性RNA分子是包含与外源RNA分子互补的序列的RNA分子,其中所述复制性RNA分子能够在细胞内复制以形成所述外源RNA分子。
6.本发明的组合物的用途和施用
根据某些实施方案,本发明的组合物可具有多种不同的应用包括例如,但不限于:调控基因表达,靶向细胞死亡,治疗各种病症和疾患诸如例如:治疗增生性疾患例如癌症、治疗传染病例如HIV,形成转基因生物体、自杀基因疗法以及类似的应用。所述组合物可用在不同的生物体上,诸如例如,哺乳动物(例如人、鼠)、鸟类、植物及类似的生物体。所述组合物可用在不同的细胞(培养的和/或体内的)、组织、器官和/或生物体的身体上。
在某些实施方案中,本发明的组合物可用来在表达为病毒miRNA的特异性内源miRNA的细胞中表达和/或活化毒性基因,以杀死表达该病毒miRNA的癌细胞或以杀死病毒感染的细胞。在本发明的另一个实施方案中,本发明的组合物可用来在包含致癌性miRNA(在癌细胞中被强烈上调的miRNA)作为特异性内源病毒miRNA的细胞中表达和/或活化毒性基因,以杀死这些细胞。
在某些实施方案中,本发明的组合物可用来在病毒miRNA或致癌性miRNA的存在下表达和/或活化报告基因以诊断疾病如病毒感染或癌症。在另一个实施方案中,稳定地转染了编码外源RNA分子的载体的细胞可用于形成抵抗病毒感染或癌症的转基因生物体。在另一个实施方案中,本发明的组合物可用来稳定地转染细胞,所述细胞用于形成能够在病毒miRNA的存在下活化报告基因以诊断病毒感染性疾病的转基因生物体。在又一个实施方案中,本发明的组合物可用来实时地监测细胞中miRNA的功能并用于诊断涉及细胞内形成miRNA或miRNA上调的疾病(例如,癌症和病毒感染)。
根据某些实施方案,多种递送系统是已知的并可用来将本发明的组合物转移到细胞中,诸如例如,包封在脂质体、微粒、微胶囊中、能够表达所述组合物的重组细胞、受体介导的内吞、将本发明的组合物构建为病毒载体或其他载体的一部分、能够被复制而在复制过程中不杀死细胞并且包含本发明的组合物的病毒载体、不能复制且包含本发明的组合物的病毒载体、注射产生包含本发明的组合物的病毒载体的细胞、注射DNA、电穿孔、磷酸钙介导的转染以及类似方法,或本领域已知的或未来待开发的任何其他方法。
根据某些实施方案,并且不期望被理论或机制束缚地,本发明的组合物和方法可在细胞中提供特定且靶向的“全部或无(all or none)”反应。换句话说,本发明的组合物和方法使得外源RNA分子仅在包括特异性内源miRNA的靶细胞中被裂解(并且因此,表达并活化外源目的蛋白),而不包括所述内源性miRNA的细胞将不能被本发明的组合物所作用。因此本发明的组合物和方法可提供增加的安全性和控制,因为在不包括所述内源性miRNA的细胞中没有观察到外源目的蛋白的遗漏表达(leakiness ofexpression)。
根据某些实施方案,提供了用于杀死特定细胞群的方法,其中所述细胞群包含独特且对这些细胞特异的特异性内源miRNA;所述方法包括将本发明的组合物引入细胞,其中所述组合物包含用于仅在表达特异性内源miRNA细胞中指导外源目的蛋白表达的一种或多种多核苷酸,其中所述一种或多种多核苷酸包括或编码包含下列的外源RNA分子:编码外源目的蛋白的序列;能够抑制外源目的蛋白的表达的抑制序列;以及针对所述特异性内源miRNA的结合位点。
根据某些实施方案,所述外源目的蛋白可以是可破坏细胞功能并因此导致细胞死亡的任何类型的蛋白质。所述蛋白质可选自诸如,但不限于以下类型的蛋白质:毒素、细胞生长抑制剂、细胞生长调节剂、细胞信号通路抑制剂、细胞信号通路调节剂、细胞通透性调节剂、细胞过程调节剂(modulators of cellular processes)及类似的蛋白质。
根据某些实施方案,提供了载体,诸如例如表达载体(病毒载体或非病毒载体),所述表达载体包含编码外源RNA分子的一种或多种多核苷酸序列,其中所述外源RNA分子包括编码外源目的蛋白的序列;能够抑制所述外源目的蛋白表达的抑制序列;以及针对特异性内源miRNA的结合位点。针对所述特异性内源miRNA的结合位点与该特异性内源miRNA内的某序列具有当将所述载体引入到包含特异性内源miRNA的细胞中时,使所述特异性内源miRNA指导所述外源RNA分子在裂解位点裂解的足够的互补性。所述裂解位点可位于针对特异性内源miRNA的结合位点内,且另外,所述裂解位点位于抑制序列和编码所述外源目的蛋白的序列之间。在某些实施方案中,所述一种或多种多核苷酸序列是DNA序列。在某些实施方案中,所述一种或多种多核苷酸序列是RNA序列。如本领域已知的,载体还可包含该载体的操作所需要的多种其他多核苷酸序列(诸如,例如,调控序列、非编码序列、结构序列以及类似序列)。
根据另外的实施方案,本发明还提供了包含有效量的本发明的组合物和药学上可接受的运载体(carrier)的药物组合物。术语“药学上可接受的”是指被联邦或州政府的监管机构批准或在美国药典或其他公认的药典中被列为用于动物且更特别地人中。术语“运载体”指与治疗剂一起施用的稀释剂、佐剂、赋形剂或媒介物。
根据某些实施方案,所述药物组合物可通过已知的任何施用途径,诸如例如,但不限于:经肠、肠胃外、注射、局部及类似途径对需要的受治疗者施用。在某些实施方案中,可期望对需要治疗的靶区域局部地施用本发明的药物组合物。这可通过例如且不限于:手术期间的局部输注、局部敷用(例如,与手术后的伤口敷料结合)、通过注射、通过导管、通过栓剂或通过植入物实现,所述植入物是有孔的、无孔的或凝胶材料,包括膜例如硅橡胶膜(sialastic membranes),或纤维。局部施用还可通过控释药物递送系统,例如纳米颗粒、基质例如控释聚合物或水凝胶实现。
在某些实施方案中,本发明的组合物可以以在靶细胞/组织中有效地产生期望作用的量施用。本发明的组合物的有效剂量可通过本领域技术人员熟知的解答诸如生物半衰期、生物利用率和毒性的参数的程序确定。本发明的组合物的有效量取决于被治疗的疾病或疾患的性质且可通过标准临床技术确定。另外,体外测定可任选地用来帮助确定最佳剂量范围。施用方法还可包括但不限于对患者的血流持久或连续地注射本发明的组合物。
在某些实施方案中,可对多种生物体诸如例如,哺乳动物、鸟类、植物及类似生物体施用所述组合物和包含所述组合物的药物组合物。例如,可对人和动物施用所述组合物和包含所述组合物的药物组合物。
在另外的实施方案中,本发明还提供了包含填充有本发明的药物组合物的一种或多种成分的一种或多种容器的药包或药盒,与所述容器可选地连接的可以是由监管药物或生物制品的制造、使用或销售的政府机构规定的形式的告示,该告示反映了得到机构针对人或动物施用的制造、使用或销售的许可。
实施例
下列实施例被示例性而非限制性地提供并且是本发明的最佳实施方案的实施例。
实施例1-由外源RNA编码的外源目的蛋白的特异性表达
实施例1中描述的实验的常规操作方法:
在转染前一天,将每孔约120,000个T293细胞接种在24孔板中,在转染当天用下列共转染每个孔:
1.海肾(renila)/萤光素酶质粒-170ng表达海肾萤光素酶基因&萤火虫萤光素酶基因的质粒(质粒E11,Psv40-内含子-MCS-RLuc---Phsvtk-Fluc,SEQ ID NO:22,或质粒E65,Psv40-内含子-Tsp-TD1-TLacZ-RLuc-PTS-60ATG---Phsvtk-Fluc,SEQ ID NO.23)。
2.被测试的质粒=30ng被测试的质粒(如下文详述的)。
3.siRNA+或siRNA-=10皮摩尔可诱导由被测试的质粒编码的mRNA裂解的siRNA双链分子(siRNA+)或不诱导由被测试的质粒编码的mRNA裂解的siRNA双链分子(siRNA-)。(下文详述)。
使用lipofectamine2000转染试剂(Invitrogen)根据厂家说明进行转染。转染后48小时,使用双重萤光素酶报告测定试剂盒(Promega)和光度计(glomax20/20promega)测量海肾萤光素酶基因的表达,并确定相对光单位(RLU)。
被测试的质粒可以是任何类型的下列质粒:
阴性对照=不编码白喉毒素(DTA)的质粒;
阳性对照=组成性地编码白喉毒素(DTA)的质粒;
受试质粒=本发明的组合物的质粒,即在抑制序列和编码白喉毒素(DTA)的下游序列之间包含针对siRNA+的靶位点的质粒。对于受试质粒,当共转染的siRNA+裂解受试质粒的抑制序列时,白喉毒素能够被表达并杀死表达白喉毒素的细胞从而-减少海肾萤光素酶的表达和总的RLU测量值。
用2种不同的siRNA+并用2种不同的siRNA-分别测试被测试的质粒,并各自一式三份。
结果如下计算:
活化倍数=在2种siRNA-中的每一种和受试质粒的存在下测量的RLU(相对光单位)平均值(6孔)除以使用siRNA+中的一种和受试质粒的RLU平均值(3孔)。
遗漏倍数=使用所有siRNA-/+和阴性对照质粒的RLU平均值除以使用2种siRNA-中的每一种和受试质粒的RLU平均值。
siRNA+/-RLU=在一种共转染的siRNA+的存在下或两种共转染的siRNA-的存在下独立地测定的RLU平均值。
使用分子生物学领域中使用的常见且已知的方法构建这些质粒。用于本文以下描述的构建质粒的骨架载体是:psiCHECKTM-2载体(promega,目录号C8021)或pcmv6-A-GFP(OriGene,目录号PS100026)。如下文关于这些受试质粒进一步详述的,每个质粒的附加名称表示该质粒序列内包含的序列。
siRNA序列:
1.RL双链体(Dharmacon,目录号P-002070-01-20)(SEQ ID NO.65(有义链)和SEQ ID66(反义链))。
2.GFP双链体II(Dharmacon,目录号P-002048-02-20),(SEQ IDNO.67(有义链)和SEQ ID NO.68(反义链))。
3.siRNA-对照(Sigma,目录号VC30002000010),(SEQ ID NO.69(有义链)和SEQ ID NO.70(反义链))。
4.抗βGal siRNA-1((靶位点:Tlacz(SEQ ID NO.71)),Dharmacon,目录号P-002070-01-20)(SEQ ID NO.72(有义链)和SEQ ID NO.73(反义链))。
5.萤光素酶GL3双链体((靶位点:Tfluc(SEQ ID NO.74)),Dharmacon,目录号D-001400-01-20),(SEQ ID NO.75(有义链)和SEQ IDNO.76(反义链))。
6.GFP双链体I((靶位点:TD1,(SEQ ID NO.77)),Dharmacon,目录号P-002048-01-20),(SEQ ID NO.78(有义链)和SEQ ID NO.79(反义链))。
7.TCTL((靶位点:TCTL(SEQ ID NO.80)),SEQ ID NO.81(有义链)和SEQ ID NO.82(反义链))。
在每个实验中,具有受试质粒中的靶位点的siRNA被用作siRNA+,而没有被测试的质粒中对应的靶位点的其他siRNA被用作siRNA-。
阴性对照质粒:
1.E34(SEQ ID NO.10)-Pcmv-4ORF∧-TD1-Tfluc---Psv40-TGFP。
2.E71(SEQ ID.NO.17)-Psv40-内含子-4ORF∧---Phsvtk-Fluc。
3.E38-3CARz-4S&L。在pacI和XhoI限制性位点之间将插入物E38(SEQ ID.NO.19)连接到PMK穿梭载体(GeneArt)中。
阳性对照质粒:
1.E28(SEQ ID.NO.11)-Pcmv-Tfluc-TD1-cDTAWT---Psv40-TGFP.
2.E20(SEQ ID.NO.12)-Pcmv-nsDTA---Psv40-TGFP
3.E70(SEQ ID.NO.13)-Psv40-内含子-cDTAWT---Phsvtk-Fluc
4.E3(SEQ ID.NO.14)-Pcmv-KDTA---Psv40-TGFP
5.E89(SEQ ID.NO.15)-Pcmv---DT∧A---Psv40-TGFP
6.E110(SEQ ID.NO.16)-Pcmv-D5∧TA---Psv40-TGFP
7.E4(SEQ ID.NO.18)-Pcmv-KDTA---Psv40-Hygro
8.E10(SEQ ID.NO.20)-Pef1-DTA24---ZEO::GFP-Pcmv
9.E143(SEQ ID.NO.21)-3多聚A-Prp119-cDTAWT---Phsvtk-Fluc
受试质粒
1.E80(SEQ ID.NO.1)-Pcmv-4ORF∧-TD1-Tfluc-S-cDTAWT---Psv40-TGFP(pCMV启动子(SEQ ID NO.1的nt.420-938);4ORF∧=4个连续的ORF中由下列组成的抑制序列:9个TISU序列和57个kozak序列,相邻ATG密码子之间为57、57、36、36、21、21、21和21nt(SEQ ID NO.1的nt1027-3547)。第一ORF(SEQ ID NO.1的nt.1031-1651)为621nt&从TISU(SEQ ID NO.1的nt.1027-1038)翻译,且接下来的3个ORF∧(SEQ IDNO.1的nt.1662-2996、nt.2306-2941和nt2951-3547)从Kozak序列翻译。最后一个ORF(SEQ ID NO.1的nt2951-3547)在野生型DTA的编码序列(cDTAwt=不含启动子/剪接/终止/多聚A位点且含有Kozak序列的wt DTA编码序列(SEQ ID NO.1的nt3568-4155)之前终止;接下来是SV40启动子控制下的TGFP编码序列。该质粒还包含靶位点TD1(SEQ ID NO.77)和Tfluc(SEQ ID NO.74)。
2.E54(SEQ ID.NO.2)-Pcmv-4CARZ-PTS-60ATG∧-3ORF∧-TD1-Tfluc-incDTAWT---Psv40-TGFP(pCMV启动子(SEQ ID NO.2的核苷酸(nt.)420-938);4CAR=4个顺式作用核酶(SEQ ID NO.2的nt.1013-1373,);PTS=过氧化物酶体靶向信号(SEQ ID NO.2的nt.1420-1500);60ATG∧=61ATG,46个在Kozak序列内,几乎每两个ATG之间隔53nt(SEQ ID NO.2的nt.1534-4554),且终止密码子在DTA编码序列(SEQ ID NO.2的nt.6745-7332)内;psv40启动子(SEQ ID.NO.2的nt.8092-8399)控制下的TGFP编码序列(SEQ ID NO.2的nt.8452-9143)。该质粒还包含靶位点TD1(SEQID NO.77)和Tfluc(SEQ ID NO.74)。
3.E113(SEQ ID.NO.3)-Pcmv-4ORF∧-TD1-Tfluc-PK-D5∧TA---Psv40-TGFP(pCMV启动子(SEQ ID NO.3的nt.420-938);4ORF∧(SEQ ID NO.3的nt.1027-3547);PK=假结(pseudoknot)-茎和环,其中环的6nt与DTA的起译密码子杂交(SEQ ID No.3的nt3561-3611);5∧=5个位于DTA的编码序列(SEQ ID NO.3的nt.3609-3806内且包含用于使RNA聚合酶1和/或3的转录终止的富含T的序列的人内含子(SEQ ID NO.3的nt.3712-3801、3856-3960、4066-4173、4380-4519和4617-4783),这些内含子嵌入在cDTAwt编码序列中;psv40启动子(SEQ ID NO.3的nt.5546-5853)控制下的TGFP编码序列(SEQ ID NO.3的nt5906-6597)。该质粒还包含靶位点TD1(SEQ ID NO.77)和Tfluc(SEQ ID NO.74)。
4.E91(SEQ ID.NO.4)-Pcmv-4ORF∧-TD1-Tfluc-DT∧A---Psv40-TGFP(pCMV启动子(SEQ ID NO.4的nt.420-938),4ORF∧(SEQ ID NO.4的nt.1027-3507);DT∧A=含有来自人胶原蛋白16A1基因的内含子且不含启动子/剪接/多聚A信号的kozak DTA(SEQ ID NO.4的nt.3520-4444);pSV40启动子(nt.5184-5491)控制下的TGFP编码序列(SEQ ID NO.4的nt.5544-6235)。该质粒还包含靶位点TD1(SEQ ID NO.77)和Tfluc(SEQ IDNO.74)。
5.E112(SEQ ID.NO.5)-Pcmv-4ORF∧-2xTLacZin内含子-8X[TCTL+TD1]-PK-D5∧TA---Psv40-TGFP(pCMV启动子(SEQ ID NO.5的nt.420-938),4ORF∧(SEQ ID NO.5的nt.1027-3436);2xTLacZin内含子=市售质粒pSELECT-GFPzeo-LacZ的内含子中的2个TLacZ靶(SEQID NO.5的nt.3438-3638);8X[TCTL+TD1](SEQ ID NO.5的nt.3647-4052);PK=假结-茎和环,其中环的6nt与DTA的起译密码子杂交(SEQ ID NO.5的nt4059-4109);5∧=5个位于DTA的编码序列(SEQ IDNO.5的nt.4107-5304内且包含用于使RNA聚合酶1和/或3的转录终止的富含T的序列的人内含子(SEQ ID NO.5的nt.4210-4299、4354-4458、4564-4671、4878-5017和5115-5281),这些内含子嵌入在cDTAwt编码序列中;pSV40启动子(SEQ ID NO.5的nt.6044-6351)控制下的TGFP编码序列(SEQ ID NO.5的nt6404-7095)。该质粒还包含8个拷贝的靶位点TD1(SEQ ID NO.77)、TCTL(SEQ ID NO.80)和2个拷贝的TLacZ(SEQ IDNO.71)。
6.E87(SEQ ID.NO.6)-Pcmv-4ORF∧-TD1-3TLacZ-Tctl-BGlob-25G-XRN1S&L-DT∧A---Psv40-TGFP(pCMV启动子(SEQ ID NO.6的nt.420-938);4ORF∧(SEQ ID NO.6的nt.1027-3430);BGlob=加帽子的β球蛋白5’截短末端(SEQ ID NO.6的nt.3577-3655)。25G=25个连续的G核苷酸段(SEQ ID NO.6的nt.3660-3684),所述段可阻碍/干扰XRN核糖核酸外切酶;XRN1S&L=可阻碍XRN1核糖核酸外切酶的黄热病毒3’UTR的茎和环结构(SEQ ID NO.6的nt.3687-3767)。DT∧A=含有来自人胶原蛋白16A1基因的内含子且不含启动子/剪接/多聚A信号的kozak DTA(SEQID NO.6的nt.3787-4711);psv40启动子(SEQ ID NO.6的nt.5811-6502)控制下的TGFP编码序列(SEQ ID NO.6的nt6404-7095)。该质粒还包含TD1(SEQ ID NO.77)、3拷贝的TLacz(SEQ ID NO.71)和TCTL靶位点(SEQID NO.80)。
7.E123(SEQ ID.NO.7)-Psv40-内含子-4ORF∧-3X[TD1-TLacZ]-4PTE-SV40内含子-HBB-DTA---Phsvtk-Fluc(pSV40启动子(SEQ ID NO.7的nt.7-419),4ORF∧=4个连续的ORF中的9个TISU序列和57个kozak序列,相邻的ATG密码子之间为57、57、36、36、21、21、21和21nt(SEQ ID NO.7的nt722-2387);4PTE=回文终止元件的4种茎和环结构(SEQ ID NO.7的nt.3318-3473)。SV40内含子=SV40小t抗原的内含子(SEQ ID NO.7的nt.3505-3596);HBB=不含ATG且包括其第一内含子的血红蛋白βmRNA(SEQ ID NO.7的nt.3627-4406);cDTAwt编码序列(SEQ ID NO.7的nt.4431-5014);HSKVK启动子(SEQ ID NO.7的nt.5106-5858)和萤火虫萤光素酶编码序列(SEQ ID NO.7的nt.5894-7546)。该质粒还包含3拷贝的TD1(SEQ ID NO.77)和TLacz靶位点(SEQ ID NO.71)。
8.E30(SEQ ID.NO.8)-Pcmv-4ORF∧-TD1-Tfluc-incDTAWT---Psv40-TGFP(pCMV启动子(SEQ ID NO.8的nt.420-938);4ORF∧=4个连续的ORF中的9个TISU序列和57个kozak序列,相邻的ATG密码子之间为57、57、36、36、21、21、21和21nt(SEQ ID NO.8的nt1027-3547)。第一ORF(SEQ ID NO.8的nt.1031-1651)从TISU(SEQ ID NO.8的nt.1027-1038)翻译,且接下来的3个ORF∧(SEQ ID NO.8的nt.1662-2996、nt.2306-2941和nt2951-3547)从Kozak序列翻译。最后一个ORF(SEQ IDNO.8的nt2951-3516)在野生型DTA的编码序列(cDTAwt=不含启动子/剪接/终止/多聚A位点且含有Kozak序列的wt DTA编码序列(SEQ ID NO.8的nt3568-4155)之前终止;接下来是SV40启动子控制下的TGFP编码序列。该质粒还包含靶位点TD1(SEQ ID NO.77)和Tfluc(SEQ ID NO.74)。
9.E142(SEQ ID.NO.9)-3多聚A-Prpl19-4ORF∧-TD1-Tfluc-S-cDTAWT---Phsvtk-Fluc。3多聚A=HSV多聚A、SV40多聚A、合成的多聚A(SEQ ID NO.9的nt.60-247);Prpl19=携带其第一内含子的RPL19(核糖体蛋白L19)的启动子(SEQ ID NO.9的nt.248-1941);4ORF∧=4个连续的ORF中的9个TISU序列和57个kozak序列,相邻的ATG密码子之间为57、57、36、36、21、21、21和21nt(SEQ ID NO.9的nt1948-4366);野生型DTA的编码序列(SEQ ID NO.9的nt.4457-5044);HSKVK启动子(nt.5136-5888)和萤火虫萤光素酶的编码序列(SEQ ID.NO.9的nt.5924-7576)。该质粒还包含靶位点TD1(SEQ ID NO.77)和Tfluc(SEQ IDNO.74)。
结果:
下表1-5和6A-C中呈现了结果。这些结果示出了在各种实验条件下在转染了所指示的质粒和siRNA分子的细胞中测量的RLU。所用的siRNA+分子是可结合其在被测试的质粒内的相应靶序列的siRNA分子。
表1:
表2:
表3:
表4:
表5:
表6A:
表6B:
表6C
关于表6A-6C:
*=表示所述2种siRNA+表现出显著的活化;
**=还与155ng的质粒E38(SEQ ID NO.19)共转染。
以上表1-5和6A-6C中呈现的结果表明在能够引发外源目的RNA裂解的siRNA分子的存在下,外源目的蛋白(DTA)表达,其表达继而导致细胞死亡增加。所述细胞死亡增加导致孔中总的RLU测量值减少,因为更少的细胞表达/产生萤光素酶基因。这些结果证实了,事实上,仅在包含特异性siRNA的细胞中,外源目的蛋白(在本实施例中为DTA)表达,因为仅在这些细胞中,外源目的RNA在裂解位点处的裂解被引发,从而允许外源目的蛋白在这些细胞中的表达。
实施例2:本发明的组合物杀死EBV-相关的胃癌癌细胞、鼻咽癌癌细胞和伯基特淋巴瘤癌细胞的用途。
胃癌是继肺癌之后世界上最普遍的癌症且是死亡率和发病率的主要原因。5年存活率小于20%。全世界约6至16%的胃癌病例与在几乎所有肿瘤中发现的爱波斯坦巴尔病毒(EBV)有关[21]。伯基特淋巴瘤是一种类型的非霍奇金淋巴瘤,其通常影响颌骨,形成大的肿瘤团。B细胞被EBV永生化是最终导致伯基特特淋巴瘤的第一步。鼻咽癌是在上呼吸道中发现的癌症,大部分通常在鼻咽部,且与EBV病毒强烈相关。
移植后淋巴增生性疾患(PTLPD)是免疫损伤患者,例如患AIDS的患者或已经历与免疫抑制有关的器官移植的患者中出现的另一种B细胞淋巴瘤,且因此推测其与EBV有关。恶性肿瘤患者的平滑肌肿瘤和霍奇金淋巴瘤也与EBV有关。
在美国,多至95%的35和40周岁之间的成人已感染了爱波斯坦巴尔病毒(EBV或HHV-4)。
爱波斯坦巴尔病毒编码在调控肿瘤和抑制凋亡方面发挥功能的23种miRNA[13]。在爱波斯坦巴尔病毒的两个基因组区域鉴定到多种miRNA并它们在转化的B细胞系的潜伏感染期间表达[20]。
在B细胞伯基特淋巴瘤、感染了EBV的鼻咽癌细胞和EBV-有关的胃癌(EBVaGC)中观察到EBV miRNA miR-BART1(SEQ ID NO.41)的表达[21]。因此可通过使用杀死表达miR-BART1的细胞的本发明的组合物杀灭这些癌症。
EBV-mir-BART1的成熟内源性miRNA链是:5’-UCUUAGUGGAAGUGACGUGCUGUG-3′(SEQ ID NO.42),本实施例的外源RNA分子的结合位点被设计为包含序列:3’-AGAAUCACCUUCACUGCACGACAC-5’(SEQ ID NO.43),该序列与EBV-mir-BART1的成熟内源性miRNA链100%互补。例如,参见图17。
编码外源目的蛋白的序列被设计为编码白喉毒素片段A(DT-A)并被设计为位于外源RNA分子中EBV-mir-BART1结合位点的下游。被引入到细胞中的单分子白喉毒素片段A可杀死所述细胞[5]且在哺乳动物细胞中,帽子的去除使mRNA的翻译降低35-50倍并使功能性mRNA的半衰期减少仅1.7倍[6]。例如,参见图17。
抑制序列位于EBV-mir-BART1结合位点上游且其被设计为包括位于人Kozak共有序列:5′-ACCAUGG-3′(SEQ ID NO.25)内的起始密码子并且不与DT-A的起译密码子处于同一读码框。例如,参见图17。
本实施例的外源RNA分子在5′端还包含非常有效的顺式作用型锤头状核酶-snorbozyme[15]以在外源RNA分子被EBV-mir-BART1裂解之前降低所述外源RNA分子的翻译效率。顺式作用型锤头状核酶-snorbozyme还包含2个起始密码子,但是其每一个都不与DT-A的起译密码子处于同一读码框。例如,参见图17。
本实施例的外源RNA分子还包含来自编码DT-A的序列下游的人HIST1H2AC(H2ac)基因的3′UTR的回文终止元件(PTE)(5′-GGCUCUUUUCAGAGCC-3′-SEQ ID NO.34)。PTE在mRNA加工和稳定性方面起重要作用[7]。来自HIST1H2AC基因的转录物缺乏多聚(A)尾巴且由于PTE仍是稳定的。例如,参见图17。
在图17所示的本实施例中,外源RNA分子由病毒载体在强的病毒CMV启动子的控制下转录。本实施例的完整外源RNA分子的序列以SEQID NO.44列出。
在引入了编码本实施例的外源RNA分子的载体的靶细胞中转录所述外源RNA分子之后,顺式作用型核酶去除5′端的帽子以减少对外源RNA分子的任何翻译且回文终止元件稳定所述外源RNA分子并防止其被降解。不符合读码框的起始密码子阻止DT-A的翻译,但是在靶细胞中存在内源性EBV-mir-BART1时,本实施例的外源RNA分子被裂解(被裂解的序列的序列以SEQ ID NO.45列出),并且不符合读码框的起始密码子分离,使得DT-A被翻译并以至少一个拷贝的蛋白质表达,所述至少一个拷贝的蛋白质足以导致细胞死亡。例如,参见图17。
实施例3:本发明的组合物杀死HIV-1感染细胞的用途
根据世界卫生组织,在2006年,全球有约3950万人患HIV。根据联合国关于HIV和AIDS的项目的估计,推定在非洲9千万人感染HIV,导致最小估值为1800万的孤儿。HIV(人免疫缺陷病毒)可导致获得性免疫缺陷综合征(AIDS)。两类HIV感染人:HIV-1和HIV-2。HIV-1更为烈性,相对容易传播且是全球大多数HIV感染的病因。HIV-2较HIV-1不太容易传播且主要局限于西非。
包括HIV的许多病毒显示出进行极少的蛋白质合成或不进行蛋白质合成的休眠期或潜伏期。在这些阶段期间,病毒感染对于免疫系统基本上是不可见的。目前的抗病毒治疗方案在消除潜伏病毒的细胞贮量方面大部分是无效的[1]。
最近因计算机方法和高通量验证而变得可行的全基因组筛选已发现了由病毒编码的109种微小RNA前体[13]。最近的研究表明了HIV-1编码的微小RNA(例如miR-N367)在影响和/或维持潜伏感染中的作用[1,14和19]。
在人T细胞中,表达nef的miRNA miR-N367(SEQ ID NO.46)抑制HIV-1的转录[19]。miR-N367通过5′-LTR中U3区域的负响应元件降低HIV-1 LTR启动子的活性[19]。因此,感染HIV-1的细胞中产生的nefmiRNA可通过转录后信号通路和转录neo-通路下调HIV-1的转录[19]。
在图18所示的本实施例中,本发明的组合物被设计为杀死包含内源性miR-N367(hiv1-mir-N367)并因此也包含HIV-1的细胞。
miR-N367的成熟内源性miRNA链是:5′-ACUGACCUUUGGAUGGUGCUUCAA-3′(SEQ ID NO.47),本实施例的外源RNA分子的结合位点被设计为包含与miR-N367的成熟miRNA链100%互补的序列:5′-UUGAAGCACCAUCCAAAGGUCAGU-3′(SEQID NO.48)。(如图18中所示)。
编码外源目的蛋白的序列被设计为编码白喉毒素(DT)蛋白并被设计为位于外源RNA分子中miR-N367结合位点的下游。(图18)。
抑制序列位于miR-N367结合位点上游且其被设计为包括2个起始密码子,其中之一位于人Kozak共有序列:5′-ACCAUGG-3′(SEQ ID NO.25)内并其每一个都不与DT的起译密码子处于同一读码框。(图18)。
外源RNA分子还包含miR-N367结合位点下游和编码DT蛋白的序列上游的22个核苷酸的核苷酸序列(SEQ ID NO.49),其中所述核苷酸序列能够结合位于编码DT的序列下游的22个核苷酸的序列(SEQ IDNO.50),其中所述外源RNA分子形成增加DT的翻译效率的环形结构,特别是当该外源RNA分子被裂解时。
外源RNA分子在5′端还包括非常有效的顺式作用型锤头状核酶-N117[16]以在外源RNA分子被内源性miRNA裂解之前降低所述外源RNA分子的翻译效率。顺式作用型锤头状核酶-N117还包含2个起始密码子,其都不与DT蛋白的起译密码子处于同一读码框。例如,参见图18。
在本实施例中,外源RNA分子由病毒载体在强的病毒CMV启动子的控制下转录。本实施例的外源RNA分子的完整序列以SEQ ID NO.51列出。
在引入了编码本实施例的外源RNA分子的载体的靶细胞中转录所述外源RNA分子之后,顺式作用型核酶去除5′端的帽子以减少对所述外源RNA分子的任何翻译。不符合读码框的起始密码子阻止DT的翻译,但是在细胞中存在内源性miR-N367(或HIV-1)时,外源RNA分子被裂解(被裂解的序列的序列以SEQ ID NO.52列出),且不符合读码框的起始密码子与编码DT蛋白的序列分离,使得DT能够表达。包括编码DT蛋白的序列的RNA部分形成增加DT蛋白翻译的环形结构以杀死HIV-1感染的细胞。例如,参见图18。
本实施例的病毒载体还可编码能够增强HIV-1感染的细胞中的HIV1-miR-N367转录的转录因子(例如,NF-κB)。该病毒载体还可编码能够阻止新的HIV-1颗粒产生的基因(例如,阻止HIV-1mRNA剪接的Rev)。
实施例4:本发明的组合物杀死转移性乳腺癌细胞的用途
与健康或未转移的致肿瘤性细胞相比,在转移性乳腺癌细胞中,miR-10b(SEQ ID NO.53)的表达被上调[8]。miR-10b的表达被转录因子Twist上调[8]。miR-10b的靶是HOXD10且HOXD10水平的降低导致更高水平的RHOC且更高水平的RHOC刺激癌细胞的运动性[8]。
在图19所示的本实施例中,本发明的组合物被设计为杀死包含转移性乳腺癌细胞中典型的内源性miR-10b的细胞。
miR-10b的成熟内源性miRNA链是:5’-UACCCUGUAGAACCGAAUUUGUG-3’(SEQ ID NO.54),本实施例的外源RNA分子被设计为包含2个miR-10b结合位点,其中所述结合位点中的一个包含与miR-10b的成熟miRNA链100%互补的序列5’-CACAAAUUCGGUUCUACAGGGUA-3’(SEQ ID NO.55)[31]。(图19)。
编码外源目的蛋白的序列被设计为编码白喉毒素片段A(DT-A)蛋白并被设计为位于外源RNA分子中的2个miR-10b结合位点之间。在哺乳动物细胞中,被引入到细胞中的单分子白喉毒素片段A可杀死该细胞[5]。
本实施例的外源RNA分子包含2个抑制序列,一个在5′端而另一个在3′端。
位于外源RNA分子的5′端的抑制序列被设计为包括3个起始密码子,其中所述起始密码子中的一个位于人Kozak共有序列:5′-ACCAUGG-3′(SEQ ID NO.25)内,且其都不与DT-A编码序列的起译密码子处于同一读码框内,并且其中所有3个起始密码子都处于同一读码框内。
位于外源RNA分子的5′端的抑制序列还包括所述3个起始密码子下游和2个miR-10b结合位点上游的核苷酸序列,其中所述核苷酸序列与所述3个起始密码子处于同一读码框内并且其中所述核苷酸序列编码用于亚细胞定位的分选信号,所述分选信号是人烷基磷酸二羟基丙酮合酶的过氧化物酶体靶向信号2(H2N---RLRVLSGHL-SEQ ID NO.27)[28]。在哺乳动物细胞中,具有用于亚细胞定位的分选信号的蛋白质当其被翻译时可与其mRNA一起定位到该亚细胞位置。
位于外源RNA分子的3′端的抑制序列被设计为包括2个miR-10b位点下游的HSV1LAT内含子,其中所述外源RNA分子是降解该外源RNA分子的无义介导的衰变(NMD)的靶,所述外源RNA分子在所述外源RNA分子中的编码序列下游包括内含子[29]。
位于外源RNA分子的3′端的抑制序列还包括3′端处的富含AU的元件,所述富含AU的元件刺激外源RNA分子的降解。富含AU的元件的长度为47个核苷酸且其包括序列:5′-AUUUA-3′(SEQ ID NO.31)和5′-UUAUUUA(U/A)(U/A)-3′(SEQ ID NO.32)[26]。
在本实施例中,外源RNA分子由病毒载体在强的病毒CMV启动子的控制下转录。本实施例的完整外源RNA分子的序列以SEQ ID NO.56列出。
在引入了编码本实施例的外源RNA分子的载体的靶细胞中转录所述外源RNA分子之后,不符合读码框的起始密码子阻止DT-A的翻译,过氧化物酶体靶向信号2将错误的蛋白和外源RNA分子发送至过氧化物酶体,内含子将外源RNA分子靶向为被无义介导的衰变(NMD)降解,且富含AU的元件也刺激外源RNA分子的降解。然而在细胞中存在内源性miR-10b时,外源RNA分子被裂解(被裂解的序列的序列以SEQ ID NO.57列出),且所有的抑制序列分离,致使DT-A蛋白被翻译并以至少一个拷贝的蛋白质表达,所述至少一个拷贝的蛋白质足以导致细胞死亡。
实施例5:本发明的组合物杀死HSV-1感染细胞的用途
包括HSV-1(单纯疱疹病毒-1)的许多病毒显示出进行极少的蛋白质合成或不进行蛋白质合成的休眠期或潜伏期。在这些阶段期间,病毒感染对于免疫系统基本上是不可见的。目前的抗病毒治疗方案在消除潜伏病毒的细胞贮量方面大部分是无效的。
单纯疱疹病毒-1(HSV-1)的潜伏相关的转录物(LAT)是神经元潜伏感染期间唯一表达的病毒基因。LAT抑制凋亡并通过促使被感染的神经元存活维持潜伏。没有归属至LAT基因的蛋白质产物。研究表明HSV-1 LAT基因编码的miRNA-miR-LAT(SEQ ID NO.58)提供对凋亡的抗性[17]。miR-LAT产生自HSV-1LAT基因的外显子1区域且因此miR-LAT在潜伏感染期间表达[17]。
在图20所示的本实施例中,本发明的组合物被设计为杀死包含内源性miR-LAT并因此也包含HSV-1的细胞。
miR-LAT的成熟内源性miRNA链是:5′-UGGCGGCCCGGCCCGGGGCC-3′(SEQ ID NO.59),且本实施例的外源RNA分子被设计为包括2个miR-LAT结合位点,其中每一个结合位点包括与miR-LAT的成熟miRNA链100%互补的序列5′-GGCCCCGGGCCGGGCCGCCA-3′(SEQ ID NO.60)[17]。
编码外源目的蛋白的序列被设计为编码白喉毒素(DT)蛋白并被设计为位于外源RNA分子中两个miR-LAT结合位点的下游(图20)。
外源RNA分子还包括2个抑制序列,一个在5′端而另一个在3′端。
位于外源RNA分子的5′端的抑制序列被设计为包括2个起始密码子,其每一个都位于人Kozak共有序列:5′-ACCAUGG-3′(SEQ ID NO.25)内且其都不与DT蛋白的起译密码子处于同一读码框内(图20)。
位于外源RNA分子的3′端的抑制序列被设计为包含在2个miR-LAT结合位点下游的翻译阻遏物smaug识别元件(SRE):5′-UGGAGCAGAGGCUCUGGCAGCUUUUGCAGCG-3′(SEQ ID NO.28)。Smaug1被编码在人14号染色体中且能够阻遏包含SRE的信使的翻译[24,25]。鼠Smaug1表达在脑中并在由突触刺激紧密调控翻译的一个亚细胞区域,突触神经小体中是丰富的。
位于外源RNA分子的3′端的抑制序列还包括3′端处的用于髓鞘化外周的RNA定位信号(A2RE-核的核糖核蛋白A2响应元件):5′-GCCAAGGAGCCAGAGAGCAUG-3′(SEQ ID NO.29)[27]。A2RE是位于MBP(髓鞘碱性蛋白)mRNA的3′-不翻译区的顺式作用序列并且对于MBP mRNA输送至少突胶质细胞的髓鞘化外周是足够且必需的[27]。hnRNP(核不均一核糖核蛋白)A2结合A2RE并介导MBP的运输[27]。
外源RNA分子还包括紧邻编码DT蛋白的序列下游的细胞质多聚腺苷酸化元件(CPE)。CPE包含紧邻编码DT蛋白的序列下游的序列5’-UUUUUUAUU-3’(SEQ ID NO.38)和编码DT蛋白的序列下游91个核苷酸处的序列5’-UUUUAUU-3’(SEQ ID NO.39)[23]。在哺乳动物中,CPEB(细胞质多聚腺苷酸化元件结合蛋白)存在于海马(脑负责长时记忆的区域)的树突层[30]。在哺乳动物海马神经元的突触-树突区室,CPEB表现为通过多聚腺苷酸化引发的翻译刺激包含CPE的α-CaMKII mRNA的翻译。
在本实施例中,外源RNA分子由病毒载体在强的病毒CMV启动子的控制下转录。本实施例的完整外源RNA分子的序列以SEQ ID NO.61列出。
在引入了编码本实施例的外源RNA分子的载体的靶细胞中转录所述外源RNA分子之后,不符合读码框的起始密码子阻止DT蛋白的翻译,Smaug1(翻译阻遏物)结合smaug识别元件(SRE)并抑制DT蛋白的翻译且hnRNP A2结合A2RE并介导外源RNA分子向髓鞘化外周的运输。然而在靶细胞中存在(HSV-1的)内源性miR-LAT时,外源RNA分子被裂解(被裂解的序列的序列以SEQ ID NO.62列出),且2个抑制序列分离,致使CPEB(细胞质多聚腺苷酸化元件结合蛋白)结合CPE并刺激裂解的外源RNA分子中多聚腺甘酸尾巴的延伸,使得DT能够表达并因此杀死所述细胞以及相邻的细胞。
参考文献列表
1.Weinberg M.S和Morris K.V,2006.Are viral-encoded microRNAsmediating latent HIV-1 infection?DNA Cell Biol25:223-231.
2.Velculescu VE等人,2006.The Consensus Coding Sequences of HumanBreast and Colorectal Cancers,Science314,5797:268-274.
3.Lord MJ,Jolliffe NA,Marsden CJ,等人,2003,Ricin Mechanisms ofCytotoxicity,Toxicol Rev22,1:53-64.
4.Jeen-Kuan Chen,Chih-Hung Hung,Yen-Chywan Liaw和Jung-Yaw Lin,1997,Identification of amino acid residues of Abrin-a A chain is essential forcatalysis and reassociation with Abrin-a B chain by site-directed mutagenesis,Protein Engineering10:827-833.
5.Yamaizumi,M,Mekada,E,Uchida,T.和Okada Y,1978,One molecule ofDiphtheria toxin fragment A introduced into a cell can kill the cell,cell15,1:245-50.
6.Gallie DR,1991,The cap and poly(A)tail function synergistically toregulate mRNA translational efficiency.Genes Dev5,11:2108-16.
7.Entrez Gene:HIST1H2AC histone cluster1,H2ac.
8.T.Dalmay,2008,MicroRNAs and cancer,Journal of Internal Medicine263,4:366-375.
9.Y Zeng,2006,Principles of micro-RNA production and maturation,Oncogene25:6156-6162.
10.BM Engels and G Hutvagner,2006,Principles and effects ofmicroRNA-mediated post-transcriptional gene regulation,Oncogene 25:6163-6169.
11.Benjamin Haley & Phillip D Zamore,2004,Kinetic analysis of the RNAienzyme complex,Nature Structural & Molecular Biology11:599-606.
12.William CS Cho,2007,OncomiRs:the discovery and progress ofmicroRNAs in cancers.Molecular Cancer6:60.
13.Vinod Scaria和Vaibhav Jadhav,2007,microRNAs in viral oncogenesis,Retrovirology4:82.
14.Vinod Scaria,Manoj Hariharan,Beena Pillai,Souvik Maiti,Samir K.Brahmachari,2007,Host-virus genome interactions:macro roles formicroRNAs,Cellular Microbiology9,12:2784-2794.
15.Maurille J.Fournier等人,1999.A small nucleolar RNA:ribozyme hybridcleaves a nucleolar RNA target in vivo with near-perfect efficiency,PNAS96,12:6609-6614.
16.Laising Yen,Jennifer Svendsen,Jeng-Shin Lee,John T.Gray,MaximeMagnier,Takashi Baba,Robert J.D′Amato & Richard C.Mulligan,2004,Exogenous control of mammalian gene expression through modulation of RNAself-cleavage,Nature431,471-476.
17.Gupta,J.J.Gartner,P.Sethupathy,A.G.Hatzigeorgiou & N.W.Fraser,2006,Anti-apoptotic function of a microRNA encoded by the HSV-1latency-associated transcript,Nature442,82-85.
18.
http://microrna.sanger.ac.uk/cgi-bin/sequences/miRNA_entry.pl?acc=MI0000267
19.Shinya Omoto和Yoichi R.Fujii,2005,Regulation of humanimmunodeficiency virus1transcription by nef microRNA,J Gen Virol86:751-755.
20.Grey F,Meyers H,White EA,Spector DH,Nelson J,2007,A HumanCytomegalovirus-Encoded microRNA Regulates Expression of Multiple ViralGenes Involved in Replication.PLoS Pathog3,11:e163.doi:10.1371/journal.ppat.0030163.
21.Do Nyun Kim,Hiun-Suk Chae,Sang Taek Oh,Jin-Hyoung Kang,ChoHyun Park,Won Sang Park,Kenzo Takada,Jae Myun Lee,Won-Keun Lee,和Suk Kyeong Lee,2007,Expression of Viral MicroRNAs in Epstein-BarrVirus-Associated Gastric Carcinoma,Journal of Virology第1033-1036页,第81卷,第2期.
22.Chabanon Herve和Ian Mickleburgh,2004,Zipcodes and postage stamps:mRNA localisation signals and their trans-acting binding proteins,Briefings inFunctional Genomics and Proteomics3:240-256.
23.Wu L,Wells D,Tay J,Mendis D,Abbott MA,Barnitt A,Quinlan E,Heynen A,Fallon JR,Richter JD,1998,CPEB-mediated cytoplasmicpolyadenylation and the regulation of experience-dependent translation ofalpha-CaMKII mRNA at synapses,Neuron21,5:936-8.
24.Maria V.Baez和Graciela L.Boccaccio,Career investigator of the ConsejoNacional de Investigaciones Cientificas y Tecnologicas,2005,MammalianSmaug Is a Translational Repressor That Forms Cytoplasmic Foci Similar toStress Granules,J.Biol.Chem280,52:43131-43140.
25.C A Smibert,J E Wilson,K Kerr,和P M Macdonald,1996,smaug proteinrepresses translation of unlocalized nanos mRNA in the Drosophila embryo,Genes & Development10:2600-2609.
26.Carine Barreau,Luc Paillard和H.Beverley Osborne,2006,AU-richelements and associated factors:are there unifying principles?,Nucleic AcidsResearch33,22:7138-7150.
27.Trent P.Munro,Rebecca J.Magee,Grahame J.Kidd,John H.Carson,ElisaBarbarese,Lisa M.Smith,和Ross Smith,1999,Mutational Analysis of aHeterogeneous Nuclear Ribonucleoprotein A2 Response Element for RNATrafficking,J Biol Chem,274,48:34389-34395.
28.Suresh subramani,1998,Components Involved in Peroxisome Import,Biogenesis,Proliferation,Turnover,and Movement,PHYSIOLOGICALREVIEWS78:171-188.
29.Isken O,Maquat LE,2007,Quality control of eukaryotic mRNA:safeguarding cells from abnormal mRNA function,Genes Dev21,15:1833-56.
30.Joel D.Richter,2001,Think globally,translate locally:What mitoticspindles and neuronal synapses have in common,Proc Natl Acad Sci USA98,13:7069-7071.
31.http://microrna.sanger.ac.uk/cgi-bin/sequences/miRNA_entry.pl?acc=MI0000267
32.Michael S.Wollenberg和Sanford M.Simon,2004,Signal SequenceCleavage of Peptidyl-tRNA Prior to Release from the Ribosome andTranslocon,J.Biol.Chem.279:24919-24922.
33.Dan Frumkin,Adam Wasserstrom,Shalev Itzkovitz,Tomer Stern,AlonHarmelin,Raya Eilam,Gideon Rechavi和Ehud Shapiro,2008,Cell LineageAnalysis of a Mouse Tumor,Cancer Research68:5924-5931.
34.Ugo Moens,2009,Silencing Viral MicroRNA as a Novel Antiviral Therapy?Journal of Biomedicine and Biotechnology.
35.Zhumur Ghosh,Bibekanand Mallick和Jayprokas Chakrabarti,2009,Cellular versus viral microRNAs in host-virus interaction.Nucleic Acids Res.
36.Michaelis M,Doerr HW,Cinatl J.Neoplasia,2009,The story of humancytomegalovirus and cancer:increasing evidence and open questions.Neoplasia Press.
37.Theodore WH,Epstein L,Gaillard WD,Shinnar S,Wainwright MS,Jacobson S,2008,Human herpes virus6B:a possible role in epilepsy?.Epilepsia.
38.Elfakess R,Dikstein R.(2008).A translation initiation element specific tomRNAs with very short 5′UTR that also regulates transcription.PloS One.2008Aug28;3(8):e3094.
Claims (42)
1.一种组合物,包含用于指导外源目的蛋白仅在表达特异性内源miRNA的细胞中表达的一种或多种多核苷酸,所述一种或多种多核苷酸编码包含下列的外源RNA分子:
a)编码所述外源目的蛋白的序列;
b)能够抑制所述外源目的蛋白表达的抑制序列;和
c)针对所述特异性内源miRNA的结合位点,
其中仅在所述特异性内源miRNA的存在下,所述外源RNA分子在裂解位点处被裂解,从而从所述编码所述外源目的蛋白的序列中释放所述抑制序列,使得所述外源目的蛋白能够被表达。
2.如权利要求1所述的组合物,其中所述裂解位点位于所述结合位点内且其中所述裂解位点位于所述抑制序列和所述编码所述外源目的蛋白的序列之间。
3.如权利要求1所述的组合物,其中所述针对所述特异性内源miRNA的结合位点与所述特异性内源miRNA内的序列具有使所述特异性内源miRNA指导所述外源RNA分子在所述裂解位点处裂解的足够的互补性。
4.如权利要求1所述的组合物,其中所述特异性内源miRNA是细胞的微小RNA、病毒微小RNA或二者。
5.如权利要求1所述的组合物,其中所述内源性微小RNA仅在赘生性细胞中表达。
6.如权利要求4所述的组合物,其中所述病毒微小RNA由选自由下列组成的组的病毒表达:双链DNA病毒、单链DNA病毒、双链RNA病毒、双链RNA病毒、单链(正链)病毒、单链(负链)病毒和逆转录病毒。
7.如权利要求1所述的组合物,其中所述外源目的蛋白是毒素。
8.如权利要求7所述的组合物,其中所述毒素选自由下列组成的组:蓖麻毒素、蓖麻毒素A链、相思豆毒素、相思豆毒素A链、白喉毒素A链及其修饰形式。
9.如权利要求7所述的组合物,其中所述毒素选自由下列组成的组:α毒素、皂草素、玉蜀黍RIP、大麦RIP、小麦RIP、玉米RIP、黑麦RIP、亚麻RIP、志贺毒素、志贺样RIP、木鳖子甙、胸苷激酶、美洲商陆抗病毒蛋白、多花白树毒蛋白、假单胞菌(Pseudomonas)外毒素、假单胞菌外毒素A、大肠杆菌(Escherichia coli)胞嘧啶脱氨酶及其修饰形式。
10.如权利要求1所述的组合物,其中所述抑制序列位于所述裂解位点上游,且其中所述抑制序列降低自所述外源RNA分子的所述外源目的蛋白的翻译效率。
11.如权利要求10所述的组合物,其中所述抑制序列包含多个起始密码子。
12.如权利要求11所述的组合物,其中每一个所述起始密码子和所述编码外源目的蛋白的序列不在同一读码框内。
13.如权利要求11所述的组合物,其中每一个所述起始密码子主要由5′-AUG-3′组成。
14.如权利要求11所述的组合物,其中每一个所述起始密码子位于Kozak共有序列内。
15.如权利要求1所述的组合物,其中所述抑制序列能够结合多肽,其中所述多肽降低自所述外源RNA分子的所述外源目的蛋白的翻译效率。
16.如权利要求15所述的组合物,其中所述多肽是翻译阻遏蛋白,其中所述翻译阻遏蛋白是内源性翻译阻遏蛋白或由所述组合物的所述一种或多种多核苷酸编码的翻译阻遏蛋白。
17.如权利要求1所述的组合物,其中所述抑制序列包含用于亚细胞定位的RNA定位信号、内源性miRNA结合位点或二者。
18.如权利要求1所述的组合物,其中所述组合物还包含编码能够直接或间接地抑制内源性核酸外切酶表达的功能RNA的多核苷酸序列。
19.如权利要求1所述的组合物,其中足够的互补性是至少30%的互补性。
20.如权利要求1所述的组合物,其中足够的互补性是至少90%的互补性。
21.如权利要求1所述的组合物,其中所述针对所述特异性内源miRNA的结合位点是针对相同或不同的内源性miRNA的多个结合位点,且其中所述裂解位点是多个裂解位点。
22.如权利要求1所述的组合物,其中所述多核苷酸包含一种或多种DNA分子、一种或多种RNA分子或其组合。
23.如权利要求1所述的组合物,其中所述特异性内源miRNA选自由下列组成的组:hsv1-miR-H1、hsv1-miR-H2、hsv1-miR-H3、hsv1-miR-H4、hsv1-miR-H5、hsv1-miR-H6、hsv2-miR-I、hcmv-miR-UL22A、hcmv-miR-UL36、hcmv-miR-UL70、hcmv-miR-UL112、hcmv-miR-UL148D、hcmv-miR-US4、hcmv-miR-US5-1、hcmv-miR-US5-2、hcmv-miR-US25-1、hcmv-miR-US25-2、hcmv-miR-US33、kshv-miR-K12-1、kshv-miR-K12-2、kshv-miR-K12-3、kshv-miR-K12-4、kshv-miR-K12-5、kshv-miR-K12-6、kshv-miR-K12-7、kshv-miR-K12-8、kshv-miR-K12-9、kshv-miR-K12-10a、kshv-miR-K12-10b、kshv-miR-K12-11、kshv-miR-K12-12、ebv-miR-BART1、ebv-miR-BART2、ebv-miR-BART3、ebv-miR-BART4、ebv-miR-BART5、ebv-miR-BART6、ebv-miR-BART7、ebv-miR-BART8、ebv-miR-BART9、ebv-miR-BART10、ebv-miR-BART11、ebv-miR-BART12、ebv-miR-BART13、ebv-miR-BART14、ebv-miR-BART15、ebv-miR-BART16、ebv-miR-BART17、ebv-miR-BART18、ebv-miR-BART19、ebv-miR-BART20、ebv-miR-BHRF1-1、ebv-miR-BHRF1-2、ebv-miR-BHRF1-3、bkv-miR-B1、jcv-miR-J1、hiv1-miR-H1、hiv1-miR-N367、hiv1-miR-TAR、sv40-miR-S1、MCPyV-miR-M1、hsv1-miR-LAT、hsv1-miR-LAT-ICP34.5、hsv2-miR-II、hsv2-miR-III、hcmv-miR-UL23、hcmv-miR-UL36-1、hcmv-miR-UL54-1、hcmv-miR-UL70-1、hcmv-miR-UL22A-1、hcmv-miR-UL112-1、hcmv-miR-UL148D-1、hcmv-miR-US4-1、hcmv-miR-US24、hcmv-miR-US33-1、hcmv-RNAβ2.7、ebv-miR-BART1-1、ebv-miR-BART1-2、ebv-miR-BART1-3、ebv-miR-BHFR1、ebv-miR-BHFR2、ebv-miR-BHFR3、hiv1-miR-TAR-5p、hiv1-miR-TAR-p、hiv1-HAAmiRNA、hiv1-VmiRNA1、hiv1-VmiRNA2、hiv1-VmiRNA3、hiv1-VmiRNA4、mir-675、hiv1-VmiRNA5、hiv2-miR-TAR2-5p、hiv2-miR-TAR2-3p、mdv1-miR-M1、mdv1-miR-M2、mdv1-miR-M3、mdv1-miR-M4、mdv1-miR-M5、mdv1-miR-M6、mdv1-miR-M7、mdv1-miR-M8、mdv1-miR-M9、mdv1-miR-M10、mdv1-miR-M11、mdv1-miR-M12、mdv1-miR-M13、mdv2-miR-M14、mdv2-miR-M15、mdv2-miR-M16、mdv2-miR-M17、mdv2-miR-M18、mdv2-miR-M19、mdv2-miR-M20、mdv2-miR-M21、mdv2-miR-M22、mdv2-miR-M23、mdv2-miR-M24、mdv2-miR-M25、mdv2-miR-M26、mdv2-miR-M27、mdv2-miR-M28、mdv2-miR-M29、mdv2-miR-M30、mcmv-miR-M23-1、mcmv-miR-M23-2、mcmv-miR-M44-1、mcmv-miR-M55-1、mcmv-miR-M87-1、mcmv-miR-M95-1、mcmv-miR-m01-1、mcmv-miR-m01-2、mcmv-miR-m01-3、mcmv-miR-m01-4、mcmv-miR-m21-1、mcmv-miR-m22-1、mcmv-miR-m59-1、mcmv-miR-m59-2、mcmv-miR-m88-1、mcmv-miR-m107-1、mcmv-miR-m108-1、mcmv-miR-m108-2、rlcv-miR-rL1-1、rlcv-miR-rL1-2、rlcv-miR-rL1-3、rlcv-miR-rL1-4、rlcv-miR-rL1-5、rlcv-miR-rL1-6、rlcv-miR-rL1-7、rlcv-miR-rL1-8、rlcv-miR-rL1-9、rlcv-miR-rL1-10、rlcv-miR-rL1-11、rlcv-miR-rL1-12、rlcv-miR-rL1-13、rlcv-miR-rL1-14、rlcv-miR-rL1-15、rlcv-miR-rL1-16、rrv-miR-rR1-1、rrv-miR-rR1-2、rrv-miR-rR1-3、rrv-miR-rR1-4、rrv-miR-rR1-5、rrv-miR-rR1-6、rrv-miR-rR1-7、mghv-miR-M1-1、mghv-miR-M1-2、mghv-miR-M1-3、mghv-miR-M1-4、mghv-miR-M1-5、mghv-miR-M1-6、mghv-miR-M1-7、mghv-miR-M1-8、mghv-miR-M1-9和sv40-miR-S1。
24.如权利要求1所述的组合物,其中所述外源RNA分子还包含位于所述起始密码子和所述编码目的蛋白的序列的起译密码子之间的终止密码子,且所述终止密码与所述起始密码子在同一读码框内,且其中所述终止密码子选自由5′-UAA-3′、5′-UAG-3′和5′-UGA-3′组成的组。
25.如权利要求1所述的组合物,其中所述抑制序列位于所述编码所述外源目的蛋白的序列上游,其中所述抑制序列能够形成具有低于-30kcal/mol的折叠自由能的二级结构,其中所述二级结构足以阻碍扫描核糖体到达所述外源目的蛋白的所述起译密码子。
26.如权利要求1所述的组合物,其中所述细胞选自由以下组成的组:人细胞、动物细胞、培养的细胞和植物细胞。
27.如权利要求1所述的组合物,其中所述组合物被引入到细胞中。
28.如权利要求1所述的组合物,其中所述细胞存在于生物体内。
29.一种诊断试剂盒,包含权利要求1所述的组合物。
30.一种药物组合物,包含权利要求1所述的组合物和一种或多种赋形剂。
31.一种用于靶向杀死靶细胞的方法,所述方法包括将权利要求1所述的组合物引入到所述靶细胞中,其中所述靶细胞包含所述特异性内源miRNA。
32.一种载体,包含编码外源RNA分子的多核苷酸序列,其中所述外源性RNA分子包含:
a)编码外源目的蛋白的序列;
b)能够抑制所述外源目的蛋白表达的抑制序列;和
c)针对特异性内源miRNA的结合位点。
33.如权利要求32所述的载体,其中所述载体是病毒载体。
34.如权利要求32所述的载体,其中所述载体是非病毒载体。
35.如权利要求32所述的载体,其中所述针对所述特异性内源miRNA的结合位点与特异性内源miRNA内的序列具有在将所述载体引入到包含所述特异性内源miRNA的细胞中后,使所述特异性内源miRNA指导所述外源RNA分子在所述裂解位点裂解的足够的互补性。
36.如权利要求35所述的载体,其中所述裂解位点位于所述针对所述特异性内源miRNA的结合位点内,且其中所述裂解位点位于所述抑制序列和所述编码所述外源目的蛋白的序列之间。
37.如权利要求36所述的载体,其中所述特异性内源miRNA是细胞的微小RNA、病毒微小RNA或二者。
38.如权利要求32所述的组合物,其中所述内源性微小RNA仅在赘生性细胞中表达。
39.如权利要求37所述的组合物,其中所述病毒微小RNA由选自由下列组成的组的病毒表达:双链DNA病毒、单链DNA病毒、双链RNA病毒、双链RNA病毒、单链(正链)病毒、单链(负链)病毒和逆转录病毒。
40.如权利要求32所述的组合物,其中所述外源目的蛋白是毒素。
41.如权利要求40所述的组合物,其中所述毒素选自由下列组成的组:蓖麻毒素、蓖麻毒素A链、相思豆毒素、相思豆毒素A链、白喉毒素A链及其修饰形式。
42.如权利要求40所述的组合物,其中所述毒素选自由下列组成的组:α毒素、皂草素、玉蜀黍RIP、大麦RIP、小麦RIP、玉米RIP、黑麦RIP、亚麻RIP、志贺毒素、志贺样RIP、木鳖子甙、胸苷激酶、美洲商陆抗病毒蛋白、多花白树毒蛋白、假单胞菌外毒素、假单胞菌外毒素A、大肠杆菌胞嘧啶脱氨酶及其修饰形式。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| ILPCT/IL2010/000894 | 2010-10-28 | ||
| PCT/IL2010/000894 WO2012056440A1 (en) | 2010-10-28 | 2010-10-28 | COMPOSITIONS AND METHODS FOR ACTIVATING EXPRESSION BY A SPECIFIC ENDOGENOUS miRNA |
| PCT/IL2011/000837 WO2012056457A2 (en) | 2010-10-28 | 2011-10-27 | Compositions and methods for activating expression by a specific endogenous mirna |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103314003A true CN103314003A (zh) | 2013-09-18 |
Family
ID=45993239
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800631535A Pending CN103314003A (zh) | 2010-10-28 | 2011-10-27 | 通过特异性内源miRNA 激活表达的组合物和方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20130245096A1 (zh) |
| EP (1) | EP2632932A4 (zh) |
| JP (1) | JP2013544511A (zh) |
| CN (1) | CN103314003A (zh) |
| AU (1) | AU2011322114A1 (zh) |
| CA (1) | CA2824604A1 (zh) |
| WO (2) | WO2012056440A1 (zh) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106574292A (zh) * | 2014-01-10 | 2017-04-19 | 国立大学法人京都大学 | 利用作为指示剂的miRNA的表达区分期望的细胞类型的方法 |
| CN108753836A (zh) * | 2018-06-04 | 2018-11-06 | 北京大学 | 一种利用rna干扰机制的基因调控或编辑系统 |
| CN108841864A (zh) * | 2018-06-04 | 2018-11-20 | 北京大学 | 一种利用rna干扰机制的分子传感器 |
| CN110016501A (zh) * | 2018-01-09 | 2019-07-16 | 江苏命码生物科技有限公司 | 不明原因发热的标记物、检测方法及其应用 |
| CN111057790A (zh) * | 2019-12-11 | 2020-04-24 | 石河子大学 | miRNA在制备用于检测KSHV潜伏感染的试剂盒中的用途 |
| CN116716351A (zh) * | 2023-03-30 | 2023-09-08 | 湖北天勤生物技术研究院有限公司 | 用于构建食蟹猴阿尔兹海默症模型的组合物及其应用和构建方法 |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SI2056845T1 (en) | 2006-08-08 | 2018-02-28 | Rheinische Friedrich-Wilhelms-Universitaet Bonn | STRUCTURE AND USE 5 'PHOSPHATE OF OLIGONUCLEOTES |
| US8524248B2 (en) * | 2007-12-14 | 2013-09-03 | University of Pittsburgh—of the Commonwealth System of Higher Education | Methods to diagnose and immunize against the virus causing human Merkel cell carcinoma |
| US9738680B2 (en) | 2008-05-21 | 2017-08-22 | Rheinische Friedrich-Wilhelms-Universität Bonn | 5′ triphosphate oligonucleotide with blunt end and uses thereof |
| EP2508530A1 (en) | 2011-03-28 | 2012-10-10 | Rheinische Friedrich-Wilhelms-Universität Bonn | Purification of triphosphorylated oligonucleotides using capture tags |
| EP2766498B1 (en) | 2011-10-14 | 2019-06-19 | President and Fellows of Harvard College | Sequencing by structure assembly |
| EP4249605A3 (en) | 2011-12-22 | 2023-11-15 | President And Fellows Of Harvard College | Methods for analyte detection |
| US11021737B2 (en) | 2011-12-22 | 2021-06-01 | President And Fellows Of Harvard College | Compositions and methods for analyte detection |
| WO2013184754A2 (en) | 2012-06-05 | 2013-12-12 | President And Fellows Of Harvard College | Spatial sequencing of nucleic acids using dna origami probes |
| AU2013316441B2 (en) * | 2012-09-13 | 2018-08-09 | Chugai Seiyaku Kabushiki Kaisha | Gene knock-in non-human animal |
| EP2712870A1 (en) | 2012-09-27 | 2014-04-02 | Rheinische Friedrich-Wilhelms-Universität Bonn | Novel RIG-I ligands and methods for producing them |
| US10138509B2 (en) | 2013-03-12 | 2018-11-27 | President And Fellows Of Harvard College | Method for generating a three-dimensional nucleic acid containing matrix |
| CN104419749B (zh) * | 2013-08-22 | 2017-02-15 | 江苏命码生物科技有限公司 | 一种用于预测干扰素治疗慢性hbv疗效的微小核糖核酸及其应用 |
| WO2016007839A1 (en) * | 2014-07-11 | 2016-01-14 | President And Fellows Of Harvard College | Methods for high-throughput labelling and detection of biological features in situ using microscopy |
| EP3233132A4 (en) * | 2014-12-19 | 2018-06-27 | Modernatx, Inc. | Terminal modifications of polynucleotides |
| US9777064B2 (en) | 2015-03-17 | 2017-10-03 | Chimera Bioengineering, Inc. | Smart CAR devices, DE CAR polypeptides, side CARs and uses thereof |
| WO2017062513A1 (en) * | 2015-10-05 | 2017-04-13 | Modernatx, Inc. | Methods for therapeutic administration of messenger ribonucleic acid drugs |
| AU2016349288A1 (en) | 2015-11-03 | 2018-05-31 | President And Fellows Of Harvard College | Method and apparatus for volumetric imaging of a three-dimensional nucleic acid containing matrix |
| US11052111B2 (en) | 2015-12-08 | 2021-07-06 | Chimera Bioengineering, Inc. | Smart CAR devices and DE CAR polypeptides for treating disease and methods for enhancing immune responses |
| WO2017189525A1 (en) | 2016-04-25 | 2017-11-02 | President And Fellows Of Harvard College | Hybridization chain reaction methods for in situ molecular detection |
| US10222369B2 (en) | 2016-05-17 | 2019-03-05 | Chimera Bioengineering, Inc. | Methods for making novel antigen binding domains |
| AU2017302587A1 (en) * | 2016-07-26 | 2019-02-07 | Senti Biosciences, Inc. | Genetic erasers |
| CN109923216A (zh) | 2016-08-31 | 2019-06-21 | 哈佛学院董事及会员团体 | 将生物分子的检测组合到使用荧光原位测序的单个试验的方法 |
| JP7239465B2 (ja) | 2016-08-31 | 2023-03-14 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 蛍光in situ配列決定による検出のための核酸配列ライブラリの作製法 |
| EP4342978A2 (en) * | 2016-09-01 | 2024-03-27 | Chimera Bioengineering Inc. | Gold optimized car t-cells |
| DE102017103383A1 (de) * | 2017-02-20 | 2018-08-23 | aReNA-Bio GbR (vertretungsberechtigter Gesellschafter: Dr. Heribert Bohlen, 50733 Köln) | System und Verfahren zur Zelltyp-spezifischen Translation von RNA-Molekülen in Eukaryoten |
| US11185568B2 (en) | 2017-04-14 | 2021-11-30 | President And Fellows Of Harvard College | Methods for generation of cell-derived microfilament network |
| US11795455B2 (en) | 2017-07-31 | 2023-10-24 | Massachusetts Institute Of Technology | RNA cleavage-induced transcript stabilizer and uses thereof |
| US11110125B2 (en) | 2018-02-13 | 2021-09-07 | Chimera Bioengineering, Inc. | Coordinating gene expression using RNA destabilizing elements |
| EP3836967A4 (en) | 2018-07-30 | 2022-06-15 | ReadCoor, LLC | METHODS AND SYSTEMS FOR SAMPLE PROCESSING OR ANALYSIS |
| CN109628489B (zh) * | 2019-01-07 | 2022-09-23 | 新乡医学院 | 一种提高cho细胞重组蛋白表达水平的方法及其应用,表达载体、表达系统及其制备方法 |
| CN114786686A (zh) | 2019-08-18 | 2022-07-22 | 嵌合体生物工程公司 | Gold控制的转基因的联合疗法 |
| WO2022182697A1 (en) * | 2021-02-23 | 2022-09-01 | Board Of Regents, The University Of Texas System | A novel rna-based approach to cancer treatment |
| EP4355882A2 (en) * | 2021-06-15 | 2024-04-24 | Modernatx, Inc. | Engineered polynucleotides for cell-type or microenvironment-specific expression |
| WO2023100955A1 (ja) * | 2021-11-30 | 2023-06-08 | 国立大学法人京都大学 | Rna分子 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1615369A (zh) * | 2001-11-29 | 2005-05-11 | 富卡斯吉诺米克斯有限责任公司 | 分析翻译调控的基因表达的方法 |
| WO2006073727A2 (en) * | 2004-12-21 | 2006-07-13 | Monsanto Technology, Llc | Recombinant dna constructs and methods for controlling gene expression |
| US20060265771A1 (en) * | 2005-05-17 | 2006-11-23 | Lewis David L | Monitoring microrna expression and function |
| US20090286242A1 (en) * | 2007-12-10 | 2009-11-19 | Cold Spring Harbor Laboratory | MicroRNA Expression Profiling and Uses Thereof |
| WO2009142602A1 (en) * | 2008-05-19 | 2009-11-26 | Agency For Science, Technology And Research | Nucleic acid molecule and method of targeting gene expression to gliomas |
| WO2010055413A1 (en) * | 2008-11-12 | 2010-05-20 | Fondazione Centro San Raffaele Del Monte Tabor | Gene vector for inducing transgene-specific immune tolerance |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7067251B2 (en) * | 2000-03-28 | 2006-06-27 | University Of Rochester | Methods of directly selecting cells expressing inserts of interest |
| US20060275262A1 (en) * | 2001-07-26 | 2006-12-07 | Mathis James M | Conditionally replicating viruses and methods for cancer virotherapy |
| US20070265220A1 (en) * | 2004-03-15 | 2007-11-15 | City Of Hope | Methods and compositions for the specific inhibition of gene expression by double-stranded RNA |
| US20070179113A1 (en) * | 2005-05-19 | 2007-08-02 | Schering Aktiengesellachaft | GM-CSF gene therapy for Crohn's disease using an improved regulated expression system |
| US20070054872A1 (en) * | 2005-08-24 | 2007-03-08 | Mirus Bio Corporation | Regulatable or conditional expression systems |
| US20090156535A1 (en) * | 2007-09-27 | 2009-06-18 | The Trustees Of Princeton University | MicroRNAs for Modulating Herpes Virus Gene Expression |
-
2010
- 2010-10-28 WO PCT/IL2010/000894 patent/WO2012056440A1/en active Application Filing
-
2011
- 2011-10-27 AU AU2011322114A patent/AU2011322114A1/en not_active Abandoned
- 2011-10-27 WO PCT/IL2011/000837 patent/WO2012056457A2/en active Application Filing
- 2011-10-27 CN CN2011800631535A patent/CN103314003A/zh active Pending
- 2011-10-27 US US13/881,350 patent/US20130245096A1/en not_active Abandoned
- 2011-10-27 CA CA2824604A patent/CA2824604A1/en not_active Abandoned
- 2011-10-27 JP JP2013535589A patent/JP2013544511A/ja active Pending
- 2011-10-27 EP EP11835739.1A patent/EP2632932A4/en not_active Withdrawn
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1615369A (zh) * | 2001-11-29 | 2005-05-11 | 富卡斯吉诺米克斯有限责任公司 | 分析翻译调控的基因表达的方法 |
| WO2006073727A2 (en) * | 2004-12-21 | 2006-07-13 | Monsanto Technology, Llc | Recombinant dna constructs and methods for controlling gene expression |
| US20060265771A1 (en) * | 2005-05-17 | 2006-11-23 | Lewis David L | Monitoring microrna expression and function |
| US20090286242A1 (en) * | 2007-12-10 | 2009-11-19 | Cold Spring Harbor Laboratory | MicroRNA Expression Profiling and Uses Thereof |
| WO2009142602A1 (en) * | 2008-05-19 | 2009-11-26 | Agency For Science, Technology And Research | Nucleic acid molecule and method of targeting gene expression to gliomas |
| WO2010055413A1 (en) * | 2008-11-12 | 2010-05-20 | Fondazione Centro San Raffaele Del Monte Tabor | Gene vector for inducing transgene-specific immune tolerance |
Non-Patent Citations (1)
| Title |
|---|
| BRIAN D BROWN,等: ""Endogenous microRNA regulation suppresses transgene expression in hematopoietic lineages and enables stable gene transfer"", 《NATURE MEDICINE》, vol. 12, no. 5, 23 April 2006 (2006-04-23), pages 585 - 591, XP002652777, DOI: 10.1038/nm1398 * |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106574292A (zh) * | 2014-01-10 | 2017-04-19 | 国立大学法人京都大学 | 利用作为指示剂的miRNA的表达区分期望的细胞类型的方法 |
| CN110016501A (zh) * | 2018-01-09 | 2019-07-16 | 江苏命码生物科技有限公司 | 不明原因发热的标记物、检测方法及其应用 |
| CN108753836A (zh) * | 2018-06-04 | 2018-11-06 | 北京大学 | 一种利用rna干扰机制的基因调控或编辑系统 |
| CN108841864A (zh) * | 2018-06-04 | 2018-11-20 | 北京大学 | 一种利用rna干扰机制的分子传感器 |
| CN108753836B (zh) * | 2018-06-04 | 2021-10-12 | 北京大学 | 一种利用rna干扰机制的基因调控或编辑系统 |
| CN108841864B (zh) * | 2018-06-04 | 2021-10-15 | 北京大学 | 一种利用rna干扰机制的分子传感器 |
| CN111057790A (zh) * | 2019-12-11 | 2020-04-24 | 石河子大学 | miRNA在制备用于检测KSHV潜伏感染的试剂盒中的用途 |
| CN111057790B (zh) * | 2019-12-11 | 2022-08-30 | 石河子大学 | miRNA在制备用于检测KSHV潜伏感染的试剂盒中的用途 |
| CN116716351A (zh) * | 2023-03-30 | 2023-09-08 | 湖北天勤生物技术研究院有限公司 | 用于构建食蟹猴阿尔兹海默症模型的组合物及其应用和构建方法 |
| CN116716351B (zh) * | 2023-03-30 | 2024-02-23 | 湖北天勤生物技术研究院有限公司 | 用于构建食蟹猴阿尔兹海默症模型的组合物及其应用和构建方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2632932A2 (en) | 2013-09-04 |
| WO2012056457A2 (en) | 2012-05-03 |
| AU2011322114A1 (en) | 2013-05-30 |
| JP2013544511A (ja) | 2013-12-19 |
| US20130245096A1 (en) | 2013-09-19 |
| WO2012056457A3 (en) | 2012-08-02 |
| EP2632932A4 (en) | 2014-12-17 |
| CA2824604A1 (en) | 2012-05-03 |
| WO2012056440A1 (en) | 2012-05-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103314003A (zh) | 通过特异性内源miRNA 激活表达的组合物和方法 | |
| JP7306696B2 (ja) | Rna誘導型核酸修飾酵素及びその使用方法 | |
| JP2023027277A (ja) | Rna誘導型核酸修飾酵素及びその使用方法 | |
| JP7402163B2 (ja) | 2a型アッシャー症候群の処置のための材料および方法 | |
| KR20210053898A (ko) | 신규 crispr 효소 및 시스템 | |
| JP2021503945A (ja) | 常染色体優性網膜色素変性の処置のための材料および方法 | |
| CN109843914A (zh) | 用于治疗疼痛相关病症的材料和方法 | |
| KR102621539B1 (ko) | 인위적으로 조작된 sc 기능 조절 시스템 | |
| US11760983B2 (en) | Enhanced hAT family transposon-mediated gene transfer and associated compositions, systems, and methods | |
| US10995328B2 (en) | Materials and methods for treatment of autosomal dominant cone-rod dystrophy | |
| CN107405357A (zh) | 多重shRNAs及其应用 | |
| CN103282372A (zh) | 用于特异性裂解细胞中的外源rna的组合物和方法 | |
| CN109415729A (zh) | 具有降低毒性的基因编辑试剂 | |
| JP7305534B2 (ja) | 疼痛関連障害を処置するための物質及び方法 | |
| JP2022522650A (ja) | Crispr-casエフェクターポリペプチド及びその使用方法 | |
| Arango-Lievano et al. | Cell-type specific expression of p11 controls cocaine reward | |
| US20090023670A1 (en) | Regulation of Transgene Expression by RNA Interference | |
| CN108866058B (zh) | 靶向KRAS的siRNA及其在制备胰腺癌治疗药物中的应用 | |
| WO2019113061A1 (en) | Compositions and methods for modulating gene expression | |
| US20240117350A1 (en) | Use of mirna-485 inhibitor to regulate psd95, synaptophysin, and caspase-3 expression | |
| EA045278B1 (ru) | Рнк-направляемые модифицирующие нуклеиновые кислоты ферменты и способы их применения | |
| WO2013018096A1 (en) | Use of integrase for targeted gene expression |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20130918 |