CN102988281A - 一种盐酸氨溴索的注射液及其制备方法 - Google Patents
一种盐酸氨溴索的注射液及其制备方法 Download PDFInfo
- Publication number
- CN102988281A CN102988281A CN2012105288942A CN201210528894A CN102988281A CN 102988281 A CN102988281 A CN 102988281A CN 2012105288942 A CN2012105288942 A CN 2012105288942A CN 201210528894 A CN201210528894 A CN 201210528894A CN 102988281 A CN102988281 A CN 102988281A
- Authority
- CN
- China
- Prior art keywords
- injection
- ambroxol hydrochloride
- weight
- weight portions
- weighing
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Abstract
本发明提供了一种盐酸氨溴索的注射液及其制备方法,该注射液中含有盐酸氨溴索15重量份、枸橼酸0.01—0.03重量份、聚乙二醇4002-20重量份、氯化钠16—18重量份、注射用水2000重量份,优选的盐酸氨溴索15重量份、枸橼酸0.02重量份、聚乙二醇4005重量份、氯化钠17重量份、注射用水2000重量份。本发明提供的盐酸氨溴索的注射液可耐受121℃,15分钟热压灭菌,并且能够与pH高于10的药品溶液配伍,稳定性良好,能够更好的保证人体用药安全。
Description
技术领域
本发明涉及盐酸氨溴索注射液,属于药物制剂技术领域,更具体的,涉及一种高稳定性的盐酸氨溴索注射液及其制备方法。
背景技术
呼吸系统疾病一般多表现为咳、痰、喘、炎,尤其是痰量加剧、咳痰困难是慢性阻塞性肺病(COPD)、支气管哮喘、囊性肺纤维化(CF)等许多呼吸系统疾病的常见症状,小儿和老人经常出现吐痰困难,轻则干扰到人们的日常生活,严重时甚至危及病人生命。同时,在胸、腹科手术情况下,往往患者会产生大量的痰液,痰的存在可堵塞呼吸道,容易引起咳嗽、喘息,甚至造成呼吸困难。痰液阻塞呼吸道导致吸入气体在肺内分布不均,通气血流比例失调,加重缺氧,并且痰液又是细菌的良好培养基,其排出不畅可促使细菌的繁殖和生长,引起炎症的发展和加重。痰液运载系统粘液纤毛因此减弱或破坏。因此应用祛痰药物促进气道内分泌物的尽快外排是治疗气道炎症的重要辅助措施和必要治疗手段。
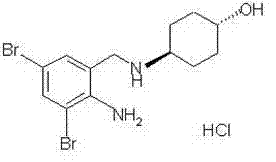
盐酸氨溴索
化学名:反式-4-〔(2-氨基3,5-二溴苄基)氨基〕环己醇盐酸盐。
英文名:Ambroxol Hydrochloride
结构式:
分 子 式: C13H18Br2N2O·HCl
分 子 量: 414.57。
盐酸氨溴索为一种黏痰溶解药,除祛痰效果明显优于其前体药物溴已新外,还具有多种生物效应,能刺激肺泡合成分泌肺泡表面物质,使其发挥保护作用,很好地用于呼吸系统疾病的治疗和预防。近年来,大量研究进一步拓展了氨溴索的临床治疗领域,主要集中在对呼吸系统的保护作用——与减少炎性介质的释放、抗氧化作用、促进肺泡和咽鼓管表面活性物质的合成、对呼吸道平滑肌的作用、影响气道壁离子转动和电位差、与其他药物的协同作用等方面有关,尤其是与抗生素联用,可提高联用抗生素在肺部浓度,提高抗菌疗效。
盐酸氨溴索的适应人群广,尤其对于幼儿、老人、孕妇,并没有特殊的用药禁忌。在多年的临床运用中,常见副作用表现为恶心、腹泻、胃肠功能紊乱,但症状都很轻微,并且停药后反应立即消失,重复使用无药物蓄积,可长期使用。
盐酸氨溴索可促进表面活性物质的形成,保护手术时机械损伤造成的PS下降,解除支气管痉挛,从而降低呼气阻力,减少肺泡过度充气和减轻对肺牵张感受器的刺激。所以盐酸氨溴索在预防胸外科手术后并发症方面的作用日益受到重视。
盐酸氨溴索于1979年由德国勃林格殷格翰公司研发上市,并先后在意大利、瑞士、阿根廷、日本等近二十个国家上市,原研上市剂型为注射液、片剂、糖浆、口服液、缓释胶囊,我国于1991年开始批准进口,商品名“沐舒坦”, 盐酸氨溴索注射液规格为2ml:15mg,盐酸氨溴索注射液适用于伴有痰液分泌不正常及排痰功能不良的急性、慢性呼吸道疾病,例如慢性支气管炎急性加重、喘息型支气管炎及支气管哮喘的祛痰治疗,手术后肺部并发症的预防性治疗,早产儿及新生儿的婴儿呼吸窘迫综合症(IRDS)的治疗。
对于盐酸氨溴索的研究,国内外多集中于制剂剂型研究及临床新适应症的开发,国内已上市的剂型有片剂、颗粒剂、胶囊、糖浆、口服溶液、口腔崩解片、注射液、分散片、咀嚼片、粉针剂、缓释胶囊、泡腾片、缓释片、缓释小丸、葡萄糖大容量注射液。
盐酸氨溴索各种口服制剂适用于急、慢性呼吸道疾病,如急、慢性支气管炎、支气管哮喘、支气管扩张,肺结核等引起的痰液粘稠,咳痰困难。盐酸氨溴索口服制剂与注射剂相比,其适应症范围小,无法满足临床急重病症患者用药以及不适合口服给药患者的治疗,因此盐酸氨溴索注射剂较其口服剂型临床应用范围更广,需求量更大。
目前国内已有7个厂家的盐酸氨溴索注射液产品上市,勃林格殷格翰1家进口,各厂家产品生产技术、产品稳定性及产品质量良莠不齐,并不能很好的保证临床用药安全,主要表现为,盐酸氨溴索在溶液中对光、氧不稳定,易发生降解破坏,稳定性不高,影响药品质量和用药安全,同时现有产品在使用时,因氨溴索在偏酸性的溶液中溶解度大,与其他高pH(pH>7)药液配剂时,盐酸氨溴索会游离析出,发生浑浊,引发安全性问题,限制了联合用药,因此有必要对盐酸氨溴索注射液进行研制使其更稳定、适用性更广。
勃林格殷格翰公司的盐酸氨溴索注射液(沐舒坦)其在2006年10月27日核准的药品说明书中记载“成分:盐酸氨溴索、一水柠檬酸、二水磷酸氢二钠、氯化钠、注射用水、氮气,有效期为60个月,不能与pH大于6.3的溶液混合,因为pH增加会导致产品产生氨溴索游离碱沉淀” 。由此可知原研产品使用时存在药液pH限制,同时原研产品采用氮气保护产品稳定,生产时所充氮气需要经过过滤除菌,增加了设备投入,在生产时会增加染菌风险,同时产品注射时溶解在药液中的氮气会进入血液,影响血液含氧量,人体内血液含氮气量升高时会引起焦燥不安、精神兴奋,因此存在引起不良反应的威胁。
中国专利CN101416956B公开了一种盐酸氨溴索注射剂由活性成分盐酸氨溴索、pH调节剂、稳定剂、注射用水、渗透压调节剂组成,使用了枸橼酸、磷酸二氢钠、氯化钠、注射用水等组分,制备过程未采用氮气,其样品有关物质含量较高(>0.1%),且其稳定性数据表明,室温最稳定的样品在室温留样36个月时有关物质量均高于0.2%,相对于0月数据增长了近1倍,有多数样品增长了近3倍,采用该专利方法制成的样品稳定性存在较大问题,无法达到原研产品60个月的有效期。
中国专利CN101836952B公开了一种盐酸氨溴索注射剂,包含盐酸氨溴索、磷酸氢二钠、枸橼酸的重量比为1:0.18—0.22:0.12—0.16,制备过程中活性炭用量为0.2%—0.3%(W/V),活性炭用量过大会对药液中的主成分发生吸附,引起活性成分损失,影响疗效,且同样存在充氮操作。
中国专利CN101836953B公开了一种盐酸氨溴索注射液,包含盐酸氨溴索14—16重量份、柠檬酸2.6—3.2重量份、磷酸氢二钠4.8—6.0重量份、氯化钠13—16重量份、注射用水1800—2500重量份,注射液pH控制在5.5—7.0,在制备时采用0.02%—0.05%的活性炭,并且采用115℃,20-30分钟的灭菌工艺,利用该方法制备的注射液虽然提高了药液的pH,但样品经冷冻后室温下放置复融缓慢并有不溶的微粒,药液一旦进入高寒地区运输时低温冻结无法复融,造成运输不便,严重影响药品稳定性,专利方法中所用活性炭量过少,难以保证细菌内毒素较低水平,同时该方法所得样品无法经受121℃15分钟的灭菌工艺,存在用药安全隐患。
本发明人经过大量系统的创造性研究工作,得到了质量更高、生产工艺更简单、成本更低、可反复冻融依然稳定、无需充氮保护、可在室温稳定存放60个月、可与pH高于10的溶液配伍使用的盐酸氨溴索注射液,创造性的解决了现有技术问题,与现有技术相比具有显著的进步,样品成分配比产生了意想不到的结果,迄今未见国内外有相关报道和公开使用。
发明内容
本发明第一个目的是克服现有技术的缺点和不足,制成可反复冻融、稳定性更好、质量更高、适合工业化生产的盐酸氨溴索注射液。
本发明的第二个目的是提供一个不需要充氮气保护就可以耐受“121℃热压灭菌15分钟”过度杀灭法工艺过程的稳定性更好的盐酸氨溴索注射液,减少充氮工艺操作,降低染菌风险,提高生产效率,减少设备投入,降低生产成本。
本发明的第三个目的是提供一个辅料用量少且可以与pH高于10的溶液配伍后依然稳定、不会析出的盐酸氨溴索注射液,具有更好的用药安全性。
另外,因磷会使水体富营养化,使自然界水中植物大量繁殖,消耗氧气,影响其他生物存活,破坏生物链,因此本发明的第四个目的是提供一个不含磷的盐酸氨溴索注射液,从而降低产品生产时车间管道等清洁所生成废水的处理难度,更有利于环境保护。
本发明提供了一种盐酸氨溴索注射液,包括如下成分:
盐酸氨溴索 15重量份
枸橼酸 0.01—0.03重量份
聚乙二醇400 2-10重量份
氯化钠 16—18重量份
注射用水 2000重量份。
所述的注射液优选包括如下成分:
盐酸氨溴索 15重量份
枸橼酸 0.02重量份
聚乙二醇400 5重量份
氯化钠 17重量份
注射用水 2000重量份。
所述的盐酸氨溴索注射液单剂量体积为2ml、4ml。
所述的盐酸氨溴索注射液采用棕色玻璃安瓿为直接接触药液的包装材料。
所述的盐酸氨溴索注射液 pH为4.3-4.8。
所述的盐酸氨溴索注射液渗透压为290—300mOsm/kg。
所述的盐酸氨溴索注射液,其特征在于每1ml盐酸氨溴索注射液中细菌内毒素含量应小于2EU。
所述的盐酸氨溴索注射液的制备方法,包括以下步骤:
1)称取处方量90%注射用水,加入处方量枸椽酸,搅拌溶解;
2)称取处方量聚乙二醇400加入至药液中,搅拌均匀;
3)称取处方量盐酸氨溴索加至药液中,搅拌溶解;
4)称取处方量氯化钠,加入至药液中,搅拌溶解;
5)按照药液体积0.1%(w/v)比例称取药用活性炭,加入至药液中,搅拌20分钟,过滤除炭,0.45μm滤器过滤,适量注射用水冲洗管道及滤器,定容至全量;
6)取样中间产品检测;
7)0.22μm滤器过滤,灌装、熔封;
8)121℃热压灭菌15分钟。
本发明的盐酸氨溴索注射液制备方法中所用枸橼酸以无水物计算投料,药用活性炭可为757或767型针用活性炭,过滤除炭操作中所用滤器可以为1—3μm惰性陶瓷滤器、钛棒滤器或聚四氟乙烯、聚丙烯滤器等药学可接受的滤器。
本发明的盐酸氨溴索注射液中盐酸氨溴索成分的含量测定采用高效液相色谱法,并通过以下步骤实现:
色谱条件及系统适用性试验:用十八烷基硅烷键合硅胶为填充剂;以0.01mol/L磷酸氢二铵溶液(用磷酸调节pH值至7.0)-乙腈(50:50)为流动相;检测波长为248nm,理论板数按盐酸氨溴索峰计算不低于5000。
测定法:精密量取本品适量,加流动相溶解并稀释制成每1ml中约含30μg的溶液,精密量取20μl,注入液相色谱仪,记录色谱图;另取盐酸氨溴索对照品,同法测定。按外标法以峰面积计算,即得。
本发明的盐酸氨溴索注射液有关物质的测定采用高效液相色谱法,并通过以下步骤实现:
色谱条件及系统适用性试验:用十八烷基硅烷键合硅胶为填充剂;以0.01mol/L磷酸氢二铵溶液(用磷酸调节pH值至7.0)-乙腈(50:50)为流动相;检测波长为248nm,理论板数按盐酸氨溴索峰计算不低于5000。
测定法:精密量取本品1ml,置10ml量瓶中,加流动相溶解并稀释制成每1ml中含0.75mg的溶液,作为供试品溶液;精密量取1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,过滤,作为对照溶液;取对照溶液20μl,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的25%;精密量取供试品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍,依据峰面积采用主成分自身对照法进行计算。
本发明的盐酸氨溴索注射液细菌内毒素检测方法参照中国药典2010年版附录XI E。
本发明人经过大量创造性的劳动,提供了可工业化生产的盐酸氨溴索注射液,具有如下优点:
本发明提供的盐酸氨溴索注射液,所用枸橼酸、聚乙二醇400辅料用量少,成本更低,更有利于减少不良反应的发生。
本发明提供的盐酸氨溴索注射液无需充氮保护,可耐受“121℃热压灭菌15分钟”过度杀灭法工艺过程,减少了氮气管道过滤等设备投入,进一步降低成本,同时减低染菌风险,有利于用药安全。
本发明提供的盐酸氨溴索注射液稳定性好,可反复冻融,稳定性良好,便于高寒地区运输,同时可以与pH高于pH高于10的溶液配伍后依然稳定、不会析出的盐酸氨溴索注射液,具有更好的用药适应性和安全性。
本发明提供的盐酸氨溴索注射液,不含磷元素,车间产生的设备及工艺管道清洁废水不会使水体富营养化,降低了清洁废水处理难度,更有利于环境保护。
具体实施方式
以下通过具体实施例,对本发明作更为详细的说明,但本发明不仅限于这些实施例。本领域技术人员根据现有知识对本发明进行等同替换或相应的逻辑改进,均属于本发明的范围。
实施例1
盐酸氨溴索 15g
枸橼酸 0.01g
聚乙二醇400 2g
氯化钠 16g
注射用水 2000g
------------------------------------------------------
制法:
1)称取处方量90%注射用水,加入处方量枸椽酸,搅拌溶解;
2)称取处方量聚乙二醇400加入至药液中,搅拌均匀;
3)称取处方量盐酸氨溴索加至药液中,搅拌溶解;
4)称取处方量氯化钠,加入至药液中,搅拌溶解;
5)按照药液体积0.1%(w/v)比例称取药用活性炭,加入至药液中,搅拌20分钟,过滤除炭,0.45μm滤器过滤,适量注射用水冲洗管道及滤器,定容至全量;
6)取样中间产品检测;
7)0.22μm滤器过滤,灌装、熔封;
8)121℃热压灭菌15分钟;
9)检漏、灯检、包装、成品检验、入库。
实施例2
盐酸氨溴索 15g
枸橼酸 0.02g
聚乙二醇400 5g
氯化钠 17g
注射用水 2000g
------------------------------------------------------
制法:
1)称取处方量90%注射用水,加入处方量枸椽酸,搅拌溶解;
2)称取处方量聚乙二醇400加入至药液中,搅拌均匀;
3)称取处方量盐酸氨溴索加至药液中,搅拌溶解;
4)称取处方量氯化钠,加入至药液中,搅拌溶解;
5)按照药液体积0.1%(w/v)比例称取药用活性炭,加入至药液中,搅拌20分钟,过滤除炭,0.45μm滤器过滤,适量注射用水冲洗管道及滤器,定容至全量;
6)取样中间产品检测;
7)0.22μm滤器过滤,灌装、熔封;
8)121℃热压灭菌15分钟;
9)检漏、灯检、包装、成品检验、入库。
实施例3
盐酸氨溴索 15g
枸橼酸 0.03g
聚乙二醇400 10g
氯化钠 18g
注射用水 2000g
------------------------------------------------------
制法:
1)称取处方量90%注射用水,加入处方量枸椽酸,搅拌溶解;
2)称取处方量聚乙二醇400加入至药液中,搅拌均匀;
3)称取处方量盐酸氨溴索加至药液中,搅拌溶解;
4)称取处方量氯化钠,加入至药液中,搅拌溶解;
5)按照药液体积0.1%(w/v)比例称取药用活性炭,加入至药液中,搅拌20分钟,过滤除炭,0.45μm滤器过滤,适量注射用水冲洗管道及滤器,定容至全量;
6)取样中间产品检测;
7)0.22μm滤器过滤,灌装、熔封;
8)121℃热压灭菌15分钟;
9)检漏、灯检、包装、成品检验、入库。
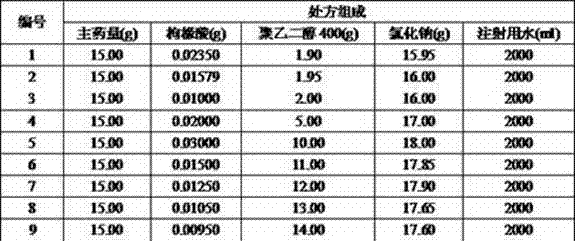
实验例1 pH对注射液稳定性影响
以盐酸氨溴索、枸橼酸、聚乙二醇400、氯化钠、注射用水为基本组成,盐酸氨溴索用量均为15g,注射用水量均为2000g,按照表中所示灭菌前pH进行调配溶液,渗透压值定为295 Osm/kg。利用过度杀灭法(121℃热压灭菌15分钟)对pH进行筛选考察,优选121℃热压灭菌15分钟稳定的处方。
由此可见,pH在4.3—4.8范围内时,溶液稳定性好,以121℃热压灭菌15分钟作为产品灭菌工艺,可以保证人体用药安全。
实验例2 活性炭用量对注射液成分的影响
为保证人体用药安全,应对本品细菌内毒素进行控制,生产过程中加入适量的针用活性炭用于吸附物料中的杂质及细菌内毒素等物质,依据《中国药典》2010版二部附录XI E,以及本品的用法用量(单次最大用量2支,规格2ml:15mg),计算本品细菌内毒素限值为每1ml不得过75EU,为保证人体用药安全,将本品的细菌内毒素水平做更严格的限定。
以4号处方(实施例2)为基本方,取处方量的90%注射用水,配制药液1800ml,分别取500ml药液进行实验,考察活性炭用量对注射液中成分的影响。
当活性炭用量为药液体积的0.10%时,细菌内毒素<2EU/ml,且活性炭用量较少,可保证人体用药安全。
实验例3 注射液反复冻融稳定性考察
为了确保本品在低温下的稳定性,进行了反复冻融试验,并与勃林格殷格翰公司市售产品(沐舒坦)进行对比实验。以4号处方(实施例2)为基本方配制注射液,将样品在—18℃条件放置两天,然后在40℃条件下高温考察两天,反复进行3次,结果见表。
由上可知,低温冻融循环试验前后,本品的各项指标均无明显变化,可见本品复融速度快,在低温及反复冻融状态下稳定性良好。
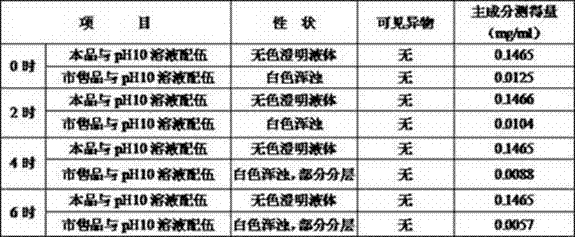
实验例4 与不同pH溶液配伍稳定性考察
本品稳定性受pH值影响较大,为保证用药安全,应进行溶液配伍稳定性考察。并与勃林格殷格翰公司市售产品(沐舒坦)进行对比实验。
4号处方(实施例2)为基本方配制盐酸氨溴索注射液,另取两份氢氧化钠加水溶解配制成pH10的溶液各100ml,分别将盐酸氨溴索注射液、市售品与氢氧化钠溶液配伍,分别考察配伍0、2、4、6小时后室温放置溶液的性状、可见异物、含量变化,结果见表。
由上可知,本发明提供的盐酸氨溴索注射液可与pH10的溶液配伍,稳定性良好。
实验例5 高温影响因素试验
以4号处方(实施例2)为基本方配制注射液,于60℃条件存放,并与勃林格殷格翰公司市售产品(沐舒坦)进行对比实验。
实验例6 光照影响因素试验
以4号处方(实施例2)为基本方配制注射液,于4500LX条件存放,并与勃林格殷格翰公司市售产品(沐舒坦)进行对比实验。
实验例7 加速稳定性试验
以4号处方(实施例2)为基本方配制注射液,于40℃±2℃条件存放,并与勃林格殷格翰公司市售产品(沐舒坦)进行对比实验。
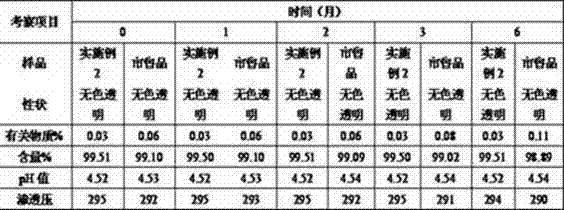
实验例8 长期稳定性试验
以4号处方(实施例2)为基本方配制注射液,于25℃±2℃条件存放,并与勃林格殷格翰公司市售产品(沐舒坦)进行对比实验,结果见表。
由上可知,本发明提供的盐酸氨溴索注射液可稳定存放60个月。
Claims (8)
1.一种盐酸氨溴索注射液,包括如下成分:
盐酸氨溴索 15重量份
枸橼酸 0.01—0.03重量份
聚乙二醇400 2-10重量份
氯化钠 16—18重量份
注射用水 2000重量份。
2.根据权利要求1所述的注射液,其特征在于包括如下成分:
盐酸氨溴索 15重量份
枸橼酸 0.02重量份
聚乙二醇400 5重量份
氯化钠 17重量份
注射用水 2000重量份。
3. 根据权利要求1或2所述的注射液,其特征在于单剂量体积为2ml、4ml。
4.根据权利要求1或2所述的注射液,采用棕色玻璃安瓿为直接接触药液的包装材料。
5.根据权利要求1或2所述的注射液,其特征在于pH为4.3-4.8。
6.根据权利要求1或2所述的注射液,其特征在于渗透压为290—300mOsm/kg。
7.根据权利要求1或2所述的注射液,其特征在于每1ml盐酸氨溴索注射液中细菌内毒素含量应小于2EU。
8.以上任一权利要求的盐酸氨溴索注射液的制备方法,包括以下步骤:
1)称取处方量90%注射用水,加入处方量枸椽酸,搅拌溶解;
2)称取处方量聚乙二醇400加入至药液中,搅拌均匀;
3)称取处方量盐酸氨溴索加至药液中,搅拌溶解;
4)称取处方量氯化钠,加入至药液中,搅拌溶解;
5)按照药液体积0.1%(w/v)比例称取药用活性炭,加入至药液中,搅拌20分钟,过滤除炭,0.45μm滤器过滤,适量注射用水冲洗管道及滤器,定容至全量;
6)取样中间产品检测;
7)0.22μm滤器过滤,灌装、熔封;
8)121℃热压灭菌15分钟。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2012105288942A CN102988281A (zh) | 2012-12-11 | 2012-12-11 | 一种盐酸氨溴索的注射液及其制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2012105288942A CN102988281A (zh) | 2012-12-11 | 2012-12-11 | 一种盐酸氨溴索的注射液及其制备方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102988281A true CN102988281A (zh) | 2013-03-27 |
Family
ID=47917715
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2012105288942A Pending CN102988281A (zh) | 2012-12-11 | 2012-12-11 | 一种盐酸氨溴索的注射液及其制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN102988281A (zh) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104840417A (zh) * | 2015-04-30 | 2015-08-19 | 济南康和医药科技有限公司 | 一种盐酸氨溴索注射液及其制备方法 |
| CN110151688A (zh) * | 2019-05-17 | 2019-08-23 | 石家庄学院 | 一种盐酸氨溴索注射液组合物及其制备方法 |
| CN113876705A (zh) * | 2021-11-17 | 2022-01-04 | 石家庄四药有限公司 | 一种盐酸乌拉地尔注射液及其制备方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101416956A (zh) * | 2007-10-22 | 2009-04-29 | 天津康鸿医药科技发展有限公司 | 一种盐酸氨溴索注射剂 |
| CN101836953A (zh) * | 2010-06-12 | 2010-09-22 | 山东罗欣药业股份有限公司 | 盐酸氨溴索组合物注射液 |
| CN102716076A (zh) * | 2012-07-06 | 2012-10-10 | 天津梅花医药有限公司 | 一种供注射用的盐酸氨溴索药物组合物 |
-
2012
- 2012-12-11 CN CN2012105288942A patent/CN102988281A/zh active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101416956A (zh) * | 2007-10-22 | 2009-04-29 | 天津康鸿医药科技发展有限公司 | 一种盐酸氨溴索注射剂 |
| CN101836953A (zh) * | 2010-06-12 | 2010-09-22 | 山东罗欣药业股份有限公司 | 盐酸氨溴索组合物注射液 |
| CN102716076A (zh) * | 2012-07-06 | 2012-10-10 | 天津梅花医药有限公司 | 一种供注射用的盐酸氨溴索药物组合物 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104840417A (zh) * | 2015-04-30 | 2015-08-19 | 济南康和医药科技有限公司 | 一种盐酸氨溴索注射液及其制备方法 |
| CN110151688A (zh) * | 2019-05-17 | 2019-08-23 | 石家庄学院 | 一种盐酸氨溴索注射液组合物及其制备方法 |
| CN113876705A (zh) * | 2021-11-17 | 2022-01-04 | 石家庄四药有限公司 | 一种盐酸乌拉地尔注射液及其制备方法 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN105250216B (zh) | 适宜雾化吸入用的盐酸氨溴索注射液 | |
| CN101836952B (zh) | 一种氨溴索注射剂及其制备方法 | |
| CN102924302A (zh) | 注射级盐酸氨溴索及其吸入用溶液 | |
| CN101606903A (zh) | 一种氨溴索的雾化吸入用溶液剂及其制备方法 | |
| CN104586758B (zh) | 一种对乙酰氨基酚注射液及其制备方法 | |
| CN103463565A (zh) | 一种莪术油注射液及其制备方法 | |
| CN107233311A (zh) | 一种以阿福特罗和格隆溴铵为活性成分的雾化剂及其制备方法 | |
| CN102988281A (zh) | 一种盐酸氨溴索的注射液及其制备方法 | |
| WO2019119720A1 (zh) | 一种福多司坦雾化吸入用溶液制剂及其制备方法 | |
| CN101627967B (zh) | 盐酸氨溴索液体制剂及其制备方法 | |
| CN111870591B (zh) | 一种控制乙酰半胱氨酸溶液硫化氢含量的方法 | |
| CN109528641A (zh) | 吸入用盐酸氨溴索溶液及其制备方法 | |
| CN111214446B (zh) | 一种供注射用法匹拉韦l-精氨酸盐冻干制剂 | |
| CN111991374A (zh) | 一种瑞德西韦吸入气雾剂及其制备方法 | |
| CN105193712B (zh) | 盐酸氨溴索注射液和制法 | |
| CN101756949A (zh) | 一种盐酸氨溴索与半胱氨酸的组合物及其制备方法 | |
| CN115969778A (zh) | 治疗精神疾病的舒必利注射液及其制法和用途 | |
| CN105213301B (zh) | 硫酸奈替米星注射液及其质控方法 | |
| CN114306218A (zh) | 满足药学抑菌要求的经粘膜给药r-氯胺酮药物组合物 | |
| CN103860461A (zh) | 一种含有活性成分盐酸氨溴索的药物组合物 | |
| CN102716069A (zh) | 含有布洛芬的注射液及其制备工艺 | |
| CN103070824B (zh) | 一种含有伊班膦酸钠的注射液 | |
| CN102525909A (zh) | 盐酸戊乙奎醚注射液的制备方法 | |
| CN111053761B (zh) | 一种吸入用双膦酸类药物及其制备方法及其在慢性阻塞性肺疾病的用途 | |
| CN110200905A (zh) | 一种盐酸氨溴索组合物及其注射液与应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20130327 |