CN102395362B - 含二氢青蒿素的舌下喷雾制剂 - Google Patents
含二氢青蒿素的舌下喷雾制剂 Download PDFInfo
- Publication number
- CN102395362B CN102395362B CN201080017965.1A CN201080017965A CN102395362B CN 102395362 B CN102395362 B CN 102395362B CN 201080017965 A CN201080017965 A CN 201080017965A CN 102395362 B CN102395362 B CN 102395362B
- Authority
- CN
- China
- Prior art keywords
- compositions
- purposes
- sublingual
- artemtherin
- triglyceride
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/006—Oral mucosa, e.g. mucoadhesive forms, sublingual droplets; Buccal patches or films; Buccal sprays
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/357—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having two or more oxygen atoms in the same ring, e.g. crown ethers, guanadrel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0043—Nose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/12—Aerosols; Foams
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/10—Anthelmintics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/14—Ectoparasiticides, e.g. scabicides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
本发明提供用于治疗肿瘤性疾病、吸虫感染和莱姆病的药物组合物,其包括能够提供二氢青蒿素的化合物和配制成用于的中链甘油三酯,其配制成经舌下、口腔或鼻腔粘膜输送,特别是通过喷雾输送。还提供了包含该组合物的输送装置。
Description
技术领域
本发明涉及药物组合物、输送方法、输送装置和用于治疗癌症的方法。本发明还涉及药物组合物、输送方法、输送装置和用于治疗吸虫感染和莱姆病(包柔氏螺旋体病)的方法。
申请人已知的背景技术和现有技术
青蒿素,可以从植物青蒿分离出,已知用于治疗疟疾,还显示出对于治疗大量癌症,即肿瘤肿瘤,特别是恶性肿瘤肿瘤有效。其中,报道治疗成功的如下:
Sing和Panwar(Integrative Cancer Therapies,5(4):2006,391-394)报道采用蒿甲醚治疗垂体腺瘤。
Singh和Verma(Archive of Oncology,10(4):2002,279-280)报道采用青蒿琥酯治疗喉部鳞状细胞癌。
Singh和Lai(Life Sciences,70(2001)49-56)报道了二氢青蒿素和全铁转铁蛋白对于人乳腺癌细胞的选择毒性。
Rowen(Townsend Letter for Doctors and Patients,December 2002)提供了使用青蒿素治疗各种癌症,包括乳腺癌、非霍奇金淋巴瘤、非小细胞肺癌和多种皮肤癌的用途的概述。
Efferth等人(″Anti-malaria drug is also active against cancer″,Int.J.Oncology,18;767-773,2001)报道了青蒿素抗55种癌症系的活性。
据信由于青蒿素与二价铁反应形成自由基的能力:和大多数癌细胞高速率摄入铁,其对于大量癌细胞具有宽泛的作用。
另外,已经证实青蒿素在治疗肝吸虫,特别是血吸虫病中有效。Keiser和Morson(Exp.Parasitol.,118(2),2008:228-37)报道了青蒿琥酯和蒿甲醚抗肝吸虫肝片吸虫的活性。
Keiser等人(J.Antimicrobial Chemotherapy,2006,57,1139-1145)还报道了青蒿琥酯和蒿甲醚是有效的抗肝片吸虫病药物。
Utzinger等人(Curr Opin Investig Drugs,2007Feb 8(2),105-16)报道了青蒿素用于治疗感染疟原虫属(Plasmodium spp.)和埃及血吸虫(Schistosoma haematobium)的用途(其具有有希望的活性),或青蒿素抗肠吸虫和肝吸虫的用途以及抗癌细胞的用途。
最近的观察还发现青蒿素具有抗包柔氏螺旋体属细菌的活性,所述细菌是莱姆病的病原体。伯氏包柔氏螺旋体(Borrelia burgdorferi)是美国莱姆病的主要病因,阿氏疏螺旋体(Borrelia afzelii)和嘎氏疏螺旋体(Borrelia garinii)是大多数欧洲病例中更常见的病原体。
因此,其中在治疗这些病症中有用的活性药物是来源于青蒿素的大量化合物,青蒿素是一种最初从青蒿中分离出的倍半萜烯内酯内过氧化物(Woodrow et al.Postgrad.Med.J.2005;81:71-78)。这些化合物包括半合成衍生物青蒿醇、青蒿琥酯、青蒿素甲醚和蒿乙醚(青蒿醚)。国际药典(Ph.Int.,World Health Organisation)列出了用于治疗疟疾的大量这些化合物(其对于抗疟疾也是活性的),即:胶囊、片剂或可注射制剂形式的青蒿素甲醚;胶囊或片剂形式的青蒿素;可注射制剂形式的蒿甲醚;和片剂形式的青蒿醇和青蒿琥酯。
一旦摄入体内,青蒿素转变成二氢青蒿素,因而这些活性化合物包括在体内提供二氢青蒿素的所有那些化合物。
一个与给药青蒿素有关的特定问题是其生物利用度低,并且当通过口服途径服用时存在首过效应,如下所述。此外,对于长期癌症治疗而言,特别优选的是患者能够自我给药的药物,或者药物可以通过非合格的助手给药,特别是在家庭环境中。这将允许患者留在家中,减轻了保健系统的压力。此外,癌症患者通常是免疫受损的,因此,保持它们远离其中获得感染的概率较高的环境,例如医院,是特别有利的。因为这些原因,至少口服剂量给药青蒿素不是有效的,特别是对于癌症疗法所需的长期治疗、对于治疗吸虫感染或治疗莱姆病;可注射的治疗有感染风险的倾向,需要有医疗资格的人员,并且在贮存期间不稳定;栓剂给药对于许多培养物也是不可接受的,不能被正经受腹泻的患者反复吸收。
可以看出,所有这些制剂都面对如上所述的给药困难。因此,本发明的目的是解决这些问题及其它问题。
发明内容
因此,在第一个方面,本发明提供一种用于治疗肿瘤肿瘤的药物组合物,其包含:能够提供二氢青蒿素的化合物;和选自如下组分的可药用赋形剂:中链甘油三酯;短链甘油三酯;ω-3-海产甘油三酯;和富含ω-3-酸的鱼油,所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
在第二个方面,本发明提供一种用于治疗吸虫感染的药物组合物,其包含:能够提供二氢青蒿素的化合物;和选自如下组分的可药用赋形剂:中链甘油三酯;短链甘油三酯;ω-3-海产甘油三酯;和富含ω-3-酸的鱼油,所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
在第三个方面,本发明提供一种用于治疗莱姆病(疏螺旋体病)的药物组合物,其包含:能够提供二氢青蒿素的化合物;和选自如下组分的可药用赋形剂:中链甘油三酯;短链甘油三酯;ω-3-海产甘油三酯;和富含ω-3-酸的鱼油,所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
本发明人发现经舌下粘膜、经口腔粘膜和经鼻腔粘膜途径给药蒿甲醚或蒿乙醚能够有效地将该药物输送进入体循环,例如用于治疗癌症和吸虫感染。此外,其首次提供了需要治疗的患者可接受的给药途经,并且其可以由不具有有医疗资格的人员给药。因此,其在治疗这些病症中具有特别的优点。所述组合物可以例如作为液体推注剂,或更优选地作为喷雾剂经舌下输送。
在欧洲药典0868中,中链甘油三酯定义为:
饱和脂肪酸甘油三酯的混合物,主要是辛酸(羊脂酸,C8H16O2)和羊蜡酸(癸酸,C10H20O2)的甘油三酯的混合物。中链甘油三酯是从椰子属(Cocos nucifera L.)胚乳的硬的、干燥部分或从非洲油棕(Elaeis guineensis Jacq)的干燥胚乳提取的油获得的。当中链甘油三酯是从椰子属的胚乳制备时,可以使用分馏椰子油。中链甘油三酯具有最少95.0%的8-10个碳原子的饱和脂肪酸。其它化学及物理特性描述在欧洲药典0868和等同文件中。
短链甘油三酯为具有链长小于6个碳原子的甘油三酯。
ω-3-海产甘油三酯在欧洲药典0868中定义为ω-3酸与甘油的单酯、二酯和三酯的混合物,主要包含三酯,其是通过浓缩纯化的ω-3酸与甘油酯化得到,或通过ω-3酸乙酯与甘油酯交换得到。ω-3酸的来源是来自如鳀科、鲹科、鲱科、胡瓜鱼科、鲑科和鲭科的多脂鱼种的鱼体油。ω-3酸确定为下述酸:α-亚麻酸(C18:3n-3)、十八碳四烯酸(C18:4n-3)、二十碳四烯酸(C20:4n-3)、二十碳五烯酸(花生五烯酸)(C20:5n-3;EPA)、二十一碳五烯酸(C21:5n-3)、二十二碳五烯酸(C22:5n-3)和鱼油酸(二十二碳六烯酸)(C22:6n-3;DHA)。ω-3酸EPA和DHA的含量之和表示成甘油三酯为最少45.0%,全部ω-3酸表示成甘油三酯为最少60.0%。可以加入生育酚作为抗氧剂。
富含ω-3-酸的鱼油也在欧洲药典中定义为从鳀科、鲹科、鲱科、胡瓜鱼科、鲭科和玉筋鱼科(Ammodytidae)的鱼获得的纯化、冷凝和除臭的脂油。ω-3酸确定为下述酸:α-亚麻酸(C18:3n-3)、十八碳四烯酸(C18:4n-3)、二十碳四烯酸(C20:4n-3)、二十碳五烯酸(二十碳五烯酸)(C20:5n-3;EPA)、二十一碳五烯酸(C21:5n-3)、二十二碳五烯酸(C22:5n-3)和鱼油酸(二十二碳六烯酸)(C22:6n-3;DHA)。
富含ω-3-酸的鱼油的含量如下:
EPA,表示为甘油三酯:最少13.0%,
DHA,表示为甘油三酯:最少9.0%,
全部ω-3-酸,表示为甘油三酯:最少28.0%。
可以加入浓度不超过主管部门规定水平的官方批准的抗氧剂。
虽然这些定义界定列举赋形剂的特别优选的组成,本领域技术人员应当理解合适的可选赋形剂的组成也可偏离这些精确的组成限定。选择的赋形剂应当显示出类似化学性质,比如以所需浓度溶解青蒿素甲醚或蒿乙醚或其它提供二氢青蒿素的化合物的能力,而不降解可药用活性成分,并且是无毒的。赋形剂还应当具有类似物理性质,比如在体温下至少是液态,优选地具有允许赋形剂使用在如下所述优选的喷雾制剂中的合适粘度。当在泵式喷雾器中使用时,用于这些应用的粘度应当足够低至能够雾化,如下所述。
作为一个实例,组合物可以基本上由青蒿素甲醚或蒿甲醚和可药用赋形剂组成,所述可药用赋形剂基本上由在37℃下为液态的甘油三酯和中链甘油三酯(如本文定义的)组成。
本发明的特别优选的组合物基本上由下述组成:青蒿素甲醚或蒿乙醚;和一种或多种选自下述的可药用赋形剂:中链甘油三酯;短链甘油三酯;和ω-3-海产甘油三酯,所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。不含显著量的其它物质(例如较高分子量脂质)使得组合物理论上适于经鼻腔粘膜、口腔粘膜,特别是舌下粘膜输送。
更优选的组合物包括:蒿甲醚或蒿乙醚和选自下述的可药用赋形剂:中链甘油三酯;短链甘油三酯;和ω-3-海产甘油三酯,所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药,特别是基本上由下述组成的组合物:蒿甲醚和选自下述的可药用赋形剂:中链甘油三酯;短链甘油三酯;和ω-3-海产甘油三酯,所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
在任一种这些组合物中,特别优选的是所述组合物基本上不含水,如本发明人已经发现,与接受的信念相反,水可以显著地减少该组合物的贮存期限,特别是当贮存在环境温度下是。优选的组合物具有小于1%(w/w)的水,更优选地小于0.5%(w/w)的水,最优选地小于0.1%(w/w)的水。
而且在任一种这些组合物中,特别优选地所述组合物基本上不含乙醇。此外,本发明人已经发现乙醇会导致可药用活性组分降解。优选的组合物特别地具有小于1%(w/w)的乙醇,更优选地小于0.5%(w/w)的乙醇,最优选地小于0.1%(w/w)的乙醇。
而且,在任一种这些组合物中,优选地青蒿素甲醚或蒿乙醚的存在浓度为2至250毫克/克赋形剂。该浓度提供了用于所述经粘膜输送的预期量的合适水平。更优选地,所述组合物包括:以2至200毫克/克赋形剂的浓度溶于赋形剂中的青蒿素甲醚或蒿乙醚。其它优选的浓度为2至100毫克/克;2至50毫克/克。较低的浓度提供特别适于儿科使用的组合物,也更可能保证可药用活性组分在宽的温度范围下保持在溶液中,而不具有一些部分比如悬浮物。这对于保证通过所列举的经粘膜途径输送药物来说特别重要。如果显著量的活性组分没有在溶液中,则一些活性成分被吞服的可能性增加,从而降低了如下所述的这种经粘膜输送的有利效果。
在特别优选的组合物中,所述赋形剂包括中链甘油三酯,所述甘油三酯包括最少95%具有6至12个碳原子的饱和脂肪酸。更优选地,所述赋形剂包括中链甘油三酯,所述甘油三酯包括最少95%具有8至10个碳原子的饱和脂肪酸。
而且在任一种这样的组合物中,特别优选地是所述组合物进一步包括精油,比如薄荷醇、香草醛或橙油、柠檬油、丁香油、薄荷油、留兰香油。这种精油特别是薄荷醇(其起增溶剂的作用)的特定技术优点描述如下。除了任何增溶的效果之外,这种精油还起香味剂的作用,具有大量益处:所述香味剂掩蔽了药物的令人不愉快的气味,从而导致患者顺应性增加。这对于基本上液体基制剂特别重要的,由于其性质其不能被包囊或“包糖衣”。所述香味剂也赋予药物的使用者或给药者反馈该药物已经成功地输送(患者可以感受到其气味),和此外其已经被输送到合适的位置。
在第二个方面,本发明提供一种包含本文描述的组合物的药物输送装置,所述装置适于输送独立剂量或连续剂量的所述组合物,每个独立剂量或连续剂量具的体积小于1000微升。使用小剂量体积减小了组合物被患者吞服或吐出的可能性。该可能性可通过使用更小体积(特别是在儿科中或用于鼻腔输送)进一步减小,因此,在进一步优选的实施方案中,每个连续剂量具有的体积小于600微升;小于400微升;小于200微升;或者甚至小于100微升。对于儿科使用或鼻腔输送,更小体积是特别优选的。
在第三个方面,本发明提供一种包含本文描述的组合物的药物输送装置,所述装置和组合物适于输送独立剂量或连续剂量的所述组合物,每个独立剂量或连续剂量包含不超过100mg,优选地不超过80mg的能够提供二氢青蒿素的化合物,比如青蒿素甲醚或蒿乙醚。这样的装置优选地适于促进舌下输送,特别是由非医学训练人员输送。用每种剂量限制输送的活性药物的含量在由缺少经验的人员治疗(例如患者在家庭环境中自我给药,其可能是长期抗癌疗法)中以避免过量给药特别重要。优选地,所述装置和组合物适于输送独立剂量或连续剂量的所述组合物,每个独立剂量或连续剂量包含不超过10mg能提供二氢青蒿素的化合物,比如青蒿素甲醚或蒿乙醚。这提供了用于儿科使用的合适装置。
优选地,根据这些方面的输送装置包括喷雾器,特别是泵式喷雾器。使用泵式喷雾器增加了应用组合物的粘膜面积,从而增加了吸收和最小化药物被吞服的可能。更优选地,所述装置适于产生具有平均液滴直径大于20微米,或者甚至大于50微米,或者优选地大于75微米的组合物喷雾剂。因此,避免或减少了非故意输送药物至肺。
在第四个方面,本发明还提供一种用于提供药物剂量的装置,其包括包含本文描述的药物组合物的容器,和设置用于输送所述药物组合物至容器外部的阀工具。这样的装置可以连接到例如单独的经口腔粘膜、经鼻腔粘膜或经舌下粘膜的输送装置,比如喷雾器。
在第五个方面,本发明提供一种用于治疗肿瘤、吸虫感染或莱姆病的试剂盒,其包括本文描述的组合物和向有需求的患者通过经舌下、口腔或鼻腔粘膜途径给药所述组合物的使用说明。优选地,所述试剂盒含有向有需求的患者通过舌下途径给药所述组合物的使用说明。
在第六个方面,本发明提供一种治疗肿瘤性疾病、吸虫感染或莱姆病的方法,其包括向有需求的患者通过经舌下、口腔或鼻腔粘膜途径给药提供治疗有效量的二氢青蒿素(例如青蒿素,特别是青蒿素甲醚或蒿乙醚)的化合物。更优选地,所述给药是通过舌下途径。
在本发明的范围内还包括使用二氢青蒿素供体化合物在制备治疗肿瘤性疾病、吸虫感染或莱姆病的根据如上所述任一个方面或优选的方面的药物组合物中的用途。
优选地,本发明提供的任一药物组合物或装置都用于治疗肿瘤、吸虫感染或莱姆病。
在任一本发明的组合物中,特别优选地所述组合物还包括转铁蛋白,比如全铁转铁蛋白,因为其增强二氢青蒿素的作用。
在本发明的任一治疗方法中,特别优选地是共同给药转铁蛋白,比如全铁转铁蛋白,因为其增强二氢青蒿素的作用。
在本发明的任一个治疗方法中,特别优选地是将所述二氢青蒿素供体化合物配制在如上所述组合物中。
本发明的范围内还包括基本上如本文描述的、参照附图的任何合适的组合或通过附图的任何合适的组合阐述的药物组合物、药物输送装置、试剂盒和方法。
放弃的实施方案
在本发明的优选的实施方案中,特别地放弃在共同悬而未决的国际专利申请PCT/GB2008/050999中公开的下述编号的方面:
1.药物组合物,其包含:
青蒿素甲醚或蒿乙醚;和
可药用赋形剂,选自:
中链甘油三酯;
短链甘油三酯;
ω-3-海产甘油三酯;和
富含ω-3-酸的鱼油
所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
2.根据方面1的组合物,其基本上由下述组分组成:
青蒿素甲醚或蒿乙醚;和
一种或多种可药用赋形剂,选自:
中链甘油三酯;
短链甘油三酯;
ω-3-海产甘油三酯;和
富含ω-3-酸的鱼油
所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
3.根据方面1的组合物,其包含:
青蒿素甲醚,和
可药用赋形剂,选自:
中链甘油三酯;
短链甘油三酯;
ω-3-海产甘油三酯;和
鱼油,富含ω-3-酸
所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
4.根据方面1的组合物,其基本上由下述组分组成:
青蒿素甲醚,和
一种或多种可药用赋形剂,选自:
中链甘油三酯;
短链甘油三酯;和
ω-3-海产甘油三酯;和
富含ω-3-酸的鱼油
所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
5.根据方面1的组合物,其基本上由下述组分组成:
青蒿素甲醚或蒿乙醚;和
基本上由下述组成的可药用赋形剂:
甘油三酯,在37℃下为液态;和
中链甘油三酯;
所述组合物配制成用于经舌下、口腔或鼻腔粘膜剂量给药。
6.根据任一个前述方面的组合物,其基本上不含水。
7.根据任一个前述方面的组合物,其基本上不含乙醇。
8.根据任一个前述方面的药物组合物,其中青蒿素甲醚或蒿乙醚的存在浓度为2至250毫克/克赋形剂。
9.根据任一个前述方面的组合物,其中所述赋形剂包括中链甘油三酯,所述甘油三酯包括最少95%具有6-12个碳原子的饱和脂肪酸。
10.根据方面8的组合物,其中所述赋形剂包括中链甘油三酯,所述甘油三酯包括最少95%具有8-10个碳原子的饱和脂肪酸。
11.根据任一项前述方面的组合物,其进一步包括精油比如薄荷醇、香草醛或橙油、柠檬油、丁香油、薄荷油、留兰香油。
12.根据任一个前述方面的组合物,用于治疗或预防疟疾。
13.根据任一个前述方面的组合物,配制成用于舌下输送。
14.药物输送装置,其包含根据任一项前述方面的组合物,所述装置适于输送独立剂量或连续剂量的所述组合物,每个独立剂量或连续剂量具有的体积小于1000微升。
15.药物输送装置,其包含根据任一项前述方面的组合物,所述装置和组合物适于输送独立剂量或连续剂量的所述组合物,每个独立剂量或连续剂量包含不超过80mg的青蒿素甲醚或蒿乙醚。
16.药物输送装置,其包含根据任一项前述方面的组合物,所述装置和组合物适于输送独立剂量或连续剂量的所述组合物,每个独立剂量或连续剂量包含不超过10mg的青蒿素甲醚或蒿乙醚。
17.根据方面14至16中任一项的输送装置,其中所述装置包括泵式喷雾器。
18.根据方面17的输送装置,其中所述装置适于制备具有平均液滴直径大于20微米的组合物喷雾剂。
19.一种用于提供药物剂量的装置,其包括包含根据方面1至13中任一项的药物组合物的容器,和设置输送所述药物组合物的剂量至容器外部的阀工具。
20.一种用于治疗或预防疟疾的试剂盒,其包括根据方面1至13中任一项的组合物和向有需求的患者通过经舌下、口腔或鼻腔粘膜途径给药所述组合物的使用说明。
21.一种用于治疗或预防疟疾的试剂盒,其包括根据方面1至13中任一项的组合物和向有需求的患者通过舌下途径给药所述组合物的使用说明。
22.一种治疗对青蒿素甲醚或蒿乙醚有应答性的疾病的方法,其包括向有需求的患者通过经舌下、口腔或鼻腔粘膜途径给药治疗有效量的青蒿素甲醚或蒿乙醚。
23.一种治疗对青蒿素甲醚有应答性的疾病的方法,其包括向有需求的患者通过经舌下、口腔或鼻腔粘膜途径给药治疗有效量的青蒿素甲醚。
24.根据方面22或23的方法,其中所述给药是通过舌下途径。
25.根据方面22至24中任一项的方法,其中所述疾病是疟疾。
26.一种用于治疗疟疾的试剂盒,其包括根据方面1至13中任一项的组合物和向有需求的患者通过经舌下、口腔或鼻腔粘膜途径给药所述组合物的使用说明。
27.一种用于治疗疟疾的试剂盒,其包括根据方面1至13中任一项的组合物和向有需求的患者通过经舌下粘膜途径给药所述组合物的使用说明。
具体实施方式
提供临床有用的治疗对二氢青蒿素(在体内由青蒿素比如青蒿素甲醚、蒿乙醚和青蒿琥酯代谢产生)有应答性的疾病、感染的最重要的方面之一是提供一种活性成分的制剂和给药途经,所述活性成分可以承受其中疾病是特别严重问题的那些群体的挑战。例如,任何制剂都需要长期稳定,且在其中例如血吸虫病是地方病的地区遭遇的较高温度下稳定。药物通常需要给药(没有延迟)至虚弱的、或许营养不良的和可能遭受上吐下泻的个体。在许多情况下,所述药物也可能需要由非医学训练人员给药。对于具有良好(和相容的)生物利用度的任何活性成分而言,保证药物到达作用位点而没有不良副作用也很重要。
为了解决这些问题,本发明人发现经舌下、口腔或鼻腔经粘膜途径给药青蒿素甲醚提供了比口服(即吞服)或肌内途径表现出的较高且更可重现水平的生物利用度更大的可能性。Navaratnam等人(Clin Pharmacokinet,2000,Oct;39(4):255-270)报道口服给药动物青蒿素甲醚的生物利用度低到19-35%,当肌肉注射给药时仅仅为54%。在人类中,青蒿素甲醚的生物利用度在肌内(25%)和直肠内(35%)途径中都很低,并且吸收方面都有相当大的可变性。该作者报道“在患有脑型疟的儿童中的初步研究显示肌内青蒿素甲醚的生物利用度是高度可变的,可能潜在地影响大多数严重疾病患者的治疗结果”。
使用经舌下、口腔或鼻腔粘膜途径给药避免了口服和直肠给药出现的首过效应。虽然成年人也许能够忍受克服药物的低生物利用度所需的短期大口服剂量的青蒿素甲醚,但是在儿童中的情形不是如此,因此,本文公开的组合物特别地适于治疗可能需要延长药物期的疾病比如癌症或可能用于儿科使用。
初始、可信的剂量范围研究的初步结果如下,显示出当通过舌下喷雾给药时,与口服给药片剂相比,药物的生物利用度出现令人惊奇地增加。
本发明人还发现,与接受的观念相反,当与可用于气雾剂的水、乙醇、或推进剂接触时,青蒿素甲醚不稳定。
表1和2显示存在于青蒿素甲醚API中的杂质,和存在于三种溶剂体系中的青蒿素甲醚:20%乙醇+80%推进剂;50%乙醇+50%推进剂;100%乙醇;和中链甘油三酯,在这种情况下,甘油三酯为以注册商标Miglyol810销售的。Miglyol为包含饱和的C8至C10脂肪酸的中链甘油三酯,典型地包含65-80%的辛酸(C8:0)和20-35%的癸酸(C10:0)。
表1显示所述组合物在30℃下贮存8周之后的杂质(作为青蒿素甲醚的HPLC色谱的峰面积的百分数)。表2在40℃下贮存8周之后的相应杂质。
表1-贮存在30℃下
表2-贮存在40℃下
代表性的色谱显示在图13中。可以看出Miglyol810制剂中的杂质水平没有显著地高于在起始青蒿素甲醚API中观察到的。在所有的其它情形中,杂质水平高于ICH用于新药产品杂质的三方协调指南下允许的那些,而没有具体鉴定或进行进一步毒理学检查。
因此,在中链甘油三酯,特别是饱和的甘油三酯比如Miglyol810中的溶液构成活性成分的稳定制剂。由于是饱和的甘油三酯,据信这将赋予青蒿素甲醚稳定性。根据其化学结构,很可能青蒿素甲醚降解的主要途径是经由还原机理,其可以解释这种含饱和脂肪酸的甘油三酯给予的保护作用。
当在喷雾输送系统中使用时,例如在人工操纵的泵式喷雾器中,甘油三酯也起泵和阀润滑剂的作用,从而消除了向制剂加入另外的润滑剂的需要。使用这种中链甘油三酯也得到了用于泵式喷雾器输送系统中合适粘度和表面张力的制剂。
进一步的优点还来自于使用中链甘油三酯:其为疏水性的,所述甘油三酯粘附到口腔粘膜,因而给予青蒿素甲醚经粘膜吸收的时间。所述组合物的疏水性质抵抗被唾液作用从口腔中冲洗掉,唾液以其它方式引起活性成分被吞服。
在本发明的特别优选的实施方案中,青蒿素甲醚-甘油三酯溶液补充有薄荷醇,或者补充有橙油或香草。本发明人发现这具有许多益处:
(1)其起味觉掩蔽剂的作用在给药药物至孩子或需要长期服用药物的患者特别重要;患者经受到药物的任何不良气味都可能会使患者顺应性更低。
(2)精油也起渗透促进剂作用,以提高药物成分经由口腔粘膜的摄取。
(3)加入香味剂还使给药药物的人员能够检查:首先药物已经分配(患者可以尝味道或闻气味),第二,其已经分配到合适的位置-如果药物例如偶然地直接分配到咽喉,应当没有任何味觉。
(4)一个令人惊奇的特性是精油(特别是左薄荷脑)也帮助青蒿素甲醚溶解。在溶解性试验中,当在青蒿素甲醚之前加入薄荷醇时,青蒿素甲醚在miglyol中的溶出出现在其后4分30秒,与之相比,当在薄荷醇之前加入青蒿素甲醚时,所述溶出出现在5分55秒。
作为一个实例,将优选的制剂(用于舌下或口腔儿科使用)在表3和4中给出。用于成年人使用,或者用于治疗某些指征,预期浓度可高于或低于所示例的。给出的两个不同剂量浓度适于喷雾输送系统。可以给出大量喷雾(即,100微升的独立喷雾启动),取决于待治疗儿童的体重:
表3:3mg青蒿素甲醚/启动
表4:6mg青蒿素甲醚/启动
表5列出了儿科使用的优选剂量方案的实例。预期另一种方案,例如剂量给药3mg/kg体重
表5:儿科剂量方案
可以以较高浓度的青蒿素甲醚,比如150-200mg/ml制备成年人使用的制剂。对于成年人使用,独立喷雾体积可以大于此处对于儿科使用描述的100微升的实例。
青蒿素甲醚的生物利用度
本申请人进行了可信的试验,以评价与口服给药片剂相比通过舌下途径输送时本发明的含青蒿素甲醚组合物的摄取。
对健康的男性成年人志愿者(16名受试者/群)进行试验,受试者受到了正常伦理学批准。研究根据本发明的三个单剂量方案,并与使用口服剂量片剂的方案相比,如下:
舌下喷雾剂方案
如上所述制备青蒿素甲醚的喷雾剂制剂,并通过舌下途径单次给药至一组志愿者。给予多次连续启动喷雾器,如下表6所示。
表6-单剂量研究的剂量方案
舌下喷雾制剂
参照口服剂量
作为参照,单次给药第四组志愿者包含青蒿素甲醚的片剂,如下表7所示。
表7-单剂量研究的剂量方案
口服片剂制剂
在给药每种剂量方案之后,采集受试者的血样,测定青蒿素甲醚及其即时代谢产物二氢青蒿素的血浆浓度,以便比较两种途径的生物利用度。
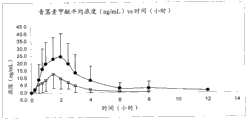
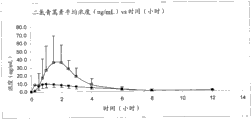
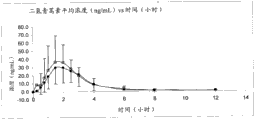
图1-6显示两个比较剂量方案的青蒿素甲醚的平均血浆浓度。图7-12显示相应的二氢青蒿素平均血浆浓度。
图1和7比较了方案T1(方块)和T4(圆点):15mg青蒿素甲醚,经由5次舌下喷雾剂量,vs.30mg青蒿素甲醚,经由片剂。
图2和8比较了方案T2(方块)和T4(圆点):30mg青蒿素甲醚,经由10次舌下喷雾剂量,vs.30mg青蒿素甲醚,经由片剂。
图3和9比较了方案T3(方块)和T4(圆点):30mg青蒿素甲醚,经由5次舌下喷雾剂量,vs.30mg青蒿素甲醚,经由片剂。
图4和10比较了方案T1(方块)和T2(圆点):15mg青蒿素甲醚,经由5次舌下喷雾剂量,vs.30mg青蒿素甲醚,经由10次舌下喷雾剂量。
图5和11比较了方案T2(方块)和T3(圆点):30mg青蒿素甲醚,经由10次舌下喷雾剂量,vs.30mg青蒿素甲醚,经由5次舌下喷雾剂量。
图6和12比较了方案T1(方块)和T3(圆点):15mg青蒿素甲醚,经由5次舌下喷雾剂量,vs.30mg青蒿素甲醚,经由5次舌下喷雾剂量。
将四个剂量方案的每个的药代动力学数据给出在下表8-11中:
表8:试验组T1
15mg青蒿素甲醚舌下喷雾剂的单次舌下给药:3mg/启动
关键词:
表9:试验组T2
30mg青蒿素甲醚舌下喷雾剂的单次舌下给药:3mg/启动
关键词如表8
表10:试验组T3
30mg青蒿素甲醚舌下喷雾剂的单次舌下给药:6mg/启动
关键词如表8
表11:试验组T4
30mg青蒿素甲醚片剂的单次口服给药,10mg/片
关键词如表8
从这些初步结果,可以看出作为一种广为接受的吸收测量方式,下列剂量的12个小时内的血液浓度曲线下的面积(AUC0-12)的比较表明与口服药片剂给药相比,本文公开的喷雾制剂的舌下给药显示出显著的和令人惊奇的青蒿素甲醚的高吸收。
通过经由本文描述的舌下喷雾途径与口服片剂给药青蒿素甲醚的生物利用度的比较,我们计算出通常用于比较两种剂量方案的青蒿素甲醚数据的F-值如下,两个剂量分别用A和B表示:
结果如下:
FT1-T4=1.67±0.60(S.D.)
FT2-T4=2.24±0.92(S.D.)
FT3-T4=2.09±0.69(S.D.)
这表明与口服给药片剂相比,当作为如本文描述的舌下喷雾剂给药时,多吸收了约1.7至2.2倍的青蒿素甲醚,尽管口服剂量最初是舌下喷雾给药两倍多。因此,对于同等剂量,舌下途径所显示出的生物利用度为口服途径的至少两倍。
检查表8-11和图1-12的数据还证实了主要活性代谢产物青蒿素甲醚(二氢青蒿素)也有这一规律。
自身诱导的避免
已知口服和直肠给药青蒿素都与个体的药物代谢的自动诱导相关(参见例如AshtonM,Hai TN,Sy ND,Huong DX,Van Huong N,Nieu NT,Cong LD.″Artemisininpharmacokinetics is time-dependent during repeated oral administration in healthy maleadults.″,Drug Metab Dispos.1998;26:25-7,和″Retrospective analysis of artemisininpharmacokinetics:application of a semiphysiological autoinduction model″,Asimus andGordi,Br.J Clin Pharmacol.2007June;63(6):758-762)。因此,系统循环青蒿素随着每个连续剂量下降,从而降低了药物剂量方案的有效性。
在可信试验中,本发明人发现通过经舌下粘膜途径给药青蒿素避免了这样的自动诱导,引起活性药物代谢产物二氢青蒿素的一致性摄取和全身浓度累积,从而在通过舌下途径给药方面具有显著的优势。通过经口腔粘膜或经鼻腔粘膜途径输送也预期到类似地避免自身诱导。
在可信测试中,对志愿者进行如下处理:在第1天和第5天进行30mg青蒿素甲醚舌下喷雾6mg/启动的单次给药,接着整夜禁食,在第2、3、和4天进行每日两次30mg青蒿素甲醚3mg/启动的舌下喷雾给药,然后进行早餐或晚餐。在下述时间点采集血样进行药代动力学分析:
第1天:服药前、服药后0.25、0.5、0.75、1、1.5、2、2.5、3、4、6、8和12小时。
第2、3和4天:早晨服药前和早晨服药后0.5、1、2和4小时,及晚上服药前和晚上服药后1小时。
第5天:服药前、服药后0.25、0.5、0.75、1、1.5、2、2.5、3、4、6、8、12和24小时。在第1天和第5天的血浆二氢青蒿素的药代动力学分析显示出同样有效的反应,表明没有自身诱导。血浆浓度曲线显示在图14中。
附图说明
图1:在单次舌下给药15mg青蒿素甲醚舌下喷雾剂3mg/启动(T1)和单次口服给药30mg青蒿素甲醚片剂10mg/片剂(T4)之后的平均血浆青蒿素甲醚浓度vs时间的标准偏差图。平均值±SD(●=参照,T4,□=试验,T1)
图2:在单次舌下给药30mg青蒿素甲醚舌下喷雾剂3mg/启动(T2)和单次口服给药30mg青蒿素甲醚片剂10mg/片剂(T4)之后的平均血浆青蒿素甲醚浓度vs时间的标准偏差图。平均值±SD(●=参照,T4,□=试验,T2)
图3:在单次舌下给药30mg青蒿素甲醚舌下喷雾剂6mg/启动(T3)对比单次口服给药30mg青蒿素甲醚片剂10mg/片剂(T4)之后的平均血浆青蒿素甲醚浓度vs时间的标准偏差图。平均值±SD(●=参照,T4,□=试验,T3)
图4:在单次舌下给药15mg青蒿素甲醚舌下喷雾剂3mg/启动(T1)对比单次舌下给药30mg青蒿素甲醚舌下喷雾剂3mg/启动(T2)之后的平均血浆青蒿素甲醚浓度vs时间的标准偏差图。平均值±SD(●=参照,T2,□=试验,T1)
图5:在单次舌下给药30mg青蒿素甲醚舌下喷雾剂3mg/启动(T2)对比单次舌下给药30mg青蒿素甲醚舌下喷雾剂6mg/启动(T3)之后的平均血浆青蒿素甲醚浓度vs时间的标准偏差图。平均值±SD(●=参照,T3,□=试验,T2)
图6:在单次舌下给药15mg青蒿素甲醚舌下喷雾剂3mg/启动(T1)对比单次舌下给药30mg青蒿素甲醚舌下喷雾剂6mg/启动(T3)之后的平均血浆青蒿素甲醚浓度vs时间的标准偏差图。平均值±SD(●=参照,T3,□=试验,T1)
图7:在单次舌下给药15mg青蒿素甲醚舌下喷雾剂3mg/启动(T1)和单次口服给药30mg青蒿素甲醚片剂10mg/片剂(T4)之后的平均血浆二氢青蒿素浓度vs时间的标准偏差图。平均值±SD(●=参照,T4,□=试验,T1)
图8:在单次舌下给药30mg青蒿素甲醚舌下喷雾剂3mg/启动(T2)和单次口服给药30mg青蒿素甲醚片剂10mg/片剂(T4)之后的平均血浆二氢青蒿素浓度vs时间的标准偏差图。平均值±SD(●=参照,T4,□=试验,T2)
图9:在单次舌下给药30mg青蒿素甲醚舌下喷雾剂6mg/启动(T3)对比单次口服给药30mg青蒿素甲醚片剂10mg/片剂(T4)之后的平均血浆二氢青蒿素浓度vs时间的标准偏差图。平均值±SD(●=参照,T4,□=试验,T3)
图10:在单次舌下给药15mg青蒿素甲醚舌下喷雾剂3mg/启动(T1)对比单次舌下给药30mg青蒿素甲醚舌下喷雾剂3mg/启动(T2)之后的平均血浆二氢青蒿素浓度vs时间的标准偏差图。平均值±SD(●=参照,T2,□=试验,T1)
图11:在单次舌下给药30mg青蒿素甲醚舌下喷雾剂3mg/启动(T2)对比单次舌下给药30mg青蒿素甲醚舌下喷雾剂6mg/启动(T3)之后的平均血浆二氢青蒿素浓度vs时间的标准偏差图。平均值±SD(●=参照,T3,□=试验,T2)
图12:在单次舌下给药15mg青蒿素甲醚舌下喷雾剂3mg/启动(T1)对比单次舌下给药30mg青蒿素甲醚舌下喷雾剂6mg/启动(T3)之后的平均血浆二氢青蒿素浓度vs时间的标准偏差图。平均值±SD(●=参照,T3,□=试验,T1)。
Claims (15)
1.一种药物组合物在制备用于治疗肿瘤性疾病的药物中的用途,所述组合物包含:
能够提供二氢青蒿素的化合物;
和
选自下述的可药用赋形剂:
中链甘油三酯;
短链甘油三酯;
ω-3海产甘油三酯;和
富含ω-3-酸的鱼油
所述组合物配制成用于经舌下、口腔或鼻腔粘膜给药。
2.根据权利要求1的用途,其中所述肿瘤性疾病为恶性肿瘤。
3.根据权利要求2的用途,其中所述肿瘤性疾病选自∶
垂体腺瘤;
鳞状细胞癌;
乳腺癌;
非霍奇金淋巴瘤;
皮肤癌;和
肺癌。
4.根据权利要求3的用途,其中所述肺癌为非小细胞肺癌。
5.一种药物组合物在制备用于治疗吸虫感染的药物中的用途,所述组合物包含:
能够提供二氢青蒿素的化合物;
和
选自下述的可药用赋形剂:
中链甘油三酯;
短链甘油三酯;
ω-3-海产甘油三酯;和
富含ω-3-酸的鱼油
所述组合物配制成用于经舌下、口腔或鼻腔粘膜给药。
6.一种药物组合物在制备用于治疗莱姆病的药物中的用途,所述组合物包含:
能够提供二氢青蒿素的化合物;
和
选自下述的可药用赋形剂:
中链甘油三酯;
短链甘油三酯;
ω-3-海产甘油三酯;和富含ω-3-酸的鱼油
所述组合物配制成用于经舌下、口腔或鼻腔粘膜给药。
7.根据权利要求1至6中任一项的用途,其中所述组合物由下述组分组成:
能够提供二氢青蒿素的化合物;和
选自下述的可药用赋形剂:
中链甘油三酯;
短链甘油三酯;
ω-3-海产甘油三酯;和
富含ω-3-酸的鱼油
所述组合物配制成用于经舌下、口腔或鼻腔粘膜给药。
8.根据权利要求1至6中任一项的用途,其中所述组合物由下述组分组成:
能够提供二氢青蒿素的化合物;和
可药用赋形剂,其由下述组分组成:
在37℃下为液态的甘油三酯;和
中链甘油三酯;
所述组合物配制成用于经舌下、口腔或鼻腔粘膜给药。
9.根据权利要求1至6中任一项的用途,其中所述化合物为青蒿素。
10.根据权利要求9的用途,其中所述化合物为青蒿素甲醚或蒿乙醚。
11.根据权利要求1-6中任一项的用途,其中所述组合物具有小于1%(w/w)的水。
12.根据权利要求1-6中任一项的用途,其中所述组合物具有小于1%(w/w)的乙醇。
13.根据权利要求1-6中任一项的用途,其中所述组合物进一步包含精油。
14.根据权利要求13所述的用途,其中所述精油为薄荷醇、香草醛或橙油、柠檬油、丁香油、薄荷油或留兰香油。
15.根据权利要求1-6中任一项的用途,其中所述组合物配制成用于舌下输送。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/GB2009/050415 WO2010122275A1 (en) | 2009-04-23 | 2009-04-23 | Pharmaceutical preparation |
| GBPCT/GB2009/050415 | 2009-04-23 | ||
| GB0906971.7A GB2469791B (en) | 2009-04-23 | 2009-04-23 | Transmucosal formulation of compounds providing dihydroartemesinin for use in the treatment of neoplastic disease |
| GB0906971.7 | 2009-04-23 | ||
| PCT/GB2010/050672 WO2010122356A1 (en) | 2009-04-23 | 2010-04-23 | Sublingual spray formulation comprising dihydroartemesinin |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN102395362A CN102395362A (zh) | 2012-03-28 |
| CN102395362B true CN102395362B (zh) | 2014-07-02 |
Family
ID=42244197
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201080017965.1A Expired - Fee Related CN102395362B (zh) | 2009-04-23 | 2010-04-23 | 含二氢青蒿素的舌下喷雾制剂 |
Country Status (24)
| Country | Link |
|---|---|
| US (4) | US20120157518A1 (zh) |
| EP (1) | EP2424523B1 (zh) |
| JP (1) | JP5795760B2 (zh) |
| CN (1) | CN102395362B (zh) |
| AU (1) | AU2010240654C1 (zh) |
| BR (1) | BRPI1014887A8 (zh) |
| CA (1) | CA2756925A1 (zh) |
| DK (1) | DK2424523T3 (zh) |
| ES (1) | ES2390046T3 (zh) |
| HK (1) | HK1164140A1 (zh) |
| HR (1) | HRP20120711T1 (zh) |
| IL (1) | IL215453A (zh) |
| ME (1) | ME02008B (zh) |
| MX (1) | MX2011010961A (zh) |
| MY (1) | MY155646A (zh) |
| NZ (1) | NZ595469A (zh) |
| PL (1) | PL2424523T3 (zh) |
| PT (1) | PT2424523E (zh) |
| RS (1) | RS52430B (zh) |
| RU (1) | RU2501550C2 (zh) |
| SG (1) | SG175162A1 (zh) |
| SI (1) | SI2424523T1 (zh) |
| WO (1) | WO2010122356A1 (zh) |
| ZA (1) | ZA201107088B (zh) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0720967D0 (en) * | 2007-10-25 | 2007-12-05 | Protophama Ltd | Anti-material pharmaceutical composition |
| RU2011139638A (ru) * | 2009-04-23 | 2013-05-27 | ЛондонФарма Лтд. | Сублингвальная фармацевтическая композиция, содержащая нейтральное масло |
| CN105142631A (zh) * | 2013-01-14 | 2015-12-09 | 健康诊所有限公司 | 抗癌药物和用途 |
| WO2016083827A1 (en) | 2014-11-27 | 2016-06-02 | Cipla Limited | Pharmaceutical composition comprising an artemisinin derivative for nasal or pulmonary delivery |
| JP2020033304A (ja) * | 2018-08-30 | 2020-03-05 | 医療法人ふじいやさか | 薬剤又はサプリメント、組成物、及び水素供給器の使用 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060233895A1 (en) * | 2005-04-15 | 2006-10-19 | Brown Paul R | Herbal remedy for treating Lyme disease |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030082107A1 (en) * | 1997-10-01 | 2003-05-01 | Dugger Harry A. | Buccal, polar and non-polar spray or capsule containing drugs for treating an infectious disease or cancer |
| CH692321A5 (de) * | 1997-11-03 | 2002-05-15 | Mepha Ag | Pharmazeutisch wirksame Zusammensetzung, welche eine gegen Malariaparasiten wirksame Substanz enthält. |
| RU2236413C2 (ru) * | 1998-07-14 | 2004-09-20 | Байер Акциенгезельшафт | Производные артемизинина, способ их получения, фармацевтическая композиция на их основе и способ лечения |
| EP1351678A2 (en) * | 2001-01-02 | 2003-10-15 | Elizabeth Shanahan-Prendergast | Treatment for inhibiting neoplastic lesions using incensole and/or furanogermacrens |
| AU2003240824B9 (en) * | 2002-05-31 | 2008-09-25 | University Of Mississippi | Transmucosal delivery of cannabinoids |
| NZ537113A (en) * | 2002-06-06 | 2007-01-26 | Univ Washington | Methods of using artemisinin-like compounds to prevent or delay the appearance of cancer |
| WO2004075921A1 (en) * | 2003-02-26 | 2004-09-10 | Vrije Universiteit Brussel | Inclusion complex of artemisinin or derivates thereof with cyclodextrins |
| US20060084675A1 (en) * | 2004-10-18 | 2006-04-20 | Thomas Efferth | Combined treatment with artesunate and an epidermal growth factor receptor kinase inhibitor |
| WO2007043057A2 (en) * | 2005-10-11 | 2007-04-19 | Yissum, Research Development Company Of The Hebrew University Of Jerusalem | Compositions for nasal delivery |
| CN100418524C (zh) * | 2005-10-26 | 2008-09-17 | 重庆医药工业研究院有限责任公司 | 一种稳定的青蒿素及青蒿素衍生物的药物组合物 |
-
2010
- 2010-04-23 ES ES10715337T patent/ES2390046T3/es active Active
- 2010-04-23 PL PL10715337T patent/PL2424523T3/pl unknown
- 2010-04-23 RS RS20120393A patent/RS52430B/en unknown
- 2010-04-23 NZ NZ595469A patent/NZ595469A/xx not_active IP Right Cessation
- 2010-04-23 CN CN201080017965.1A patent/CN102395362B/zh not_active Expired - Fee Related
- 2010-04-23 MY MYPI2011005080A patent/MY155646A/en unknown
- 2010-04-23 JP JP2012506584A patent/JP5795760B2/ja not_active Expired - Fee Related
- 2010-04-23 BR BRPI1014887A patent/BRPI1014887A8/pt not_active Application Discontinuation
- 2010-04-23 DK DK10715337.1T patent/DK2424523T3/da active
- 2010-04-23 RU RU2011139637/15A patent/RU2501550C2/ru active
- 2010-04-23 WO PCT/GB2010/050672 patent/WO2010122356A1/en active Application Filing
- 2010-04-23 MX MX2011010961A patent/MX2011010961A/es active IP Right Grant
- 2010-04-23 CA CA2756925A patent/CA2756925A1/en not_active Abandoned
- 2010-04-23 ME MEP-2012-393A patent/ME02008B/me unknown
- 2010-04-23 US US13/265,518 patent/US20120157518A1/en not_active Abandoned
- 2010-04-23 AU AU2010240654A patent/AU2010240654C1/en not_active Ceased
- 2010-04-23 SI SI201030076T patent/SI2424523T1/sl unknown
- 2010-04-23 SG SG2011073954A patent/SG175162A1/en unknown
- 2010-04-23 EP EP10715337A patent/EP2424523B1/en active Active
- 2010-04-23 PT PT10715337T patent/PT2424523E/pt unknown
-
2011
- 2011-09-28 ZA ZA2011/07088A patent/ZA201107088B/en unknown
- 2011-10-02 IL IL215453A patent/IL215453A/en active IP Right Grant
-
2012
- 2012-05-18 HK HK12104912.3A patent/HK1164140A1/zh not_active IP Right Cessation
- 2012-09-06 HR HRP20120711AT patent/HRP20120711T1/hr unknown
-
2015
- 2015-07-30 US US14/813,424 patent/US20160022629A1/en not_active Abandoned
-
2017
- 2017-09-06 US US15/697,240 patent/US20170368023A1/en not_active Abandoned
-
2018
- 2018-10-18 US US16/164,610 patent/US20190142737A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060233895A1 (en) * | 2005-04-15 | 2006-10-19 | Brown Paul R | Herbal remedy for treating Lyme disease |
Non-Patent Citations (4)
| Title |
|---|
| C.J.Janse, et al.comparison of in vivo and in vitro antimalarial activity of artemisinin,dihydroartemisinin and sodium artesunate in the plasmodium bergher-rodent model.《international journal for parasitology》.1994,第24卷(第4期),589-594. |
| comparison of in vivo and in vitro antimalarial activity of artemisinin,dihydroartemisinin and sodium artesunate in the plasmodium bergher-rodent model;C.J.Janse, et al;《international journal for parasitology》;19940701;第24卷(第4期);589-594 * |
| Elka Touitou et al.Treatment of malaria in a mouse model by intranasal.《International Journal for Parasitology》.2006,第36卷1493–1498. |
| Treatment of malaria in a mouse model by intranasal;Elka Touitou et al;《International Journal for Parasitology》;20061201;第36卷;1493–1498 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101835464B (zh) | 抗疟疾药物组合物 | |
| US20190142737A1 (en) | Sublingual spray formulation comprising dihydroartemesinin | |
| WO2010122275A1 (en) | Pharmaceutical preparation | |
| GB2469791A (en) | Lipophilic compositions comprising an artemisinin derivative and their therapeutic uses | |
| AU2013201643B2 (en) | Anti-malarial pharmaceutical composition | |
| GB2482431A (en) | Transmucosal formulation of compounds providing dihydroartemesinin for use in the treatment of a fluke infestation | |
| GB2482615A (en) | Transmucosal formulation of compounds providing dihydroartemesinin for use in the treatment of Lyme disease |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1164140 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: GR Ref document number: 1164140 Country of ref document: HK |
|
| CF01 | Termination of patent right due to non-payment of annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20140702 Termination date: 20210423 |