CN100439373C - 羟考酮盐酸盐多晶型物 - Google Patents
羟考酮盐酸盐多晶型物 Download PDFInfo
- Publication number
- CN100439373C CN100439373C CNB038191725A CN03819172A CN100439373C CN 100439373 C CN100439373 C CN 100439373C CN B038191725 A CNB038191725 A CN B038191725A CN 03819172 A CN03819172 A CN 03819172A CN 100439373 C CN100439373 C CN 100439373C
- Authority
- CN
- China
- Prior art keywords
- oxycodone hydrochloride
- twenty
- crystalline form
- oxycodone
- mixture
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D489/00—Heterocyclic compounds containing 4aH-8, 9 c- Iminoethano-phenanthro [4, 5-b, c, d] furan ring systems, e.g. derivatives of [4, 5-epoxy]-morphinan of the formula:
- C07D489/06—Heterocyclic compounds containing 4aH-8, 9 c- Iminoethano-phenanthro [4, 5-b, c, d] furan ring systems, e.g. derivatives of [4, 5-epoxy]-morphinan of the formula: with a hetero atom directly attached in position 14
- C07D489/08—Oxygen atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pain & Pain Management (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
本发明公开了羟考酮盐酸盐多晶型物,其与羟考酮结合或替代羟考酮用作镇痛剂。
Description
背景技术
羟考酮(4,5-环氧-14-羟基-3-甲氧基-17-甲基吗啡喃-6-酮)是已知的麻醉止痛剂。其盐酸盐在许多产品中商用,如Oxycontin、Tylox和Percocet。
发明简述
本发明涉及九种新晶型羟考酮盐酸盐。它们在此被确定为晶型A和I-VIII。熟知类型的羟考酮盐酸盐在下文中描述为羟考酮。
发明详述
所有的九种晶型直接或间接衍生自羟考酮,其特征最显著的是它们的°2θX射线粉末衍射图和X射线衍射峰的相对强度的物理学数据。
本发明一方面是羟考酮的新晶型。另一方面是制备这些新晶型的方法。因为这些晶型本质上与羟考酮本身具有相同的效果,所以对于药学效果而言它们可以取代羟考酮或与羟考酮结合使用。这些新晶型可以以纯晶型生产并使用,或这些晶型可与其他晶型和/或羟考酮结合来生产和使用。本发明另一个方面是组合物,该组合物包含治疗有效量的一种或多种这些新晶型,任选与羟考酮结合,和其药学上可接受的载体。另一个方面是一种为有此需要的哺乳动物、优选人提供镇痛效果的方法,此方法包括向所述的哺乳动物给药有效量的一种或多种本发明的新晶型,任选与羟考酮结合。羟考酮的治疗用途和剂量范围、给药的方式等在本领域都是熟知的。
“纯”的含义是指本发明的每种晶型是大约90-100%,优选是95-100%,更优选是98-100%(重量/重量)的纯度;例如不含其它羟考酮晶型、溶剂、和/或其它不需要的非羟考酮杂质。本发明的优选的多晶型物是不含其他羟考酮晶型的,优选98-100%纯度。
本发明的晶型可以通过包括以下步骤的方法生产;
1)将羟考酮溶解在包含水、有机溶剂如二噁烷或乙醇,或水与低级链烷醇即乙醇、异丙醇或丁醇的混合物的溶剂中,任选加热上述溶液到60℃,任选搅拌上述溶液,和任选蒸发所述溶剂至沉淀出新的羟考酮晶型;或
2)加热晶型A到60-120℃;或
3)加热羟考酮到200℃。
本发明的另一个实施方案是通过上述方法制备的羟考酮晶型,更特别地是通过如实施例所叙述的方法生产的晶型。
附图简述
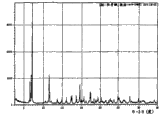
图1是以°2θ描绘的羟考酮的X射线粉末衍射图。
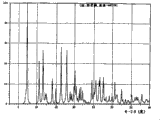
图2是以°2θ描绘的A晶型羟考酮的X射线粉末衍射图。
图3是以°2θ描绘的I晶型羟考酮的X射线粉末衍射图。
图4是以°2θ描绘的II晶型羟考酮的X射线粉末衍射图。
图5是以°2θ描绘的III晶型羟考酮的X射线粉末衍射图。
图6是以°2θ描绘的IV晶型羟考酮的X射线粉末衍射图。
图7是以°2θ描绘的V晶型羟考酮的X射线粉末衍射图。
图8是以°2θ描绘的VI晶型羟考酮的X射线粉末衍射图。
图9是以°2θ描绘的VII晶型羟考酮的X射线粉末衍射图。
图10是以°2θ描绘的VIII晶型羟考酮的X射线粉末衍射图。
表I概述了每种羟考酮晶型的X射线粉末衍射图的主峰。给出了每个峰的相对强度(R.I.),其中R.I.是每个峰高度与最高峰的比值,最高峰记为100%。
数据是使用下列仪器之一得到的:
1)使用Cu Kα辐射的Shamadzu XRD-6000X射线粉末衍射仪,该仪器配备有细焦点X射线管,设定40kV和40mA。发散和散射狭缝设置在1°和接受狭缝设置在0.15mm。衍射线通过NaI闪烁检测器检测。从2.5-40°2θ,以3°/分钟(步长0.4秒/0.02°)使用θ-2θ连续扫描;或
2)使用Cu Kα辐射的Inel XRG-300X射线粉末衍射仪,配备有曲线定位灵敏检测器,设定40kV和30mA。在0.03°分辨率下、于120°的2θ范围实时收集数据。
将样品装在毛细X射线管中并通过旋转管分析。
表I
羟考酮°2θ峰和相对强度
| 羟考酮 | R.I. | A | R.I. | I | R.I. | II | R.I. | III | R.I. |
| 8.35 | 43 | 7.52 | 14 | 7.26 | 100 | 6.96 | 23 | 7.44 | 62 |
| 10.75 | 40 | 7.87 | 76 | 10.68 | 14 | 7.51 | 80 | 7.52 | 58 |
| 12.10 | 100 | 10.36 | 12 | 11.81 | 74 | 10.75 | 77 | 7.74 | 16 |
| 14.00 | 30 | 10.67 | 15 | 13.85 | 19 | 11.77 | 53 | 7.88 | 11 |
| 14.14 | 20 | 11.10 | 19 | 18.21 | 29 | 12.36 | 68 | 11.77 | 17 |
| 16.02 | 25 | 11.64 | 19 | 17.77 | 19 | 13.96 | 23 | 16.25 | 100 |
| 16.24 | 56 | 11.88 | 67 | 20.09 | 13 | 15.11 | 15 | 18.04 | 10 |
| 17.21 | 12 | 13.04 | 24 | 24.90 | 12 | 16.27 | 100 | 20.18 | 10 |
| 17.72 | 35 | 15.88 | 20 | 26.27 | 28 | 17.94 | 57 | 25.28 | 10 |
| 18.26 | 38 | 16.14 | 100 | 27.39 | 11 | 20.13 | 37 | 25.48 | 10 |
| 19.14 | 41 | 17.66 | 16 | 32.41 | 11 | 20.48 | 28 | ||
| 19.46 | 14 | 17.98 | 47 | 20.83 | 33 | ||||
| 20.16 | 14 | 19.76 | 13 | 21.49 | 11 | ||||
| 20.29 | 43 | 20.09 | 50 | 22.24 | 12 | ||||
| 20.72 | 13 | 20.86 | 28 | 23.76 | 11 | ||||
| 21.60 | 12 | 20.88 | 15 | 25.30 | 57 | ||||
| 21.81 | 14 | 21.41 | 17 | 25.58 | 34 | ||||
| 23.54 | 15 | 22.72 | 12 | 25.76 | 17 | ||||
| 24.04 | 21 | 22.98 | 13 | 26.26 | 15 | ||||
| 25.22 | 24 | 23.99 | 11 | 27.60 | 13 | ||||
| 26.09 | 12 | 25.06 | 33 | 28.07 | 12 | ||||
| 26.87 | 10 | 25.57 | 48 | 30.41 | 15 | ||||
| 28.17 | 19 | 26.17 | 12 | 31.37 | 11 | ||||
| 28.36 | 11 | 28.96 | 30 | 35.93 | 11 | ||||
| 29.01 | 14 | 30.25 | 16 | ||||||
| 30.02 | 17 | 31.10 | 14 | ||||||
| 30.18 | 12 | 38.31 | 13 |
表I(续)
| IV | R.I. | V | R.I. | VI | R.I. | VII | R.I. | VIII | R.I. |
| 7.38 | 37 | 6.85 | 19 | 7.31 | 100 | 7.94 | 31 | 10.50 | 13 |
| 10.59 | 51 | 7.16 | 28 | 10.70 | 41 | 8.18 | 55 | 10.81 | 100 |
| 11.84 | 78 | 7.37 | 100 | 11.80 | 51 | 8.40 | 10 | 12.28 | 17 |
| 13.97 | 22 | 11.48 | 30 | 12.48 | 10 | 10.52 | 10 | 12.58 | 64 |
| 14.91 | 12 | 19.47 | 18 | 13.90 | 25 | 10.73 | 21 | 12.72 | 78 |
| 16.01 | 65 | 22.20 | 11 | 14.89 | 18 | 11.24 | 30 | 12.92 | 73 |
| 16.24 | 14 | 22.35 | 15 | 16.30 | 56 | 11.78 | 44 | 13.08 | 57 |
| 17.44 | 36 | 17.87 | 49 | 12.02 | 24 | 13.24 | 38 | ||
| 17.62 | 100 | 18.86 | 10 | 12.40 | 48 | 13.42 | 19 | ||
| 18.19 | 24 | 19.85 | 10 | 13.83 | 22 | 14.50 | 15 | ||
| 19.02 | 10 | 20.17 | 30 | 14.00 | 12 | 14.64 | 14 | ||
| 19.51 | 13 | 20.54 | 16 | 15.82 | 11 | 24.04 | 18 | ||
| 19.95 | 75 | 21.48 | 14 | 16.18 | 100 | 24.14 | 22 | ||
| 20.67 | 14 | 21.99 | 16 | 17.64 | 15 | 24.52 | 35 | ||
| 21.08 | 26 | 22.47 | 11 | 18.00 | 14 | 24.64 | 43 | ||
| 21.31 | 22 | 24.47 | 22 | 18.18 | 21 | 24.78 | 24 | ||
| 21.87 | 12 | 25.35 | 11 | 18.88 | 14 | 27.31 | 28 | ||
| 22.55 | 17 | 25.55 | 19 | 19.10 | 14 | 28.17 | 10 | ||
| 24.34 | 45 | 26.40 | 24 | 19.36 | 11 | ||||
| 25.11 | 56 | 26.65 | 24 | 19.50 | 11 | ||||
| 25.38 | 26 | 27.56 | 25 | 20.14 | 21 | ||||
| 26.58 | 45 | 30.68 | 19 | 20.48 | 22 | ||||
| 27.32 | 10 | 32.56 | 16 | 21.06 | 20 | ||||
| 27.59 | 27 | 35.12 | 10 | 21.91 | 11 | ||||
| 28.01 | 15 | 37.84 | 11 | 23.86 | 12 | ||||
| 29.36 | 10 | 24.08 | 32 | ||||||
| 30.14 | 13 | 25.04 | 22 | ||||||
| 30.38 | 34 | 25.38 | 50 | ||||||
| 31.20 | 12 | 25.58 | 29 | ||||||
| 34.26 | 12 | 27.89 | 12 | ||||||
| 34.58 | 11 | 29.23 | 11 | ||||||
| 35.35 | 14 | 30.33 | 21 | ||||||
| 36.36 | 18 |
表II概述了每个羟考酮晶型的X射线粉末衍射图的峰,它们是独特的(在±0.20°2θ不与其他晶型共有的峰)或高强度的(R.I.≥15)。
表II
显著的羟考酮的°2θ峰
| A | I | II | III | IV | V | VI | VII | VIII |
| 7.87 | 7.26 | 7.51 | 7.44 | 11.84 | 6.85 | 7.31 | 8.16 | 10.81 |
| 11.88 | 11.81 | 10.75 | 7.52 | 16.01 | 7.16 | 11.80 | 12.40 | 12.58 |
| 16.14 | 16.21 | 12.36 | 11.77 | 17.82 | 7.37 | 16.30 | 16.18 | 12.72 |
| 20.09 | 26.27 | 16.27 | 16.25 | 19.95 | 11.48 | 17.87 | 25.38 | 12.92 |
| 22.98 | 32.41 | 35.93 | 34.26 | 30.68 | ||||
| 38.31 | 34.58 | 32.56 | ||||||
| 35.35 | 37.84 | |||||||
| 36.36 |
本发明通过下面的实施例进一步说明,它们只是用于解释而非限制。
实施例1
晶型A的制备
将29.8mg的羟考酮和0.8mL的75∶25的乙醇/水混合在管形瓶中,声波处理溶解固体。过滤(0.2μm尼龙过滤器)样品并开盖蒸发至干,获得晶型A。
实施例2
晶型I的制备
将50.0mg的羟考酮和0.3mL水混合在管形瓶中,声波处理溶解固体,过滤(0.2μm尼龙过滤器)样品并开盖蒸发至干,获得晶型I。
实施例3
晶型II的制备
将199.4mg的羟考酮和2mL的95∶5的乙醇/水混合在管形瓶中形成混浊的样品,在60℃搅动。过滤(0.2μm尼龙过滤器)样品并使之缓慢蒸发,即覆盖带有一个针孔的箔来蒸发,产生晶型II。
实施例4
晶型III的制备
将100.5mg的羟考酮与1.6mL的乙醇混合在管形瓶中,在60℃搅拌约10分钟。过滤(0.2μm尼龙过滤器)样品至干净的管形瓶中,然后封盖冷却到20℃,产生晶型III。
实施例5
晶型IV的制备
将49.8mg的羟考酮与18mL的二噁烷混合在管形瓶中形成混浊样品,在室温下搅拌过夜。生成的固体通过真空过滤收集,产生晶型IV。
实施例6
晶型V制备
将50.0mg的羟考酮与3.3mL的92∶8的丁醇/水混合在管形瓶中,声波处理溶解固体。过滤(0.2μm尼龙过滤器)样品并开盖蒸发至干,获得晶型V。
实施例7
晶型VI的制备
将50.8mg的羟考酮和6mL的92∶8的异丙醇/水混合在管形瓶中,声波溶解固体。过滤(0.2μm尼龙过滤器)样品并非常慢速地蒸发,即覆盖带有一个针孔的箔使之蒸发至干,获得晶型VI。
实施例8
晶型VII的制备
将晶型A羟考酮在变温XRPD上加热到60-120℃维持少于30分钟,产生晶型VII。
实施例9
晶型VIII的制备
将羟考酮在变温XRPD上加热到200℃维持少于30分钟,产生晶型VIII。
Claims (23)
1.羟考酮盐酸盐的晶型A,其特征在于具有下面°2θ峰和相对强度:
2.羟考酮盐酸盐的晶型I,其特征在于具有下面°2θ峰和相对强度:
3.羟考酮盐酸盐的晶型II,其特征在于具有下面°2θ峰和相对强度:
4.羟考酮盐酸盐的晶型III,其特征在于具有下面°2θ峰和相对强度:
5.羟考酮盐酸盐的晶型IV,其特征在于具有下面°2θ峰和相对强度:
6.羟考酮盐酸盐的晶型V,其特征在于具有下面°2θ峰和相对强度:
7.羟考酮盐酸盐的晶型VI,其特征在于具有下面°2θ峰和相对强度:
8.羟考酮盐酸盐的晶型VII,其特征在于具有下面°2θ峰和相对强度:
9.羟考酮盐酸盐的晶型VIII,其特征在于具有下面°2θ峰和相对强度:
10.权利要求1-9任一项的晶型,其纯度为90-100%(重量/重量)。
11.权利要求10的晶型,其纯度为95-100%。
12.权利要求10的晶型,其纯度为98-100%。
13.制备权利要求1的羟考酮盐酸盐的晶型A的方法,其包括:混合羟考酮盐酸盐和75∶25的乙醇/水,声波处理溶解固体,过滤上述的混合物,并开盖蒸发上述混合物至干,产生晶型A。
14.制备权利要求2的羟考酮盐酸盐的晶型I的方法,其包括:混合羟考酮盐酸盐和水,声波处理溶解固体,过滤上述的混合物,和开盖蒸发上述混合物至干,产生晶型I。
15.制备权利要求3的羟考酮盐酸盐的晶型II的方法,其包括:混合羟考酮盐酸盐和乙醇/水,在60℃搅拌所述混合物,过滤所述的混合物,和非常慢速地蒸发上述混合物至干,产生晶型II。
16.制备权利要求4的羟考酮盐酸盐的晶型III的方法,其包括:混合羟考酮盐酸盐和乙醇,在60℃搅拌所述混合物,过滤所述的混合物,和封盖冷却所述的混合物到20℃,产生晶型III。
17.制备权利要求5的羟考酮盐酸盐的晶型IV的方法,其包括:混合羟考酮盐酸盐和二噁烷,在室温下搅拌所述混合物过夜,产生晶型IV。
18.制备权利要求6的羟考酮盐酸盐的晶型V的方法,其包括:混合羟考酮盐酸盐和92∶8的丁醇/水,声波处理溶解固体,过滤所述的混合物,和开盖蒸发上述混合物至干,产生晶型V。
19.制备权利要求7的羟考酮盐酸盐的晶型VI的方法,其包括:混合羟考酮盐酸盐和92∶8的异丙醇/水,声波处理溶解固体,过滤所述的混合物,和非常慢速地蒸发上述混合物至干,产生晶型VI。
20.制备权利要求8的羟考酮盐酸盐的晶型VII的方法,其包括:加热晶型A到60-120℃并维持少于30分钟,产生晶型VII。
21.制备权利要求9的羟考酮盐酸盐的晶型VIII的方法,其包括:加热羟考酮盐酸盐到200℃并维持少于30分钟,产生晶型VIII。
22.包含治疗有效量的一种或多种权利要求1-9的晶型和其药学可接受的载体的组合物,该组合物任选地结合羟考酮。
23.权利要求1-9的一种或多种晶型在制备向有此需要的人提供镇痛效果的药物中的用途,任选地结合羟考酮。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US40382602P | 2002-08-15 | 2002-08-15 | |
| US60/403,826 | 2002-08-15 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1675217A CN1675217A (zh) | 2005-09-28 |
| CN100439373C true CN100439373C (zh) | 2008-12-03 |
Family
ID=31888288
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB038191725A Expired - Fee Related CN100439373C (zh) | 2002-08-15 | 2003-08-15 | 羟考酮盐酸盐多晶型物 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US7534888B2 (zh) |
| EP (1) | EP1537118A1 (zh) |
| CN (1) | CN100439373C (zh) |
| AU (1) | AU2003258280A1 (zh) |
| CA (1) | CA2495182A1 (zh) |
| WO (1) | WO2004016618A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114276358A (zh) * | 2022-01-07 | 2022-04-05 | 北京华素制药股份有限公司 | 羟考酮盐酸盐的多晶型物及其制备方法和用途 |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW201509943A (zh) | 2004-03-30 | 2015-03-16 | Euro Celtique Sa | 含有小於25ppm14-羥可待因酮之羥可酮鹽酸鹽之組成物、醫藥劑型、延遲釋出口服劑型及醫藥上可以接受的包裝 |
| SA07280459B1 (ar) | 2006-08-25 | 2011-07-20 | بيورديو فارما إل. بي. | أشكال جرعة صيدلانية للتناول عن طريق الفم مقاومة للعبث تشتمل على مسكن شبه أفيوني |
| ES2659168T3 (es) | 2010-07-02 | 2018-03-14 | Johnson Matthey Public Limited Company | Proceso para la síntesis y purificación de oxicodona |
| US10227354B2 (en) | 2013-12-18 | 2019-03-12 | Cody Laboratories, Inc. | Conversion of oxycodone base to oxycodone hydrochloride |
| US9062062B1 (en) | 2013-12-18 | 2015-06-23 | Cody Laboratories, Inc. | Synthesis of oxycodone hydrochloride |
| US8846923B1 (en) | 2013-12-18 | 2014-09-30 | Cody Laboratories, Inc. | Preparation of 14-hydroxycodeinone sulfate |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0900582A1 (en) * | 1997-08-21 | 1999-03-10 | Johnson Matthey Public Limited Company | Method for removal of residual organic solvents from a crystalline bulk substance and use thereof in manufacturing pharmaceuticals |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE286431C (zh) | ||||
| DE411530C (de) | 1923-09-12 | 1925-03-30 | Chem Fab | Verfahren zur Darstellung von Oxykodeinon |
| US5266331A (en) * | 1991-11-27 | 1993-11-30 | Euroceltique, S.A. | Controlled release oxycodone compositions |
-
2003
- 2003-08-15 WO PCT/US2003/025778 patent/WO2004016618A1/en not_active Ceased
- 2003-08-15 AU AU2003258280A patent/AU2003258280A1/en not_active Abandoned
- 2003-08-15 US US10/641,440 patent/US7534888B2/en not_active Expired - Fee Related
- 2003-08-15 CA CA002495182A patent/CA2495182A1/en not_active Abandoned
- 2003-08-15 EP EP03788595A patent/EP1537118A1/en not_active Ceased
- 2003-08-15 CN CNB038191725A patent/CN100439373C/zh not_active Expired - Fee Related
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0900582A1 (en) * | 1997-08-21 | 1999-03-10 | Johnson Matthey Public Limited Company | Method for removal of residual organic solvents from a crystalline bulk substance and use thereof in manufacturing pharmaceuticals |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114276358A (zh) * | 2022-01-07 | 2022-04-05 | 北京华素制药股份有限公司 | 羟考酮盐酸盐的多晶型物及其制备方法和用途 |
| CN114276358B (zh) * | 2022-01-07 | 2023-09-12 | 北京华素制药股份有限公司 | 羟考酮盐酸盐的多晶型物及其制备方法和用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1537118A1 (en) | 2005-06-08 |
| WO2004016618A1 (en) | 2004-02-26 |
| CN1675217A (zh) | 2005-09-28 |
| AU2003258280A1 (en) | 2004-03-03 |
| US20070197572A1 (en) | 2007-08-23 |
| CA2495182A1 (en) | 2004-02-26 |
| US7534888B2 (en) | 2009-05-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2023116645A (ja) | フリー体のクリサボロールの結晶形ならびにそれらの調製方法および使用 | |
| US7759481B2 (en) | Solid state forms of 5-azacytidine and processes for preparation thereof | |
| WO2022121670A1 (zh) | Tolebrutinib的晶型及其制备方法和用途 | |
| US10532988B2 (en) | Crystalline forms of neurotrophin mimetic compounds and their salts | |
| CN100439373C (zh) | 羟考酮盐酸盐多晶型物 | |
| US20220162177A1 (en) | Crystalline forms of neurotrophin mimetic compounds and their salts | |
| US12384784B2 (en) | Polymorphs of Acalabrutinib, a Bruton's tyrosine kinase inhibitor | |
| WO2018103027A1 (zh) | 替吡法尼的晶型及其制备方法及药物组合物 | |
| WO2017114456A1 (zh) | 吗啉衍生物的盐及其晶型、其制备方法及药物组合物、用途 | |
| JP6434591B2 (ja) | 4−[2−ジメチルアミノ−1−(1−ヒドロキシシクロヘキシル)エチル]フェニル4−メチルベンゾエートヒドロクロリドの多形体、それらを作製する方法及びそれらの使用 | |
| WO2018214877A1 (zh) | 一种地佐辛晶型及其制备方法 | |
| CN116041351A (zh) | 盐酸咪达唑仑新晶型及其制备方法 | |
| CN116528872A (zh) | 5-氟-1-(4-氟-3-(4-(嘧啶-2-基)哌嗪-1-羰基)苄基)喹唑啉-2,4(1h,3h)-二酮的结晶形式及其制备 | |
| US8399475B2 (en) | Crystalline and amorphous forms of naltrexone hydrochloride | |
| WO2017107791A1 (zh) | 取代的氨基吡喃衍生物的晶型 | |
| WO2000058310A1 (en) | Zolpidem salts | |
| TWI902254B (zh) | 化合物8-氯-3-戊基-3,7-二氫-1h-嘌呤-2,6-二酮的晶型及其製備方法 | |
| WO2018001335A1 (zh) | Nbi-98854的晶型及其制备方法和用途 | |
| CN112851640B (zh) | 嘧啶苯甲酰胺化合物的硫酸盐及其用途 | |
| CN111565723A (zh) | 百部螺碱及其盐的固体形式 | |
| WO2024125591A1 (zh) | 苯并恶嗪酮类化合物的结晶及其制备 | |
| CN101171253A (zh) | 氢可酮多晶型物 | |
| WO2018059420A1 (zh) | E52862盐酸盐晶型h及其制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20081203 Termination date: 20090815 |