[001] Refere-se a presente invenção a novas formas de sal cristalino do ácido (1R*,2R*,4R*)-2-(2-{[3- (4, 7-dimetoxi-1H-benzoimidazol-2-il)- propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il isobutírico (doravante também referido como “COMPOSTO") ou seus enantiômeros, processos para a sua preparação, composições farmacêuticas que contêm as ditas formas de sais cristalinos, e seu uso como bloqueadores de canais de cálcio no tratamento ou prevenção de angina crônica estável, hipertensão, isquemia (renal e cardíaca), arritmias cardíacas incluindo fibrilação atrial, hipertrofia cardíaca, ou insuficiência cardíaca congestiva. As ditas formas de sais cristalinos da presente invenção também podem ser usadas, isoladamente ou em composições farmacêuticas, para o tratamento de enfermidades renais, diabetes e suas complicações, hiperaldosteronismo, epilepsia, dor neuropática, ou câncer em seres humanos e outros mamíferos.
Antecedentes da Invenção
[002] Muitos distúrbios cardiovasculares têm sido associados com uma “sobrecarga de cálcio” resultante de um influxo de cálcio elevado anormal através da membrana de plasma das células musculares lisas cardíacas e vasculares. Existem 3 caminhos principais através dos quais o cálcio extracelular pode entrar nestas células: 1) canais de cálcio ativados por receptor, 2) canais de cálcio pulsados por ligante e 3) canais de cálcio operados por voltagem (VOCs).
[003] Os VOCs foram classificados em 6 categorias principais: L (Duradouros), T (Transitórios), N (Neuronais), P (células Purkinje), Q (depois de P) e R (Remanescentes ou Resistentes).
[004] Os canais de cálcio do tipo L são responsáveis pelo movimento para dentro do cálcio que inicia a contração nas células do músculo liso e cardíaco sugerindo uma aplicação putativa para bloqueadores destes canais no campo cardiovascular. Sob este aspecto, têm sido usados bloqueadores de canais de cálcio do tipo L em clínicas desde o início dos anos 60 e são agora recomendados como um tratamento de primeira linha para hipertensão sistólica-diastólica e angina de peito.
[005] Os canais de cálcio do tipo T são encontrados em vários tecidos, tais como na vasculatura coronariana e periférica, nódulo sinoatrial e fibras de Purkinje, cérebro, glândulas adrenais e no rim. Esta distribuição ampla sugere um bloqueador de canal do tipo T para ter uma proteção cardiovascular putativa, para ter um efeito nos distúrbios do sono, distúrbios de humor, depressão, enxaqueca, hiperaldosteronemia, trabalho de parto prematuro, incontinência urinária, envelhecimento cerebral ou distúrbios neurodegenerativos, tais como doença de Alzheimer.
[006] O Mibefradil (Posicor®), o primeiro bloqueador de canais de cálcio do tipo L e do tipo T, demonstrou um efeito superior sobre os bloqueadores de canais de cálcio, que visou o canal L predominantemente.
[007] O Mibefradil foi usado para o tratamento de hipertensão e angina sem mostrar efeitos colaterais negativos freqüentemente observados nos bloqueadores de canal L, tais como inotropia, taquicardia reflexa, liberação de hormônio vaso-restritor ou edema periférico. Adicionalmente, o mibefradil mostrou um efeito potencialmente cardioprotetor (Villame, Cardiovascular Drugs and Therapy 15, 41-28, 2001; Ramires, J Mol Cell Cardiol 1998, 30, 475-83), um efeito de proteção renal (Honda, Hypertension 19, 2031-37, 2001), e demonstrou um efeito positivo no tratamento de insuficiência cardíaca (Clozel, Proceedings Association American Physicians 1999, 111, 429-37).
[008] Apesar da enorme demanda por um composto deste perfil, o mibefradil foi retirado do mercado em 1998 (um ano depois do seu lançamento), devido a interações do fármaco CYP 3A4 inaceitáveis. Além disso, também foram reportadas anormalidades de ECG (ou seja, prolongamentos de QT) e interações com o efluxo de digocina mediado por MDR-1 (du Souich, Clin Pharmacol Ther 67, 24957, 2000; Wandel, Drug Metab Dispos 2000, 28, 895-8).
[009] Descobriu-se agora que, sob determinadas condições, podem ser encontradas formas de sal cristalino do COMPOSTO éster do ácido ((1R*,2R*,4R*)-2-(2-{[3-(4,7-dimetoxi-1H-benzoimidazol-2-il)- propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il isobutírico). As ditas formas de sal cristalino do COMPOSTO são novas e podem ter propriedades vantajosas, especialmente comparadas com a base livre (W02008/132679) ou o sal de cloridrato do COMPOSTO. Essas vantagens podem incluir melhores propriedades de fluxo, melhor solubilidade, menos higroscopicidade, melhor capacidade de reprodução na manufatura (por exemplo melhores parâmetros de filtragem, melhor reprodutibilidade de formação, melhor sedimentação), morfologia definida e/ou melhor estabilidade a longo prazo.
Descrição das Figuras
[0010] A Figura 1 mostra o diagrama de difração de pó ao raios X do sal de ácido clorídrico do COMPOSTO em uma forma cristalina quando obtido a partir do Exemplo de Referência S1. O diagrama de difração por raios X medido com o método 1 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (2θ) (estão reportados picos selecionados a partir da faixa 2-40°, 2teta com intensidade relativa maior do que 10%): 3,02° (100%), 9,19° (88%), 9,77° (81%), 10,81° (16%), 12,50° (19%), 12,94° (21%), 13,15° (30%), 14,30° (26%), 14,62° (24%), 15,36° (66%), 16.14° (37%), 17.08° (73%), 18,12° (76%), 19,46° (45%), 19,71° (40%), 20,54° (35%), 20.92° (31%), 21.17° (29%), 21,56° (41%), 22,47° (29%), 22,90°(22%), 23,99° (24%), 25.41° (52%), 26.05° (31%), 26,90° (32%), 27,28° (24%), e 28,45° (37%).
[0011] A Figura 2 mostra o diagrama de difração de pó ao raios X do sal de ácido di-metilsulfônico do COMPOSTO em uma forma cristalina como obtido a partir do Exemplo S2. O diagrama de difração de raios X medido com o método 1 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 2-40°, 2teta com intensidade relativa maior do que 10%): 3,97° (100%), 7,21° (42%), 10,00° (39%), 14,09° (40%), 14,45° (29%), 15,99° (55%), 16,38° (22%), 17,16° (51%), 18,12° (44%), 18,34° (53%), 18,60° (19%), 19,38° (25%), 20,62° 935%), 21,02° (74%), 21,79° (18%), 22,24° (25%), 26,66° (30%), e 27,63° (29%).
[0012] A Figura 3 mostra o diagrama de difração de pó ao raios X do sal de ácido di-toluenossulfônico do COMPOSTO em uma forma cristalina como obtido a partir do Exemplo S3. O diagrama de difração de raios X medido com o método 1 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 2-40°, 2teta com intensidade relativa maior do que 10%): 4,35° (31%), 5,79° (100%), 7,43° (16%), 8,62° (17%), 10,93° (19%), 11,51° (31%), 13,98° (34%), 15,81° (26%), 8,06° (30%), 19,00° (20%), 19,39° (21%), 19,84° (31%), 20,30° (25%), e 25,51° (20%).
[0013] A Figura 4 mostra o diagrama de difração de pó ao raios X do sal de ácido sulfúrico do COMPOSTO em uma forma cristalina como obtido a partir do Exemplo S4. O diagrama de difração de raios X medido com o método 1 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 2-30°, 2teta com intensidade relativa maior do que 10%): 2,85° (100%), 8,50° (21%), 9,50° (28%), 11,78° (85%), 13,26° (41%), 13,69° (51%), 14,19° (82%), 15,78° (40%), 16,47° (39%), 17,12° (38%), 18,91° (40%), 19,48° (43%), 26,77° (65%), e 27,24° (63%).
[0014] A Figura 5 mostra o diagrama de difração de pó ao raios X do sal de ácido di-maléico do COMPOSTO em uma forma cristalina como obtido a partir do Exemplo S5. O diagrama de difração de raios X medido com o método 1 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 2-40°, 2teta com intensidade relativa maior do que 10%): 5,07° (26%), 8,19° (12%), 10,15° (93%), 15,26° (39%), 17,20° (12%), 17,61° (18%), 20,39° (100%), 20,88° (12%), 22,63° (47%), 23,93° (43%), 24,27° (26%), 24,51° (13%), 24,73° (17%), 25,61° (21%), 29,42° (25%), e 32,93° (16%).
[0015] A Figura 6 mostra o diagrama de difração de pó ao raios X do sal de ácido sesqui-fumárico do COMPOSTO em uma forma cristalina como obtido a partir do Exemplo S6. O diagrama de difração de raios X medido com o método 1 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 2-40°, 2teta com intensidade relativa maior do que 10%): 5,27° (57%), 8,05° (100%), 12,93° (18%), 15,20° (10%), 15,50° (20%), 19,45° (14%), 20,31° (31%), 20,61° (62%), 21,11° (27%), 22,77° (15%), 25,42° (11%), 26,22° (11%), e 31,27° (21%).
[0016] A Figura 7 mostra o diagrama de difração de pó ao raios X do sal de ácido di-bromídrico do COMPOSTO em uma forma cristalina como obtido a partir do Exemplo S7. O diagrama de difração de raios X medido com o método 1 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 2-40°, 2teta com intensidade relativa maior do que 10%): 3,1° (59%), 6,2° (28%), 9,3° (18%), 14,4° (11%), 15,6° (100%), 17,3° (33%), 18,1° (15%), 19,4° (20%), 20,0° (37%), 21,4° (14%), 22,8° (16%), e 34,8° (43%).
[0017] A Figura 8 mostra o diagrama de difração de pó ao raios X do sal de ácido sesqui-naftaleno-1,5-dissulfônico do COMPOSTO em uma forma cristalina como obtido a partir do procedimento geral para a formação de sal. O diagrama de difração de raios X medido com o método 2 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 8-26,5°, 2teta com intensidade relativa maior do que 10%): 9,9° (40%), 10,4° (18%), 12,8] (42%), 14,2° (100%), 15,0° (73%), 18,3° (68%), 19° (54%), 20,1° (39%), 20,6° (48%), 21,3° (83%),23,8° (13%), 24,9° (14%), e 26,2° (22%).
[0018] A Figura 9 mostra o diagrama de difração de pó ao raios X do sal de ácido di-benzenossulfônico do COMPOSTO em uma forma cristalina como obtido a partir do procedimento geral para a formação de sal. O diagrama de difração de raios X medido com o método 2 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 8-26,5°, 2teta com intensidade relativa maior do que 10%): 8,1° (16%), 8,5° (18%), 10,9° (20%), 11,4° (16%), 12,3° (20%), 12,6° (37%), 12,9° (22%), 13,4° (55%), 14,6° (32%), (20%), 15,3° (37%), 16,1° (27%), 17,5° 971%), 17,9° (37%), 19,1° (22%), 19,4° (25%), 20,1° (46", 21,3° (91%), 21,8° (46%), 22,7° (100%), 23,6° (18%), 24,5° (20%) e 25,5° (21%.
[0019] A Figura 10 mostra o diagrama de difração de pó ao raios X do sal de ácido di-etanossulfônico do COMPOSTO em uma forma cristalina como obtido a partir do procedimento geral para a formação de sal. O diagrama de difração de raios X medido com o método 2 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 8-26,5°, 2teta com intensidade relativa maior do que 10%): 9,6° (25%), 9,9° (21%), 10,5° (23,3%), 11,2° (27%), 11,9° (17%), 12,9° (48%), 14,5° (53%), 15,0° (40%), 15,7° (100%), 16,5°(65%), 17,0° (40%), 17,7° (49%), 19,0° (67%), 19,7° (69%), 20,4° (68%), 21,5° (55%), 22,6°(67%), e 23,3° (47%).
[0020] A Figura 11 mostra o diagrama de difração de pó ao raios X do sal de ácido di-naftaleno-2-sulfônico do COMPOSTO em uma forma cristalina como obtido a partir do procedimento geral para a formação de sal. O diagrama de difração de raios X medido com o método 2 mostra picos que são dotados de uma intensidade relativa, quando comparados ao pico mais intenso no diagrama, das seguintes percentagens (intensidades de pico relativas dadas entre parênteses) sob os ângulos de refração 2teta indicados (estão reportados picos selecionados a partir da faixa 8-26,5°, 2teta com intensidade relativa maior do que 10%): 9,8° (98%), 11,2° (45%), 11,8° (24%), 13,7° (20%), 14,6° (33%), 15,6° (100%), 16,9° (90%), 19,4° (96%), 22,4° (45%), e 23,9° (23%).
[0021] Nos diagramas de difração de raios X da Figura 1 à Figura 11 o ângulo de refração 2teta (2θ) é marcado no eixo horizontal e as contagens no eixo vertical.
Descrição Detalhada da Invenção
[0022] 1) A invenção refere-se a um sal cristalino, especialmente um sal cristalino essencialmente puro, do COMPOSTO (éster do ácido (1R*,2R*,4R*)-2-(2-{[3-(4,7-dimetoxi-1H-benzoimidazol-2-il)-propil]-metil- amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il isobutírico); em que o dito sal cristalino consiste de: 1 equivalente do COMPOSTO; um componente ácido que consiste de 1 a 2 equivalentes de um ácido selecionado a partir do grupo que consiste de ácido bromídrico, ácido sulfúrico, ácido maléico, ácido fumárico, ácido metanossulfônico, ácido para-toluenossulfônico, ácido benzenossulfônico, ácido naftaleno-1,5- dissulfônico, ácido naftaleno-2-sulfônico, e ácido etanossulfônico; e de 0 até 5 equivalentes de água.
[0023] 2) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 1), em que o COMPOSTO é éster do ácido (1R,2R,4R)-2-(2-{[3-(4,7-dimetoxi-1H-benzoimidazol-2-il)- propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il isobutírico, enriquecido enantiomericamente.
[0024] 3) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 1), em que o COMPOSTO é éster do ácido (1R,2R,4R)-2-(2-{[3-(4,7-dimetoxi-1H-benzoimidazol-2-il)- propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il isobutírico, enriquecido enantiomericamente.
[0025] 4) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 1), em que o COMPOSTO é éster do ácido (1R*,2R*,4R*)-2-(2-{[3-(4,7-dimetoxi-1H-benzoimidazol-2- il)-propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il isobutírico, na forma enriquecida enantiomericamente sendo dotado de rotação óptica negativa.
[0026] 5) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 4), em que o referido sal cristalino contém de 0 a 3 (especialmente de 0,5 até 3, notavelmente de 1 a 2) equivalentes de água.
[0027] 6) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) a 4), em que o dito sal cristalino contém 0 equivalentes de água.
[0028] 7) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 6), em que o componente ácido do dito sal cristalino consiste de 1 ou 2 (especialmente 2) equivalentes de ácido bromídrico, 1 ou 2 equivalentes de ácido sulfúrico, 1 ou 2 (especialmente 2) equivalentes de ácido maléico, de 1 a 2 (especialmente 1,5) equivalentes de ácido fumárico, 1 ou 2 (especialmente 2) equivalentes de ácido metanossulfônico, 1 ou 2 (especialmente 2) equivalentes de ácido para-toluenossulfônico, 1 ou 2 (especialmente 2) equivalentes de ácido benzenossulfônico, 1 a 2 (especialmente 1,5) equivalentes de ácido naftaleno-1,5-dissulfônico, 1 ou 2 (especialmente 2) equivalentes de ácido naftaleno-2-sulfônico, ou 1 ou 2 (especialmente 2) equivalentes de ácido etanossulfônico.
[0029] Em uma sub-concretização, o componente ácido do dito sal cristalino consiste preferentemente de 2 equivalentes de ácido bromídrico, 1 ou 2 equivalentes de ácido sulfúrico, 2 equivalentes de ácido maléico, 1 to 2 (especialmente 1.5) equivalentes de ácido fumárico, 2 equivalentes de ácido metanossulfônico, 2 equivalentes de ácido para-toluenossulfônico, ou 2 equivalentes de ácido benzenossulfônico. Em outra sub-concretização, o componente ácido do dito sal cristalino preferentemente consiste de 1 ou 2 (especialmente 2) equivalentes de ácido maléico, ou 1 a 2 (especialmente 1,5) equivalentes de ácido fumárico.
[0030] 8) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 2 equivalentes de ácido bromídrico. Uma sub-concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 5) ou 7), em que o componente ácido do dito sal cristalino consiste de 2 equivalentes de ácido bromídrico; e em que o dito sal cristalino contém cerca de 3 equivalentes de água.
[0031] 9) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 1 ou 2 equivalentes de ácido sulfúrico.
[0032] 10) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 2 equivalentes de ácido maléico.
[0033] 11) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 1 a 2 (especialmente 1,5) equivalentes de ácido fumárico.
[0034] 12) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 2 equivalentes de ácido metanossulfônico.
[0035] 13) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 2 equivalentes de ácido para-toluenossulfônico.
[0036] 14) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 2 equivalentes de ácido benzenossulfônico.
[0037] 15) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 1 a 2 (especialmente 1,5) equivalentes de ácido naftaleno-1,5-dissulfônico.
[0038] 16) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 2 equivalentes de ácido naftaleno-2-sulfônico.
[0039] 17) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com qualquer uma das concretizações 1) até 7), em que o componente ácido do dito sal cristalino consiste de 2 equivalentes de ácido etanossulfônico.
[0040] 18) Outra concretização refere-se a um sal cristalino, especialmente um sal cristalino essencialmente puro, do COMPOSTO de acordo com concretização 1) ou 10), em que o dito sal cristalino consiste de: 1 equivalente do COMPOSTO, ou do COMPOSTO enantiomericamente enriquecido tal como definido em qualquer uma das concretizações 2) a 4); 2 equivalentes de ácido maléico; e 0 equivalentes de água.
[0041] 19) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 10) ou 18), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 10,15°, 20,39°, e 22,63°.
[0042] 20) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com concretização 10) ou 18), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 5,07°, 8,19°, 10,15°, 15,26°, 17,61°, 20,39°, 22,63°, 23,93°, 24,27°, e 25,61°.
[0043] 21) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 10) ou 18), o que exibe essencialmente o padrão de difração de pó ao raios X conforme ilustrado na Figura 5.
[0044] 22) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 10) ou 18) até 21), o que tem um ponto de fusão de cerca de 147°C tal como determinado por calorimetria de varredura diferencial utilizando-se o método tal como descrito neste contexto.
[0045] 23) Em outra concretização a presente invenção refere-se a um sal cristalino de acordo com qualquer uma das concretizações 10) ou 18) até 22), capaz de ser obtido por: 1. refluxo de uma solução do COMPOSTO (682 g, 84% p/p, 1,05 mol) em EtOAc (6,3 L, 11 volumes); 2. adição de ácido maléico (256 g, 2,2 mol, 2,1 eq) dissolvido em Me0H (630 ml, 1,1 volumes); 3. agitação da mistura resultante sob refluxo durante 15 minutos e resfriamento para 65-68°C dentro de 30 minutos; 4. semeadura opcional com 0,04% p/p de cristais de semeadura; 5. resfriamento da mistura para 40°C dentro de 3 horas; 6. resfriamento da mistura para 20°C dentro 1 hora; 7. filtragem do sólido sob 0,2 bar de nitrogênio e enxaguamento do sólido com EtOAc (1500 ml 2,6 volumes); e 8. secagem do sólido sob 1 atmosfera de nitrogênio durante 24 horas.
[0046] 24) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 8), caracterizado pela presença de picos no diagrama de difração de pós ao raios X sob os seguintes ângulos de refração 2θ: 9,3°, 15,6°, e 17,3°.
[0047] 25) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 8) ou 24), caracterizado pela presença de picos no diagrama de difração de pós ao raios X sob os seguintes ângulos de refração 2θ: 6,2, 9,3°, 15,6°, 17,3°, 18,1°, 19,4°, 20,0°, and 22,8°.
[0048] 26) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 8), 24) ou 25), que mostra essencialmente o padrão de difração de pó ao raios X como ilustrado na Figura 7.
[0049] 27) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 11), caracterizado pela presença de picos de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 5,27°, 8,05°, e 20,61°.
[0050] 28) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 11) ou 27), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 5,27°, 8,05°, 12,93°, 19,45°, 20,61°, 21,11° e 31,27°.
[0051] 29) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 11), 27) ou 28), que mostra essencialmente o padrão de difração de pó por raios X conforme ilustrado na Figura 6.
[0052] 30) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 11), ou 27) até 29), que tem um ponto de fusão de cerca de 180°C quando determinado por calorimetria de varredura diferencial utilizando-se o método tal como descrito neste contexto.
[0053] 31) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 12), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 7,21° e 10,00°.
[0054] 32) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 12) ou 31), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 3,97°, 7,21°, 10,00°, 15,99°, 17,16°, e 21,02°.
[0055] 33) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 12), 31) ou 32), que mostra essencialmente o padrão de difração de pó ao raios X tal como ilustrado na Figura 2.
[0056] 34) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 13), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 5,79° e 19,84°.
[0057] 35) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 13) ou 34), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 4,35°, 5,79°, 10,93°, 13,98°, 15,81° e 19,84°.
[0058] 36) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 13), 34) ou 35), que mostra essencialmente o padrão de difração de pó ao raios X tal como ilustrado na Figura 3.
[0059] 37) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 14), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 13,4°, 17,5°, e 21,3°.
[0060] 38) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 14) ou 37), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 12,6°, 13,4°, 14,7°, 17,5°, 21,3°, e 22,7°.
[0061] 39) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 14), 37) ou 38), que mostra essencialmente o padrão de difração de pó ao raios X tal como ilustrado na Figura 9.
[0062] 40) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 15), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 9,9°, 14,2°, e 21,3°.
[0063] 41) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 15) ou 40), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 9,9°, 12,9°, 14,2°, 20,1°, 20,6°, e 21,3°.
[0064] 42) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 15), 40) ou 41), que mostra essencialmente o padrão de difração de pó ao raios X tal como ilustrado na Figura 8.
[0065] 43) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 16), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 9,8°, 11,2°, e 15,6°.
[0066] 44) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 16) ou 43), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 9,8°, 11,2°, 15,6°, 22,4°, e 23,9°.
[0067] 45) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 16), 43) ou 44), que mostra essencialmente o padrão de difração de pó ao raios X tal como ilustrado na Figura 11.
[0068] 46) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 17), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 11,2°, 15,7°, e 20,4°.
[0069] 47) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 17) ou 46), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 11,2°, 14,5°, 15,7°, 17,7°, 20,4°, e 22,6°.
[0070] 48) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 17), 46) ou 47), que mostra essencialmente o padrão de difração de pó ao raios X tal como ilustrado na Figura 10.
[0071] 49) A invenção refere-se ainda a um sal cristalino, especialmente um sal cristalino essencialmente puro, do COMPOSTO (ácido (1R*,2R*,4R*)-2-(2-{[3-(4,7-dimetoxi-1 H-benzoimidazol-2-il)-propil]- metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il éster isobutírico); em que o dito sal cristalino consiste de: • 1 equivalente do COMPOSTO; • um componente ácido que consiste de cerca de 1 equivalente de ácido sulfúrico; e • cerca de 6 equivalentes de água.
[0072] 50) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 49), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 11,78°, 13,69°, e 14,19°.
[0073] 51) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 49) ou 50), caracterizado pela presença de picos no diagrama de difração de pó ao raios X sob os seguintes ângulos de refração 2θ: 2,85°, 8,50°, 9,50°, 11,78°, 13,26°, 13,69°, e 14,19°.
[0074] 52) Outra concretização refere-se a um sal cristalino do COMPOSTO de acordo com a concretização 49), 50) ou 51), que mostra essencialmente o padrão de difração de pó ao raios X tal como ilustrado na Figura 4.
[0075] Para evitar quaisquer dúvidas, sempre que uma das concretizações expostas anteriormente, especialmente uma das concretizações 19), 20), 24), 25), 27), 28), 31), 32), 34), 35), 37), 38), 40), 41), 43), 44), 46), 47), 50) e 51), se refere a “picos no diagrama de difração de pó ao raios X nos ângulos de refração seguintes 2θ”, o dito diagrama de difração de pó ao raios X é obtido utilizando-se radiação Cu Koc1 (X = 1,5406 A); e deve ser compreendido que a exatidão dos valores 2θ quando proporcionados neste contexto encontra-se na faixa de +/- 0,1-0,2°. Notavelmente, quando se especifica um ângulo de refração 2teta (2θ) para um pico nas concretizações da invenção e nas reivindicações, o valor 2θ dado deverá ser compreendido como sendo um intervalo que vai desde o dito valor menos 0,2° até ao dito valor mais 0,2° (20 +/- 0,2°); e preferentemente que vai desde o dito valor menos 0,1° até ao dito valor mais 0,1° (20 +/- 0,1°).
[0076] Para evitar quaisquer dúvidas, a configuração relativa dos estereoisômeros é indicada como se segue: éster do ácido (1R*,2R*,4R*)-2-(2-{[3-(4,7-dimetoxi-1H- benzoimidazol -2-il)-propil]-meti-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en- 2-il isobutírico denomina éster do ácido (1R,2R,4R)-2-(2-{[3-(4,7-dimetoxi-1H- benzoimidazol-2-il)-propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en- 2-il isobutírico, ou éster do ácido (1S,2S,4S)-2-(2-{[3-(4,7-dimetoxi-1H- benzoimidazol-2-il)-propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en- 2-il isobutírico, ou misturas destes dois enantiômeros, tais como, por exemplo, o racemato.
[0077] Abrangidas pelo escopo da presente invenção estão as formas de sal cristalino do COMPOSTO, ou seja, o éster do ácido (1R*,2R*,4R*)-2-(2-{[3-(4,7-dimetoxi-1H-benzoimidazol-2- il)-propil]- metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il isobutírico, descrito neste contexto; em que o COMPOSTO pode estar na forma racêmica; na forma enantomericamente enriquecida do enantiômero da configuração absoluta (1 R,2R,4R); na forma enantiomericamente enriquecida do enantiômero de configuração absoluta (1S,2S,4S); ou na forma de qualquer mistura destes dois enantiômeros. Preferida é a forma enantiomericamente enriquecida que tem rotação óptica negativa tal como determinada utilizando-se o método como descrito neste contexto.
[0078] Onde se utiliza a forma plural para compostos, sais, composições farmacêuticas, enfermidades e assemelhados, esta também pretende ter o significado de um único composto, sal ou assemelhado.
[0079] O termo “enantiomericamente enriquecido” é compreendido no contexto da presente invenção como significando especialmente que pelo menos 90, preferentemente pelo menos 95, e com maior preferência pelo menos 99 por cento, em peso, do COMPOSTO estão presentes na forma de um enantiômero do COMPOSTO.
[0080] O termo “essencialmente puro" é compreendido no contexto da presente invenção como significando especialmente que pelo menos 90, preferentemente pelo menos 95, e com maior preferência pelo menos 99 por cento, em peso, dos cristais de um COMPOSTO estão presentes em uma forma cristalina de acordo com a presente invenção, especialmente em uma única forma cristalina da presente invenção.
[0081] Quando se define a presença de pico, por exemplo, em um diagrama de difração de pó ao raios X, uma abordagem comum é fazer isto em termos de relação S/N (S = sinal, N = ruído). De acordo com esta definição, quando se estabelece que um pico tem de estar presente em um diagrama de difração de pó por raios X, fica entendido que o pico no diagrama de difração de pó por raios X é definido por ter uma relação S/N (S = sinal, N = ruído) maior do que x (sendo x um valor numérico maior do que 1), usualmente maior do que 2, especialmente maior do que 3.
[0082] No contexto com o estabelecimento de que a forma cristalina mostra essencialmente um padrão de difração de pó por raios X tal como ilustrado na Figura 1 até à Figura 11, respectivamente, o termo “essencialmente" significa que pelo menos os picos principais do diagrama ilustrado nas ditas figuras, ou seja, aqueles que têm uma intensidade relativa de mais que 10%, especialmente mais do que 20%, em comparação com o pico mais intenso no diagrama, têm de estar presentes. Não obstante, a pessoa versada na técnica da difração de pó por raios X reconhecerá que as intensidades relativas no diagrama de difração de pó por raios X podem estar sujeitas a fortes variações de intensidade devido aos efeitos de orientação preferidos.
[0083] A menos que usado com relação a temperaturas, o termo “aproximadamente" colocado antes de um valor numérico “X" refere-se no presente pedido a um intervalo que se estende desde X menos 10% de X até X mais 10% de X, e preferentemente a um intervalo que se estende desde X menos 5% de X até X mais 5% de X. No caso particular das temperaturas, o termo “aproximadamente” colocado antes de uma temperatura "Y" refere-se na presente invenção a um intervalo que se estende desde a temperatura Y menos 10°C até Y mais 10°C, e preferentemente a um intervalo que se estende desde Y menos 5°C até Y mais 5°C. A temperatura ambiente significa uma temperatura de aproximadamente 25°C. Quando na presente invenção se utiliza o termo equivalente(s) n, em que n é um número, entende-se e situa-se dentro do escopo do presente pedido que n está-se referindo a aproximadamente o número n, preferentemente n está-se referindo ao número n exato.
[0084] Os sais cristalinos, especialmente os sais cristalinos essencialmente puros, do COMPOSTO de acordo com qualquer uma das concretizações 1) até 51) podem ser usados como medicamentos, por exemplo, na forma de composições farmacêuticas para administração entérica ou parentérica.
[0085] A produção das composições farmacêuticas pode ser realizada de uma maneira que será familiar para qualquer pessoa versada na técnica (vide, por exemplo, Remington, The Science e Practice de Pharmacy, 21st Edition (2005), Part 5, “Pharmaceutical Manufacturing” [published by Lippincott Williams & Wilkins]) ao trazerem-se as formas cristalinas da presente invenção, opcionalmente em combinação com outras substâncias terapeuticamente valiosas, para uma forma de administração galênica em conjunto com materiais carreadores sólidos ou líquidos, terapeuticamente compatíveis, inertes, não tóxicos, adequados e, quando desejado, adjuvantes farmacêuticos usuais.
[0086] Os sais cristalinos, especialmente os sais cristalinos essencialmente puros, do COMPOSTO de acordo com qualquer uma das concretizações 1) até 51) podem ser usados como componente simples ou como misturas com outras formas cristalinas da forma amorfa do COMPOSTO.
[0087] Os sais cristalinos, especialmente os sais cristalinos essencialmente puros, do COMPOSTO de acordo com qualquer uma das concretizações 1) até 51) são de utilidade na preparação de um medicamento e/ou são adequados • para o tratamento ou prevenção de angina crônica estável, hipertensão, isquemia (renal e cardíaca), arritmias cardíacas que inclui fibrilação atrial, hipertrofia cardíaca, ou insuficiência cardíaca congestiva.
[0088] Os sais cristalinos, especialmente os sais cristalinos essencialmente puros, do COMPOSTO de acordo com qualquer uma das concretizações 1) até 51) são ainda também de utilidade na preparação de um medicamento e/ou são adequados para os seguintes grupos de enfermidades isoladamente ou em qualquer combinação: • para o tratamento de enfermidades renais, diabetes e suas complicações, hiperaldosteronismo, epilepsia, dor neuropática, ou câncer em seres humanos e outros mamíferos; • para o uso como agente anti-fibrilatório, agente anti- asmático, agente anti-aterosclerótico, aditivo para soluções cardioplégicas para circulações pulmonares, adjuntor para terapia trombolítica, como agente anti-agregante, ou como agente para o tratamento de angina instável; • para o tratamento ou profilaxia de hipertensão, especialmente hipertensão portal, hipertensão secundária para tratamento com eritropoietina e hipertensão com baixa renina; • para o uso em enfermidades hipóxicas ou isquêmicas, ou como agente anti-isquêmico para o tratamento de, por exemplo, isquemia cardíaca, renal e cerebral e reperfusão (por exemplo, que ocorre depois de cirurgia de revascularização cardiopulmonar), vasoespasmo das coronárias e cerebral e assemelhados, terapia para enfermidades vasculares periféricas (por exemplo, doença de Raynaud, claudicação intermitente, doença de Takayashus), doença calciforme incluindo iniciação e/ou evolução da dor de crise; • para o tratamento ou profilaxia de distúrbios relacionados com função da célula renal, glomerular e mensagial, incluindo insuficiência renal aguda e crônica, defropatia diabética, nefropatia induzida por hipertensão, lesão glomerular, dano renal relacionado com a idade ou diálise, nefroesclerose, nefrotoxicidade relacionada com agente de imagem e contraste e com ciclosporina, isquemia renal, refluxo vesicorretal primário, ou glomeruloesclerose; • para o uso em terapia para infarto do miocárdio, tratamento de hipertrofia cardíaca, hipertensão pulmonar primária e secundária, terapia para insuficiência cardíaca congestiva que inclui inibição de fibrose, inibição de dilatação do ventrículo esquerdo, remodelagem e disfunção, ou restenose em seguida a angioplastia ou implante de stent; • para o tratamento de endotoxemia ou choque de endotoxina, ou choque hemorrágico; • para o tratamento de disfunção sexual tanto nos homens (disfunção erétil, por exemplo, devido a diabetes mellitus, ferimento da medula espinal, prostatectomia radical, etiologia psicogênica e outras causas) quanto nas mulheres por melhoramento do fluxo sanguíneo para a genitália, especialmente corpos cavernosos; • para a prevenção e/ou redução de câncer ou dano em órgão alvo associado com proliferação de células; • para terapia de distúrbios metabólicos ou enfermidades inflamatórias crônicas, diabetes mellitus dependente de insulina e não dependente de insulina e suas complicações (por exemplo, neuropatia, retinopatia, hiperaldosteronismo, remodelagem óssea, psoríase, artrite, artrite reumatóide, sarcoidose osteoartrite, ou dermatite eczematosa; • para o tratamento de hepatotoxicidade e falência repentina, doença hepática e lesão incluindo complicação concomitante (por exemplo, hepatotoxicidade, fibrose, cirrose), conseqüências perniciosas de tumores, tais como hipertensão resultante de hemangiopericitoma, enfermidades espáticas do trato urinário e/ou bexiga, síndrome hepato-renal, enfermidades imunológicas envolvendo vasculite, tais como lupus, esclerose sistêmica, crioglobulinemia mista, fibrose associada com disfunção renal e hepatotoxicidade; • para o uso em enfermidades gastrintestinais, tais como colite ulcerosa, doença de Crohn, dano da mucosa gástrica, doença inflamatória intestinal e doença isquêmica intestinal, enfermidades da vesícula biliar ou baseadas no conduto biliar, tais como colangite, pancreatite, regulagem do crescimento celular, hipertrofia prostática benigna, ou transplante, ou para o uso como agente anti- diarréico; • para o tratamento de distúrbios envolvendo bronco constrição ou distúrbios de inflamação crônica ou aguda, tais como doença pulmonar obstrutiva e síndrome da angústia de adultos; • para alívio da dor que inclui dor neuropática, dor periférica e dor associada com câncer, tal com odor associada com câncer de próstata ou câncer ósseo; • para o tratamento de distúrbios vasculares do sistema nervoso central, tais como acidente vascular cerebral, ataques isquêmicos, enxaqueca e hemorragia subaracnóidea, distúrbios de comportamento do sistema nervosa central, tratamento de demência que inclui demência de Alzheimer, demência senil e demência vascular, epilepsia, ou distúrbios do sono; ou • para redução de morbidade geral e/ou mortalidade como um resultado das utilidades anteriormente citadas.
[0089] A presente invenção também se refere a um método para a prevenção ou tratamento de uma enfermidade ou distúrbio mencionado neste contexto que compreende administrar a um paciente uma quantidade farmaceuticamente ativa de um sal cristalino, especialmente de um sal cristalino essencialmente puro, do COMPOSTO de acordo com qualquer uma das concretizações 1) até 51).
[0090] Além disso, os sais cristalinos, especialmente os sais cristalinos essencialmente puros, do COMPOSTO de acordo com qualquer uma das concretizações 1) até 51) também podem ser usados favoravelmente em combinação com um ou mais agentes selecionados a partir de agentes hipolipemiantes tais como estatinas, anticoagulantes tais como cumarinas, agentes antitrombóticos, tais como clopidogrel, β- bloqueadores, e outros agentes cardio-protetores.
[0091] A presente invenção também se refere a um processo para a preparação do COMPOSTO em uma forma racêmica e enriquecida enantiomericamente, e a processos para a preparação e caracterização de sais cristalinos do COMPOSTO de acordo com qualquer uma das concretizações 1) até 51), estando os ditos processos descritos na parte experimental em seguida. Parte Experimental
[0092] Os Exemplos seguintes ilustram a invenção de forma mais detalhada. As temperaturas são dadas em graus Celsius. Se não estiverem estabelecidas de outra maneira, as percentagens são dadas em peso. Abreviaturas conforme usadas neste contexto e na descrição exposta anteriormente: aq. aquoso ca. aproximadamente CC cromatografia de coluna em gel de sílica DCM diclorometano DIPA diisopropil-amina DIPEA diisopropil-etilamina, base de Hünig, etil- diisopropilaminaDMAP 4-dimetilamino-piridina DMF dimetilformamida DSC calorimetria diferencial de varredura eq. equivalente(s) Et20 éter etílico EtOAc acetato de etila EtOH etanol Fig. figura h hora(s) 1H-NMR ressonância magnética nuclear hidrogênio-1 Hept heptano Hex hexano HOBt 1-hidroxibenzotriazol MEK 2-butanona MeCN acetonitrila Me0H metanol NEt3 trietilamina Pd/C paládio em carbono 2-PrOH isopropanol Red-Al sódio-bis(2-metoxietoxi)hidreto de alumínio RH umidade relativa rt temperatura ambiente rpm rotações por minuto sat. saturado TBME éter terc-butílico de metila tert. terciário THF tetraidrofurano TsOH ácido para (p)-tolueno sulfônico XRPD difração de pó por raios X Análise de difração de pó por raios X (XRPD):
[0093] Método 1: Coletaram-se padrões de difração de pó por raios X em um difractômetro de raios X Bruker D8 Advance equipado com um detector LynxEye com janela 3° operado com Cu Ka-radiação em geometria de reflexo (Bragg-Brentano). Tipicamente, o tubo de raios X foi operado sob 40kV/40mA. Aplicou-se uma dimensão de etapa de 0,02° (2θ) e um tempo de etapa de 37 seg sobre uma faixa de varredura de 2 - 50° em 2teta (2θ). A fenda de divergência foi ajustada para V12 ou V20 variável, dependente da profundidade do suporte de amostra. O pó (cerca de 15 mg para 0,1 mm de profundidade e cerca de 80 mg para 1 mm de profundidade) foi levemente prensado em um suporte de amostra de cristal simples de silício com profundidade de 0,1 mm ou 1 mm e as amostras foram rodadas em seu próprio plano durante a medição. As amostras selecionadas foram cobertas com ouropel Kapton. Os dados de difração são reportados utilizando-se Cu Kα1 (X = 1,5406 Â), depois de o componente Kα2 ter sido despojado utilizando-se o software de avaliação de instrumento (EVA). Além disso, o sinal de fundo foi removido utilizando-se o software de avaliação de instrumento (EVA), para amostras que foram cobertas por Kapton durante a aquisição de dados. A exatidão dos valores 2θ tais como proporcionados neste contexto situa-se na faixa de +/- 0,1-0,2° como é geralmente o caso para o padrão de difração de
[0094] Método 2: Coletaram-se padrões de difração de pó por raios X em um difractômetro de raios X Bruker D8 Advance equipado com um detector GADDS HiStar operado com Cu Ka-radiação em geometria de reflexo. Tipicamente, o tubo de raios X foi operado sob 40kV/40mA. O desempenho do instrumento é verificado utilizando-se um padrão Corundum certificado (NIST 1976). As amostras operadas sob condições ambiente foram preparadas como espécimes de placa plana utilizando-se o pó como recebido. Aproximadamente 3 mg da amostra foram suavemente prensados em uma lamina de microscópio. Os dados foram coletados sobre uma faixa angular de 7,6° até 26,7° 2θ em 1 armação com um tempo de aquisição de 180segundo. Os dados de difração estão reportados sem o componente Kα2 ser despojado e o sinal de fundo foi removido utilizando-se o software de avaliação de instrumento (EVA). A exatidão dos valores 2θ tais como proporcionados neste contexto situa-se na faixa de +/- 0,1-0,2°, como é geralmente o caso para o padrão de difração de pó por raios X convencionalmente registrado.
[0095] Pontos de fusão foram medidos em um aparelho Buchi B-540 e não foram corrigidos; ou foram medidos, se explicitamente estabelecido, por colorimetria de varredura diferencial (DSC):
[0096] Os dados de DSC foram coletados em um Perkin Elmer DSC7. Tipicamente, aqueceram-se 2-3 mg de amostra, previamente armazenada aberta sob nitrogênio seco durante 16 horas, foi aquecida em uma bandeja de ouro fechada sob 20°C min-1 a partir de -20°C até 200°C. Os pontos de fusão estão reportados como temperaturas de pico.
[0097] As rotações ópticas foram medidas em um aparelho Jasco P1030 sob temperatura ambiente utilizando-se a linha D de sódio (X = 589 nm).
[0098] 1H-NMR foram medidas em um Bruker Avance 400 (400 MHz); os desvios químicos são dados em ppm em relação ao solvente usado; multiplicidades: s = simples, d = duplo, t = terceto, q = quarteto, p = pentupleto, hex = hexeto, sept = septupleto, m = multipleto, dm = duplo de multipleto, br = amplo, as constantes de acoplamento são dadas em Hz). Os ensaios de NMR foram medidos utilizando-se dimetiléter de hidroquinona como padrão interno.
[0099] Higroscopicidade foi avaliada através de medições de sorção de vapor gravimétrico digitalizadas em um SPS11-100m (Projekt Messtechnik, Ulm, Germany) (a taxa de varredura foi 5% de mudança de umidade relativa por hora, o ciclo iniciou sob 50% de umidade relativa seguido por uma varredura a seco e uma varredura ascendente para 95% de umidade relativa). A classificação foi efetuada de acordo com o European Pharmacopea Technical Guide (1999 edition) (por exemplo, levemente higroscópico: aumento na massa é menor do que 2% e igual ou maior do que 0,2% massa/massa). Foi considerada a alteração de massa entre 40% de umidade relativa e 80% de umidade relativa na varredura ascendente.
[00100] LC-MS foram executados utilizando-se as seguintes condições: Finnigan Navigator com HP 1100 Binary Pump e DAD, coluna: 4,6x50 mm, Zorbax SB-AQ, 5 jim, 120 A, gradiente: 5-95% acetonitrila em água, 1 min, com 0,04% ácido trifluoroacético, fluxo: 4,5 ml/min, tR é dado em min.
[00101] Os compostos são purificados por HPLC de preparação (coluna: X-terra RP18, 50x19 mm, 5 jim, gradiente: 10-95% acetonitrila em água contendo 0,5 % de ácido fórmico) ou por cromatografia de coluna em gel de sílica. Os racematos podem ser separados nos seus enantiômeros por HPLC de preparação (condições preferidas: Daicel, ChiralCel OD 20x250 mm, 10 jim, 4% etanol em hexano, fluxo 10-20 ml/min). 1. Preparação e caracterização do COMPOSTO
[00102] A preparação do COMPOSTO é conhecida a partir da W02008/132679: Preparação dos intermediários Procedimentos gerais para a preparação dos intermediários chave K:
[00103] Os intermediários chave K1A e K2A o que são derivados biciclo[2.2.2]oct-5-en-2-il ou biciclo[3.2.2]non-8-en-6-il são obtidos como uma mistura entre o racemato principal dotado da configuração relativa (R*,R*,R*) (ou seja, a ponte -(CH2)2- da metade cicloexeno é cis para o grupo -OR2 sendo hidroxila) e o racemato menor tendo a configuração relativa (R*,S*,R*) (ou seja, a ponte -(CH2)2- da metade cicloexeno é trans para o grupo -OR2 sendo hidroxila). Os racematos maiores e menores podem ser separados tal como se descreveu para o intermediário chave K1A no procedimento A1.5. O racemato maior é isolado e usado na preparação dos exemplos adiante. K1A: Éster TERC-butílico de ácido rac-(1R*,2R*,4R1-(2-hidroxi-5-fenil- biciclo[2.2.2]oct-5-en-2-il)-acético K1 A.1 (Procedimento A1.1): rac-(1R*,4R*)-Biciclo[2.2.2] octano-2,5-diona
[00104] Misturaram-se e aqueceram-se 25 ml de 2-(trimetilsililoxi)- 1,3-cicloexadieno e 13 ml de α-acetoxiacrilonitrila a 150°C em um vaso fechado durante 22 h. O óleo viscoso de cor laranja escuro obtido foi dissolvido em 200 ml de MeOH. Depois de adição gota a gota de uma solução de 2,2 g de metóxido de sódio em 150 ml de MeOH a mistura de reação foi submetida a agitação durante 3 h sob rt, vazada em gelo/água e extraída com DCM. As fases orgânicas foram concentradas in vacuo e o resíduo bruto foi purificado por CC com EtOAc-Hept (1:2) para proporcionar 7,9 g de rac-(1R*,4R*)- biciclo[2.2.2]octano-2,5-diona.
[00105] LC-MS: tR = 0,44 min. K1A.2 (Procedimento A1.2): rac-(1R*,4R*)-Espiro[biciclo [2.2.2]octano-2,2‘- [ 1,3]dioxolan]-5-ona
[00106] A 4,0 g de rac-(1R*,4R*)-biciclo[2.2.2]octano-2,5-diona (intermediário K1A.1), dissolvido em 120 ml de tolueno, adicionaram-se 1,7 ml de etileno glicol e 0,27 g de TsOH e a solução foi aquecida sob agitação vigorosa para refluxo durante 3,5 h. A mistura de reação foi refrigerada para a rt, resfriada rapidamente com NaHCO3 aq. saturado, extraída com Et20, e a fase orgânica foi evaporada. O produto bruto foi purificado por CC com Hex-EtOAc (7:3) para proporcionar 2,41 g de rac- (1R*,4R*)-spiro[biciclo[2.2.2]octano-2,21-[1,3]dioxolan]-5-ona na forma de um óleo amarelo.
[00107] LC-MS: tR = 0,64 min; [M-FH-FCH3CN]+: 224,35. K1A.3 (Procedimento A1.3): Mistura de rac-(7R*,8R*,10R*)- e rac- (7R*,8S*,10R*)-7,10-(1,2- etileno)-8-fenil-1,4-dioxa-spiro[4,5]decan-8-ol
[00108] A uma solução de 2.41 g de rac-(1R*,4R*)- spiro[biciclo[2.2.2]octano-2,2’-[1,3]dioxolan]-5-ona (intermediário K1A.2) em 80 ml Et2O, adicionou-se 14,5 ml de solução de brometo de fenilmagnésio (1M em Et2O) gota a gota durante 10 min. A mistura de reação foi submetida a agitação durante 4 h sob rt. Então, a mistura foi resfriada rapidamente de maneira cuidadosa com gelo, adicionaram-se 8 ml de 2N HCI e as fases foram separadas. A fase orgânica foi evaporada e o produto bruto foi purificado por CC com Hept-EtOAC (7:3) para proporcionar 0,37 g de 7,10-(1,2-etileno)-8-fenil-1,4-dioxa- spiro[4.5]de-can-8-ol na forma de um óleo incolor. (A separação dos diastereômeros por CC é possível mas não foi realizada neste caso).
[00109] LC-MS: tR = 0,84 min; [M-H2O+H]+: 243,34. K1 A.4 (Procedimento A1.4): rac-(1R*,4R*)-5-fenil-biciclo[2.2.2]oct-5-en-2- ona
[00110] A uma solução de 0,54 g de 7,10-(1,2-etileno)-8-fenil- 1,4-dioxa-spiro[4.5]decan-8-ol (intermediário K1A.3) em 20 ml de acetona adicionou-se 200 mg de TsOH e então a mistura foi submetida a agitação durante 2 dias sob rt. A mistura de reação foi resfriada rapidamente com NaHCO3 aq. sat., extraída com EtOAC e a fase orgânica foi evaporada. O produto bruto foi purificado por CC com Hept-EtOAC (7:3) para proporcionar 0,34 g de rac-(1R*,4R*)-5-fenil-biciclo[2.2.2]oct-5-en-2-ona na forma de um óleo incolor.
[00111] LC-MS: tR = 0,93 min; [M+H+CH3CN]+: 240,11. K1 A.5 (Procedimento A1.5): éster terc-butílico de ácido rac-(1R*,2R*,4R*)- (2-Hidroxi-5-fenil-biciclo[-2.2.2]oct-5-en-2-il)-acético e éster terc-butílico de ácido rac-(1R*,2S*,4R*)-(2-hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)- acético
[00112] A uma solução de 0,51 ml de DIPA em 0,5 ml de THF adicionaram-se 2,2 ml de n-butillítio (1,6M em Hex) gota a gota a -20°C. Depois de 10 min, adicionaram-se 0,5 ml de tolueno e a solução foi submetida a agitação durante 30 min. A mistura foi refrigerada para - 50°C, adicionaram-se 0,73 ml de acetato terc.-butila e continuou-se com a agitação durante 1 h sob -50°C. Então, adicionou-se 0,32 g de rac- (1R*,4R*)-5-fenil-biciclo[2.2.2]oct-5-en-2-ona (intermediário K1A.4) dissolvido em 1 ml de THF e a solução foi submetida a agitação a -50 até - 20°C durante 2,5 h. A mistura de reação foi vazada em gelo/aq. HCI, a fase orgânica foi separada, lavada e evaporada. O produto de reação bruto foi purificado por CC com Hept-EtOAc (9:1) para proporcionar 0,30 g do racemato principal, éster terc-butílico de ácido rac-(1R*,2R*,4R*)-2-hidroxi- 5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético, na forma de um sólido branco e 0,07 g do racemato menor, éster terc-butílico de ácido rac-(1R*,2S*,4R*)-2- hidroxi-5-fenil-biciclo[2.2.2] oct-5-en-2-il)-acético, na forma de um óleo incolor.
[00113] LC-MS (racemato principal): tR = 1,06 min; [M-(CH3)3-H2O- FH]+: 241,11.
[00114] LC-MS (racemato menor): tR = 1,05 min; [M+H]+: 315,18. K1A.6: éster terc-butílico de ácido (1S,2S,4S)-(2-hidroxi-5-fenil- biciclo[2.2.2]oct-5-en-2-il)-acético e éster terc-butílico de ácido (1R,2R,4R)- (2-Hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético
[00115] Separou-se éster terc-butílico de ácido rac-(1R*,2R*,4R*)-(2- Hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético nos respectivos enantiômeros utilizando-se HPLC quiral prep. (coluna: Daicel ChiralPak AD- H, 20x250 mm, 5 pm; Hex/ EtOH 95:5, fluxo 16 ml/min).
[00116] HPLC analítico quiral (Daicel ChiralPak AD-H, 4,6x250 mm, 5 pm; Hex/ EtOH 95:5, fluxo 0,8 ml/min):
[00117] éster terc-butílico de ácido(1R,2R,4R)-(2-hidroxi-5-fenil- biciclo[2.2.2]oct-5-en-2-il)-acético:
[00118] Enantiômero A: tR = 6,70 min. éster terc-butílico de ácido (1S,2S,4S)-(2-Hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético: Enantiômero B: tR = 7,93 min. BB. [3-(4,7-Dimetoxi-1H-benzoimidazol-2-il)-propil]-metil-amina BB.1 3,6-Dimetoxi-benzeno-1,2-diamina
[00119] Sintetizou-se 3,6-dimetoxi-benzeno-1,2-diamina por dissolução de 6,0 g de 1,4-dimetoxi-2,3-dinitro-benzeno (Eur.J.Org.Chem. 2006, 2786-2794) em 220 ml EtOH, evacuação 3 vezes com N2 e adicionando-se 600 mg de l0% p Pd/C. A reação foi submetida a agitação sob uma atmosfera de H2 (balão). Outros 300 mg de 10% p Pd/C foram adicionados depois de 2 dias e a mistura foi submetida a agitação durante outras 24 h. Filtragem sobre um chumaço de celite e lavagem com EtOH e EtOAc proporcionou depois de concentração in vacuo 4,3 g de 3,6-dimetoxi- benzeno-1,2-diamina na forma de um sólido preto.
[00120] LC-MS: tR = 0,48 min; [M+H]+: 169,09. BB.2 Éster benzílico de ácido[3-(2-amino-3,6-dimetoxi-fenilcarbamoil)- propil] -metil-carbâmico
[00121] A uma solução de 3,1 g de ácido 4-(benziloxicarbonil-metil- amino)-butírico em 80 ml DCM adicionaram-se 6,5 ml de DIPEA, 1,8 g de HOBt, 2,6 g de EDC e 154 mg de DMAP. Depois de submetida a agitação durante 10 min, adicionaram-se 2,1 g de 3,6-dimetoxi-benzeno-1,2-diamina, dissolvidos em 20 ml de DCM, e a mistura foi submetida a agitação sob rt durante a noite. A reação foi resfriada rapidamente com sat. aq. NaHCO3, as fases foram separadas e a fase orgânica foi lavada com salmoura, submetida a secagem sobre MgSO4 e concentrada in vacuo para proporcionar o composto do título bruto na forma de um óleo preto.
[00122] LC-MS: tR = 0,88 min; [M+H]+: 402,06. BB.3 Éster benzílico de ácido [3-(4,7-dimetoxi-1 H-benzo-imidazol-2-il)- propil]-metil-carbâmico
[00123] A uma mistura do éster benzílico de ácido [3-(2-amino-3,6- dimetoxi-fenilcarbamoil)-propil]-metil-carbâmi-co bruto mencionado anteriormente em 16 ml de tolueno adicionaram-se 4 ml de DMF e 1,9 g de TsOH e a reação foi aquecida até 150°C durante 2 h no microondas. Adicionou-se NaHCO3 sat. aq. e as fases foram separadas. A fase orgânica foi lavada com salmoura, submetida a secagem sobre MgSO4, concentrada in vacuo, filtrada sobre um chumaço curto de gel de sílica com EtOAc e concentrada novamente. Purificação por CC com EtOAc proporcionou 2,7 g de éster benzílico de ácido 3-(4,7-dimetoxi-1H- benzoimidazol-2-il)-propill-metil-carbâmico na forma de uma resina castanha.
[00124] LC-MS: tR = 0,85 min; [M+H]+: 384,62. BB.4 [3-(4,7-Dimetoxi-1H-benzoimidazol-2-il)-propil]-metil-amina
[00125] Uma solução de 2,6 g de éster benzílico de ácido 3-(4,7- dimetoxi-1H-benzoimidazol-2-il)-propill-metil-carbâmico em 60 ml EtOH foi evacuada 3 vezes com N2, antes de serem adicionados 260 mg de 10% p de Pd/C. A mistura de reação foi então submetida a agitação sob uma atmosfera de H2 (balão) durante 5 horas sob temperatura ambiente. Filtragem sobre um chumaço de celite e lavagem com EtOH proporcionou depois de concentração in vacuo 1,7 g de 3-(4,7-dimetoxi-1H-benzoimidazol-2-il)- propill-metil-amina na forma de uma espuma de cor castanha.
[00126] LC-MS: tR = 0,57 min; [M+H]+: 250,13. Preparação do COMPOSTO Exemplo de Referência 1A: Éster de ácido rac-(1R*,2R*,4R1-2-(2-{[3-(4,7- dimetoxi-1H-benzoimidazol-2-il)-propil]-metil-amino}-etil)-5-fenil- biciclo[2.2.2]oct-5-en-2-il isobutírico 1.1 (Procedimento P1.1): Ácido rac-(1R*,2R*,4R*)-(2-hidroxi-5-fenil- biciclo[2.2.2]oct-5-en-2-il)-acético
[00127] A uma solução de 4,0 g de éster terc-butílico de ácido rac- (1R*,2R*,4R*)-(2-hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético em 25 ml de EtOH adicionaram-se 2,1 g de LiOH.H2O, 8 ml de H2O e 22 ml de MeOH. A mistura de reação foi submetida a agitação sob rt durante 3 d e então concentrada. O resíduo foi dividido entre água e Et2O. A camada aquosa foi separada e acidulada com 1N HCI resultando na formação de um sólido branco. O sólido foi filtrado, lavado com 5 ml aq. HCI e submetido a secagem in vacuo para obter-se 3,2 g de ácido rac-(1R*,2R*,4R*)-(2-hidroxi- 5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético na forma de um sólido branco.
[00128] LC-MS: tR = 0,86 min; [M-H2O+H]+: 241,28. 1.2 (Procedimento P1.2):rac-(1R*,2R*,4R*)-N-1-3-(4,7-Dimetoxi-1H- benzoimidazol-2-il)-propil-1-2-(2-hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)- N-metil-acetamida
[00129] A uma solução de 280 mg de ácido rac-(1R*,2R*,4R*)-(2- hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético em 7 ml de THF adicionaram-se 0,58 ml de DIPEA, 175 mg de HOBt e 250 mg de EDC sob rt. Depois de submetida a agitação durante 10 min, adicionaram-se 270 mg de 3- (4,7-dimetoxi-1H-benzoimidazol-2-il)-propill-metil-amina e a mistura de reação foi submetida a agitação sob temperatura ambiente durante a noite. A mistura de reação foi resfriada rapidamente com sat. aq. NaHCO3, as fases foram separadas and a fase orgânica foi lavada com água e salmoura, submetida a secagem sobre MgSO4 e concentrada in vacuo. Purificação por CC utilizando-se EtOAc-MeOH (5:1 até 2:1) proporcionou 475 mg de rac-(1R*,2R*,4 R*)-N43-(4,7-dimetoxi-1H-benzoimidazol-2-il)- propil]-2-(2-hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-N-metil-acetamida na forma de uma espuma branca.
[00130] LC-MS: tR = 0.91 min; [M+H]+: 490.06. 1.3 (Procedimento P1.3): rac-(1R*,2R*,4R*)-2-(2-{[3-(4,7-Dimetoxi-1H- benzoimidazol-2-il)-propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en- 2-ol
[00131] A uma solução de 310 mg de rac-(1R*,2R*,4R*)-N-[3-(4,7- dimetoxi-1H-benzoimidazol-2-il)-propil]-2-(2-hidroxi-5-fenil- biciclo[2.2.2]oct-5-en-2-il)-N-metil-acetamida em 8 ml de tolueno adicionaram-se gota a gota 0,77 ml de uma solução Red-Al (65% em tolueno) a 0°C. Depois de agitação durante 10 min a 0°C, o banho de resfriamento foi removido e continuou-se com a agitação durante 3 h sob rt. A mistura de reação foi então vazada cuidadosamente em uma mistura de 1M NaOH/gelo e submetida a agitação durante 10 min. A fase aquosa foi extraída com tolueno, as fases orgânicas combinadas foram lavadas com salmoura, submetidas a secagem sobre MgSO4 e concentradas in vacuo. Purificação por CC utilizando-se EtOAc-MeOH (2:1) proporcionou 230 mg de rac-(1R*,2R*,4R*)-2-(2-{[3-(4,7-dimetoxi-1H-benzoimidazol-2-il)-propil]- metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-ol na forma de uma espuma branca.
[00132] LC-MS: tR = 0,79 min; [M+H]+: 476,13. 1.4 : Éster do ácido rac-(1R*,2R*,4R1-2-(2-{ 1-3-(4,7-dimetoxi-1H- benzoimidazol-2-il)-propil] -metil-amino} -etil)-5-fenil-biciclo [2.2.2] oct-5-en- 2-il isobutírico
[00133] A uma solução de 199 mg de rac-(1R*,2R*,4R*)-2-(2-{[3- (4,7-dimetoxi-1H-benzoimidazol-2-il)-propil]-metil-amino}-etil)-5-fenil- biciclo[2.2.2]oct-5-en-2-ol em 4 ml de DCM adicionaram-se 0,2 ml de NEt3 e 0,1 ml de cloreto de isobutiril a 0°C. A mistura de reação foi submetida a agitação durante a noite permitindo-se que a temperatura alcançasse lentamente a rt. A reação foi resfriada rapidamente com NaHCO3 aq. sat., as fases foram separadas e a fase aquosa foi re-extraída com DCM. As fases orgânicas combinadas foram lavadas com salmoura, submetidas a secagem sobre MgSO4 e concentradas in vacuo. O resíduo foi redissolvido em 3 ml de EtOAc, gel de sílica e adicionaram-se 1,5 ml de MeOH e a mistura foi submetida a agitação vigorosamente durante 7 d. A mistura foi filtrada, lavada completamente com EtOAc-MeOH (2:1) e evaporada. Purificação por CC utilizando-se EtOAc-MeOH (5:1 até 3:1 + 0,1% NEt3) proporcionou 186 mg de éster do ácido rac- (1R*,2R*,4R*)-2- (2- {[3-(4,7-dimetoxi-1H-benzoimidazol-2-il)-propil]-metil-amino}-etil)-5-fenil- biciclo[2.2.2]oct-5-en-2-il-isobutírico na forma de uma espuma bege.
[00134] LC-MS: tR = 0,90 min; [M+H]+: 546,23. Exemplo de referência 2A: Éster do ácido (1S,2S,4S)-2-(2-{[3-(4,7- dimetoxi-1 H-benzoi midazol-2-il)-propil]-metil-amino}-etil)-5-fenil- biciclo[2.2.2]oct-5-en-2-il-isobutírico 2.1: Ácido (1S,2S,4S)-(2-hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético
[00135] Preparado de acordo com o procedimento P1.1 no Exemplo de Referência 1A utilizando-se o enantiômero B de éster terc-butílico de ácido rac-(1R*,2R*,4R*)-(2-hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético (vide K1A.6).
[00136] LC-MS: tR = 0,91 min; [M-H2O+H]+: 241,10. 2.2: (1S,2S,4S)-2-(2-{[3-(4,7-Dimetoxi-1H-benzoimida-zol-2-il)-propil]- metil-amino}-etil)-5-fenil-biciclo[2.2.2] oct-5-en-2-ol
[00137] Preparado de acordo com os procedimentos P1.2 até P1.3 no Exemplo de Referência 1A utilizando-se o ácido (2-hidroxi-5-fenil- biciclo[2.2.2]oct-5-en-2-il)-acético exposto anteriormente.
[00138] LC-MS: tR = 0,78 min; [M+H]+: 476,09. 2.3: Éster do ácido (1S,2S,4S)-2-(2-{1-3-(4,7-dimetoxi-1H -benzoimidazol- 2-il)-propil-1-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il isobutírico
[00139] Preparado de acordo com o procedimento P1.4 no Exemplo de Referência 1A utilizando-se o 2-(2-{[3- (4, 7-dimetoxi-1H- benzoimidazol-2-il)-propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5- en-2-ol exposto anteriormente.
[00140] LC-MS: tR = 0,89 min; [M+H]+: 546,19. Exemplo de referência 3A: Éster do ácido (1 R,2R,4R)-2-(2-{[3-(4,7- dimetoxi-1 H-benzoi midazol-2-il)-propil]-metil-ami no}-etil)-5-fenil- biciclo[2.2.2]oct-5-en-2-il-isobutírico 3.1: Ácido (1R,2R,4R)-(2-hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético
[00141] Preparado de acordo com o procedimento P1.1 no Exemplo de referência 1 utilizando-se o enantiômero A de éster terc-butílico de ácido rac- (1R*,2R*,4R*)-(2-hidroxi-5-fenil-biciclo[2.2.2]oct-5-en-2-il)-acético (vide K1A.6).
[00142] LC-MS: tR = 0,91 min; [M-H2O+H]+: 241,16. 3.2: (1R,2R,4R)-2-(2-{ 1-3-(4,7-Dimetoxi-1H-benzoimidazol-2-v1)-propv1- 1-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-ol
[00143] Preparado de acordo com os procedimentos P1.2 até P1.3 no Exemplo de referência 1 que contêm o ácido (2-hidroxi-5-fenil- biciclo[2.2.2]oct-5-en-2-il)-acético exposto anteriormente.
[00144] LC-MS: tR = 0,79 min; [M+H]+: 476,09. 3.3: Éster do ácido (1R,2R,4R)-2-(2-{1-3-(4,7-dimetoxi-1H-benzoimidazol-2- il)-propill-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-il-isobutírico
[00145] Preparado de acordo com o procedimento P1.4 no Exemplo de referência 1A utilizando-se o 2-(2-{[3- (4, 7-dimetoxi-1H-benzoimidazol-2- il)-propil]-metil-amino}-etil)-5-fenil-biciclo[2.2.2]oct-5-en-2-ol exposto anteriormente.
[00146] LC-MS: tR = 0,89 min; [M+H]+: 546,11.
[00147] Rotação óptica: alfa D (c = 10 mg/ml EtOH) = -21.5°.
[00148] 1H NMR (MeOD, 400 MHz) δ 7,39-7,37 (m, 2H), 7,30 (t, J = 6,4 Hz, 2H), 7,24-7,20 (m, 1H), 6,60 (s, 2 H), 6,43 (br d, J = 7,6 Hz, 1H), 3,91 (s, 6H), 3,27-3,23 (m, 1H), 3,18-3,15 (m, 1H), 2,87 (t, J = 7,6 Hz, 2H), 2,54 (sept, J = 7,0 Hz, 1H), 2,47-2,37 (m, 4H), 2,21 (s, 3H), 2,192,12 (m, 1H), 2,01-1,92 (m, 5H), 1,75-1,65 (m, 2H), 1,48-1,38 (m, 1H), 1,27-1,19 (m, 1H), 1,16 (d, J= 7,0 Hz, 6H). Testes Biológicos Ensaio de canal L IN VITRO
[00149] A atividade antagonista do cana L (valores IC50) dos Exemplos de Referência 1A, 2A, e 3A é determinada de acordo com o método experimental exposto em seguida.
[00150] Células de rim embrionárias (HEK293) expressoras do canal Cav1.2 humano adicionalmente às subunidades auxiliares β-2a e α2δ-1, são desenvolvidas em meio de cultura (DMEM que contém 10% de soro de bezerro fetal desativador a quente (FCS), 100 U/ml de penicilina, 100 μg/ml de estreptomicina, 100 μg/ml de G418, 40 μg/ml de zeocina e 100 μg/ml de higromicina). As células são semeadas numa quantidade de 20.000 células/cavidade em placas estéreis pretas de fundo transparente com 384 cavidades (revestidas de lisina poli-L, Becton Dickinson). As placas semeadas são incubadas durante a noite a 37°C em 5% CO2. A solução de KCI é preparada como solução estoque 80 mM em tampão de ensaio (HBSS que contém 0,1% BSA, 20 mM HEPES, 0,375 g/I NaHCO3, ajustado para pH 7,4 com NaOH) para o uso no ensaio sob uma concentração final de 20 mM. Antagonistas são preparados como soluções estoque de 10 mM em DMSO, então diluídos em placas de 384 cavidades, primeiro em DMSO, então em tampão de ensaio para obtenção de 3x estoques. No dia do ensaio, 25 μl de tampão de coloração (HBSS que contém 20 mM HEPES, 0,375 g/I NaHCO3, e 3 μM do indicador de cálcio fluorescente fluo-4 AM (1 mM de solução estoque em DMSO, que contém 10% Pluronic) é adicionado a cada cavidade da placa semeada. As placas de células de 384 cavidades são incubadas durante 60 min a 37°C em 5% CO2 seguidas por lavagem com 2 x 50 μl por cavidade utilizando-se tampão de ensaio deixando-se 50 μl/cavidade deste tampão para equilíbrio sob temperatura ambiente (30-60 min). Dentro da leitora Fluorescent Imaging Plate Reader (FLIPR, Molecular Devices), adicionam-se antagonistas à placa em um volume de 25 μl/cavidade, incubadas durante 3 min e finalmente adicionam-se 25 μl/cavidade de solução KCI para despolarização celular. A fluorescência para cada cavidade a intervalos de 2 segundos durante 8 minutos, e a área sob a curva de cada pico de fluorescência é comparada à área do pico de fluorescência induzido por 20 mM KCI com veículo em vez de antagonista. Para cada antagonista, determina-se o valor IC50 (a concentração (em nM) do COMPOSTO necessária para inibir 50% da resposta de fluorescência induzida por Ca2+) até 10 μm.
[00151] Mediram-se os valores IC50 dos compostos dos exemplos de referência 1A, 2A, e 3A e eles situam-se na faixa de 156 até 439 nM. Ensaio de canal T IN VITRO:
[00152] A atividade antagonista de canal T (valores IC50) dos Exemplo de Referências 1A, 2A, e 3A é determinada de acordo com o seguinte método experimental e os dados estão ilustrados na Tabela 1.
[00153] Células de rim embrionárias humano (HEK293) expressoras do canal Cav13.1, Cav3.2 ou Cav3.3, respectivamente, são desenvolvidas em meio de cultura (DMEM que contém 10% de soro de bezerro fetal desativado a quente (FCS), 100 U/ml de penicilina, 100 μg/ml de estreptomicina, e 1 mg/ml de G418). As células são semeadas numa quantidade de 20.000 células/cavidade em placas estéreis pretas de fundo transparente com 384 cavidades (revestidas de lisina poli-L, Becton Dickinson). As placas semeadas são incubadas durante a noite a 37°C em 5% CO2. A solução de Ca2+ é preparada como 100 mM de solução estoque em 100 mM de cloreto de tetraetilamônio (cloreto-TEA) 50 mM HEPES, 2,5 mM CaCl2, 5 mM KCl, 1 mM MgCl2, ajustado para pH 7,2 com TEA- hidróxido, para o uso no ensaio sob uma concentração final de 10 mM. Antagonistas são preparados como soluções estoque de 10 mM em DMSO, então diluídos em placas de 384 cavidades, primeiro em DMSO, então em 100 mM cloreto-TEA, 50 mM HEPES, 2,5 mM CaCl2, 5 mM de KCl, 1 mM de MgCl2, ajustado para pH 7,2 com hidróxido-TEA, para obtenção de 9x estoques. No dia do ensaio, 25 μl de tampão de coloração (HBSS que contém 20 mM HEPES, 0,375 g/l NaHCOs, e 3 μM do indicador de cálcio fluorescente fluo-4 AM (1 mM de solução estoque em DMSO, que contém 10% Pluronic) é adicionado a cada cavidade da placa semeada. As placas de células de 384 cavidades são incubadas durante 60 min a 37°C em 5% CO2 seguidas por lavagem com 2 x 50 μl por cavidade utilizando-se HBSS que contém 0,1% BSA, 20 mM HEPES, 0,375 g/l de NaHCO3, deixando-se 50 μl/cavidade deste tampão para equilíbrio sob temperatura ambiente (30-60 min). Dentro da leitora Fluorescent Imaging Plate Reader (FLIPR, Molecular Devices), adicionam-se antagonistas à placa em um volume de 25 μl/cavidade, incubadas durante 3 min e finalmente adicionam-se 6,25 μl/cavidade de solução de Ca2+. A fluorescência é medida para cada cavidade a intervalos de 2 segundos durante 8 minutos, e a área sob a curva de cada pico de fluorescência é comparada à área do pico de fluorescência induzido por 10 mM Ca2+ com veículo em vez de antagonista. Para cada antagonista, determina-se o valor IC50 (a concentração (em nM) do COMPOSTO necessária para inibir 50% da resposta de fluorescência induzida por Ca2+) até 10 μm. Tabela 1:
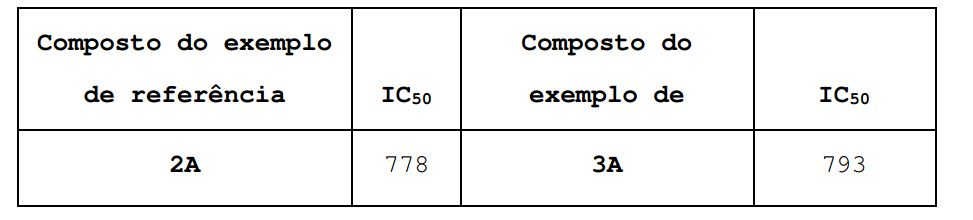
[00154] Os Exemplos de Referência 1A, 2A, e 3A foram testados quanto ao seu potencial para reduzir a pressão sanguínea e seu efeito na contratilidade do músculo do coração. Os valores de EC50 nos corações de camundongo isolados foram determinados de acordo com a Literatura (Doring HJ. The isolated perfused heart according to Langendorff técnica-- function--application, Physiol. Bohemoslov. 1990, 39(6), 481-504; Kligfield P, Horner H, Brachfeld N., A model de graded ischemia in the isolated perfused rat heart, J. Appl. Physiol. 1976 Jun, 40(6), 1004-8).
[00155] O composto do exemplo de referência 1A foi medido utilizando-se o procedimento descrito anteriormente para o experimento de Langendorff com um EC50 de 5 nM. II. Preparação de formas de sal do COMPOSTO II.a) Procedimento geral para a formação geral com COMPOSTO:
[00156] Dissolveu-se 1 eq. do COMPOSTO em SOLVENT1. A solução foi levada a 50°C. Adicionaram-se 2 Equivalentes de ácido dissolvidos em SOLVENT2. A mistura foi submetida a agitação sob 50°C durante 5 min e desligou-se a fonte de aquecimento. Deixou-se a mistura esfriar para a rt dentro 1 hora. Quando se observou um precipitado a mistura foi filtrada e o sólido foi isolado. No caso em que não se obteve sólido a mistura foi evaporada para secagem e adicionaram-se 6 volumes de heptano. A mistura foi aquecida para refluxo, adicionaram-se 3 volumes de EtOAc até ficar todo dissolvido. No caso em que a dissolução não foi concluída adicionaram-se mais 3 volumes de EtOAc. Se a dissolução ainda não foi concluída, adicionou-se o mínimo possível de MeOH até ser concluída a dissolução. Deixou-se a mistura esfriar lentamente para a rt. Sob a temperatura ambiente o vaso foi raspado com uma espátula e foi ainda resfriador para 0°C. A mistura foi filtrada e a solução foi evaporada para secagem no rota vapor.
[00157] Da maneira que é utilizado neste contexto, o termo “volumes" significa 1L para 1kg de material sólido.
[00158] SOLVENT1 = 8 volumes EtOAc para: ácido benzenossulfônico, ácido benzóico, ácido salicílico, sacarina, ácido para- toluenossulfônico, ácido malônico, ácido metanossulfônico, ácido naftaleno- 2-sulfônico, ácido naftaleno-1,5-dissulfônico, ácido etanossulfônico, ácido málico, ácido glicólico, ácido cetoglutárico, e ácido fumárico;
[00159] SOLVENT1 = 1.8 volumes EtOAc para: ácido bromídrico, e ácido clorídrico;
[00160] SOLVENT1 = 8 volumes acetona para: ácido sulfúrico, e ácido fosfórico;
[00161] SOLVENT1 = 7 volumes acetona para: ácido cítrico, ácido succínico, e ácido tartárico.
[00162] SOLVENT2 = 7 volumes EtOAc para: ácido cítrico;
[00163] SOLVENT2 = 3 volumes EtOAc para: ácido benzenossulfônico, ácido benzóico, ácido metanossulfônico, ácido salicílico, e sarina (parcialmente solúvel);
[00164] SOLVENT2 = 3 volumes Me0H para: ácido para- toluenossulfônico, ácido malônico, ácido naftaleno-2-sulfônico, ácido naftaleno-1,5-dissulfônico, ácido málico, ácido glicólico, ácido cetoglutárico, e ácido fumárico;
[00165] SOLVENT2 = 15 volumes acetona para: ácido succínico;
[00166] SOLVENT2 = 12 volumes EtOH para: ácido tartárico;
[00167] SOLVENT2 = água para: ácido bromídrico, ácido clorídrico, ácido sulfúrico, e ácido fosfórico.
[00168] Os resultados obtidos utilizando-se o procedimento geral descrito anteriormente encontram-se sumariados nas Tabelas 1 e 2. No caso em que se usaram procedimentos particulares para preparar formas de sal cristalino do COMPOSTO, esses procedimentos estão descritos no Exemplo de Referência S1 e nos Exemplos S2 até S7 adiante. Tabela 1: Dados de Caracterização para as formas de sal cristalino do COMPOSTO obtidas de acordo com o procedimento geral.
Tabela 2: Dados de Caracterização para outras formas de sal do COMPOSTO adquiridas de acordo com o procedimento geral.
Exemplo de referência S1: Preparação e caracterização do sal de ácido di-clorídrico do COMPOSTO
[00169] Adicionaram-se 7,598 ml aq. HCI (0,1N) a 200,7 mg de COMPOSTO resultando em uma suspensão branca. Adicionaram-se 5 ml de 2-PrOH e solução clara obtida foi evaporada para secagem sob nitrogênio. Adicionaram-se 4 ml de TBME ao resíduo e a suspensão foi submetida a agitação com um ciclo de temperatura (T1 = 20°C, T2 = 25°C, tempo de retenção 1 h, respectivamente; taxa de aquecimento e refrigeração 5°C/h, 500 rpm). Depois de 18 repetições a suspensão foi filtrada e o sólido foi submetido a secagem in vacuum para proporcionar 265 mg do sal de ácido di- clorídrico do COMPOSTO. Tabela Sl: Dados de caracterização para o sal de ácido di- clorídrico do COMPOSTO
Exemplo S2: Preparação e caracterização do sal de ácido di- metanossulfônico do COMPOSTO
[00170] Adicionou-se 0,0476 ml de ácido metanossulfônico a uma solução límpida de 199,7 mg do COMPOSTO dissolvido em 7 ml de EtOAc. A solução límpida foi evaporada para secagem sob nitrogênio e o resíduo obtido foi colocado em suspensão e submetido a agitação em 4 ml de uma mistura de EtOAc/heptano (1:3) com um ciclo de temperatura (T1 = 20°C, T2 = 25°C, tempo de conservação 1 h, respectivamente; taxa de aquecimento e refrigeração 5°C/h, 500 rpm). Depois de 18 repetições a suspensão foi filtrada e o sólido foi submetido a secagem in vacuum. O sólido obtido foi colocado em suspenso e submetido a agitação em 1 ml de TBME (ciclo de temperatura: T1 = 20°C, T2 = 25°C, tempo de conservação 1 h, respectivamente; taxa de aquecimento e refrigeração 5°C/h, 500 rpm). Depois de 18 repetições a suspensão foi filtrada e o sólido foi submetido a secagem in vacuum para proporcionar o sal de ácido di-metanossulfônico do COMPOSTO. Tabela S2: Dados de caracterização para o sal de ácido di- metanossulfônico do COMPOSTO
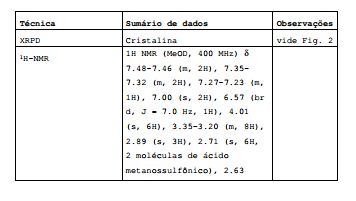

Exemplo S3: Preparação e caracterização do sal de ácido di-para- toluenossulfônico do COMPOSTO
[00171] Dissolveram-se 199,7 mg do COMPOSTO em 7 ml de EtOAc. Adicionaram-se 139,2 mg de ácido para-toluenossulfônico dissolvido em 10 ml de EtOAc. A solução límpida foi evaporada para secagem sob nitrogênio e o resíduo foi colocado em suspensão em 4 ml de uma mistura de EtOAc/Hept (1:3), e submetida a agitação com um ciclo de temperatura (ciclo de temperatura: T1 = 20°C, T2 = 25°C, tempo de conservação 1 h, respectivamente; taxa de aquecimento e refrigeração 5°C/h, 500 rpm). Depois de 18 ciclos o solvente foi evaporado sob vácuo e o resíduo sólido foi colocado em suspensão em 2 ml de EtOAc. Depois de breve sonicação (3 min) a suspensão foi submetida a agitação com um ciclo de temperatura (ciclo de temperatura: T1 = 20°C, T2 = 25°C, tempo de conservação 1 h, respectivamente; taxa de aquecimento e refrigeração 5°C/h, 500 rpm). Depois de 18 repetições a suspensão foi filtrada e o sólido foi submetido a secagem in vacuum para proporcionar 173,8 mg do sal de ácido di-para- toluenossulfônico do COMPOSTO. Tabela S3: Dados de caracterização para o sal de ácido di-para- toluenossulfônico do COMPOSTO.
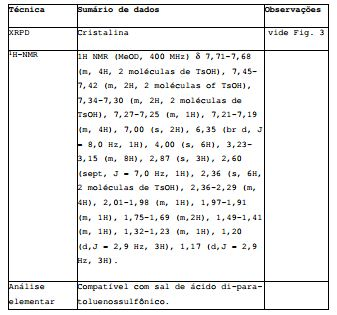
Exemplo S4: Preparação e caracterização do sal de ácido sulfúrico do COMPOSTO
[00172] Adicionou-se 0,733 ml de ácido sulfúrico aquoso (0,5M) a uma solução de 200,2 mg do COMPOSTO em 10 ml de MEK resultando em uma solução límpida. Depois de 2 dias a suspensão obtida foi filtrada e o sólido foi submetido a secagem in vacuum durante 1h proporcionando o sal de mono-ácido sulfúrico do COMPOSTO que continha cerca de 6 equivalentes de água. Tabela S4: Dados de caracterização para o sal de di-ácido sulfúrico do COMPOSTO
Exemplo S5: Preparação e caracterização do sal de di-ácido maléico do COMPOSTO
[00173] Adicionou-se ácido maléico (256 g, 2,2 mol, 2,1 eq), dissolvido em Me0H (630 ml, 1,1 volumes) a uma solução submetida a refluxo do COMPOSTO (682 g, 84% p/p (ensaio NMR), 1,05 mol) em EtOAc (6,3 L, 11 volumes). A mistura resultante foi submetida a agitação sob refluxo durante 15 minutos e foi então refrigerada para 65-68°C dentro de 30 minutos e semeada com 0,04% p/p de cristais de semeadura de sal de di- ácido maléico do COMPOSTO (os cristais de semeadura foram obtidos depois de cristalização cuidadosa utilizando-se o mesmo protocolo). A mistura foi então refrigerada de 65-68°C para 40°C dentro de 3 h. A suspensão obtida foi então refrigerada para 20°C durante 1 h, filtrada sob 0,2 bar de nitrogênio e enxaguada com EtOAc (1500 ml, 2,6 volumes). O sólido branco obtido foi então submetido a secagem sob 1 atmosfera de nitrogênio durante 24 horas para proporcionar 715 g (88%) do sal de di-ácido maléico do COMPOSTO. Tabela S5: Dados de caracterização para o sal de di-ácido maléico do COMPOSTO

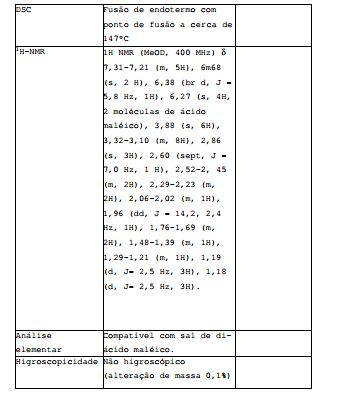
Exemplo S6: Preparação do sal sesqui-fumarato do COMPOSTO
[00174] Dissolveram-se 199,5 mg do COMPOSTO em 5 ml EtOAc. Adicionou-se lentamente uma solução límpida de 85,4 mg de ácido fumárico em 5 ml de THF. A solução límpida obtida foi concentrada para 3 ml de solução sob nitrogênio resultando em precipitação. A mistura foi filtrada e o sólido foi submetido a secagem in vacuum. O sólido obtido era o sal sesqui- ácido fumárico do COMPOSTO. Tabela S6: Dados de caracterização para o sal sesqui-ácido fumárico do COMPOSTO
Exemplo S7: Preparação do sal di-ácido bromídrico do COMPOSTO
[00175] Adicionou-se lentamente 0,3665 ml de ácido bromídrico aquoso 2 molar a uma solução de 199,8 mg do COMPOSTO em 0,4 ml de THF e a suspensão obtida foi aquecida (pistola térmica). A solução límpida foi refrigerada para a temperatura ambiente resultando em uma precipitação. Adicionou-se 3 ml de THF, a suspensão foi submetida a agitação, filtrada e o sólido foi submetido a secagem in vacuum (1h, 3 mbar). O sólido obtido era o sal de di-ácido bromídrico do COMPOSTO que continha cerca de 3 equivalentes de água. Tabela S7: Dados de caracterização para o sal di-ácido bromídrico do COMPOSTO




















