BR112018008359B1 - Sistema adaptado para tratamento térmico de tecidos biológicos - Google Patents
Sistema adaptado para tratamento térmico de tecidos biológicos Download PDFInfo
- Publication number
- BR112018008359B1 BR112018008359B1 BR112018008359-3A BR112018008359A BR112018008359B1 BR 112018008359 B1 BR112018008359 B1 BR 112018008359B1 BR 112018008359 A BR112018008359 A BR 112018008359A BR 112018008359 B1 BR112018008359 B1 BR 112018008359B1
- Authority
- BR
- Brazil
- Prior art keywords
- approximately
- tissue
- pulsed
- target tissue
- energy source
- Prior art date
Links
- 238000010438 heat treatment Methods 0.000 title description 15
- 108010004889 Heat-Shock Proteins Proteins 0.000 claims abstract description 76
- 102000002812 Heat-Shock Proteins Human genes 0.000 claims abstract description 76
- 230000004913 activation Effects 0.000 claims abstract description 36
- 230000006378 damage Effects 0.000 claims abstract description 22
- 238000007669 thermal treatment Methods 0.000 claims abstract description 4
- 238000002604 ultrasonography Methods 0.000 claims description 64
- 230000036770 blood supply Effects 0.000 claims description 3
- 238000000034 method Methods 0.000 abstract description 22
- 230000001225 therapeutic effect Effects 0.000 abstract description 14
- 230000004044 response Effects 0.000 abstract description 6
- 230000035939 shock Effects 0.000 abstract description 5
- 230000002035 prolonged effect Effects 0.000 abstract description 3
- 210000001519 tissue Anatomy 0.000 description 174
- 238000011282 treatment Methods 0.000 description 50
- 230000003287 optical effect Effects 0.000 description 25
- 210000004027 cell Anatomy 0.000 description 24
- 238000010521 absorption reaction Methods 0.000 description 22
- 230000005855 radiation Effects 0.000 description 19
- 230000008901 benefit Effects 0.000 description 17
- 230000000694 effects Effects 0.000 description 15
- 230000005670 electromagnetic radiation Effects 0.000 description 14
- 238000004519 manufacturing process Methods 0.000 description 14
- 230000002207 retinal effect Effects 0.000 description 14
- 230000005451 protein repair Effects 0.000 description 13
- 102000004169 proteins and genes Human genes 0.000 description 13
- 108090000623 proteins and genes Proteins 0.000 description 13
- 238000009792 diffusion process Methods 0.000 description 11
- 210000000624 ear auricle Anatomy 0.000 description 11
- 230000008439 repair process Effects 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- 230000006870 function Effects 0.000 description 9
- 239000002775 capsule Substances 0.000 description 8
- 230000035515 penetration Effects 0.000 description 8
- 230000000638 stimulation Effects 0.000 description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 239000000835 fiber Substances 0.000 description 7
- 230000007774 longterm Effects 0.000 description 7
- 230000001413 cellular effect Effects 0.000 description 6
- 230000007423 decrease Effects 0.000 description 6
- 239000013307 optical fiber Substances 0.000 description 6
- 206010061218 Inflammation Diseases 0.000 description 5
- 230000002159 abnormal effect Effects 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 201000010099 disease Diseases 0.000 description 5
- 210000001035 gastrointestinal tract Anatomy 0.000 description 5
- 230000004054 inflammatory process Effects 0.000 description 5
- 239000006187 pill Substances 0.000 description 5
- 210000001525 retina Anatomy 0.000 description 5
- 210000003583 retinal pigment epithelium Anatomy 0.000 description 5
- 210000002784 stomach Anatomy 0.000 description 5
- 230000000451 tissue damage Effects 0.000 description 5
- 231100000827 tissue damage Toxicity 0.000 description 5
- 108090000695 Cytokines Proteins 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 206010012689 Diabetic retinopathy Diseases 0.000 description 4
- 230000005856 abnormality Effects 0.000 description 4
- 239000002671 adjuvant Substances 0.000 description 4
- 206010064930 age-related macular degeneration Diseases 0.000 description 4
- 208000015181 infectious disease Diseases 0.000 description 4
- 208000002780 macular degeneration Diseases 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- 210000003928 nasal cavity Anatomy 0.000 description 4
- 210000000664 rectum Anatomy 0.000 description 4
- 101100507655 Canis lupus familiaris HSPA1 gene Proteins 0.000 description 3
- 208000003569 Central serous chorioretinopathy Diseases 0.000 description 3
- 206010009944 Colon cancer Diseases 0.000 description 3
- 206010012688 Diabetic retinal oedema Diseases 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 206010028980 Neoplasm Diseases 0.000 description 3
- 230000003915 cell function Effects 0.000 description 3
- 201000011190 diabetic macular edema Diseases 0.000 description 3
- 239000004744 fabric Substances 0.000 description 3
- 230000035876 healing Effects 0.000 description 3
- 208000014951 hematologic disease Diseases 0.000 description 3
- 238000003384 imaging method Methods 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 238000013532 laser treatment Methods 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 201000007914 proliferative diabetic retinopathy Diseases 0.000 description 3
- 230000000241 respiratory effect Effects 0.000 description 3
- 210000003437 trachea Anatomy 0.000 description 3
- 230000004304 visual acuity Effects 0.000 description 3
- 208000019838 Blood disease Diseases 0.000 description 2
- 206010021143 Hypoxia Diseases 0.000 description 2
- XUMBMVFBXHLACL-UHFFFAOYSA-N Melanin Chemical compound O=C1C(=O)C(C2=CNC3=C(C(C(=O)C4=C32)=O)C)=C2C4=CNC2=C1C XUMBMVFBXHLACL-UHFFFAOYSA-N 0.000 description 2
- 206010049816 Muscle tightness Diseases 0.000 description 2
- 208000017442 Retinal disease Diseases 0.000 description 2
- 206010038923 Retinopathy Diseases 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 230000001363 autoimmune Effects 0.000 description 2
- 210000000746 body region Anatomy 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 210000000621 bronchi Anatomy 0.000 description 2
- 230000005779 cell damage Effects 0.000 description 2
- 208000037887 cell injury Diseases 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 210000001072 colon Anatomy 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 238000002052 colonoscopy Methods 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 230000008021 deposition Effects 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 230000005684 electric field Effects 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- 208000018706 hematopoietic system disease Diseases 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 210000002429 large intestine Anatomy 0.000 description 2
- 231100000518 lethal Toxicity 0.000 description 2
- 230000001665 lethal effect Effects 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 230000003818 metabolic dysfunction Effects 0.000 description 2
- 210000003097 mucus Anatomy 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 210000001989 nasopharynx Anatomy 0.000 description 2
- 231100001160 nonlethal Toxicity 0.000 description 2
- 230000000737 periodic effect Effects 0.000 description 2
- 230000000649 photocoagulation Effects 0.000 description 2
- 239000000049 pigment Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 210000001533 respiratory mucosa Anatomy 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 210000000813 small intestine Anatomy 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 230000035882 stress Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 102100038222 60 kDa heat shock protein, mitochondrial Human genes 0.000 description 1
- 101710154868 60 kDa heat shock protein, mitochondrial Proteins 0.000 description 1
- 108091006112 ATPases Proteins 0.000 description 1
- 102000057290 Adenosine Triphosphatases Human genes 0.000 description 1
- 206010002660 Anoxia Diseases 0.000 description 1
- 241000976983 Anoxia Species 0.000 description 1
- 206010071155 Autoimmune arthritis Diseases 0.000 description 1
- 101100339887 Drosophila melanogaster Hsp27 gene Proteins 0.000 description 1
- 206010052804 Drug tolerance Diseases 0.000 description 1
- 102000003676 Glucocorticoid Receptors Human genes 0.000 description 1
- 108090000079 Glucocorticoid Receptors Proteins 0.000 description 1
- 102000018932 HSP70 Heat-Shock Proteins Human genes 0.000 description 1
- 108010027992 HSP70 Heat-Shock Proteins Proteins 0.000 description 1
- 101150096895 HSPB1 gene Proteins 0.000 description 1
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 1
- 101001016865 Homo sapiens Heat shock protein HSP 90-alpha Proteins 0.000 description 1
- 241000712431 Influenza A virus Species 0.000 description 1
- 208000001344 Macular Edema Diseases 0.000 description 1
- 206010025415 Macular oedema Diseases 0.000 description 1
- 206010064912 Malignant transformation Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 102000005431 Molecular Chaperones Human genes 0.000 description 1
- 108010006519 Molecular Chaperones Proteins 0.000 description 1
- 208000000112 Myalgia Diseases 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 206010057430 Retinal injury Diseases 0.000 description 1
- 208000007014 Retinitis pigmentosa Diseases 0.000 description 1
- 102000004389 Ribonucleoproteins Human genes 0.000 description 1
- 108010081734 Ribonucleoproteins Proteins 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000003444 anaesthetic effect Effects 0.000 description 1
- 230000007953 anoxia Effects 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000009830 antibody antigen interaction Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 210000000436 anus Anatomy 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 208000011775 arteriosclerosis disease Diseases 0.000 description 1
- 230000003190 augmentative effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000007960 cellular response to stress Effects 0.000 description 1
- 230000004637 cellular stress Effects 0.000 description 1
- 201000005667 central retinal vein occlusion Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 230000007012 clinical effect Effects 0.000 description 1
- 230000003750 conditioning effect Effects 0.000 description 1
- 201000008615 cone dystrophy Diseases 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 239000002619 cytotoxin Substances 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000035622 drinking Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000006353 environmental stress Effects 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000002839 fiber optic waveguide Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 125000001475 halogen functional group Chemical group 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 235000003642 hunger Nutrition 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000000266 injurious effect Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 230000031700 light absorption Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000005923 long-lasting effect Effects 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000010230 macular retinal edema Diseases 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000036212 malign transformation Effects 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 208000013465 muscle pain Diseases 0.000 description 1
- 231100001049 no known adverse-effect Toxicity 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 239000012466 permeate Substances 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000003504 photosensitizing agent Substances 0.000 description 1
- 238000010248 power generation Methods 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 230000004845 protein aggregation Effects 0.000 description 1
- 230000006432 protein unfolding Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000008263 repair mechanism Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 208000004644 retinal vein occlusion Diseases 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 230000037351 starvation Effects 0.000 description 1
- 238000004381 surface treatment Methods 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 238000009210 therapy by ultrasound Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 230000029812 viral genome replication Effects 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 230000036642 wellbeing Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N7/00—Ultrasound therapy
- A61N7/02—Localised ultrasound hyperthermia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/40—Applying electric fields by inductive or capacitive coupling ; Applying radio-frequency signals
- A61N1/403—Applying electric fields by inductive or capacitive coupling ; Applying radio-frequency signals for thermotherapy, e.g. hyperthermia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/02—Radiation therapy using microwaves
- A61N5/022—Apparatus adapted for a specific treatment
- A61N5/025—Warming the body, e.g. hyperthermia treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/02—Radiation therapy using microwaves
- A61N5/04—Radiators for near-field treatment
- A61N5/045—Radiators for near-field treatment specially adapted for treatment inside the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N5/0601—Apparatus for use inside the body
- A61N5/0603—Apparatus for use inside the body for treatment of body cavities
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N5/0613—Apparatus adapted for a specific treatment
- A61N5/0625—Warming the body, e.g. hyperthermia treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N5/067—Radiation therapy using light using laser light
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N7/00—Ultrasound therapy
- A61N7/02—Localised ultrasound hyperthermia
- A61N7/022—Localised ultrasound hyperthermia intracavitary
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N5/0601—Apparatus for use inside the body
- A61N5/0603—Apparatus for use inside the body for treatment of body cavities
- A61N2005/0604—Lungs and/or airways
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N5/0601—Apparatus for use inside the body
- A61N5/0603—Apparatus for use inside the body for treatment of body cavities
- A61N2005/0608—Rectum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N5/0601—Apparatus for use inside the body
- A61N5/0603—Apparatus for use inside the body for treatment of body cavities
- A61N2005/0609—Stomach and/or esophagus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N2005/063—Radiation therapy using light comprising light transmitting means, e.g. optical fibres
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N2005/0635—Radiation therapy using light characterised by the body area to be irradiated
- A61N2005/0643—Applicators, probes irradiating specific body areas in close proximity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/06—Radiation therapy using light
- A61N2005/0658—Radiation therapy using light characterised by the wavelength of light used
- A61N2005/0659—Radiation therapy using light characterised by the wavelength of light used infrared
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N7/00—Ultrasound therapy
- A61N2007/0073—Ultrasound therapy using multiple frequencies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N7/00—Ultrasound therapy
- A61N2007/0082—Scanning transducers
Abstract
MÉTODO PARA O TRATAMENTO TÉRMICO DE TECIDOS BIOLÓGICOS. Um método para o tratamento térmico de tecidos biológicos inclui o fornecimento de uma fonte de energia pulsada com parâmetros energéticos selecionados de modo a elevar a temperatura alvo a um nível para alcançar um efeito terapêutico, enquanto a elevação média de temperatura do tecido durante um período de tempo prolongado é mantido em ou abaixo de um nível predeterminado, de modo a não danificar permanentemente o tecido alvo. A aplicação da fonte de energia pulsada ao tecido alvo induz uma resposta ao choque térmico e estimula a ativação da proteína de choque térmico no tecido alvo, de modo a tratar terapeuticamente o tecido alvo.
Description
[0001] A presente invenção é geralmente direcionada a um sistema adaptado para realizar um método para o tratamento térmico de tecidos biológicos. Mais particularmente, a presente invenção se refere a um sistema adaptado para realizar método para aplicar uma fonte de energia pulsada a tecido biológico para estimular a ativação de proteínas de choque térmico e facilitar a reparação de proteínas sem danificar o tecido.
[0002] Os inventores verificaram que há um efeito terapêutico no tecido biológico e, particularmente, tecido biológico danificado ou danificado, elevando-se controladamente a temperatura do tecido até uma faixa de temperatura predeterminada, mantendo a elevação média de temperatura do tecido durante vários minutos em ou abaixo de um nível predeterminado, de modo a não danificar permanentemente o tecido alvo. Acredita-se que a elevação da temperatura do tecido de maneira tão controlada estimula seletivamente a ativação da proteína de choque térmico e/ou a produção e a facilitação do reparo proteico, que serve como um mecanismo para tratar terapeuticamente o tecido.
[0003] As proteínas de choque térmico (HSPs) são uma família de proteínas que são produzidas pelas células em resposta à exposição a condições estressantes. A produção de altos níveis de proteínas de choque térmico pode ser desencadeada pela exposição a diferentes tipos de condições de estresse ambiental, como infecção, inflamação, exercício, exposição da célula a toxinas, inanição, hipóxia ou privação de água.
[0004] Sabe-se que as proteínas de choque térmico desempenham um papel na resposta a um grande número de condições anormais nos tecidos do corpo, incluindo infecção viral, inflamação, transformações malignas, exposição a agentes oxidantes, citotoxinas e anoxia. Várias proteínas de choque térmico funcionam como chaperonas intracelulares para outras proteínas e membros da família HSP são expressos ou ativados em níveis baixos a moderados devido ao seu papel essencial na manutenção da proteína e simplesmente monitorando as proteínas da célula mesmo sob condições não estressantes. Essas atividades fazem parte do sistema de reparo da própria célula, chamado de resposta ao estresse celular ou resposta ao choque térmico.
[0005] As proteínas de choque térmico são tipicamente nomeadas de acordo com seu peso molecular. Por exemplo, Hsp60, Hsp70 e Hsp80 se referem às famílias de proteínas de choque térmico na ordem de 60, 70 e 80 quilodaltons de tamanho, respectivamente. Eles agem de várias maneiras diferentes. Por exemplo, a Hsp70 tem domínios de ligação a peptídeos e ATPase que estabilizam estruturas de proteínas em estados desdobrados e competentes em termos de montagem. As Hsp60s mitocondriais formam estruturas em formato de anel facilitando a montagem de proteínas em estados nativos. A Hsp90 desempenha um papel regulador do supressor associando-se à tirosina quinases celulares, fatores de transcrição e receptores de glucocorticoides. Hsp27 suprime a agregação de proteínas.
[0006] As proteínas de choque térmico Hsp70 são um membro das proteínas de choque térmico ligadas à membrana e extracelulares que estão envolvidas na ligação de antígenos e na sua apresentação ao sistema imunológico. Descobriu-se que a Hsp70 inibe a atividade da ribonucleoproteína do vírus influenza A e bloqueia a replicação do vírus. As proteínas de choque térmico derivadas de tumores provocam imunidade protetora específica. Observações experimentais e clínicas mostraram que as proteínas de choque térmico estão envolvidas na regulação da artrite autoimune, diabetes mellitus tipo 1, esclerose arterial, esclerose múltipla e outras reações autoimunes.
[0007] Portanto, acredita-se que é vantajoso poder elevar de modo seletivo e controlado a temperatura do tecido alvo até uma faixa de temperatura predeterminada durante um curto período de tempo, mantendo ao mesmo tempo a elevação média de temperatura do tecido a uma temperatura predeterminada por um longo período de tempo. Acredita-se que isto induz a resposta ao choque térmico a fim de aumentar o número ou a atividade de proteínas de choque térmico no tecido do corpo em resposta a infecções ou outras anormalidades. No entanto, isso deve ser feito de maneira controlada, a fim de não danificar ou destruir o tecido ou a área do corpo a ser tratado. A presente invenção atende a essas necessidades e fornece outras vantagens relacionada.
[0008] Por exemplo, o documento WO 2009/088550 A2 refere-se a sistemas e métodos para tratamentos médicos a laser e, mais especificamente, ao condicionamento pré-traumático e pós- traumático in vivo de tecido animal (como tecido humano) usando luz laser para modulação e intensificação da cura.
[0009] O documento Norte Americano US 2014/074191 A1 descreve dispositivos, sistemas e métodos para tratar imperfeições dermatológicas e, mais especificamente, para dispositivos médicos dermatológicos, sistemas e métodos para realizar estimulação de choque térmico não causador de lesões em tecido humano ou animal.
[00010] A presente invenção é direcionada a um método para o tratamento térmico de tecidos biológicos através da aplicação de uma fonte de energia pulsada ao tecido alvo para tratar terapeuticamente o tecido alvo. A fonte de energia pulsada tem parâmetros de energia, incluindo comprimento de onda ou frequência, ciclo de trabalho e duração de trem de pulso. Os parâmetros de energia são selecionados de modo a elevar uma temperatura de tecido alvo a 11°C para alcançar um efeito terapêutico, em que a elevação média de temperatura do tecido ao longo de vários minutos é mantida em ou abaixo de um nível predeterminado de modo a não danificar permanentemente o tecido alvo.
[00011] Os parâmetros de fonte de energia podem ser selecionados de modo que a temperatura do tecido alvo seja elevada entre aproximadamente 6°C a 11°C, pelo menos durante a aplicação da fonte de energia pulsada ao tecido alvo. A elevação média de temperatura do tecido alvo ao longo de vários minutos é mantida a 6°C ou menos, tal como a aproximadamente 1°C ou menos ao longo de vários minutos.
[00012] Os parâmetros de energia da fonte de energia pulsada são selecionados de modo que aproximadamente 20 a 40 joules de energia são absorvidos por cada centímetro cúbico do tecido alvo. A aplicação da fonte de energia pulsada ao tecido alvo induz uma resposta ao choque térmico e estimula a ativação da proteína de choque térmico no tecido alvo sem danificar o tecido alvo.
[00013] Um dispositivo pode ser inserido em uma cavidade do corpo para aplicar a energia pulsada ao tecido. A energia pulsada pode ser aplicada a uma área externa de um corpo que é adjacente ao tecido alvo, ou tem um suprimento de sangue próximo a uma superfície da área externa do corpo.
[00014] A fonte de energia pulsada pode compreender uma radiofrequência. A radiofrequência pode estar entre aproximadamente 3 a 6 megahertz (MHz). Pode ter um ciclo de trabalho entre aproximadamente 2,5% a 5%. Pode ter uma duração de trem pulsado entre aproximadamente 0,2 a 0,4 segundo. A radiofrequência pode ser gerada com um dispositivo que tem um raio de bobina entre aproximadamente 2 e 6 mm e aproximadamente 13 e 57 espiras de ampères.
[00015] A fonte de energia pulsada pode compreender uma frequência de micro-ondas entre 10 a 20 gigahertz (GHz). O microondas pode ter uma duração de trem de pulso de aproximadamente entre 0,2 e 0,6 segundo. O micro-ondas pode ter um ciclo de trabalho entre aproximadamente 2% e 5%. O micro-ondas pode ter uma potência média entre aproximadamente 8 e 52 watts.
[00016] A fonte de energia pulsada pode compreender um feixe de luz pulsada, tal como uma luz de laser. O feixe de luz pode ter um comprimento de onda entre aproximadamente 530 nm e 1300 nm, e com mais preferência, entre 800 nm e 1.000 nm. O feixe de luz pulsada pode ter uma potência entre aproximadamente 0,5 e 74 watts. O feixe de luz pulsada tem um ciclo de trabalho menor que 10% e, de preferência, entre 2,5% e 5%. O feixe de luz pulsada pode ter uma duração de trem de pulso de aproximadamente 0,1 e 0,6 segundo.
[00017] A fonte de energia pulsada pode compreender um ultrassom pulsado. O ultrassom tem uma frequência entre aproximadamente 1 e 5 MHz. O ultrassom tem uma duração de trem de aproximadamente 0,1 e 0,5 segundos. O ultrassom pode ter um ciclo de trabalho entre aproximadamente 2% e 10%. O ultrassom tem uma potência entre aproximadamente 0,46 e 28,6 watts.
[00018] Outras características e vantagens da presente invenção se tornarão evidentes a partir da seguinte descrição mais detalhada, tomada em conjunto com os desenhos anexos, que ilustram, a título de exemplo, os princípios da invenção.
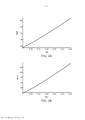
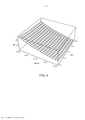
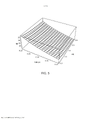
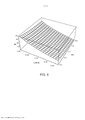
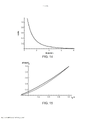
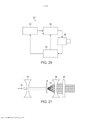
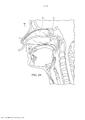
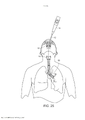
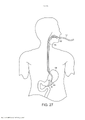
[00019] Os desenhos anexos ilustram a invenção. Em tais desenhos: As FIGURAS 1A e 1B são gráficos que ilustram a potência média de uma fonte de laser em comparação com o raio de uma fonte e a duração de trem de pulso do laser; As FIGURAS 2A e 2B são gráficos que ilustram o tempo para a temperatura decair, dependendo do raio da fonte de laser e do comprimento de onda; As FIGURAS 3-6 são gráficos que ilustram as espiras de pico de ampère para várias radiofrequências, ciclos de trabalho e raios de bobina; A FIGURA 7 é um gráfico que representa o tempo de elevação da temperatura para o decaimento em comparação com o raio da bobina de radiofrequência; As FIGURAS 8 e 9 são gráficos que representam a potência média de micro-ondas em comparação com a frequência de micro-ondas e durações de trem de pulso; A FIGURA 10 é um gráfico que representa o tempo para a temperatura decair para várias frequências de micro-ondas; A FIGURA 11 é um gráfico que representa a potência média da fonte de ultrassons em comparação com a frequência e a duração de trem de pulso; As FIGURAS 12 e 13 são gráficos que representam o tempo para o decaimento da temperatura para várias frequências de ultrassons; A FIGURA 14 é um gráfico que representa o volume da região aquecida focal em comparação com a frequência de ultrassons; A FIGURA 15 é um gráfico que compara equações de temperatura sobre durações de pulso para uma fonte de energia de ultrassom; As FIGURAS 16 e 17 são gráficos que ilustram a magnitude do logaritmo do dano e as integrais de Arrhenius de ativação de HSP em função da temperatura e da duração do pulso; A FIGURA 18 é uma vista esquemática de uma unidade geradora de luz que produz séries temporizadas de pulsos, tendo um tubo de luz a partir da mesma, de acordo com a presente invenção; A FIGURA 19 é uma vista em seção transversal de um dispositivo de fornecimento de fotoestimulação que fornece energia eletromagnética para o tecido alvo, de acordo com a presente invenção; A FIGURA 20 é uma vista esquemática que ilustra um sistema usado para gerar um feixe de luz de laser, de acordo com a presente invenção; A FIGURA 21 é uma vista esquemática dos elementos ópticos usados para gerar um padrão geométrico de luz de laser, de acordo com a presente invenção; A FIGURA 22 é uma vista esquemática que ilustra uma modalidade alternativa do sistema usado para gerar feixes de luz de laser para tratar tecido, de acordo com a presente invenção; A FIGURA 23 é uma vista esquemática que ilustra ainda outra modalidade de um sistema usado para gerar feixes de luz de laser para tratar tecido de acordo com a presente invenção; A FIGURA 24 é uma vista em seção transversal e esquemática de uma extremidade de um endoscópio inserido na cavidade nasal e tratamento do tecido na mesma, de acordo com a presente invenção; A FIGURA 25 é uma vista esquemática e parcialmente seccionada de um broncoscópio que se estende através da traqueia e para dentro dos brônquios de um pulmão e fornece tratamento ao mesmo, de acordo com a presente invenção; A FIGURA 26 é uma vista esquemática de um colonoscópio que fornece fotoestimulação a uma área intestinal ou do cólon do corpo, de acordo com a presente invenção; A FIGURA 27 é uma vista esquemática de um endoscópio inserido em um estômago e fornecendo tratamento ao mesmo, de acordo com a presente invenção; A FIGURA 28 é uma vista em perspectiva parcialmente seccionada de um endoscópio de cápsula, usado de acordo com a presente invenção; A FIGURA 29 é uma vista esquemática de um ultrassom focalizado de alta intensidade pulsado para tratar o tecido interno do corpo, de acordo com a presente invenção; A FIGURA 30 é uma vista esquemática para fornecimento de terapia à corrente sanguínea de um paciente, através de um lóbulo de orelha, de acordo com a presente invenção; A FIGURA 31 é uma vista em seção transversal de um dispositivo de terapia de estimulação da presente invenção usado no fornecimento de fotoestimulação ao sangue, através de um lóbulo de orelha, de acordo com a presente invenção.
[00020] Como mostrado nos desenhos anexos, e como descrito aqui mais completamente, a presente invenção é direcionada a um sistema e método para fornecer uma fonte de energia pulsada, tal como laser, ultrassons, radiofrequência ultravioleta, radiofrequência de micro-ondas e semelhantes, tendo parâmetros de energia selecionados para causarem um curso térmico no tecido para elevar a temperatura do tecido durante um curto período de tempo a um nível suficiente para alcançar um efeito terapêutico, mantendo uma temperatura média do tecido durante um período prolongado de tempo abaixo de um nível predeterminado, de modo a evitar o dano permanente do tecido. Acredita-se que a criação do curso de tempo térmico estimula a ativação ou produção de proteína de choque térmico e facilita o reparo da proteína sem causar nenhum dano.
[00021] Os inventores da presente invenção verificaram que a radiação eletromagnética, na forma de vários comprimentos de onda de luz de laser, pode ser aplicada ao tecido da retina de uma maneira que não destrói ou danifica o tecido da retina, ao mesmo tempo em que obtém efeitos benéficos em doenças oculares. Acredita-se que isto pode ser devido, pelo menos em parte, à estimulação e ativação das proteínas de choque térmico e à facilitação do reparo proteico no tecido da retina. Isto é divulgado nos pedidos de patente dos Estados Unidos, números de série 14/607.959, depositado em 28 de janeiro de 2015, 13/798.523 depositado em 13 de março de 2013 e 13/481.124 depositado em 25 de maio de 2012, cujo conteúdo é incorporado por referência como se fosse feito na íntegra.
[00022] Os inventores verificaram que um feixe de luz de laser pode ser gerado o qual é terapêutico, mas subletal às células do tecido da retina e evita, assim, fotocoagulação prejudicial no tecido da retina que fornece tratamento preventivo e protetor do tecido da retina do olho. Vários parâmetros do feixe de luz devem ser levados em consideração e selecionados de forma que a combinação dos parâmetros selecionados atinja o efeito terapêutico sem danificar permanentemente o tecido. Esses parâmetros incluem comprimento de onda do laser, raio da fonte de laser, potência média do laser, duração de pulso total e ciclo de trabalho do trem de pulso.
[00023] A seleção desses parâmetros pode ser determinada exigindo que a integral de Arrhenius para ativação de HSP seja maior que 1 ou unidade. As integrais de Arrhenius são usadas para analisar os impactos das ações no tecido biológico. Veja, por exemplo, The CRC Handbook of Thermal Engineering, ed. Frank Kreith, Springer Science and Business Media (2000). Ao mesmo tempo, os parâmetros selecionados não devem danificar permanentemente o tecido. Assim, a integral de Arrhenius para dano também pode ser usada, onde a integral de Arrhenius resolvida é menor que 1 ou unidade. Alternativamente, as restrições do FDA/FCC sobre a deposição de energia por unidade de grama de tecido e a elevação da temperatura como medida em períodos de minutos, são satisfeitas de modo a evitar danos permanentes nos tecidos. Os requisitos de FDA/FCC sobre deposição de energia e aumento de temperatura são amplamente usados e podem ser referenciados, por exemplo, em www.fda.gov/medicaldevices/deviceregulationandguidance/guidanc edocuments/ucm073817.htm#attacha for electromagnetic sources, and Anastosio and P. LaRivero, ed., Emerging Imaging Technologies. CRC Press (2012), para fontes de ultrassom. De modo geral, a elevação da temperatura do tecido entre 6°C e 11°C pode criar efeito terapêutico, ativando as proteínas de choque térmico, mantendo a temperatura média do tecido durante um período prolongado, como por exemplo, seis minutos, abaixo de uma temperatura predeterminada, tal como 6°C e mesmo 1°C ou menos, em certas circunstâncias, não danificarão permanentemente o tecido.
[00024] Os inventores verificaram que a geração de um feixe de luz de laser de micropulso sublimiar e subletal que tem um comprimento de onda maior que 532 nm e um ciclo de trabalho menor que 10% a uma intensidade ou potência predeterminada e um comprimento de pulso ou tempo de exposição predeterminados cria desejável fotoestimulação da retina sem áreas visíveis de queimadura ou destruição do tecido. Mais particularmente, um feixe de luz de laser tendo um comprimento de onda entre 550 nm e 1300 nm, e em uma modalidade particularmente preferencial, entre 810 nm e 1000 nm, com um ciclo de trabalho de aproximadamente 2,5% a 5% e uma intensidade ou potência predeterminada entre 100-590 watts por centímetro quadrado na retina ou aproximadamente 1 watt por ponto de laser para cada ponto de tratamento na retina) e um comprimento de pulso ou tempo de exposição predeterminado (como entre 100 e 600 milissegundos ou menos) cria uma fotoestimulação da retina "verdadeira subliminar" na qual todas as áreas do epitélio pigmentar da retina expostas à irradiação de laser são preservadas e disponíveis para contribuir terapeuticamente. Em outras palavras, os inventores verificaram que o aumento do tecido da retina, pelo menos até um nível terapêutico, mas abaixo de um nível celular ou letal do tecido, recria o benefício do efeito halo dos métodos da técnica anterior sem destruir, queimar ou de outra forma, danificar o tecido da retina. Isto é referido aqui como tratamento com laser de micropulso com diodo sublimiar (SDM).
[00025] Como o SDM não produz dano da retina induzido por laser (fotocoagulação), e não tem efeito adverso conhecido, e tem sido descrito como um tratamento eficaz em vários distúrbios da retina (incluindo retinopatia diabética proliferativa (PDR) do edema macular diabético (DME), edema macular devido à oclusão da veia central da retina (BRVO), coriorretinopatia serosa central (CSR), reversão da tolerância ao fármaco, e tratamento profilático de retinopatias degenerativas progressivas, como degeneração macular relacionada à idade, doença de Stargard, distrofias do cone e retinite pigmentosa. A segurança do SDM é tal que pode ser usada transfovealmente em olhos com acuidade visual 20/20 para reduzir o risco de perda visual devido a DME envolvendo a fóvea precoce.
[00026] Um mecanismo pelo qual o SDM pode funcionar é a geração ou ativação de proteínas de choque térmico (HSPs). Apesar de uma variedade quase infinita de possíveis anormalidades celulares, as células de todos os tipos compartilham um mecanismo comum e altamente conservado de reparo: proteínas de choque térmico (HSPs). As HSPs são induzidas quase imediatamente, em segundos a minutos, por quase qualquer tipo de estresse ou lesão celular. Na ausência de lesão celular letal, as HSPs são extremamente eficazes em reparar e retornar a célula viável em direção a um estado funcional mais normal. Embora as HSPs sejam transitórias, geralmente atingindo o pico em horas e persistindo por alguns dias, seus efeitos podem ser duradouros. As HSPs reduzem a inflamação, um fator comum em muitos distúrbios.
[00027] O tratamento com laser pode induzir a produção ou ativação de HSP e alterar a expressão de citocinas. Quanto mais repentino e severo o estresse celular não letal (como a irradiação a laser), mais rápida e robusta a ativação de HSP. Assim, uma explosão de picos térmicos de baixa temperatura repetitivos a uma taxa de variação muito íngreme (~ 7°C de elevação com cada micropulso de 100μs, ou 70.000°C/s) produzida por cada exposição de SDM é especialmente eficaz para estimular a ativação de HSPs, particularmente, em comparação com a exposição não letal ao tratamento subliminar com lasers de ondas contínuas, o que pode duplicar apenas a baixa elevação média de temperatura do tecido.
[00028] Comprimentos de onda do laser abaixo de 550 nm produzem efeitos fotoquímicos cada vez mais citotóxicos. Em 810 nm, o SDM produz estresse celular fototérmico, em vez de fotoquímico. Assim, o SDM é capaz de afetar o tecido sem danificá-lo. Os benefícios clínicos do SDM são, portanto, principalmente produzidos pela ativação celular fototérmica submórbida de HSP. Em células disfuncionais, a estimulação da HSP pelo SDM resulta em expressão normalizada de citocinas e, consequentemente, melhora da estrutura e a função. Os efeitos terapêuticos dessa interação laser de “baixa intensidade”/tecido são amplificados pela aplicação de laser de “alta densidade”, recrutando todas as células disfuncionais na área do tecido alvo por tratamento denso/confluente de uma grande área de tecido, incluindo todas as áreas de patologia, maximizando, assim, o efeito do tratamento. Estes princípios definem a estratégia de tratamento do SDM aqui descrita.
[00029] Como as células que funcionam normalmente não precisam de reparo, a estimulação de HSP em células normais tenderia a não ter efeito clínico notável. A “patosseletividade” dos efeitos do laser infravermelho próximo, como o SDM, afetando as células doentes, mas não afetando as normais, em vários tipos de células é consistente com as observações clínicas do SDM. Foi relatado que o SDM tem uma faixa terapêutica clinicamente ampla, única entre as modalidades de laser da retina, consistente com as previsões do American National Standards Institute “Maximum Permissible Exposure”. Embora o SDM possa causar efeitos fototérmicos diretos, como desdobramento e desagregação da proteína entrópica, o SDM parece otimizado para a estimulação clinicamente segura e eficaz do reparo mediado por HSP.
[00030] Como observado acima, enquanto a estimulação de SDM de HSPs é inespecífica em relação ao processo da doença, o resultado do reparo mediado por HSP é, por sua natureza, específico do estado da disfunção. As HSPs tendem a consertar o que está errado, seja o que for. Assim, a eficácia observada de SDM em condições da retina é de tão ampla disparidade quanto BRVO, DME, PDR, CSR, retinopatia relacionada à idade e genética e NAMD tolerante a fármacos. Conceitualmente, essa facilidade pode ser considerada uma espécie de modo “Redefinir para Padrão” da ação do SDM. Para a ampla faixa de distúrbios em que a função celular é crítica, o SDM normaliza a função celular desencadeando uma “redefinição” (para as “configurações padrões de fábrica”) via reparo celular mediado por HSP.
[00031] Os inventores verificaram que o tratamento com SDM de pacientes que sofrem de degeneração macular relacionada com a idade (AMD) pode retardar o progresso ou mesmo parar a progressão da AMD. A maioria dos pacientes apresentou melhora significativa na acuidade visual mesóptica logMAR funcional dinâmica e na acuidade visual do contraste mesóptico após o tratamento com SDM. Acredita-se que o SDM funcione orientando, preservando e “normalizando” (indo ao normal) a função do epitélio pigmentar da retina (RPE).
[00032] O SDM também demonstrou parar ou reverter as manifestações do estado de doença da retinopatia diabética sem danos associados ao tratamento ou efeitos adversos, apesar da persistência do diabetes mellitus sistêmico. Com base nisso, tem-se como hipótese que o SDM pode funcionar induzindo um retorno a uma função celular mais normal e à expressão de citocinas em células RPE afetadas pela diabetes, análogo ao apertar o botão “redefinir” de um dispositivo eletrônico para restaurar as configurações padrões de fábrica. Com base nas informações e estudos acima, o tratamento com SDM pode afetar diretamente a expressão de citocinas via ativação da proteína de choque térmico (HSP) no tecido alvo.
[00033] Como as proteínas de choque térmico desempenham um papel na resposta a um grande número de condições anormais no tecido do corpo que não o tecido ocular, acredita-se que sistemas e metodologias semelhantes possam ser usados com vantagem no tratamento de tais condições anormais, infecções, etc. Como tal, a presente invenção é direcionada à aplicação controlada de ultrassons ou radiação eletromagnética para tratar condições anormais incluindo inflamações, condições autoimunes e cânceres que são acessíveis por meio de elementos ópticos de fibra de endoscópios ou sondas de superfície bem como ondas eletromagnéticas/sonoras focadas. Por exemplo, cânceres na superfície da próstata que têm a maior ameaça de metástase podem ser acessados por um sistema de fibra óptica em um protoscópio. Os tumores do cólon podem ser acessados por um sistema de fibra óptica, como os usados na colonoscopia.
[00034] Como indicado acima, a fotoestimulação com laser de micropulso com diodo sublimiar (SDM) tem sido eficaz em estimular o reparo direto de proteínas levemente desdobradas no tecido ocular. Além da ativação de HSP, uma outra forma que pode ocorrer é porque os picos de temperatura causados pelos micropulsos na forma de um curso de tempo térmico permitem a difusão da água dentro das proteínas, e isso permite a quebra das ligações de hidrogênio peptídeo-peptídeo que impedem a proteína de retornar ao seu estado nativo. A difusão da água em proteínas resulta em um aumento no número de ligações de hidrogênio restritivas por um fator da ordem de mil. Assim, acredita-se que este processo pode ser aplicado a outras doenças vantajosamente também.
[00035] Como explicado acima, a fonte de energia a ser aplicada ao tecido alvo terá parâmetros energéticos e operacionais que devem ser determinados e selecionados de modo a alcançar o efeito terapêutico sem danificar permanentemente o tecido. Usando uma fonte de energia de feixe de luz, tal como um feixe de luz de laser, por exemplo, os parâmetros de comprimento de onda do laser, ciclo de trabalho e duração de trem de pulso total devem ser levados em consideração. Outros parâmetros que podem ser considerados incluem o raio da fonte de laser, bem como a potência média do laser. O ajuste ou seleção de um desses parâmetros pode ter um efeito em pelo menos um outro parâmetro.
[00036] As FIGS. 1A e 1B ilustram gráficos que mostram a potência média em watts em comparação com o raio da fonte de laser (entre 0,1 cm e 0,4 cm) e a duração de trem de pulso (entre 0,1 e 0,6 segundo). A FIG. 1A mostra um comprimento de onda de 880 nm, enquanto a FIG.1B tem um comprimento de onda de 1000 nm. Pode-se ver nestas figuras que a potência requerida diminui monotonicamente à medida que o raio da fonte diminui, à medida que a duração do trem total aumenta e à medida que o comprimento de onda diminui. Os parâmetros preferenciais para o raio da fonte de laser são de 1 mm a 4 mm. Para um comprimento de onda de 880 nm, o valor mínimo de energia é de 0,55 watts, com um raio da fonte de laser de 1 mm, e a duração de trem de pulso total é de 600 milissegundos. O valor máximo de energia para o comprimento de onda de 880 nm é de 52,6 watts quando o raio da fonte de laser é de 4 mm e a duração total do dreno do pulso é de 100 milissegundos. No entanto, ao selecionar um laser com um comprimento de onda de 1000 nm, o valor mínimo de energia é de 0,77 watts com raio de fonte laser de 1 mm e duração de trem de pulso total de 600 milissegundos e um valor máximo de energia de 73,6 watts o raio é de 4 mm e a duração de pulso total é de 100 milissegundos. As potências de pico correspondentes, durante um pulso individual, são obtidas das potências médias dividindo-se pelo ciclo de trabalho.
[00037] O volume da região de tecido a ser aquecido é determinado pelo comprimento de onda, o comprimento de absorção no tecido relevante e pela largura do feixe. A duração de pulso total e a potência média do laser determinam a energia total fornecida para aquecer o tecido, e o ciclo de trabalho do trem de pulso fornece o ponto, o pico ou a potência associada com a potência média do laser. De preferência, os parâmetros de energia da fonte de energia pulsada são selecionados de modo que aproximadamente 20 a 40 joules de energia sejam absorvidos por cada centímetro cúbico do tecido alvo.
[00038] O comprimento de absorção é muito pequeno na fina camada de melanina no epitélio pigmentado da retina. Em outras partes do corpo, o comprimento de absorção geralmente não é tão pequeno. Em comprimentos de onda que variam de 400 nm a 2000 nm, a profundidade de penetração e a pele estão na faixa de 0,5 mm a 3,5 mm. A profundidade de penetração nos tecidos mucosos humanos na faixa de 0,5 mm a 6,8 mm. Consequentemente, o volume aquecido será limitado à superfície externa ou interna onde a fonte de radiação é colocada, com uma profundidade igual à profundidade de penetração, e uma dimensão transversal igual à dimensão transversal da fonte de radiação. Uma vez que a fonte de energia do feixe de luz é usada para tratar tecidos doentes perto de superfícies externas ou perto de superfícies internas acessíveis, um raio de fonte entre 1 mm e 4 mm e operando um comprimento de onda de 880 nm produz uma profundidade de penetração de aproximadamente 2,5 mm e um comprimento de onda de 1000 nm produz uma profundidade de penetração de aproximadamente 3,5 mm.
[00039] Foi determinado que o tecido alvo pode ser aquecido até aproximadamente 11°C durante um curto período de tempo, tal como menos de um segundo, para criar o efeito terapêutico da invenção enquanto se mantém a temperatura média do tecido alvo para uma faixa de temperatura mais baixa, tal como menos de 6°C ou mesmo 1°C ou menos durante um período de tempo prolongado, tal como vários minutos. A seleção do ciclo de trabalho e a duração de trem de pulso total fornecem intervalos de tempo nos quais o calor pode se dissipar. Um ciclo de trabalho menor que 10%, e de preferência, entre 2,5% e 5%, com uma duração de pulso total entre 100 milissegundos e 600 milissegundos, foi considerado eficaz. As FIGS. 2A e 2B ilustram o tempo de decaimento de 10°C a 1°C para uma fonte de laser com um raio compreendido entre 0,1 cm e 0,4 cm, sendo o comprimento de onda de 880 nm na FIG. 2A e 1000 nm na FIG. 2B. Pode ser visto que o tempo de decaimento é menor quando se utiliza um comprimento de onda de 880 nm, mas o comprimento de onda está dentro dos requisitos e parâmetros operacionais aceitáveis para alcançar os benefícios da presente invenção sem causar danos permanentes nos tecidos.
[00040] Verificou-se que a elevação média de temperatura da região alvo desejada, aumentando pelo menos 6°C e até 11°C, e de preferência, aproximadamente 10°C, durante o período total de irradiação, resulta na ativação de HSP. O controle da temperatura do tecido alvo é determinado escolhendo os parâmetros alvos e de fonte, de modo que a integral de Arrhenius para ativação de HSP seja maior que 1, enquanto ao mesmo tempo assegurando a conformidade com os requisitos de FDA/FCC conservadores para evitar danos ou um dano na integral de Arrhenius sendo menor que 1.
[00041] Para atender às restrições de FDA/FCC conservadoras para evitar danos permanentes nos tecidos, para os feixes de luz e outras fontes de radiação eletromagnética, a elevação média de temperatura do tecido alvo em qualquer período de seis minutos é de 1°C ou menos. As FIGS. 2A e 2B acima ilustram os tempos de decaimento típicos requeridos para que a temperatura na região alvo aquecida diminua por difusão térmica a partir de uma elevação de temperatura de aproximadamente 10°C para 1°C; como pode ser visto na FIG. 2A quando o comprimento de onda é de 880 nm e o diâmetro da fonte é de 1 mm, o tempo de queda de temperatura é de 16 segundos. O tempo de queda de temperatura é de 107 segundos quando o diâmetro da fonte é de 4 mm. Como mostrado na FIG. 2B, quando o comprimento de onda é de 1.000 nm, o tempo de queda de temperatura é de 18 segundos quando o diâmetro da fonte é de 1 mm e 136 segundos quando o diâmetro da fonte é de 4 mm. Isso está bem dentro do tempo em que a elevação média de temperatura é mantida ao longo de vários minutos, como 6 minutos ou menos. Embora a temperatura do tecido alvo seja elevada, como aproximadamente 10°C, muito rapidamente, tal como em uma fração de segundo durante a aplicação da fonte de energia ao tecido, o ciclo de trabalho relativamente baixo fornece períodos de tempo relativamente longos entre os pulsos de energia aplicados ao tecido e a duração de trem de pulso relativamente curta assegura difusão de temperatura suficiente dentro de um período de tempo relativamente curto compreendendo vários minutos, como 6 minutos ou menos, em que não há dano tecidual permanente.
[00042] Os parâmetros diferem para as fontes de energia individuais, incluindo micro-ondas, lasers infravermelhos, radiofrequência e ultrassom, porque as propriedades de absorção dos tecidos diferem para esses diferentes tipos de fontes de energia. O teor de água no tecido pode variar de um tipo de tecido para outro, no entanto, existe uma uniformidade observada das propriedades dos tecidos em condições normais ou quase normais que permitiram a publicação de parâmetros de tecido que são amplamente usados pelos clínicos na concepção de tratamentos. Abaixo estão as tabelas que ilustram as propriedades das ondas eletromagnéticas em meios biológicos, com a Tabela 1 referente a músculos, pele e tecidos com alto teor de água, e a Tabela 2 referente à gordura, ossos e tecidos com baixo teor de água.
[00043] Os comprimentos de absorção de radiofrequência no tecido do corpo são longos em comparação com as dimensões do corpo. Consequentemente, a região aquecida é determinada pelas dimensões da bobina que é a fonte da energia de radiofrequência e não pelos comprimentos de absorção. A longas distâncias “r” de uma bobina, o campo magnético (próximo) de uma bobina cai como 1/r3. Em distâncias menores, os campos elétrico e magnético podem ser expressos em termos do potencial magnético do vetor que, por sua vez, pode ser expresso em forma fechada em termos de integrais elípticas do primeiro e do segundo tipo. O aquecimento ocorre apenas em uma região que é comparável em tamanho com as dimensões da própria fonte da bobina. Como consequência, se for desejado aquecer, de preferência, uma região caracterizada por um raio, a bobina da fonte será escolhida para ter um raio semelhante. O aquecimento cai muito rapidamente fora de uma região hemisférica de raio por causa da queda de 1/r3 do campo magnético. Uma vez que se propõe o uso da radiofrequência do tecido doente acessível somente externamente ou a partir de cavidades internas, é razoável considerar um raio de bobina entre aproximadamente 2 a 6 mm.
[00044] O raio da(s) bobina(s) de fonte, bem como o número de amperes-espira (NI) nas bobinas da fonte fornecem a magnitude e a extensão espacial do campo magnético, e a radiofrequência é um fator que relaciona a magnitude do campo elétrico com a magnitude do campo magnético. O aquecimento é proporcional ao produto da condutividade e ao quadrado do campo elétrico. Para tecidos alvos de interesse que estão próximos a superfícies externas ou internas, a condutividade é a da pele e do tecido mucoso. O ciclo de trabalho do trem de pulso, bem como a duração de trem total de um trem de pulso, são fatores que afetam a quantidade de energia total que é fornecida ao tecido.
[00045] Parâmetros preferenciais para uma fonte de energia de radiofrequência foram determinados como raios de bobina entre 2 e 6 mm, radiofrequências na faixa de 3-6 MHz, durações de trem de pulso total de 0,2 a 0,4 segundo e um ciclo de trabalho entre 2,5% e 5%. As FIGS. 3-6 mostram como o número de amperes-espira varia à medida que esses parâmetros são variados, a fim de fornecer um aumento de temperatura que produza uma integral de Arrhenius de aproximadamente um ou uma unidade para ativação de HSP. Com referência à FIG. 3, para uma frequência RF de 6 MHz, a duração de trem de pulso entre 0,2 e 0,4 segundo, o raio da bobina entre 0,2 e 0,6 cm e um ciclo de trabalho de 5%, o pico de amperes-espira (NI) é 13 no raio de bobina de 0,6 cm e 20 no raio da bobina de 0,2 cm. Para uma frequência de 3 MHz, como ilustrado na FIG. 4, o pico de amperes-espira é 26 quando a duração de trem de pulso é de 0,4 segundo e o raio da bobina é de 0,6 cm e o ciclo de trabalho é de 5%. No entanto, com o mesmo ciclo de trabalho de 5%, o pico de amperes-espira é 40 quando o raio da bobina é de 0,2 cm e a duração de trem de pulso é de 0,2 segundo. Um ciclo de trabalho de 2,5% é usado nas FIGS. 5 e 6. Isto produz, como ilustrado na FIG. 5, 18 amperes-espira para uma radiofrequência de 6MHz com um raio de bobina de 0,6 cm e uma duração de trem de pulso de 0,4 s, e 29 amperes-espira quando o raio da bobina é de apenas 0,2 cm e a duração de trem de pulso é de 0,2 s. Com referência à FIG. 6, com um ciclo de trabalho de 2,5% e uma radiofrequência de 3 MHz, o pico de voltagem é 36 quando a duração de trem de pulso é de 0,4 segundo e o raio da bobina é de 0,6 cm e 57 amperes-espira quando a duração de trem de pulso é de 0,2 segundo e o raio da bobina é de 0,2 cm.
[00046] O tempo, em segundos, para a elevação de temperatura decair de aproximadamente 10°C para aproximadamente 1°C para raios de bobina entre 0,2 cm e 0,6 cm é ilustrado para uma fonte de energia de radiofrequência na FIG. 7. O tempo de queda de temperatura é de aproximadamente 37 segundos quando o raio da bobina de radiofrequência é de 0,2 cm e aproximadamente 233 segundos quando o raio da bobina de radiofrequência é de 0,5 cm. Quando o raio da bobina de radiofrequência é de 0,6 cm, o tempo de decaimento é de aproximadamente 336 segundos, o que ainda está dentro do intervalo aceitável de tempo de decaimento, mas em uma faixa superior do mesmo.
[00047] As micro-ondas são outra fonte de energia eletromagnética que pode ser usada de acordo com a presente invenção. A frequência de micro-ondas determina a distância de penetração no tecido. O ganho de uma corneta de micro-ondas cônica é grande em comparação com o comprimento de onda das micro-ondas, indicando que sob essas circunstâncias a energia é irradiada principalmente em uma carga direta estreita. Tipicamente, uma fonte de micro-ondas usada de acordo com a presente invenção tem uma dimensão linear na ordem de um centímetro ou menos, assim a fonte é menor que o comprimento de onda, caso em que a fonte de micro-ondas pode ser aproximada como uma antena dipolar. Essas pequenas fontes de micro-ondas são mais fáceis de inserir nas cavidades internas do corpo e, também, podem ser usadas para irradiar superfícies externas. Nesse caso, a região aquecida pode ser aproximada por um hemisfério com um raio igual ao comprimento de absorção do micro-ondas no tecido do corpo a ser tratado. Como as micro-ondas são usadas para tratar tecidos perto de superfícies externas ou superfícies acessíveis a partir de cavidades internas, utilizam- se frequências na faixa dos 10-20 GHz, em que as correspondentes distâncias de penetração são apenas entre aproximadamente 2 e 4 mm.
[00048] A elevação de temperatura do tecido usando uma fonte de energia de micro-ondas é determinada pela potência média do micro-ondas e pela duração de trem de pulso total. O ciclo de trabalho do trem de pulso determina a potência de pico em um único pulso em um trem de pulsos. Como o raio da fonte é menor que aproximadamente 1 centímetro, e as frequências entre 10 e 20 GHz são tipicamente usadas, uma duração de trem de pulso resultante de 0,2 e 0,6 segundo é preferencial.
[00049] A potência requerida diminui monotonicamente à medida que a duração do trem aumenta e à medida que a frequência de micro-ondas aumenta. Para uma frequência de 10 GHz, a potência média é de 18 watts quando a duração de trem de pulso é de 0,6 segundo e 52 watts quando a duração de trem de pulso é de 0,2 segundo. Para uma frequência de micro-ondas de 20 GHz, uma potência média de 8 watts é usada quando o trem de pulso é de 0,6 segundo e pode ser de 26 watts quando a duração de trem de pulso é de apenas 0,2 segundo. A potência de pico correspondente é obtida a partir da potência média simplesmente dividindo pelo ciclo de trabalho.
[00050] Com referência agora à FIG. 8, um gráfico representa a potência média de micro-ondas em watts de um micro-ondas tendo uma frequência de 10 GHz e uma duração de trem de pulso entre 0,2 segundo e 0,6 segundo. A FIG. 9 é um gráfico semelhante, mas mostrando a potência média de micro-ondas para um micro-ondas com uma frequência de 20 GHz. Assim, será visto que a potência média da fonte de micro-ondas varia conforme a duração de trem total e a frequência de micro-ondas variam. A condição controladora, no entanto, é que a integral de Arrhenius para ativação de HSP na região aquecida é de aproximadamente 1.
[00051] Com referência à FIG. 10, um gráfico ilustra o tempo, em segundos, para a temperatura decair de aproximadamente 10°C para 1°C em comparação com frequências de micro-ondas entre 58 MHz e 20000 MHz. O decaimento mínimo e máximo da temperatura para a faixa preferencial de frequências de micro-ondas é de 8 segundos quando a frequência de micro-ondas é de 20 GHz e de 16 segundos quando a frequência de micro-ondas é de 10 GHz.
[00052] O uso do ultrassom como fonte de energia permite o aquecimento de tecidos superficiais e tecidos de diferentes profundidades no corpo, incluindo tecidos mais profundos. O comprimento de absorção do ultrassom no corpo é bastante longo, como evidenciado pelo uso generalizado de imagens. Como consequência, o ultrassom pode ser focado em regiões alvos profundas dentro do corpo, com o aquecimento de um feixe de ultrassom focado concentrado principalmente na região focal aproximadamente cilíndrica do feixe. A região aquecida tem um volume determinado pelo centro focal do disco arejado e o comprimento da região do centro focal, que é o parâmetro confocal. Múltiplos feixes de fontes em diferentes ângulos também podem ser usados, ocorrendo o aquecimento nas regiões focais sobrepostas.
[00053] Para o ultrassom, os parâmetros relevantes para determinar a temperatura do tecido são a frequência do ultrassom, a duração de trem total e a potência do transdutor quando a comprimento focal e o diâmetro do transdutor de ultrassom são dados. A frequência, comprimento focal e diâmetro determinam o volume da região focal onde a energia ultrassônica está concentrada. É o volume focal que compreende o volume alvo de tecido para tratamento. Os transdutores com um diâmetro de aproximadamente 5 cm e com um comprimento focal de aproximadamente 10 cm estão prontamente disponíveis. As dimensões focais favoráveis são alcançadas quando a frequência do ultrassom está entre 1 e 5 MHz, e a duração de trem total é de 0,1 a 0,5 segundo. Por exemplo, para um comprimento focal de 10 cm e o diâmetro do transdutor de 5 cm, os volumes focais são 0,02 cc a 5 MHz e 2,36 cc a 1 MHz.
[00054] Com referência agora à FIG. 11, um gráfico ilustra a potência da fonte média em watts em comparação com a frequência (entre 1 MHz e 5 MHz) e a duração de trem de pulso (entre 0,1 e 0,5 segundo). Um comprimento focal do transdutor de 10 cm e um diâmetro de fonte de 5 cm foram assumidos. A potência necessária para fornecer a integral de Arrhenius para a ativação de HSP de aproximadamente 1 diminui monotonicamente à medida que a frequência aumenta e a duração de trem total aumenta. Dados os parâmetros preferenciais, a potência mínima para uma frequência de 1 GHz e duração de 0,5 segundo é de 5,72 watts, enquanto que para a frequência de 1 GHz e duração de trem de pulso de 0,1 segundo, a potência máxima é de 28,6 watts. Para uma frequência de 5 GHz, são necessários 0,046 watts para uma duração de trem de pulso de 0,5 segundos, sendo necessários 0,23 watts para uma duração de trem de pulso de 0,1 segundo. A potência de pico correspondente durante um pulso individual é obtida simplesmente dividindo-se pelo ciclo de trabalho.
[00055] A FIGURA 12 ilustra o tempo, em segundos, para a temperatura difundir ou decair de 10°C para 6°C quando a frequência de ultrassom está entre 1 e 5 MHz. A FIG. 13 ilustra o tempo, em segundos, para decair de aproximadamente 10 a aproximadamente 1 para frequências de ultrassons de 1 a 5 MHz. Para a comprimento focal preferencial de 10 cm e o diâmetro do transdutor de 5 cm, o tempo máximo de decaimento da temperatura é de 366 segundos quando a frequência de ultrassom é de 1 MHz, e o decaimento de temperatura mínimo é de 15 segundos quando a frequência de micro-ondas é de 5 MHz. Como o FDA exige apenas que a elevação de temperatura seja menor que 6°C para tempos de teste de minutos, o tempo de decaimento de 366 segundos a 1 MHz para obter um aumento de 1°C nos vários minutos é permitido. Como pode ser visto nas FIGS. 12 e 13, os tempos de decaimento para um aumento de 6°C são muito menores, por um fator de aproximadamente 70, do que o de 1°C.
[00056] A FIGURA 14 ilustra o volume da região aquecida focal, em centímetros cúbicos, em comparação com as frequências de ultrassons entre 1 e 5 MHz. Considerando as frequências de ultrassom na faixa de 1 a 5 MHz, os tamanhos focais correspondentes para essas frequências variam de 3,7 mm a 0,6 mm, e o comprimento da região focal varia de 5,6 cm a 1,2 cm. Os volumes de tratamento correspondentes variam entre aproximadamente 2,4 cc e 0,02 cc.
[00057] Exemplos de parâmetros que geram uma integral de Arrhenius de ativação de HSP desejada maior que 1 e integral de Arrhenius de dano menor que 1 é uma potência total de ultrassom entre 5,8-17 watts, uma duração de pulso de 0,5 segundo, um intervalo entre pulsos de 5 segundos, com um número total de pulsos 10 dentro do tempo de fluxo de pulso total de 50 segundos. O volume de tratamento alvo seria de aproximadamente 1 mm em um lado. Volumes de tratamento maiores poderiam ser tratados por um sistema de ultrassom similar a um sistema óptico difratado a laser, através da aplicação de ultrassom em múltiplas colunas adjacentes, mas separadas e espaçadas aplicadas simultaneamente. Os múltiplos feixes de ultrassom focalizados convergem em um alvo de tratamento muito pequeno dentro do corpo, a convergência permitindo um aquecimento mínimo, exceto nos feixes sobrepostos no alvo. Esta área seria aquecida e estimularia a ativação de HSPs e facilitaria o reparo de proteínas através de pontos de altas temperaturas transientes. No entanto, dado o aspecto pulsante da invenção, bem como a área relativamente pequena a ser tratada a qualquer momento, o tratamento está em conformidade com os requisitos de FDA/FCC para a elevação média de temperatura a longo prazo (minutos) < 1K. Uma importante distinção da invenção dos tratamentos de aquecimento terapêutico existentes para a dor e tensão muscular é que não existem pontos de T elevados nas técnicas existentes, e estes são necessários para ativar eficazmente as HSPs e facilitar a reparação de proteínas para fornecer cicatrização ao nível celular.
[00058] O modo de transmissão de pulso do fornecimento de energia tem uma vantagem distinta sobre um único pulso ou modo gradual de fornecimento de energia, no que se refere à ativação de HSPs reparadoras e à facilitação do reparo de proteínas. Há duas considerações que estão relacionadas com essa vantagem:
[00059] Primeiro, uma grande vantagem para a ativação de HSP e reparo de proteína em um modo de fornecimento de energia de SDM vem da produção de uma temperatura de cume na ordem de 10°C. Este grande aumento na temperatura tem um grande impacto nas integrais de Arrhenius que descrevem quantitativamente o número de HSPs que são ativadas e a taxa de difusão de água nas proteínas que facilita o reparo de proteínas. Isso ocorre porque a temperatura entra em um exponencial que tem um grande efeito de amplificação.
[00060] É importante que a elevação de temperatura não permaneça no valor alto (10°C ou mais) por muito tempo, porque então isso violaria os requisitos de FDA e FCC que, em períodos de minutos, a elevação média da temperatura deve ser menor que 1°C (ou no caso do ultrassom 6°C).
[00061] Um modo de SDM de fornecimento de energia satisfaz unicamente estas duas considerações precedentes pela escolha judiciosa da potência, tempo de pulso, intervalo de pulso e o volume da região alvo a ser tratada. O volume da região de tratamento entra porque a temperatura deve decair a partir do seu alto valor da ordem de 10°C com bastante rapidez para que a elevação da temperatura média a longo prazo não exceda o limite de FDA/FCC de 6°C para frequências de ultrassom e 1°C ou menos para fontes de energia de radiação eletromagnética.
[00062] Para uma região de dimensão linear L, o tempo que leva a temperatura de pico para e-vezes no tecido é aproximadamente L2/16D, onde D = 0,00143 cm2/s é o coeficiente de difusão de calor típico. Por exemplo, se L = 1 mm, o tempo de decaimento é de aproximadamente 0,4 segundo. Assim, para uma região de 1 mm em um lado, um trem consistindo em 10 pulsos de duração de 0,5 segundo, com uma faixa entre pulsos de 5 segundos, pode atingir a elevação momentânea de temperatura desejada sem exceder um aumento médio de temperatura a longo prazo de 1°C. Isto é demonstrado mais abaixo.
[00063] A limitação do volume aquecido é a razão pela qual a radiação eletromagnética de RF não é uma opção tão boa para o tratamento do tipo SDM de regiões profundas com o corpo quanto o ultrassom. As profundidades longas da pele (distâncias de penetração) e o aquecimento Ôhmico ao longo da profundidade da pele resultam em um grande volume aquecido cuja inércia térmica não permite a obtenção de uma alta temperatura de cume que ativa HSPs e facilita o reparo de proteínas e a rápida queda de temperatura o que satisfaz o limite de FDA e de FCC a longo prazo na elevação média da temperatura.
[00064] O ultrassom já foi usado para aquecer terapeuticamente as regiões do corpo para aliviar a dor e a tensão muscular. No entanto, o aquecimento não seguiu o protocolo do tipo SDM e não possui os cumes de temperatura responsáveis pela excitação das HSPs.
[00065] Considere, então, um grupo de feixes de ultrassom focalizados que são direcionados a uma região alvo dentro do corpo. Para simplificar a matemática, suponha que os feixes sejam substituídos por uma única fonte com uma forma de superfície esférica focalizada no centro da esfera. Os comprimentos de absorção do ultrassom podem ser razoavelmente longos. A Tabela 3 abaixo mostra os coeficientes de absorção típicos para ultrassom em 1 MHz. Os coeficientes de absorção são aproximadamente forneceis à frequência. Tabela 3. Coeficientes de absorção típicos para ultrassom de 1 MHz em tecido corporal: Tecido do corpo Coeficiente de Atenuação a 1 MHz (cm-1) Água 0,00046 Sangue 0,0415 Gordura 0,145 Fígado 0,115-0,217 Rim 0,23 Músculo 0,3-0,76 Osso 1,15
[00066] Assumindo que a variação geométrica da radiação de entrada devido ao foco domina qualquer variação devido à atenuação, a intensidade do ultrassom de entrada a uma distância “r” do foco pode ser escrita aproximadamente como: onde P denota a potência total de ultrassom. A elevação de temperatura no final de um pulso curto de duração tp em r é então onde α é o coeficiente de absorção e Cv é a capacidade térmica de volume específico. Este será o caso até que o “r” seja alcançado no qual o comprimento de difusão de calor em tp se torne comparável a “r”, ou o limite de difração do feixe focalizado seja alcançado. Para “r” menor, a elevação de temperatura é essencialmente independente de “r”. Como exemplo, suponha que o limite de difração seja alcançado a uma distância radial menor que a determinada pela difusão de calor. Então onde D é o coeficiente de difusão de calor, e para r<rdif, a elevação de temperatura a tp é Assim, no final do pulso, podemos escrever para a elevação de temperatura: Sobre a aplicação da função de Green na equação de difusão de calor, para esta distribuição de temperatura inicial, descobrimos que a temperatura dT (t) no ponto focal r = 0 no momento t é
[00067] Uma boa aproximação para a eq. [7] é fornecida por: como pode ser visto na FIG. 15, que é uma comparação de eqs. [7] e [9] para dT (t)/dTo na zona de tratamento alvo. A curva inferior é a expressão aproximada da eq [9]. A integral de Arrhenius para um trem de N pulsos pode agora ser avaliada com a elevação de temperatura dada pela eq. [9]. Nesta expressão, onde dT(t-ntI) é a expressão da eq. [9] com t substituído por t- ntI e com tI designando o intervalo entre os pulsos.
[00068] A integral de Arrhenius pode ser avaliada aproximadamente dividindo o intervalo de integração na porção onde ocorrem os cumes de temperatura e a porção onde o cume de temperatura está ausente. O somatório sobre a contribuição do cume de temperatura pode ser simplificado aplicando a fórmula de ponto final de Laplace à integral sobre o cume de temperatura. Além disso, a integral sobre a porção quando os cumes estão ausentes pode ser simplificada notando que a elevação da temperatura que não é de cume alcança muito rapidamente um valor assintótico, de modo que uma boa aproximação é obtida substituindo a elevação variável do tempo pelo seu valor assintótico. Quando estas aproximações são feitas, a eq. [10] torna-se: (Então 2,5 na eq. [13] surge da soma sobre n de (N-n)-3/2 e é a magnitude do número harmônico (N, 3/2) para N típico de interesse.)
[00069] É interessante comparar essa expressão com a de SDM aplicada à retina. O primeiro termo é muito semelhante ao da contribuição do cume no caso da retina, exceto que o intervalo de cume eficaz é reduzido por um fator de 3 para este caso de raio convergente 3D. O segundo termo, envolvendo dTN(Nti) é muito menor do que no caso da retina. Lá, a elevação da temperatura de fundo foi comparável em magnitude à elevação da temperatura de pico. Mas aqui no caso do feixe convergente, a elevação da temperatura de fundo é muito menor pela razão (tp/ti)3/2. isso mostra a importância da contribuição do cume para a ativação ou produção de HSPs e a facilitação do reparo de proteínas, já que a elevação da temperatura de fundo que é similar à elevação em um caso contínuo de aquecimento por ultrassom é insignificante em comparação com a contribuição do cume. No final do trem de pulso, mesmo essa elevação de temperatura baixa desaparece rapidamente pela difusão de calor.
[00070] As FIGURAS 16 e 17 mostram a magnitude do logaritmo das integrais de Arrhenius para dano e para ativação ou produção de HSP em função de dTo para uma duração de pulso tp = 0,5 s, intervalo de pulso tI = 10 s e número total de pulsos N = 10. O logaritmo de integrais de Arrhenius [eq. 12] para danos e para ativação de HSP em função da elevação de temperatura em graus Kelvin de um único pulso dTo, por uma duração de pulso tp = 0,5 s, Intervalo de pulso tI = 10 s, e um número total de pulsos de ultrassom N = 10. A FIG. 16 mostra o logaritmo da integral de dano com as constantes de Arrhenius A = 8,71x1033 s-1 e = 3,55x10- 12 ergs. A FIG. 17 mostra o logaritmo da integral de ativação de HSP com as constantes de Arrhenius A = 1,24x1027 s-1 e = 2,66x10- 12 ergs. Os gráficos nas FIGS. 16 e 17 mostram que Qdano não excede 1 até que dTo exceda 11,3 K, enquanto Qhsp é maior que 1 em todo o intervalo mostrado, para a condição desejada para reparo celular sem dano.
[00071] A equação [8] mostra que, quando α = 0,1 cm-1, um dTo de 11,5 K pode ser obtido com uma potência de ultrassom total de 5,8 watts. Isso é facilmente alcançável. Se α é aumentado por um fator de 2 ou 3, a potência resultante ainda é facilmente alcançável. O volume da região onde a elevação de temperatura é constante (isto é, o volume correspondente a r=rd = (4Dtp)1/2) é 0,00064 cc. Isso corresponde a um cubo que tem 0,86 mm em um lado.
[00072] Este exemplo simples demonstra que o ultrassom focalizado deve ser utilizável para estimular a profundidade de HSPs reparadoras no fundo do corpo com equipamentos facilmente alcançáveis: Potência de ultrassom total: 5,8 watts - 17 watts Tempo de Pulso 0,5 s Intervalo de Pulso 5 s Duração de trem total (N=10) 50 s Para agilizar o tratamento de volumes internos maiores, um sistema SAPRA pode ser usado.
[00073] A fonte de energia pulsada pode ser direcionada para um exterior de um corpo que é adjacente ao tecido alvo ou tem um suprimento de sangue próximo à superfície do exterior do corpo. Alternativamente, um dispositivo pode ser inserido em uma cavidade de um corpo para aplicar a fonte de energia pulsada ao tecido alvo. Se a fonte de energia é aplicada fora do corpo ou dentro do corpo e que tipo de dispositivo é usado vai depender da fonte de energia selecionada e usada para tratar o tecido alvo.
[00074] A fotoestimulação, de acordo com a presente invenção, pode ser eficazmente transmitida para uma área de superfície interna ou tecido do corpo utilizando um endoscópio, tal como um broncoscópio, protoscópio, colonoscópio ou semelhante. Cada um destes consiste essencialmente em um tubo flexível que contém ele próprio um ou mais tubos internos. Tipicamente, um dos tubos internos compreende um tubo de luz ou fibra óptica de multimodo que conduz a luz para baixo no telescópio para iluminar a região de interesse e permitir que o médico veja o que está no lado iluminado. Outro tubo interno pode consistir em fios que transportam uma corrente elétrica para permitir ao médico cauterizar o tecido iluminado. Ainda outro tubo interno pode consistir em uma ferramenta de biópsia que permite ao médico cortar e prender qualquer tecido iluminado.
[00075] Na presente invenção, um desses tubos internos é usado como um tubo de radiação eletromagnética, como uma fibra óptica de multimodo, para transmitir o SDM ou outros pulsos de radiação eletromagnética que são alimentados no telescópio na extremidade que o médico prende. Com referência agora à FIG. 18, uma unidade de geração de luz 10, tal como um laser tendo um comprimento de onda e/ou frequência desejados é usada para gerar radiação eletromagnética, tal como luz de laser, de uma forma controlada, pulsada para ser distribuída através de um tubo ou conduto de luz 12 para uma extremidade distal do telescópio 14, ilustrada na FIG. 19, que é inserida no corpo e a luz de laser ou outra radiação 16 é fornecida ao tecido alvo 18 a ser tratado.
[00076] Com referência agora à FIG. 20, é mostrado um diagrama esquemático de um sistema para gerar radiação de energia eletromagnética, tal como luz de laser, incluindo SDM. O sistema, geralmente referido pelo número de referência 20, inclui um console de laser 22, tal como, por exemplo, o laser de díodos micropulsados de infravermelhos próximos de 810 nm na modalidade preferencial. O laser gera um feixe de luz de laser que é passado através de elementos ópticos, tal como uma lente ou máscara óptica, ou uma pluralidade de lentes e/ou máscaras ópticas 24 conforme necessário. Os elementos ópticos do projetor de laser 24 passa o feixe de luz modelado para um dispositivo de distribuição 26, tal como um endoscópio, para projetar a luz do feixe de laser no tecido alvo do paciente. Será entendido que a caixa rotulada 26 pode representar tanto o projetor de feixe de laser como o dispositivo de distribuição, bem como um sistema de visualização/câmara, tal como um endoscópio, ou compreende dois componentes diferentes em utilização. O sistema de visualização/câmara 26 fornece retorno a um monitor de exibição 28, que também pode incluir o hardware computadorizado necessário, entrada e controle de dados, etc. para manipular o laser 22, os elementos ópticos 24 e/ou os componentes de projeção/visualização 26.
[00077] Com referência agora à FIG. 21, em uma modalidade, o feixe de luz de laser 30 pode ser passado através de uma lente colimadora 32 e depois através de uma máscara 34. Em uma modalidade particularmente preferencial, a máscara 34 compreende uma rede de difração. A grade de difração/máscara 34 produz um objeto geométrico, ou mais tipicamente um padrão geométrico de múltiplos pontos de laser produzidos simultaneamente ou outros objetos geométricos. Isto é representado pelos múltiplos feixes de luz de laser marcados com o número de referência 36. Alternativamente, os múltiplos pontos de laser podem ser gerados por uma pluralidade de guias de onda de fibra óptica. Qualquer método de geração de pontos de laser permite a criação de um número muito grande de pontos de laser simultaneamente em um campo de tratamento muito amplo. De fato, um número muito alto de pontos de laser, talvez numerando em centenas, mesmo milhares ou mais, poderia ser gerado simultaneamente para cobrir uma determinada área do tecido alvo, ou possivelmente até a totalidade do tecido alvo. Uma vasta gama de aplicações de pontos de laser separados pequenos aplicados simultaneamente pode ser desejável, evitando assim certas desvantagens e riscos de tratamento que são conhecidos por estarem associados a grandes aplicações de pontos de laser.
[00078] Usando recursos ópticos com um tamanho de recurso em paridade com o comprimento de onda do laser empregado, por exemplo, usando uma grade de difração, é possível tirar vantagem dos efeitos da mecânica quântica que permitem a aplicação simultânea de um grande número de pontos de laser para uma área alvo muito grande. Os pontos individuais produzidos por essas redes de difração são todos de geometria óptica semelhante ao feixe de entrada, com variação mínima de potência para cada ponto. O resultado é uma pluralidade de pontos de laser com irradiância adequada para produzir uma aplicação de tratamento inofensiva, mas eficaz, simultaneamente em uma grande área alvo. A presente invenção também contempla o uso de outros objetos geométricos e padrões gerados por outros elementos ópticos difrativos.
[00079] A luz de laser que passa através da máscara 34 difrata, produzindo um padrão periódico a uma distância longe da máscara 34, mostrado pelos feixes de laser marcados 36 na FIG. 21. O único feixe de laser 30 foi assim formado em centenas ou mesmo milhares de feixes de laser individuais 36 de modo a criar o padrão desejado de pontos ou outros objetos geométricos. Estes feixes de laser 36 podem ser passados através de lentes adicionais, colimadores, etc. 38 e 40 de modo a transportar os raios de laser e formar o padrão desejado. Tais lentes adicionais, colimadores, etc. 38 e 40 podem ainda transformar e redirecionar os feixes laser 36 conforme necessário.
[00080] Padrões arbitrários podem ser construídos controlando a forma, espaçamento e padrão da máscara óptica 34. O padrão e os pontos de exposição podem ser criados e modificados arbitrariamente conforme desejado de acordo com os requisitos da aplicação por especialistas no campo da engenharia óptica. As técnicas fotolitográficas, especialmente aquelas desenvolvidas no campo de fabricação de semicondutores, podem ser usadas para criar o padrão geométrico simultâneo de pontos ou outros objetos.
[00081] A FIG. 22 ilustra esquematicamente um sistema que acopla múltiplas fontes de luz no subconjunto óptico gerador de padrões descrito acima. Especificamente, este sistema 20’ é semelhante ao sistema 20 descrito na FIG. 20 acima. As diferenças principais entre o sistema alternativo 20’ e o sistema 20 anteriormente descrito é a inclusão de uma pluralidade de consoles laser, cujas saídas são, cada uma, alimentadas a um acoplador de fibras 42. O acoplador de fibras produz uma única saída que é passada para os elementos do projetor de laser 24, conforme descrito no sistema anterior. O acoplamento da pluralidade de consoles de laser 22 em uma única fibra óptica é conseguido com um acoplador de fibras 42 como é conhecido na técnica. Outros mecanismos conhecidos para combinar múltiplas fontes de luz estão disponíveis e podem ser usados para substituir o acoplador de fibras aqui descrito.
[00082] Neste sistema 20' as múltiplas fontes de luz 22 seguem um caminho semelhante ao descrito no sistema anterior 20, isto é, colimadas, difratadas, recolimadas e direcionadas para o dispositivo de projetor e/ou tecido. Neste sistema alternativo 20’, o elemento difrativo deve funcionar de maneira diferente do que foi descrito anteriormente, dependendo do comprimento de onda de luz que passa, o que resulta em um padrão ligeiramente variável. A variação é linear com o comprimento de onda da fonte de luz que é difratada. Em geral, a diferença nos ângulos de difração é pequena o suficiente para que os diferentes padrões de sobreposição possam ser direcionados ao longo do mesmo caminho óptico através do dispositivo de projetor 26 para o tecido para tratamento.
[00083] Uma vez que o padrão resultante irá variar ligeiramente para cada comprimento de onda, um deslocamento sequencial para atingir cobertura completa será diferente para cada comprimento de onda. Este deslocamento sequencial pode ser realizado de dois modos. No primeiro modo, todos os comprimentos de onda de luz são aplicados simultaneamente sem cobertura idêntica. Um padrão de direção de deslocamento para obter cobertura completa para um dos múltiplos comprimentos de onda é usado. Assim, enquanto a luz do comprimento de onda selecionado alcança uma cobertura completa do tecido, a aplicação dos outros comprimentos de onda alcança uma cobertura incompleta ou sobreposta do tecido. O segundo modo aplica sequencialmente cada fonte de luz de um comprimento de onda variável com o padrão de direção adequado para obter uma cobertura completa do tecido para esse comprimento de onda específico. Este modo exclui a possibilidade de tratamento simultâneo usando múltiplos comprimentos de onda, mas permite que o método óptico atinja cobertura idêntica para cada comprimento de onda. Isso evita uma cobertura incompleta ou sobreposta para qualquer um dos comprimentos de onda ópticos.
[00084] Estes modos também podem ser misturados e combinados. Por exemplo, dois comprimentos de onda podem ser aplicados simultaneamente com um comprimento de onda alcançando uma cobertura completa e o outro alcançando uma cobertura incompleta ou sobreposta, seguido por um terceiro comprimento de onda aplicado sequencialmente e obtendo uma cobertura completa.
[00085] A FIG. 23 ilustra esquematicamente ainda outra modalidade alternativa do sistema da invenção 20”. Este sistema 20” é configurado geralmente do mesmo modo que o sistema 20” representado na FIG. 20. A principal diferença reside na inclusão de múltiplos canais de subconjuntos geradores de padrões sintonizados em um comprimento de onda específico da fonte de luz. Múltiplos consoles de laser 22 são dispostos em paralelo com cada um levando diretamente seus próprios elementos ópticos de projetor laser 24. Os elementos ópticos de projetor de laser de cada canal 44a, 44b, 44c compreendem um colimador 32, máscara ou grade de difração 34 e recolimadores 38, 40 como descrito em relação com a FIG. 21 acima - o conjunto inteiro de elementos ópticos sintonizados para o comprimento de onda específico gerado pelo console de laser correspondente 22. A saída de cada conjunto de elementos ópticos 24 é então direcionada para um divisor de feixes 46 para combinação com os outros comprimentos de onda. É conhecido pelos versados na técnica que um divisor de feixes usado em reverso pode ser usado para combinar múltiplos feixes de luz em uma única saída. A saída de canal combinada do divisor de feixe final 46c é então direcionada através do dispositivo de projetor 26.
[00086] Neste sistema 20” os elementos ópticos para cada canal são sintonizados para produzir o padrão exato especificado para o comprimento de onda do canal. Consequentemente, quando todos os canais são combinados e alinhados adequadamente, um único padrão de direção pode ser usado para obter uma cobertura completa do tecido para todos os comprimentos de onda.
[00087] O sistema 20” pode usar tantos canais 44a, 44b, 44c, etc. e divisores de feixe 46a, 46b, 46c, etc. quanto comprimentos de onda de luz existentes sendo usados no tratamento.
[00088] A implementação do sistema 20” pode tirar proveito de diferentes simetrias para reduzir o número de restrições de alinhamento. Por exemplo, os padrões de grade propostos são periódicos em duas dimensões e direcionados em duas dimensões para obter cobertura completa. Como resultado, se os padrões de cada canal forem idênticos, conforme especificado, o padrão real de cada canal não precisaria ser alinhado para o mesmo padrão de direção para obter cobertura completa para todos os comprimentos de onda. Cada canal só precisaria estar alinhado opticamente para conseguir uma combinação eficiente.
[00089] No sistema 20”, cada canal começa com uma fonte de luz 22, que pode ser de uma fibra óptica como em outras modalidades do subconjunto de geração de padrão. Esta fonte de luz 22 é direcionada para o conjunto óptico 24 para colimação, difração, recolimação e é direcionado para o divisor de feixes que combina o canal com a saída principal.
[00090] Será entendido que os sistemas de geração de luz de laser ilustrados nas FIGS. 20-23 são exemplificadores. Outros dispositivos e sistemas podem ser usados para gerar uma fonte de luz de laser de SDM que pode ser passada operacionalmente através de um dispositivo de projetor, tipicamente na forma de um endoscópio tendo um tubo de luz ou algo semelhante. Outras formas de radiação eletromagnética também podem ser geradas e usadas, incluindo ondas ultravioletas, micro-ondas, outras ondas de radiofrequência e luz de laser em comprimentos de onda predeterminados. Além disso, as ondas de ultrassons podem também ser geradas e usadas para criar um pico de temperatura térmica no tecido alvo suficiente para ativar ou produzir proteínas de choque térmico nas células do tecido alvo sem danificar o próprio tecido alvo. Para isso, tipicamente, uma fonte pulsada de energia de radiação ultrassônica ou eletromagnética é fornecida e aplicada ao tecido alvo de uma maneira que eleva a temperatura do tecido alvo, tal como entre 6°C e 11°C, transientemente, enquanto apenas 6°C ou 1°C ou menos a longo prazo, tal como ao longo de vários minutos.
[00091] Para tecidos profundos que não estão perto de um orifício interno, um tubo de luz não é um meio eficaz de fornecer a energia pulsada. Nesse caso, energia eletromagnética de baixa frequência pulsada ou, de preferência, ultrassom pulsado pode ser usada para causar uma série de cumes de temperatura no tecido alvo.
[00092] Assim, de acordo com a presente invenção, uma fonte de radiação eletromagnética ou de ultrassom pulsada é aplicada ao tecido alvo, a fim de estimular a produção ou ativação de HSP e para facilitar a reparação da proteína no tecido animal vivo. Em geral, a radiação eletromagnética pode ser de ondas ultravioletas, micro-ondas, outras ondas de radiofrequência, luz de laser em comprimentos de onda predeterminados, etc. Por outro lado, se a energia eletromagnética for usada para alvos de tecidos profundos longe dos orifícios naturais, os comprimentos de absorção restringem os comprimentos de onda às micro-ondas ou ondas de radiofrequência, dependendo da profundidade do tecido alvo. No entanto, o ultrassom deve ser preferencial à radiação eletromagnética de comprimento de onda longo para alvos de tecidos profundos longe dos orifícios naturais.
[00093] A radiação eletromagnética ou de ultrassom é pulsada de modo a criar um curso de tempo térmico no tecido que estimula a produção ou ativação de HSP e facilita o reparo proteico sem causar danos às células e ao tecido a ser tratado. A área e/ou volume do tecido tratado é também controlada e minimizada de modo que os cumes de temperatura são da ordem de vários graus, por exemplo, aproximadamente 10°C, mantendo a elevação de temperatura a longo prazo menor que o limite imposto por FDA, como 1°C. Verificou-se que, se uma área ou volume de tecido muito grande for tratada, a temperatura aumentada do tecido não pode ser difundida suficientemente rápida o suficiente para satisfazer os requisitos de FDA. No entanto, a limitação da área e/ou volume do tecido tratado, bem como a criação de uma fonte de energia pulsada realiza os objetivos da presente invenção de estimular a ativação ou produção de HSP por aquecimento ou, de outra forma, estressar as células e tecidos, permitindo que as células e tecidos tratados dissipem qualquer excesso de calor gerado dentro de limites aceitáveis.
[00094] Acredita-se que a estimulação da produção de HSP de acordo com a presente invenção pode ser eficazmente usada no tratamento de uma ampla faixa de anormalidades teciduais, doenças e até infecções. Por exemplo, os vírus que causam resfriados afetam principalmente uma pequena porta do epitélio respiratório nas passagens nasais e na nasofaringe. Semelhante à retina, o epitélio respiratório é um tecido fino e claro. Com referência à FIG. 24, uma vista em seção transversal de uma cabeça humana 48 é mostrada com um endoscópio 14 inserido na cavidade nasal 50 e energia 16, tal como luz de laser ou semelhante, sendo direcionada para o tecido 18 a ser tratado dentro da cavidade nasal 50. O tecido 18 a ser tratado pode estar dentro da cavidade nasal 50, incluindo as passagens nasais e a nasofaringe.
[00095] Para assegurar a absorção da energia de laser, ou outra fonte de energia, o comprimento de onda pode ser ajustado a um pico de absorção de infravermelho (IR) da água, ou um corante adjuvante pode ser usado para servir como fotossensibilizador. Em tal caso, o tratamento consiste em beber, ou aplicar topicamente, o adjuvante, esperar alguns minutos para o adjuvante permear a superfície do tecido, e depois administrar a luz de laser ou outra fonte de energia 16 ao tecido alvo 18 durante alguns segundos, tal como através de fibras ópticas em um endoscópio 14, como ilustrado na FIG. 24. Para fornecer conforto ao paciente, o endoscópio 14 poderia ser inserido após a aplicação de um anestésico tópico. Se necessário, o procedimento pode ser repetido periodicamente, como em um dia ou mais.
[00096] O tratamento pode estimular a ativação ou produção das proteínas de choque térmico e facilitar a reparação de proteínas sem danificar as células e tecidos a serem tratados. Como discutido acima, certas proteínas de choque térmico foram encontradas como desempenhando um papel importante na resposta imune, bem como no bem-estar das células alvos e tecido. A fonte de energia pode ser luz de laser monocromática, tal como luz de laser de comprimento de onda de 810 nm, administrada de uma maneira semelhante à descrita nos pedidos de patente acima referenciados, mas administrada através de um endoscópio ou semelhante, como ilustrado na FIG. 24. O corante adjuvante pode ser selecionado de modo a aumentar a absorção da luz de laser. Embora isto compreenda um método e uma modalidade particularmente preferenciais para realizar a invenção, será apreciado que outros tipos de energia e meios de distribuição podem ser usados para alcançar os mesmos objetivos de acordo com a presente invenção.
[00097] Com referência agora à FIG. 25, existe uma situação semelhante para o vírus da gripe, em que o alvo primário é o epitélio da árvore respiratória superior, em segmentos com diâmetros superiores a 3,3 mm, ou seja, as seis gerações superiores da árvore respiratória superior. Uma fina camada de muco separa as células epiteliais alvos do lúmen das vias aéreas, e é nessa camada que ocorrem as interações de antígeno-anticorpo que resultam na inativação do vírus.
[00098] Com referência contínua à FIG. 25, o tubo de luz flexível 12 de um broncoscópio 14 é inserido através da boca do indivíduo 52 através da garganta e da traqueia 54 e em um brônquio 56 da árvore respiratória. Ali a luz de laser ou outra fonte de energia 16 é administrada e aplicada ao tecido nesta área dos segmentos superiores para tratar o tecido e a área da mesma maneira descrita acima em relação à FIG. 24. Está contemplado que um comprimento de onda de laser ou outra energia pode ser selecionado de modo a corresponder a um pico de absorção de IR da água residente no muco para aquecer o tecido e estimular a ativação ou produção de HSP e facilitar a reparação de proteína, com os seus benefícios inerentes.
[00099] Com referência agora à FIG. 26, um colonoscópio 14 pode ter tubo óptico flexível 12 do mesmo inserido no ânus e reto 58 e no intestino grosso 60 ou no intestino delgado 62 de modo a administrar a luz de laser selecionada ou outra fonte de energia 16 à área e tecido a ser tratado, como ilustrado. Isso poderia ser usado para ajudar no tratamento do câncer de cólon, bem como outros problemas gastrointestinais.
[000100] Tipicamente, o procedimento poderia ser realizado de forma semelhante a uma colonoscopia em que o intestino seria depurado de todas as fezes, e o paciente deitaria de lado e o médico inseriria a porção longa e fina do tubo de luz 12 do colonoscópio 14 no reto e o moveria para a área do cólon, intestino grosso 60 ou intestino delgado 64 para a área a ser tratada. O médico pode ver através de um monitor a via do membro flexível inserido 12 e até ver o tecido na ponta do colonoscópio 14 dentro do intestino, de modo a ver a área a ser tratada. Utilizando um dos outros tubos de fibra óptica ou de luz, a ponta 64 do telescópio seria direcionada para o tecido a ser tratado e a fonte de luz de laser ou outra radiação 16 seria fornecida através de um dos tubos de luz do colonoscópio 14 para tratar a área do tecido a ser tratada, como descrito acima, a fim de estimular a ativação ou produção de HSP nesse tecido 18.
[000101] Com referência agora à FIG. 27, outro exemplo em que a presente invenção pode ser vantajosamente usada é o que é frequentemente referido como síndroma de "gotejamento do intestino", uma condição do trato gastrointestinal (GI) marcada por inflamação e outra disfunção metabólica. Uma vez que o trato GI é suscetível à disfunção metabólica semelhante a da retina, prevê-se que este responda bem ao tratamento da presente invenção. Isto pode ser feito por meio de tratamento de laser de micropulso por diodo (SDM) sublimiar, como discutido acima, ou por outras fontes de energia e meios como discutido aqui e conhecidos na técnica.
[000102] Com referência contínua à FIG. 27, o tubo de luz flexível 12 de um endoscópio ou semelhante é inserido pela boca do paciente 52 através da área da garganta e da traqueia 54 e para o estômago 66, onde a ponta ou extremidade 64 do mesmo é direcionada para o tecido 18 a ser tratado, e a luz de laser ou outra fonte de energia 16 é direcionada para o tecido 18. Será apreciado pelos versados na técnica que um colonoscópio pode também ser usado e inserido através do reto 58 e no estômago 66 ou qualquer tecido entre o estômago e o reto.
[000103] Se necessário, um pigmento cromóforo pode ser aplicado ao tecido GI por via oral para permitir a absorção da radiação. Se, por exemplo, a radiação de 810 nm sem foco de um diodo de laser ou LED fosse usada, o pigmento teria um pico de absorção de 810 nm ou próximo. Alternativamente, o comprimento de onda da fonte de energia poderia ser ajustado para um comprimento de onda ligeiramente maior em um pico de absorção de água, de modo que nenhum cromóforo aplicado externamente seria necessário.
[000104] É também contemplado pela presente invenção que um endoscópio de cápsula 68, tal como o ilustrado na FIG. 28, pode ser usado para administrar a radiação e a fonte de energia de acordo com a presente invenção. Tais cápsulas são relativamente de tamanho pequenas, como aproximadamente uma polegada de comprimento, de modo a serem engolidas pelo paciente. Quando a cápsula ou a pílula 68 é engolida e entra no estômago e passa através do trato gastrointestinal, quando no local apropriado, a cápsula ou pílula 68 pode receber energia e sinais, tal como através da antena 70, de modo a ativar a fonte de energia 72, tal como um diodo laser e circuitos relacionados, com uma lente apropriada 74 focando a luz de laser ou radiação gerada através de uma cobertura transparente para radiação 76 e sobre o tecido a ser tratado. Será entendido que a localização do endoscópio de cápsula 68 pode ser determinada por uma variedade de meios tais como imageamento externo, rastreio de sinal, ou mesmo por meio de uma câmara miniatura com luzes através da qual o médico veria imagens do trato GI através de qual pílula ou cápsula 68 estava passando no momento. A cápsula ou pílula 68 pode ser fornecida com a sua própria fonte de energia, tal como em virtude de uma bateria, ou pode ser alimentada externamente através de uma antena, de tal modo que o diodo de laser 72 ou outra fonte de geração de energia cria o comprimento de onda e fonte de energia pulsada desejados para tratar o tecido e a área a ser tratada.
[000105] Como no tratamento da retina em aplicações anteriores, a radiação seria pulsada para aproveitar os cumes de temperatura de micropulso e a segurança associada, e a energia poderia ser ajustada para que o tratamento fosse completamente inofensivo ao tecido. Isso pode envolver o ajuste da potência de pico, tempos de pulso e taxa de repetição para elevar a temperatura na ordem de 10°C, mantendo a elevação de temperatura a longo prazo menor do que o limite estabelecido por FDA de 1°C. Se a forma de pílula 68 de aplicação for usada, o dispositivo pode ser alimentado por uma pequena bateria recarregável ou por excitação indutiva sem fio ou semelhante. O tecido aquecido/estressado pode estimular a ativação ou produção de HSP e facilitar o reparo de proteína, e os benefícios resultantes dos mesmos.
[000106] A partir dos exemplos anteriores, a técnica da presente invenção é limitada ao tratamento de condições em superfícies próximas do corpo ou em superfícies internas facilmente acessíveis por meio de fibras ópticas ou outros meios ópticos de aplicação. A razão pela qual a aplicação de SDM para ativar a atividade de HSP é limitada às regiões da superfície próximas ou opticamente acessíveis do corpo é que o comprimento de absorção de IR ou radiação visível no corpo é muito curto. No entanto, existem condições mais profundas no tecido ou no corpo que podem beneficiar da presente invenção. Assim, a presente invenção contempla o uso de ultrassons e/ou radiofrequência (RF) e ainda radiações eletromagnéticas (EM) de comprimentos de onda mais curtos, tais como micro-ondas, que têm comprimentos de absorção relativamente longos nos tecidos corporais. O uso de ultrassom pulsado é preferencial à radiação eletromagnética de RF para ativar a atividade de HSP corretiva em tecido anormal que é inacessível à superfície de SDM ou semelhante. As fontes de ultrassom pulsado também podem ser usadas para anormalidades em ou perto das superfícies também.
[000107] Com referência agora à FIG. 29, com ultrassom, uma profundidade de região específica do corpo pode ser especificamente orientada usando um ou mais feixes que estão focados no sítio alvo. O aquecimento pulsante será em grande parte apenas na região alvo onde os feixes estão focados e se sobrepõem.
[000108] Conforme ilustrado na FIG. 29, um transdutor de ultrassons 78 ou semelhante gera uma pluralidade de feixes de ultrassons 80 que são acoplados à pele através de um gel de acústica-impedância-correspondência, e penetram através da pele 82 e através de tecido não danificado em frente do foco dos feixes 80 para um órgão alvo 84, tal como o fígado ilustrado, e especificamente para um tecido alvo 86 a ser tratado onde os feixes de ultrassons 80 estão focados. Como mencionado acima, o aquecimento por pulsos será então apenas na região alvo focada 86 onde os feixes focalizados 80 se sobrepõem. O tecido à frente e atrás da região focalizada 86 não será aquecido ou afetado apreciavelmente.
[000109] A presente invenção contempla não apenas o tratamento de tecido superficial próxima ou de superfície, tal como com o uso da luz de laser ou semelhante, tecido profundo usando, por exemplo, feixes de ultrassom focados ou semelhantes, mas também o tratamento de doenças do sangue, como como septicemia. Como indicado acima, o tratamento com ultrassom focalizado pode ser usado tanto na superfície quanto no tecido corporal profundo, e também pode ser aplicado neste caso no tratamento do sangue. No entanto, também está contemplado que o SDM e as opções de tratamento semelhantes que são tipicamente limitadas ao tratamento de superfície próxima ou de superfície das células epiteliais e semelhantes sejam usados no tratamento de doenças do sangue em áreas onde o sangue é acessível através de uma camada relativamente fina de tecido. como o lóbulo de orelha.
[000110] Com referência agora às FIGS. 30 e 31, o tratamento de distúrbios do sangue requer simplesmente a transmissão de SDM ou de outra radiação eletromagnética ou pulsos de ultrassons para o lóbulo de orelha 88, onde o SDM ou outra fonte de energia de radiação pode passar através do tecido do lóbulo de orelha para o sangue que passa pelo lóbulo de orelha. Será apreciado que esta abordagem também pode ocorrer em outras áreas do corpo onde o fluxo de sangue é relativamente alto e/ou está próximo da superfície do tecido, tal como as pontas dos dedos, dentro da boca ou garganta, etc.
[000111] Com referência novamente às FIGS. 30 e 31, um lóbulo de orelha 88 é mostrado adjacente a um dispositivo de grampo 90 configurado para transmitir radiação de SDM ou semelhante. Isto poderia ser, por exemplo, por meio de um ou mais diodos de laser 92 que transmitem a frequência desejada no pulso e no trem de pulso desejados para o lóbulo de orelha 88. A energia pode ser fornecida, por exemplo, por meio de um acionamento de lâmpada 94. Alternativamente, o acionamento da lâmpada 94 pode ser a fonte real de luz de laser, que seria transmitida através de elementos ópticos e eletrônicos apropriados para o lóbulo de orelha 88. O dispositivo de grampo 90 pode ser apenas usado para fixação no lóbulo de orelha do paciente e tornar a radiação restringida no lóbulo de orelha do paciente 88. Isto pode ser feito por meio de espelhos, refletores, difusores, etc. Isto pode ser controlado por um computador de controle 96, que pode ser operado por um teclado 98 ou semelhante. O sistema pode também incluir um monitor e alto-falantes 100, se necessário, por exemplo, se o procedimento for realizado por um operador a uma certa distância do paciente.
[000112] O tratamento proposto com um trem de pulsos eletromagnéticos ou ultrassom tem duas grandes vantagens sobre os tratamentos anteriores que incorporam um único pulso curto ou sustentado (longo). Primeiro, os pulsos individuais curtos (de preferência, de subsegundo) no trem ativam os mecanismos de redefinição celular como a ativação de HSP com maiores constantes de velocidade de reação do que aqueles que operam em escalas de tempo maiores (minuto ou hora). Em segundo lugar, os pulsos repetidos no tratamento fornecem grandes picos térmicos (na ordem de 10.000) que permitem que o sistema de reparo da célula ultrapasse mais rapidamente a barreira de energia de ativação que separa um estado celular disfuncional do estado funcional desejado. O resultado líquido é um "limiar terapêutico reduzido" no sentido de que uma potência média aplicada mais baixa e a energia total aplicada podem ser usadas para atingir o objetivo de tratamento desejado.
[000113] Embora várias modalidades tenham sido descritas em detalhe para os propósitos de ilustração, várias modificações podem ser feitas sem se distanciar do escopo e do espírito da invenção. Como consequência, a invenção não deve ser limitada, exceto como pelas reivindicações anexas.
Claims (14)
1. SISTEMA ADAPTADO PARA TRATAMENTO TÉRMICO DE TECIDOS BIOLÓGICOS, caracterizado por compreender: uma fonte de energia pulsada (16) tendo parâmetros de energia pré-selecionados incluindo comprimento de onda ou frequência, potência e um ciclo de trabalho de 10% ou menos que aumenta uma temperatura de tecido alvo entre aproximadamente 6 e 11 Graus Celsius pelo menos durante a aplicação da fonte de energia pulsada ao tecido alvo (18) para um duração de trem pulsado total de menos que um segundo, em que a média de aumento de temperatura do tecido ao longo de seis minutos ou menos é mantida a ou abaixo de seis graus Celsius de modo a não danificar o tecido alvo permanentemente.
2. Sistema, de acordo com a reivindicação 1, caracterizado por a fonte de energia pulsada (16) estimular a ativação da proteína de choque térmico no tecido alvo.
3. Sistema, de acordo com a reivindicação 1, caracterizado por incluir a média de aumento de temperatura do tecido alvo (18) é mantida a aproximadamente um grau Celsius ou menos por seis minutos ou menos.
4. Sistema, de acordo com a reivindicação 1, caracterizado por os parâmetros de energia da fonte de energia pulsada (16) serem selecionados de modo que aproximadamente 20 a 40 joules de energia são absorvidos por cada centímetro cúbico do tecido alvo.
5. Sistema, de acordo com a reivindicação 1, caracterizado por incluir um dispositivo (14) inserível em uma cavidade de um corpo para aplicar a fonte de energia pulsada ao tecido alvo.
6. Sistema, de acordo com a reivindicação 1, caracterizado por a fonte de energia pulsada (16) ser aplicada a um suprimento de sangue próximo ao tecido alvo (18).
7. Sistema, de acordo com a reivindicação 1, caracterizado por a fonte de energia pulsada (16) compreender luz de laser, micro-ondas, radio frequência ou ultrassom.
8. Sistema, de acordo com qualquer uma das reivindicações 1, 2 ou 3 - 6, caracterizado por a fonte de energia pulsada (16) compreender uma radiofrequência entre aproximadamente três a seis megahertz, um ciclo de trabalho entre aproximadamente 2,5% a 5% e uma duração de trem de pulso de entre aproximadamente 0,2 a 0,4 segundo, e preferencialmente gerada com um dispositivo que tem um raio de bobina entre aproximadamente 2 e 6 mm e entre espiras de aproximadamente 13 e 57 ampères.
9. Sistema, de acordo com qualquer uma das reivindicações 1 a 3, caracterizado por a fonte de energia pulsada (16) compreender uma frequência de micro-ondas entre aproximadamente 10 e 20 GHz, uma duração de trem de pulso de aproximadamente entre 0,2 e 0,6 segundo e um ciclo de entre aproximadamente 2% a 5%.
10. Sistema, de acordo com a reivindicação 9, caracterizado por o micro-ondas ter uma potência média entre aproximadamente 8 e 52 watts.
11. Sistema, de acordo com qualquer uma das reivindicações 1, 2, ou 3 - 6, caracterizado por a fonte de energia pulsada (16) compreender um feixe de luz pulsada (30) com um comprimento de onda entre aproximadamente 530 nm e 1300 nm, um ciclo de trabalho menor que 10% e uma duração de trem de pulso entre aproximadamente 0,1 e 0,6 segundo.
12. Sistema, de acordo com a reivindicação 11, caracterizado por o feixe de luz pulsada ter um comprimento de onda entre 800 nm e 1000 nm e uma potência entre aproximadamente 0,5 e 74 watts.
13. Sistema, de acordo com qualquer uma das reivindicações 1 a 4, caracterizado por a fonte de energia pulsada compreender ultrassom pulsado com uma frequência entre aproximadamente 1MHz e 5MHz, uma duração de trem entre aproximadamente 0,1 e 0,5 segundo e um ciclo de trabalho entre aproximadamente 2% a 10%.
14. Sistema, de acordo com a reivindicação 13, caracterizado por o ultrassom ter uma potência entre aproximadamente 0,46 e 28,6 watts.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US14/922,885 | 2015-10-26 | ||
| US14/922,885 US9427602B2 (en) | 2012-05-25 | 2015-10-26 | Pulsating electromagnetic and ultrasound therapy for stimulating targeted heat shock proteins and facilitating protein repair |
| US15/214,726 | 2016-07-20 | ||
| US15/214,726 US10531908B2 (en) | 2012-05-25 | 2016-07-20 | Method for heat treating biological tissues using pulsed energy sources |
| PCT/US2016/046043 WO2017074532A1 (en) | 2015-10-26 | 2016-08-08 | Method for heat treating biological tissues using pulsed energy sources |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112018008359A2 BR112018008359A2 (pt) | 2018-10-23 |
| BR112018008359B1 true BR112018008359B1 (pt) | 2022-10-18 |
Family
ID=58631061
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112018008359-3A BR112018008359B1 (pt) | 2015-10-26 | 2016-08-08 | Sistema adaptado para tratamento térmico de tecidos biológicos |
Country Status (9)
| Country | Link |
|---|---|
| EP (1) | EP3368153A4 (pt) |
| JP (4) | JP7125117B2 (pt) |
| CN (1) | CN108136195A (pt) |
| AU (2) | AU2016346526B2 (pt) |
| BR (1) | BR112018008359B1 (pt) |
| CA (1) | CA2996981C (pt) |
| HK (1) | HK1252432A1 (pt) |
| SG (1) | SG11201801331UA (pt) |
| WO (1) | WO2017074532A1 (pt) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20190022405A1 (en) * | 2016-02-13 | 2019-01-24 | Lumenis Ltd. | Apparatus and cosmetic method for treating hyperhidrosis |
| GB2587031A (en) * | 2019-09-16 | 2021-03-17 | Creo Medical Ltd | Electrosurgical apparatus for treating biological tissue with microwave energy, and method for controlling microwave energy |
| KR102355947B1 (ko) * | 2021-03-23 | 2022-02-08 | 어썸레이 주식회사 | 전자기파를 이용한 염증성 질환의 치료, 억제 및 예방을 위한 치료 장치 및 방법 |
| CN114818412B (zh) * | 2022-03-18 | 2022-09-27 | 北京航空航天大学 | 一种人脑受电磁辐射的高精度计算方法 |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4825880A (en) * | 1987-06-19 | 1989-05-02 | The Regents Of The University Of California | Implantable helical coil microwave antenna |
| JPH01135367A (ja) * | 1987-11-20 | 1989-05-29 | Olympus Optical Co Ltd | レーザ光照射装置 |
| JPH02252469A (ja) * | 1989-03-27 | 1990-10-11 | Olympus Optical Co Ltd | 生体深部治療装置 |
| US6156028A (en) * | 1994-03-21 | 2000-12-05 | Prescott; Marvin A. | Method and apparatus for therapeutic laser treatment of wounds |
| US5983141A (en) * | 1996-06-27 | 1999-11-09 | Radionics, Inc. | Method and apparatus for altering neural tissue function |
| DE19823947A1 (de) * | 1998-05-28 | 1999-12-02 | Baasel Carl Lasertech | Verfahren und Vorrichtung zum oberflächlichen Erwärmen von Gewebe |
| WO2000023147A1 (en) * | 1998-10-20 | 2000-04-27 | Dornier Medtech Holding International Gmbh | Thermal therapy with tissue protection |
| CA2398238A1 (en) * | 2000-01-25 | 2001-08-02 | Palomar Medical Technologies, Inc. | Method and apparatus for medical treatment utilizing long duration electromagnetic radiation |
| JP2006500972A (ja) * | 2002-06-19 | 2006-01-12 | パロマー・メディカル・テクノロジーズ・インコーポレイテッド | ある深さの組織を輻射熱によって治療する方法および装置 |
| KR20050062597A (ko) * | 2002-10-07 | 2005-06-23 | 팔로마 메디칼 테크놀로지스, 인코포레이티드 | 포토바이오스티뮬레이션을 수행하기 위한 장치 및 방법 |
| CA2512161A1 (en) * | 2003-01-28 | 2004-08-12 | Shanghai Sunway Biotech Co., Ltd | Hyperthermia oncolysis co-therapy |
| JP2005087282A (ja) * | 2003-09-12 | 2005-04-07 | Matsushita Electric Ind Co Ltd | レーザ治療装置 |
| JP2005224505A (ja) * | 2004-02-16 | 2005-08-25 | Terumo Corp | 光照射装置 |
| BRPI0509744A (pt) * | 2004-04-09 | 2007-09-25 | Palomar Medical Tech Inc | métodos e produtos para produção de látices de ilhotas tratadas com emr em tecidos e seus usos |
| BRPI0615974A2 (pt) * | 2005-07-27 | 2011-05-31 | Univ Florida | uso de choque térmico para tratar uma doença ocular em um indivìduo, método para recrutar uma célula-tronco para um tecido ocular de um indivìduo com necessidade da mesma, uso de choque térmico para tratar uma doença ou um distúrbio ocular em um indivìduo com necessidade do mesmo, uso de choque térmico para regenerar a retina em um indivìduo com necessidade do mesmo, uso de choque térmico para reparar os danos ao epitélio pgmentar da retina em um indivìduo com necessidade do mesmo, uso de choque térmico para tratar a degeneração macular em um indivìduo com necessidade do mesmo, composição farmacêutica para o recrutamento de células-tronco, composição farmacêutica para recrutamento de células-tronco em um tecido ocular, kit e método para identificar um agente que aumenta o recrutamento de células-tronco em um tecido ocular |
| KR20090034925A (ko) * | 2006-06-27 | 2009-04-08 | 팔로마 메디칼 테크놀로지스, 인코포레이티드 | 핸드헬드 광미용 장치 |
| US7909781B2 (en) * | 2006-08-22 | 2011-03-22 | Schwartz Donald N | Ultrasonic treatment of glaucoma |
| US20080076958A1 (en) * | 2006-09-21 | 2008-03-27 | Alma Lasers Ltd. | Method And Apparatus For Treating A Fungal Nail Infection With Shortwave And/Or Microwave Radiation |
| US20100049180A1 (en) * | 2007-10-19 | 2010-02-25 | Lockheed Martin Corporation | System and method for conditioning animal tissue using laser light |
| WO2008049082A2 (en) * | 2006-10-18 | 2008-04-24 | Minnow Medical, Inc. | Inducing desirable temperature effects on body tissue |
| US9403029B2 (en) * | 2007-07-18 | 2016-08-02 | Visualase, Inc. | Systems and methods for thermal therapy |
| US8174267B2 (en) * | 2008-09-30 | 2012-05-08 | Vivant Medical, Inc. | Intermittent microwave energy delivery system |
| US8141557B2 (en) * | 2008-10-22 | 2012-03-27 | Peyman Gholam A | Method of oscillatory thermotherapy of biological tissue |
| CA2786262A1 (en) * | 2010-01-07 | 2011-07-14 | Cheetah Omni, Llc | Fiber lasers and mid-infrared light sources in methods and systems for selective biological tissue processing and spectroscopy |
| JP5664996B2 (ja) * | 2010-03-29 | 2015-02-04 | 国立大学法人秋田大学 | 超音波照射装置 |
| US10219947B2 (en) * | 2012-05-25 | 2019-03-05 | Ojai Retinal Technology, Llc | System and process for retina phototherapy |
| WO2014040014A1 (en) | 2012-09-10 | 2014-03-13 | Dermal Photonics Corporation | Systems and methods for usage replenishment |
| EP2914193B1 (en) * | 2012-11-01 | 2021-07-28 | Seminex Corporation | Variable intensity laser treatments of the skin |
-
2016
- 2016-08-08 BR BR112018008359-3A patent/BR112018008359B1/pt active IP Right Grant
- 2016-08-08 EP EP16860435.3A patent/EP3368153A4/en active Pending
- 2016-08-08 CA CA2996981A patent/CA2996981C/en active Active
- 2016-08-08 JP JP2018507578A patent/JP7125117B2/ja active Active
- 2016-08-08 AU AU2016346526A patent/AU2016346526B2/en active Active
- 2016-08-08 CN CN201680055265.9A patent/CN108136195A/zh active Pending
- 2016-08-08 SG SG11201801331UA patent/SG11201801331UA/en unknown
- 2016-08-08 WO PCT/US2016/046043 patent/WO2017074532A1/en active Application Filing
-
2018
- 2018-09-12 HK HK18111733.9A patent/HK1252432A1/zh unknown
-
2020
- 2020-08-07 AU AU2020213374A patent/AU2020213374B2/en active Active
-
2022
- 2022-05-13 JP JP2022079630A patent/JP7353671B6/ja active Active
- 2022-05-13 JP JP2022079631A patent/JP2022124488A/ja active Pending
- 2022-05-13 JP JP2022079632A patent/JP2022119821A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2017074532A1 (en) | 2017-05-04 |
| CA2996981C (en) | 2023-08-01 |
| AU2020213374B2 (en) | 2021-04-29 |
| CN108136195A (zh) | 2018-06-08 |
| JP7353671B2 (ja) | 2023-10-02 |
| JP2018533992A (ja) | 2018-11-22 |
| EP3368153A4 (en) | 2019-02-27 |
| AU2016346526A1 (en) | 2018-03-15 |
| HK1252432A1 (zh) | 2019-05-24 |
| JP7353671B6 (ja) | 2023-10-20 |
| JP2022124488A (ja) | 2022-08-25 |
| CA2996981A1 (en) | 2017-05-04 |
| JP2022119821A (ja) | 2022-08-17 |
| AU2016346526B2 (en) | 2020-08-27 |
| AU2020213374A1 (en) | 2020-08-27 |
| BR112018008359A2 (pt) | 2018-10-23 |
| JP7125117B2 (ja) | 2022-08-24 |
| EP3368153A1 (en) | 2018-09-05 |
| SG11201801331UA (en) | 2018-05-30 |
| JP2022122878A (ja) | 2022-08-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10953241B2 (en) | Process for providing protective therapy for biological tissues or fluids | |
| US9427602B2 (en) | Pulsating electromagnetic and ultrasound therapy for stimulating targeted heat shock proteins and facilitating protein repair | |
| US10531908B2 (en) | Method for heat treating biological tissues using pulsed energy sources | |
| JP6778772B2 (ja) | 標的とされた熱ショックタンパク質を刺激する及びタンパク質修復を促進するためのパルス状の電磁療法および超音波治療法 | |
| JP7353671B6 (ja) | レーザー光を利用し熱ショックタンパク質の活性化を刺激するように適応させたシステム | |
| US20170203132A1 (en) | System and process utilizing pulsed energy to treat biological tissue | |
| CA3030483A1 (en) | Process for providing protective therapy for biological tissues or fluids | |
| US20200398072A1 (en) | Process utilizing pulsed energy to heat treat biological tissue | |
| JP7239990B2 (ja) | 生体組織を熱処置するためのパルスエネルギーを利用したプロセス | |
| WO2018169560A1 (en) | System and process utilizing pulsed energy to treat biological tissue |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 08/08/2016, OBSERVADAS AS CONDICOES LEGAIS |