[0001] A invenção refere-se a novos anticorpos 12G4 humanizados mutados e a fragmentos destes direcionados contra o receptor tipo II do hormônio anti-mülleriano.
[0002] O câncer de ovário é a principal causa de cânceres ginecológicos e é a quinta causa mais comum de mortalidade por câncer em mulheres, podendo ter as três origens histológicas a seguir: - o epitélio superficial (tumor epitelial com vários subtipos), que representa de 85% a 90% dos cânceres de ovário, - cordões sexuais/estroma (tumor da granulosa, 3% do total de cânceres de ovário), que representam cerca de 10% dos tumores de ovário, - células germinativas, que representam 5% dos cânceres de ovário.
[0003] Ele é geralmente assintomático durante os primeiros estágios, daí seu apelido de “assassino silencioso” (La Marca A., Volpe A. The Anti-Mullerian hormone and ovarian cancer. Human Reproduction Update, Vol.13, No.3 pp. 265 a 273, 2007).
[0004] Estes são os quatro estágios e prognósticos (classificação da FIGO: Federação Internacional de Ginecologia e Obstetrícia), dentre os quais a taxa de sobrevivência diminui consideravelmente a partir do estágio 2: Estágio I: Tumor limitado aos ovários (sobrevivência por 5 anos: 90% a 70%), Estágio II: Tumor em um ou dois ovários e extensão à pelve (sobrevivência por 5 anos: 70% a 40%), Estágio III: Tumor em um ou dois ovários e extensão ao exterior da pelve (sobrevivência por 5 anos: 20%), Estágio IV: Metástases distantes, excluindo metástases peritoneais (sobrevivência por 5 anos: menos de 10%),
[0005] (Fauci, Braunwald et al. Principles of internal medicine. Harrison's 17th edition / National Cancer Institute cancer.gov / CNGOF [Faculdades Nacionais Francesas de Ginecologistas e Obstetras]).
[0006] As principais estratégias adotadas para tratar o câncer de ovário são cirurgia e quimioterapia, em especial como tratamento de primeira linha, tal como uma mistura de carboplatina e paclitaxel.
[0007] Recentemente, também foram desenvolvidos anticorpos monoclonais como o cetuximab, o qual volta-se contra o receptor do fator de crescimento epidérmico (EGFR, Ozols R. F. et al., Focus on epithelial ovarian cancer, Cancer Cell. 2004, Jan; 5(1): 19 a 24).
[0008] Outros anticorpos monoclonais estão atualmente na fase III, tal como o abagovomad, voltado contra o CA-125, a Avastina, voltada contra o fator de crescimento endotelial vascular (VEGF-A), ou o farletuzumab, voltado contra o receptor-alfa de folato (FRA).
[0009] O hormônio anti-mülleriano humano é uma glicoproteína de 560 aminoácidos, um membro da família do TGF-β. Ele é um hormônio liberado pelas células de Sertoli do testículo fetal, causando assim a degeneração do duto de Müller.
[00010] Ele se expressa em adultos nas células de Sertoli e Leydig (testículos) e nas células da granulosa (ovário).
[00011] Ele tem papel na atividade do ovário adulto na regulação da foliculogênese.
[00012] O receptor tipo II do hormônio anti-mülleriano (AMHR-II) é um peptídeo de 573 aminoácidos e possui atividade de quinase serina-treonina.
[00013] Ele está envolvido na regressão do duto de Müller associada ao desenvolvido do sistema reprodutor humano. Ele atrofia nos homens, onde forma apenas a vesícula prostática e o hidátide séssil, mas perdura nas mulheres, onde dá origem às trompas de falópio, ao útero e à maior parte da vagina.
[00014] Esse receptor se expressa geralmente nas células epiteliais tumorais dos ovários humanos.
[00015] O pedido internacional WO 2008/053330 descreve um anticorpo monoclonal 12G4 murino voltado contra o AMHR-II para tratar de cânceres de ovário. No entanto, os versados na técnica bem sabem que a administração de anticorpos monoclonais murinos em seres humanos causa reações imunológicas.
[00016] Esse pedido internacional também menciona que o anticorpo pode ser quimérico ou humanizado, mas não o descreve como tal.
[00017] No entanto, anticorpos quiméricos também desencadeiam reações imunológicas, e anticorpos humanizados, levemente imunogênicos, têm a desvantagem de que sua afinidade de ligação a antígenos pode diminuir e, por conseguinte, eles podem se tornar menos ativos.
[00018] É possível, de acordo com este pedido, aumentar a referida afinidade mutando-se os aminoácidos presentes no anticorpo humanizado, em especial, modificando-se a sequência de peptídeos do anticorpo humanizado ao mesmo tempo em que se mantém o índice hidropático, isto é, sua hidrofobicidade e sua carga, por exemplo, pela substituição dos aminoácidos a seguir: substituição arginina-lisina ou glutamato-aspartato ou serina-treonina ou glutamina-asparagina ou valina- leucina-isoleucina.
[00019] Um dos objetivos da invenção consiste em proporcionar anticorpos 12G4 humanizados mutados, ou fragmentos destes, com afinidade ao menos igual à do anticorpo quimérico não-mutado correspondente, especificidade para o receptor AMHR-II e que não desencadeiam reações imunológicas.
[00020] Outro objetivo da invenção consiste em proporcionar meios para produzir os referidos anticorpos específicos do receptor AMHR-II.
[00021] A invenção também se refere ao uso desses anticorpos na qualidade de fármacos para tratar de cânceres de ovário.
[00022] A invenção refere-se a um anticorpo monoclonal 12G4 humanizado que compreende ou composto por: a) uma cadeia leve que compreende ou composta por: - uma região variável cuja sequência de aminoácidos é representada pela SEQ ID NO: 2 (sem líder) ou pela SEQ ID NO: 4 (com líder), e - uma região constante cuja sequência de aminoácidos é representada pela SEQ ID NO: 6 ou por uma sequência ao menos 80% homóloga a esta, b) uma cadeia pesada que compreende ou composta por: - uma região variável cuja sequência de aminoácidos é representada pela SEQ ID NO: 8 (sem líder) ou pela SEQ ID NO: 10 (com líder), e - uma região constante cuja sequência de aminoácidos é representada pela SEQ ID NO: 12 ou por uma sequência ao menos 80% homóloga a esta,
[00023] em que o referido anticorpo monoclonal 12G4 humanizado é mutado, compreende ao menos uma mutação na cadeia leve e/ou na cadeia pesada e possui uma KD para o receptor tipo II do hormônio anti-mülleriano humano (AMHRII) ao menos igual à do anticorpo monoclonal 12G4 quimérico que compreende ou é composto por: - uma região variável cuja sequência de aminoácidos é representada pela SEQ ID NO: 14 (sem líder), e - uma região constante cuja sequência de aminoácidos é representada pela SEQ ID NO: 6, b) uma cadeia pesada que compreende ou composta por: - uma região variável cuja sequência de aminoácidos é representada pela SEQ ID NO: 18 (sem líder) ou pela SEQ ID NO: 10 (com líder), e - uma região constante cuja sequência de aminoácidos é representada pela SEQ ID NO: 12,
[00024] no caso do referido receptor, de preferência, abaixo de 10-7M, em especial abaixo de 10-8M, em especial de 10-9M a 1011M.
[00025] Os anticorpos da invenção também apresentam afinidade ao menos igual a um terço ou um meio da afinidade do anticorpo 12G4 murino.
[00026] No decorrer da descrição, o sintagma entre parênteses “com líder” após o número de sequência indica que a referida sequência compreende o peptídeo de sinal ou a codificação de sequência para o peptídeo de sinal, isto é, o peptídeo que define que a proteína será segregada.
[00027] Por outro lado, o sintagma entre parênteses “sem líder” indica que a referida sequência não compreende o peptídeo de sinal ou a codificação de sequência para este.
[00028] A invenção baseia-se na descoberta dos inventores de que os anticorpos 12G4 humanizados mutados da invenção, embora apresentem ao menos uma mutação na CDR (três regiões que determinam o reconhecimento do antígeno) cujo índice hidropático não é respeitado, isto é, em uma região crucial para a afinidade e ligação ao antígeno e que, por via de regra, só permite substituições de aminoácidos do mesmo índice hidropático (por exemplo, arginina-lisina, glutamato-aspartato, serina- treonina, glutamina-asparagina ou valina-leucina-isoleucina), ainda assim apresentam as propriedades a seguir: - possuem uma KD para o receptor AMHR-II (determinada de acordo com o Exemplo 1) ao menos semelhante ou mesmo inferior à do anticorpo 12G4 quimérico correspondente e, portanto, uma afinidade superior ou igual à do anticorpo 12G4 quimérico correspondente para os anticorpos ou fragmentos de anticorpos da técnica anterior, - possuem especificidade para o receptor AMHR-II, - não desencadeiam reações imunológicas ou reações inferiores à do anticorpo murino.
[00029] A título exemplificativo, o Exemplo 1 representa a KD obtida com anticorpos da invenção produzidos em células CHO ou YB2/0.
[00030] No decorrer da descrição, os termos “12G4” e “LFB112”, também utilizado, denotam a mesma coisa e representam o mesmo anticorpo.
[00031] É possível determinar a afinidade dos referidos anticorpos por meio de um ensaio BIAcore, o qual é bem conhecido pelos versados na técnica.
[00032] Na invenção, o termo “anticorpo” refere-se a uma imunoglobulina, uma proteína multimérica composta por 4 cadeias que participa da resposta imunológica adquirida.
[00033] As imunoglobulinas são bem conhecidas pelos versados na técnica e compreendem um conjunto de dois dímeros, cada um composto por uma cadeia pesada e outra leve. O complexo multimérico é unido pela ligação de uma cadeia leve com uma cadeia pesada por uma ponte de bissulfeto entre duas cisteínas, as duas cadeias pesadas em si também sendo unidas por duas pontes de bissulfeto.
[00034] Cada uma das cadeias pesadas e leves compreende uma região constante e uma região variável. O conjunto de cadeias que compõe um anticorpo pode definir uma estrutura tridimensional em forma de Y, na qual - a base do Y corresponde à região constante Fc, a qual é reconhecida por complemento e pelos receptores Fc, e - as extremidades dos braços do Y correspondem aos respectivos conjuntos de regiões variáveis das cadeias leve e pesada.
[00035] Mais especificamente, cada cadeia leve compreende uma região variável (VL) e uma região constante (CL). Cada cadeia pesada compreende uma região variável (VH) e uma região constante composta por três domínios constantes CH1, CH2 e CH3. Os domínios CH2 e CH3 constroem o domínio Fc.
[00036] A figura 1 ilustra esquematicamente a estrutura de um anticorpo.
[00037] A região variável da cadeia leve compreende três regiões que determinam o reconhecimento do antígeno (CDR) cercadas por quatro regiões de estrutura (FR). A dobradura tridimensional da região variável é tal que as 3 CDRs são expostas do mesmo lado da proteína e permitem a formação de uma estrutura específica que reconhece um antígeno específico.
[00038] A figura 2 ilustra a estrutura em forma de cordão de pérolas de uma região variável de uma cadeia leve ou pesada de um anticorpo.
[00039] Os anticorpos descritos na invenção foram isolados e purificados e são diferentes dos anticorpos naturais porque são humanizados. Esses anticorpos são maduros, isto é, possuem uma estrutura tridimensional ad hoc que os permite reconhecer o antígeno, e possuem todas as modificações pós-translacionais essenciais para seu reconhecimento de antígenos, em especial glicosilação e a formação de pontes de bissulfeto intra e intermoleculares.
[00040] Eles são anticorpos monoclonais, isto é, só reconhecem um único determinante antigênico no receptor AMHR-II, à diferença dos anticorpos policlonais, que correspondem a uma mistura de anticorpos e, portanto, reconhecem vários determinantes antigênicos em uma mesma proteína.
[00041] Por “anticorpo monoclonal quimérico”, na invenção, entende-se um anticorpo isolado cuja sequência de cada cadeia leve e/ou pesada compreende ou é composta por uma sequência híbrida derivada de ao menos dois animais (ou seres humanos) diferentes.
[00042] Mais especificamente, o anticorpo 12G4 quimérico é um híbrido camundongo/ser humano, o que indica que uma região da sequência das cadeias leves e pesadas deriva da sequência de uma imunoglobulina 12G4 de camundongo e que o restante da sequência das referidas cadeias pesadas e das referidas cadeias leves e pesadas deriva da sequência de uma imunoglobulina humana, ou, como opção, de várias imunoglobulinas humanas.
[00043] A figura 18 dá o mapa do vetor de expressão para produzir o anticorpo 12G4 quimérico.
[00044] Por “anticorpo monoclonal 12G4 humanizado”, na invenção, entende-se um anticorpo isolado no qual somente as CDRs de cada cadeia leve e pesada do anticorpo 12G4, em especial murino, foram transplantadas nas cadeias leves e pesadas de um anticorpo humano.
[00045] A figura 19 dá o mapa do vetor de expressão para produzir o anticorpo 12G4 humanizado.
[00046] Doravante, as expressões “anticorpo 12G4 quimérico” e “anticorpo 12G4 quimérico não-mutado” denotarão o mesmo anticorpo.
[00047] Por “anticorpo monoclonal 12G4 humanizado mutado”, na invenção, entende-se um anticorpo monoclonal 12G4 humanizado no qual realizou-se ao menos uma mutação na região variável da cadeia leve e/ou na região constante da cadeia leve e/ou na região variável da cadeia pesada ou na região constante da cadeia pesada.
[00048] Portanto, a definição do anticorpo monoclonal humanizado mutado da invenção cobre tanto: - o precursor do anticorpo humanizado mutado, em especial o anticorpo ser humano/camundongo conforme definimos acima, quanto - o anticorpo humanizado mutado, em especial ser humano/camundongo, definido acima.
[00049] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende ao menos uma mutação em ao menos uma CDR na região variável da cadeia leve e com uma afinidade pelo referido receptor ao menos igual à do referido anticorpo monoclonal 12G4 quimérico.
[00050] Nessa concretização, quando uma única mutação se faz presente, ela se dá na CDR1 ou na CDR2 ou na CDR3.
[00051] Quando mais de uma mutação se faz presente, a segunda, bem como as outras, se dá na CDR1 e/ou na CDR2 e/ou na CR3 e/ou em qualquer outra região do anticorpo.
[00052] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende ainda ao menos uma mutação nas regiões FR da cadeia leve (VL).
[00053] Na presente invenção, os inventores descobriram que, ao realizar ao menos uma mutação na CDR1 ou na CDR2 ou na CDR3 do anticorpo 12G4 humanizado e ao menos uma mutação na região variável, em especial na FR da cadeia leve, a referida ao menos uma mutação não necessariamente respeita o índice hidropático dos aminoácidos, mas, ainda assim, possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com uma afinidade ao menos igual à do anticorpo quimérico não-mutado e que não ocasiona reações imunológicas ou de menor importância.
[00054] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende ao menos uma mutação na CDR1 e ao menos uma mutação nas regiões FR da cadeia leve (VL).
[00055] Na presente invenção, os inventores descobriram que, ao realizar ao menos uma mutação na CDR1 do anticorpo 12G4 humanizado e ao menos uma mutação na região variável, em especial na FR da cadeia leve, a referida ao menos uma mutação não necessariamente respeita o índice hidropático dos aminoácidos, mas, ainda assim, possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com uma afinidade ao menos igual à do anticorpo quimérico não-mutado e que não ocasiona reações imunológicas.
[00056] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende ao menos uma mutação na CDR2 e ao menos uma mutação nas regiões FR da cadeia leve (VL).
[00057] Na presente invenção, os inventores descobriram que, ao realizar ao menos uma mutação na CDR2 do anticorpo 12G4 humanizado e ao menos uma mutação na região variável, em especial na FR da cadeia leve, a referida ao menos uma mutação não necessariamente respeita o índice hidropático dos aminoácidos, mas, ainda assim, possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com uma afinidade ao menos igual à do anticorpo quimérico não-mutado e que não ocasiona reações imunológicas.
[00058] Em uma concretização vantajosa, a invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende ao menos uma mutação na CDR3 e ao menos uma mutação nas regiões FR da cadeia leve (VL).
[00059] Na presente invenção, os inventores descobriram que, ao realizar ao menos uma mutação na CDR3 do anticorpo 12G4 humanizado e ao menos uma mutação na região variável, em especial na FR da cadeia leve, a referida ao menos uma mutação não necessariamente respeita o índice hidropático dos aminoácidos, mas, ainda assim, possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com uma afinidade ao menos igual à do anticorpo quimérico não-mutado e que não ocasiona reações imunológicas.
[00060] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, com uma ADCC contra células, em especial Cov434, Asc 1 e META 2815, que expressam o receptor AMHR II particularmente superior à ADCC contra as mesmas células do referido anticorpo monoclonal 12G4 humanizado não-mutado.
[00061] A ADCC (toxicidade celular dependente de anticorpo) é um mecanismo no qual, quando o anticorpo reconhece um antígeno, a porção Fc do anticorpo é reconhecida por um receptor FCY de uma célula exterminadora que, após a ligação, é capaz de exterminar a célula que detém o antígeno.
[00062] Na presente invenção, os inventores descobriram que, ao realizar ao menos uma mutação em uma ou mais das CDRs do anticorpo 12G4 humanizado, a afinidade deste diminui particularmente em relação ao anticorpo quimérico ou murino correspondente (Exemplo 2) e que, embora a CDR corresponda a uma região de reconhecimento de antígenos particularmente grande, a referida ao menos uma mutação possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com afinidade ao menos igual à do anticorpo quimérico não-mutado e que não ocasiona reações imunológicas ou reações menos pronunciadas.
[00063] No contexto da presente invenção, a numeração adotada baseia-se na numeração de um fragmento ScFv, a cadeia pesada sendo numerada de 1 a 115 e a cadeia leve de 131 a 236, conforme ilustram as figuras 3A e 3B no caso do anticorpo 12G4 humanizado, onde as contas riscadas correspondem aos aminoácidos ausentes da referida sequência.
[00064] As duas cadeias são reunidas por um ligante que compreende os aminoácidos de 116 a 130.
[00065] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, no qual ao menos uma das referidas mutações em ao menos uma CDR na região variável da cadeia leve se dá na CDR presente na região que contém os aminoácidos de 179 a 184 da região variável da cadeia leve, cuja sequência de aminoácidos é representada pela SEQ ID NO: 2.
[00066] A região que contém os aminoácidos de 179 a 184 não corresponde à CDR completa.
[00067] Nessa concretização, se o anticorpo só tiver uma mutação, ela se dá na região da CDR da cadeia leve que contém os aminoácidos de 179 a 184.
[00068] Ele pode, certamente, incluir outras mutações em outras CDRs.
[00069] Na presente invenção, os inventores descobriram que, ao realizar ao menos uma mutação na região que compreende os aminoácidos de 179 a 184 na CDR do anticorpo 12G4 humanizado, a referida ao menos uma mutação possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com afinidade ao menos igual à do anticorpo quimérico não-mutado e que não ocasiona reações imunológicas.
[00070] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, no qual ao menos uma das mutações localizadas na CDR presente na região que contém os aminoácidos de 179 a 184 corresponde à substituição de ao menos um dos aminoácidos a seguir: S179P, E184K, E184G, E184D, S182F.
[00071] A notação adotada neste documento corresponde aos códigos de letra única familiares aos versados na técnica.
[00072] A notação S179P, por exemplo, significa que a serina do aminoácido na posição 179 é substituída por uma prolina.
[00073] Na presente invenção, os inventores descobriram que, quando ocorre ao menos uma mutação na região que compreende os aminoácidos de 179 a 184 na CDR do anticorpo 12G4 humanizado, a referida ao menos uma mutação não necessariamente respeita o índice hidropático dos aminoácidos substituídos, mas, ainda assim, possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com afinidade ao menos igual à do anticorpo quimérico não-mutado.
[00074] À guia de exemplo, a figura 17 ilustra a afinidade da ligação ao receptor AMHR-II por parte dos anticorpos humanizados mutados de acordo com a invenção. O anticorpo 6B_78 só possui uma mutação localizada na CDR na região variável da cadeia leve (E184K), na qual um ácido glutâmico é substituído por uma lisina, por exemplo, substituição de um aminoácido ácido por um aminoácido básico, o qual, portanto, possui uma carga totalmente diferente, uma vez que oposta, e, ainda assim, exibe atividade e, em especial, afinidade apreciavelmente melhores do que as do anticorpo 12G4 humanizado não-mutado e iguais às do anticorpo 12G4 quimérico não- mutado sem ocasionar reações imunológicas.
[00075] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende ainda ao menos uma mutação nas regiões FR da cadeia leve (VL).
[00076] Na presente invenção, os inventores descobriram que, ao realizar ao menos uma mutação na região que compreende os aminoácidos de 179 a 184 na CDR do anticorpo 12G4 humanizado e ao menos uma mutação na região variável, em especial na FR da cadeia leve, a referida ao menos uma mutação não necessariamente respeita o índice hidropático dos aminoácidos, mas, ainda assim, possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com afinidade ao menos igual à do anticorpo quimérico não-mutado e que não ocasiona reações imunológicas.
[00077] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende ainda ao menos uma mutação na cadeia pesada.
[00078] Na presente invenção, os inventores descobriram que, ao realizar ao menos uma mutação na região que compreende os aminoácidos de 179 a 184 na CDR do anticorpo 12G4 humanizado, ao menos uma mutação na região variável, em especial na FR da cadeia leve, e ao menos uma mutação na cadeia pesada, a referida ao menos uma mutação não necessariamente respeita o índice hidropático dos aminoácidos, mas, ainda assim, possibilita não só preservar a atividade do anticorpo humanizado como também obter um anticorpo humanizado mutado com afinidade ao menos igual à do anticorpo quimérico não-mutado e que não ocasiona reações imunológicas.
[00079] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, no qual ao menos uma das referidas mutações nas regiões FR da cadeia leve (VL) se dá na região FR adjacente à região que contém os aminoácidos de 179 a 184.
[00080] À guia de exemplo, a figura 17 e as tabelas I e VII (fixação no alvo AMHRII-Fc determinada por ELISA) demonstram a afinidade de ligação ao receptor AMHR-II por parte do anticorpo humanizado mutado de acordo com a invenção.
[00081] Sendo assim, o anticorpo 3C_23 possui três mutações: - uma mutação na CDR na região variável da cadeia leve (S179P), na qual substitui-se uma serina por uma prolina, isto é, substituição de um aminoácido hidrófilo por um aminoácido hidrófobo, - uma mutação na região variável, em especial na FR da cadeia leve (I177T), isto é, substituição de um aminoácido hidrófobo por um aminoácido hidrófilo, o qual possui um valor completamente diferente do índice hidropático, de acordo com o pedido internacional WO 2008/053330 (+4,5 no caso da isoleucina e -0,7 no caso da treonina), e - uma mutação na cadeia pesada (Q3R), isto é, substituição de uma glutamina por uma arginina para as quais o valor do índice hidropático, de acordo com o pedido internacional WO 2008/053330, varia de - 3,5 no caso da glutamina e -4,5 no caso da arginina,
[00082] e possui ainda uma afinidade apreciavelmente melhor do que a do anticorpo 12G4 humanizado não-mutado e superior à do anticorpo 12G4 quimérico não-mutado.
[00083] Ademais, o anticorpo 3C_23K, que, além das mutações do anticorpo 3D_23, possui uma segunda mutação na CDR na região variável da cadeia leve (E184K) na qual um ácido glutâmico é substituído por uma lisina, isto é, substituição de um aminoácido ácido por uma aminoácido básico, o qual, portanto, possui uma carga totalmente diferente, uma vez que de sinal oposto, ainda assim, exibe atividade e, em especial, afinidade apreciavelmente melhores do que as do anticorpo 12G4 humanizado não-mutado e superiores às do anticorpo 12G4 quimérico não-mutado sem ocasionar reações imunológicas.
[00084] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, no qual ao menos uma das referidas mutações nas regiões FR da cadeia leve (VL) corresponde à substituição de ao menos um dos aminoácidos a seguir: I132T, A143T, T150A, S158P, L175Q, I177T, Y178H, V187A, S192T, G197D, F212S.
[00085] Em uma concretização vantajosa, a presente invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, no qual ao menos uma das referidas mutações na cadeia pesada corresponde à substituição de ao menos um dos aminoácidos a seguir: Q1E, Q3E, Q3R, Q6E, A9T, V11A, K12R, K13R, K19E, V20A, A24G, A24V, A24T, Q39E, A40V, S31G, L45P, D56N, A76T, A79T, R87G, T58A, Q62R, V67M, I70N, T74A, S77P, A79T, S88P, E89D, F102S, A103T, L110P, S114T.
[00086] Em uma concretização vantajosa, a invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende uma cadeia leve e uma cadeia pesada selecionadas dentre: a) uma cadeia leve que compreende ou composta por uma região variável cuja sequência de aminoácidos é representada pela SEQ ID NO: 2 na qual realizou-se ao menos uma das substituições de aminoácidos localizados em uma das CDRs a seguir: S179P, E184K, E184G, E184D, S182F, ou uma cadeia leve que compreende ou composta por uma região variável cuja sequência de aminoácidos é representada pela SEQ ID NO: 2 na qual realizou-se ao menos uma das substituições de aminoácidos localizados em uma das CDRs a seguir: S179P, E184K, E184G, E184D, S182F, e ao menos uma das substituições de aminoácidos localizados nas regiões FR a seguir: I132T, A143T, T150A, S158P, L175Q, Y178H, V187A, S192T, G197D, F212S, e por uma região constante cuja sequência de aminoácidos é representada pela SEQ ID NO: 6, b) uma cadeia pesada cuja sequência de aminoácidos é representada pela SEQ ID NO: 58 na qual realizou-se uma substituição de ao menos um dos aminoácidos a seguir: Q1E, Q3E, Q3R, Q6E, A9T, V11A, K12R, K13R, K19E, V20A, A24G, A24V, A24T, Q39E, A40V, S31G, L45P, D56N, A76T, A79T, R87G, T58A, Q62R, V67M, I70N, T74A, S77P, A79T, S88P, E89D, F102S, A103T, L110P, S114T.
[00087] A tabela VII do Exemplo 3 traz os vários clones obtidos e suas substituições. Ela também demonstra que o índice hidropático varia consideravelmente em função das mutações, mas sem levar à perda de atividade e/ou afinidade ao antígeno e possibilitando até mesmo, no caso de certos clones, obter aumento na afinidade em relação ao anticorpo quimérico correspondente (razão Ab da invenção/anticorpo quimérico superior ou igual a 1).
[00088] Nessa concretização, é possível construir um anticorpo derivado da combinação de dois anticorpos obtidos previamente e aumentar ainda mais a atividade e a afinidade pelo receptor AMHR-II em relação ao anticorpo 12G4 quimérico não-mutado.
[00089] Em uma concretização vantajosa, a invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que compreende uma cadeia leve e uma cadeia pesada selecionadas dentre: a) uma cadeia leve que compreende ou composta por uma região variável cuja sequência de aminoácidos é representada pela: - SEQ ID NO: 22 (sem líder) ou SEQ ID NO: 24 (com líder), ou - SEQ ID NO: 30 (sem líder) ou SEQ ID NO: 32 (com líder), ou - SEQ ID NO: 34 (sem líder) ou SEQ ID NO: 36 (com líder), ou - SEQ ID NO: 46 (sem líder) ou SEQ ID NO: 48 (com líder), e por uma região constante cuja sequência de aminoácidos é representada pela SEQ ID NO: 6, b) uma cadeia pesada que compreende ou composta por uma região variável cuja sequência de aminoácidos é representada pela: - SEQ ID NO: 38 (sem líder) ou SEQ ID NO: 40 (com líder), - SEQ ID NO: 26 (sem líder) ou SEQ ID NO: 28 (com líder), - SEQ ID NO: 8 (sem líder) ou SEQ ID NO: 10 (com líder), - SEQ ID NO: 42 (sem líder) ou SEQ ID NO: 44 (com líder), - SEQ ID NO: 50 (sem líder) ou SEQ ID NO: 52 (com líder),
[00090] e por uma região constante cuja sequência de aminoácidos é representada pela SEQ ID NO: 12.
[00091] Em uma concretização vantajosa, a invenção refere-se a um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, que possui: a) uma cadeia leve composta pela sequência de aminoácidos representada pela: líder), e - SEQ ID NO: 70 (sem líder) ou SEQ ID NO: 72 (com b) uma cadeia pesada composta pela sequência de aminoácidos representada pela: - SEQ ID NO: 74 (sem líder) ou SEQ ID NO: 76 (com líder), (anticorpo 3C_23) ou a) uma cadeia leve composta pela sequência de aminoácidos representada pela: líder), e - SEQ ID NO: 78 (sem líder) ou SEQ ID NO: 80 (com b) uma cadeia pesada composta pela sequência de aminoácidos representada pela: - SEQ ID NO: 58 (sem líder) ou SEQ ID NO: 60 (com líder), (anticorpo 6B_78) ou a) uma cadeia leve composta pela sequência de aminoácidos representada pela: líder), e - SEQ ID NO: 82 (sem líder) ou SEQ ID NO: 84 (com b) uma cadeia pesada composta pela sequência de aminoácidos representada pela: - SEQ ID NO: 86 (sem líder) ou SEQ ID NO: 88 (com líder), (anticorpo 3C_23K) ou a) uma cadeia leve composta pela sequência de aminoácidos representada pela: líder), e - SEQ ID NO: 78 (sem líder) ou SEQ ID NO: 80 (com b) uma cadeia pesada composta pela sequência de aminoácidos representada pela: - SEQ ID NO: 90 (sem líder) ou SEQ ID NO: 92 (com líder), (anticorpo 4C_35) ou a) uma cadeia leve composta pela sequência de aminoácidos representada pela: - SEQ ID NO: 94 (sem líder) ou SEQ ID NO: 96 (com líder), e b) uma cadeia pesada composta pela sequência de aminoácidos representada pela: - SEQ ID NO: 98 (sem líder) ou SEQ ID NO: 100 (com líder), (anticorpo 5B_42)
[00092] De acordo com outro aspecto, a invenção refere- se a um fragmento de um anticorpo monoclonal 12G4 humanizado mutado, conforme definimos acima, selecionado dentre o grupo de fragmentos composto por: Fv, Fab, F(ab')2, Fab', dsFv, scFv, Sc(Fv)2, “diacorpos”.
[00093] De acordo com outro aspecto, a invenção refere- se a um ácido nucleico que compreende ou composto por uma codificação de sequência para a cadeia leve de um anticorpo monoclonal definido acima e/ou que compreende ou composto por uma codificação de sequência para a cadeia pesada do anticorpo monoclonal definido acima.
[00094] Em uma concretização vantajosa, a invenção refere-se a um ácido nucleico definido acima no qual a codificação de sequência para a cadeia leve compreende ou consiste nas sequências a seguir: a) uma codificação de sequência para a região variável da cadeia leve representada pela SEQ ID NO: 53 na qual realizou-se uma substituição de ao menos um códon, permitindo assim a substituição, em uma das CDRs, de um ou mais dos aminoácidos a seguir: S179P, E184K, E184G, E184D, S182F, ou b) uma codificação de sequência para a região variável da cadeia leve representada pela SEQ ID NO: 53 na qual: - realizou-se ao menos uma substituição de um códon, permitindo assim a substituição, em uma das CDRs, de um ou mais dos aminoácidos a seguir: S179P, E184K, E184G, E184D, S182F, e - realizou-se ao menos uma substituição de ao menos um códon, permitindo assim a substituição, em uma das FRs, de um ou mais dos aminoácidos a seguir: I132T, A143T, T150A, S158P, L175Q, I177T, Y178H, V187A, S192T, G197D, F212S,
[00095] e uma codificação de sequência para a região constante representada pela SEQ ID NO: 5.
[00096] Em uma concretização vantajosa, a invenção refere-se a um ácido nucleico definido acima no qual a codificação de sequência para a cadeia pesada compreende ou consiste nas sequências a seguir: a) SEQ ID NO: 57, na qual realizou-se uma substituição de ao menos um códon, permitindo assim a substituição de um ou mais dos aminoácidos a seguir: Q1E, Q3E, Q3R, Q6E, A9T, V11A, K12R, K13R, K19E, V20A, A24G, A24V, A24T, Q39E, A40V, S31G, L45P, D56N, A76T, A79T, R87G, T58A, Q62R, V67M, I70N, T74A, S77P, A79T, S88P, E89D, F102S, A103T, L110P, S114T.
[00097] Em uma concretização vantajosa, a invenção refere-se a um ácido nucleico, conforme definimos acima, que compreende uma das cadeias leves definidas acima e uma das cadeias pesadas definidas acima.
[00098] Em uma concretização vantajosa, a invenção refere-se a um ácido nucleico definido acima no qual a codificação de sequência para a cadeia leve compreende ou consiste em uma codificação de sequência para uma região variável e uma codificação de sequência para uma região constante selecionadas dentre as seguintes: a) região variável: - SEQ ID NO: 21 (sem líder) ou SEQ ID NO: 23 (com líder), ou - SEQ ID NO: 29 (sem líder) ou SEQ ID NO: 31 (com líder), ou - SEQ ID NO: 33 (sem líder) ou SEQ ID NO: 35 (com líder), ou - SEQ ID NO: 45 (sem líder) ou SEQ ID NO: 47 (com líder), ou b) região constante - SEQ ID NO: 5.
[00099] Em uma concretização vantajosa, a invenção refere-se a um ácido nucleico definido acima no qual a codificação de sequência para a cadeia pesada compreende ou consiste em uma codificação de sequência para uma região variável e uma codificação de sequência para uma região constante selecionadas dentre as seguintes: a) região variável: - SEQ ID NO: 25 (sem líder) ou SEQ ID NO: 27 (com líder), ou - SEQ ID NO: 7 (sem líder) ou SEQ ID NO: 9 (com líder), ou - SEQ ID NO: 37 (sem líder) ou SEQ ID NO: 39 (com líder), ou - SEQ ID NO: 41 (sem líder) ou SEQ ID NO: 43 (com líder), ou - SEQ ID NO: 49 (sem líder) ou SEQ ID NO: 51 (com líder), b) região constante - SEQ ID NO: 11.
[000100] Em uma concretização vantajosa, a invenção refere-se a um ácido nucleico definido acima no qual a codificação de sequência para a cadeia leve é selecionada dentre as sequências a seguir: - SEQ ID NO: 69 (sem líder) ou SEQ ID NO: 71 (com líder), ou - SEQ ID NO: 77 (sem líder) ou SEQ ID NO: 79 (com líder), ou - SEQ ID NO: 81 (sem líder) ou SEQ ID NO: 83 (com líder), ou - SEQ ID NO: 93 (sem líder) ou SEQ ID NO: 95 (com líder), e a codificação de sequência para a cadeia pesada é selecionada dentre as sequências a seguir: - SEQ ID NO: 73 (sem líder) ou SEQ ID NO: 75 (com líder), ou - SEQ ID NO: 57 (sem líder) ou SEQ ID NO: 59 (com líder), ou - SEQ ID NO: 85 (sem líder) ou SEQ ID NO: 87 (com líder), ou - SEQ ID NO: 89 (sem líder) ou SEQ ID NO: 91 (com líder), ou - SEQ ID NO: 97 (sem líder) ou SEQ ID NO: 99 (com líder).
[000101] Em uma concretização vantajosa, a invenção refere-se a um ácido nucleico definido acima no qual a codificação de sequência para a cadeia leve e a codificação de sequência para a cadeia pesada são conforme o seguinte: a) codificação de sequência para a cadeia leve: SEQ ID NO: 69 (sem líder) ou SEQ ID NO: 71 (com líder), e b) codificação de sequência para a cadeia pesada: SEQ ID NO: 73 (sem líder) ou SEQ ID NO: 75 (com líder), (anticorpo 3C_23) ou a) codificação de sequência para a cadeia leve: SEQ ID NO: 77 (sem líder) ou SEQ ID NO: 79 (com líder), e b) codificação de sequência para a cadeia pesada: SEQ ID NO: 57 (sem líder) ou SEQ ID NO: 59 (com líder), (anticorpo 6B_78) ou b) codificação de sequência para a cadeia leve: SEQ ID NO: 81 (sem líder) ou SEQ ID NO: 83 (com líder), e b) codificação de sequência para a cadeia pesada: SEQ ID NO: 85 (sem líder) ou SEQ ID NO: 87 (com líder), (anticorpo 3C_23K) ou a) codificação de sequência para a cadeia leve: SEQ ID NO: 77 (sem líder) ou SEQ ID NO: 79 (com líder), e b) codificação de sequência para a cadeia pesada: SEQ ID NO: 89 (sem líder) ou SEQ ID NO: 91 (com líder), (anticorpo 4C_35) ou a) codificação de sequência para a cadeia leve: SEQ ID NO: 93 (sem líder) ou SEQ ID NO: 95 (com líder), e b) codificação de sequência para a cadeia pesada: SEQ ID NO: 97 (sem líder) ou SEQ ID NO: 99 (com líder), (anticorpo 5B_42).
[000102] De acordo com outro aspecto, a invenção refere-se a um vetor de expressão que compreende ao menos um acido nucleico definido acima, o referido ácido nucleico estando sob controle dos elementos que permitem sua expressão.
[000103] “Vetor de expressão” define, na invenção, uma molécula de DNA que possui elementos que permitem sua replicação (duplicação) em ao menos um organismo vivo. Esses elementos que permitem a replicação são, mais especificamente, origens de replicação em levedura ou bactérias, ou elementos que controlam a replicação de um vírus.
[000104] Os vetores de acordo com a invenção são, em específico, plasmídios, fagos, cromossomos artificiais de levedura (YAC), cromossomos artificiais bacterianos (BAC), genomas modificados de vírus replicativos ou de vírus integrativos etc.
[000105] Esses vetores são chamados de “vetores de expressão” porque possuem sequências de nucleotídeos que permitem a expressão, isto é, a transcrição para RNA, das sequências de nucleotídeos que controlam.
[000106] Na invenção, a referida sequência de ácidos nucleicos presente no referido vetor é posta “sob controle dos elementos que permitem sua expressão”. Isso significa que o referido vetor de expressão possui ao menos uma sequência de iniciação de transcrição, tal como um promotor de um vírus, por exemplo, o promotor precoce do vírus símio SV40 ou do Citomegalovírus (CMV), ou sequências de promotores do vírus Rous sarcoma (RSV) e, em especial, uma sequência ou promotor que compreende uma caixa TATA. Ademais, o referido vetor também possui ao menos uma sequência de terminação de transcrição e, em especial, uma sequência de poliadenilação, derivada de um gene mamífero, em especial humano.
[000107] A essas sequências, indispensáveis à expressão da sequência de nucleotídeos contida no referido vetor, é possível acrescentar outras sequências para regular ou modular a expressão da referida sequência. Uma lista não-limitante inclui: íntrons de genes mamíferos e, em especial, humanos, sequências para regular a transcrição do tipo intensificador ou sequências de genes mamíferos e, em especial, humanos que foram transcritas, mas não traduzidas.
[000108] Uma concretização vantajosa da invenção refere-se a um vetor de expressão, conforme definimos acima, que compreende ao menos um ácido nucleico selecionado dentre os ácidos nucleicos que compreendem as sequências a seguir: SEQ ID NO 59, 71, 75, 79, 83, 87, 91, 95 ou 99.
[000109] Em outra concretização vantajosa, a invenção refere-se a um vetor de expressão, conforme definimos acima, que compreende: - um primeiro ácido nucleico selecionado dentre os ácidos nucleicos com as sequências a seguir: SEQ ID NO 71, 79, 83 ou 95, o referido primeiro ácido nucleico estando sob controle dos elementos que permitem sua expressão, e - um segundo ácido nucleico selecionado dentre os ácidos nucleicos com as sequências a seguir: SEQ ID NO 59, 75, 87, 91 ou 99, o referido segundo ácido nucleico estando sob controle dos elementos que permitem sua expressão.
[000110] Esse vetor de expressão, portanto, compreende duas sequências supramencionadas de ácidos nucleicos e, mais especificamente, compreende uma codificação de sequência de ácidos nucleicos para a cadeia leve do anticorpo monoclonal definido acima e uma codificação de sequência de ácidos nucleicos para a cadeia pesada do anticorpo monoclonal definido acima.
[000111] De preferência, o referido vetor de expressão contém um primeiro elemento, o qual permite a expressão da codificação de sequência de ácidos nucleicos para a cadeia leve do anticorpo monoclonal definido acima, e um segundo elemento, o qual permite a expressão da codificação da sequência de ácidos nucleicos para a cadeia pesada do anticorpo monoclonal definido acima, os referidos elementos primeiro e segundo, que permitem a expressão das referidas sequências de ácidos nucleicos, sendo idênticos ou diferentes, de preferência idênticos. Esses elementos de controle são, em especial, as sequências de repetição terminal longa (LTR) do vírus RSV.
[000112] Outra concretização da invenção refere-se a um vetor de expressão definido acima, o qual compreende ao menos um gene de resistência a antibióticos.
[000113] Por “ao menos um gene de resistência”, na invenção, entende-se que o referido vetor de expressão pode conter 1 ou 2 ou 3 ou 4 ou 5 ou 6 genes de resistência a antibióticos.
[000114] “Gene de resistência a antibióticos” define, na invenção, um gene cujo produto da expressão exerce um efeito citostático (inibição de crescimento) ou citolítico (morte celular) nas células. Os antibióticos aos quais a invenção se refere, em especial, atuam sobre células procarióticas, mas também podem atuar sobre células eucarióticas, sejam elas de leveduras, plantas, insetos, anfíbios ou mamíferos.
[000115] Mais especificamente, o vetor de expressão supramencionado possui um gene de resistência a antibióticos específico para células procarióticas e ao menos um gene de resistência a antibióticos específico para células eucarióticas (de preferência dois).
[000116] Como antibióticos específicos para células procarióticas, podemos citar a ampicilina, a tetraciclina e seus derivados, a higromicina, a canamicina etc. Como antibióticos específicos para células eucarióticas, podemos citar o G418, a Geneticina (sais de G418), a puromicina, o metrotrexato, a blasticidina etc.
[000117] As unidades de transcrição (TUs) da codificação de interesse para a cadeia pesada e para a cadeia leve são clonadas na forma de cDNA e como submissas ao promotor de RSV. Esse promotor corresponde à LTR (repetição terminal longa) do vírus Rous sarcoma, o qual contém um elemento intensificador em sua região 5’.
[000118] Um íntron artificial otimizado para um splicing alternativo e composto por uma sequência de doação na região 5’ isolada da beta-globina humana e na região 3’ por uma sequência de aceitação derivada do gene da região variável da cadeia pesada da imunoglobulina é clonado imediatamente na região 3’ do promotor. As TUs de interesse são terminadas com sequências de poliadenilação derivadas do gene do hormônio de crescimento (GH) de origem humana (hGH) para a cadeia pesada e de origem bovina (bGH) para a cadeia leve. Essa diferença de origem na escolha das poliAs tem o objetivo de limitar recombinações entre os genes de interesse. Essa combinação de promotor LTRRSV, íntron quimérico, cDNA e sequência poliA foi selecionada porque confere alta atividade transcricional e translacional na linha celular YB2/0.
[000119] O vetor de expressão contém, além das TUs de interesse, várias TUs para resistência a moléculas químicas:
[000120] Gene Bla: este gene (chamado de Amp nos mapas de restrição dos vetores) expressa a enzima beta-lactamase na bactéria (promotor procariótico) e confere resistência à ampicilina.
[000121] Gene neo: este gene codifica a enzima npt II (neomicina-fosfotransferase II) sob controle do promotor SV40 e confere resistência a vários antibióticos, como a neomicina, a canamicina ou o G418, nas células mamíferas transfectadas que o expressam.
[000122] Gene Dhfr: este gene codifica a enzima DHFR (DiHidroFolato Redútase) sob controle do promotor SV40 e confere resistência ao metotrexato (MTX). Esse método pode ser adotado para a amplificação gênica aumentando-se a concentração de MTX, resultando assim em aumento na produção de anticorpos por parte das células transfectadas.
[000123] As figuras de 18 a 22 ilustram os mapas dos vetores de expressão utilizados para produzir os clones 3C_23, 6B_78, 3C_23K, 4C_35 e 5B_42.
[000124] Em outro aspecto, a invenção refere-se a uma célula hospedeira ou linha celular transformada por um ácido nucleico definido acima e/ou por um vetor de expressão definido acima. Mais especificamente, a referida célula ou linha celular é caracterizada por: - apresentar apoptose inferior a 25%, - ser estável durante divisões celulares, e - segregar ao menos 14 μg/ml dos anticorpos monoclonais definidos acima.
[000125] O conceito de estabilidade celular sugere que as células resultantes da clonagem das células clonadas derivadas das células que contêm ao menos um vetor que permite a expressão de um anticorpo monoclonal de acordo com a invenção são capazes, durante várias divisões, de conservar suas propriedades de resistência a antibióticos e de produzir anticorpos monoclonais.
[000126] Em ainda outro aspecto, a invenção refere-se a uma composição farmacêutica e, em especial, a uma composição vacinal que compreende ao menos: - um anticorpo monoclonal definido acima, ou - um ácido nucleico definido acima, ou - um vetor definido acima, ou - um fragmento do referido anticorpo monoclonal definido acima, junto com um veículo aceitável do ponto de vista farmacêutico.
[000127] Para maior vantagem, a invenção refere-se a uma composição farmacêutica, e, em especial, a uma composição vacinal, que compreende ao menos um anticorpo monoclonal definido acima junto com um veículo aceitável do ponto de vista farmacêutico.
[000128] A dosagem do ingrediente ativo depende, em especial, do método de administração e pode ser determinada com facilidade pelos versados na técnica.
[000129] Um “veículo aceitável do ponto de vista farmacêutico” refere-se a um material não-tóxico compatível com um sistema biológico, tal como uma célula, cultura celular, tecido ou organismo.
[000130] Uma quantidade terapeuticamente eficaz (dose unitária) pode variar de 0,01 mg/kg a 500 mg/kg, de preferência, de 0,1 mg/kg a 500 mg/kg, de preferência, de 0,1 mg/kg a 100 mg/kg, de preferência, de 0,1 mg/kg a 20 mg/kg, de preferência, de 0,1 mg/kg a 10 mg/kg e, mais preferencialmente, de 1 mg/kg a 10 mg/kg, em uma ou mais administrações semanais durante várias semanas ou meses.
[000131] Ademais, uma quantidade terapeuticamente eficaz (dose unitária) pode variar de 0,2 mg/m2 a 10 g/m2, de preferência, de 0,2 mg/m2 a 1 g/m2, de preferência, de 2 mg/m2 a 1 g/m2, de preferência, de 20 gm2 a 1 g/m2 e, mais preferencialmente, de 20 mg/m2 a 0,5 g/m2, em uma ou mais administrações semanais durante várias semanas ou meses.
[000132] A composição farmacêutica da invenção pode, em especial, ser administrada por via intravenosa, em especial por injeção ou por perfusão gradual, por via subcutânea, sistematicamente, localmente por infiltrações, per os ou por via respiratória ou pulmonar por meio de aerossol.
[000133] Os preparados para administração parenteral podem incluir suspensões, emulsões ou soluções estéreis aquosas ou não- aquosas. Exemplos de solventes não-aquosos incluem o propileno-glicol, o polietileno-glicol, óleos vegetais, tal como o óleo de oliva, ou ésteres orgânicos injetáveis, tal como o oleato de etila. Veículos aquosos compreendem água, soluções álcool/água, emulsões ou suspensões.
[000134] A forma farmacêutica vantajosa da composição farmacêutica da invenção pode ser administrada por via oral e compreende - um anticorpo monoclonal definido acima, ou - um ácido nucleico definido acima, ou - um vetor de expressão definido acima, ou - um fragmento do referido anticorpo monoclonal definido acima, junto com um excipiente, na presença ou ausência de um propelente.
[000135] Em uma concretização da invenção, o aerossol se dá na forma de um líquido que contém o anticorpo humanizado mutado e um excipiente. Os excipientes, com maior frequência, são álcoois, mas é possível utilizar qualquer outro excipiente conhecido pelos versados na técnica no contexto da invenção. O aerossol em forma líquida pode ser combinado a um gás propelente como o clorofluorocarbonos (CFCs) ou o hidrofluorocarbonos (HFAs).
[000136] O aerossol em forma líquida também pode compreender micropartículas de lipídios e um excipiente. Neste caso, os excipientes podem ser selecionados dentre a dipalmitoilfofatidilcolina (DPPC) sintética, a lactose ou o amido hidroxietílico (HES). As micropartículas são, então, administradas por meio de um insuflador.
[000137] Em outra concretização da invenção, o aerossol é na forma de pó. O pó é composto por partículas com tamanho entre 1 e 10 μm e, de preferência, menos de 9 μm ou, de preferência, menos de 5 μm. Como exemplo não-limitante, podem-se adotar os métodos a seguir para obter um pó seco: pulverização acompanhada por secagem por congelamento ou cristalização por ultrassom, ou precipitação direcionada.
[000138] O aerossol será administrado, dependendo de se está em forma líquida ou sólida, por meio de um nebulizador, o qual pode ser pneumático, ultrassônico ou do tipo em peneira, ou de um pulverizador de aerossol (de líquido pressurizado, mecânico, eletrohidrodinâmico, térmico), no caso das fórmulas líquidas, ou por meio de um inalador, no caso de fórmulas sólidas. (Reychler G., Dessanges JF e Vecellio L, Rev. Mal. Respir, 2007; 24: 1.013 a 1.023).
[000139] De acordo com outro aspecto, a invenção refere-se a um produto que compreende um primeiro preparado farmacêutico, o qual compreende um anticorpo monoclonal definido acima, e um segundo preparado farmacêutico, o qual compreende um composto anticancerígeno convencional, em especial o paclitaxel ou um sal de platina, em especial a oxaliplatina, a cisplatina ou a carboplatina, como um preparado combinado para uso simultâneo, à parte ou em sequência no tratamento de pacientes com doenças associadas ao receptor tipo II do hormônio anti-müleriano humano, em especial, câncer de ovário, em especial câncer de ovário metastático, câncer seroso, hipernofroma, endometrioide, epitélio coloidal, câncer de próstata, câncer de células germinativas, câncer de endométrio, tumor mülleriano misto maligno do útero, leiomiossarcoma, sarcoma do estroma endometrial.
[000140] De acordo com outro aspecto, a presente invenção refere-se ao uso de ao menos: - um anticorpo monoclonal definido acima, ou - um fragmento do referido anticorpo monoclonal definido acima, ou - um ácido nucleico definido acima, ou - um vetor definido acima, ou - uma célula definida acima, para preparar um fármaco destinado a tratar ou prevenir uma doença associada ao receptor tipo II do hormônio anti-mülleriano humano, em especial: câncer de ovário, em especial câncer de ovário metastático, câncer seroso, hipernofroma, endometrioide, epitélio coloidal, câncer de próstata, câncer de células germinativas, câncer de endométrio, tumor mülleriano misto maligno do útero, leiomiossarcoma, sarcoma do estroma endometrial.
[000141] Por “tratamento”, entende-se a maneira de tratar uma patologia desenvolvida cujos sintomas são visíveis. Por “prevenção”, entende-se a maneira de impedir o desenvolvimento da referida patologia.
[000142] Em uma concretização vantajosa, a presente invenção refere-se ao uso de um anticorpo definido acima, ou de um fragmento deste definido acima, para diagnosticar e/ou monitorar o câncer de ovário.
[000143] Em uma concretização vantajosa, a invenção refere-se ao uso de um anticorpo definido acima, ou de um fragmento deste definido acima, que compreende ainda um fármaco anticancerígeno convencional, em especial o paclitaxel ou um sal de platina, em especial a oxaliplatina, a cisplatina ou a carboplatina.
[000144] De acordo com outro aspecto, a invenção refere-se a: - um anticorpo monoclonal conforme definido acima, ou - um fragmento do referido anticorpo monoclonal conforme definido acima, ou - um ácido nucleico conforme definido acima, ou - um vetor conforme definido acima, ou - uma célula conforme definido acima, para uso no tratamento ou na prevenção de uma patologia associada ao receptor tipo II do hormônio anti-mülleriano humano, em especial: câncer de ovário, em especial câncer de ovário metastático, câncer seroso, hipernofroma, endometrioide, epitélio coloidal, câncer de próstata, câncer de células germinativas, câncer de endométrio, tumor mülleriano misto maligno do útero, leiomiossarcoma, sarcoma do estroma endometrial.
[000145] Em uma concretização vantajosa, utiliza-se o anticorpo monoclonal definido acima, ou um fragmento deste definido acima, para diagnosticar e/ou monitorar um câncer associado ao receptor tipo II do hormônio anti-mülleriano humano, em especial: câncer de ovário, em especial câncer de ovário metastático, câncer seroso, hipernofroma, endometrioide, epitélio coloidal, câncer de próstata, câncer de células germinativas, câncer de endométrio, tumor mülleriano misto maligno do útero, leiomiossarcoma, sarcoma do estroma endometrial.
[000146] Em uma concretização vantajosa, o anticorpo monoclonal definido acima, ou um fragmento deste definido acima, ou o ácido nucleico definido acima ou o vetor definido acima ou a célula definida acima compreende ainda um fármaco anticancerígeno convencional, em especial o paclitaxel ou um sal de platina, em especial a oxaliplatina, a cisplatina ou a carboplatina.
[000147] De acordo com outro aspecto, a presente invenção refere-se a um kit que contém ao menos: - um anticorpo monoclonal conforme definido acima, ou - um fragmento do referido anticorpo monoclonal conforme definido acima, ou - um ácido nucleico conforme definido acima, ou - um vetor conforme definido acima, ou - uma célula conforme definido acima,
[000148] para uso no diagnóstico de uma patologia associada ao receptor tipo II do hormônio anti-mülleriano humano, em especial o câncer de ovário.
[000149] De acordo com outro aspecto, a invenção refere-se a um método para diagnosticar uma patologia associada ao receptor tipo II do hormônio anti-mülleriano humano, em especial o câncer de ovário, em uma amostra biológica humana, o método compreendendo as etapas a seguir: a. marcar uma biópsia previamente obtida de um paciente, b. determinar a presença de um receptor tipo II do hormônio anti-mülleriano humano.
[000150] De acordo com outro aspecto, a invenção refere-se a um método para diagnosticar uma patologia associada ao receptor tipo II do hormônio anti-mülleriano humano, em especial o câncer de ovário, em uma amostra biológica humana, o método compreendendo as etapas a seguir: a. obter uma biópsia de um paciente, b. marcar a biópsia, c. determinar a presença de um receptor tipo II do hormônio anti-mülleriano humano.
[000151] A marcação da biópsia é realizada de acordo com técnicas bem conhecidas pelos versados na técnica.
[000152] É possível determinar a presença do receptor por meio de técnicas bem conhecidas pelos versados na técnica, tais como imunoensaio, ligação etc.
[000153] De acordo com outro aspecto, a invenção refere-se a um método para tratar uma patologia associada ao receptor tipo II do hormônio anti-mülleriano humano, em especial o câncer de ovário, em uma amostra biológica humana, o método compreendendo as etapas a seguir: a. obter uma biópsia de um paciente, b. marcar a biópsia, c. determinar a presença de um receptor tipo II do hormônio anti-mülleriano humano, d. caso determine-se a presença de um receptor tipo II do hormônio anti-mülleriano humano, tratar o paciente com: i. um anticorpo monoclonal conforme definido acima, ou ii. um fragmento do referido anticorpo monoclonal conforme definido acima, ou iii. um ácido nucleico conforme definido acima, ou iv. um vetor conforme definido acima, ou v. uma célula conforme definido acima.
DESCRIÇÃO DAS FIGURAS
[000154] A figura 1 ilustra uma representação diagramática de um anticorpo. As partes pretas correspondem às partes constantes das cadeias pesadas, as partes cinza-escuro correspondem às partes constantes das cadeias leves, as partes cinza-claro correspondem às partes variáveis das cadeias pesadas, e as partes brancas correspondem às partes variáveis das cadeias leves. -S-S- representa as pontes de dissulfeto estabelecidas entre duas cisteínas. As CDRs e as regiões de estrutura são indicadas por setas. Os fragmentos Fab e Fc também são ilustrados.
[000155] A figura 2 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos de uma parte variável de uma cadeia leve ou de uma cadeia pesada de imunoglobulina. As contas pretas correspondem aos aminoácidos que formam as regiões de estrutura, ao passo que as contas cinza correspondem aos aminoácidos que representam as CDRs.
[000156] A figura 3 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia pesada (figura 3A: aminoácidos de 1 a 115, SEQ ID NO: 8) e da cadeia leve (Figura 3b: aminoácidos de 131 a 236, SEQ ID NO: 2) no anticorpo humanizado 12G4 com a numeração adotada a fim de definir a posição das mutações. As contas riscadas correspondem a aminoácidos que não se fazem presentes na sequência e que, portanto, não são contados na numeração.
[000157] A figura 4 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia pesada no anticorpo 12G4 quimérico (SEQ ID NO: 66).
[000158] A figura 5 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia leve no anticorpo 12G4 quimérico (SEQ ID NO: 62).
[000159] A figura 6 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia pesada no anticorpo 12G4 humanizado não-mutado (SEQ ID NO: 58) e no anticorpo 12G4 humanizado mutado (6B_78; SEQ ID NO: 58).
[000160] A figura 7 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia leve no anticorpo 12G4 humanizado não-mutado (SEQ ID NO: 54).
[000161] A figura 8 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia pesada no anticorpo 12G4 humanizado mutado (3C_23; SEQ ID NO: 74).
[000162] A figura 9 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia leve no anticorpo 12G4 humanizado mutado (3C_23; SEQ ID NO: 70).
[000163] A figura 10 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia leve no anticorpo 12G4 humanizado mutado (6B_78; SEQ ID NO: 78).
[000164] A figura 11 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia pesada no anticorpo 12G4 humanizado mutado (3C_23K; SEQ ID NO: 86).
[000165] A figura 12 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia leve no anticorpo 12G4 humanizado mutado (3C_23K; SEQ ID NO: 82).
[000166] A figura 13 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia pesada no anticorpo 12G4 humanizado mutado (4C_35; SEQ ID NO: 90).
[000167] A figura 14 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia leve no anticorpo 12G4 humanizado mutado (4C_35; SEQ ID NO: 78).
[000168] A figura 15 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia pesada no anticorpo 12G4 humanizado mutado (5B_42; SEQ ID NO: 98).
[000169] A figura 16 ilustra uma representação diagramática em forma de cordão de pérolas da sequência de aminoácidos da parte variável da cadeia leve no anticorpo 12G4 humanizado mutado (5B_42; SEQ ID NO: 94).
[000170] A figura 17 ilustra a determinação da afinidade de ligação por parte do anticorpo ao receptor AMHR-II em um ensaio de ELISA convencional obtida com anticorpos mutados (Fab) de acordo com a invenção.
[000171] O eixo X ilustra a concentração de (Fab) em μg/ml e o eixo Y ilustra a OD em 450 nm.
[000172] A curva pontilhada com círculos brancos vazios representa a ligação do anticorpo 12G4 humanizado não-mutado.
[000173] A curva com triângulos pintados de pretos representa a ligação do anticorpo 12G4 humanizado mutado com uma mutação na CDR (E184K) na região variável da cadeia leve (anticorpo 6B_78).
[000174] A curva com triângulos brancos vazios representa a ligação do anticorpo 12G4 humanizado mutado com uma mutação na CDR (S179P) na região variável da cadeia leve, uma mutação na região FR (I177T) na região variável da cadeia leve e uma mutação na região variável da cadeia pesada (Q3R) (anticorpo 3C_23).
[000175] A curva com círculos brancos vazios representa a ligação do anticorpo 12G4 humanizado mutado com uma mutação na CDR (E184K) na região variável da cadeia leve, uma mutação na CDR (S179P) na região variável da cadeia leve, uma mutação na região FR (I177T) na região variável da cadeia leve e uma mutação na região variável da cadeia pesada (Q3R) (anticorpo 3C_23K).
[000176] A curva com círculos pintados de pretos representa a ligação do anticorpo 12G4 quimérico não-mutado.
[000177] A figura 18 ilustra a representação diagramática do vetor de clonagem H622-14 para o anticorpo 12G4 quimérico que contém a cadeia pesada na qual o líder VH AMHR-II se funde à região variável da cadeia pesada (VH AMHR-II), que, por sua vez, se funde à região constante da imunoglobulina humana (CH T125), e a cadeia leve na qual o líder VK AMHR-II se funde à região variável da cadeia leve (VK AMHR-II), que, por sua vez, se funde à região constante da imunoglobulina humana (CK T125).
[000178] Também são ilustrados os vários elementos reguladores (promotores, íntrons quiméricos, sítios de poliadenilação etc.), bem como os genes de resistência a antibióticos e as origens de replicação.
[000179] A figura 19 ilustra a representação diagramática do vetor de clonagem H622-18 para o anticorpo 12G4 humanizado não-mutado que contém a cadeia pesada na qual o líder VH AMHR-II humanizado se funde à região variável da cadeia pesada (VH AMHR- II humanizado), que, por sua vez, se funde à região constante da imunoglobulina humana (CH T125), e a cadeia leve na qual o líder VK AMHR-II se funde à região variável da cadeia leve (VK AMHR-II humanizado), que, por sua vez, se funde à região constante da imunoglobulina humana (CK T125).
[000180] Também são ilustrados os vários elementos reguladores (promotores, íntrons quiméricos, sítios de poliadenilação etc.), bem como os genes de resistência a antibióticos e as origens de replicação.
[000181] A figura 20 ilustra a representação diagramática do vetor de clonagem H622-18 MAO 3C23 para o anticorpo 12G4 humanizado mutado 3C_23 que contém a cadeia pesada na qual o líder VH 3C_23 se funde à região variável da cadeia pesada (VH 3C_23), que, por sua vez, se funde à região constante da imunoglobulina humana (CH T125), e a cadeia leve na qual o líder VK 3C_23 se funde à região variável da cadeia leve (VK 3C_23), que, por sua vez, se funde à região constante da imunoglobulina humana (CK T125).
[000182] Também são ilustrados os vários elementos reguladores (promotores, íntrons quiméricos, sítios de poliadenilação etc.), bem como os genes de resistência a antibióticos e as origens de replicação.
[000183] A figura 21 ilustra a representação diagramática do vetor de clonagem H622-18 MAO 6B_78 para o anticorpo 12G4 humanizado mutado 6B_78 que contém a cadeia pesada na qual o líder VH AMHR-II humanizado se funde à região variável da cadeia pesada (VH AMHR-II humanizado), que, por sua vez, se funde à região constante da imunoglobulina humana (CH T125), e a cadeia leve na qual o líder VK 6B_78 se funde à região variável da cadeia leve (VK 6B_78), que, por sua vez, se funde à região constante da imunoglobulina humana (CK T125).
[000184] Também são ilustrados os vários elementos reguladores (promotores, íntrons quiméricos, sítios de poliadenilação etc.), bem como os genes de resistência a antibióticos e as origens de replicação.
[000185] A figura 22 ilustra a representação diagramática do vetor de clonagem H622-18 MAO 3C_23K para o anticorpo 12G4 humanizado mutado 3C_23K que contém a cadeia pesada na qual o líder VH 3C_23K se funde à região variável da cadeia pesada (VH 3C_23K), que, por sua vez, se funde à região constante da imunoglobulina humana (CH T125), e a cadeia leve na qual o líder VK 3C_23K se funde à região variável da cadeia leve (VK 3C_23K), que, por sua vez, se funde à região constante da imunoglobulina humana (CK T125).
[000186] Também são ilustrados os vários elementos reguladores (promotores, íntrons quiméricos, sítios de poliadenilação etc.), bem como os genes de resistência a antibióticos e as origens de replicação.
[000187] A figura 23 ilustra os protocolos diagramáticos para construir os fragmentos scFv.
[000188] A seta preta sob a região 2/3 de VH indica a codificação de sequência para o N-terminal 2/3 da ligação peptídica.
[000189] A seta preta sob a região 2/3 de VL indica a codificação de sequência para o C-terminal 2/3 da ligação peptídica.
[000190] As figuras 24A e 24B ilustram a subclonagem das sequências de nucleotídeos das cadeias leves VL-CL e das cadeias pesadas VH-CH1 dos anticorpos mLFB112 e huLFB112 nos vetores de expressão pMG62-Fab. Figura 24A: mLFB112 Figura 24B: huLFB112
[000191] A figura 25 ilustra a atividade de ADCC dos anticorpos anti-AMHRII humanizados da invenção em comparação à do anticorpo 12G4 humanizado não-mutado. Os resultados são expressos em porcentagem de lise da célula ASC1 (eixo Y) em função da quantidade de anticorpos acrescentados em ng/ml (eixo X). Média ± SEM.
[000192] A curva com losangos representa o anticorpo anti-AMHRII 3C_23 (R901 3C_23), a curva com triângulos com ponta voltada para cima representa o anticorpo anti-AMHRII 6B_78 (R901 6B_78), a curva com triângulos com ponta voltada para baixo representa o anticorpo anti- AMHRII 3C_23K (R901 3C_23K), e a curva com círculos representa o anticorpo 12G4 anti-AMHRII humanizado não-mutado.
[000193] A figura 26 ilustra o mapa do vetor de expressão do plasmídio pIRES-neo utilizado para gerar a linha cov434-AMHRII.
[000194] As figuras 27A e 27B ilustram a atividade de ADCC de anticorpos anti-AMHRII quiméricos e humanizados produzidos em células YB2/0 (figura 27A) e em células CHO (figura 27B) na linha COV434- AMHRII.
[000195] Os resultados são expressos em porcentagem de lise de células COV434-AMHRII (eixo Y) em função da quantidade de anticorpos acrescentados em ng/ml (eixo X). Média de 3 ensaios ± SEM.
[000196] Figura 27A: a curva com losangos representa o anticorpo anti-AMHRII 12G4 quimérico não-mutado, a curva com quadrados pintados representa o anticorpo anti-AmhRII YB2/0 3C_23 (R901 3C_23), a curva com triângulos com ponta voltada para baixo representa o anticorpo anti- AMHRII YB2/0 6B_78 (R901 6B_78), a curva com triângulos com ponta voltada para cima representa o anticorpo anti-AMHRII YB2/0 3C_23K (R901 3C_23K), e a curva com retângulos vazios representa o anticorpo anti-CD20 adotado como controle negativo.
[000197] Figura 27B: a curva com losangos representa o anticorpo anti-AMHRII 12G4 quimérico não-mutado, a curva com triângulos com ponta voltada para cima representa o anticorpo anti-AMHRII CHO 3C_23 (R901 3C_23), a curva com triângulos com ponta voltada para baixo representa o anticorpo anti-AMHRII CHO 3C_23K (R901 3C_23K), a curva com círculos representa o anticorpo anti-AMHRII CHO 6B_78 (R901 6B_78), e a curva com retângulos vazios representa o anticorpo anti-CD20 adotado como controle negativo.
[000198] A figura 28 ilustra a atividade de ADCC dos anticorpos anti-AMHRII humanizados produzidos em células YB2/0 e CHO na linha Asc 1. Os resultados são expressos em porcentagem de lise das células Asc 1 (eixo Y) em função da quantidade de anticorpos acrescentados em ng/ml (eixo X). Média de 3 testes ± SEM.
[000199] A curva com losangos representa o anticorpo anti-AMHRII YB2/0 3C_23K, e a curva com triângulos com ponta voltada para cima representa o anticorpo anti-AMHRII CHO 3C_23K.
[000200] A figura 29 ilustra a atividade de ADCC dos anticorpos anti-AMHRII humanizados produzidos em YB2/0 e CHO na linha META 2815. Os resultados são expressos em porcentagem de lise das células META 2815 (eixo Y) em função da quantidade de anticorpos acrescentados em ng/ml (eixo X). Média de 3 testes ± SEM.
[000201] A curva com losangos representa o anticorpo anti-AMHRII YB2/0 3C_23K, a curva com triângulos com ponta voltada para cima representa o anticorpo anti-AMHRII CHO 3C_23K, e a curva com círculos representa o anticorpo anti-CD20 adotado como controle negativo (anti-CD20 A/R603 09/045).
[000202] A figura 30 ilustra o efeito do anticorpo anti- AMHRII 3C_23K na proliferação das células COV434-AMHRII. O valor de 100% corresponde à proliferação das células COV434-AMHRII observada sem anticorpos (média de 3 testes ± SD). Da esquerda para a direita, os histogramas ilustram:
[000203] O controle sem anticorpos, um anticorpo antiP24, o anticorpo anti-AMHRII YB2/0 3C_23K, o anticorpo anti-AMHRII CHO 3C_23K, um anticorpo P24 na presença de um agente de reticulação (CK), o anticorpo anti-AMHRII YB2/0 3C_23K na presença de CK, o anticorpo anti- AMHRII CHO 3C_23K na presença de CK, colquicina a 1 μg/ml.
[000204] A figura 31 ilustra o efeito do anticorpo anti- AMHRII 3C_23K na proliferação de células META 2815. O valor de 100% corresponde à proliferação das células META 2815 observada sem anticorpos (média de 3 testes ± SD). Da esquerda para a direita, os histogramas ilustram:
[000205] O controle sem anticorpos, um anticorpo antiP24, o anticorpo anti-AMHRII YB2/0 3C_23K, o anticorpo anti-AMHRII CHO 3C_23K, um agente de reticulação sozinho, um anticorpo antiP24 na presença de um agente de reticulação (CK), o anticorpo anti-AMHRII YB2/0 3C_23K na presença de CK, o anticorpo anti-AMHRII CHO 3C_23K na presença de CK, colquicina a 1 μg/ml.
[000206] As figuras 32A e 32B ilustram a variação nos volumes de tumor (figura 32A) e nas curvas de sobrevivência (figura 32B) sob efeito do tratamento com 3C23K-YB2/0 por meio de injeções intraperitoneais de anticorpos realizadas em intervalos de 2 a 3 dias a uma dose de 10 mg/kg/inj AMHRII. por um total de 18 injeções (setas pretas) no modelo cov434- Figura 32A: Eixo Y: volumes de tumor em mm3 Eixo X: dias após a injeção das células tumorais Curva com losangos: veículo Curva com retângulos: anticorpo anti-AMHRII YB2/0 3C_23K Figura 32B: Eixo Y: porcentagem de sobrevivência Eixo X: dias após a injeção das células tumorais Curva com losangos: veículo Curva com retângulos: anticorpo anti-AMHRII YB2/0 3C_23K
[000207] As figuras 33A e 33B ilustram a variação nos volumes de tumor (figura 33A) e nas curvas de sobrevivência (figura 33B) sob efeito do tratamento com 3C23K-YB2/0 por meio de injeções intraperitoneais de anticorpos realizadas em intervalos de 2 a 3 dias a uma dose de 10 mg/kg/inj por um total de 18 injeções (setas pretas) em um modelo Asc1a5. Figura 33A: Eixo Y: volumes de tumor em mm3 Eixo X: dias após a injeção das células tumorais Curva com losangos: veículo Curva com retângulos: anticorpo anti-AMHRII YB2/0 3C_23K Figura 33B: Eixo Y: porcentagem de sobrevivência Eixo X: dias após a injeção das células tumorais Curva com losangos: veículo Curva com retângulos: anticorpo anti-AMHRII YB2/0 3C_23K
[000208] As figuras 34A e 34B ilustram a variação nos volumes de tumor (figura 34A) e nas curvas de sobrevivência (figura 34B) sob efeito do tratamento com 3C23K-YB2/0 por meio de injeções intraperitoneais de anticorpos realizadas em intervalos de 2 a 3 dias a uma dose de 10 mg/kg/inj por um total de 18 injeções (setas pretas) no modelo META 2815. Figura 34A: Eixo Y: volumes de tumor em mm3 Eixo X: dias após a injeção das células tumorais Curva com losangos: veículo Curva com retângulos: anticorpo anti-AMHRII YB2/0 3C_23K Figura 34B: Eixo Y: porcentagem de sobrevivência Eixo X: dias após a injeção das células tumorais Curva com losangos: veículo Curva com retângulos: anticorpo anti-AMHRII YB2/0 3C_23K EXEMPLOS EXEMPLO 1: Determinação da afinidade dos anticorpos anti-AMHR-II
[000209] Determinamos a afinidade dos anticorpos por seu antígeno, AMHR-II, pela técnica de SPR (Ressonância de Plásmon de Superfície) em um aparelho BIACore X100 (BIACore, GE Healthcare). O receptor recombinante AMHR-II, expresso na forma de proteína de fusão com uma região Fc, é imobilizado por ligação covalente entre suas funções amina e os grupos carboxila de dextrano ativados em ésteres de succinimida, presentes na superfície do chip sensor tipo CM5. Os grupos COOH do chip sensor são ativados por 7 minutos com uma mistura EDC/NHS (N-hidroxisuccinimida a 0,1 M e 3-(N,N-dimetilamina)propil-N-etilcarbodiimida a 0,1 M) em um fluxo de 10 μl/min, então a proteína de fusão AMHR-II/Fc, diluída a 5 μg/ml em tampão de acetato de sódio a 10 mM com pH de 4,0, é injetada a 5 μl/min na trilha 2 do chip sensor a fim de atingir 300 RU. Os grupos de éster que não reagiram com as aminas da proteína de fusão são desativados injetando-se uma solução de etanolamina-HCl a 1 M com pH de 8,5 durante 7 minutos a um fluxo de 10/min. A trilha 1, que serve como controle negativo, foi ativada e desativada à maneira da trilha 2.
[000210] Todas as medições são tiradas a 25° C. Os antibióticos que serão analisados são diluídos em tampão de HBS-EP em andamento (BIACore, GE Healthcare) a concentrações de 6,25 a 3333 nM e injetados no chip sensor durante 2 minutos a um fluxo de 30 μl/min. A etapa de dissociação é monitorada durante 10 minutos e, então, a superfície é regenerada injetando-se tampão de glicina a 10 mM com pH de 1,5 durante 30 segundos a 10 μl/min.
[000211] Os sensorgramas obtidos são analisados usando-se o modelo cinético 1:2 do software BIAevaluation 3.1. Resultados Os anticorpos foram produzidos em células CHO ou YB 2/0 (tabela I) Tabela I
[000212] As mutações introduzidas nos anticorpos 6B_78 e 3C_23 produzem aumento na afinidade pelo antígeno AMHR-II em um fator de 2,3 a 2,6 em relação ao anticorpo quimérico (12G4 - quimérico).
[000213] As mutações dos dois anticorpos 6B_78 e 3C_23 surtem um efeito sinérgico; a introdução da mutação do anticorpo 6B_78 no anticorpo 3C_23 causa aumento na afinidade por um fator de 10. EXEMPLO 2: Determinação da afinidade do anticorpo 12G4 murino quimérico ou humanizado em células cov434-AMHR-II (peptídeo epítopo de sequência: GGGGNLTQDRAQVEMQGSR (SEQ ID NO: 101) e GGGGNLTQARGQVEMQGSR (SEQ ID NO: 102) para o peptídeo de controle negativo)
[000214] A afinidade do anticorpo quimérico determinada no receptor humano AMHR-II é de cerca de 10-8 M. Exemplo 3: Preparação de anticorpos 12G4 humanizados mutados
[000215] O anticorpo murino é substancialmente equivalente ao anticorpo quimérico e exibe forte afinidade.
[000216] O anticorpo 12G4 humanizado (huLFB112) foi obtido transplantando-se laços de CDR hipervariáveis do anticorpo 12G4 murino (mLFB112) em uma estrutura de proteína de natureza humana (“transplante de CDR”).
[000217] O anticorpo humanizado apresenta perda de afinidade apreciável em comparação ao anticorpo murino.
[000218] O objetivo final é, portanto, aumentar a afinidade do anticorpo humanizado a fim de restaurar as características de ligação iniciais do anticorpo murino. Essa otimização será realizada por meio de um ciclo de evolução molecular pela tecnologia MutaGen, pertencente à Millegen company. 3.1 Construção e validação das ferramentas moleculares 3.1.1. Construção dos fragmentos scFv
[000219] A codificação das sequências de nucleotídeos para as regiões variáveis das cadeias leves (VL) e das cadeias pesadas (VH) dos anticorpos murinos e humanizados foi amplificada por PCR usando-se iniciadores adequados. As sequências amplificadas foram, então, reunidas a fim de gerar um fragmento de anticorpo recombinante do tipo scFv. Várias construções foram realizadas desta maneira: orientação VH-VL ou VL-VH e uso de duas ligações de peptídeos diferentes (ligação de peptídeos de 15 ou de 18 aminoácidos). Realizou-se um total de 8 construções, quatro para o anticorpo murino e quatro para o anticorpo humanizado. O princípio para a construção dos fragmentos scFv é ilustrado dado (esquema I). As sequências de codificação para esses scFv foram, então, subclonadas no vetor de expressão de fagomídeos da MilleGen (pMG58). Esse vetor possibilita expressar fragmentos de anticorpos do tipo scFv e exibi-los na superfície de um bacteriófago tipo M13 (fago-scFv).
[000220] As sequências de nucleotídeos dos domínios VH e VL dos anticorpos murinos e humanizados foram verificadas por sequenciamento de DNA. A figura 23 resume o protocolo. 3.1.2. Expressão do scFv na superfície dos fagos e caracterização por ELISA
[000221] A quantidade de alvo alimentada (80 μg) não nos permitiu testar todas as 8 construções realizadas. Doravante, chamaremos o anticorpo murino mLFB112 expresso na forma de um scFv de mVH-VL, ao passo que chamaremos o anticorpo humanizado huLFB112 de huVH-VL. 3.1.2.1, Produção dos fagos-scFv
[000222] As bactérias XL1-Blue transformadas pelos vetores pMG58 contendo a codificação de DNA para o scFv mVH-VL, de um lado, e para o scFv huVH-V, do outro, são cultivadas a 30° C a uma OD em 600 nm de 0,5 a 0,6. Após acrescentar IPTG e infectar as bactérias com fagos auxiliares (M13KO7, New England Biolabs), as culturas são cultivadas a 26° C de um dia para o outro. No dia seguinte, as partículas de fago (fagos-scFv) são recuperadas do sobrenadante de cultura, precipitadas por meio de uma solução PEG/NaCl, concentradas (100 x) e quantificadas.
[000223] Neste caso, uma concentração da ordem de 8x1011 fagos/ml é obtida para os dois scFv. 3.1.2.2, Ensaio de ELISA-fagos
[000224] Verificou-se a funcionalidade do scFv mVH- VL e do huVH-VL produzidos na superfície dos fagos por meio de ensaios de ELISA diretos. Protocolo: 1) Imobilização do alvo: 100 μl/cavidade do alvo recombinante diluído a 5 μg/ml em PBS1X, isto é, 500 ng/cavidade, de um dia para o outro a 4°. Uso de placas de microtitulação Nunc-Immuno Plate Maxisorp, 2) Saturação: 200 μl/cavidade de PBS1X-leite desnatado a 4%, incubação durante 2 h a 37° C, 3) Ligação: 100 μl/cavidade das soluções de fagos-scFv murinos e humanizados diluídos em PBS1X-leite a 2%-Tween20 a 0,05% (série de diluição dupla), incubação durante 2 h a 37° C, 4) Detecção: 100 μl/cavidade do anticorpo M13 anti-fagos ligado a peroxídase (diluição 1/10000, GE Healthcare), incubação durante 2 h a 37° C 5) Detecção: 100 μl/cavidade de TMB 6) Neutralização: 100 μl/cavidade de H2SO4 7) Medição da OD em 450 nm Resultados (Tabela II): Tabela II
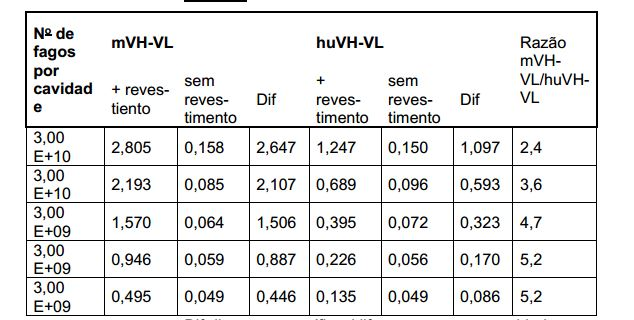
Dif: ligação específica (diferença entre as cavidades com revestimento e sem) Calculou-se a razão mVH-VL/huVH-VL com o valor de ligação específica (“Dif”) 3.1.3: Construção dos fragmentos Fab
[000225] As sequências de nucleotídeos das cadeias leves VL-CL e pesadas VH-CH1 dos anticorpos mLFB112 e huLFB112 foram subclonadas nos vetores de expressão pMG62-Fab (figuras 24A e 24B). Vetores de expressão pMG62-Fab
[000226] A) As duas cadeias VL-CL e VH-CH1 são expressas a partir do promotor pLac a montante da cadeia leve, a cadeia pesada VH-CH1 funde-se a uma marca para detecção (peptídeo V5) e a uma marca para purificação com IMAC (6xHis).
[000227] B) Cada uma das cadeias leve e pesada depende de um promotor. RBS: Sítio de ligação de ribossomos. 3.2 Construção e validação das ferramentas moleculares Construção da biblioteca pelo MutaGenTM
[000228] O objetivo definido para esta etapa foi o de obter um banco de dados de 5x106 variantes com 1 a 2 mutações de aminoácido por scFv.
[000229] As mutações foram introduzidas nos domínios VL e VH do anticorpo humanizado huLFB112 por meio da tecnologia MutaGenTM. Por fim, obteve-se um banco de dados amplo composto por cerca de 5x107 clones mutados com 1 a 5 mutações de aminoácidos por scFv, isto é, 10 vezes a diversidade inicialmente tencionada.
[000230] Para tanto, construíram-se diversos subbancos de dados de acordo com diferentes condições experimentais: condições U, M, US e UE definidas por diferentes nucleotídeo iniciadores, enzimas mutase utilizadas e número de replicações. Esses sub-bancos de dados são 4 em número e são designados como R20U, 45M, R20US e R20UE. Para todos esses sub-bancos de dados, realizou-se um total de 295 sequências para definir com precisão as diferentes características de mutagênese. A tabela III abaixo dá uma ideia dos principais dados obtidos pela análise das operações de sequenciamento. Tabela III Análise das mutações dos diferentes sub- bancos de dados
Análise das sequências de nucleotídeos
Análise das sequências de aminoácidos
3.2. Elaboração das cond ições de se eção
[000231] A fim de avaliar diferentes estratégias de seleção, preparamos uma mistura artificial com os fagos-scFv murinos e humanizados (mistura de 1/2000, mLFB112/huLFB112) com o objetivo de simular a triagem do banco de dados. Essa simulação da triagem deve possibilitar a validação de diferentes condições de seleção que têm por objetivo amplificar com rapidez o clone mais afim dentro da referida mistura artificial (isto é, o clone murino mLFB112 neste caso). As várias estratégias avaliaram: i) Uso de uma quantidade constante do alvo imobilizado no decorrer dos ciclos de seleção (Cond 1) ii) Diminuição da quantidade do alvo imobilizado no decorrer dos ciclos de seleção (Cond 2) ii) Teste para uma condição “koff”: tempo de incubação prolongado dos fagos-scFv com o alvo (Cond 3)
[000232] Essas várias condições foram realizadas em 3 ciclos de seleção. O sequenciamento foi realizado nos clones retidos após cada ciclo de seleção. Os resultados são dados na Tabela IV abaixo. Tabela IV Avaliação das três estratégias de triagem
[000233] Os resultados dão a impressão de que a condição 1 (quantidade fixa de alvo) confere o melhor desempenho para amplificar o clone com melhor afinidade, mLFB112 (9 clones de 10). O uso de uma quantidade menor de alvo (100 ng/cavidade) parece menos adequado; somente 3 clones de 10 após 3 ciclos de seleção corresponderam ao clone com melhor afinidade. O mesmo se aplica à condição 3 com base em um tempo de incubação prolongado (“seleção koff”) que não possibilita a amplificação suficiente do clone mLFB112. Ademais, o número de fagos recuperados para essa última condição mencionada após 3 ciclos não é alto (2x104 fagos). Portanto, pareceu-nos desaconselhável utilizar as condições 2 e 3 para uma mistura mais diversificada de clones, como é o caso do banco de dados construído no contexto deste projeto. 3.3. Triagem primária (ciclos de seleção)
[000234] Após elaborar as condições de triagem, decidiu-se, portanto, utilizar 2 condições de triagem: Cond A: 1 μg/cavidade do alvo durante 4 ciclos de seleção, então 2 ciclos com 0,5 μg/cavidade Cond B: 0,5 μg/cavidade para 6 ciclos de seleção. A tabela V abaixo traz os resultados obtidos. Tabela V: Resultados dos ciclos de seleção
[000235] Após essas seleções, os clones obtidos foram sequenciados a partir do 3o ciclo de seleção. Os resultados obtidos foram comparados aos obtidos para o banco de dados inicial (Tabela VI). Tabela VI: Resultados das operações de sequenciamento
[000236] Banco de dados: bando de dados inicial decorrente da mistura dos bancos de dados R20U, 45M, R20US, R20Ueta.
[000237] A análise dessas operações de sequenciamento revelou a presença de clones redundantes. Ao todo, de todos os clones sequenciados, obtiveram-se 113 clones mutados exclusivos. 3.4. Triagem secundária (ELISA-fagos)
[000238] A triagem secundária consistiu em analisar individualmente os clones selecionados ao término da triagem primária. Para tanto, os 113 clones mutados exclusivos foram transferidos a uma placa de cultura (96 cavidades, 1,2 ml).
[000239] Após produzir as partículas de fago, os sobrenadantes de cultura contendo os fagos-scFv foram utilizados para realizar o ensaio de ligação por ELISA. Avaliou-se a ligação dos clones mutados em duas diluições (% e % dos sobrenadantes contendo os scFv-fagos). Os clones murinos (mLFB112) e os clones humanizados (huLFB112) construídos sob o formato scFv-fagos foram utilizados como referência em cada uma das placas de ensaio. Testou-se cada um dos clones mutados ao menos duas vezes.
[000240] Os resultados são expressos em razão, isto é, as diferenças de ligação (OD405nm) entre os clones mutados e as referências huLFB112 e mLFB112. - Razão relativa ao scFv humanizado huLFB112 (Razão / huLFB112) - Razão relativa ao scFv murino mLFB112 (Razão / mLFB112)
[000241] Dos 113 clones testados, só os melhores são dados abaixo.
[000242] A tabela VII abaixo traz os vários clones obtidos e as mutações presentes (posição e substituição de aminoácidos) na cadeia leve e/ou na cadeia pesada, bem como a afinidade de ligação dos clones determinada pelo ELISA.
[000243] Os valores demonstrados após as substituições correspondem à mudança nos valores do índice hidropático em função das várias substituições.
[000244] Os valores de afinidade de ligação correspondem à razão da afinidade de ligação do anticorpo da invenção pelo receptor AMHRR-II para a afinidade de ligação do anticorpo 12G4 humanizado não-mutado ou para a afinidade de ligação do anticorpo 12G4 quimérico não- mutado.
[000245] Os valores de afinidade de ligação dados são a média de ao menos quatro valores e os números entre parênteses correspondem ao desvio padrão.
[000246] A tabela VII demonstra que, com as substituições realizadas, embora elas tenham levado a grandes mudanças no índice hidropático, a afinidade de ligação dos anticorpos da invenção pelo receptor é muito maior do que a do anticorpo 12G4 humanizado não-mutado e ao menos igual à do anticorpo 12G4 quimérico não-mutado: razão AC da invenção/12G4 quimérico superior ou igual a 1.
[000247] O anticorpo humanizado mutado demonstra uma afinidade restaurada ou mesmo superior à do anticorpo quimérico ou murino. TABELA VII
(Q1E, Q3E, Q6E, K19E, Q39E e Q62E: MARCA códon suprimido, traduzido para E nas bactérias E. coli XL1-Blue utilizadas) NT: não-testado Exemplo 4: Comparação de clones com melhora na afinidade
[000248] Os clones positivos 3C_23K, 3C_23 e 6B_78 foram comparados entre si determinando-se a afinidade de ligação do anticorpo ao receptor AMHR-II em um ensaio ELISA convencional obtido com anticorpos mutados solúveis (Fab) de acordo com a invenção.
[000249] A figura 17 apresenta os resultados obtidos. Exemplo 5: Estabelecimento da linha AMHRII cov434- AMHRII transfectada
[000250] A linha cov434-AMHRII foi gerada pela transfecção de um plasmídio expressando a codificação de cDNA para o AMHRII na linha de tumor da granulosa cov434 (van den Berg-Bakker, C., et al., 1993. Establishment and characterization of 7 ovarian carcinoma cell lines and one granulosa tumour cell line: Growth features and cytogenetics. International Journal of Cancer 53: 613; Zhang, H. et al., 2000. Characterization of an immortalized human granulosa cell line (COV434). Molecular Human Reproduction 6: 146) não expressando o AMHRII.
[000251] Em suma, o cDNA do AMHRII foi clonado no plasmídio comercial pIRES-neo (Clontech - Takara Bio Europe, França, referências 6060-1). Graças à sequência IRES, o AMHRII e o neo são expressos sob controle de um mesmo promotor CMV (figura 26).
[000252] Essa construção foi transfectada com estabilidade na linha de câncer da granulosa cov434 (agente de transfecção Fugene, Roche). Os transfectantes obtidos foram, então, avaliados por citometria e por Western blotting quanto à expressão do receptor AMHRII. Após a subclonagem, o clone celular cov434-AMHRII-1F3, contendo um vetor do tipo pIRES-neo, foi retido para estudos in vitro e in vivo. Doravante, chamaremos essa linha de cov434-AMHRII. Exemplo 6: Estabelecimento de linhas primárias a partir de líquido ascítico ou biópsia de pacientes com carcinoma epitelial de ovário
[000253] As principais etapas no estabelecimento das linhas derivadas de amostras de líquido ascítico (linha Asc 1) são as seguintes: - D0: Recebimento do líquido ascítico e início imediato da cultura da amostra. Centrifuga-se a amostra durante 5 minutos a 1.000 rev/min e colhe-se o precipitado em 2 ml de meio para semear um frasco T25 (meio RPMI com FCS a 10%). - D2 a D46: Cultura com observação microscópica regular. Acrescenta-se um meio fresco regularmente durante este período. Também lava-se com PBS de dois em dois dias a fim de remover os eritrócitos e fibroblastos contaminantes.
[000254] Por volta do D13, todas as células contaminantes desapareceram e observou-se um tapete confluente ainda heterogêneo de células (dois tipos diferentes). - D46: Transferência: no D46, observou-se um tapete homogêneo de células tumorais e, então, as células foram lavadas e transferidas por raspagem para ser re-semeadas em dois frascos T75. - D61: Avaliação da expressão de AMHRII por FACS: após lavar com PBS, as células são removidas do raspador e analisadas por citometria de fluxo (marcação 12G4 AcM a 10 μg/mL, FITC anti-camundongo AcII). Os bancos de dados são construídos neste estágio.
[000255] A linha AMHRII positiva é cultivada durante mais 10 dias a fim de confirmar a expressão do receptor AMHRII. - D71: Confirmação da expressão de AMHRII por FACS:
[000256] As linhas assim estabelecidas são mantidas em meio RPMI com FCS a 10%, com uma passagem por semana (1/15 de diluição).
[000257] No caso de biópsias (linha META 2815), o tumor primário é primeiramente mantido em camundongos imunodeficientes (transplantes da amostra no espaço interescapular, 3 passagens sucessivas em camundongos) e, então, o tumor é removido e dilacerado antes de ser disposto no meio de cultura. Em seguida, aplica-se um protocolo idêntico ao das amostras de líquido ascítico. Exemplo 7: Avaliação da afinidade dos vários anticorpos humanizados candidatos
[000258] Realizamos este estudo no anticorpo 12G4 murino original, bem como nos anticorpos humanizados candidatos 3C23, 6B78 e 3C23K (de sequência 3C_23, 6B_78 e 3C_23K, respectivamente) produzidos em YB2/0. Avaliou-se a afinidade desses anticorpos nas células cov434-AMHRII.
[000259] Em suma, determinou-se a KD pelo método de saturação, acrescentando doses crescentes de anticorpos rádio-marcados a um número constante de células cov434-AMHRII. As células (1x106 em 50 μl de PBS/BSA a 0,5%) foram incubadas (volume final de 150 μl) durante 1 hora a 4° C na presença de doses crescentes de anticorpos marcados de antemão com iodo 125 (125I). Para cada anticorpo, realizaram-se quatro diluições em PBS/BSA a 0,5% a partir das soluções de anticorpos marcadas e não- marcadas (84,4 μg/ml). Avaliou-se a fixação não-específica incubando as células na presença de um excesso molar de anticorpos não-marcados de 100 vezes.
[000260] Após a incubação, as amostras foram congeladas em nitrogênio líquido e, então, analisadas em um contador gama. Determinou-se a fixação específica subtraindo a fixação obtida na presença de um excesso de anticorpos não-marcados.
[000261] A análise de Scatchard, realizada no software PRISM, possibilitou determinar as constantes de afinidade dadas na tabela VIII. Tabela VIII: Constante de dissociação (KD) dos anticorpos anti-AMHRII
[000262] De acordo com este estudo, ao que parece, o anticorpo anti-AMHRII humanizado 3C23K tem a melhor afinidade (KD = 5,3 nM) em comparação aos dois outros anticorpos candidatos 6B78 e 3C23. O anticorpo 3C23K também possui uma afinidade cerca de três vezes superior à do anticorpo 12G4 murino original (KD = 15,4 nM). Exemplo 8: Comparação da atividade de ADCC dos anticorpos da invenção com a atividade de ADCC do anticorpo 12G4 humanizado não-mutado 1. MATERIAL E MÉTODOS 1.1. Princípio dos métodos ADCC
[000263] As células-alvo ASC1 obtidas dos pacientes são aderentes e são preparadas no dia anterior ao ensaio. Elas são removidas com tripsina e incubadas em EMS + FCS a 5% em uma placa de fundo plano a uma taxa de 50 μl por cavidade a uma concentração de 6 x 10% células/ml. As placas são incubadas a 37° C em CO2 a 7% da noite para o dia.
[000264] No dia seguinte, as células se aderiram ao fundo da cavidade. Aspira-se o sobrenadante e acrescenta-se o volume necessário de tampão por cavidade para realizar o ensaio na presença de NK e anticorpos.
[000265] As células exterminadoras (células NK) são purificadas de antemão pela técnica de depleção negativa desenvolvida pela empresa Miltenyi (Miltenyi Biotec - kit de isolação de células NK humanas, ref 130-092-657), a partir do sangue periférico de doadores saudáveis. A técnica de ADCC consiste em incubar as células NK com células-alvo ASC1 na presença de diferentes concentrações do anticorpo anti-AMHRII humanizado (0,005 a 5.000 ng/ml) com razão E/T de 10/1. Após 4 horas de incubação, mede-se a atividade citotóxica induzida pelos anticorpos anti-AMHRII por colorimetria determinando, nos sobrenadantes, uma enzima intracelular chamada de lactato desidrogenase (LDH) liberada pelas células-alvo lisadas (Roche Diagnostics - Kit de Detecção de Citotoxicidade LDH, ref 11644793001). 2.1 Elementos estudados - Anticorpos anti-AMHRII: 829 10 054, YB2/0 humanizado, R901 3C23K 829 10 050, YB2/0 humanizado, R901 3C23 829 10 051, YB2/0 humanizado, R901 6B78 632 07 107, 12G4 anti-AMHRII humanizado não-mutado - Dossiê de cultura de células ASC1 871 10 063 Os resultados são dados na figura 25.
[000266] A tabela IX traz os dados brutos correspondentes à figura 25. Tabela IX:
[000267] A tabela X apresenta os valores de Emax e EC50 obtidos com vários anticorpos. Tabela X
Exemplo 9: Comparação da atividad e de ADCC dos anticorpos da invenção com o anticorpo 12G4 quimérico
[000268] Avaliou-se a atividade de ADCC do anticorpo candidato humanizado 3C_23K (ha12G4 de sequência 3C_23K: mutações VHQ3R [SEQ ID NO: 82, sem líder, ou SEQ ID NO: 84, com líder], e VLI177T/S179P/E184K [SEQ ID NO: 86, sem líder, ou SEQ ID NO: 88, com líder]).
[000269] Em suma, as células efetoras (células exterminadoras NK; NK: Exterminadora Natural) são purificadas de antemão pela técnica de depleção negativa desenvolvida pela empresa Miltenyi (Miltenyi Biotec - kit de isolação de células NK humanas, ref 130-092-657), a partir do sangue periférico de doadores saudáveis, após uma primeira etapa de purificação das células mononucleadas em Ficoll.
[000270] O ensaio in vitro da atividade de ADCC consiste em incubar as células NK com células-alvo (linhas cov434-AMHRII, Asc 1 e META 2815) na presença de diferentes concentrações de anticorpos anti-AMHRII (anticorpo quimérico ch12G4, anticorpo 3C23K-YB2/0 humanizado, produzido em YB2/0, e 3C_23K-CHO, produzido em CHO). A razão efetor/alvo aplicada é de 15/1. Os anticorpos são diluídos em meios de cultura a concentrações de 0,005 a 5.000 ng/ml.
[000271] Após 4 horas de incubação, mede-se a atividade citotóxica induzida pelos anticorpos anti-AMHRII por colorimetria determinando, nos sobrenadantes, uma enzima intracelular chamada de lactato desidrogenase (LDH) liberada pelas células-alvo lisadas (Roche Diagnostics - Kit de Detecção de Citotoxicidade LDH, ref 11644793001).
[000272] A porcentagem de lise é calculada pela fórmula a seguir: % de lise = [(ER - SR) / (100 - SR)] - [(NC - SR) / (100 - SR) onde: ER = liberação de LDH na presença de anticorpos e células NK SR = liberação espontânea de LDH a partir da célula alvo sozinha NC = liberação de LDH na presença de células NK e ausência de anticorpos
[000273] Os resultados são expressos em porcentagem de lise em função da quantidade do anticorpo. Os valores de Emax e EC50 são calculados com o software PRISM.
[000274] A figura 26 apresenta os resultados obtidos na linha cov434-AMHRII. A baixa atividade do anticorpo 3C_23K-CHO não permite obter um platô nas condições de ensaio. Com o intuito de comparar a eficácia dos anticorpos, realiza-se o cálculo dos 50% relativos neste caso, o qual representa a quantidade do anticorpo 3C_23K-CHO necessária para atingir 50% do platô do anticorpo quimérico (50% relativo = 1). De acordo com essa avaliação, o anticorpo humanizado com a melhor atividade de ADCC na linha COV434-AMRHII é o anticorpo 3C_23K (50% relativo: 0,84) produzido em YB2/0. Os anticorpos humanizados de sequência 3C_23 e 6B_78 têm um valor de 50% relativo igual a 6,41 e 36,92, respectivamente.
[000275] A figura 28 apresenta os resultados obtidos na linha Asc 1. O anticorpo 3C_23K-YB2/0 possui uma atividade citotóxica dependente da dose nas células Asc 1 com um valor de EC50 estimado em 2,24 ng/ml. A baixa atividade do anticorpo 3C_23K-CHO não permite obter um platô nas condições de ensaio. Com o intuito de comparar a eficácia dos dois anticorpos, realizou-se o cálculo dos 50% relativos, o qual representa a quantidade do anticorpo 3C_23K-CHO necessária para atingir 50% do platô do anticorpo 3C_23K-YB2/0 (50% relativo = 1). De acordo com a essa avaliação, a atividade citotóxica do anticorpo 3C_23K-YB2/0 é cerca de 40 vezes superior à do anticorpo produzido em CHO (50% relativo = 39,4).
[000276] À semelhança, os resultados apresentados na figura 29 demonstram que os anticorpos 3C_23K-YB2/0 e 3C_23K-CHO produzem lise dependente da dose nas células META 2815. A atividade citotóxica do anticorpo 3C_23K-YB2/0 (EC50 = 30,5 ng/ml) é cerca de 146 vezes superior à do anticorpo 3C_23K-CHO (EC50 = 466,9 ng/ml).
[000277] Juntos, esses resultados indicam que os anticorpos anti-AMHRII 3C_23K produzidos em YB2/0 têm a capacidade de provocar a lise de células que expressam o antígeno AMHRII. A diferença em EC50 entre os anticorpos anti-AMHRII-YB2/0 e anti-AMHRII-CHO sugere uma vantagem particular para o anticorpo anti-AMHRII-YB2/0 em condições de baixa expressão antigênica ou de baixa penetrância do anticorpo no tumor. Exemplo 10: Estudos de proliferação celular
[000278] Demonstrou-se a inibição da proliferação celular medindo o crescimento celular com o tempo na presença ou ausência dos anticorpos anti-AMHRII testados.
[000279] Em suma, as células-alvo (cov434-AMHRII, Asc 1, META2815) são cultivadas em placas P6 (1 x 105 células/cavidade) durante 72 horas a 37° C na presença dos anticorpos anti-AMHRII (10 μg/ml) expressos em CHO ou YB2/0, com ou sem agentes de reticulação (igG Anti- Humano de Bode em 2 Fragmentos F(ab’) AffiniPure, Fragmento FCY Específico ref: 109-006-008, Jackson Immunoresearch, França). As células são tratadas com tripsina durante 5 minutos e, então, contadas no CEDEX, um contador celular automático com base na viabilidade celular (azul tripano). Estabelece-se um controle positivo de inibição da proliferação na presença de 1μg/ml de colquicina (Ref: C3915, Sigma-Aldrich, França). Estabelece-se um controle negativo na presença de um anticorpo não-relevante (anti-P24). Todas as diluições são preparadas em um meio de cultura (RPMI com FCS a 10%). Os resultados são expressos em porcentagem de proliferação, o valor de 100% correspondendo à proliferação das células observada na ausência de anticorpos.
[000280] A figura 30 traz os resultados obtidos com a linha cov434-AMHRII.
[000281] De acordo com essas observações, os anticorpos 3C_23K-YB2/0 e 3C_23K-CHO induzem cerca de 40% de inibição da proliferação celular nas células cov434-AMHRII na presença de um agente de reticulação (CK). Esse efeito citostático não é observado na presença de um anticorpo não-relevante (anticorpo p24), ao passo que o controle positivo com colquicinas (10 μg/ml) induz 88% de inibição.
[000282] À semelhança, os resultados apresentados na figura 31 demonstram que os anticorpos 3C_23K-YB2/0 e 3C_23K-CHO induzem cerca de 40% de inibição da proliferação celular na linha META 2815 na presença de um agente de reticulação (CK).
[000283] Essa inibição de proliferação celular pode ser decorrente da sinalização celular induzida pelos anticorpos anti-AMHRII nas linhas cov434-AMHRII e META 2815. Exemplo 11: Efeito in vivo do anticorpo 3C 23K-YB2/0 em tumores COV434-AMHRII
[000284] Avaliou-se a eficácia antitumoral do anticorpo 3C_23K-YB2/0 em um tratamento posterior em camundongos suíços fêmeos imunodeficientes após a injeção subcutânea (s.c.) de células tumorais COV434-AMHRII. As injeções (inj) intraperitoneais (i.p.) do anticorpo foram realizadas em intervalos de 2 a 3 dias a uma dose de 10 mg/kg/inj por um total de 18 injeções. O grupo tratado com o anticorpo 3C_23K-YB2/0 foi comparado ao grupo tratado com o veículo (PBS). Materiais e métodos
[000285] Camundongos suíços fêmeos imunodeficientes foram utilizados (Harlan). No dia 0 do experimento, aplicou-se uma injeção subcutânea de 7,106 células tumorais COV434/AMHRII misturadas com Matrigel (razão 1:1) nos camundongos. Em seguida, os animais foram tratados com injeção i.p. de PBS ou 3C_23K-YB2/0 com 10 mg/kg/inj a partir do dia 16 (volume de tumor entre 84 e 270 mm3, 3 injeções por semana durante 6 semanas [total de 18 injeções]).
[000286] Mediu-se o volume de tumor de 2 a 3 vezes por semana. O volume de tumor (TV) foi calculado usando a fórmula a seguir:
[000287] TV (mm3) = (comprimento x largura x altura)/2, onde o comprimento corresponde ao maior diâmetro do tumor e a largura corresponde ao menor diâmetro do tumor.
[000288] As curvas de crescimento de tumor foram representadas graficamente levando-se em conta a média dos volumes de tumor (MTV). Os animais foram submetidos a eutanásia quando o volume de tumor individual atingiu 2.000 mm3. Em cada um dos grupos, as curvas foram interrompidas quando 30% dos animais no grupo foram submetidos a eutanásia.
[000289] A inibição do crescimento de tumor (T/C), definida como a razão do volume de tumor mediano dos grupos tratados para o volume mediano do grupo de controle tratado com o veículo, foi calculada de acordo com o seguinte: T/C = (TV mediano do grupo tratado/TV mediano do grupo de veículo) x 100 - T/C acima de 42%, o produto é considerado ineficaz - T/C entre 42% e 10%, o produto possui efeito antitumoral
[000290] - T/C abaixo de 10%, o produto é mesmo eficaz
[000291] As diferenças estatísticas entre os diferentes grupos foram obtidas pelo teste de Kruskal-Wallis usando-se a comparação ANOVA (software Stagraphics centurion XV). As diferenças foram tidas como significativas se P < 0,05. Um teste de logrank, para comparar os parâmetros de sobrevivência do estudo, também foi realizado via ANOVA (software Statgraphics centurion XV). As diferenças foram tidas como significativas se P < 0,05. Resultados
[000292] O anticorpo 3C_23K-YB2/0 apresenta atividade antitumoral, uma vez que observou-se um retardo no modelo COV434-AMHRII (figuras 32A e 32B).
[000293] A comparação estatística dos volumes de tumor em cada tempo de medição, desde o início do tratamento, demonstra que o anticorpo 3C_23K-YB2/0 retarda o crescimento do tumor (Kruskal-Wallis via ANOVA). A razão T/C calculada entre os grupos tratados com 3C_23K- YB2/0 e o veículo demonstra uma diferença significativa em todos os tempos de medição, também desde o início do tratamento. O teste lograng também demonstra que, em termos de sobrevivência, o grupo tratado com 3C_23K- YB2/0 é estatisticamente diferente do grupo tratado com o veículo.
[000294] A tabela XI abaixo demonstra a evolução dos volumes de tumor (razão tratado/controle T/C em %) sob efeito do tratamento com 3C_23K-YB2/0 no modelo cov434-AMHRII. Tabela XI
[000295] A tabela XII abaixo apresenta as análises estatísticas obtidas no modelo cov434-AMHRII. Tabela XII
Exemplo 12: Efeito in vivo do anticorpo 3C 23K-Y tumores Asc1A5
[000296] Avaliou-se a eficácia antitumoral do anticorpo 3C_23K-YB2/0 em um tratamento posterior em camundongos suíços fêmeos imunodeficientes após a injeção subcutânea (s.c.) de células tumorais Asc1A5 (clone da linha Asc 1 original). As injeções (inj) intraperitoneais (i.p.) do anticorpo foram realizadas em intervalos de 2 a 3 dias a uma dose de 10 mg/kg/inj por um total de 18 injeções. O grupo tratado com o anticorpo 3C_23K-YB2/0 foi comparado ao grupo tratado com o veículo (PBS). Materiais e métodos
[000297] Camundongos suíços fêmeos imunodeficientes foram utilizados (Harlan). No dia 0 do experimento, aplicou-se uma injeção subcutânea de 7,106 células tumorais Asc1A5 misturadas com Matrigel (razão 1:1) nos camundongos. Em seguida, os animais foram tratados com injeção i.p. de PBS ou 3C_23K-YB2/0 com 10 mg/kg/inj a partir do dia 12 (volume de tumor entre 40 e 160 mm3, 3 injeções por semana durante 6 semanas [total de 18 injeções]).
[000298] Mediu-se o volume de tumor de 2 a 3 vezes por semana. O volume de tumor (TV) foi calculado usando a fórmula a seguir:
[000299] TV (mm3) = (comprimento x largura x altura)/2, onde o comprimento corresponde ao maior diâmetro do tumor e a largura corresponde ao menor diâmetro do tumor.
[000300] As curvas de crescimento de tumor foram representadas graficamente levando-se em conta a média dos volumes de tumor (MTV). Os animais foram submetidos a eutanásia quando o volume de tumor individual atingiu 2.000 mm3. Em cada um dos grupos, as curvas foram interrompidas quando 30% dos animais no grupo foram submetidos a eutanásia.
[000301] A inibição do crescimento de tumor (T/C), definida como a razão do volume de tumor mediano dos grupos tratados para o volume mediano do grupo de controle tratado com o veículo, foi calculada de acordo com o seguinte: T/C = (TV mediano do grupo tratado/TV mediano do grupo de veículo) x 100 - T/C acima de 42%, o produto é considerado ineficaz - T/C entre 42% e 10%, o produto possui efeito antitumoral - T/C abaixo de 10%, o produto é mesmo eficaz
[000302] As diferenças estatísticas entre os diferentes grupos foram obtidas pelo teste de Kruskal-Wallis usando-se a comparação ANOVA (software Stagraphics centurion XV). As diferenças foram tidas como significativas se P < 0,05. Um teste de logrank, para comparar os parâmetros de sobrevivência do estudo, também foi realizado via ANOVA (software Statgraphics centurion XV). As diferenças foram tidas como significativas se P < 0,05. Resultados
[000303] O anticorpo 3C_23K-YB2/0 demonstrou atividade antitumoral, uma vez que observou-se um retardo no crescimento do tumor em comparação ao grupo tratado com o veículo no modelo Asc1A5 (figuras 33A e 33B).
[000304] A comparação estatística dos volumes de tumor em cada tempo de medição, desde o início do tratamento, demonstra que o anticorpo 3C_23K-YB2/0 retarda o crescimento do tumor (Kruskal-Wallis via ANOVA). A razão T/C calculada entre os grupos tratados com 3C_23K- YB2/0 e o veículo demonstra uma diferença significativa em todos os tempos de medição, também desde o início do tratamento. O teste lograng também demonstra que, em termos de sobrevivência, o grupo tratado com 3C_23K- YB2/0 é estatisticamente diferente do grupo tratado com o veículo.
[000305] A tabela XIII abaixo apresenta a evolução dos volumes de tumor (razão tratado/controle T/C em %) sob efeito do tratamento com 3C_23K-YB2/0 obtido no modelo Asc1a5. Tabela XIII
[000306] A tabela XIV abaixo apresenta as análises estatísticas obtidas no modelo Asc1a5. Tabela XIV
Exemplo 13: Efeito in vivo do anticorpo 3C 23K-YB2/0 em tumores Meta2815
[000307] Avaliou-se a eficácia antitumoral do anticorpo 3C_23K-YB2/0 em um tratamento posterior em camundongos suíços fêmeos imunodeficientes após a injeção subcutânea (s.c.) de células tumorais Meta 2815. As injeções (inj) intraperitoneais (i.p.) do anticorpo foram realizadas em intervalos de 2 a 3 dias a uma dose de 10 mg/kg/inj por um total de 18 injeções. O grupo tratado com o anticorpo 3C_23K-YB2/0 foi comparado ao grupo tratado com o veículo (PBS). Materiais e métodos
[000308] Camundongos suíços fêmeos imunodeficientes foram utilizados (Harlan). No dia 0 do experimento, aplicou-se aos camundongos uma injeção subcutânea de 8 x 106 de células tumorais Meta2815. Em seguida, os animais foram tratados com injeção i.p. de PBS ou 3C_23K-YB2/0 com 10 mg/kg/inj a partir do dia 33 (volume de tumor entre 45 e 240 mm3, 3 injeções por semana durante 6 semanas [total de 18 injeções]).
[000309] Mediu-se o volume de tumor de 2 a 3 vezes por semana. O volume de tumor (TV) foi calculado usando a fórmula a seguir:
[000310] TV (mm3) = (comprimento x largura x altura)/2, onde o comprimento corresponde ao maior diâmetro do tumor e a largura corresponde ao menor diâmetro do tumor.
[000311] As curvas de crescimento de tumor foram representadas graficamente levando-se em conta a média dos volumes de tumor (MTV). Os animais foram submetidos a eutanásia quando o volume de tumor individual atingiu 2.000 mm3. Em cada um dos grupos, as curvas foram interrompidas quando 30% dos animais no grupo foram submetidos a eutanásia.
[000312] A inibição do crescimento de tumor (T/C), definida como a razão do volume de tumor mediano dos grupos tratados para o volume mediano do grupo de controle tratado com o veículo, foi calculada de acordo com o seguinte: T/C = (TV mediano do grupo tratado/TV mediano do grupo de veículo) x 100 - T/C acima de 42%, o produto é considerado ineficaz - T/C entre 42% e 10%, o produto possui efeito antitumoral - T/C abaixo de 10%, o produto é mesmo eficaz
[000313] As diferenças estatísticas entre os diferentes grupos foram obtidas pelo teste de Kruskal-Wallis usando-se a comparação ANOVA (software Stagraphics centurion XV). As diferenças foram tidas como significativas se P < 0,05. Um teste de logrank, para comparar os parâmetros de sobrevivência do estudo, também foi realizado via ANOVA (software Statgraphics centurion XV). As diferenças foram tidas como significativas se P < 0,05. Resultados
[000314] O anticorpo 3C_23K-YB2/0 demonstrou atividade antitumoral, uma vez que observou-se um retardo no crescimento do tumor em comparação ao grupo tratado com o veículo no modelo Meta2815 (figuras 34A e 34B).
[000315] A comparação estatística dos volumes de tumor em cada tempo de medição, desde o início do tratamento, demonstra que o anticorpo 3C_23K-YB2/0 retarda o crescimento do tumor (Kruskal-Wallis via ANOVA). A razão T/C calculada entre os grupos tratados com 3C_23K- YB2/0 e o veículo demonstra uma diferença significativa em todos os tempos de medição, também desde o início do tratamento. O teste lograng também demonstra que, em termos de sobrevivência, o grupo tratado com 3C_23K- YB2/0 é estatisticamente diferente do grupo tratado com o veículo. A tabela XV abaixo apresenta a evolução dos volumes de tumor (razão tratado/controle T/C em %) sob efeito do tratamento com 3C_23K- YB2/0 no modelo META 2815. Tabela XV
[000316] A tabela XVI abaixo apresenta as análises estatísticas obtidas no modelo META 2815. Tabela XVI



























































