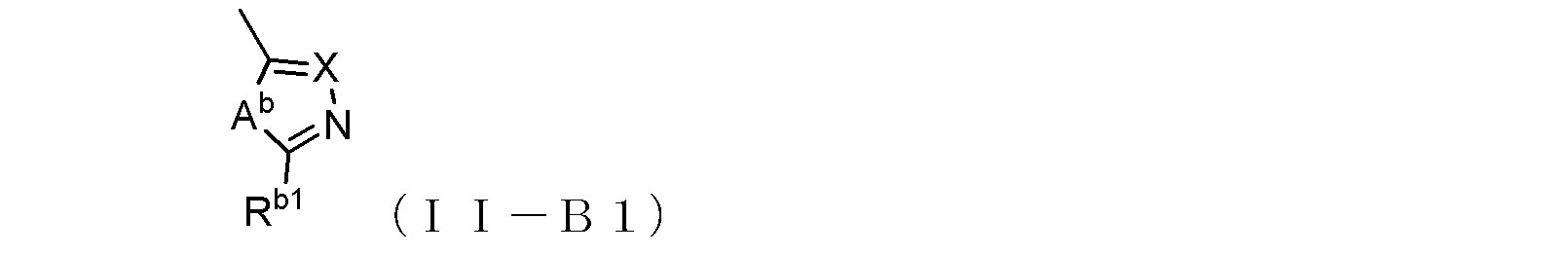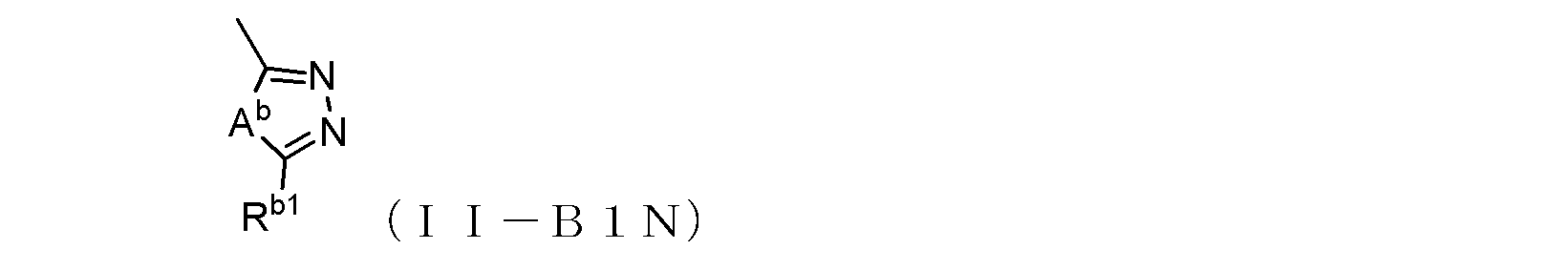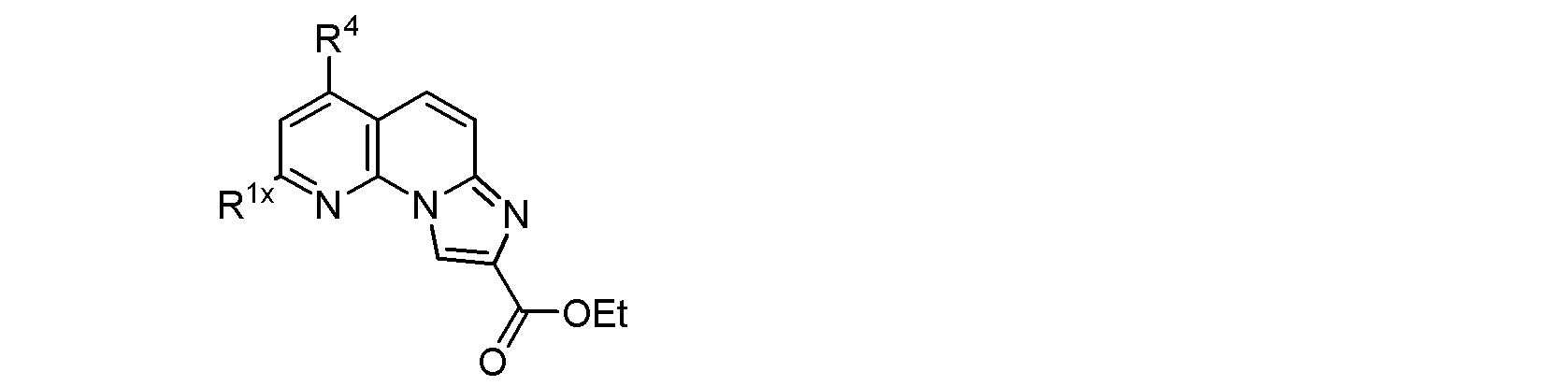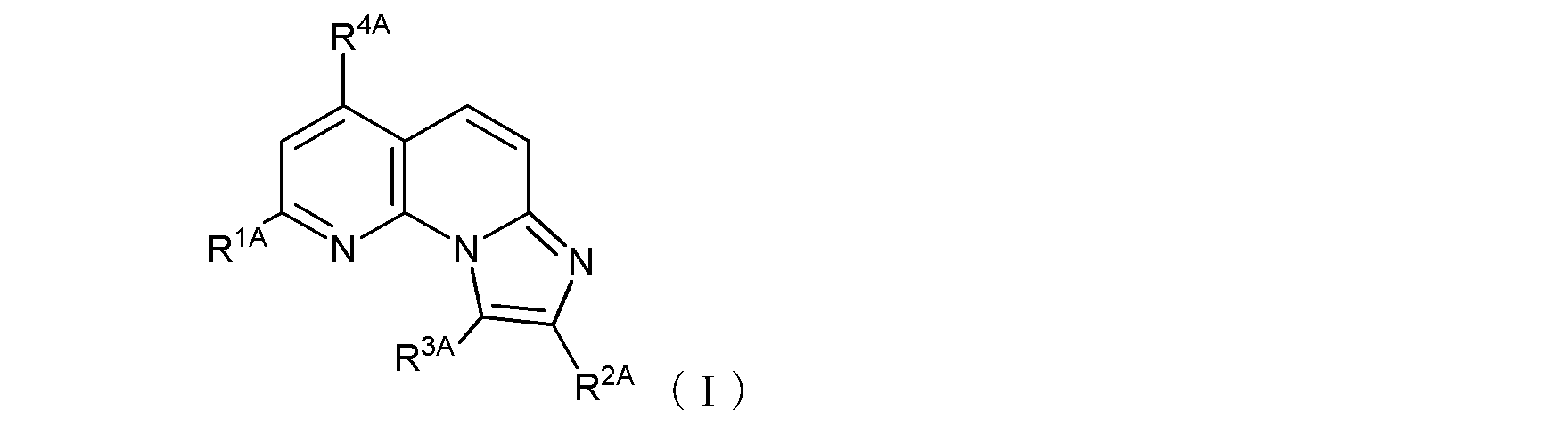WO2018043747A1 - 抗b型肝炎ウイルス剤 - Google Patents
抗b型肝炎ウイルス剤 Download PDFInfo
- Publication number
- WO2018043747A1 WO2018043747A1 PCT/JP2017/031825 JP2017031825W WO2018043747A1 WO 2018043747 A1 WO2018043747 A1 WO 2018043747A1 JP 2017031825 W JP2017031825 W JP 2017031825W WO 2018043747 A1 WO2018043747 A1 WO 2018043747A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- group
- atom
- substituted
- formula
- hydrogen atom
- Prior art date
Links
- 0 *c1c(*)nc(cc2)[n]1c1c2c(*)cc(*)n1 Chemical compound *c1c(*)nc(cc2)[n]1c1c2c(*)cc(*)n1 0.000 description 6
- YCTHSPSUCMFMNH-UHFFFAOYSA-N CCOC(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1)=O Chemical compound CCOC(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1)=O YCTHSPSUCMFMNH-UHFFFAOYSA-N 0.000 description 1
- LHKRWVSLPCUVSD-UHFFFAOYSA-N CCOC(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(O)n1)=O Chemical compound CCOC(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(O)n1)=O LHKRWVSLPCUVSD-UHFFFAOYSA-N 0.000 description 1
- CTPOHFMTWXRMJM-UHFFFAOYSA-N CCOC(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(OC)n1)=O Chemical compound CCOC(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(OC)n1)=O CTPOHFMTWXRMJM-UHFFFAOYSA-N 0.000 description 1
- QVLMXQWQVIXHIX-UHFFFAOYSA-N CC[O](C)C(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(Br)n1)=O Chemical compound CC[O](C)C(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(Br)n1)=O QVLMXQWQVIXHIX-UHFFFAOYSA-N 0.000 description 1
- UFMMIFZMLIEAOF-UHFFFAOYSA-N CN(C)CCNCc(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1 Chemical compound CN(C)CCNCc(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1 UFMMIFZMLIEAOF-UHFFFAOYSA-N 0.000 description 1
- GNMSBZKTNHGQSC-UHFFFAOYSA-N COc(cc1)ccc1-c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1 Chemical compound COc(cc1)ccc1-c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1 GNMSBZKTNHGQSC-UHFFFAOYSA-N 0.000 description 1
- IWZJGKOTVFXQIP-UHFFFAOYSA-N COc1nc([n]2c(cc3)nc(-c4nnc[o]4)c2)c3c(C(F)(F)F)c1 Chemical compound COc1nc([n]2c(cc3)nc(-c4nnc[o]4)c2)c3c(C(F)(F)F)c1 IWZJGKOTVFXQIP-UHFFFAOYSA-N 0.000 description 1
- SFKVPDWMUJFBHV-UHFFFAOYSA-N COc1nc([n]2c(cc3)nc(C(Nc4ccncc4)=O)c2)c3c(C(F)(F)F)c1 Chemical compound COc1nc([n]2c(cc3)nc(C(Nc4ccncc4)=O)c2)c3c(C(F)(F)F)c1 SFKVPDWMUJFBHV-UHFFFAOYSA-N 0.000 description 1
- DJEMXTIXIBTHNG-UHFFFAOYSA-N Cc1c(-c2nnc[o]2)nc(cc2)[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1 Chemical compound Cc1c(-c2nnc[o]2)nc(cc2)[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1 DJEMXTIXIBTHNG-UHFFFAOYSA-N 0.000 description 1
- ISQGWXJLHBORBL-UHFFFAOYSA-N Cc1nnc(-c(nc2cc3)c[n]2c2c3c(C(F)(F)F)cc(C(F)(F)F)n2)[o]1 Chemical compound Cc1nnc(-c(nc2cc3)c[n]2c2c3c(C(F)(F)F)cc(C(F)(F)F)n2)[o]1 ISQGWXJLHBORBL-UHFFFAOYSA-N 0.000 description 1
- YVGVPKLTMGMCPC-UHFFFAOYSA-N FC(c1cc(C(F)(F)F)nc2c1ccc1nc(-c(cc3)ccc3F)c[n]21)(F)F Chemical compound FC(c1cc(C(F)(F)F)nc2c1ccc1nc(-c(cc3)ccc3F)c[n]21)(F)F YVGVPKLTMGMCPC-UHFFFAOYSA-N 0.000 description 1
- CQRMHSRHWONGKT-UHFFFAOYSA-N FC(c1cc(C(F)(F)F)nc2c1ccc1nc(-c3cnc[o]3)c[n]21)(F)F Chemical compound FC(c1cc(C(F)(F)F)nc2c1ccc1nc(-c3cnc[o]3)c[n]21)(F)F CQRMHSRHWONGKT-UHFFFAOYSA-N 0.000 description 1
- DTQCLKSFBJFXJV-UHFFFAOYSA-N FC(c1cc(C(F)(F)F)nc2c1ccc1nc(-c3nnc(COCc4ccccc4)[o]3)c[n]21)(F)F Chemical compound FC(c1cc(C(F)(F)F)nc2c1ccc1nc(-c3nnc(COCc4ccccc4)[o]3)c[n]21)(F)F DTQCLKSFBJFXJV-UHFFFAOYSA-N 0.000 description 1
- LIEMIIRKUZVMIR-UHFFFAOYSA-N FC(c1cc(C(F)(F)F)nc2c1ccc1nc(-c3nnc[s]3)c[n]21)(F)F Chemical compound FC(c1cc(C(F)(F)F)nc2c1ccc1nc(-c3nnc[s]3)c[n]21)(F)F LIEMIIRKUZVMIR-UHFFFAOYSA-N 0.000 description 1
- XSRCLMHZKWWMMN-UHFFFAOYSA-N FC(c1cc(Cl)nc2c1ccc1nc(-c3nnc[o]3)c[n]21)(F)F Chemical compound FC(c1cc(Cl)nc2c1ccc1nc(-c3nnc[o]3)c[n]21)(F)F XSRCLMHZKWWMMN-UHFFFAOYSA-N 0.000 description 1
- JTRGZJBBDKWIFP-UHFFFAOYSA-N NCCOc1nc([n]2c(cc3)nc(-c4nnc[o]4)c2)c3c(C(F)(F)F)c1 Chemical compound NCCOc1nc([n]2c(cc3)nc(-c4nnc[o]4)c2)c3c(C(F)(F)F)c1 JTRGZJBBDKWIFP-UHFFFAOYSA-N 0.000 description 1
- AXWJKGGJQQYHLX-UHFFFAOYSA-N NCCOc1nc([n]2c(cc3)nc(C(Nc4ccncc4)=O)c2)c3c(C(F)(F)F)c1 Chemical compound NCCOc1nc([n]2c(cc3)nc(C(Nc4ccncc4)=O)c2)c3c(C(F)(F)F)c1 AXWJKGGJQQYHLX-UHFFFAOYSA-N 0.000 description 1
- YTZCIANSTXNNRS-UHFFFAOYSA-N NNC(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(O)n1)=O Chemical compound NNC(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(O)n1)=O YTZCIANSTXNNRS-UHFFFAOYSA-N 0.000 description 1
- HLKTZWPJLCYGTR-UHFFFAOYSA-N O=C(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1)NC1CCNCC1 Chemical compound O=C(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1)NC1CCNCC1 HLKTZWPJLCYGTR-UHFFFAOYSA-N 0.000 description 1
- QPXPECLPSHNKBP-UHFFFAOYSA-N O=C(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1)Nc1ccncc1 Chemical compound O=C(c(nc1cc2)c[n]1c1c2c(C(F)(F)F)cc(C(F)(F)F)n1)Nc1ccncc1 QPXPECLPSHNKBP-UHFFFAOYSA-N 0.000 description 1
- WPPBGRSJEWVJQX-UHFFFAOYSA-N OC(COc1nc([n]2c(cc3)nc(-c4nnc[o]4)c2)c3c(C(F)(F)F)c1)=O Chemical compound OC(COc1nc([n]2c(cc3)nc(-c4nnc[o]4)c2)c3c(C(F)(F)F)c1)=O WPPBGRSJEWVJQX-UHFFFAOYSA-N 0.000 description 1
- ITUODFVGNJZSJL-UHFFFAOYSA-N OCc1nnc(-c(nc2cc3)c[n]2c2c3c(C(F)(F)F)cc(C(F)(F)F)n2)[o]1 Chemical compound OCc1nnc(-c(nc2cc3)c[n]2c2c3c(C(F)(F)F)cc(C(F)(F)F)n2)[o]1 ITUODFVGNJZSJL-UHFFFAOYSA-N 0.000 description 1
- UGKUEDNNJJGYDB-UHFFFAOYSA-N Oc1nc([n]2c(cc3)nc(-c4nnc[o]4)c2)c3c(C(F)(F)F)c1 Chemical compound Oc1nc([n]2c(cc3)nc(-c4nnc[o]4)c2)c3c(C(F)(F)F)c1 UGKUEDNNJJGYDB-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4375—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having nitrogen as a ring heteroatom, e.g. quinolizines, naphthyridines, berberine, vincamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Virology (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Gastroenterology & Hepatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
特定の構造を有する化合物又はその塩を含む、インターフェロン様活性を奏し得る抗B型肝炎ウイルス薬が提供される。
Description
本発明は、抗B型肝炎ウイルス剤等に関する。なお、本明細書に記載される文献(特に先行技術文献)に記載される内容は参照により本明細書に組み込まれる。
B型肝炎ウイルス(HBV)持続感染者は日本では人口の約1%(約100万人)、世界では人口の約7%(約4億人)と推定されており、慢性肝炎、肝硬変、肝細胞がん、肝不全に進展する感染者に対する効果的な治療薬が希求されている。
現在、B型肝炎の治療には、主に核酸アナログ製剤とインターフェロン(IFN)製剤が使用されている。核酸アナログ製剤(例えば、エンテカビルやテノホビルなど)は、HBVが感染した肝細胞の中でウイルスが子孫ウイルスの遺伝子を形成するのに必須なHBVポリメラーゼを阻害するが、薬剤耐性ウイルスの出現などが問題となっている。HBV DNAは、ウイルスが作るポリメラーゼによってcovalently closed circular DNA(cccDNA)へと修復され、cccDNAが鋳型となり、ウイルスRNAが合成され、一部はmRNAとして、HBs抗原、HBe抗原、HBc抗原というウイルスの体を形成するのに必要なタンパク質の翻訳に利用される。ところが、HBV cccDNAは感染した肝細胞に残りやすく、HBVの完全駆逐は困難と考えられており、患者は生涯、治療薬を飲み続けなければならないという問題点がある(非特許文献1)。
IFNは、免疫細胞が分泌するサイトカインの1つで、免疫細胞を活性化するとともに、ウイルスのライフサイクルの様々な点に作用してウイルスの増殖を抑える働きがある。現在、ペグインターフェロン(pegylated interferon: Peg-IFN)が一般臨床で使用可能となり、B型肝炎の治療成績は向上している。しかし、Peg-IFNによる治療効果が得られる症例は、HBe抗原陽性・陰性に関わらず約30%であること、さらには様々な副作用が報告されていること、侵襲性が高い注射製剤であること、など多くの課題が残されている。
これらの問題を克服するために、非核酸系低分子量抗ウイルス治療薬の開発研究が行われている。例えば、HCVレプリコン細胞を用いたIFN疑似薬として、RO8191(非特許文献2)やその関連化合物(非特許文献3、特許文献1)が報告されているが、いずれの化合物も細胞毒性、溶解性、体内動態など問題点を抱えている。
Nassal, M. Gut, 2015: 64, 1972-1984.
Konishi, H. et al. Sci. Rep. 2012:2, 259.
Wei, L. et al. J. Interferon Cytokine Res. 2016: 36, 180-191.
本発明は、新規なB型肝炎ウイルス治療剤の提供を課題とする。
本発明者らは、特定の構造を有する化合物がインターフェロン様活性を有しており、よって当該特定の化合物を用いることでB型肝炎を治療できる可能性を見出し、さらに改良を重ねて本発明を完成させるに至った。
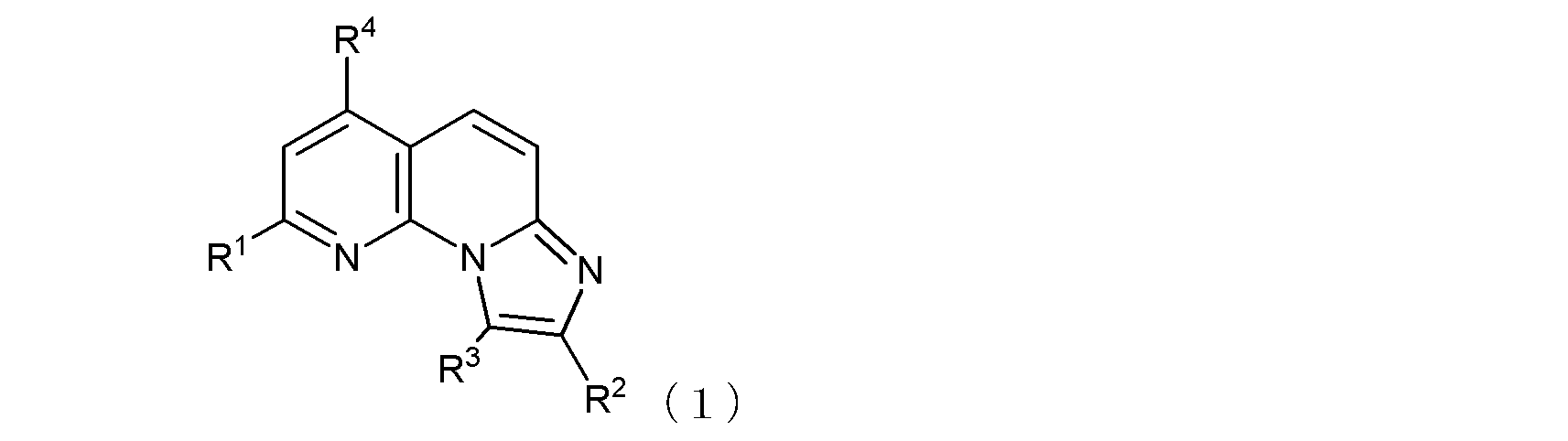
本発明は例えば以下の項に記載の主題を包含する。
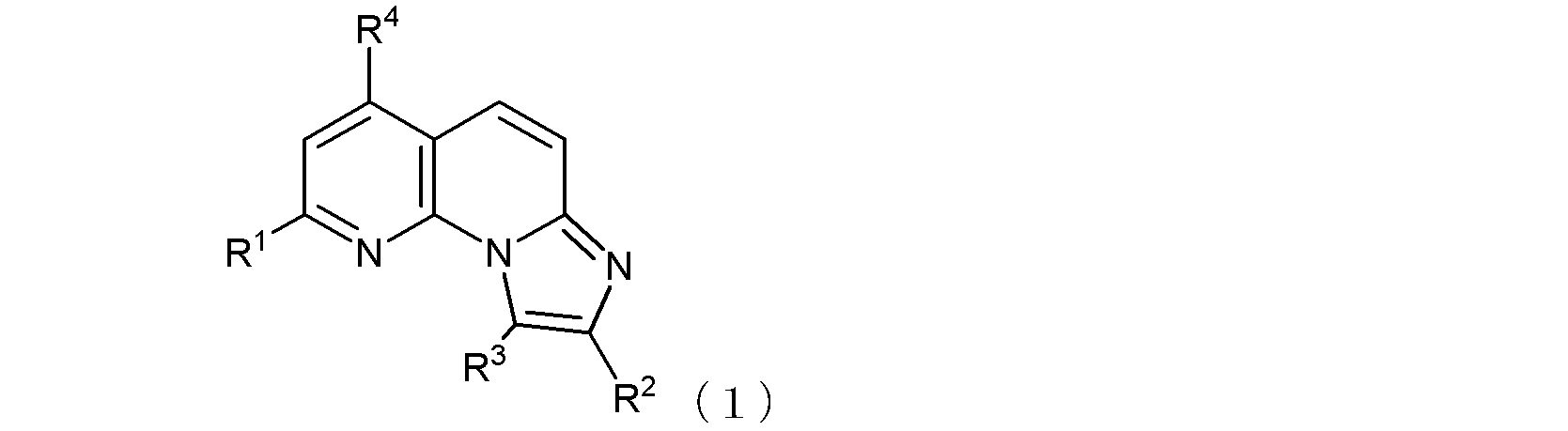
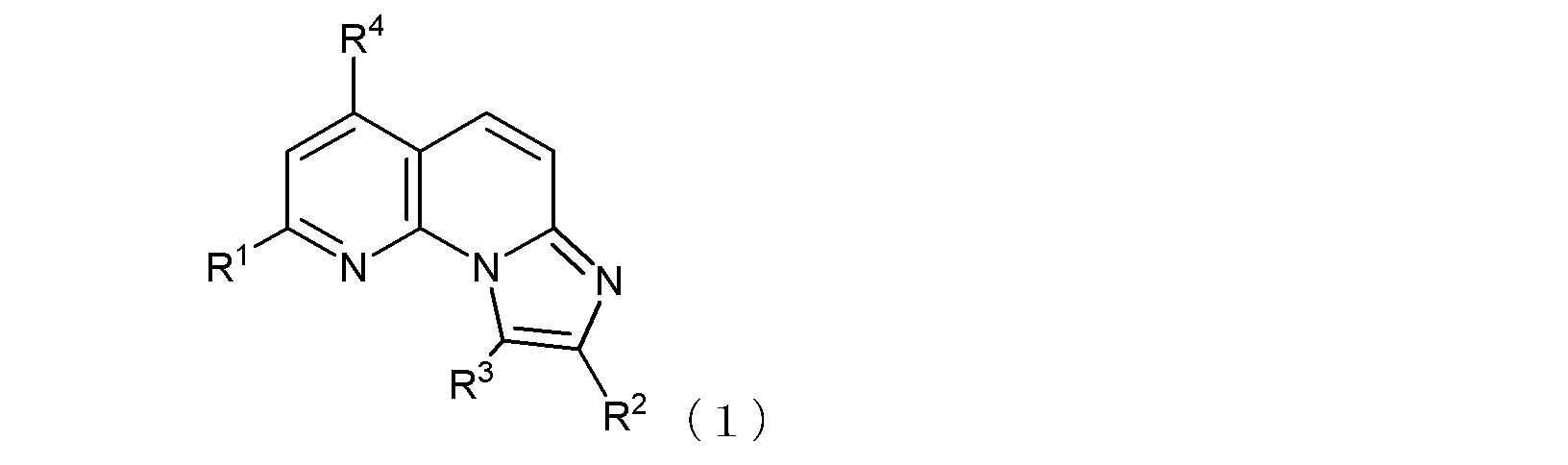
項1.
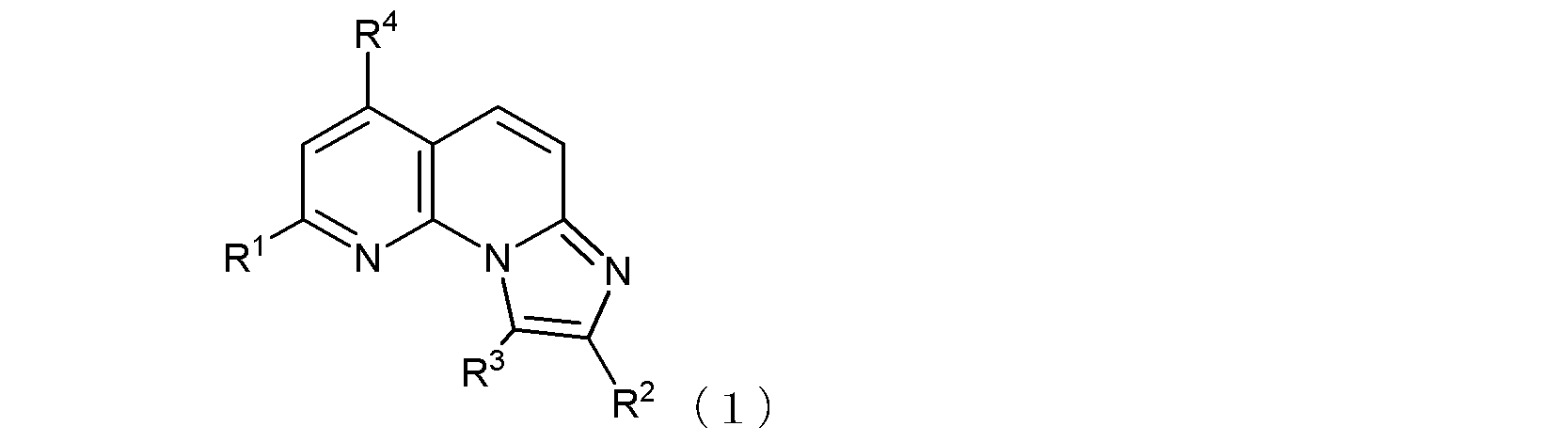
式(1):
項1.
式(1):
(式中、R1及びR4は同一又は異なって、メチル基、トリフルオロメチル基、ハロゲン原子、ヒドロキシル基、あるいは、末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2は、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基、ホルミルアミノ基、ピリジル基、又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
以下の式(1-1):
R2は、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基、ホルミルアミノ基、ピリジル基、又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
以下の式(1-1):
〔式中、Aは、酸素原子又は硫黄原子を示し、Xは窒素原子又は炭素原子を示し、Rz1は、水素原子、あるいは末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基を示す。〕で示される基、あるいは、
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
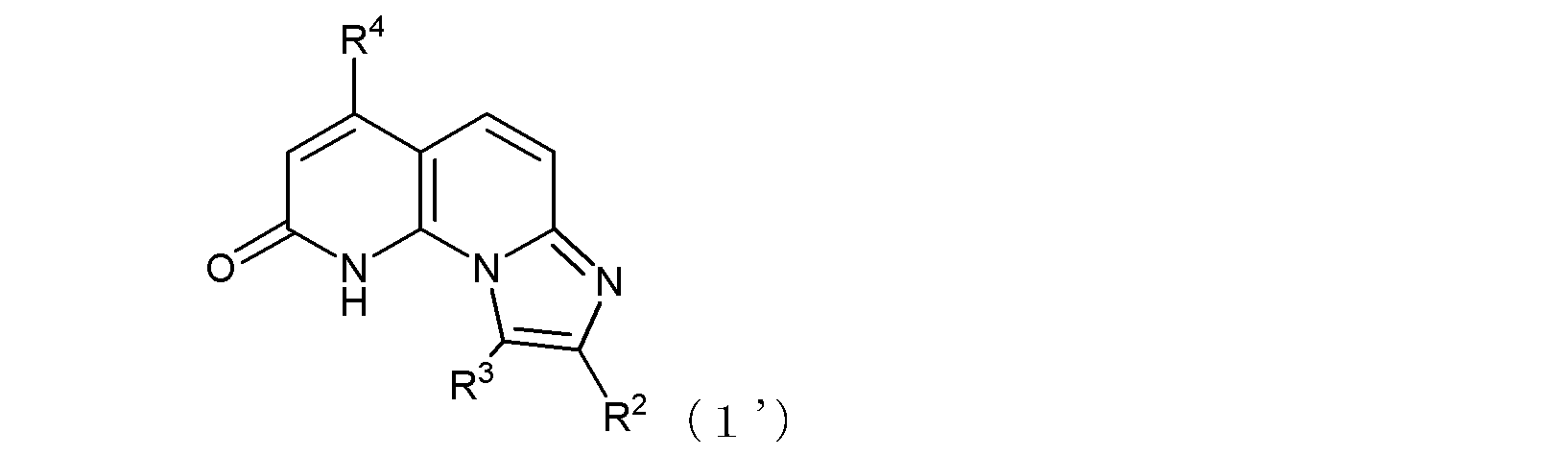
R3は水素原子又は低級アルキル基を示す。
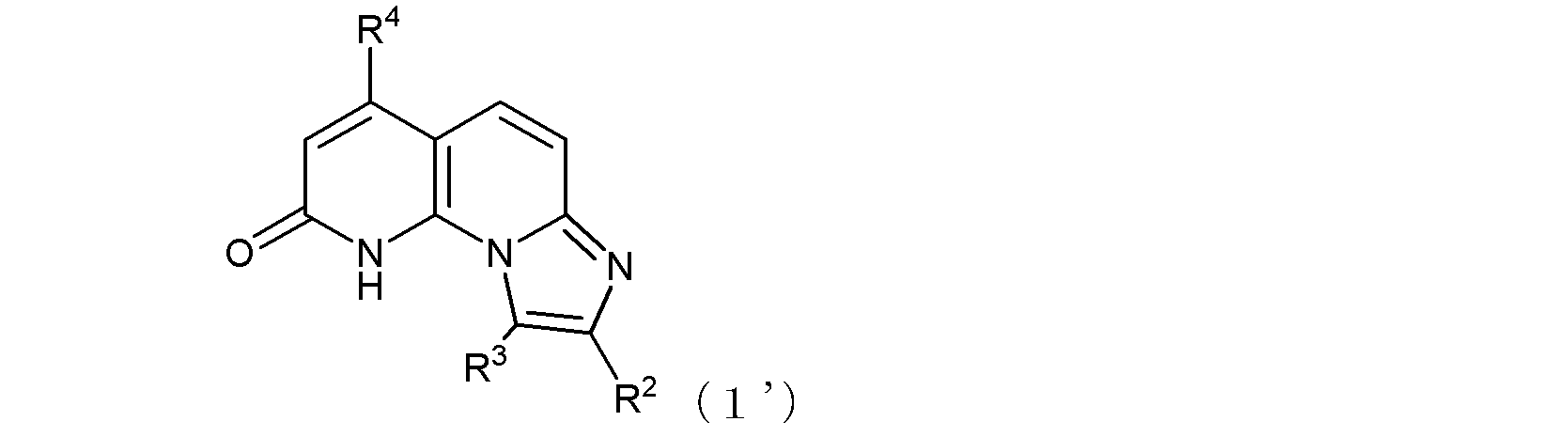
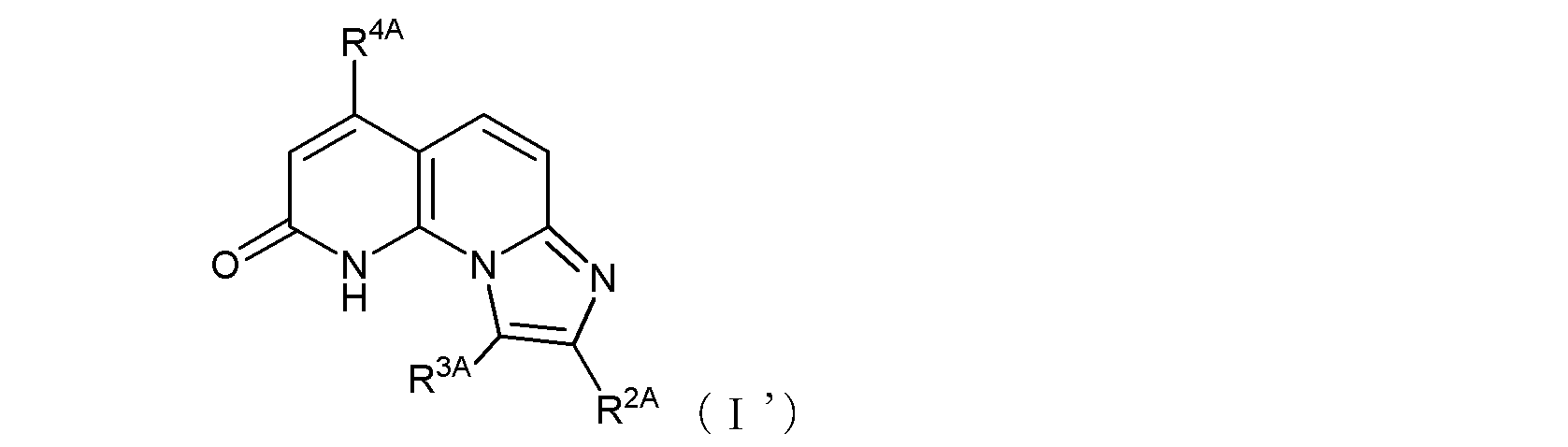
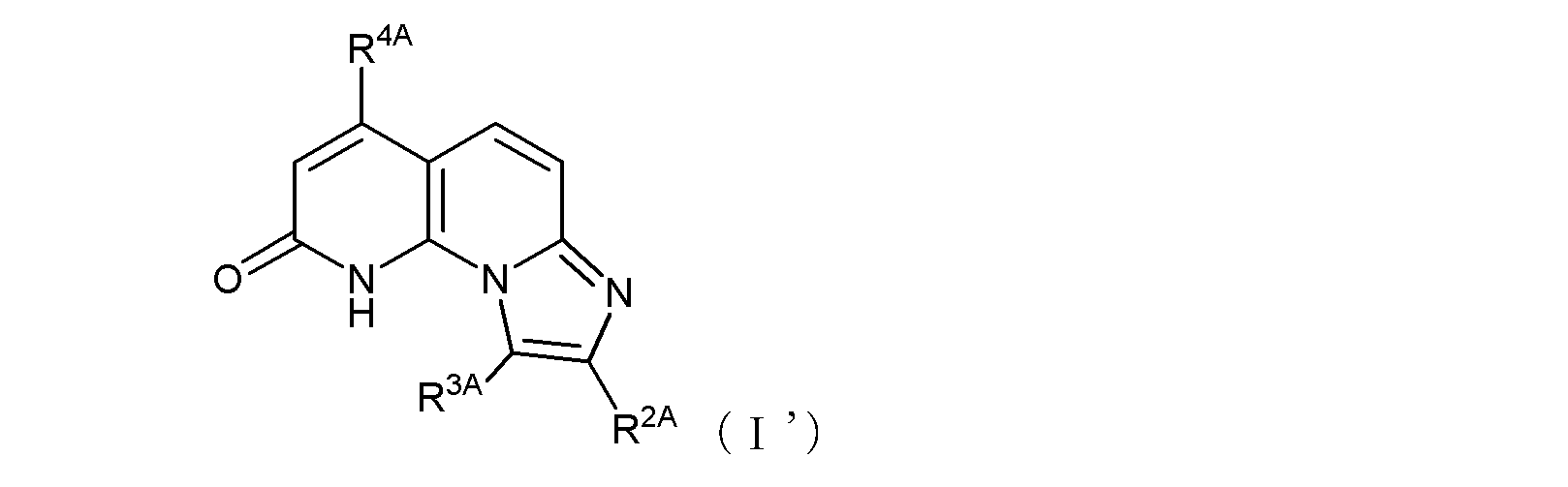
ここで、R1がヒドロキシル基である場合には、式(1)は、その互変異性体〔つまり、以下の式(1’)で示される化合物:式中、R2、R3、及びR4は式(1)におけるそれらと同じ〕をも含む。
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
R3は水素原子又は低級アルキル基を示す。
ここで、R1がヒドロキシル基である場合には、式(1)は、その互変異性体〔つまり、以下の式(1’)で示される化合物:式中、R2、R3、及びR4は式(1)におけるそれらと同じ〕をも含む。
但し、R1及びR4がともにトリフルオロメチル基であり、R3が水素原子であり、且つR2が式(1-1)で示される基であってAが酸素原子を示す場合は、Rz1は水素原子ではない。)
で示される化合物、又はその薬学的に許容される塩を含む、
抗B型肝炎ウイルス剤。
項2.
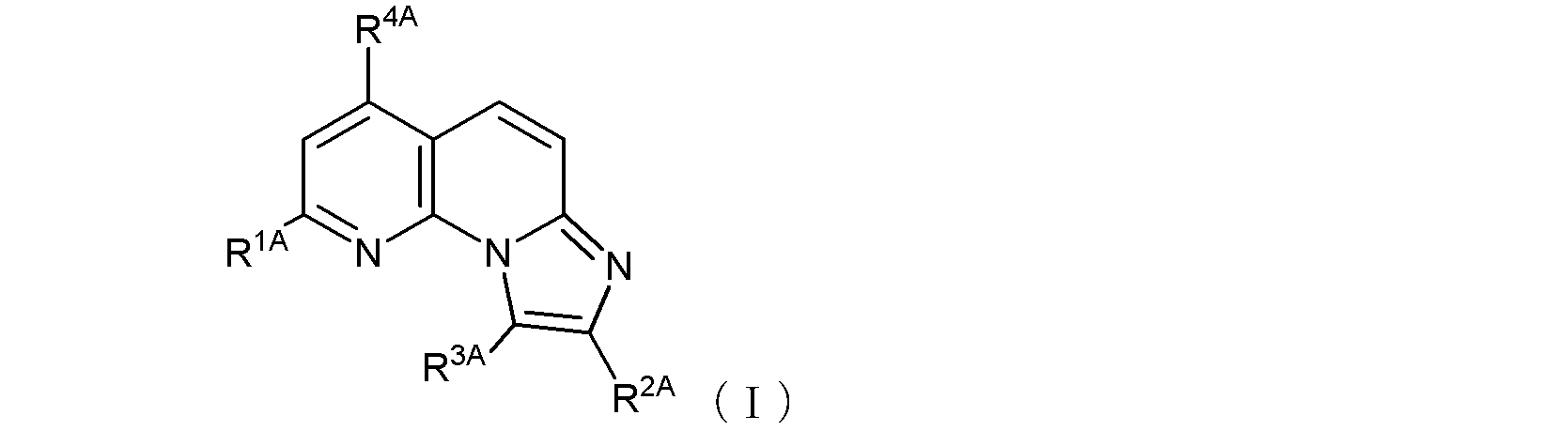
式(1)で示される化合物が、式(I):
で示される化合物、又はその薬学的に許容される塩を含む、
抗B型肝炎ウイルス剤。
項2.
式(1)で示される化合物が、式(I):
(式中、R1A及びR4Aは同一又は異なって、メチル基、トリフルオロメチル基、ハロゲン原子、ヒドロキシル基、又は、末端炭素原子に結合した水素原子が、ヒドロキシル基で置換されていてもよい低級アルコキシ基を示し、
R2Aは、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子、又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基で置換されていてもよいカルバモイル基、あるいは
以下の式(I-A1):
R2Aは、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子、又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基で置換されていてもよいカルバモイル基、あるいは
以下の式(I-A1):
〔式中、Xは窒素原子又は炭素原子を示し、Ra1は、水素原子又は低級アルキル基を示す。〕で示される基、
を示し、
R3Aは水素原子又は低級アルキル基を示す。
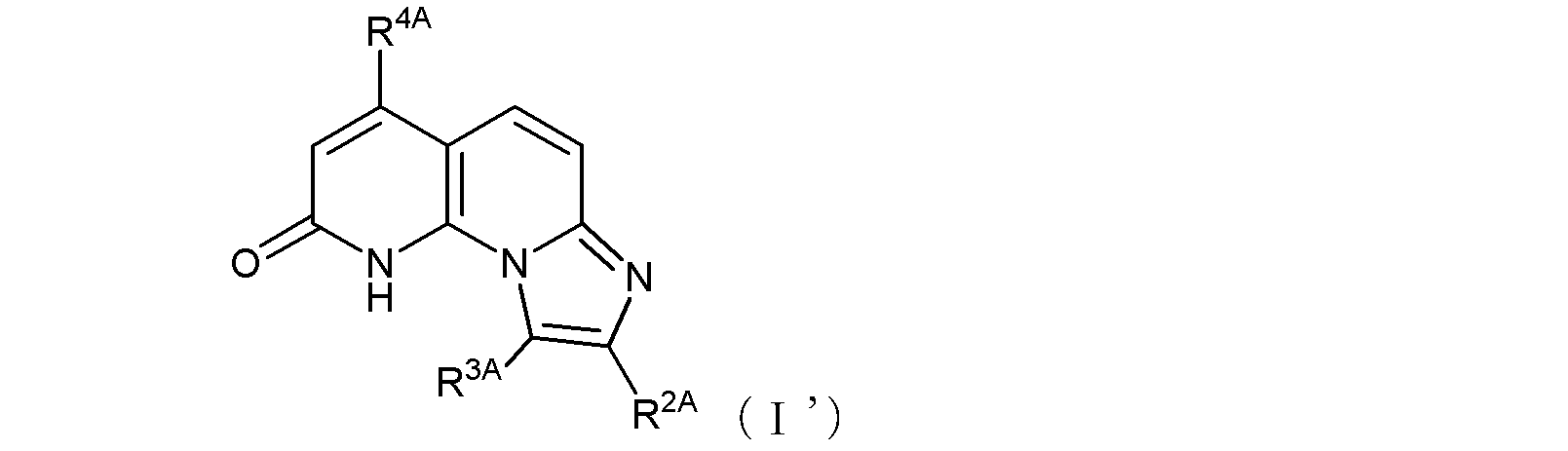
ここで、R1Aがヒドロキシル基である場合には、式(I)は、その互変異性体〔つまり、以下の式(I’)で示される化合物:式中R2A、R3A、及びR4Aは式(I)におけるそれらと同じ〕をも含む。
を示し、
R3Aは水素原子又は低級アルキル基を示す。
ここで、R1Aがヒドロキシル基である場合には、式(I)は、その互変異性体〔つまり、以下の式(I’)で示される化合物:式中R2A、R3A、及びR4Aは式(I)におけるそれらと同じ〕をも含む。
但し、R1A及びR4Aがともにトリフルオロメチル基であり、R3Aが水素原子であり、且つR2Aが式(I-A1)で示される基であってXが窒素原子を示すときは、Ra1はメチル基である。)
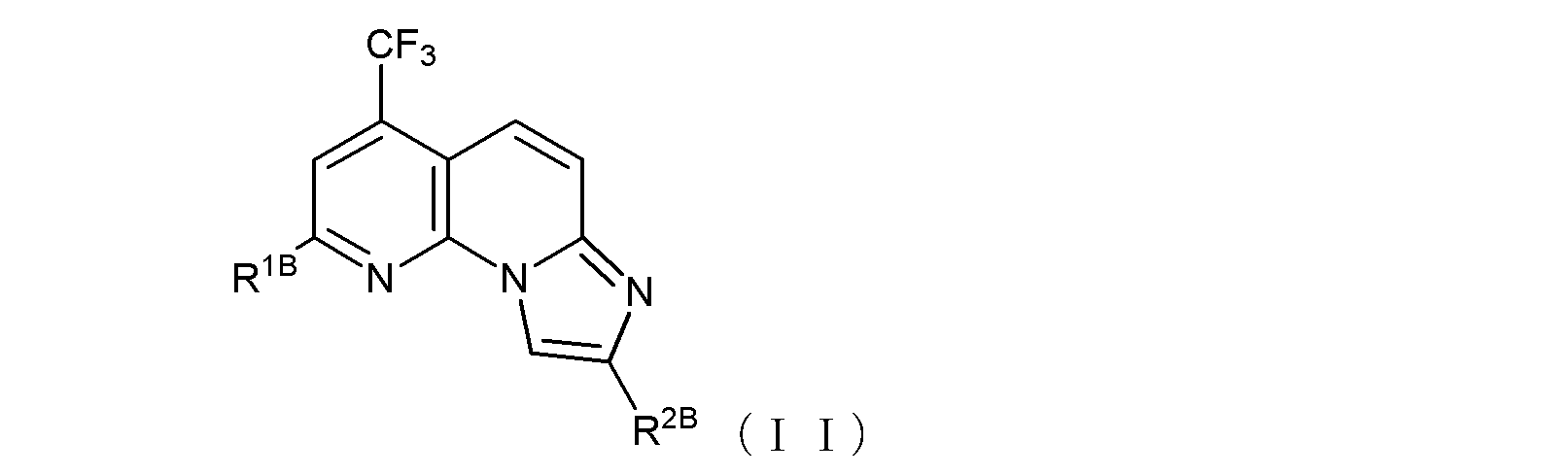
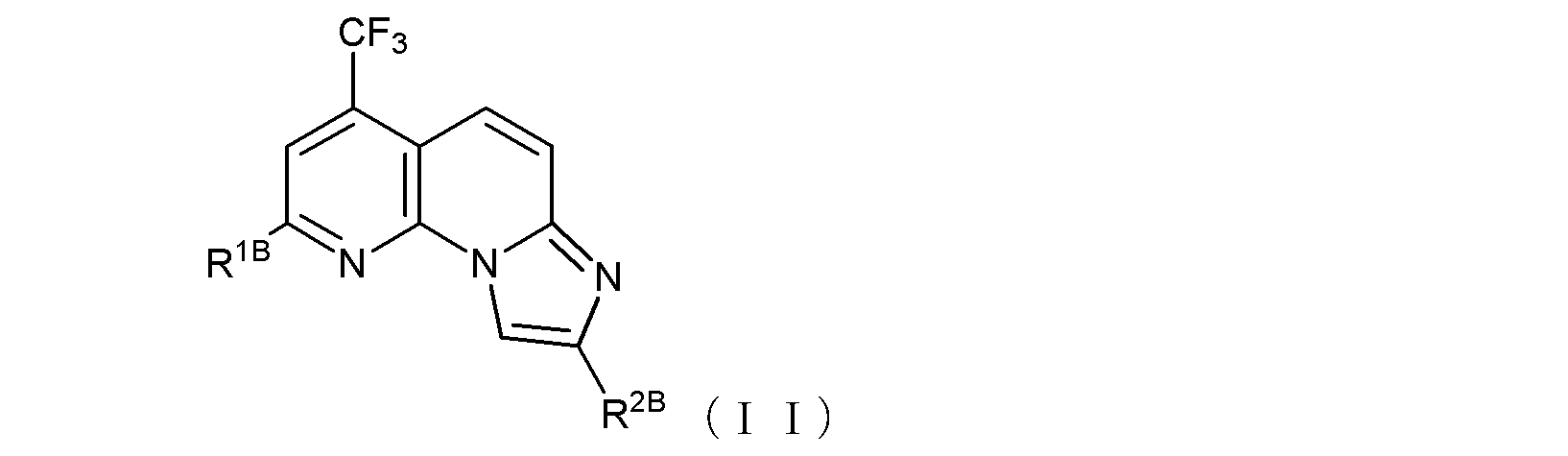
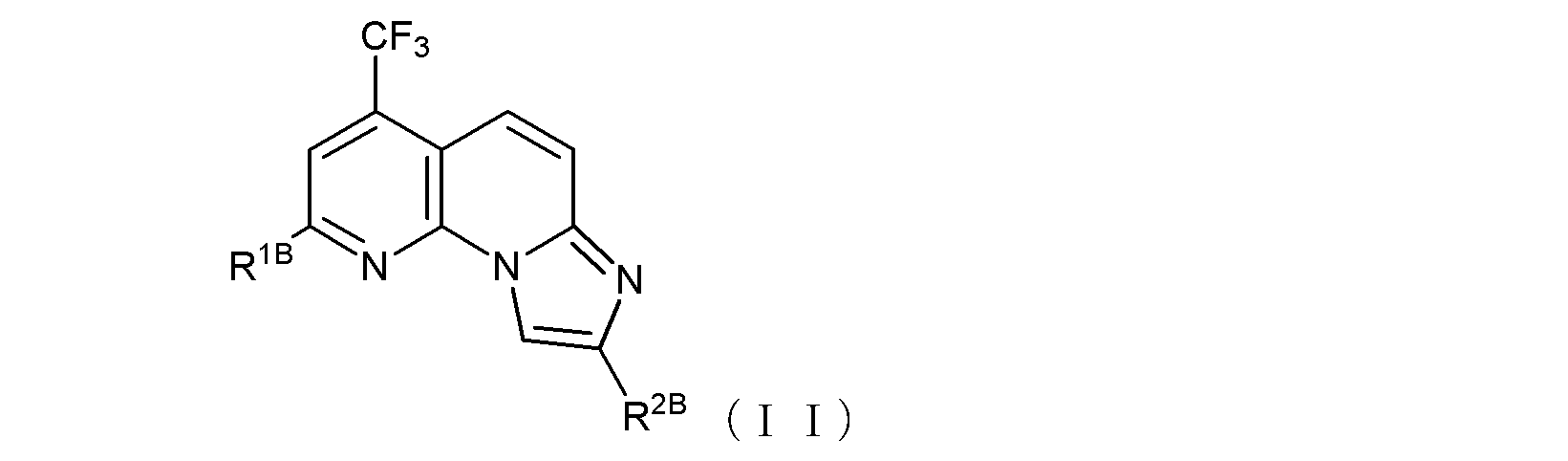
で示される化合物であるか、又は、式(II):
で示される化合物であるか、又は、式(II):
(式中、R1Bは、トリフルオロメチル基、ハロゲン原子、あるいは、
末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2Bは、カルボキシルメチル基、カルボキシルエチル基、あるいは
窒素原子に結合した水素原子がホルミルアミノ基、ピリジル基又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
式(II-B1):
末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2Bは、カルボキシルメチル基、カルボキシルエチル基、あるいは
窒素原子に結合した水素原子がホルミルアミノ基、ピリジル基又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
式(II-B1):
〔式中、Abは、酸素原子又は硫黄原子を示し、Xは窒素原子又は炭素原子を示し、Rb1は、水素原子、あるいは末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基を示す。〕で示される基、あるいは、
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
ここで、R2Bと、R2Bの結合する炭素原子との間に-C≡C-基が含まれていてもよく、
但し、R1Bがトリフルオロメチル基又は塩素原子であり、R2BとR2Bの結合する炭素原子との間に-C≡C-基が含まれておらず、且つR2Bが式(II-B1)で示される基である場合、Xが窒素原子を示すときRb1は炭素数2~6のアルキル基であり、Xが炭素原子を示すときRb1は水素原子ではない。)
で示される化合物である、
項1に記載の抗B型肝炎ウイルス剤。
項3.
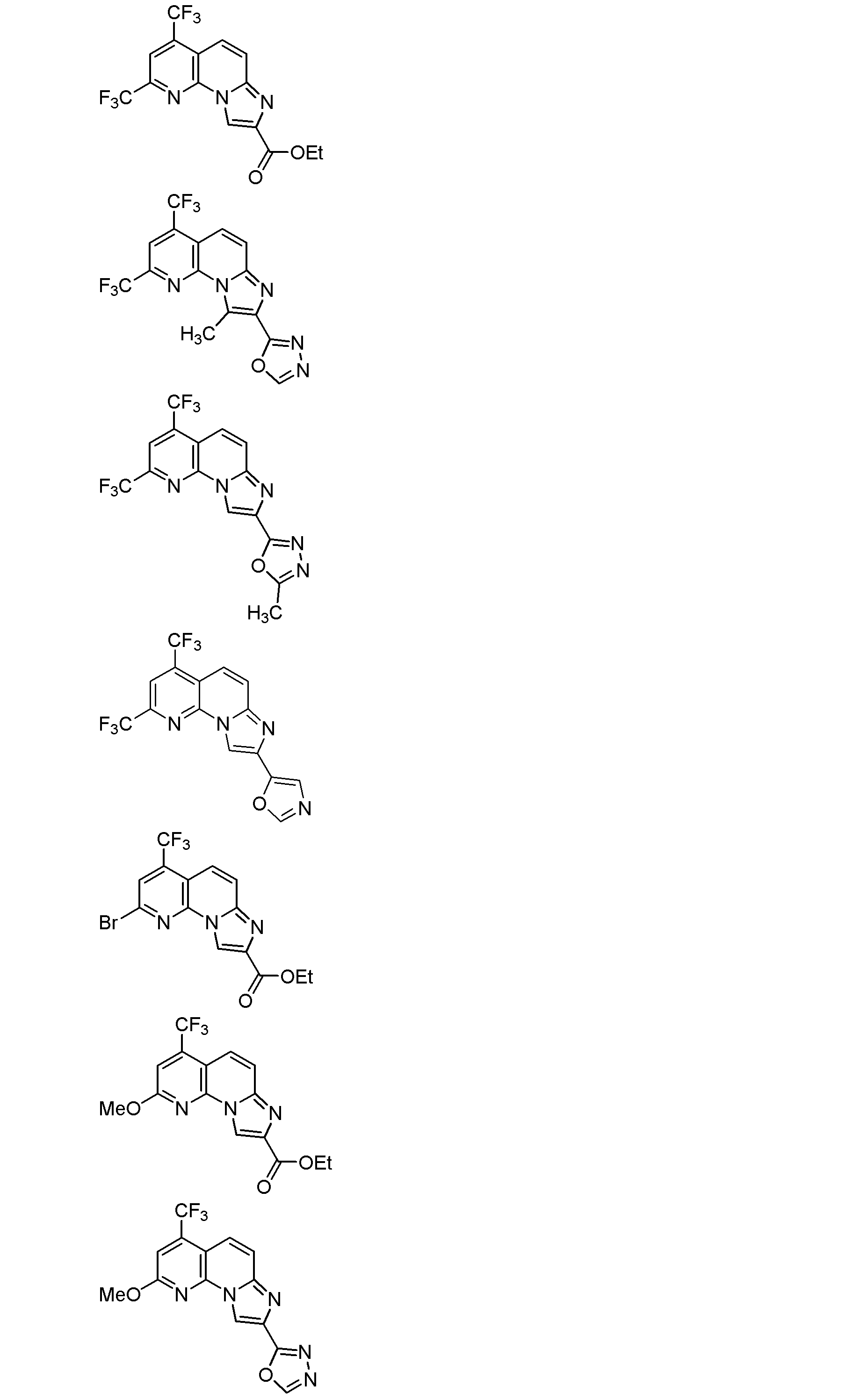
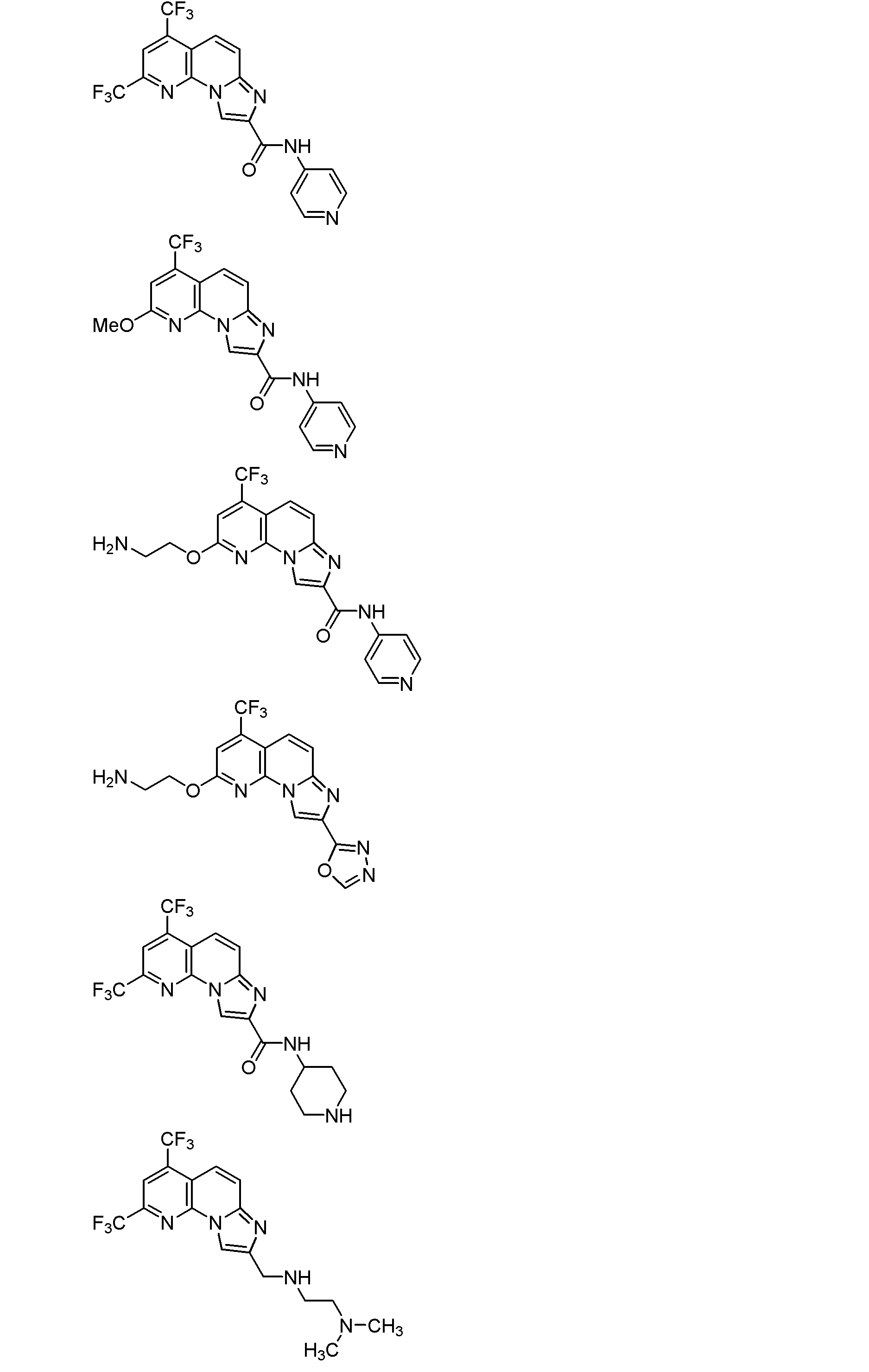
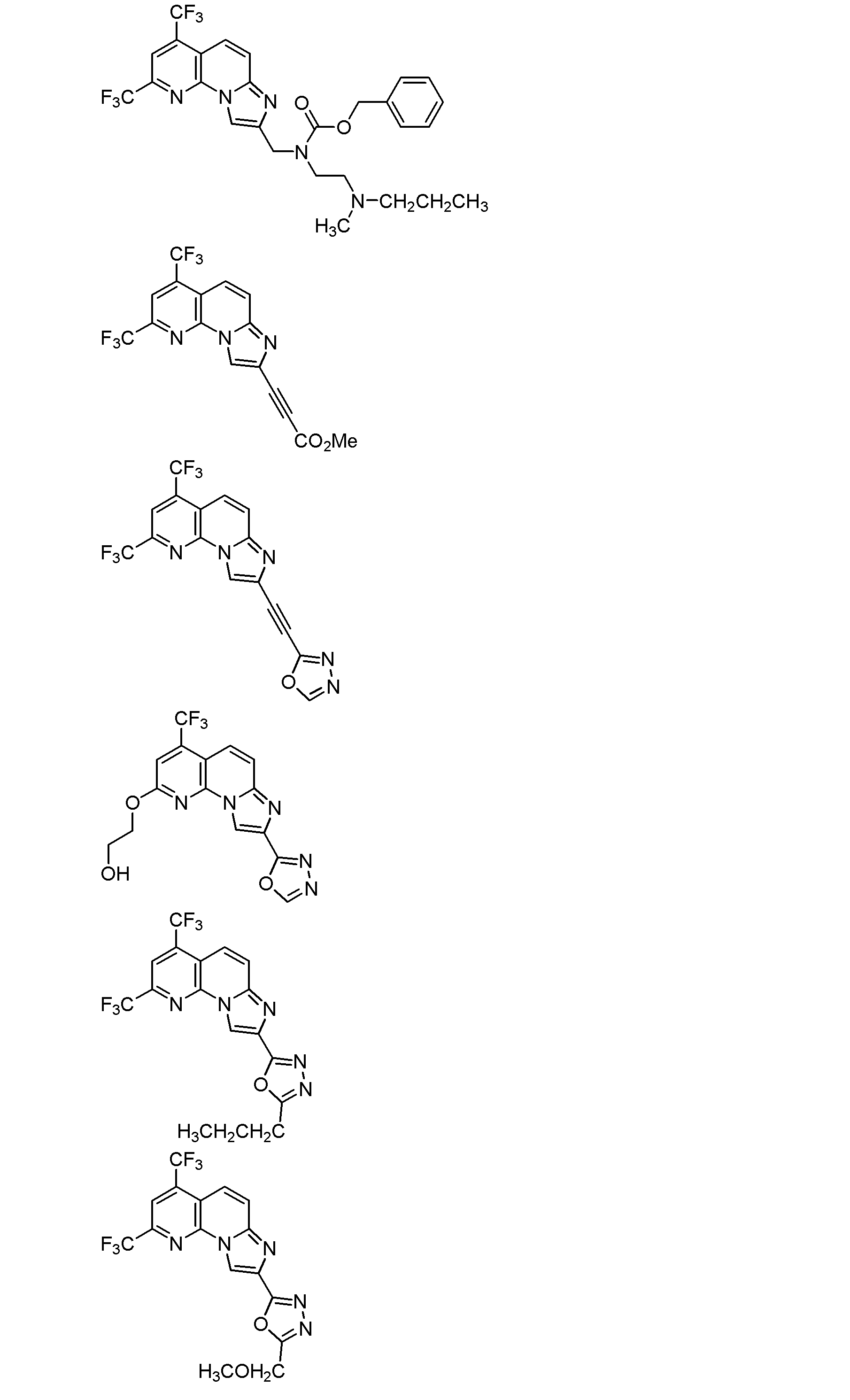
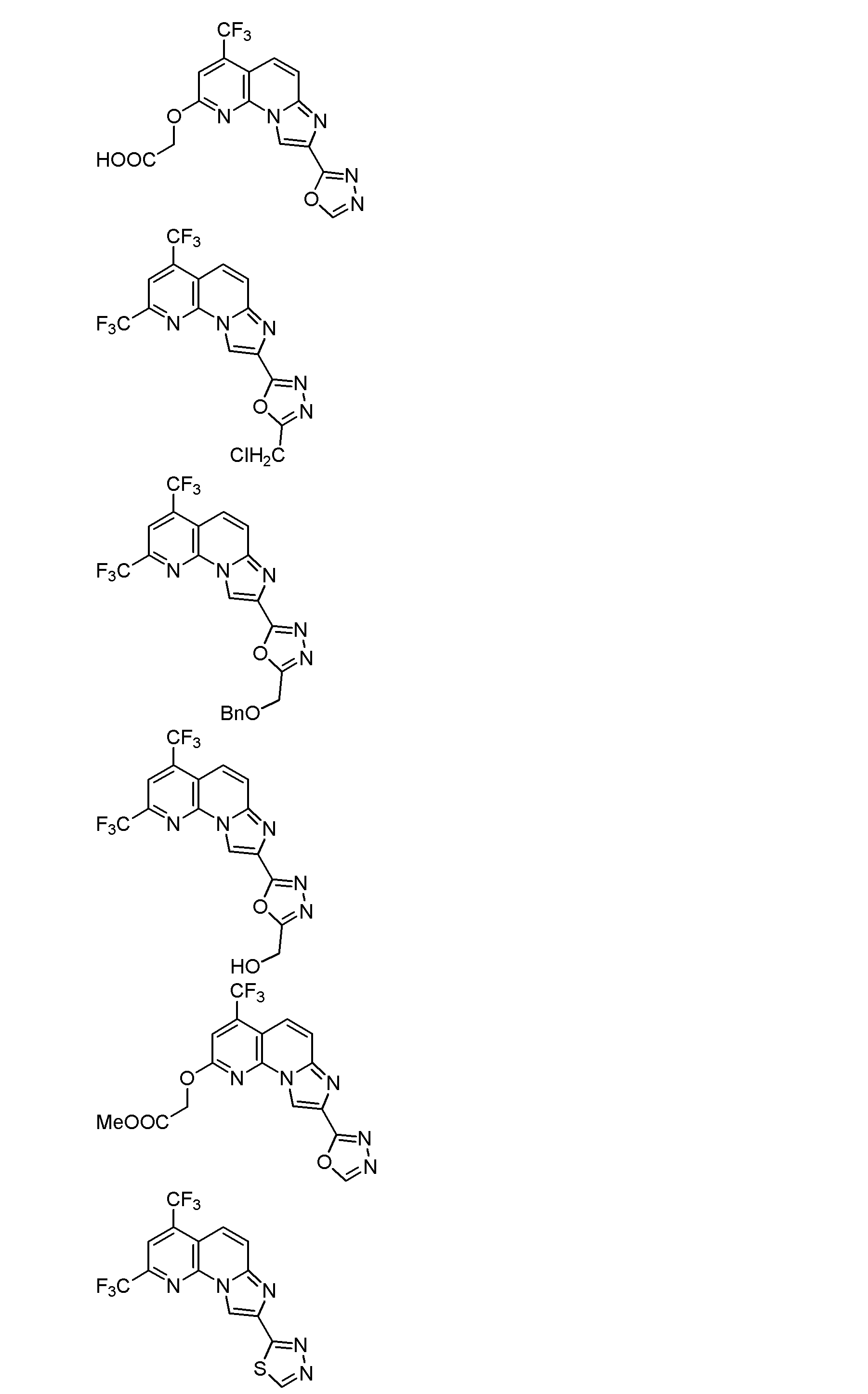
式(1)で示される化合物が、以下のいずれかの式(式中、Meはメチル基を、Etはエチル基を、Bnはベンジル基を、それぞれ示す。)で示される化合物である、項1に記載の項B型肝炎ウイルス剤。
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
ここで、R2Bと、R2Bの結合する炭素原子との間に-C≡C-基が含まれていてもよく、
但し、R1Bがトリフルオロメチル基又は塩素原子であり、R2BとR2Bの結合する炭素原子との間に-C≡C-基が含まれておらず、且つR2Bが式(II-B1)で示される基である場合、Xが窒素原子を示すときRb1は炭素数2~6のアルキル基であり、Xが炭素原子を示すときRb1は水素原子ではない。)
で示される化合物である、
項1に記載の抗B型肝炎ウイルス剤。
項3.
式(1)で示される化合物が、以下のいずれかの式(式中、Meはメチル基を、Etはエチル基を、Bnはベンジル基を、それぞれ示す。)で示される化合物である、項1に記載の項B型肝炎ウイルス剤。
なお、上記各式で示される化合物は、本発明に係る抗B型肝炎ウイルス剤に含まれる化合物として好ましい。ただし、これらの化合物のうち、1又は複数の化合物を、本発明に係る抗B型肝炎ウイルス剤に含まれる化合物から除いてもよい。
項4.
抗B型肝炎ウイルス核酸アナログ剤と、請求項1、2又は3に記載の化合物又はその薬学的に許容される塩とを含むか、あるいは、
抗B型肝炎ウイルス核酸アナログ剤を投与された若しくは投与される対象に、項1、2又は3に記載の化合物又はその薬学的に許容される塩を投与するように用いられる
抗B型肝炎ウイルス剤。
項5.
式(1):
項4.
抗B型肝炎ウイルス核酸アナログ剤と、請求項1、2又は3に記載の化合物又はその薬学的に許容される塩とを含むか、あるいは、
抗B型肝炎ウイルス核酸アナログ剤を投与された若しくは投与される対象に、項1、2又は3に記載の化合物又はその薬学的に許容される塩を投与するように用いられる
抗B型肝炎ウイルス剤。
項5.
式(1):
(式中、R1及びR4は同一又は異なって、メチル基、トリフルオロメチル基、ハロゲン原子、ヒドロキシル基、あるいは、末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、ここで、R1がヒドロキシル基である場合には、式(1)は、その互変異性体〔つまり、以下の式(1’)で示される化合物:式中、R2、R3、及びR4は式(1)と同じ〕をも含み、
R2は、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基、ピリジル基、又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
以下の式(1-1):
ハロゲン原子又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基、ピリジル基、又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
以下の式(1-1):
〔式中、Aは、酸素原子又は硫黄原子を示し、Xは窒素原子又は炭素原子を示し、Rz1は、水素原子、あるいは末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基を示す。〕で示される基、あるいは、
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
R3は水素原子又は低級アルキル基を示す。
但し、R1及びR4がともにトリフルオロメチル基であり、R3が水素原子であり、且つR2が式(1-1)で示される基であってAが酸素原子を示す場合は、Rz1は水素原子ではない。)
で示される化合物、又はその薬学的に許容される塩を含む、
インターフェロン疑似薬。
項6.
式(II):
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
R3は水素原子又は低級アルキル基を示す。
但し、R1及びR4がともにトリフルオロメチル基であり、R3が水素原子であり、且つR2が式(1-1)で示される基であってAが酸素原子を示す場合は、Rz1は水素原子ではない。)
で示される化合物、又はその薬学的に許容される塩を含む、
インターフェロン疑似薬。
項6.
式(II):
(式中、R1Bは、トリフルオロメチル基、ハロゲン原子、あるいは、
末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2Bは、カルボキシルメチル基、カルボキシルエチル基、あるいは
窒素原子に結合した水素原子がピリジル基又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
式(II-B1):
末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2Bは、カルボキシルメチル基、カルボキシルエチル基、あるいは
窒素原子に結合した水素原子がピリジル基又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
式(II-B1):
〔式中、Abは、酸素原子又は硫黄原子を示し、Xは窒素原子又は炭素原子を示し、Rb1は、水素原子、あるいは末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基を示す。〕で示される基、あるいは、
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
ここで、R2Bと、R2Bの結合する炭素原子との間に-C≡C-基が含まれていてもよく、
但し、R1Bがトリフルオロメチル基又は塩素原子であり、R2BとR2Bの結合する炭素原子との間に-C≡C-基が含まれておらず、且つR2Bが式(II-B1)で示される基である場合、Xが窒素原子を示すときRb1は炭素数2~6のアルキル基であり、Xが炭素原子を示すときRb1は水素原子ではない。)
で示される化合物又はその薬学的に許容される塩。
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
ここで、R2Bと、R2Bの結合する炭素原子との間に-C≡C-基が含まれていてもよく、
但し、R1Bがトリフルオロメチル基又は塩素原子であり、R2BとR2Bの結合する炭素原子との間に-C≡C-基が含まれておらず、且つR2Bが式(II-B1)で示される基である場合、Xが窒素原子を示すときRb1は炭素数2~6のアルキル基であり、Xが炭素原子を示すときRb1は水素原子ではない。)
で示される化合物又はその薬学的に許容される塩。
本発明に係る抗B型肝炎ウイルス剤により、効率的にHBVを予防および/または治療できる。
以下、本発明の各実施形態について、さらに詳細に説明する。なお、本明細書において、化合物を表す式中、メチル基をMe、エチル基をEt、ベンジル基をBn、と示すことがある。
本発明に包含される抗B型肝炎ウイルス剤は、特定の構造を有する化合物、又はその薬学的に許容される塩を含む。
当該化合物は、式(1):
(式中、R1及びR4は同一又は異なって、メチル基、トリフルオロメチル基、ハロゲン原子〔好ましくはF、Br、又はClであり、より好ましくはCl〕、ヒドロキシル基、あるいは、末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、ここで、R1がヒドロキシル基である場合には、式(1)は、その互変異性体〔つまり、以下の式(1’)で示される化合物:式中R2、R3、及びR4は式(1)と同じ〕をも含み、
R2は、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子〔好ましくはF、Br、又はClであり、より好ましくはF〕又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基、ピリジル基(好ましくは2-ピリジル基、3-ピリジル基、又は4-ピリジル基であり、より好ましくは4-ピリジル基)、又はピペリジル基(好ましくは1-ピペリジル基、2-ピペリジル基、3-ピペリジル基、又は4-ピペリジル基であり、より好ましくは4-ピペリジル基)で置換されていてもよいカルバモイル基、あるいは
以下の式(1-1):
ハロゲン原子〔好ましくはF、Br、又はClであり、より好ましくはF〕又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基、ピリジル基(好ましくは2-ピリジル基、3-ピリジル基、又は4-ピリジル基であり、より好ましくは4-ピリジル基)、又はピペリジル基(好ましくは1-ピペリジル基、2-ピペリジル基、3-ピペリジル基、又は4-ピペリジル基であり、より好ましくは4-ピペリジル基)で置換されていてもよいカルバモイル基、あるいは
以下の式(1-1):
〔式中、Aは、酸素原子又は硫黄原子を示し、Xは窒素原子又は炭素原子を示し、Rz1は、水素原子、あるいは末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基を示す。〕で示される基、あるいは、
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
R3は水素原子又は低級アルキル基を示す。
但し、R1及びR4がともにトリフルオロメチル基であり、R3が水素原子であり、且つR2が式(1-1)で示される基であってAが酸素原子を示しXが窒素原子を示す場合は、Rz1は水素原子ではない。)
で示される化合物である。
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
R3は水素原子又は低級アルキル基を示す。
但し、R1及びR4がともにトリフルオロメチル基であり、R3が水素原子であり、且つR2が式(1-1)で示される基であってAが酸素原子を示しXが窒素原子を示す場合は、Rz1は水素原子ではない。)
で示される化合物である。
上記の通り、R1及びR4は同一又は異なってよい。R4はメチル基又はトリフルオロメチル基であることが好ましい。R4はメチル基又はトリフルオロメチル基でない場合には、R1がメチル基又はトリフルオロメチル基であることが好ましく、トリフルオロメチル基であることがより好ましい。
また、(i)末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基としては、炭素数1~6(1、2、3、4、5又は6)のアルコキシ基が好ましく、炭素数1~4のアルコキシ基がより好ましく、炭素数1~3のアルコキシ基がさらに好ましく、炭素数1又は2のアルコキシ基がよりさらに好ましい。当該低級アルコキシ基の炭素鎖は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。
ここでのカルボキシアルキル基のアルキル基としては、炭素数1~4のアルキル基が好ましく、炭素数1~3のアルキル基がより好ましく、炭素数1又は2のアルキル基がさらに好ましい。(すなわち、ここでのカルボキシアルキル基は、炭素数1~4、1~3、1又は2のカルボキシアルキル基であり得る。)また、当該カルボキシアルキル基は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。当該カルボキシアルキル基としては、具体的には、カルボキシメチル基(-COOCH3)、カルボキシエチル基(-COOCH2CH3)などが好ましく例示できる。
ここでのアルコキシ基(すなわち、前記低級アルコキシ基の末端炭素原子に結合した水素原子と置換され得るアルコキシ基)としては、炭素数1~6(1、2、3、4、5、又は6)、1~4、1~3、又は1~2のアルコキシ基が好ましい。また、当該アルコキシ基は直鎖状又は分岐鎖状であり得る。当該アルコキシ基としては、具体的には、-OCH3、-OCH2CH3、-OCH2CH2CH3、-OCH(CH3)CH3、-OCH2CH2CH2CH3、-OCH2CH(CH3)CH3、-OCH(CH3)CH2CH3、-OCH2CH2CH2CH2CH3、-OCH2CH2CH(CH3)CH3、-OCH2CH(CH3)CH2CH3、-OCH(CH3)CH2CH2CH3などが好ましく例示できる。
ここでのアルキルチオ基としては、炭素数1~6(1、2、3、4、5、又は6)、1~4、1~3、又は1~2のアルキルチオ基が好ましい。また、当該アルキルチオ基は直鎖状又は分岐鎖状であり得る。当該アルキルチオ基としては、具体的には、-SCH3(メチルチオ基)、-SCH2CH3(エチルチオ基)、-SCH2CH2CH3、-SCH(CH3)CH3、-SCH2CH2CH2CH3、-SCH2CH(CH3)CH3、-SCH(CH3)CH2CH3などが好ましく例示できる。
ここでのアルキルスルフィニル基としては、炭素数1~6(1、2、3、4、5、又は6)、1~4、1~3、又は1~2のアルキルスルフィニル基が好ましい。また、当該アルキルスルフィニル基は直鎖状又は分岐鎖状であり得る。当該アルキルスルフィニル基としては、具体的には、-SOCH3、-SOCH2CH3、-SOCH2CH2CH3、-SCH(CH3)CH3、-SOCH2CH2CH2CH3、-SOCH2CH(CH3)CH3、-SOCH(CH3)CH2CH3などが好ましく例示できる。
ここでのアルキルスルホニル基としては、炭素数1~6(1、2、3、4、5、又は6)、1~4、1~3、又は1~2のアルキルスルホニル基が好ましい。また、当該アルキルスルホニル基は直鎖状又は分岐鎖状であり得る。当該アルキルスルホニル基としては、具体的には、-SO2CH3、-SO2CH2CH3、-SO2CH2CH2CH3、-SO2CH2CH2CH2CH3、-SO2CH2CH(CH3)CH3、-SO2CH(CH3)CH2CH3などが好ましく例示できる。
当該(i)低級アルコキシ基の末端炭素原子に結合した水素原子が置換されている場合、置換される水素原子数は1又は2であることが好ましく、1であることがより好ましい。また、当該(i)低級アルコキシ基が有する炭素鎖は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。
当該(i)低級アルコキシ基としては、特に制限されるわけではないが、具体的には、例えば-OCH3、-OCH2CH3、-OCH2CH2CH3、-OCH(CH3)CH3、-OCH2CH2CH2CH3、-OCH2CH(CH3)CH3、-OCH(CH3)CH2CH3、-OCH2CH2CH2CH2CH3、-OCH2CH2CH(CH3)CH3、-OCH2CH(CH3)CH2CH3、-OCH(CH3)CH2CH2CH3、-OCH2OH、-OCH2CH2OH、-OCH2COOH、-OCH2CH2COOH、-OCH2COOCH3、-OCH2CH2COOCH3、-OCH2COOCH2CH3、-OCH2CH2COOCH2CH3、
-OCH2CH2CH3、-OCH2CH2OCH3、-OCH2OCH2CH3、
-OCH2CH2CH2OCH3、-OCH2CH2OCH2CH3、-OCH2OCH2CH2CH3、-OCH2OCH(CH3)CH3、-OCH(CH3)CH2OCH3、
-OCH2SH、-OCH2CH2SH、-OCH2CH2CH2SH、-OCH(CH3)CH2SH、-OCH2CH2CH2CH2SH、-OCH2CH(CH3)CH2SH、-OCH(CH3)CH2CH2SH、-OCH2CH2CH2CH2CH2SH、-OCH2CH2CH(CH3)CH2SH、-OCH2CH(CH3)CH2CH2SH、-OCH(CH3)CH2CH2CH2SH、
-OCH2SCH3、-OCH2CH2SCH3、-OCH2SCH2CH3、
-OCH2CH2CH2SCH3、-OCH2CH2SCH2CH3、-OCH2SCH2CH2CH3、
-OCH2SCH(CH3)CH3、
-OCH2CH(CH3)SCH3、
-OCH(CH3)CH2SCH3、-OCH(CH3)SCH2CH3、
-OCH2CH2CH2CH2SCH3、-OCH2CH2CH2SCH2CH3、-OCH2CH2SCH2CH2CH3、-OCH2SCH2CH2CH2CH3、
-OCH2CH2SCH(CH3)CH3、-OCH2SCH2CH(CH3)CH3、
-OCH2CH2CH(CH3)SCH3、-OCH2SCH(CH3)CH2CH3、
-OCH2CH(CH3)CH2SCH3、-OCH2CH(CH3)SCH2CH3、
-OCH(CH3)CH2CH2SCH3、-OCH(CH3)CH2SCH2CH3、-OCH(CH3)SCH2CH2CH3、
-OCH2CH2CH2CH2CH2SCH3、-OCH2CH2CH2CH2SCH2CH3、-OCH2CH2CH2SCH2CH2CH3、-OCH2CH2SCH2CH2CH2CH3、-OCH2SCH2CH2CH2CH2CH3、
-OCH2CH2CH2SCH(CH3)CH3、-OCH2CH2SCH2CH(CH3)CH3、-OCH2SCH2CH2CH(CH3)CH3、
-OCH2CH2CH2CH(CH3)SCH3、-OCH2CH2SCH(CH3)CH2CH3、-OCH2SCH2CH(CH3)CH2CH3、
-OCH2CH2CH(CH3)CH2SCH3、-OCH2CH2CH(CH3)SCH2CH3、-OCH2SCH(CH3)CH2CH2CH3、
-OCH2CH(CH3)CH2CH2SCH3、-OCH2CH(CH3)CH2SCH2CH3、-OCH2CH(CH3)SCH2CH2CH3、
-OCH(CH3)CH2CH2CH2SCH3、-OCH(CH3)CH2CH2SCH2CH3、-OCH(CH3)CH2SCH2CH2CH3、-OCH(CH3)SCH2CH2CH2CH3、
-OCH2SOCH3、-OCH2CH2SOCH3、-OCH2SOCH2CH3、-OCH2CH2SOCH2CH3、
-OCH2SO2CH3、-OCH2CH2SO2CH3、-OCH2SO2CH2CH3、-OCH2CH2SO2CH2CH3、
-OCH2NH2、-OCH2CH2NH2、等が好ましく例示できる。
-OCH2CH2CH3、-OCH2CH2OCH3、-OCH2OCH2CH3、
-OCH2CH2CH2OCH3、-OCH2CH2OCH2CH3、-OCH2OCH2CH2CH3、-OCH2OCH(CH3)CH3、-OCH(CH3)CH2OCH3、
-OCH2SH、-OCH2CH2SH、-OCH2CH2CH2SH、-OCH(CH3)CH2SH、-OCH2CH2CH2CH2SH、-OCH2CH(CH3)CH2SH、-OCH(CH3)CH2CH2SH、-OCH2CH2CH2CH2CH2SH、-OCH2CH2CH(CH3)CH2SH、-OCH2CH(CH3)CH2CH2SH、-OCH(CH3)CH2CH2CH2SH、
-OCH2SCH3、-OCH2CH2SCH3、-OCH2SCH2CH3、
-OCH2CH2CH2SCH3、-OCH2CH2SCH2CH3、-OCH2SCH2CH2CH3、
-OCH2SCH(CH3)CH3、
-OCH2CH(CH3)SCH3、
-OCH(CH3)CH2SCH3、-OCH(CH3)SCH2CH3、
-OCH2CH2CH2CH2SCH3、-OCH2CH2CH2SCH2CH3、-OCH2CH2SCH2CH2CH3、-OCH2SCH2CH2CH2CH3、
-OCH2CH2SCH(CH3)CH3、-OCH2SCH2CH(CH3)CH3、
-OCH2CH2CH(CH3)SCH3、-OCH2SCH(CH3)CH2CH3、
-OCH2CH(CH3)CH2SCH3、-OCH2CH(CH3)SCH2CH3、
-OCH(CH3)CH2CH2SCH3、-OCH(CH3)CH2SCH2CH3、-OCH(CH3)SCH2CH2CH3、
-OCH2CH2CH2CH2CH2SCH3、-OCH2CH2CH2CH2SCH2CH3、-OCH2CH2CH2SCH2CH2CH3、-OCH2CH2SCH2CH2CH2CH3、-OCH2SCH2CH2CH2CH2CH3、
-OCH2CH2CH2SCH(CH3)CH3、-OCH2CH2SCH2CH(CH3)CH3、-OCH2SCH2CH2CH(CH3)CH3、
-OCH2CH2CH2CH(CH3)SCH3、-OCH2CH2SCH(CH3)CH2CH3、-OCH2SCH2CH(CH3)CH2CH3、
-OCH2CH2CH(CH3)CH2SCH3、-OCH2CH2CH(CH3)SCH2CH3、-OCH2SCH(CH3)CH2CH2CH3、
-OCH2CH(CH3)CH2CH2SCH3、-OCH2CH(CH3)CH2SCH2CH3、-OCH2CH(CH3)SCH2CH2CH3、
-OCH(CH3)CH2CH2CH2SCH3、-OCH(CH3)CH2CH2SCH2CH3、-OCH(CH3)CH2SCH2CH2CH3、-OCH(CH3)SCH2CH2CH2CH3、
-OCH2SOCH3、-OCH2CH2SOCH3、-OCH2SOCH2CH3、-OCH2CH2SOCH2CH3、
-OCH2SO2CH3、-OCH2CH2SO2CH3、-OCH2SO2CH2CH3、-OCH2CH2SO2CH2CH3、
-OCH2NH2、-OCH2CH2NH2、等が好ましく例示できる。
なお、R1及びR4のいずれか一方にのみ当該(i)低級アルコキシ基であってよく、R1のみ当該(i)低級アルコキシ基であってもよい。
R2で示される、(ii)ハロゲン原子又は低級アルコキシ基で置換されていてもよいフェニル基において、低級アルコキシ基は炭素数1~4のアルコキシ基が好ましく、炭素数1~3のアルコキシ基がより好ましく、炭素数1又は2のアルコキシ基がさらに好ましい。また、ハロゲン原子としては、上記の通りF、Br、又はClが好ましく、Fがより好ましい。フェニル基において置換される水素原子数は1又は2であることが好ましく、1であることがより好ましい。
当該(ii)フェニル基としては、具体的には、フェニル基、メトキシフェニル基(好ましくはp-メトキシフェニル基)、エトキシフェニル基(好ましくはp-エトキシフェニル基)、フルオロフェニル基(好ましくは4-フルオロフェニル基)が好ましく例示できる。
また、R2で示される、(iii)窒素原子に結合した水素原子がアミノ基、ホルミルアミノ基、ピリジル基、又はピペリジル基で置換されていてもよいカルバモイル基において、水素原子が置換される場合は、置換水素原子数は1又は2であることが好ましく、1であることがより好ましい。また、上述の通り、ピリジル基は、好ましくは2-ピリジル基、3-ピリジル基、又は4-ピリジル基であり、より好ましくは4-ピリジル基である。また、ピペリジル基は、好ましくは1-ピペリジル基、2-ピペリジル基、3-ピペリジル基、又は4-ピペリジル基であり、より好ましくは4-ピペリジル基である。
また、R2で示される、式(1-1)で示される基において、Aは酸素原子であることが好ましい。
また、式(1-1)で示される基のRz1は、(iv)末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基であり得、当該(iv)低級アルキル基は炭素数1~4のアルキル基であることが好ましく、炭素数1~3のアルキル基であることがより好ましく、炭素数1又は2のアルキル基であることがさらに好ましい。また、直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。当該(iv)低級アルキル基の末端炭素原子に結合した水素原子が置換される場合、置換水素原子数は1又は2であることが好ましく、1であることがより好ましい。当該水素原子と置換され得るハロゲンとしては、F、Br、又はClが好ましく、Clがより好ましい。また、当該水素原子と置換され得るアルコキシ基としては、炭素数1~4のアルコキシ基が好ましく、炭素数1~3のアルコキシ基がより好ましく、炭素数1又は2のアルコキシ基がさらに好ましい。
また、式(1-1)で示される基のRz1は、(iv)末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基であり得、当該(iv)低級アルキル基は炭素数1~4のアルキル基であることが好ましく、炭素数1~3のアルキル基であることがより好ましく、炭素数1又は2のアルキル基であることがさらに好ましい。また、直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。当該(iv)低級アルキル基の末端炭素原子に結合した水素原子が置換される場合、置換水素原子数は1又は2であることが好ましく、1であることがより好ましい。当該水素原子と置換され得るハロゲンとしては、F、Br、又はClが好ましく、Clがより好ましい。また、当該水素原子と置換され得るアルコキシ基としては、炭素数1~4のアルコキシ基が好ましく、炭素数1~3のアルコキシ基がより好ましく、炭素数1又は2のアルコキシ基がさらに好ましい。
また、Xが窒素原子を示す場合には、式(1-1)で示される基は式(1-1N):
〔式中、A及びRz1は、前記に同じ。〕で示される基であり、Xが炭素原子を示す場合には、式(1-1)で示される基は式(1-1C):
〔式中、A及びRz1は、前記に同じ。〕で示される基である。(つまり、Xが炭素原子を示すとは、Xが基:=CH-であることをいう。)
また、R2で示される、(v)末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基における、N,N-ジアルキルアミノ基としては、以下の式(1-2):
また、R2で示される、(v)末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基における、N,N-ジアルキルアミノ基としては、以下の式(1-2):
(式中、Rz2及びRz3は同一又は異なって、メチル基、エチル基、n-プロピル基、n-ブチル基、イソプロピル基、又はイソブチル基を示し、好ましくはメチル基又はエチル基を示す。)で示される基が例示できる。
また、当該(v)低級アルキル基としては、炭素数1~6(1、2、3、4、5又は6)のアルキル基が好ましく、炭素数1~4のアルキル基がより好ましく、炭素数1~3のアルキル基がさらに好ましく、炭素数1又は2のアルキル基がよりさらに好ましい。当該アルキル基は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。
また、当該(v)低級アルキル基の炭素原子が窒素原子で置換されている場合には、当該置換窒素原子数は1又は2であることが好ましく、1であることがより好ましい。また、置換される炭素原子は、当該低級アルキル基の炭素数にもよるが、末端から1、2、3、4、5又は6番目の炭素原子であり得、R2でが結合する炭素原子に結合する炭素原子あるいは末端の炭素原子ではないことが好ましい。例えば、当該低級アルキル基の炭素数が3である場合は、窒素原子で置換される炭素原子は末端から2番目の炭素原子であることが好ましく、当該低級アルキル基の炭素数が4である場合は、窒素原子で置換される炭素原子は末端から2又は3番目の炭素原子であることが好ましく、当該低級アルキル基の炭素数が5である場合は、窒素原子で置換される炭素原子は末端から2、3又は4番目の炭素原子であることが好ましく、当該低級アルキル基の炭素数が6である場合は、窒素原子で置換される炭素原子は末端から2、3、4又は5番目の炭素原子であることが好ましい。特に好ましい当該(v)低級アルキル基の一例として、次の式(1-3):
(式中、Rz2及びRz3は前記に同じ。)で示される基が挙げられる。
なお、炭素原子が窒素原子で置換された場合、当該窒素原子には水素原子が1つ結合しているが、上述の通り、当該水素原子はベンジルオキシカルボニル基で置換されていてもよい。
R3で示される低級アルキル基は、炭素数1~6(1、2、3、4、5又は6)のアルキル基が好ましく、炭素数1~4のアルキル基がより好ましく、炭素数1~3のアルキル基がさらに好ましく、炭素数1又は2のアルキル基がよりさらに好ましい。当該アルキル基は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。
なお、上述の通り、R1及びR4がともにトリフルオロメチル基であり、R3が水素原子であり、且つR2が式(1-1)で示される基であってAが酸素原子を示す場合は、Rz1は水素原子ではない。言い換えれば、当該場合は、Rz1は上記(iv)低級アルキル基であるということである。
上記の抗B型肝炎ウイルス剤が含む特定の化合物(すなわち、上記式(1)で示される化合物)の中でも、以下に説明する、A群に属する化合物又はB群に属する化合物(それぞれ「A群化合物」「B群化合物」とよぶことがある)が好ましい。なお、A群にもB群にも属する化合物を「AB両群化合物」とよぶことがある。本発明には、A群化合物であってAB両群化合物ではない化合物、並びに、B群化合物であってAB両群化合物ではない化合物、という概念も包含される。当該概念は、A群化合物の範囲が減縮された場合、及び/又はB群化合物の範囲が減縮された場合をも包含する。
A群化合物は、式(I):
(式中、R1A及びR4Aは同一又は異なって、メチル基、トリフルオロメチル基、ハロゲン原子〔好ましくはF、Br、又はClであり、より好ましくはCl〕、ヒドロキシル基、又は、末端炭素原子に結合した水素原子が、ヒドロキシル基で置換されていてもよい低級アルコキシ基を示し、ここで、R1Aがヒドロキシル基である場合には、式(I)は、その互変異性体〔つまり、以下の式(I’)で示される化合物:式中R2A、R3A、及びR4Aは式(I)と同じ〕をも含み、
R2Aは、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子〔好ましくはF、Br、又はClであり、より好ましくはF〕又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基で置換されていてもよいカルバモイル基、あるいは
以下の式(I-A1):
ハロゲン原子〔好ましくはF、Br、又はClであり、より好ましくはF〕又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基で置換されていてもよいカルバモイル基、あるいは
以下の式(I-A1):
〔式中、Xは窒素原子又は炭素原子を示し、Ra1は、水素原子又は低級アルキル基を示す。〕で示される基、
を示し、
R3Aは水素原子又は低級アルキル基を示す。
但し、R1A及びR4Aがともにトリフルオロメチル基であり、R3Aが水素原子であり、且つR2Aが式(I-A1)で示される基であってXが窒素原子を示すときは、Ra1はメチル基である。)
で示される化合物である。
上記の通り、R1A及びR4Aは同一又は異なってよい。末端炭素原子に結合した水素原子が、ヒドロキシル基で置換されていてもよい低級アルコキシ基としては、上記の、R1及びR4で示される、末端炭素原子に結合した水素原子が、ヒドロキシル基で置換されていてもよい低級アルコキシ基についての説明がそのまま当てはまる。
を示し、
R3Aは水素原子又は低級アルキル基を示す。
但し、R1A及びR4Aがともにトリフルオロメチル基であり、R3Aが水素原子であり、且つR2Aが式(I-A1)で示される基であってXが窒素原子を示すときは、Ra1はメチル基である。)
で示される化合物である。
上記の通り、R1A及びR4Aは同一又は異なってよい。末端炭素原子に結合した水素原子が、ヒドロキシル基で置換されていてもよい低級アルコキシ基としては、上記の、R1及びR4で示される、末端炭素原子に結合した水素原子が、ヒドロキシル基で置換されていてもよい低級アルコキシ基についての説明がそのまま当てはまる。
特に制限はされないが、R1A及びR4Aはの組み合わせ(R1A:R4A)は、好ましくは(メチル基:メチル基)、(ヒドロキシル基:メチル基)、(メチル基:トリフルオロメチル基)、(トリフルオロメチル基:トリフルオロメチル基)、又は(ヒドロキシル基:トリフルオロメチル基)、である。
R2Aで示される、低級アルコキシ基で置換されていてもよいフェニル基において、低級アルコキシ基は炭素数1~4のアルコキシ基が好ましく、炭素数1~3のアルコキシ基がより好ましく、炭素数1又は2のアルコキシ基がさらに好ましい。また、フェニル基において置換される水素原子数は1又は2であることが好ましく、1であることがより好ましい。R2Aで示される、低級アルコキシ基で置換されていてもよいフェニル基としては、具体的には、フェニル基、メトキシフェニル基(好ましくはp-メトキシフェニル基)、エトキシフェニル基(好ましくはp-エトキシフェニル基)、フルオロフェニル基(好ましくは4-フルオロフェニル基)が好ましく例示できる。
R2Aで示される、窒素原子に結合した水素原子がアミノ基で置換されていてもよいカルバモイル基としては、具体的には、-CO-NH2、-CO-NH(NH2)、が好ましく例示できる。
式(I-A1)で示される基において、Ra1は水素原子又は低級アルキル基を示す。当該低級アルキル基としては、炭素数1~6(1、2、3、4、5又は6)のアルキル基が好ましく、炭素数1~4のアルキル基がより好ましく、炭素数1~3のアルキル基がさらに好ましく、炭素数1又は2のアルキル基がよりさらに好ましい。当該アルキル基は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。
また、Xが窒素原子を示す場合には、式(I-A1)で示される基は式(I-A1N):
〔式中、Ra1は、前記に同じ。〕で示される基であり、Xが炭素原子を示す場合には、式(I-A1)で示される基は式(I-A1C):
〔式中、Ra1は、前記に同じ。〕で示される基である。(つまり、Xが炭素原子を示すとは、Xが基:=CH-であることをいう。)
R3Aで示される、低級アルキル基としては、炭素数1~6(1、2、3、4、5又は6)のアルキル基が好ましく、炭素数1~4のアルキル基がより好ましく、炭素数1~3のアルキル基がさらに好ましく、炭素数1又は2のアルキル基がよりさらに好ましい。当該アルキル基は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。
R3Aで示される、低級アルキル基としては、炭素数1~6(1、2、3、4、5又は6)のアルキル基が好ましく、炭素数1~4のアルキル基がより好ましく、炭素数1~3のアルキル基がさらに好ましく、炭素数1又は2のアルキル基がよりさらに好ましい。当該アルキル基は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。
B群化合物は、式(II):
(式中、R1Bは、トリフルオロメチル基、ハロゲン原子〔好ましくはF、Br、又はClであり、より好ましくはBr〕、あるいは、
末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2Bは、カルボキシルメチル基、カルボキシルエチル基、あるいは
窒素原子に結合した水素原子がホルミルアミノ基、ピリジル基又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
式(II-B1):
末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2Bは、カルボキシルメチル基、カルボキシルエチル基、あるいは
窒素原子に結合した水素原子がホルミルアミノ基、ピリジル基又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
式(II-B1):
〔式中、Abは、酸素原子又は硫黄原子を示し、Xは窒素原子又は炭素原子を示し、Rb1は、水素原子、あるいは末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基を示す。〕で示される基、あるいは、
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
ここで、R2Bと、R2Bの結合する炭素原子との間に-C≡C-基が含まれていてもよく、
但し、R1Bがトリフルオロメチル基又は塩素原子であり、R2BとR2Bの結合する炭素原子との間に-C≡C-基が含まれておらず、且つR2Bが式(II-B1)で示される基である場合、Xが窒素原子を示すときRb1は炭素数2~6のアルキル基であり、Xが炭素原子を示すときRb1は水素原子ではない。)
で示される化合物である。
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
ここで、R2Bと、R2Bの結合する炭素原子との間に-C≡C-基が含まれていてもよく、
但し、R1Bがトリフルオロメチル基又は塩素原子であり、R2BとR2Bの結合する炭素原子との間に-C≡C-基が含まれておらず、且つR2Bが式(II-B1)で示される基である場合、Xが窒素原子を示すときRb1は炭素数2~6のアルキル基であり、Xが炭素原子を示すときRb1は水素原子ではない。)
で示される化合物である。
R1Bで示される、末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基については、上記(i)低級アルコキシ基の説明が、そのまま当てはまる。
R2Bで示される、窒素原子に結合した水素原子がホルミルアミノ基、ピリジル基又はピペリジル基で置換されていてもよいカルバモイル基において、水素原子が置換される場合は、置換水素原子数は1又は2であることが好ましく、1であることがより好ましい。また、ピリジル基は、好ましくは2-ピリジル基、3-ピリジル基、又は4-ピリジル基であり、より好ましくは4-ピリジル基である。また、ピペリジル基は、好ましくは1-ピペリジル基、2-ピペリジル基、3-ピペリジル基、又は4-ピペリジル基であり、より好ましくは4-ピペリジル基である。
また、R2Bで示される、式(II-B1)で示される基において、Abは酸素原子であることが好ましい。また、式(II-B1)で示される基のRb1は、末端炭素原子に結合した水素原子が、ハロゲン、ヒドロキシル基、ベンジルオキシ基、又はアルコキシ基で置換されていてもよい低級アルキル基であり得、当該低級アルキル基については、上記(iv)低級アルキル基の説明が、そのまま当てはまる。すなわち、当該低級アルキル基としては、炭素数1~4のアルキル基であることが好ましく、炭素数1~3のアルキル基であることがより好ましく、炭素数1又は2のアルキル基であることがさらに好ましい。また、直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。当該低級アルキル基の末端炭素原子に結合した水素原子が置換される場合、置換水素原子数は1又は2であることが好ましく、1であることがより好ましい。当該水素原子と置換され得るハロゲンとしては、F、Br、又はClが好ましく、Clがより好ましい。また、当該水素原子と置換され得るアルコキシ基としては、炭素数1~4のアルコキシ基が好ましく、炭素数1~3のアルコキシ基がより好ましく、炭素数1又は2のアルコキシ基がさらに好ましい。
また、Xが窒素原子を示す場合には、式(II-B1)で示される基は式(II-B1N):
〔式中、Ab及びRb1は、前記に同じ。〕で示される基であり、Xが炭素原子を示す場合には、式(II-B1)で示される基は式(II-B1C):
〔式中、Ab及びRb1は、前記に同じ。〕で示される基である。(つまり、Xが炭素原子を示すとは、Xが基:=CH-であることをいう。)
また、R2Bで示される、末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基については、上記(v)低級アルキル基の説明が、そのまま当てはまる。すなわち、当該低級アルキル基における、N,N-ジアルキルアミノ基としては、上記式(1-2)で示される基が例示できる。
また、R2Bで示される、末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基については、上記(v)低級アルキル基の説明が、そのまま当てはまる。すなわち、当該低級アルキル基における、N,N-ジアルキルアミノ基としては、上記式(1-2)で示される基が例示できる。
また、当該低級アルキル基としては、炭素数1~6(1、2、3、4、5又は6)のアルキル基が好ましく、炭素数1~4のアルキル基がより好ましく、炭素数1~3のアルキル基がさらに好ましく、炭素数1又は2のアルキル基がよりさらに好ましい。当該アルキル基は直鎖状又は分岐鎖状であり得、直鎖状であることが好ましい。
また、当該低級アルキル基の炭素原子が窒素原子で置換されている場合には、当該置換窒素原子数は1又は2であることが好ましく、1であることがより好ましい。また、置換される炭素原子は、当該低級アルキル基の炭素数にもよるが、末端から1、2、3、4、5又は6番目の炭素原子であり得、R2Bでが結合する炭素原子に結合する炭素原子あるいは末端の炭素原子ではないことが好ましい。例えば、当該低級アルキル基の炭素数が3である場合は、窒素原子で置換される炭素原子は末端から2番目の炭素原子であることが好ましく、当該低級アルキル基の炭素数が4である場合は、窒素原子で置換される炭素原子は末端から2又は3番目の炭素原子であることが好ましく、当該低級アルキル基の炭素数が5である場合は、窒素原子で置換される炭素原子は末端から2、3又は4番目の炭素原子であることが好ましく、当該低級アルキル基の炭素数が6である場合は、窒素原子で置換される炭素原子は末端から2、3、4又は5番目の炭素原子であることが好ましい。特に好ましい当該低級アルキル基の一例として、上記式(1-3)で示される基が挙げられる。
なお、炭素原子が窒素原子で置換された場合、当該窒素原子には水素原子が1つ結合しているが、上述の通り、当該水素原子はベンジルオキシカルボニル基で置換されていてもよい。
また、上記各式で示される各化合物において、各置換基は、記載している条件の範囲内であれば、あらゆる組み合わせが可能である。よって、そのような全ての置換基組み合わせで示される化合物が上記各式には包含される。
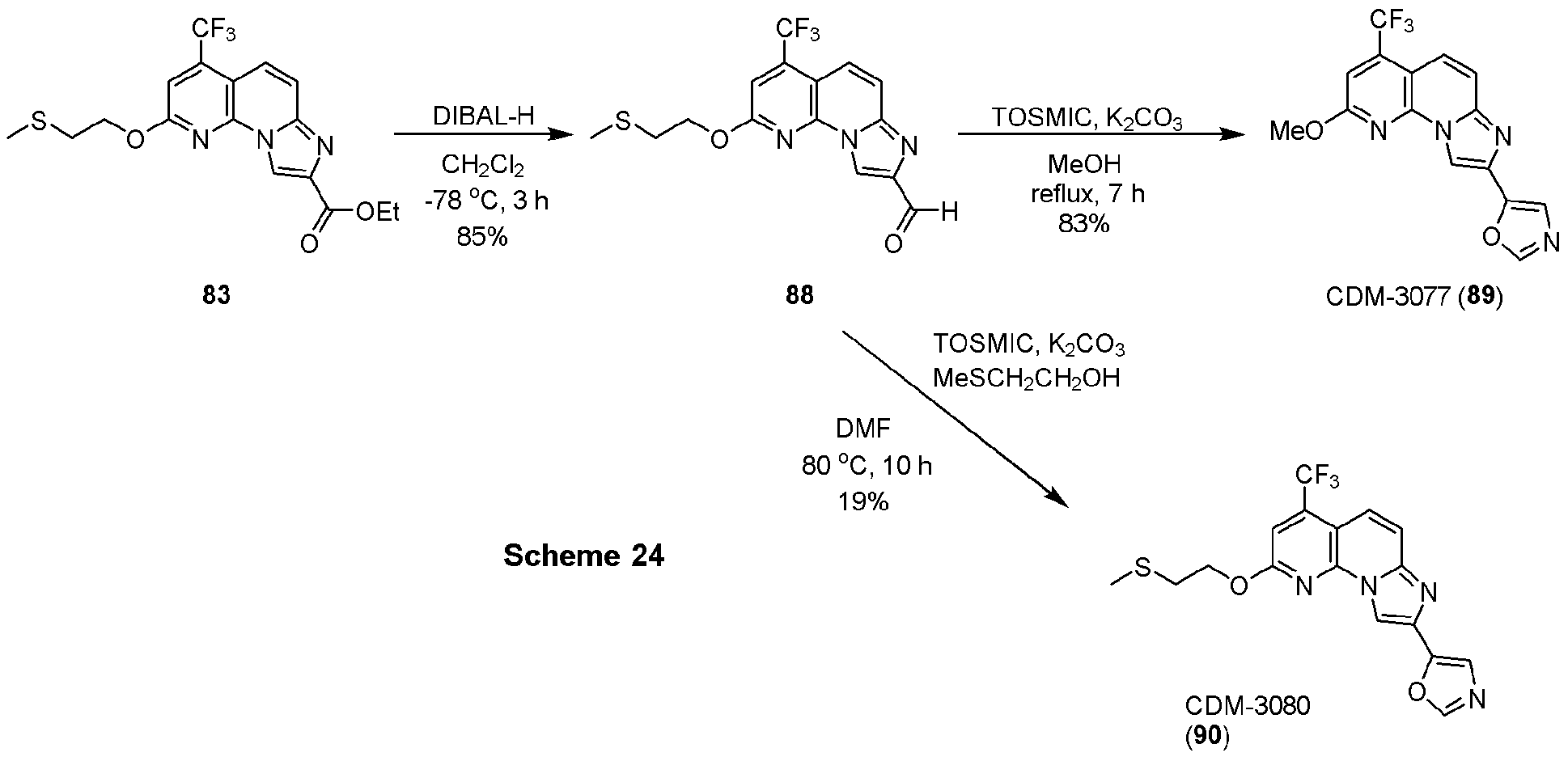
上記式(1)で示される化合物は、例えば、WO2013/059559に示される方法及び下記スキーム1~16に示す方法、若しくはこれらの方法から容易に認識できる方法により、製造することができる。
例えば、次式:
(式中、R1及びR4は前記に同じであり、好ましくはR1及びR4は同一又は異なってヒドロキシル基又はトリフルオロメチル基を示す。)で示される化合物を出発物質として、場合によっては、特に次式:
(式中、R4は前記に同じであり、R1xはヒドロキシル基又はトリフルオロメチル基を示す。)で示される化合物を中間物質としつつ、下述する各スキームに示される方法若しくは当該方法から容易に認識できる方法により、上記式(1)で示される化合物を製造できることが当業者に容易に認識される。
また、上記式(1)で示される化合物の中には、公知の化合物であるか、又は公知の方法もしくは公知の方法から容易に認識できる方法で製造できる化合物が含まれる。
また、上記式(1)で示される化合物の中には、公知の化合物であるか、又は公知の方法もしくは公知の方法から容易に認識できる方法で製造できる化合物が含まれる。
また、当該抗B型肝炎ウイルス剤は、前述の通り、上記特定の化合物又はその薬学的に許容される塩を含む。
当該化合物の塩としては、例えば、塩基性基に対する塩として、具体的には、塩酸、硫酸、リン酸、硝酸、臭化水素酸等の無機酸との塩、酢酸、クエン酸、安息香酸、マレイン酸、フマル酸、酒石酸、コハク酸、タンニン酸、酪酸、ヒベンズ酸、パモ酸、エナント酸、デカン酸、テオクル酸、サリチル酸、乳酸、シュウ酸、マンデル酸、リンゴ酸等の有機カルボン酸との塩、メタンスルホン酸、ベンゼンスルホン酸、p-トルエンスルホン酸等の有機スルホン酸との塩が例示される。また、例えば、酸性基に対する塩として、具体的には、アンモニウム塩、ナトリウム、カリウム等のアルカリ金属との塩、カルシウム、マグネシウム等のアルカリ土類金属との塩、アルミニウム塩、亜鉛塩、トリエチルアミン、エタノールアミン、モルホリン、ピロリジン、ピペリジン、ピペラジン、ジシクロへキシルアミン等の有機アミンとの塩、アルギニン、リジン等の塩基性アミノ酸との塩が挙げられる。なお、塩としては、1種の塩を用いてもよく、2種またはそれ以上の塩を組み合わせて用いてもよい。
また、当該特定の化合物は、溶媒和物であってもよく、例えば好ましい溶媒和物として水和物が例示できる。当該特定の化合物又はその塩は、任意の結晶型であってもよい。
当該特定の化合物は、1種単独で又は2種以上を組み合わせて用いてもよい。例えば、抗B型肝炎ウイルス剤は式(1)で示される化合物からなる群より選択される少なくとも1種の化合物を含み、好ましくは式(I)及び/又は式(II)で示される化合物からなる群より選択される少なくとも1種の化合物を含む。
本発明に包含される抗B型肝炎ウイルス剤(抗HBV薬)は、有効成分である上記化合物を、水、生理食塩水、または緩衝液等の薬理学的に許容される溶媒を用いて希釈、溶解、または分散等し、対象に投与するための医薬形態とすることができる。当該抗B型肝炎ウイルス剤は、任意の剤形で製剤化されていてよい。剤形としては、例えば、錠剤、カプセル剤、顆粒剤、細粒剤、散剤、徐放性製剤、液剤、懸濁剤、エマルジョン剤、シロップ剤、エリキシル剤等の経口剤、注射剤、坐剤等の非経口剤が挙げられる。製剤化にあたっては、例えば、賦形剤、結合剤、崩壊剤、滑沢剤、緩衝剤、安定化剤、矯味剤、矯臭剤、着色剤、香料、希釈剤、界面活性剤等の薬理学的に許容される添加剤を使用することができる。
抗B型肝炎ウイルス剤における有効成分の濃度は、HBVを予防および/または治療できる範囲において特に制限されず、有効成分の種類、剤型、投与態様等の諸条件に応じて適宜設定することができる。例えば、50%(w/w)以下、10%(w/w)以下、または5%(w/w)以下であってよい。また例えば、0.01%(w/w)以上、0.1%(w/w)以上、または1%(w/w)以上であってよい。
本発明の抗B型肝炎ウイルス剤を対象に投与することにより、HBV感染症の予防および/または治療を行うことができる。よって、本発明の抗B型肝炎ウイルス剤は、HBV感染症の予防および/または治療用の医薬として使用することができる。また、本発明は、本発明の抗B型肝炎ウイルス剤を治療または予防が必要なヒト等の哺乳動物を含む対象に投与することを含む、HBV感染症を予防および/または治療する方法をも包含する。本発明はまた、式(1)で示される化合物の、HBV感染症の治療又は予防用医薬品の製造への使用も包含する。
本発明の抗B型肝炎ウイルス剤の投与量は、有効成分の含有量、用法、年齢、性別、症状の程度等の諸条件に応じて適宜設定することができる。本発明の抗B型肝炎ウイルス剤の投与量は、有効成分の投与量に換算して、例えば、好ましくは0.1mg/kg体重/日~500mg/kg体重/日、より好ましくは1mg/kg体重/日~100mg/kg体重/日であることができる。本発明の抗B型肝炎ウイルス剤は、1日1回又は複数回(例えば2又は3回)に分けて投与することができる。各回の投与時の投与量は、有効成分の投与量に換算して一定でもよく、差があってもよい。
また、上記式(1)で示される化合物又はその塩は、HBV感染に対して有効な他の薬剤と組み合わせて使用してもよい。これらは、治療の過程において別々に投与されてもよいし、単一の剤形(例えば錠剤、静脈用溶液、又はカプセル剤など)において、上記式(1)で示される化合物又はその塩と当該他の薬剤とを組み合わせて用いてもよい。このような他の薬剤としては、例えば、インターフェロン、ペグ化インターフェロンや、ラミブジン、アデホビル、エンテカビル、テノホビル、テルビブジン、クレブジン、ジピボキシル、ジソプロキシル等の核酸アナログ製剤が挙げられる。この中では核酸アナログ製剤との組み合わせが好ましく、エンテカビルとの組み合わせがより好ましい。すなわち、本発明は、抗B型肝炎ウイルス核酸アナログ剤と、式(1)で示される化合物又はその塩とを含む抗B型肝炎ウイルス剤をも好ましく包含し、これには合剤やキットが含まれる。またさらに、本発明は、抗B型肝炎ウイルス核酸アナログ剤を投与された若しくはされる対象に、式(1)で示される化合物を投与することを特徴とする、抗B型肝炎ウイルス剤をも好ましく包含する。これらの抗B型肝炎ウイルス剤においては、核酸アナログ製剤と式(1)で示される化合物又はその塩の投与割合、投与レジメン等は、患者の年齢、症状、体重等によって適宜選択することができる。
また、式(1)で示される化合物又はその塩は、体内に投与されると、インターフェロン様活性を示すことで、抗HBV効果を発揮する。このため、式(I)で示される化合物又はその塩はインターフェロン疑似薬としても用いることができ、本発明は、式(I)で示される化合物又はその塩を含むインターフェロン疑似薬をも包含する。
なお、本明細書において「含む」とは、「本質的にからなる」と、「からなる」をも包含する(The term "comprising" includes "consisting essentially of” and "consisting of.")。
なお、本明細書において「含む」とは、「本質的にからなる」と、「からなる」をも包含する(The term "comprising" includes "consisting essentially of” and "consisting of.")。
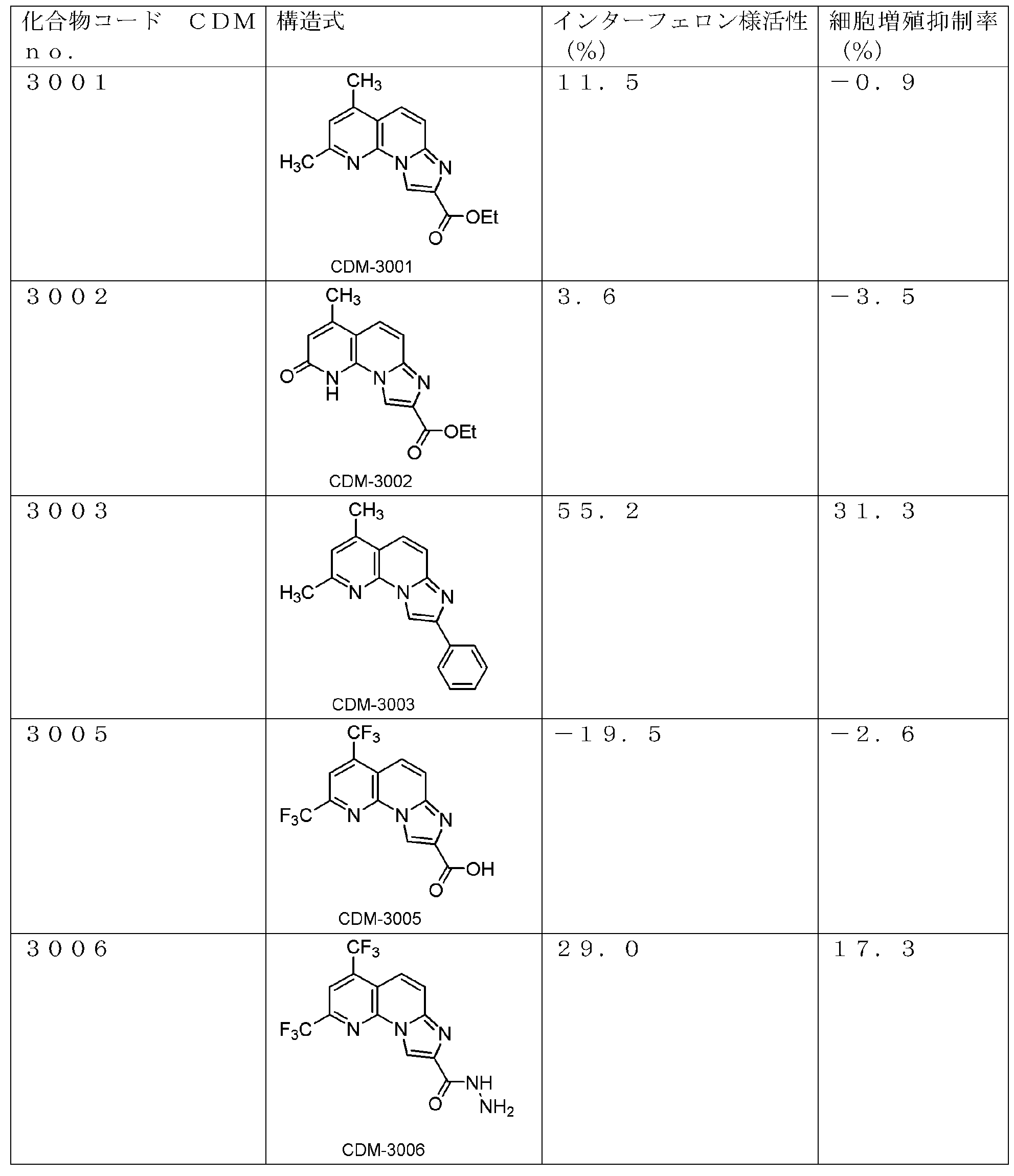
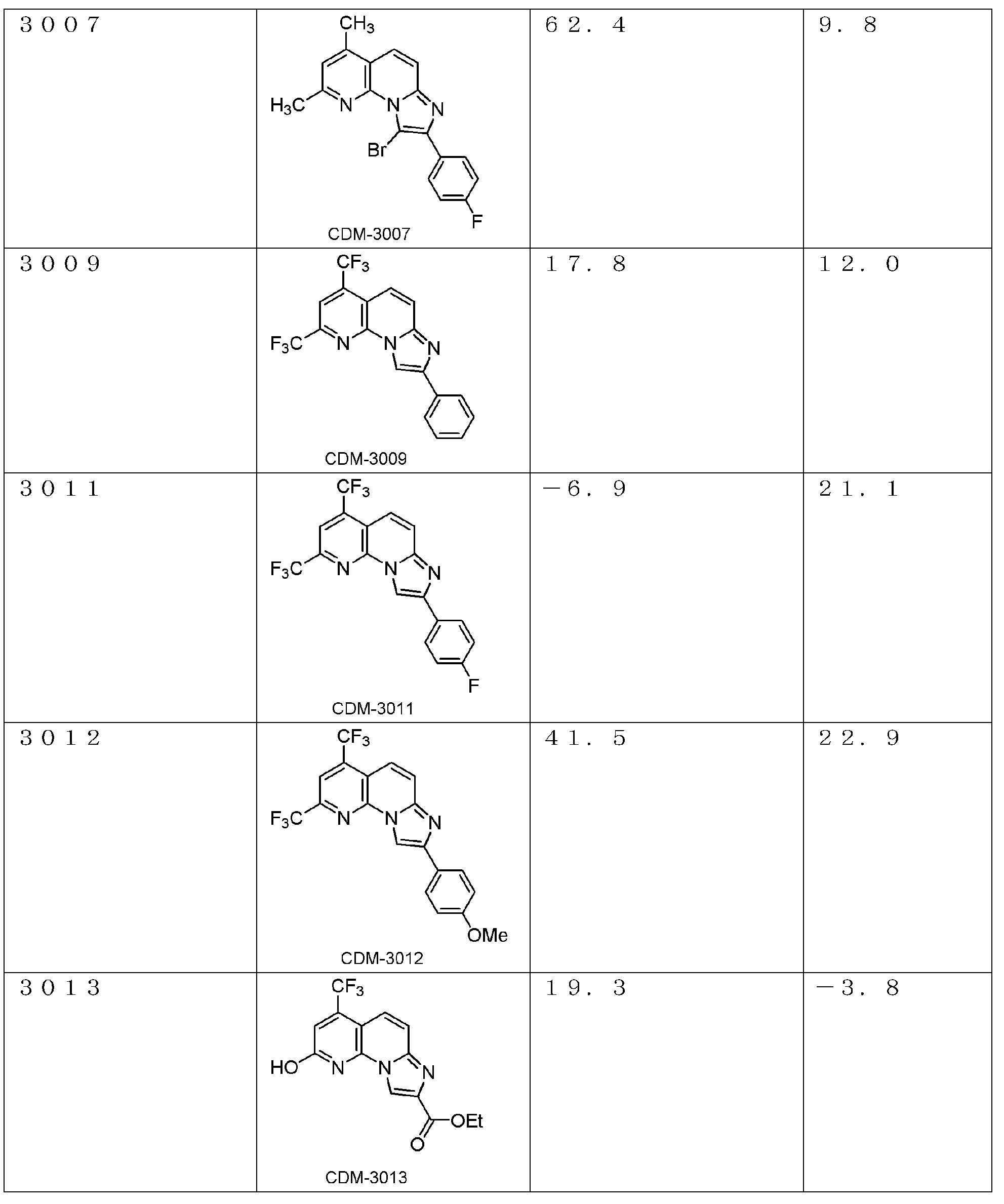
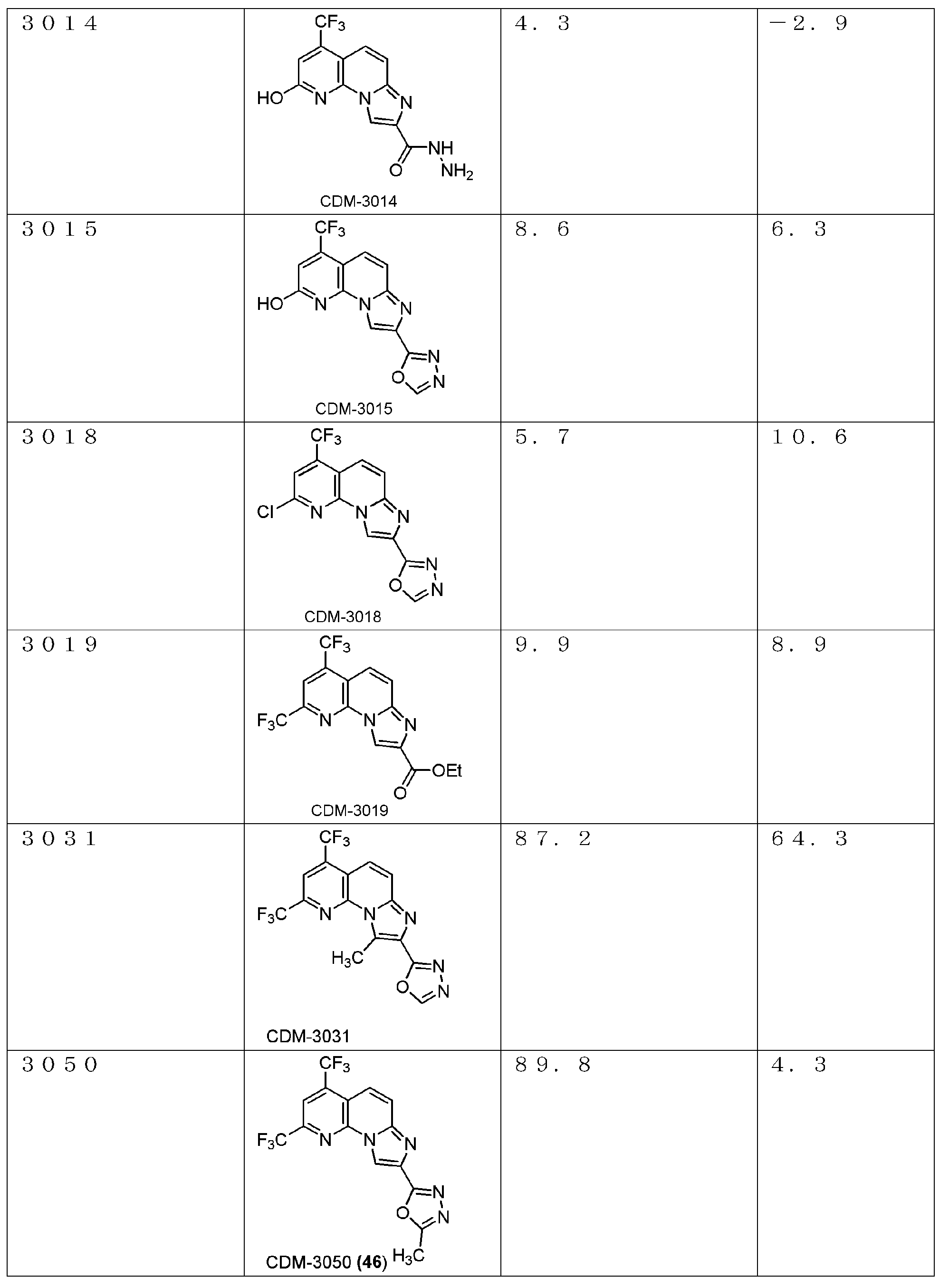
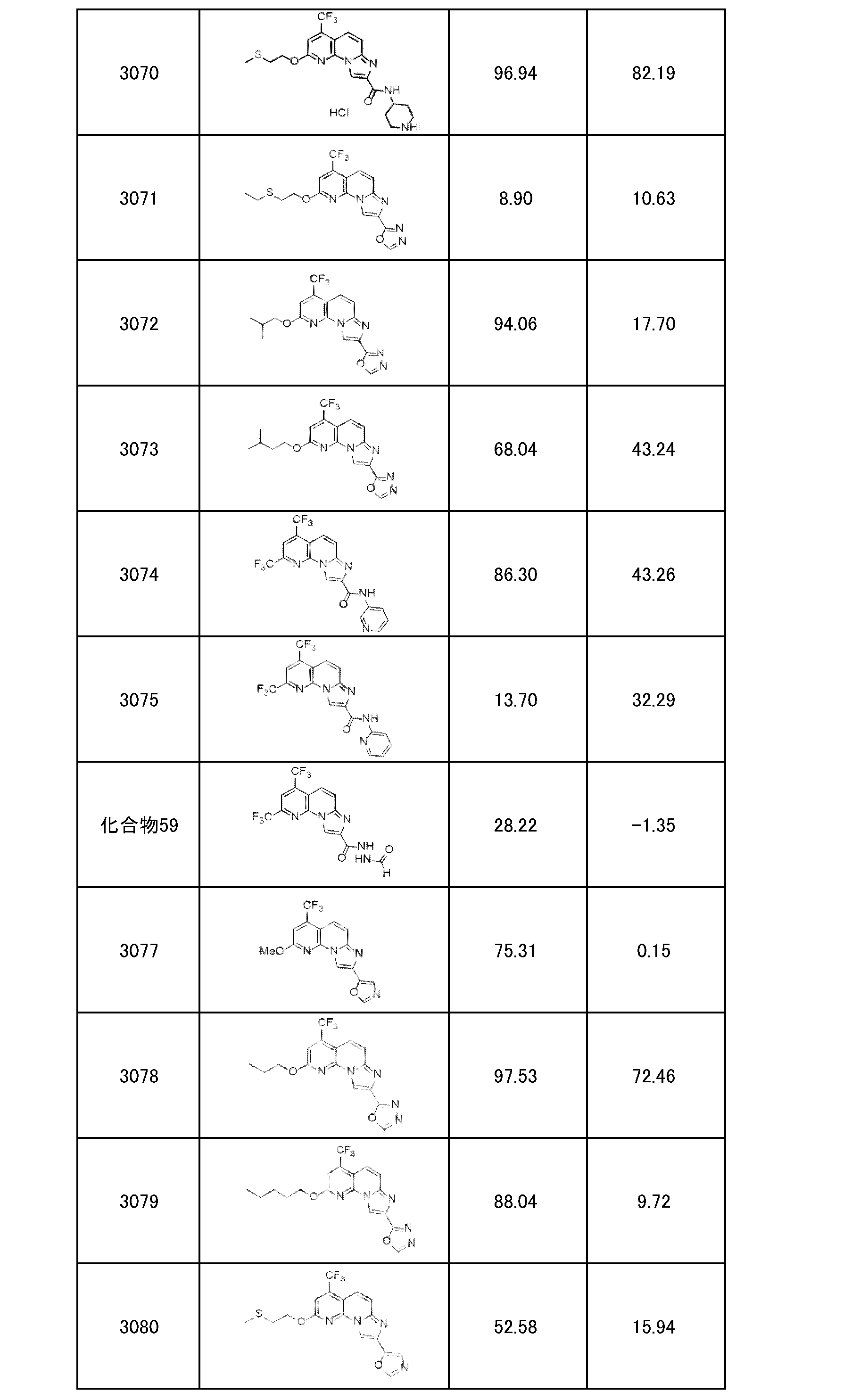
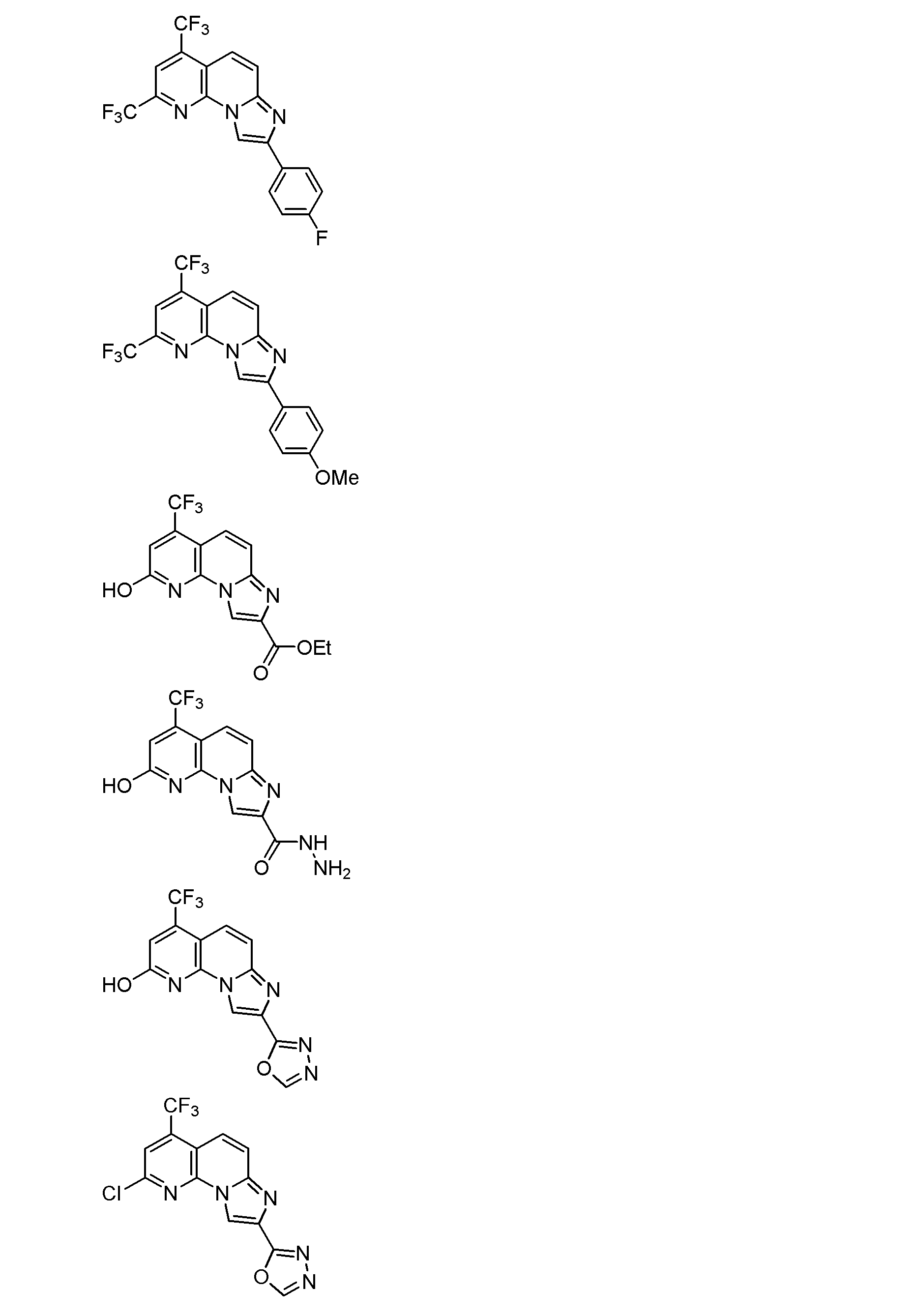
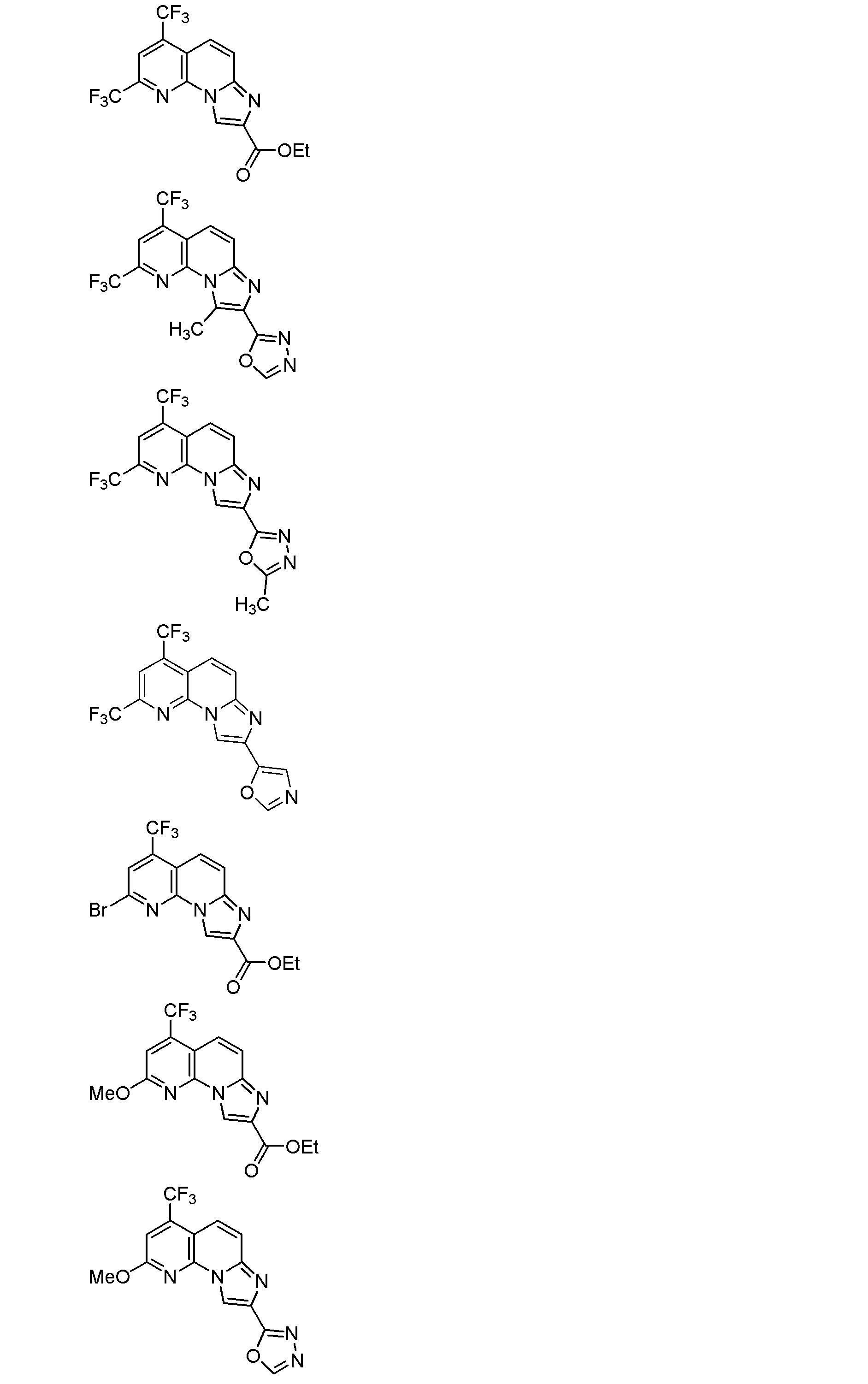
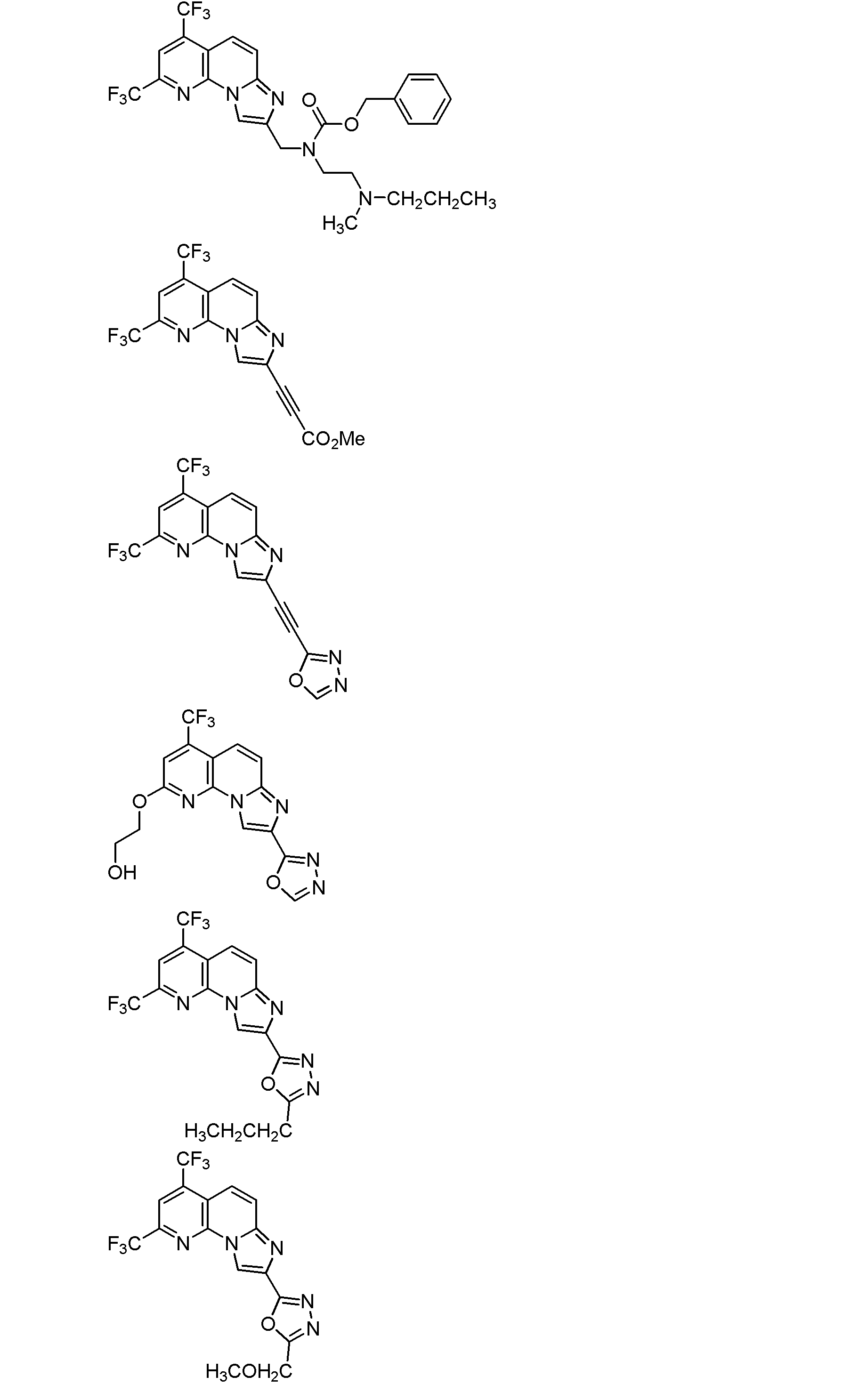
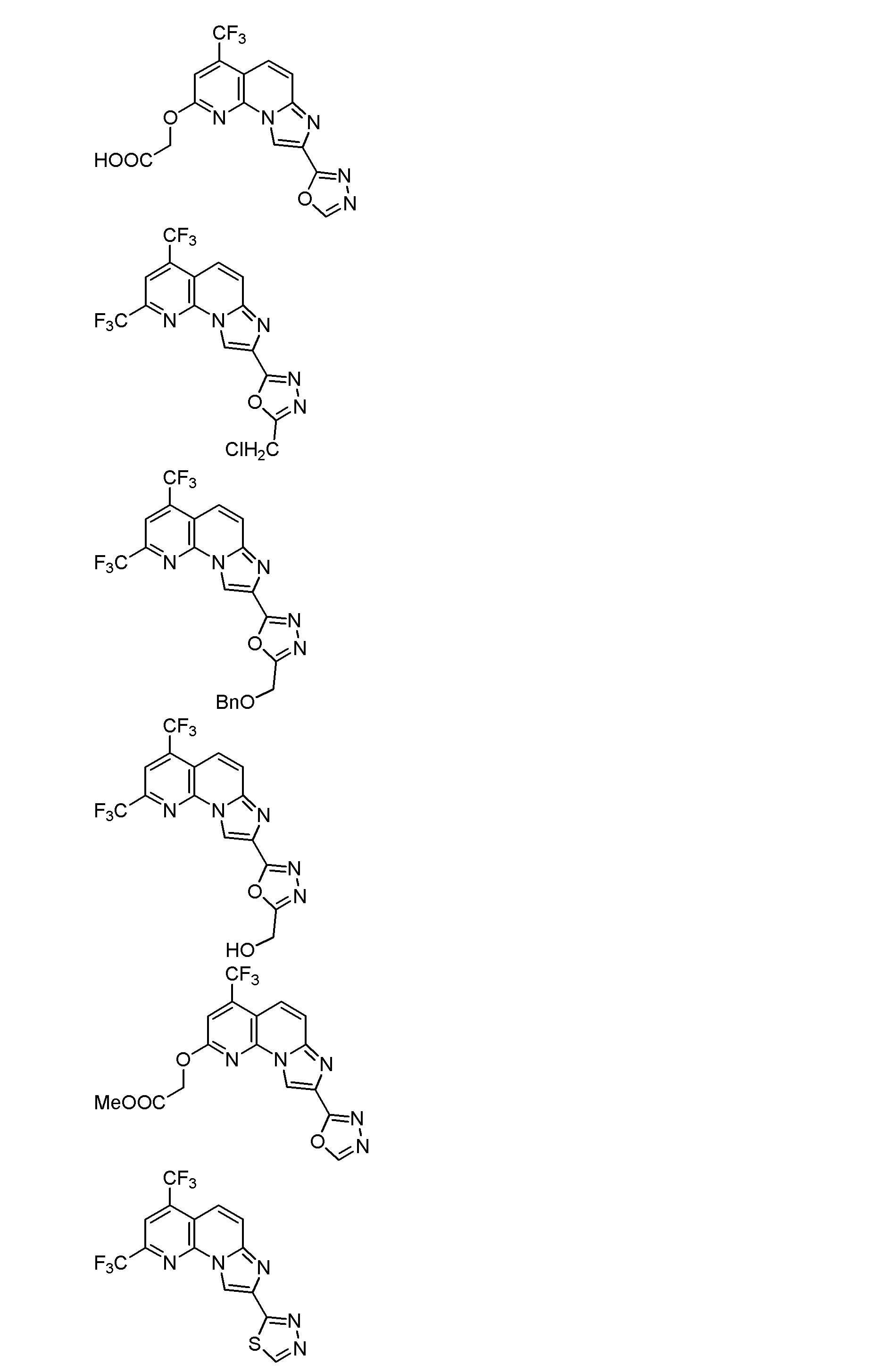
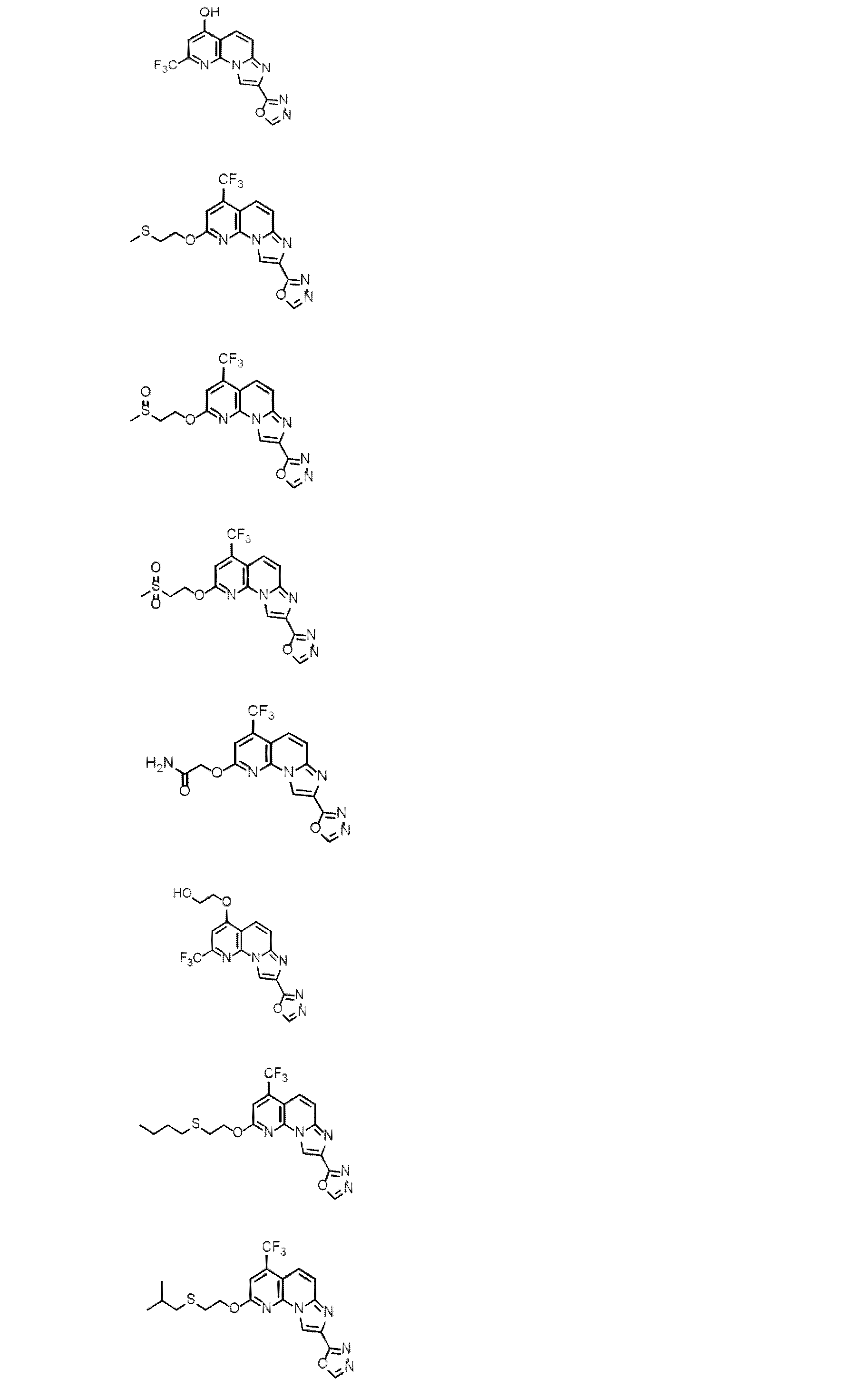
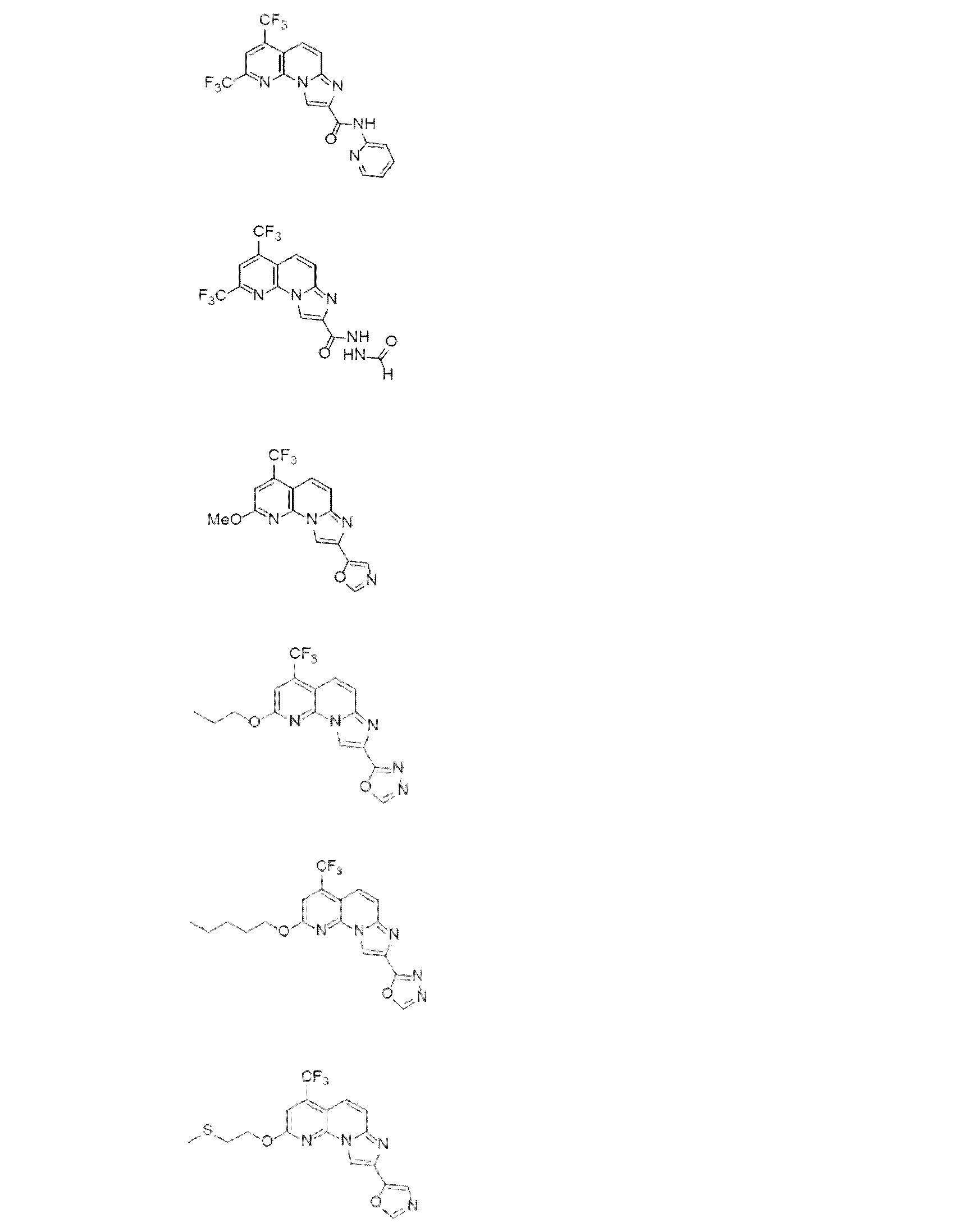
以下、本発明を具体的に説明するが、本発明は下記の例に限定されるものではない。なお、以下化合物はCDM番号(「CDM-3000番台の番号」の記載)及び/又は各スキームにおいて記載する化合物番号(一桁又は二桁の整数)を用いて特定することがある。
各化合物の合成
各化合物の合成
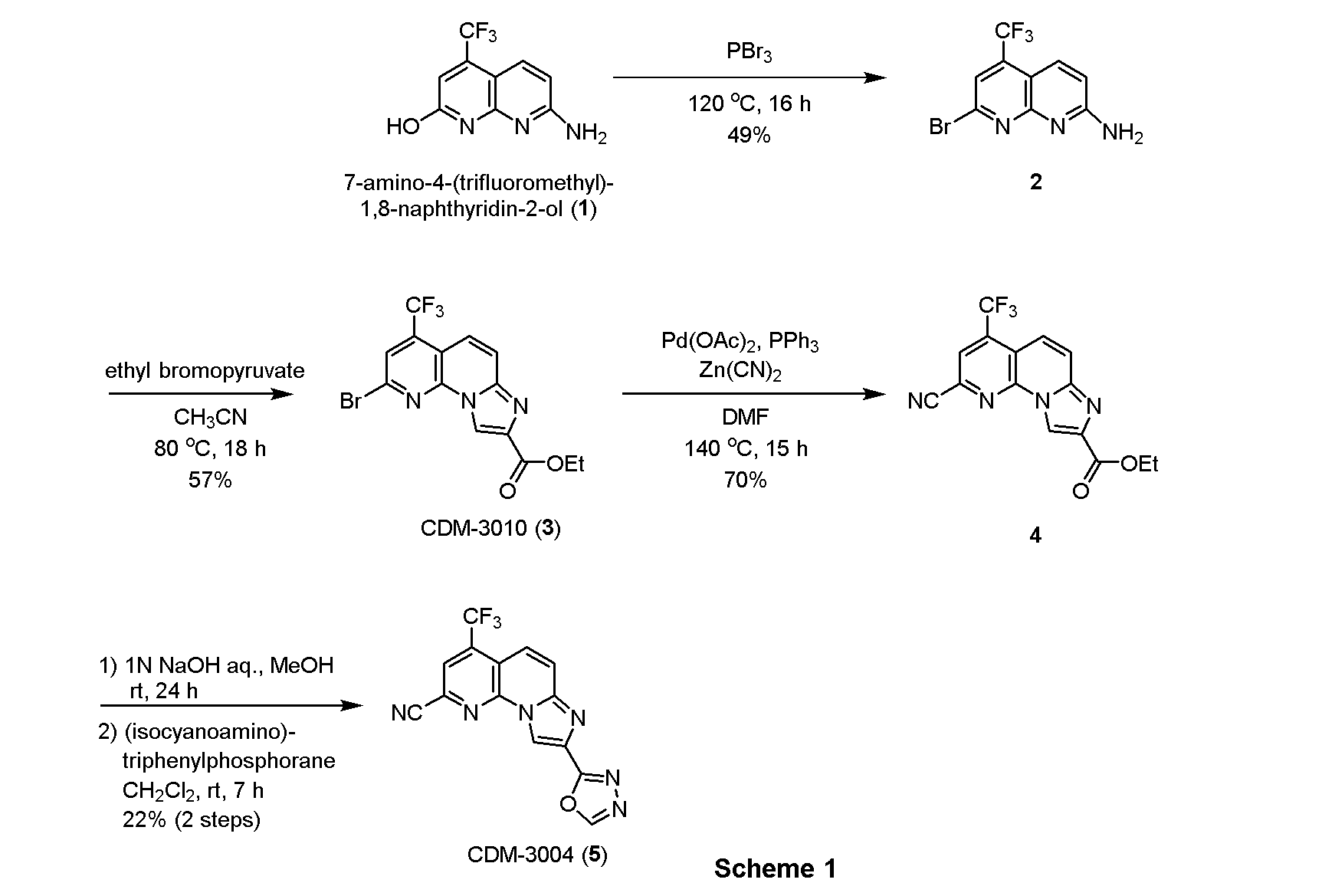
・ブロモ体2の合成
7-アミノ-4-(トリフルオロメチル)-1,8-ナフチリジン-2-オール(1, 1.27g, 5.53mmol)を三臭化リン(20.0mL)に懸濁させ、120℃で16時間撹拌した。反応液を氷水にあけ、アンモニア水を用いてpH約8とし、クロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/n-hexane=30:70)にて精製し、ブロモ体2を791.2 mg(49%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.15 (1H, d, J = 9.0), 7.62 (1H, s), 7.02 (1H, d, J = 7.5), 6.04 (2H, br-s).
7-アミノ-4-(トリフルオロメチル)-1,8-ナフチリジン-2-オール(1, 1.27g, 5.53mmol)を三臭化リン(20.0mL)に懸濁させ、120℃で16時間撹拌した。反応液を氷水にあけ、アンモニア水を用いてpH約8とし、クロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/n-hexane=30:70)にて精製し、ブロモ体2を791.2 mg(49%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.15 (1H, d, J = 9.0), 7.62 (1H, s), 7.02 (1H, d, J = 7.5), 6.04 (2H, br-s).
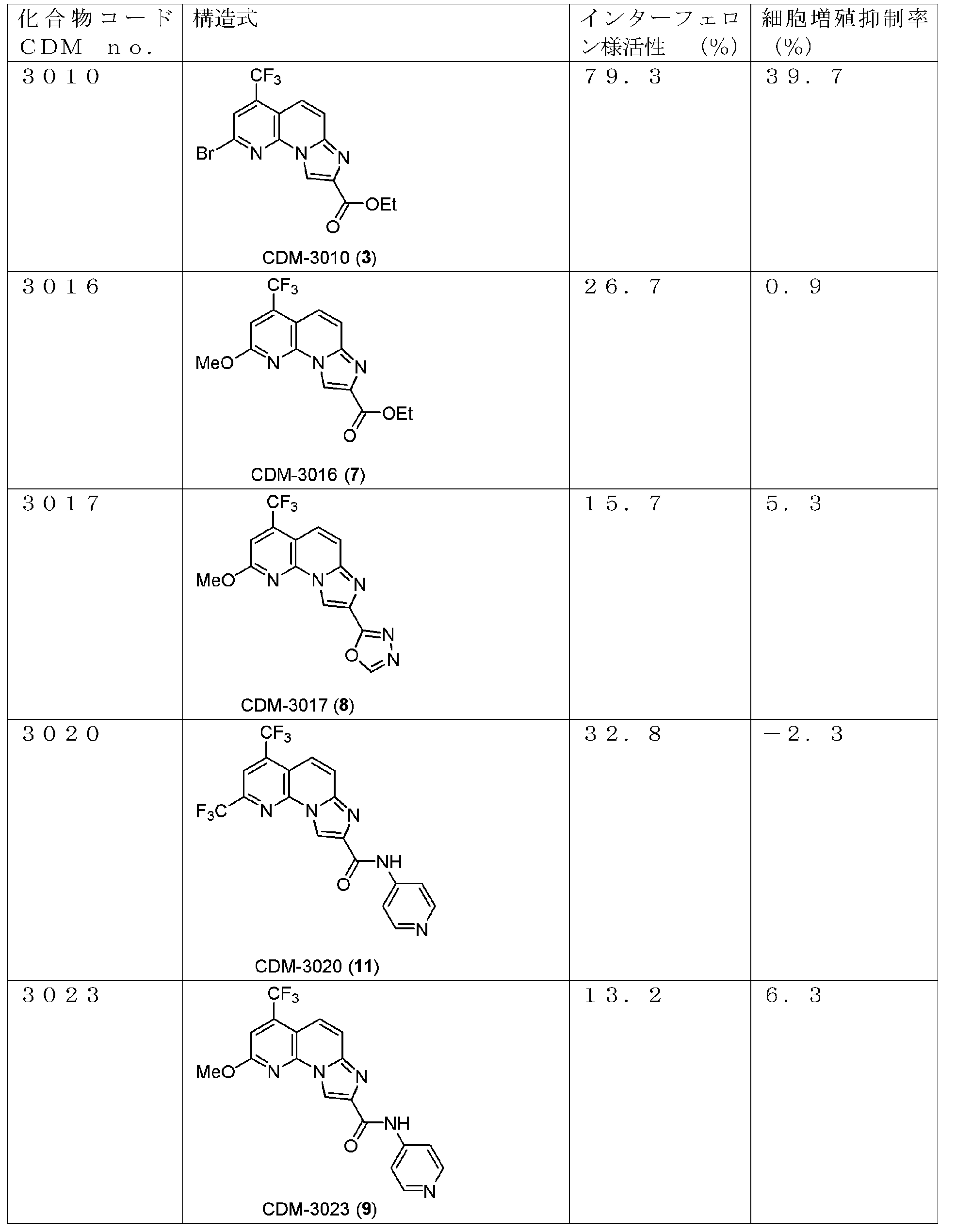
・CDM-3010(3)の合成
ブロモ体(2, 1.31g, 4.49mmol)をアセトニトリル(80.0mL)に溶解させ、ブロモピルビン酸エチル(0.68mL, 5.44mmol)を加えて80℃で12時間撹拌した。反応液をクロロホルムで希釈し、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、CDM-3010(3)を990.2mg(57%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.07 (1H, s), 7.88 (1H, d, J = 9.5), 7.85-7.79 (2H, overlapped), 4.51 (2H, q, J = 7.5), 1.47 (3H, t, J = 7.0); HR-ESI-MS calcd for C14H10BrF3N3O2 [M+H]+: 387.9908, found: 387.9837.
ブロモ体(2, 1.31g, 4.49mmol)をアセトニトリル(80.0mL)に溶解させ、ブロモピルビン酸エチル(0.68mL, 5.44mmol)を加えて80℃で12時間撹拌した。反応液をクロロホルムで希釈し、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、CDM-3010(3)を990.2mg(57%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.07 (1H, s), 7.88 (1H, d, J = 9.5), 7.85-7.79 (2H, overlapped), 4.51 (2H, q, J = 7.5), 1.47 (3H, t, J = 7.0); HR-ESI-MS calcd for C14H10BrF3N3O2 [M+H]+: 387.9908, found: 387.9837.
・ニトリル体4の合成
CDM-3010(3, 262.6mg, 0.677mmol)、酢酸パラジウム (16.0mg, 0.07mmol)、トリフェニルホスフィン (36.5mg, 0.14mmol)、およびシアン化亜鉛(161.6mg, 1.38mmol)を反応容器に取り、窒素雰囲気下DMF(12.5mL)に溶解させ、140℃で15時間撹拌した。反応液を酢酸エチルで希釈し、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=8:92)にて精製し、ニトリル体4を158.4mg(70%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.12 (1H, s), 7.94 (1H, d, J = 10.0), 7.87 (1H, J = 2.0), 4.51 (2H, q, J = 7.0), 1.47 (3H, t, J = 6.5).
CDM-3010(3, 262.6mg, 0.677mmol)、酢酸パラジウム (16.0mg, 0.07mmol)、トリフェニルホスフィン (36.5mg, 0.14mmol)、およびシアン化亜鉛(161.6mg, 1.38mmol)を反応容器に取り、窒素雰囲気下DMF(12.5mL)に溶解させ、140℃で15時間撹拌した。反応液を酢酸エチルで希釈し、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=8:92)にて精製し、ニトリル体4を158.4mg(70%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.12 (1H, s), 7.94 (1H, d, J = 10.0), 7.87 (1H, J = 2.0), 4.51 (2H, q, J = 7.0), 1.47 (3H, t, J = 6.5).
・CDM-3004(5)の合成
ニトリル体(4, 21.4mg, 0.064mmol)をメタノール(0.5mL)に溶解させ、1N水酸化ナトリウム水溶液(0.5mL)を加えて24時間撹拌した。反応液を1N塩酸を用いてpH3~4にし、クロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をジクロロメタン(1.2mL)に溶解させ、(イソシアノアミノ)トリフェニルホスホラン(19.3mg, 0.064mmol)を加えて7時間撹拌した。反応液を留去後、得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、CDM-3004(5)を4.6mg (22%,2 steps)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.02 (1H, s), 8.52 (1H, s), 7.68 (1H, d, J = 10.0), 7.45 (1H, d, J = 10.0), 7.02 (1H, s); HR-ESI-MS calcd for C14H6F3N6O [M+H]+: 331.0555, found: 331.0568.
ニトリル体(4, 21.4mg, 0.064mmol)をメタノール(0.5mL)に溶解させ、1N水酸化ナトリウム水溶液(0.5mL)を加えて24時間撹拌した。反応液を1N塩酸を用いてpH3~4にし、クロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をジクロロメタン(1.2mL)に溶解させ、(イソシアノアミノ)トリフェニルホスホラン(19.3mg, 0.064mmol)を加えて7時間撹拌した。反応液を留去後、得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、CDM-3004(5)を4.6mg (22%,2 steps)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.02 (1H, s), 8.52 (1H, s), 7.68 (1H, d, J = 10.0), 7.45 (1H, d, J = 10.0), 7.02 (1H, s); HR-ESI-MS calcd for C14H6F3N6O [M+H]+: 331.0555, found: 331.0568.
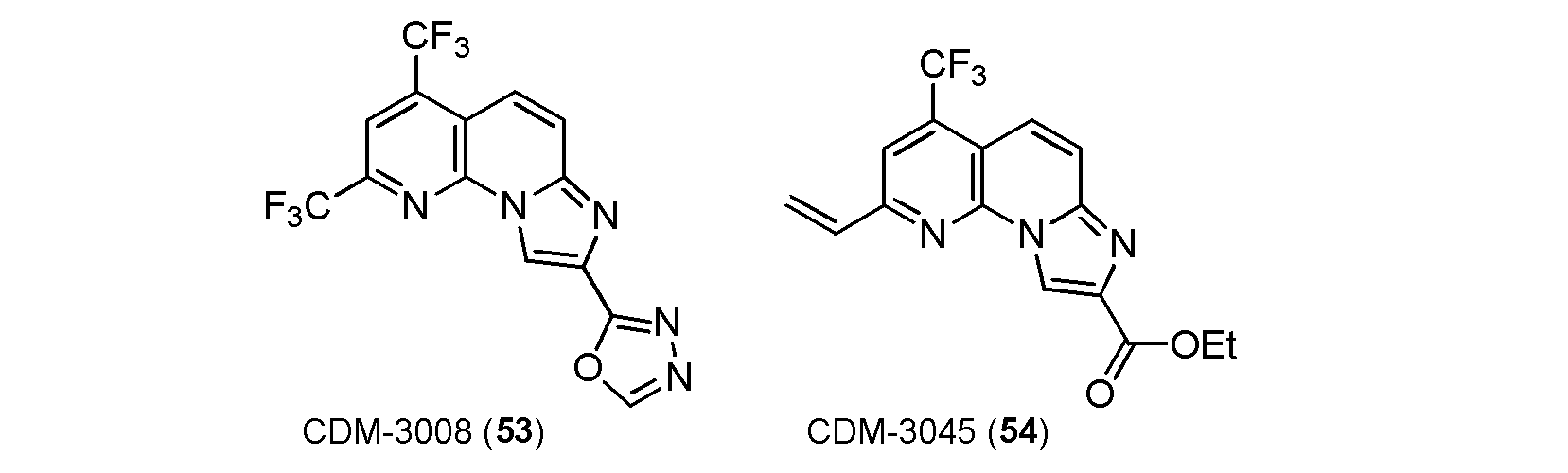
・CDM-3008(53)の合成
CDM-3004(5,scheme 1)の合成方法に基づいて合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.42 (1H, s), 9.20 (1H, s), 8.49 (1H, s), 8.10 (1H, d, J = 9.5), 7.94 (1H, d, J = 10.0); HR-ESI-MS calcd for C14H5F6N5NaO [M+H]+: 396.0296, found: 396.0287.
CDM-3004(5,scheme 1)の合成方法に基づいて合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.42 (1H, s), 9.20 (1H, s), 8.49 (1H, s), 8.10 (1H, d, J = 9.5), 7.94 (1H, d, J = 10.0); HR-ESI-MS calcd for C14H5F6N5NaO [M+H]+: 396.0296, found: 396.0287.
・CDM-3045(54)の合成
ニトリル体4の合成(Scheme 1)の合成方法に基づいて合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.12 (1H, s), 7.79 (1H, d, J = 9.5), 7.77 (1H, s), 7.73 (1H, d, J = 9.5), 6.98 (1H, dd, J = 11.0, 3.5), 6.60 (1H, d, J = 11.0), 5.82 (1H, d, J = 11.0), 4.50 (2H, q, J = 3.5), 1.48 (3H, t, J = 3.5); HR-ESI-MS calcd for C16H13F3N3O2 [M+H]+: 336.0960, found: 336.0917.
ニトリル体4の合成(Scheme 1)の合成方法に基づいて合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.12 (1H, s), 7.79 (1H, d, J = 9.5), 7.77 (1H, s), 7.73 (1H, d, J = 9.5), 6.98 (1H, dd, J = 11.0, 3.5), 6.60 (1H, d, J = 11.0), 5.82 (1H, d, J = 11.0), 4.50 (2H, q, J = 3.5), 1.48 (3H, t, J = 3.5); HR-ESI-MS calcd for C16H13F3N3O2 [M+H]+: 336.0960, found: 336.0917.
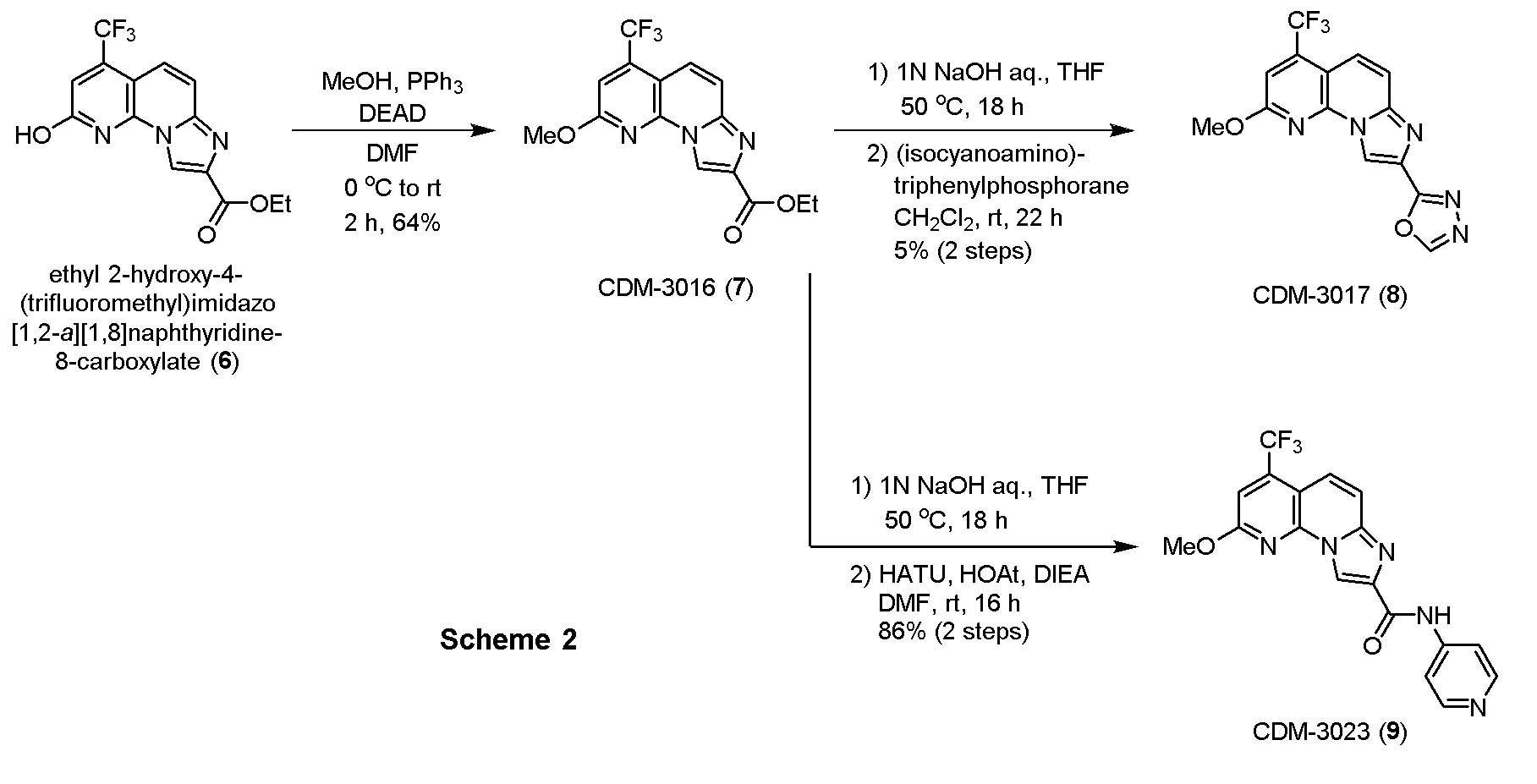
・CDM-3016(7)の合成
エチル-2-ヒドロキシ-4-(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(6, 173.0mg, 0.53mmol)(CDM No.はCDM-3013)、トリフェニルホスフィン(279.0mg, 1.06mmol)を反応容器に取り、窒素雰囲気下DMF (5.0mL)に溶解させ、氷冷下DEAD(2.2 M in toluene, 0.48mL, 1.06mmol)を加えて室温に昇温し、2時間撹拌した。反応液を酢酸エチルで希釈し、蒸留水で洗浄、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、CDM-3016(7)を115.0mg(64%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.97 (1H, s), 7.78 (1H, dd, J = 12.0, 2.0), 7.65 (1H, d, J = 12.0), 7.28 (1H, s), 4.51 (2H, q, J = 9.0), 4.19 (3H, s), 1.48 (3H, t, J = 9.8); HR-ESI-MS calcd for C15H13F3N3O3 [M+H]+: 340.0909, found: 340.0897, calcd for C15H13F3N3NaO3 [M+Na]+: 362.0728, found: 362.0704.
エチル-2-ヒドロキシ-4-(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(6, 173.0mg, 0.53mmol)(CDM No.はCDM-3013)、トリフェニルホスフィン(279.0mg, 1.06mmol)を反応容器に取り、窒素雰囲気下DMF (5.0mL)に溶解させ、氷冷下DEAD(2.2 M in toluene, 0.48mL, 1.06mmol)を加えて室温に昇温し、2時間撹拌した。反応液を酢酸エチルで希釈し、蒸留水で洗浄、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、CDM-3016(7)を115.0mg(64%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.97 (1H, s), 7.78 (1H, dd, J = 12.0, 2.0), 7.65 (1H, d, J = 12.0), 7.28 (1H, s), 4.51 (2H, q, J = 9.0), 4.19 (3H, s), 1.48 (3H, t, J = 9.8); HR-ESI-MS calcd for C15H13F3N3O3 [M+H]+: 340.0909, found: 340.0897, calcd for C15H13F3N3NaO3 [M+Na]+: 362.0728, found: 362.0704.
・CDM-3017(8)の合成
CDM-3016(7, 22.6mg, 0.067mmol)をTHF(0.8mL)に溶解させ、1N水酸化ナトリウム水溶液(0.2mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2に調整し、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をジクロロメタン(1.0mL)に溶解させ、(イソシアノアミノ)トリフェニルホスホラン(91.0mg, 0.30mmol)を加えて22時間撹拌した。反応液を留去後、得られた残渣をHPLC(Cosmosil ARII, φ20×250mm, eluent : CH3CN/H2O=50:50, 0.1% TFA) にて精製し、CDM-3017(8)を1.2mg(5%, 2 steps)得た。
1H NMR (500 MHz, CD3OD) δ ppm: 9.17 (1H, s), 9.11 (1H, s), 9.06 (1H, s), 7.94 (1H, d, J = 9.5), 7.67 (1H, d, J = 10.5), 4.24 (3H, s) ; HR-ESI-MS calcd for C14H9F3N5O2 [M+H]+: 336.0708, found: 336.0656, calcd for C14H8F3N5NaO2 [M+Na]+: 358.0528, found: 358.0472.
CDM-3016(7, 22.6mg, 0.067mmol)をTHF(0.8mL)に溶解させ、1N水酸化ナトリウム水溶液(0.2mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2に調整し、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をジクロロメタン(1.0mL)に溶解させ、(イソシアノアミノ)トリフェニルホスホラン(91.0mg, 0.30mmol)を加えて22時間撹拌した。反応液を留去後、得られた残渣をHPLC(Cosmosil ARII, φ20×250mm, eluent : CH3CN/H2O=50:50, 0.1% TFA) にて精製し、CDM-3017(8)を1.2mg(5%, 2 steps)得た。
1H NMR (500 MHz, CD3OD) δ ppm: 9.17 (1H, s), 9.11 (1H, s), 9.06 (1H, s), 7.94 (1H, d, J = 9.5), 7.67 (1H, d, J = 10.5), 4.24 (3H, s) ; HR-ESI-MS calcd for C14H9F3N5O2 [M+H]+: 336.0708, found: 336.0656, calcd for C14H8F3N5NaO2 [M+Na]+: 358.0528, found: 358.0472.
・CDM-3023(9)の合成
CDM-3016(7, 232.7mg, 0.64mmol)をTHF(8.0mL)に溶解させ、1N水酸化ナトリウム水溶液(2.0mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2にし、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
CDM-3016(7, 232.7mg, 0.64mmol)をTHF(8.0mL)に溶解させ、1N水酸化ナトリウム水溶液(2.0mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2にし、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物を窒素雰囲気下DMF(4.0mL)に溶解させ、HATU(488.7mg, 1.29mmol), HOAt(173.6mg, 1.29mmol), DIEA(0.22mL, 1.29mmol)を加えて30分撹拌後、4-アミノピリジン(120.9mg, 1.29mmol)を加えて16時間撹拌した。析出した固体をろ取した後に酢酸エチルで洗浄し、CDM-3023(9)を215.1mg(86%, 2 steps)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 10.83 (1H, s), 9.05 (1H, s), 8.45 (2H, dd, J = 5.0, 1.8), 7.92 (2H, dd, J = 4.5, 2.0), 7.79 (1H, dd, J = 9.5, 1.5), 7.73 (2H, J = 9.5), 7.56 (1H, s), 4.18 (3H, s); HR-ESI-MS calcd for C18H13F3N5O2 [M+H]+: 388.1021, found: 388.1003.
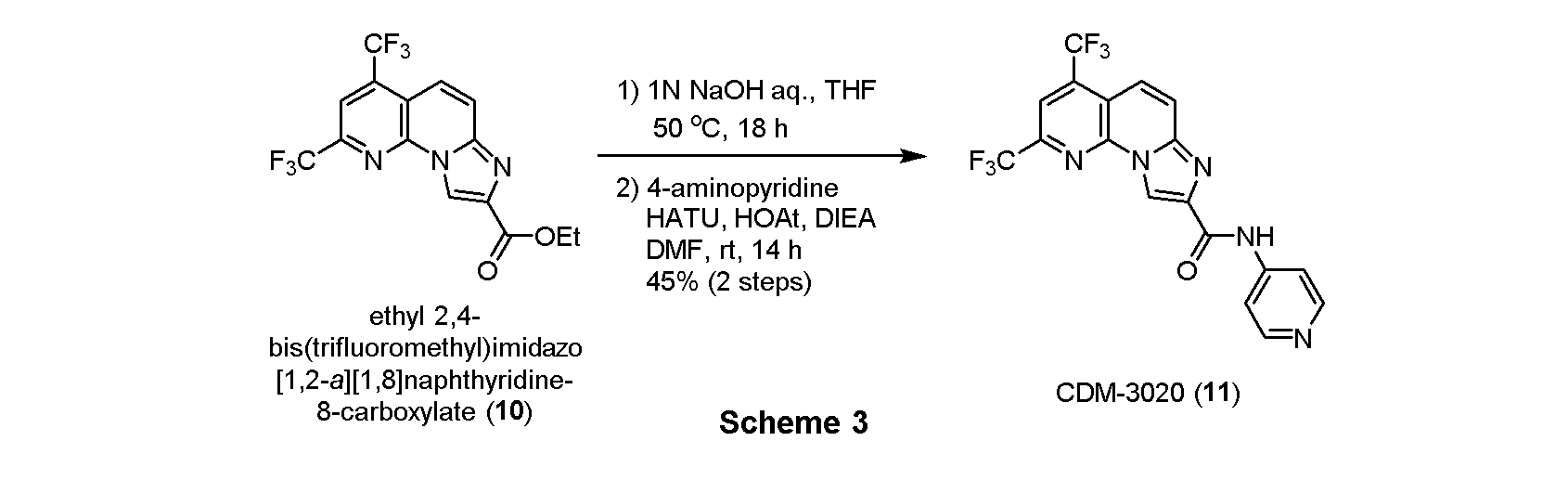
・CDM-3020(11)の合成
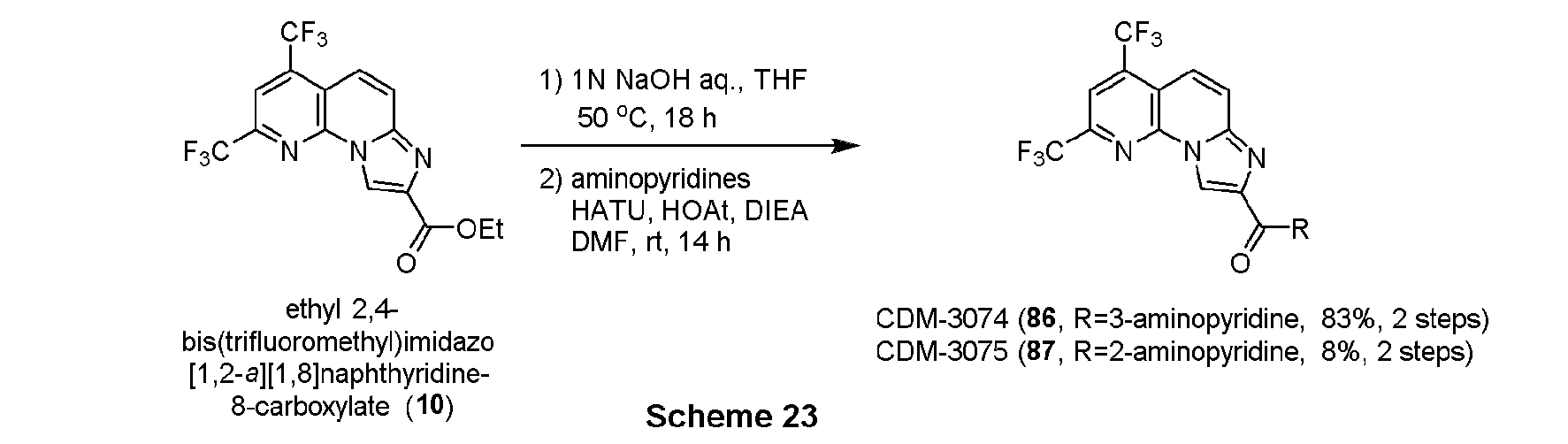
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 114.3mg, 0.30mmol)(CDM No.はCDM-3019)をTHF(4.0mL)に溶解させ、1N水酸化ナトリウム水溶液(1.0mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2にし、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 114.3mg, 0.30mmol)(CDM No.はCDM-3019)をTHF(4.0mL)に溶解させ、1N水酸化ナトリウム水溶液(1.0mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2にし、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をDMF(2.0mL)に溶解させ、HATU(229.0mg, 0.60mmol), HOAt(80.7mg, 0.60mmol), DIEA(0.10mL, 0.6mmol)を加えて30分撹拌後、4-アミノピリジン(56.2mg, 0.6mmol)を加えて14時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography(AcOEt/CHCl3=5:95)にて精製し、CDM-3020(11)を57.3 mg (45%, 2 steps)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 10.87 (1H, s), 9.12 (1H, s), 8.49 (1H, s), 8.46 (2H, dd, J = 5.0, 2.0), 8.06 (1H, d, J = 10.0), 7.94 (1H, dd, J = 10.5, 2.0), 7.90 (2H, J = 5.0, 1.0); HR-ESI-MS calcd for C18H10F6N5O [M+H]+: 426.0790, found: 426.0780.
1H NMR (500 MHz, DMSO-d6) δ ppm: 10.87 (1H, s), 9.12 (1H, s), 8.49 (1H, s), 8.46 (2H, dd, J = 5.0, 2.0), 8.06 (1H, d, J = 10.0), 7.94 (1H, dd, J = 10.5, 2.0), 7.90 (2H, J = 5.0, 1.0); HR-ESI-MS calcd for C18H10F6N5O [M+H]+: 426.0790, found: 426.0780.
・クロル体12の合成
7-アミノ-4-(トリフルオロメチル)-1,8-ナフチリジン-2-オール (1, 849.0mg, 2.61mmol)をDMF(25.2mL)に溶解させ、オキシ塩化リン(0.49mL, 5.26mmol)を加え80℃で5時間撹拌した。室温に戻した後に蒸留水(2.0mL)を加え、析出した固体をろ取し、クロル体12を300.6mg(34%)得た。ろ液を飽和炭酸水素ナトリウム水溶液を用いてpH8-9とし、クロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥させ、48時間静置した。析出した固体をろ取し、クロル体12をさらに146.3mg(17%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.07 (1H, s), 7.88 (1H, d, J = 9.5), 7.85-7.79 (2H, overlapped), 4.51 (2H, q, J = 7.5), 1.47 (3H, t, J = 7.0).
7-アミノ-4-(トリフルオロメチル)-1,8-ナフチリジン-2-オール (1, 849.0mg, 2.61mmol)をDMF(25.2mL)に溶解させ、オキシ塩化リン(0.49mL, 5.26mmol)を加え80℃で5時間撹拌した。室温に戻した後に蒸留水(2.0mL)を加え、析出した固体をろ取し、クロル体12を300.6mg(34%)得た。ろ液を飽和炭酸水素ナトリウム水溶液を用いてpH8-9とし、クロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥させ、48時間静置した。析出した固体をろ取し、クロル体12をさらに146.3mg(17%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.07 (1H, s), 7.88 (1H, d, J = 9.5), 7.85-7.79 (2H, overlapped), 4.51 (2H, q, J = 7.5), 1.47 (3H, t, J = 7.0).
・ベンジルアミン体13の合成
クロル体12(105.0mg, 0.306mmol)、酢酸パラジウム(6.8mg, 0.030mmol)、XPhos(14.6mg, 0.030mmol)、およびt-ブトキシナトリウム(58.2mg, 0.060mmol)を反応容器に取り、窒素雰囲気下toluene(3.5mL)に溶解させ、ベンジルアミン(50.1μL, 0.46mmol) を加えて120℃で15時間撹拌した。反応液を酢酸エチルで希釈し、1N塩酸で洗浄、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography(AcOEt/CHCl3=5:95)にて精製し、ベンジルアミン体13を41.0mg(32%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.86 (1H, s), 7.63 (1H, d, J = 8.0), 7.45-7.25 (6H, overlapped), 6.95 (1H, d, J = 29.0), 4.78 (2H, m), 4.47 (2H, q, J = 7.5), 1.46 (3H, t, J = 7.0).
クロル体12(105.0mg, 0.306mmol)、酢酸パラジウム(6.8mg, 0.030mmol)、XPhos(14.6mg, 0.030mmol)、およびt-ブトキシナトリウム(58.2mg, 0.060mmol)を反応容器に取り、窒素雰囲気下toluene(3.5mL)に溶解させ、ベンジルアミン(50.1μL, 0.46mmol) を加えて120℃で15時間撹拌した。反応液を酢酸エチルで希釈し、1N塩酸で洗浄、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography(AcOEt/CHCl3=5:95)にて精製し、ベンジルアミン体13を41.0mg(32%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.86 (1H, s), 7.63 (1H, d, J = 8.0), 7.45-7.25 (6H, overlapped), 6.95 (1H, d, J = 29.0), 4.78 (2H, m), 4.47 (2H, q, J = 7.5), 1.46 (3H, t, J = 7.0).
・CDM-3027(14)の合成
CDM-3020(11、Scheme 3)と同様にして、上記Scheme 4に記載の条件下で合成した。
1H NMR (500 MHz, CD3OD) δ ppm: 9.08 (1H, s), 8.71 (2H, d, J = 7.5), 8.51 (2H, d, J = 5.5), 7.83 (1H, d, J = 9.0), 7.52 (2H, d, J = 7.5), 7.48 (1H, d, J = 10.0), 7.40 (2H, t, J = 7.5), 7.31 (1H, t, J = 7.5), 7.23 (1H, s), 4.86 (1H, s); HR-ESI-MS calcd for C24H18F3N6O [M+H]+: 463.1494, found: 463.1485.
CDM-3020(11、Scheme 3)と同様にして、上記Scheme 4に記載の条件下で合成した。
1H NMR (500 MHz, CD3OD) δ ppm: 9.08 (1H, s), 8.71 (2H, d, J = 7.5), 8.51 (2H, d, J = 5.5), 7.83 (1H, d, J = 9.0), 7.52 (2H, d, J = 7.5), 7.48 (1H, d, J = 10.0), 7.40 (2H, t, J = 7.5), 7.31 (1H, t, J = 7.5), 7.23 (1H, s), 4.86 (1H, s); HR-ESI-MS calcd for C24H18F3N6O [M+H]+: 463.1494, found: 463.1485.
・CDM-3021(15)の合成
CDM-3027(14, 5.0mg, 6.7μmol)を濃硫酸(0.5mL)に溶解させ、1時間撹拌した。反応液を氷水にあけ、アンモニア水を用いてpH約8とし、メタノール/クロロホルム(5:95)で三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をHPLC(PEGASIL ODS SP100, φ20×250mm, eluent : CH3CN/H2O=50:50, 0.01% TFA) にて精製し、CDM-3017(8)を1.3mg (52%)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 8.79 (1H, s), 8.70 (2H, br-s), 8.37 (2H, d, J = 6.0), 7.65-7.63 (3H, overlapped), 7.46 (1H, d, J = 9.5), 7.14 (1H, s); HR-ESI-MS calcd for C17H12F3N6O [M+H]+: 373.1025, found: 373.1014.
CDM-3027(14, 5.0mg, 6.7μmol)を濃硫酸(0.5mL)に溶解させ、1時間撹拌した。反応液を氷水にあけ、アンモニア水を用いてpH約8とし、メタノール/クロロホルム(5:95)で三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をHPLC(PEGASIL ODS SP100, φ20×250mm, eluent : CH3CN/H2O=50:50, 0.01% TFA) にて精製し、CDM-3017(8)を1.3mg (52%)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 8.79 (1H, s), 8.70 (2H, br-s), 8.37 (2H, d, J = 6.0), 7.65-7.63 (3H, overlapped), 7.46 (1H, d, J = 9.5), 7.14 (1H, s); HR-ESI-MS calcd for C17H12F3N6O [M+H]+: 373.1025, found: 373.1014.
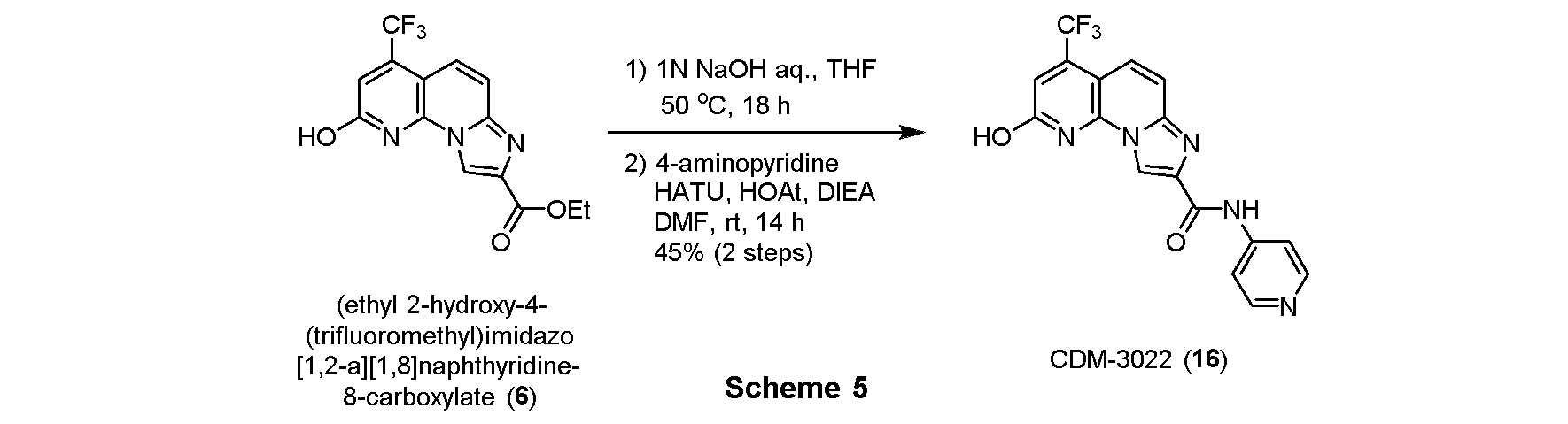
・CDM-3022(16)の合成
CDM-3020(11、Scheme 3)と同様にして、上記Scheme 5に記載の条件下で合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 10.79 (1H, s), 8.84 (1H, s), 8.40 (2H, m), 7.91 (2H, d, J = 7.5), 7.72 (1H, d, J = 12.5), 7.60 (1H, d, J = 12.5), 7.25 (1H, s); HR-ESI-MS calcd for C17H11F3N5O2 [M+H]+: 374.0865, found: 374.0821.
CDM-3020(11、Scheme 3)と同様にして、上記Scheme 5に記載の条件下で合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 10.79 (1H, s), 8.84 (1H, s), 8.40 (2H, m), 7.91 (2H, d, J = 7.5), 7.72 (1H, d, J = 12.5), 7.60 (1H, d, J = 12.5), 7.25 (1H, s); HR-ESI-MS calcd for C17H11F3N5O2 [M+H]+: 374.0865, found: 374.0821.
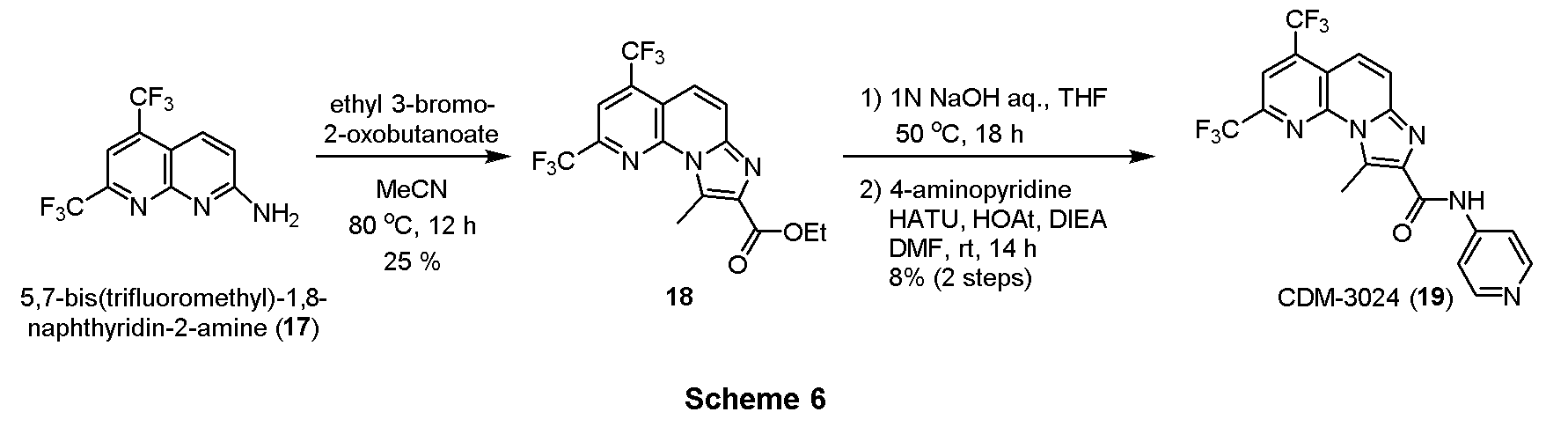
・三環性化合物18の合成
5,7-ビス(トリフルオロメチル)-1,8-ナフチリジン-2-アミン (17, 100.0 mg, 0.357 mmol)をアセトニトリル (2.0 mL)に溶解させ、エチル-3-ブロモ-2-オキソブタノエート(55.8μL, 0.393mmol)を加えて80 oCで12時間撹拌した。反応液を減圧留去後、得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、三環性化合物18を35.1mg(25%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.10 (1H, s), 7.90 (1H, d, J = 10.0), 7.81 (1H, d, J = 9.5), 4.51 (2H, q, J = 7.0), 1.55 (3H, s), 1.48 (3H, t, J = 7.5).
5,7-ビス(トリフルオロメチル)-1,8-ナフチリジン-2-アミン (17, 100.0 mg, 0.357 mmol)をアセトニトリル (2.0 mL)に溶解させ、エチル-3-ブロモ-2-オキソブタノエート(55.8μL, 0.393mmol)を加えて80 oCで12時間撹拌した。反応液を減圧留去後、得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、三環性化合物18を35.1mg(25%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.10 (1H, s), 7.90 (1H, d, J = 10.0), 7.81 (1H, d, J = 9.5), 4.51 (2H, q, J = 7.0), 1.55 (3H, s), 1.48 (3H, t, J = 7.5).
・CDM-3024(19)の合成
CDM-3020(11、Scheme 3)と同様にして上記Scheme 6に記載の条件下で合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 11.6 (1H, s), 8.73 (2H, br-s), 8.51 (1H, s), 8.42 (2H, br-s), 8.30 (1H, s), 8.07 (1H, d, J = 9.5), 7.92 (1H, d, J = 10.0), 3.15 (3H, s); HR-ESI-MS calcd for C19H25F6N5O [M+H]+: 440.0946, found: 440.0920.
CDM-3020(11、Scheme 3)と同様にして上記Scheme 6に記載の条件下で合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 11.6 (1H, s), 8.73 (2H, br-s), 8.51 (1H, s), 8.42 (2H, br-s), 8.30 (1H, s), 8.07 (1H, d, J = 9.5), 7.92 (1H, d, J = 10.0), 3.15 (3H, s); HR-ESI-MS calcd for C19H25F6N5O [M+H]+: 440.0946, found: 440.0920.
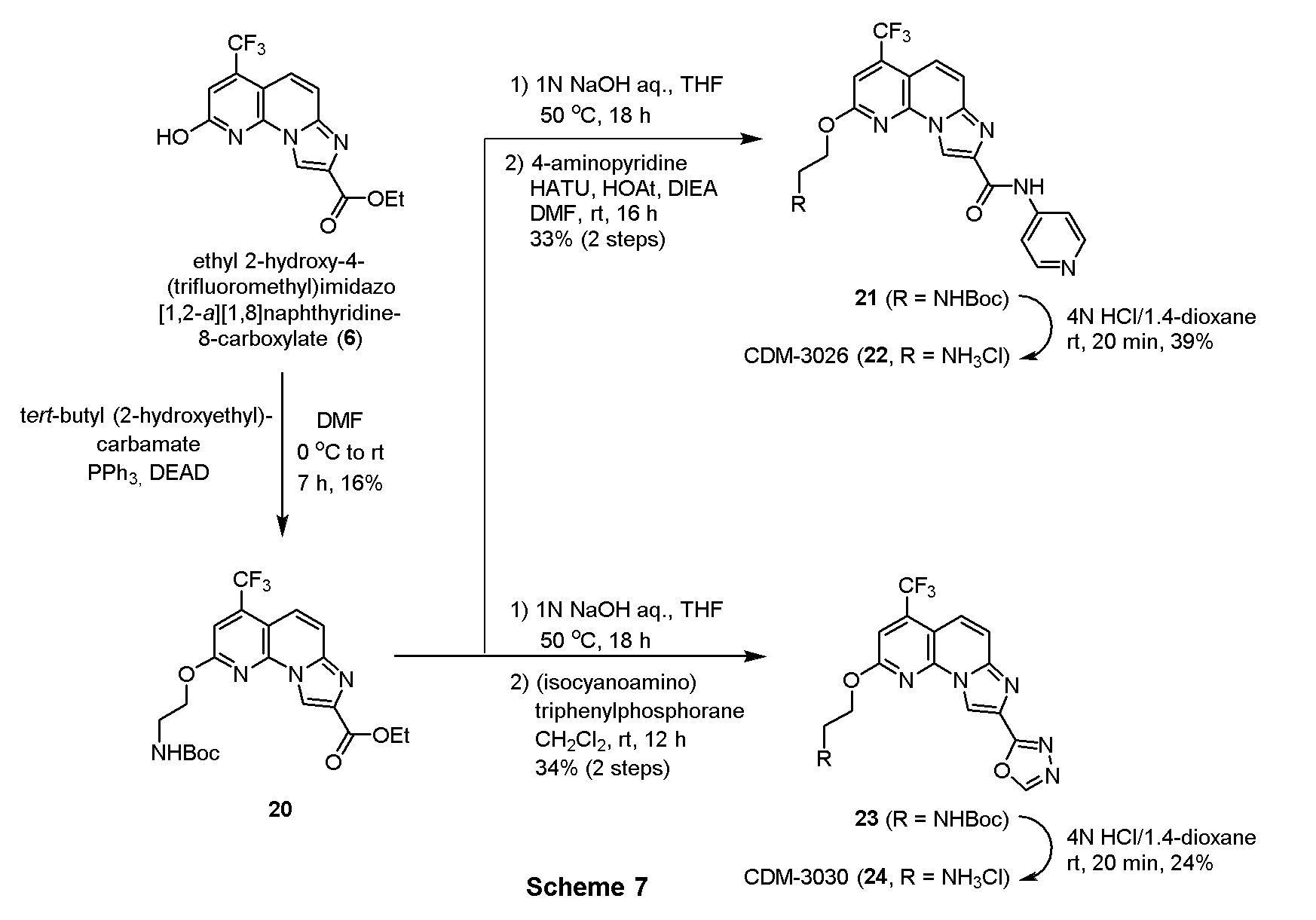
・化合物20の合成
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 7に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.93 (1H, s), 7.76 (1H, d, J = 8.0), 7.64 (1H, d, J = 10.0), 7.29 (1H, s), 4.63 (2H, m), 4.50 (2H, q, J = 7.5), 3.60 (2H, m), 1.49 (3H, t, J = 7.0), 1.45 (9H,s).
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 7に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.93 (1H, s), 7.76 (1H, d, J = 8.0), 7.64 (1H, d, J = 10.0), 7.29 (1H, s), 4.63 (2H, m), 4.50 (2H, q, J = 7.5), 3.60 (2H, m), 1.49 (3H, t, J = 7.0), 1.45 (9H,s).
・4-アミノピリジン縮合体21の合成
CDM-3020(11、Scheme 3)と同様にして、上記Scheme 7に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.38 (1H, s), 9.03 (1H, s), 8.58 (2H, d, J = 6.0), 7.83 (1H, d, J = 8.5), 7.73 (2H, d, J = 6.5), 7.58 (1H, d, J = 9.5), 7.32 (1H, s), 4.64 (2H, m), 3.67 (2H, m), 1.46 (9H, s).
CDM-3020(11、Scheme 3)と同様にして、上記Scheme 7に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.38 (1H, s), 9.03 (1H, s), 8.58 (2H, d, J = 6.0), 7.83 (1H, d, J = 8.5), 7.73 (2H, d, J = 6.5), 7.58 (1H, d, J = 9.5), 7.32 (1H, s), 4.64 (2H, m), 3.67 (2H, m), 1.46 (9H, s).
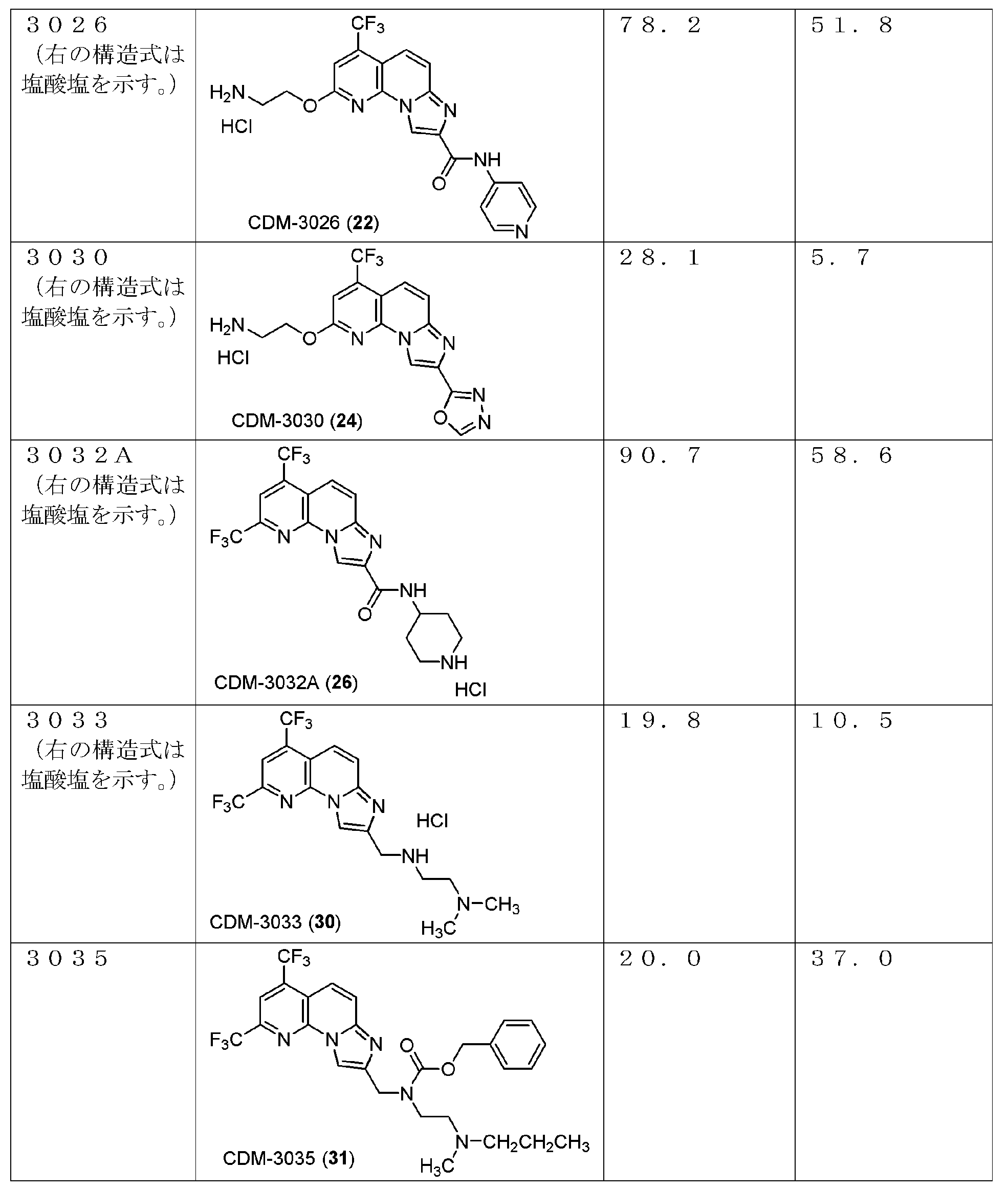
・CDM-3026(22)の合成
4-アミノピリジン縮合体21(50.0mg, 0.097mmol)を4N HCl/1.4-dioxaneに溶解させ、20分撹拌した。反応液を留去後、得られた残渣をHPLC(PEGASIL ODS SP100, φ20×250mm, eluent:CH3CN/H2O=25:75, 0.1% TFA) にて精製し、CDM-3026(22)を17.1 mg(39%)得た。
1H NMR (500 MHz, CD3OD) δ ppm: 9.23 (1H, s), 8.68 (2H, d, J = 7.0), 8.51 (2H, d, J = 7.5), 7.97(1H, d, J = 9.5), 7.78 (1H, d, J = 10.0), 7.57 (1H, s), 4.90 (2H, overlapped), 3.53 (2H, dd, J = 5.0, 5.0); HR-ESI-MS calcd for C19H16F3N6O2 [M+H]+: 417.1287, found: 417.1331 (脱塩体として観測).
4-アミノピリジン縮合体21(50.0mg, 0.097mmol)を4N HCl/1.4-dioxaneに溶解させ、20分撹拌した。反応液を留去後、得られた残渣をHPLC(PEGASIL ODS SP100, φ20×250mm, eluent:CH3CN/H2O=25:75, 0.1% TFA) にて精製し、CDM-3026(22)を17.1 mg(39%)得た。
1H NMR (500 MHz, CD3OD) δ ppm: 9.23 (1H, s), 8.68 (2H, d, J = 7.0), 8.51 (2H, d, J = 7.5), 7.97(1H, d, J = 9.5), 7.78 (1H, d, J = 10.0), 7.57 (1H, s), 4.90 (2H, overlapped), 3.53 (2H, dd, J = 5.0, 5.0); HR-ESI-MS calcd for C19H16F3N6O2 [M+H]+: 417.1287, found: 417.1331 (脱塩体として観測).
・オキサジアゾール含有化合物23の合成
CDM-3017(8、Scheme 2)と同様にして、上記Scheme 7に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.10 (1H, s), 8.55 (1H, s), 7.80 (1H, d, J = 8.5), 7.60 (1H, d, J = 9.5), 7.30 (1H, s), 5.01 (1H, s, br-s), 4.63 (2H, m), 3.67 (2H, m), 1.43 (9H, s).
CDM-3017(8、Scheme 2)と同様にして、上記Scheme 7に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.10 (1H, s), 8.55 (1H, s), 7.80 (1H, d, J = 8.5), 7.60 (1H, d, J = 9.5), 7.30 (1H, s), 5.01 (1H, s, br-s), 4.63 (2H, m), 3.67 (2H, m), 1.43 (9H, s).
・CDM-3030(24)の合成
CDM-3026(22,Scheme 7)と同様にして、上記Scheme 7に記載の条件下で合成した。
1H NMR (500 MHz, CD3OD) δ ppm: 9.15 (1H, s), 9.13 (1H, s), 7.94 (1H, d, J = 9.5), 7.69 (1H, d, J = 9.5), 7.55 (1H, s), 4.90 (2H, m), 3.56 (2H, m); HR-ESI-MS calcd for C15H12F3N2O2 [M+H]+: 365.0974, found: 365.0958 (脱塩体として観測).
CDM-3026(22,Scheme 7)と同様にして、上記Scheme 7に記載の条件下で合成した。
1H NMR (500 MHz, CD3OD) δ ppm: 9.15 (1H, s), 9.13 (1H, s), 7.94 (1H, d, J = 9.5), 7.69 (1H, d, J = 9.5), 7.55 (1H, s), 4.90 (2H, m), 3.56 (2H, m); HR-ESI-MS calcd for C15H12F3N2O2 [M+H]+: 365.0974, found: 365.0958 (脱塩体として観測).
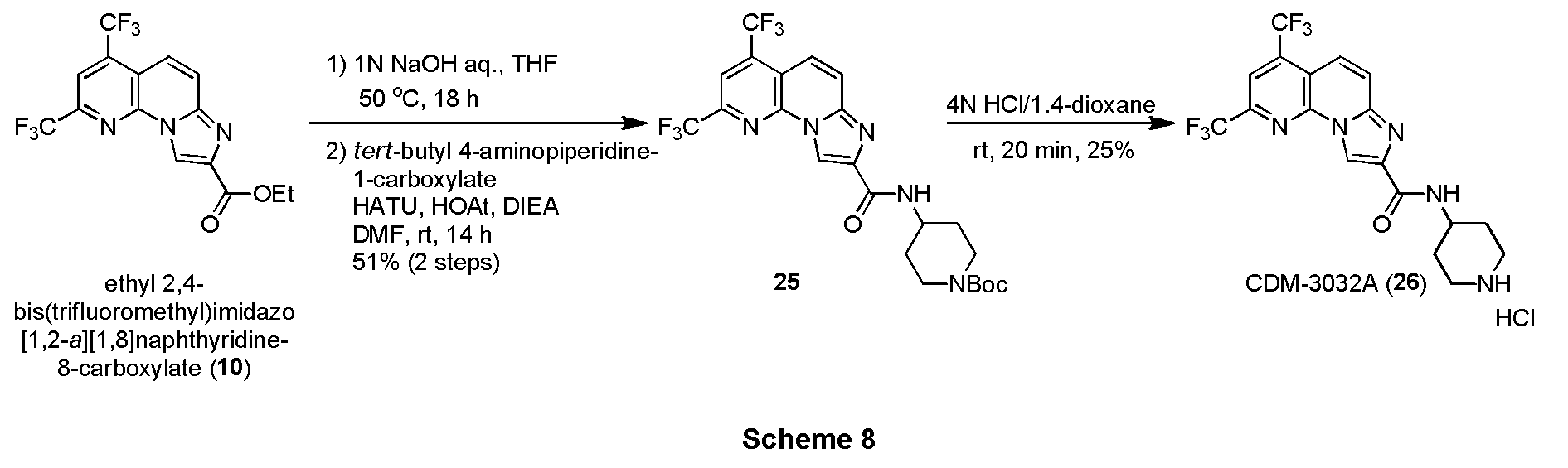
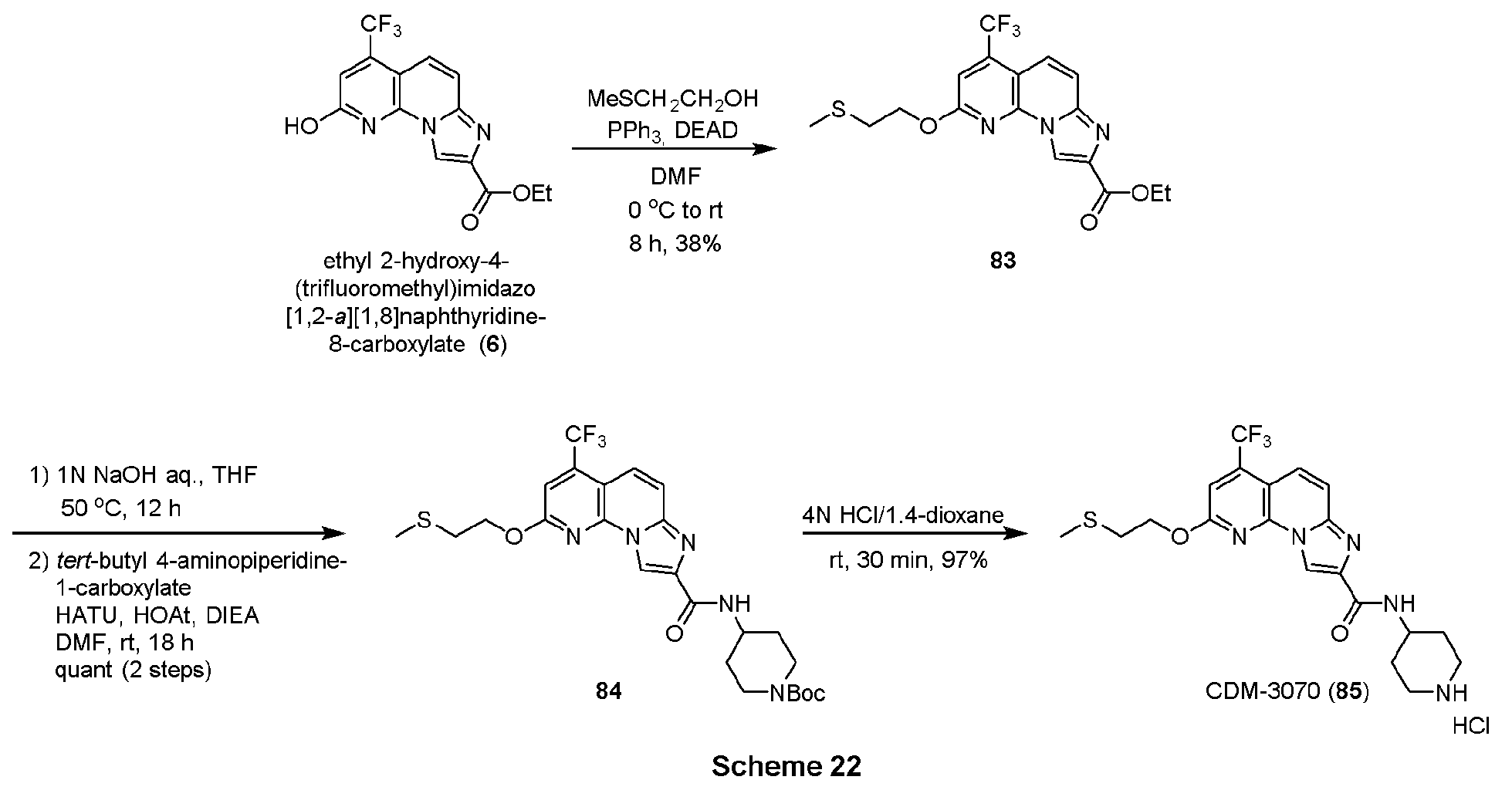
・ピペリジン含有化合物25の合成
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 63.7mg, 0.169mmol)をTHF(2.0mL)に溶解させ、1N水酸化ナトリウム水溶液(0.5mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2にし、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をDMF(1.0mL)に溶解させ、HATU(128.5mg, 0.338mmol), HOAt(45.6mg, 0.338mmol), DIEA(58.8μL, 0.338mmol)を加えて30分撹拌後、tert-ブチル4-アミノピペリジン-1-カルボキシレート(67.6mg, 0.338mmol)を加えて14時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、ピペリジン含有化合物25を45.9mg (51%, 2 steps)得た。
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 63.7mg, 0.169mmol)をTHF(2.0mL)に溶解させ、1N水酸化ナトリウム水溶液(0.5mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2にし、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をDMF(1.0mL)に溶解させ、HATU(128.5mg, 0.338mmol), HOAt(45.6mg, 0.338mmol), DIEA(58.8μL, 0.338mmol)を加えて30分撹拌後、tert-ブチル4-アミノピペリジン-1-カルボキシレート(67.6mg, 0.338mmol)を加えて14時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、ピペリジン含有化合物25を45.9mg (51%, 2 steps)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.13 (1H, s), 8.11 (1H, s), 8.01 (2H, br-s), 7.88 (1H, d, J = 12.5), 7.79 (1H, d, J = 12.5), 4.28-4.10 (3H, overlapped), 2.80 (2H, m), 2.04 (2H, m), 1.50 (2H, m), 1.47 (9H, s).
・CDM-3032A(26)の合成
CDM-3026(22, Scheme 7)と同様にして、上記Scheme 8に記載の条件下で合成した。
1H NMR (500 MHz, CD3OD) δ ppm: 9.08 (1H, s), 8.34 (1H, s), 8.03 (1H, d, J = 8.0), 7.93 (1H, d, J = 10.0), 4.22 (1H, m), 3.37 (2H, m), 3.18 (2H, m), 2.20 (2H, m), 1.91 (2H, m); HR-ESI-MS calcd for C18H16F6N5O [M+H]+: 432.1259, found: 432.1232 (脱塩体として観測).
CDM-3026(22, Scheme 7)と同様にして、上記Scheme 8に記載の条件下で合成した。
1H NMR (500 MHz, CD3OD) δ ppm: 9.08 (1H, s), 8.34 (1H, s), 8.03 (1H, d, J = 8.0), 7.93 (1H, d, J = 10.0), 4.22 (1H, m), 3.37 (2H, m), 3.18 (2H, m), 2.20 (2H, m), 1.91 (2H, m); HR-ESI-MS calcd for C18H16F6N5O [M+H]+: 432.1259, found: 432.1232 (脱塩体として観測).
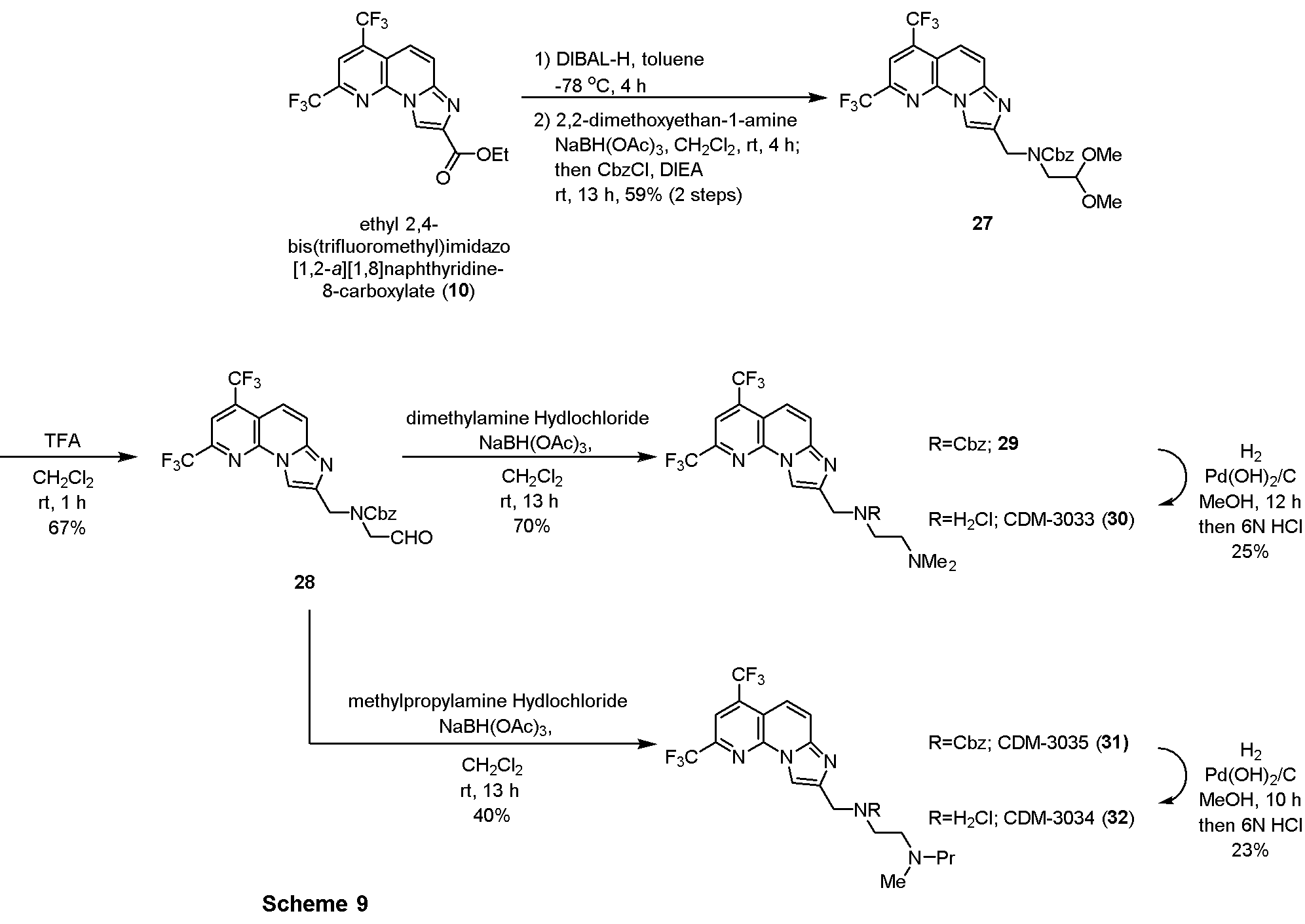
・ジメトキシ体27の合成
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 265.0mg, 0.71mmol)を窒素雰囲気下トルエン(7.0mL)に溶解させ、-78℃に冷却後、DIBAL-H(1.0M in hexane, 0.85mL, 0.85mmol)を滴下し4時間撹拌した。メタノール(0.5mL)、飽和ロッシェル塩水溶液(0.5mL)を加えて室温に昇温後5時間撹拌し、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物を窒素雰囲気下ジクロロメタン(20.0mL)に溶解させ、2,2-ジメトキシエタン-1-アミン(77.0μL, 0.71mmol), 水素化トリアセトキシボロヒドリド(164.7mg, 0.78mmol)を加えて4時間撹拌後、DIEA(185.0μL, 1.07mmol), CbzCl(152.0μL, 1.07mmol)を滴下し13時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、ジメトキシ体27を232.3mg (59%, 2 steps)得た。
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 265.0mg, 0.71mmol)を窒素雰囲気下トルエン(7.0mL)に溶解させ、-78℃に冷却後、DIBAL-H(1.0M in hexane, 0.85mL, 0.85mmol)を滴下し4時間撹拌した。メタノール(0.5mL)、飽和ロッシェル塩水溶液(0.5mL)を加えて室温に昇温後5時間撹拌し、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物を窒素雰囲気下ジクロロメタン(20.0mL)に溶解させ、2,2-ジメトキシエタン-1-アミン(77.0μL, 0.71mmol), 水素化トリアセトキシボロヒドリド(164.7mg, 0.78mmol)を加えて4時間撹拌後、DIEA(185.0μL, 1.07mmol), CbzCl(152.0μL, 1.07mmol)を滴下し13時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、ジメトキシ体27を232.3mg (59%, 2 steps)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.49 (0.5H, s), 8.30 (0.5H, s), 8.07 (1H, s), 7.87-7.78 (2H, overlapped), 7.42-7.18 (5H, overlapped), 5.20 (2H, d, J = 19.5), 4.82 (2H, d, J = 17.5), 4.58 (1H, m), 3.56 (1H, d, J = 22.0, 5.5), 3.43 (3H, s), 3.34 (3H, s).
・アルデヒド体28の合成
ジメトキシ体27(39.4mg, 0.073mmol)をジクロロメタン(0.5mL)に溶解させ、TFA(0.5mL)を滴下し1時間撹拌した。反応液を留去後、得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=10:90)にて精製し、アルデヒド体27を24.9mg (67%)得た。
ジメトキシ体27(39.4mg, 0.073mmol)をジクロロメタン(0.5mL)に溶解させ、TFA(0.5mL)を滴下し1時間撹拌した。反応液を留去後、得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=10:90)にて精製し、アルデヒド体27を24.9mg (67%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.03 (1H, m), 8.62 (0.5H, s), 8.39 (0.5H, s), 8.18-7.78 (3H, overlapped), 7.42-7.22 (5H, overlapped), 5.18 (2H, d, J = 26.0), 4.81 (2H, d, J = 31.0), 4.29 (2H, d, J = 14.0).
・ジメチルアミン体29の合成
アルデヒド体28(24.9mg, 0.049mmol)を窒素雰囲気下ジクロロメタン (0.5mL)に溶解させ、ジメチルアミン塩酸塩(11.9mg, 0.147mmol), 水素化トリアセトキシボロヒドリド(31.0mg, 0.147mmol)を加えて13時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (MeOH/CHCl3=10:90)にて精製し、ジメチルアミン体29を18.0mg (70%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.52 (0.5H, s), 8.35 (0.5H, s), 8.05 (1H, s), 7.82-7.62 (2H, overlapped), 7.45-7.04 (5H, overlapped), 5.20 (2H, s), 4.74 (2H, s), 3.65 (2H, m), 2.70 (2H, m), 2.45 (3H, s), 2.28 (3H, s).
アルデヒド体28(24.9mg, 0.049mmol)を窒素雰囲気下ジクロロメタン (0.5mL)に溶解させ、ジメチルアミン塩酸塩(11.9mg, 0.147mmol), 水素化トリアセトキシボロヒドリド(31.0mg, 0.147mmol)を加えて13時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (MeOH/CHCl3=10:90)にて精製し、ジメチルアミン体29を18.0mg (70%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.52 (0.5H, s), 8.35 (0.5H, s), 8.05 (1H, s), 7.82-7.62 (2H, overlapped), 7.45-7.04 (5H, overlapped), 5.20 (2H, s), 4.74 (2H, s), 3.65 (2H, m), 2.70 (2H, m), 2.45 (3H, s), 2.28 (3H, s).
・CDM-3033(30)の合成
ジメチルアミン体29(18.0mg, 0.033mmol)をメタノール(1.0mL)に溶解させ、水酸化パラジウム(1.7mg)を加えて水素雰囲気下、12時間撹拌した。反応液をセライトを用いて濾過した後、6N塩酸(0.1mL)を加えて溶媒を減圧留去した。得られた残渣をHPLC(PEGASIL ODS SP100, φ20×250mm, eluent:CH3CN/H2O=40:60, 0.1% TFA)にて精製し、CDM-3033(30)を3.6mg(25%)得た。
ジメチルアミン体29(18.0mg, 0.033mmol)をメタノール(1.0mL)に溶解させ、水酸化パラジウム(1.7mg)を加えて水素雰囲気下、12時間撹拌した。反応液をセライトを用いて濾過した後、6N塩酸(0.1mL)を加えて溶媒を減圧留去した。得られた残渣をHPLC(PEGASIL ODS SP100, φ20×250mm, eluent:CH3CN/H2O=40:60, 0.1% TFA)にて精製し、CDM-3033(30)を3.6mg(25%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.76 (1H, s), 8.14 (1H, s), 7.95 (1H, d, J = 8.0), 7.85 (1H, d, J = 10.5), 4.55 (2H, s), 4.45 (1H, br-s), 3.74 (2H, m), 3.68 (2H, m), 2.92 (6H, s); HR-ESI-MS calcd for C17H18F6N5 [M+H]+: 406.1466, found: 406.1446 (脱塩体として観測).
・CDM-3035 (31)の合成
ジメチルアミン体29(Scheme 9)と同様にして、上記Scheme 9に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.61 (0.3H, s), 8.38 (0.7H, s), 8.14 (1H, s), 8.08-7.90 (2H, overlapped), 7.41-7.18 (5H, overlapped), 5.18 (2H, s), 4.74 (2H, m), 3.86 (2H, m), 3.50-3.10 (2H, overlapped), 3.02-2.77 (3H, overlapped), 2.74-2.60 (2H, overlapped), 1.76 (2H, m), 0.98 (2H, m), 0.82 (1H, m); HR-ESI-MS calcd for C27H28F6N5O2 [M+H]+: 568.2147, found: 568.2131.
ジメチルアミン体29(Scheme 9)と同様にして、上記Scheme 9に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.61 (0.3H, s), 8.38 (0.7H, s), 8.14 (1H, s), 8.08-7.90 (2H, overlapped), 7.41-7.18 (5H, overlapped), 5.18 (2H, s), 4.74 (2H, m), 3.86 (2H, m), 3.50-3.10 (2H, overlapped), 3.02-2.77 (3H, overlapped), 2.74-2.60 (2H, overlapped), 1.76 (2H, m), 0.98 (2H, m), 0.82 (1H, m); HR-ESI-MS calcd for C27H28F6N5O2 [M+H]+: 568.2147, found: 568.2131.
・CDM-3034(32)の合成
CDM-3033(30, Scheme 9)と同様にして、上記Scheme 9に記載の条件下で合成した。
CDM-3033(30, Scheme 9)と同様にして、上記Scheme 9に記載の条件下で合成した。
1H NMR (500 MHz, CD3OD) δ ppm: 8.80 (1H, s), 8.34 (1H, s), 8.02 (1H, d, J = 8.0), 7.93 (1H, d, J = 10.5), 4.49 (2H, m), 3.55 (4H, overlapped), 3.15 (2H, m), 2.92 (3H, s), 1.78 (2H, m), 1.01 (3H, dd, J = 7.5, 7.5); HR-ESI-MS calcd for C19H22F6N5 [M+H]+: 434.1779, found: 434.1791 (脱塩体として観測).
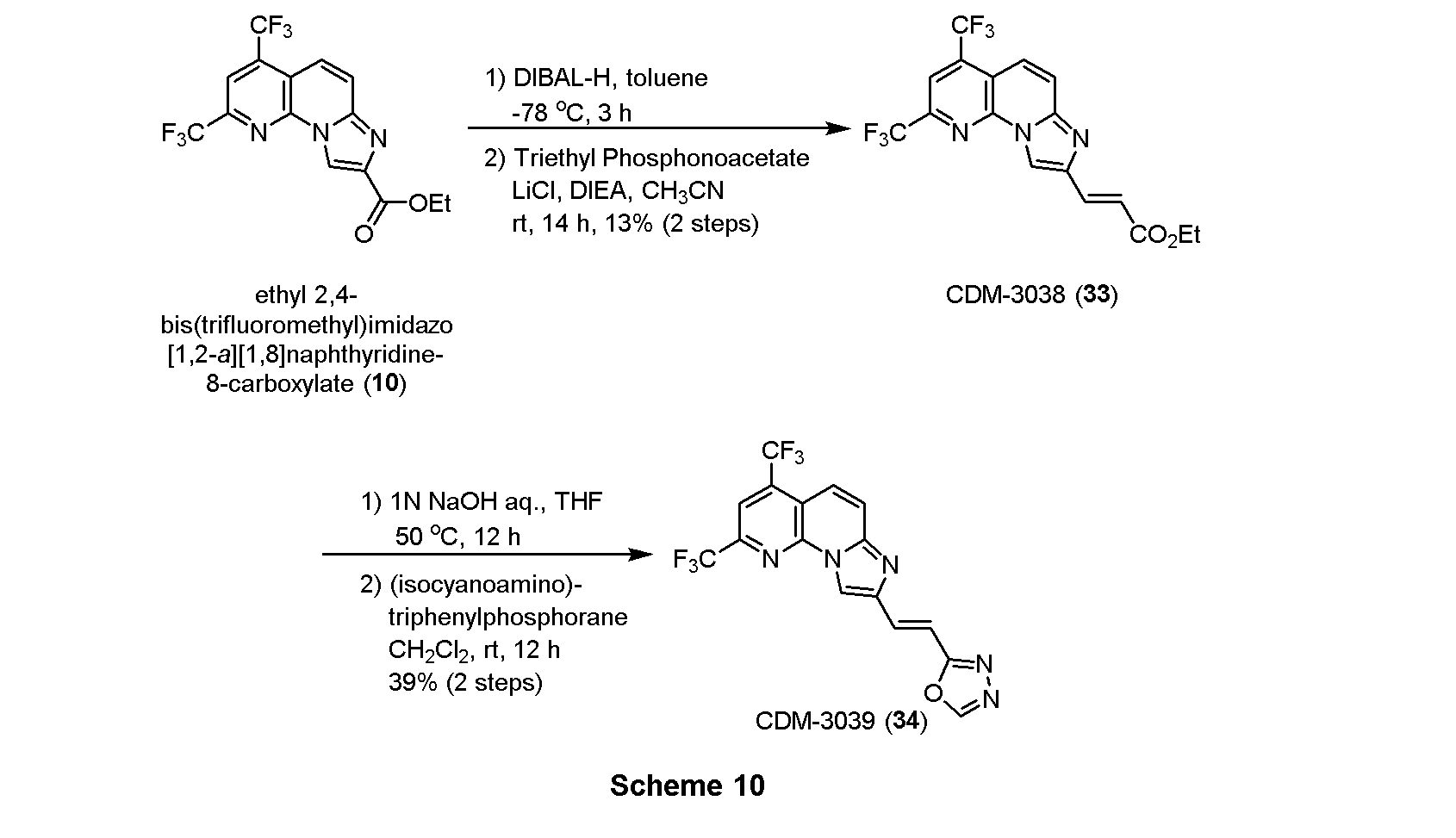
・CDM-3038 (33)の合成
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート 10, 364.0mg, 0.97mmol)を窒素雰囲気下トルエン(9.6mL)に溶解させ、-78℃に冷却後、DIBAL-H(1.0M in hexane, 1.45mL, 1.45mmol)を滴下し4時間撹拌した。メタノール(0.7mL)、飽和ロッシェル塩水溶液(0.7mL)を加えて室温に昇温後5時間撹拌し、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート 10, 364.0mg, 0.97mmol)を窒素雰囲気下トルエン(9.6mL)に溶解させ、-78℃に冷却後、DIBAL-H(1.0M in hexane, 1.45mL, 1.45mmol)を滴下し4時間撹拌した。メタノール(0.7mL)、飽和ロッシェル塩水溶液(0.7mL)を加えて室温に昇温後5時間撹拌し、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をアセトニトリル(9.3mL)に溶解させ、塩化リチウム(1.75g, 41.4mmol)、 トリエチルホスホノアセテート(0.55mL, 2.76mmol)、DIEA(0.48mL, 2.76mmol)を加えて14時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/hexane=10:90→20:80)にて精製し、CDM-3038(33)を48.0mg(13%, 2 steps)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.70 (1H, s), 8.10 (1H, s), 7.89 (2H, t, J = 11.5), 7.78 (1H, d, J = 16.0), 6.93 (1H, d, J = 15.5), 4.29 (2H, q, J = 7.0), 1.35 (3H, t, J = 7.0); HR-ESI-MS calcd for C17H12F6N3O2 [M+H]+: 404.0834, found: 404.0818.
・CDM-3039(34)の合成
CDM-3017(8、Scheme 2)と同様にして、上記Scheme 10に記載の条件下で合成した。
CDM-3017(8、Scheme 2)と同様にして、上記Scheme 10に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.72 (1H, s), 8.44 (1H, s), 8.10 (1H, s), 7.90 (1H, d, J = 11.0, 7.88 (1H, d, J = 10.0), 7.73 (1H, d, J = 8.0), 7.58 (1H, d, J = 8.0); HR-ESI-MS calcd for C16H8F6N5O [M+H]+: 400.0633, found: 400.0595.
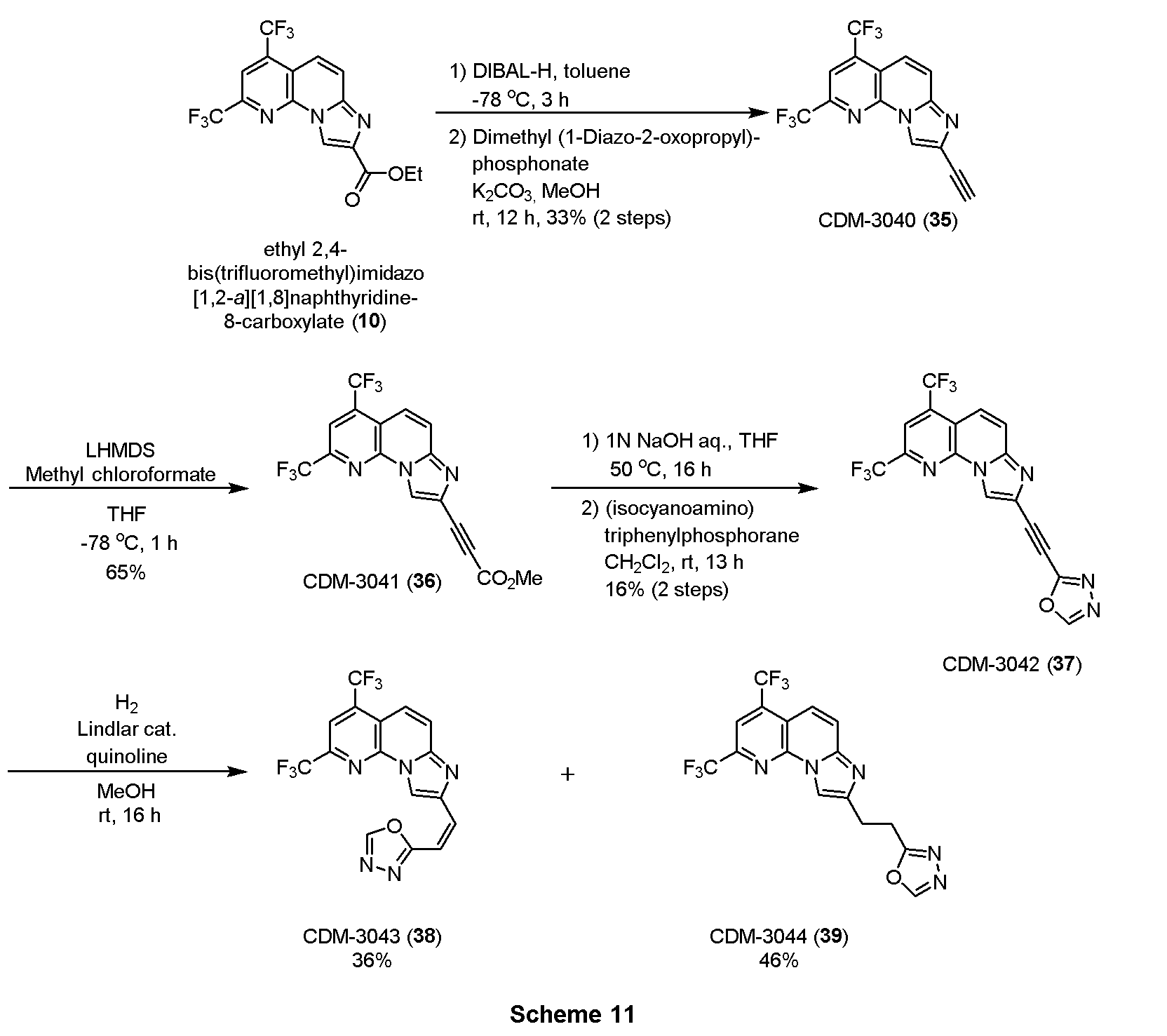
・CDM-3040(35)の合成
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 180.0mg, 0.48mmol)を窒素雰囲気下トルエン(4.8mL)に溶解させ、-78℃に冷却後、DIBAL-H(1.0M in hexane, 0.72mL, 0.72mmol)を滴下し4時間撹拌した。メタノール(0.4mL)、飽和ロッシェル塩水溶液(0.4mL)を加えて室温に昇温後5時間撹拌し、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 180.0mg, 0.48mmol)を窒素雰囲気下トルエン(4.8mL)に溶解させ、-78℃に冷却後、DIBAL-H(1.0M in hexane, 0.72mL, 0.72mmol)を滴下し4時間撹拌した。メタノール(0.4mL)、飽和ロッシェル塩水溶液(0.4mL)を加えて室温に昇温後5時間撹拌し、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
大平-ベストマン試薬 (92.2mg, 0.48mmol)をメタノール(4.0mL)に溶解させ、氷冷下炭酸カリウム(72.9mg, 0.53mmol)を加えて室温に昇温し、10分間撹拌した。再び氷冷し、上記の粗生成物をメタノール(3.0mL)に溶解したものを滴下し、室温に昇温後12時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/hexane=20:80)にて精製し、CDM-3040 (35)を52.1 mg(33%, 2 steps)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.74 (1H, s), 8.09 (1H, s), 7.87 (1H, d, J = 9.5), 7.84 (1H, d, J = 9.5), 3.29 (1H, s); HR-ESI-MS calcd for C14H6F6N3 [M+H]+: 330.0466, found: 330.0434.
・CDM-3041(36)の合成
CDM-3040(35, 38.6mg, 0.117mmol)を窒素雰囲気下THF(1.0mL)に溶解させ、-78℃に冷却しLHMDS(1.1M in THF, 0.23mL, 0.253mmol)を加え1時間撹拌後、クロロギ酸メチル(18.0μL, 0.234mmol)を加えて1時間撹拌した。飽和塩化アンモニウム水溶液を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/hexane=20:80)にて精製し、CDM-3041(36)を29.6mg(65%)得た。
CDM-3040(35, 38.6mg, 0.117mmol)を窒素雰囲気下THF(1.0mL)に溶解させ、-78℃に冷却しLHMDS(1.1M in THF, 0.23mL, 0.253mmol)を加え1時間撹拌後、クロロギ酸メチル(18.0μL, 0.234mmol)を加えて1時間撹拌した。飽和塩化アンモニウム水溶液を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/hexane=20:80)にて精製し、CDM-3041(36)を29.6mg(65%)得た。
1H NMR (500 MHz, CDCl3) δ ppm:8.90 (1H, s), 8.11 (1H, s), 7.89 (1H, d, J = 10.0), 7.83 (1H, d, J = 10.0), 3.87 (3H, s); HR-ESI-MS calcd for C16H8F6N3O2 [M+H]+: 388.0521, found: 388.0498.
・CDM-3042(37)の合成
CDM-3017(8、Scheme 2)と同様にして、上記Scheme 11に記載の条件下で合成した。
・CDM-3042(37)の合成
CDM-3017(8、Scheme 2)と同様にして、上記Scheme 11に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.97 (1H, s), 8.51 (1H, s), 8.14 (1H, s), 7.91 (1H, d, J = 9.5), 7.87 (1H, d, J = 10.0); HR-ESI-MS calcd for C16H6F6N5O [M+H]+: 398.0477, found: 398.0450.
・CDM-3043(38)、及びCDM-3044(39)の合成
CDM-3042(37, 5.3mg, 13.4μmol)をMeOH(1.0 mL)に溶解させ、LIndlar触媒(7.0mg)、キノリン(1.6μL, 13.4μmol)を加えて水素雰囲気化16時間撹拌した。セライトを用いて濾過後、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/hexane=40:60→60:40)にて精製し、CDM-3043(37)を1.9 mg(36%)、CDM-3044(38)を2.5mg(46%)得た。
CDM-3042(37, 5.3mg, 13.4μmol)をMeOH(1.0 mL)に溶解させ、LIndlar触媒(7.0mg)、キノリン(1.6μL, 13.4μmol)を加えて水素雰囲気化16時間撹拌した。セライトを用いて濾過後、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/hexane=40:60→60:40)にて精製し、CDM-3043(37)を1.9 mg(36%)、CDM-3044(38)を2.5mg(46%)得た。
CDM-3043 (38): 1H NMR (500 MHz, CDCl3) δ ppm: 10.23 (1H, s), 8.54 (1H, s), 8.25 (1H, d, J = 9.5), 8.22 (1H, s), 8.07 (1H, d, J = 8.5), 7.37 (1H, d, J = 13.5), 6.77 (1H, d, 13.5); HR-ESI-MS calcd for C16H8F6N5O [M+H]+: 400.0633, found: 400.0587.
CDM-3044 (39): 1H NMR (500 MHz, CDCl3) δ ppm: 8.41 (1H, s), 8.35 (1H, s), 8.05 (1H, s), 7.83-7.70 (2H, overlapped), 3.49-3.40 (4H, overlapped); HR-ESI-MS calcd for C16H10F6N5O [M+H]+: 402.0790, found: 402.0751.
CDM-3044 (39): 1H NMR (500 MHz, CDCl3) δ ppm: 8.41 (1H, s), 8.35 (1H, s), 8.05 (1H, s), 7.83-7.70 (2H, overlapped), 3.49-3.40 (4H, overlapped); HR-ESI-MS calcd for C16H10F6N5O [M+H]+: 402.0790, found: 402.0751.
・化合物40の合成
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 12に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.94 (1H, s), 7.68-7.62 (2H, overlapped), 7.28 (1H, s), 4.64 (2H, t, J = 5.0), 4.51 (2H, q, J = 7.0), 4.07 (2H, t, J = 5.0), 1.48 (3H, t, J = 7.5), 0.91 (9H, s), 0.12 (6H, s).
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 12に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.94 (1H, s), 7.68-7.62 (2H, overlapped), 7.28 (1H, s), 4.64 (2H, t, J = 5.0), 4.51 (2H, q, J = 7.0), 4.07 (2H, t, J = 5.0), 1.48 (3H, t, J = 7.5), 0.91 (9H, s), 0.12 (6H, s).
・四環性化合物41の合成
CDM-3017 (8、Scheme 2)と同様にして、上記Scheme 12に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.10 (1H, s), 8.55 (1H, s), 7.82 (1H, d, J = 9.5), 7.66 (1H, d, J = 9.5), 7.31 (1H, s), 4.65 (2H, t, J = 4.8), 4.08 (2H, t, J = 5.5), 0.91 (9H, s), 0.12 (6H, s).
CDM-3017 (8、Scheme 2)と同様にして、上記Scheme 12に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.10 (1H, s), 8.55 (1H, s), 7.82 (1H, d, J = 9.5), 7.66 (1H, d, J = 9.5), 7.31 (1H, s), 4.65 (2H, t, J = 4.8), 4.08 (2H, t, J = 5.5), 0.91 (9H, s), 0.12 (6H, s).
・CDM-3049(42)の合成
四環性化合物41(153.0mg, 0.367mmol)をTHF(4.0mL)に溶解させ、氷冷下、酢酸(21.0μL, 0.367mmol)、テトラブチルアンモニウムフルオライド(1.0M in THF, 0.55mL, 0.55mmol)を加えて室温に昇温し、1時間撹拌した。析出した固体をろ取した後に酢酸エチルで洗浄し、CDM-3049(42)を110.0mg(82%)得た。
四環性化合物41(153.0mg, 0.367mmol)をTHF(4.0mL)に溶解させ、氷冷下、酢酸(21.0μL, 0.367mmol)、テトラブチルアンモニウムフルオライド(1.0M in THF, 0.55mL, 0.55mmol)を加えて室温に昇温し、1時間撹拌した。析出した固体をろ取した後に酢酸エチルで洗浄し、CDM-3049(42)を110.0mg(82%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.86 (1H, s), 7.73 (1H, d, J = 8.0), 7.60 (1H, d, J = 10.0), 7.52 (1H, s), 4.64 (2H, t, J = 4.5), 3.83 (2H, t, J = 5.0); HR-ESI-MS calcd for C15H11F3N5O3 [M+H]+: 366.0814, found: 366.0817.
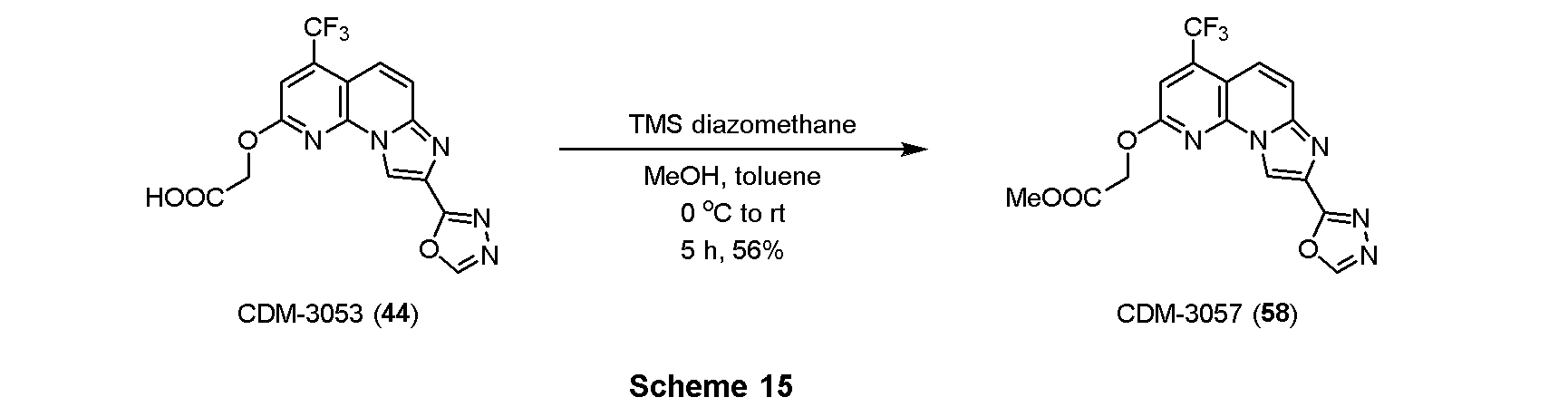
・アルデヒド体43の合成
CDM-3049(42, 53.0mg, 0.145mmol)を窒素雰囲気下DMSO(6.0mL)に溶解させ、トリエチルアミン(0.12mL, 0.87mmol)、SO3-Py(138.7mg, 0.87mmol)を加えて16時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt)にて精製し、アルデヒド体43を21.0 mg(40%)得た。
CDM-3049(42, 53.0mg, 0.145mmol)を窒素雰囲気下DMSO(6.0mL)に溶解させ、トリエチルアミン(0.12mL, 0.87mmol)、SO3-Py(138.7mg, 0.87mmol)を加えて16時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt)にて精製し、アルデヒド体43を21.0 mg(40%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.89 (1H, s), 8.94 (1H, s), 8.57 (1H, s), 7.86 (1H, d, J = 9.5), 7.54 (1H, d, J = 10.0), 7.48 (1H, s), 5.24 (2H, s).
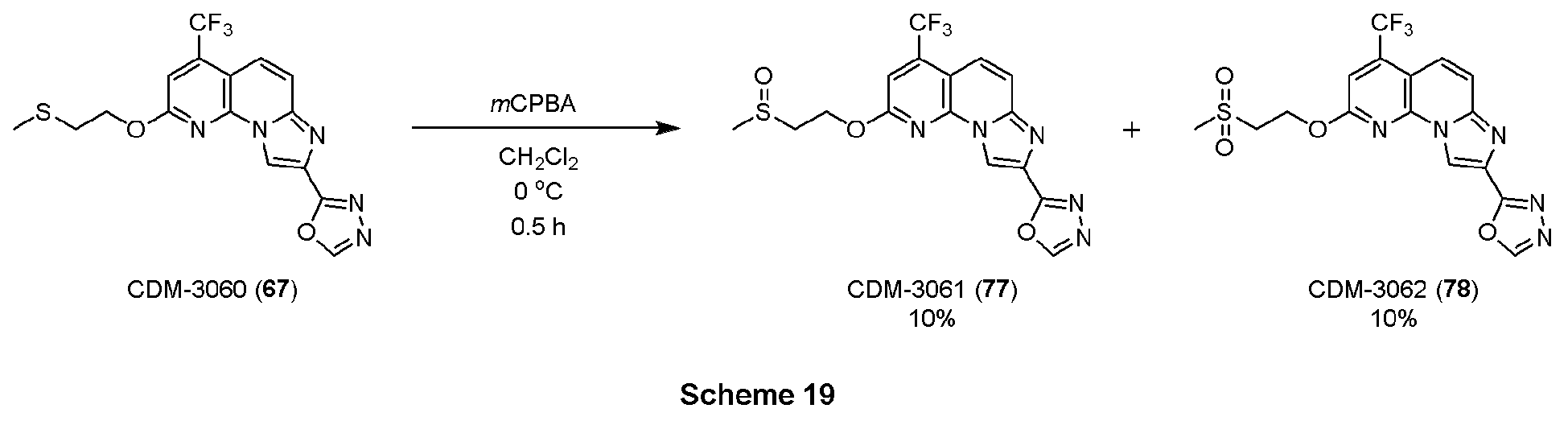
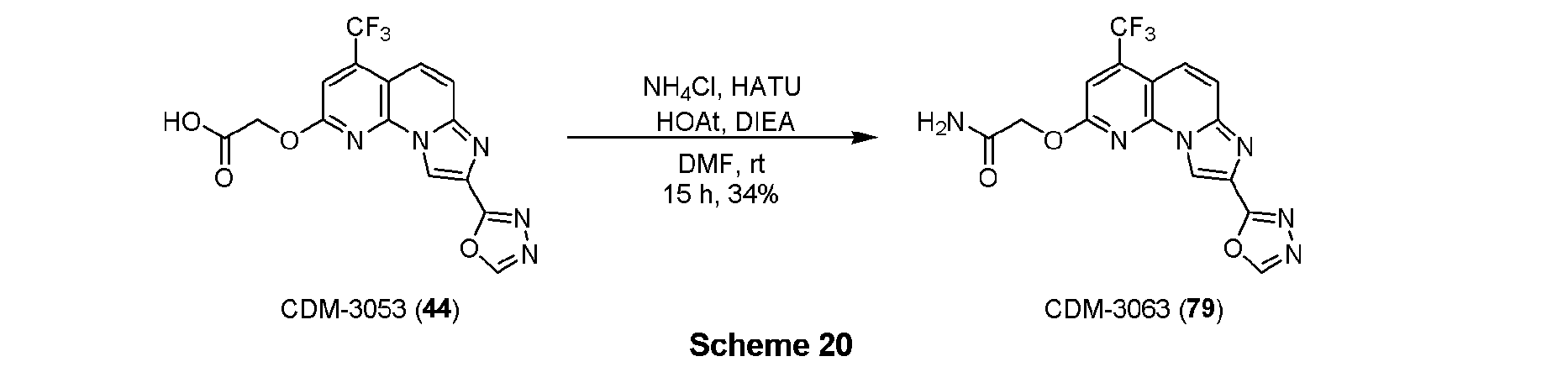
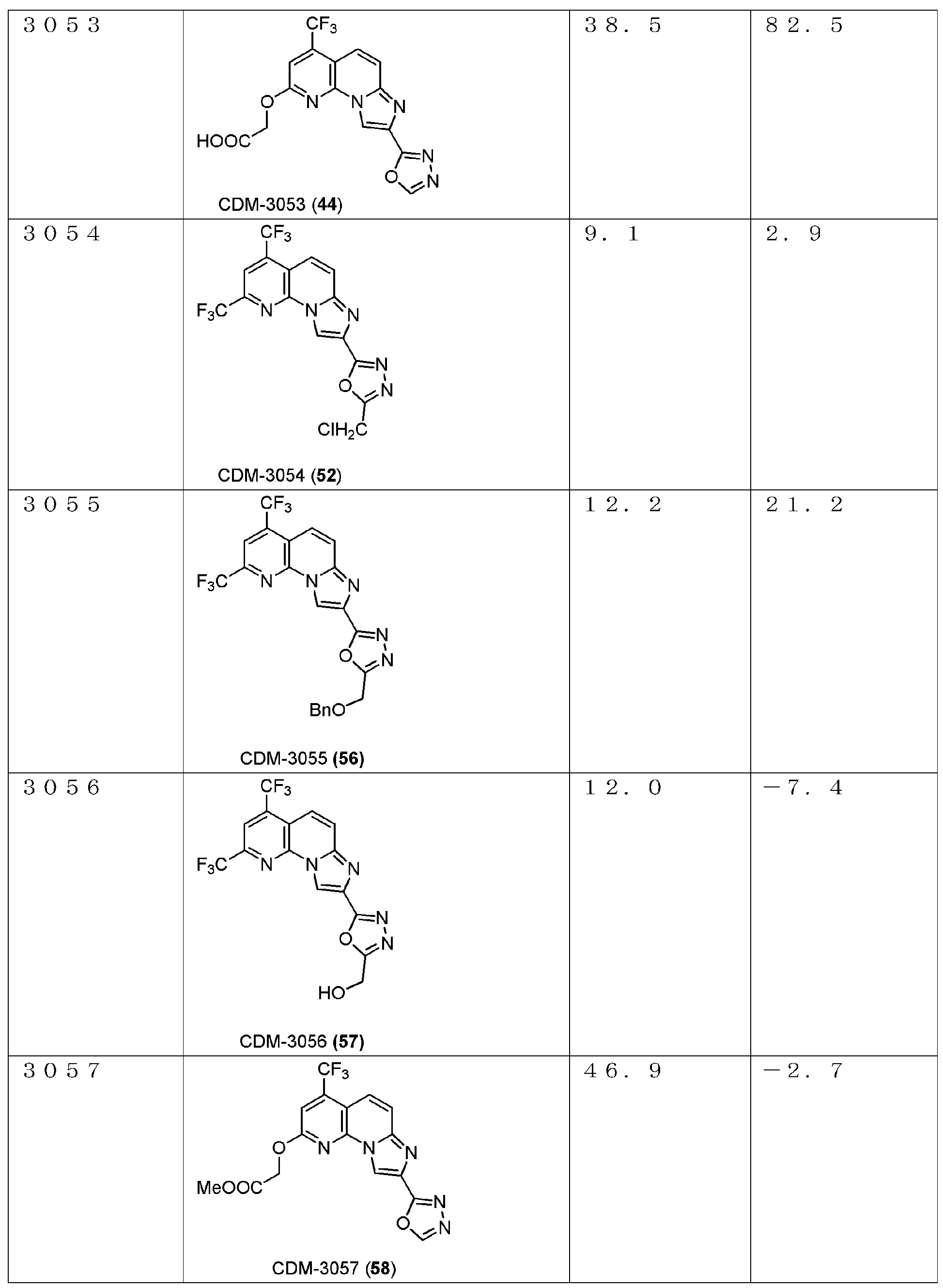
・CDM-3053(44)の合成
アルデヒド体43(21.0mg, 0.058mmol)をt-BuOH(0.8mL)に溶解させ、2-メチル-2-ブテン(0.12mL,1.16mmol)を加えた後に氷冷し、亜塩素酸ナトリウム(31.4mg, 0.348mmol)、およびリン酸二水素ナトリウム一水和物(18.1mg, 0.116mmol)を蒸留水(0.4mL)に溶解させて滴下し、室温に昇温後14時間撹拌した。反応液を分液ロートに移し、クロロホルムで三回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をHPLC(Cosmosil ARII, φ20×250mm, eluent:CH3CN/H2O=50:50, 0.1%TFA) にて精製し、CDM-3053(44)を2.0mg(9%)得た。
アルデヒド体43(21.0mg, 0.058mmol)をt-BuOH(0.8mL)に溶解させ、2-メチル-2-ブテン(0.12mL,1.16mmol)を加えた後に氷冷し、亜塩素酸ナトリウム(31.4mg, 0.348mmol)、およびリン酸二水素ナトリウム一水和物(18.1mg, 0.116mmol)を蒸留水(0.4mL)に溶解させて滴下し、室温に昇温後14時間撹拌した。反応液を分液ロートに移し、クロロホルムで三回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をHPLC(Cosmosil ARII, φ20×250mm, eluent:CH3CN/H2O=50:50, 0.1%TFA) にて精製し、CDM-3053(44)を2.0mg(9%)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.42 (1H, s), 9.09 (1H, s), 7.90 (1H, d, J = 10.0), 7.83 (1H, J = 10.0), 7.71 (1H, s), 5.24 (2H, s); HR-ESI-MS calcd for C15H9F3N5O4 [M+H]+: 380.0607, found: 380.0586.
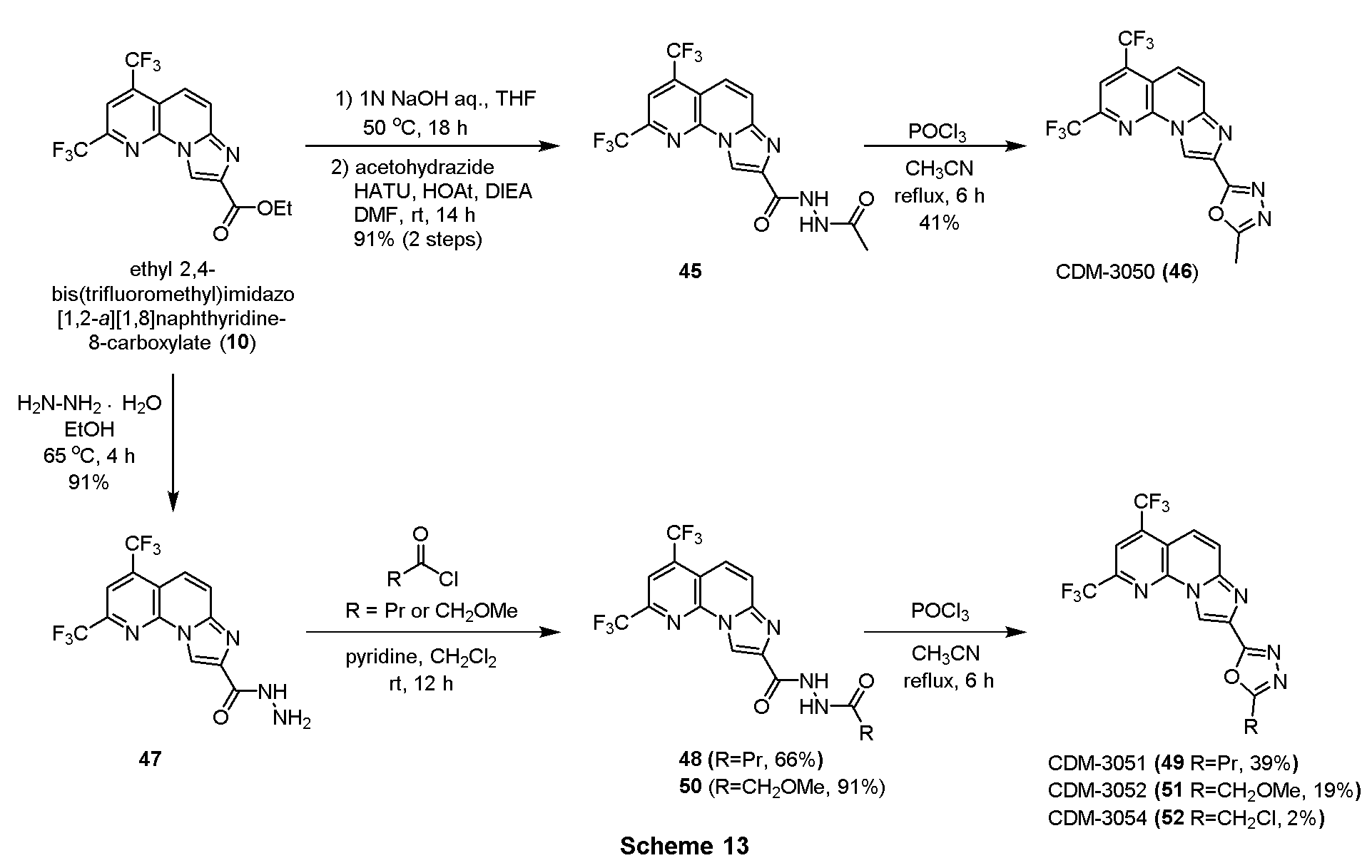
・アセトヒドラジド45の合成
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 83.1mg, 0.223mmol)をTHF(4.0mL)に溶解させ、1N水酸化ナトリウム水溶液(1.0mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2にし、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をDMF(1.1mL)に溶解させ、HATU(170.0mg, 0.446mmol), HOAt(60.4mg, 0.446mmol), DIEA(77.9μL, 0.446mmol)を加えて30分撹拌後、アセトヒドラジド(33.1mg, 0.446mmol)を加えて14時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography(MeOH/CHCl3=5:95)にて精製し、アセトヒドラジド45を75.0mg(91%, 2 steps)得た。
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 83.1mg, 0.223mmol)をTHF(4.0mL)に溶解させ、1N水酸化ナトリウム水溶液(1.0mL)を加えて50℃で18時間撹拌した。反応液を1N塩酸を用いてpH約2にし、酢酸エチルで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた粗生成物は精製を行わず、次の反応に用いた。
上記の粗生成物をDMF(1.1mL)に溶解させ、HATU(170.0mg, 0.446mmol), HOAt(60.4mg, 0.446mmol), DIEA(77.9μL, 0.446mmol)を加えて30分撹拌後、アセトヒドラジド(33.1mg, 0.446mmol)を加えて14時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography(MeOH/CHCl3=5:95)にて精製し、アセトヒドラジド45を75.0mg(91%, 2 steps)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.33 (1H, s), 8.01 (1H, d, J = 12.5), 7.94 (1H, d, J = 12.0), 2.08 (3H, s).
・CDM-3050(46)の合成
アセトヒドラジド45(23.0mg, 0.057mmol)をアセトニトリル (2.0mL)に溶解させ、塩化ホスホリル(21.2μL, 0.228mmol)を滴下し6時間加熱還流を行った。蒸留水を加えて反応を止めた後、飽和炭酸水素ナトリウム水溶液を用いてpH8-9へと中和し、クロロホルムで三回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography(AcOEt/CHCl3=40:60)にて精製し、CDM-3050(46)を9.0mg(41%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.27 (1H, s), 8.15 (1H, s), 7.94-7.90 (2H, overlapped), 2.69 (1H, s); HR-ESI-MS calcd for C15H8F6N5O [M+H]+: 388.0633, found: 388.0634, calcd for C15H7F6N5NaO [M+Na]+: 410.0452, found: 410.0443.
アセトヒドラジド45(23.0mg, 0.057mmol)をアセトニトリル (2.0mL)に溶解させ、塩化ホスホリル(21.2μL, 0.228mmol)を滴下し6時間加熱還流を行った。蒸留水を加えて反応を止めた後、飽和炭酸水素ナトリウム水溶液を用いてpH8-9へと中和し、クロロホルムで三回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography(AcOEt/CHCl3=40:60)にて精製し、CDM-3050(46)を9.0mg(41%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.27 (1H, s), 8.15 (1H, s), 7.94-7.90 (2H, overlapped), 2.69 (1H, s); HR-ESI-MS calcd for C15H8F6N5O [M+H]+: 388.0633, found: 388.0634, calcd for C15H7F6N5NaO [M+Na]+: 410.0452, found: 410.0443.
・ヒドラジド47の合成
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 274.0mg, 0.727mmol)をエタノール(3.6mL)に溶解させ、抱水ヒドラジン(0.71mL, 14.5mmol)を加えて65℃で4時間撹拌した。析出した固体をろ取後、エタノールで洗浄し、ヒドラジド47を240.0mg(91%)得た。
エチル 2,4-ビス(トリフルオロメチル)イミダゾ[1,2-a][1,8]ナフチリジン-8-カルボキシレート(10, 274.0mg, 0.727mmol)をエタノール(3.6mL)に溶解させ、抱水ヒドラジン(0.71mL, 14.5mmol)を加えて65℃で4時間撹拌した。析出した固体をろ取後、エタノールで洗浄し、ヒドラジド47を240.0mg(91%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.16 (1H, s), 8.40 (1H, s), 8.12 (1H, s), 7.90 (1H, d, J = 9.0), 7.81 (1H, d, J = 9.5), 4.13 (1H, s), 3.50 (1H, s).
・ヒドラジド48の合成
ヒドラジド47(50.5mg, 0.139mmol)をジクロロメタン(1.4mL)およびピリジン(0.7mL)に溶解させ、氷冷下ブチリルクロリド(15.9μL, 0.153mmol)を滴下し室温に昇温後、12時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (MeOH/CHCl3=3:97)にて精製し、ヒドラジド48を40.0mg(66%)得た。
ヒドラジド47(50.5mg, 0.139mmol)をジクロロメタン(1.4mL)およびピリジン(0.7mL)に溶解させ、氷冷下ブチリルクロリド(15.9μL, 0.153mmol)を滴下し室温に昇温後、12時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (MeOH/CHCl3=3:97)にて精製し、ヒドラジド48を40.0mg(66%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.63 (1H, s), 9.17 (1H, s), 8.18 (1H, s), 8.13 (1H, s), 7.90 (1H, d, J = 11.5), 7.83 (1H, d, J = 9.5), 2.34 (2H, t, J = 7.0), 1.78 (2H, q, J = 7.5), 1.03 (3H, t, J = 7.5).
・CDM-3051(49)の合成
CDM-3050(46, Scheme 13)と同様にして、上記Scheme 13に記載の条件下で合成した。
CDM-3050(46, Scheme 13)と同様にして、上記Scheme 13に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.28 (1H, s), 8.16 (1H, s), 8.01 (1H, d, J = 9.0), 7.96 (1H, d, J = 8.5), 2.99 (2H, t, J = 7.5), 1.95 (2H, m), 1.09 (3H, t, J = 7.5); HR-ESI-MS calcd for C17H12F6N5O [M+H]+: 416.0946, found: 416.0947, calcd for C17H11F6N5NaO [M+Na]+: 438.0765, found: 438.0737.
・ヒドラジド50の合成
ヒドラジド48(Scheme 13)と同様にして、上記Scheme 13に記載の条件下で合成した。
ヒドラジド48(Scheme 13)と同様にして、上記Scheme 13に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.49 (1H, d, J = 5.0), 9.18 (1H, s), 8.91 (1H, d, J = 5.5), 8.13 (1H, s), 7.91 (1H, d, J = 11.0), 7.83 (1H, d, J = 9.5), 4.13 (2H, s), 3.52 (3H, s).
・CDM-3052(51)、CDM-3054(52)の合成
CDM-3050(46, Scheme 13)と同様にして、上記Scheme 13に記載の条件下で合成した。
CDM-3052(51):
1H NMR (500 MHz, CDCl3) δ ppm: 9.29 (1H, s), 8.15 (1H, s), 7.97 (1H, d, J = 9.5), 7.94 (1H, d, J = 10.0), 4.78 (2H, s), 3.53 (3H, s); HR-ESI-MS calcd for C16H9F6N5NaO2 [M+Na]+: 440.0558, found: 440.0523.
CDM-3054(52)
1H NMR (500 MHz, CDCl3) δ ppm: 9.31 (1H, s), 8.16 (1H, s), 8.00-7.92 (2H, overlapped), 4.83 (2H, s); HR-ESI-MS calcd for C15H6ClF6N5NaO [M+Na]+: 444.0063, found: 444.0050.
CDM-3050(46, Scheme 13)と同様にして、上記Scheme 13に記載の条件下で合成した。
CDM-3052(51):
1H NMR (500 MHz, CDCl3) δ ppm: 9.29 (1H, s), 8.15 (1H, s), 7.97 (1H, d, J = 9.5), 7.94 (1H, d, J = 10.0), 4.78 (2H, s), 3.53 (3H, s); HR-ESI-MS calcd for C16H9F6N5NaO2 [M+Na]+: 440.0558, found: 440.0523.
CDM-3054(52)
1H NMR (500 MHz, CDCl3) δ ppm: 9.31 (1H, s), 8.16 (1H, s), 8.00-7.92 (2H, overlapped), 4.83 (2H, s); HR-ESI-MS calcd for C15H6ClF6N5NaO [M+Na]+: 444.0063, found: 444.0050.
・ヒドラジド55の合成
ヒドラジド48(scheme 13)と同様にして、上記Scheme 14に記載の条件下で合成した。
ヒドラジド48(scheme 13)と同様にして、上記Scheme 14に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.49 (1H, m), 9.19 (1H, s), 8.95 (1H, m), 8.13 (1H, s), 7.91 (1H, d, J = 8.0), 7.83 (1H, d, J = 10.0), 7.38 (5H, overlapped), 4.68 (2H, s), 4.20 (2H, s).
・CDM-3055(56)の合成
CDM-3050(46, Scheme 13)と同様にして、上記Scheme 14に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.28 (1H, s), 8.16 (1H, s), 7.98 (1H, d, 10.0), 7.95 (1H, d, J = 10.0), 4.84 (2H, s), 4.72 (2H, s); HR-ESI-MS calcd for C22H13F6N5NaO2 [M+Na]+: 516.0871, found: 516.0865.
CDM-3050(46, Scheme 13)と同様にして、上記Scheme 14に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.28 (1H, s), 8.16 (1H, s), 7.98 (1H, d, 10.0), 7.95 (1H, d, J = 10.0), 4.84 (2H, s), 4.72 (2H, s); HR-ESI-MS calcd for C22H13F6N5NaO2 [M+Na]+: 516.0871, found: 516.0865.
・CDM-3056(57)の合成
CDM-3055(56, 6.3mg, 12.8μmol)をMeOH(0.8mL)、およびTHF(0.8mL)に溶解させ、パラジウム炭素(10%, 1.3mg)を加えて水素雰囲気下45度にて20時間撹拌した。セライトを用いて濾過後、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/hexane=50:50)にて精製し、CDM-3056(57)を0.8mg(15%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.30 (1H, s), 8.16 (1H, s), 8.00-7.90 (2H, overlapped), 5.02 (2H, s); HR-ESI-MS calcd for C15H8F6N5O2 [M+H]+: 404.0582, found: 404.0614.
CDM-3055(56, 6.3mg, 12.8μmol)をMeOH(0.8mL)、およびTHF(0.8mL)に溶解させ、パラジウム炭素(10%, 1.3mg)を加えて水素雰囲気下45度にて20時間撹拌した。セライトを用いて濾過後、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/hexane=50:50)にて精製し、CDM-3056(57)を0.8mg(15%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.30 (1H, s), 8.16 (1H, s), 8.00-7.90 (2H, overlapped), 5.02 (2H, s); HR-ESI-MS calcd for C15H8F6N5O2 [M+H]+: 404.0582, found: 404.0614.
・CDM-3057(58)の合成
CDM-3053(44, 2.6mg, 6.86μmol)を窒素雰囲気下トルエン(0.32mL)、およびメタノール(0.12mL)に溶解させ、氷冷下トリメチルシリルジアゾメタン(10% in hexane, 80.1μL, 0.048mmol)を加え、室温に昇温し5時間撹拌した。酢酸を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をHPLC(PEGASIL ODS SP100, φ20×250mm, eluent:CH3CN/H2O=50:50, 0.01%TFA)にて精製し、CDM-3057(58)を1.5 mg(56%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.97 (1H, s), 8.57 (1H, s), 7.86 (1H, d, J = 10.0), 7.73 (1H, d, J = 9.5), 7.46 (1H, s), 5.15 (2H, s), 3.87 (3H, s); HR-ESI-MS calcd for C16H11F3N5O4 [M+H]+: 394.0763, found: 394.0757.
CDM-3053(44, 2.6mg, 6.86μmol)を窒素雰囲気下トルエン(0.32mL)、およびメタノール(0.12mL)に溶解させ、氷冷下トリメチルシリルジアゾメタン(10% in hexane, 80.1μL, 0.048mmol)を加え、室温に昇温し5時間撹拌した。酢酸を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をHPLC(PEGASIL ODS SP100, φ20×250mm, eluent:CH3CN/H2O=50:50, 0.01%TFA)にて精製し、CDM-3057(58)を1.5 mg(56%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.97 (1H, s), 8.57 (1H, s), 7.86 (1H, d, J = 10.0), 7.73 (1H, d, J = 9.5), 7.46 (1H, s), 5.15 (2H, s), 3.87 (3H, s); HR-ESI-MS calcd for C16H11F3N5O4 [M+H]+: 394.0763, found: 394.0757.
・ヒドラジド59の合成
ヒドラジド47(37.3mg, 0.103mmol)をギ酸(1.1mL)に溶解させ、24時間撹拌した。蒸留水を加え、析出した固体をろ取し、ヒドラジド59を21.7mg(54%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.12 (1H, s), 8.33 (1H, s), 8.19 (1H, s), 8.03 (1H, d, J = 10.0), 7.95 (1H, d, J = 9.5).
ヒドラジド47(37.3mg, 0.103mmol)をギ酸(1.1mL)に溶解させ、24時間撹拌した。蒸留水を加え、析出した固体をろ取し、ヒドラジド59を21.7mg(54%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.12 (1H, s), 8.33 (1H, s), 8.19 (1H, s), 8.03 (1H, d, J = 10.0), 7.95 (1H, d, J = 9.5).
・CDM-3058(60)の合成
ヒドラジド59(21.7mg, 0.055mmol)をトルエン(2.0mL)に溶解させ、ローソン試薬(22.5mg, 0.055mmol)を加え1.5時間撹拌した。クロロホルムに希釈し、飽和炭酸水素ナトリウム水溶液で洗浄、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (MeOH/CHCl3=2:98)にて精製し、CDM-3058(60)を17.7mg(82%)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.67 (1H, s), 9.13 (1H, s), 8.48 (1H, s), 8.08 (1H, d, J = 10.0), 7.94 (1H, d, J = 10.5); HR-ESI-MS calcd for C14H6F6N5S [M+H]+: 390.0248, found: 390.0234.
ヒドラジド59(21.7mg, 0.055mmol)をトルエン(2.0mL)に溶解させ、ローソン試薬(22.5mg, 0.055mmol)を加え1.5時間撹拌した。クロロホルムに希釈し、飽和炭酸水素ナトリウム水溶液で洗浄、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (MeOH/CHCl3=2:98)にて精製し、CDM-3058(60)を17.7mg(82%)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.67 (1H, s), 9.13 (1H, s), 8.48 (1H, s), 8.08 (1H, d, J = 10.0), 7.94 (1H, d, J = 10.5); HR-ESI-MS calcd for C14H6F6N5S [M+H]+: 390.0248, found: 390.0234.
・三環性化合物62の合成
CDM-3010(3、Scheme 1)と同様にして、上記Scheme 17に記載の条件下で合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 8.74 (1H, s), 7.89 (1H, d, J = 9.5), 7.63 (1H, d, J = 9.5), 7.31 (1H, s), 4.31 (2H, q, J = 7.0), 1.31 (3H, t, J = 7.0).
CDM-3010(3、Scheme 1)と同様にして、上記Scheme 17に記載の条件下で合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 8.74 (1H, s), 7.89 (1H, d, J = 9.5), 7.63 (1H, d, J = 9.5), 7.31 (1H, s), 4.31 (2H, q, J = 7.0), 1.31 (3H, t, J = 7.0).
・CDM-3059(63)の合成
三環性化合物(62, 20.2mg, 0.062mmol)をエタノール(1.0mL)に溶解させ、抱水ヒドラジン(0.71mL, 14.5mmol)を加えて47時間過熱還流した。析出した固体をろ取後、エタノールで洗浄し、得られた固体をこのまま次の反応に用いた。
上記の固体をオルトギ酸トリメリル(2.0mL)に溶解させ、パラトルエンスルホン酸一水和物(7.7mg)を加えて80℃で15時間撹拌した。析出した固体をろ取後、CDM-3059(63)を4.7mg(24%)得た。
1H NMR (400 MHz, MeOD) δ ppm: 9.11 (1H, s), 9.10 (1H, s), 8.11 (1H, d, J = 12.5), 7.65 (1H, d, J = 11.5), 7.34 (1H, s); HR-ESI-MS calcd for C13H6F3N5O2 [M+H]+: 322.0552, found: 322.0521.
三環性化合物(62, 20.2mg, 0.062mmol)をエタノール(1.0mL)に溶解させ、抱水ヒドラジン(0.71mL, 14.5mmol)を加えて47時間過熱還流した。析出した固体をろ取後、エタノールで洗浄し、得られた固体をこのまま次の反応に用いた。
上記の固体をオルトギ酸トリメリル(2.0mL)に溶解させ、パラトルエンスルホン酸一水和物(7.7mg)を加えて80℃で15時間撹拌した。析出した固体をろ取後、CDM-3059(63)を4.7mg(24%)得た。
1H NMR (400 MHz, MeOD) δ ppm: 9.11 (1H, s), 9.10 (1H, s), 8.11 (1H, d, J = 12.5), 7.65 (1H, d, J = 11.5), 7.34 (1H, s); HR-ESI-MS calcd for C13H6F3N5O2 [M+H]+: 322.0552, found: 322.0521.
・光延反応生成物64の合成
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 17に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.19 (1H, s), 8.54 (1H, s), 7.97 (1H, d, J = 10.0), 7.70 (1H, d, J = 9.5), 7.37 (1H, s), 4.45 (2H, t, J = 4.5), 4.14 (2H, t, J = 4.5), 0.90 (9H, s), 0.11 (6H, s).
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 17に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 9.19 (1H, s), 8.54 (1H, s), 7.97 (1H, d, J = 10.0), 7.70 (1H, d, J = 9.5), 7.37 (1H, s), 4.45 (2H, t, J = 4.5), 4.14 (2H, t, J = 4.5), 0.90 (9H, s), 0.11 (6H, s).
・CDM-3064(65)の合成
CDM-3049(42、Scheme 12)と同様にして、上記Scheme 17に記載の条件下で合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.41 (1H, s), 9.01 (1H, s), 8.10 (1H, d, J = 9.5), 7.85 (1H, d, J = 10.0), 7.76 (1H, s), 4.49 (2H, t, J = 4.5), 3.88 (2H, s); HR-ESI-MS calcd for C15H10F3N5O3 [M+H]+: 366.0814, found: 366.0709.
CDM-3049(42、Scheme 12)と同様にして、上記Scheme 17に記載の条件下で合成した。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.41 (1H, s), 9.01 (1H, s), 8.10 (1H, d, J = 9.5), 7.85 (1H, d, J = 10.0), 7.76 (1H, s), 4.49 (2H, t, J = 4.5), 3.88 (2H, s); HR-ESI-MS calcd for C15H10F3N5O3 [M+H]+: 366.0814, found: 366.0709.
・CDM-3060(67)、CDM-3065(68)、CDM-3066(69)、CDM-3068(70)、CDM-3069(71)、CDM-3071(72)、CDM-3072(73)、CDM-3073(74)、CDM-3078(75)、CDM-3079(76)の合成
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 18に記載の条件下で合成した。
CDM-3060(67);1H NMR (500 MHz, CDCl3) δ ppm: 9.09 (1H, s), 8.56 (1H, s), 7.82 (1H, d, J = 10.0), 7.67 (1H, d, J = 10.0), 7.32 (1H, s), 4.76 (2H, t, J = 7.0), 3.01 (2H, t, J = 7.0), 2.25 (3H, s); HR-ESI-MS calcd for C16H12F3N5O2S [M+H]+: 396.0742, found: 396.0632.
CDM-3065(68);1H NMR (500 MHz, CDCl3) δ ppm: 9.15 (1H, s), 8.60 (1H, s), 7.91 (1H, d, J = 9.5), 7.83 (1H, d, J = 10.0), 7.37 (1H, s), 4.75 (2H, q, J = 6.5), 3.03 (2H, t, J = 6.5), 2.68 (2H, t, J = 7.5), 1.65 (2H, quin, J = 7.5), 1.46 (2H, sext, J = 7.5), 0.95 (3H, t, J = 7.5),; HR-ESI-MS calcd for C19H18F3N5O2S [M+H]+: 438.1212, found: 438.1208.
CDM-3066(69);1H NMR (500 MHz, CDCl3) δ ppm: 9.09 (1H, s), 8.56 (1H, s), 7.83 (1H, d, J = 9.5), 7.68 (1H, d, J = 10.0), 7.32 (1H, s), 4.73 (2H, t, J = 7.0), 3.01 (2H, t, J = 7.0), 2.56 (2H, d, J = 6.5), 1.88 (1H, m) 1.04 (6H, d, J = 6.0); HR-ESI-MS calcd for C19H18F3N5O2S [M+H]+: 438.1212, found: 438.1207.
CDM-3068(70);1H NMR (500 MHz, CDCl3) δ ppm: 9.16 (1H, s), 8.60 (1H, s), 7.90 (1H, d, J = 9.5), 7.80 (1H, d, J = 10.0), 7.33 (1H, s), 4.59 (2H, t, J = 6.5), 1.90 (2H, quin, J = 7.0), 1.56 (2H, sext, J = 7.5), 1.04 (3H, t, J = 7.5); HR-ESI-MS calcd for C17H14F3N5O2 [M+H]+: 378.1178, found: 378.1146.
CDM-3069(71);1H NMR (500 MHz, CDCl3) δ ppm: 9.15 (1H, s), 8.59 (1H, s), 7.89 (1H, d, J = 9.5), 7.79 (1H, d, J = 10.0), 7.42 (1H, s), 4.76 (2H, t, J = 4.5), 3.88 (2H, t, J = 4.5), 3.49 (3H, s); HR-ESI-MS calcd for C16H12F3N5O3 [M+H]+: 380.0970, found: 380.0970.
CDM-3071(72);1H NMR (500 MHz, CDCl3) δ ppm: 9.10 (1H, s), 8.57 (1H, s), 7.84 (1H, d, J = 10.0), 7.70 (1H, d, J = 9.5), 7.33 (1H, s), 4.75 (2H, t, J = 6.5), 3.04 (2H, t, J = 7.0), 2.71 (2H, q, J = 7.5), 1.35 (3H, t, J = 7.5); HR-ESI-MS calcd for C17H14F3N5O2S [M+H]+: 410.0899, found: 410.0761.
CDM-3072(73);1H NMR (500 MHz, CDCl3) δ ppm: 9.22 (1H, s), 8.65 (1H, s), 7.97 (1H, d, J = 10.0), 7.89 (1H, d, J = 9.5), 7.39 (1H, s), 4.37 (2H, d, J = 7.0), 2.20 (1H, m), 1.12 (6H, d J = 6.0); HR-ESI-MS calcd for C17H14F3N5O2 [M+H]+: 378.1178, found: 378.1037.
CDM-3073(74);1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.56 (1H, s), 7.82 (1H, d, J = 10.0), 7.67 (1H, d, J = 10.0), 7.29 (1H, s), 4.61 (2H, t, J = 6.5), 1.88 (1H, m, J = 7.0), 1.79 (2H, q, J = 6.5), 1.03 (6H, d, J = 6.5); HR-ESI-MS calcd for C18H16F3N5O2 [M+H]+: 392.1334, found: 392.1207.
CDM-3078(75);1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.56 (1H, s), 7.82 (1H, d, J = 8.5), 7.66 (1H, d, J = 9.5), 7.30 (1H, s), 4.53 (2H, t, J = 6.5), 1.94 (2H, sext, J = 7.0), 1.12 (3H, t, J = 7.5); HR-ESI-MS calcd for C16H12F3N5O2 [M+H]+: 364.1021, found: 364.0936.
CDM-3079(76);1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.56 (1H, s), 7.82 (1H, d, J = 11.5), 7.67 (1H, d, J = 10.0), 7.29 (1H, s), 4.57 (2H, t, J = 6.5), 1.91 (2H, q, J = 7.0), 1.54-1.41 (4H, overlapped), 0.97 (3H, t, J = 7.5); HR-ESI-MS calcd for C18H16F3N5O2 [M+H]+: 392.1334, found: 392.1249.
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 18に記載の条件下で合成した。
CDM-3060(67);1H NMR (500 MHz, CDCl3) δ ppm: 9.09 (1H, s), 8.56 (1H, s), 7.82 (1H, d, J = 10.0), 7.67 (1H, d, J = 10.0), 7.32 (1H, s), 4.76 (2H, t, J = 7.0), 3.01 (2H, t, J = 7.0), 2.25 (3H, s); HR-ESI-MS calcd for C16H12F3N5O2S [M+H]+: 396.0742, found: 396.0632.
CDM-3065(68);1H NMR (500 MHz, CDCl3) δ ppm: 9.15 (1H, s), 8.60 (1H, s), 7.91 (1H, d, J = 9.5), 7.83 (1H, d, J = 10.0), 7.37 (1H, s), 4.75 (2H, q, J = 6.5), 3.03 (2H, t, J = 6.5), 2.68 (2H, t, J = 7.5), 1.65 (2H, quin, J = 7.5), 1.46 (2H, sext, J = 7.5), 0.95 (3H, t, J = 7.5),; HR-ESI-MS calcd for C19H18F3N5O2S [M+H]+: 438.1212, found: 438.1208.
CDM-3066(69);1H NMR (500 MHz, CDCl3) δ ppm: 9.09 (1H, s), 8.56 (1H, s), 7.83 (1H, d, J = 9.5), 7.68 (1H, d, J = 10.0), 7.32 (1H, s), 4.73 (2H, t, J = 7.0), 3.01 (2H, t, J = 7.0), 2.56 (2H, d, J = 6.5), 1.88 (1H, m) 1.04 (6H, d, J = 6.0); HR-ESI-MS calcd for C19H18F3N5O2S [M+H]+: 438.1212, found: 438.1207.
CDM-3068(70);1H NMR (500 MHz, CDCl3) δ ppm: 9.16 (1H, s), 8.60 (1H, s), 7.90 (1H, d, J = 9.5), 7.80 (1H, d, J = 10.0), 7.33 (1H, s), 4.59 (2H, t, J = 6.5), 1.90 (2H, quin, J = 7.0), 1.56 (2H, sext, J = 7.5), 1.04 (3H, t, J = 7.5); HR-ESI-MS calcd for C17H14F3N5O2 [M+H]+: 378.1178, found: 378.1146.
CDM-3069(71);1H NMR (500 MHz, CDCl3) δ ppm: 9.15 (1H, s), 8.59 (1H, s), 7.89 (1H, d, J = 9.5), 7.79 (1H, d, J = 10.0), 7.42 (1H, s), 4.76 (2H, t, J = 4.5), 3.88 (2H, t, J = 4.5), 3.49 (3H, s); HR-ESI-MS calcd for C16H12F3N5O3 [M+H]+: 380.0970, found: 380.0970.
CDM-3071(72);1H NMR (500 MHz, CDCl3) δ ppm: 9.10 (1H, s), 8.57 (1H, s), 7.84 (1H, d, J = 10.0), 7.70 (1H, d, J = 9.5), 7.33 (1H, s), 4.75 (2H, t, J = 6.5), 3.04 (2H, t, J = 7.0), 2.71 (2H, q, J = 7.5), 1.35 (3H, t, J = 7.5); HR-ESI-MS calcd for C17H14F3N5O2S [M+H]+: 410.0899, found: 410.0761.
CDM-3072(73);1H NMR (500 MHz, CDCl3) δ ppm: 9.22 (1H, s), 8.65 (1H, s), 7.97 (1H, d, J = 10.0), 7.89 (1H, d, J = 9.5), 7.39 (1H, s), 4.37 (2H, d, J = 7.0), 2.20 (1H, m), 1.12 (6H, d J = 6.0); HR-ESI-MS calcd for C17H14F3N5O2 [M+H]+: 378.1178, found: 378.1037.
CDM-3073(74);1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.56 (1H, s), 7.82 (1H, d, J = 10.0), 7.67 (1H, d, J = 10.0), 7.29 (1H, s), 4.61 (2H, t, J = 6.5), 1.88 (1H, m, J = 7.0), 1.79 (2H, q, J = 6.5), 1.03 (6H, d, J = 6.5); HR-ESI-MS calcd for C18H16F3N5O2 [M+H]+: 392.1334, found: 392.1207.
CDM-3078(75);1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.56 (1H, s), 7.82 (1H, d, J = 8.5), 7.66 (1H, d, J = 9.5), 7.30 (1H, s), 4.53 (2H, t, J = 6.5), 1.94 (2H, sext, J = 7.0), 1.12 (3H, t, J = 7.5); HR-ESI-MS calcd for C16H12F3N5O2 [M+H]+: 364.1021, found: 364.0936.
CDM-3079(76);1H NMR (500 MHz, CDCl3) δ ppm: 9.11 (1H, s), 8.56 (1H, s), 7.82 (1H, d, J = 11.5), 7.67 (1H, d, J = 10.0), 7.29 (1H, s), 4.57 (2H, t, J = 6.5), 1.91 (2H, q, J = 7.0), 1.54-1.41 (4H, overlapped), 0.97 (3H, t, J = 7.5); HR-ESI-MS calcd for C18H16F3N5O2 [M+H]+: 392.1334, found: 392.1249.
・CDM-3061(77)、CDM-3062(78)の合成
CDM-3060(67, 11.0mg, 0.028mmol)をジクロロメタン(0.6mL)に溶解させ、氷冷下メタクロロ安息香酸(6.4mg, 2.8μmol)を加えて30分撹拌した。クロロホルムで希釈後、飽和チオ硫酸ナトリウム水溶液で洗浄、飽和炭酸水素ナトリウム水溶液で洗浄、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (MeOH/CHCl3=5:95)にて精製し、CDM-3061(77)を1.2mg(10%)、CDM-3062(78)を1.2mg(10%)得た。
CDM-3061(77);1H NMR (500 MHz, DMSO-d6) δ ppm: 9.43 (1H, s), 9.33 (1H, s), 7.85 (1H, d, J = 10.5), 7.82 (1H, d, J = 9.5), 7.67 (1H, s), 5.04 (2H, t, J = 6.0), 3.78 (2H, t, J = 6.0), 3.13 (3H, s); HR-ESI-MS calcd for C16H12F3N5O3S [M+H]+: 412.0691, found: 412.0691.
CDM-3062(78);1H NMR (500 MHz, DMSO-d6) δ ppm: 9.42 (1H, s), 9.323 (1H, s), 7.82 (1H, d, J = 9.5), 7.79 (1H, d, J = 10.0), 7.60 (1H, s), 5.10-5.06 (1H, m), 5.01-4.96 (1H, m), 3.46-3.41 (1H, m), 3.23-3.18 (1H, m), 2.67 (3H, s); HR-ESI-MS calcd for C16H12F3N5O4S [M+H]+: 428.0640, found: 428.0495.
CDM-3060(67, 11.0mg, 0.028mmol)をジクロロメタン(0.6mL)に溶解させ、氷冷下メタクロロ安息香酸(6.4mg, 2.8μmol)を加えて30分撹拌した。クロロホルムで希釈後、飽和チオ硫酸ナトリウム水溶液で洗浄、飽和炭酸水素ナトリウム水溶液で洗浄、brine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (MeOH/CHCl3=5:95)にて精製し、CDM-3061(77)を1.2mg(10%)、CDM-3062(78)を1.2mg(10%)得た。
CDM-3061(77);1H NMR (500 MHz, DMSO-d6) δ ppm: 9.43 (1H, s), 9.33 (1H, s), 7.85 (1H, d, J = 10.5), 7.82 (1H, d, J = 9.5), 7.67 (1H, s), 5.04 (2H, t, J = 6.0), 3.78 (2H, t, J = 6.0), 3.13 (3H, s); HR-ESI-MS calcd for C16H12F3N5O3S [M+H]+: 412.0691, found: 412.0691.
CDM-3062(78);1H NMR (500 MHz, DMSO-d6) δ ppm: 9.42 (1H, s), 9.323 (1H, s), 7.82 (1H, d, J = 9.5), 7.79 (1H, d, J = 10.0), 7.60 (1H, s), 5.10-5.06 (1H, m), 5.01-4.96 (1H, m), 3.46-3.41 (1H, m), 3.23-3.18 (1H, m), 2.67 (3H, s); HR-ESI-MS calcd for C16H12F3N5O4S [M+H]+: 428.0640, found: 428.0495.
・CDM-3063(79)の合成
CDM-3053(44, 9.9mg, 0.026mmol)をDMF(0.1mL)に溶解させ、HATU(19.8mg, 0.052mmol), HOAt(7.1mg, 0.052mmol), DIEA(18.2μL, 0.104mmol)を加えて30分撹拌後、塩化アンモニウム(2.8mg, 0.052mmol)を加えて15時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、CDM-3063(79)を3.3mg (34%)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.40 (1H, s), 9.14 (1H, s), 7.81 (1H, d, J = 10.0), 7.72 (1H, d, J = 9.5), 7.65 (1H, s), 7.38 (2H, s), 5.03 (2H, s); HR-ESI-MS calcd for C15H9F3N6O3 [M+H]+: 379.0766, found: 379.0663.
CDM-3053(44, 9.9mg, 0.026mmol)をDMF(0.1mL)に溶解させ、HATU(19.8mg, 0.052mmol), HOAt(7.1mg, 0.052mmol), DIEA(18.2μL, 0.104mmol)を加えて30分撹拌後、塩化アンモニウム(2.8mg, 0.052mmol)を加えて15時間撹拌した。蒸留水を加えて反応を停止させ、酢酸エチルで二回抽出、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=5:95)にて精製し、CDM-3063(79)を3.3mg (34%)得た。
1H NMR (500 MHz, DMSO-d6) δ ppm: 9.40 (1H, s), 9.14 (1H, s), 7.81 (1H, d, J = 10.0), 7.72 (1H, d, J = 9.5), 7.65 (1H, s), 7.38 (2H, s), 5.03 (2H, s); HR-ESI-MS calcd for C15H9F3N6O3 [M+H]+: 379.0766, found: 379.0663.
・光延反応生成物81の合成
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 21に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.96 (1H, s), 8.56 (1H, s), 7.80 (1H, d, J = 9.5), 7.70 (1H, d, J = 9.5), 7.46 (6H, d, J = 9.0), 7.29-7.177 (9H, overlapped), 4.30 (2H, t, J = 6.5), 2.78 (1H, t, J = 6.5).
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 21に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.96 (1H, s), 8.56 (1H, s), 7.80 (1H, d, J = 9.5), 7.70 (1H, d, J = 9.5), 7.46 (6H, d, J = 9.0), 7.29-7.177 (9H, overlapped), 4.30 (2H, t, J = 6.5), 2.78 (1H, t, J = 6.5).
・CDM-3067(82)の合成
化合物81 (20.0mg, 0.032mmol)をジクロロメタン(1.0mL)に溶解させ、氷冷下トリフルオロ酢酸(4.9μL, 0.064mmol)、トリイソプロピルシラン(26.4μL, 0.128mmol)を加えて室温に昇温し、26時間撹拌した。反応液を減圧留去し、得られた残渣をSiO2 flash column chromatography (AcOEt/n-Hexane=5:95)にて精製し、CDM-3067(82)を8.0mg (65%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.10 (1H, s), 8.57 (1H, s), 7.84 (1H, d, J = 9.5), 7.70 (1H, d, J = 10.0), 7.35 (1H, s), 4.73 (2H, t, J = 7.0), 3.04 (2H, dt, J = 8.5, 7.0), 1.70 (1H, t, J = 8.5); HR-ESI-MS calcd for C15H10F3N5O2S [M+H]+: 382.0586, found: 382.0579.
化合物81 (20.0mg, 0.032mmol)をジクロロメタン(1.0mL)に溶解させ、氷冷下トリフルオロ酢酸(4.9μL, 0.064mmol)、トリイソプロピルシラン(26.4μL, 0.128mmol)を加えて室温に昇温し、26時間撹拌した。反応液を減圧留去し、得られた残渣をSiO2 flash column chromatography (AcOEt/n-Hexane=5:95)にて精製し、CDM-3067(82)を8.0mg (65%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 9.10 (1H, s), 8.57 (1H, s), 7.84 (1H, d, J = 9.5), 7.70 (1H, d, J = 10.0), 7.35 (1H, s), 4.73 (2H, t, J = 7.0), 3.04 (2H, dt, J = 8.5, 7.0), 1.70 (1H, t, J = 8.5); HR-ESI-MS calcd for C15H10F3N5O2S [M+H]+: 382.0586, found: 382.0579.
・光延反応生成物83の合成
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 22に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.88 (1H, s), 7.73 (1H, d, J = 10.0), 7.60 (1H, d, J = 9.5), 4.71 (2H, t, J = 6.5), 4.48 (2H, q, J = 7.5), 2.98 (2H, q, J = 6.5), 2.24 (3H, s), 1.45 (2H, d, J = 7.0)
CDM-3016(7、Scheme 2)と同様にして、上記Scheme 22に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.88 (1H, s), 7.73 (1H, d, J = 10.0), 7.60 (1H, d, J = 9.5), 4.71 (2H, t, J = 6.5), 4.48 (2H, q, J = 7.5), 2.98 (2H, q, J = 6.5), 2.24 (3H, s), 1.45 (2H, d, J = 7.0)
・ピペリジン含有化合物84の合成
化合物25(Scheme 2)と同様にして、上記Scheme 22に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.89 (1H, s), 7.77 (1H, d, J = 10.0), 7.52 (1H, d, J = 10.5), 7.30-7.29 (2H, overlapped), 4.74 (2H, t, J = 7.0), 4.21-4.12 (3H, overlapped), 3.00-2.95 (4H, overlapped), 2.26 (3H, s), 2.05 (2H, d, J = 9.0), 1.51 (2H, d, J = 10.0), 1.48 (9H, s).
化合物25(Scheme 2)と同様にして、上記Scheme 22に記載の条件下で合成した。
1H NMR (500 MHz, CDCl3) δ ppm: 8.89 (1H, s), 7.77 (1H, d, J = 10.0), 7.52 (1H, d, J = 10.5), 7.30-7.29 (2H, overlapped), 4.74 (2H, t, J = 7.0), 4.21-4.12 (3H, overlapped), 3.00-2.95 (4H, overlapped), 2.26 (3H, s), 2.05 (2H, d, J = 9.0), 1.51 (2H, d, J = 10.0), 1.48 (9H, s).
・CDM-3070(85)の合成
CDM-3026(22, Scheme 7)と同様にして、上記Scheme 22に記載の条件下で合成した。
1H NMR (500 MHz, MeOD) δ ppm: 9.04 (1H, s), 8.00 (1H, d, J = 8.5), 7.70 (1H, d, J = 9.5), 7.51 (1H, s), 4.85 (2H, t, J = 7.0), 4.29 (1H, t, J = 10.5), 3.54 (2H, d, J = 13.5), 3.23 (2H, t, J = 10.0), 3.07 (2H, t, J = 7.0), 2.31-2.29 (7H, overlapped), 1.96 (2H, m); HR-ESI-MS calcd for C20H22F3N5O2S [M+H]+: 454.1525, found: 454.1513.
CDM-3026(22, Scheme 7)と同様にして、上記Scheme 22に記載の条件下で合成した。
1H NMR (500 MHz, MeOD) δ ppm: 9.04 (1H, s), 8.00 (1H, d, J = 8.5), 7.70 (1H, d, J = 9.5), 7.51 (1H, s), 4.85 (2H, t, J = 7.0), 4.29 (1H, t, J = 10.5), 3.54 (2H, d, J = 13.5), 3.23 (2H, t, J = 10.0), 3.07 (2H, t, J = 7.0), 2.31-2.29 (7H, overlapped), 1.96 (2H, m); HR-ESI-MS calcd for C20H22F3N5O2S [M+H]+: 454.1525, found: 454.1513.
・CDM-3074(86)、CDM-3075(87)の合成
CDM-3020(11, Scheme 3)と同様にして、上記Scheme 23に記載の条件下で合成した。
CDM-3074(86);1H NMR (500 MHz, DMSO-d6) δ ppm: 10.77 (1H, s), 9.10 (1H, s), 9.05 (1H, d, J = 2.5), 8.51 (1H, s), 8.32-8.30 (2H,overlapped), 8.07 (1H, d, J = 9.5), 7.96 (1H,dd、 J = 10.0, 2.0), 7.40 (1H,dd、 J = 8.5, 4.5); HR-ESI-MS calcd for C18H10F6N5O [M+H]+: 426.0790, found: 426.0775.
CDM-3075(87);1H NMR (500 MHz, DMSO-d6) δ ppm: 10.07 (1H, s), 9.20 (1H, s), 8.46 (1H, s), 8.37 (1H, d, J = 9.0), 8.23 (1H, d, J = 8.0), 8.08 (1H, d, J = 10.5), 7.96 (1H, d, J = 8.0), 7.86 (1H, t, J = 7.8), 7.17 (1H, dd, J = 6.5, 4.5); HR-ESI-MS calcd for C18H10F6N5O [M+H]+: 426.0790, found: 426.0807.
CDM-3020(11, Scheme 3)と同様にして、上記Scheme 23に記載の条件下で合成した。
CDM-3074(86);1H NMR (500 MHz, DMSO-d6) δ ppm: 10.77 (1H, s), 9.10 (1H, s), 9.05 (1H, d, J = 2.5), 8.51 (1H, s), 8.32-8.30 (2H,overlapped), 8.07 (1H, d, J = 9.5), 7.96 (1H,dd、 J = 10.0, 2.0), 7.40 (1H,dd、 J = 8.5, 4.5); HR-ESI-MS calcd for C18H10F6N5O [M+H]+: 426.0790, found: 426.0775.
CDM-3075(87);1H NMR (500 MHz, DMSO-d6) δ ppm: 10.07 (1H, s), 9.20 (1H, s), 8.46 (1H, s), 8.37 (1H, d, J = 9.0), 8.23 (1H, d, J = 8.0), 8.08 (1H, d, J = 10.5), 7.96 (1H, d, J = 8.0), 7.86 (1H, t, J = 7.8), 7.17 (1H, dd, J = 6.5, 4.5); HR-ESI-MS calcd for C18H10F6N5O [M+H]+: 426.0790, found: 426.0807.
・アルデヒド88の合成
化合物83(20.3mg, 0.051mmol)を窒素雰囲気下ジクロロメタン(0.5mL)に溶解させ、-78℃に冷却後、DIBAL-H(1.0M in hexane, 0.10mL, 0.10mmol)を滴下し3時間撹拌した。メタノール(0.5mL)、飽和ロッシェル塩水溶液(0.5mL)を加えて室温に昇温後5時間撹拌し、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=20:80)にて精製し、アルデヒド88を15.3mg (85%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 10.2 (1H, s), 8.92 (1H, s), 7.80 (2H, d, J = 10.0), 7.63 (2H, d, J = 10.0), 7.32 (1H, s), 4.74 (2H, t, J = 7.0), 3.00 (2H, t, J = 7.0), 2.26 (3H, s)
化合物83(20.3mg, 0.051mmol)を窒素雰囲気下ジクロロメタン(0.5mL)に溶解させ、-78℃に冷却後、DIBAL-H(1.0M in hexane, 0.10mL, 0.10mmol)を滴下し3時間撹拌した。メタノール(0.5mL)、飽和ロッシェル塩水溶液(0.5mL)を加えて室温に昇温後5時間撹拌し、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=20:80)にて精製し、アルデヒド88を15.3mg (85%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 10.2 (1H, s), 8.92 (1H, s), 7.80 (2H, d, J = 10.0), 7.63 (2H, d, J = 10.0), 7.32 (1H, s), 4.74 (2H, t, J = 7.0), 3.00 (2H, t, J = 7.0), 2.26 (3H, s)
・CDM-3077(89)の合成
化合物88(15.3mg, 0.043mmol)をメタノール(1.5mL)に溶解させ、炭酸カリウム(6.0mg, 0.043mmol)、パラトルエンスルホニルメチルイソシアニド(8.4mg, 0.043mmol)を加えて80℃で7時間加熱還流した。蒸留水を加えて反応を停止させ、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=40:60)にて精製し、CDM-3077(89)を12.0mg (83%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.57 (1H, s), 7.97 (1H, s), 7.76 (1H, d, J = 10.0), 7.63 (1H, s), 7.60 (1H, d, J = 10.0), 7.25 (1H, s), 4.20 (1H, s); HR-ESI-MS calcd for C15H9F3N4O2 [M+H]+: 335.0756, found: 335.0759.
化合物88(15.3mg, 0.043mmol)をメタノール(1.5mL)に溶解させ、炭酸カリウム(6.0mg, 0.043mmol)、パラトルエンスルホニルメチルイソシアニド(8.4mg, 0.043mmol)を加えて80℃で7時間加熱還流した。蒸留水を加えて反応を停止させ、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=40:60)にて精製し、CDM-3077(89)を12.0mg (83%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.57 (1H, s), 7.97 (1H, s), 7.76 (1H, d, J = 10.0), 7.63 (1H, s), 7.60 (1H, d, J = 10.0), 7.25 (1H, s), 4.20 (1H, s); HR-ESI-MS calcd for C15H9F3N4O2 [M+H]+: 335.0756, found: 335.0759.
・CDM-3080(90)の合成
化合物88(16.2mg, 0.046mmol)をジメチルホルムアミド(0.6mL)に溶解させ、炭酸カリウム(6.9mg, 0.051mmol)、パラトルエンスルホニルメチルイソシアニド(9.8mg, 0.051mmol)、2-メチルチオエタノール(39.6μL, 0.46mmol)を加えて80℃で10時間加熱還流した。蒸留水を加えて反応を停止させ、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=20:80)にて精製し、CDM-3080(90)を3.4mg (19%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.59 (1H, s), 8.05 (1H, s), 7.92 (2H, overlapped), 7.77 (1H, s), 7.36 (1H, s), 4.79 (2H, t, J = 7.0), 3.03 (2H, t, J = 7.0), 2.29 (3H, s); HR-ESI-MS calcd for C17H13F3N4O2S [M+H]+: 395.0790, found: 395.0697.
化合物88(16.2mg, 0.046mmol)をジメチルホルムアミド(0.6mL)に溶解させ、炭酸カリウム(6.9mg, 0.051mmol)、パラトルエンスルホニルメチルイソシアニド(9.8mg, 0.051mmol)、2-メチルチオエタノール(39.6μL, 0.46mmol)を加えて80℃で10時間加熱還流した。蒸留水を加えて反応を停止させ、反応液を分液ロートに移してクロロホルムで三回抽出し、有機層を合わせてbrine洗浄、Na2SO4で乾燥し、溶媒を減圧留去した。得られた残渣をSiO2 flash column chromatography (AcOEt/CHCl3=20:80)にて精製し、CDM-3080(90)を3.4mg (19%)得た。
1H NMR (500 MHz, CDCl3) δ ppm: 8.59 (1H, s), 8.05 (1H, s), 7.92 (2H, overlapped), 7.77 (1H, s), 7.36 (1H, s), 4.79 (2H, t, J = 7.0), 3.03 (2H, t, J = 7.0), 2.29 (3H, s); HR-ESI-MS calcd for C17H13F3N4O2S [M+H]+: 395.0790, found: 395.0697.
HCVレプリコン細胞を用いたインターフェロン様活性の測定
上記のようにして合成した化合物及び公知化合物を被験化合物として用い、各化合物のインターフェロン様活性を検討した。
HCVゲノムの一部をルシフェラーゼに置換し、この配列を恒常的に発現する細胞株であるHCVレプリコン細胞を1x104 cells/wellの密度で96ウェルプレートに撒き、37℃、5%CO2の条件でDMEM-GlutaMAX (Thermo Fisher Scientific Inc.社製)に10% 牛胎仔血清、100 U/ml Penicillin、 100μg/ml Streptomycin (Thermo Fisher Scientific Inc.社製)、 500μg/ml G418(Wako社製)を含む培養液を用いて培養し、1日後に被検化合物(30μM)を加え3日間培養した。その後、培養液を新しい75μlの培養液へ交換し、さらに75μlの発光基質Steady-Glo Luciferase Assay System(プロメガ社)を加え振盪し、30分後に発光強度をプレートリーダーのEnSight(PerkinElmer)を用いて定量してインターフェロン様活性を決定した。また、同様に処理した細胞を用いて細胞生存率(細胞増殖抑制率)を細胞増殖キットII(XTTアッセイ:ロシュ・ダイアグノスティクス(株))を用いてミトコンドリア活性を発色に変換し、30分後に490nmの吸光度をプレートリーダーのEnSight (PerkinElmer)を用いて定量して決定した。
HCVレプリコン細胞を被検化合物で処理した際の発光強度と細胞増殖抑制率を表1、表2及び表3に示した。なお、表1、表2及び表3の各化合物の構造式中、Meはメチル基、Etはエチル基、Bnはベンジル基を示す。また、表1の化合物は上記A群化合物であり、表2及び表3の化合物は上記B群化合物である。ただし、化合物コード3059及び3064の化合物は表1及び表3の両方に記載しているところ、これら2つの化合物は上記A群化合物である。
コントロールとしてDMSOのみで処理した細胞の発光強度と細胞増殖抑制率を100%とした。例えば、CDM-3008処理によりほとんど細胞増殖抑制率は低下しないが、インターフェロン様活性は92.1%であった。一方、CDM-3003、CDM-3007、及びCDM-3012のインターフェロン様活性は、それぞれ55.2%(31.3%)、62.4%(9.8%)、41.5%(22.9%)であった(表1)。なお、括弧内は増殖抑制率を示す。また、CDM-3020、CDM-3023、CDM-3026、CDM-3030、CDM-3032A、CDM-3050、CDM-3050のインターフェロン様活性は、それぞれ32.8%(-2.3%)、13.2%(6.3%)、28.1%(5.7%)、90.7%(58.6%)、89.8%(4.3%)、38.5%(82.5%)であった(表2)。なお、括弧内は増殖抑制率を示す。
これらの結果は、当該被験化合物群がインターフェロン様活性を有していることを示し、よって抗HBV活性を有する化合物であることを示している。
上記のようにして合成した化合物及び公知化合物を被験化合物として用い、各化合物のインターフェロン様活性を検討した。
HCVゲノムの一部をルシフェラーゼに置換し、この配列を恒常的に発現する細胞株であるHCVレプリコン細胞を1x104 cells/wellの密度で96ウェルプレートに撒き、37℃、5%CO2の条件でDMEM-GlutaMAX (Thermo Fisher Scientific Inc.社製)に10% 牛胎仔血清、100 U/ml Penicillin、 100μg/ml Streptomycin (Thermo Fisher Scientific Inc.社製)、 500μg/ml G418(Wako社製)を含む培養液を用いて培養し、1日後に被検化合物(30μM)を加え3日間培養した。その後、培養液を新しい75μlの培養液へ交換し、さらに75μlの発光基質Steady-Glo Luciferase Assay System(プロメガ社)を加え振盪し、30分後に発光強度をプレートリーダーのEnSight(PerkinElmer)を用いて定量してインターフェロン様活性を決定した。また、同様に処理した細胞を用いて細胞生存率(細胞増殖抑制率)を細胞増殖キットII(XTTアッセイ:ロシュ・ダイアグノスティクス(株))を用いてミトコンドリア活性を発色に変換し、30分後に490nmの吸光度をプレートリーダーのEnSight (PerkinElmer)を用いて定量して決定した。
HCVレプリコン細胞を被検化合物で処理した際の発光強度と細胞増殖抑制率を表1、表2及び表3に示した。なお、表1、表2及び表3の各化合物の構造式中、Meはメチル基、Etはエチル基、Bnはベンジル基を示す。また、表1の化合物は上記A群化合物であり、表2及び表3の化合物は上記B群化合物である。ただし、化合物コード3059及び3064の化合物は表1及び表3の両方に記載しているところ、これら2つの化合物は上記A群化合物である。
コントロールとしてDMSOのみで処理した細胞の発光強度と細胞増殖抑制率を100%とした。例えば、CDM-3008処理によりほとんど細胞増殖抑制率は低下しないが、インターフェロン様活性は92.1%であった。一方、CDM-3003、CDM-3007、及びCDM-3012のインターフェロン様活性は、それぞれ55.2%(31.3%)、62.4%(9.8%)、41.5%(22.9%)であった(表1)。なお、括弧内は増殖抑制率を示す。また、CDM-3020、CDM-3023、CDM-3026、CDM-3030、CDM-3032A、CDM-3050、CDM-3050のインターフェロン様活性は、それぞれ32.8%(-2.3%)、13.2%(6.3%)、28.1%(5.7%)、90.7%(58.6%)、89.8%(4.3%)、38.5%(82.5%)であった(表2)。なお、括弧内は増殖抑制率を示す。
これらの結果は、当該被験化合物群がインターフェロン様活性を有していることを示し、よって抗HBV活性を有する化合物であることを示している。
なお、上記スキーム又は下記表に示す化合物のうち、公知であるものの一部について、それらの化合物が記載されている公知文献及び/又は購入先(販社)を以下に示す。
・CDM-3001: 1) Journal of Heterocyclic Chemistry, 1997, 34(3), 765-771.
2) WO2013/059559
購入先: Aldrich, 193606-69-8
・CDM-3002: 購入先: Aldrich, 957756-49-9
・CDM-3003: 1) Journal of Heterocyclic Chemistry, 1992, 29(2), 283-287.
2) Heterocycles, 1996, 43(6), 1229-1241.
3) Journal of Heterocyclic Chemistry, 1997, 34(3), 765-771.
購入先: Aldrich, 142271-98-5
・CDM-3005: 1) WO2013/059559
2) ACS Medicinal Chemistry Letters, 2015, 6(9), 977-981.
購入先: APOLLO, 439094-96-9
・CDM-3006: WO2013/059559
購入先: Bionet research (Key Organics Ltd.), 691868-81-2
・CDM-3007: 購入先: specs, 193606-84-7
・CDM-3009: ACS Medicinal Chemistry Letters (2015), 6(9), 977-981.
購入先: Bionet research (Key Organics Ltd.), 691868-84-5
・CDM-3011: 購入先: Bionet research (Key Organics Ltd.), 691868-91-4
・CDM-3012: 購入先: Bionet research (Key Organics Ltd.), 439093-80-8
・CDM-3013: WO2013/059559
・CDM-3014: WO2013/059559
・CDM-3015: WO2013/059559
・CDM-3018: WO2013/059559
・CDM-3019: WO2013/059559
・CDM-3031: WO2013/059559
・CDM-3050: ACS Medicinal Chemistry Letters, 2015, 6(9), 977-981.
・CDM-3001: 1) Journal of Heterocyclic Chemistry, 1997, 34(3), 765-771.
2) WO2013/059559
購入先: Aldrich, 193606-69-8
・CDM-3002: 購入先: Aldrich, 957756-49-9
・CDM-3003: 1) Journal of Heterocyclic Chemistry, 1992, 29(2), 283-287.
2) Heterocycles, 1996, 43(6), 1229-1241.
3) Journal of Heterocyclic Chemistry, 1997, 34(3), 765-771.
購入先: Aldrich, 142271-98-5
・CDM-3005: 1) WO2013/059559
2) ACS Medicinal Chemistry Letters, 2015, 6(9), 977-981.
購入先: APOLLO, 439094-96-9
・CDM-3006: WO2013/059559
購入先: Bionet research (Key Organics Ltd.), 691868-81-2
・CDM-3007: 購入先: specs, 193606-84-7
・CDM-3009: ACS Medicinal Chemistry Letters (2015), 6(9), 977-981.
購入先: Bionet research (Key Organics Ltd.), 691868-84-5
・CDM-3011: 購入先: Bionet research (Key Organics Ltd.), 691868-91-4
・CDM-3012: 購入先: Bionet research (Key Organics Ltd.), 439093-80-8
・CDM-3013: WO2013/059559
・CDM-3014: WO2013/059559
・CDM-3015: WO2013/059559
・CDM-3018: WO2013/059559
・CDM-3019: WO2013/059559
・CDM-3031: WO2013/059559
・CDM-3050: ACS Medicinal Chemistry Letters, 2015, 6(9), 977-981.
HBV感染培養肝細胞における抗HBV活性の評価
PXBマウス由来新鮮ヒト肝細胞(PXB細胞;フェニックスバイオ社製)を0.7x105 cells/wellの密度でコラーゲンコートした96ウェルプレート(FALCON社製)に撒き、37℃、5%CO2の条件でdHCGM培地(自家製)を用いて7日培養した。遺伝子型CのHBV(フェニックスバイオ社製)を最終的に1x105 コピー数/穴となるように4% PEG8000と共に培養液に加え、そこに被検化合物を加えて1条件あたり3穴の細胞を1日培養した。培地を交換後、被検化合物を再度加え、その後も被検化合物を含んだ培地により3もしくは4日おきに交換し、14日後に、細胞の生存率を、細胞内ミトコンドリア活性をReal-time Glo MT Cell viability kit (Promega社製)を用いて化学発光シグナルに変換した後、発光強度をプレートリーダーのEnSight (PerkinElmer)を用いて定量して決定した。同時に、QIAamp DNA mini kit(Qiagen社製)を用いて細胞よりゲノムDNAとHBV由来のDNAを抽出・精製し、DNA溶液(2μL)とTaqMan Gene Expression Master Mix (Thermo Fisher Scientific Inc.社製) (5μL)、100μMプライマー(0.02μL) (HBV DNA Fr: ACTCACCAACCTCCTGTCCT(配列番号1), HBV DNA Rv: GACAAACGGGCAACATACCT (配列番号2)または cccDNA Fr: ACTCTTGGACTCBCAGCAATG(配列番号3), cccDNA Rv: CTTTATACGGGTCAATGTCCA(配列番号4))、100μMプローブ(0.01μL) (HBV DNA: [FAM]TATCGCTGGATGTGTCTGCGGCGT[TAM](配列番号5)またはcccDNA: [FAM]TTCAAGCCTCCAAGCTGTGCCTTGG[TAM](配列番号6))を混合し、qPCRの反応を60℃2分→95℃10分→(95℃10秒→60℃20秒)x70サイクルの条件で行い、LightCycler96(Roche社製)を用いてシグナルを検出してHBV DNA量(HBV遺伝子コピー数)とcccDNA量(HBV cccDNAコピー数)を定量した。
PXBマウス由来新鮮ヒト肝細胞(PXB細胞;フェニックスバイオ社製)を0.7x105 cells/wellの密度でコラーゲンコートした96ウェルプレート(FALCON社製)に撒き、37℃、5%CO2の条件でdHCGM培地(自家製)を用いて7日培養した。遺伝子型CのHBV(フェニックスバイオ社製)を最終的に1x105 コピー数/穴となるように4% PEG8000と共に培養液に加え、そこに被検化合物を加えて1条件あたり3穴の細胞を1日培養した。培地を交換後、被検化合物を再度加え、その後も被検化合物を含んだ培地により3もしくは4日おきに交換し、14日後に、細胞の生存率を、細胞内ミトコンドリア活性をReal-time Glo MT Cell viability kit (Promega社製)を用いて化学発光シグナルに変換した後、発光強度をプレートリーダーのEnSight (PerkinElmer)を用いて定量して決定した。同時に、QIAamp DNA mini kit(Qiagen社製)を用いて細胞よりゲノムDNAとHBV由来のDNAを抽出・精製し、DNA溶液(2μL)とTaqMan Gene Expression Master Mix (Thermo Fisher Scientific Inc.社製) (5μL)、100μMプライマー(0.02μL) (HBV DNA Fr: ACTCACCAACCTCCTGTCCT(配列番号1), HBV DNA Rv: GACAAACGGGCAACATACCT (配列番号2)または cccDNA Fr: ACTCTTGGACTCBCAGCAATG(配列番号3), cccDNA Rv: CTTTATACGGGTCAATGTCCA(配列番号4))、100μMプローブ(0.01μL) (HBV DNA: [FAM]TATCGCTGGATGTGTCTGCGGCGT[TAM](配列番号5)またはcccDNA: [FAM]TTCAAGCCTCCAAGCTGTGCCTTGG[TAM](配列番号6))を混合し、qPCRの反応を60℃2分→95℃10分→(95℃10秒→60℃20秒)x70サイクルの条件で行い、LightCycler96(Roche社製)を用いてシグナルを検出してHBV DNA量(HBV遺伝子コピー数)とcccDNA量(HBV cccDNAコピー数)を定量した。
CDM-3026、CDM-3030、及びCDM-3032Aの活性について検討した結果を図1に示した。グラフに細胞生存率とHBV遺伝子コピー数を、溶媒のみで処理したコントロール細胞の各インデックスの値を100としたときの%でプロットした。
CDM-3026で処理した細胞の生存率は98%から91%でわずかな毒性しか示さなかった。CDM-3030処理した細胞の生存率は95%から88%であった。また、CD-3032処理した細胞の生存率は103%から90%でわずかな細胞毒性しか示さなかった。
CDM-3026処理した細胞のHBV遺伝子コピー数は90%から76%まで減少し、抗HBV作用が認められたがIC50は算出できなかった。CDM-3030は、抗HBV活性を示し、濃度依存的にPXB細胞のHBV遺伝子コピー数を低下させ、終濃度0.1μMで処理した細胞のHBV遺伝子コピー数は、コントロール細胞の95%、終濃度1μMと10μMで処理した細胞のHBV遺伝子コピー数は、コントロール細胞のそれぞれ87%と53%になった。IC50は約10μMであった。CDM-3032Aは、抗HBV活性を示し、濃度依存的にPXB細胞のHBV遺伝子コピー数を低下させ、終濃度0.1μMで処理した細胞のHBV遺伝子コピー数は、コントロール細胞の76%、終濃度1μMと10μMで処理した細胞のHBV遺伝子コピー数は、コントロール細胞のそれぞれ72%と48%になった。IC50は8.4μMであった。
また、CDM-3020、CDM-3023の活性について検討した結果、CDM-3020(30μM)およびCDM-3023(3μM)はそれぞれPBX細胞のHBV遺伝子コピー数を30.0%、37.2%阻害し、またHBV cccDNAコピー数を63.0%、54.6%阻害した。
また、CDM-3060及びCDM-3068の活性について検討した結果を図2に示した。CDM-3060(30μM)及びCDM-3068(30μM)はPXB細胞のHBV遺伝子コピー数をそれぞれ約60%及び約88%抑制し、また、HBV cccDNAコピー数をそれぞれ約59%及び約97%抑制した(図2)。
なお、ペグインターフェロン アルファ-2a製剤(ペガシス、CHUGAI)のHBV遺伝子コピー数の50%抑制濃度、及びHBV cccDNAコピー数の50%抑制濃度は、それぞれ、7.0ng/ml、19.0ng/mlであった。
以上の結果は、本発明化合物群がHBV遺伝子コピー数の抑制、及びHBV cccDNAコピー数の抑制に基づく、抗HBV活性をも有することを示している。
マウス肝臓ミクロソーム及びヒト肝臓ミクロソームを用いたin vitro代謝試験
250μlの0.2mol/Lリン酸カリウム緩衝液(pH 7.4)、165μlの超純水,25μlの20mg/mlマウスまたはヒト肝臓ミクロソーム(Corning社製)及び10μlの2.9μmol/L CDM-3023、 29μmol/L CDM-3026、 又は29μmol/L CDM-3032Aを、この順で混和した。37℃で約5分間プレインキュベーションした後に、50μlのNADPH regenerating system (Corning社製)を添加し、37℃で振盪(設定値:約100回/分)させながら、0、30、60、及び120分間インキュベーションを行い、氷冷しておいたメタノール200μLに,反応後試料50μLを加えて攪拌し,反応を停止した。この反応後試料250μLにインターナルスタンダード250μLを加えて攪拌し、遠心(約10000×g、4℃、15分間)を行い、上清を別のチューブに移した。HPLCシステム(20Aシステム:島津社製)に分析カラム:Triart C18 plus(50×2.1mm、3μm、株式会社YMC製)を接続し、移動相A:0.1vol%ぎ酸と移動相B:メタノール/アセトニトリル(1:1,v/v)をもちいて流速0.3mL/minで、0分に移動相A(80%)移動相B(20%)から13分に移動相A(10%)移動相B(90%)のグラジエントをかけ溶出し、MS/MS(API4000:AB Sciex社製)で解析した。試料を分析し、ピーク面積を検量線に当てはめて定量値を算出した。データの算出は、表計算ソフトMicrosoft Excel 2007(SP3,Microsoft Corp. 製)とGraphPad Prism(ver. 5.0,GraphPad Corp. 製)を用いて行った。
その結果、CDM-3032Aはマウス肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は120分以上、ヒト肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は120分以上であった。また、CDM-3023はマウス肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は15.3分、ヒト肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は11.6分であった。CDM-3026はマウス肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は15.8分、ヒト肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は260分であった。なお、CDM-3008のマウス肝臓ミクロソーム及びヒト肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は、それぞれ58.2分、34.1分であった。
250μlの0.2mol/Lリン酸カリウム緩衝液(pH 7.4)、165μlの超純水,25μlの20mg/mlマウスまたはヒト肝臓ミクロソーム(Corning社製)及び10μlの2.9μmol/L CDM-3023、 29μmol/L CDM-3026、 又は29μmol/L CDM-3032Aを、この順で混和した。37℃で約5分間プレインキュベーションした後に、50μlのNADPH regenerating system (Corning社製)を添加し、37℃で振盪(設定値:約100回/分)させながら、0、30、60、及び120分間インキュベーションを行い、氷冷しておいたメタノール200μLに,反応後試料50μLを加えて攪拌し,反応を停止した。この反応後試料250μLにインターナルスタンダード250μLを加えて攪拌し、遠心(約10000×g、4℃、15分間)を行い、上清を別のチューブに移した。HPLCシステム(20Aシステム:島津社製)に分析カラム:Triart C18 plus(50×2.1mm、3μm、株式会社YMC製)を接続し、移動相A:0.1vol%ぎ酸と移動相B:メタノール/アセトニトリル(1:1,v/v)をもちいて流速0.3mL/minで、0分に移動相A(80%)移動相B(20%)から13分に移動相A(10%)移動相B(90%)のグラジエントをかけ溶出し、MS/MS(API4000:AB Sciex社製)で解析した。試料を分析し、ピーク面積を検量線に当てはめて定量値を算出した。データの算出は、表計算ソフトMicrosoft Excel 2007(SP3,Microsoft Corp. 製)とGraphPad Prism(ver. 5.0,GraphPad Corp. 製)を用いて行った。
その結果、CDM-3032Aはマウス肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は120分以上、ヒト肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は120分以上であった。また、CDM-3023はマウス肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は15.3分、ヒト肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は11.6分であった。CDM-3026はマウス肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は15.8分、ヒト肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は260分であった。なお、CDM-3008のマウス肝臓ミクロソーム及びヒト肝臓ミクロソームを用いた代謝実験における半減期(T1/2)は、それぞれ58.2分、34.1分であった。
抗B型肝炎ウイルス効果持続のためには、肝臓における半減期は長い方が有利であると考えられることから、特にヒトを対象とする場合には、これら4種の化合物の中では、CDM-3032A及びCDM-3026が特に有利であると考えられた。
Claims (6)
- 式(1):
R2は、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基、ホルミルアミノ基、ピリジル基、又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
以下の式(1-1):
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
R3は水素原子又は低級アルキル基を示す。
ここで、R1がヒドロキシル基である場合には、式(1)は、その互変異性体〔つまり、以下の式(1’)で示される化合物:式中、R2、R3、及びR4は式(1)におけるそれらと同じ〕をも含む。
で示される化合物、又はその薬学的に許容される塩を含む、
抗B型肝炎ウイルス剤。 - 式(1)で示される化合物が、式(I):
R2Aは、カルボキシル基、カルボキシルメチル基、カルボキシルエチル基、あるいは
ハロゲン原子、又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基で置換されていてもよいカルバモイル基、あるいは
以下の式(I-A1):
を示し、
R3Aは水素原子又は低級アルキル基を示す。
ここで、R1Aがヒドロキシル基である場合には、式(I)は、その互変異性体〔つまり、以下の式(I’)で示される化合物:式中R2A、R3A、及びR4Aは式(I)におけるそれらと同じ〕をも含む。
で示される化合物であるか、又は、式(II):
末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2Bは、カルボキシルメチル基、カルボキシルエチル基、あるいは
窒素原子に結合した水素原子がホルミルアミノ基、ピリジル基又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
式(II-B1):
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
ここで、R2Bと、R2Bの結合する炭素原子との間に-C≡C-基が含まれていてもよく、
但し、R1Bがトリフルオロメチル基又は塩素原子であり、R2BとR2Bの結合する炭素原子との間に-C≡C-基が含まれておらず、且つR2Bが式(II-B1)で示される基である場合、Xが窒素原子を示すときRb1は炭素数2~6のアルキル基であり、Xが炭素原子を示すときRb1は水素原子ではない。)
で示される化合物である、
請求項1に記載の抗B型肝炎ウイルス剤。 - 抗B型肝炎ウイルス核酸アナログ剤と、請求項1、2又は3に記載の化合物又はその薬学的に許容される塩とを含むか、あるいは、
抗B型肝炎ウイルス核酸アナログ剤を投与された若しくは投与される対象に、請求項1、2又は3に記載の化合物又はその薬学的に許容される塩を投与するように用いられる
抗B型肝炎ウイルス剤。 - 式(1):
ハロゲン原子又は低級アルコキシ基で置換されていてもよいフェニル基、あるいは
窒素原子に結合した水素原子がアミノ基、ピリジル基、又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
以下の式(1-1):
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
R3は水素原子又は低級アルキル基を示す。
但し、R1及びR4がともにトリフルオロメチル基であり、R3が水素原子であり、且つR2が式(1-1)で示される基であってAが酸素原子を示す場合は、Rz1は水素原子ではない。)
で示される化合物、又はその薬学的に許容される塩を含む、
インターフェロン疑似薬。 - 式(II):
末端炭素原子に結合した水素原子が、ヒドロキシル基、カルボキシル基、カルボキシルアルキル基、アルコキシ基、チオール基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、カルバモイル基、又はアミノ基で置換されていてもよい低級アルコキシ基を示し、
R2Bは、カルボキシルメチル基、カルボキシルエチル基、あるいは
窒素原子に結合した水素原子がピリジル基又はピペリジル基で置換されていてもよいカルバモイル基、あるいは、
式(II-B1):
末端炭素原子に結合した水素原子がN,N-ジアルキルアミノ基で置換された、炭素原子が窒素原子で置換されていてもよい低級アルキル基(当該低級アルキル基が窒素原子で置換されている場合には、当該窒素原子に結合した水素原子がベンジルオキシカルボニル基で置換されていてもよい)、
を示し、
ここで、R2Bと、R2Bの結合する炭素原子との間に-C≡C-基が含まれていてもよく、
但し、R1Bがトリフルオロメチル基又は塩素原子であり、R2BとR2Bの結合する炭素原子との間に-C≡C-基が含まれておらず、且つR2Bが式(II-B1)で示される基である場合、Xが窒素原子を示すときRb1は炭素数2~6のアルキル基であり、Xが炭素原子を示すときRb1は水素原子ではない。)
で示される化合物又はその薬学的に許容される塩。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016173023 | 2016-09-05 | ||
| JP2016-173023 | 2016-09-05 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2018043747A1 true WO2018043747A1 (ja) | 2018-03-08 |
Family
ID=61301268
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2017/031825 WO2018043747A1 (ja) | 2016-09-05 | 2017-09-04 | 抗b型肝炎ウイルス剤 |
Country Status (1)
| Country | Link |
|---|---|
| WO (1) | WO2018043747A1 (ja) |
Cited By (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019165374A1 (en) | 2018-02-26 | 2019-08-29 | Gilead Sciences, Inc. | Substituted pyrrolizine compounds as hbv replication inhibitors |
| WO2019195181A1 (en) | 2018-04-05 | 2019-10-10 | Gilead Sciences, Inc. | Antibodies and fragments thereof that bind hepatitis b virus protein x |
| WO2019193543A1 (en) | 2018-04-06 | 2019-10-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotides |
| WO2019193542A1 (en) | 2018-04-06 | 2019-10-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides |
| WO2019193533A1 (en) | 2018-04-06 | 2019-10-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'2'-cyclic dinucleotides |
| WO2019200247A1 (en) | 2018-04-12 | 2019-10-17 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the hepatitis b virus genome |
| WO2019211799A1 (en) | 2018-05-03 | 2019-11-07 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide |
| WO2020028097A1 (en) | 2018-08-01 | 2020-02-06 | Gilead Sciences, Inc. | Solid forms of (r)-11-(methoxymethyl)-12-(3-methoxypropoxy)-3,3-dimethyl-8-0x0-2,3,8,13b-tetrahydro-1h-pyrido[2,1-a]pyrrolo[1,2-c] phthalazine-7-c arboxylic acid |
| WO2020092528A1 (en) | 2018-10-31 | 2020-05-07 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds having hpk1 inhibitory activity |
| WO2020092621A1 (en) | 2018-10-31 | 2020-05-07 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds as hpk1 inhibitors |
| US10662416B2 (en) | 2016-10-14 | 2020-05-26 | Precision Biosciences, Inc. | Engineered meganucleases specific for recognition sequences in the hepatitis B virus genome |
| WO2020178768A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| WO2020178770A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotides and prodrugs thereof |
| WO2020178769A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides and prodrugs thereof |
| WO2020214652A1 (en) | 2019-04-17 | 2020-10-22 | Gilead Sciences, Inc. | Solid forms of a toll-like receptor modulator |
| WO2020214663A1 (en) | 2019-04-17 | 2020-10-22 | Gilead Sciences, Inc. | Solid forms of a toll-like receptor modulator |
| WO2020237025A1 (en) | 2019-05-23 | 2020-11-26 | Gilead Sciences, Inc. | Substituted exo-methylene-oxindoles which are hpk1/map4k1 inhibitors |
| WO2020263830A1 (en) | 2019-06-25 | 2020-12-30 | Gilead Sciences, Inc. | Flt3l-fc fusion proteins and methods of use |
| WO2021034804A1 (en) | 2019-08-19 | 2021-02-25 | Gilead Sciences, Inc. | Pharmaceutical formulations of tenofovir alafenamide |
| US10966999B2 (en) | 2017-12-20 | 2021-04-06 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3′3′ cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| WO2021067181A1 (en) | 2019-09-30 | 2021-04-08 | Gilead Sciences, Inc. | Hbv vaccines and methods treating hbv |
| WO2021113765A1 (en) | 2019-12-06 | 2021-06-10 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the hepatitis b virus genome |
| WO2021188959A1 (en) | 2020-03-20 | 2021-09-23 | Gilead Sciences, Inc. | Prodrugs of 4'-c-substituted-2-halo-2'-deoxyadenosine nucleosides and methods of making and using the same |
| US11203610B2 (en) | 2017-12-20 | 2021-12-21 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2′3′ cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| WO2022031894A1 (en) | 2020-08-07 | 2022-02-10 | Gilead Sciences, Inc. | Prodrugs of phosphonamide nucleotide analogues and their pharmaceutical use |
| WO2022087149A2 (en) | 2020-10-22 | 2022-04-28 | Gilead Sciences, Inc. | Interleukin-2-fc fusion proteins and methods of use |
| WO2022241134A1 (en) | 2021-05-13 | 2022-11-17 | Gilead Sciences, Inc. | COMBINATION OF A TLR8 MODULATING COMPOUND AND ANTI-HBV siRNA THERAPEUTICS |
| WO2022271659A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2022271684A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2022271650A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2022271677A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2023244672A1 (en) | 2022-06-14 | 2023-12-21 | Assembly Biosciences, Inc. | 2-(imidazo[1, 2-a]1,8-naphthyridin-8-yl)-1,3,4-oxadiazole derivatives as enhancers of innate immune response for the treatment of viral infections |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014532626A (ja) * | 2011-10-21 | 2014-12-08 | グラクソスミスクライン エルエルシー | 自然免疫応答を増強する化合物および方法 |
-
2017
- 2017-09-04 WO PCT/JP2017/031825 patent/WO2018043747A1/ja active Application Filing
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014532626A (ja) * | 2011-10-21 | 2014-12-08 | グラクソスミスクライン エルエルシー | 自然免疫応答を増強する化合物および方法 |
Non-Patent Citations (2)
| Title |
|---|
| HUAN,WANG ET AL.: "Discovery of Imidazol[1,2-a] [1,8]naphthyridine Derivatives as Potential HCV Entry Inhibitor.", ACS MEDICINAL CHEMISTRY LETTERS, vol. 6, no. 9, 2015, pages 977 - 981, XP055472205 * |
| KONISHI,HIDEYUKI ET AL.: "An orally available, small-molecule interferon inhibitis viral replication.", SCIENTIFIC REPORTS, vol. 2, 2012, XP055472204 * |
Cited By (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11274285B2 (en) | 2016-10-14 | 2022-03-15 | Precision Biosciences, Inc. | Engineered meganucleases specific for recognition sequences in the Hepatitis B virus genome |
| US10662416B2 (en) | 2016-10-14 | 2020-05-26 | Precision Biosciences, Inc. | Engineered meganucleases specific for recognition sequences in the hepatitis B virus genome |
| US11203610B2 (en) | 2017-12-20 | 2021-12-21 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2′3′ cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| US10966999B2 (en) | 2017-12-20 | 2021-04-06 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3′3′ cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| WO2019165374A1 (en) | 2018-02-26 | 2019-08-29 | Gilead Sciences, Inc. | Substituted pyrrolizine compounds as hbv replication inhibitors |
| WO2019195181A1 (en) | 2018-04-05 | 2019-10-10 | Gilead Sciences, Inc. | Antibodies and fragments thereof that bind hepatitis b virus protein x |
| WO2019193533A1 (en) | 2018-04-06 | 2019-10-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'2'-cyclic dinucleotides |
| US11292812B2 (en) | 2018-04-06 | 2022-04-05 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3′3′-cyclic dinucleotides |
| WO2019193542A1 (en) | 2018-04-06 | 2019-10-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides |
| WO2019193543A1 (en) | 2018-04-06 | 2019-10-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotides |
| US11149052B2 (en) | 2018-04-06 | 2021-10-19 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2′3′-cyclic dinucleotides |
| US11788077B2 (en) | 2018-04-12 | 2023-10-17 | Precision Biosciences, Inc. | Polynucleotides encoding optimized engineered meganucleases having specificity for a recognition sequence in the Hepatitis B virus genome |
| WO2019200247A1 (en) | 2018-04-12 | 2019-10-17 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the hepatitis b virus genome |
| US11142750B2 (en) | 2018-04-12 | 2021-10-12 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the Hepatitis B virus genome |
| WO2019211799A1 (en) | 2018-05-03 | 2019-11-07 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide |
| WO2020028097A1 (en) | 2018-08-01 | 2020-02-06 | Gilead Sciences, Inc. | Solid forms of (r)-11-(methoxymethyl)-12-(3-methoxypropoxy)-3,3-dimethyl-8-0x0-2,3,8,13b-tetrahydro-1h-pyrido[2,1-a]pyrrolo[1,2-c] phthalazine-7-c arboxylic acid |
| WO2020092621A1 (en) | 2018-10-31 | 2020-05-07 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds as hpk1 inhibitors |
| WO2020092528A1 (en) | 2018-10-31 | 2020-05-07 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds having hpk1 inhibitory activity |
| US11766447B2 (en) | 2019-03-07 | 2023-09-26 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3′3′-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| WO2020178769A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides and prodrugs thereof |
| WO2020178770A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotides and prodrugs thereof |
| WO2020178768A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| WO2020214663A1 (en) | 2019-04-17 | 2020-10-22 | Gilead Sciences, Inc. | Solid forms of a toll-like receptor modulator |
| WO2020214652A1 (en) | 2019-04-17 | 2020-10-22 | Gilead Sciences, Inc. | Solid forms of a toll-like receptor modulator |
| WO2020237025A1 (en) | 2019-05-23 | 2020-11-26 | Gilead Sciences, Inc. | Substituted exo-methylene-oxindoles which are hpk1/map4k1 inhibitors |
| WO2020263830A1 (en) | 2019-06-25 | 2020-12-30 | Gilead Sciences, Inc. | Flt3l-fc fusion proteins and methods of use |
| WO2021034804A1 (en) | 2019-08-19 | 2021-02-25 | Gilead Sciences, Inc. | Pharmaceutical formulations of tenofovir alafenamide |
| WO2021067181A1 (en) | 2019-09-30 | 2021-04-08 | Gilead Sciences, Inc. | Hbv vaccines and methods treating hbv |
| WO2021113765A1 (en) | 2019-12-06 | 2021-06-10 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the hepatitis b virus genome |
| WO2021188959A1 (en) | 2020-03-20 | 2021-09-23 | Gilead Sciences, Inc. | Prodrugs of 4'-c-substituted-2-halo-2'-deoxyadenosine nucleosides and methods of making and using the same |
| WO2022031894A1 (en) | 2020-08-07 | 2022-02-10 | Gilead Sciences, Inc. | Prodrugs of phosphonamide nucleotide analogues and their pharmaceutical use |
| WO2022087149A2 (en) | 2020-10-22 | 2022-04-28 | Gilead Sciences, Inc. | Interleukin-2-fc fusion proteins and methods of use |
| WO2022241134A1 (en) | 2021-05-13 | 2022-11-17 | Gilead Sciences, Inc. | COMBINATION OF A TLR8 MODULATING COMPOUND AND ANTI-HBV siRNA THERAPEUTICS |
| WO2022271659A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2022271684A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2022271650A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2022271677A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2023244672A1 (en) | 2022-06-14 | 2023-12-21 | Assembly Biosciences, Inc. | 2-(imidazo[1, 2-a]1,8-naphthyridin-8-yl)-1,3,4-oxadiazole derivatives as enhancers of innate immune response for the treatment of viral infections |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2018043747A1 (ja) | 抗b型肝炎ウイルス剤 | |
| US10717730B1 (en) | Dihydroisoquinoline compound | |
| JP6813665B2 (ja) | 4−ピリドン化合物またはその塩、それを含む医薬組成物および剤 | |
| US9156839B2 (en) | Fused bicyclic sulfamoyl derivatives and the use thereof as medicaments for the treatment of hepatitis B | |
| US9533990B2 (en) | Inhibitors of secretion of hepatitis B virus antigens | |
| US10301255B2 (en) | Hepatitis B antiviral agents | |
| US20170355701A1 (en) | Hepatitis b antiviral agents | |
| WO2003002518A1 (en) | Novel 2,4-difluorobenzamide derivatives as antiviral agents | |
| WO2002079187A1 (en) | Methoxy-1,3,5-triazine derivatives as antiviral agents | |
| JP5616063B2 (ja) | Hcv阻害剤として有用なカルボキシアミド4−[(4−ピリジル)アミノ]ピリミジン | |
| US20210276967A1 (en) | Inhibitors of hepatitis b virus | |
| US6608058B2 (en) | 6-methylnicotinamide derivatives as antiviral agents | |
| US11236108B2 (en) | Functionalized heterocycles as antiviral agents | |
| JP2021506852A (ja) | Hbv感染と関連する疾患を治療するためのイソキサゾール化合物 | |
| US9790225B2 (en) | 4-amino-3-phenylamino-6-phenylpyrazolo[3,4-d]pyrimidine derivatives, their manufacture and their use as antiviral active substances | |
| PT2376479E (pt) | Furancarboxamidas substituídas e respetivas utilizações | |
| WO2001038306A9 (en) | Novel 3-nitropyridine derivatives and the pharmaceutical compositions containing said derivatives | |
| US6743795B1 (en) | 3-nitropyridine derivaives and the pharmaceutical compositions containing said derivatives | |
| US11738019B2 (en) | Substituted heterocycles as antiviral agents | |
| RU2738848C1 (ru) | Ингибитор вируса гепатита В (ВГВ), представляющий собой производные N-{ 3-[6-(диалкиламино)пиридазин-3-ил]фенил} арилсульфонамида и производные N-{ 4-[6-(диалкиламино)пиридазин-3-ил]фенил} арилсульфонамида | |
| RU2726456C1 (ru) | Ингибитор вируса гепатита В (ВГВ) | |
| TWI654198B (zh) | Aryl substituted phosphonium derivatives and their application in medicine | |
| JP2022534961A (ja) | Hbvカプシド集合モジュレーターとしてのアゼピン | |
| US20230151027A1 (en) | Spirocyclic inhibitors of hepatitis b virus | |
| US6762189B1 (en) | 5-pyrimidinecarboxamide derivatives and the pharmaceutical compositions containing said derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 17846750 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| NENP | Non-entry into the national phase |
Ref country code: JP |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 17846750 Country of ref document: EP Kind code of ref document: A1 |