WO2017110317A1 - ニコチンアミドモノヌクレオチド誘導体、その塩、その製造方法、皮膚外用剤、化粧料、食品添加剤 - Google Patents
ニコチンアミドモノヌクレオチド誘導体、その塩、その製造方法、皮膚外用剤、化粧料、食品添加剤 Download PDFInfo
- Publication number
- WO2017110317A1 WO2017110317A1 PCT/JP2016/083942 JP2016083942W WO2017110317A1 WO 2017110317 A1 WO2017110317 A1 WO 2017110317A1 JP 2016083942 W JP2016083942 W JP 2016083942W WO 2017110317 A1 WO2017110317 A1 WO 2017110317A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- ion
- salt
- acid
- nmn
- compound
- Prior art date
Links
- DAYLJWODMCOQEW-TURQNECASA-N NMN zwitterion Chemical class NC(=O)C1=CC=C[N+]([C@H]2[C@@H]([C@H](O)[C@@H](COP(O)([O-])=O)O2)O)=C1 DAYLJWODMCOQEW-TURQNECASA-N 0.000 title claims abstract description 143
- 150000003839 salts Chemical class 0.000 title claims abstract description 96
- 235000013373 food additive Nutrition 0.000 title claims description 31
- 239000002778 food additive Substances 0.000 title claims description 31
- 238000004519 manufacturing process Methods 0.000 title claims description 20
- 239000000490 cosmetic additive Substances 0.000 title 1
- 239000003860 topical agent Substances 0.000 title 1
- 125000002252 acyl group Chemical group 0.000 claims abstract description 46
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 27
- 229920006395 saturated elastomer Polymers 0.000 claims abstract description 20
- VILAVOFMIJHSJA-UHFFFAOYSA-N dicarbon monoxide Chemical group [C]=C=O VILAVOFMIJHSJA-UHFFFAOYSA-N 0.000 claims abstract description 12
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 10
- 125000001183 hydrocarbyl group Chemical group 0.000 claims abstract description 5
- 150000001875 compounds Chemical class 0.000 claims description 141
- 239000003795 chemical substances by application Substances 0.000 claims description 56
- -1 halogen ion Chemical class 0.000 claims description 55
- 239000002537 cosmetic Substances 0.000 claims description 51
- 238000002360 preparation method Methods 0.000 claims description 51
- 150000001450 anions Chemical class 0.000 claims description 45
- 239000007788 liquid Substances 0.000 claims description 35
- 239000002904 solvent Substances 0.000 claims description 35
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 claims description 32
- 238000005917 acylation reaction Methods 0.000 claims description 30
- 230000002378 acidificating effect Effects 0.000 claims description 24
- 150000001768 cations Chemical class 0.000 claims description 23
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 claims description 21
- 229930195735 unsaturated hydrocarbon Natural products 0.000 claims description 15
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 12
- 229910052799 carbon Inorganic materials 0.000 claims description 12
- PHIQHXFUZVPYII-ZCFIWIBFSA-O (R)-carnitinium Chemical compound C[N+](C)(C)C[C@H](O)CC(O)=O PHIQHXFUZVPYII-ZCFIWIBFSA-O 0.000 claims description 10
- 229930195734 saturated hydrocarbon Natural products 0.000 claims description 10
- 229960004203 carnitine Drugs 0.000 claims description 9
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Natural products OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 claims description 7
- 150000001735 carboxylic acids Chemical class 0.000 claims description 6
- 235000021122 unsaturated fatty acids Nutrition 0.000 claims description 6
- FKNQFGJONOIPTF-UHFFFAOYSA-N Sodium cation Chemical compound [Na+] FKNQFGJONOIPTF-UHFFFAOYSA-N 0.000 claims description 5
- 229910052736 halogen Inorganic materials 0.000 claims description 5
- 229910001415 sodium ion Inorganic materials 0.000 claims description 5
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 claims description 5
- DBSABEYSGXPBTA-RXSVEWSESA-N (2r)-2-[(1s)-1,2-dihydroxyethyl]-3,4-dihydroxy-2h-furan-5-one;phosphoric acid Chemical compound OP(O)(O)=O.OC[C@H](O)[C@H]1OC(=O)C(O)=C1O DBSABEYSGXPBTA-RXSVEWSESA-N 0.000 claims description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims description 4
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 claims description 4
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 claims description 4
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 claims description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 claims description 4
- ZMJBYMUCKBYSCP-UHFFFAOYSA-N Hydroxycitric acid Chemical compound OC(=O)C(O)C(O)(C(O)=O)CC(O)=O ZMJBYMUCKBYSCP-UHFFFAOYSA-N 0.000 claims description 4
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 claims description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-L Oxalate Chemical compound [O-]C(=O)C([O-])=O MUBZPKHOEPUJKR-UHFFFAOYSA-L 0.000 claims description 4
- NPYPAHLBTDXSSS-UHFFFAOYSA-N Potassium ion Chemical compound [K+] NPYPAHLBTDXSSS-UHFFFAOYSA-N 0.000 claims description 4
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 claims description 4
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 claims description 4
- 235000010323 ascorbic acid Nutrition 0.000 claims description 4
- 229960005070 ascorbic acid Drugs 0.000 claims description 4
- 239000011668 ascorbic acid Substances 0.000 claims description 4
- 229940071097 ascorbyl phosphate Drugs 0.000 claims description 4
- 229910001424 calcium ion Inorganic materials 0.000 claims description 4
- 150000004820 halides Chemical class 0.000 claims description 4
- 229910001425 magnesium ion Inorganic materials 0.000 claims description 4
- 229910001414 potassium ion Inorganic materials 0.000 claims description 4
- 150000004671 saturated fatty acids Chemical class 0.000 claims description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 claims description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 claims description 3
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 claims description 3
- 150000008064 anhydrides Chemical class 0.000 claims description 3
- 229940089491 hydroxycitric acid Drugs 0.000 claims description 3
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 claims 1
- 235000002906 tartaric acid Nutrition 0.000 claims 1
- 239000011975 tartaric acid Substances 0.000 claims 1
- 239000000047 product Substances 0.000 description 43
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 43
- 239000000126 substance Substances 0.000 description 33
- 238000006243 chemical reaction Methods 0.000 description 25
- 150000002430 hydrocarbons Chemical group 0.000 description 25
- 239000000243 solution Substances 0.000 description 25
- 239000002253 acid Substances 0.000 description 23
- 238000012360 testing method Methods 0.000 description 23
- 239000006071 cream Substances 0.000 description 22
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 22
- 239000006210 lotion Substances 0.000 description 22
- 239000007787 solid Substances 0.000 description 21
- 210000004209 hair Anatomy 0.000 description 19
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 18
- IPCSVZSSVZVIGE-UHFFFAOYSA-N n-hexadecanoic acid Natural products CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 18
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 17
- 238000005160 1H NMR spectroscopy Methods 0.000 description 17
- 239000002994 raw material Substances 0.000 description 17
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 16
- 239000000843 powder Substances 0.000 description 15
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 14
- 230000015572 biosynthetic process Effects 0.000 description 13
- 239000000203 mixture Substances 0.000 description 13
- 238000003786 synthesis reaction Methods 0.000 description 13
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 12
- 238000000034 method Methods 0.000 description 12
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 11
- ARBOVOVUTSQWSS-UHFFFAOYSA-N hexadecanoyl chloride Chemical compound CCCCCCCCCCCCCCCC(Cl)=O ARBOVOVUTSQWSS-UHFFFAOYSA-N 0.000 description 11
- 238000004128 high performance liquid chromatography Methods 0.000 description 11
- 239000003925 fat Substances 0.000 description 10
- 235000019197 fats Nutrition 0.000 description 10
- 150000002500 ions Chemical class 0.000 description 10
- 231100000245 skin permeability Toxicity 0.000 description 10
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 9
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- 235000021314 Palmitic acid Nutrition 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 230000003712 anti-aging effect Effects 0.000 description 9
- 230000000052 comparative effect Effects 0.000 description 9
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 9
- 239000003960 organic solvent Substances 0.000 description 9
- 239000004480 active ingredient Substances 0.000 description 8
- FZAQROFXYZPAKI-UHFFFAOYSA-N anthracene-2-sulfonyl chloride Chemical compound C1=CC=CC2=CC3=CC(S(=O)(=O)Cl)=CC=C3C=C21 FZAQROFXYZPAKI-UHFFFAOYSA-N 0.000 description 8
- 239000000463 material Substances 0.000 description 8
- 239000002453 shampoo Substances 0.000 description 8
- 239000000344 soap Substances 0.000 description 8
- BAWFJGJZGIEFAR-NNYOXOHSSA-O NAD(+) Chemical class NC(=O)C1=CC=C[N+]([C@H]2[C@@H]([C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 BAWFJGJZGIEFAR-NNYOXOHSSA-O 0.000 description 7
- 238000005481 NMR spectroscopy Methods 0.000 description 7
- 125000000217 alkyl group Chemical group 0.000 description 7
- 239000003921 oil Substances 0.000 description 7
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 238000004440 column chromatography Methods 0.000 description 6
- 239000002781 deodorant agent Substances 0.000 description 6
- 239000002552 dosage form Substances 0.000 description 6
- 239000000839 emulsion Substances 0.000 description 6
- 239000000499 gel Substances 0.000 description 6
- 229950006238 nadide Drugs 0.000 description 6
- 239000002304 perfume Substances 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- 238000010521 absorption reaction Methods 0.000 description 5
- 238000001914 filtration Methods 0.000 description 5
- 239000004615 ingredient Substances 0.000 description 5
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 5
- 238000003756 stirring Methods 0.000 description 5
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 4
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 4
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- 125000003342 alkenyl group Chemical group 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 239000003480 eluent Substances 0.000 description 4
- VKOBVWXKNCXXDE-UHFFFAOYSA-N icosanoic acid Chemical compound CCCCCCCCCCCCCCCCCCCC(O)=O VKOBVWXKNCXXDE-UHFFFAOYSA-N 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 239000003456 ion exchange resin Substances 0.000 description 4
- 229920003303 ion-exchange polymer Polymers 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 230000035699 permeability Effects 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 239000000741 silica gel Substances 0.000 description 4
- 229910002027 silica gel Inorganic materials 0.000 description 4
- 238000005406 washing Methods 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 150000001449 anionic compounds Chemical class 0.000 description 3
- 150000001767 cationic compounds Chemical class 0.000 description 3
- 239000008406 cosmetic ingredient Substances 0.000 description 3
- 230000018044 dehydration Effects 0.000 description 3
- 238000006297 dehydration reaction Methods 0.000 description 3
- 239000006260 foam Substances 0.000 description 3
- 230000037308 hair color Effects 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 3
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 3
- 229910001412 inorganic anion Inorganic materials 0.000 description 3
- 229910001411 inorganic cation Inorganic materials 0.000 description 3
- XEEYBQQBJWHFJM-UHFFFAOYSA-N iron Substances [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 3
- 235000013336 milk Nutrition 0.000 description 3
- 210000004080 milk Anatomy 0.000 description 3
- 150000002891 organic anions Chemical class 0.000 description 3
- 150000002892 organic cations Chemical class 0.000 description 3
- 239000012488 sample solution Substances 0.000 description 3
- 150000004670 unsaturated fatty acids Chemical class 0.000 description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- HNSDLXPSAYFUHK-UHFFFAOYSA-N 1,4-bis(2-ethylhexyl) sulfosuccinate Chemical compound CCCCC(CC)COC(=O)CC(S(O)(=O)=O)C(=O)OCC(CC)CCCC HNSDLXPSAYFUHK-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 239000012981 Hank's balanced salt solution Substances 0.000 description 2
- 238000004566 IR spectroscopy Methods 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-L L-tartrate(2-) Chemical compound [O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O FEWJPZIEWOKRBE-JCYAYHJZSA-L 0.000 description 2
- OYHQOLUKZRVURQ-HZJYTTRNSA-N Linoleic acid Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(O)=O OYHQOLUKZRVURQ-HZJYTTRNSA-N 0.000 description 2
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 230000032683 aging Effects 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 description 2
- 235000020661 alpha-linolenic acid Nutrition 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 150000001244 carboxylic acid anhydrides Chemical class 0.000 description 2
- 239000012295 chemical reaction liquid Substances 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 238000005100 correlation spectroscopy Methods 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 210000003298 dental enamel Anatomy 0.000 description 2
- 150000001991 dicarboxylic acids Chemical class 0.000 description 2
- JXTHNDFMNIQAHM-UHFFFAOYSA-N dichloroacetic acid Chemical compound OC(=O)C(Cl)Cl JXTHNDFMNIQAHM-UHFFFAOYSA-N 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- NQGIJDNPUZEBRU-UHFFFAOYSA-N dodecanoyl chloride Chemical compound CCCCCCCCCCCC(Cl)=O NQGIJDNPUZEBRU-UHFFFAOYSA-N 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 210000004709 eyebrow Anatomy 0.000 description 2
- 230000001815 facial effect Effects 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 239000003205 fragrance Substances 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 150000002243 furanoses Chemical group 0.000 description 2
- VZCCETWTMQHEPK-QNEBEIHSSA-N gamma-linolenic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/CCCCC(O)=O VZCCETWTMQHEPK-QNEBEIHSSA-N 0.000 description 2
- 235000020664 gamma-linolenic acid Nutrition 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- YWGHUJQYGPDNKT-UHFFFAOYSA-N hexanoyl chloride Chemical compound CCCCCC(Cl)=O YWGHUJQYGPDNKT-UHFFFAOYSA-N 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- OYHQOLUKZRVURQ-IXWMQOLASA-N linoleic acid Natural products CCCCC\C=C/C\C=C\CCCCCCCC(O)=O OYHQOLUKZRVURQ-IXWMQOLASA-N 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- 239000008267 milk Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 230000003020 moisturizing effect Effects 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 150000002762 monocarboxylic acid derivatives Chemical class 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- REEZZSHJLXOIHL-UHFFFAOYSA-N octanoyl chloride Chemical compound CCCCCCCC(Cl)=O REEZZSHJLXOIHL-UHFFFAOYSA-N 0.000 description 2
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 2
- 235000021313 oleic acid Nutrition 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N phosphoric acid Substances OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000001226 reprecipitation Methods 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 230000000475 sunscreen effect Effects 0.000 description 2
- 239000000516 sunscreening agent Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 2
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 2
- 239000000341 volatile oil Substances 0.000 description 2
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- ODIGIKRIUKFKHP-UHFFFAOYSA-N (n-propan-2-yloxycarbonylanilino) acetate Chemical compound CC(C)OC(=O)N(OC(C)=O)C1=CC=CC=C1 ODIGIKRIUKFKHP-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- OHVLMTFVQDZYHP-UHFFFAOYSA-N 1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-2-[4-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]piperazin-1-yl]ethanone Chemical compound N1N=NC=2CN(CCC=21)C(CN1CCN(CC1)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)=O OHVLMTFVQDZYHP-UHFFFAOYSA-N 0.000 description 1
- KZEVSDGEBAJOTK-UHFFFAOYSA-N 1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-2-[5-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]-1,3,4-oxadiazol-2-yl]ethanone Chemical compound N1N=NC=2CN(CCC=21)C(CC=1OC(=NN=1)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)=O KZEVSDGEBAJOTK-UHFFFAOYSA-N 0.000 description 1
- LRMSQVBRUNSOJL-UHFFFAOYSA-N 2,2,3,3,3-pentafluoropropanoic acid Chemical compound OC(=O)C(F)(F)C(F)(F)F LRMSQVBRUNSOJL-UHFFFAOYSA-N 0.000 description 1
- JVKRKMWZYMKVTQ-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]pyrazol-1-yl]-N-(2-oxo-3H-1,3-benzoxazol-6-yl)acetamide Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C=1C=NN(C=1)CC(=O)NC1=CC2=C(NC(O2)=O)C=C1 JVKRKMWZYMKVTQ-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- DFGKGUXTPFWHIX-UHFFFAOYSA-N 6-[2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]piperazin-1-yl]acetyl]-3H-1,3-benzoxazol-2-one Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)N1CCN(CC1)CC(=O)C1=CC2=C(NC(O2)=O)C=C1 DFGKGUXTPFWHIX-UHFFFAOYSA-N 0.000 description 1
- LQSJUQMCZHVKES-UHFFFAOYSA-N 6-iodopyrimidin-4-amine Chemical compound NC1=CC(I)=NC=N1 LQSJUQMCZHVKES-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 241001237961 Amanita rubescens Species 0.000 description 1
- 241000195940 Bryophyta Species 0.000 description 1
- JPVYNHNXODAKFH-UHFFFAOYSA-N Cu2+ Chemical compound [Cu+2] JPVYNHNXODAKFH-UHFFFAOYSA-N 0.000 description 1
- 208000001840 Dandruff Diseases 0.000 description 1
- 108091006149 Electron carriers Proteins 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- HBBGRARXTFLTSG-UHFFFAOYSA-N Lithium ion Chemical compound [Li+] HBBGRARXTFLTSG-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- VEQPNABPJHWNSG-UHFFFAOYSA-N Nickel(2+) Chemical compound [Ni+2] VEQPNABPJHWNSG-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- 108091005770 SIRT3 Proteins 0.000 description 1
- 102000011990 Sirtuin Human genes 0.000 description 1
- 108050002485 Sirtuin Proteins 0.000 description 1
- 102000000344 Sirtuin 1 Human genes 0.000 description 1
- 108010041191 Sirtuin 1 Proteins 0.000 description 1
- 102000000478 Sirtuin 3 Human genes 0.000 description 1
- DFPAKSUCGFBDDF-ZQBYOMGUSA-N [14c]-nicotinamide Chemical compound N[14C](=O)C1=CC=CN=C1 DFPAKSUCGFBDDF-ZQBYOMGUSA-N 0.000 description 1
- KQNSPSCVNXCGHK-UHFFFAOYSA-N [3-(4-tert-butylphenoxy)phenyl]methanamine Chemical compound C1=CC(C(C)(C)C)=CC=C1OC1=CC=CC(CN)=C1 KQNSPSCVNXCGHK-UHFFFAOYSA-N 0.000 description 1
- 239000006096 absorbing agent Substances 0.000 description 1
- 238000000862 absorption spectrum Methods 0.000 description 1
- GFTWDQJSZPFMOZ-UHFFFAOYSA-N acetyl acetate Chemical compound CC(=O)OC(C)=O.CC(=O)OC(C)=O GFTWDQJSZPFMOZ-UHFFFAOYSA-N 0.000 description 1
- 230000000397 acetylating effect Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229940077464 ammonium ion Drugs 0.000 description 1
- 239000002280 amphoteric surfactant Substances 0.000 description 1
- 239000003945 anionic surfactant Substances 0.000 description 1
- 239000000058 anti acne agent Substances 0.000 description 1
- 229940124340 antiacne agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 125000001204 arachidyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 229910001422 barium ion Inorganic materials 0.000 description 1
- 239000003788 bath preparation Substances 0.000 description 1
- 125000002511 behenyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000007844 bleaching agent Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 229940006460 bromide ion Drugs 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 239000003093 cationic surfactant Substances 0.000 description 1
- 125000003901 ceryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- SECPZKHBENQXJG-UHFFFAOYSA-N cis-palmitoleic acid Natural products CCCCCCC=CCCCCCCCC(O)=O SECPZKHBENQXJG-UHFFFAOYSA-N 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000005515 coenzyme Substances 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 230000003750 conditioning effect Effects 0.000 description 1
- 229910001431 copper ion Inorganic materials 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000003493 decenyl group Chemical group [H]C([*])=C([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000007854 depigmenting agent Substances 0.000 description 1
- 230000035617 depilation Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 229960005215 dichloroacetic acid Drugs 0.000 description 1
- PBWZKZYHONABLN-UHFFFAOYSA-N difluoroacetic acid Chemical compound OC(=O)C(F)F PBWZKZYHONABLN-UHFFFAOYSA-N 0.000 description 1
- GPLRAVKSCUXZTP-UHFFFAOYSA-N diglycerol Chemical class OCC(O)COCC(O)CO GPLRAVKSCUXZTP-UHFFFAOYSA-N 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 125000005066 dodecenyl group Chemical group C(=CCCCCCCCCCC)* 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000010410 dusting Methods 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 239000003974 emollient agent Substances 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- VZCCETWTMQHEPK-UHFFFAOYSA-N gamma-Linolensaeure Natural products CCCCCC=CCC=CCC=CCCCCC(O)=O VZCCETWTMQHEPK-UHFFFAOYSA-N 0.000 description 1
- 229960002733 gamolenic acid Drugs 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000004519 grease Substances 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 239000008266 hair spray Substances 0.000 description 1
- 125000002818 heptacosyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- JLRBNGCMXSGALP-UHFFFAOYSA-N heptanoic acid Chemical compound CCCCCCC(O)=O.CCCCCCC(O)=O JLRBNGCMXSGALP-UHFFFAOYSA-N 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 150000001261 hydroxy acids Chemical class 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000000077 insect repellent Substances 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-M iodide Chemical compound [I-] XMBWDFGMSWQBCA-UHFFFAOYSA-M 0.000 description 1
- 229940006461 iodide ion Drugs 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- 239000008274 jelly Substances 0.000 description 1
- 125000002463 lignoceryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000000865 liniment Substances 0.000 description 1
- 235000020778 linoleic acid Nutrition 0.000 description 1
- 229960004488 linolenic acid Drugs 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 229910001416 lithium ion Inorganic materials 0.000 description 1
- 229910001437 manganese ion Inorganic materials 0.000 description 1
- 125000002960 margaryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 239000003595 mist Substances 0.000 description 1
- 125000002819 montanyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000011929 mousse Nutrition 0.000 description 1
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- KEMQGTRYUADPNZ-UHFFFAOYSA-N n-heptadecanoic acid Natural products CCCCCCCCCCCCCCCCC(O)=O KEMQGTRYUADPNZ-UHFFFAOYSA-N 0.000 description 1
- 210000000282 nail Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910001453 nickel ion Inorganic materials 0.000 description 1
- 125000002465 nonacosyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001196 nonadecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005187 nonenyl group Chemical group C(=CCCCCCCC)* 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- 125000005064 octadecenyl group Chemical group C(=CCCCCCCCCCCCCCCCC)* 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 238000010979 pH adjustment Methods 0.000 description 1
- 230000026792 palmitoylation Effects 0.000 description 1
- 125000000913 palmityl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002460 pentacosyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002958 pentadecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- YPJUNDFVDDCYIH-UHFFFAOYSA-N perfluorobutyric acid Chemical compound OC(=O)C(F)(F)C(F)(F)C(F)(F)F YPJUNDFVDDCYIH-UHFFFAOYSA-N 0.000 description 1
- 150000004713 phosphodiesters Chemical class 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 238000003918 potentiometric titration Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000001012 protector Effects 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 238000007788 roughening Methods 0.000 description 1
- 235000003441 saturated fatty acids Nutrition 0.000 description 1
- 210000002374 sebum Anatomy 0.000 description 1
- 239000003352 sequestering agent Substances 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000008257 shaving cream Substances 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229920002545 silicone oil Polymers 0.000 description 1
- 231100000274 skin absorption Toxicity 0.000 description 1
- 230000037384 skin absorption Effects 0.000 description 1
- 230000008417 skin turnover Effects 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 125000004079 stearyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 150000003505 terpenes Chemical class 0.000 description 1
- 235000007586 terpenes Nutrition 0.000 description 1
- 125000005063 tetradecenyl group Chemical group C(=CCCCCCCCCCCCC)* 0.000 description 1
- 229910001432 tin ion Inorganic materials 0.000 description 1
- 230000001256 tonic effect Effects 0.000 description 1
- 150000003628 tricarboxylic acids Chemical class 0.000 description 1
- 125000002469 tricosyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005040 tridecenyl group Chemical group C(=CCCCCCCCCCCC)* 0.000 description 1
- 125000002889 tridecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005065 undecenyl group Chemical group C(=CCCCCCCCCC)* 0.000 description 1
- 125000002948 undecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 230000002087 whitening effect Effects 0.000 description 1
- DTOSIQBPPRVQHS-UHFFFAOYSA-N α-Linolenic acid Chemical compound CCC=CCC=CCC=CCCCCCCCC(O)=O DTOSIQBPPRVQHS-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/048—Pyridine radicals
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS, OR NON-ALCOHOLIC BEVERAGES, NOT COVERED BY SUBCLASSES A21D OR A23B-A23J; THEIR PREPARATION OR TREATMENT, e.g. COOKING, MODIFICATION OF NUTRITIVE QUALITIES, PHYSICAL TREATMENT; PRESERVATION OF FOODS OR FOODSTUFFS, IN GENERAL
- A23L29/00—Foods or foodstuffs containing additives; Preparation or treatment thereof
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS, OR NON-ALCOHOLIC BEVERAGES, NOT COVERED BY SUBCLASSES A21D OR A23B-A23J; THEIR PREPARATION OR TREATMENT, e.g. COOKING, MODIFICATION OF NUTRITIVE QUALITIES, PHYSICAL TREATMENT; PRESERVATION OF FOODS OR FOODSTUFFS, IN GENERAL
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/13—Nucleic acids or derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/60—Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/60—Sugars; Derivatives thereof
- A61K8/606—Nucleosides; Nucleotides; Nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/18—Antioxidants, e.g. antiradicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
- A61Q19/08—Anti-ageing preparations
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
Definitions
- the present invention relates to a novel nicotinamide mononucleotide derivative, a salt thereof, a production method thereof, a skin external preparation, a cosmetic, and a food additive.
- Nicotinamide mononucleotide (hereinafter sometimes abbreviated as “NMN”) is an intermediate metabolite of nicotinamide adenine dinucleotide (NAD + ), which is a coenzyme.
- NAD + is an electron carrier present in all living species.
- sirtuin related to aging (NAD + dependent deacetylase Sirt1, SIRT3). It is considered that the aging phenomenon can be suppressed by increasing intracellular NAD + .
- NAD + is an intermediate metabolite NMN
- anti-aging effect is observed in the administration experiment to mice (e.g., see Non-Patent Document 1.). Therefore, it has been studied to use the anti-aging action of NMN for applications such as external preparations for skin, cosmetics and food additives.
- Non-Patent Document 2 proposes a method for synthesizing a phosphodiester type NMN derivative which is an NMN derivative having a lipophilic functional group.
- Non-Patent Document 2 shows a synthesis example of diacetyl NMN obtained by acetylating two hydroxyl groups of NMN as a synthetic intermediate.
- NMN derivatives have not been able to obtain sufficient in vivo absorption.
- diacetyl NMN described in Non-Patent Document 2 has insufficient lipid solubility of acyl groups, sufficient skin permeability cannot be obtained, and absorption in the body is insufficient. For this reason, it has been required to improve the in vivo absorbability of NMN derivatives.
- Non-Patent Document 2 has a problem that it is difficult to convert it to NMN, which is expected to have an anti-aging effect, after skin absorption.
- NMN derivatives when used as materials for external preparations for skin, cosmetics, and food additives, they must have sufficient water solubility so that they can be used in various dosage forms such as aqueous, emulsified, solid, powder, and tablets. Is desirable.
- the present invention has been made in view of the above circumstances, and an object of the present invention is to provide an NMN derivative that is easily decomposed into NMN in the body and has sufficient fat solubility and water solubility.
- a nicotinamide mononucleotide derivative or a salt thereof which is a compound represented by the general formula (1).
- R 1 and R 2 are each independently a hydrogen atom or an acyl group having 3 to 30 carbon atoms, and the hydrocarbon group bonded to the carbonyl carbon of the acyl group is a linear or branched chain
- the salt of the compound of general formula (1) is nitrate ion, sulfate ion, carbonate ion, hydrogen carbonate ion, halogen ion, formate ion, acetate ion, citrate ion, tartrate ion, oxalate ion, fumarate ion Selected from the group consisting of anions of saturated or unsaturated fatty acids having 3 to 20 carbon atoms, anions of carnitine and its derivatives, anions of hydroxycitric acid and its derivatives, anions of ascorbic acid, and anions of ascorbyl phosphate and its derivatives
- the nicotinamide mononucleotide derivative or a salt thereof according to [1] or [2], wherein the nicotinamide mononucleotide derivative is a salt formed with one or more anions.
- the salt of the compound of the general formula (1) is combined with one or more cations selected from the group consisting of sodium ion, potassium ion, calcium ion, magnesium ion, zinc ion, ammonium ion, carnitine and cations of derivatives thereof.
- a linear or branched saturated or unsaturated hydrocarbon group is bonded to the carbonyl carbon in a solvent containing 20% by mass or more of a strongly acidic liquid having a pKa of 2.0 or less for nicotinamide mononucleotide.
- an acylation reaction using one or more acylating agents selected from the group consisting of carboxylic acids having an acyl group having 3 to 30 carbon atoms, halides of the carboxylic acids, and anhydrides of the carboxylic acids.
- the method for producing a nicotinamide mononucleotide derivative or a salt thereof according to any one of [1] to [4].
- the NMN derivative of the present invention or a salt thereof is easily decomposed into NMN in the body and has sufficient fat solubility and water solubility.
- the NMN derivative of the present invention or a salt thereof has a high fat-solubility so that it can be absorbed into the body, and after being absorbed in the body, it is easily decomposed into NMN in the body. For this reason, for example, when used as a material for external preparations for skin, cosmetics, and food additives, a high anti-aging effect can be expected as compared with the case where NMN having the same mass is used. Further, the NMN derivative of the present invention or a salt thereof has sufficient fat solubility and water solubility. For this reason, it can utilize for the skin external preparation, cosmetics, and food additive of various dosage forms, such as a water system, an emulsion system, solid, powder, and a tablet.
- nicotinamide mononucleotide (NMN) derivative of the present invention or a salt thereof, a production method thereof, a skin external preparation, a cosmetic, and a food additive will be described in detail.
- the present invention is not limited only to the examples shown below, and various applications are possible within the scope of the claims.
- NMN derivatives or salts thereof The NMN derivative of this embodiment is a compound represented by the following general formula (1) (hereinafter sometimes abbreviated as “compound (1)”).
- R 1 and R 2 are each independently a hydrogen atom or an acyl group having 3 to 30 carbon atoms, and the hydrocarbon group bonded to the carbonyl carbon of the acyl group is a linear or branched chain
- the NMN derivative of this embodiment is an inner salt in which an acid and a base are present in the molecule as represented by the general formula (1).
- At least one of R 1 and R 2 in the general formula (1) is the acyl group. That is, both R 1 and R 2 are the acyl group, R 1 is the acyl group and R 2 is a hydrogen atom, R 1 is a hydrogen atom and R 2 is the acyl group Some are equivalent. Further, when both of R 1 and R 2 are the acyl group, to R 1 and R 2 may be the same acyl group, it may be a different acyl group.
- R 1 and R 2 in the general formula (1) are each independently a hydrogen atom or an acyl group having 3 to 30 carbon atoms.
- the hydrocarbon group (hydrocarbyl group) bonded to the carbonyl carbon of the acyl group is a saturated or unsaturated hydrocarbon group having 2 to 29 carbon atoms.
- the saturated or unsaturated hydrocarbon group may be either linear or branched.
- saturated hydrocarbon group examples include ethyl group, propyl group, butyl group, pentyl group, hexyl group, heptyl group, octyl group, nonyl group, decyl group, undecyl group, dodecyl group, tridecyl group.
- the number of unsaturated bonds may be one, or two or more. When the number of unsaturated bonds is 2 or more, all the unsaturated bonds may be double bonds or triple bonds, and double bonds and triple bonds are mixed in the unsaturated hydrocarbon group. May be.
- the position of the unsaturated bond is not particularly limited.
- the number of unsaturated bonds in the unsaturated hydrocarbon group is preferably 1 to 3, and more preferably 1 or 2.
- the unsaturated hydrocarbon group preferably has only a double bond as an unsaturated bond.
- Examples of the unsaturated hydrocarbon group include ethenyl group, propenyl group, butenyl group, pentenyl group, hexenyl group, heptenyl group, octenyl group, nonenyl group, decenyl group, undecenyl group, dodecenyl group, tridecenyl group, tetradecenyl group, pentadecenyl group , Hexadecenyl group, heptadecenyl group, octadecenyl group, nonadecenyl group, icocenyl group, henycocenyl group, dococenyl group, tricocenyl group, tetracocenyl group, pentacocenyl group, hexacocenyl group, heptacocenyl group, octacocenyl group, nonacosen
- the hydrocarbon group bonded to the carbonyl carbon of the acyl group is preferably an alkyl group or an alkenyl group from the viewpoint of availability of raw materials and production costs. Moreover, it is preferable that the said hydrocarbon group couple
- the carbon number of the acyl group in R 1 and R 2 is 3 to 30, preferably 4 to 24, more preferably 5 to 20, and particularly preferably 6 to 16. That is, the hydrocarbon group bonded to the carbonyl carbon of the acyl group has 2 to 29, preferably 3 to 23, more preferably 4 to 19, and more preferably 5 to 15. It is particularly preferred.
- the carbon number of the acyl group is 3 or more (the carbon number of the hydrocarbon group is 2 or more), sufficient fat solubility is obtained, and thus high in-vivo absorbability is obtained. Further, when the acyl group has 30 or less carbon atoms (the hydrocarbon group has 29 or less carbon atoms), sufficient water solubility can be obtained.
- the salt of the NMN derivative (salt of the compound (1)) of this embodiment is formed by an anion (or cation) derived from the compound (1) and a cation (or anion) derived from a compound other than the compound (1). It is a compound that has been.
- the salt of compound (1) include a salt formed by reacting compound (1) with an acid or a base. Such salt may be a salt formed with compound (1) as a cation and an anion, or a salt formed with compound (1) as an anion and a cation.
- the site that can be a cation moiety in the compound (1) includes a hydrogen atom (H + ) coordinated to a nitrogen atom of a pyridine ring and a nitrogen atom of an amino group represented by “—NH 2 ” (—NH 3 + ).
- a phosphoric acid group can be illustrated as a site
- the cation and the anion constituting the salt of one molecule of the compound (1) may be either one or two or more. When there are two or more cations and anions, these cations or anions may all be the same, all may be different, or only some may be the same.
- the salt of the compound (1) is electrically neutral as a whole molecule, that is, the total value of the cation valence and the total value of the anion valence contained in the salt of one molecule of the compound (1) are the same. It is preferable that
- the anion that forms the salt of the compound (1) together with the compound (1) that becomes a cation may be an inorganic anion or an organic anion.
- the valences of the inorganic anion and the organic anion are not particularly limited, and may be monovalent or divalent or higher, for example.
- Preferred inorganic anions include nitrate ions, sulfate ions, carbonate ions, hydrogen carbonate ions, halogen ions and the like.
- the halogen ion include fluoride ion, chloride ion, bromide ion, and iodide ion.
- preferable organic anions include anions of carboxylic acid, anions of carnitine and derivatives thereof, anions of hydroxycitric acid and derivatives thereof, anions of ascorbic acid, anions of ascorbyl phosphate and derivatives thereof, and the like.
- the anion of the carboxylic acid may be an anion of a monocarboxylic acid (monovalent carboxylic acid) or an anion of a polyvalent carboxylic acid such as a dicarboxylic acid or a tricarboxylic acid.
- carboxylic acid anion examples include formate ion, acetate ion, propanoic acid (propionic acid) ion, butanoic acid (butyric acid) ion, pentanoic acid (valeric acid) ion, hexanoic acid (caproic acid) ion, heptanoic acid (enanthic acid).
- the “fatty acid” means a monocarboxylic acid having a chain structure unless otherwise specified.
- the above-mentioned saturated or unsaturated fatty acid anions preferably have 2 to 25 carbon atoms, and more preferably 3 to 20 carbon atoms.
- the anion of unsaturated fatty acid preferably has 1 to 4 unsaturated bonds.
- the above-mentioned saturated or unsaturated dicarboxylic acid anion preferably has 2 to 6 carbon atoms, and more preferably 2 to 4 carbon atoms. Further, the anion of an unsaturated dicarboxylic acid having 2 or more carbon atoms preferably has one unsaturated bond.
- anions forming the salt of compound (1) together with the compound (1) becoming a cation, nitrate ion, sulfate ion, carbonate ion, bicarbonate ion, halogen ion, formate ion, acetate ion, Citrate ion, tartrate ion, oxalate ion, fumarate ion, anion of saturated or unsaturated fatty acid having 3 to 20 carbon atoms, anion of carnitine and its derivative, anion of hydroxycitrate and its derivative, anion of ascorbic acid And one or more anions selected from the group consisting of anions of ascorbyl phosphate and derivatives thereof.
- the cation forming the salt of the compound (1) together with the compound (1) converted to an anion may be an inorganic cation or an organic cation.
- the valences of the inorganic cation and the organic cation are not particularly limited, and may be, for example, monovalent or divalent or higher.
- Preferred inorganic cations include sodium ion, potassium ion, calcium ion, magnesium ion, lithium ion, barium ion, aluminum ion, zinc ion, copper ion (Cu + , Cu 2+ ), iron ion (Fe 2+ , Fe 3+ ), Examples include manganese ions, nickel ions, tin ions (Sn 2+ , Sn 4+ ), ammonium ions, and the like. Examples of preferable organic cations include carnitine and cations of carnitine derivatives.
- cations that form the salt of compound (1) together with the compound (1) as an anion sodium ion, potassium ion, calcium ion, magnesium ion, zinc ion, ammonium ion, carnitine, and carnitine
- One or more cations selected from the group consisting of cations of derivatives are preferred.
- the salt of compound (1) and compound (1) of this embodiment may exist independently, and may exist in the state in which the salt of compound (1) and compound (1) was mixed.
- compound (1) has a plurality of stereoisomers such as an asymmetric atom in the molecule. That is, all of these stereoisomers are included in the compound (1) and salts thereof of the present embodiment (hereinafter, these compounds may be collectively referred to as “compound (1), etc.”).
- the compound (1) or the like may be only the ⁇ isomer, which is a stereoisomer, only the ⁇ isomer, or a mixture of the ⁇ isomer and the ⁇ isomer.
- the compound (1) and the like of the present embodiment have appropriate fat solubility when at least one of R 1 and R 2 in the general formula (1) is an acyl group having 3 or more carbon atoms. Therefore, the compound (1) and the like are superior in skin affinity and skin permeability and have higher in-vivo absorption (percutaneous absorption) than NMN, conventional NMN derivatives and salts thereof. Moreover, after being absorbed into the body, the compound (1) and the like of this embodiment are easily decomposed by a biological enzyme reaction in the body to become an NMN that is expected to have an anti-aging action. Therefore, for example, the external preparation for skin containing the compound (1) and the cosmetics have a significantly larger amount of NMN reaching the skin tissue than the case of containing NMN, conventional NMN derivatives and salts thereof. It will be a thing.
- compound (1) etc. have sufficient fat solubility, when at least one of R ⁇ 1 > and R ⁇ 2 > in General formula (1) is a C30 or less acyl group, for example, It has sufficient water solubility when used as a material for external preparations for skin, cosmetics, and food additives. For this reason, compound (1) and the like are excellent in handleability, can be easily blended into external preparations for skin, cosmetics and food additives, and have various dosage forms such as aqueous, emulsified, solid, powder and tablets. It can be used for external preparations, cosmetics and food additives. Therefore, the compound (1) and the like are useful as materials for external preparations for skin, cosmetics, and food additives.
- NMN is acylated using an acylating agent in a solvent containing 20% by mass or more of a strongly acidic liquid having a pKa of 2.0 or less.
- NMN used as a raw material may be only the ⁇ isomer, which is a stereoisomer, or only the ⁇ isomer, or a mixture of the ⁇ isomer and the ⁇ isomer.
- a solvent containing 20% by mass or more of a strongly acidic liquid having a pKa of 2.0 or less is used.
- a strongly acidic liquid a solvent that is liquid at 25 ° C. is used.
- a polyvalent acid such as sulfuric acid can have a plurality of pKa values.
- the solvent has a plurality of pKa values, the lowest pKa value is adopted in the present invention.
- the acid dissociation constant pKa is a parameter indicating the degree of acid dissociation.
- Ka the ionization constant of the acid
- the pKa is usually measured in water at 25 ° C. using a potentiometric titration method, ultraviolet-visible spectroscopy, nuclear magnetic resonance spectroscopy, or the like.
- the pKa of very strong acids such as hydrochloric acid and sulfuric acid cannot be measured accurately in water due to the leveling effect of the solvent.
- the pKa values measured in organic solvents such as acetic acid, dimethyl sulfoxide, acetonitrile, etc., which have higher proton donating ability than water, are compared, or the Hammett acidity function value is compared. Need to compare.
- pKa values in water such as hydrochloric acid and sulfuric acid are sometimes shown in the literature, these are estimated values converted into values in water based on the results measured in an organic solvent.
- a strongly acidic liquid having a pKa of 2.0 or less in the present embodiment is a liquid having a pKa in water of 2.0 or less.
- the liquid having a pKa of 2.0 or less corresponds to a liquid whose pKa measurement value in water is 2.0 or less, a substance whose acidity is too strong to be measured in water, or an organic solvent.
- the pKa in water converted from the measurement result in is 2.0 or less.
- the pKa of the strongly acidic liquid is 2.0 or less, NMN can be sufficiently dissolved in the solvent. As a result, NMN can be efficiently acylated and compound (1) and the like can be obtained in high yield.
- the pKa of the strongly acidic liquid is preferably 1.5 or less, more preferably 1.0 or less.
- strongly acidic liquids having a pKa of 2.0 or less include trifluoroacetic acid, difluoroacetic acid, dichloroacetic acid, pentafluoropropionic acid, heptafluorobutyric acid, perfluoropentanoic acid, perfluorohexanoic acid, sulfuric acid, methanesulfone.
- Examples include acid, ethanesulfonic acid, trifluoromethanesulfonic acid and the like.
- the strong acid liquid may be used alone or in combination of two or more strong acid liquids. When using 2 or more types together, the combination and ratio can be suitably selected according to the objective.
- a mixture of a strongly acidic liquid and another organic solvent may be used as the solvent.
- the organic solvent mixed with the strongly acidic liquid is not particularly limited as long as it does not react with NMN and does not decompose with acid. Specific examples of these organic solvents include dichloromethane, chloroform, 1,2-dichloroethane, toluene, benzene, dimethyl sulfoxide, N, N-dimethylformamide, acetonitrile, and the like.
- the ratio of the strongly acidic liquid in the solvent is 20% by mass to 100% by mass.
- the content of the strongly acidic liquid in the solvent is 20% by mass or more, NMN can be sufficiently dissolved in the solvent, so that NMN can be efficiently acylated and compound (1) or the like can be obtained in a high yield. Is obtained.
- the content of the strongly acidic liquid in the solvent is preferably 50% by mass to 100% by mass, and more preferably 80% by mass to 100% by mass.
- the content of the strongly acidic liquid in the solvent being 100% by mass means that the strongly acidic liquid itself is used as the solvent.
- the amount of the solvent used with respect to the amount of NMN used as a raw material is not particularly limited, and may be appropriately selected in consideration of the solubility of NMN in the solvent, the stirring property of the reaction solution, and the like.
- the acylating agent a carboxylic acid having an acyl group having 3 to 30 carbon atoms in which a linear or branched saturated or unsaturated hydrocarbon group is bonded to a carbonyl carbon, the carboxylic acid
- the above-mentioned halides and carboxylic acid anhydrides are used.
- the carboxylic acid halide it is preferable to use a chloride or bromide.
- acylating agent since a high yield is obtained among the above, palmitoyl chloride (CH 3 (CH 2 ) 14 COCl), lauroyl chloride (CH 3 (CH 2 ) 10 COCl), octanoyl chloride (CH It is preferable to use a carboxylic acid chloride (acid chloride) such as 3 (CH 2 ) 6 COCl) or hexanoyl chloride (CH 3 (CH 2 ) 4 COCl).
- carboxylic acid chloride such as 3 (CH 2 ) 6 COCl) or hexanoyl chloride (CH 3 (CH 2 ) 4 COCl).
- These acylating agents may be used individually by 1 type, and may be used in combination of 2 or more type. When two or more acylating agents are used in combination, the combination and ratio can be appropriately selected according to the purpose.
- the amount of acylating agent used relative to the amount of raw material NMN is preferably adjusted as appropriate according to the type of target product (type of acylating agent), the type of solvent, and the like.
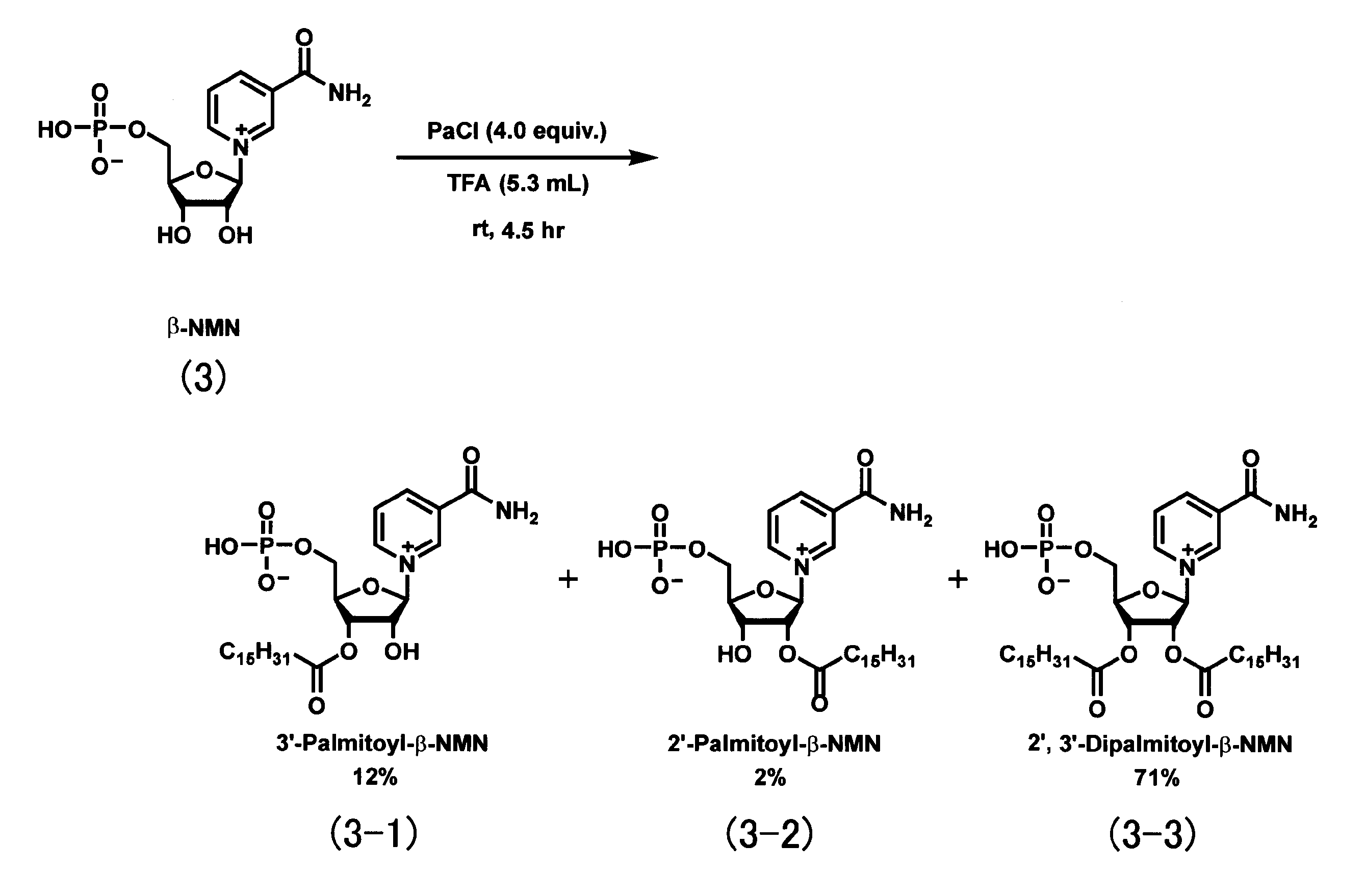
- Two hydroxyl groups present in the sugar skeleton (furanose ring) of NMN are arranged at the 3′-position and the 2′-position.
- the reactivity of the acylation reaction differs between the 2'-position hydroxyl group and the 3'-position hydroxyl group of the sugar skeleton of NMN.
- the hydroxyl group at the 3 ′ position is more reactive in the acylation reaction than the hydroxyl group at the 2 ′ position. Therefore, when the amount of acylating agent used for NMN is small, a product in which only the 3′-position hydroxyl group of the sugar skeleton is acylated (in compound (1), R 1 is an acyl group and R 2 is hydrogen). It is easy to generate atoms).
- acylating agent used for NMN when the amount of the acylating agent used for NMN is large, a product in which not only the 3′-position but also the 2′-position hydroxyl group of the sugar skeleton is acylated (in the compound (1), R 1 and R 2 are acyl groups). ) Is easy to generate. Further, regardless of the amount of acylating agent used for NMN, a product in which only the 2′-position hydroxyl group of the sugar skeleton is acylated (in compound (1), R 1 is a hydrogen atom, and R 2 is an acyl group. ) Is not generated the most.
- the hydroxyl group at the 3′-position of the sugar skeleton is acylated with a small amount of acylating agent used for NMN. Thereafter, different types of acylating agents are added to acylate the non-acylated hydroxyl groups of the sugar skeleton. This produces a compound (1) or the like in which different types of acyl groups are introduced into R 1 and R 2 .
- the amount of the acylating agent to be used first is preferably adjusted as appropriate while monitoring the progress of the acyl reaction.
- the reaction temperature of the acylation reaction is not particularly limited, but is preferably ⁇ 20 ° C. to 50 ° C., more preferably 0 ° C. to 30 ° C. Since NMN is a compound that is easily decomposed by heating, the reaction temperature of the acylation reaction is preferably 50 ° C. or lower. When the reaction temperature is too low, the acylation reaction proceeds slowly and the reaction time becomes long.
- the reaction time for the acylation reaction is not particularly limited, but is preferably 0.5 to 24 hours, and more preferably 0.5 to 12 hours.
- the compound (1) and the like produced by the acylation reaction can be post-treated by a known method as necessary after completion of the acylation reaction, and the target compound (1) and the like can be taken out by a known method. it can.
- post-treatment such as filtration, washing, extraction, pH adjustment, dehydration, concentration, etc. is performed alone or on the reaction solution obtained after the completion of the acylation reaction, or Two or more types can be used in combination.
- the target compound (1) and the like can be extracted from the post-treated product by concentration, crystallization, reprecipitation, column chromatography or the like.
- the taken out compound (1) and the like are further subjected to operations such as crystallization, reprecipitation, column chromatography, extraction, stirring and washing of crystals with a solvent, if necessary, or in combination of two or more. You may refine
- the compound (1) and the like produced by the acylation reaction can be used for the intended use without being taken out after the acylation reaction is completed, after the post-treatment of the obtained reaction liquid as necessary. It may be used continuously.
- the target object taken out by the above-described production method may be an internal salt in which an acid and a base are present in the molecule of the compound (1), or a part or all of the target product may be a compound (1). In some cases, acid and base are not present in the molecule of 1). Further, a part or all of the target product taken out by the above production method is formed of an anion (or cation) derived from the compound (1) and a cation (or anion) derived from a compound other than the compound (1). In some cases, it is a salt of the compound (1).
- the salt of compound (1) may be produced by the following method. That is, the compound (1) produced by the above acylation reaction is treated with an excess amount of acid or base to react the compound (1) etc. with the acid or base.
- the salt of the obtained compound (1) can be taken out by the same method as the compound (1) and the like described above.
- the salt of the compound (1) is obtained by removing the compound (1) and the like produced by the above-described production method, treating the removed compound (1) and the like with an excess amount of acid or base, and then treating the compound (1). And the like, and an acid or a base may be reacted. Also in this case, the obtained salt of the compound (1) can be taken out in the same manner as in the case of the compound (1) and the like.
- the compound (1) and its salt obtained in this embodiment are, for example, nuclear magnetic resonance spectroscopy (NMR), mass spectrometry (MS), infrared spectroscopy (IR), ultraviolet / visible spectroscopy (UV-).
- NMR nuclear magnetic resonance spectroscopy
- MS mass spectrometry
- IR infrared spectroscopy
- UV- ultraviolet / visible spectroscopy
- linear or branched saturated or unsaturated NMN is contained in a solvent containing 20% by mass or more of a strongly acidic liquid having a pKa of 2.0 or less.
- a strongly acidic liquid having a pKa of 2.0 or less Using at least one acylating agent selected from a carboxylic acid having a C 3-30 acyl group in which a hydrocarbon group is bonded to a carbonyl carbon, a halide of the carboxylic acid, and an anhydride of the carboxylic acid An acylation reaction is performed. For this reason, it is easily decomposed into NMN in the body, and has sufficient fat solubility and sufficient water solubility when used as a material for external preparations for skin, cosmetics, and food additives.
- a compound (1) etc. can be manufactured.
- NMN used as a raw material in this embodiment does not dissolve in a general organic solvent. For this reason, NMN hardly undergoes an acylation reaction under the general conditions for the acylation reaction of alcohol. Further, when heating is performed to dissolve NMN in an organic solvent, NMN is decomposed.
- a solvent containing 20% by mass or more of a strongly acidic liquid having a pKa of 2.0 or less is used. Accordingly, NMN can be efficiently acylated by dissolving NMN in a solvent without decomposing NMN.
- the skin external preparation of this embodiment contains the compound (1) of the embodiment described above or a salt thereof. Moreover, the cosmetic of this embodiment contains the skin external preparation of this embodiment. The skin external preparation of this embodiment can also be used as a cosmetic.
- the skin external preparations and cosmetics include shampoo, oil shampoo, cream shampoo, conditioning shampoo, dandruff shampoo, hair color shampoo, rinse integrated shampoo, rinse, treatment, hair pack, hair foam, hair mousse, hair Spray, hair mist, hair wax, hair gel, water grease, set lotion, color lotion, hair tonic, hair liquid, pomade, tic, hair cream, hair blow, split hair coat, hair oil, permanent wave agent, straight permanent agent, oxidative dyeing Hair, Hair Bleach, Hair Color Pretreatment, Hair Color After Treatment, Perm Pretreatment, Perm After Treatment, Hair Manicure, Education Cosmetics for hair such as facial cleansers, cleansing foams, washing powders, facial cleansing powders, cleansing creams, cleansing milks, cleansing lotions, cleansing gels, cleansing oils, cleansing masks, lotions, soft skin lotions, astringent lotions Lotion, multi-layer lotion, emulsion, emollient lotion, moisture lotion, milky lotion, nourishing lotion, nourishing milk, skin moisture, moisture emulsion, massage lotion, cleansing lotion, protect
- Cosmetics makeup cosmetics such as white powder, dusting powder, foundations, makeup base, lipstick, lip gloss, blusher, eyeliner, mascara, eye shadow, eyebrow, eyebrow, nail enamel, enamel remover, nail treatment; perfume Fragrance cosmetics such as perfume, perfume, eau de perfume, eau de toilette, eau de cologne, perfume, aromatic powder, perfume soap, body lotion, bath oil, etc .; body shampoo, body cleanser, body powder, deodorant lotion, deodorant powder, deodorant spray, Body cosmetics such as deodorant sticks, deodorant cosmetics, depigmenting agents, depilation / hair removal agents, bath preparations, insect repellent sprays, insectopelpers; ointments, patches, lotions, liniments, liquid coatings, etc. Exemplification Kill.
- Examples of the skin external preparation and cosmetic dosage forms include oil-in-water (O / W) type, water-in-oil (W / O) type, W / O / W type, and O / W / O type emulsified types; Emulsified polymer type; oily; solid; liquid; kneaded; stick; volatile oil; powder; jelly; gel; paste; cream; sheet; Examples include lamellar form; foam form; flake form and the like.
- the skin external preparation and cosmetic may contain at least one selected from the group consisting of compound (1) and salts thereof as essential components. Therefore, the external preparation for skin and cosmetics may contain the compound (1) and may not contain the salt of the compound (1), or may contain the salt of the compound (1) and the compound (1). What does not contain may be sufficient, and the thing containing both the salt of a compound (1) and a compound (1) may be sufficient.
- the compound (1) contained in the external preparation for skin and cosmetics may be only one kind, or two or more kinds. In the case of two or more types, the combination and ratio can be appropriately selected depending on the purpose.
- the salt of the compound (1) contained in the external preparation for skin and cosmetics may be one kind or two or more kinds. In the case of two or more types, the combination and ratio can be appropriately selected depending on the purpose.
- the above-mentioned external preparation for skin and cosmetics may contain other ingredients such as components usually used for external preparations for skin or cosmetics, as long as they do not impair the effects of the present invention.
- the component may be contained at a general concentration, for example, 100 ppm by mass to 90% by mass with respect to the total amount of the external preparation for skin or cosmetic.
- Examples of the components that are usually used in the external preparation for skin or cosmetics include ingredients such as raw materials described in existing raw material specifications or official documents, pharmaceutically acceptable carriers, additives, etc. as external preparations for skin. .
- ingredients such as raw materials described in existing raw material specifications or official documents, pharmaceutically acceptable carriers, additives, etc. as external preparations for skin.
- the 14th revised Japanese Pharmacopoeia edited by the Japan Standards Association, published by Jiho Co., Ltd., April 2001
- Cosmetic Raw Material Standards Second Edition published by Yakuji Nippo, 1984
- cosmetic ingredient non-standard ingredient standards supervised by the Pharmaceutical Affairs Bureau, Ministry of Health and Welfare, published by Yakuji Nippo, 1993
- cosmetic ingredient non-standard ingredient standards supplement Ministry of Health and Welfare
- Supervised by the Bureau of Public Affairs published by Yakuji Nippo, 1993
- Permitted by varieties of cosmetics Ministry of Health and Welfare, Division of Pharmacy, published by Yakuji Nippo, 1993
- Examples of the pharmaceutically acceptable ingredient as a skin external preparation include water, hydrocarbons, natural fats and oils, fatty acids, higher alcohols, alkyls described in JP-A-2012-236800, paragraphs 0018 to 0050.
- the total content (content of essential components) of the compound (1) and salts thereof is preferably 0.01 to 20% by mass, 0.05 to It is more preferably 12% by mass, and particularly preferably 0.1 to 10% by mass.
- the total content of the compound (1) and the salt thereof is not less than the above lower limit value, an anti-aging action by the compound (1) and the salt thereof can be easily obtained, and a more excellent effect as a skin external preparation or cosmetic can be obtained. It is done.
- excessive use of these components can be suppressed as the total content of the compound (1) and its salt is not more than the above upper limit.
- the dosage of the external preparation for skin varies depending on the patient's symptoms, weight, age, sex, etc., and cannot be determined unconditionally, but usually the dosage of the active ingredient (compound (1 ) And its total salt dose) is preferably in an amount of 0.4 to 400 mg / person.
- the external preparation for skin is administered in a predetermined amount once a day or divided into a plurality of times. Since the skin external preparation of this embodiment contains the compound (1) and its salt having high absorbability in the body, the dose of the active ingredient (the total dose of the compound (1) and its salt) is used as the active ingredient. This can be reduced compared to the case of using.
- the amount of the cosmetic of the present embodiment varies depending on the subject's symptoms, body weight, age, sex, etc., and cannot be determined unconditionally, but usually the amount of the active ingredient used per day for an adult (compound The total amount of (1) and its salt is preferably 0.4 to 400 mg / person.
- the cosmetic is used by dividing a predetermined amount once or a plurality of times a day. Since the cosmetic of the present embodiment contains the compound (1) having a high absorbability in the body and a salt thereof, the amount of the active ingredient used (the total amount of the compound (1) and the salt used) is determined as NMN as the active ingredient. Compared with the case of using, it can reduce.
- the said skin external preparation and cosmetics can be manufactured by mix
- the skin external preparation and cosmetics can be produced in the same manner as known skin external preparations and cosmetics, except that compound (1) or a salt thereof is blended.
- the skin external preparation and cosmetics of this embodiment are easily decomposed into NMN in the body, and contain a compound (1) and the like having excellent skin affinity and skin permeability and high absorbability in the body. Therefore, the skin external preparation and cosmetics of this embodiment can be expected to have a high anti-aging effect.
- the skin external preparation of this embodiment is a sebum control agent, a skin turnover normalizing agent, an anti-inflammatory agent, an anti-acne agent, an anti-skin roughening agent, a white hair inhibitor, a hair nourishing external preparation, an anti-aging agent, and the like.
- the external preparation for skin and cosmetics of this embodiment contain the compound (1) etc. which have sufficient fat solubility and water solubility, according to a use, various things, such as a water system, an emulsion system, solid, powder, and a tablet, are included. Can be in dosage form.
- the food additive of this embodiment contains the compound (1) of the embodiment described above or a salt thereof.
- the food additive of this embodiment should just contain 1 or more types chosen from the group which consists of a compound (1) and its salt as an essential component similarly to the skin external preparation and cosmetics of embodiment mentioned above. . Therefore, the said food additive may contain the compound (1), may not contain the salt of the compound (1), contains the salt of the compound (1), and contains the compound (1). It may not be present, or may contain both the compound (1) and the salt of the compound (1).
- the compound (1) contained in the food additive may be only one type or two or more types. In the case of two or more types, the combination and ratio can be appropriately selected depending on the purpose. Similarly, only 1 type may be sufficient as the salt of the compound (1) which the said food additive contains, and 2 or more types may be sufficient as it. In the case of two or more types, the combination and ratio can be appropriately selected depending on the purpose.
- the food additive may contain an optional component known in the art, if necessary, in addition to the compound (1) or a salt thereof.
- An arbitrary component is not specifically limited, According to the objective, it can select suitably.
- Arbitrary components may be used individually by 1 type and may use 2 or more types together. When using 2 or more types together, the combination and ratio can be suitably selected according to the objective.
- Content of the arbitrary component in the said food additive is not specifically limited, What is necessary is just to adjust suitably according to the objective.
- the total content of the food additive compound (1) and the salt thereof is not particularly limited and may be appropriately adjusted according to the purpose, but is usually 0.001 to 0.1. It is preferable that it is mass%.
- the amount of the food additive used in the present embodiment varies depending on the purpose and cannot be determined unconditionally. Usually, the amount of the active ingredient consumed per day per adult (the total amount of the compound (1) and its salt) Is preferably 10 to 1000 mg / person.
- the said food additive can be manufactured by the method similar to a well-known food additive except mix
- the food additive of the present embodiment is easily decomposed into NMN in the body, and contains a compound (1) having high absorbability in the body. Therefore, the food additive of this embodiment can be expected to have a high anti-aging effect. Moreover, since the food additive of this embodiment contains the compound (1) etc. which have sufficient fat solubility and water solubility, a tablet, a coated tablet, a pill, a powder, a granule similarly to a well-known food additive. And various dosage forms such as capsules, solutions, suspensions, emulsions and the like.
- ⁇ -nicotinamide mononucleotide ( ⁇ -NMN): Sigma-Aldrich Co. LLC.
- Trifluoroacetic acid (TFA): Tokyo Chemical Industry Co., Ltd.
- Sulfuric Acid Pure Chemical Co., Ltd.
- Palmitoyl Chloride (PaCl (CH 3 (CH 2 ) 14 COCl)): Tokyo Chemical Industry Co., Ltd.
- octanoyl chloride (OctCl (CH 3 (CH 2 ) 6 COCl)): Tokyo Chemical industry Co., Ltd. hexanoyl chloride (HexCl (CH 3 (CH 2 ) 4 COCl)): Tokyo Chemical Industry Co., Ltd. Palmitic acid (PaOH (CH 3 (CH 2 ) 14 COOH)): Tokyo Chemical Industry Co., Ltd. Acetic anhydride: Tokyo Chemical Industry Co., Ltd. Pyridine (dehydration): Wako Pure Chemical Industries, Ltd. Hexane: Wako Pure Chemical Industries, Ltd. Acetonitrile Co., Ltd .: Wako Pure Chemical Industries, Ltd. N, N-dimethylform Amide (dehydration) (DMF): Wako Pure Chemical Industries, Ltd.
- DMF N-dimethylform Amide
- the structure identification of the products was performed by NMR measurement.
- NMR measurement a sample obtained by dissolving about 15 mg of a sample to be measured in various heavy solvents was measured using “Avance III-400” manufactured by Bruker Biospin.
- TFA trifluoroacetic acid
- the reaction solution obtained after completion of the acylation reaction was concentrated to dryness as a post-treatment (removal of TFA), 20 mL of hexane and 20 mL of acetonitrile were added and stirred, and then the undissolved white solid was recovered by filtration ( (Removal of palmitic acid and residual TFA) 10 mL of water was added to the collected white solid and stirred, and the white solid remaining in the same manner was collected by filtration (removal of NMN).
- the recovered white solid (product) is purified by a combination of column chromatography (silica gel and ion exchange resin), so that the main component 3 ′ represented by the above general formula (3-1) is represented as the main component.
- -Palmitoyl- ⁇ -nicotinamide mononucleotide (3'-Palmitoyl- ⁇ -NMN) was obtained as a white solid (0.061 g, isolated yield 27%).
- Table 1 shows the acylating agent used in Example 1, the molar ratio of the acylating agent to NMN (acylating agent / NMN), the solvent, and the isolated yield of the main component.
- the structure of the target product was confirmed by performing various NMR measurements ( 1 H-NMR, 13 C-NMR, 13 C DEPT135, 1 H- 1 H-COSY). Further, from the chemical shift of the 1′-position proton of the sugar skeleton, it was confirmed that it was not epimerized, and it was found that the ⁇ -NMN structure was retained.
- the 1 H-NMR and 13 C-NMR data of the obtained 3′-Palmitoyl- ⁇ -NMN are shown below.
- TFA trifluoroacetic acid
- the reaction solution obtained after the completion of the acylation reaction is concentrated to dryness as a post-treatment (TFA removal), added with 20 mL of hexane, and washed 15 times with acetonitrile (30 mL) (disappearance of palmitic acid). Were determined by HPLC analysis condition 1), and the hexane layer was concentrated to obtain a white solid.
- the obtained white solid is purified by a combination of column chromatography (silica gel and ion exchange resin), so that 2 ′, 3 ′ represented by the above general formula (3-3), which is the target product, as a main component. Dipalmitoyl- ⁇ -nicotinamide mononucleotide (2 ′, 3′-Dipalmitoyyl- ⁇ -NMN) was obtained as a white solid (0.151 g, isolated yield 46%).
- Table 1 shows the acylating agent used in Example 2, the molar ratio of the acylating agent to NMN (acylating agent / NMN), the solvent, and the isolated yield of the main component.
- the structure of the target product was confirmed by performing various NMR measurements ( 1 H-NMR, 13 C-NMR, 13 C DEPT135, 1 H- 1 H-COSY). Further, from the chemical shift of the 1′-position proton of the sugar skeleton, it was confirmed that it was not epimerized, and it was found that the ⁇ -NMN structure was retained.
- the 1 H-NMR and 13 C-NMR data of the obtained 2 ′, 3′-Dipalmitoyyl- ⁇ -NMN are shown below.
- Example 1 As shown in Table 1, 3′-palmitoyl- ⁇ -NMN was obtained as a main product in Example 1 in which palmitoyl chloride as an acylating agent was used in a 2-fold molar amount with respect to NMN.
- Example 2 In Example 2 in which palmitoyl chloride was used in a 4-fold molar amount with respect to NMN, 2 ′, 3′-dipalmitoyl- ⁇ -NMN was obtained as a main product.
- Example 3 [Example 5] [Example 7]
- the acylation reaction was carried out in the same manner as in Example 1 except that the acylating agents shown in Table 1 were used, and the conversion rate and product yield were determined in the same manner as in Example 1. The results are shown in Table 1.
- the reaction solution obtained after the completion of the acylation reaction is post-treated in the same manner as in Example 1, and the post-treated product is combined with column chromatography (silica gel and ion exchange resin). By refine
- Table 1 shows the acylating agent used in Examples 3, 5 and 7, the molar ratio of acylating agent to NMN (acylating agent / NMN), solvent, and isolated yield of the main component.
- the structures of the target products of Examples 3, 5, and 7 were confirmed in the same manner as in Example 1. 1 H-NMR and 13 C-NMR data are shown below.
- Example 4 [Example 6] [Example 8]
- the acylation reaction was carried out in the same manner as in Example 2 except that the acylating agent shown in Table 1 was used, and the conversion rate and product yield were determined in the same manner as in Example 2. The results are shown in Table 1. Further, the reaction solution obtained after the completion of the acylation reaction is post-treated in the same manner as in Example 2, and the post-treated product is combined with column chromatography (silica gel and ion exchange resin). By refine
- Table 1 shows the acylating agent used in Examples 4, 6 and 8, the molar ratio of acylating agent to NMN (acylating agent / NMN), solvent, and isolated yield of the main component.
- the structures of the target products of Examples 4, 6, and 8 were confirmed in the same manner as in Example 1. 1 H-NMR and 13 C-NMR data are shown below.
- a 3′-acylated product, a 2′-acylated product, and a 2 ′, 3′-diacylated product are prepared by adjusting the amount of carboxylic acid chloride used as an acylating agent. It was possible to change the production ratio.
- NMN is acylated at a molar ratio of the acylating agent and NMN shown in Table 1 to give 3 '-Palmitoyl- ⁇ -NMN was obtained as the main product.
- nicotinamide which is a decomposition product of NMN
- Table 1 when N, N-dimethylformamide was used as a solvent, NMN acylated product was not obtained.
- ⁇ Skin permeability test> The compounds obtained in Examples 1 to 8 and Synthesis Example 1 as test substances and ⁇ -nicotinamide mononucleotide as Comparative Example 2 were dissolved in Dulbecco's PBS ( ⁇ ) solution, respectively. After adjusting the pH to 7.4 using an aqueous sodium hydroxide solution and / or hydrochloric acid, a sample solution having a concentration of 0.2% by mass was obtained.
- a three-dimensional cultured human skin model (“EPI-606X” manufactured by Kurabo Industries) (area 3.8 cm 2 ) was set in a 6-well plate containing PBS solution (1 mL) so that the lower part thereof was immersed. And it left still for 30 minutes in 37 degreeC and the conditions of a carbon dioxide concentration of 5% in an incubator.
- the PBS solution in the lower well of the skin model was replaced with HBSS ( ⁇ ) solution (Hanks solution) (1 mL) (hereinafter referred to as “receiver solution”), and the sample solution obtained above (700 ⁇ L) was administered on the skin model. And it was left still for 24 hours in an incubator on the conditions of 37 degreeC and a carbon dioxide concentration of 5%.
- the sample solution on the skin model was removed using a pipette, and then the skin model was taken out of the well and washed with a PBS ( ⁇ ) solution.
- a section of the skin model was cut out and placed in a 2 mL tube. Methanol (1 mL) and stainless steel beads (made by TOMY, diameter 5.5 mm) are added to this tube, and the section is crushed using MULTI BEADS SHOCKER (made by Yasui Kikai Co., Ltd.) at 2000 rpm, 10 seconds, 10 times. did.
- the resulting solution was transferred to a 2 mL Eppendorf tube, centrifuged at 12000 rpm for 5 minutes, and the supernatant was filtered with a filter (pore size 0.22 ⁇ m) to obtain a skin model extract.
- the test substance in the skin model extract and the receiver liquid was quantified under the above-described HPLC analysis condition 1 for each test substance.
- the total amount of the test substance absorbed by the skin model in each well was calculated.
- the quantitative value of the test substance in the receiver solution was defined as the amount of the test substance that passed through the skin model.
- the total value A ( ⁇ g) of the total amount of the test substance absorbed by the skin model and the test substance amount permeated through the skin model was calculated.
- permeation rate (%) to the skin model was calculated for each test substance administered to the skin model by the following formula (i).
- the acylated ⁇ -NMN derivative which was the compound obtained in Examples 1 to 8, had a higher permeability than the non-acylated ⁇ -NMN of Comparative Example 2.
- Examples 1 and 2 carbon number 16
- Examples 3 and 4 carbon number 12 in which the acyl group arranged in the sugar skeleton of NMN has a large number of carbon atoms. Then, the penetration rate was high.
- the acylated ⁇ -NMN derivative which is the compound obtained in Synthesis Example 1
- the compound according to the present invention has a remarkably high permeability among ⁇ -NMN derivatives and is extremely excellent as an active ingredient of a skin external preparation.
- the acylated ⁇ -NMN derivatives which are the compounds obtained in Examples 1 to 8, were all evaluated as “ ⁇ ” when 0.01 g / 100 mL, and had sufficient water solubility. It was confirmed that it had.
- Examples 3 and 4 carbon number 12
- Examples 5 and 6 carbon number 8 in which the acyl group in which the sugar skeleton of NMN is arranged have a small number of carbon atoms.
- Examples 7 and 8 carbon number 6
- all evaluations of 1 g / 100 mL, 0.1 g / 100 mL, and 0.01 g / 100 mL were “ ⁇ ”, and the water solubility was high.
- Example 10 Preparation of 2 ′, 3′-dipalmitoyl- ⁇ -NMN hydrochloride
- the 2 ′, 3′-dipalmitoyl- ⁇ -nicotinamide mononucleotide prepared in Example 2 was treated under reduced pressure to sufficiently remove moisture.
- the 2 ′, 3′-dipalmitoyl- ⁇ -nicotinamide mononucleotide (0.050 g, 0.062 mmol) after removal of moisture was subjected to 3 mL of hydrogen chloride (4 mol / L, 1,4- A dioxane solution (Tokyo Chemical Industry Co., Ltd.) was added and dissolved, and the mixture was stirred for 10 minutes.
- hydrogen chloride 4 mol / L, 1,4- A dioxane solution (Tokyo Chemical Industry Co., Ltd.) was added and dissolved, and the mixture was stirred for 10 minutes.
- the chloride ion concentration in the obtained 2 ′, 3′-dipalmitoyl- ⁇ -NMN hydrochloride was quantified by ion chromatography under the following conditions. As a result, it was confirmed that the NMN derivative became a cation and the anion (Cl ⁇ ) derived from hydrogen chloride formed a salt with a molar ratio of approximately 1: 1.
- Example 11 Preparation of 2 ′, 3′-dipalmitoyl- ⁇ -NMN sodium salt
- the 2 ′, 3′-dipalmitoyl- ⁇ -nicotinamide mononucleotide prepared in Example 2 was treated under reduced pressure to sufficiently remove water.
- 3 mL of methanol was added to 2 ′, 3′-dipalmitoyl- ⁇ -nicotinamide mononucleotide (0.050 g, 0.062 mmol) after removing water, and then 0.01 mol / L with stirring at room temperature.
- An aqueous sodium hydroxide solution (0.062 mmol, 6.2 mL, Junsei Chemical Co., Ltd.) was added and stirred for 10 minutes. Thereafter, the mixture was concentrated to dryness at room temperature to obtain 2 ′, 3′-dipalmitoyl- ⁇ -NMN sodium salt as a white solid (0.052 g, 0.062 mmol).
- the sodium ion concentration in the obtained 2 ′, 3′-dipalmitoyl- ⁇ -NMN sodium salt was quantified by ion chromatography under the following conditions. As a result, it was confirmed that the NMN derivative became an anion and the cation (Na + ) derived from sodium hydroxide formed a salt with a molar number of about 1: 1.
- Example 11 Using the 2 ′, 3′-dipalmitoyl- ⁇ -NMN sodium salt obtained in Example 11 as a test substance, a skin permeability test and a water solubility test were conducted in the same manner as in Example 1. The results of the skin permeability test are shown in Table 2. Table 3 shows the results of the water solubility test.
- Example 11 As shown in Table 2, the compound obtained in Example 11 (a salt of an acylated ⁇ -NMN derivative) had higher permeability than the non-acylated ⁇ -NMN of Comparative Example 2. Moreover, as shown in Table 3, the compound obtained in Example 11 was evaluated as “ ⁇ ” in the case of 0.01 g / 100 mL, and it was confirmed that the compound had sufficient water solubility.
Abstract
一般式(1)で表されるニコチンアミドモノヌクレオチド誘導体またはその塩。(式中、R1およびR2は、それぞれ独立に水素原子または炭素数3~30のアシル基。アシル基のカルボニル炭素に結合している炭化水素基は、直鎖状若しくは分岐鎖状の飽和または不飽和の炭化水素基。R1およびR2の少なくとも一方は前記アシル基。)
Description
本発明は、新規なニコチンアミドモノヌクレオチド誘導体、その塩、その製造方法、皮膚外用剤、化粧料、食品添加剤に関する。
本出願は、2015年12月21日に日本に出願された特願2015-249020に基づき優先権を主張し、その内容をここに援用する。
本出願は、2015年12月21日に日本に出願された特願2015-249020に基づき優先権を主張し、その内容をここに援用する。
ニコチンアミドモノヌクレオチド(以下、「NMN」と略記することがある。)は、補酵素であるニコチンアミドアデニンジヌクレオチド(NAD+)の中間代謝産物である。
NAD+は、全ての生物種に存在する電子伝達体である。NAD+については、近年、老化現象に関わるサーチュイン(NAD+依存性脱アセチル化酵素Sirt1、Sirt3)との関連が注目されている。細胞内のNAD+を増加させることで、老化現象の抑制が可能であると考えられている。
NAD+は、全ての生物種に存在する電子伝達体である。NAD+については、近年、老化現象に関わるサーチュイン(NAD+依存性脱アセチル化酵素Sirt1、Sirt3)との関連が注目されている。細胞内のNAD+を増加させることで、老化現象の抑制が可能であると考えられている。
NAD+の中間代謝産物であるNMNについても、NAD+と同様に、マウスへの投与実験において抗老化作用が見られる(例えば、非特許文献1参照。)。そこで、NMNの持つ抗老化作用を、皮膚外用剤、化粧料、食品添加剤などの用途に利用することが検討されている。
しかし、NMNは、高極性物質である。このため、NMNを皮膚外用剤の材料として使用しても、皮膚浸透性が不十分であり、十分な体内吸収性が得られない。NMNの皮膚浸透性を向上させる方法としては、NMNに親油性の官能基を導入する方法が考えられる。
例えば、非特許文献2には、親油性の官能基を有するNMN誘導体であるリン酸ジエステル型NMN誘導体の合成方法が提案されている。また、非特許文献2には、合成中間体として、NMNの2か所の水酸基をアセチル化したジアセチルNMNの合成例が示されている。
例えば、非特許文献2には、親油性の官能基を有するNMN誘導体であるリン酸ジエステル型NMN誘導体の合成方法が提案されている。また、非特許文献2には、合成中間体として、NMNの2か所の水酸基をアセチル化したジアセチルNMNの合成例が示されている。
Cell Metab.,14,528-536(2011)
Tetrahedron,65,8378-8383(2009)
しかしながら、従来のNMN誘導体は、十分な体内吸収性が得られるものではなかった。例えば、非特許文献2に記載されているジアセチルNMNは、アシル基の脂溶性が不十分であるため、十分な皮膚浸透性が得られず、体内吸収性が不十分であった。このため、NMN誘導体の体内吸収性を向上させることが要求されていた。
また、非特許文献2に記載のリン酸ジエステル型NMN誘導体は、皮膚吸収後に、抗老化作用の期待されるNMNへの変換が困難であるという問題があった。
また、NMN誘導体を皮膚外用剤、化粧料、食品添加剤の材料として利用する場合、水系,乳化系,固体,粉末,錠剤といった様々な剤型に対応できるように、十分な水溶性を有することが望ましい。
また、NMN誘導体を皮膚外用剤、化粧料、食品添加剤の材料として利用する場合、水系,乳化系,固体,粉末,錠剤といった様々な剤型に対応できるように、十分な水溶性を有することが望ましい。
本発明は、上記事情に鑑みてなされたものであり、体内で容易にNMNに分解され、十分な脂溶性および水溶性を有するNMN誘導体を提供することを課題とする。
本発明者らは、上記課題を解決するために、鋭意検討した。
その結果、NMNの糖骨格(フラノース環)に存在する2つの水酸基の一方または両方において、水酸基の水素原子に代えて炭素数3~30のアシル基を導入した新規NMN誘導体およびその塩の開発に成功した。そして、この新規NMN誘導体およびその塩が、体内で容易にNMNに分解されるものであり、十分な脂溶性を有するために優れた皮膚浸透性が得られ、高い体内吸収性を有する上、皮膚外用剤、化粧料、食品添加剤の材料として利用する場合に十分な水溶性を有することを確認し、本発明を完成するに至った。
すなわち、本発明は以下の構成を採用する。
その結果、NMNの糖骨格(フラノース環)に存在する2つの水酸基の一方または両方において、水酸基の水素原子に代えて炭素数3~30のアシル基を導入した新規NMN誘導体およびその塩の開発に成功した。そして、この新規NMN誘導体およびその塩が、体内で容易にNMNに分解されるものであり、十分な脂溶性を有するために優れた皮膚浸透性が得られ、高い体内吸収性を有する上、皮膚外用剤、化粧料、食品添加剤の材料として利用する場合に十分な水溶性を有することを確認し、本発明を完成するに至った。
すなわち、本発明は以下の構成を採用する。
[1] 一般式(1)で表される化合物であるニコチンアミドモノヌクレオチド誘導体またはその塩。
(式中、R1およびR2は、それぞれ独立に水素原子または炭素数3~30のアシル基であり、前記アシル基のカルボニル炭素に結合している炭化水素基は、直鎖状若しくは分岐鎖状の飽和または不飽和の炭化水素基であり、R1およびR2の少なくとも一方は、前記アシル基である。)
[2] 一般式(1)中におけるR1およびR2が、それぞれ独立に炭素数6~16のアシル基である[1]に記載のニコチンアミドモノヌクレオチド誘導体またはその塩。
[3] 一般式(1)の化合物の塩が、硝酸イオン、硫酸イオン、炭酸イオン、炭酸水素イオン、ハロゲンイオン、ギ酸イオン、酢酸イオン、クエン酸イオン、酒石酸イオン、シュウ酸イオン、フマル酸イオン、炭素数3~20の飽和または不飽和脂肪酸のアニオン、カルニチンおよびその誘導体のアニオン、ヒドロキシクエン酸およびその誘導体のアニオン、アスコルビン酸のアニオン、並びにアスコルビルリン酸およびその誘導体のアニオンからなる群より選ばれる1種以上のアニオンと共に形成された塩である、[1]または[2]に記載のニコチンアミドモノヌクレオチド誘導体またはその塩。
[4] 一般式(1)の化合物の塩が、ナトリウムイオン、カリウムイオン、カルシウムイオン、マグネシウムイオン、亜鉛イオン、アンモニウムイオン、カルニチンおよびその誘導体のカチオンからなる群より選ばれる1種以上のカチオンと共に形成された塩である、[1]または[2]に記載のニコチンアミドモノヌクレオチド誘導体またはその塩。
[5] ニコチンアミドモノヌクレオチドを、pKaが2.0以下の強酸性液体を20質量%以上含む溶媒中で、直鎖状若しくは分岐鎖状の飽和または不飽和の炭化水素基がカルボニル炭素に結合している炭素数3~30のアシル基を有するカルボン酸、前記カルボン酸のハロゲン化物、前記カルボン酸の無水物から選ばれる1種以上のアシル化剤を用いてアシル化反応させることを特徴とする[1]~[4]のいずれかに記載のニコチンアミドモノヌクレオチド誘導体またはその塩の製造方法。
[6] 前記強酸性液体が、トリフルオロ酢酸または硫酸である[5]に記載のニコチンアミドモノヌクレオチド誘導体またはその塩の製造方法。
[7] [1]~[4]のいずれかに記載のニコチンアミドモノヌクレオチド誘導体またはその塩を含有する皮膚外用剤。
[8] [7]に記載の皮膚外用剤を含有する化粧料。
[9] [1]~[4]のいずれかに記載のニコチンアミドモノヌクレオチド誘導体またはその塩を含有する食品添加剤。
[8] [7]に記載の皮膚外用剤を含有する化粧料。
[9] [1]~[4]のいずれかに記載のニコチンアミドモノヌクレオチド誘導体またはその塩を含有する食品添加剤。
本発明のNMN誘導体またはその塩は、体内で容易にNMNに分解されるものであり、十分な脂溶性および水溶性を有する。本発明のNMN誘導体またはその塩は、十分な脂溶性を有することにより高い体内吸収性が得られ、しかも体内に吸収された後、体内で容易にNMNに分解される。このため、例えば、皮膚外用剤、化粧料、食品添加剤の材料として用いた場合に、同じ質量のNMNを用いた場合と比べて、高い抗老化作用が期待できる。また、本発明のNMN誘導体またはその塩は、十分な脂溶性および水溶性を有する。このため、水系,乳化系,固体,粉末,錠剤といった様々な剤型の皮膚外用剤、化粧料、食品添加剤に利用できる。
以下、本発明のニコチンアミドモノヌクレオチド(NMN)誘導体またはその塩、およびその製造方法、皮膚外用剤、化粧料、食品添加剤について詳細に説明する。本発明は、以下に示す例のみに限定されるものではなく、請求項に記載の範囲内において様々な応用が可能である。
「1.NMN誘導体またはその塩」
(NMN誘導体)
本実施形態のNMN誘導体は、下記一般式(1)で表される化合物(以下、「化合物(1)」と略記することがある。)である。
(NMN誘導体)
本実施形態のNMN誘導体は、下記一般式(1)で表される化合物(以下、「化合物(1)」と略記することがある。)である。
(式中、R1およびR2は、それぞれ独立に水素原子または炭素数3~30のアシル基であり、前記アシル基のカルボニル炭素に結合している炭化水素基は、直鎖状若しくは分岐鎖状の飽和または不飽和の炭化水素基であり、R1およびR2の少なくとも一方は、前記アシル基である。)
本実施形態のNMN誘導体は、一般式(1)で表されるように分子内に酸と塩基が存在している分子内塩である。
一般式(1)中のR1およびR2の少なくとも一方は、前記アシル基である。すなわち、R1およびR2の両方が前記アシル基であるもの、R1が前記アシル基であってR2が水素原子であるもの、R1が水素原子であってR2が前記アシル基であるものが相当する。また、R1およびR2の両方が前記アシル基である場合、R1とR2は同じアシル基であってもよいし、異なるアシル基であってもよい。
一般式(1)中のR1およびR2は、それぞれ独立に水素原子または炭素数3~30のアシル基である。前記アシル基のカルボニル炭素に結合している炭化水素基(ヒドロカルビル基)は、炭素数2~29の飽和または不飽和の炭化水素基である。飽和または不飽和の炭化水素基は、直鎖状および分岐鎖状のいずれでもよい。
前記飽和炭化水素基(アルキル基)として、具体的には、エチル基、プロピル基、ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基、ウンデシル基、ドデシル基、トリデシル基、テトラデシル基、ペンタデシル基、ヘキサデシル基、ヘプタデシル基、オクタデシル基、ノナデシル基、イコシル基、ヘンイコシル基、ドコシル基、トリコシル基、テトラコシル基、ペンタコシル基、ヘキサコシル基、ヘプタコシル基、オクタコシル基、ノナコシル基等の、炭素数が2~29の直鎖状のアルキル基や、例えば、ヘキシルデシル基等の、前記直鎖状のアルキル基と同じ炭素数で分岐鎖状のアルキル基が例示できる。
前記不飽和炭化水素基としては、前記飽和炭化水素基として例示したアルキル基に含まれる炭素原子間の単結合(C-C)のうち1個以上が、不飽和結合(二重結合(C=C)または三重結合(C≡C))とされてなる基が例示できる。
前記不飽和炭化水素基において、不飽和結合の数は1個のみでもよいし、2個以上でもよい。不飽和結合の数が2個以上である場合、全ての不飽和結合が二重結合または三重結合であってもよいし、不飽和炭化水素基中に二重結合と三重結合とが混在していてもよい。前記不飽和炭化水素基において、不飽和結合の位置は特に限定されない。
前記不飽和炭化水素基において、不飽和結合の数は1個のみでもよいし、2個以上でもよい。不飽和結合の数が2個以上である場合、全ての不飽和結合が二重結合または三重結合であってもよいし、不飽和炭化水素基中に二重結合と三重結合とが混在していてもよい。前記不飽和炭化水素基において、不飽和結合の位置は特に限定されない。
前記不飽和炭化水素基は、不飽和結合の数が1~3個であることが好ましく、1または2個であることがより好ましい。また、前記不飽和炭化水素基は、不飽和結合として二重結合のみを有するものが好ましい。
前記不飽和炭化水素基としては、エテニル基、プロペニル基、ブテニル基、ペンテニル基、ヘキセニル基、ヘプテニル基、オクテニル基、ノネニル基、デセニル基、ウンデセニル基、ドデセニル基、トリデセニル基、テトラデセニル基、ペンタデセニル基、ヘキサデセニル基、ヘプタデセニル基、オクタデセニル基、ノナデセニル基、イコセニル基、ヘンイコセニル基、ドコセニル基、トリコセニル基、テトラコセニル基、ペンタコセニル基、ヘキサコセニル基、ヘプタコセニル基、オクタコセニル基、ノナコセニル基等の、炭素数が2~29の直鎖状のアルケニル基や、これら直鎖状のアルケニル基と同じ炭素数で分岐鎖状のアルケニル基が好ましい。
前記アシル基のカルボニル炭素に結合している前記炭化水素基は、原料の入手しやすさ及び製造コストの観点から、アルキル基またはアルケニル基であることが好ましい。
また、前記アシル基のカルボニル炭素に結合している前記炭化水素基は、原料の入手しやすさ及び製造コストの観点から、直鎖状であることが好ましい。
また、前記アシル基のカルボニル炭素に結合している前記炭化水素基は、原料の入手しやすさ及び製造コストの観点から、直鎖状であることが好ましい。
R1およびR2における前記アシル基の炭素数は、3~30であり、4~24であることが好ましく、5~20であることがより好ましく、6~16であることが特に好ましい。すなわち、前記アシル基のカルボニル炭素に結合している炭化水素基の炭素数は、2~29であり、3~23であることが好ましく、4~19であることがより好ましく、5~15であることが特に好ましい。
アシル基の炭素数が3以上(炭化水素基の炭素数が2以上)であると、脂溶性が十分に得られるため、高い体内吸収性が得られる。また、アシル基の炭素数が30以下(炭化水素基の炭素数が29以下)であると、十分な水溶性が得られる。
アシル基の炭素数が3以上(炭化水素基の炭素数が2以上)であると、脂溶性が十分に得られるため、高い体内吸収性が得られる。また、アシル基の炭素数が30以下(炭化水素基の炭素数が29以下)であると、十分な水溶性が得られる。
(NMN誘導体の塩)
本実施形態のNMN誘導体の塩(化合物(1)の塩)は、化合物(1)に由来するアニオン(またはカチオン)と、化合物(1)以外の化合物に由来するカチオン(またはアニオン)とで形成されている化合物である。
化合物(1)の塩としては、化合物(1)と、酸または塩基とが反応して形成された塩が挙げられる。このような塩は、化合物(1)がカチオンとなってアニオンと共に形成された塩であってもよいし、化合物(1)がアニオンとなってカチオンと共に形成された塩であってもよい。
本実施形態のNMN誘導体の塩(化合物(1)の塩)は、化合物(1)に由来するアニオン(またはカチオン)と、化合物(1)以外の化合物に由来するカチオン(またはアニオン)とで形成されている化合物である。
化合物(1)の塩としては、化合物(1)と、酸または塩基とが反応して形成された塩が挙げられる。このような塩は、化合物(1)がカチオンとなってアニオンと共に形成された塩であってもよいし、化合物(1)がアニオンとなってカチオンと共に形成された塩であってもよい。
化合物(1)でカチオン部となり得る部位としては、ピリジン環の窒素原子と、「-NH2」で表されるアミノ基の窒素原子に水素イオン(H+)が配位したもの(-NH3
+)とが例示できる。
一方、化合物(1)でアニオン部となり得る部位としては、リン酸基が例示できる。
一方、化合物(1)でアニオン部となり得る部位としては、リン酸基が例示できる。
また、一分子の化合物(1)の塩を構成するカチオンおよびアニオンは、いずれも1個のみでもよいし、2個以上でもよい。カチオンおよびアニオンが2個以上である場合、これらカチオンまたはアニオンは、すべて同じであってもよいし、すべて異なっていてもよく、一部のみ同じであってもよい。
化合物(1)の塩は、分子全体として電気的に中性、すなわち、一分子の化合物(1)の塩に含まれるカチオンの価数の合計値とアニオンの価数の合計値とが、同じであることが好ましい。
化合物(1)の塩は、分子全体として電気的に中性、すなわち、一分子の化合物(1)の塩に含まれるカチオンの価数の合計値とアニオンの価数の合計値とが、同じであることが好ましい。
化合物(1)がカチオンになったものと共に、化合物(1)の塩を形成するアニオンは、無機アニオンであってもよいし、有機アニオンであってもよい。また、無機アニオンおよび有機アニオンの価数は、特に限定されず、例えば、1価でもよいし2価以上でもよい。
好ましい無機アニオンとしては、硝酸イオン、硫酸イオン、炭酸イオン、炭酸水素イオン、ハロゲンイオン等が例示できる。前記ハロゲンイオンとしては、フッ化物イオン、塩化物イオン、臭化物イオン、ヨウ化物イオン等が例示できる。
好ましい無機アニオンとしては、硝酸イオン、硫酸イオン、炭酸イオン、炭酸水素イオン、ハロゲンイオン等が例示できる。前記ハロゲンイオンとしては、フッ化物イオン、塩化物イオン、臭化物イオン、ヨウ化物イオン等が例示できる。
好ましい有機アニオンとしては、カルボン酸のアニオン、カルニチンおよびその誘導体のアニオン、ヒドロキシクエン酸およびその誘導体のアニオン、アスコルビン酸のアニオン、アスコルビルリン酸およびその誘導体のアニオン等が例示できる。
前記カルボン酸のアニオンは、モノカルボン酸(1価カルボン酸)のアニオンでもよいし、ジカルボン酸、トリカルボン酸等の多価カルボン酸のアニオンでもよい。
前記カルボン酸のアニオンは、モノカルボン酸(1価カルボン酸)のアニオンでもよいし、ジカルボン酸、トリカルボン酸等の多価カルボン酸のアニオンでもよい。
前記カルボン酸のアニオンとしては、ギ酸イオン、酢酸イオン、プロパン酸(プロピオン酸)イオン、ブタン酸(酪酸)イオン、ペンタン酸(吉草酸)イオン、ヘキサン酸(カプロン酸)イオン、ヘプタン酸(エナント酸)イオン、オクタン酸(カプリル酸)イオン、ノナン酸(ペラルゴン酸)イオン、デカン酸(カプリン酸)イオン、ドデカン酸(ラウリン酸)イオン、テトラデカン酸(ミリスチン酸)イオン、ペンタデカン酸イオン、ヘキサデカン酸(パルミチン酸)イオン、ヘプタデカン酸イオン、オクタデカン酸(ステアリン酸)イオン、エイコサン酸(アラキジン酸)イオン、cis-9-オクタデセン酸(オレイン酸)イオン、cis,cis-9,12-オクタデカジエン酸(リノール酸)イオン、cis,cis,cis-9,12,15-オクタデカトリエン酸(α-リノレン酸)イオン、all-cis-6,9,12-オクタデカトリエン酸(γ-リノレン酸)イオン、(5Z,8Z,11Z,14Z)-イコサ-5,8,11,14-テトラエン酸(アラキドン酸)イオン等の飽和または不飽和の脂肪酸のアニオン、シュウ酸イオン、マロン酸イオン、コハク酸イオン、グルタル酸イオン、アジピン酸イオン、フマル酸イオン、マレイン酸イオン等の飽和または不飽和ジカルボン酸のアニオン、クエン酸イオン、酒石酸イオン、ヒドロキシクエン酸イオン等のヒドロキシ酸のアニオン等が例示できる。
なお、本明細書において「脂肪酸」とは、特に断りのない限り、モノカルボン酸のうち、鎖状構造を有するものを意味する。
上述の飽和または不飽和の脂肪酸のアニオンは、炭素数が2~25であることが好ましく、3~20であることがより好ましい。また、不飽和の脂肪酸のアニオンは、不飽和結合を1~4個有するものが好ましい。
上述の飽和または不飽和の脂肪酸のアニオンは、炭素数が2~25であることが好ましく、3~20であることがより好ましい。また、不飽和の脂肪酸のアニオンは、不飽和結合を1~4個有するものが好ましい。
上述の飽和または不飽和ジカルボン酸のアニオンは、炭素数が2~6であることが好ましく、2~4であることがより好ましい。また、炭素数2以上の不飽和ジカルボン酸のアニオンは、不飽和結合を1個有するものが好ましい。
上記の化合物(1)がカチオンになったものと共に、化合物(1)の塩を形成するアニオンの中でも特に、硝酸イオン、硫酸イオン、炭酸イオン、炭酸水素イオン、ハロゲンイオン、ギ酸イオン、酢酸イオン、クエン酸イオン、酒石酸イオン、シュウ酸イオン、フマル酸イオン、炭素数3~20の飽和または不飽和の脂肪酸のアニオン、カルニチンおよびその誘導体のアニオン、ヒドロキシクエン酸およびその誘導体のアニオン、アスコルビン酸のアニオン、並びにアスコルビルリン酸およびその誘導体のアニオンからなる群より選ばれる1種以上のアニオンであることが好ましい。
化合物(1)がアニオンになったものと共に、化合物(1)の塩を形成するカチオンは、無機カチオンであってもよいし、有機カチオンであってもよい。また、無機カチオンおよび有機カチオンの価数は、特に限定されず、例えば、1価でもよいし2価以上でもよい。
好ましい無機カチオンとしては、ナトリウムイオン、カリウムイオン、カルシウムイオン、マグネシウムイオン、リチウムイオン、バリウムイオン、アルミニウムイオン、亜鉛イオン、銅イオン(Cu+、Cu2+)、鉄イオン(Fe2+、Fe3+)、マンガンイオン、ニッケルイオン、スズイオン(Sn2+、Sn4+)、アンモニウムイオン等が例示できる。
好ましい有機カチオンとしては、カルニチン、およびカルニチン誘導体のカチオン等が例示できる。
好ましい有機カチオンとしては、カルニチン、およびカルニチン誘導体のカチオン等が例示できる。
上記の化合物(1)がアニオンになったものと共に、化合物(1)の塩を形成するカチオンの中でも特に、ナトリウムイオン、カリウムイオン、カルシウムイオン、マグネシウムイオン、亜鉛イオン、アンモニウムイオン、カルニチン、およびカルニチン誘導体のカチオンからなる群より選ばれる1種以上のカチオンであることが好ましい。
本実施形態の化合物(1)および化合物(1)の塩は単独で存在していてもよいし、化合物(1)と化合物(1)の塩とが混在した状態で存在していてもよい。
また、化合物(1)には、その分子中に不斉原子が存在するなど、複数の立体異性体が存在する。すなわち、本実施形態の化合物(1)およびその塩(以下、これら化合物を包括して「化合物(1)等」と略記することがある。)には、これらすべての立体異性体が包含される。具体的には、化合物(1)等は、立体異性体であるα体のみ、またはβ体のみであってもよいし、α体とβ体の混合物であってもよい。
また、化合物(1)には、その分子中に不斉原子が存在するなど、複数の立体異性体が存在する。すなわち、本実施形態の化合物(1)およびその塩(以下、これら化合物を包括して「化合物(1)等」と略記することがある。)には、これらすべての立体異性体が包含される。具体的には、化合物(1)等は、立体異性体であるα体のみ、またはβ体のみであってもよいし、α体とβ体の混合物であってもよい。
本実施形態の化合物(1)等は、一般式(1)中のR1およびR2の少なくとも一方が、炭素数3以上のアシル基であることにより、適度な脂溶性を有している。このため、化合物(1)等は、NMN、従来のNMN誘導体およびこれらの塩よりも、皮膚親和性および皮膚浸透性に優れ、体内吸収性(経皮吸収性)が高い。しかも、本実施形態の化合物(1)等は、体内に吸収された後、体内での生体酵素反応により容易に分解されて、抗老化作用の期待されるNMNとなる。したがって、例えば、化合物(1)等を含む皮膚外用剤、化粧料は、NMN、従来のNMN誘導体およびこれらの塩を含む場合と比較して、皮膚組織にまで到達するNMNの量が顕著に多いものとなる。
また、化合物(1)等は、十分な脂溶性を有するにもかかわらず、一般式(1)中のR1およびR2の少なくとも一方が、炭素数30以下のアシル基であることにより、例えば、皮膚外用剤、化粧料、食品添加剤の材料として利用する場合に十分な水溶性を有している。このため、化合物(1)等は、取り扱い性に優れ、皮膚外用剤、化粧料、食品添加剤への配合が容易であり、水系,乳化系,固体,粉末,錠剤といった様々な剤型の皮膚外用剤、化粧料、食品添加剤に利用できる。よって、化合物(1)等は、皮膚外用剤、化粧料、食品添加剤の材料として有用である。
「2.NMN誘導体またはその塩の製造方法」
本実施形態の化合物(1)等の製造方法では、NMNを、pKaが2.0以下の強酸性液体を20質量%以上含む溶媒中で、アシル化剤を用いてアシル化反応させる。
本実施形態において、原料として用いるNMNは、立体異性体であるα体のみ、またはβ体のみであってもよいし、α体とβ体の混合物であってもよい。
本実施形態の化合物(1)等の製造方法では、NMNを、pKaが2.0以下の強酸性液体を20質量%以上含む溶媒中で、アシル化剤を用いてアシル化反応させる。
本実施形態において、原料として用いるNMNは、立体異性体であるα体のみ、またはβ体のみであってもよいし、α体とβ体の混合物であってもよい。
本実施形態では、溶媒として、pKaが2.0以下の強酸性液体を20質量%以上含むものを用いる。強酸性液体としては、25℃において液体である溶媒を用いる。硫酸等の多価の酸においては、複数のpKa値を持ちうる。溶媒が複数のpKa値を持つ場合、本発明では最も低いpKa値を採用する。
ここでpKaについて詳しく説明する。
酸解離定数pKaとは、酸の解離度を示すパラメーターである。酸の電離定数をKaとすると、pKa=-log10Kaで定義される。pKaの値が小さいほど、酸として強いことを意味する。pKaは、電位滴定法、紫外可視分光法、核磁気共鳴分光法などを用いて通常25℃の水中で測定される。
酸解離定数pKaとは、酸の解離度を示すパラメーターである。酸の電離定数をKaとすると、pKa=-log10Kaで定義される。pKaの値が小さいほど、酸として強いことを意味する。pKaは、電位滴定法、紫外可視分光法、核磁気共鳴分光法などを用いて通常25℃の水中で測定される。
しかし、塩酸や硫酸などの非常に強い酸のpKaは、水中では溶媒による水平化効果のために正確に測定できない。水平化効果とは、オキソニウムイオン(H3O+、pKa=-1.7)よりも強い酸を水中で測定しようとしても、酸は水と完全に反応して、オキソニウムイオンとしての酸の強さを反映してしまうため、見かけ上、酸の強弱がなくなる現象である。したがって、非常に強い酸の強弱を比較するためには、水よりもプロトン供与能の高い酢酸、ジメチルスルホキシド、アセトニトリルなどの有機溶媒中で測定したpKa値を比較するか、ハメットの酸度関数の値を比較する必要がある。塩酸や硫酸などの水中でのpKa値が文献等で示されていることがあるが、これらは有機溶媒中で測定した結果に基づいて、水中での値に換算した推算値である。
本実施形態におけるpKaが2.0以下の強酸性液体とは、水中でのpKaが2.0以下の液体のことである。本実施形態において、pKaが2.0以下の液体に該当するのは、水中でのpKaの実測値が2.0以下であったもの、酸性が強すぎて水中では測定できないもの、有機溶媒中での測定結果から換算した水中でのpKaが2.0以下であるものである。
本実施形態では、強酸性液体のpKaが2.0以下であるので、溶媒中にNMNを十分に溶解させることができる。その結果、NMNを効率よくアシル化反応でき、高い収率で化合物(1)等が得られる。強酸性液体のpKaは、好ましくは1.5以下であり、より好ましくは1.0以下である。
pKaが2.0以下の強酸性液体として、具体的には、トリフルオロ酢酸、ジフルオロ酢酸、ジクロロ酢酸、ペンタフルオロプロピオン酸、ヘプタフルオロ酪酸、パーフルオロペンタン酸、パーフルオロヘキサン酸、硫酸、メタンスルホン酸、エタンスルホン酸、トリフルオロメタンスルホン酸等が例示できる。これらの中でコストの観点から、トリフルオロ酢酸、硫酸、メタンスルホン酸、トリフルオロメタンスルホン酸を用いることが好ましい。
前記強酸性液体は、1種を単独で用いてもよいし、2種以上の強酸性液体を組み合わせて用いてもよい。2種以上を併用する場合には、その組み合わせおよび比率は、目的に応じて適宜選択できる。
本実施形態では、溶媒として、強酸性液体と、その他の有機溶媒とを混合したものを用いてもよい。強酸性液体と混合する有機溶媒は、NMNと反応せず、酸で分解しないものであれば、特に限定されない。これら有機溶媒として、具体的には、ジクロロメタン、クロロホルム、1,2-ジクロロエタン、トルエン、ベンゼン、ジメチルスルホキシド、N,N-ジメチルホルムアミド、アセトニトリル等が例示できる。
溶媒中の強酸性液体の比率は、20質量%~100質量%である。溶媒中の強酸性液体の含有量が20質量%以上であると、溶媒中にNMNを十分に溶解させることができるので、NMNを効率よくアシル化反応でき、高い収率で化合物(1)等が得られる。NMNの溶解性の観点から溶媒中の強酸性液体の含有量は、50質量%~100質量%が好ましく、さらに好ましくは80質量%~100質量%である。溶媒中の強酸性液体の含有量が100質量%であるとは、強酸性液体自体を溶媒として用いることを意味する。
原料であるNMNの使用量に対する溶媒の使用量は特に限定されず、NMNの溶媒に対する溶解性や、反応液の撹拌性等を考慮して、適宜選択すればよい。
原料であるNMNの使用量に対する溶媒の使用量は特に限定されず、NMNの溶媒に対する溶解性や、反応液の撹拌性等を考慮して、適宜選択すればよい。
本実施形態では、アシル化剤として、直鎖状若しくは分岐鎖状の飽和または不飽和の炭化水素基がカルボニル炭素に結合している炭素数3~30のアシル基を有するカルボン酸、前記カルボン酸のハロゲン化物、前記カルボン酸の無水物を用いる。アシル化剤として、前記カルボン酸のハロゲン化物を用いる場合、塩化物または臭化物を用いることが好ましい。
アシル化剤としては、上記の中でも特に、高い収率が得られるため、パルミトイルクロリド(CH3(CH2)14COCl)、ラウロイルクロリド(CH3(CH2)10COCl)、オクタノイルクロリド(CH3(CH2)6COCl)、ヘキサノイルクロリド(CH3(CH2)4COCl)などのカルボン酸塩化物(酸クロリド)を用いることが好ましい。
これらのアシル化剤は、1種を単独で用いてもよいし、2種以上を組み合わせて用いてもよい。アシル化剤として、2種以上を併用する場合には、その組み合わせおよび比率は、目的に応じて適宜選択できる。
これらのアシル化剤は、1種を単独で用いてもよいし、2種以上を組み合わせて用いてもよい。アシル化剤として、2種以上を併用する場合には、その組み合わせおよび比率は、目的に応じて適宜選択できる。
原料であるNMNの使用量に対するアシル化剤の使用量は、目的とする生成物の種類(アシル化剤の種類)、溶媒の種類などに応じて適宜調節することが好ましい。NMNの糖骨格(フラノース環)に存在する2つの水酸基は、3´位と2´位とに配置されている。本実施形態の方法を用いてNMNをアシル化すると、糖骨格の3´位の水酸基がアシル化された化合物と、2´位の水酸基がアシル化された化合物と、3´位および2´位の水酸基がアシル化された化合物とが生成する。本実施形態では、NMNの使用量に対するアシル化剤の使用量を調節することで、以下に示すように、これらの生成比率を変化させることができる。
NMNの糖骨格の2´位の水酸基と3´位の水酸基とでは、アシル化反応の反応性が異なっている。3´位の水酸基は、2´位の水酸基よりも、アシル化反応の反応性が高い。このため、NMNに対するアシル化剤の使用量が少ないと、糖骨格の3´位の水酸基のみがアシル化された生成物(化合物(1)において、R1がアシル基であり、R2が水素原子であるもの)が生成しやすくなる。また、NMNに対するアシル化剤の使用量が多いと、糖骨格の3´位だけでなく2´位の水酸基もアシル化された生成物(化合物(1)において、R1およびR2がアシル基であるもの)が生成しやすくなる。また、NMNに対するアシル化剤の使用量に関わらず、糖骨格の2´位の水酸基のみがアシル化された生成物(化合物(1)において、R1が水素原子であり、R2がアシル基であるもの)が最も多く生成されることはない。
具体的には、例えばアシル化剤として、酸クロリドを用い、溶媒としてトリフルオロ酢酸を用いる場合、酸クロリドをNMNに対して0.5~2倍モル量用いると、糖骨格の3´位の水酸基のみがアシル化された生成物が最も多く生成する。また、酸クロリドをNMNに対して2.5倍モル量以上用いると、糖骨格の2´位および3´位の水酸基が両方ともアシル化された生成物が最も多く生成する。
また、糖骨格の2´位と3´位の水酸基の反応性の違いを利用することで、化合物(1)等におけるR1とR2に異なる種類のアシル基を導入することも可能である。すなわち、最初に、NMNに対して少ない使用量のアシル化剤で糖骨格3´位の水酸基をアシル化する。その後、異なる種類のアシル化剤を加えて、糖骨格のアシル化されていない水酸基をアシル化する。このことにより、R1とR2に異なる種類のアシル基が導入された化合物(1)等が生成する。この場合、最初に使用するアシル化剤の使用量は、アシル反応の進行度をモニタリングしながら適宜調節することが好ましい。
アシル化反応の反応温度については、特に限定されないが、-20℃~50℃であることが好ましく、さらに好ましくは0℃~30℃である。NMNは、加熱により分解しやすい化合物であるため、アシル化反応の反応温度を50℃以下とすることが好ましい。反応温度が低すぎると、アシル化反応の進行が遅くなり、反応時間が長くなるため、-20℃以上とすることが好ましい。
また、アシル化反応の反応時間は、特に限定されないが、0.5~24時間であることが好ましく、0.5~12時間であることがより好ましい。
また、アシル化反応の反応時間は、特に限定されないが、0.5~24時間であることが好ましく、0.5~12時間であることがより好ましい。
アシル化反応により生成した化合物(1)等は、アシル化反応の終了後、必要に応じて公知の手法によって後処理を行い、目的物である化合物(1)等を公知の手法によって取り出すことができる。
アシル化反応の終了後の後処理としては、アシル化反応の終了後に得られた反応液に対して、ろ過、洗浄、抽出、pH調整、脱水、濃縮等の後処理をいずれか単独で、または2種以上組み合わせて行うことができる。また、濃縮、結晶化、再沈殿、カラムクロマトグラフィー等により、後処理後の生成物から目的物である化合物(1)等を取り出すことができる。
アシル化反応の終了後の後処理としては、アシル化反応の終了後に得られた反応液に対して、ろ過、洗浄、抽出、pH調整、脱水、濃縮等の後処理をいずれか単独で、または2種以上組み合わせて行うことができる。また、濃縮、結晶化、再沈殿、カラムクロマトグラフィー等により、後処理後の生成物から目的物である化合物(1)等を取り出すことができる。
取り出した化合物(1)等は、さらに必要に応じて、結晶化、再沈殿、カラムクロマトグラフィー、抽出、溶媒による結晶の撹拌洗浄等の操作をいずれか単独で、または2種以上組み合わせて1回以上行うことで、精製してもよい。
また、アシル化反応により生成した化合物(1)等は、アシル化反応の終了後、得られた反応液に対して必要に応じて後処理を行った後、取り出すことなく、目的とする用途に引き続き用いてもよい。
なお、上述の製造方法により取り出した目的物は、全部が、化合物(1)の分子内に酸と塩基が存在している分子内塩である場合もあるし、一部または全部が、化合物(1)の分子内に酸および塩基が存在していないものである場合もある。また、上述の製造方法により取り出した目的物の一部または全部が、化合物(1)に由来するアニオン(またはカチオン)と、化合物(1)以外の化合物に由来するカチオン(またはアニオン)とで形成されている化合物(1)の塩である場合もある。
なお、上述の製造方法により取り出した目的物は、全部が、化合物(1)の分子内に酸と塩基が存在している分子内塩である場合もあるし、一部または全部が、化合物(1)の分子内に酸および塩基が存在していないものである場合もある。また、上述の製造方法により取り出した目的物の一部または全部が、化合物(1)に由来するアニオン(またはカチオン)と、化合物(1)以外の化合物に由来するカチオン(またはアニオン)とで形成されている化合物(1)の塩である場合もある。
また、化合物(1)の塩は、以下に示す方法により製造してもよい。すなわち、上述のアシル化反応により生成した化合物(1)等を過剰量の酸または塩基で処理して、化合物(1)等と、酸または塩基とを反応させる。得られた化合物(1)の塩は、上述した化合物(1)等と同じ方法で取り出すことができる。
また、化合物(1)の塩は、上述の製造方法により生成した化合物(1)等を取り出した後、取り出した化合物(1)等を過剰量の酸または塩基で処理して、化合物(1)等と、酸または塩基とを反応させることにより製造してもよい。この場合も、得られた化合物(1)の塩は、化合物(1)等の場合と同じ方法で取り出すことができる。
本実施形態において得られた化合物(1)およびその塩は、例えば、核磁気共鳴分光法(NMR)、質量分析法(MS)、赤外分光法(IR)、紫外・可視分光法(UV-VIS吸収スペクトル)等、公知の手法で構造を確認できる。
本実施形態の化合物(1)等の製造方法では、NMNを、pKaが2.0以下の強酸性液体を20質量%以上含む溶媒中で、直鎖状若しくは分岐鎖状の飽和または不飽和の炭化水素基がカルボニル炭素に結合している炭素数3~30のアシル基を有するカルボン酸、前記カルボン酸のハロゲン化物、前記カルボン酸の無水物から選ばれる1種以上のアシル化剤を用いてアシル化反応させる。このため、体内で容易にNMNに分解されるものであり、十分な脂溶性と、皮膚外用剤、化粧料、食品添加剤の材料として利用する場合に十分な水溶性とを有する本実施形態の化合物(1)等を製造できる。
一般的に、アルコールのアシル化反応を行う場合には、アルコールをジクロロメタン、トルエン、N,N-ジメチルホルムアミド等の有機溶媒に溶解させて、トリエチルアミン、ピリジン、N-メチルモルホリン、4-ジメチルアミノピリジン等の塩基存在下で、カルボン酸塩化物またはカルボン酸無水物と反応させている。
本実施形態において原料として用いるNMNは、一般的な有機溶媒には溶解しない。このため、NMNは、アルコールのアシル化反応を行う場合の一般的な条件では、ほとんどアシル化反応しない。また、NMNを有機溶媒に溶解させるために加熱すると、NMNが分解してしまう。
本実施形態において原料として用いるNMNは、一般的な有機溶媒には溶解しない。このため、NMNは、アルコールのアシル化反応を行う場合の一般的な条件では、ほとんどアシル化反応しない。また、NMNを有機溶媒に溶解させるために加熱すると、NMNが分解してしまう。
これに対して、本実施形態の製造方法では、溶媒として、pKaが2.0以下の強酸性液体を20質量%以上含むものを用いる。したがって、NMNを分解させることなく、NMNを溶媒中に溶解させて、効率よくNMNをアシル化反応させることができる。
「3.皮膚外用剤、化粧料」
本実施形態の皮膚外用剤は、上述した実施形態の化合物(1)またはその塩を含有する。また、本実施形態の化粧料は、本実施形態の皮膚外用剤を含有する。本実施形態の皮膚外用剤は、化粧料として用いることもできる。
本実施形態の皮膚外用剤は、上述した実施形態の化合物(1)またはその塩を含有する。また、本実施形態の化粧料は、本実施形態の皮膚外用剤を含有する。本実施形態の皮膚外用剤は、化粧料として用いることもできる。
前記皮膚外用剤および化粧料の種類としては、シャンプー、オイルシャンプー、クリームシャンプー、コンディショニングシャンプー、ふけ用シャンプー、ヘアカラー用シャンプー、リンス一体型シャンプー、リンス、トリートメント、ヘアパック、ヘアフォーム、ヘアムース、ヘアスプレー、ヘアミスト、ヘアワックス、ヘアジェル、ウォーターグリース、セットローション、カラーローション、ヘアトニック、ヘアリキッド、ポマード、チック、ヘアクリーム、ヘアブロー、枝毛コート、ヘアオイル、パーマネントウェーブ用剤、ストレートパーマ剤、酸化染毛剤、ヘアブリーチ、ヘアカラープレトリートメント、ヘアカラーアフタートリートメント、パーマプレトリートメント、パーマアフタートリートメント、ヘアマニキュア、育毛剤等の毛髪用化粧料;洗顔料、クレンジングフォーム、洗粉、洗顔パウダー、クレンジングクリーム、クレンジングミルク、クレンジングローション、クレンジングジェル、クレンジングオイル、クレンジングマスク、化粧水、柔軟化粧水、収れん化粧水、洗浄用化粧水、多層式化粧水、乳液、エモリエントローション、モイスチャーローション、ミルキィーローション、ナリシングローション、ナリシングミルク、スキンモイスチャー、モイスチャーエマルション、マッサージローション、クレンジングローション、プロテクトエマルション、サンプロテクト、サンプロテクター、UVケアミルク、サンスクリーン、メーキャップローション、角質スムーザー、エルボーローション、ハンドローション、ボディローション、クリーム、エモリエントクリーム、栄養クリーム、ナリシングクリーム、バニシングクリーム、モイスチャークリーム、ナイトクリーム、マッサージクリーム、クレンジングクリーム、メーキャップクリーム、ベースクリーム、プレメーキャップクリーム、サンスクリーンクリーム、サンタンクリーム、除毛クリーム、デオドラントクリーム、シェービングクリーム、角質軟化クリーム、ジェル、クレンジングジェル、モイスチャージェル、石鹸、化粧石鹸、透明石鹸、薬用石鹸、液状石鹸、ひげそり石鹸、合成化粧石鹸、パック、マスク、ピールオフパック、粉末パック、ウォッシングパック、オイルパック、クレンジングマスク、エッセンス、保湿エッセンス、美白エッセンス、紫外線防止エッセンス、リポソーム美容液、リポソーム化粧水等の基礎化粧料;白粉・打粉類、ファンデーション類、化粧下地、口紅類、リップグロス、頬紅類、アイライナー、マスカラ、アイシャドー、眉墨、アイブロー、ネイルエナメル、エナメルリムーバー、ネイルトリートメント等のメーキャップ化粧料;香水、パフューム、パルファム、オードパルファム、オードトワレ、オーデコロン、練香水、芳香パウダー、香水石鹸、ボディローション、バスオイル等の芳香化粧料;ボディシャンプー、ボディ洗浄料、ボディーパウダー、デオドラントローション、デオドラントパウダー、デオドラントスプレー、デオドラントスティック、防臭化粧料、脱色剤、脱毛・除毛剤、浴用剤、虫よけスプレー、インセクトリペラー等のボディ化粧料;軟膏剤、貼付剤、ローション剤、リニメント剤、液状塗布剤等が例示できる。
前記皮膚外用剤および化粧料の剤型としては、水中油(O/W)型、油中水(W/O)型、W/O/W型、O/W/O型等の乳化型;乳化高分子型;油性;固形;液状;練状;スティック状;揮発性油型;粉状;ゼリー状;ジェル状;ペースト状;クリーム状;シート状;フィルム状;ミスト状;スプレー型;多層状;泡状;フレーク状等が例示できる。
前記皮膚外用剤および化粧料は、必須成分として化合物(1)およびその塩からなる群より選ばれる1種以上を含有していればよい。したがって、前記皮膚外用剤および化粧料は、化合物(1)を含有し、化合物(1)の塩を含有していないものでもよいし、化合物(1)の塩を含有し、化合物(1)を含有していないものでもよいし、化合物(1)および化合物(1)の塩を共に含有するものでもよい。
前記皮膚外用剤および化粧料の含有する化合物(1)は、1種のみでもよいし、2種以上でもよい。2種以上である場合、その組み合わせおよび比率は、目的に応じて適宜選択できる。同様に、前記皮膚外用剤および化粧料の含有する化合物(1)の塩は、1種のみでもよいし、2種以上でもよい。2種以上である場合、その組み合わせおよび比率は、目的に応じて適宜選択できる。
前記皮膚外用剤および化粧料は、化合物(1)またはその塩の他に、必要に応じて、本発明の効果を損なわない範囲で、皮膚外用剤または化粧料に通常用いられる成分などの他の成分を、一般的な濃度、例えば、皮膚外用剤または化粧料の全体量に対して100質量ppm~90質量%含有していてもよい。
皮膚外用剤または化粧料に通常用いられる成分としては、例えば、既存の原料規格書または公定書に記載された原料、皮膚外用剤として薬学的に許容される担体、添加剤等の成分が挙げられる。
既存の原料規格書または公定書に記載された原料としては、第十四改正日本薬局方(財団法人日本公定書協会編集、株式会社じほう発行、2001年4月)、化粧品原料基準第二版注解(日本公定書協会編、薬事日報社発行、1984年)、化粧品原料基準外成分規格(厚生省薬務局審査課監修、薬事日報社発行、1993年)、化粧品原料基準外成分規格追補(厚生省薬務局審査課監修、薬事日報社発行、1993年)、化粧品種別許可基準(厚生省薬務局審査課監修、薬事日報社発行、1993年)、International Cosmetic Ingredient Dictionary and Handbook 2002 Ninth Edition Vol.1~4,by CTFA、化粧品原料辞典(日光ケミカルズ発行、平成3年)等に記載されたものが例示できる。
既存の原料規格書または公定書に記載された原料としては、第十四改正日本薬局方(財団法人日本公定書協会編集、株式会社じほう発行、2001年4月)、化粧品原料基準第二版注解(日本公定書協会編、薬事日報社発行、1984年)、化粧品原料基準外成分規格(厚生省薬務局審査課監修、薬事日報社発行、1993年)、化粧品原料基準外成分規格追補(厚生省薬務局審査課監修、薬事日報社発行、1993年)、化粧品種別許可基準(厚生省薬務局審査課監修、薬事日報社発行、1993年)、International Cosmetic Ingredient Dictionary and Handbook 2002 Ninth Edition Vol.1~4,by CTFA、化粧品原料辞典(日光ケミカルズ発行、平成3年)等に記載されたものが例示できる。
皮膚外用剤として薬学的に許容される成分としては、水、特開2012-236800号公報の段落0018~0050に記載されている、炭化水素類、天然油脂類、脂肪酸類、高級アルコール類、アルキルグリセリルエーテル類、エステル類、シリコーン油類、多価アルコール類、一価の低級アルコール類、糖類、高分子類、陰イオン界面活性剤、陽イオン界面活性剤、両性界面活性剤、非イオン界面活性剤、天然系界面活性剤、紫外線吸収剤、粉体類、色材類、アミノ酸類、ペプチド類、ビタミン類、ビタミン様作用因子類、防腐剤、酸化防止剤、金属イオン封鎖剤、保湿剤、抗炎症剤、pH調整剤、塩類、有機酸類、美白剤、精油類、テルペン類、香料、等が例示できる。
これらの他の成分は、1種を単独で用いてもよいし、2種以上を併用してもよい。2種以上を併用する場合、その組み合わせおよび比率は、目的に応じて適宜選択できる。
本実施形態の皮膚外用剤および化粧料は、前記化合物(1)およびその塩の総含有量(必須成分の含有量)が、0.01~20質量%であることが好ましく、0.05~12質量%であることがより好ましく、0.1~10質量%であることが特に好ましい。化合物(1)およびその塩の総含有量が前記下限値以上であると、化合物(1)およびその塩による抗老化作用が得られやすくなり、皮膚外用剤または化粧料としてより優れた効能が得られる。また、化合物(1)およびその塩の総含有量が前記上限値以下であると、これらの成分の過剰使用を抑制できる。
本実施形態の皮膚外用剤の投与量は、患者の症状、体重、年齢、性別等によって異なり、一概には決定できないが、通常、成人1人1日あたり、有効成分の投与量(化合物(1)およびその塩の総投与量)が0.4~400mg/人となる量であることが好ましい。
前記皮膚外用剤は、所定量を1日に1回または複数回に分けて投与される。
本実施形態の皮膚外用剤は、高い体内吸収性を有する化合物(1)およびその塩を含むため、有効成分の投与量(化合物(1)およびその塩の総投与量)を、有効成分としてNMNを用いた場合と比較して低減できる。
前記皮膚外用剤は、所定量を1日に1回または複数回に分けて投与される。
本実施形態の皮膚外用剤は、高い体内吸収性を有する化合物(1)およびその塩を含むため、有効成分の投与量(化合物(1)およびその塩の総投与量)を、有効成分としてNMNを用いた場合と比較して低減できる。
また、本実施形態の化粧料の使用量は、対象者の症状、体重、年齢、性別等によって異なり、一概には決定できないが、通常、成人1人1日あたり、有効成分の使用量(化合物(1)およびその塩の総使用量)が0.4~400mg/人となる量であることが好ましい。
前記化粧料は、所定量を1日に1回または複数回に分けて使用される。
本実施形態の化粧料は、高い体内吸収性を有する化合物(1)およびその塩を含むため、有効成分の使用量(化合物(1)およびその塩の総使用量)を、有効成分としてNMNを用いた場合と比較して低減できる。
前記化粧料は、所定量を1日に1回または複数回に分けて使用される。
本実施形態の化粧料は、高い体内吸収性を有する化合物(1)およびその塩を含むため、有効成分の使用量(化合物(1)およびその塩の総使用量)を、有効成分としてNMNを用いた場合と比較して低減できる。
前記皮膚外用剤および化粧料は、化合物(1)またはその塩、および必要に応じて他の成分を配合し、製剤化することで製造できる。
前記皮膚外用剤および化粧料は、化合物(1)またはその塩を配合すること以外は、公知の皮膚外用剤および化粧料と同様の方法で製造できる。
前記皮膚外用剤および化粧料は、化合物(1)またはその塩を配合すること以外は、公知の皮膚外用剤および化粧料と同様の方法で製造できる。
本実施形態の皮膚外用剤および化粧料は、体内で容易にNMNに分解されるものであり、皮膚親和性および皮膚浸透性に優れ、高い体内吸収性を有する化合物(1)等を含有する。したがって、本実施形態の皮膚外用剤および化粧料は、高い抗老化作用が期待できる。特に、本実施形態の皮膚外用剤は、皮脂制御剤、肌のターンオーバーの正常化剤、抗炎症剤、抗アクネ剤、抗肌荒れ剤、白髪抑制剤、養毛外用剤、アンチエイジング剤等として有用である。また、本実施形態の皮膚外用剤および化粧料は、十分な脂溶性および水溶性を有する化合物(1)等を含むため、用途に応じて、水系,乳化系,固体,粉末,錠剤といった様々な剤型にすることができる。
「4.食品添加剤」
本実施形態の食品添加剤は、上述した実施形態の化合物(1)またはその塩を含有する。本実施形態の食品添加剤は、上述した実施形態の皮膚外用剤および化粧料と同様に、必須成分として化合物(1)およびその塩からなる群より選ばれる1種以上を含有していればよい。したがって、前記食品添加剤は、化合物(1)を含有し、化合物(1)の塩を含有していないものでもよいし、化合物(1)の塩を含有し、化合物(1)を含有していないものでもよいし、化合物(1)および化合物(1)の塩を共に含有するものでもよい。
本実施形態の食品添加剤は、上述した実施形態の化合物(1)またはその塩を含有する。本実施形態の食品添加剤は、上述した実施形態の皮膚外用剤および化粧料と同様に、必須成分として化合物(1)およびその塩からなる群より選ばれる1種以上を含有していればよい。したがって、前記食品添加剤は、化合物(1)を含有し、化合物(1)の塩を含有していないものでもよいし、化合物(1)の塩を含有し、化合物(1)を含有していないものでもよいし、化合物(1)および化合物(1)の塩を共に含有するものでもよい。
前記食品添加剤の含有する化合物(1)は、1種のみでもよいし、2種以上でもよい。2種以上である場合、その組み合わせおよび比率は、目的に応じて適宜選択できる。同様に、前記食品添加剤の含有する化合物(1)の塩は、1種のみでもよいし、2種以上でもよい。2種以上である場合、その組み合わせおよび比率は、目的に応じて適宜選択できる。
前記食品添加剤は、化合物(1)またはその塩の他に、必要に応じて、当該分野で公知の任意成分を含有していてもよい。任意成分は特に限定されず、目的に応じて適宜選択できる。任意成分は、1種を単独で用いてもよいし、2種以上を併用してもよい。2種以上を併用する場合、その組み合わせおよび比率は、目的に応じて適宜選択できる。前記食品添加剤中の任意成分の含有量は、特に限定されず、目的に応じて適宜調節すればよい。
前記食品添加剤の化合物(1)およびその塩の総含有量(必須成分の含有量)は、特に限定されず、目的に応じて適宜調節すればよいが、通常は0.001~0.1質量%であることが好ましい。
本実施形態の食品添加剤の使用量は、目的によって異なり、一概には決定できないが、通常、成人1人1日あたり、有効成分の摂取量(化合物(1)およびその塩の総摂取量)が10~1000mg/人となる量であることが好ましい。
前記食品添加剤は、化合物(1)またはその塩を配合すること以外は、公知の食品添加剤と同様の方法で製造できる。
本実施形態の食品添加剤の使用量は、目的によって異なり、一概には決定できないが、通常、成人1人1日あたり、有効成分の摂取量(化合物(1)およびその塩の総摂取量)が10~1000mg/人となる量であることが好ましい。
前記食品添加剤は、化合物(1)またはその塩を配合すること以外は、公知の食品添加剤と同様の方法で製造できる。
本実施形態の食品添加剤は、体内で容易にNMNに分解されるものであり、高い体内吸収性を有する化合物(1)等を含有する。したがって、本実施形態の食品添加剤は、高い抗老化作用が期待できる。また、本実施形態の食品添加剤は、十分な脂溶性および水溶性を有する化合物(1)等を含むため、公知の食品添加剤と同様に、錠剤、被覆錠剤、丸剤、散剤、顆粒剤、カプセル剤、液剤、懸濁剤、乳剤等の様々な剤型にすることができる。
以下、実施例により本発明をより詳細に説明する。なお、本発明は、以下に示す実施例に、何ら限定されるものではない。
以下に示す実施例および比較例では、原料として以下に示す試薬を用いた。
β-ニコチンアミドモノヌクレオチド(β-NMN):Sigma-Aldrich Co.LLC.
トリフルオロ酢酸(TFA):東京化成工業株式会社
硫酸:純正化学株式会社
パルミトイルクロリド(PaCl(CH3(CH2)14COCl)):東京化成工業株式会社
ラウロイルクロリド(LauCl(CH3(CH2)10COCl)):東京化成工業株式会社
オクタノイルクロリド(OctCl(CH3(CH2)6COCl)):東京化成工業株式会社
ヘキサノイルクロリド(HexCl(CH3(CH2)4COCl)):東京化成工業株式会社
パルミチン酸(PaOH(CH3(CH2)14COOH)):東京化成工業株式会社
無水酢酸:東京化成工業株式会社
ピリジン(脱水):和光純薬工業株式会社
ヘキサン:和光純薬工業株式会社
アセトニトリル:和光純薬工業株式会社
N,N-ジメチルホルムアミド(脱水)(DMF):和光純薬株式会社
β-ニコチンアミドモノヌクレオチド(β-NMN):Sigma-Aldrich Co.LLC.
トリフルオロ酢酸(TFA):東京化成工業株式会社
硫酸:純正化学株式会社
パルミトイルクロリド(PaCl(CH3(CH2)14COCl)):東京化成工業株式会社
ラウロイルクロリド(LauCl(CH3(CH2)10COCl)):東京化成工業株式会社
オクタノイルクロリド(OctCl(CH3(CH2)6COCl)):東京化成工業株式会社
ヘキサノイルクロリド(HexCl(CH3(CH2)4COCl)):東京化成工業株式会社
パルミチン酸(PaOH(CH3(CH2)14COOH)):東京化成工業株式会社
無水酢酸:東京化成工業株式会社
ピリジン(脱水):和光純薬工業株式会社
ヘキサン:和光純薬工業株式会社
アセトニトリル:和光純薬工業株式会社
N,N-ジメチルホルムアミド(脱水)(DMF):和光純薬株式会社
また、以下の各実施例および比較例、合成例において、目的物であるNMN誘導体およびパルミチン酸の定量を下記のHPLC(高速液体クロマトグラフ)分析条件1で分析し、原料(β-NMN)の定量を下記のHPLC分析条件2で分析した。
[HPLC分析条件1]
カラム:昭和電工社製「Shodex(登録商標) Silica 5C8 4E(4.6mmI.D.×250mm)」×2本
溶離液:H3PO4,KH2PO4水溶液(H3PO4濃度:15mmol/L、KH2PO4濃度:15mmol/L)/アセトニトリル= 30/70(体積比)
流速:1.2mL/min
カラム温度:40℃
検出器:UV(210nm)およびRI(示差屈折)
サンプル注入量:20μL
カラム:昭和電工社製「Shodex(登録商標) Silica 5C8 4E(4.6mmI.D.×250mm)」×2本
溶離液:H3PO4,KH2PO4水溶液(H3PO4濃度:15mmol/L、KH2PO4濃度:15mmol/L)/アセトニトリル= 30/70(体積比)
流速:1.2mL/min
カラム温度:40℃
検出器:UV(210nm)およびRI(示差屈折)
サンプル注入量:20μL
[HPLC分析条件2]
カラム:昭和電工社製「Shodex(登録商標) RSpak(商標)DM-614(6.0mmI.D.×150mm)」×4本
溶離液:0.02% H3PO4水溶液
流速:0.8mL/min
カラム温度:40℃
検出器:UV(210nm)およびRI(示差屈折)
サンプル注入量:20μL
カラム:昭和電工社製「Shodex(登録商標) RSpak(商標)DM-614(6.0mmI.D.×150mm)」×4本
溶離液:0.02% H3PO4水溶液
流速:0.8mL/min
カラム温度:40℃
検出器:UV(210nm)およびRI(示差屈折)
サンプル注入量:20μL
また、以下の各実施例および比較例、合成例において、生成物の構造同定は、NMR測定により行った。NMR測定は、測定対象の試料約15mgを各種重溶媒に溶解させて得られたサンプルを、Bruker Biospin社製「AvanceIII-400」を用いて測定した。
<化合物の製造>
[実施例1]
TFA溶媒中での3´-パルミトイル-β―NMNの合成
[実施例1]
TFA溶媒中での3´-パルミトイル-β―NMNの合成
上記一般式(3)で表されるβ-ニコチンアミドモノヌクレオチド(β-NMN、0.133g、0.40mmol)を、強酸性液体であるトリフルオロ酢酸(TFA、5.4mL、pKa=-0.25)に加えて完全に溶解させ、室温(23℃)でアシル化剤としてパルミトイルクロリド(PaCl、0.110g、0.40mmol)を加えて1時間撹拌した。その後、パルミトイルクロリド(PaCl、0.110g、0.40mmol)を追添して、さらに3.5時間撹拌し、合計で4.5時間アシル化反応させた。
アシル化反応の終了後に得られた反応液を一部サンプリングし、HPLC分析条件1で生成物を定量し、HPLC分析条件2で原料を定量し、転化率と上記一般式(3-1)~(3-3)で表される化合物それぞれの収率を求めた。その結果を表1に示す。
アシル化反応の終了後に得られた反応液に対して、後処理として濃縮乾固し(TFAの除去)、ヘキサン20mLおよびアセトニトリル20mLを加えて撹拌後、溶け残った白色固体をろ過で回収し(パルミチン酸および残存TFAの除去)、回収した白色固体に水10mLを加えて撹拌後、同様に溶け残った白色固体をろ過で回収した(NMNの除去)。回収した白色固体(生成物)を、カラムクロマトグラフィー(シリカゲルおよびイオン交換樹脂)を組み合わせて精製することで、主成分として、目的物である上記一般式(3-1)で表される3´-パルミトイル-β-ニコチンアミドモノヌクレオチド(3´-Palmitoyl-β―NMN)を白色固体として得た(0.061g、単離収率27%)。
表1に、実施例1で使用したアシル化剤、アシル化剤とNMNとのモル比(アシル化剤/NMN)、溶媒、主成分の単離収率を示す。
目的物の構造は、各種NMR測定(1H-NMR、13C-NMR、13C DEPT135、1H-1H-COSY)を行うことで確認した。また、糖骨格の1´位プロトンのケミカルシフトから、エピマー化していないことを確認し、β-NMN構造を保持していることが分かった。
得られた3´-Palmitoyl-β―NMNの1H-NMRおよび13C-NMRデータを以下に示す。
目的物の構造は、各種NMR測定(1H-NMR、13C-NMR、13C DEPT135、1H-1H-COSY)を行うことで確認した。また、糖骨格の1´位プロトンのケミカルシフトから、エピマー化していないことを確認し、β-NMN構造を保持していることが分かった。
得られた3´-Palmitoyl-β―NMNの1H-NMRおよび13C-NMRデータを以下に示す。
1H-NMR(400MHz,THF-d8/D2O=5/1):δ(ppm)=9.50(s,1H),9.29(d,J=8.0Hz,1H),9.02(d,J=8.0Hz,1H),8.37(dd,J=8.0 and 8.0Hz,1H),6.11(d,J=4.0Hz,1H),5.43(d,J=4.0Hz,1H),4.78(dd,J=4.0 and 4.0Hz,1H),4.59(m,1H),4.06-4.31(m,2H),2.44(m,2H),1.61(m,2H),1.25(m,24H),0.85(t,J=4.0Hz,3H)
13C-NMR(100MHz,THF-d8/D2O=5/1):δ(ppm)=173.8, 165.5, 147.3, 143.6, 140.6, 135.5, 129.8, 101.2, 87.7, 77.5, 75.7, 65.4, 34.6, 32.8, 30.1-30.6, 23.5, 14.5
[実施例2]
TFA溶媒中での2´,3´-ジパルミトイル-β―NMNの合成
TFA溶媒中での2´,3´-ジパルミトイル-β―NMNの合成
上記一般式(3)で表されるβ-ニコチンアミドモノヌクレオチド(β-NMN、0.135g、0.40mmol)を、強酸性液体であるトリフルオロ酢酸(TFA、5.3mL、pKa=-0.25)に加えて完全に溶解させ、室温(23℃)でアシル化剤としてパルミトイルクロリド(PaCl、0.224g、0.81mmol)を加えて1時間撹拌した。その後、パルミトイルクロリド(PaCl、0.220g、0.80mmol)を追添して、さらに3.5時間撹拌し、合計で4.5時間アシル化反応させた。
アシル化反応の終了後に得られた反応液を一部サンプリングし、実施例1と同様にして、転化率と上記一般式(3-1)~(3-3)で表される化合物それぞれの収率を求めた。その結果を表1に示す。
アシル化反応の終了後に得られた反応液に対して、後処理として濃縮乾固し(TFAの除去)、ヘキサン20mLを加えて、アセトニトリル(30mL)を用いて15回洗浄し(パルミチン酸の消失をHPLC分析条件1で定量して確認)、ヘキサン層を濃縮することで白色固体を得た。得られた白色固体を、カラムクロマトグラフィー(シリカゲルおよびイオン交換樹脂)を組み合わせて精製することで、主成分として、目的物である上記一般式(3-3)で表される2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチド(2´,3´-Dipalmitoyl-β―NMN)を白色固体として得た(0.151g、単離収率46%)。
表1に、実施例2で使用したアシル化剤、アシル化剤とNMNとのモル比(アシル化剤/NMN)、溶媒、主成分の単離収率を示す。
目的物の構造は、各種NMR測定(1H-NMR、13C-NMR、13C DEPT135、1H-1H-COSY)を行うことで確認した。また、糖骨格の1´位プロトンのケミカルシフトから、エピマー化していないことを確認し、β-NMN構造を保持していることが分かった。
得られた2´,3´-Dipalmitoyl-β―NMNの1H-NMRおよび13C-NMRデータを以下に示す。
目的物の構造は、各種NMR測定(1H-NMR、13C-NMR、13C DEPT135、1H-1H-COSY)を行うことで確認した。また、糖骨格の1´位プロトンのケミカルシフトから、エピマー化していないことを確認し、β-NMN構造を保持していることが分かった。
得られた2´,3´-Dipalmitoyl-β―NMNの1H-NMRおよび13C-NMRデータを以下に示す。
1H-NMR(400MHz,THF-d8,50℃):δ(ppm)=9.61(s,1H),9.38(d,J=8.0Hz,1H),9.15(d,J=8.0Hz,1H),8.42(dd,J=8.0 and 8.0Hz,1H),6.57(d,J=4.0Hz,1H),5.64(dd,J=4.0 and 4.0Hz,1H),5.54(d,J=4.0Hz,1H),4.62(m,1H),4.15-4.37(m,2H),2.38(m,4H),1.60(m,4H),1.30(m,48H),0.89(t,J=4.0Hz,6H)
13C-NMR(100MHz,THF-d8,50℃):δ(ppm)=174.6, 166.3, 148.1, 144.4, 141.4, 136.3, 130.6, 99.3, 88.5, 77.7, 71.5, 65.6, 34.6, 33.0, 30.3-30.9, 23.7, 14.7
表1に示すように、アシル化剤であるパルミトイルクロリドをNMNに対して2倍モル量用いた実施例1では、3´-パルミトイル-β-NMNが主生成物として得られた。
また、パルミトイルクロリドをNMNに対して4倍モル量用いた実施例2では、2´,3´-ジパルミトイル-β-NMNが主生成物として得られた。
表1に示すように、アシル化剤であるパルミトイルクロリドの使用量を調整することで、糖骨格の3´位の水酸基がアシル化された化合物(3´-アシル化体)と、2´位の水酸基がアシル化された化合物(2´-アシル化体)と、3´位および2´位の水酸基がアシル化された化合物(2´,3´-ジアシル化体)との生成比率を変化させることができた。
また、パルミトイルクロリドをNMNに対して4倍モル量用いた実施例2では、2´,3´-ジパルミトイル-β-NMNが主生成物として得られた。
表1に示すように、アシル化剤であるパルミトイルクロリドの使用量を調整することで、糖骨格の3´位の水酸基がアシル化された化合物(3´-アシル化体)と、2´位の水酸基がアシル化された化合物(2´-アシル化体)と、3´位および2´位の水酸基がアシル化された化合物(2´,3´-ジアシル化体)との生成比率を変化させることができた。
[実施例3][実施例5][実施例7]
表1に示すアシル化剤を用いたこと以外は、実施例1と同様にしてアシル化反応を行い、実施例1と同様にして、転化率と生成物の収率を求めた。その結果を表1に示す。
また、アシル化反応の終了後に得られた反応液に対して、実施例1と同様にして後処理を行い、後処理後の生成物を、カラムクロマトグラフィー(シリカゲルおよびイオン交換樹脂)を組み合わせて精製することで、目的物である表1に示す主成分を白色固体として得た。
表1に示すアシル化剤を用いたこと以外は、実施例1と同様にしてアシル化反応を行い、実施例1と同様にして、転化率と生成物の収率を求めた。その結果を表1に示す。
また、アシル化反応の終了後に得られた反応液に対して、実施例1と同様にして後処理を行い、後処理後の生成物を、カラムクロマトグラフィー(シリカゲルおよびイオン交換樹脂)を組み合わせて精製することで、目的物である表1に示す主成分を白色固体として得た。
表1に、実施例3、5、7で使用したアシル化剤、アシル化剤とNMNとのモル比(アシル化剤/NMN)、溶媒、主成分の単離収率を示す。
実施例3、5、7の目的物の構造は、実施例1と同様にして確認した。1H-NMRおよび13C-NMRデータを以下に示す。
実施例3、5、7の目的物の構造は、実施例1と同様にして確認した。1H-NMRおよび13C-NMRデータを以下に示す。
(実施例3)3´-ラウロイル-β―NMN
1H-NMR(400MHz,THF-d8/D2O=5/1):δ(ppm)=9.50(s,1H),9.29(d,J=8.0Hz,1H),9.03(d,J=8.0Hz,1H),8.38(dd,J=8.0 and 8.0Hz,1H),6.11(d,J=4.0Hz,1H),5.43(d,J=4.0Hz,1H),4.78(dd,J=4.0 and 4.0Hz,1H),4.59(m,1H),4.04-4.32(m,2H),2.44(m,2H),1.61(m,2H),1.27(m,16H),0.85(t,J=4.0Hz,3H)
1H-NMR(400MHz,THF-d8/D2O=5/1):δ(ppm)=9.50(s,1H),9.29(d,J=8.0Hz,1H),9.03(d,J=8.0Hz,1H),8.38(dd,J=8.0 and 8.0Hz,1H),6.11(d,J=4.0Hz,1H),5.43(d,J=4.0Hz,1H),4.78(dd,J=4.0 and 4.0Hz,1H),4.59(m,1H),4.04-4.32(m,2H),2.44(m,2H),1.61(m,2H),1.27(m,16H),0.85(t,J=4.0Hz,3H)
13C-NMR(100MHz,THF-d8/D2O=5/1):δ(ppm)=173.8, 165.5, 147.3, 143.6, 140.6, 135.5, 129.8, 101.2, 87.8, 77.5, 75.7, 65.4, 34.6, 32.8, 30.0-30.6, 23.6, 14.5
(実施例5)3´-オクタノイル-β―NMN
1H-NMR(400MHz,THF-d8/D2O=5/1):δ(ppm)=9.50(s,1H),9.29(d,J=8.0Hz,1H),9.01(d,J=8.0Hz,1H),8.38(dd,J=8.0 and 8.0Hz,1H),6.11(d,J=4.0Hz,1H),5.43(d,J=4.0Hz,1H),4.78(dd,J=4.0 and 4.0Hz,1H),4.59(m,1H),4.06-4.33(m,2H),2.42(m,2H),1.62(m,2H),1.27(m,8H),0.86(t,J=4.0Hz,3H)
1H-NMR(400MHz,THF-d8/D2O=5/1):δ(ppm)=9.50(s,1H),9.29(d,J=8.0Hz,1H),9.01(d,J=8.0Hz,1H),8.38(dd,J=8.0 and 8.0Hz,1H),6.11(d,J=4.0Hz,1H),5.43(d,J=4.0Hz,1H),4.78(dd,J=4.0 and 4.0Hz,1H),4.59(m,1H),4.06-4.33(m,2H),2.42(m,2H),1.62(m,2H),1.27(m,8H),0.86(t,J=4.0Hz,3H)
13C-NMR(100MHz,THF-d8/D2O=5/1):δ(ppm)=173.8, 165.5, 147.3, 143.5, 140.6, 135.5, 129.8, 101.2, 87.7, 77.5, 75.7, 65.4, 34.5, 32.8, 30.2-30.6, 23.6, 14.6
(実施例7)3´-ヘキサノイル-β―NMN
1H-NMR(400MHz,THF-d8/D2O=5/1):δ(ppm)=9.50(s,1H),9.29(d,J=8.0Hz,1H),9.02(d,J=8.0Hz,1H),8.38(dd,J=8.0 and 8.0Hz,1H),6.11(d,J=4.0Hz,1H),5.43(d,J=4.0Hz,1H),4.78(dd,J=4.0 and 4.0Hz,1H),4.59(m,1H),4.06-4.30(m,2H),2.44(m,2H),1.63(m,2H),1.27(m,4H),0.86(t,J=4.0Hz,3H)
1H-NMR(400MHz,THF-d8/D2O=5/1):δ(ppm)=9.50(s,1H),9.29(d,J=8.0Hz,1H),9.02(d,J=8.0Hz,1H),8.38(dd,J=8.0 and 8.0Hz,1H),6.11(d,J=4.0Hz,1H),5.43(d,J=4.0Hz,1H),4.78(dd,J=4.0 and 4.0Hz,1H),4.59(m,1H),4.06-4.30(m,2H),2.44(m,2H),1.63(m,2H),1.27(m,4H),0.86(t,J=4.0Hz,3H)
13C-NMR(100MHz,THF-d8/D2O=5/1):δ(ppm)=173.8, 165.7, 147.3, 143.6, 140.6, 135.5, 129.8, 101.2, 87.7, 77.5, 75.7, 65.4, 34.6, 32.9, 30.3-30.5, 23.5, 14.6
[実施例4][実施例6][実施例8]
表1に示すアシル化剤を用いたこと以外は、実施例2と同様にしてアシル化反応を行い、実施例2と同様にして、転化率と生成物の収率を求めた。その結果を表1に示す。
また、アシル化反応の終了後に得られた反応液に対して、実施例2と同様にして後処理を行い、後処理後の生成物を、カラムクロマトグラフィー(シリカゲルおよびイオン交換樹脂)を組み合わせて精製することで、目的物である表1に示す主成分を白色固体として得た。
表1に示すアシル化剤を用いたこと以外は、実施例2と同様にしてアシル化反応を行い、実施例2と同様にして、転化率と生成物の収率を求めた。その結果を表1に示す。
また、アシル化反応の終了後に得られた反応液に対して、実施例2と同様にして後処理を行い、後処理後の生成物を、カラムクロマトグラフィー(シリカゲルおよびイオン交換樹脂)を組み合わせて精製することで、目的物である表1に示す主成分を白色固体として得た。
表1に、実施例4、6、8で使用したアシル化剤、アシル化剤とNMNとのモル比(アシル化剤/NMN)、溶媒、主成分の単離収率を示す。
実施例4、6、8の目的物の構造は、実施例1と同様にして確認した。1H-NMRおよび13C-NMRデータを以下に示す。
実施例4、6、8の目的物の構造は、実施例1と同様にして確認した。1H-NMRおよび13C-NMRデータを以下に示す。
(実施例4)2´,3´-ジラウロイル-β―NMN
1H-NMR(400MHz,THF-d8,50℃):δ(ppm)=9.61(s,1H),9.38(d,J=8.0Hz,1H),9.15(d,J=8.0Hz,1H),8.42(dd,J=8.0 and 8.0Hz,1H),6.57(d,J=4.0Hz,1H),5.64(dd,J=4.0 and 4.0Hz,1H),5.54(d,J=4.0Hz,1H),4.62(m,1H),4.15-4.37(m,2H),2.38(m,4H),1.61(m,4H),1.32(m,32H),0.88(t,J=4.0Hz,6H)
1H-NMR(400MHz,THF-d8,50℃):δ(ppm)=9.61(s,1H),9.38(d,J=8.0Hz,1H),9.15(d,J=8.0Hz,1H),8.42(dd,J=8.0 and 8.0Hz,1H),6.57(d,J=4.0Hz,1H),5.64(dd,J=4.0 and 4.0Hz,1H),5.54(d,J=4.0Hz,1H),4.62(m,1H),4.15-4.37(m,2H),2.38(m,4H),1.61(m,4H),1.32(m,32H),0.88(t,J=4.0Hz,6H)
13C-NMR(100MHz,THF-d8,50℃):δ(ppm)=174.6, 166.3, 148.1, 144.4, 141.4, 136.3, 130.6, 99.3, 88.5, 77.7, 71.5, 65.6, 34.6, 33.0, 30.2-30.9, 23.8, 14.9
(実施例6)2´,3´-ジオクタノイル-β―NMN
1H-NMR(400MHz,THF-d8,50℃):δ(ppm)=9.61(s,1H),9.38(d,J=8.0Hz,1H),9.15(d,J=8.0Hz,1H),8.42(dd,J=8.0 and 8.0Hz,1H),6.57(d,J=4.0Hz,1H),5.64(dd,J=4.0 and 4.0Hz,1H),5.54(d,J=4.0Hz,1H),4.62(m,1H),4.15-4.37(m,2H),2.39(m,4H),1.61(m,4H),1.31(m,16H),0.90(t,J=4.0Hz,6H)
1H-NMR(400MHz,THF-d8,50℃):δ(ppm)=9.61(s,1H),9.38(d,J=8.0Hz,1H),9.15(d,J=8.0Hz,1H),8.42(dd,J=8.0 and 8.0Hz,1H),6.57(d,J=4.0Hz,1H),5.64(dd,J=4.0 and 4.0Hz,1H),5.54(d,J=4.0Hz,1H),4.62(m,1H),4.15-4.37(m,2H),2.39(m,4H),1.61(m,4H),1.31(m,16H),0.90(t,J=4.0Hz,6H)
13C-NMR(100MHz,THF-d8,50℃):δ(ppm)=174.6, 166.3, 148.1, 144.4, 141.4, 136.3, 130.6, 99.3, 88.5, 77.7, 71.5, 65.6, 34.6, 33.0, 30.5-30.9, 23.9, 14.8
(実施例8)2´,3´-ジヘキサノイル-β―NMN
1H-NMR(400MHz,THF-d8,50℃):δ(ppm)=9.61(s,1H),9.38(d,J=8.0Hz,1H),9.15(d,J=8.0Hz,1H),8.42(dd,J=8.0 and 8.0Hz,1H),6.57(d,J=4.0Hz,1H),5.64(dd,J=4.0 and 4.0Hz,1H),5.54(d,J=4.0Hz,1H),4.62(m,1H),4.15-4.37(m,2H),2.39(m,4H),1.62(m,4H),1.32(m,8H),0.88(t,J=4.0Hz,6H)
1H-NMR(400MHz,THF-d8,50℃):δ(ppm)=9.61(s,1H),9.38(d,J=8.0Hz,1H),9.15(d,J=8.0Hz,1H),8.42(dd,J=8.0 and 8.0Hz,1H),6.57(d,J=4.0Hz,1H),5.64(dd,J=4.0 and 4.0Hz,1H),5.54(d,J=4.0Hz,1H),4.62(m,1H),4.15-4.37(m,2H),2.39(m,4H),1.62(m,4H),1.32(m,8H),0.88(t,J=4.0Hz,6H)
13C-NMR(100MHz,THF-d8,50℃):δ(ppm)=174.6, 166.3, 148.1, 144.4, 141.4, 136.3, 130.6, 99.3, 88.5, 77.7, 71.5, 65.6, 34.6, 33.0, 30.3-30.7, 23.6, 14.6
表1に示すように、アシル化剤としてカルボン酸塩化物を用いた場合、アシル化剤をNMNに対して2倍モル量用いた実施例3、5、7では、NMNの3´-アシル化体が主生成物(主成分)として得られた。
また、カルボン酸塩化物をNMNに対して4倍モル量用いた実施例4、6、8では、NMNの2´,3´-ジアシル化体が主生成物として得られた。
表1に示すように、アシル化剤であるカルボン酸塩化物の使用量を調整することで、3´-アシル化体と、2´-アシル化体と、2´,3´-ジアシル化体との生成比率を変化させることができた。
また、カルボン酸塩化物をNMNに対して4倍モル量用いた実施例4、6、8では、NMNの2´,3´-ジアシル化体が主生成物として得られた。
表1に示すように、アシル化剤であるカルボン酸塩化物の使用量を調整することで、3´-アシル化体と、2´-アシル化体と、2´,3´-ジアシル化体との生成比率を変化させることができた。
[実施例9]
硫酸溶媒中での3´-パルミトイル-β―NMNの合成
β-ニコチンアミドモノヌクレオチド(β-NMN、0.133g、0.40mmol)を、強酸性液体である濃硫酸(H2SO4、8.0mL、pKaは酸性が強すぎて水中では測定できない)に加えて完全に溶解させ、40℃でアシル化剤としてパルミチン酸(PaOH、0.410g、1.60mmol)を加えて12時間撹拌し、アシル化反応させた。
硫酸溶媒中での3´-パルミトイル-β―NMNの合成
β-ニコチンアミドモノヌクレオチド(β-NMN、0.133g、0.40mmol)を、強酸性液体である濃硫酸(H2SO4、8.0mL、pKaは酸性が強すぎて水中では測定できない)に加えて完全に溶解させ、40℃でアシル化剤としてパルミチン酸(PaOH、0.410g、1.60mmol)を加えて12時間撹拌し、アシル化反応させた。
アシル化反応の終了後に得られた反応液を一部サンプリングし、HPLC分析条件1で生成物を定量し、HPLC分析条件2で原料を定量し、転化率と生成物の収率を求めた。その結果を表1に示す。
表1に、実施例9で使用したアシル化剤、アシル化剤とNMNとのモル比(アシル化剤/NMN)、溶媒を示す。
また、実施例9の生成物の構造を、1H-NMRおよび13C-NMR測定を行うことにより確認した。その結果、3´-パルミトイル-β―NMNが主成分であった。
表1に、実施例9で使用したアシル化剤、アシル化剤とNMNとのモル比(アシル化剤/NMN)、溶媒を示す。
また、実施例9の生成物の構造を、1H-NMRおよび13C-NMR測定を行うことにより確認した。その結果、3´-パルミトイル-β―NMNが主成分であった。
表1に示すように、強酸性液体として硫酸を用い、アシル化剤としてパルミチン酸を用いて、表1に示すアシル化剤とNMNとのモル比で、NMNをアシル化反応させることで、3´-パルミトイル-β―NMNが主生成物として得られた。
[比較例1]
DMF溶媒中でのパルミトイル化反応
β-ニコチンアミドモノヌクレオチド(β-NMN、0.050g、0.15mmol)をN,N-ジメチルホルムアミド(DMF、3.0mL)に懸濁させて、ピリジン(0.144g、1.83mmol)を加えて、すぐに60℃でパルミトイルクロリド(PaCl、0.085g、0.31mmol)を加えて3時間撹拌した。その後、パルミトイルクロリド(PaCl、0.165g、0.60mmol)を追添して、さらに3時間撹拌し、合計で6時間反応させた。
DMF溶媒中でのパルミトイル化反応
β-ニコチンアミドモノヌクレオチド(β-NMN、0.050g、0.15mmol)をN,N-ジメチルホルムアミド(DMF、3.0mL)に懸濁させて、ピリジン(0.144g、1.83mmol)を加えて、すぐに60℃でパルミトイルクロリド(PaCl、0.085g、0.31mmol)を加えて3時間撹拌した。その後、パルミトイルクロリド(PaCl、0.165g、0.60mmol)を追添して、さらに3時間撹拌し、合計で6時間反応させた。
反応の終了後に得られた反応液を一部サンプリングし、HPLC分析条件1で生成物を定量し、HPLC分析条件2で原料を定量し、転化率と生成物の収率を求めた。その結果を表1に示す。
また、反応の終了後に得られた反応液を過剰量の水に滴下し、析出してきた白色固体をろ過で除去した(パルミチン酸の除去)。ろ液を濃縮し、真空乾燥して残った褐色固体を回収した。
また、反応の終了後に得られた反応液を過剰量の水に滴下し、析出してきた白色固体をろ過で除去した(パルミチン酸の除去)。ろ液を濃縮し、真空乾燥して残った褐色固体を回収した。
生成物の構造を、1H-NMRおよび13C-NMR測定を行うことにより確認した。その結果、NMNの分解物であるニコチン酸アミドが主成分であった。
表1に示すように、溶媒としてN,N-ジメチルホルムアミドを用いた場合、NMNのアシル化体は得られなかった。
表1に示すように、溶媒としてN,N-ジメチルホルムアミドを用いた場合、NMNのアシル化体は得られなかった。
[合成例1]
無水酢酸による2´,3´-ジアセチル-β―NMNの合成
アシル化剤である無水酢酸(8.68g、85.0mmol)とピリジン(7.84g、99.1mmol)との混合液を0℃に冷却し、ここにβ-ニコチンアミドモノヌクレオチド(β-NMN、0.254g、0.76mmol)を溶解させた水溶液(0.8mL)を加えた。HPLCで反応をモニタリングしながら、0℃で3時間撹拌した。
無水酢酸による2´,3´-ジアセチル-β―NMNの合成
アシル化剤である無水酢酸(8.68g、85.0mmol)とピリジン(7.84g、99.1mmol)との混合液を0℃に冷却し、ここにβ-ニコチンアミドモノヌクレオチド(β-NMN、0.254g、0.76mmol)を溶解させた水溶液(0.8mL)を加えた。HPLCで反応をモニタリングしながら、0℃で3時間撹拌した。
反応後、溶媒を濃縮し、水10mLを加えて再び濃縮する操作を繰り返して残留する無水酢酸とピリジンを除去した。得られた残渣をメタノール(2.0mL)に溶解後、氷冷したジエチルエーテル(40mL)に滴下し、析出してきた固体をろ過で回収した。回収した固体を再びジエチルエーテルに懸濁させて洗浄後、真空乾燥することで、主成分として、目的物である2´,3´-ジアセチル-β-ニコチンアミドモノヌクレオチド(2´,3´-Diacetyl-β―NMN)を単離収率65%で得た。1H-NMRおよび13C-NMRを測定することで、生成物の構造同定を行った。
<皮膚浸透性試験>
被験物質である実施例1~8および合成例1で得た化合物と、比較例2としてのβ-ニコチンアミドモノヌクレオチドとを、それぞれダルベッコPBS(-)溶液に溶解させて、得られた溶液のpHを水酸化ナトリウム水溶液および/または塩酸を用いて7.4に調整した後、濃度0.2質量%の試料溶液とした。
被験物質である実施例1~8および合成例1で得た化合物と、比較例2としてのβ-ニコチンアミドモノヌクレオチドとを、それぞれダルベッコPBS(-)溶液に溶解させて、得られた溶液のpHを水酸化ナトリウム水溶液および/または塩酸を用いて7.4に調整した後、濃度0.2質量%の試料溶液とした。
PBS溶液(1mL)を入れた6ウェルプレートに、三次元培養ヒト皮膚モデル(クラボウ社製「EPI-606X」)(面積3.8cm2)を、その下部が浸るようにセットした。そして、37℃、二酸化炭素濃度5%の条件でインキュベーター中において30分間静置した。次いで、皮膚モデルの下部ウェル内のPBS溶液をHBSS(-)溶液(ハンクス溶液)(1mL)に置換し(以下、これを「レシーバー液」と称する)、上記で得られた試料溶液(700μL)を皮膚モデル上に投与した。そして、37℃、二酸化炭素濃度5%の条件でインキュベーター中において24時間静置した。
24時間静置後、ピペットを用いて皮膚モデル上の試料溶液を除去した後、皮膚モデルをウェルから取り出し、PBS(-)溶液で洗浄した。次いで、皮膚モデルの切片を切り出し、2mLチューブに入れた。このチューブにメタノール(1mL)とステンレスビーズ(TOMY社製、直径5.5mm)を加え、MULTI BEADS SHOCKER(安井器械社製)を用いて、2000rpm、10秒、10回の条件で前記切片を破砕した。
破砕後、得られた溶液を2mLエッペンチューブに移し、12000rpmで5分間遠心して、上清をフィルター(孔径0.22μm)でろ過し、皮膚モデル抽出液を得た。
破砕後、得られた溶液を2mLエッペンチューブに移し、12000rpmで5分間遠心して、上清をフィルター(孔径0.22μm)でろ過し、皮膚モデル抽出液を得た。
次いで、皮膚モデル抽出液およびレシーバー液中の被験物質を、各被験物質ごとに上述のHPLC分析条件1により定量した。皮膚モデル抽出液中の被験物質の定量値より、各ウェル内で皮膚モデルの吸収した被験物質の全量を算出した。また、レシーバー液中の被験物質の定量値を、皮膚モデルを透過した被験物質量とした。そして、皮膚モデルの吸収した被験物質の全量と、皮膚モデルを透過した被験物質量との合計値A(μg)を算出した。
そして、下記式(i)により、皮膚モデルに投与した被験物質について、それぞれ皮膚モデルへの浸透率(%)を算出した。さらに、各被験物質毎に3回ずつ上記の皮膚浸透性試験を行い、それぞれ浸透率(%)を算出した。結果を表2に示す。また、表2に、実施例1~8および合成例1で得た化合物の主成分を示す。なお、表2に示す浸透率の欄における(±)の前の数値は、3回の結果の平均値であり、(±)の後の数値は、3回の結果のバラつき範囲である。
浸透率(%)=(A/1400(皮膚モデルに投与した被験物質量(μg)))×100 ・・・・(i)
そして、下記式(i)により、皮膚モデルに投与した被験物質について、それぞれ皮膚モデルへの浸透率(%)を算出した。さらに、各被験物質毎に3回ずつ上記の皮膚浸透性試験を行い、それぞれ浸透率(%)を算出した。結果を表2に示す。また、表2に、実施例1~8および合成例1で得た化合物の主成分を示す。なお、表2に示す浸透率の欄における(±)の前の数値は、3回の結果の平均値であり、(±)の後の数値は、3回の結果のバラつき範囲である。
浸透率(%)=(A/1400(皮膚モデルに投与した被験物質量(μg)))×100 ・・・・(i)
表2に示すように、実施例1~8で得た化合物であるアシル化されたβ-NMN誘導体は、アシル化されていない比較例2のβ-NMNと比較して、浸透率が高かった。
特に、実施例1~8のうち、NMNの糖骨格に配置されたアシル基の炭素数が多い実施例1および実施例2(炭素数16)、実施例3および実施例4(炭素数12)では、浸透率が高かった。
特に、実施例1~8のうち、NMNの糖骨格に配置されたアシル基の炭素数が多い実施例1および実施例2(炭素数16)、実施例3および実施例4(炭素数12)では、浸透率が高かった。
これに対し、合成例1で得た化合物であるアシル化されたβ-NMN誘導体は、NMNの糖骨格の3´位および2´位に配置されたアシル基の炭素数が少ない(炭素数2)ため、アシル化されていない比較例2のβ-NMNと同等の浸透率であった。
このように、本発明に係る化合物は、β-NMN誘導体の中でも、浸透率が顕著に高く、皮膚外用剤の有効成分として極めて優れていることが示された。
このように、本発明に係る化合物は、β-NMN誘導体の中でも、浸透率が顕著に高く、皮膚外用剤の有効成分として極めて優れていることが示された。
<水溶解性試験>
被験物質として、実施例1~8および合成例1で得た化合物と、比較例2としてのβ-ニコチンアミドモノヌクレオチドを用い、以下に示す手順で、各被験物質の水への溶解性を調べた。
100mLのガラスバイアルに、各被験物質を1g、0.1g、0.01gずつ量り取った。そこに精製水100mL加え、よく撹拌したのち静置し、16時間後に溶液の様子を、以下に示す基準により目視判定した。その結果を表3に示す。また、表3に、実施例1~8および合成例1で得た化合物の主成分を示す。
被験物質として、実施例1~8および合成例1で得た化合物と、比較例2としてのβ-ニコチンアミドモノヌクレオチドを用い、以下に示す手順で、各被験物質の水への溶解性を調べた。
100mLのガラスバイアルに、各被験物質を1g、0.1g、0.01gずつ量り取った。そこに精製水100mL加え、よく撹拌したのち静置し、16時間後に溶液の様子を、以下に示す基準により目視判定した。その結果を表3に示す。また、表3に、実施例1~8および合成例1で得た化合物の主成分を示す。
「基準」
○:澄明
△:濁りあり,沈殿なし
×:沈殿あり
○:澄明
△:濁りあり,沈殿なし
×:沈殿あり
表3に示すように、実施例1~8で得た化合物であるアシル化されたβ-NMN誘導体は、0.01g/100mLである場合の評価が全て「○」となり、十分な水溶性を有していることが確認できた。
特に、実施例1~8のうち、NMNの糖骨格の配置されたアシル基の炭素数が少ない実施例3および実施例4(炭素数12)、実施例5および実施例6(炭素数8)、実施例7および実施例8(炭素数6)では、1g/100mL、0.1g/100mL、0.01g/100mLの全ての評価が「○」であり、水溶性が高かった。
特に、実施例1~8のうち、NMNの糖骨格の配置されたアシル基の炭素数が少ない実施例3および実施例4(炭素数12)、実施例5および実施例6(炭素数8)、実施例7および実施例8(炭素数6)では、1g/100mL、0.1g/100mL、0.01g/100mLの全ての評価が「○」であり、水溶性が高かった。
[実施例10]
2´,3´-ジパルミトイル-β-NMN塩酸塩の調製
実施例2で作製した2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチドを減圧処理し、水分を充分に除去した。水分を除去後の2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチド(0.050g、0.062mmol)に対して、窒素雰囲気下で3mLの塩化水素(4mol/L、1,4-ジオキサン溶液(東京化成工業株式会社))を加えて溶解させて、10分間撹拌した。撹拌後、減圧濃縮を行い、余剰の塩化水素(4mol/L、1,4-ジオキサン溶液)を留去した。留去後の残渣を真空乾燥することで目的物である2´,3´-ジパルミトイル-β―NMN塩酸塩を白色固体として得た(0.052g、0.062mmol)。
2´,3´-ジパルミトイル-β-NMN塩酸塩の調製
実施例2で作製した2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチドを減圧処理し、水分を充分に除去した。水分を除去後の2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチド(0.050g、0.062mmol)に対して、窒素雰囲気下で3mLの塩化水素(4mol/L、1,4-ジオキサン溶液(東京化成工業株式会社))を加えて溶解させて、10分間撹拌した。撹拌後、減圧濃縮を行い、余剰の塩化水素(4mol/L、1,4-ジオキサン溶液)を留去した。留去後の残渣を真空乾燥することで目的物である2´,3´-ジパルミトイル-β―NMN塩酸塩を白色固体として得た(0.052g、0.062mmol)。
得られた2´,3´-ジパルミトイル-β―NMN塩酸塩中の塩化物イオン濃度をイオンクロマトグラフ法により下記の条件で定量した。その結果、NMN誘導体がカチオンになったものと、塩化水素に由来するアニオン(Cl-)とが、ほぼ1:1のモル数で塩を形成していることを確認した。
(イオンクロマトグラフ分析条件)
カラム:Dionex Ion Pack AS12A(商品名:ダイオネクス社製)
溶離液:2.7mM炭酸ナトリウム水溶液/0.3mM炭酸水素ナトリウム水溶液
流速:1.2mL/min
カラム温度:40℃
検出器:電気伝導度
カラム:Dionex Ion Pack AS12A(商品名:ダイオネクス社製)
溶離液:2.7mM炭酸ナトリウム水溶液/0.3mM炭酸水素ナトリウム水溶液
流速:1.2mL/min
カラム温度:40℃
検出器:電気伝導度
[実施例11]
2´,3´-ジパルミトイル-β-NMNナトリウム塩の調製
実施例2で作製した2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチドを減圧処理し、水分を充分に除去した。水分を除去後の2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチド(0.050g、0.062mmol)に対して、メタノール3mLを加えた後、室温で撹拌しながら0.01mol/L水酸化ナトリウム水溶液(0.062mmol、6.2mL、純正化学株式会社)を加えて、10分間撹拌した。その後、室温で濃縮乾固させることで、目的物である2´,3´-ジパルミトイル-β―NMNナトリウム塩を白色固体として得た(0.052g、0.062mmol)。
2´,3´-ジパルミトイル-β-NMNナトリウム塩の調製
実施例2で作製した2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチドを減圧処理し、水分を充分に除去した。水分を除去後の2´,3´-ジパルミトイル-β-ニコチンアミドモノヌクレオチド(0.050g、0.062mmol)に対して、メタノール3mLを加えた後、室温で撹拌しながら0.01mol/L水酸化ナトリウム水溶液(0.062mmol、6.2mL、純正化学株式会社)を加えて、10分間撹拌した。その後、室温で濃縮乾固させることで、目的物である2´,3´-ジパルミトイル-β―NMNナトリウム塩を白色固体として得た(0.052g、0.062mmol)。
得られた2´,3´-ジパルミトイル-β―NMNナトリウム塩中のナトリウムイオン濃度を、イオンクロマトグラフ法により下記の条件で定量した。その結果、NMN誘導体がアニオンになったものと、水酸化ナトリウムに由来するカチオン(Na+)とが、ほぼ1:1のモル数で塩を形成していることを確認した。
(イオンクロマトグラフ分析条件)
カラム:Dionex Ion Pack CS12A(商品名:ダイオネクス社製)
溶離液:20mMメタンスルホン酸水溶液
流速:1.0mL/min
カラム温度:40℃
検出器:電気伝導度
カラム:Dionex Ion Pack CS12A(商品名:ダイオネクス社製)
溶離液:20mMメタンスルホン酸水溶液
流速:1.0mL/min
カラム温度:40℃
検出器:電気伝導度
実施例11で得た2´,3´-ジパルミトイル-β―NMNナトリウム塩を被験物質として用い、実施例1と同様にして、皮膚浸透性試験と水溶解性試験とを行った。皮膚浸透性試験の結果を表2に示す。また、水溶解性試験の結果を表3に示す。
表2に示すように、実施例11で得た化合物(アシル化されたβ-NMN誘導体の塩)は、アシル化されていない比較例2のβ-NMNと比較して、浸透率が高かった。また、表3に示すように、実施例11で得た化合物は、0.01g/100mLである場合の評価が「○」であり、十分な水溶性を有していることが確認できた。
Claims (9)
- 一般式(1)中におけるR1およびR2が、それぞれ独立に炭素数6~16のアシル基である請求項1に記載のニコチンアミドモノヌクレオチド誘導体またはその塩。
- 一般式(1)の化合物の塩が、硝酸イオン、硫酸イオン、炭酸イオン、炭酸水素イオン、ハロゲンイオン、ギ酸イオン、酢酸イオン、クエン酸イオン、酒石酸イオン、シュウ酸イオン、フマル酸イオン、炭素数3~20の飽和または不飽和脂肪酸のアニオン、カルニチンおよびその誘導体のアニオン、ヒドロキシクエン酸およびその誘導体のアニオン、アスコルビン酸のアニオン、並びにアスコルビルリン酸およびその誘導体のアニオンからなる群より選ばれる1種以上のアニオンと共に形成された塩である、請求項1または請求項2に記載のニコチンアミドモノヌクレオチド誘導体またはその塩。
- 一般式(1)の化合物の塩が、ナトリウムイオン、カリウムイオン、カルシウムイオン、マグネシウムイオン、亜鉛イオン、アンモニウムイオン、カルニチンおよびその誘導体のカチオンからなる群より選ばれる1種以上のカチオンと共に形成された塩である、請求項1または請求項2に記載のニコチンアミドモノヌクレオチド誘導体またはその塩。
- ニコチンアミドモノヌクレオチドを、pKaが2.0以下の強酸性液体を20質量%以上含む溶媒中で、直鎖状若しくは分岐鎖状の飽和または不飽和の炭化水素基がカルボニル炭素に結合している炭素数3~30のアシル基を有するカルボン酸、前記カルボン酸のハロゲン化物、前記カルボン酸の無水物から選ばれる1種以上のアシル化剤を用いてアシル化反応させることを特徴とする請求項1~4のいずれか一項に記載のニコチンアミドモノヌクレオチド誘導体またはその塩の製造方法。
- 前記強酸性液体が、トリフルオロ酢酸または硫酸である請求項5に記載のニコチンアミドモノヌクレオチド誘導体またはその塩の製造方法。
- 請求項1~4のいずれか一項に記載のニコチンアミドモノヌクレオチド誘導体またはその塩を含有する皮膚外用剤。
- 請求項7に記載の皮膚外用剤を含有する化粧料。
- 請求項1~4のいずれか一項に記載のニコチンアミドモノヌクレオチド誘導体またはその塩を含有する食品添加剤。
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US15/777,756 US10654882B2 (en) | 2015-12-21 | 2016-11-16 | Nicotinamide mononucleotide derivative and salt thereof, method for producing same, topical skin preparation, cosmetic and food additive |
| ES16878213T ES2812456T3 (es) | 2015-12-21 | 2016-11-16 | Derivado de mononucleótido de nicotinamida y sal del mismo, método para producir el mismo, agente tópico, cosmético y aditivo alimentario |
| EP19206089.5A EP3636654A1 (en) | 2015-12-21 | 2016-11-16 | Nicotinamide mononucleotide derivative and salt thereof, method for producing same, topical skin preparation, cosmetic and food additive |
| JP2017557797A JP6803854B2 (ja) | 2015-12-21 | 2016-11-16 | ニコチンアミドモノヌクレオチド誘導体、その塩、その製造方法、皮膚外用剤、化粧料、食品添加剤 |
| EP16878213.4A EP3401323B1 (en) | 2015-12-21 | 2016-11-16 | Nicotinamide mononucleotide derivative and salt thereof, method for producing the same, topical agent, cosmetic and food additive |
| CN201680073930.7A CN108368146B (zh) | 2015-12-21 | 2016-11-16 | 烟酰胺单核苷酸衍生物、其盐、其制造方法、皮肤外用剂、化妆料、食品添加剂 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015249020 | 2015-12-21 | ||
| JP2015-249020 | 2015-12-21 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2017110317A1 true WO2017110317A1 (ja) | 2017-06-29 |
Family
ID=59089343
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2016/083942 WO2017110317A1 (ja) | 2015-12-21 | 2016-11-16 | ニコチンアミドモノヌクレオチド誘導体、その塩、その製造方法、皮膚外用剤、化粧料、食品添加剤 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US10654882B2 (ja) |
| EP (2) | EP3636654A1 (ja) |
| JP (1) | JP6803854B2 (ja) |
| CN (1) | CN108368146B (ja) |
| ES (1) | ES2812456T3 (ja) |
| WO (1) | WO2017110317A1 (ja) |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016135750A (ja) * | 2015-01-23 | 2016-07-28 | 株式会社ベスビオ | 化粧料 |
| WO2019078177A1 (ja) * | 2017-10-16 | 2019-04-25 | めぐみ 田中 | ニコチンアミドモノヌクレオチドを含む化粧品組成物 |
| US10392416B2 (en) | 2015-10-02 | 2019-08-27 | Metro International Biotech, Llc | Crystal forms of beta-nicotinamide mononucleotide |
| WO2019222368A1 (en) * | 2018-05-15 | 2019-11-21 | Jumpstart Fertility Pty Ltd | Amino acid salts of nicotinic acid mononucleotide and nicotinamide mononucleotide as anti-ageing agents |
| US10548913B2 (en) | 2015-08-05 | 2020-02-04 | Metro International Biotech, Llc | Nicotinamide mononucleotide derivatives and their uses |
| US10618927B1 (en) | 2019-03-22 | 2020-04-14 | Metro International Biotech, Llc | Compositions and methods for modulation of nicotinamide adenine dinucleotide |
| CN111093397A (zh) * | 2017-09-14 | 2020-05-01 | 田中惠 | 一种抗衰老剂以及抗衰老方法 |
| US20210230208A1 (en) * | 2018-05-15 | 2021-07-29 | Life Biosciences, Inc. | Inorganic salts of nicotinamide mononucloetide as anti-aging agents |
| US11180521B2 (en) | 2018-01-30 | 2021-11-23 | Metro International Biotech, Llc | Nicotinamide riboside analogs, pharmaceutical compositions, and uses thereof |
| US11787830B2 (en) | 2021-05-27 | 2023-10-17 | Metro International Biotech, Llc | Crystalline solids of nicotinic acid mononucleotide and esters thereof and methods of making and use |
| US11939348B2 (en) | 2019-03-22 | 2024-03-26 | Metro International Biotech, Llc | Compositions comprising a phosphorus derivative of nicotinamide riboside and methods for modulation of nicotinamide adenine dinucleotide |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112823778A (zh) * | 2019-11-21 | 2021-05-21 | 百瑞全球有限公司 | 毛发护理组合物及其制备方法 |
| CN110974781A (zh) * | 2020-01-02 | 2020-04-10 | 崔立峰 | 一种用于皮肤创面修复的凝胶 |
| FR3110410A1 (fr) * | 2020-05-20 | 2021-11-26 | Nuvamid Sa | Compositions cosmétiques anti-âge comprenant de la NMN |
| WO2021234009A1 (fr) * | 2020-05-20 | 2021-11-25 | Nuvamid Sa | Compositions cosmetiques anti-age comprenant du nmn |
| CN114577936A (zh) * | 2022-03-03 | 2022-06-03 | 中科谱研(北京)科技有限公司 | 一种胶囊中β-烟酰胺单核苷酸的分离检测方法 |
| CN114652850B (zh) * | 2022-03-31 | 2023-12-29 | 深圳深创生物药业有限公司 | 一种具有抗衰老作用的多肽偶联nmn化合物及其应用 |
| CN114748379B (zh) * | 2022-05-05 | 2023-10-24 | 有货(北京)信息技术有限公司 | 一种含有nmn的纯结晶型氨基酸洁面膏及其制备方法 |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS61176598A (ja) * | 1985-01-24 | 1986-08-08 | ネオフアルメド・ソチエタ・ペル・アチオニ | シチジン−ジホスフエ−ト−コリンのアシル化誘導体、その製造方法及びその治療的使用 |
| WO2004013083A1 (en) * | 2002-07-26 | 2004-02-12 | Chiesi Farmaceutici S. P. A. | Nolomirole hydrochloride form i |
| JP2007031415A (ja) * | 2004-09-24 | 2007-02-08 | Showa Denko Kk | ヒドロキシクエン酸誘導体類及びこれを含む皮膚外用剤 |
| JP2007522148A (ja) * | 2004-02-06 | 2007-08-09 | スミスクライン・ビーチャム・コーポレイション | カルシウム受容体アンタゴニスト化合物 |
| JP2007254393A (ja) * | 2006-03-23 | 2007-10-04 | Showa Denko Kk | 皮膚外用剤 |
| CN104771330A (zh) * | 2015-03-16 | 2015-07-15 | 邦泰生物工程(深圳)有限公司 | 一种含烟酰胺单核苷酸抗衰老美容护肤品组合物 |
| CN104814974A (zh) * | 2015-03-16 | 2015-08-05 | 邦泰生物工程(深圳)有限公司 | 烟酰胺单核苷酸在制备抗衰老药物或保健品的应用 |
| WO2015186114A1 (en) * | 2014-06-06 | 2015-12-10 | Glaxosmithkline Intellectual Property (No.2) Limited | Nicotinamide riboside analogs and pharmaceutical compositions and uses thereof |
| WO2016117465A1 (ja) * | 2015-01-19 | 2016-07-28 | 昭和電工株式会社 | 化合物、化合物の塩、皮膚外用剤、化粧料及び食品添加剤 |
-
2016
- 2016-11-16 JP JP2017557797A patent/JP6803854B2/ja active Active
- 2016-11-16 EP EP19206089.5A patent/EP3636654A1/en active Pending
- 2016-11-16 ES ES16878213T patent/ES2812456T3/es active Active
- 2016-11-16 CN CN201680073930.7A patent/CN108368146B/zh active Active
- 2016-11-16 EP EP16878213.4A patent/EP3401323B1/en active Active
- 2016-11-16 US US15/777,756 patent/US10654882B2/en active Active
- 2016-11-16 WO PCT/JP2016/083942 patent/WO2017110317A1/ja active Application Filing
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS61176598A (ja) * | 1985-01-24 | 1986-08-08 | ネオフアルメド・ソチエタ・ペル・アチオニ | シチジン−ジホスフエ−ト−コリンのアシル化誘導体、その製造方法及びその治療的使用 |
| WO2004013083A1 (en) * | 2002-07-26 | 2004-02-12 | Chiesi Farmaceutici S. P. A. | Nolomirole hydrochloride form i |
| JP2007522148A (ja) * | 2004-02-06 | 2007-08-09 | スミスクライン・ビーチャム・コーポレイション | カルシウム受容体アンタゴニスト化合物 |
| JP2007031415A (ja) * | 2004-09-24 | 2007-02-08 | Showa Denko Kk | ヒドロキシクエン酸誘導体類及びこれを含む皮膚外用剤 |
| JP2007254393A (ja) * | 2006-03-23 | 2007-10-04 | Showa Denko Kk | 皮膚外用剤 |
| WO2015186114A1 (en) * | 2014-06-06 | 2015-12-10 | Glaxosmithkline Intellectual Property (No.2) Limited | Nicotinamide riboside analogs and pharmaceutical compositions and uses thereof |
| WO2016117465A1 (ja) * | 2015-01-19 | 2016-07-28 | 昭和電工株式会社 | 化合物、化合物の塩、皮膚外用剤、化粧料及び食品添加剤 |
| CN104771330A (zh) * | 2015-03-16 | 2015-07-15 | 邦泰生物工程(深圳)有限公司 | 一种含烟酰胺单核苷酸抗衰老美容护肤品组合物 |
| CN104814974A (zh) * | 2015-03-16 | 2015-08-05 | 邦泰生物工程(深圳)有限公司 | 烟酰胺单核苷酸在制备抗衰老药物或保健品的应用 |
Non-Patent Citations (2)
| Title |
|---|
| IMAI: "A possibility of nutriceuticals as an anti-aging intervention: Activation of sirtuins by promoting mammalian NAD biosynthesis", PHARMACOLOGICAL RESEARCH, vol. 62, no. 1, 1 July 2010 (2010-07-01), pages 42 - 47, XP027046798, ISSN: 1043-6618, Retrieved from the Internet <URL:https://doi.org/10.1016/j.phrs.2010.01.006> * |
| PROCOPIO, A. ET AL.: "Lipophilic Hydroxytyrosol Esters: Fatty Acid Conjugates for Potential Topical Administration", JOURNAL OF NATURAL PRODUCTS, vol. 74, no. 11, 28 November 2011 (2011-11-28), pages 2377 - 2381, XP055395794, ISSN: 0163-3864 * |
Cited By (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016135750A (ja) * | 2015-01-23 | 2016-07-28 | 株式会社ベスビオ | 化粧料 |
| US10548913B2 (en) | 2015-08-05 | 2020-02-04 | Metro International Biotech, Llc | Nicotinamide mononucleotide derivatives and their uses |
| US11878027B2 (en) | 2015-08-05 | 2024-01-23 | Metro International Biotech, Llc | Nicotinamide mononucleotide derivatives and their uses |
| US11464796B2 (en) | 2015-08-05 | 2022-10-11 | Metro International Biotech, Llc | Nicotinamide mononucleotide derivatives and their uses |
| US11059847B2 (en) | 2015-10-02 | 2021-07-13 | Metro International Biotech, Llc | Crystal forms of β-nicotinamide mononucleotide |
| US10392416B2 (en) | 2015-10-02 | 2019-08-27 | Metro International Biotech, Llc | Crystal forms of beta-nicotinamide mononucleotide |
| CN111093397A (zh) * | 2017-09-14 | 2020-05-01 | 田中惠 | 一种抗衰老剂以及抗衰老方法 |
| EP3682746A4 (en) * | 2017-09-14 | 2021-03-10 | Megumi Tanaka | AGING PROTECTION AGENTS AND AGING PROTECTION PROCEDURES |
| US11219590B2 (en) | 2017-09-14 | 2022-01-11 | Megumi Tanaka | Anti-aging agent and anti-aging method |
| WO2019078177A1 (ja) * | 2017-10-16 | 2019-04-25 | めぐみ 田中 | ニコチンアミドモノヌクレオチドを含む化粧品組成物 |
| US11180521B2 (en) | 2018-01-30 | 2021-11-23 | Metro International Biotech, Llc | Nicotinamide riboside analogs, pharmaceutical compositions, and uses thereof |
| WO2019222368A1 (en) * | 2018-05-15 | 2019-11-21 | Jumpstart Fertility Pty Ltd | Amino acid salts of nicotinic acid mononucleotide and nicotinamide mononucleotide as anti-ageing agents |
| JP2021524501A (ja) * | 2018-05-15 | 2021-09-13 | ジャンプスタート ファーティリティ ピーティーワイ リミテッド | 抗加齢剤としてのニコチン酸モノヌクレオチド及びニコチンアミドモノヌクレオチドのアミノ酸塩 |
| US20210230208A1 (en) * | 2018-05-15 | 2021-07-29 | Life Biosciences, Inc. | Inorganic salts of nicotinamide mononucloetide as anti-aging agents |
| JP7432585B2 (ja) | 2018-05-15 | 2024-02-16 | ジャンプスタート ファーティリティ ピーティーワイ リミテッド | 抗加齢剤としてのニコチン酸モノヌクレオチド及びニコチンアミドモノヌクレオチドのアミノ酸塩 |
| US10618927B1 (en) | 2019-03-22 | 2020-04-14 | Metro International Biotech, Llc | Compositions and methods for modulation of nicotinamide adenine dinucleotide |
| US11939348B2 (en) | 2019-03-22 | 2024-03-26 | Metro International Biotech, Llc | Compositions comprising a phosphorus derivative of nicotinamide riboside and methods for modulation of nicotinamide adenine dinucleotide |
| US11787830B2 (en) | 2021-05-27 | 2023-10-17 | Metro International Biotech, Llc | Crystalline solids of nicotinic acid mononucleotide and esters thereof and methods of making and use |
| US11952396B1 (en) | 2021-05-27 | 2024-04-09 | Metro International Biotech, Llc | Crystalline solids of nicotinic acid mononucleotide and esters thereof and methods of making and use |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3401323B1 (en) | 2020-07-08 |
| CN108368146B (zh) | 2021-06-08 |
| US10654882B2 (en) | 2020-05-19 |
| JPWO2017110317A1 (ja) | 2018-10-04 |
| US20180334474A1 (en) | 2018-11-22 |
| CN108368146A (zh) | 2018-08-03 |
| ES2812456T3 (es) | 2021-03-17 |
| EP3401323A1 (en) | 2018-11-14 |
| EP3636654A1 (en) | 2020-04-15 |
| EP3401323A4 (en) | 2019-05-22 |
| JP6803854B2 (ja) | 2020-12-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6803854B2 (ja) | ニコチンアミドモノヌクレオチド誘導体、その塩、その製造方法、皮膚外用剤、化粧料、食品添加剤 | |
| JP4907137B2 (ja) | ヒドロキシクエン酸誘導体類及びこれを含む皮膚外用剤 | |
| JPWO2009084477A1 (ja) | 皮膚外用剤および化粧料 | |
| EP1928402B1 (en) | Carnitine derivative, salt thereof, external skin preparation and cosmetic preparation | |
| JP6389308B1 (ja) | 皮膚外用剤 | |
| WO2009084471A1 (ja) | 乳化皮膚外用剤および化粧料 | |
| JP5047507B2 (ja) | カルニチン誘導体及びその塩、皮膚外用剤ならびに化粧料 | |
| JP4624831B2 (ja) | イノシトール誘導体を含有する皮膚外用剤及び化粧料 | |
| US11045471B2 (en) | Melanin production inhibitor, whitening agent, fibroblast activator, collagen and/or elastin production promotor and wrinkle ameliorant | |
| JP6716470B2 (ja) | 化合物、化合物の塩、皮膚外用剤、化粧料及び食品添加剤 | |
| US20170209354A1 (en) | Multilamellar vesicle preparation containing acyl basic amino acid derivative and physiologically active substance | |
| CN114269333A (zh) | 用于美容或可食用组合物的大麻二酚酸酯 | |
| JP2007254376A (ja) | 養毛化粧料 | |
| WO2015147236A1 (ja) | 組成物、化粧料 | |
| JP2007254388A (ja) | 抗肌荒れ化粧料 | |
| JP6238394B2 (ja) | セラミド産生促進剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 16878213 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2017557797 Country of ref document: JP Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 15777756 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |