WO2013118950A1 - 고체 아민을 함침한 제올라이트 수착제의 제조방법 및 그 방법에 의해 제조된 수착제 - Google Patents
고체 아민을 함침한 제올라이트 수착제의 제조방법 및 그 방법에 의해 제조된 수착제 Download PDFInfo
- Publication number
- WO2013118950A1 WO2013118950A1 PCT/KR2012/005808 KR2012005808W WO2013118950A1 WO 2013118950 A1 WO2013118950 A1 WO 2013118950A1 KR 2012005808 W KR2012005808 W KR 2012005808W WO 2013118950 A1 WO2013118950 A1 WO 2013118950A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- zeolite
- impregnated
- solid amine
- carbon dioxide
- sorbent
- Prior art date
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/30—Processes for preparing, regenerating, or reactivating
- B01J20/32—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D53/00—Separation of gases or vapours; Recovering vapours of volatile solvents from gases; Chemical or biological purification of waste gases, e.g. engine exhaust gases, smoke, fumes, flue gases, aerosols
- B01D53/02—Separation of gases or vapours; Recovering vapours of volatile solvents from gases; Chemical or biological purification of waste gases, e.g. engine exhaust gases, smoke, fumes, flue gases, aerosols by adsorption, e.g. preparative gas chromatography
- B01D53/025—Separation of gases or vapours; Recovering vapours of volatile solvents from gases; Chemical or biological purification of waste gases, e.g. engine exhaust gases, smoke, fumes, flue gases, aerosols by adsorption, e.g. preparative gas chromatography with wetted adsorbents; Chromatography
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D53/00—Separation of gases or vapours; Recovering vapours of volatile solvents from gases; Chemical or biological purification of waste gases, e.g. engine exhaust gases, smoke, fumes, flue gases, aerosols
- B01D53/34—Chemical or biological purification of waste gases
- B01D53/46—Removing components of defined structure
- B01D53/62—Carbon oxides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/02—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof comprising inorganic material
- B01J20/10—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof comprising inorganic material comprising silica or silicate
- B01J20/16—Alumino-silicates
- B01J20/18—Synthetic zeolitic molecular sieves
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/02—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof comprising inorganic material
- B01J20/10—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof comprising inorganic material comprising silica or silicate
- B01J20/16—Alumino-silicates
- B01J20/18—Synthetic zeolitic molecular sieves
- B01J20/186—Chemical treatments in view of modifying the properties of the sieve, e.g. increasing the stability or the activity, also decreasing the activity
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/30—Processes for preparing, regenerating, or reactivating
- B01J20/32—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating
- B01J20/3202—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating characterised by the carrier, support or substrate used for impregnation or coating
- B01J20/3204—Inorganic carriers, supports or substrates
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/30—Processes for preparing, regenerating, or reactivating
- B01J20/32—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating
- B01J20/3231—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating characterised by the coating or impregnating layer
- B01J20/3242—Layers with a functional group, e.g. an affinity material, a ligand, a reactant or a complexing group
- B01J20/3244—Non-macromolecular compounds
- B01J20/3246—Non-macromolecular compounds having a well defined chemical structure
- B01J20/3248—Non-macromolecular compounds having a well defined chemical structure the functional group or the linking, spacer or anchoring group as a whole comprising at least one type of heteroatom selected from a nitrogen, oxygen or sulfur, these atoms not being part of the carrier as such
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/30—Processes for preparing, regenerating, or reactivating
- B01J20/32—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating
- B01J20/3231—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating characterised by the coating or impregnating layer
- B01J20/3242—Layers with a functional group, e.g. an affinity material, a ligand, a reactant or a complexing group
- B01J20/3244—Non-macromolecular compounds
- B01J20/3246—Non-macromolecular compounds having a well defined chemical structure
- B01J20/3248—Non-macromolecular compounds having a well defined chemical structure the functional group or the linking, spacer or anchoring group as a whole comprising at least one type of heteroatom selected from a nitrogen, oxygen or sulfur, these atoms not being part of the carrier as such
- B01J20/3251—Non-macromolecular compounds having a well defined chemical structure the functional group or the linking, spacer or anchoring group as a whole comprising at least one type of heteroatom selected from a nitrogen, oxygen or sulfur, these atoms not being part of the carrier as such comprising at least two different types of heteroatoms selected from nitrogen, oxygen or sulphur
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/30—Processes for preparing, regenerating, or reactivating
- B01J20/32—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating
- B01J20/3231—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating characterised by the coating or impregnating layer
- B01J20/3242—Layers with a functional group, e.g. an affinity material, a ligand, a reactant or a complexing group
- B01J20/3244—Non-macromolecular compounds
- B01J20/3246—Non-macromolecular compounds having a well defined chemical structure
- B01J20/3248—Non-macromolecular compounds having a well defined chemical structure the functional group or the linking, spacer or anchoring group as a whole comprising at least one type of heteroatom selected from a nitrogen, oxygen or sulfur, these atoms not being part of the carrier as such
- B01J20/3255—Non-macromolecular compounds having a well defined chemical structure the functional group or the linking, spacer or anchoring group as a whole comprising at least one type of heteroatom selected from a nitrogen, oxygen or sulfur, these atoms not being part of the carrier as such comprising a cyclic structure containing at least one of the heteroatoms nitrogen, oxygen or sulfur, e.g. heterocyclic or heteroaromatic structures
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2252/00—Absorbents, i.e. solvents and liquid materials for gas absorption
- B01D2252/20—Organic absorbents
- B01D2252/204—Amines
- B01D2252/2041—Diamines
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2252/00—Absorbents, i.e. solvents and liquid materials for gas absorption
- B01D2252/20—Organic absorbents
- B01D2252/204—Amines
- B01D2252/20436—Cyclic amines
- B01D2252/20442—Cyclic amines containing a piperidine-ring
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2252/00—Absorbents, i.e. solvents and liquid materials for gas absorption
- B01D2252/20—Organic absorbents
- B01D2252/204—Amines
- B01D2252/20436—Cyclic amines
- B01D2252/20447—Cyclic amines containing a piperazine-ring
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2252/00—Absorbents, i.e. solvents and liquid materials for gas absorption
- B01D2252/20—Organic absorbents
- B01D2252/204—Amines
- B01D2252/20478—Alkanolamines
- B01D2252/20484—Alkanolamines with one hydroxyl group
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2253/00—Adsorbents used in seperation treatment of gases and vapours
- B01D2253/10—Inorganic adsorbents
- B01D2253/106—Silica or silicates
- B01D2253/108—Zeolites
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2253/00—Adsorbents used in seperation treatment of gases and vapours
- B01D2253/20—Organic adsorbents
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2253/00—Adsorbents used in seperation treatment of gases and vapours
- B01D2253/30—Physical properties of adsorbents
- B01D2253/302—Dimensions
- B01D2253/306—Surface area, e.g. BET-specific surface
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2253/00—Adsorbents used in seperation treatment of gases and vapours
- B01D2253/30—Physical properties of adsorbents
- B01D2253/302—Dimensions
- B01D2253/308—Pore size
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2253/00—Adsorbents used in seperation treatment of gases and vapours
- B01D2253/30—Physical properties of adsorbents
- B01D2253/302—Dimensions
- B01D2253/311—Porosity, e.g. pore volume
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2257/00—Components to be removed
- B01D2257/50—Carbon oxides
- B01D2257/504—Carbon dioxide
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/20—Air quality improvement or preservation, e.g. vehicle emission control or emission reduction by using catalytic converters
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02C—CAPTURE, STORAGE, SEQUESTRATION OR DISPOSAL OF GREENHOUSE GASES [GHG]
- Y02C20/00—Capture or disposal of greenhouse gases
- Y02C20/40—Capture or disposal of greenhouse gases of CO2
Definitions
- the present invention relates to a technique for capturing and storing carbon dioxide, and more particularly, to a molded zeolite impregnated with a solid amine and a method of manufacturing the same.
- CO2 emissions are expected to increase from 28 gigatons in 2005 to 57 gigatons by 2050.
- 14 gigatons of carbon dioxide emissions should be maintained in 2050, which means that emissions should be held at half of 2005 emissions.
- CCS carbon dioxide capture & storage
- adsorption method selectively separates carbon dioxide by using affinity between molecules on the surface of gas and solid, which is easy to operate, requires low maintenance and energy, and can apply various adsorbents according to the characteristics of the process.
- Xiaoliang Xu, Xingxiang Zhao, Linbing Sun, Xiaoqin Liu "Adsorption separation of carbon dioxide, methane and n ⁇ itrogen on monoethanol amine modified ⁇ -zeolite", Journal of Natural Gas Chemistry 18 (2009) 167-172).
- adsorbent Depending on the type of adsorbent, carbon dioxide separation efficiency is highly dependent (Drage, TC, Smith, KM, Arenillas, A., Blackman.JM and Sanpe, CE, "Development of Strategies for the Regeneration of Polythylenimine Based CO2 Adsorption", Prepr. Pap -Am.Chem.Soc., Div.Fuel Chem., 51 (1), 112 (2006)), and used adsorbents include activated carbon, aluminum oxide, zeolite, carbon molecular sieve, hollow silica, etc.
- zeolites are called molecular sieves because they adsorb according to the size, shape or characteristics of the molecules constituting the mixture.
- MCM-41 silica is a sorbent prepared by impregnating poly ethyleneimine (PEI) in a "molecular basket” (Xu, X., Song, C. and Andresen, JM, "Preparation and Characterization of Novel CO2 Molecular Basket Adsorbents) Based on Polymer-modified Mesoporous Molecular Sieve MCM-41 ", Micro. Meso.
- PEI poly ethyleneimine
- the sorption agent prepared by impregnating the adsorbent with the adsorbent is adsorbed and absorbed at the same time (hereinafter referred to as sorption capacity).
- sorption capacity The sorption agent prepared by impregnating the adsorbent with the adsorbent is adsorbed and absorbed at the same time (hereinafter referred to as sorption capacity).
- MEA monoethanolamine
- the sorption capacity of carbon dioxide may be lower than that of the molded zeolite itself.
- the present invention was devised to solve the above-mentioned conventional problems, piperazine has been used as a mixture to improve the absorption rate of tertiary amine because the reaction rate with carbon dioxide is 10 times faster than MEA as a cyclic amine structure material (Piperazine, PZ) is impregnated into the molded zeolite to improve the carbon dioxide sorption capacity. That is, the present invention provides a molded zeolite sorbent impregnated with piperazine, which can be utilized for separating carbon dioxide from combustion exhaust gas, and a method of manufacturing the same.
- a molded zeolite sorbent impregnated with piperazine which can be utilized for separating carbon dioxide from combustion exhaust gas, and a method of manufacturing the same.
- the present invention comprises the steps of preparing a solid amine aqueous solution; Adding molded zeolite to the solid amine aqueous solution; Impregnating the zeolite solution in a vacuum state; It provides a method for producing a zeolite sorbent impregnated with a solid amine, comprising the step of drying the impregnation solution.
- the present application also comprises the impregnation step is performed for about 2 to 8 hours at a temperature of about 30 to 90 °C, the drying step is about 90 to about 90 to about 3 to 5 hours after maintaining the impregnation at about 20 to 30 °C
- a method for preparing a zeolite sorbent impregnated with a solid amine comprising drying in a vacuum oven at 110 ° C. for about 10 to 30 hours.
- the present application also provides a method for preparing a zeolite sorbent impregnated with a solid amine, wherein the aqueous solid amine solution further comprises about 1 to 10% by volume of methyl alcohol.
- the present application also relates to solid amines of the present disclosure comprising 1,3-diamino-2-propanol, butylenediamine, 1,4 butylenediamine, hexamethylenediamine, 2,2-dimethyl-1,3-propanediamine, 2-methyl Piperazine, 2,3-dimethylpiperazine, 2,5-dimethylpiperazine, 1- (3-hydroxypropyl), cis 2,6-dimethyl-piperazine, trans 2,5-dimethyl-piperazine, 2
- Preparation of zeolite sorbents impregnated with at least one solid amine selected from the group consisting of -methyl piperazine, 2-peperidinethanol, 3-piperidineethanol, 4-piperidineethanol, homopiperazine and pyrrazine Provide a method.
- the present application also provides a method for preparing a zeolite sorbent impregnated with a solid amine, wherein the solid amine herein is included in an amount determined in consideration of its solubility, density, viscosity or surface tension.
- the present application also provides a process for preparing a zeolite sorbent impregnated with a solid amine, wherein the solid amine of the present disclosure is comprised in about 1 to 100% by weight, depending on solubility.
- the present application provides a method for preparing a zeolite sorbent impregnated with a solid amine, wherein pyreazine is used as the solid amine, and the piperazine is included in an amount of about 1 to 15% by weight.
- the present application also provides a method for preparing a zeolite sorbent impregnated with a solid amine, wherein the shaped zeolite used herein is added in an amount of about 2 to 100 g per about 100 ml of the aqueous solid amine solution.
- the application also provides a zeolite sorbent impregnated with a solid amine prepared according to the method herein.
- the present application also provides a method for capturing carbon dioxide comprising the use of a sorbent prepared according to the method herein.
- the sorption capacity of carbon dioxide removal of the PZ-impregnated molded zeolite sorbent is superior to the adsorption capacity of carbon dioxide removal capacity of the molded zeolite itself before PZ impregnation.
- the temperature at which combustion flue gas is discharged to the atmosphere it shows 1.8 times higher sorption capacity than the adsorption capacity of molded zeolite before impregnation, and 20 times more carbon dioxide sorption capacity than the sorption capacity of zeolite sorbent impregnated with MEA. Can be used effectively.
- 1A and 1B are XRD patterns of MEA, PZ impregnated zeolite 13X pellets: (a) MEA impregnation and (b) PZ impregnation.
- 2A and 2B are FT-IR patterns of MEA, PZ impregnated zeolite 13X pellets: (a) MEA impregnation and (b) PZ impregnation.
- 3A-3C are N 2 isothermal adsorption and desorption curves of adsorbent and sorbent: (a) zeolite 13X pellets; (b) 50% by weight MEA impregnated zeolite pellets; And (c) 50 wt% PZ impregnated zeolite pellets.
- 5 is a graph of carbon dioxide sorption amount of PZ-impregnated zeolite 13X pellets with temperature.
- 6A-6C are graphs comparing the carbon dioxide sorption amount of MEA impregnated zeolite 13X pellets and PZ impregnated zeolite 13X pellets: (a) 25 ° C .; (b) 50 ° C .; And (c) 75 ° C.
- the present application relates to a method for preparing a sorbent prepared by impregnating a molded zeolite with a solid amine.
- the method herein comprises preparing a solid amine aqueous solution; Adding molded zeolite to the solid amine aqueous solution; Impregnating the zeolite solution; Drying the impregnation solution.
- the term “sorbent” refers to the impregnation of an adsorbent that separates carbon dioxide by chemical bonding with a compound such as an amine, into an adsorbent that physically separates carbon dioxide by pores, such as zeolites.
- the removal capacity is called the adsorption capacity and the carbon dioxide removal capacity of the sorbent is called a sorption capacity, and generally the adsorption capacity and the sorption capacity are used in the same sense, and thus, the sorption capacity and the adsorption capacity can be used interchangeably.
- the molded zeolite is used by impregnating a solid amine to improve the carbon dioxide removal ability of the molded zeolite used as the carbon dioxide adsorbent.
- the solid amine refers to an amine that can be solidified at room temperature, and various materials known in the art may be used.
- the solid amine that may be used herein is a cyclic amine, which is superior to the aliphatic amine, and may include a material capable of maintaining a solid state at room temperature. Maintaining a solid form at room temperature has the advantage of not blocking pores that affect the performance of the adsorbent when the solid amine is impregnated into the solid adsorbent.
- a representative example of a material having such a feature is piperazine, and when a material having a similar property is used as a separation medium, excellent carbon dioxide sorption capacity can be obtained.
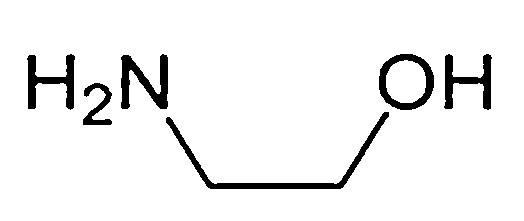
- Solid amines that may be used herein include, for example, 1,3-diamino-2-propanol, butylene diamine, 1,4 butylene diamine (1 , 4-butylene diamine), hexamethylene diamine, 2,2-dimethyl-1,3-propanediamine, 2-methylpiperazine (2- methylpiperazine), 2,3-dimethylpiperazine, 2,5-dimethylpiperazine, 1- (3-hydroxylpropyl) piperazine), cis 2,6-dimethyl-piperazine, trans 2,5-dimethyl-piperazine, 2-methyl piperazine (2 -methyl piperazine, 2-piperidine ethanol, 3-piperidine ethanol, 4-piperidine ethanol, 4-piperidine ethanol, homo piperazine ) And pyreazine.
- the solid amine is included in an amount of about 1 to 15% by weight. In one implementation, pyrazine is used.
- the aqueous solid amine solution in the present method may further comprise about 1 to 10% by volume of methyl alcohol.
- methyl alcohol and water may be used as a solvent, and when methyl alcohol is used as a solution, the solubility of the amine may be increased.
- methyl alcohol When methyl alcohol is included in the impregnation solution, about 1 to 10% by volume of methyl alcohol is added thereto and then mixed to prepare an aqueous solution.
- the amount of solid amine used depends specifically on the type of solid amine used, and may be determined in consideration of the solubility, density, viscosity, and surface tension of the solid amine used.
- Solid amines may be included in amounts of about 1 to 100 weight percent based on water.
- piperazine may be mixed at about 1 to 15% by weight to prepare a solution that can be impregnated with the adsorbent.
- the prepared solution is added to about 100 ml of a solid amine solution, for example, by adding about 2 to 100 g of zeolite in accordance with the amount of amine impregnated in the zeolite to adjust the ratio of impregnation.
- the impregnation amount can be adjusted, for example, so that the impregnation amount of the solid amine with respect to zeolite 13X is 30, 50, or 70% by weight.
- the impregnation process can be carried out using a rotary evaporator, for example, and can be carried out, for example, for about 2 to 8 hours at 30-90 ° C. in a vacuum, for example at about 50-600 mmHg.
- a drying step is performed, and firstly, maintained at room temperature, for example, 3 to 5 hours at 20 to 30 ° C., so that the impregnated amine is sufficiently fixed to the zeolite, and then to about 90 to 100 ° C. to completely remove moisture. It is kept dry for about 10 to 30 hours in a controlled vacuum oven.
- the present application relates to zeolite sorbents impregnated with solid amines prepared according to the methods herein.
- the present application relates to a carbon dioxide capture method comprising the use of a zeolite sorbent impregnated with a solid amine prepared according to the methods herein.
- the method of capturing carbon dioxide using a zeolite adsorbent is known and can be used, for example, as described in the following literatures: preparation of a honeycomb adsorbent carrying a zeolite, such as a bait species, and carbon dioxide adsorption properties thereof, J. Korean Ind. Eng. Chem., Vol. 20, No. 6, December 2009, 663-669.
- an aqueous solution is prepared by adding 5% by volume of methyl alcohol based on water, and then mixing PZ (Samchun pure chemical CO ,. 99.0%) by 10% by weight based on water to impregnate the adsorbent.
- the solution was prepared.
- Zeolite was then added to the prepared solution.
- the amount of solution and zeolite was adjusted according to the amount of amine impregnation on the zeolite.
- zeolites impregnated with 30, 50, and 70% by weight of PZ or MEA were prepared.
- 10 g of zeolite was added to 30, 50, and 70 ml of impregnation, respectively.
- the zeolite was impregnated with amine using a rotary evaporator, and the temperature was performed at 80 ° C. for 5 hours in a vacuum state of 50-600 mmHg.
- the drying process was carried out, and after maintaining for 4 hours at 25 °C, the molded zeolite impregnated with MEA or PZ was maintained for 24 hours in a vacuum oven controlled at 100 °C sufficiently dried It was.
- the physical and chemical characteristics of the molded zeolite 13X prepared in Example 1 were compared with those of the molded zeolite 13X adsorbent impregnated with MEA and PZ.
- XRD x-ray diffractometer, rigaku Co., M / N: D / MAX 2500H
- M / N D / MAX 2500H
- XRD XRD was used to characterize the molded zeolite and the molded zeolite impregnated with MEA and PZ, and the analysis results are shown in FIG. 1.
- (a) is the XRD result of the sorbent impregnated with the molded zeolite 13X by impregnating the molded zeolite 13X with 3, 5, or 7 weight% of MEA.
- the two peaks indicated by dots indicate that the sensitivity of the XRD peaks decreased as the MEA concentration increased. This was judged to decrease as the MEA concentration was increased by canceling the peak of the molded zeolite, which was previously described in theorys and Applications of Chem. Eng., 2007, Vol. 13, No. 2].
- (b) shows the XRD results of the molded zeolite 13X impregnated with 3, 5, or 7 wt% PZ at different concentrations of the molded zeolite 13X and PZ.
- XRD peak sensitivity is lowering. The reason is considered to be the same phenomenon as MEA.
- FT-IR was measured and the results are shown in FIG. 2.
- (a) is the result of measuring FT-IR after impregnating in molded zeolite 13X by making MEA impregnation concentration 3, 5, or 7 weight%.
- a peak of the absorption region OH alcohol of a wide intensity was observed at 3278 cm ⁇ 1 .
- 2934 ⁇ 2874cm -1 is between the absorption region of the intermediate intensity of the CH stretch peak was observed the absorption zone a primary amine NH peak of the intermediate intensity between 1648 to 1581cm -1 were observed. That is, it can be seen that the intensity of the peak of the FT-IR increases with the concentration of the MEA impregnation. Before the MEA impregnation, neither the OH peak nor the NH peak could be found, but after the MEA impregnation, the OH peak and the NH peak could be identified. This shows that the zeolite 13X pellets were impregnated with MEA.
- (b) is a result of measuring FT-IR after impregnating the molded zeolite 13X with a PZ impregnation concentration of 3, 5, or 7% by weight.
- the peak of the strong zeolite 13X impregnated with 3 wt% PZ with strong intensity of the peak showed an NH peak at 1637 cm ⁇ 1 as an absorption region of weak acid intensity.
- the peaks of 50 and 70 wt% PZ impregnated molded zeolite 13X it can be seen that there is no significant difference. It is determined that the amount of PZ affects the peak.
- NH peaks were not identified before PZ impregnation, but NH peaks were observed after PZ impregnation, indicating that PZ was impregnated into the molded zeolite 13X.
- the surface area of the molded zeolite 13X was 613.53 m 2 / g and the pore volume was measured to be 29.35 ⁇ 10 ⁇ 2 cm 3 / g.
- the specific surface area and pore volume of the MEA impregnated molded zeolite 13X show that it decreases gradually with increasing weight ratio of the impregnated amine. This result is believed to be due to blocking pores during impregnation because the MEA molecular diameter is larger than the molded zeolite 13X.
- FIG. 3 shows an N 2 isothermal desorption curve.
- FIG. 4 shows the carbon dioxide adsorption capacity by temperature after impregnating the molded zeolite with a weight ratio of 0, 30, 50 or 70% by weight of MEA, respectively. Detailed results thereof are shown in Table 3. As the adsorbed temperature increases, the adsorbed capacity decreases and the high adsorption capacity is 83.02 mg-CO 2 / gr-sorbent at 25 °C. However, as the adsorption temperature increased to 75 °C, the adsorption capacity rapidly decreased to 28.4 mg-CO 2 / gr-sorbent.
- the temperature generated during thermal power generation 43.8 mg-CO 2 / gr-sorbent shows a decrease in adsorption capacity of about 1/2 of 25 °C.
- the reason for the rapid decrease in adsorption capacity according to the temperature is that the adsorption capacity depends on the temperature because the zeolite adsorbent separates carbon dioxide by physical performance.
- the molded zeolite sorbent impregnated with MEA has a lower carbon dioxide sorption capacity than that of zeolite itself. That is, since it exhibits a very low sorption capacity compared with the molded zeolite, the sorbent impregnated with the MEA in the molded zeolite becomes ineffective.
- MEA impregnated molded zeolites show little specific surface area compared to molded zeolites as shown in Table 2. When the carbon dioxide is separated by using the adsorbent, the specific surface area that the carbon dioxide can come into contact with the sorbent is very important. However, the impregnated MEA in the molded zeolite almost eliminates the specific surface area, so the adsorption capacity is very low since there is no site where carbon dioxide can contact the surface of the sorbent.
- FIG. 5 The result of measuring carbon dioxide adsorption performance after impregnating PZ as an aromatic amine in the molded zeolite is shown in FIG. 5.
- the carbon dioxide adsorption capacity according to the temperature 25 ° C., 50 ° C., 75 ° C.
- Table 4 detailed results thereof are shown in Table 4.
- the carbon dioxide sorption capacity of the sorbent impregnated with PZ in the molded zeolite was increased.
- Zeolite impregnated with PZ showed a carbon dioxide adsorption capacity similar to that of the molded zeolite at 25 ° C., but higher adsorption capacity than that of the molded zeolite at 50 ° C. and 75 ° C. Especially at 50 °C, the discharge temperature of combustion flue gas after coal-fired power generation, the molded zeolite shows 43.8 mg-CO 2 / gr-sorbent, whereas the PZ-impregnated zeolite is 78.7 mg-CO 2 / gr-sorbent PZ impregnated molding The adsorption capacity of the zeolite was 1.8 times higher than that of the molded zeolite.
- the zeolite impregnated with PZ has a specific surface area of 564 to 569 m 2 / g, and the specific surface area does not decrease even after PZ impregnation, compared to the specific surface area of 613 m 2 / g of the molded zeolite.
- the specific surface area can be prevented from lowering. Since PZ is impregnated into the zeolite without blocking the pores, the physical adsorption capacity of carbon dioxide is increased by the zeolite with a small pore as the adsorbent, and the chemical absorption capacity of the carbon dioxide is increased by the impregnated chemical absorbent PZ.
- 6 shows the results of comparing the adsorption capacity of carbon dioxide with temperature after impregnating MEA and PZ in the molded zeolite.
- 6 (a) shows the sorption capacity at 25 ° C. The figure shows that the CO2 sorption capacity does not change even if the impregnated amounts of MEA and PZ increase. This is because the molded zeolite has a limit impregnation amount of amine, and the impregnation limit value is 30% by weight or less.
- (b) and (c) shows a result similar to (a) as a result of comparing carbon dioxide sorption capacity after impregnation at 50 ° C and 75 ° C.
- the emission temperature of combustion flue gas in the power generation using fossil fuel shows more than 20 times more CO2 absorption capacity than MEA when PZ impregnated, and shows high adsorption capacity even when compared with molded zeolite. It can be seen that there is a high possibility of use as a separation medium.
Landscapes
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Inorganic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Environmental & Geological Engineering (AREA)
- Solid-Sorbent Or Filter-Aiding Compositions (AREA)
Abstract
본원은 고체 아민을 함침한 성형 제올라이트 및 그 제조방법에 관한 것이다. 본원의 방법으로 제조된 제올라이트는 고체 아민이 함침되지 않은 제올라이트 및 MEA가 함친된 제올라이트와 비교하여 월등한 이산화탄소 수착능을 갖는다. 또한 연소 배기 가스가 대기 중으로 배출되는 온도에서도 기존의 것과 비교하여 높은 흡착능을 가져, 이산화탄소 포집에 효과적으로 사용될 수 있다.
Description
본원은 이산화탄소를 포집하고 저장하는 기술에 관한 것으로, 구체적으로 고체 아민을 함침한 성형 제올라이트 및 그 제조방법에 관한 것이다.
지구 온난화는 해수면 상승, 기근, 말라리아와 같은 질병의 발생, 물 부족 현상 등의 변화와 같은 지구 생태계를 교란시키는 결과를 초래하여 인류에 큰 재항을 불러 오게 될 것으로 예상된다. 따라서 1992년 6월 브라질의 리우환경회의에서 지구온난화에 따른 이상기후현상을 예방하기 위한 목적으로 기후변화에 관한 국제연합 기본협약(UNFCCC: United National Framework Convention on Climate Change)이 채택되었으며, 이후 지구 온난화 방지를 위한 기후변화협약이 진행되고 있다.
국제에너지기구(IEA, International Energy Association)가 발표한 Energy Technology Perspective 2050에 따르면, 이산화탄소 배출량은 2005년 28 기가톤(giga ton)에서 2050년 57기가톤으로 증가할 것으로 본다. 안정적 지구환경을 유지하기 위해서는 2050년에 14 기가톤의 이산화탄소 배출이 유지되어야 하며, 이는 2005년 이산화탄소 배출량의 1/2수준으로 배출을 억제해야 한다는 것을 의미한다.
따라서 이산화탄소를 획기적으로 저감하는 기술개발이 필요하며, 이산화탄소 저감기술 중 약 20%를 차지하는 이산화탄소 포집 및 저장(CCS, Carbon dioxide Capture & Storage)기술의 개발이 특히 중요하다. CCS의 실용화를 위해서는 이산화탄소 포집비용을 저감해야 하고, 구체적으로 포집을 위한 혁신적인 분리매체와 이를 이용한 공정을 개발해야 한다.
현재 이산화탄소를 포집, 분리하는 기술에는 막분리법, 흡수법, 흡착법이 있으며 각각에 대한 연구가 활발히 진행 중에 있다. 그 중 흡착법은 기체와 고체 표면에서 분자 사이의 친화력을 이용해 의해 이산화탄소를 선택적으로 분리하는 것으로, 조작이 간편하고 유지 보수 및 에너지 요구량이 낮으며, 공정의 특성에 따라 다양한 흡착제를 적용할 수 있는 장점(Xiaoliang Xu, Xingxiang Zhao, Linbing Sun, Xiaoqin Liu, "Adsorption separation of carbon dioxide, methane and n`itrogen on monoethanol amine modified β-zeolite", Journal of Natural Gas Chemistry 18(2009)167-172)이 있다. 흡착제의 종류에 따라 이산화탄소 분리 효율이 크게 좌우(Drage, T. C., Smith, K. M., Arenillas, A., Blackman. J. M. and Sanpe, C. E., "Development of Strategies for the Regeneration of Polythylenimine Based CO2 Adsorption", Prepr. Pap.-Am. Chem.Soc., Div. Fuel Chem., 51(1),112(2006))되며, 사용되는 흡착제로는 활성탄, 알루미늄 산화물, 제올라이트, 탄소 분자체, 중공성 실리카 등(Youngmin Cho, Ji-Yun Lee, Soon-Bark Kwon, Duck-Shin Park, Jin-Sik Choi and Ju-Yeol Lee, "Adsorption and Desorption Characteristics of Carbon Dioxide at Low Concentration on Zeolite 5A and 13X", J. KOSAE Vol. 27, No. 2(2011) pp. 191~200)이 있다. 그 중 제올라이트는 혼합물을 구성하고 있는 분자들의 크기, 모양 또는 특성에 따라 흡착하기 때문에 분자체라고 불리기도 하며 높은 흡착력을 가지고 있을 뿐만 아니라 선택성이 높아 이산화탄소 분리에 유리하다.
그러나 제올라이트 등 고체 흡착제는 분리 특성에 의하여 이산화탄소를 분리하기 때문에 이산화탄소 제거능력에 한계가 있으므로, 이를 극복하기 위하여 이산화탄소를 흡수하는 아민 기반의 흡수제를 흡착제에 함침하는 연구가 국내외에서 다양하게 수행되고 있다.
예를 들어, MCM-41 실리카에 poly ethyleneimine (PEI)을 함침시켜 제조한 수착제인 "molecular basket"(Xu, X., Song, C. and Andresen, J. M., "Preparation and Characterization of Novel CO2 Molecular Basket Adsorbents Based on Polymer-modified Mesoporous Molecular Sieve MCM-41", Micro. Meso. Mater., 62, 29-45(2003)), 제올라이트 13X에 monoethanolamine (MEA)을 함침한 수착제(Chatti, R., Bansiwal, A.K., Thote, J.A., Kumar, V., Jadhav, P., Lokhande, S.K., Biniwale, R.B., Labhsetwar, N. K., Rayalu, S. S., "Amine loaded zeolites for carbon dioxide capture: Amine loading and adsorption studies", Microporous Mesoporous Mater. 121, 84-89 (2009)), 활성탄과 제올라이트 13X에 monoethanolamine (MEA), triethanolamine (TEA)를 함침한 수착제(Diogo P. BezerraRonan S. Oliveira Rodrigo S. Vieira Celio L. Cavalcante Jr. Diana C.S. Azevedo, "Adsorption of CO2 on nitrogen-enriched activated carbon and zeolite 13X", Adsorption (2011) 17: 235-246 DOI 10.1007/s10450-011-9320-z), MEA가 함침된 메조포러스 수착제(Ye-Won Park, Il-Hyun Beak, Sang-Do Park, Jae-Wook Lee and So-Jin park, "CO2 Removal using MEA (monoethanolamine) Impregnated Mesoporous Materials", Korean Chem. Eng. Res., Vol. 45, No. 6, December, 2007, pp. 573-581) 등이 있다.
이와 흡착제에 함침물질을 함침하여 제작한 수착제는 흡착과 흡수를 동시에 하게(이하 이를 수착능이라 한다.) 되어 흡착제 자체보다는 이산화탄소 제거효과가 뛰어난 것이 일반적이다. 그러나, 흡착제로 사용되는 성형 제올라이트에 함침 물질로 모노에탄올아민(monoethanolamine, MEA)을 사용하여 수착제를 제조한 경우, 기대한 만큼 이산화탄소 제거효과를 얻기 어렵고, 특히 연소 배기가스의 대기 중 방출온도인 50℃에서는 오히려 성형 제올라이트 자체를 사용했을 때보다 이산화탄소 수착능이 감소하기도 한다. 따라서 성형 제올라이트를 이용한 수착제 제조를 위해서는, 성형 제올라이트에 함침하여 수착능을 향상시킬 수 있는 최적의 고체 아민을 발굴하고, 상기 발굴된 고체아민을 함침하기 위한 이용한 함침 기술의 개발이 필요하다.
본원은 전술한 종래의 문제점을 해결하기 위해 안출된 것으로, 고리형 아민 구조 물질로써 이산화탄소와의 반응속도가 MEA보다 10여배 빠르기 때문에 3급 아민의 흡수 속도를 향상시키기 위해 혼합제로 사용되어 온 피페라진 (Piperazine, PZ)을 성형 제올라이트에 함침하여 이산화탄소 수착능을 향상시키고자 한다. 즉, 연소 배기가스 중 이산화탄소 분리용으로 활용가능 한, 피페라진이 함침된 성형 제올라이트 수착제 및 그 제조방법을 제공하고자 한다.
본원은 고체 아민 수용액을 준비하는 단계; 상기 고체 아민 수용액에 성형 제올라이트를 첨가하는 단계; 상기 제올라이트 용액을 진공상태에서 함침하는 단계; 상기 함침 용액을 건조하는 단계를 포함하는, 고체 아민을 함침한 제올라이트 수착제를 제조하는 방법을 제공한다.
본원은 또한 상기 함침단계는 약 30 내지 90℃의 온도에서 약 2 내지 8 시간 동안 수행되고, 상기 건조 단계는 함침물을 약 20 내지 30℃에서 약 3 내지 5시간 동안 유지한 후, 약 90 내지 110℃의 진공 오븐에서 약 10 내지 30시간 건조하는 단계를 포함하는, 고체 아민을 함침한 제올라이트 수착제를 제조하는 방법을 제공한다.
본원은 또한 고체 아민 수용액은 메틸 알콜을 약 1 내지 10 부피% 추가로 포함하는, 고체 아민을 함침한 제올라이트 수착제의 제조방법을 제공한다.
본원은 또한 본원의 고체 아민은 1,3-디아미노-2-프로판올, 부틸렌디아민, 1,4 부틸렌 디아민, 헥사메틸렌디아민, 2,2-디메틸-1,3-프로판디아민, 2-메틸피페라진, 2,3-디메틸피페라진, 2,5-디메틸피페라진, 1-(3-하이드록실프로필), 시스 2,6-디메틸-피페라진, 트랜스 2,5-디메틸-피페라진, 2-메틸 피페라진, 2-페페리딘에탄올, 3-피페리딘에탄올, 4-피페리딘에탄올, 호모피페라진 및 피레라진으로 구성되는 군으로부터 선택되는 하나 이상인 고체 아민을 함침한 제올라이트 수착제의 제조방법을 제공한다.
본원은 또한 본원의 고체 아민은 그 용해도, 밀도, 점도 또는 표면장력을 고려하여 결정되는 양으로 포함되는, 고체 아민을 함침한 제올라이트 수착제의 제조방법을 제공한다.
본원은 또한 본원의 고체 아민은 용해도에 따라 약 1 내지 100 중량%로 포함되는, 고체 아민을 함침한 제올라이트 수착제의 제조방법을 제공한다.
본원은 고체아민으로서, 피레라진이 사용되며, 상기 피페라진은 약 1 내지 15 중량%의 양으로 포함되는, 고체 아민을 함침한 제올라이트 수착제의 제조방법을 제공한다.
본원은 또한 본원에 사용되는 성형 제올라이트는 상기 고체 아민 수용액 약 100ml 당 약 2 내지 100g의 양 으로 추가되는 것인, 고체 아민을 함침한 제올라이트 수착제의 제조방법을 제공한다.
본원은 또한 본원의 방법에 따라 제조된 고체 아민을 함침한 제올라이트 수착제를 제공한다.
본원은 또한 본원의 방법에 따라 제조된 수착제의 사용을 포함하는 이산화탄소 포집 방법을 제공한다.
본원의 PZ이 함침된 성형 제올라이트 수착제의 이산화탄소 제거능력인 수착능은 PZ 함침전 성형 제올라이트 자체의 이산화탄소 제거능력인 흡착능보다 뛰어나다. 연소 배가스가 대기 중으로 배출되는 온도인 50℃에서도 함침전 성형 제올라이트의 흡착능에 비해 1.8배 높은 수착능을 나타내고, MEA를 함침한 제올라이트 수착제의 수착능에 비해서는 20배 이상의 이산화탄소 수착능을 나타내어 이산화탄소 포집에 효과적으로 사용될 수 있다.
도 1a 및 도 1b는 MEA, PZ 함침된 제올라이트 13X 펠릿의 XRD 패턴이다: (a) MEA 함침 및 (b) PZ 함침.
도 2a 및 도 2b는 MEA, PZ 함침된 제올라이트 13X 펠릿의 FT-IR 패턴이다: (a) MEA 함침 및 (b) PZ 함침.
도 3 a 내지 도 3c는 흡착제, 및 수착제의 N2 등온 흡탈착 곡선이다: (a) 제올라이트 13X 펠릿; (b) 50중량% MEA 함침 제올라이트 펠릿; 및 (c) 50중량% PZ 함침 제올라이트 펠릿.
도 4는 온도에 따른 MEA 함침 제올라이트 13X 펠릿의 이산화탄소 수착량 그래프이다.
도 5는 온도에 따른 PZ 함침 제올라이트 13X 펠릿의 이산화탄소 수착량 그래프이다.
도 6a 내지 도 6c는 MEA 함침 제올라이트 13X 펠릿과 PZ 함침 제올라이트 13X 펠릿의 이산화탄소 수착량을 비교한 그래프이다: (a) 25℃; (b) 50℃; 및 (c) 75℃.
본원은 성형 제올라이트에 고체 아민을 함침하여 제조하는 수착제의 제조 방법에 관한 것이다.
본원의 방법은 고체 아민 수용액을 준비하는 단계; 상기 고체 아민 수용액에 성형 제올라이트를 첨가하는 단계; 상기 제올라이트 용액을 함침하는 단계; 상기 함침 용액을 건조하는 단계를 포함한다.
본원에서 사용된 용어 “수착제”는 아민과 같은 화합물과의 화학적인 결합에 의하여 이산화탄소를 분리하는 흡수제를 제올라이트와 같이 기공에 의하여 물리적으로 이산화탄소를 분리하는 흡착제에 함침하는 것을 의미하고, 흡착제의 이산화탄소 제거능력을 흡착능, 수착제의 이산화탄소 제거능력을 수착능이라고 하는데, 일반적으로 흡착능과 수착능을 같은 의미로 사용하고 있으며, 따라서 본원에서는 수착능과 흡착능이교환적으로 사용될 수 있다.
본원에서는 이산화탄소 흡착제로 사용되는 성형 제올라이트의 이산화탄소 제거 능력을 향상시키기 위해 성형 제올라이트에 고체 아민을 함침하여 사용한다. 본원에서 고체 아민이란, 상온에서 고체화 될 수 있는 아민을 일컫는 것으로 당업계에 공지된 다양한 물질이 사용될 수 있다. 본원에 사용될 수 있는 고체 아민은 고리형 아민으로써 이는 지방족형태의 아민보다 이산화탄소의 흡수특성이 우수하며, 상온에서 고체상태를 유지할 수 있는 물질을 포함할 수 있다. 상온에서 고체형태를 유지하게 되면, 고체 아민을 고상인 흡착제에 함침할 경우에 흡착제의 성능을 좌우하는 기공을 막지 않는 장점이 있다. 이와 같은 특징을 갖는 물질의 대표적 예는 피페라진으로, 이와 유사한 성질을 가지고 있는 물질을 분리매체로 사용할 경우 우수한 이산화탄소 수착능을 얻을 수 있을 것이다.
본원에 사용될 수 있는 고체 아민은 예를 들면, 1,3-디아미노-2-프로판올(1,3-diamino-2-propanol), 부틸렌디아민(butylene diamine), 1,4 부틸렌 디아민(1,4-butylene diamine), 헥사메틸렌디아민 (hexa methylene diamine), 2,2-디메틸-1,3-프로판디아민(2,2-dimethyl-1,3-propanediamine), 2-메틸피페라진(2-methylpiperazine), 2,3-디메틸피페라진(2,3-dimethylpiperazine), 2,5-디메틸피페라진(2,5-dimethylpiperazine), 1-(3-하이드록실프로필)(1-(3-hydroxylpropyl)piperazine), 시스 2,6-디메틸-피페라진(cis 2,6-dimethyl-piperazine), 트랜스 2,5-디메틸-피페라진(trans 2,5-dimethyl-piperazine), 2-메틸 피페라진(2-methyl piperazine), 2-피페리딘에탄올(2-piperidine ethanol), 3-피페리딘에탄올(3-piperidine ethanol), 4-피페리딘에탄올(4-piperidine ethanol), 호모피페라진(homo piperazine) 및 피레라진을 포함하나 이로 제한하는 것은 아니다. 상술한 종류를 포함하는 다양한 고체 아민 중 하나 이상의 물질이 본원에 사용될 수 있다. 상기 고체 아민은 약 1 내지 15 중량%의 양으로 포함된다. 한 구현 에서는 피레라진이 사용된다.
본원 방법에서 고체 아민 수용액은 추가로 메틸 알콜을 약 1 내지 10 부피% 로 포함할 수 있다. 함침액으로 메틸 알콜과 물이 용매로 사용될 수 있으며, 이때 메틸 알콜을 용액으로 사용할 경우에 아민의 용해도를 높일 수 있다.
함침액에 메틸 알콜이 포함되는 경우, 물을 기준으로 메틸 알콜 약 l 내지 10부피%를 넣은 후 혼합하여 수용액을 제조한다.
사용되는 고체 아민의 양은 구체적으로 사용되는 고체 아민의 종류에 따라 달라지며, 사용되는 고체 아민의 용해도, 밀도, 점도, 표면 장력을 고려하여 결정할 수 있다. 고체 아민을 물을 기준으로 하여 약 1 내지 100 중량%의 양으로 포함될 수 있다. 예를 들면 피페라진의 경우 약 1 내지 15 중량%로 혼합하여 흡착제에 함침 할 수 있는 용액을 제조한다. 제조된 용액은 제올라이트에 아민의 함침량에 따라 고체 아민 용액 약 100ml에 예를 들면 제올라이트를 약 2 내지 100g 추가하여 함침량의 비율을 조정한다. 함침량은 예를 들면, 제올라이트 13X에 대한 고체아민의 함침량이 30, 50, 또는 70 중량%이 되도록 조절할 수 있다. 함침 공정은 예를 들면 로터리 에바퍼레이터를 이용하여 수행될 수 있으며, 예를 들면, 진공상태 예를 들면 약 50-600mmHg에서 30-90℃ 온도에서 약 2 내지 8 시간 동안 수행될 수 있다.
함침 공정 후 건조 단계를 수행하며, 우선, 상온 예를 들면 20 내지 30℃에서 3 내지 5 시간 유지하여 함침된 아민이 제올라이트에 충분히 고착되게 하며, 이후 수분을 완전히 제거하기 위하여 약 90 내지 100℃로 조절된 진공 오븐에서 약 10 내지 30시간 유지하여 충분히 건조한다.
다른 양태에서 본원은 본원의 방법에 따라 제조된 고체 아민을 함침한 제올라이트 수착제에 관한 것이다.
또다른 양태에서 본원은 본원의 방법에 따라 제조된 고체 아민을 함침한 제올라이트 수착제의 사용을 포함하는 이산화탄소 포집 방법에 관한 것이다.
제올라이트 흡착제를 사용한 이산화탄소 포집 방법은 공지된 것으로, 예를 들면 하기 문헌에 기재된 것을 사용할 수 있다: 유인종 등, 제올라이트가 담지된 허니컴 흡착제의 제조 및 이의 이산화탄소 흡착특성, J. Korean Ind. Eng. Chem., Vol. 20, No. 6, December 2009, 663-669.
이하, 본 발명의 이해를 돕기 위해서 실시예를 제시한다. 그러나 하기의 실시예는 본 발명을 보다 쉽게 이해하기 위하여 제공되는 것일 뿐 본 발명이 하기의 실시예에 한정되는 것은 아니다.
실시예 1. 흡착능 비교를 위한 PZ 및 MEA 함침 제올라이트 제조
성형 제올라이트 13X(Sigma-Aldrich CO., Pellet type, 3.2mm)에 피페라진 (Samchun pure chemical CO,. 99.0%)과 Monoethanolamine(Samchun pure chemical CO., 99.0%)을 사용하였다. 함침시 Methyl alcohol(Samchun pure chemical CO., 99.5%)과 증류수를 용매로 사용하였다. MEA 와 PZ 물질의 구조 및 특성은 표 1에 나타내었다
표 1 MEA와 PZ의 물리적 특성
| 모노에탄올아민(MEA) | 피페라진(PZ) | |
| 분자구조 | ||
| 분자식 | C2H7NO | C4H10N2 |
| 분자량 | 61.08 gmol-1 | 86.14 gmol-1 |
| 끓는점 | 176 ℃ | 145-146 ℃ |
| 녹는점 | - | 108-112 ℃ |
| 극성표면적 | 46.25 Å2 | 24.06 Å2 |
| 밀도 | 0.974 g/cm3 | 0.874 g/cm3 |
| 증발 엔탈피 | 47.428 kJ/mol | 38.624 kJ/mol |
구체적으로 물을 기준으로 메틸 알콜을 5 부피% 넣은 후 혼합하여 수용액을 제조한 후 PZ (Samchun pure chemical CO,. 99.0%)를 물을 기준으로 하여 10 중량%로 혼합하여 흡착제에 함침할 수 있는 용액을 제조하였다.
이어 제조된 용액에 제올라이트를 추가하였다. 제올라이트에 대한 아민의 함침량에 따라 용액 및 제올라이트의 양을 조절하였다. 본 실시예에서는 30, 50 및 70중량%의 PZ 또는 MEA가 함침된 제올라이트를 제조하였으며, 이 경우, 각각 30, 50, 70 ml의 함침액에, 10g의 제올라이트를 추가하였다.
이어 로터리 에바퍼레이터를 이용하여 제올라이트에 아민을 함침하였으며, 50-600mmHg의 진공상태에서 온도를 80도씨에서 5시간 동안 수행하였다.
위와 같이 성형 제올라이트에 MEA와 PZ를 함침시킨 다음 건조공정을 진행하였으며, 25℃에서 4시간 유지한 후, MEA 또는 PZ로 함침된 성형 제올라이트를 100℃로 조절된 진공 오븐에서 24시간 유지하여 충분히 건조하였다.
실시예 2 제조된 고체아민이 함침된 제올라이트의 특성 비교 분석
실시예 1에서 제조된 성형 제올라이트 13X의 물리적, 화학적 특징과 MEA 및 PZ가 함침된 성형 제올라이트 13X 흡착제의 물리적, 화학적 특징을 비교하였다. 흡착제인 성형 제올라이트 13X 화학구조와, MEA 및 PZ가 함침된 성형 제올라이트의 화학구조를 알아보기 위하여 XRD (x-ray diffractometer, rigaku Co., M/N: D/MAX 2500H)를 이용하여 측정하였다. FT-IR (fourier transform infrared spectroscopy, Thermo electron Co., M/N: NICOLET 6700)로 성형 제올라이트의 물리적 특성과, MEA 및 PZ가 함침된 성형 제올라이트 13X의 물리적 특성을 파악하였으며, KBr 첨가제를 넣은 다음 500~4000 cm-1 범위에서 측정하였다. 또한, Surface area analyzer (Micrommeritics Co., M/N: Tristar™II 3020 V1.03)을 사용하여 시료에 대해 비표면적 및 기공분포곡선을 측정했고, 분석 방법으로는 불순물을 제거하기 위해 150℃, 2시간 전처리를 하였으며, 전처리 후 질소를 이용한 흡탈착 실험을 하였다. 분석 후 시료의 비표면적을 계산하기 위해 BET(brunauer-emmett-teller) 방법 (I. Siminiceanu, I. Lazau, Z. Ecsedi, L. Lupa, C. Burciag, "Textural Characterization of a New Iron-Based Ammonia Synthesis Catalyst", Chem. Bull. "POLITEHNICA" Univ. (Timisoara), Volume 53(67), 1-2, 2008)을 사용하였고, 기공분포 곡선은 BJH(barret, joyner and halenda) 방법(I. Siminiceanu, I. Lazau, Z. Ecsedi, L. Lupa, C. Burciag, "Textural Characterization of a New Iron-Based Ammonia Synthesis Catalyst", Chem. Bull. "POLITEHNICA" Univ. (Timisoara), Volume 53(67), 1-2, 2008)을 이용하였다.
결과는 도 1 내지 도 3에 기재되어 있다.
- XRD 분석 결과
성형 제올라이트 및 MEA, PZ 함침된 성형 제올라이트 특성을 파악하기 위해 XRD를 사용하였으며, 분석결과는 도 1에 나타냈었다. (a)는 성형 제올라이트 13X와, MEA를 3, 5, 또는 7 중량%로 함침하여 성형 제올라이트 13X에 함침한 수착제의 XRD 결과이다. 점으로 표시된 두 피크를 보면 MEA 농도가 높아질수록 XRD 피크의 감도는 낮아지고 있음을 보이고 있다. 이는 MEA 농도가 증가할수록 성형 제올라이트의 피크를 상쇄시켜 감소되었다고 판단되며 이는 종전 [박예원 등 Theories and Applications of Chem. Eng., 2007, Vol.13, No.2]의 실험결과와 비슷하다. (b)는 성형 제올라이트 13X와 PZ 농도를 달리하여 3, 5, 또는 7 중량% PZ가 함침된 성형 제올라이트 13X의 XRD 결과 이며, 점으로 표시된 두 피크를 보면 PZ도 MEA와 마찬가지로 함침 농도가 높아질수록 XRD 피크 감도는 낮아지고 있다. 그 이유는 MEA와 같은 현상이라고 판단된다.
- FT-IR 분석 결과
성형 제올라이트 13X에 MEA, PZ 함침 전후의 특성을 파악하기 위해 FT-IR을 측정하여 그 결과 도 2에 나타내었다. (a)는 MEA 함침 농도를 3, 5, 또는 7 중량%로 하여 성형 제올라이트 13X에 함침한 후 FT-IR을 측정한 결과이다. 그 중 피크의 세기가 강한 7 중량% MEA를 함침한 성형 제올라이트 13X의 피크를 보면 3278cm-1 에서 넓은 세기의 흡수 영역 O-H alcohol의 피크가 관찰되었다. 2934~2874cm-1 사이에서 중간 세기의 흡수 영역의 C-H stretch의 피크가 관찰되었으며 1648 내지 1581cm-1 사이에서 중간 세기의 흡수 영역 1차 아민 N-H 피크가 관찰되었다. 즉, MEA 함침 농도에 따라 FT-IR의 피크의 세기가 증가하는 것을 확인할 수 있다. MEA 함침 전에는 O-H 피크나 N-H 피크를 찾아 볼 수 없지만 MEA 함침 후에는 O-H 피크와 N-H 피크를 확인 할 수 있었다. 이로부터 제올라이트 13X 펠렛에 MEA가 함침 되었음을 알 수 있었다. (b)는 PZ 함침 농도를 3, 5, 또는 7 중량%로 하여 성형 제올라이트 13X에 함침한 후 FT-IR을 측정한 결과이다. 그 중 피크의 세기가 강한 3 중량% PZ 함침한 성형 제올라이트 13X의 피크를 보면 1637 cm-1에서 약산 세기의 흡수 영역인 N-H 피크가 관찰되었다. 50과 70 중량% PZ 함침한 성형 제올라이트 13X의 피크를 보면 크게 차이가 없는 것을 확인 할 수 있다. PZ의 양이 피크에 영향을 주는 것이라고 판단된다. PZ 함침 전 N-H 피크를 확인할 수 없었지만 PZ 함침 후에는 N-H 피크를 확인할 수 있었고, 이는 PZ가 성형 제올라이트 13X에 함침 되었음을 알 수 있었다.
- 비표면적 및 기공분포 곡선 결과
비표면적, 기공부피 그리고 기공 크기를 측정하여 표 2에 나타내었다. 성형 제올라이트 13X의 표면적은 613.53 m2/g 이고, 기공 부피는 29.35x10-2cm3/g으로 측정 되었다. MEA 함침된 성형 제올라이트 13X의 비표면적과 기공 부피는 함침된 아민의 중량비가 증가할수록 점차 감소하는 것을 보여준다. 이와 같은 결과는 MEA 분자 지름이 성형 제올라이트 13X보다 크므로 함침 시 기공을 막기 때문이라고 판단된다. 성형 제올라이트 13X의 비표면적과 기공부피를 비교해 본 결과 MEA 함침된 성형 제올라이트 13X의 비표면적과 기공부피가 감소되는 것을 볼 수 있어서, 성형 제올라이트 13X의 기공을 MEA가 막은 것을 확인할 수 있었다. PZ 함침된 성형 제올라이트 13X의 함침된 PZ의 중량비가 증가할수록 비표면적은 감소하는 반면 기공 부피는 증가하는 것을 확인할 수 있다. 비표면적이 감소하는 것은 MEA가 함침 되었을 때와 같은 이유라고 판단된다. 그러나 성형 제올라이트 13X의 비표면적과 기공의 부피를 비교해 본 결과, PZ가 함침된 성형 제올라이트 13X의 비표면적은 감소되었으나 기공의 부피는 별 차이가 없어 보인다. MEA가 함침된 성형 제올라이트 13X와 PZ가 함침된 성형 제올라이트 13X의 비표면적과 기공 부피를 비교하면, PZ가 함침된 성형 제올라이트 13X의 비표면적과 기공 부피가 더 높은 값으로 측정되었다.
도 3에 N2 등온 흡탈착 곡선을 나타내었다. (a)는 성형 제올라이트 13X의 흡탈착 곡선으로 P/P0=0.1, P/P0=0.8 내지 1.0 영역에서 기울기 변화를 보이고 있는데, 이는 성형 제올라이트 13X의 기공의 모세관 응축(capillary filling)때문이다. (b)는 5 중량% MEA 함침된 성형 제올라이트 13X의 흡탈착 곡선으로 P/P0=0.1 영역에서와 P/P0=0.8 영역에서 기울기 변화를 확인할 수 있다. (c)는 5 중량% PZ 함침된 성형 제올라이트 13X의 흡탈착 곡선으로 P/P0=0.1, P/P0=0.8 내지 1.0 영역에서 기울기의 변화를 확인할 수 있으며 성형 제올라이트 13X와 같은 모세관 응축을 보이고 있다.
표 2 MEA와 PZ 함침량에 따른 제올라이트 13X의 표면적, 기공 부피 및 기공 크기
| 재료 | 함침량(wt%) | 비표면적(m2/g) | 기공부피 (cm2/g) | 기공크기(nm) |
| 제올라이트 13X | - | 613.5 | 29.35x10-2 | 1.9 |
| MEA함침 제올라이트 13X | 30 | 0.4 | 3.19x10-4 | 3.5 |
| 50 | 0.3 | 1.97x10-4 | 2.6 | |
| 70 | 0.3 | 1.92x10-4 | 2.2 | |
| PZ함침 제올라이트 13X | 30 | 569.4 | 29.38x10-2 | 2.1 |
| 50 | 566.9 | 29.42x10-2 | 2.1 | |
| 70 | 564.2 | 29.82x10-2 | 2.1 |
실시예 3. 아민 함침 제올라이트 수착제의 이산화탄소 흡착 성능
실시예 1에서 제조된 성형 제올라이트 13X에 MEA와 PZ를 각각 30, 50, 또는 70 중량%로 함침한 수착제에 대한 이산화탄소 흡착 성능을 알아보기 위해 TGA (thermal grvimeeric analysis, TA Instrument Co., SDT Q600)를 사용하였다. 질소가스 조건에서 10℃/min의 가열속도로 상온에서 설정온도까지 가열하였다. 설정온도(25℃, 50℃, 75℃)에 도달하면 이산화탄소 흡착 실험을 위해 15% 이산화탄소 함유(N2 balance) 가스로 교체한 후 20℃/min으로 4시간 동안 실험을 수행하였다.
- MEA 함침된 성형 제올라이트 수착제의 이산화탄소 흡착 성능
성형 제올라이트의 이산화탄소 분리능을 향상시키기 위하여 제 1급 아민인 MEA를 성형 제올라이트에 함침 한 후 이에 대한 이산화탄소 흡착 성능을 파악하였다. 도 4는 성형 제올라이트에 MEA의 중량비 0, 30, 50 또는 70 중량%를 각각 함침한 후에 온도별 이산화탄소 흡착능을 나타내고 있다. 이에 대한 자세한 결과는 표 3에 나타내었다. 성형 제올라이트는 흡착온도가 증가할수록 흡착능은 감소되며 25℃ 에서 83.02 mg-CO2/gr-sorbent로 높은 흡착능을 나타낸다. 그러나 75℃로 흡착온도가 증가함에 따라 28.4 mg-CO2/gr-sorbent로 급격히 흡착능이 저하된다. 또한 화력발전시 발생되는 온도인 50℃에서는 43.8 mg-CO2/gr-sorbent로써 25℃의 1/2 정도의 흡착능 저하를 보이고 있다. 상기와 같이 온도에 따라 흡착능의 급속한 저하되는 이유는 제올라이트 흡착제가 물리적 성능에 의하여 이산화탄소를 분리하기 때문에 온도에 따라 흡착능이 좌우되기 때문이다.
그림에서 보는 바와 같이 MEA가 함침된 성형 제올라이트 수착제는 이산화탄소 수착능이 제올라이트 자체의 흡착능보다 오히려 낮아진다. 즉, 성형 제올라이트와 비교하여 아주 낮은 수착능을 나타내기 때문에 성형 제올라이트에 MEA를 함침한 수착제는 활용가능성이 없게 된다. MEA 함침 성형 제올라이트는 표 2에서 보는 바와 같이 성형 제올라이트와 비교하여 비표면적이 거의 없음을 보여주고 있다. 흡착제를 이용하여 이산화탄소를 분리 시 이산화탄소가 수착제가 접촉할 수 있는 비표면적은 매우 중요하다. 그러나 성형 제올라이트에 MEA를 함침시키면 비표면적이 거의 없어지게 되므로 이산화탄소가 수착제 표면에 접촉할 수 있는 부위가 없기 때문에 흡착능이 매우 낮아지게 된다.
표 3 온도에 따른 MEA 함침 제올라이트 13X 펠릿의 CO2 흡착량
| T(℃) | 제올라이트 13X(mg-CO2/gr-sorbent) | 제올라이트 13XMEA 30 wt%(mg-CO2/gr-sorbent) | 제올라이트 13XMEA 50 wt%(mg-CO2/gr-sorbent) | 제올라이트 13XMEA 70 wt%(mg-CO2/gr-sorbent) |
| 25℃ | 83.3 | 2.6 | 4 | 4.8 |
| 50℃ | 43.8 | 3.3 | 3.4 | 3.6 |
| 75℃ | 28.4 | 2.8 | 3.1 | 1.5 |
- PZ 함침된 성형 제올라이트 흡착제의 이산화탄소 흡착 성능
성형 제올라이트에 방향족 아민인 PZ를 함침한 후 이산화탄소 흡착 성능을 측정한 결과를 도 5에 나타내었다. 도 5에서는 0, 30, 50, 또는 70 중량% PZ를 함침한 후 온도(25℃, 50℃, 75℃)에 따른 이산화탄소 흡착능을 나타내었다. 또한 이에 대한 자세한 결과를 표 4에 나타내었다. 그림에서 보는 바와 같이, 성형 제올라이트에 PZ를 함침한 수착제의 이산화탄소 수착능은 증가되었다. PZ가 함침된 제올라이트는 25℃에서 성형 제올라이트의 흡착능과 유사한 이산화탄소 흡착능을 보이고 있으나, 50℃와 75℃에서는 성형 제올라이트의 흡착능보다 높은 흡착능을 보이고 있다. 특히 석탄 화력발전 후 연소배가스의 배출온도인 50℃에서는 성형 제올라이트는 43.8mg-CO2/gr-sorbent를 나타내고 있으나, PZ가 함침된 성형 제올라이트는 78.7 mg-CO2/gr-sorbent로 PZ 함침 성형 제올라이트의 흡착능이 성형 제올라이트의 흡착능보다 1.8배의 흡착능이 증가되었다.
PZ는 제 1급 아민인 MEA보다 흡수 속도가 10배 이상 빠르기 때문에 PZ를 함침한 성형 제올라이트 수착제에 이산화탄소가 반응할 때, 이산화탄소가 함침되어 있는 PZ와 빠른 속도로 결합할 수 있으므로 이산화탄소 흡착량이 증가된다.
또한, 표 1에서 보는 바와 같이 PZ의 녹는점은 108 내지 112℃이므로, 상온에서 고체로 존재하기 때문에 PZ를 물에 녹인 후 성형 제올라이트에 함침한다. 따라서 PZ를 성형 제올라이트에 함침시 쉽게 고체상으로 전화되어 성형 제올라이트의 기공을 막지 않고 함침 할 수 있으며, 표 2의 PZ 함침 후의 비표면적 측정결과에 나타내었다. PZ를 함침한 제올라이트는 비표면적이 564 내지 569 m2/g으로 성형 제올라이트의 비표면적 613 m2/g에 비교하여 PZ 함침 후에도 비표면적의 저하가 없으므로, 상온에서 고상의 흡수제를 고체 흡착에 함침 시 비표면적이 낮아지는 것을 방지 할 수 있다. PZ가 기공을 막지 않고 제올라이트에 함침되므로, 흡착제로서 기공이 작은 제올라이트에 의해 이산화탄소의 물리적 흡착능이 증가하면서, 함침된 화학 흡수제인 PZ에 의해 이산화탄소의 화학적 흡수능을 증가한다.
표 4 온도에 따른 PZ 함침 제올라이트 13X 펠릿의 CO2 흡착량
| T(℃) | 제올라이트 13X(mg-CO2/gr-sorbent) | 제올라이트 13XPZ 30 wt%(mg-CO2/gr-sorbent) | 제올라이트 13XPZ 50 wt%(mg-CO2/gr-sorbent) | 제올라이트 13XPZ 70 wt%(mg-CO2/gr-sorbent) |
| 25℃ | 83.3 | 88.1 | 85.3 | 88.9 |
| 50℃ | 43.8 | 78.7 | 77.9 | 86.7 |
| 75℃ | 28.4 | 43.2 | 45.4 | 44.5 |
- MEA 와 PZ 함침된 성형 제올라이트 흡착제 이산화탄소 흡능착 비교
MEA와 PZ를 성형 제올라이트에 함침 한 후 온도에 따른 이산화탄소 흡착능을 비교한 결과를 도 6에 나타내었다. 도 6의 (a)는 25℃에서 수착능을 나타내고 있다. 그림에서 보면 MEA와 PZ의 함침량이 증가하여도 이산화탄소 수착능의 변화가 없음을 보이고 있다. 이는 성형 제올라이트에 아민의 한계 함침량이 있기 때문이며, 함침 한계치는 30 중량% 이하이다. (b) 및 (c)는 50℃, 75℃에서 함침 후 이산화탄소 수착능을 비교한 결과로써 (a)와 유사한 결과를 보이고 있다. 특히 화석연료를 이용한 발전 시 연소배가스의 대기 중 방출온도인 50℃에서 성능을 비교하면 PZ 함침 시 MEA보다 20배 이상의 이산화탄소 흡수능을 나타내고 있으며 성형 제올라이트와 비교할 때도 높은 흡착능을 보이고 있어 연소 후 이산화탄소 포집용 분리매체로써 활용 가능성이 높음을 알 수 있다.
Claims (12)
- 고체 아민을 함침한 제올라이트 수착제를 제조하는 방법으로,고체 아민 수용액을 준비하는 단계;상기 고체 아민 수용액에 성형 제올라이트를 첨가하는 단계;상기 제올라이트 용액을 진공상태에서 함침하는 단계; 및상기 함침 후 건조하는 단계를 포함하는, 고체아민을 함침한 제올라이트 수착제의 제조방법.
- 제 1 항에 있어서, 상기 함침하는 단계는 30 내지 90℃의 온도에서 2 내지 8 시간 동안 진행되는 것인, 고체아민을 함침한 제올라이트 수착제의 제조방법.
- 제 1 항에 있어서, 상기 건조하는 단계는 90 내지 110℃의 진공 오븐에서 10 내지 30시간 진행되는 것인, 고체아민을 함침한 제올라이트 수착제의 제조방법.
- 제 1 항에 있어서, 상기 고체 아민 수용액은 메틸 알콜을 1 내지 10 부피% 추가로 포함하는, 고체 아민을 함침한 제올라이트 수착제의 제조방법.
- 제 1 항에 있어서, 상기 건조단계는 상기 함침 단계 직 후, 함침 용액을 20 내지 30℃에서 3 내지 5시간 동안 유지하는 단계를 추가로 포함하는, 고체 아민을 함침한 제올라이트 수착제의 제조방법.
- 제 1 항에 있어서, 상기 고체 아민은 1,3-디아미노-2-프로판올, 부틸렌디아민, 1,4 부틸렌 디아민, 헥사메틸렌디아민, 2,2-디메틸-1,3-프로판디아민, 2-메틸피페라진, 2,3-디메틸피페라진, 2,5-디메틸피페라진, 1-(3-하이드록실프로필), 시스 2,6-디메틸-피페라진, 트랜스 2,5-디메틸-피페라진, 2-메틸 피페라진, 2-페페리딘에탄올, 3-피페리딘에탄올, 4-피페리딘에탄올, 호모피페라진 및 피레라진으로 구성되는 군으로부터 선택되는 하나 이상인 고체 아민을 함침한 제올라이트 수착제의 제조방법.
- 제 6 항에 있어서, 상기 하나 이상의 고체 아민은 그 용해도, 밀도, 점도 또는 표면장력을 고려하여 결정되는 양으로 포함되는, 고체 아민을 함침한 제올라이트 수착제의 제조방법.
- 제 6 항에 있어서, 상기 고체 아민은 피폐라진인, 고체 아민을 함침한 제올라이트 수착제의 제조방법.
- 제 8 항에 있어서, 상기 피페라진은 1 내지 15 중량%의 양으로 포함되는, 고체 아민을 함침한 제올라이트 수착제의 제조방법.
- 제 1 항에 있어서,상기 성형 제올라이트는 상기 고체 아민 수용액 100ml 당 2 내지 100g의 양 으로 추가되는 것인, 고체 아민을 함침한 제올라이트 수착제의 제조방법.
- 제 1 항 내지 제 10 항 중 어느 한 항의 방법에 따라 제조된, 고체 아민을 함침한 제올라이트 수착제.
- 제 11 항에 따른 고체 아민을 함침한 제올라이트 수착제의 사용을 포함하는 이산화탄소 포집 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2012-0013070 | 2012-02-09 | ||
| KR1020120013070A KR101333617B1 (ko) | 2012-02-09 | 2012-02-09 | 고체 아민을 함침한 제올라이트 수착제의 제조방법 및 그 방법에 의해 제조된 수착제 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2013118950A1 true WO2013118950A1 (ko) | 2013-08-15 |
Family
ID=48947689
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/KR2012/005808 WO2013118950A1 (ko) | 2012-02-09 | 2012-07-20 | 고체 아민을 함침한 제올라이트 수착제의 제조방법 및 그 방법에 의해 제조된 수착제 |
Country Status (2)
| Country | Link |
|---|---|
| KR (1) | KR101333617B1 (ko) |
| WO (1) | WO2013118950A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2022128431A1 (en) | 2020-12-18 | 2022-06-23 | Climeworks Ag | Improved materials for direct air capture and uses thereof |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101696395B1 (ko) * | 2015-11-24 | 2017-01-16 | 한국과학기술원 | 다이아민-제올라이트 복합체 및 그 제조방법 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20090069271A (ko) * | 2006-08-10 | 2009-06-30 | 유니버시티 오브 써던 캘리포니아 | 공기를 포함하는 가스 혼합물로부터 이산화탄소를 분리하기위한 나노 구조의 지지 고형 재생성 폴리아민 및 폴리아민폴리올 흡착제 |
| US20100263534A1 (en) * | 2007-11-08 | 2010-10-21 | The University Of Akron | Amine absorber for carbon dioxide capture and processes for making and using the same |
| KR20110121288A (ko) * | 2010-04-30 | 2011-11-07 | 인하대학교 산학협력단 | 이산화탄소 흡수용 아민-제올라이트 복합체 및 이의 제조방법 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090155889A1 (en) * | 2007-12-13 | 2009-06-18 | Alstom Technology Ltd | System and method for regeneration of an absorbent solution |
| CN102470314B (zh) | 2009-07-27 | 2014-09-17 | 川崎重工业株式会社 | 二氧化碳分离方法及装置 |
-
2012
- 2012-02-09 KR KR1020120013070A patent/KR101333617B1/ko active IP Right Grant
- 2012-07-20 WO PCT/KR2012/005808 patent/WO2013118950A1/ko active Application Filing
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20090069271A (ko) * | 2006-08-10 | 2009-06-30 | 유니버시티 오브 써던 캘리포니아 | 공기를 포함하는 가스 혼합물로부터 이산화탄소를 분리하기위한 나노 구조의 지지 고형 재생성 폴리아민 및 폴리아민폴리올 흡착제 |
| US20100263534A1 (en) * | 2007-11-08 | 2010-10-21 | The University Of Akron | Amine absorber for carbon dioxide capture and processes for making and using the same |
| KR20110121288A (ko) * | 2010-04-30 | 2011-11-07 | 인하대학교 산학협력단 | 이산화탄소 흡수용 아민-제올라이트 복합체 및 이의 제조방법 |
Non-Patent Citations (1)
| Title |
|---|
| HONG, MI SO ET AL.: "Separation of Carbon Dioxide Using Pelletized Zeolite Adsorbent with Amine Impregration", KOREAN CHEM. ENG. RES., vol. 50, no. 2, 30 April 2012 (2012-04-30), pages 244 - 250 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2022128431A1 (en) | 2020-12-18 | 2022-06-23 | Climeworks Ag | Improved materials for direct air capture and uses thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20130091828A (ko) | 2013-08-20 |
| KR101333617B1 (ko) | 2013-11-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107661748B (zh) | 有机胺功能化大孔容二氧化硅co2吸附剂及其制备方法 | |
| Meng et al. | Comprehensive study of CO2 capture performance under a wide temperature range using polyethyleneimine-modified adsorbents | |
| US9649618B2 (en) | Method for preparing solid amine gas adsorption material | |
| KR102002640B1 (ko) | 아민작용기를 도입하여 이산화탄소 흡착률을 향상시킨 메조다공성 중공형 실리카 물질의 제조방법 | |
| US11794164B2 (en) | Pcstructures including supported polyamines and methods of making the supported polyamines | |
| EP2214814A1 (en) | Amine absorber for carbon dioxide capture and processes for making and using the same | |
| KR20090069271A (ko) | 공기를 포함하는 가스 혼합물로부터 이산화탄소를 분리하기위한 나노 구조의 지지 고형 재생성 폴리아민 및 폴리아민폴리올 흡착제 | |
| Sun et al. | Synthesis and functionalisation of spherical meso-, hybrid meso/macro-and macro-porous cellular silica foam materials with regulated pore sizes for CO 2 capture | |
| US10449514B2 (en) | Core-shell compositions, methods of making the same, and gas separation processes using the same | |
| Chiang et al. | Effects of activation on the properties of electrospun carbon nanofibers and their adsorption performance for carbon dioxide | |
| Huang et al. | Adsorption of CO2 on chitosan modified CMK-3 at ambient temperature | |
| Kumar et al. | Amine-impregnated nanoarchitectonics of mesoporous silica for capturing dry and humid 400 ppm carbon dioxide: A comparative study | |
| US11642651B2 (en) | Cucurbituril-polyethylenimine-silica complex, preparation method thereof and carbon dioxide absorbent comprising same | |
| WO2013118950A1 (ko) | 고체 아민을 함침한 제올라이트 수착제의 제조방법 및 그 방법에 의해 제조된 수착제 | |
| KR101418868B1 (ko) | 이산화탄소 포집용 미세다공성 흡착제의 제조방법 | |
| Sekizkardes et al. | Single polymer sorbent fibers for high performance and rapid direct air capture | |
| Anbia et al. | Synthesis of polyaniline/mesoporous carbon nanocomposites and their application for CO 2 sorption | |
| KR20120004580A (ko) | 메조포러스 물질을 이용한 이산화탄소 흡착제 및 이를 이용한 이산화탄소 제거방법 | |
| KR102488884B1 (ko) | 쿠커비투릴-아민 화합물-다공체 복합체, 이의 제조방법 및 이를 포함하는 이산화탄소 흡착제 | |
| Kim et al. | A study on grafting efficiency of amine and CO 2 sorption behavior inside amorphous silica | |
| WO2017090825A1 (ko) | 다이아민-제올라이트 복합체 및 그 제조방법 | |
| CN115445575A (zh) | 一种固体胺吸附剂及其制备方法和一种二氧化碳吸附和再生方法 | |
| US9808784B2 (en) | Mesoporous cellular foam impregnated with iron-substituted heteropolyacid, preparation method therefor, and carbon dioxide separation method using same | |
| CN105289484A (zh) | 一种高效吸附活性炭纤维布及其制备方法 | |
| He et al. | Facile synthesis of aminated indole-based porous organic polymer for highly selective capture of CO 2 by the coefficient effect of π–π-stacking and hydrogen bonding |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 12868273 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 12868273 Country of ref document: EP Kind code of ref document: A1 |