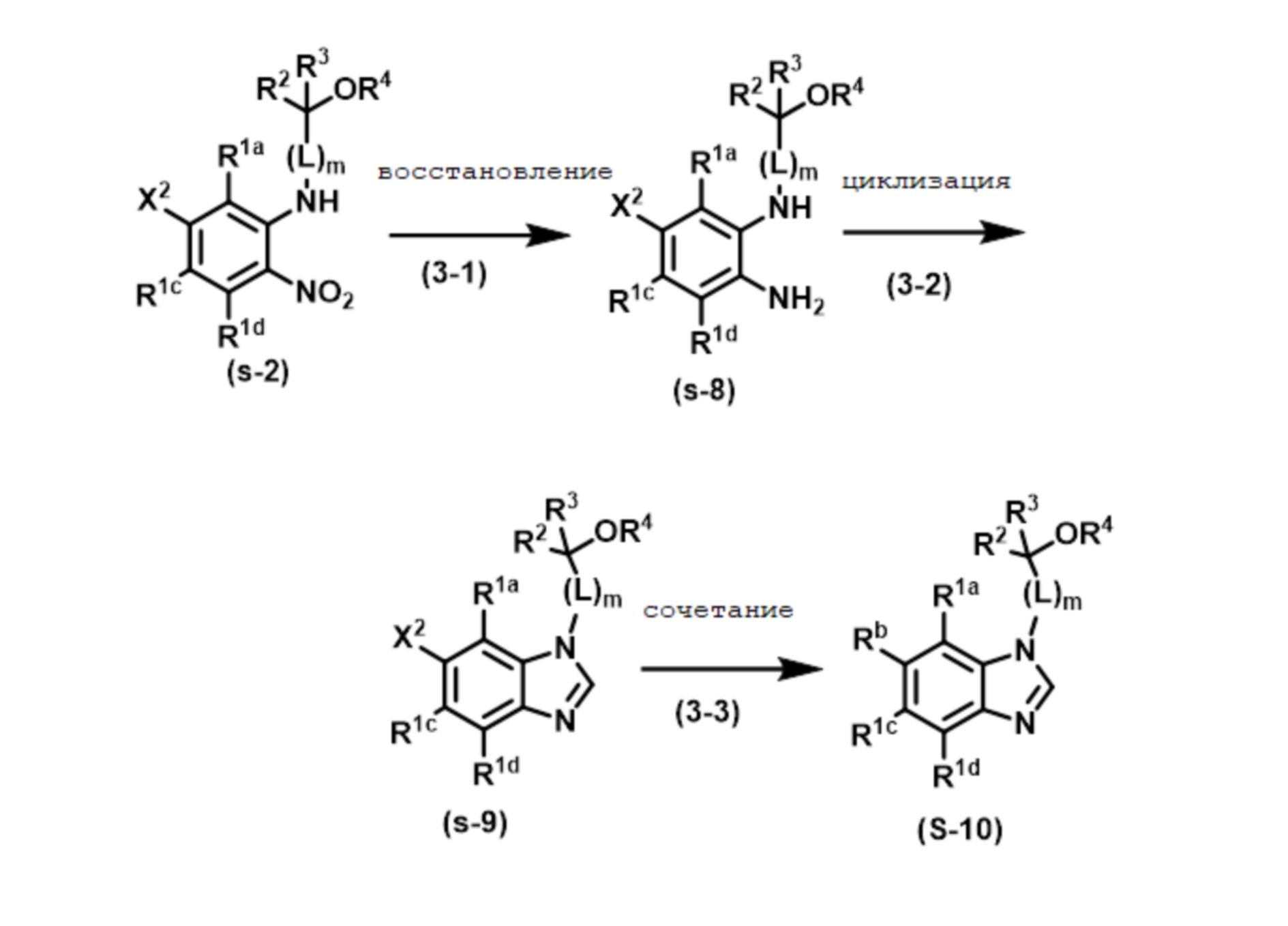
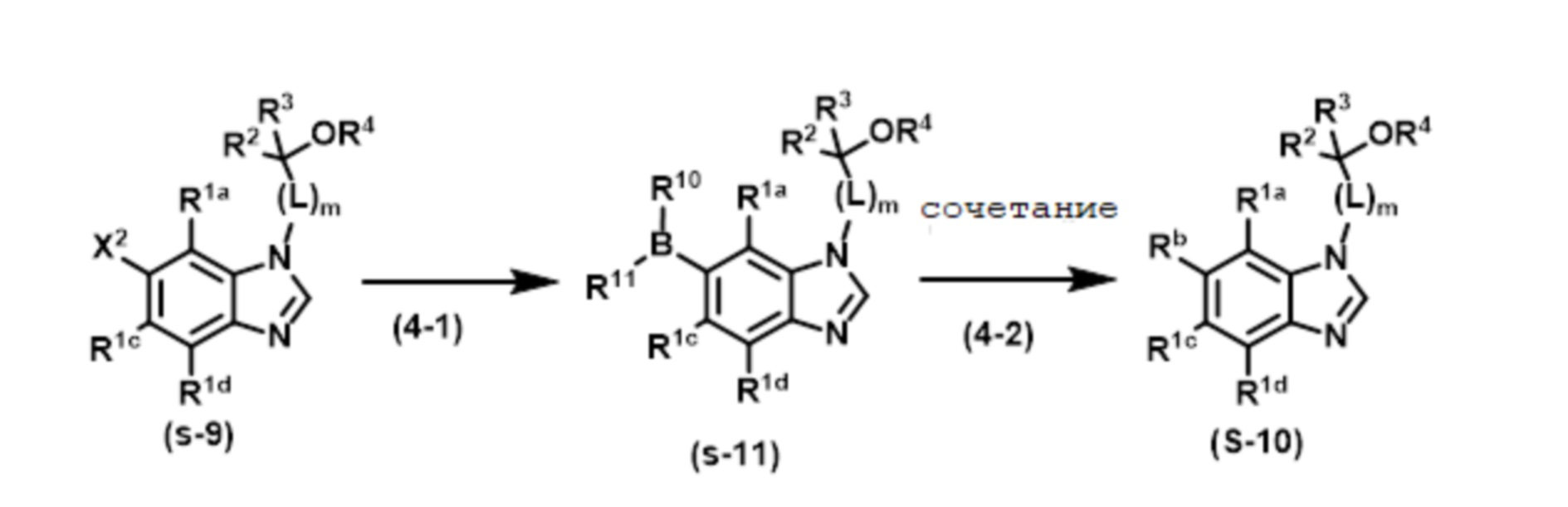
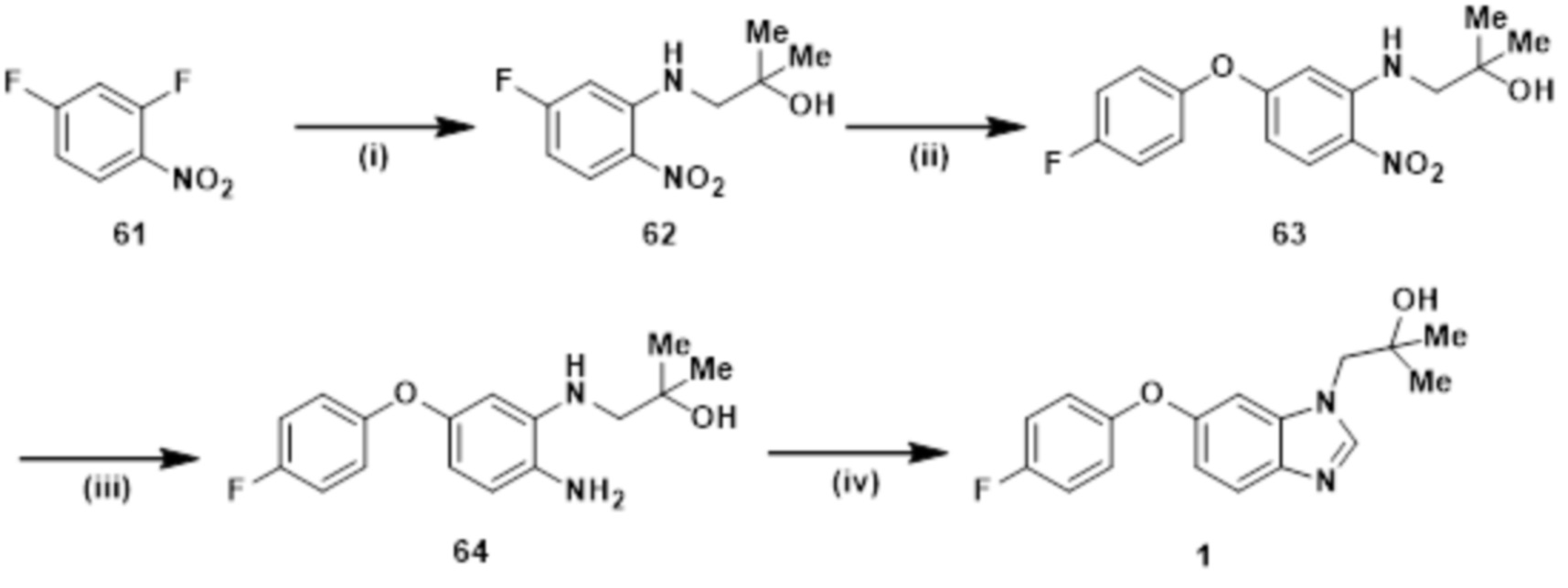
RU2775673C2 - Новое соединение бензимидазола и его медицинское применение - Google Patents
Новое соединение бензимидазола и его медицинское применение Download PDFInfo
- Publication number
- RU2775673C2 RU2775673C2 RU2018105683A RU2018105683A RU2775673C2 RU 2775673 C2 RU2775673 C2 RU 2775673C2 RU 2018105683 A RU2018105683 A RU 2018105683A RU 2018105683 A RU2018105683 A RU 2018105683A RU 2775673 C2 RU2775673 C2 RU 2775673C2
- Authority
- RU
- Russia
- Prior art keywords
- independently selected
- substituents independently
- optionally substituted
- benzimidazol
- substituent group
- Prior art date
Links
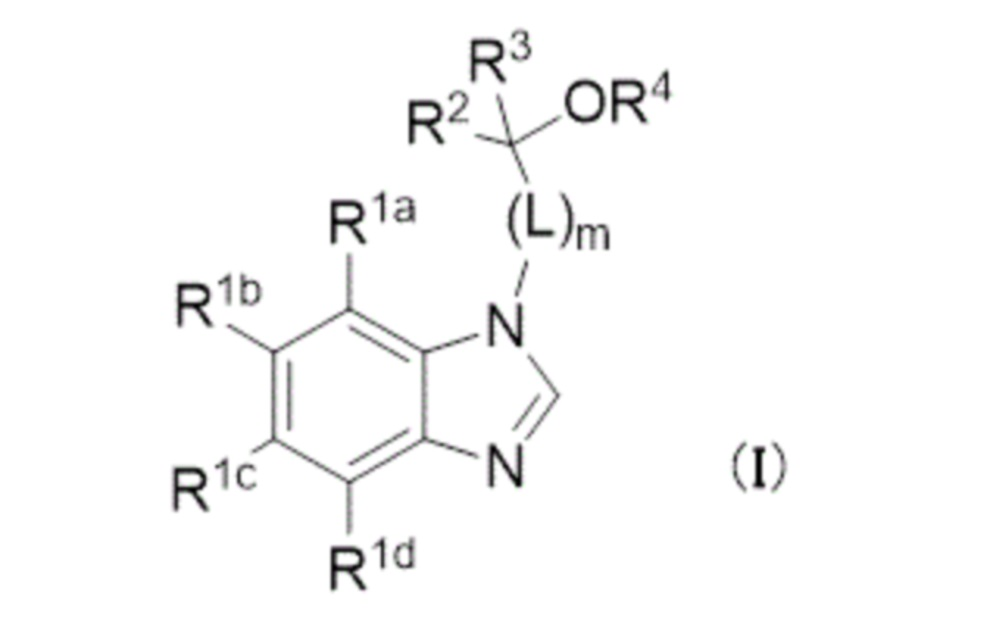
- -1 benzimidazole compound Chemical class 0.000 title claims description 119
- 150000001875 compounds Chemical class 0.000 claims abstract description 245
- 150000003839 salts Chemical class 0.000 claims abstract description 98
- 238000000034 method Methods 0.000 claims abstract description 78
- 239000003814 drug Substances 0.000 claims abstract description 38
- 229940079593 drug Drugs 0.000 claims abstract description 34
- 208000004296 neuralgia Diseases 0.000 claims abstract description 21
- 208000021722 neuropathic pain Diseases 0.000 claims abstract description 19
- 206010065390 Inflammatory pain Diseases 0.000 claims abstract description 18
- 208000001294 Nociceptive Pain Diseases 0.000 claims abstract description 17
- 208000010261 Small Fiber Neuropathy Diseases 0.000 claims abstract description 17
- 206010073928 Small fibre neuropathy Diseases 0.000 claims abstract description 17
- 208000027520 Somatoform disease Diseases 0.000 claims abstract description 17
- 201000010099 disease Diseases 0.000 claims abstract description 17
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 17
- 201000011384 erythromelalgia Diseases 0.000 claims abstract description 17
- 208000027753 pain disease Diseases 0.000 claims abstract description 17
- 230000001314 paroxysmal effect Effects 0.000 claims abstract description 17
- 208000017692 primary erythermalgia Diseases 0.000 claims abstract description 17
- 206010013990 dysuria Diseases 0.000 claims abstract description 15
- 238000004519 manufacturing process Methods 0.000 claims abstract description 15
- 201000006417 multiple sclerosis Diseases 0.000 claims abstract description 14
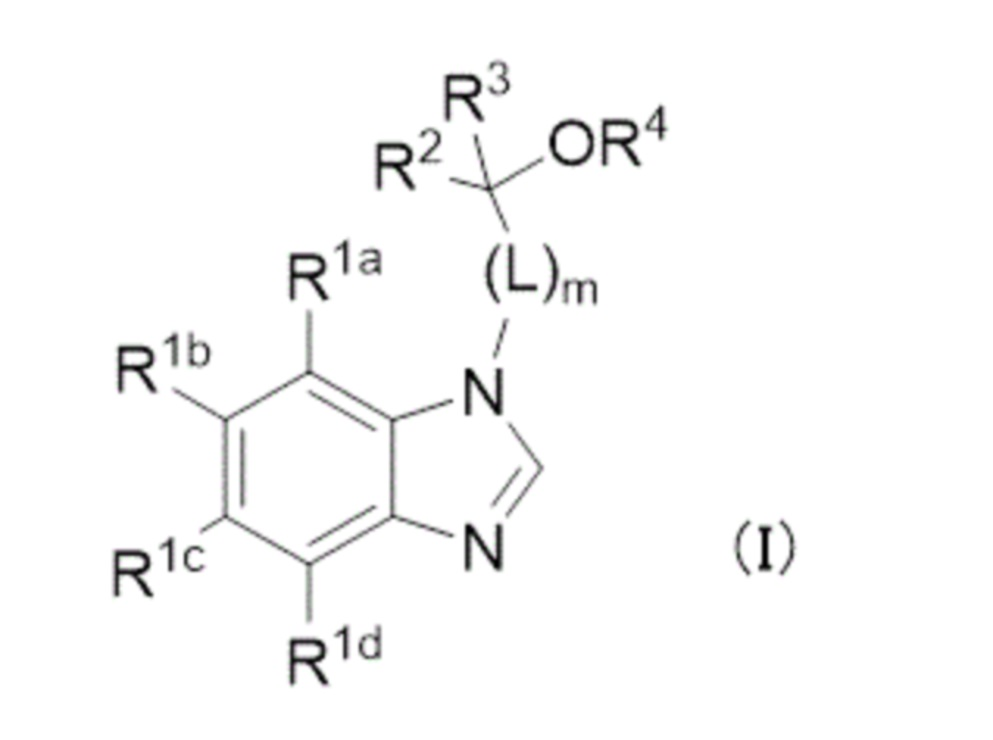
- 125000001424 substituent group Chemical group 0.000 claims description 582
- 125000000217 alkyl group Chemical group 0.000 claims description 160
- 229910052739 hydrogen Inorganic materials 0.000 claims description 142
- 239000001257 hydrogen Substances 0.000 claims description 142
- 125000003545 alkoxy group Chemical group 0.000 claims description 115
- 229910052736 halogen Inorganic materials 0.000 claims description 114
- 150000002367 halogens Chemical class 0.000 claims description 113
- 125000001072 heteroaryl group Chemical group 0.000 claims description 82
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 claims description 80
- 125000003118 aryl group Chemical group 0.000 claims description 78
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 74
- 125000000000 cycloalkoxy group Chemical group 0.000 claims description 74
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 74
- 150000002431 hydrogen Chemical class 0.000 claims description 65
- 125000005553 heteroaryloxy group Chemical group 0.000 claims description 52
- 125000004432 carbon atom Chemical group C* 0.000 claims description 51
- 125000004104 aryloxy group Chemical group 0.000 claims description 49
- 229910052799 carbon Inorganic materials 0.000 claims description 38
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 32
- 125000005843 halogen group Chemical group 0.000 claims description 27
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 19
- 125000004769 (C1-C4) alkylsulfonyl group Chemical group 0.000 claims description 18
- 101000654386 Homo sapiens Sodium channel protein type 9 subunit alpha Proteins 0.000 claims description 13
- 102100031367 Sodium channel protein type 9 subunit alpha Human genes 0.000 claims description 12
- 125000003282 alkyl amino group Chemical group 0.000 claims description 10
- 125000006310 cycloalkyl amino group Chemical group 0.000 claims description 10
- 239000012634 fragment Substances 0.000 claims description 10
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 claims description 9
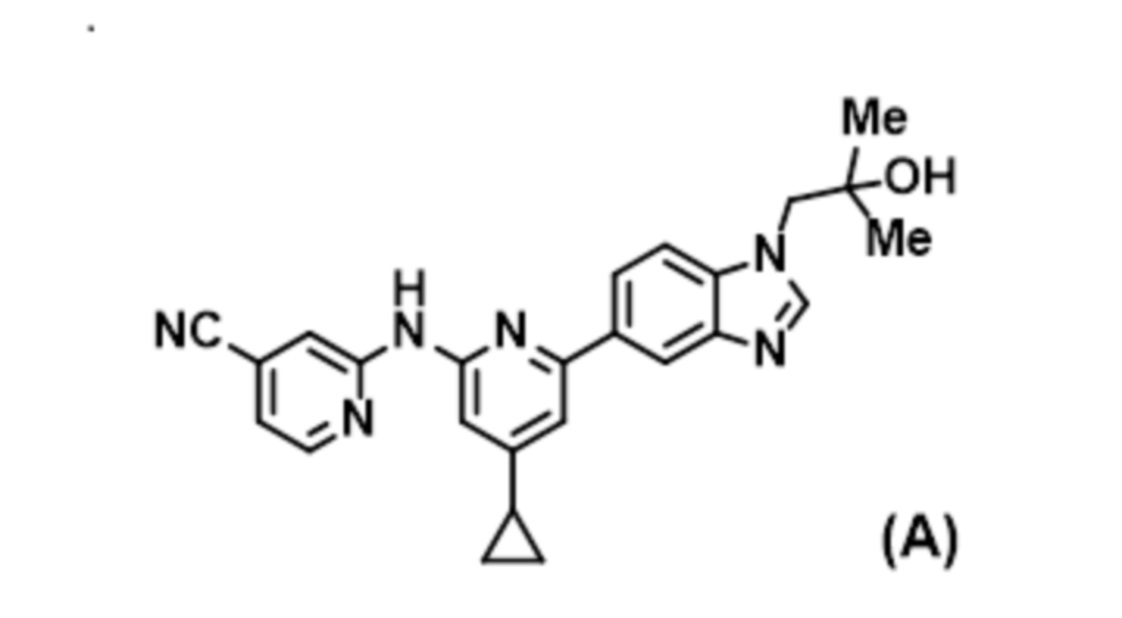
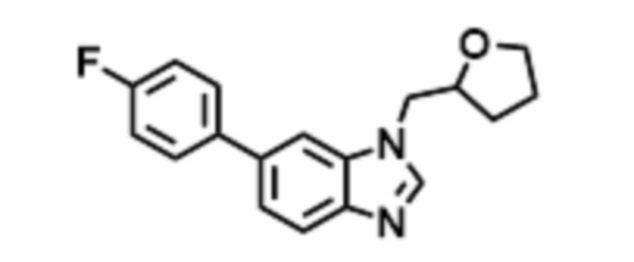
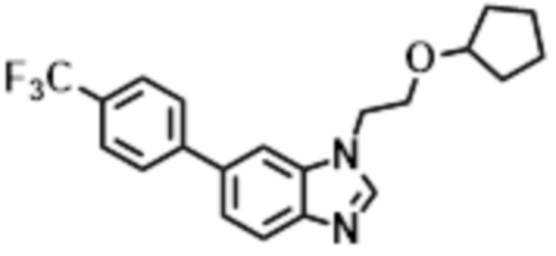
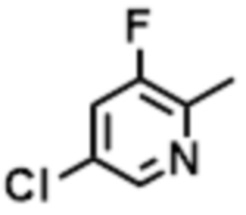
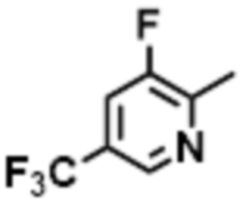
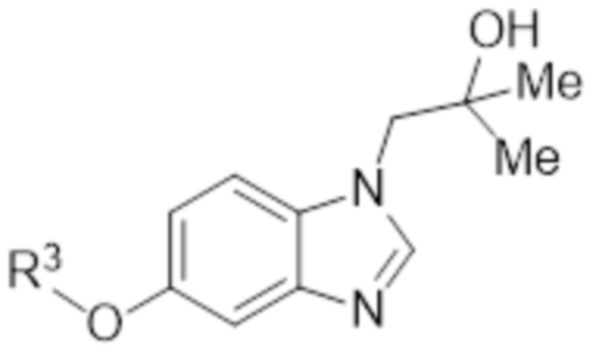
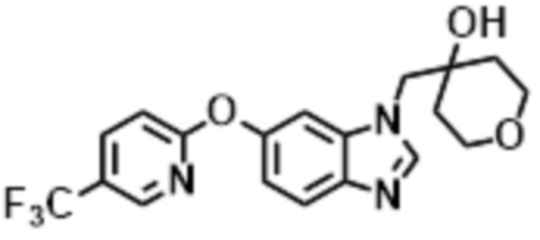
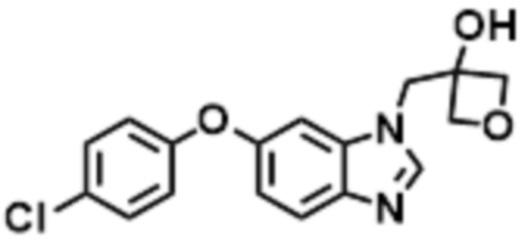
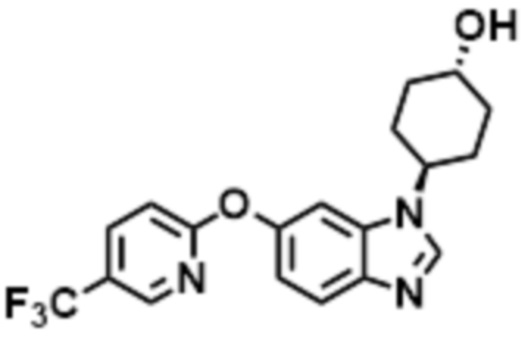
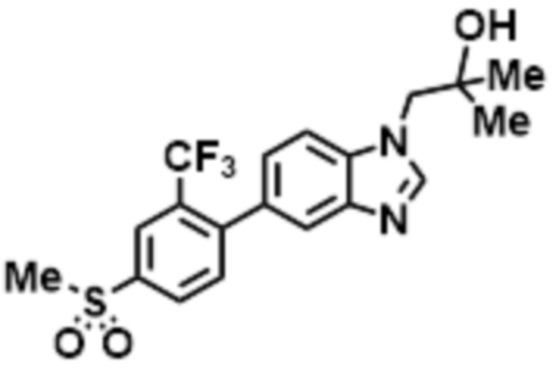
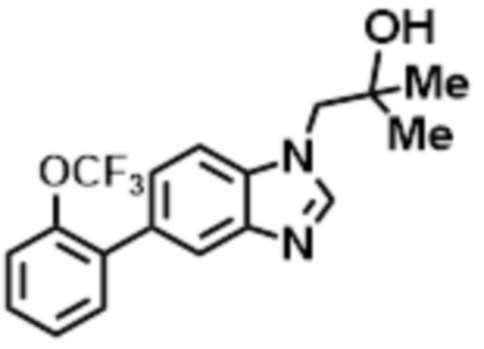
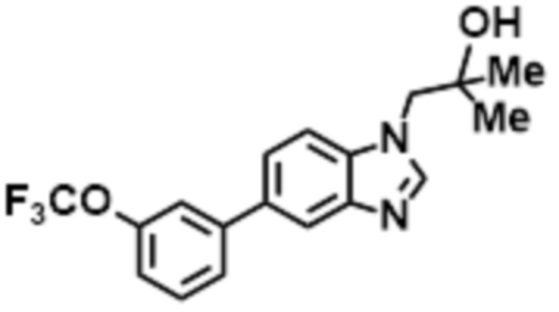
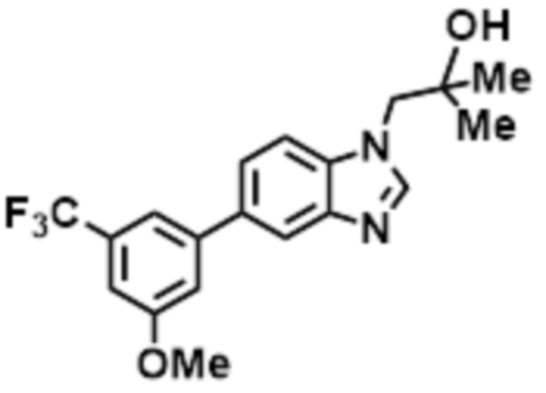
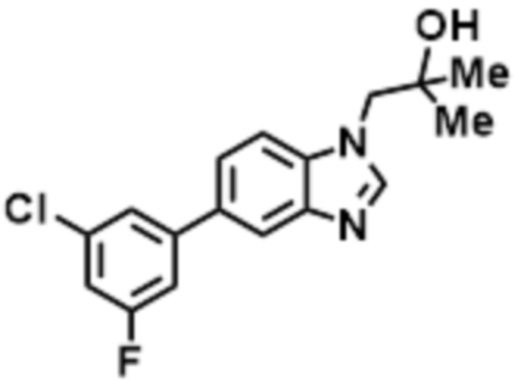
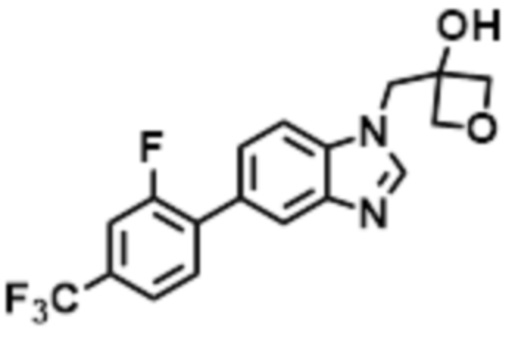
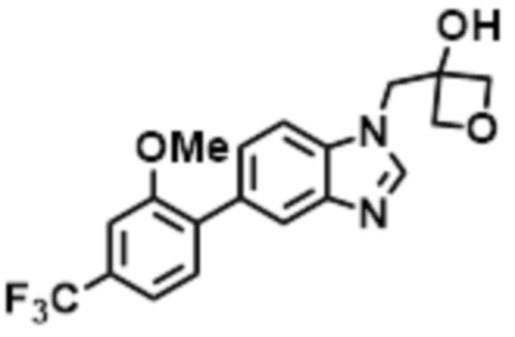
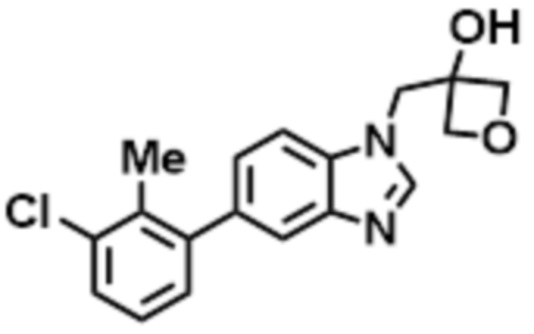
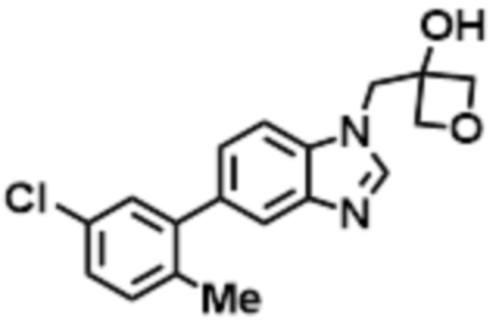
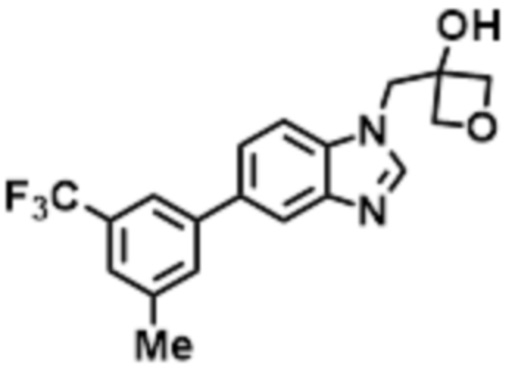
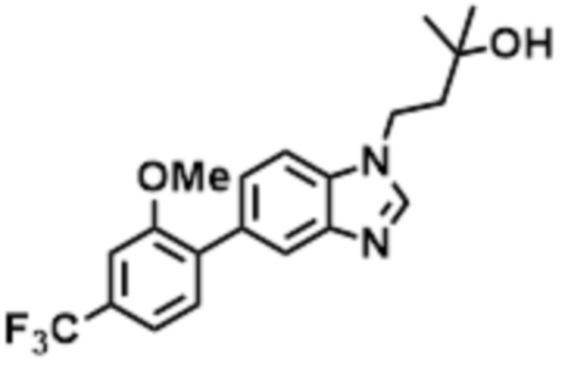
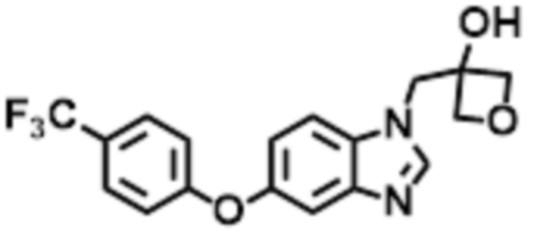
- LBGUDZXEWCRTOF-UHFFFAOYSA-N 2-methyl-1-[6-[5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)C(F)(F)F)(C)O LBGUDZXEWCRTOF-UHFFFAOYSA-N 0.000 claims description 9
- 125000005842 heteroatom Chemical group 0.000 claims description 9
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 9
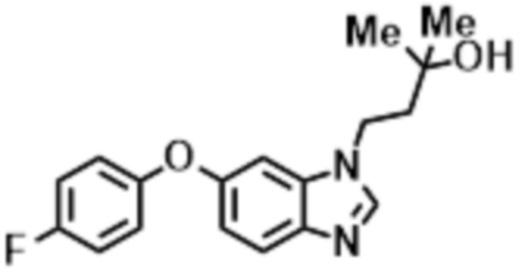
- WHPPNBMQFKEPFQ-UHFFFAOYSA-N 1-[6-(4-fluorophenoxy)benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound FC1=CC=C(OC=2C=CC3=C(N(C=N3)CC(C)(O)C)C=2)C=C1 WHPPNBMQFKEPFQ-UHFFFAOYSA-N 0.000 claims description 8
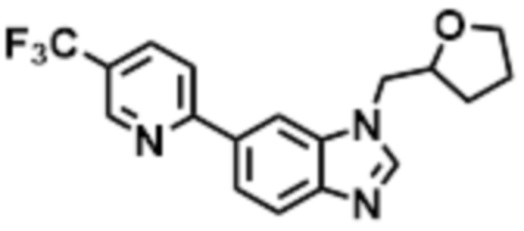
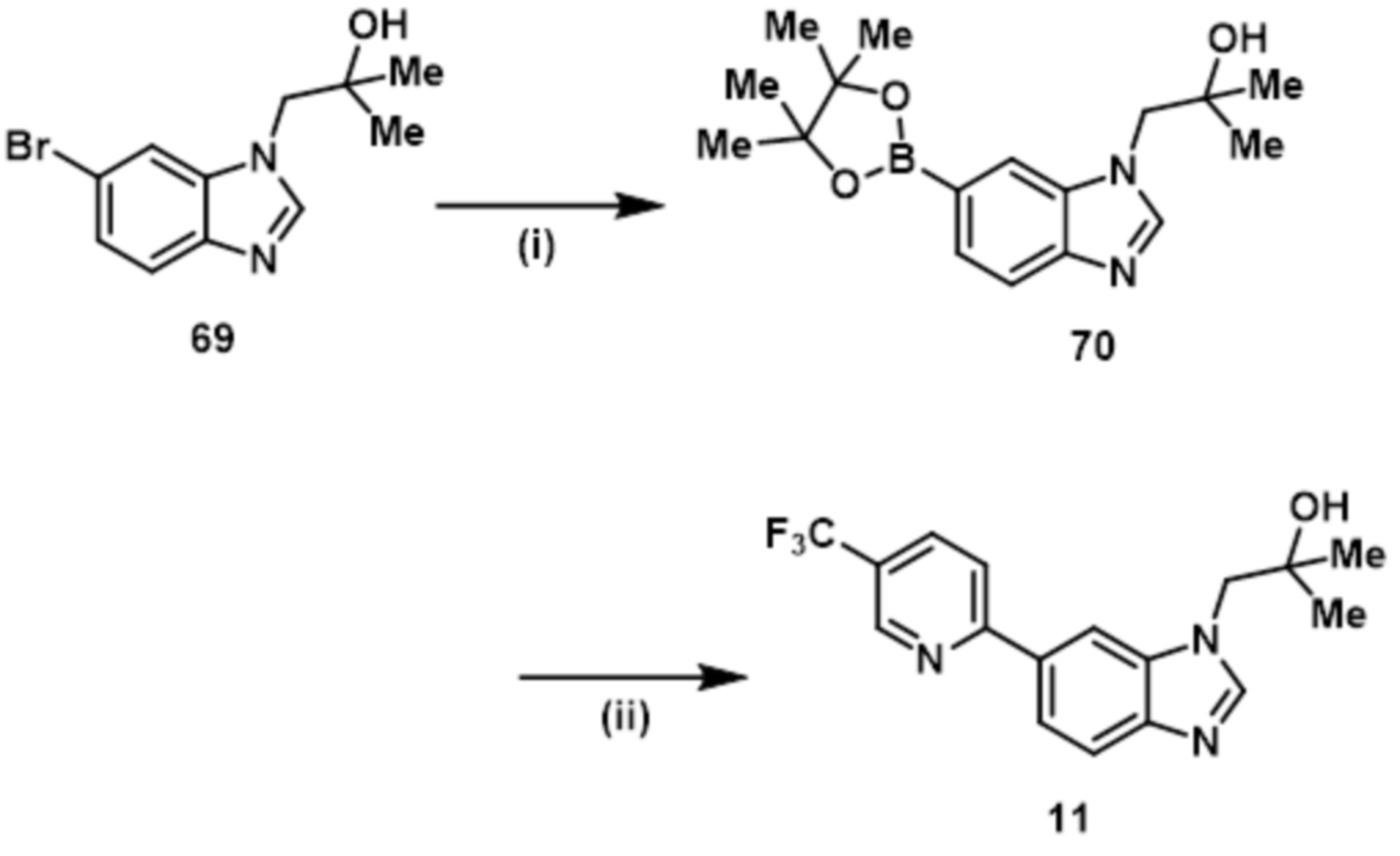
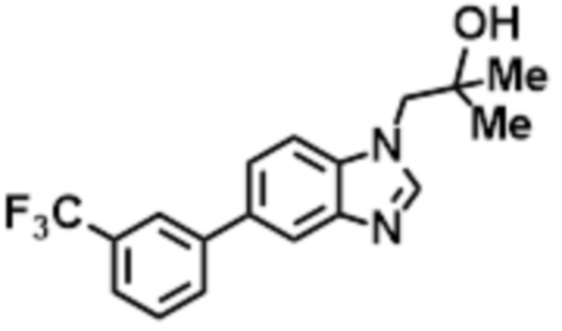
- CQIHBEKHGJWJCS-UHFFFAOYSA-N 2-methyl-1-[6-[5-(trifluoromethyl)pyridin-2-yl]benzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)C1=NC=C(C=C1)C(F)(F)F)(C)O CQIHBEKHGJWJCS-UHFFFAOYSA-N 0.000 claims description 8
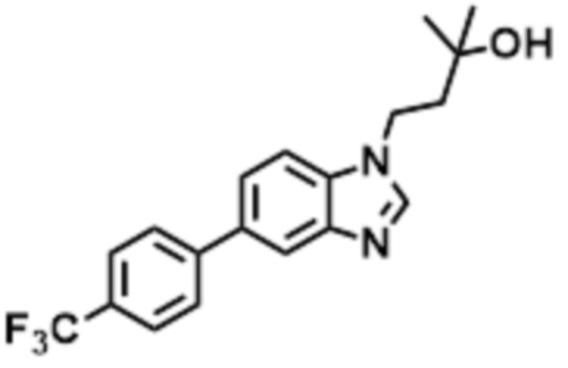
- IBUAJFFFVSQDJY-UHFFFAOYSA-N 2-methyl-4-[6-[5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]butan-2-ol Chemical compound CC(C)(CCN1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)C(F)(F)F)O IBUAJFFFVSQDJY-UHFFFAOYSA-N 0.000 claims description 8
- WZPSQCIJYTVQAP-UHFFFAOYSA-N 2-methyl-1-[6-[5-(2,2,2-trifluoroethyl)pyridin-2-yl]oxybenzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)CC(F)(F)F)(C)O WZPSQCIJYTVQAP-UHFFFAOYSA-N 0.000 claims description 7
- 239000004480 active ingredient Substances 0.000 claims description 7
- 125000004414 alkyl thio group Chemical group 0.000 claims description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 7
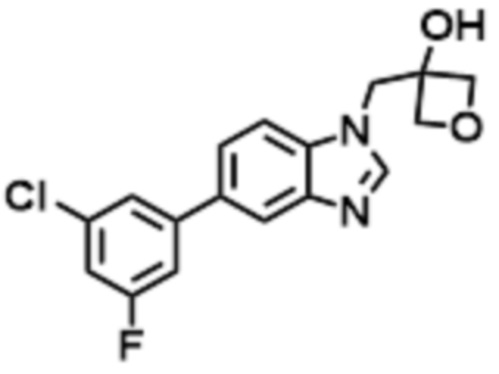
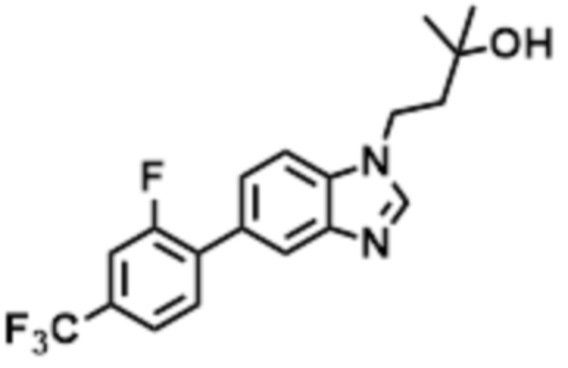
- QCQSSZIRVCAQII-UHFFFAOYSA-N 1-[5-[3-fluoro-5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound FC=1C(=NC=C(C=1)C(F)(F)F)OC1=CC2=C(N(C=N2)CC(C)(O)C)C=C1 QCQSSZIRVCAQII-UHFFFAOYSA-N 0.000 claims description 6
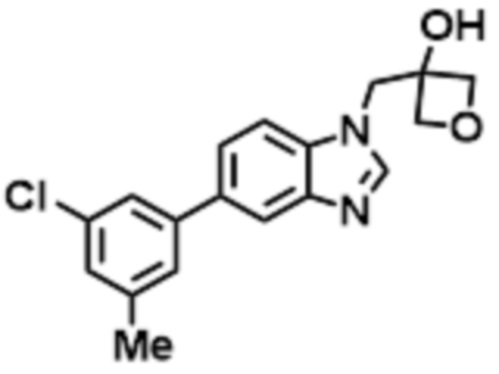
- HZTINSOGTJLZDO-UHFFFAOYSA-N 1-[6-(4-chlorophenoxy)benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound ClC1=CC=C(OC=2C=CC3=C(N(C=N3)CC(C)(O)C)C=2)C=C1 HZTINSOGTJLZDO-UHFFFAOYSA-N 0.000 claims description 6
- NBGOPIRZHIPQRD-UHFFFAOYSA-N 2-methyl-1-[5-[5-(trifluoromethyl)pyrazin-2-yl]oxybenzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=CC(=C2)OC1=NC=C(N=C1)C(F)(F)F)(C)O NBGOPIRZHIPQRD-UHFFFAOYSA-N 0.000 claims description 6
- RLMNBUFULNLOPS-UHFFFAOYSA-N 2-methyl-1-[6-(6-methylpyridin-3-yl)oxybenzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC=1C=NC(=CC=1)C)(C)O RLMNBUFULNLOPS-UHFFFAOYSA-N 0.000 claims description 6
- KVCQQTCXWKRGCX-UHFFFAOYSA-N 2-methyl-1-[6-[4-(trifluoromethoxy)phenoxy]benzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC1=CC=C(C=C1)OC(F)(F)F)(C)O KVCQQTCXWKRGCX-UHFFFAOYSA-N 0.000 claims description 6
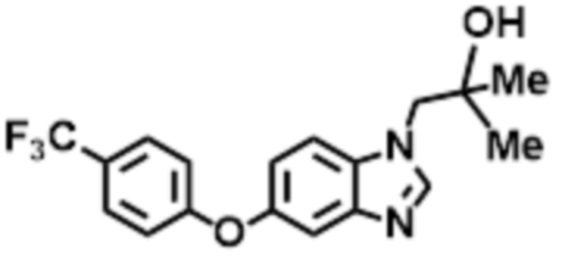
- JVOMABVXOFVUOL-UHFFFAOYSA-N 2-methyl-1-[6-[4-(trifluoromethyl)phenoxy]benzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC1=CC=C(C=C1)C(F)(F)F)(C)O JVOMABVXOFVUOL-UHFFFAOYSA-N 0.000 claims description 6
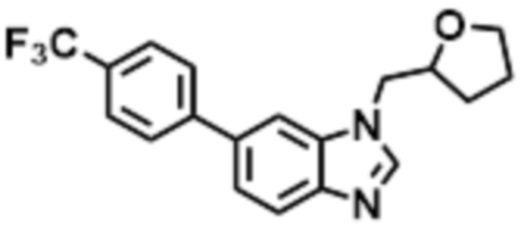
- HVVOVNLIPDULFL-UHFFFAOYSA-N 2-methyl-1-[6-[4-(trifluoromethyl)phenyl]benzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)C1=CC=C(C=C1)C(F)(F)F)(C)O HVVOVNLIPDULFL-UHFFFAOYSA-N 0.000 claims description 6
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 6
- 229910052717 sulfur Inorganic materials 0.000 claims description 6
- 239000011593 sulfur Chemical group 0.000 claims description 6
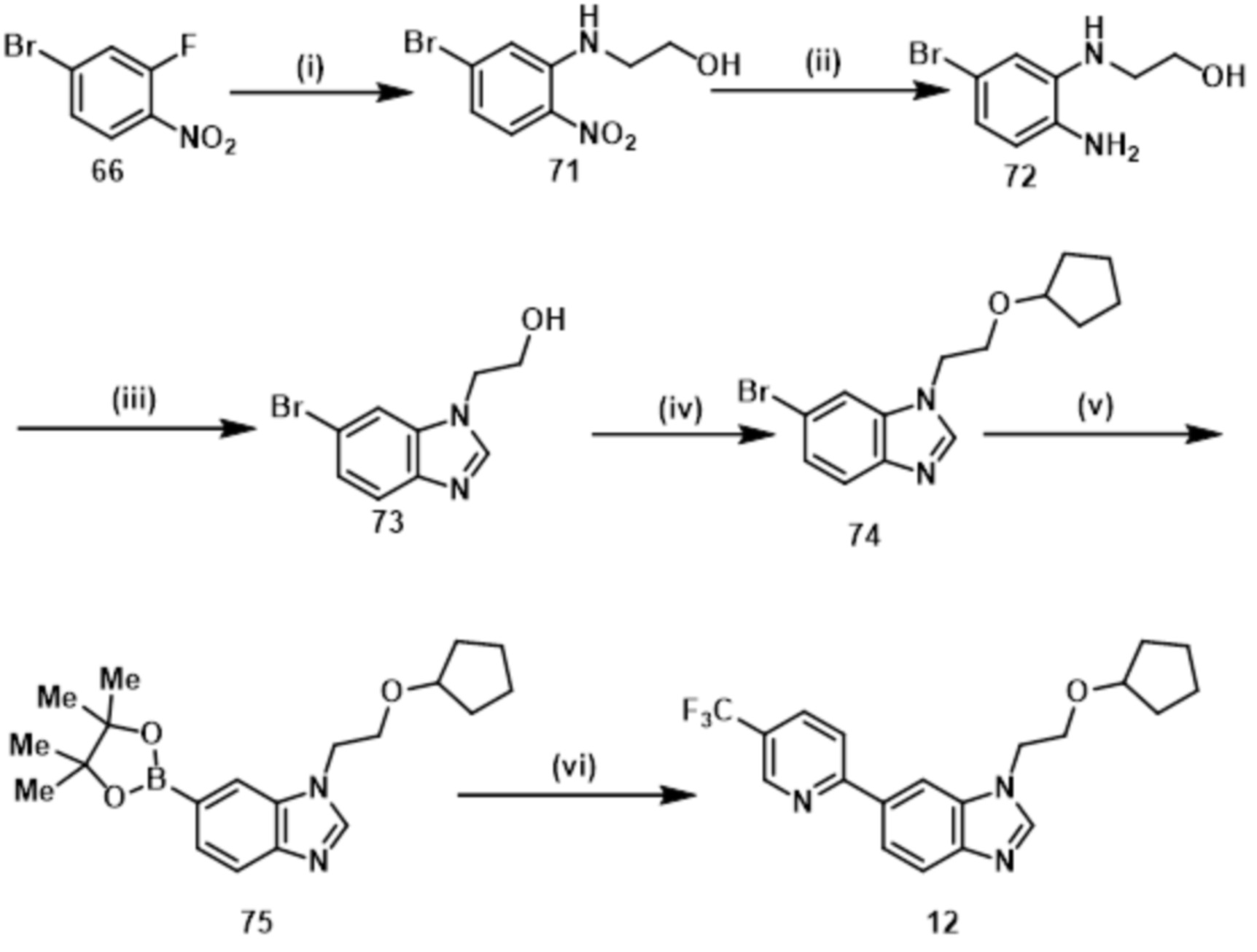
- CFNGDNQQJBDFBB-UHFFFAOYSA-N 1-(2-cyclopentyloxyethyl)-6-[5-(trifluoromethyl)pyridin-2-yl]benzimidazole Chemical compound C1(CCCC1)OCCN1C=NC2=C1C=C(C=C2)C1=NC=C(C=C1)C(F)(F)F CFNGDNQQJBDFBB-UHFFFAOYSA-N 0.000 claims description 5
- 229910052757 nitrogen Inorganic materials 0.000 claims description 5
- CTSHCVLSZISSOJ-NSHDSACASA-N (3S)-2-methyl-3-[6-[5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]butan-2-ol Chemical compound CC(C)([C@H](C)N1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)C(F)(F)F)O CTSHCVLSZISSOJ-NSHDSACASA-N 0.000 claims description 4
- WSKQGFLILOLDCX-UHFFFAOYSA-N 1-[6-[2-fluoro-4-(trifluoromethyl)phenyl]benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound FC1=C(C=CC(=C1)C(F)(F)F)C=1C=CC2=C(N(C=N2)CC(C)(O)C)C=1 WSKQGFLILOLDCX-UHFFFAOYSA-N 0.000 claims description 4
- YMSHWPHXUKHDTK-UHFFFAOYSA-N 3-[[5-[2-methoxy-4-(trifluoromethyl)phenyl]benzimidazol-1-yl]methyl]oxetan-3-ol Chemical compound COC1=C(C=CC(=C1)C(F)(F)F)C1=CC2=C(N(C=N2)CC2(COC2)O)C=C1 YMSHWPHXUKHDTK-UHFFFAOYSA-N 0.000 claims description 4
- XVLYOFSDBMMBGI-UHFFFAOYSA-N 3-[[6-[2-methoxy-4-(trifluoromethyl)phenyl]benzimidazol-1-yl]methyl]oxetan-3-ol Chemical compound COC1=C(C=CC(=C1)C(F)(F)F)C=1C=CC2=C(N(C=N2)CC2(COC2)O)C=1 XVLYOFSDBMMBGI-UHFFFAOYSA-N 0.000 claims description 4
- UGENHCOEIHLMNX-UHFFFAOYSA-N 3-[[6-[4-(trifluoromethoxy)phenoxy]benzimidazol-1-yl]methyl]oxetan-3-ol Chemical compound FC(OC1=CC=C(OC=2C=CC3=C(N(C=N3)CC3(COC3)O)C=2)C=C1)(F)F UGENHCOEIHLMNX-UHFFFAOYSA-N 0.000 claims description 4
- ARHHCSGDZLRWOP-UHFFFAOYSA-N 4-[6-(4-chlorophenoxy)benzimidazol-1-yl]-2-methylbutan-2-ol Chemical compound ClC1=CC=C(OC=2C=CC3=C(N(C=N3)CCC(C)(O)C)C=2)C=C1 ARHHCSGDZLRWOP-UHFFFAOYSA-N 0.000 claims description 4
- FIALBLBZRZHFPX-UHFFFAOYSA-N 6-(4-fluorophenoxy)-1-(oxolan-2-ylmethyl)benzimidazole Chemical compound FC1=CC=C(OC=2C=CC3=C(N(C=N3)CC3OCCC3)C=2)C=C1 FIALBLBZRZHFPX-UHFFFAOYSA-N 0.000 claims description 4
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 claims description 4
- RKTBASLBIOLEPQ-UHFFFAOYSA-N 1-(2-cyclopentyloxyethyl)-6-[4-(trifluoromethyl)phenyl]benzimidazole Chemical compound C1(CCCC1)OCCN1C=NC2=C1C=C(C=C2)C1=CC=C(C=C1)C(F)(F)F RKTBASLBIOLEPQ-UHFFFAOYSA-N 0.000 claims description 3
- JABHSUCMPLVSCD-UHFFFAOYSA-N 1-(oxolan-2-ylmethyl)-6-[4-(trifluoromethyl)phenyl]benzimidazole Chemical compound O1C(CCC1)CN1C=NC2=C1C=C(C=C2)C1=CC=C(C=C1)C(F)(F)F JABHSUCMPLVSCD-UHFFFAOYSA-N 0.000 claims description 3
- PCDYQWFOXJHSNV-UHFFFAOYSA-N 1-[5-(5-chloro-3-fluoropyridin-2-yl)oxybenzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound ClC=1C=C(C(=NC=1)OC1=CC2=C(N(C=N2)CC(C)(O)C)C=C1)F PCDYQWFOXJHSNV-UHFFFAOYSA-N 0.000 claims description 3
- QCUGSRDKQARTMF-UHFFFAOYSA-N 1-[[6-[5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]methyl]cyclobutan-1-ol Chemical compound FC(C=1C=CC(=NC=1)OC=1C=CC2=C(N(C=N2)CC2(CCC2)O)C=1)(F)F QCUGSRDKQARTMF-UHFFFAOYSA-N 0.000 claims description 3
- PMMRKGLNGVJHIF-UHFFFAOYSA-N 2-[5-(3,5-dimethyl-1,2-oxazol-4-yl)benzimidazol-1-yl]ethanol Chemical compound CC1=NOC(=C1C1=CC2=C(N(C=N2)CCO)C=C1)C PMMRKGLNGVJHIF-UHFFFAOYSA-N 0.000 claims description 3
- IGYLLEJQDWYRTD-UHFFFAOYSA-N 2-[5-[2-(2-hydroxyethyl)-1,2,4-triazol-3-yl]benzimidazol-1-yl]ethanol Chemical compound OCCN1N=CN=C1C1=CC=C(N(CCO)C=N2)C2=C1 IGYLLEJQDWYRTD-UHFFFAOYSA-N 0.000 claims description 3
- KHDIPYXRQQOOJW-UHFFFAOYSA-N 2-[5-[2-(oxolan-3-yl)imidazol-1-yl]benzimidazol-1-yl]ethanol Chemical compound C=1C=C2N(CCO)C=NC2=CC=1N1C=CN=C1C1CCOC1 KHDIPYXRQQOOJW-UHFFFAOYSA-N 0.000 claims description 3
- AWHXXUQDQFALTH-UHFFFAOYSA-N 2-[5-[5-(2-methoxyethyl)-2-(2,2,2-trifluoroethyl)-1,2,4-triazol-3-yl]benzimidazol-1-yl]ethanol Chemical compound FC(F)(F)CN1N=C(CCOC)N=C1C1=CC=C(N(CCO)C=N2)C2=C1 AWHXXUQDQFALTH-UHFFFAOYSA-N 0.000 claims description 3
- OOAWHBXKELGWND-UHFFFAOYSA-N 2-[5-[5-(oxolan-3-yl)-1h-1,2,4-triazol-3-yl]benzimidazol-1-yl]ethanol Chemical compound C=1C=C2N(CCO)C=NC2=CC=1C(N=1)=NNC=1C1CCOC1 OOAWHBXKELGWND-UHFFFAOYSA-N 0.000 claims description 3
- ZWAMTGNERQARLM-UHFFFAOYSA-N 2-[5-[5-methyl-2-(1-methylpiperidin-4-yl)-1,2,4-triazol-3-yl]benzimidazol-1-yl]ethanol Chemical compound C1CN(C)CCC1N1C(C=2C=C3N=CN(CCO)C3=CC=2)=NC(C)=N1 ZWAMTGNERQARLM-UHFFFAOYSA-N 0.000 claims description 3
- GBTDJIDXEOUIGK-UHFFFAOYSA-N 2-butyl-6-[3-(2-hydroxyethyl)benzimidazol-5-yl]-3,4-dihydropyrrolo[1,2-a]pyrazin-1-one Chemical compound C(CCC)N1C(C=2N(CC1)C(=CC=2)C=1C=CC2=C(N(C=N2)CCO)C=1)=O GBTDJIDXEOUIGK-UHFFFAOYSA-N 0.000 claims description 3
- VXHXTJVVYZHUEB-NRAVZPKASA-N 2-chloro-6-[7-fluoro-1-[(1s,3s)-3-methoxycyclohexyl]benzimidazol-5-yl]-9-(oxan-2-yl)purine Chemical compound C1[C@@H](OC)CCC[C@@H]1N1C2=C(F)C=C(C=3C=4N=CN(C=4N=C(Cl)N=3)C3OCCCC3)C=C2N=C1 VXHXTJVVYZHUEB-NRAVZPKASA-N 0.000 claims description 3
- IUPLQVAXUFVLJF-UHFFFAOYSA-N 2-methyl-1-[5-[5-(trifluoromethyl)pyrimidin-2-yl]oxybenzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=CC(=C2)OC1=NC=C(C=N1)C(F)(F)F)(C)O IUPLQVAXUFVLJF-UHFFFAOYSA-N 0.000 claims description 3
- UFZDMZQUGMHNDE-UHFFFAOYSA-N 2-methyl-1-[6-(4-methylphenoxy)benzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC1=CC=C(C=C1)C)(C)O UFZDMZQUGMHNDE-UHFFFAOYSA-N 0.000 claims description 3
- VHVXJURQGADTDV-UHFFFAOYSA-N 2-methyl-1-[6-[6-(trifluoromethyl)pyridin-3-yl]oxybenzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC=1C=NC(=CC=1)C(F)(F)F)(C)O VHVXJURQGADTDV-UHFFFAOYSA-N 0.000 claims description 3
- OHKXSNDUEWTBDA-UHFFFAOYSA-N 3-[[6-[5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]methyl]oxetan-3-ol Chemical compound FC(C=1C=CC(=NC=1)OC=1C=CC2=C(N(C=N2)CC2(COC2)O)C=1)(F)F OHKXSNDUEWTBDA-UHFFFAOYSA-N 0.000 claims description 3
- MOLMDKIAUNFARC-UHFFFAOYSA-N 4-[4-chloro-6-[3-(2-methoxyethyl)benzimidazol-5-yl]pyrimidin-2-yl]morpholine Chemical compound ClC1=CC(=NC(=N1)N1CCOCC1)C=1C=CC2=C(N(C=N2)CCOC)C=1 MOLMDKIAUNFARC-UHFFFAOYSA-N 0.000 claims description 3
- HQJUHUUDHASPKB-UHFFFAOYSA-N 5-(2-chlorophenyl)-3-(2-hydroxyethyl)benzimidazole-4-carbonitrile Chemical compound N#CC1=C2N(CCO)C=NC2=CC=C1C1=CC=CC=C1Cl HQJUHUUDHASPKB-UHFFFAOYSA-N 0.000 claims description 3
- CZDUOPAAVANXRO-UHFFFAOYSA-N 6-[3-(2-hydroxyethyl)benzimidazol-5-yl]-2-(3-methylbutyl)-3,4-dihydropyrrolo[1,2-a]pyrazin-1-one Chemical compound OCCN1C=NC2=C1C=C(C=C2)C1=CC=C2N1CCN(C2=O)CCC(C)C CZDUOPAAVANXRO-UHFFFAOYSA-N 0.000 claims description 3
- 241000124008 Mammalia Species 0.000 claims description 3
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 3
- 125000005554 pyridyloxy group Chemical group 0.000 claims description 3
- JABLISBXBZCSSZ-UHFFFAOYSA-N 1-[5-[2-fluoro-4-(trifluoromethyl)phenyl]benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound FC1=C(C=CC(=C1)C(F)(F)F)C1=CC2=C(N(C=N2)CC(C)(O)C)C=C1 JABLISBXBZCSSZ-UHFFFAOYSA-N 0.000 claims description 2
- HFFDNZJMPWMLGT-UHFFFAOYSA-N 1-[5-[2-methoxy-4-(trifluoromethyl)phenyl]benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound COC1=C(C=CC(=C1)C(F)(F)F)C1=CC2=C(N(C=N2)CC(C)(O)C)C=C1 HFFDNZJMPWMLGT-UHFFFAOYSA-N 0.000 claims description 2
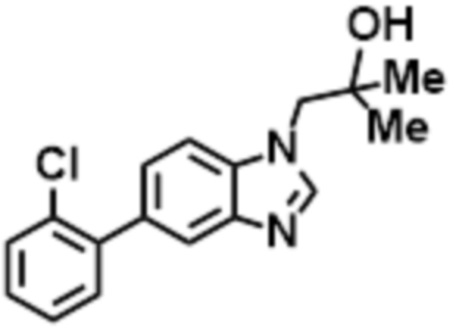
- UIXVQTQMCKPVBC-UHFFFAOYSA-N 1-[6-(4-chloro-2-fluorophenyl)benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound ClC1=CC(=C(C=C1)C=1C=CC2=C(N(C=N2)CC(C)(O)C)C=1)F UIXVQTQMCKPVBC-UHFFFAOYSA-N 0.000 claims description 2
- LVVPWVQUOFIJAI-UHFFFAOYSA-N 2-methyl-1-[5-[4-(trifluoromethoxy)phenyl]benzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=CC(=C2)C1=CC=C(C=C1)OC(F)(F)F)(C)O LVVPWVQUOFIJAI-UHFFFAOYSA-N 0.000 claims description 2
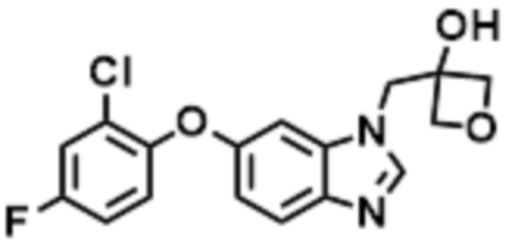
- LIAHDLGKTJXVPY-UHFFFAOYSA-N 3-[[6-(2-chloro-4-fluorophenoxy)benzimidazol-1-yl]methyl]oxetan-3-ol Chemical compound ClC1=C(OC=2C=CC3=C(N(C=N3)CC3(COC3)O)C=2)C=CC(=C1)F LIAHDLGKTJXVPY-UHFFFAOYSA-N 0.000 claims description 2
- ZUETWPLDMQPJBT-UHFFFAOYSA-N 3-[[6-[4-(trifluoromethyl)phenoxy]benzimidazol-1-yl]methyl]oxetan-3-ol Chemical compound FC(C1=CC=C(OC=2C=CC3=C(N(C=N3)CC3(COC3)O)C=2)C=C1)(F)F ZUETWPLDMQPJBT-UHFFFAOYSA-N 0.000 claims description 2
- WQHUWNUPVZZPAP-UHFFFAOYSA-N 4-[6-[2-methoxy-4-(trifluoromethyl)phenyl]benzimidazol-1-yl]-2-methylbutan-2-ol Chemical compound COC1=C(C=CC(=C1)C(F)(F)F)C=1C=CC2=C(N(C=N2)CCC(C)(O)C)C=1 WQHUWNUPVZZPAP-UHFFFAOYSA-N 0.000 claims description 2
- 125000004652 decahydroisoquinolinyl group Chemical group C1(NCCC2CCCCC12)* 0.000 claims description 2
- 125000004856 decahydroquinolinyl group Chemical group N1(CCCC2CCCCC12)* 0.000 claims description 2
- 125000001070 dihydroindolyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 claims description 2
- 125000004611 dihydroisoindolyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 claims description 2
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 claims description 2
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 claims description 2
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 claims description 2
- 125000004853 tetrahydropyridinyl group Chemical group N1(CCCC=C1)* 0.000 claims description 2
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 claims description 2
- 239000000126 substance Substances 0.000 abstract description 10
- 230000000694 effects Effects 0.000 abstract description 6
- 230000002401 inhibitory effect Effects 0.000 abstract description 6
- 238000005160 1H NMR spectroscopy Methods 0.000 description 194
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 132
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 96
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 62
- 238000002360 preparation method Methods 0.000 description 61
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 51
- 239000012044 organic layer Substances 0.000 description 46
- 239000011541 reaction mixture Substances 0.000 description 43
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 40
- 239000000203 mixture Substances 0.000 description 39
- 239000002904 solvent Substances 0.000 description 36
- 238000006243 chemical reaction Methods 0.000 description 35
- 239000000243 solution Substances 0.000 description 32
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 28
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 28
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 26
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 26
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 25
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 24
- 239000000047 product Substances 0.000 description 23
- 238000010898 silica gel chromatography Methods 0.000 description 23
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 22
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 22
- 238000012360 testing method Methods 0.000 description 22
- 239000002585 base Substances 0.000 description 19
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 18
- 208000002193 Pain Diseases 0.000 description 17
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 17
- 239000007858 starting material Substances 0.000 description 17
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 14
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 14
- 230000009467 reduction Effects 0.000 description 14
- 238000006722 reduction reaction Methods 0.000 description 14
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 13
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 13
- 238000009835 boiling Methods 0.000 description 13
- 239000011737 fluorine Substances 0.000 description 13
- 229910052731 fluorine Inorganic materials 0.000 description 13
- 235000019253 formic acid Nutrition 0.000 description 13
- 230000035484 reaction time Effects 0.000 description 13
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 12
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 12
- 229910000024 caesium carbonate Inorganic materials 0.000 description 12
- 230000003595 spectral effect Effects 0.000 description 12
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 12
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 11
- 239000003054 catalyst Substances 0.000 description 11
- 230000005764 inhibitory process Effects 0.000 description 11
- 229910000027 potassium carbonate Inorganic materials 0.000 description 11
- 125000006239 protecting group Chemical group 0.000 description 11
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 10
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 10
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 10
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 9
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 9
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 9
- 239000000706 filtrate Substances 0.000 description 9
- 239000012299 nitrogen atmosphere Substances 0.000 description 9
- 230000002265 prevention Effects 0.000 description 9
- 108091006146 Channels Proteins 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 8
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 8
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 229910001415 sodium ion Inorganic materials 0.000 description 8
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 7
- 210000004027 cell Anatomy 0.000 description 7
- 239000000460 chlorine Substances 0.000 description 7
- 229910052801 chlorine Inorganic materials 0.000 description 7
- 238000000605 extraction Methods 0.000 description 7
- 208000033808 peripheral neuropathy Diseases 0.000 description 7
- OOKAZRDERJMRCJ-KOUAFAAESA-N (3r)-7-[(1s,2s,4ar,6s,8s)-2,6-dimethyl-8-[(2s)-2-methylbutanoyl]oxy-1,2,4a,5,6,7,8,8a-octahydronaphthalen-1-yl]-3-hydroxy-5-oxoheptanoic acid Chemical compound C1=C[C@H](C)[C@H](CCC(=O)C[C@@H](O)CC(O)=O)C2[C@@H](OC(=O)[C@@H](C)CC)C[C@@H](C)C[C@@H]21 OOKAZRDERJMRCJ-KOUAFAAESA-N 0.000 description 6
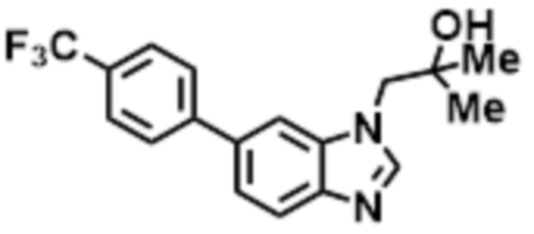
- CVJLVIXHZCIATA-UHFFFAOYSA-N 1-[5-(4-fluorophenyl)benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound FC1=CC=C(C=C1)C1=CC2=C(N(C=N2)CC(C)(O)C)C=C1 CVJLVIXHZCIATA-UHFFFAOYSA-N 0.000 description 6
- LXQMHOKEXZETKB-UHFFFAOYSA-N 1-amino-2-methylpropan-2-ol Chemical compound CC(C)(O)CN LXQMHOKEXZETKB-UHFFFAOYSA-N 0.000 description 6
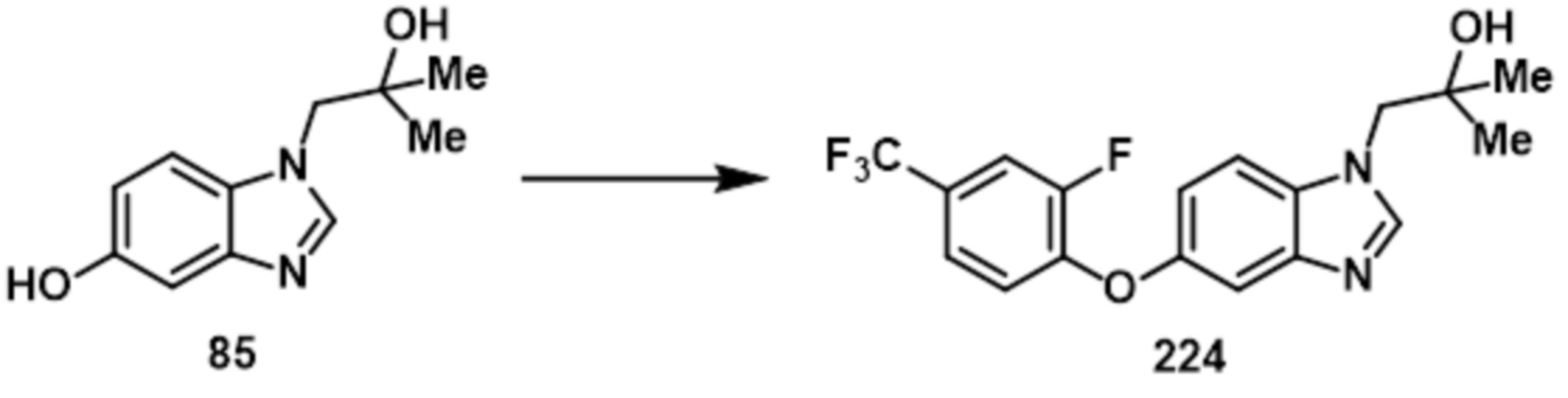
- ULWFHILRHAJEGX-UHFFFAOYSA-N 3-(2-hydroxy-2-methylpropyl)benzimidazol-5-ol Chemical compound OC(CN1C=NC2=C1C=C(C=C2)O)(C)C ULWFHILRHAJEGX-UHFFFAOYSA-N 0.000 description 6
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 6
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 6
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 6
- 230000000202 analgesic effect Effects 0.000 description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 6
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 6
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 6
- 150000002430 hydrocarbons Chemical group 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 229930195734 saturated hydrocarbon Natural products 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 6
- 239000011701 zinc Substances 0.000 description 6
- 229910052725 zinc Inorganic materials 0.000 description 6
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 5
- HFMQAIZBLYXPQR-UHFFFAOYSA-N 1-(2-hydroxy-2-methylpropyl)benzimidazol-5-ol Chemical compound OC(CN1C=NC2=C1C=CC(=C2)O)(C)C HFMQAIZBLYXPQR-UHFFFAOYSA-N 0.000 description 5
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 5
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 5
- 239000001961 anticonvulsive agent Substances 0.000 description 5
- 239000012267 brine Substances 0.000 description 5
- 239000013078 crystal Substances 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 125000000623 heterocyclic group Chemical group 0.000 description 5
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 5
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 239000011734 sodium Substances 0.000 description 5
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 5
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- YIHJVYKMHLWTIM-SNVBAGLBSA-N (3R)-2-methyl-3-[2-nitro-5-[5-(trifluoromethyl)pyridin-2-yl]oxyanilino]butan-2-ol Chemical compound CC(C)([C@@H](C)NC1=C(C=CC(=C1)OC1=NC=C(C=C1)C(F)(F)F)[N+](=O)[O-])O YIHJVYKMHLWTIM-SNVBAGLBSA-N 0.000 description 4
- CTSHCVLSZISSOJ-LLVKDONJSA-N (3R)-2-methyl-3-[6-[5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]butan-2-ol Chemical compound CC(C)([C@@H](C)N1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)C(F)(F)F)O CTSHCVLSZISSOJ-LLVKDONJSA-N 0.000 description 4
- YURXCUVDCIDDHM-PGMHMLKASA-N (3r)-3-amino-2-methylbutan-2-ol;hydrochloride Chemical compound Cl.C[C@@H](N)C(C)(C)O YURXCUVDCIDDHM-PGMHMLKASA-N 0.000 description 4
- DEVSOMFAQLZNKR-RJRFIUFISA-N (z)-3-[3-[3,5-bis(trifluoromethyl)phenyl]-1,2,4-triazol-1-yl]-n'-pyrazin-2-ylprop-2-enehydrazide Chemical compound FC(F)(F)C1=CC(C(F)(F)F)=CC(C2=NN(\C=C/C(=O)NNC=3N=CC=NC=3)C=N2)=C1 DEVSOMFAQLZNKR-RJRFIUFISA-N 0.000 description 4
- HMYNYZOKILFTJA-UHFFFAOYSA-N 1-(2-cyclopentyloxyethyl)-6-(4-fluorophenoxy)benzimidazole Chemical compound C1(CCCC1)OCCN1C=NC2=C1C=C(C=C2)OC1=CC=C(C=C1)F HMYNYZOKILFTJA-UHFFFAOYSA-N 0.000 description 4
- FZXLWBVMLTWEQK-UHFFFAOYSA-N 1-(2-methylprop-2-enyl)-6-[5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazole Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)C(F)(F)F)=C FZXLWBVMLTWEQK-UHFFFAOYSA-N 0.000 description 4
- QKJGUMLWLHFSJC-UHFFFAOYSA-N 1-(4-bromo-2-nitroanilino)-2-methylpropan-2-ol Chemical compound CC(C)(O)CNC1=CC=C(Br)C=C1[N+]([O-])=O QKJGUMLWLHFSJC-UHFFFAOYSA-N 0.000 description 4
- NDNGLNPQOYFHRV-UHFFFAOYSA-N 1-(5-bromobenzimidazol-1-yl)-2-methylpropan-2-ol Chemical compound BrC1=CC=C2N(CC(C)(O)C)C=NC2=C1 NDNGLNPQOYFHRV-UHFFFAOYSA-N 0.000 description 4
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 4
- AVVVJXHEJMFHLK-UHFFFAOYSA-N 2-methyl-1-(2-nitro-5-phenylmethoxyanilino)propan-2-ol Chemical compound C(C1=CC=CC=C1)OC=1C=CC(=C(C=1)NCC(C)(O)C)[N+](=O)[O-] AVVVJXHEJMFHLK-UHFFFAOYSA-N 0.000 description 4
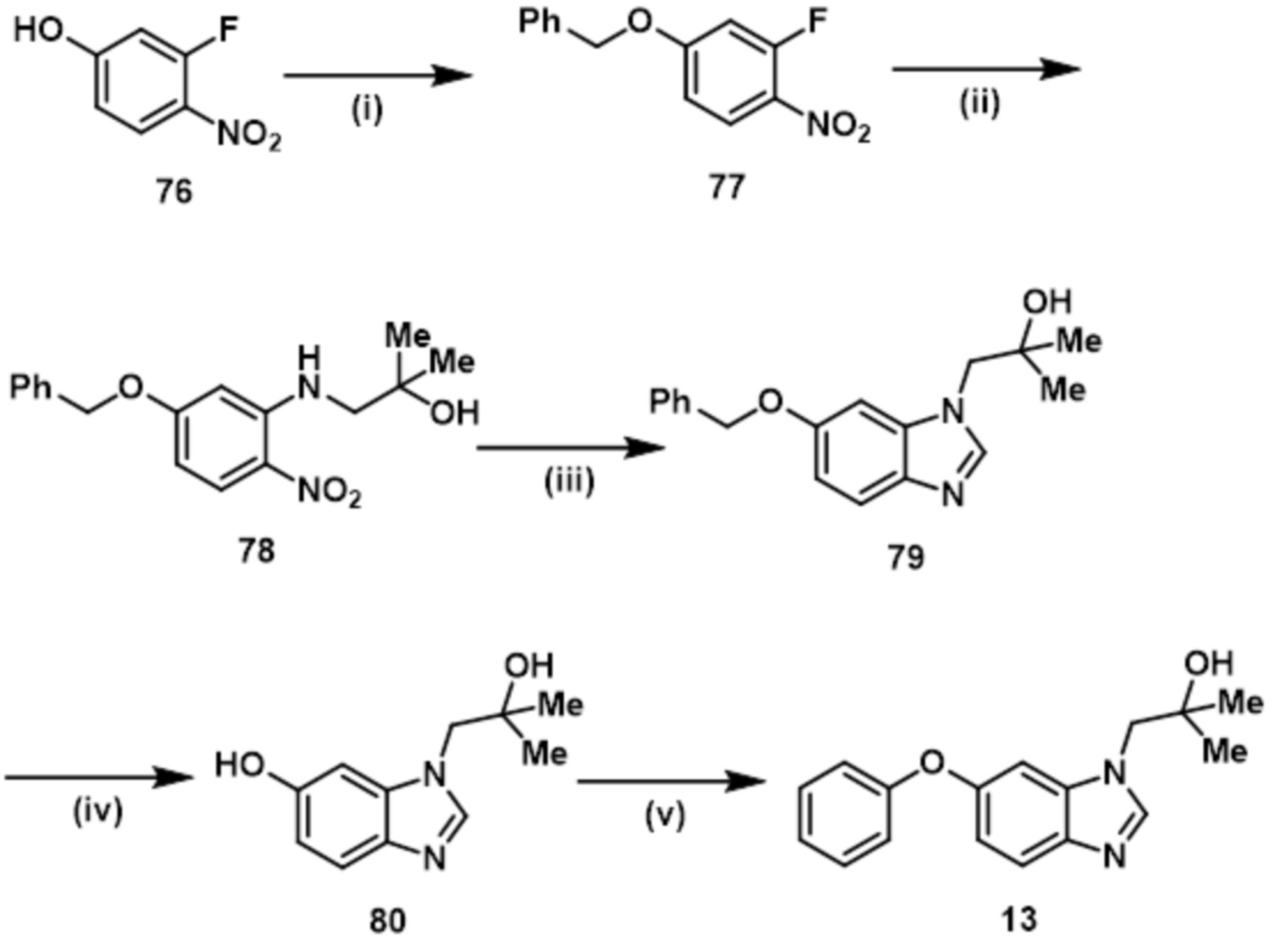
- PYPAMPUBEJGHCS-UHFFFAOYSA-N 2-methyl-1-(6-phenylmethoxybenzimidazol-1-yl)propan-2-ol Chemical compound C(C1=CC=CC=C1)OC=1C=CC2=C(N(C=N2)CC(C)(O)C)C=1 PYPAMPUBEJGHCS-UHFFFAOYSA-N 0.000 description 4
- DQAZPZIYEOGZAF-UHFFFAOYSA-N 4-ethyl-n-[4-(3-ethynylanilino)-7-methoxyquinazolin-6-yl]piperazine-1-carboxamide Chemical compound C1CN(CC)CCN1C(=O)NC(C(=CC1=NC=N2)OC)=CC1=C2NC1=CC=CC(C#C)=C1 DQAZPZIYEOGZAF-UHFFFAOYSA-N 0.000 description 4
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 4
- VKLKXFOZNHEBSW-UHFFFAOYSA-N 5-[[3-[(4-morpholin-4-ylbenzoyl)amino]phenyl]methoxy]pyridine-3-carboxamide Chemical compound O1CCN(CC1)C1=CC=C(C(=O)NC=2C=C(COC=3C=NC=C(C(=O)N)C=3)C=CC=2)C=C1 VKLKXFOZNHEBSW-UHFFFAOYSA-N 0.000 description 4
- RSIWALKZYXPAGW-NSHDSACASA-N 6-(3-fluorophenyl)-3-methyl-7-[(1s)-1-(7h-purin-6-ylamino)ethyl]-[1,3]thiazolo[3,2-a]pyrimidin-5-one Chemical compound C=1([C@@H](NC=2C=3N=CNC=3N=CN=2)C)N=C2SC=C(C)N2C(=O)C=1C1=CC=CC(F)=C1 RSIWALKZYXPAGW-NSHDSACASA-N 0.000 description 4
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 4
- JQUCWIWWWKZNCS-LESHARBVSA-N C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F Chemical compound C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F JQUCWIWWWKZNCS-LESHARBVSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- QOVYHDHLFPKQQG-NDEPHWFRSA-N N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O Chemical compound N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O QOVYHDHLFPKQQG-NDEPHWFRSA-N 0.000 description 4
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 4
- GOORRFPLUCPNTO-UHFFFAOYSA-N [2-methyl-1-[6-[5-(2,2,2-trifluoroethyl)pyridin-2-yl]oxybenzimidazol-1-yl]propan-2-yl] acetate Chemical compound C(C)(=O)OC(CN1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)CC(F)(F)F)(C)C GOORRFPLUCPNTO-UHFFFAOYSA-N 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 239000000935 antidepressant agent Substances 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 238000010531 catalytic reduction reaction Methods 0.000 description 4
- GWNFQAKCJYEJEW-UHFFFAOYSA-N ethyl 3-[8-[[4-methyl-5-[(3-methyl-4-oxophthalazin-1-yl)methyl]-1,2,4-triazol-3-yl]sulfanyl]octanoylamino]benzoate Chemical compound CCOC(=O)C1=CC(NC(=O)CCCCCCCSC2=NN=C(CC3=NN(C)C(=O)C4=CC=CC=C34)N2C)=CC=C1 GWNFQAKCJYEJEW-UHFFFAOYSA-N 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- 150000004678 hydrides Chemical class 0.000 description 4
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 4
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 4
- 201000001119 neuropathy Diseases 0.000 description 4
- 230000007823 neuropathy Effects 0.000 description 4
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 4
- KJIFKLIQANRMOU-UHFFFAOYSA-N oxidanium;4-methylbenzenesulfonate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1 KJIFKLIQANRMOU-UHFFFAOYSA-N 0.000 description 4
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 150000003180 prostaglandins Chemical class 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 229910000029 sodium carbonate Inorganic materials 0.000 description 4
- 239000012312 sodium hydride Substances 0.000 description 4
- 229910000104 sodium hydride Inorganic materials 0.000 description 4
- 230000000638 stimulation Effects 0.000 description 4
- 229960001052 streptozocin Drugs 0.000 description 4
- ZBSFLGNSQZRBCS-SSDOTTSWSA-N tert-butyl n-[(2r)-3-hydroxy-3-methylbutan-2-yl]carbamate Chemical compound CC(O)(C)[C@@H](C)NC(=O)OC(C)(C)C ZBSFLGNSQZRBCS-SSDOTTSWSA-N 0.000 description 4
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 3
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 3
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 3
- STPKWKPURVSAJF-LJEWAXOPSA-N (4r,5r)-5-[4-[[4-(1-aza-4-azoniabicyclo[2.2.2]octan-4-ylmethyl)phenyl]methoxy]phenyl]-3,3-dibutyl-7-(dimethylamino)-1,1-dioxo-4,5-dihydro-2h-1$l^{6}-benzothiepin-4-ol Chemical compound O[C@H]1C(CCCC)(CCCC)CS(=O)(=O)C2=CC=C(N(C)C)C=C2[C@H]1C(C=C1)=CC=C1OCC(C=C1)=CC=C1C[N+]1(CC2)CCN2CC1 STPKWKPURVSAJF-LJEWAXOPSA-N 0.000 description 3
- VUEGYUOUAAVYAS-JGGQBBKZSA-N (6ar,9s,10ar)-9-(dimethylsulfamoylamino)-7-methyl-6,6a,8,9,10,10a-hexahydro-4h-indolo[4,3-fg]quinoline Chemical compound C1=CC([C@H]2C[C@@H](CN(C)[C@@H]2C2)NS(=O)(=O)N(C)C)=C3C2=CNC3=C1 VUEGYUOUAAVYAS-JGGQBBKZSA-N 0.000 description 3
- KKHFRAFPESRGGD-UHFFFAOYSA-N 1,3-dimethyl-7-[3-(n-methylanilino)propyl]purine-2,6-dione Chemical compound C1=NC=2N(C)C(=O)N(C)C(=O)C=2N1CCCN(C)C1=CC=CC=C1 KKHFRAFPESRGGD-UHFFFAOYSA-N 0.000 description 3
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 3
- QXOGPTXQGKQSJT-UHFFFAOYSA-N 1-amino-4-[4-(3,4-dimethylphenyl)sulfanylanilino]-9,10-dioxoanthracene-2-sulfonic acid Chemical compound Cc1ccc(Sc2ccc(Nc3cc(c(N)c4C(=O)c5ccccc5C(=O)c34)S(O)(=O)=O)cc2)cc1C QXOGPTXQGKQSJT-UHFFFAOYSA-N 0.000 description 3
- VCUXVXLUOHDHKK-UHFFFAOYSA-N 2-(2-aminopyrimidin-4-yl)-4-(2-chloro-4-methoxyphenyl)-1,3-thiazole-5-carboxamide Chemical compound ClC1=CC(OC)=CC=C1C1=C(C(N)=O)SC(C=2N=C(N)N=CC=2)=N1 VCUXVXLUOHDHKK-UHFFFAOYSA-N 0.000 description 3
- QEBYEVQKHRUYPE-UHFFFAOYSA-N 2-(2-chlorophenyl)-5-[(1-methylpyrazol-3-yl)methyl]-4-[[methyl(pyridin-3-ylmethyl)amino]methyl]-1h-pyrazolo[4,3-c]pyridine-3,6-dione Chemical compound C1=CN(C)N=C1CN1C(=O)C=C2NN(C=3C(=CC=CC=3)Cl)C(=O)C2=C1CN(C)CC1=CC=CN=C1 QEBYEVQKHRUYPE-UHFFFAOYSA-N 0.000 description 3
- UUODQIKUTGWMPT-UHFFFAOYSA-N 2-fluoro-5-(trifluoromethyl)pyridine Chemical compound FC1=CC=C(C(F)(F)F)C=N1 UUODQIKUTGWMPT-UHFFFAOYSA-N 0.000 description 3
- 125000004198 2-fluorophenyl group Chemical group [H]C1=C([H])C(F)=C(*)C([H])=C1[H] 0.000 description 3
- DFRAKBCRUYUFNT-UHFFFAOYSA-N 3,8-dicyclohexyl-2,4,7,9-tetrahydro-[1,3]oxazino[5,6-h][1,3]benzoxazine Chemical compound C1CCCCC1N1CC(C=CC2=C3OCN(C2)C2CCCCC2)=C3OC1 DFRAKBCRUYUFNT-UHFFFAOYSA-N 0.000 description 3
- BGAJNPLDJJBRHK-UHFFFAOYSA-N 3-[2-[5-(3-chloro-4-propan-2-yloxyphenyl)-1,3,4-thiadiazol-2-yl]-3-methyl-6,7-dihydro-4h-pyrazolo[4,3-c]pyridin-5-yl]propanoic acid Chemical compound C1=C(Cl)C(OC(C)C)=CC=C1C1=NN=C(N2C(=C3CN(CCC(O)=O)CCC3=N2)C)S1 BGAJNPLDJJBRHK-UHFFFAOYSA-N 0.000 description 3
- 125000004180 3-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(F)=C1[H] 0.000 description 3
- GDUANFXPOZTYKS-UHFFFAOYSA-N 6-bromo-8-[(2,6-difluoro-4-methoxybenzoyl)amino]-4-oxochromene-2-carboxylic acid Chemical compound FC1=CC(OC)=CC(F)=C1C(=O)NC1=CC(Br)=CC2=C1OC(C(O)=O)=CC2=O GDUANFXPOZTYKS-UHFFFAOYSA-N 0.000 description 3
- XASOHFCUIQARJT-UHFFFAOYSA-N 8-methoxy-6-[7-(2-morpholin-4-ylethoxy)imidazo[1,2-a]pyridin-3-yl]-2-(2,2,2-trifluoroethyl)-3,4-dihydroisoquinolin-1-one Chemical compound C(N1C(=O)C2=C(OC)C=C(C=3N4C(=NC=3)C=C(C=C4)OCCN3CCOCC3)C=C2CC1)C(F)(F)F XASOHFCUIQARJT-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- PKMUHQIDVVOXHQ-HXUWFJFHSA-N C[C@H](C1=CC(C2=CC=C(CNC3CCCC3)S2)=CC=C1)NC(C1=C(C)C=CC(NC2CNC2)=C1)=O Chemical compound C[C@H](C1=CC(C2=CC=C(CNC3CCCC3)S2)=CC=C1)NC(C1=C(C)C=CC(NC2CNC2)=C1)=O PKMUHQIDVVOXHQ-HXUWFJFHSA-N 0.000 description 3
- QPLDLSVMHZLSFG-UHFFFAOYSA-N Copper oxide Chemical compound [Cu]=O QPLDLSVMHZLSFG-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 239000007995 HEPES buffer Substances 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- LVDRREOUMKACNJ-BKMJKUGQSA-N N-[(2R,3S)-2-(4-chlorophenyl)-1-(1,4-dimethyl-2-oxoquinolin-7-yl)-6-oxopiperidin-3-yl]-2-methylpropane-1-sulfonamide Chemical compound CC(C)CS(=O)(=O)N[C@H]1CCC(=O)N([C@@H]1c1ccc(Cl)cc1)c1ccc2c(C)cc(=O)n(C)c2c1 LVDRREOUMKACNJ-BKMJKUGQSA-N 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- IOSLINNLJFQMFF-XMMPIXPASA-N [(2R)-1-[[4-[[3-[(4-fluorophenyl)methylsulfanyl]phenoxy]methyl]phenyl]methyl]pyrrolidin-2-yl]methanol Chemical compound FC1=CC=C(CSC=2C=C(OCC3=CC=C(CN4[C@H](CCC4)CO)C=C3)C=CC=2)C=C1 IOSLINNLJFQMFF-XMMPIXPASA-N 0.000 description 3
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 3
- 235000019270 ammonium chloride Nutrition 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 229940121363 anti-inflammatory agent Drugs 0.000 description 3
- 239000002260 anti-inflammatory agent Substances 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 3
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 3
- XJHCXCQVJFPJIK-UHFFFAOYSA-M caesium fluoride Chemical compound [F-].[Cs+] XJHCXCQVJFPJIK-UHFFFAOYSA-M 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
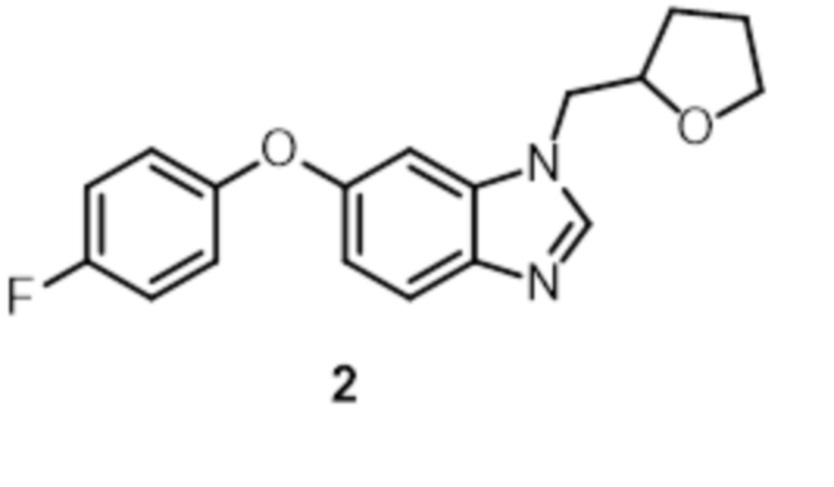
- 229940125904 compound 1 Drugs 0.000 description 3
- 229940125797 compound 12 Drugs 0.000 description 3
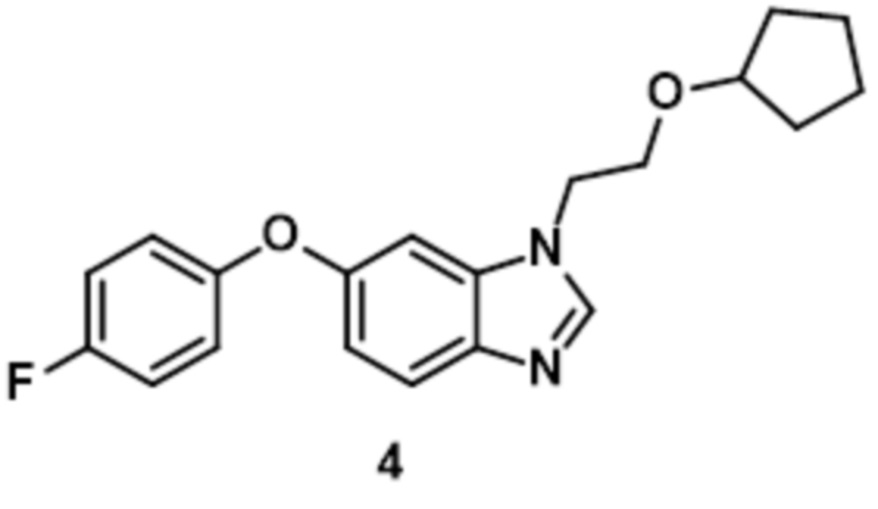
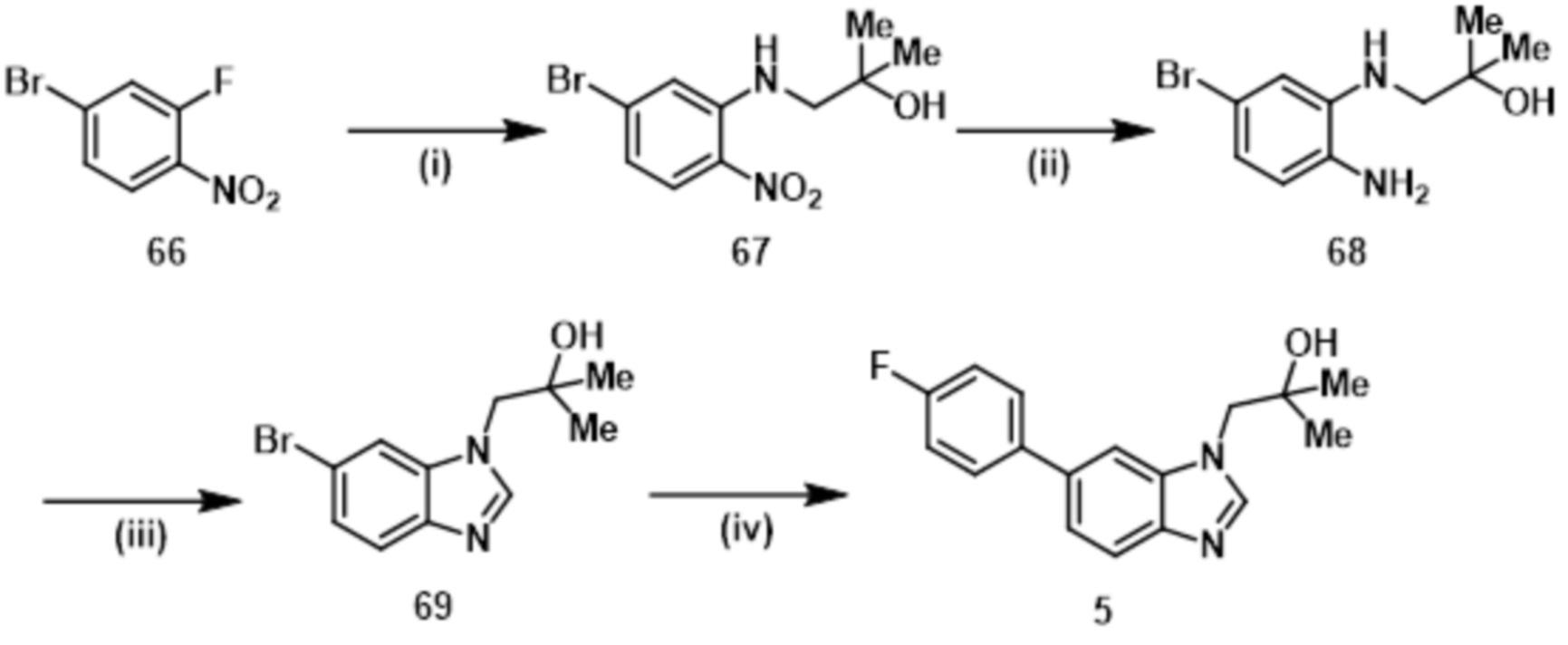
- 229940125898 compound 5 Drugs 0.000 description 3
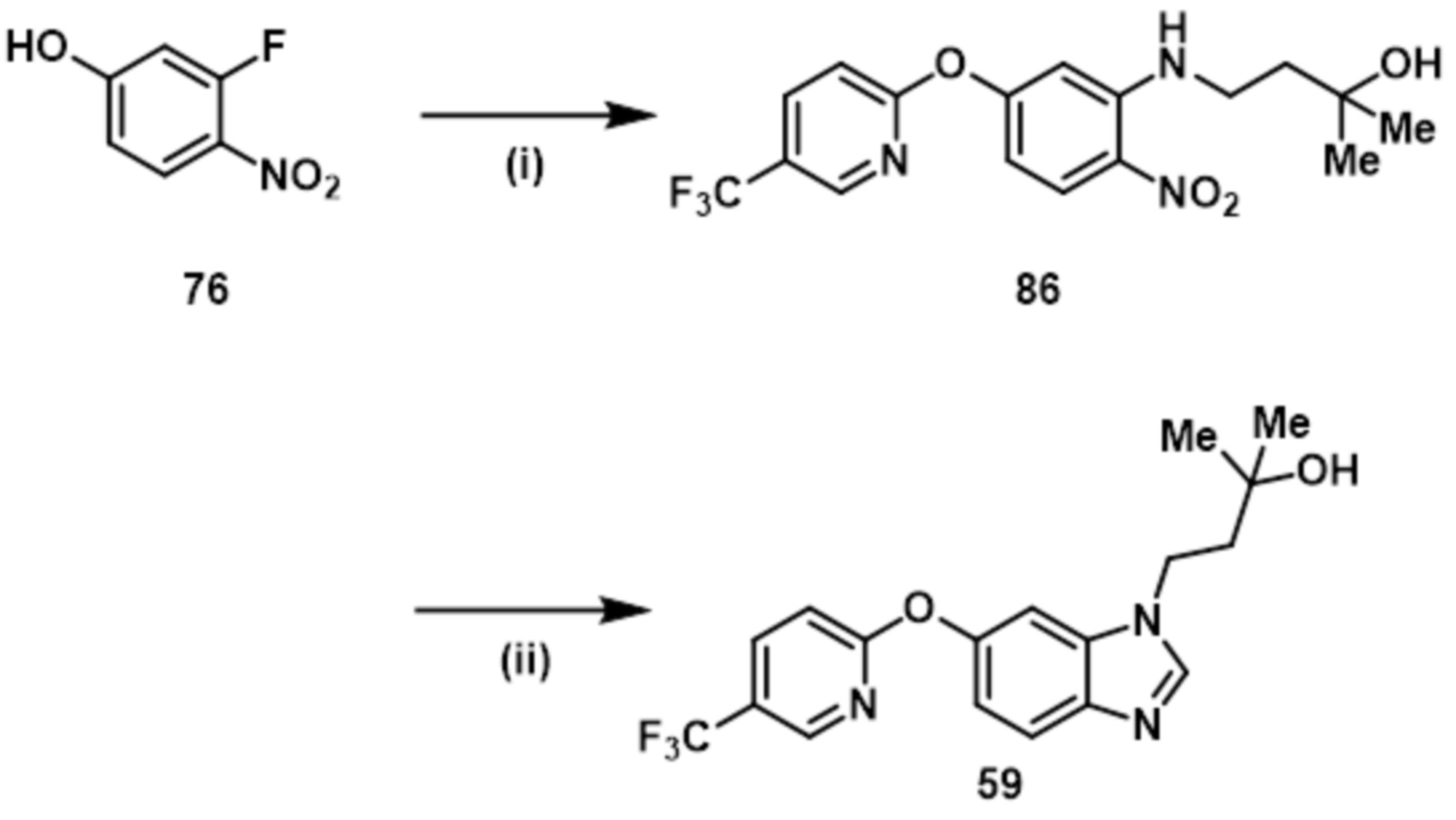
- 229940125900 compound 59 Drugs 0.000 description 3
- 229940126179 compound 72 Drugs 0.000 description 3
- OPQARKPSCNTWTJ-UHFFFAOYSA-L copper(ii) acetate Chemical compound [Cu+2].CC([O-])=O.CC([O-])=O OPQARKPSCNTWTJ-UHFFFAOYSA-L 0.000 description 3
- 230000002999 depolarising effect Effects 0.000 description 3
- BJXYHBKEQFQVES-NWDGAFQWSA-N enpatoran Chemical compound N[C@H]1CN(C[C@H](C1)C(F)(F)F)C1=C2C=CC=NC2=C(C=C1)C#N BJXYHBKEQFQVES-NWDGAFQWSA-N 0.000 description 3
- 150000002170 ethers Chemical class 0.000 description 3
- 238000010438 heat treatment Methods 0.000 description 3
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 3
- 238000005984 hydrogenation reaction Methods 0.000 description 3
- 239000000543 intermediate Substances 0.000 description 3
- YGBMCLDVRUGXOV-UHFFFAOYSA-N n-[6-[6-chloro-5-[(4-fluorophenyl)sulfonylamino]pyridin-3-yl]-1,3-benzothiazol-2-yl]acetamide Chemical compound C1=C2SC(NC(=O)C)=NC2=CC=C1C(C=1)=CN=C(Cl)C=1NS(=O)(=O)C1=CC=C(F)C=C1 YGBMCLDVRUGXOV-UHFFFAOYSA-N 0.000 description 3
- 239000004084 narcotic analgesic agent Substances 0.000 description 3
- 210000005036 nerve Anatomy 0.000 description 3
- 229910052760 oxygen Chemical group 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 3
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 3
- 235000019798 tripotassium phosphate Nutrition 0.000 description 3
- WNKZABBEOHAFMP-MRXNPFEDSA-N (2R)-2-methyl-3-[6-[5-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]propane-1,2-diol Chemical compound C[C@](CO)(CN1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)C(F)(F)F)O WNKZABBEOHAFMP-MRXNPFEDSA-N 0.000 description 2
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 2
- ZEUITGRIYCTCEM-KRWDZBQOSA-N (S)-duloxetine Chemical compound C1([C@@H](OC=2C3=CC=CC=C3C=CC=2)CCNC)=CC=CS1 ZEUITGRIYCTCEM-KRWDZBQOSA-N 0.000 description 2
- YUCBLVFHJWOYDN-HVLQGHBFSA-N 1,4-bis[(s)-[(2r,4s,5r)-5-ethyl-1-azabicyclo[2.2.2]octan-2-yl]-(6-methoxyquinolin-4-yl)methoxy]phthalazine Chemical compound C1=C(OC)C=C2C([C@H](OC=3C4=CC=CC=C4C(O[C@H]([C@@H]4N5CC[C@H]([C@H](C5)CC)C4)C=4C5=CC(OC)=CC=C5N=CC=4)=NN=3)[C@H]3C[C@@H]4CCN3C[C@@H]4CC)=CC=NC2=C1 YUCBLVFHJWOYDN-HVLQGHBFSA-N 0.000 description 2
- KFRWFMROQIGDDJ-UHFFFAOYSA-N 1-[6-(4-fluorophenyl)benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound FC1=CC=C(C=C1)C=1C=CC2=C(N(C=N2)CC(C)(O)C)C=1 KFRWFMROQIGDDJ-UHFFFAOYSA-N 0.000 description 2
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- VVCMGAUPZIKYTH-VGHSCWAPSA-N 2-acetyloxybenzoic acid;[(2s,3r)-4-(dimethylamino)-3-methyl-1,2-diphenylbutan-2-yl] propanoate;1,3,7-trimethylpurine-2,6-dione Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O.CN1C(=O)N(C)C(=O)C2=C1N=CN2C.C([C@](OC(=O)CC)([C@H](C)CN(C)C)C=1C=CC=CC=1)C1=CC=CC=C1 VVCMGAUPZIKYTH-VGHSCWAPSA-N 0.000 description 2
- NAMYKGVDVNBCFQ-UHFFFAOYSA-N 2-bromopropane Chemical compound CC(C)Br NAMYKGVDVNBCFQ-UHFFFAOYSA-N 0.000 description 2
- NEURYOYRKPFLKH-UHFFFAOYSA-N 2-chloro-1-isocyanato-4-(trifluoromethyl)benzene Chemical group FC(F)(F)C1=CC=C(N=C=O)C(Cl)=C1 NEURYOYRKPFLKH-UHFFFAOYSA-N 0.000 description 2
- OKGONKWYXNSEMI-UHFFFAOYSA-N 2-methyl-1-(6-phenoxybenzimidazol-1-yl)propan-2-ol Chemical compound CC(CN1C=NC2=C1C=C(C=C2)OC1=CC=CC=C1)(C)O OKGONKWYXNSEMI-UHFFFAOYSA-N 0.000 description 2
- HWBQRXSLBNCXGN-UHFFFAOYSA-N 2-methyl-1-[5-[6-(trifluoromethyl)pyridin-2-yl]oxybenzimidazol-1-yl]propan-2-ol Chemical compound CC(CN1C=NC2=C1C=CC(=C2)OC1=NC(=CC=C1)C(F)(F)F)(C)O HWBQRXSLBNCXGN-UHFFFAOYSA-N 0.000 description 2
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 2
- 229940118148 Aldose reductase inhibitor Drugs 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 208000000094 Chronic Pain Diseases 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 2
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical group C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 208000004454 Hyperalgesia Diseases 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 2
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 2
- 208000004550 Postoperative Pain Diseases 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 206010037779 Radiculopathy Diseases 0.000 description 2
- 229940123934 Reductase inhibitor Drugs 0.000 description 2
- 101150080511 Scn9a gene Proteins 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 239000003288 aldose reductase inhibitor Substances 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 229960000836 amitriptyline Drugs 0.000 description 2
- KRMDCWKBEZIMAB-UHFFFAOYSA-N amitriptyline Chemical compound C1CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 KRMDCWKBEZIMAB-UHFFFAOYSA-N 0.000 description 2
- VZTDIZULWFCMLS-UHFFFAOYSA-N ammonium formate Chemical compound [NH4+].[O-]C=O VZTDIZULWFCMLS-UHFFFAOYSA-N 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 125000002619 bicyclic group Chemical group 0.000 description 2
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 2
- HUCVOHYBFXVBRW-UHFFFAOYSA-M caesium hydroxide Chemical compound [OH-].[Cs+] HUCVOHYBFXVBRW-UHFFFAOYSA-M 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 229960000623 carbamazepine Drugs 0.000 description 2
- FFGPTBGBLSHEPO-UHFFFAOYSA-N carbamazepine Chemical compound C1=CC2=CC=CC=C2N(C(=O)N)C2=CC=CC=C21 FFGPTBGBLSHEPO-UHFFFAOYSA-N 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 229940000425 combination drug Drugs 0.000 description 2
- 229940125782 compound 2 Drugs 0.000 description 2
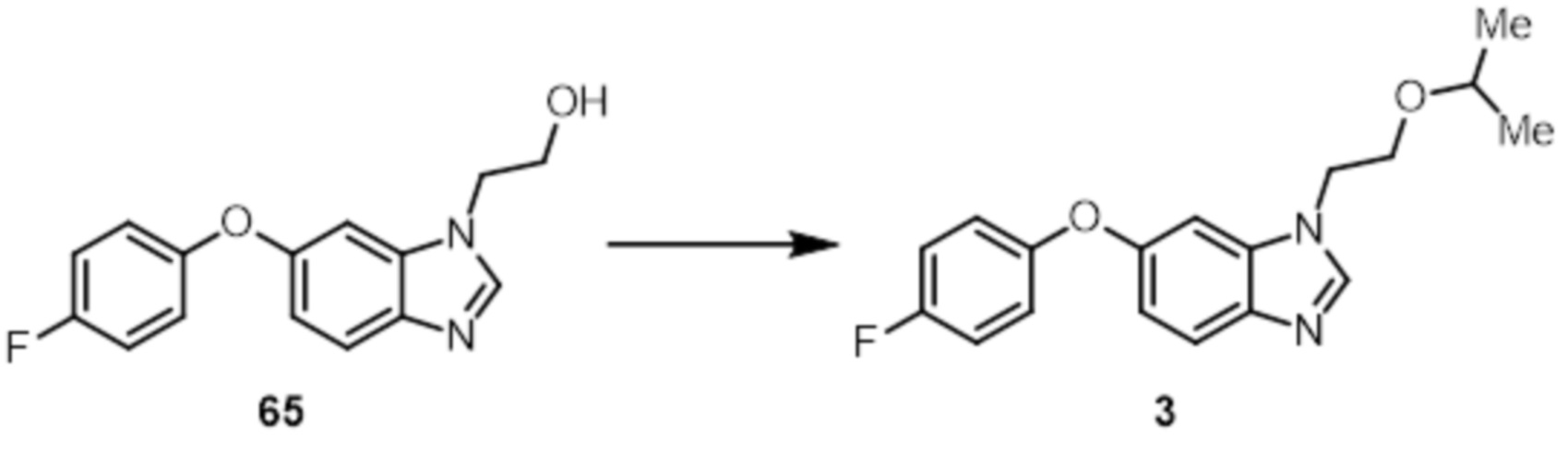
- 229940126214 compound 3 Drugs 0.000 description 2
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 2
- USVZFSNDGFNNJT-UHFFFAOYSA-N cyclopenta-1,4-dien-1-yl(diphenyl)phosphane (2,3-dichlorocyclopenta-1,4-dien-1-yl)-diphenylphosphane iron(2+) Chemical compound [Fe++].c1cc[c-](c1)P(c1ccccc1)c1ccccc1.Clc1c(cc[c-]1Cl)P(c1ccccc1)c1ccccc1 USVZFSNDGFNNJT-UHFFFAOYSA-N 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 2
- 229960001259 diclofenac Drugs 0.000 description 2
- 229960002866 duloxetine Drugs 0.000 description 2
- CHNUOJQWGUIOLD-NFZZJPOKSA-N epalrestat Chemical compound C=1C=CC=CC=1\C=C(/C)\C=C1/SC(=S)N(CC(O)=O)C1=O CHNUOJQWGUIOLD-NFZZJPOKSA-N 0.000 description 2
- 229950010170 epalrestat Drugs 0.000 description 2
- CHNUOJQWGUIOLD-UHFFFAOYSA-N epalrestate Natural products C=1C=CC=CC=1C=C(C)C=C1SC(=S)N(CC(O)=O)C1=O CHNUOJQWGUIOLD-UHFFFAOYSA-N 0.000 description 2
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 210000004051 gastric juice Anatomy 0.000 description 2
- MNQZXJOMYWMBOU-UHFFFAOYSA-N glyceraldehyde Chemical compound OCC(O)C=O MNQZXJOMYWMBOU-UHFFFAOYSA-N 0.000 description 2
- 102000048004 human SCN9A Human genes 0.000 description 2
- SHFJWMWCIHQNCP-UHFFFAOYSA-M hydron;tetrabutylazanium;sulfate Chemical compound OS([O-])(=O)=O.CCCC[N+](CCCC)(CCCC)CCCC SHFJWMWCIHQNCP-UHFFFAOYSA-M 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- OJZYRQPMEIEQFC-UAWLTFRCSA-N limaprost Chemical compound CCCC[C@H](C)C[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1CCCC\C=C\C(O)=O OJZYRQPMEIEQFC-UAWLTFRCSA-N 0.000 description 2
- 229950009365 limaprost Drugs 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000012280 lithium aluminium hydride Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 2
- 229960005181 morphine Drugs 0.000 description 2
- 210000002569 neuron Anatomy 0.000 description 2
- LQNUZADURLCDLV-UHFFFAOYSA-N nitrobenzene Substances [O-][N+](=O)C1=CC=CC=C1 LQNUZADURLCDLV-UHFFFAOYSA-N 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 229960002085 oxycodone Drugs 0.000 description 2
- 239000001301 oxygen Chemical group 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 2
- 229960005489 paracetamol Drugs 0.000 description 2
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 2
- LZMJNVRJMFMYQS-UHFFFAOYSA-N poseltinib Chemical compound C1CN(C)CCN1C(C=C1)=CC=C1NC1=NC(OC=2C=C(NC(=O)C=C)C=CC=2)=C(OC=C2)C2=N1 LZMJNVRJMFMYQS-UHFFFAOYSA-N 0.000 description 2
- 235000011056 potassium acetate Nutrition 0.000 description 2
- NROKBHXJSPEDAR-UHFFFAOYSA-M potassium fluoride Chemical compound [F-].[K+] NROKBHXJSPEDAR-UHFFFAOYSA-M 0.000 description 2
- LJCNRYVRMXRIQR-OLXYHTOASA-L potassium sodium L-tartrate Chemical compound [Na+].[K+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O LJCNRYVRMXRIQR-OLXYHTOASA-L 0.000 description 2
- AYXYPKUFHZROOJ-ZETCQYMHSA-N pregabalin Chemical compound CC(C)C[C@H](CN)CC(O)=O AYXYPKUFHZROOJ-ZETCQYMHSA-N 0.000 description 2
- 229960001233 pregabalin Drugs 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000002098 pyridazinyl group Chemical group 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 238000011552 rat model Methods 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- 239000012266 salt solution Substances 0.000 description 2
- 230000001953 sensory effect Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 235000011006 sodium potassium tartrate Nutrition 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 230000002889 sympathetic effect Effects 0.000 description 2
- 229960002180 tetracycline Drugs 0.000 description 2
- 229930101283 tetracycline Natural products 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 150000003522 tetracyclines Chemical class 0.000 description 2
- CFMYXEVWODSLAX-QOZOJKKESA-N tetrodotoxin Chemical compound O([C@@]([C@H]1O)(O)O[C@H]2[C@@]3(O)CO)[C@H]3[C@@H](O)[C@]11[C@H]2[C@@H](O)N=C(N)N1 CFMYXEVWODSLAX-QOZOJKKESA-N 0.000 description 2
- 229950010357 tetrodotoxin Drugs 0.000 description 2
- CFMYXEVWODSLAX-UHFFFAOYSA-N tetrodotoxin Natural products C12C(O)NC(=N)NC2(C2O)C(O)C3C(CO)(O)C1OC2(O)O3 CFMYXEVWODSLAX-UHFFFAOYSA-N 0.000 description 2
- 229960004380 tramadol Drugs 0.000 description 2
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- MWKJTNBSKNUMFN-UHFFFAOYSA-N trifluoromethyltrimethylsilane Chemical compound C[Si](C)(C)C(F)(F)F MWKJTNBSKNUMFN-UHFFFAOYSA-N 0.000 description 2
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 2
- PNXLPJLIIIINQT-UHFFFAOYSA-N 1-(2-amino-5-bromoanilino)-2-methylpropan-2-ol Chemical compound CC(C)(O)CNC1=CC(Br)=CC=C1N PNXLPJLIIIINQT-UHFFFAOYSA-N 0.000 description 1
- UMSAYYOAEGAULL-UHFFFAOYSA-N 1-(5-bromo-2-nitroanilino)-2-methylpropan-2-ol Chemical compound CC(C)(O)CNC1=CC(Br)=CC=C1[N+]([O-])=O UMSAYYOAEGAULL-UHFFFAOYSA-N 0.000 description 1
- UQCPRYSXYPKKKQ-UHFFFAOYSA-N 1-(5-fluoro-2-nitroanilino)-2-methylpropan-2-ol Chemical compound CC(C)(O)CNC1=CC(F)=CC=C1[N+]([O-])=O UQCPRYSXYPKKKQ-UHFFFAOYSA-N 0.000 description 1
- AVTCRIAODMSJSS-UHFFFAOYSA-N 1-(6-bromobenzimidazol-1-yl)-2-methylpropan-2-ol Chemical compound C1=C(Br)C=C2N(CC(C)(O)C)C=NC2=C1 AVTCRIAODMSJSS-UHFFFAOYSA-N 0.000 description 1
- PVTFOZYFIJOUIK-UHFFFAOYSA-N 1-[2-amino-5-(4-fluorophenoxy)anilino]-2-methylpropan-2-ol Chemical compound NC1=C(C=C(C=C1)OC1=CC=C(C=C1)F)NCC(C)(O)C PVTFOZYFIJOUIK-UHFFFAOYSA-N 0.000 description 1
- YHQDYACJLDLQEY-UHFFFAOYSA-N 1-[5-[2-fluoro-4-(trifluoromethyl)phenoxy]benzimidazol-1-yl]-2-methylpropan-2-ol Chemical compound FC1=C(OC2=CC3=C(N(C=N3)CC(C)(O)C)C=C2)C=CC(=C1)C(F)(F)F YHQDYACJLDLQEY-UHFFFAOYSA-N 0.000 description 1
- KVBJIVDDLMDAPB-UHFFFAOYSA-N 1-chloro-2-nitro-4-phenylmethoxybenzene Chemical compound C1=C(Cl)C([N+](=O)[O-])=CC(OCC=2C=CC=CC=2)=C1 KVBJIVDDLMDAPB-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- WGFNXGPBPIJYLI-UHFFFAOYSA-N 2,6-difluoro-3-[(3-fluorophenyl)sulfonylamino]-n-(3-methoxy-1h-pyrazolo[3,4-b]pyridin-5-yl)benzamide Chemical compound C1=C2C(OC)=NNC2=NC=C1NC(=O)C(C=1F)=C(F)C=CC=1NS(=O)(=O)C1=CC=CC(F)=C1 WGFNXGPBPIJYLI-UHFFFAOYSA-N 0.000 description 1
- JOPNOOCLGBNBRN-UHFFFAOYSA-N 2-(2-amino-5-bromoanilino)ethanol Chemical compound NC1=CC=C(Br)C=C1NCCO JOPNOOCLGBNBRN-UHFFFAOYSA-N 0.000 description 1
- STLXYDWVBIZQAQ-UHFFFAOYSA-N 2-(5-bromo-2-nitroanilino)ethanol Chemical compound OCCNC1=CC(Br)=CC=C1[N+]([O-])=O STLXYDWVBIZQAQ-UHFFFAOYSA-N 0.000 description 1
- IBYILKHAOCIBAK-UHFFFAOYSA-N 2-(6-bromobenzimidazol-1-yl)ethanol Chemical compound BrC=1C=CC2=C(N(C=N2)CCO)C=1 IBYILKHAOCIBAK-UHFFFAOYSA-N 0.000 description 1
- WGRQJLYBTVKHTI-UHFFFAOYSA-N 2-[(4-cyclopropylpyridin-2-yl)amino]pyridine-4-carbonitrile Chemical compound C1(CC1)C1=CC(=NC=C1)NC=1C=C(C#N)C=CN=1 WGRQJLYBTVKHTI-UHFFFAOYSA-N 0.000 description 1
- GSKMWMFOQQBVMI-UHFFFAOYSA-N 2-bromo-5-(trifluoromethyl)pyridine Chemical compound FC(F)(F)C1=CC=C(Br)N=C1 GSKMWMFOQQBVMI-UHFFFAOYSA-N 0.000 description 1
- JUGGVCLJDPHFQC-UHFFFAOYSA-N 2-fluoro-1-nitro-4-phenylmethoxybenzene Chemical compound C1=C(F)C([N+](=O)[O-])=CC=C1OCC1=CC=CC=C1 JUGGVCLJDPHFQC-UHFFFAOYSA-N 0.000 description 1
- IZOIOCQPMHHDHN-UHFFFAOYSA-N 2-fluoro-6-(trifluoromethyl)pyridine Chemical compound FC1=CC=CC(C(F)(F)F)=N1 IZOIOCQPMHHDHN-UHFFFAOYSA-N 0.000 description 1
- UZGNVLTZYYXHAR-UHFFFAOYSA-N 2-methyl-1-(2-nitro-4-phenylmethoxyanilino)propan-2-ol Chemical compound C(C1=CC=CC=C1)OC1=CC(=C(C=C1)NCC(C)(O)C)[N+](=O)[O-] UZGNVLTZYYXHAR-UHFFFAOYSA-N 0.000 description 1
- XJBSEMPIPRKZOQ-UHFFFAOYSA-N 2-methyl-1-(5-phenylmethoxybenzimidazol-1-yl)propan-2-ol Chemical compound C(C1=CC=CC=C1)OC1=CC2=C(N(C=N2)CC(C)(O)C)C=C1 XJBSEMPIPRKZOQ-UHFFFAOYSA-N 0.000 description 1
- QNZFXWRBBVASHD-UHFFFAOYSA-N 2-methyl-1-[2-nitro-5-[5-(trifluoromethyl)pyridin-2-yl]oxyanilino]propan-2-ol Chemical compound CC(CNC1=C(C=CC(=C1)OC1=NC=C(C=C1)C(F)(F)F)[N+](=O)[O-])(C)O QNZFXWRBBVASHD-UHFFFAOYSA-N 0.000 description 1
- QNQCXWOCDUHFIY-UHFFFAOYSA-N 2-methyl-4-[2-nitro-5-[5-(trifluoromethyl)pyridin-2-yl]oxyanilino]butan-2-ol Chemical compound CC(C)(CCNC1=C(C=CC(=C1)OC1=NC=C(C=C1)C(F)(F)F)[N+](=O)[O-])O QNQCXWOCDUHFIY-UHFFFAOYSA-N 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- WNEODWDFDXWOLU-QHCPKHFHSA-N 3-[3-(hydroxymethyl)-4-[1-methyl-5-[[5-[(2s)-2-methyl-4-(oxetan-3-yl)piperazin-1-yl]pyridin-2-yl]amino]-6-oxopyridin-3-yl]pyridin-2-yl]-7,7-dimethyl-1,2,6,8-tetrahydrocyclopenta[3,4]pyrrolo[3,5-b]pyrazin-4-one Chemical compound C([C@@H](N(CC1)C=2C=NC(NC=3C(N(C)C=C(C=3)C=3C(=C(N4C(C5=CC=6CC(C)(C)CC=6N5CC4)=O)N=CC=3)CO)=O)=CC=2)C)N1C1COC1 WNEODWDFDXWOLU-QHCPKHFHSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-M 3-carboxy-2,3-dihydroxypropanoate Chemical compound OC(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-M 0.000 description 1
- UQDAWKXAXZHYMW-UHFFFAOYSA-N 4-amino-2-methylbutan-2-ol;hydrochloride Chemical compound Cl.CC(C)(O)CCN UQDAWKXAXZHYMW-UHFFFAOYSA-N 0.000 description 1
- NUKYPUAOHBNCPY-UHFFFAOYSA-N 4-aminopyridine Chemical compound NC1=CC=NC=C1 NUKYPUAOHBNCPY-UHFFFAOYSA-N 0.000 description 1
- RHMPLDJJXGPMEX-UHFFFAOYSA-N 4-fluorophenol Chemical compound OC1=CC=C(F)C=C1 RHMPLDJJXGPMEX-UHFFFAOYSA-N 0.000 description 1
- LBUNNMJLXWQQBY-UHFFFAOYSA-N 4-fluorophenylboronic acid Chemical compound OB(O)C1=CC=C(F)C=C1 LBUNNMJLXWQQBY-UHFFFAOYSA-N 0.000 description 1
- VRYFIYXAIZXOAN-UHFFFAOYSA-N 6-(4-fluorophenoxy)-1-(2-propan-2-yloxyethyl)benzimidazole Chemical compound FC1=CC=C(OC=2C=CC3=C(N(C=N3)CCOC(C)C)C=2)C=C1 VRYFIYXAIZXOAN-UHFFFAOYSA-N 0.000 description 1
- NQUIDARPCLMKCE-UHFFFAOYSA-N 6-bromo-1-(2-cyclopentyloxyethyl)benzimidazole Chemical compound BrC=1C=CC2=C(N(C=N2)CCOC2CCCC2)C=1 NQUIDARPCLMKCE-UHFFFAOYSA-N 0.000 description 1
- AFWWKZCPPRPDQK-UHFFFAOYSA-N 6-chloropyridine-3-carbaldehyde Chemical compound ClC1=CC=C(C=O)C=N1 AFWWKZCPPRPDQK-UHFFFAOYSA-N 0.000 description 1
- CYJRNFFLTBEQSQ-UHFFFAOYSA-N 8-(3-methyl-1-benzothiophen-5-yl)-N-(4-methylsulfonylpyridin-3-yl)quinoxalin-6-amine Chemical compound CS(=O)(=O)C1=C(C=NC=C1)NC=1C=C2N=CC=NC2=C(C=1)C=1C=CC2=C(C(=CS2)C)C=1 CYJRNFFLTBEQSQ-UHFFFAOYSA-N 0.000 description 1
- ZRPZPNYZFSJUPA-UHFFFAOYSA-N ARS-1620 Chemical compound Oc1cccc(F)c1-c1c(Cl)cc2c(ncnc2c1F)N1CCN(CC1)C(=O)C=C ZRPZPNYZFSJUPA-UHFFFAOYSA-N 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010001497 Agitation Diseases 0.000 description 1
- 208000003130 Alcoholic Neuropathy Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 206010003591 Ataxia Diseases 0.000 description 1
- 208000008035 Back Pain Diseases 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- 206010005063 Bladder pain Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 206010058019 Cancer Pain Diseases 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- DSLZVSRJTYRBFB-LLEIAEIESA-N D-glucaric acid Chemical compound OC(=O)[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O DSLZVSRJTYRBFB-LLEIAEIESA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 229940098778 Dopamine receptor agonist Drugs 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 206010072132 Fracture pain Diseases 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 206010071602 Genetic polymorphism Diseases 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 244000301682 Heliotropium curassavicum Species 0.000 description 1
- 235000015854 Heliotropium curassavicum Nutrition 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 208000035154 Hyperesthesia Diseases 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 208000008930 Low Back Pain Diseases 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- 208000019022 Mood disease Diseases 0.000 description 1
- 208000000112 Myalgia Diseases 0.000 description 1
- CLMLXQFTOHQBET-UHFFFAOYSA-N N-(2-methylprop-2-enyl)-2-nitro-5-[5-(trifluoromethyl)pyridin-2-yl]oxyaniline Chemical compound CC(CNC1=C(C=CC(=C1)OC1=NC=C(C=C1)C(F)(F)F)[N+](=O)[O-])=C CLMLXQFTOHQBET-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 208000028389 Nerve injury Diseases 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 206010036376 Postherpetic Neuralgia Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 208000035977 Rare disease Diseases 0.000 description 1
- 241000700157 Rattus norvegicus Species 0.000 description 1
- 206010040026 Sensory disturbance Diseases 0.000 description 1
- 101710097939 Sodium channel protein type 9 subunit alpha Proteins 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- 229940100514 Syk tyrosine kinase inhibitor Drugs 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- 108010084455 Zeocin Proteins 0.000 description 1
- BEJKKXBNBABRSS-UHFFFAOYSA-N [1-[6-(5-formylpyridin-2-yl)oxybenzimidazol-1-yl]-2-methylpropan-2-yl] acetate Chemical compound C(C)(=O)OC(CN1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)C=O)(C)C BEJKKXBNBABRSS-UHFFFAOYSA-N 0.000 description 1
- NHEVUHSEKVCDDV-UHFFFAOYSA-N [2-methyl-1-[6-[5-(2,2,2-trifluoro-1-hydroxyethyl)pyridin-2-yl]oxybenzimidazol-1-yl]propan-2-yl] acetate Chemical compound C(C)(=O)OC(CN1C=NC2=C1C=C(C=C2)OC1=NC=C(C=C1)C(C(F)(F)F)O)(C)C NHEVUHSEKVCDDV-UHFFFAOYSA-N 0.000 description 1
- CKUAXEQHGKSLHN-UHFFFAOYSA-N [C].[N] Chemical group [C].[N] CKUAXEQHGKSLHN-UHFFFAOYSA-N 0.000 description 1
- DSVGQVZAZSZEEX-UHFFFAOYSA-N [C].[Pt] Chemical compound [C].[Pt] DSVGQVZAZSZEEX-UHFFFAOYSA-N 0.000 description 1
- DHKHZGZAXCWQTA-UHFFFAOYSA-N [N].[K] Chemical compound [N].[K] DHKHZGZAXCWQTA-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000005298 acute pain Diseases 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 239000000674 adrenergic antagonist Substances 0.000 description 1
- 208000020701 alcoholic polyneuropathy Diseases 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 206010053552 allodynia Diseases 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 229940125681 anticonvulsant agent Drugs 0.000 description 1
- 239000002111 antiemetic agent Substances 0.000 description 1
- 239000000939 antiparkinson agent Substances 0.000 description 1
- 239000002249 anxiolytic agent Substances 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 201000004339 autoimmune neuropathy Diseases 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 150000001556 benzimidazoles Chemical class 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- KCXMKQUNVWSEMD-UHFFFAOYSA-N benzyl chloride Chemical compound ClCC1=CC=CC=C1 KCXMKQUNVWSEMD-UHFFFAOYSA-N 0.000 description 1
- 229940073608 benzyl chloride Drugs 0.000 description 1
- 102000012740 beta Adrenergic Receptors Human genes 0.000 description 1
- 108010079452 beta Adrenergic Receptors Proteins 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229930189065 blasticidin Natural products 0.000 description 1
- 210000003461 brachial plexus Anatomy 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- BRTFVKHPEHKBQF-UHFFFAOYSA-N bromocyclopentane Chemical compound BrC1CCCC1 BRTFVKHPEHKBQF-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 210000004903 cardiac system Anatomy 0.000 description 1
- 229950008138 carmellose Drugs 0.000 description 1
- 206010007821 cauda equina syndrome Diseases 0.000 description 1
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 210000001638 cerebellum Anatomy 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 229940099112 cornstarch Drugs 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000013480 data collection Methods 0.000 description 1
- 230000003210 demyelinating effect Effects 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- RAFNCPHFRHZCPS-UHFFFAOYSA-N di(imidazol-1-yl)methanethione Chemical compound C1=CN=CN1C(=S)N1C=CN=C1 RAFNCPHFRHZCPS-UHFFFAOYSA-N 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- 239000012973 diazabicyclooctane Substances 0.000 description 1
- YNHIGQDRGKUECZ-UHFFFAOYSA-N dichloropalladium;triphenylphosphanium Chemical compound Cl[Pd]Cl.C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-N 0.000 description 1
- KPHWPUGNDIVLNH-UHFFFAOYSA-M diclofenac sodium Chemical compound [Na+].[O-]C(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl KPHWPUGNDIVLNH-UHFFFAOYSA-M 0.000 description 1
- 150000005690 diesters Chemical class 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- DGODWNOPHMXOTR-UHFFFAOYSA-N dipotassium;dioxido(dioxo)osmium;dihydrate Chemical compound O.O.[K+].[K+].[O-][Os]([O-])(=O)=O DGODWNOPHMXOTR-UHFFFAOYSA-N 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000003136 dopamine receptor stimulating agent Substances 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- MVPICKVDHDWCJQ-UHFFFAOYSA-N ethyl 3-pyrrolidin-1-ylpropanoate Chemical compound CCOC(=O)CCN1CCCC1 MVPICKVDHDWCJQ-UHFFFAOYSA-N 0.000 description 1
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 229960004979 fampridine Drugs 0.000 description 1
- YAGKRVSRTSUGEY-UHFFFAOYSA-N ferricyanide Chemical compound [Fe+3].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-] YAGKRVSRTSUGEY-UHFFFAOYSA-N 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 210000002683 foot Anatomy 0.000 description 1
- WBJINCZRORDGAQ-UHFFFAOYSA-N formic acid ethyl ester Natural products CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 150000002366 halogen compounds Chemical class 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 239000002638 heterogeneous catalyst Substances 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 238000000589 high-performance liquid chromatography-mass spectrometry Methods 0.000 description 1
- 210000000548 hind-foot Anatomy 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 239000003326 hypnotic agent Substances 0.000 description 1
- 230000000642 iatrogenic effect Effects 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 208000033065 inborn errors of immunity Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 239000013067 intermediate product Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960001375 lactose Drugs 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- SIAPCJWMELPYOE-UHFFFAOYSA-N lithium hydride Chemical compound [LiH] SIAPCJWMELPYOE-UHFFFAOYSA-N 0.000 description 1
- 229910000103 lithium hydride Inorganic materials 0.000 description 1
- 229940031703 low substituted hydroxypropyl cellulose Drugs 0.000 description 1
- 229960002373 loxoprofen Drugs 0.000 description 1
- BAZQYVYVKYOAGO-UHFFFAOYSA-M loxoprofen sodium hydrate Chemical compound O.O.[Na+].C1=CC(C(C([O-])=O)C)=CC=C1CC1C(=O)CCC1 BAZQYVYVKYOAGO-UHFFFAOYSA-M 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 230000001071 malnutrition Effects 0.000 description 1
- 235000000824 malnutrition Nutrition 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 229960001855 mannitol Drugs 0.000 description 1
- 229960003194 meglumine Drugs 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- HNQIVZYLYMDVSB-UHFFFAOYSA-N methanesulfonimidic acid Chemical compound CS(N)(=O)=O HNQIVZYLYMDVSB-UHFFFAOYSA-N 0.000 description 1
- 125000005948 methanesulfonyloxy group Chemical group 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- GJDICGOCZGRDFM-ZCFIWIBFSA-N methyl (2r)-2-[(2-methylpropan-2-yl)oxycarbonylamino]propanoate Chemical compound COC(=O)[C@@H](C)NC(=O)OC(C)(C)C GJDICGOCZGRDFM-ZCFIWIBFSA-N 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 230000027939 micturition Effects 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 125000005186 naphthyloxy group Chemical group C1(=CC=CC2=CC=CC=C12)O* 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000008764 nerve damage Effects 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 150000002828 nitro derivatives Chemical class 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 231100000862 numbness Toxicity 0.000 description 1
- 208000015380 nutritional deficiency disease Diseases 0.000 description 1
- 239000000014 opioid analgesic Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- 208000038009 orphan disease Diseases 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 230000008050 pain signaling Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 210000000578 peripheral nerve Anatomy 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- CWCMIVBLVUHDHK-ZSNHEYEWSA-N phleomycin D1 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC[C@@H](N=1)C=1SC=C(N=1)C(=O)NCCCCNC(N)=N)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C CWCMIVBLVUHDHK-ZSNHEYEWSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 208000006473 polyradiculopathy Diseases 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 235000011181 potassium carbonates Nutrition 0.000 description 1
- 239000011698 potassium fluoride Substances 0.000 description 1
- 235000003270 potassium fluoride Nutrition 0.000 description 1
- NTTOTNSKUYCDAV-UHFFFAOYSA-N potassium hydride Chemical compound [KH] NTTOTNSKUYCDAV-UHFFFAOYSA-N 0.000 description 1
- 229910000105 potassium hydride Inorganic materials 0.000 description 1
- CUQOHAYJWVTKDE-UHFFFAOYSA-N potassium;butan-1-olate Chemical compound [K+].CCCC[O-] CUQOHAYJWVTKDE-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000000634 powder X-ray diffraction Methods 0.000 description 1
- 208000028529 primary immunodeficiency disease Diseases 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 238000001226 reprecipitation Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 210000001044 sensory neuron Anatomy 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- MFBOGIVSZKQAPD-UHFFFAOYSA-M sodium butyrate Chemical compound [Na+].CCCC([O-])=O MFBOGIVSZKQAPD-UHFFFAOYSA-M 0.000 description 1
- 235000009518 sodium iodide Nutrition 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 229940045902 sodium stearyl fumarate Drugs 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- DPKBAXPHAYBPRL-UHFFFAOYSA-M tetrabutylazanium;iodide Chemical compound [I-].CCCC[N+](CCCC)(CCCC)CCCC DPKBAXPHAYBPRL-UHFFFAOYSA-M 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- BSYVTEYKTMYBMK-UHFFFAOYSA-N tetrahydrofurfuryl alcohol Chemical compound OCC1CCCO1 BSYVTEYKTMYBMK-UHFFFAOYSA-N 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000004149 thio group Chemical group *S* 0.000 description 1
- 229910052718 tin Inorganic materials 0.000 description 1
- 239000011135 tin Substances 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- GKASDNZWUGIAMG-UHFFFAOYSA-N triethyl orthoformate Chemical compound CCOC(OCC)OCC GKASDNZWUGIAMG-UHFFFAOYSA-N 0.000 description 1
- AHZJKOKFZJYCLG-UHFFFAOYSA-K trifluoromethanesulfonate;ytterbium(3+) Chemical compound [Yb+3].[O-]S(=O)(=O)C(F)(F)F.[O-]S(=O)(=O)C(F)(F)F.[O-]S(=O)(=O)C(F)(F)F AHZJKOKFZJYCLG-UHFFFAOYSA-K 0.000 description 1
- 125000005951 trifluoromethanesulfonyloxy group Chemical group 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 206010044652 trigeminal neuralgia Diseases 0.000 description 1
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 1
- 210000001170 unmyelinated nerve fiber Anatomy 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 229940063674 voltaren Drugs 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Abstract
Настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли. В формуле (I) значение радикалов такое, как указано в формуле изобретения. Также предложены лекарственное средство для лечения заболевания, вовлекающего Nav 1,7, применение соединения формулы (I) при производстве лекарства и способ лечения заболевания, вовлекающего Nav 1,7. Предложенное соединение формулы (I) обладает ингибирующей активностью в отношении Nav 1,7 и может применяться для лечения заболевания, вовлекающего Nav 1,7, такого как нейропатическая боль, ноцицептивная боль, воспалительная боль, нейропатия мелких волокон, эритромелалгия, пароксизмальное чрезмерное болевое расстройство, дизурия и рассеяный склероз. 5 н. и 15 з.п. ф-лы, 14 табл., 200 пр.
Description
Область техники, к которой относится изобретение
[0001] Настоящее изобретение может относиться к лекарственному средству для лечения или предотвращения заболевания, поражающего Na-канал, особенно SCN9A (Nav 1,7), которое содержит новое соединение, имеющее в качестве активного ингредиента бензимидазоловый каркас или его фармацевтически приемлемую соль. Более подробно, оно относится к лекарственному средству для лечения или предотвращения заболевания, такого как нейропатическая боль, ноцицептивная боль, воспалительная боль, нейропатия мелких волокон, эритромелалгия, пароксизмальное чрезмерное болевое расстройство, дизурия и рассеяный склероз.
Уровень техники
[0002] Как известно в настоящее время, α-субъединица потенциалзависимого Na-канала, которая образует поры, включает 9 видов. Недавно было доказано, что субъединица, в частности Nav 1,7, в широком смысле связана с передачей сигнала острой и хронической боли.
[0003] SCN9A (Nav 1,7) представляет собой тетродотоксин (TTX)-чувствительный Na-канал, локализованный в периферическом чувствительном нерве или симпатетическом нерве, который также называется NENA или PN1. Физиологически, функция канала Nav 1,7 состоит в усилении болевого сигнала (т.е. в создании генераторного потенциала) в чувствительном нервном окончании. В области генетических исследований стало очевидно, что человек, ген SCN9A которого мутрирует, приводя к потере функции, показывает врожденную нечувствительность к боли. И наоборот, у пациентов, страдающих от тяжелого орфанного заболевания, такого как эритромелалгия и пароксизмальное чрезмерное болевое расстройство, наблюдают, что ген SCN9A мутрирует, приводя к получению функции. Кроме того, сообщалось, что приблизительно 30% пациентов, страдающих от небольшой волоконной нейропатии, имеют генетический полиморфизм для улучшения функции Nav 1,7 (непатентный документ 1). И предполагают, что функция канала Nav 1,7 непосредственно касается гипервозбудимости нейрона DRG у пациентов, страдающих от боли, поскольку уровень экспрессии и активность увеличиваются в нейроне DRG животных модели, страдающих от хронической боли, а нейропатическая боль и воспалительная боль уменьшаются в эксперименте с нокаутом гена (непатентный документ 2).
[0004] Патентный документ 1 раскрывает производное бензимидазола, представленное следующей формулой (A), но соединение имеет 2-((4-циклопропилпиридин-2-ил)амино)изоникотинонитрил в качестве важной подструктуры, которая отличается от соединения настоящего изобретения. а изобретение, описанное в патентном документе 1, направлено на ингибитор тирозинкиназы Syk, таким образом патентный документ 1 совсем не раскрывает настоящее изобретение.
Список цитирования
(Патентная литература)
[0005] [Патентный документ 1] WO 2012/057262
(Непатентная литература)
[0006] [Непатентный документ 1] Nat Rev Neurosci. 14: 49, 2013
[Непатентный документ 2] Nat Commun. 3: 791, 2012
Сущность изобретения
[0007] (Техническая проблема)
Цель настоящего изобретения может состоять в предоставлении лекарства для лечения или предотвращения заболевания, вовлекающего Nav 1,7, конкретно такого как нейропатическая боль, ноцицептивная боль, воспалительная боль, нейропатия мелких волокон, эритромелалгия, пароксизмальное чрезмерное болевое расстройство, дизурия и рассеяный склероз.
[0008] (Решение проблемы)
Авторы настоящего изобретения провели интенсивные исследования, пытаясь решить упомянутую выше проблему, и обнаружили, что соединение, имеющее бензимидазольное кольцо, упомянутое ниже, или его фармацевтически приемлемую соль, может ингибировать изменение мембранного потенциала или сам ток ионов Na через Na-канал в экспрессирующей ген Nav 1,7 клетке, т.е. соединение или его фармацевтически приемлемая соль представляет собой блокатор, имеющий ингибиторную активность для Nav 1,7. В дополнение, авторы настоящего изобретения обнаружили, что производное полезно в качестве лекарства для лечения или предотвращения такого заболевания как нейропатическая боль, ноцицептивная боль, воспалительная боль, нейропатия мелких волокон, эритромелалгия и пароксизмальное чрезмерное болевое расстройство, что привело к доработке настоящего изобретения. Соответственно, настоящее изобретение может предоставить соединение бензимидазола, представленное следующей формулой (I) (далее, также называемое «соединение, представленное формулой (I)» или «соединение формулы (I)»), или его фармацевтически приемлемую соль (далее, также называемую «соединение настоящего изобретения»).
[0009] Настоящее изобретение можно продемонстрировать следующим образом.
Пункт 1
Соединение формулы (I):
или его фармацевтически приемлемая соль, при этом
R1a, R1b, R1c и R1d представляют собой независимо водород, галоген, циано, C1-4 алкил, C1-4 алкокси, C1-4 алкиламино, (при этом каждый алкильный фрагмент алкила, алкокси и алкиламино может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C3-7 циклоалкил, C3-7 циклоалкокси, C3-7 циклоалкиламино, (при этом каждый циклоалкильный фрагмент циклоалкила, циклоалкокси и циклоалкиламино может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси (при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C1-4 алкилтио, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей), при условии, что по меньшей мере один из R1a, R1b, R1c и R1d представляет собой указанный выше C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси,
R2 и R3 представляют собой независимо водород, C1-6 алкил, который может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-10 циклоалкил,
R4 представляет собой водород, C1-6 алкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-7 циклоалкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей,
m составляет 1, 2 или 3,
L представляет собой CR7R8 при условии, что, когда m составляет 2 или 3, каждые CR7R8 являются независимо одинаковыми или разными,
R7 и R8 представляют собой независимо водород, гидроксил, C1-4 алкил, C1-4 алкокси, (при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C3-7 циклоалкил или C3-7 циклоалкокси, (при этом каждый циклоалкильный фрагмент циклоалкила и циклоалкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), или
в R2, R3 и -OR4, R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (II) с -OR4
в формуле (II),
e и f составляют независимо 1, 2 или 3,
R4, как определено выше,
V представляет собой одинарную связь или атом кислорода,
R5a, R5b, R5c и R5d представляют собой независимо водород, галоген, гидроксил, C1-4 алкил или C1-4 алкокси, при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или
в R2, R3, -OR4 и CR7R8 в L,
R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IV) с R3, -OR4 и R8
в формуле (IV),
m1 составляет 0 или 1,
m2 составляет 0 или 1, а j составляет 1, 2, 3 или 4, когда m1 составляет 1, или
m2 составляет 0, 1 или 2, а j составляет 1, 2, 3 или 4, когда m1 составляет 0,
R3, R4, R8 и L, как определено выше,
R9a, R9b, R9c и R9d представляют собой независимо водород, галоген, гидроксил, C1-4 алкил или C1-4 алкокси, при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или
R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (III) с R2
в формуле (III),
h составляет 1, 2, 3 или 4,
R2, как определено выше,
R6a, R6b и R6c представляют собой независимо водород, галоген, гидроксил, C1-4 алкил или C1-4 алкокси, при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей,
при условии, что все из R2, R3 и -OR4 не объединены вместе с образованием кольца,
Группа A заместителей представляет собой независимо галоген, гидроксил, C1-4 алкокси, C3-7 циклоалкил или C3-7 циклоалкокси, а
Группа B заместителей представляет собой независимо галоген, гидроксил, C1-4 алкил, C1-4 алкокси, C3-7 циклоалкил или C3-7 циклоалкокси,
при условии, что следующие соединения исключены:
6-[6-хлор-2-(морфолин-4-ил)пиримидин-4-ил]-1-(2-метоксиэтил)-1H-бензимидазол,
2-[5-(3,5-диметил-1,2-оксазол-4-ил)-1H-бензимидазол-1-ил]этанол,
2-{5-[5-(тетрагидрофуран-3-ил)-4H-1,2,4-триазол-3-ил]-1H-бензимидазол-1-ил}этанол,
2-{5-[3-(2-метоксиэтил)-1-(2,2,2-трифторэтил)-1H-1,2,4-триазол-5-ил]-1H-бензимидазол-1-ил}этанол,
2-{5-[3-метил-1-(1-метилпиперидин-4-ил)-1H-1,2,4-триазол-5-ил]-1H-бензимидазол-1-ил}этанол,
2-бутил-6-[1-(2-гидроксиэтил)-1H-бензимидазол-6-ил]-3,4-дигидропирроло[1,2-a]пиразин-1(2H)-он,
6-[1-(2-гидроксиэтил)-1H-бензимидазол-6-ил]-2-(3-метилбутил)-3,4-дигидропирроло[1,2-a]пиразин-1(2H)-он,
2-{5-[1-(2-гидроксиэтил)-1H-бензимидазол-5-ил]-1H-1,2,4-триазол-1-ил}этанол,
6-(2-хлорфенил)-1-(2-гидроксиэтил)-1H-бензимидазол-7-карбонитрил,
2-хлор-6-{7-фтор-1-[(1S,3S)-3-метоксициклогексил]-1H-бензимидазол-5-ил}-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин и
2-{5-[2-(тетрагидрофуран-3-ил)-1H-имидазол-1-ил]-1H-бензимидазол-1-ил}этанол.
[0010] Пункт 2
Соединение по пункту 1, представленное в формуле (I):
или его фармацевтически приемлемая соль, при этом
R1a, R1b, R1c и R1d представляют собой независимо водород, галоген, циано, C1-4 алкил, C1-4 алкокси, C1-4 алкиламино, (при этом каждый алкильный фрагмент алкила, алкокси и алкиламино может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C3-7 циклоалкил, C3-7 циклоалкокси, C3-7 циклоалкиламино, (при этом каждый циклоалкильный фрагмент циклоалкила, циклоалкокси и циклоалкиламино может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси (при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C1-4 алкилтио, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей), при условии, что по меньшей мере один из R1a, R1b, R1c и R1d представляет собой указанный выше C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси,
R2 и R3 представляют собой независимо водород, C1-6 алкил, который может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-10 циклоалкил,
R4 представляет собой водород, C1-6 алкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-7 циклоалкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей,
m составляет 1, 2 или 3,
L представляет собой CR7R8 при условии, что, когда m составляет 2 или 3, каждые CR7R8 являются независимо одинаковыми или разными,
R7 и R8 представляют собой независимо водород, гидроксил, C1-4 алкил, C1-4 алкокси (при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C3-7 циклоалкил или C3-7 циклоалкокси, (при этом каждый циклоалкильный фрагмент циклоалкила и циклоалкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), или
в R2, R3 и -OR4, R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (II) с -OR4
в формуле (II),
e и f составляют независимо 1, 2 или 3,
R4, как определено выше,
V представляет собой одинарную связь или атом кислорода,
R5a, R5b, R5c и R5d представляют собой независимо водород, галоген, гидроксил, C1-4 алкил или C1-4 алкокси, при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или
R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (III) с R2
в формуле (III),
h составляет 1, 2, 3 или 4,
R2, как определено выше,
R6a, R6b и R6c представляют собой независимо водород, галоген, гидроксил, C1-4 алкил или C1-4 алкокси, при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей,
при условии, что все из R2, R3 и -OR4 не объединены вместе с образованием кольца,
Группа A заместителей представляет собой независимо галоген, гидроксил, C1-4 алкокси, C3-7 циклоалкил или C3-7 циклоалкокси, а
Группа B заместителей представляет собой независимо галоген, гидроксил, C1-4 алкил, C1-4 алкокси, C3-7 циклоалкил или C3-7 циклоалкокси.
[0011] Пункт 3
Соединение по пункту 1 или 2 или его фармацевтически приемлемая соль, при этом
R1a, R1b, R1c и R1d представляют собой независимо водород, галоген, циано, C1-4 алкил, C1-4 алкокси (при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен одинаковыми или разными и 1-3 галогенами), C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси (при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей).
[0012] Пункт 4
Соединение по любому одному из пунктов 1-3 или его фармацевтически приемлемая соль, при этом
R1a, R1b, R1c и R1d представляют собой независимо водород, C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
[0013] Пункт 5
Соединение по любому одному из пунктов 1-4 или его фармацевтически приемлемая соль, при этом R1a и R1d представляют собой водород.
[0014] Пункт 6
Соединение по любому одному из пунктов 1 и 3-5 или его фармацевтически приемлемая соль, при этом
R2 и R3 представляют собой независимо водород или C1-6 алкил, который может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, при условии, что и R2 и R3 не являются водородом, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIa) с -OR4
в формуле (IIa),
e и f составляют независимо 1 или 2,
R4 и V, как определено в пункте 1, а
R5a, R5b, R5c и R5d представляют собой независимо водород или галоген или
в R2, R3, -OR4 и CR7R8 в L,
R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IVa) с R3, -OR4 и R8
в формуле (IVa),
m1 составляет 0,
m2 составляет 1 или 2,
j составляет 1, 2 или 3,
R3, как определено выше,
R4, R8 и L, как определено в пункте 1, а
R9a, R9b, R9c и R9d представляют собой независимо водород или галоген.
[0015] Пункт 7
Соединение по любому одному из пунктов 1 и 3-6 или его фармацевтически приемлемая соль, при этом
R2 и R3 представляют собой независимо C1-6 алкил, необязательно замещенный одинаковыми или разными и 1-5 галогенами, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIb) с -OR4
в формуле (IIb),
e и f составляют независимо 1 или 2,
R4 и V, как определено в пункте 1, а
R5a, R5b, R5c и R5d представляют собой независимо водород или галоген или
в R2, R3, -OR4 и CR7R8 в L,
R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IVa) с R3, -OR4 и R8
в формуле (IVa),
m1 составляет 0,
m2 составляет 1 или 2,
j составляет 1, 2 или 3,
R4 представляет собой водород,
R8 и L, как определено в пункте 1, а
R9a, R9b, R9c и R9d представляют собой независимо водород или галоген.
[0016] Пункт 8
Соединение по любому одному из пунктов 1-6 или его фармацевтически приемлемая соль, при этом
R2 и R3 представляют собой независимо водород или C1-6 алкил, который может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIa) с -OR4
в формуле (IIa),
e и f составляют независимо 1 или 2,
R4 и V, как определено в пункте 1, а
R5a, R5b, R5c и R5d представляют собой независимо водород или галоген.
[0017] Пункт 9
Соединение по любому одному из пунктов 1-6 или его фармацевтически приемлемая соль, при этом
R2 и R3 представляют собой независимо водород или C1-6 алкил, необязательно замещенный одинаковыми или разными и 1-5 галогенами, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIb) с -OR4
в формуле (IIb),
e и f составляют независимо 1 или 2,
R4 и V, как определено в пункте 1, а
R5a, R5b, R5c и R5d представляют собой независимо водород или галоген.
[0018] Пункт 10
Соединение по любому одному из пунктов 1-9 или его фармацевтически приемлемая соль, при этом
R2 и R3 представляют собой независимо водород или C1-6 алкил, необязательно замещенный одинаковыми или разными и 1-5 галогенами, и R2 и R3 не объединены вместе с атомом углерода, с которым они соединены с образованием кольца.
[0019] Пункт 11
Соединение по любому одному из пунктов 1-5 и 10 или его фармацевтически приемлемая соль, при этом
R4 представляет собой водород, C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами, или C3-7 циклоалкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, или
R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIIa) с R2
в формуле (IIIa),
h составляет 1, 2 или 3,
R2, как определено в пункте 1,
R6a, R6b и R6c представляют собой независимо водород, галоген или C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами.
[0020] Пункт 12
Соединение по любому одному из пунктов 1-11 или его фармацевтически приемлемая соль, при этом
R4 представляет собой водород, C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами, или C3-7 циклоалкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, а R3 и -OR4 не объединены вместе с атомом углерода, с которым они соединены с образованием кольца.
[0021] Пункт 13
Соединение по любому одному из пунктов 1-12 или его фармацевтически приемлемая соль, при этом R4 представляет собой водород.
[0022] Пункт 14
Соединение по любому одному из пунктов 1-13 или его фармацевтически приемлемая соль, при этом
R7 и R8 представляют собой независимо водород или C1-4 алкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, а
m составляет 1 или 2.
[0023] Пункт 15
Соединение по любому одному из пунктов 1-14 или его фармацевтически приемлемая соль, при этом R7 и R8 представляют собой водород, а m составляет 1.
[0024] Пункт 16
Соединение по любому одному из пунктов 1-15 или его фармацевтически приемлемая соль, при этом
R1b или R1c представляет собой C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
[0025] Пункт 17
Соединение по любому одному из пунктов 1-16 или его фармацевтически приемлемая соль, при этом
R1b представляет собой C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
[0026] Пункт 18
Соединение по любому одному из пунктов 1-16 или его фармацевтически приемлемая соль, при этом
R1c представляет собой C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
[0027] Пункт 19
Соединение по любому одному из пунктов 1-16 или его фармацевтически приемлемая соль, при этом
R1b или R1c представляет собой C6-10 арилокси или 5-12-членный гетероарилокси, при этом арильный фрагмент арилокси и гетероарильный фрагмент гетероарилокси могут быть независимо замещены 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
[0028] Пункт 20
Соединение по любому одному из пунктов 1-16 или его фармацевтически приемлемая соль, при этом
R1b или R1c представляет собой C6-10 арил или 5-12-членный гетероарил, при этом арил и гетероарил могут быть независимо замещены 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
[0029] Пункт 21
Соединение по любому одному из пунктов 1-20 или его фармацевтически приемлемая соль, при этом R2 и R3 представляют собой независимо C1-6 алкил, необязательно замещенный одинаковыми или разными и 1-5 галогенами.
[0030] Пункт 22
Соединение по любому одному из пунктов 1 и 3-20 или его фармацевтически приемлемая соль, при этом
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIb) с -OR4
в формуле (IIb),
e и f составляют независимо 1 или 2,
R4 и V, как определено в пункте 1, а
R5a, R5b, R5c и R5d представляют собой независимо водород или галоген, или
в R2, R3, -OR4 и CR7R8 в L,
R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IVa) с R3, -OR4 и R8
в формуле (IVa),
m1 составляет 0,
m2 составляет 1 или 2,
j составляет 1, 2 или 3,
R4 представляет собой водород,
R8 и L, как определено в пункте 1, а
R9a, R9b, R9c и R9d представляют собой независимо водород или галоген.
[0031] Пункт 23
Соединение по пункту 1 или 2 или его фармацевтически приемлемая соль, которое выбирают из следующих соединений:
Пример 1: 1-[6-(4-фторфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 2: 6-(4-фторфенокси)-1-(тетрагидрофуран-2-илметил)-1H-бензимидазол,
Пример 7: 1-(тетрагидрофуран-2-илметил)-6-[4-(трифторметил)фенил]-1H-бензимидазол,
Пример 9: 2-метил-1-{6-[4-(трифторметил)фенил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 10: 1-[2-(циклопентилокси)этил]-6-[4-(трифторметил)фенил]-1H-бензимидазол,
Пример 11: 2-метил-1-{6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 12: 1-[2-(циклопентилокси)этил]-6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол,
Пример 14: 2-метил-1-[6-(4-метилфенокси)-1H-бензимидазол-1-ил]пропан-2-ол,
Пример 15: 2-метил-1-{6-[4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 20: 1-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 22: 2-метил-1-{6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 24: 2-метил-1-{6-[(6-метилпиридин-3-ил)окси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 25: 2-метил-1-(6-{[6-(трифторметил)пиридин-3-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 28: 2-метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 51: 2-метил-1-(5-{[5-(трифторметил)пиразин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 52: 2-метил-1-(5-{[5-(трифторметил)пиримидин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 53: 1-(5-{[3-фтор-5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)-2-метилпропан-2-ол,
Пример 54: 1-{5-[(5-хлор-3-фторпиридин-2-ил)окси]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
Пример 56: 3-[(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)метил]оксетан-3-ол,
Пример 58: 1-[(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)метил]циклобутанoл,
Пример 59: 2-метил-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол,
Пример 60: 2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 93: 3-({6-[4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
Пример 94: 3-({6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
Пример 101: 4-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилбутан-2-ол,
Пример 110: 3-{[6-(2-хлор-4-фторфенокси)-1H-бензимидазол-1-ил]метил}оксетан-3-ол,
Пример 118: цис-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)циклогексанол,
Пример 123: 1-{6-[2-фтор-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
Пример 130: 1-[6-(4-хлор-2-фторфенил)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 148: 3-({6-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
Пример 173: 4-{6-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилбутан-2-ол,
Пример 176: 1-{5-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
Пример 179: 2-метил-1-{5-[4-(трифторметокси)фенил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 181: 1-{5-[2-фтор-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
Пример 205: 3-({5-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}метил)оксетан-3-ол, и
Пример 229: (3S)-2-метил-3-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол.
[0032] Пункт 24
Соединение по пункту 1 или 2 или его фармацевтически приемлемая соль, которое выбирают из следующих соединений:
Пример 1: 1-[6-(4-фторфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 2: 6-(4-фторфенокси)-1-(тетрагидрофуран-2-илметил)-1H-бензимидазол,
Пример 7: 1-(тетрагидрофуран-2-илметил)-6-[4-(трифторметил)фенил]-1H-бензимидазол,
Пример 9: 2-метил-1-{6-[4-(трифторметил)фенил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 10: 1-[2-(циклопентилокси)этил]-6-[4-(трифторметил)фенил]-1H-бензимидазол,
Пример 11: 2-метил-1-{6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 12: 1-[2-(циклопентилокси)этил]-6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол,
Пример 14: 2-метил-1-[6-(4-метилфенокси)-1H-бензимидазол-1-ил]пропан-2-ол,
Пример 15: 2-метил-1-{6-[4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 20: 1-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 22: 2-метил-1-{6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 24: 2-метил-1-{6-[(6-метилпиридин-3-ил)окси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 25: 2-метил-1-(6-{[6-(трифторметил)пиридин-3-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 28: 2-метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 51: 2-метил-1-(5-{[5-(трифторметил)пиразин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 52: 2-метил-1-(5-{[5-(трифторметил)пиримидин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 53: 1-(5-{[3-фтор-5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)-2-метилпропан-2-ол,
Пример 54: 1-{5-[(5-хлор-3-фторпиридин-2-ил)окси]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
Пример 56: 3-[(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)метил]оксетан-3-ол,
Пример 58: 1-[(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)метил]циклобутанoл,
Пример 59: 2-метил-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол, и
Пример 60: 2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол.
[0033] Пункт 25
Соединение по пункту 1 или 2 или его фармацевтически приемлемая соль, которое выбирают из следующих соединений:
Пример 1: 1-[6-(4-фторфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 9: 2-метил-1-{6-[4-(трифторметил)фенил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 11: 2-метил-1-{6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 15: 2-метил-1-{6-[4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 20: 1-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 22: 2-метил-1-{6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 24: 2-метил-1-{6-[(6-метилпиридин-3-ил)окси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 28: 2-метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 51: 2-метил-1-(5-{[5-(трифторметил)пиразин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 53: 1-(5-{[3-фтор-5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)-2-метилпропан-2-ол,
Пример 59: 2-метил-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол,
Пример 60: 2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 94: 3-({6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
Пример 101: 4-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилбутан-2-ол,
Пример 118: цис-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)циклогексанол,
Пример 123: 1-{6-[2-фтор-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
Пример 148: 3-({6-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
Пример 205: 3-({5-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}метил)оксетан-3-ол, и
Пример 229: (3S)-2-метил-3-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол.
[0034] Пункт 26
Соединение по пункту 1 или 2 или его фармацевтически приемлемая соль, которое выбирают из следующих соединений:
Пример 1: 1-[6-(4-фторфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 9: 2-метил-1-{6-[4-(трифторметил)фенил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 11: 2-метил-1-{6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 15: 2-метил-1-{6-[4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 20: 1-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
Пример 22: 2-метил-1-{6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 24: 2-метил-1-{6-[(6-метилпиридин-3-ил)окси]-1H-бензимидазол-1-ил}пропан-2-ол,
Пример 28: 2-метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 51: 2-метил-1-(5-{[5-(трифторметил)пиразин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
Пример 53: 1-(5-{[3-фтор-5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)-2-метилпропан-2-ол,
Пример 59: 2-метил-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол, и
Пример 60: 2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол.
[0035] Пункт 27
Фармацевтическая композиция, содержащая соединение по любому одному из пунктов 1-26 или его фармацевтически приемлемую соль.
[0036] Пункт 28
Лекарственное средство для лечения заболевания, вовлекающего Nav 1,7 (SCN9A), содержащее соединение по любому одному из пунктов 1-26 или его фармацевтически приемлемая соль в качестве активного ингредиента.
Пункт 29
Соединение по любому одному из пунктов 1-26 или его фармацевтически приемлемая соль, или соединение, выбранное из группы, состоящей из
6-[6-хлор-2-(морфолин-4-ил)пиримидин-4-ил]-1-(2-метоксиэтил)-1H-бензимидазол,
2-[5-(3,5-диметил-1,2-оксазол-4-ил)-1H-бензимидазол-1-ил]этанол,
2-{5-[5-(тетрагидрофуран-3-ил)-4H-1,2,4-триазол-3-ил]-1H-бензимидазол-1-ил}этанол,
2-{5-[3-(2-метоксиэтил)-1-(2,2,2-трифторэтил)-1H-1,2,4-триазол-5-ил]-1H-бензимидазол-1-ил}этанол,
2-{5-[3-метил-1-(1-метилпиперидин-4-ил)-1H-1,2,4-триазол-5-ил]-1H-бензимидазол-1-ил}этанол,
2-бутил-6-[1-(2-гидроксиэтил)-1H-бензимидазол-6-ил]-3,4-дигидропирроло[1,2-a]пиразин-1(2H)-он,
6-[1-(2-гидроксиэтил)-1H-бензимидазол-6-ил]-2-(3-метилбутил)-3,4-дигидропирроло[1,2-a]пиразин-1(2H)-он,
2-{5-[1-(2-гидроксиэтил)-1H-бензимидазол-5-ил]-1H-1,2,4-триазол-1-ил}этанол,
6-(2-хлорфенил)-1-(2-гидроксиэтил)-1H-бензимидазол-7-карбонитрил,
2-хлор-6-{7-фтор-1-[(1S,3S)-3-метоксициклогексил]-1H-бензимидазол-5-ил}-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин и
2-{5-[2-(тетрагидрофуран-3-ил)-1H-имидазол-1-ил]-1H-бензимидазол-1-ил}этанол,
или его фармацевтически приемлемая соль.
Пункт 30
Лекарственное средство для лечения заболевания, вовлекающего Nav 1,7 (SCN9A), содержащее соединение по пункту 29 или его фармацевтически приемлемую соль в качестве активного ингредиента.
[0037] Пункт 29 такой же, как любой из пунктов 1-26, при условии, что 11 соединений, исключенных в условии в конце пункта 1, не должны быть исключены.
[0038] Пункт 31
Лекарственное средство для лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии или рассеянного склероза, которое в качестве активного ингредиента содержит соединение по любому одному из пунктов 1-26 или его фармацевтически приемлемую соль.
Пункт 32
Лекарственное средство для лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии или рассеянного склероза, которое в качестве активного ингредиента содержит соединение по пункту 29 или его фармацевтически приемлемую соль.
[0039] Пункт 33
Фармацевтическая комбинация, содержащая соединение по любому одному из пунктов 1-26 или его фармацевтически приемлемую соль и по меньшей мере одно лекарственное средство, выбранное из группы, состоящей из противоэпилептического средства, антидепрессивного средства, наркотического анальгетика, противовоспалительного средства, ингибитора редуктазы и лекарственного средства производного простагландина.
Пункт 34
Фармацевтическая комбинация, содержащая соединение по пункту 29 или его фармацевтически приемлемую соль и по меньшей мере одно лекарственное средство, выбранное из группы, состоящей из противоэпилептического средства, антидепрессивного средства, наркотического анальгетика, противовоспалительного средства, ингибитора редуктазы и лекарственного средства производного простагландина.
[0040] Пункт 35
Применение соединения по любому одному из пунктов 1-26 или его фармацевтически приемлемой соли при производстве лекарства для лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии или рассеянного склероза.
Пункт 36
Применение соединения по пункту 29 или его фармацевтически приемлемой соли при производстве лекарства для лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии или рассеянного склероза.
[0041] Пункт 37
Способ лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии или рассеянного склероза, который включает введение терапевтически эффективного количества соединения по любому одному из пунктов 1-26 или его фармацевтически приемлемой соли нуждающемуся в них млекопитающему.
Пункт 38
Способ лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии или рассеянного склероза, который включает введение терапевтически эффективного количества соединения по пункту 29 или его фармацевтически приемлемой соли нуждающемуся в них млекопитающему.
[0042] (Эффект изобретения)
Настоящее изобретение предоставляет блокатор Nav 1,7, содержащий новое соединение бензимидазола или его фармацевтически приемлемую соль. Соединения настоящего изобретения полезны в качестве лекарства для лечения или предотвращения заболевания, вовлекающего Nav 1,7 (SCN9A), а именно, соединения могут применяться для пациента, страдающего от нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства и тому подобное.
Описание вариантов осуществления
[0043] Далее, настоящее изобретение объясняется более подробно. Количество атомов углерода в «группе заместителей», используемых в данном документе, может быть иногда выражено, например, как «C1-6». Конкретно, пункт «C1-6 алкил» означает алкил, имеющий 1-6 атомов углерода. В настоящем описании группа заместителей, которая не сопровождается «необязательно замещенный» или «замещенный», означает «незамещенную» группу заместителей. Например, «C1-6 алкил» означает «незамещенный C1-6 алкил».
[0044] Группы заместителей в настоящем описании иногда могут выражаться без термина «группа». В случае, когда «необязательно замещенный» используется в определении групп заместителей, количество замещающих групп не ограничено при условии, что имеются замены, т.е. Одна или больше. Это означает, что возможным количеством замещающих групп является доступное для замены количество на атомах углерода или атомах углерода-азота в группе заместителей, которые приемлемы для замены. Если не утверждается иное, определение каждой группы заместителей также распространяется на случай частичного содержания группы заместителей или случай, когда группа заместителей замещают другие группы заместителей.
[0045] Если не утверждается иное, участок связывания групп заместителей не ограничен при условии, что участок доступен для связывания.
[0046] «Галоген» включает, например, фтор, хлор, бром и иод, предпочтительно фтор и хлор.
[0047] «C1-2 алкил» означает насыщенную углеводородную группу, имеющую 1-2 атома углерода, «C1-3 алкил» означает насыщенную углеводородную группу прямой или разветвленной цепи, имеющую 1-3 атома углерода, «C1-4 алкил» означает насыщенную углеводородную группу прямой или разветвленной цепи, имеющую 1-4 атома углерода, а «C1-6 алкил» означает насыщенную углеводородную группу прямой или разветвленной цепи, имеющую 1-6 атомов углерода. «C1-2 алкил» включает, например, метил и этил; «C1-3 алкил» включает, например, пропил и изопропил, кроме указанного выше алкила; «C1-4 алкил» кроме указанного выше алкила включает, например, бутил, изобутил, втор-бутил и трет-бутил; а «C1-6 алкил» кроме указанного выше алкила включает, например, пентил, изопентил, неопентил, 1-этилпропил, гексил и их структурный изомер. Предпочтительные примеры «C1-6 алкила» или «C1-4 алкила» включают «C1-3 алкил», а более предпочтительно метил и этил.
[0048] «C3-7 циклоалкил» означает неароматическую циклическую углеводородную группу (т.е. Насыщенную углеводородную группу и частично-ненасыщенную углеводородную группу), имеющую 3-7 атомов углерода, а «C3-10 циклоалкил» означает неароматическую циклическую углеводородную группу (т.е. Насыщенную углеводородную группу и частично-ненасыщенную углеводородную группу), имеющую 3-10 атомов углерода. «C3-7 циклоалкил» и «C3-10 циклоалкил» также включают циклоалкил с мостиком. «C3-7 циклоалкил» включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклопентил, циклогексенил и циклогептил. «C3-10 циклоалкил» кроме указанного выше включает, например, циклооктил и адамантил, предпочтительно, «C3-7 циклоалкил».
[0049] «C3-7 циклоалкил» и «C3-10 циклоалкил» также включают бициклическое конденсированное кольцо, в котором «C3-7 циклоалкил» и «C3-10 циклоалкил» слиты с бензолом или 5- или 6-членным кольцом, имеющим один гетероатом, выбранный из атома азота, серы или кислорода, или одинаковые или разные и два или более (например, 2-4) их гетероатомов (например, «5- или 6-членный моноциклический гетероарил», упомянутый ниже, и 5- или 6-членное кольцо в «3-7-членном неароматическом гетероциклиле», упомянутом ниже), соответственно. Примеры бициклического конденсированного кольца включают группы следующих формул.
[0050] «C6-10 арил» означает ароматическую углеводородную группу, имеющую 6-10 атомов углерода, предпочтительно фенил. «C6-10 арил» включает, например, фенил, 1-нафтил и 2-нафтил.
[0051] «C6-10 арил» также содержит конденсированное кольцо, в котором «фенил» слит с 5- или 6-членным кольцом, имеющим один гетероатом, выбранный из атома азота, серы или кислорода, или одинаковые или разные и два или более (например, 2-4) их гетероатомов (например, «5- или 6-членный моноциклический гетероарил», упомянутый ниже, и 5- или 6-членное кольцо в «3-7-членном неароматическом гетероциклиле», упомянутом ниже), или 5-7-членное циклоалкильное кольцо (например, циклопентан, циклогексан и циклогептан). Примеры конденсированного кольца включают группы следующих формул.
[0052] «5-12-членный гетероарил» означает 5-12-членную моно или многоциклическую ароматическую группу, имеющую один гетероатом, выбранный из атома азота, серы или кислорода, или одинаковые или разные и два или более (например, 2-4) их гетероатомов, кроме атомов углерода в качестве атомов кольца, предпочтительно, «5- или 6-членный моноциклический гетероарил». «5- или 6-членный моноциклический гетероарил» означает 5- или 6-членную моноциклическую ароматическую группу внутри «5-12-членного гетероарила».
[0053] Многоциклический гетероарил в «5-12-членном гетероариле» включает, например, конденсированное кольцо, в котором слиты два одинаковых или разных моноциклических гетероарила, или слиты моноциклический гетероарил и ароматическое кольцо (например, бензол) или неароматическое кольцо (например, циклогексан).
«5-12-членный гетероарил» включает, например, группы формул, показанных ниже. Предпочтительно, «5-12-членный гетероарил» включает пиразолил, имидазолил, пиридил, пиримидинил, пиразинил и пиридазинил. Другой вариант осуществления предпочтительно включает бензофуранил, в котором участок связывания находится на гетероарильном (фурановом) кольце, пиридиле, пиримидиниле, пиразиниле и пиридазиниле. Примеры «5- или 6-членного моноциклического гетероарила» включают моноциклические группы из групп следующих формул.
[0054] «3-7-членный неароматический гетероциклил» означает 3-7-членную циклическую группу, имеющую один гетероатом, выбранный из атома азота, кислорода или серы, или одинаковые или разные и два или более (например, 2-4, предпочтительно 2-3) их гетероатомов, кроме атомов углерода в качестве атомов кольца. Гетероциклил является неароматическим, при этом он может представлять собой насыщенный гетероциклил или частично-ненасыщенный гетероциклил. Предпочтительно одним из них является насыщенный гетероциклил, более предпочтительно 5- или 6-членный насыщенный гетероциклил. «3-7-членный неароматический гетероциклил» включает, например, оксетанил, азетидинил, пиранил, тетрагидрофурил, пирролидинил, пиразолидинил, имидазолидинил, пиперидинил, морфолинил, тиоморфолинил, диоксотиоморфолинил, гексаметилениминил, оксазолидинил, тиазолидинил, имидазолидинил, оксоимидазолидинил, диоксоимидазолидинил, оксо-оксазолидинил, диоксо-оксазолидинил, диоксотиазолидинил, тетрагидропиранил и тетрагидропиридинил, и предпочтительно пиранил, тетрагидрофурил, пирролидинил, пиперидинил и морфолинил.
[0055] «3-7-членный неароматический гетероциклил» также содержит конденсированное кольцо, в котором 3-7-членный неароматический гетероциклил слит с бензолом или 6-членным гетероарилом (например, пиридином, пиримидином или пиридазином). Их примеры включают дигидроиндолил, дигидроизоиндолил, дигидропуринил, дигидротиазолопиримидинил, дигидробензодиоксанил, изоиндолинил, индазолил, пирролопиридинил, тетрагидрохинолинил, декагидрохинолинил, тетрагидроизохинолинил, декагидроизохинолинил, тетрагидронафтиридинил и тетрагидропиридоазепинил.
[0056] «C1-2 алкокси» означает окси группу, замещенную указанным выше «C1-2 алкилом», а «C1-4 алкокси» означает окси группу, замещенную указанным выше «C1-4 алкилом». «C1-2 алкокси» включает, например, метокси и этокси, а «C1-4 алкокси» кроме указанных выше примеров включает, например, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси и трет-бутокси. Предпочтительно, «C1-4 алкокси» включает метокси, этокси и изопропокси.
[0057] «C3-7 циклоалкокси» означает окси группу, замещенную указанным выше «C3-7 циклоалкилом». «C3-7 циклоалкокси» включает, например, циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси, и предпочтительно циклогексилокси. «C5-6 циклоалкокси» означает циклоалкокси, имеющий 5 или 6 атомов углерода внутри «C3-7 циклоалкокси».
[0058] «C6-10 арилокси» означает окси группу, замещенную указанным выше «C6-10 арилом». «C6-10 арилокси» включает, например, фенилокси и нафтилокси, и предпочтительно фенилокси.
[0059] «5-12-членный гетероарилокси» означает окси группу, замещенную указанным выше «5-12-членным гетероарилом». «5-12-членный гетероарилокси» включает, например, пиридилокси, имидазолилокси и фурилокси, и предпочтительно пиридилокси.
[0060] «C1-4 алкиламино» означает аминогруппу, замещенную одним или двумя указанными выше «C1-4 алкилами». «C1-4 алкиламино» включает, например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, диметиламино, диэтиламино и этилметиламино, и предпочтительно метиламино и диметиламино.
[0061] «C3-7 циклоалкиламино» означает аминогруппу, замещенную одним или двумя указанными выше «C3-7 циклоалкилами». «C3-7 циклоалкиламино» включает, например, циклопропиламино, циклобутиламино, циклопентиламино, циклогексиламино и дициклопропиламино, и предпочтительно циклогексиламино.
[0062] «C1-4 алкилсульфонил» означает сульфонильную группу, замещенную указанным выше «C1-4 алкилом». «C1-4 алкилсульфонил» включает, например, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил и бутилсульфонил, и предпочтительно метилсульфонил.
[0063] «C1-4 алкилтио» означает тиогруппу, замещенную указанным выше «C1-4 алкилом». «C1-4 алкилтио» включает, например, метилтио, этилтио, пропилтио, изопропилтио и бутилтио, и предпочтительно метилтио.
[0064] Для того, чтобы раскрыть настоящее соединение изложенной выше формулы (I) более подробно, каждый символ, используемый в настоящем изобретении, дополнительно объясняется ниже, показывая предпочтительные примеры.
[0065] Предпочтительно, R1a, R1b, R1c и R1d включают независимо водород, галоген, циано, C1-4 алкил, C1-4 алкокси, C1-4 алкиламино, (при этом каждый алкильный фрагмент алкила, алкокси и алкиламино может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C3-7 циклоалкил, C3-7 циклоалкокси, C3-7 циклоалкиламино, (при этом каждый циклоалкильный фрагмент циклоалкила, циклоалкокси и циклоалкиламино может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил и 5-12-членный гетероарилокси (при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C1-4 алкилтио, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей), при условии, что по меньшей мере один из R1a, R1b, R1c и R1d представляет собой указанный выше C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси.
[0066] Более предпочтительно, R1a, R1b, R1c и R1d включают независимо водород, галоген, циано, C1-4 алкил, C1-4 алкокси, (при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен одинаковыми или разными и 1-3 галогенами), C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил и 5-12-членный гетероарилокси (при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей), при условии, что по меньшей мере один из R1a, R1b, R1c и R1d представляет собой указанный выше C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси.
[0067] Еще более предпочтительно, R1a и R1d включают водород, а R1b и R1c представляют собой независимо водород, C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и необязательно замещенного C1-4 алкила, при условии, что и R1b и R1c не являются водородом.
[0068] В другом варианте осуществления R1a, R1b, R1c и R1d;
R1a и R1d представляют собой водород, а R1b и R1c представляют собой независимо водород, C6-10 арилокси или 5-12-членный гетероарилокси, при этом арильный фрагмент арилокси и гетероарильный фрагмент гетероарилокси могут быть независимо замещены 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и необязательно замещенного C1-4 алкила, при условии, что и R1b, и R1c не являются водородом.
[0069] В другом варианте осуществления R1a, R1b, R1c и R1d;
R1a и R1d представляют собой водород, а R1b и R1c представляют собой независимо водород, C6-10 арил или 5-12-членный гетероарил, при этом арил и гетероарил могут быть независимо замещены 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и необязательно замещенного C1-4 алкила, при условии, что и R1b, и R1c не являются водородом.
[0070] В другом варианте осуществления R1a, R1b, R1c и R1d;
R1a и R1d представляют собой водород,
один из R1b и R1c представляет собой C6-10 арилокси или 5-12-членный гетероарилокси, при этом арильный фрагмент арилокси и гетероарильный фрагмент гетероарилокси могут быть независимо замещены 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и необязательно замещенного C1-4 алкила, а другой представляет собой водород.
[0071] В другом варианте осуществления R1a, R1b, R1c и R1d;
R1a и R1d представляют собой водород,
один из R1b и R1c представляет собой C6-10 арил или 5-12-членный гетероарил, при этом арил и гетероарил могут быть независимо замещены 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и необязательно замещенного C1-4 алкила, а другой представляет собой водород.
[0072] Предпочтительные примеры R1a, R1b, R1c и R1d включают водород, фтор, хлор, метил, этил, изопропил, изобутил, циклопропил, циклопентил, циклогексил, метокси, этокси, фенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 4-(трифторметил)фенил, 5-(трифторметил)пиридин-2-ил, фенокси, 3-фторфенокси, 4-фторфенокси, 3,4-дифторфенокси, 3,5-дифторфенокси, 4-хлорфенокси, 4-метилфенокси, 4-(трифторметил)фенокси, 4-метоксифенокси, 4-(трифторметокси)фенокси, 4-цианофенокси, 4-(метилсульфонил)фенокси, (5-метилпиридин-2-ил)окси, (5-(трифторметил)пиридин-2-ил)окси и (5-фторпиридин-2-ил)окси.
[0073] Более предпочтительные примеры R1a, R1b, R1c и R1d включают водород, фтор, хлор, метил, этил, изопропил, изобутил, циклопропил, циклопентил, циклогексил, метокси, этокси, фенил, 4-фторфенил, 4-(трифторметил)фенил, 5-(трифторметил)пиридин-2-ил, фенокси, 3-фторфенокси, 4-фторфенокси, 3,4-дифторфенокси, 3,5-дифторфенокси, 4-хлорфенокси, 4-метилфенокси, 4-(трифторметил)фенокси, 4-метоксифенокси, 4-(трифторметокси)фенокси, 4-цианофенокси, 4-(метилсульфонил)фенокси, (5-метилпиридин-2-ил)окси, (5-(трифторметил)пиридин-2-ил)окси и (5-фторпиридин-2-ил)окси.
[0074] Еще более предпочтительные примеры R1a, R1b, R1c и R1d включают водород, фтор, 4-(трифторметил)фенил, 5-(трифторметил)пиридин-2-ил, 3-фторфенокси, 4-фторфенокси, 4-хлорфенокси, 4-метилфенокси, 4-(трифторметил)фенокси, 4-(трифторметокси)фенокси, (5-метилпиридин-2-ил)окси и (5-(трифторметил)пиридин-2-ил)окси.
[0075] Другие варианты осуществления R1a, R1b, R1c и R1d включают водород, фтор, хлор, метил, этил, изопропил, изобутил, циклопропил, циклопентил, циклогексил, метокси, этокси, фенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 4-(трифторметил)фенил, 5-(трифторметил)пиридин-2-ил, фенокси, 3-фторфенокси, 4-фторфенокси, 3,4-дифторфенокси, 3,5-дифторфенокси, 4-хлорфенокси, 4-метилфенокси, 4-(трифторметил)фенокси, 4-метоксифенокси, 4-(трифторметокси)фенокси, 4-цианофенокси, 4-(метилсульфонил)фенокси, (5-метилпиридин-2-ил)окси, (5-(трифторметил)пиридин-2-ил)окси, (5-фторпиридин-2-ил)окси, 2-метокси-4-(трифторметил)фенил, 2-фтор-4-(трифторметил)фенил, 2-хлор-4-(трифторметил)фенил, 4-(трифторметокси)фенил, (5-хлорпиридин-2-ил)окси, 2,4-дихлорфенил, 2-хлор-4-фторфенокси, 4-хлор-2-фторфенокси и 2,4-дихлорфенокси.
[0076] Другие варианты осуществления R1a, R1b, R1c и R1d включают водород, фтор, 4-(трифторметил)фенил, 5-(трифторметил)пиридин-2-ил, 3-фторфенокси, 4-фторфенокси, 4-хлорфенокси, 4-метилфенокси, 4-(трифторметил)фенокси, 4-(трифторметокси)фенокси, (5-метилпиридин-2-ил)окси, (5-(трифторметил)пиридин-2-ил)окси, 2-метокси-4-(трифторметил)фенил, 4-(трифторметокси)фенил и (5-хлорпиридин-2-ил)окси.
[0077] Предпочтительно, R2 и R3 включают водород и C1-6 алкил, который может быть замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, а более предпочтительно водород и C1-6 алкил, необязательно замещенный 1-5 галогенами.
[0078] Предпочтительные примеры R2 и R3 включают водород, метил, этил, изопропил, изобутил, трифторметил, циклопропил, циклопентил и циклогексил, а более предпочтительно водород, метил и этил.
[0079] А R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (II) с -OR4.
[0080] В приведенной выше формуле (II) предпочтительно e и f составляют независимо 1 или 2.
[0081] Предпочтительно, R5a, R5b, R5c и R5d представляют собой независимо водород или галоген.
[0082] А R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IV) с R3, -OR4 и R8.
[0083] В приведенной выше формуле (IV), предпочтительно m1 составляет 0, и предпочтительно m2 составляет 1 или 2.
Предпочтительно, j составляет 1, 2 или 3.
[0084] Предпочтительно, R9a, R9b, R9c и R9d представляют собой независимо водород или галоген.
Предпочтительно, R4 представляет собой водород.
[0085] Предпочтительно, R4 представляет собой водород, C1-4 алкил, который может быть замещен одинаковыми или разными и 1-3 галогенами, или C3-7 циклоалкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, а более предпочтительно водород.
[0086] Предпочтительные примеры R4 включают водород, метил, этил, пропил, изопропил, циклопропил, циклобутил, циклопентил и циклогексил, а более предпочтительно водород, изопропил и циклопентил, а еще более предпочтительно водород.
[0087] А R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (III) с R2.
[0088] В приведенной выше формуле (III) h предпочтительно представляет собой 1, 2 или 3, а более предпочтительно 2 или 3.
[0089] Предпочтительно, R6a, R6b и R6c представляют собой независимо водород, галоген или C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами, а более предпочтительно водород.
[0090] Предпочтительные примеры R6a, R6b и R6c включают водород, фтор, гидроксил, метил, трифторметил, метокси, этокси и трифторметокси, а более предпочтительно водород, фтор и метил, и еще более предпочтительно водород.
[0091] Предпочтительно, m составляет 1 или 2, а более предпочтительно 1.
[0092] L представляет собой CR7R8 при условии, что, когда m составляет 2 или 3, каждые CR7R8 являются независимо одинаковыми или разными.
[0093] Предпочтительно, R7 и R8 включают водород и C1-4 алкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, а более предпочтительно водород.
[0094] Предпочтительные примеры R7 и R8 включают водород, метил и этил, а более предпочтительно водород.
[0095] Предпочтительно, группа A заместителей включает фтор, хлор, гидроксил, C1-2 алкокси, и C5-6 циклоалкокси, а более предпочтительно фтор, гидроксил и C1-2 алкокси.
[0096] Предпочтительно, группа B заместителей включает фтор, хлор, гидроксил, C1-2 алкил, C1-2 алкокси и C5-6 циклоалкокси, а более предпочтительно фтор, гидроксил, C1-2 алкил и C1-2 алкокси.
[0097] Вариант осуществления соединения формулы (I) включает следующее соединение или его фармацевтически приемлемую соль:
R1a, R1b, R1c и R1d представляют собой независимо водород, C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, при условии, что по меньшей мере один из R1a, R1b, R1c и R1d представляет собой указанный выше C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси,
R2 и R3 представляют собой независимо водород или C1-6 алкил, который может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, при условии, что и R2 и R3 не являются водородом, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIa) с -OR4
в формуле (IIa),
e и f составляют независимо 1 или 2,
R4 представляет собой водород, C1-6 алкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-7 циклоалкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей,
V представляет собой одинарную связь или атом кислорода,
R5a, R5b, R5c и R5d представляют собой независимо водород или галоген или
в R2, R3, -OR4 и CR7R8 в L,
R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IVa) с R3, -OR4 и R8
в формуле (IVa),
m1 составляет 0,
m2 составляет 1 или 2,
j составляет 1, 2 или 3,
R3 представляет собой водород или C1-6 алкил, необязательно замещенный 1-3 галогенами,
R4 представляет собой водород или C3-7 циклоалкил, необязательно замещенный 1-3 галогенами,
R8 представляет собой водород, гидроксил, C1-4 алкил, C1-4 алкокси (при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C3-7 циклоалкил или C3-7 циклоалкокси, (при этом каждый циклоалкильный фрагмент циклоалкила и циклоалкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей),
L представляет собой CR7R8, при условии, что, когда m составляет 2, каждые CR7R8 являются независимо одинаковыми или разными,
R9a, R9b, R9c и R9d представляют собой независимо водород или галоген,
R4 представляет собой водород, C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами, или C3-7 циклоалкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, или
R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIIa) с R2
в формуле (IIIa),
h составляет 1, 2 или 3,
R2 представляет собой водород, C1-6 алкил, который может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-10 циклоалкил,
R6a, R6b и R6c представляют собой независимо водород, галоген или C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами,
m составляет 1 или 2,
L представляет собой CR7R8, при условии, что, когда m составляет 2, каждые CR7R8 являются независимо одинаковыми или разными,
R7 и R8 представляют собой независимо водород или C1-4 алкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей.
[0098] Другой вариант осуществления соединения формулы (I) включает следующее соединение или его фармацевтически приемлемую соль:
R1a и R1d представляют собой водород,
по меньшей мере один из R1b и R1c представляет собой C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей,
R2 и R3 представляют собой независимо C1-6 алкил, необязательно замещенный одинаковыми или разными и 1-5 галогенами, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIb) с -OR4
в формуле (IIb),
e и f составляют независимо 1 или 2,
R4 представляет собой водород, C1-6 алкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-7 циклоалкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей,
V представляет собой одинарную связь или атом кислорода,
R5a, R5b, R5c и R5d представляют собой независимо водород или галоген или
в R2, R3, -OR4 и CR7R8 в L,
R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IVa) с R3, -OR4 и R8
в формуле (IVa),
m1 составляет 0,
m2 составляет 1 или 2,
j составляет 1 или 2,
R3 представляет собой водород или C1-4 алкил,
R4 представляет собой водород,
R8 представляет собой водород или C1-4 алкил,
L представляет собой CR7R8, при условии, что, когда m составляет 2, каждые CR7R8 являются независимо одинаковыми или разными,
R9a, R9b, R9c и R9d представляют собой независимо водород или галоген,
R4 представляет собой водород, C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами, или C3-7 циклоалкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами, или
R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIIa) с R2
в формуле (IIIa),
h составляет 1, 2 или 3,
R2 представляет собой водород или C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами,
R6a, R6b и R6c представляют собой независимо водород, галоген или C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами,
m составляет 1 или 2,
L представляет собой CR7R8, при условии, что, когда m составляет 2, каждые CR7R8 являются независимо одинаковыми или разными,
R7 и R8 представляют собой независимо водород или C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами.
[0099] Другой вариант осуществления соединения формулы (I) включает следующее соединение или его фармацевтически приемлемую соль:
R1a и R1d представляют собой водород,
один из R1b и R1c представляет собой фенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 4-(трифторметил)фенил, 5-(трифторметил)пиридин-2-ил, фенокси, 3-фторфенокси, 3,4-дифторфенокси, 3,5-дифторфенокси, 4-хлорфенокси, 4-(трифторметил)фенокси, 4-(трифторметокси)фенокси, 4-цианофенокси, 4-(метилсульфонил)фенокси, (5-метилпиридин-2-ил)окси, (5-(трифторметил)пиридин-2-ил)окси, (5-фторпиридин-2-ил)окси, 2-метокси-4-(трифторметил)фенил, 2-фтор-4-(трифторметил)фенил, 2-хлор-4-(трифторметил)фенил, 4-(трифторметокси)фенил, (5-хлорпиридин-2-ил)окси, 2,4-дихлорфенил, 2-хлор-4-фторфенокси, 4-хлор-2-фторфенокси или 2,4-дихлорфенокси, а другой представляет собой водород,
а R2 и R3 представляют собой метил, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIc) с -OR4
в формуле (IIc),
e и f составляют независимо 1 или 2,
R4 представляет собой водород,
V представляет собой одинарную связь или атом кислорода, или
R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IVc) с R3, -OR4 и R8
в формуле (IVc),
R3, R4 и R8 представляют собой водород,
m1 составляет 0,
m2 составляет 1 или 2,
j составляет 1 или 2,
L представляет собой CR7R8, и
как R7, так и R8 представляют собой водород,
R4 представляет собой водород, изопропил или циклопентил, или
R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIIb) с R2
в формуле (IIIa),
R2 представляет собой водород, а
h составляет 2,
m составляет 1,
L представляет собой CR7R8, и
как R7, так и R8 представляют собой независимо водород или метил.
[0100] Ниже упомянуты способы получения соединения настоящего изобретения. Соединение (I) настоящего изобретения может быть получено, например, согласно способам 1-5, показанным ниже.
[0101] Способ 1:
Соединение (I), в котором R1b представляет собой ORa, т.е. Соединение (S-5) или его фармацевтически приемлемая соль может быть получено, например, в соответствии со следующим способом.
На схеме выше R1a, R1c, R1d, R2, R3, R4, L и m соответствуют определению в пункте 1; RaO- означает R1b, который выбирают из C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C6-10 арилокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или 5-12-членного гетероарилокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей; а X1 и X2 представляют собой независимо уходящую группу, такую как галоген, трифторметансульфонилокси и метансульфонилокси.
[0102] Стадия (1-1):
Эта стадия представляет собой способ получения соединения нитроанилина (s-2) посредством реакции соединения нитробензола (s-1) и соединения амина. Основание, используемое в данном документе, включает неорганическое основание, такое как натрия гидроксид, калия гидроксид, калия карбонат и цезия карбонат, и органическое основание, такое как триэтиламин, диизопропилэтиламин и DABCO (1,4-диазабицикло[2,2,2]октан). Когда аминовое соединение используется в большом избытке, нет необходимости использовать такое основание. Растворитель, используемый в данном документе, включает эфиры, такие как THF, диметоксиэтан и 1,4-диоксан; DMF; NMP; ацетонитрил; и тому подобное. Время реакции обычно составляет от 10 минут до 10 часов, а температура реакции составляет от 0°C до температуры кипения растворителя, используемого в данном документе.
[0103] Стадия (1-2):
Эта стадия представляет собой способ получения соединения (s-3) посредством реакции соединения нитроанилина (s-2) и соединения, имеющего гидроксил. Основание, используемое в данном документе, включает натрия гидроксид, калия гидроксид, калия карбонат, цезия карбонат, натрия гидрид и тому подобное. Растворитель, используемый в данном документе, включает эфиры, такие как THF, 1,2-диметоксиэтан и 1,4-диоксан; DMF; NMP; ацетонитрил и тому подобное. Время реакции обычно составляет от 10 минут до 10 часов, а температура реакции составляет от 0°C до температуры кипения растворителя, используемого в данном документе.
[0104] Стадия (1-3):
Эта стадия представляет собой способ получения аминосоединения (s-4) посредством восстановления нитросоединения (s-3). Условие реакции настоящей стадии включает общее условие для восстановления нитрогруппы, например, каталитического восстановления при гидрогенизации палладированным углем и тому подобное, металлотермического восстановления цинком, железом и тому подобное, и гидридного восстановления алюмогидридом лития и тому подобное. Растворитель, используемый в данном документе, может быть выбран из обычно используемых растворителей в зависимости от каждого условия восстановления, и включает метанол, этанол, THF, этилацетат и тому подобное для каталитического восстановления; THF, уксусную кислоту, метанол, этанол и тому подобное для металлотермического восстановления; и диэтиловый эфир, THF и тому подобное для гидридного восстановления. Время реакции обычно составляет от приблизительно 10 минут до приблизительно 24 часов, а температура реакции составляет от 0°C до температуры кипения растворителя, используемого в данном документе.
[0105] Стадия (1-4):
Эта стадия представляет собой способ получения соединения (S-5) посредством реакции соединения фенилендиамина (s-4) и муравьиной кислоты или эквивалента муравьиной кислоты, подлежащих циклизации. Эквивалент муравьиной кислоты включает ортоформиаты, такие как метилортоформиат и этилортоформиат. На настоящей стадии можно использовать катализатор, который представляет собой органическую кислоту, такую как муравьиная кислота и уксусная кислота, и кислоту Льюиса, такую как иттербия трифлат. Растворитель, используемый в данном документе, представляет собой спирты, такие как метанол и этанол. Также в качестве растворителя возможно использование муравьиной кислоты, ортоформиата и тому подобное, которые упомянуты выше в качестве реагента. Время реакции обычно составляет от приблизительно 10 минут до приблизительно 24 часов, а температура реакции составляет от комнатной температуры до температуры кипения растворителя, используемого в данном документе.
[0106] Соединение (I), в котором любой один или более R1a, R1b, R1c и R1d представляет собой ORa или его фармацевтически приемлемую соль, может быть также получено способом, аналогичным указанному выше способу.
[0107] Способ 2:
Соединение (I), в котором R4 представляет собой R4a (алкил или циклоалкил), т.е. Соединение (s-7) или его фармацевтически приемлемая соль может быть получено, например, в соответствии со следующим способом.
На схеме выше R1a, R1b, R1c, R1d, R2, R3, L и m соответствуют определению в пункте 1; X3 имеет такое же определение, как и X1 выше; а R4a имеет такое же, как R4, при условии, что исключен водород.
[0108] Стадия (2-1):
Эта стадия представляет собой способ получения эфирного соединения (S-7) посредством реакции спиртового соединения (s-6), которое представляет собой соединение (s-5), в котором R4 представляет собой водород, и, например, соединение R4aX3 в присутствии основания. Основание, используемое в данном документе, включает натрия гидрид, калия гидрид, лития гидрид, бутиллитий, калия бутоксид и тому подобное. Растворитель, используемый в данном документе, включает эфиры, такие как диэтиловый эфир и THF; DMF; NMP; диметилсульфоксид и тому подобное. Время реакции обычно составляет от приблизительно 10 минут до приблизительно 24 часов, а температура реакции составляет от 0°C до температуры кипения растворителя, используемого в данном документе.
[0109] Способ 3:
Соединение (I), в котором R1b представляет собой Rb (арил или гетероарил), т.е. Соединение (S-10) или его фармацевтически приемлемая соль может быть получено, например, в соответствии со следующим способом.
На схеме выше R1a, R1c, R1d, R2, R3, R4, L и m соответствуют определению в пункте 1; X2 соответствуют определению выше; а Rb представляет собой C6-10 арил или 5-12-членный гетероарил, при этом арил и гетероарил могут быть независимо замещены 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C1-4 алкилтио, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
[0110] Стадия (3-1):
Эта стадия представляет собой способ получения аминосоединения (s-8) посредством селективного восстановления нитрогруппы в соединении нитробензола (s-2). Условие реакции настоящей стадии включает каталитическое восстановление при гидрогенизации отравленной серой платиной-углеродом и тому подобное; металлотермическое восстановление цинком, железом, оловом и тому подобное; и гидридное восстановление алюмогидридом лития и тому подобное. Растворитель, используемый в данном документе, может быть выбран из обычно используемых растворителей в зависимости от каждого условия восстановления, и включает метанол, этанол, THF, этилацетат и тому подобное для каталитического восстановления; THF, уксусную кислоту, метанол, этанол и тому подобное для металлотермического восстановления; и диэтиловый эфир, THF и тому подобное для гидридного восстановления. Время реакции обычно составляет от приблизительно 10 минут до приблизительно 24 часов, а температура реакции составляет от 0°C до температуры кипения растворителя, используемого в данном документе.
[0111] Стадия (3-2):
Эта стадия представляет собой способ получения соединения (s-9) посредством обработки аминосоединения (s-8) способом, аналогичным стадии (1-4).
[0112] Стадия (3-3):
Эта стадия представляет собой способ получения соединения (S-10) посредством реакции соединения (s-9) и соединения бороновой кислоты, имеющего Rb группу или его сложноэфирное соединение, в присутствии основания и катализатора. Конкретно, эта стадия представляет собой способ посредством реакции соединения Suzuki. Основание, используемое в данном документе, включает натрия карбонат, калия карбонат, цезия карбонат, трикалия фосфат и тому подобное. Катализатор, используемый в данном документе, включает палладия ацетат, тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)дипалладий и тому подобное.
Растворитель, используемый в данном документе, включает 1,4-диоксан, толуол, 1,2-диметоксиэтан и тому подобное. Время реакции обычно составляет от приблизительно 30 минут до приблизительно 24 часов, а температура реакции составляет от комнатной температуры до температуры кипения растворителя, используемого в данном документе.
[0113] Соединение (I), в котором любой один или более R1a, R1b, R1c и R1d представляет собой Rb, или его фармацевтически приемлемая соль также могут быть получены способом, аналогичным указанному выше способу.
[0114] Способ 4:
Соединение (I), в котором R1b представляет собой Rb, т.е. Соединение (S-10) или его фармацевтически приемлемая соль также могут быть получены, например, в соответствии со следующим способом.
На схеме выше R1a, R1c, R1d, R2, R3, R4, L и m, как определено в пункте 1; Rb и X2, как определено выше; а R10 и R11 представляют собой независимо необязательно замещенный C1-4 алкил, необязательно замещенный C1-4 алкокси, необязательно замещенный C1-4 диалкиламино, необязательно замещенный C6-10 арил, необязательно замещенный C6-10 арилокси, необязательно замещенный 5-12-членный гетероарил, необязательно замещенный 5-12-членный гетероарилокси или гидроксил. Предпочтительно, R10R11B- включает следующие структуры, но без ограничения ими.
[0115] Стадия (4-1):
Эта стадия представляет собой способ получения боронатного сложноэфирного соединения (s-11) посредством реакции соединения (s-9) и диборного соединения, такого как бис(пинаколато)дибор в присутствии катализатора и основания. Катализатор, используемый в данном документе, включает дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий, тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)дипалладий, бис(трифенилфосфин)палладия дихлорид и тому подобное.
Основание, используемое в данном документе, включает калия ацетат, трикалия фосфат, калия карбонат и тому подобное. Растворитель, используемый в данном документе, включает 1,4-диоксан, толуол, 1,2-диметоксиэтан и тому подобное. Время реакции обычно составляет от приблизительно 1 часа до приблизительно 48 часов, а температура реакции составляет от комнатной температуры до температуры кипения растворителя, используемого в данном документе.
[0116] Стадия (4-2):
Эта стадия представляет собой способ получения соединения (S-10) посредством реакции боронатного сложноэфирного соединения (s-11) и галоидного соединения, имеющего группу Rb, или трифлатного соединения, имеющего группу Rb (такую как Rb-X (X: атом галогена) или CF3SO2O-Rb) в присутствии катализатора и основания. Конкретно, эта стадия представляет собой способ посредством реакции сочетания Suzuki. Основание, используемое в данном документе, включает натрия карбонат, калия карбонат, цезия карбонат, трикалия фосфат и тому подобное. Катализатор, используемый в данном документе, включает палладия ацетат, тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)дипалладий и тому подобное. Растворитель, используемый в данном документе, включает 1,4-диоксан, толуол, 1,2-диметоксиэтан и тому подобное. Время реакции обычно составляет от приблизительно 30 минут до приблизительно 48 часов, а температура реакции составляет от комнатной температуры до температуры кипения растворителя, используемого в данном документе.
[0117] Соединение (I), в котором любой один или более R1a, R1b, R1c и R1d представляет собой Rb, или его фармацевтически приемлемая соль также могут быть получены способом, аналогичным указанному выше способу.
[0118] Способ 5:
Соединение (I), в котором R1b представляет собой ORa, т.е. Соединение (S-5) или его фармацевтически приемлемая соль также могут быть получены, например, в соответствии со следующим способом.
На схеме выше R1a, R1c, R1d, R2, R3, R4, L и m, как определено в пункте 1; а Ra, X1 и X3, как определено выше. Bn означает бензильную группу. Вместо бензильной группы также может использоваться защитная группа, аналогичная бензильной группе, например, замещенная бензильная группа, которая раскрыта в Protective Groups in Organic Synthesis.
[0119] Стадия (5-1):
Эта стадия представляет собой способ получения соединения (s-13), например, посредством реакции соединения (s-12) с Bn-X3 в присутствии основания. Основание, используемое в данном документе, включает натрия карбонат, калия карбонат, цезия карбонат, натрия гидрид и тому подобное. Bn-X3 может включать бензила хлорид, бензила бромид и тому подобное. При необходимости, к нему может быть добавлен натрия иодид, калия иодид, тетрабутиламмония иодид, тетрабутиламмония гидросульфат и тому подобное. Растворитель, используемый в данном документе, включает ацетон, ацетонитрил, THF, диэтиловый эфир, 1,4-диоксан, 1,2-диметоксиэтан, DMF, NMP и тому подобное. Время реакции обычно составляет от приблизительно 30 минут до приблизительно 24 часов, а температура реакции составляет от 0°C до температуры кипения растворителя, используемого в данном документе. В дополнение, соединение (s-13) также может быть получено из соединения (s-12) согласно способу (условию), раскрытому в Protective Groups in Organic Synthesis и тому подобное.
[0120] Стадия (5-2):
Эта стадия представляет собой способ получения соединения (s-14) из соединения (s-13) способом, аналогичным стадии (1-1).
[0121] Стадия (5-3):
Эта стадия представляет собой способ получения соединения (s-15) из соединения (s-14) способом, аналогичным стадии (3-1) (т.е. Способом выборочного восстановления нитрогруппы).
[0122] Стадия (5-4):
Эта стадия представляет собой способ получения соединения (s-16) из соединения (s-15) способом, аналогичным стадии (1-4).
[0123] Стадия (5-5):
Эта стадия представляет собой способ получения соединения (s-17), например, путем гидрогенизации соединения (s-16) для снятия с него защиты для гидроксильной группы. Катализатор, используемый в данном документе, представляет собой гетерогенный катализатор, такой как палладированный уголь. Условие гидрогенизации означает «в атмосфере водорода» или «в присутствии муравьиной кислоты, аммония формиата и тому подобного». Растворитель, используемый в данном документе, включает метанол, этанол, THF, этилацетат и тому подобное. Время реакции обычно составляет от приблизительно 30 минут до приблизительно 24 часов, а температура реакции составляет от 0°C до температуры кипения растворителя, используемого в данном документе. В дополнение, соединение (s-17) также может быть получено из соединения (s-16) согласно способу (условию), раскрытому в Protective Groups in Organic Synthesis и тому подобное.
[0124] Стадия (5-6):
Эта стадия представляет собой способ получения соединения (S-5) из соединения (s-17), который включает следующие два условия реакции, но без ограничения ими.
1) в качестве условия реакции с использованием основания, она включает способ получения соединения (S-5) из соединения (s-17) и Ra-X4, при этом Ra в R1b представляет собой C1-4 алкил, необязательно замещенный 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкил, необязательно замещенный 1-3 заместителями, независимо выбранными из группы B заместителей, C6-10 арил, необязательно замещенный 1-3 заместителями, независимо выбранными из группы B заместителей, или 5-12-членный гетероарил, необязательно замещенный 1-3 заместителями, независимо выбранными из группы B заместителей, а X4 такой же, как указанный выше X1, согласно реакции, аналогичной стадии (1-2).
2) в качестве условия реакции с использованием катализатора и основания, она включает способ с использованием соединения бороновой кислоты, имеющего Ra, или галогенового соединения, имеющего Ra. Катализатор, используемый в данном документе, включает меди (II) ацетат, меди (I) иодид, меди (II) оксид и тому подобное. Основание, используемое в данном документе, включает калия карбонат, цезия карбонат, калия гидроксид, триэтиламин и тому подобное. Растворитель, используемый в данном документе, включает хлорформ, 1,4-диоксан, DMF, диметилсульфоксид, NMP (N-метил-2-пирролидинон) и тому подобное. Время реакции обычно составляет от приблизительно 30 минут до приблизительно 24 часов, а температура реакции составляет от комнатной температуры до температуры кипения растворителя, используемого в данном документе.
[0125] Соединение (I), в котором любой один или более R1a, R1b, R1c и R1d представляет собой ORa, или его фармацевтически приемлемая соль также могут быть получены способом, аналогичным указанному выше способу.
[0126] Указанное выше восстановление нитрогруппы [стадия (1-3), стадия (3-1), стадия (5-3)] и последующая циклизация [стадия (1-4), стадия (3-2), стадия (5-4)] могут быть проделаны последовательно, например, путем добавления муравьиной кислоты или эквивалента муравьиной кислоты, такого как ортоформиат, на стадии восстановления (s-3) или (s-14), таким образом циклизированные соединения (S-5), (s-9) или (s-16) могут быть получены за одну стадию. Время реакции составляет от 10 минут до 12 часов, а температура реакции составляет от комнатной температуры до температуры кипения растворителя, используемого в данном документе.
[0127] Комнатная температура в способах выше означает конкретно 10°C-30°C.
[0128] Исходные материалы и промежуточные продукты в способах выше представляют собой известные соединения или могут быть получены с известными соединениями согласно известному способу. В случае, когда любая функциональная группа, не являющаяся целевым участком реакции, может реагировать или может не подходить для способов выше, функциональная группа, не являющаяся целевым участком реакции, может быть защищена для реакции, и защитная группа может быть расщеплена, давая требуемое соединение после завершения реакции. Защитная группа, используемая в данном документе, включает, например, обычную защитную группу, раскрытую в упомянутых выше Protective Groups in Organic Synthesis и тому подобное. Конкретно, защитная группа для аминогруппы включает, например, этоксикарбонил, трет-бутоксикарбонил, ацетил, бензил и тому подобное; и защитная группа для гидроксила включает, например, три(низший алкил)силил, ацетил, бензил и тому подобное.
[0129] Введение и расщепление защитных групп может быть проделано обычным способом в органической химии (например, см. упомянутые выше Protective Groups in Organic Synthesis) или аналогичным способом.
[0130] За счет правильного изменения функциональной группы (групп) в промежуточном или конечном продукте в способах выше, также можно получать иное соединение, определенное в настоящем изобретении. Преобразование функциональной группы (групп) можно проводить согласно обычному способу (напр., Comprehensive Organic Transformations, R. C. Larock (1989)).
[0131] Промежуточные и требуемые соединения в способах выше можно выделять/очищать путем очистки, обычно используемой в синтетической органической химии, например, нейтрализации, фильтрации, экстракции, мойки, сушки, концентрирования, рекристаллизации, разнообразной хроматографии и т.д. Некоторые промежуточные продукты могут использоваться на следующей стадии без всякой очистки.
Оптические изомеры настоящего изобретения могут быть выделены путем использования известного способа разделения на соответствующей стадии, например, разделения с помощью оптически активной колонки и фракционированной кристаллизации. И можно использовать оптически-активный исходный материал.
Соединениями настоящего изобретения иногда может быть оптический изомер, стереоизомер, таутомер, такой как кетоенольное соединение, и/или геометрический изомер, которые, следовательно, включают все возможные изомеры, включая указанные выше изомеры и их смеси.
[0132] Соединения настоящего изобретения также могут включать соединение формулы (I), его пролекарство и его фармацевтически приемлемую соль, кроме указанных выше изомеров. И соединения настоящего изобретения или их фармацевтически приемлемые соли могут быть в форме аддукта с водой или с каждым растворителем, следовательно, они также включают такие аддукты. В дополнение, соединения настоящего изобретения также могут включать различные варианты осуществления кристаллов и соединений, в которых часть или все атомы, составляющие соединения, заменены другим изотопом (например, заменяя водород на дейтерий и заменяя 12C на 14C).
[0133] Пункт «пролекарство соединения формулы (I)», используемый в данном документе, означает соединение, которое может быть преобразовано в соединение формулы (I) посредством реакции с ферментом, желудочным соком и т.д., в интравитальных физиологических условиях, т.е. Соединение, которое может быть ферментативно окислено, восстановлено, гидролизовано или каким-то образом преобразовано в соединение формулы (I), и соединение, которое может быть гидролизовано желудочным соком и тому подобное для преобразования в соединение формулы (I).
[0134] «Фармацевтически приемлемая соль», используемая в данном документе, включает, например, соль присоединения основания или соль присоединения кислоты. Соль присоединения основания включает, например, соль щелочного металла, такую как соль натрия и соль калия; соль щелочноземельного металла, такую как соль кальция и соль магния; соль присоединения водорастворимого амина, такую как соль аммония и N-метилглюкамин (меглюмин); и низшую алканоламмониевую соль органического амина. Соль присоединения кислоты включает, например, гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, саххарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, p-толуолсульфонат и памоат[1,1'-метилен-бис-(2-гидрокси-3-нафтоат)].
[0135] Соли настоящего соединения могут быть получены, например, следующим образом. Например, когда настоящее соединение получено в виде соли, его соль может быть получена путем ее прямой очистки. Когда настоящее соединение получено в свободной форме, его соль может быть получена путем его растворения или суспендирования в подходящем органическом растворителе, добавления к нему возможной кислоты или основания, а затем обработки полученной смеси обычным способом.
[0136] Соединение формулы (I), полученное указанными выше способами, может быть выделено/очищено обычным способом, таким как экстракция, хроматографическая колонка, рекристаллизация и повторное осаждения. Экстракционный растворитель, используемый в данном документе, включает, например, диэтиловый эфир, этилацетат, хлорформ, дихлорметан, толуол и тому подобное. Очистку на хроматографической колонке можно проводить кислотой, щелочью или различной химической обработкой силикагеля, алюминия и тому подобное. Элюирующий растворитель, используемый в данном документе, включает, например, гексан/этилацетат, гексан/хлорформ, этилацетат/метанол, хлорформ/метанол, ацетонитрил/вода, метанол/вода и тому подобное.
[0137] Новые соединения настоящего изобретения или их фармацевтически приемлемые соли, имеющие бензимидазольное кольцо, имеют свойство, ингибирующее Nav 1,7, и таким образом могут использоваться в качестве лекарства для лечения или предотвращения боли, вовлекающей периферический нерв, такой как C-волокна и Aδ-волокна, спонтанной боли, такой как онемение, жгучей боли, ноющей боли, покалывающей боли и стреляющей боли, нейропатической боли, сопровождаемой гипералгезией, такой как механическая стимуляция и холодовая стимуляция или аллодиния, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства и т.д. Нейропатическая боль включает, например, диабетическую нейропатию, постгерпетическую невралгию, индуцированную химиотерапией нейропатию, боль, обусловленную раком, поражение чувствительного нерва, вызванное вирусной инфекцией при синдроме имммунодефицита человека, невралгию тройничного нерва, комплексный регионарный болевой синдром, симпатическую рефлекторную дистрофию, невралгию после хирургического вмешательства на пояснице, фантомные боли в ампутированных конечностях, боль после повреждения спинного мозга, персистирующую послеоперационную боль, воспалительную демиелинизирующую полирадикулопатию, алкогольную нейропатию, периферическую нейропатию вследствие ущемления, ятрогенную нейропатию, внезапное сенсорное расстройство, нейропатию, индуцированную недостаточным питанием, нейропатию, индуцированную облучением, радикулопатию, токсическую периферическую нейропатию, посттравматическую периферическую нейропатию, повреждения в виде разрыва плечевого сплетения, невралгию языкоглоточного нерва, аутоиммунную нейропатию и хронический синдром конского хвоста. Ноцицептивная боль или воспалительная боль включает боль в пояснице, абдоминальную боль, хронический ревматоидный артрит, боль, вызванную остеоартритом, миалгию, острую послеоперационную боль, боль при переломах, боль после ожогового поражения и тому подобное. В дополнение, настоящие соединения или их фармацевтически приемлемые соли могут также использоваться в качестве лекарства для лечения или предотвращения дизурии. Дизурия включает частое мочеиспускание, боль в мочевом пузыре, обусловленную гиперплазией простаты, и тому подобное. Кроме того, настоящие соединения или их фармацевтически приемлемые соли могут также использоваться в качестве лекарства для лечения или предотвращения атаксии, развившегося вследствие подавления аномального нервного возбуждения в мозжечке при рассеяном склерозе. В дополнение, настоящие соединения или их фармацевтически приемлемые соли могут представлять собой лекарственное средство, не имеющее побочного действия на сердце или центральную нервную систему, которое представляет собой проблему у существующего медикаментозного лечения, поскольку они имеют селективную ингибирующую активность в отношении Nav 1,7.
[0138] Настоящие соединения можно вводить перорально, парентерально или ректально, а суточная доза может варьировать в зависимости от соединения, режима введения, состояния/возраста пациента и т.д. Для перорального введения, например, настоящие соединения обычно можно вводить в дозировке приблизительно 0,01-1000 мг, предпочтительно приблизительно 0,1-500 мг в день на килограмм массы тела человека или млекопитающего и от одного до нескольких раз. Для парентерального введения, такого как внутривенная инъекция, например, настоящие соединения обычно можно вводить в дозировке приблизительно 0,01-300 мг, предпочтительно приблизительно 1-100 мг на килограмм массы тела человека или млекопитающего.
[0139] Настоящие соединения можно вводить перорально или парентерально непосредственно или в виде содержащей их подходящей готовой формы. Их готовой формой может быть, например, таблетка, капсула, порошок, гранула, жидкость, суспензия, инъекция, пластырь, гелевый пластырь и тому подобное, но без ограничения этим. Готовая форма может быть получена с фармацевтически приемлемыми вспомогательными веществами в известных средствах. Вспомогательные вещества могут быть выбраны для любой цели, включая эксципиент, разрыхлитель, связующее вещество, флюидизирующее вещество, смазывающее вещество, покрывающий агент, солюбилизатор, солюбилизирующий агент, загуститель, диспергирующий агент, стабилизирующий агент, подсластитель, ароматизатор и тому подобное. Конкретно, они включают, например, лактозу, маннитол, микрокристаллическую целлюлозу, низкозамещенную гидроксипропилцеллюлозу, кукурузный крахмал, частично прежелатизированный крахмал, кармеллозу кальция, кроскармеллозу натрия, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилспирт, магния стеарат, натрия стеарилфумарат, полиэтиленгликоль, пропиленгликоль, титана оксид, тальк и тому подобное.
[0140] Настоящие соединения и их фармацевтически приемлемые соли могут использоваться в комбинации, например, с нестероидным противовоспалительным средством, таким как целекоксиб, вольтарен, ибупрофен, локсопрофен, ацетаминофен, диклофенак и дексаметазон и опиоидный аналгетик, такой как трамадол, морфин и оксикодон, для того, чтобы усилить их действие. В дополнение, настоящие соединения и их фармацевтически приемлемые соли также могут использоваться в комбинации с противоэпилептическим средством (таким как прегабалин и карбамазепин), ингибитором альдозоредуктазы (таким как эпалрестат), препаратом производного простагландина (таким как лимапрост альфадекс), антидепрессивным средством (таким как амитриптилин и дулоксетин), противосудорожным агентом, анксиолитическим агентом, агонистом рецептора допамина, антипаркинсоническим агентом, гормональным препаратом, лекарством против головной боли, антагонистом β-адренергического рецептора, лекарственным средством для лечения деменции, лекарственным средством для лечения растройства настроения, и тому подобным. Предпочтительными лекарственными средствами, используемыми в комбинации с настоящим соединением и его фармацевтически приемлемой солью, включают противоэпилептическое средство, такое как прегабалин и карбамазепин, антидепрессивное средство, такое как амитриптилин и дулоксетин, наркотический анальгетик, такой как морфин, оксикодон и трамадол, противовоспалительное средство, такое как ацетаминофен, диклофенак и дексаметазон, ингибитор альдозоредуктазы, такой как эпалрестат, и производное простагландина, такое как лимапрост альфадекс. Для того, чтобы уменьшить их побочные эффекты, настоящие соединения и их фармацевтически приемлемые соли могут использоваться в комбинации с противорвотным лекарственным средством и снотворным лекарственным средством. Интервал введения настоящего соединения и его сопутствующего лекарственного средства не ограничен, т.е. сопутствующее лекарственное средство можно вводить в то же самое время, что и настоящее соединение, или через подходящий интервал. Или настоящее соединение и его сопутствующее лекарственное средство могут быть приготовлены в виде комбинированного лекарственного средства. Доза комбинированного лекарственного средства может быть должным образом определена на основании стандарта используемой в клинической практике его дозы. Соотношение комбинации настоящего соединения и его сопутствующего лекарственного средства может быть должным образом определено на основании пациента-объекта, пути введения, заболевания, патологии, сопутствующего лекарственного средства и т.д. Например, когда пациентом-объектом является человек, сопутствующее лекарственное средство может использоваться, как массовая часть 0,01-1000 на часть настоящего соединения.
Примеры
[0141] Настоящее изобретение далее объясняется более подробно путем ссылки на Примеры и Фармакологические тесты; однако технические рамки настоящего изобретения не ограничены такими Примерами и тому подобным. Хроматография с силикагелем или колоночная хроматография с аминосиликагелем, используемая в рабочих примерах, была продуктом, сделанным YAMAZEN CORPORATION. Каждое соединение идентифицировали по спектру протонного ядерного магнитного резонанса (1H-NMR), высокопроизводительным жидкостным хроматограф-масс-спектрометром (LCMS) и т.д. 1H-NMR измеряли с помощью JNM-LA300 (JEOL) или JNM-AL400 (JEOL).
[0142] Параметры порошковой рентгеновской дифрактометрии состояли в следующем.
Измерительная установка: X'pert-MPD (Spectris Co. Ltd).
Рентгеновский анализ: Cu Kα1/45 кВ/40 мА
Входная щель: 15 мм (Авто)/Щель для предотвращения дивергенции: 15 мм (Авто)
Пробоотборная пластина: неотражающая Si пластина
Размер шага: 0,017°
Диапазон сканирования: 4-40° (2θ)
Время интеграции: 100 секунд/шаг
[0143] Высокопроизводительная жидкостная хроматография-масс-спектрометрия: условие измерения LCMS показано ниже, а обнаруженное значение масс-спектрографии [MS (м/з)] показано как M+H.
MS детектор: ACQITY SQD
HPLC: ACQITY UPLC
Колонка: ACQITY BEH C18 1,7 мкм, 2,1×50 мм
Скорость протекания: 0,75 мл/мин
Длина волны: 254 нм
Подвижная фаза: A: 0,05% водная муравьиная кислота
B: ацетонитрил
Временная программа:
Время шага (мин)
1 0,0-1,3 A:B=90:10 => 1:99
2 1,3-1,5 A:B=1:99
3 1,5-2,0 A:B=90:10
[0144] Если не утверждается иное, соединения исходного материала, реакционные реагенты и растворители, используемые в данном документе, представляли собой имеющиеся на рынке продукты или их получали согласно известным способам.
[0145] В следующих примерах и фармакологических тестах, сокращения, показанные ниже, могут иногда использоваться для упрощения описания настоящего описания. Me: метил, Ac: ацетил, Ph: фенил, THF: тетрагидрофуран, DMF: N,N-диметилформальдегид, NMP: N-метил-2-пирролидинон, DMAP: N,N-диметил-4-аминопиридин, HEPES: 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновая кислота, EGTA: O,O'-бис(2-аминоэтил)этиленгликоль-N,N,N',N'-тетраацетат, AD-mix-β: смесь реагентов гидрохинидин-1,4-фталазинедиил диэфир/калия карбонат/калия феррицианид/калия осмат дигидрат=2/624/624/1 (молярное отношение), Pd/C: палладий/углерод, Pt-S/C: отравленная серой платина/углерод, J: константа взаимодействия, s: синглет, d: дублет, t: триплет, q: квартет, dd: двойной дублет, td: 3 дублета, tt: 3 триплет, m: мультиплет, br: широкий.
[0146] Пример 1: получение 1-[6-(4-фторфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ола (соединение 1)
[0147] Стадия (i): получение 1-[(5-фтор-2-нитрофенил)амино]-2-метилпропан-2-ола (соединение 62)
Смесь соединения 61 (1,59 г), 1-амино-2-метилпропан-2-ола (0,98 г), диизопропилэтиламина (5,22 мл) и DMF (50 мл) встряхивали при 60°C в течение 2 часов. В реакционную смесь добавляли воду и смесь этилацетата/гексана (= 1/1), и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом, а затем концентрировали под давлением восстановления для получения соединения 62 в качестве предварительного продукта.
[0148] Стадия (ii): получение 1-[(5-(4-фторфенокси)-2-нитрофенил]амино)-2-метилпропан-2-ола (соединение 63)
Смесь предварительного продукта соединения 62, полученного на стадии (i), 4-фторфенола (1,68 г), цезия карбоната (6,52 г) и NMP (25 мл) встряхивали при 100°C в течение 2 часов. В реакционную смесь добавляли воду и смесь этилацетата/гексана (= 1/1), и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: гексан/этилацетат=3/1) для получения соединения 63 (3,10 г).
[0149] Стадия (iii): получение 1-{[2-амино-5-(4-фторфенокси)фенил]амино)-2-метилпропан-2-ола (соединение 64)
Смесь соединения 63 (3,10 г), аммония формиата (2,95 г), 10% Pd/C (0,30 г) и метанола (47 мл) встряхивали при 50°C в течение 2 часов. Реакционную смесь фильтровали через целит, и фильтрат концентрировали под давлением восстановления. В остаток добавляли насыщенный водный натрия гидрокарбонат и этилацетат, и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=99/1) для получения соединения 64 (2,70 г).
[0150] Стадия (iv): получение 1-[6-(4-фторфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ола (соединение 1)
Смесь соединения 64 (0,60 г), триметила ортоформиата (1,73 мл) и моногидрата p-толуолсульфоновой кислоты (0,079 г) встряхивали при 60°C в течение 1 часа. В реакционную смесь добавляли насыщенный водный натрия гидрокарбонат и этилацетат, и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=95/5) для получения соединения 1 (0,41 г).
1H-NMR (DMSO-d6) δ: 1,06 (6H, s), 4,08 (2H, s), 4,72 (1H, s), 6,87 (1H, m), 6,96-6,99 (2H, m), 7,17 (2H, m), 7,39 (1H, m), 7,62 (1H, m), 8,09 (1H, s).
XRD ; 2θ=12,1, 13,6, 15,0, 15,2, 16,8, 18,5, 19,1, 19,6, 19,9, 20,1, 20,7, 21,8, 23,5, 24,0, 24,5, 25,2, 26,0, 26,7, 30,4, 34,8
[0151] Пример 2: получение 6-(4-фторфенокси)-1-(тетрагидрофуран-2-илметил)-1H-бензимидазола (соединение 2)
Соединение 2 (0,26 г) получали согласно способу примера 1 путем использования исходного материала, (тетрагидрофуран-2-ил)метанола (0,607 г), вместо 1-амино-2-метилпропан-2-ола.
1H-NMR (DMSO-d6) δ: 1,49 (1H, m), 1,75 (2H, m), 1,94 (1H, m), 3,63 (2H, m), 4,07-4,34 (3H, m), 6,87-6,90 (1H, m), 6,97-7,02 (2H, m), 7,19 (2H, m), 7,35 (1H, m), 7,62 (1H, m), 8,14 (1H, s).
[0152] Пример 3: получение 6-(4-фторфенокси)-1-[2-(пропан-2-илокси)этил]-1H-бензимидазола (соединение 3)
Смесь соединения 65 (0,050 г), полученную согласно примеру 1, с соответствующим исходным материалом, натрия гидридом (0,011 г) и DMF (1,0 мл), встряхивали при 0°C в течение 30 минут. В реакционный раствор добавляли 2-бромпропан (0,045 г), и смесь встряхивали при комнатной температуре дополнительно в течение 2 часов. В реакционную смесь добавляли насыщенный водный аммония хлорид и этилацетат, и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=99/1) для получения соединения 3 (9 мг).
1H-NMR (DMSO-d6) δ: 0,94 (6H, d, J=6,1 Hz), 3,44 (1H, m), 3,64 (2H, t, J=5,0 Hz), 4,30 (2H, t, J=5,0 Hz), 6,87-7,02 (3H, m), 7,18 (2H, m), 7,32 (1H, m), 7,62 (1H, m), 8,13 (1H, s).
[0153] Пример 4: получение 1-[2-(циклопентилокси)этил]-6-(4-фторфенокси)-1H-бензимидазола (соединение 4)
Соединение 4 (0,007 г) получали согласно способу примера 3 путем использования бромциклопентана (0,049 г) вместо 2-бромпропана.
LCMS:T=0,828, м/з=341
[0154] Пример 5: получение 1-[6-(4-фторфенил)-1H-бензимидазол-1-ил]-2-метилпропан-2-ола (соединение 5)
[0155] Стадия (i): получение 1-[(5-бром-2-нитрофенил)амино]-2-метилпропан-2-ола (соединение 67)
Соединение 67 (1,20 г) получали согласно способу стадии (i) в примере 1 путем использования соединения 66 (1,1 г) вместо соединения 61.
[0156] Стадия (ii): получение 1-[(2-амино-5-бромфенил)амино]-2-метилпропан-2-ола (соединение 68)
Соединение 68 (0,811 г) получали согласно способу стадии (iii) в примере 1 путем использования соединения 67 (1,20 г) вместо соединения 63 и 3% Pt-S/C (0,24 г) вместо 10% Pd/C в качестве катализатора.
[0157] Стадия (iii): получение 1-(6-бром-1H-бензимидазол-1-ил)-2-метилпропан-2-ола (соединение 69)
Соединение 69 (0,210 г) получали согласно способу стадии (iv) в примере 1 путем использования соединения 68 (0,259 г) вместо соединения 64 и уксусной кислоты (0,060 г) вместо моногидрата p-толуолсульфоновой кислоты.
[0158] Стадия (iv): получение 1-[6-(4-фторфенил)-1H-бензимидазол-1-ил]-2-метилпропан-2-ола (соединение 5)
Смесь соединения 69 (0,050 г), 4-фторфенилбороновой кислоты (0,052 г), тетракис(трифенилфосфин)палладия (0,043 г) и 1,4-диоксана (1,0 мл) встряхивали при 80°C в течение 1 часа. В реакционную смесь добавляли воду и этилацетат, и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=99/1) для получения соединения 5 (30 мг).
1H-NMR (DMSO-d6) δ: 1,11 (6H, s), 4,20 (2H, s), 4,79 (1H, s), 7,29 (2H, m), 7,45 (1H, m), 7,66-7,76 (3H, m), 7,94 (1H, s), 8,13 (1H, s).
[0159] Примеры 6-10:
Примеры 6-10, показанные в следующей таблице, получали согласно способу примера 5 путем использования каждого соответствующего исходного материала.
[Таблица 1]
| Пример | Химическая структура | Спектральные данные |
| 6 | LCMS:T=0,666, м/з=297 | |
| 7 | LCMS:T=0,831, м/з=347 | |
| 8 | 1H-NMR (DMSO-d6) δ: 1,53-1,82 (3H, m), 1,95-2,00 (1H, m), 3,58-3,79 (2H, m), 4,18-4,51 (3H, m), 7,76 (1H, m), 8,06 (1H, m), 8,29 (3H, m), 8,48 (1H, s), 9,03 (1H, s). | |
| 9 | 1H-NMR (DMSO-d6) δ: 1,12 (6H, s), 4,23 (2H, s), 4,81 (1H, s), 7,55 (1H, m), 7,73 (1H, m), 7,82 (2H, m), 7,94 (2H, m), 8,07 (1H, s), 8,18 (1H, s). | |
| 10 | LCMS:T=1,055, м/з=375 |
[0160] Пример 11: получение 2-метил-1-{6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол-1-ил}пропан-2-ола (соединение 11)
[0161] Стадия (i): получение 2-метил-1-[6-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)-1H-бензимидазол-1-ил]пропан-2-ола (соединение 70)
Смесь соединения 69 (0,10 г), бис(пинаколато)дибора (0,142 г), дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия (0,054 г), калия ацетата (0,146 г) и 1,4-диоксана (2,0 мл) встряхивали при 90°C в течение 2 часов. В реакционную смесь добавляли воду и этилацетат, и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: гексан/этилацетат=8/1) для получения соединения 70 (90 мг).
[0162] Стадия (ii): получение 2-метил-1-{6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол-1-ил}пропан-2-ола (соединение 11)
Смесь соединения 70 (90 мг), 2-бром-5-трифторметилпиридина (0,126 г), 3 моль/л водного натрия карбоната (0,372 мл), тетракис(трифенилфосфин)палладия (86 мг) и 1,4-диоксана (2 мл) встряхивали при 80°C в течение 1 часа. В реакционную смесь добавляли воду и этилацетат, и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: перемешанный растворитель хлорформа и метанола) для получения соединения 11 (40 мг).
1H-NMR (DMSO-d6) δ: 1,13 (6H, s), 4,25 (2H, s), 4,83 (1H, s), 7,74 (1H, m), 8,04 (1H, m), 8,24 (3H, m), 8,49 (1H, s), 9,02 (1H, s).
[0163] Пример 12: получение 1-[2-(циклопентилокси)этил]-6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазола (соединение 12)
[0164] Стадия (i): получение 2-[(5-бром-2-нитрофенил)амино]этан-1-ола (соединение 71)
Соединение 71 (0,698 г) получали согласно способу стадии (i) в примере 5 путем использования 2-аминоэтанола (0,458 г) вместо 1-амино-2-метилпропан-2-ола.
[0165] Стадия (ii): получение 2-[(2-амино-5-бромфенил)амино]этан-1-ола (соединение 72)
Соединение 72 (0,561 г) получали согласно способу стадии (ii) в примере 5 путем использования соединения 71 (0,698 г) вместо соединения 67.
[0166] Стадия (iii): получение 2-(6-бром-1H-бензимидазол-1-ил)этан-1-ола (соединение 73)
Соединение 73 (0,19 г) получали согласно способу стадии (iii) в примере 5 путем использования соединения 72 (0,231 г) вместо соединения 68.
[0167] Стадия (iv): получение 6-бром-1-[2-(циклопентилокси)этил]-1H-бензимидазола (соединение 74)
Соединение 74 (0,025 г) получали согласно способу примера 3 путем использования соединения 73 (0,19 г) вместо соединения 65.
[0168] Стадия (v): получение 1-[2-(циклопентилокси)этил]-6-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)-1H-бензимидазола (соединение 75)
Соединение 75 получали согласно способу стадии (i) в примере 11 путем использования соединения 74 (0,015 г) вместо соединения 69. черновой продукт использовали на следующей стадии без очистки.
[0169] Стадия (vi): получение 1-[2-(циклопентилокси)этил]-6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазола (соединение 12)
Соединение 12 (0,018 г) получали согласно способу стадии (ii) в примере 11 путем использования соединения 75 вместо соединения 70.
LCMS:T=0,974, м/з=376
[0170] Пример 13: получение 2-метил-1-(6-фенокси-1H-бензимидазол-1-ил)пропан-2-ола (соединение 13)
[0171] Стадия (i): получение 4-(бензилокси)-2-фтор-1-нитробензола (соединение 77)
В атмосфере азота калия карбонат (27,1 г) добавляли в раствор соединения 76 (20,5 г) в DMF (326 мл) при комнатной температуре, а затем смесь встряхивали. Реакционную смесь нагревали до 97°C, и бензила бромид (27,9 г) добавляли в нее по каплям в течение 20 минут. Реакционную смесь встряхивали дополнительно в течение 1 часа. В реакционную смесь добавляли этилацетат и воду, и целевой продукт извлекали в органическом слое. Органический слой дважды промывали водой, а затем концентрировали под давлением восстановления. К полученному остатку добавляли толуол (162 мл), и смесь концентрировали под давлением восстановления. (Указанную выше процедуру экстракции повторяли дважды). Полученный остаток промывали в суспензии со смесью этилацетата/гексана (= 1/4) для получения соединения 77 (28,0 г).
[0172] Стадия (ii): получение 1-{[5-(бензилокси)-2-нитрофенил]амино}-2-метилпропан-2-ола (соединение 78)
В атмосфере азота диизопропилэтиламин (32 г) добавляли в раствор соединения 77 (24,5 г) в NMP (248 мл) при комнатной температуре. Реакционную смесь нагревали до 88°C, и 1-амино-2-метилпропан-2-ол (11,48 г) добавляли в нее по каплям в течение 12 минут. Реакционную смесь встряхивали дополнительно в течение 1 часа. В реакционную смесь добавляли этилацетат и воду, и целевой продукт извлекали в органическом слое. Водный слой экстрактировали с этилацетатом, и объединенный органический слой промывали водой. Органический слой концентрировали под давлением восстановления. К полученному остатку добавляли толуол (248 мл), и смесь концентрировали под давлением восстановления. (Указанную выше процедуру экстракции повторяли дважды). К полученному остатку добавляли воду (248 мл) по каплям. Осажденный кристалл собирали на фильтре и сушили для получения соединения 78 (32,8 г).
[0173] Стадия (iii): получение 1-[6-(бензилокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ола (соединение 79)
В раствор соединения 78 (0,5 г) в метаноле (7,9 мл) добавляли триметилортоформиат (4,37 мл), муравьиную кислоту (0,6 мл) и цинк (0,52 г), и смесь встряхивали, нагревая при 70°C в течение 1 часа. Реакционную смесь фильтровали через целит, и фильтрат концентрировали под давлением восстановления. В остаток добавляли водный раствор соли Rochelle (30 мл) и этилацетат (30 мл), и целевой продукт извлекали в органическом слое. Органический слой промывали рассолом, сушили над безводным натрия сульфатом, а затем концентрировали под давлением восстановления для получения соединения 79 (0,45 г).
[0174] Стадия (iv): получение 1-(2-гидрокси-2-метилпропил)-1H-бензимидазол-6-ола (соединение 80)
В раствор соединения 79 (0,5 г) в метаноле (5,6 мл) при комнатной температуре добавляли 10% палладированный уголь (50% содержание воды, 0,1 г), и смесь встряхивали в атмосфере водорода в течение 4 часов. Реакционную смесь фильтровали через целит, и фильтрат концентрировали под давлением восстановления. К полученному остатку добавляли этилацетат/гексан, и смесь промывали в суспензии при комнатной температуре. Полученные кристаллы собирали на фильтре и сушили для получения соединения 80 (0,32 г).
[0175] Стадия (v): получение 2-метил-1-(6-фенокси-1H-бензимидазол-1-ил)пропан-2-ола (соединение 13)
Реакционную смесь соединения 80 (0,10 г), фенилбороновой кислоты (0,118 г), меди ацетата (0,132 г), триэтиламина (0,198 мл) и хлорформа (2,5 мл) встряхивали при 35°C в течение 2 часов. В реакционную смесь добавляли насыщенный водный аммония хлорид и этилацетат, и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=98/2) для получения соединения 13 (0,013 г).
1H-NMR (DMSO-d6) δ: 1,06 (6H, s), 4,08 (2H, s), 4,73 (1H, s), 6,87-6,94 (3H, m), 7,05 (1H, m), 7,33 (2H, m), 7,42 (1H, m), 7,62 (1H, m), 8,09 (1H, s).
[0176] Примеры 14-27:
Примеры 14-27, показанные в следующей таблице, получали согласно способу примера 13 путем использования каждого соответствующего исходного материала.
[Таблица 2]
| Пример | Ra- | Спектральные данные |
| 14 | 1H-NMR (DMSO-d6) δ: 1,06 (6H, s), 2,25 (3H, s), 4,07 (2H, s), 4,72 (1H, s), 6,84 (3H, m), 7,13 (2H, m), 7,36 (1H, m), 7,60 (1H, m), 8,07 (1H, s). | |
| 15 | 1H-NMR (DMSO-d6) δ: 1,14 (6H, s), 4,11 (2H, s), 4,73 (1H, s), 6,95-7,08 (3H, m), 7,53 (1H, m), 7,68 (3H, m), 8,13 (1H, s). | |
| 16 | 1H-NMR (CDCl3) δ: 1,27 (6H, s), 4,12 (2H, s), 6,66 (1H, dt, J=10,4, 2,4 Hz), 6,72-6,79 (2H, m), 7,03 (1H, dd, J=8,9, 2,1 Hz), 7,13 (1H, d, J=1,8 Hz), 7,21-7,27 (1H, m), 7,76 (1H, d, J=8,5 Hz), 8,34 (1H, s). | |
| 17 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 4,16 (2H, s), 6,42-6,54 (3H, m), 7,06 (1H, dd, J=8,5, 2,4 Hz), 7,17 (1H, d, J=1,8 Hz), 7,82 (1H, d, J=9,2 Hz), 8,48 (1H, s). | |
| 18 | 1H-NMR (CDCl3) δ: 1,27 (6H, s), 4,13 (2H, s), 6,66-6,71 (1H, m), 6,77-6,82 (1H, m), 7,00 (1H, dd, J=8,9, 2,1 Hz), 7,06-7,13 (2H, m), 7,77 (1H, d, J=8,5 Hz), 8,39 (1H, s). | |
| 19 | 1H-NMR (CDCl3) δ: 1,27 (6H, s), 3,03 (3H, s), 4,12 (2H, s), 7,01-7,06 (3H, m), 7,17-7,26 (1H, m), 7,79 (1H, d, J=8,5 Hz), 7,85 (2H, d, J=8,5 Hz), 8,28 (1H, s). | |
| 20 | 1H-NMR (DMSO-d6) δ: 1,07 (6H, s), 4,09 (2H, s), 4,73 (1H, s), 6,89-6,96 (3H, m), 7,37 (2H, m), 7,44 (1H, m), 7,64 (1H, m), 8,11 (1H, s). | |
| 21 | 1H-NMR (CDCl3) δ: 1,20 (6H, s), 3,73 (3H, s), 3,96 (2H, s), 6,78-6,82 (2H, m), 6,85-6,90 (3H, m), 6,92 (1H, d, J=1,8 Hz), 7,56 (1H, d, J=9,2 Hz), 7,93 (1H, s). | |
| 22 | 1H-NMR (CDCl3) δ: 1,26 (6H, s), 4,08 (2H, s), 6,93-7,00 (3H, m), 7,09-7,16 (3H, m), 7,73 (1H, d, J=8,5 Hz), 8,17 (1H, s). | |
| 23 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 4,13 (2H, s), 6,96-6,99 (2H, m), 7,03 (1H, dd, J=8,9, 2,1 Hz), 7,18 (1H, d, J=1,8 Hz), 7,55-7,59 (2H, m), 7,81 (1H, d, J=8,5 Hz), 8,33 (1H, s). | |
| 24 | 1H-NMR (DMSO-d6) δ: 1,06 (6H, s), 2,42 (3H, s), 4,08 (2H, s), 4,72 (1H, s), 6,90 (1H, m), 7,23 (2H, m), 7,42 (1H, m), 7,63 (1H, m), 8,09 (1H, s), 8,20 (1H, m). | |
| 25 | 1H-NMR (DMSO-d6) δ: 1,07 (6H, s), 4,11 (2H, s), 4,73 (1H, s), 7,04 (1H, m), 7,44 (1H, m), 7,60 (1H, m), 7,71 (1H, m), 7,85 (1H, m), 8,15 (1H, s), 8,52 (1H, m). | |
| 26 | 1H-NMR (DMSO-d6) δ: 1,07 (6H, s), 2,22 (3H, s), 4,09 (2H, s), 4,72 (1H, s), 6,85-6,91 (2H, m), 7,44 (1H, m), 7,59-7,65 (2H, m), 7,94 (1H, m), 8,09 (1H, s). | |
| 27 | 1H-NMR (CDCl3) δ: 1,25 (6H, s), 1,74 (1H, s), 4,04 (2H, s), 6,96-6,97 (1H, m), 7,11-7,12 (1H, m), 7,22-7,22 (2H, m), 7,73-7,75 (1H, m), 7,96-7,97 (1H, m), 8,11-8,11 (1H, m). |
[0177] Пример 28: получение 2-метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ола (соединение 28)
Реакционную смесь соединения 80 (1,34 г), 2-фтор-5-(трифторметил)пиридина (1,40 г), цезия карбоната (3,18 г) и ацетонитрила (22 мл) встряхивали при 60°C в течение 4 часов. В реакционную смесь добавляли воду и этилацетат, и целевой продукт извлекали в органическом слое. Органический слой сушили над безводным натрия сульфатом и концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=95/5) для получения соединения 28 (1,78 г).
1H-NMR (DMSO-d6) δ: 1,07 (6H, s), 4,11 (2H, s), 4,73 (1H, s), 7,00 (1H, m), 7,18 (1H, m), 7,56 (1H, m), 7,66 (1H, m), 8,13 (1H, s), 8,20 (1H, m), 8,54 (1H, m).
XRD ; 2θ=9,1, 12,9, 13,7, 17,5, 18,0, 18,1, 20,5, 20,8, 21,2, 21,8, 22,3, 23,2, 23,8, 24,6, 24,9, 26,9, 27,3, 28,2, 30,2, 32,5
[0178] Примеры 29-42:
Примеры 29-42, показанные в следующей таблице, получали согласно способу примера 28 путем использования каждого соответствующего исходного материала.
[Таблица 3]
| Пример | Ra- | Спектральные данные |
| 29 | 1H-NMR (CDCl3) δ: 1,22 (6H, s), 4,00 (2H, s), 6,82 (1H, dd, J=9,2, 3,7 Hz), 6,94 (1H, dd, J=8,9, 2,1 Hz), 7,17 (1H, d, J=2,4 Hz), 7,33-7,38 (1H, m), 7,65 (1H, d, J=9,2 Hz), 7,89 (1H, s), 7,92 (1H, d, J=3,1 Hz). | |
| 30 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,65 (1H, s), 4,08 (2H, s), 7,04-7,08 (2H, m), 7,29 (1H, d, J=1,8 Hz), 7,79 (1H, d, J=8,5 Hz), 7,97-7,99 (2H, m), 8,24 (1H, dd, J=4,9, 1,8 Hz). | |
| 31 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,75 (1H, s), 4,07 (2H, s), 7,04 (1H, dd, J=8,9, 2,1 Hz), 7,13 (1H, s), 7,17 (1H, d, J=5,5 Hz), 7,26 (1H, d, J=2,1 Hz), 7,79 (1H, d, J=8,9 Hz), 7,97 (1H, s), 8,29 (1H, d, J=5,5 Hz). | |
| 32 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,69 (1H, s), 4,07 (2H, s), 7,03-7,05 (2H, m), 7,35-7,36 (2H, m), 7,75-7,82 (2H, m), 7,98 (1H, s). | |
| 33 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,95 (1H, s), 4,07 (2H, s), 6,63 (1H, t, J=55,8 Hz), 6,97-7,04 (2H, m), 7,26 (1H, d, J=1,8 Hz), 7,77 (1H, d, J=8,5 Hz), 7,82 (1H, d, J=9,2 Hz), 7,95 (1H, s), 8,24 (1H, s). | |
| 34 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,81 (1H, s), 4,06 (2H, s), 6,86 (1H, d, J=8,5 Hz), 7,02 (1H, dd, J=9,2, 1,8 Hz), 7,23 (1H, d, J=1,8 Hz), 7,60-7,63 (1H, m), 7,76 (1H, d, J=8,5 Hz), 7,95 (1H, s), 8,08 (1H, d, J=2,4 Hz). | |
| 35 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,63 (1H, s), 4,08 (2H, s), 7,10 (1H, dd, J=8,5, 2,1 Hz), 7,30 (1H, d, J=9,8 Hz), 7,39 (1H, d, J=2,1 Hz), 7,78 (1H, d, J=9,8 Hz), 7,82 (1H, d, J=8,5 Hz), 7,98 (1H, s). |
[0179] [Таблица 4]
| Пример | Ra- | Спектральные данные |
| 36 | 1H-NMR (CDCl3) δ: 1,29 (6H, s), 1,66 (1H, s), 4,08 (2H, s), 7,06 (1H, dd, J=8,9, 2,1 Hz), 7,30 (1H, d, J=2,1 Hz), 7,82 (1H, d, J=8,9 Hz), 7,99 (1H, s), 8,40 (1H, s), 8,49 (1H, s). | |
| 37 | 1H-NMR (CDCl3) δ: 1,26 (6H, s), 2,05 (1H, s), 4,03 (2H, s), 7,06 (1H, dd, J=8,5, 2,4 Hz), 7,15 (1H, d, J=9,2 Hz), 7,35 (1H, d, J=2,4 Hz), 7,47 (1H, d, J=9,2 Hz), 7,76 (1H, d, J=8,5 Hz), 7,93 (1H, s). | |
| 38 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,82 (1H, s), 4,07 (2H, s), 7,03-7,06 (1H, m), 7,27-7,27 (1H, m), 7,49-7,51 (1H, m), 7,75-7,77 (1H, m), 7,83-7,83 (1H, m), 7,95 (1H, s). | |
| 39 | 1H-NMR (CDCl3) δ: 1,29 (6H, s), 1,68 (1H, s), 4,08 (2H, s), 7,07 (1H, dd, J=8,9, 2,1 Hz), 7,31 (1H, d, J=2,4 Hz), 7,68 (1H, dd, J=9,5, 2,1 Hz), 7,80 (1H, d, J=8,9 Hz), 7,98 (1H, s), 8,13 (1H, d, J=2,4 Hz). | |
| 40 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,81 (1H, s), 4,07 (2H, s), 7,00-7,03 (2H, m), 7,26 (1H, d, J=2,3 Hz), 7,79 (1H, d, J=8,7 Hz), 7,90 (1H, dd, J=8,7, 2,3 Hz), 7,97 (1H, s), 8,42-8,43 (1H, m). | |
| 41 | 1H-NMR (CDCl3) δ: 1,29 (6H, s), 1,71 (1H, s), 4,08 (2H, s), 7,08 (1H, dd, J=8,5, 2,4 Hz), 7,31 (1H, d, J=2,4 Hz), 7,81 (1H, d, J=8,5 Hz), 7,99 (1H, s), 8,77 (2H, s). | |
| 42 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,70 (1H, s), 4,08 (2H, s), 6,77-6,78 (2H, m), 6,98-7,00 (1H, m), 7,19 (1H, d, J=1,8 Hz), 7,80 (1H, d, J=8,5 Hz), 8,01 (1H, s), 8,19 (1H, d, J=5,5 Hz). |
[0180] Пример 43: получение 2-метил-1-(5-{[6-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ола (соединение 43)
[0181] Стадия (i): получение 4-(бензилокси)-1-хлор-2-нитробензола (соединение 82)
В атмосфере азота калия карбонат (5,97 г) и бензила бромид (5,91 г) добавляли в раствор соединения 81 (5 г) в DMF (56 мл) при комнатной температуре, а затем смесь встряхивали в течение 3 часов. В реакционную смесь добавляли этилацетат и воду, и целевой продукт извлекали в органическом слое. Органический слой промывали рассолом, и сушили над безводным натрия сульфатом. После концентрирования органического слоя под давлением восстановления, остаток очищали посредством колоночной хроматографии с силикагелем (элюат: гексан/этилацетат=90/10) для получения соединения 82 (7,52 г).
[0182] Стадия (ii): получение 1-{[4-(бензилокси)-2-нитрофенил]амино}-2-метилпропан-2-ола (соединение 83)
В атмосфере азота диизопропилэтиламин (5,53 г) и 1-амино-2-метилпропан-2-ол (3,05 г) добавляли в раствор соединения 82 (7,52 г) в NMP (30 мл) при комнатной температуре, и смесь встряхивали при 100°C в течение 1 часа, а затем при 150°C в течение 1 часа. Реакционную смесь оставляли охлаждаться при комнатной температуре, и диизопропилэтиламин (5,53 г) и калия флюорид (1,99 г) добавляли в нее при комнатной температуре. Смесь встряхивали при 150°C в течение 1 часа, а затем при 200°C в течение 40 часов. В реакционную смесь добавляли этилацетат и воду, и целевой продукт извлекали в органическом слое. Органический слой промывали рассолом, и сушили над безводным натрия сульфатом. После концентрирования органического слоя под давлением восстановления, остаток очищали посредством колоночной хроматографии с силикагелем (элюат: гексан/этилацетат=60/40) для получения соединения 83 (5,3 г).
[0183] Стадия (iii): получение 1-[5-(бензилокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ола (соединение 84)
В раствор соединения 83 (5,3 г) в метаноле (85 мл) добавляли триметилортоформиат (44,4 г), муравьиную кислоту (7,71 г) и цинк (5,48 г), и смесь встряхивали при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через целит, и фильтрат концентрировали под давлением восстановления. Остаток очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=95/5) для получения соединения 84 (2,68 г).
[0184] Стадия (iv): получение 1-(2-гидрокси-2-метилпропил)-1H-бензимидазол-5-ола (соединение 85)
В раствор соединения 84 (2,68 г) в метаноле (45 мл) добавляли 10% палладированный уголь (50% содержание воды, 0,53 г), и смесь встряхивали в атмосфере водорода в течение 4 часов. Реакционную смесь фильтровали через целит, и фильтрат концентрировали под давлением восстановления. К полученному остатку добавляли этилацетат, и смесь промывали в суспензии при комнатной температуре. Полученные кристаллы собирали на фильтре и сушили для получения соединения 85 (1,58 г).
[0185] Стадия (v): получение 2-метил-1-(5-{[6-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ола (соединение 43)
В атмосфере азота 2-фтор-6-(трифторметил)пиридин (0,048 г) и цезия карбонат (0,118 г) добавляли в раствор соединения 85 (0,05 г) в NMP (1 мл) при комнатной температуре, и смесь встряхивали при 100°C в течение 3 часов. Реакционную смесь непосредственно очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=95/5) для получения соединения 43 (0,064 г).
1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,83 (1H, br s), 4,14 (2H, s), 6,98 (1H, d, J=8,7 Hz), 7,13 (1H, dd, J=8,7, 2,3 Hz), 7,35 (1H, d, J=7,3 Hz), 7,45 (1H, d, J=8,7 Hz), 7,56 (1H, d, J=1,8 Hz), 7,78 (1H, t, J=8,0 Hz), 8,07 (1H, s).
[0186] Примеры 44-54:
Примеры 44-54, показанные в следующей таблице, получали согласно способу примера 43 путем использования каждого соответствующего исходного материала.
[Таблица 5]
| Пример | R3- | Спектральные данные |
| 44 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,81 (1H, br s), 4,14 (2H, s), 7,00 (1H, d, J=8,7 Hz), 7,10 (1H, dd, J=8,9, 2,1 Hz), 7,48 (1H, d, J=8,7 Hz), 7,56 (1H, d, J=2,3 Hz), 7,87 (1H, dd, J=8,7, 2,7 Hz), 8,08 (1H, s), 8,40-8,42 (1H, m). | |
| 45 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,86 (1H, br s), 4,13 (2H, s), 7,10 (1H, dd, J=8,7, 2,3 Hz), 7,14 (1H, s), 7,16 (1H, d, J=5,0 Hz), 7,47 (1H, d, J=8,7 Hz), 7,55 (1H, d, J=2,3 Hz), 8,02 (1H, s), 8,29 (1H, d, J=5,0 Hz). | |
| 46 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,81 (1H, br s), 4,12 (2H, s), 7,05 (1H, dd, J=7,3, 5,0 Hz), 7,12 (1H, dd, J=8,7, 2,3 Hz), 7,46 (1H, d, J=8,7 Hz), 7,57 (1H, d, J=2,3 Hz), 7,98 (1H, dd, J=8,0, 1,6 Hz), 8,02 (1H, s), 8,25 (1H, dd, J=5,0, 1,4 Hz). | |
| 47 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,86 (1H, br s), 4,11 (2H, s), 6,87-6,90 (1H, m), 6,95 (1H, ddd, J=7,3, 5,0, 0,9 Hz), 7,10 (1H, dd, J=8,7, 2,3 Hz), 7,44 (1H, d, J=8,7 Hz), 7,53 (1H, d, J=2,3 Hz), 7,65 (1H, ddd, J=8,8, 6,7, 1,5 Hz), 8,00 (1H, s), 8,16 (1H, dt, J=5,0, 1,1 Hz). | |
| 48 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,80 (1H, br s), 1,80 (0H, s), 4,12 (2H, s), 6,88 (1H, dd, J=9,1, 3,7 Hz), 7,09 (1H, dd, J=8,7, 2,3 Hz), 7,38-7,46 (2H, m), 7,51 (1H, d, J=2,3 Hz), 7,99 (1H, d, J=2,7 Hz), 8,03 (1H, s). | |
| 49 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,72 (1H, br s), 4,15 (2H, s), 6,87 (1H, d, J=9,1 Hz), 7,11 (1H, dd, J=8,7, 2,3 Hz), 7,47 (1H, d, J=8,7 Hz), 7,55 (1H, d, J=1,8 Hz), 7,62 (1H, dd, J=8,7, 2,7 Hz), 8,08-8,09 (1H, m), 8,17 (1H, br s). | |
| 50 | 1H-NMR (CDCl3) δ: 1,27 (6H, s), 1,88 (1H, br s), 4,12 (2H, s), 7,15 (1H, dd, J=8,7, 2,3 Hz), 7,32 (1H, d, J=9,1 Hz), 7,48 (1H, d, J=8,7 Hz), 7,59 (1H, d, J=2,3 Hz), 7,79 (1H, d, J=9,1 Hz), 7,96 (1H, s). | |
| 51 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,76 (1H, br s), 4,15 (2H, s), 7,11 (1H, dd, J=9,1, 2,3 Hz), 7,51 (1H, d, J=8,7 Hz), 7,60 (1H, d, J=2,3 Hz), 8,12 (1H, s), 8,40 (1H, d, J=0,9 Hz), 8,50 (1H, d, J=0,9 Hz). | |
| 52 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,77 (1H, br s), 4,15 (2H, s), 7,14 (1H, dd, J=8,7, 2,3 Hz), 7,51 (1H, d, J=9,1 Hz), 7,61 (1H, d, J=1,8 Hz), 8,11 (1H, s), 8,77 (2H, d, J=0,9 Hz). | |
| 53 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,70 (1H, br s), 4,16 (2H, s), 7,14 (1H, dd, J=8,9, 2,1 Hz), 7,50 (1H, d, J=9,2 Hz), 7,62 (1H, d, J=2,4 Hz), 7,67 (1H, dd, J=9,5, 2,1 Hz), 8,14 (1H, s), 8,15 (1H, s). | |
| 54 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,70 (1H, br s), 4,15 (2H, s), 7,13 (1H, dd, J=8,7, 2,3 Hz), 7,46-7,52 (2H, m), 7,58 (1H, d, J=2,3 Hz), 7,84 (1H, d, J=2,3 Hz), 8,16 (1H, s). |
[0187] Примеры 55-58:
Примеры 55-58, показанные в следующей таблице, получали согласно способу примера 59 путем использования каждого соответствующего исходного материала.
[Таблица 6]
| Пример | Химическая структура | Спектральные данные |
| 55 | 1H-NMR (CDCl3)δ: 1,48 (2H, d, J=11,6 Hz), 1,75-1,83 (2H, m), 2,69 (1H, br s), 3,72 (2H, td, J=11,6, 1,8 Hz), 3,80 (2H, td, J=5,8, 3,7 Hz), 4,09 (2H, s), 6,98-7,02 (2H, m), 7,27 (1H, d, J=1,8 Hz), 7,69 (1H, d, J=8,5 Hz), 7,89 (1H, dd, J=8,5, 2,4 Hz), 7,89 (1H, s), 8,38 (1H, s). | |
| 56 | 1H-NMR (CDCl3) δ: 4,39 (1H, br s), 4,51 (2H, s), 4,56 (2H, d, J=7,9 Hz), 4,63 (2H, d, J=7,9 Hz), 7,00 (2H, td, J=8,2, 5,9 Hz), 7,36 (1H, d, J=2,4 Hz), 7,66 (1H, d, J=8,5 Hz), 7,89 (1H, dd, J=8,5, 2,4 Hz), 7,94 (1H, s), 8,38 (1H, s). | |
| 57 | 1H-NMR (CDCl3) δ: 0,83 (2H, dd, J=6,6, 5,7 Hz), 1,04 (2H, t, J=6,2 Hz), 1,59 (3H, br s), 4,20 (2H, s), 6,87 (1H, dd, J=8,7, 2,3 Hz), 7,00 (1H, d, J=8,7 Hz), 7,21 (1H, d, J=1,8 Hz), 7,44 (1H, d, J=9,1 Hz), 7,86-7,89 (2H, m), 8,39 (1H, t, J=0,9 Hz). | |
| 58 | 1H-NMR (CDCl3) δ: 1,63-1,73 (1H, m), 1,84-1,92 (1H, m), 2,06 (2H, q, J=10,6 Hz), 2,17 (2H, q, J=7,1 Hz), 4,22 (2H, s), 6,99-7,03 (2H, m), 7,31 (1H, s), 7,75 (1H, d, J=8,5 Hz), 7,88 (1H, dd, J=8,5, 1,8 Hz), 8,02 (1H, s), 8,40 (1H, s). |
[0188] Пример 59: получение 2-метил-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ола (соединение 59)
[0189] Стадия (i): получение 2-метил-4-[(2-нитро-5-{[5-(трифторметил)пиридин-2-ил]окси}фенил)амино]бутан-2-ола (соединение 86)
В раствор соединения 76 (0,35 г) в NMP (7,5 мл) при комнатной температуре добавляли диизопропилэтиламин (1,01 г). В смесь добавляли 4-амино-2-метилбутан-2-ол гидрохлорид (0,37 г), и реакционный раствор нагревали до 110°C и встряхивали в течение 3,5 часов. Реакционный раствор охлаждали до комнатной температуры. В реакционный раствор добавляли цезия карбонат (0,95 г) и 2-фтор-5-(трифторметил)пиридин (0,42 г), и реакционный раствор нагревали до 110°C и встряхивали в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры, в него добавляли этилацетат и воду, и целевой продукт извлекали в органическом слое. Водный слой экстрактировали с этилацетатом, и объединенный органический слой промывали водой. Органический слой концентрировали под давлением восстановления, и остаток очищали посредством колоночной хроматографии с силикагелем (элюат: гексан/этилацетат=65/35) для получения соединения 86 (0,6 г).
[0190] Стадия (ii): получение 2-метил-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ола (соединение 59)
В раствор соединения 86 (0,6 г) в метаноле (7,8 мл) добавляли триметилортоформиат (4,26 мл), муравьиную кислоту (0,6 мл) и цинк (0,51 г), и смесь встряхивали, нагревая при 70°C в течение 2 часов. Реакционную смесь фильтровали через целит, и фильтрат концентрировали под давлением восстановления. Полученный остаток очищали посредством колоночной хроматографии с аминосиликагелем (элюат: хлорформ/метанол=93/7) для получения соединения 59 (0,23 г).
1H-NMR (CDCl3) δ: 1,31 (6H, s), 2,01-2,05 (2H, m), 4,30-4,34 (2H, m), 7,02 (1H, d, J=8,7 Hz), 7,06 (1H, dd, J=8,7, 2,3 Hz), 7,23 (1H, d, J=2,3 Hz), 7,82 (1H, d, J=8,7 Hz), 7,89 (1H, dd, J=8,7, 2,7 Hz), 8,04 (1H, s), 8,42-8,42 (1H, m).
[0191] Пример 60: получение 2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ола (соединение 60)
[0192] Стадия (i): получение 1-{6-[(5-формилпиридин-2-ил)окси]-1H-бензимидазол-1-ил}-2-метилпропан-2-ил ацетата (соединение 87)
В раствор соединения 80 (0,103 г) в DMF (1 мл) добавляли 6-хлорникотинальдегид (85 мг) и цезия карбонат (326 мг), и смесь нагревали при 110°C в течение 1 часа. Реакционную смесь фильтровали, и в фильтрат добавляли DMAP (92 мг) и уксусный ангидрид (0,142 мл). Смесь встряхивали при комнатной температуре в течение 3 дней. В реакционную смесь добавляли воду и этилацетат:гексан=2:1 (о/о), и целевой продукт извлекали в органическом слое (указанную выше процедуру экстракции повторяли три раз). Органический слой концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат: хлорформ/метанол=95/5) для получения соединения 87 (130 мг).
[0193] Стадия (ii): получение 2-метил-1-(6-{[5-(2,2,2-трифтор-1-гидроксиэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ил ацетата (соединение 88)
В раствор соединения 87 (0,13 г) и триметил(трифторметил)силана (0,163 мл) в DMF (3,7 мл) добавляли калия карбонат (0,025 г) и цезия флюорид (0,056 г), и смесь встряхивали при комнатной температуре в течение 2 часов. В реакционную смесь добавляли другой триметил(трифторметил)силан (0,075 мл), и реакционную смесь встряхивали при комнатной температуре дополнительно в течение 1 часа. В реакционную смесь добавляли воду и этилацетат:гексан=2:1 (о/о), и целевой продукт извлекали в органическом слое (указанную выше процедуру экстракции повторяли три раз). Органический слой концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат:хлорформ/метанол=95/5) для получения соединения 88 (0,106 г).
[0194] Стадия (iii): получение 2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ил ацетата (соединение 89)
Раствор соединения 88 (0,1 г) и тиокарбонилдиимидазола (0,051 г) в сухом THF (2 мл) нагревали с обратным холодильником в течение 2 часов. После того, как реакционную смесь оставляли, позволяя охлаждаться при комнатной температуре, реакционную смесь концентрировали под давлением восстановления. В остаток добавляли этилацетат и воду, и целевой продукт извлекали в органическом слое. Органический слой промывали рассолом, сушили над безводным натрия сульфатом, а затем концентрировали под давлением восстановления. Полученный остаток растворяли в сухом толуоле (2 мл) в атмосфере азота, а затем в него добавляли азобисизобутиронитрил (0,008 г) и три-n-бутилтингидрид (0,137 г). Смесь встряхивали при 90°C в течение 1 часа. Реакционную смесь концентрировали под давлением восстановления, а затем остаток очищали посредством колоночной хроматографии с силикагелем (элюат:хлорформ/метанол=95/5) для получения соединения 89 (0,076 мг).
[0195] Стадия (iv): получение 2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ола (соединение 60)
В раствор соединения 89 (0,076 мг) в метаноле (2 мл) добавляли калия карбонат (100 мг), и смесь встряхивали при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали, и фильтрат концентрировали под давлением восстановления. Остаток очищали посредством колоночной хроматографии с силикагелем (элюат:хлорформ/метанол=95/5) для получения соединения 60 (0,055 г).
1H-NMR (CDCl3) 1,22 (6H, s), 3,21-3,29 (2H, m), 4,01 (2H, s), 6,84 (6H, s), 6,94-6,99 (1H, m), 7,21 (2H, s), 7,56 (1H, d, J=8,2 Hz), 7,69 (1H, dd, J=8,7, 2,3 Hz), 7,88 (1H, s), 7,98 (1H, s).
[0196] Примеры 90-115:
Примеры 90-115, показанные в следующей таблице, получали согласно способу примера 1 путем использования каждого соответствующего исходного материала.
[Таблица 7]
| Пример | Химическая структура | Спектральные данные |
| 90 | 1H-NMR (CDCl3) δ: 4,54 (2H, s), 4,58 (4H, dd, J=55,5, 7,9 Hz), 6,93-7,05 (5H, m), 7,14 (1H, d, J=2,4 Hz), 7,64 (1H, d, J=9,2 Hz), 8,27 (1H, d, J=4,3 Hz). | |
| 91 | 1H-NMR (CDCl3) δ: 4,55 (2H, s), 4,58 (4H, dd, J=53,1, 7,9 Hz), 6,89-6,91 (2H, m), 6,99 (1H, dd, J=9,2, 2,4 Hz), 7,19 (1H, d, J=1,8 Hz), 7,26-7,28 (2H, m), 7,65 (1H, d, J=8,5 Hz), 8,26 (1H, s). | |
| 92 | 1H-NMR (CDCl3) δ: 2,32 (3H, s), 4,52 (2H, s), 4,58 (4H, dd, J=55,5, 7,9 Hz), 6,87-6,89 (2H, m), 6,98 (1H, dd, J=8,9, 2,1 Hz), 7,12-7,13 (3H, m), 7,60 (1H, d, J=8,5 Hz), 8,21 (1H, s). | |
| 93 | 1H-NMR (CDCl3) δ: 4,50 (2H, s), 4,59 (4H, dd, J=27,4, 8,2 Hz), 6,95-7,00 (3H, m), 7,24-7,25 (1H, m), 7,53 (2H, d, J=9,1 Hz), 7,64 (1H, d, J=8,7 Hz), 7,96 (1H, s). | |
| 94 | 1H-NMR (CDCl3) δ: 4,57 (2H, s), 4,59 (4H, dd, J=52,5, 7,9 Hz), 6,94-7,02 (3H, m), 7,16 (2H, m), 7,23 (1H, d, J=1,8 Hz), 7,68 (1H, d, J=8,5 Hz), 8,31 (1H, s). XRD ; 2θ=7,7, 11,5, 15,4, 17,4, 17,8, 19,3, 21,2, 21,9, 22,5, 23,1, 23,5, 25,6, 26,1, 27,0, 31,0, 32,3, 33,2, 35,0, 36,0, 39,0 |
|
| 95 | 1H-NMR (CDCl3) δ: 4,58 (2H, s), 4,59 (4H, dd, J=54,3, 7,3 Hz), 6,66 (1H, dd, J=10,4, 2,4 Hz), 6,75-6,79 (2H, m), 7,03 (1H, d, J=9,2 Hz), 7,25-7,27 (2H, m), 7,68 (1H, d, J=8,5 Hz), 8,32 (1H, s). | |
| 96 | 1H-NMR (CDCl3) δ: 4,58 (4H, dd, J=58,0, 7,9 Hz), 4,65 (2H, s), 7,11 (1H, dd, J=8,5, 2,4 Hz), 7,34 (1H, dd, J=8,9, 2,7 Hz), 7,36 (1H, d, J=2,4 Hz), 7,63 (1H, d, J=8,5 Hz), 7,83 (1H, d, J=9,2 Hz), 8,44 (1H, d, J=3,1 Hz), 8,60 (1H, s). | |
| 97 | 1H-NMR (CDCl3) δ: 1,29 (6H, s), 1,99-2,01 (2H, m), 4,28 (2H, t, J=7,6 Hz), 6,94-6,96 (3H, m), 7,08 (1H, s), 7,15 (2H, m), 7,74 (1H, d, J=8,5 Hz), 7,97 (1H, s). | |
| 98 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 2,02 (2H, d, J=13,4 Hz), 4,27-4,30 (2H, br m), 6,66-6,72 (3H, m), 6,99 (1H, d, J=6,1 Hz), 7,10 (1H, s), 7,24 (1H, s), 7,74 (1H, d, J=7,9 Hz), 7,95 (1H, s). | |
| 99 | 1H-NMR (CDCl3) δ: 1,29 (6H, s), 2,00 (2H, t, J=7,9 Hz), 2,31 (3H, s), 4,28 (2H, dd, J=8,9, 7,0 Hz), 6,89 (2H, m), 6,99 (1H, d, J=8,5 Hz), 7,05 (1H, d, J=1,8 Hz), 7,11 (2H, m), 7,72 (1H, d, J=8,5 Hz), 8,12 (1H, s). | |
| 100 | 1H-NMR (CDCl3) δ: 1,29 (6H, s), 2,00 (2H, t, J=7,9 Hz), 4,28 (2H, m), 6,93-7,03 (6H, m), 7,73 (1H, d, J=8,5 Hz), 8,07 (1H, s). | |
| 101 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,99-2,03 (2H, m), 4,28-4,32 (2H, m), 6,90-6,91 (2H, m), 6,98 (1H, dd, J=8,5, 2,4 Hz), 7,07 (1H, d, J=2,4 Hz), 7,26-7,27 (2H, m), 7,75 (1H, d, J=9,2 Hz), 8,12 (1H, br s). XRD ; 2θ=7,7, 15,3, 16,2, 16,4, 17,0, 18,9, 20,2, 20,3, 20,9, 21,2, 23,7, 24,4, 25,4, 27,5, 28,3, 28,6, 29,0, 31,0, 32,0, 34,5 |
|
| 102 | 1H-NMR (CDCl3) δ: 1,26 (6H, s), 1,97-2,01 (2H, m), 4,28-4,32 (2H, m), 6,96-7,01 (3H, m), 7,10 (1H, d, J=2,4 Hz), 7,51 (2H, m), 7,77 (1H, d, J=9,2 Hz), 8,27-8,28 (1H, br m). | |
| 103 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 2,02-2,08 (2H, m), 4,37 (2H, t, J=7,9 Hz), 7,07 (1H, dd, J=8,9, 2,1 Hz), 7,19 (1H, d, J=1,8 Hz), 7,30 (1H, dd, J=8,9, 2,7 Hz), 7,61 (1H, d, J=9,2 Hz), 7,86 (1H, d, J=8,5 Hz), 8,40 (1H, s), 8,46 (1H, d, J=2,4 Hz). | |
| 104 | 1H-NMR (CDCl3) δ: 1,27 (6H, s), 3,27-3,35 (2H, m), 4,03 (2H, s), 6,90-6,97 (3H, m), 7,09 (1H, d, J=2,4 Hz), 7,20 (2H, m), 7,67 (1H, d, J=8,5 Hz), 7,92 (1H, s). | |
| 105 | 1H-NMR (CDCl3) δ: 3,31 (2H, q, J=10,8 Hz), 4,48 (2H, s), 4,59 (4H, dd, J=27,2, 7,6 Hz), 6,91-6,97 (3H, m), 7,19-7,22 (3H, m), 7,60 (1H, d, J=8,5 Hz), 7,93 (1H, s). | |
| 106 | 1H-NMR (DMSO-d6) δ: 4,43 (4H, dd, J=37,5, 7,0 Hz), 4,51 (2H, s), 6,17 (1H, s), 6,91-6,94 (2H, m), 7,36 (1H, dd, J=8,5, 2,4 Hz), 7,40 (1H, d, J=1,8 Hz), 7,64 (1H, d, J=9,2 Hz), 7,75 (1H, d, J=2,4 Hz), 8,26 (1H, s). | |
| 107 | 1H-NMR (CDCl3) δ: 4,08 (1H, s), 4,50 (2H, s), 4,60 (4H, dd, J=31,0, 7,8 Hz), 6,82 (1H, m), 6,93 (1H, m), 7,02 (1H, dd, 2,4, 2,4 Hz), 7,20 (1H, dd, J=2,1, 2,1 Hz), 7,34 (1H, dd, J=8,9, 2,1 Hz), 7,61 (1H, dd, J=8,9, 2,1 Hz), 7,94 (1H, d, J=2,4 Hz). | |
| 108 | LCMS: T=0,782, м/з=399, 401 | |
| 109 | 1H-NMR (CDCl3) δ: 4,48 (2H, s), 4,58 (4H, dd, J=23,5, 7,6 Hz), 6,89-6,94 (2H, m), 7,03-7,06 (1H, m), 7,12 (1H, d, J=2,4 Hz), 7,20 (1H, dd, J=10,4, 2,4 Hz), 7,58 (1H, d, J=9,2 Hz), 7,91 (1H, s). | |
| 110 | 1H-NMR (CDCl3) δ: 4,48 (2H, s), 4,57 (4H, dd, J=11,3, 7,6 Hz), 6,91 (3H, m), 7,07 (1H, d, J=2,4 Hz), 7,20-7,23 (1H, m), 7,66 (1H, d, J=8,5 Hz), 7,95 (1H, s). | |
| 111 | 1H-NMR (CDCl3) δ: 4,19 (1H, br s), 4,51 (2H, s), 4,61 (4H, dd, J=33,0, 7,9 Hz), 6,81 (2H,), 6,94 (1H, dd, J=8,5, 2,4 Hz), 7,03 (1H, dd, J=1,8, 1,8 Hz), 7,22 (1H, d, J=2,4 Hz), 7,61 (1H, d, J=8,5 Hz), 7,95 (1H, s). | |
| 112 | 1H-NMR (CDCl3) δ: 4,51 (2H, s), 4,57-4,59 (4H, m), 6,81 (1H, d, J=2,4 Hz), 6,96-7,02 (2H, m), 7,20 (1H, d, J=1,8 Hz), 7,37 (1H, d, J=8,5 Hz), 7,73 (1H, d, J=8,5 Hz), 8,00 (1H, s). | |
| 113 | 1H-NMR (DMSO-d6) δ: 1,33 (3H, s), 2,63-2,59 (2H, m), 2,54-2,50 (2H, m), 5,28 (1H, s), 7,00 (1H, dd, J=8,8, 2,4 Hz), 7,08 (2H, m), 7,54 (1H, d, J=1,6 Hz), 7,69 (2H, m), 7,71 (1H, d, J=8,8 Hz), 8,39 (1H, s). | |
| 114 | 1H-NMR (DMSO-d6) δ: 4,38 (2H, d, J=6,8 Hz), 4,48 (2H, d, J=6,8 Hz), 4,51 (2H, s), 6,17 (1H, m), 6,97-7,00 (1H, m), 7,23 (1H, d, J=8,8, 2,4 Hz), 7,46 (1H, d, J=2,4 Hz), 7,54 (1H, d, J=2,4 Hz), 7,66 (1H, d, J=8,8 Hz), 8,14 (1H, d, J=8,8 Hz), 8,26 (1H, s), 9,39 (1H, s). | |
| 115 | 1H-NMR (DMSO-d6) δ: 4,38 (2H, d, J=6,8 Hz), 4,48 (2H, d, J=6,8 Hz), 4,52 (2H, s), 6,18 (1H, m), 7,03 (1H, dd, J=8,4, 2,4 Hz), 7,30 (1H, d, J=2,4 Hz), 7,46 (1H, dd, J=8,0, 4,4 Hz), 7,53-7,57 (2H, m), 7,68-7,70 (1H, m), 8,01-8,04 (1H, m), 8,20-8,22 (1H, m), 8,28 (1H, s), 8,78 (1H, dd, J=2,0, 4,4 Hz). |
[0197] Примеры 116-121:
Примеры 116-121, показанные в следующей таблице, получали согласно способу примера 59 путем использования каждого соответствующего исходного материала.
[Таблица 8]
| Пример | Химическая структура | Спектральные данные |
| 116 | 1H-NMR (CDCl3) δ: 1,73 (6H, s), 3,94 (2H, s), 7,00 (2H, m), 7,39 (1H, d, J=2,4 Hz), 7,70 (1H, d, J=8,5 Hz), 7,88 (1H, dd, J=8,9, 2,1 Hz), 7,97 (1H, s), 8,40 (1H, s). | |
| 117 | 1H-NMR (CDCl3) δ: 1,43-1,54 (2H, m), 1,78-1,92 (2H, m), 2,11-2,22 (4H, m), 3,75 (1H, tt, J=10,7, 4,4 Hz), 4,11 (1H, tt, J=12,2, 3,8 Hz), 6,97 (1H, d, J=8,5 Hz), 7,01 (1H, dd, J=8,5, 2,4 Hz), 7,17 (1H, d, J=2,4 Hz), 7,77 (1H, d, J=8,5 Hz), 7,85 (1H, dd, J=8,9, 2,7 Hz), 7,99 (1H, s), 8,37 (1H, d, J=1,8 Hz). | |
| 118 | 1H-NMR (CDCl3) δ: 1,46 (1H, d, J=2,4 Hz), 1,67-1,76 (2H, m), 1,95-2,03 (4H, m), 2,27-2,36 (2H, m), 4,12-4,19 (2H, m), 7,02 (2H, m), 7,22-7,24 (1H, m), 7,82 (1H, d, J=9,2 Hz), 7,88 (1H, dd, J=8,5, 2,4 Hz), 8,04 (1H, s), 8,42 (1H, s). | |
| 119 | 1H-NMR (CDCl3) δ: 1,60-1,87 (8H, m), 4,21 (2H, s), 7,00 (1H, d, J=8,5 Hz), 7,03 (1H, dd, J=8,5, 2,4 Hz), 7,29 (1H, d, J=2,4 Hz), 7,78 (1H, d, J=9,2 Hz), 7,88 (1H, dd, J=8,5, 2,4 Hz), 8,00 (1H, s), 8,40 (1H, s). | |
| 120 | 1H-NMR (CDCl3) δ: 1,28 (6H, s), 1,61 (1H, s), 4,07 (2H, s), 6,94 (1H, d, J=8,5 Hz), 7,04 (1H, dd, J=8,5, 2,4 Hz), 7,25 (1H, d, J=2,4 Hz), 7,53-7,57 (1H, m), 7,79 (1H, d, J=8,5 Hz), 7,96 (1H, s), 8,07 (1H, d, J=3,1 Hz). | |
| 121 | 1H-NMR (DMSO-d6) δ: 1,33 (3H, s), 2,59-2,64 (2H, m), 2,51-2,54 (2H, m), 5,28 (1H, s), 7,02-7,04 (1H, m), 7,20 (1H, d, J=8,8 Hz), 7,56-7,57 (1H, m), 7,68 (1H, d, J=8,8 Hz), 8,21 (1H, dd, J=2,4, 8,8Hz), 8,38 (1H, s), 8,54-8,55 (1H, m). |
[0198] Примеры 122-174:
Примеры 122-174, показанные в следующей таблице, получали согласно способу примера 5 путем использования каждого соответствующего исходного материала.
[Таблица 9]
| Пример | Химическая структура | Спектральные данные |
| 122 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 4,27 (2H, s), 7,53 (1H, d, J=8,5 Hz), 7,69 (1H, d, J=1,2 Hz), 7,76 (1H, d, J=8,5 Hz), 7,93 (1H, d, J=8,5 Hz), 8,06 (1H, dd, J=7,9, 1,8 Hz), 8,45 (1H, d, J=7,9 Hz), 8,96 (1H, d, J=2,4 Hz). | |
| 123 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 4,23 (2H, s), 7,45-7,47 (3H, m), 7,60 (1H, dd, J=7,6, 7,6 Hz), 7,66 (1H, s), 7,88 (1H, d, J=8,5 Hz), 8,36 (1H, s). | |
| 124 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 3,84 (3H, s), 4,22 (2H, s), 7,19 (1H, s), 7,30 (1H, d, J=7,9 Hz), 7,44 (2H, m), 7,62 (1H, s), 7,84 (1H, d, J=8,5 Hz), 8,38 (1H, s). | |
| 125 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 3,97 (3H, s), 4,24 (2H, s), 6,82 (1H, d, J=8,5 Hz), 7,46 (1H, dd, J=8,2, 1,5 Hz), 7,57 (1H, s), 7,81 (1H, dd, J=8,5, 2,4 Hz), 7,85 (1H, d, J=8,5 Hz), 8,38-8,41 (2H, br m). | |
| 126 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 2,62 (3H, s), 4,20 (2H, s), 7,26 (1H, d, J=9,8 Hz), 7,44 (1H, d, J=8,5 Hz), 7,65 (1H, s), 7,84-7,86 (2H, m), 8,09 (1H, s), 8,74 (1H, s). | |
| 127 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 3,57 (4H, t, J=4,9 Hz), 3,84 (4H, t, J=4,9 Hz), 4,24 (2H, s), 6,73 (1H, d, J=8,5 Hz), 7,46 (1H, dd, J=8,2, 1,5 Hz), 7,57 (1H, s), 7,79 (1H, dd, J=8,5, 2,4 Hz), 7,84 (1H, d, J=8,5 Hz), 8,39 (1H, s), 8,46 (1H, d, J=2,4 Hz). | |
| 128 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,73 (1H, br s), 3,78 (3H, s), 4,13 (2H, s), 6,69-6,76 (2H, m), 7,28 (1H, dd, J=7,5, 7,5 Hz), 7,35 (1H, dd, J=8,7, 1,4 Hz), 7,54 (1H, s), 7,78 (1H, d, J=8,7 Hz), 7,96 (1H, s). | |
| 129 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,75 (1H, s), 2,22 (3H, s), 4,11 (2H, s), 7,14-7,20 (3H, m), 7,25 (1H, s), 7,32 (1H, d, J=1,4 Hz), 7,78 (1H, d, J=8,2 Hz), 7,99 (1H, s). | |
| 130 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,86 (1H, s), 4,14 (2H, s), 7,17-7,23 (2H, m), 7,35-7,43 (2H, m), 7,59-7,59 (1H, br m), 7,81 (1H, d, J=8,2 Hz), 7,99 (1H, s). | |
| 131 | 1H-NMR (CDCl3) δ: 1,27 (6H, s), 1,70 (1H, s), 4,10 (2H, s), 7,16 (1H, d, J=8,2 Hz), 7,31 (1H, d, J=8,2 Hz), 7,36 (1H, s), 7,51 (1H, d, J=8,2 Hz), 7,72 (1H, s), 7,77 (1H, d, J=8,2 Hz), 8,01 (1H, s). | |
| 133 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,72 (1H, s), 4,13 (2H, s), 7,23-7,33 (3H, m), 7,49 (2H, m), 7,81 (1H, d, J=7,9 Hz), 8,01 (1H, s). | |
| 133 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,82 (1H, s), 4,15 (2H, s), 7,14 (1H, m), 7,34-7,40 (3H, m), 7,62 (1H, s), 7,82 (1H, d, J=8,5 Hz), 8,01 (1H, s). | |
| 134 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,82 (1H, s), 4,16 (2H, s), 7,19 (1H, dd, J=8,9, 8,9 Hz), 7,39 (1H, dd, J=8,5, 1,8 Hz), 7,42-7,47 (1H, m), 7,54 (1H, d, J=1,8 Hz), 7,62 (1H, dd, J=6,7, 2,4 Hz), 7,80 (1H, d, J=8,5 Hz), 7,99 (1H, s). | |
| 135 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,79 (1H, br s), 3,10 (3H, s), 4,16 (2H, s), 7,42 (1H, m), 7,66-7,71 (2H, m), 7,77 (2H, m), 7,85 (1H, d, J=8,5 Hz), 8,03 (1H, s). | |
| 136 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,80 (1H, s), 4,12 (2H, s), 7,26-7,30 (1H, m), 7,47-7,58 (3H, m), 7,74 (1H, s), 7,79-7,84 (1H, m), 8,00-8,02 (1H, m). | |
| 137 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,75 (1H, s), 4,18 (2H, s), 7,46-7,63 (4H, m), 7,78 (1H, d, J=7,3 Hz), 7,83-7,85 (2H, m), 8,02 (1H, s). | |
| 138 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,58 (1H, s), 4,13 (2H, s), 7,26-7,32 (3H, m), 7,36-7,39 (1H, m), 7,45-7,49 (1H, m), 7,51 (1H, s), 7,79 (1H, d, J=8,5 Hz), 8,00 (1H, s). | |
| 139 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,87 (1H, s), 4,16 (2H, s), 7,28-7,32 (1H, m), 7,36 (1H, m), 7,43-7,49 (2H, m), 7,59 (2H, s), 7,80 (1H, d, J=8,2 Hz), 7,99 (1H, s). | |
| 140 | 1H-NMR (CDCl3) δ: 1,30 (6H, s), 1,69 (1H, s), 4,13 (2H, s), 7,31-7,37 (4H, m), 7,45-7,49 (1H, m), 7,53 (1H, d, J=0,9 Hz), 7,81 (1H, d, J=8,2 Hz), 8,01 (1H, s). | |
| 141 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,84 (1H, s), 4,17 (2H, s), 7,17-7,20 (1H, m), 7,42-7,47 (3H, m), 7,53 (1H, dd, J=7,9, 1,2 Hz), 7,59 (1H, d, J=1,2 Hz), 7,82 (1H, d, J=8,5 Hz), 8,00 (1H, s). | |
| 142 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,76 (1H, s), 3,90 (3H, s), 4,17 (2H, s), 7,09 (1H, s), 7,29 (1H, s), 7,43 (1H, s), 7,46 (1H, dd, J=8,2, 1,5 Hz), 7,59 (1H, s), 7,82 (1H, d, J=8,5 Hz), 8,01 (1H, s). | |
| 143 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,74 (1H, s), 4,17 (2H, s), 7,05 (1H, ddd, J=8,2, 2,1, 2,1 Hz), 7,21 (1H, ddd, J=9,8, 1,8, 1,8 Hz), 7,39 (1H, dd, J=1,5, 1,5 Hz), 7,43 (1H, dd, J=8,5, 1,8 Hz), 7,58 (1H, d, J=1,8 Hz), 7,82 (1H, d, J=8,5 Hz), 8,01 (1H, s). | |
| 144 | 1H-NMR (DMSO-d6) δ: 1,12 (6H, s), 4,16 (2H, s), 4,80 (1H, s), 7,50 (1H, dd, J=8,4, 2,0 Hz), 7,66 (1H, d, J=8,4 Hz), 7,99-8,00 (1H, m), 8,13 (1H, s), 9,16 (1H, s), 9,40 (1H, s). | |
| 145 | 1H-NMR (DMSO-d6) δ: 1,14 (6H, s), 4,25 (2H, s), 4,82 (1H, s), 7,54-7,57 (1H, m), 7,64-7,67 (1H, m), 7,75 (1H, d, J=8,0 Hz), 8,10 (1H, d, J=9,2 Hz), 8,15-8,19 (3H, m), 8,29-8,30 (1H, m), 8,43 (1H, dd, J=8,8, 1,2 Hz), 8,88-8,89 (1H, m). | |
| 146 | 1H-NMR (DMSO-d6) δ: 1,11 (6H, s), 4,16 (2H, s), 4,77 (1H, s), 6,99-7,00 (1H, m), 7,42-7,44 (1H, m), 7,58-7,61 (1H, m), 7,73-7,74 (1H, m), 7,87 (1H, s), 8,08 (1H, s), 8,14-8,15 (1H, m). | |
| 147 | 1H-NMR (DMSO-d6) δ: 1,13 (6H, s), 4,23 (2H, s), 4,80 (1H, s), 7,54 (1H, dd, J=8,4, 2,0 Hz), 7,69 (1H, d, J=8,4 Hz), 7,77-7,80 (1H, m), 7,85 (1H, d, J=8,4 H), 8,05 (1H, d, J=1,2 Hz), 8,12 (1H, d, J=1,2 Hz), 8,14 (1H, s), 8,78 (1H, s). | |
| 148 | 1H-NMR (DMSO-d6) δ: 3,84 (3H, s), 4,42 (2H, d, J=6,7 Hz), 4,54 (2H, d, J=6,7 Hz), 4,59 (2H, s), 6,22 (1H, s), 7,33 (1H, dd, J=8,2, 1,5 Hz), 7,37-7,41 (2H, m), 7,55 (1H, d, J=7,9 Hz), 7,66 (1H, d, J=8,5 Hz), 7,84 (1H, s), 8,28 (1H, s). XRD ; 2θ=6,6, 13,0, 13,2, 13,6, 15,4, 18,0, 18,6, 19,6, 20,0, 21,0, 21,5, 21,8, 23,4, 24,0, 24,9, 25,7, 26,5, 27,5, 27,9, 29,3 |
|
| 149 | 1H-NMR (CDCl3) δ: 4,61 (2H, s), 4,65 (4H, dd, J=20,1, 7,9 Hz), 7,33 (1H, m), 7,46 (2H, m), 7,57 (1H, dd, J=7,9, 7,9 Hz), 7,65 (1H, d, J=8,5 Hz), 7,72 (1H, s), 7,99 (1H, s). | |
| 150 | 1H-NMR (CDCl3) δ: 4,59 (2H, s), 4,65 (4H, dd, J=20,8, 7,9 Hz), 7,23 (1H, d, J=6,7 Hz), 7,48 (1H, d, J=7,9 Hz), 7,57 (1H, dd, J=7,9, 1,2 Hz), 7,62 (1H, d, J=1,2 Hz), 7,66 (1H, d, J=8,5 Hz), 7,75 (1H, d, J=1,2 Hz), 8,00 (1H, s). | |
| 151 | 1H-NMR (CDCl3) δ: 4,56-4,63 (6H, m), 7,14 (1H, dd, J=8,5, 1,2 Hz), 7,30 (1H, d, J=7,9 Hz), 7,47 (1H, s), 7,52 (1H, dd, J=8,2, 2,1 Hz), 7,68 (1H, d, J=8,5 Hz), 7,73 (1H, d, J=2,4 Hz), 8,01 (1H, s). | |
| 152 | 1H-NMR (CDCl3) δ: 4,57-4,68 (6H, m), 7,19-7,25 (3H, m), 7,44-7,48 (1H, m), 7,57 (1H, s), 7,62 (1H, d, J=8,2 Hz), 7,97 (1H, s). | |
| 153 | 1H-NMR (CDCl3) δ: 4,57-4,68 (6H, m), 7,18-7,24 (3H, m), 7,45-7,46 (1H, m), 7,57 (1H, s), 7,62 (1H, d, J=8,2 Hz), 7,97 (1H, s). | |
| 154 | 1H-NMR (CDCl3) δ: 4,49-4,58 (6H, m), 7,10 (1H, dd, J=8,9, 8,9 Hz), 7,23 (1H, dd, J=8,3, 1,5 Hz), 7,31-7,35 (1H, m), 7,48-7,55 (3H, m), 7,87 (1H, s). | |
| 155 | 1H-NMR (CDCl3) δ: 4,60-4,67 (6H, m), 7,36 (1H, dd, J=7,9, 1,8 Hz), 7,42 (1H, dd, J=8,6, 2,4 Hz), 7,50 (1H, d, J=7,9 Hz), 7,65-7,68 (3H, m), 7,99 (1H, s). | |
| 156 | 1H-NMR (CDCl3) δ: 4,58 (2H, s), 4,62-4,67 (4H, m), 7,20 (1H, dd, J=8,3, 1,5 Hz), 7,28-7,29 (2H, m), 7,49 (1H, d, J=1,8 Hz), 7,58 (1H, d, J=1,2 Hz), 7,62 (1H, d, J=8,6 Hz), 7,97 (1H, s). | |
| 157 | 1H-NMR (CDCl3) δ: 4,59 (2H, s), 4,62-4,66 (4H, m), 7,21-7,28 (2H, m), 7,35 (1H, d, J=2,4 Hz), 7,40 (1H, d, J=8,6 Hz), 7,59 (1H, d, J=1,2 Hz), 7,65 (1H, d, J=8,6 Hz), 7,99 (1H, s). | |
| 158 | 1H-NMR (CDCl3) δ: 4,56-4,63 (6H, m), 7,27-7,31 (2H, m), 7,41 (2H, m), 7,58-7,61 (2H, m), 7,93 (1H, s). | |
| 159 | 1H-NMR (CDCl3) δ: 2,25 (3H, s), 4,01 (1H, br s), 4,57-4,67 (6H, m), 7,11-7,18 (3H, m), 7,36 (1H, dd, J=7,0, 2,7 Hz), 7,43 (1H, d, J=1,2 Hz), 7,65 (1H, d, J=8,5 Hz), 7,99 (1H, s). | |
| 160 | 1H-NMR (CDCl3) δ: 2,19 (3H, s), 4,23 (1H, s), 4,58-4,67 (6H, m), 7,13 (1H, dd, J=8,2, 1,5 Hz), 7,17-7,24 (3H, m), 7,44 (1H, d, J=1,8 Hz), 7,64 (1H, d, J=7,9 Hz), 7,99 (1H, s). | |
| 161 | 1H-NMR (CDCl3) δ: 3,80 (1H, s), 4,62-4,67 (6H, m), 7,24-7,30 (1H, m), 7,34 (1H, m), 7,57-7,62 (1H, m), 7,67-7,74 (3H, m), 8,01 (1H, s). | |
| 162 | 1H-NMR (CDCl3) δ: 4,30 (1H, s), 4,60-4,69 (6H, m), 7,21-7,24 (1H, m), 7,52-7,66 (5H, m), 8,00 (1H, s). | |
| 163 | 1H-NMR (CDCl3) δ: 3,90-3,91 (4H, m), 4,61-4,68 (6H, m), 7,10 (1H, s), 7,28 (1H, s), 7,39-7,43 (2H, m), 7,67-7,69 (2H, m), 8,00 (1H, s). | |
| 164 | 1H-NMR (CDCl3) δ: 4,19 (1H, s), 4,62-4,69 (6H, m), 7,37-7,41 (2H, m), 7,56-7,68 (4H, m), 7,98 (1H, s). | |
| 165 | 1H-NMR (CDCl3) δ: 3,79 (1H, s), 4,60-4,66 (6H, m), 7,06 (1H, m), 7,20 (1H, m), 7,36-7,39 (2H, m), 7,67-7,71 (2H, m), 8,01 (1H, s). | |
| 166 | 1H-NMR (CDCl3) δ: 2,30 (3H, d, J=1,8 Hz), 4,24 (1H, s), 4,57-4,68 (6H, m), 7,11 (1H, dd, J=8,5, 1,2 Hz), 7,30 (1H, dd, J=7,9, 7,9 Hz), 7,40 (1H, d, J=7,3 Hz), 7,43 (1H, d, J=1,2 Hz), 7,63-7,67 (2H, m), 8,00 (1H, s). | |
| 167 | 1H-NMR (CDCl3) δ: 3,94 (3H, s), 4,51 (1H, s), 4,57 (2H, s), 4,65 (4H, dd, J=21,7, 7,6 Hz), 6,93-6,97 (2H, m), 7,21-7,28 (2H, m), 7,58-7,60 (2H, m), 7,95 (1H, s). | |
| 168 | 1H-NMR (CDCl3) δ: 3,91 (1H, s), 4,59-4,66 (6H, m), 7,21 (1H, dd, J=8,2, 1,5 Hz), 7,41 (1H, dd, J=7,9, 7,9 Hz), 7,53 (1H, dd, J=7,6, 1,5 Hz), 7,58 (1H, d, J=1,2 Hz), 7,68-7,73 (2H, m), 8,01 (1H, s). | |
| 169 | 1H-NMR (CDCl3) δ: 2,40 (3H, s), 4,60-4,72 (6H, m), 4,78 (1H, s), 7,15 (1H, s), 7,26 (1H, s), 7,32 (1H, dd, J=8,5, 1,8 Hz), 7,36 (1H, s), 7,53 (1H, d, J=7,9 Hz), 7,64 (1H, d, J=1,2 Hz), 7,92 (1H, s). | |
| 170 | 1H-NMR (CDCl3) δ: 1,33 (6H, s), 1,41 (1H, s), 2,04-2,06 (2H, m), 4,35-4,39 (2H, m), 7,12-7,14 (2H, m), 7,44 (1H, dd, J=8,5, 1,8 Hz), 7,51 (1H, d, J=1,2 Hz), 7,56-7,59 (2H, m), 7,82 (1H, d, J=8,5 Hz), 7,93 (1H, s). | |
| 171 | 1H-NMR (CDCl3) δ: 1,33 (6H, s), 1,41 (1H, s), 2,04-2,06 (2H, m), 4,35-4,39 (2H, m), 7,40-7,41 (2H, m), 7,45 (1H, dd, J=8,2, 1,5 Hz), 7,52 (1H, d, J=1,2 Hz), 7,54-7,56 (2H, m), 7,83 (1H, d, J=8,5 Hz), 7,93 (1H, s). | |
| 172 | 1H-NMR (CDCl3) δ: 1,34 (6H, s), 1,36 (1H, s), 2,04-2,06 (2H, m), 4,37-4,41 (2H, m), 7,50 (1H, dd, J=8,5, 1,8 Hz), 7,58 (1H, s), 7,71 (4H, m), 7,86 (1H, d, J=8,5 Hz), 7,96 (1H, s). | |
| 173 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,33 (1H, s), 2,02-2,07 (2H, m), 3,86 (3H, s), 4,33-4,37 (2H, m), 7,19 (1H, d, J=1,2 Hz), 7,30 (1H, dd, J=8,2, 1,5 Hz), 7,40 (1H, dd, J=8,2, 1,5 Hz), 7,46 (1H, d, J=7,9 Hz), 7,53 (1H, d, J=1,2 Hz), 7,82 (1H, d, J=7,9 Hz), 7,94 (1H, s). | |
| 174 | 1H-NMR (CDCl3) δ: 1,33 (6H, s), 2,03-2,07 (2H, m), 4,36-4,40 (2H, m), 7,42-7,50 (3H, m), 7,59-7,64 (2H, m), 7,87 (1H, d, J=8,5 Hz), 7,97 (1H, s). |
[0199] Пример 175: получение 1-[5-(4-фторфенил)-1H-бензимидазол-1-ил]-2-метилпропан-2-ола (соединение 175)
[0200] Стадия (i): получение 1-[(4-бром-2-нитрофенил)амино]-2-метилпропан-2-ола (соединение 175b)
Соединение 175b (4,81 г) получали согласно способу стадии (i) в примере 1 путем использования соединения 175a (5,0 г) вместо соединения 61.
[0201] Стадия (ii): получение 1-(5-бром-1H-бензимидазол-1-ил)-2-метилпропан-2-ола (соединение 175c)
Соединение 175c (3,52 г) получали согласно способу стадии (ii) в примере 59 путем использования соединения 175b (4,80 г) вместо соединения 86.
[0202] Стадия (iii): получение 1-[5-(4-фторфенил)-1H-бензимидазол-1-ил]-2-метилпропан-2-ола (соединение 175)
Соединение 175 (29 мг) получали согласно способу стадии (iv) в примере 5 путем использования соединения 175c (50 мг) вместо соединения 69.
1H-NMR (CDCl3) δ: 1,31 (6H, s), 4,19 (2H, s), 7,10-7,13 (2H, m), 7,49 (2H, m), 7,54-7,57 (2H, m), 7,92 (1H, s), 8,23 (1H, s).
[0203] Примеры 176-223:
Примеры 176-223, показанные в следующей таблице, получали согласно способу примера 175 путем использования каждого соответствующего исходного материала.
[Таблица 10]
| Пример | Химическая структура | Спектральные данные |
| 176 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 3,85 (3H, s), 4,20 (2H, s), 7,18 (1H, s), 7,29 (1H, d, J=7,3 Hz), 7,44 (1H, d, J=7,9 Hz), 7,46-7,51 (2H, m), 7,95 (1H, s), 8,28 (1H, s). | |
| 177 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 3,55-3,57 (4H, m), 3,83-3,85 (4H, m), 4,20 (2H, s), 6,73 (1H, d, J=8,5 Hz), 7,48-7,51 (2H, m), 7,77-7,80 (1H, m), 7,91 (1H, s), 8,28 (1H, s), 8,47 (1H, s). | |
| 178 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 4,20 (2H, s), 7,38-7,41 (2H, m), 7,51-7,55 (4H, m), 7,94 (1H, s), 8,28 (1H, s). | |
| 179 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 4,22 (2H, s), 7,28 (2H, m), 7,52 (2H, m), 7,61 (2H, m), 7,96 (1H, d, J=1,2 Hz), 8,36 (1H, s). | |
| 180 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 4,21 (2H, s), 7,55-7,59 (2H, m), 7,74 (1H, d, J=7,9 Hz), 8,01 (1H, d, J=1,2 Hz), 8,06 (1H, dd, J=8,2, 2,1 Hz), 8,29 (1H, s), 8,96 (1H, d, J=1,8 Hz). | |
| 181 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 4,21 (2H, s), 7,41-7,61 (5H, m), 7,97 (1H, s), 8,31 (1H, s). | |
| 182 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 3,97 (3H, s), 4,20 (2H, s), 6,82 (1H, d, J=8,5 Hz), 7,47-7,52 (2H, m), 7,81 (1H, dd, J=8,5, 1,8 Hz), 7,91 (1H, s), 8,28 (1H, s), 8,40 (1H, d, J=2,4 Hz). | |
| 183 | 1H-NMR (CDCl3) δ: 1,27 (6H, s), 2,56 (3H, s), 4,10 (2H, s), 7,17-7,19 (1H, m), 7,41-7,47 (2H, m), 7,76 (1H, dd, J=8,2, 1,5 Hz), 7,85 (1H, s), 7,98 (1H, s), 8,64 (1H, s). | |
| 184 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 4,21 (2H, s), 7,55 (2H, m), 7,68-7,71 (4H, m), 8,00 (1H, s), 8,29 (1H, s). | |
| 185 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,77 (1H, s), 4,14 (2H, s), 7,29-7,34 (3H, m), 7,47-7,49 (2H, m), 7,80 (1H, d, J=1,2 Hz), 8,01 (1H, s). | |
| 186 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,70 (1H, br s), 3,79 (3H, s), 4,13 (2H, s), 6,69-6,75 (2H, m), 7,26-7,31 (1H, m), 7,39-7,46 (2H, m), 7,88 (1H, d, J=1,2 Hz), 7,97 (1H, s). | |
| 187 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,73 (1H, s), 2,24 (3H, s), 4,15 (2H, s), 7,16-7,21 (3H, m), 7,25 (1H, s), 7,46 (1H, d, J=8,5 Hz), 7,67 (1H, d, J=1,2 Hz), 8,00 (1H, s). | |
| 188 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,81 (1H, s), 4,14 (2H, s), 7,17-7,21 (2H, m), 7,38-7,50 (3H, m), 7,89 (1H, s), 8,00 (1H, s). | |
| 189 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,77 (1H, s), 4,15 (2H, s), 7,11-7,15 (1H, m), 7,33-7,38 (2H, m), 7,44-7,52 (2H, m), 7,91 (1H, s), 8,00 (1H, s). | |
| 190 | 1H-NMR (CDCl3) δ: 1,31 (6H, s), 1,78 (1H, s), 4,14 (2H, s), 7,19 (1H, m), 7,41-7,50 (3H, m), 7,61 (1H, dd, J=6,7, 2,4 Hz), 7,88 (1H, d, J=1,2 Hz), 8,00 (1H, s). | |
| 191 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,64 (1H, s), 4,14 (2H, s), 7,21 (1H, d, J=8,2 Hz), 7,31 (1H, d, J=8,2 Hz), 7,44 (1H, d, J=8,7 Hz), 7,51 (1H, d, J=8,2 Hz), 7,71 (2H, m), 8,02 (1H, br s). | |
| 192 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,75 (1H, s), 4,15 (2H, s), 7,34-7,38 (1H, m), 7,49-7,58 (3H, m), 7,74 (1H, s), 7,84 (1H, s), 8,03 (1H, s). | |
| 193 | 1H-NMR (CDCl3) δ: 1,33 (6H, s), 1,69 (1H, s), 3,14 (3H, s), 4,16 (2H, s), 7,21-7,26 (1H, m), 7,47-7,53 (1H, m), 7,59-7,64 (1H, m), 7,73-7,76 (1H, m), 8,04-8,15 (2H, m), 8,33 (1H, br s). | |
| 194 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,86 (1H, s), 4,15 (2H, s), 7,51-7,58 (4H, m), 7,78 (1H, d, J=7,3 Hz), 7,84 (1H, s), 7,95 (1H, s), 8,00 (1H, s). | |
| 195 | 1H-NMR (CDCl3) δ: 1,33 (6H, s), 1,70 (1H, s), 4,15 (2H, s), 7,25-7,33 (2H, m), 7,37 (1H, s), 7,39 (1H, d, J=1,8 Hz), 7,46-7,49 (2H, m), 7,84 (1H, d, J=1,2 Hz), 8,00 (1H, s). | |
| 196 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,78 (1H, s), 4,14 (2H, s), 7,28 (1H, m), 7,35 (1H, dd, J=7,9, 7,9 Hz), 7,47-7,51 (3H, m), 7,59 (1H, dd, J=1,8, 1,8 Hz), 7,93 (1H, s), 7,99 (1H, s). | |
| 197 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,73 (1H, s), 4,15 (2H, s), 7,34-7,41 (4H, m), 7,45-7,49 (2H, m), 7,86 (1H, d, J=1,2 Hz), 8,00 (1H, s). | |
| 198 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,80 (1H, s), 4,15 (2H, s), 7,16 (1H, d, J=8,5 Hz), 7,42-7,55 (5H, m), 7,94 (1H, s), 8,00 (1H, s). | |
| 199 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,95 (1H, s), 3,89 (3H, s), 4,15 (2H, s), 7,07 (1H, s), 7,28 (1H, s), 7,42 (1H, s), 7,50 (2H, m), 7,92 (1H, s), 8,00 (1H, s). | |
| 200 | 1H-NMR (CDCl3) δ: 1,32 (6H, s), 1,88 (1H, s), 4,14 (2H, s), 7,03 (1H, m), 7,17-7,21 (1H, m), 7,37 (1H, d, J=1,8 Hz), 7,44-7,52 (2H, m), 7,89 (1H, d, J=1,2 Hz), 8,00 (1H, s). | |
| 201 | 1H-NMR (DMSO-d6) δ: 1,12 (6H, s), 4,17 (2H, s), 4,80 (1H, s), 7,59 (1H, dd, J=8,4, 1,6 Hz), 7,73-7,78 (2H, m), 7,83 (1H, d, J=8,8 Hz), 7,93 (1H, d, J=1,6 Hz), 8,07 (1H, d, J=1,6 Hz),8,15 (1H, s), 8,77 (1H, s). | |
| 202 | 1H-NMR (DMSO-d6) δ: 1,10 (6H, s), 4,15 (2H, s), 4,78 (1H, s), 7,56 (1H, dd, J=8,4, 1,2 Hz), 7,71 (1H, d, J=8,4 Hz), 8,01 (1H, d, J=1,2 Hz), 8,13 (1H, s), 9,20 (1H, s), 9,41 (1H, s). | |
| 203 | 1H-NMR (DMSO-d6) δ: 4,43 (2H, d, J=6,8 Hz), 4,55 (2H, d, J=6,8 Hz), 4,61 (2H, s), 6,26 (1H, s), 7,46-7,49 (1H, m), 7,65-7,68 (1H, m), 7,77-7,86 (4H, m), 8,35 (1H, s). | |
| 204 | 1H-NMR (DMSO-d6) δ: 4,43 (2H, d, J=7,2 Hz), 4,54 (2H, d, J=7,2 Hz), 4,59 (2H, s), 6,25 (1H, s), 7,43 (2H, m), 7,57 (1H, dd, J=8,4, 2,0 Hz), 7,78 (1H, d, J=8,4 Hz), 7,81-7,84 (2H, m), 7,92-7,91 (1H, m), 8,30 (1H, s). | |
| 205 | 1H-NMR (CDCl3) δ: 3,84 (3H, s), 4,58-4,65 (6H, m), 7,17 (1H, s), 7,27 (1H, d, J=7,9 Hz), 7,39 (1H, d, J=7,3 Hz), 7,45 (1H, dd, J=8,5, 1,2 Hz), 7,57 (1H, d, J=8,5 Hz), 7,85 (1H, d, J=1,8 Hz), 8,00 (1H, s). | |
| 206 | 1H-NMR (CDCl3) δ: 4,60-4,66 (6H, m), 7,38 (1H, dd, J=8,2, 1,5 Hz), 7,46 (1H, d, J=7,9 Hz), 7,56 (1H, dd, J=7,9, 1,2 Hz), 7,61 (1H, d, J=7,9 Hz), 7,74 (1H, d, J=1,2 Hz), 7,78 (1H, d, J=1,2 Hz), 8,05 (1H, s). | |
| 207 | 1H-NMR (CDCl3) δ: 4,59-4,65 (6H, m), 7,22-7,27 (2H, m), 7,51 (1H, dd, J=8,2, 2,1 Hz), 7,55 (1H, d, J=8,5 Hz), 7,65 (1H, s), 7,72 (1H, d, J=1,8 Hz), 8,02 (1H, s). | |
| 208 | 1H-NMR (CDCl3) δ: 2,25 (3H, s), 3,65 (1H, br s), 4,60-4,66 (6H, m), 7,09-7,16 (2H, m), 7,21 (1H, dd, J=8,5, 1,6 Hz), 7,35 (1H, dd, J=7,8, 1,8 Hz), 7,56 (1H, d, J=8,2 Hz), 7,61 (1H, d, J=0,9 Hz), 8,03 (1H, s). | |
| 209 | 1H-NMR (CDCl3) δ: 2,19 (3H, s), 3,59 (1H, s), 4,59-4,67 (6H, m), 7,16-7,24 (4H, m), 7,56 (1H, d, J=8,7 Hz), 7,60 (1H, d, J=0,9 Hz), 8,01 (1H, s). | |
| 210 | 1H-NMR (CDCl3) δ: 3,37 (1H, d, J=7,3 Hz), 4,61-4,66 (6H, m), 7,22-7,27 (1H, m), 7,47 (1H, m), 7,54-7,59 (1H, m), 7,62 (1H, d, J=8,5 Hz), 7,68 (1H, dd, J=7,3, 1,8 Hz), 7,84 (1H, s), 8,02 (1H, s). | |
| 211 | 1H-NMR (CDCl3) δ: 3,83 (1H, s), 4,61-4,68 (6H, m), 7,37 (1H, dd, J=8,5, 1,2 Hz), 7,50-7,62 (4H, m), 7,71 (1H, d, J=1,8 Hz), 8,02 (1H, s). | |
| 212 | 1H-NMR (CDCl3) δ: 3,87 (3H, s), 4,27 (1H, s), 4,60 (2H, s), 4,68 (4H, dd, J=21,1, 7,6 Hz), 7,05 (1H, s), 7,17 (1H, s), 7,30 (1H, s), 7,46 (1H, dd, J=8,5, 1,8 Hz), 7,59 (1H, d, J=8,5 Hz), 7,68 (1H, d, J=1,2 Hz), 7,94 (1H, s). | |
| 213 | 1H-NMR (CDCl3) δ: 4,46 (1H, s), 4,60 (2H, s), 4,69 (4H, dd, J=23,5, 7,5 Hz), 7,35 (1H, s), 7,43-7,49 (3H, m), 7,58 (1H, d, J=8,7 Hz), 7,64 (1H, s), 7,92 (1H, s). | |
| 214 | 1H-NMR (CDCl3) δ: 3,45 (1H, s), 4,59-4,67 (6H, m), 7,03 (1H, m), 7,14 (1H, m), 7,32 (1H, s), 7,45 (1H, dd, J=8,5, 1,6 Hz), 7,59 (1H, d, J=8,7 Hz), 7,78 (1H, s), 7,99 (1H, s). | |
| 215 | 1H-NMR (CDCl3) δ: 2,30 (3H, d, J=1,2 Hz), 3,80 (1H, s), 4,61-4,67 (6H, m), 7,20 (1H, dd, J=8,2, 1,5 Hz), 7,29 (1H, dd, J=7,6, 7,6 Hz), 7,36 (1H, d, J=6,7 Hz), 7,56-7,64 (3H, m), 8,03 (1H, s). | |
| 216 | 1H-NMR (CDCl3) δ: 3,27 (1H, s), 3,94 (3H, s), 4,60-4,65 (6H, m), 6,95 (2H, m), 7,24-7,28 (1H, m), 7,39 (1H, dd, J=8,2, 1,5 Hz), 7,57 (1H, d, J=8,5 Hz), 7,78 (1H, d, J=1,8 Hz), 8,01 (1H, s). | |
| 217 | 1H-NMR (CDCl3) δ: 3,23 (1H, br s), 4,61-4,64 (7H, m), 7,35 (1H, dd, J=8,2, 1,5 Hz), 7,40 (1H, m), 7,52 (1H, dd, J=7,9, 1,2 Hz), 7,60 (1H, d, J=8,5 Hz), 7,70 (1H, dd, J=7,9, 1,8 Hz), 7,75 (1H, d, J=1,2 Hz), 8,05 (1H, s). | |
| 218 | 1H-NMR (CDCl3) δ: 2,36 (3H, s), 4,56-4,73 (6H, m), 7,13 (2H, m), 7,23-7,25 (1H, m), 7,41 (1H, dd, J=8,2, 1,5 Hz), 7,55 (1H, d, J=8,5 Hz), 7,61 (1H, d, J=1,8 Hz), 7,89 (1H, s). | |
| 219 | 1H-NMR (CDCl3) δ: 1,34 (6H, s), 1,37 (1H, s), 2,03-2,08 (2H, m), 4,34-4,38 (2H, m), 7,11-7,13 (2H, m), 7,44-7,50 (2H, m), 7,56-7,58 (2H, m), 7,93 (2H, s). | |
| 220 | 1H-NMR (CDCl3) δ: 1,33 (6H, s), 1,35 (1H, s), 2,04-2,06 (2H, m), 4,34-4,38 (2H, m), 7,39-7,41 (2H, m), 7,44-7,50 (2H, m), 7,53-7,57 (2H, m), 7,94 (1H, s), 7,95 (1H, s). | |
| 221 | 1H-NMR (CDCl3) δ: 1,34 (6H, s), 1,38 (1H, s), 2,04-2,08 (2H, m), 4,35-4,39 (2H, m), 7,48-7,55 (2H, m), 7,67-7,74 (4H, m), 7,96 (1H, s), 8,01 (1H, d, J=1,2 Hz). | |
| 222 | 1H-NMR (CDCl3) δ: 1,34 (6H, s), 2,04-2,08 (2H, m), 3,85 (3H, s), 4,34-4,38 (2H, m), 7,18 (1H, s), 7,29 (1H, d, J=7,9 Hz), 7,45-7,46 (3H, m), 7,94 (2H, s). | |
| 223 | 1H-NMR (CDCl3) δ: 1,34 (6H, s), 2,04-2,08 (2H, m), 4,36-4,40 (2H, m), 7,42-7,48 (4H, m), 7,59-7,61 (1H, m), 7,96-7,97 (2H, m). |
[0204] Пример 224: получение 1-{5-[2-фтор-4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}-2-метилпропан-2-ола
Соединение 224 (13 мг) получали согласно способу стадии (v) в примере 13 путем использования соединения 85 (50 мг).
LCMS: T=0,743, м/з=369
[0205] Примеры 225 и 226:
Примеры 225 и 226, показанные в следующей таблице, получали согласно способу примера 224 путем использования каждого соответствующего исходного материала.
[Таблица 11]
| Пример | Химическая структура | Спектральные данные |
| 225 | 1H-NMR (DMSO-d6) δ: 1,11 (6H, s), 4,16 (2H, s), 4,79 (1H, s), 7,03-7,07 (3H, m), 7,39 (1H, d, J=2,4 Hz), 7,68 (2H, m), 7,73 (1H, d, J=8,4 Hz), 8,17 (1H, s). | |
| 226 | 1H-NMR (DMSO-d6) δ: 4,43 (2H, d, J=7,2 Hz), 4,54 (2H, d, J=7,2 Hz), 4,58 (2H, s), 6,25 (1H, s), 7,05-7,07 (3H, m), 7,40 (1H, d, J=2,8 Hz), 7,68 (1H, d, J=9,2 Hz), 7,76 (1H, d, J=9,2 Hz), 8,32 (1H, s). |
[0206] Пример 227: получение (2R)-2-метил-3-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-1,2-диола
[0207] Стадия (i): получение N-(2-метилпроп-2-ен-1-ил)-2-нитро-5-{[5-(трифторметил)пиридин-2-ил]окси}анилина (соединение 227a)
Соединение 227a (1,64 г) получали согласно способу стадии (i) в примере 59 путем использования соответствующего исходного материала.
Стадия (ii): получение 1-(2-метилпроп-2-ен-1-ил)-6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазола (соединение 227b)
Соединение 227b (1,25 г) получали согласно способу стадии (ii) в примере 59 путем использования соединения 227a.
Стадия (iii): получение (2R)-2-метил-3-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-1,2-диола (соединение 198)
В атмосфере азота воду (1 мл), AD-mix-β (200 мг) и метансульфонамид (14 мг) добавляли в раствор соединения 227b (50 мг) в трет-бутанoле (1 мл), и реакционную смесь встряхивали при комнатной температуре в течение 5 часов. Реакционную смесь непосредственно очищали посредством колоночной хроматографии с аминосиликагелем (элюат: хлорформ/метанол=95/5) для получения соединения 227 (26 мг).
LCMS: T=0,537, м/з=368
[0208] Пример 228: получение (3R)-2-метил-3-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ола
[0209] Стадия (i): получение трет-бутил[(2R)-3-гидрокси-3-метилбутан-2-ил]карбомата (соединение 228b)
В атмосфере азота 3 моль/л метилмагния бромид/диэтиловый эфир (5,90 мл) добавляли в раствор Boc-D-аланина метилового эфира (1,0 г) в диэтиловом эфире (25 мл) при 0°C, и смесь встряхивали при комнатной температуре в течение 3 часов. Реакционную смесь гасили водным аммония хлоридом, а затем экстрактировали этилацетатом, и органический слой сушили над безводным натрия сульфатом. Концентрированный остаток очищали посредством колоночной хроматографии с силикагелем (элюат:гексан/этилацетат=70/30) для получения соединения 228b (0,86 г).
Стадия (ii): получение (3R)-3-амино-2-метилбутан-2-ол моногидрохлорида (соединение 228c)
В атмосфере азота 4 моль/л соляную кислоту/этилацетат добавляли в раствор соединения 228b (0,86 г) в этилацетате (5 мл), и смесь встряхивали при комнатной температуре в течение 2 часов. Растворитель в реакционной смеси удаляли путем азеотропии толуолом, и полученный остаток промывали в суспензии этилацетатом для получения соединения 228c (0,54 г).
Стадия (iii): получение (3R)-2-метил-3-[(2-нитро-5-{[5-(трифторметил)пиридин-2-ил]окси}фенил)амино]бутан-2-ола (соединение 228d)
Соединение 228d (490 мг) получали согласно способу стадии (i) в примере 59 путем использования соединения 76 (200 мг) и соединения 228c (213 мг).
Стадия (iv): получение (3R)-2-метил-3-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ола (соединение 228)
Соединение 228 (102 мг) получали согласно способу стадии (ii) в примере 59 путем использования соединения 228d (490 мг).
1H-NMR (CDCl3) δ: 1,15 (3H, s), 1,33 (3H, s), 1,64 (3H, d, J=7,3 Hz), 1,73 (1H, s), 4,27 (1H, q, J=7,1 Hz), 7,00 (1H, d, J=9,2 Hz), 7,03 (1H, dd, J=8,9, 2,1 Hz), 7,25 (1H, d, J=2,4 Hz), 7,78 (1H, d, J=8,5 Hz), 7,88 (1H, dd, J=8,5, 2,4 Hz), 8,11 (1H, s), 8,41 (1H, d, J=2,4 Hz).
Пример 229:
Пример 229, показанный в следующей таблице, получали согласно способу примера 228 путем использования соответствующего исходного материала.
[Таблица 12]
| Пример | Химическая структура | Спектральные данные |
| 229 | 1H-NMR (CDCl3) δ: 1,14 (3H, s), 1,33 (3H, s), 1,64 (3H, d, J=7,3 Hz), 1,82 (1H, s), 4,27 (1H, q, J=7,2 Hz), 6,99 (1H, d, J=8,7 Hz), 7,02 (1H, dd, J=8,7, 2,3 Hz), 7,25 (1H, d, J=2,3 Hz), 7,77 (1H, d, J=8,7 Hz), 7,88 (1H, dd, J=8,7, 2,7 Hz), 8,10 (1H, s), 8,41 (1H, s). |
[0210] Пример 28:
2-Метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол (соединение 28) может быть получен следующим образом.
[0211] Стадия (i): получение 2-метил-1-[(2-нитро-5-{[5-(трифторметил)пиридин-2-ил]окси}фенил)амино]пропан-2-ола (соединение 28a)
В раствор соединения 76 (1,00 г) в NMP (16 мл) при комнатной температуре добавляли диизопропилэтиламин (2,06 г). В смесь добавляли 1-амино-2-метилпропан-2-ол (0,74 г), и реакционную смесь нагревали до 100°C и встряхивали в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры, и в него добавляли цезия карбонат (3,11 г) и 2-фтор-5-(трифторметил)пиридин (1,37 г). Реакционную смесь нагревали до 100°C и встряхивали в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры, и в него добавляли этилацетат, гексан и воду. И целевой продукт извлекали в органическом слое. Органический слой промывали водой и сушили над безводным натрия сульфатом. Органический слой концентрировали под давлением восстановления, и полученный остаток промывали в суспензии (элюат:гексан/этилацетат=9/1) для получения соединения 28a (1,53 г).
[0212] Стадия (ii): получение 2-метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ола (соединение 28)
В раствор соединения 28a (0,50 г) в метаноле (6,7 мл) добавляли триметилортоформиат (3,7 мл), муравьиную кислоту (0,52 мл) и цинк (0,44 г), и смесь встряхивали, нагревая при 70°C в течение 2 часов. Реакционную смесь фильтровали через целит, и фильтрат концентрировали под давлением восстановления. Полученный остаток растворяли в этилацетате, промывали водным раствором соли Rochelle и рассолом, и сушили над безводным натрия сульфатом. Концентрированный неочищенный кристалл очищали путем рекристаллизации из гексана/этилацетата (= 1:5) для получения соединения 28 (0,33 г).
[0213] Фармакологический тест
Измерение тока ионов Na в клетках, экспрессирующих ген потенциалзависимого Na-канала
Ток Nav 1,7 измеряли с помощью автоматизированного анализа пэтч-кламп, используя клетки, стабильно экспрессирующие человеческий SCN9A.
[0214] Клетки, стабильно экспрессирующие человеческий SCN9A
Индуцированные тетрациклином клетки, стабильно экспрессирующие SCN9A, получили от ChanTest Corporation. Клетки пересевали в среде Хэма F-12, содержащей 10% фетальную бычью сыворотку, 100 единиц/мл пенициллина-стрептомицина, 0,01 мг/мл бластицидина и 0,4 мг/мл зеоцина. За день перед измерением среду заменили средой Хэма F-12, содержащей 1 мкг/мл тетрациклина, 100 мкмоль/л натрия бутирата, 10% фетальную бычью сыворотку и 100 единиц/мл пенициллина-стрептомицина. На следующий день измеряли ток ионов Na с помощью автоматизированного анализа пэтч-кламп.
[0215] Электрофизиологическое измерение тока ионов Na
Ток ионов Na измеряли с помощью автоматизированного анализа пэтч-кламп, используя следующий внеклеточный раствор и внутриклеточный раствор.
[0216] Внеклеточный раствор (ммоль/л): NaCl 130, MgCl2 2, CaCl2 2, CdCl2 0,1, NiCl2 0,1, тетраэтиламмоний-Cl 18, 4-аминопиридин 1, HEPES 10, (pH 7,4, отрегулированный с помощью NaOH)
[0217] Внутриклеточный раствор (ммоль/л): CsF 120, EGTA 10, NaCl 15, HEPES 10, (pH 7,2, отрегулированный с помощью CsOH)
[0218] Управление стимулирующим импульсом и сбор данных осуществляли с использованием усилителя EPC10 и программного обеспечения Patch Master (HEKA). Данные отбирали при 10 кГц и фильтровали посредством ФНЧ при 3 кГц. Все измерения осуществляли при комнатной температуре. Исходный потенциал устанавливали на потенциальную 50% инактивацию канала Nav 1,7 (приблизительно -60 мВ), и один раз давали деполяризующий импульс 20 миллисекунд (+10 мВ). Норму ингибирования тестируемых соединений вычисляли на основании результатов клеток, пиковый ток которых составлял 500 пА или более, когда давали деполяризующий импульс, и параметр для всех клеток которых не сильно изменялся до конца сбора данных. Норму ингибирования тока ионов Na тестируемыми соединениями вычисляли согласно следующей формуле вычисления с пиковым значением тока, генерируемого деполяризующим импульсом.
Норма ингибирования тока ионов Na (%)=100 x [(пиковое значение тока в отсутствии тестируемого соединения)-(пиковое значение тока в присутствии тестируемого соединения)]/(пиковое значение тока в отсутствии тестируемого соединения)
[0219] Результат:
Оценивали норму ингибирования тока ионов Na соединением каждого примера. Результаты показали, что соединения настоящего изобретения демонстрируют ингибирующий эффект для Nav 1,7. В следующей таблице показана норма ингибирования (%), при этом концентрация каждого соединения составляет 10 мкмоль/л.
[Таблица 13]
| Пример | норма ингибирования (%) | Пример | норма ингибирования (%) | Пример | норма ингибирования (%) | Пример | норма ингибирования (%) |
| 1 | 83 | 2 | 85 | 3 | 65 | 4 | 52 |
| 5 | 39 | 6 | 41 | 7 | 67 | 8 | 32 |
| 9 | 77 | 10 | 52 | 11 | 75 | 12 | 58 |
| 13 | 25 | 14 | 68 | 15 | 57 | 16 | 67 |
| 17 | 31 | 18 | 41 | 19 | 39 | 20 | 91 |
| 21 | 12 | 22 | 73 | 23 | 47 | 24 | 56 |
| 25 | 72 | 26 | 39 | 27 | 31 | 28 | 82 |
| 29※ | 16 | 30 | 42 | 31 | 21 | 32 | 35 |
| 33 | 41 | 34 | 20 | 35 | 39 | 36 | 42 |
| 37 | 44 | 38 | 43 | 39 | 46 | 40 | 42 |
| 41 | 29 | 42 | 31 | 43 | 20 | 44 | 26 |
| 45 | 42 | 46 | 33 | 47 | 38 | 48 | 17 |
| 49※ | 23 | 50 | 25 | 51 | 44 | 52 | 46 |
| 53 | 69 | 54 | 62 | 55 | 37 | 56 | 45 |
| 57 | 47 | 58 | 48 | 59 | 49 | 60 | 52 |
| 90 | 15 | 91 | 24 | 92 | 16 | 93 | 42 |
| 94 | 73 | 95※ | 66 | 96※ | 32 | 97 | 83 |
| 98 | 25 | 99 | 12 | 100 | 10 | 101 | 43 |
| 102 | 59 | 103 | 10 | 104 | 57 | 105 | 38 |
| 106 | 50 | 107 | 51 | 108 | 57 | 109 | 30 |
| 110 | 58 | 111 | 52 | 112 | 39 | 113 | 68 |
| 114 | 26 | 115 | 31 | 116 | 33 | 117※ | 44 |
| 118 | 33 | 119 | 36 | 120 | 13 | 121 | 21 |
| 122 | 14 | 123 | 64 | 124 | 61 | 125 | 13 |
| 126※ | 7 | 127※ | 16 | 128 | 24 | 129 | 51 |
| 130 | 48 | 131 | 62 | 132 | 65 | 133 | 60 |
| 134 | 50 | 135 | 29 | 136 | 70 | 137 | 38 |
| 138 | 34 | 139 | 35 | 140 | 24 | 141 | 53 |
| 142 | 55 | 143 | 35 | 144 | 19 | 145 | 15 |
| 146 | 17 | 147 | 15 | 148 | 59 | 149 | 34 |
| 150 | 47 | 151 | 44 | 152 | 38 | 153 | 25 |
| 154 | 52 | 155 | 55 | 156 | 54 | 157 | 51 |
| 158 | 53 | 159 | 45 | 160 | 25 | 161 | 49 |
| 162 | 63 | 163 | 47 | 164 | 63 | 165 | 35 |
| 166 | 54 | 167 | 71 | 168 | 77 | 169 | 46 |
| 170 | 32 | 171 | 60 | 172 | 64 | 173 | 80 |
| 174 | 66 | 175 | 16 | 176 | 73 | 177 | 54 |
| 178 | 34 | 179 | 61 | 180 | 33 | 181 | 45 |
| 182※ | 11 | 183※ | 30 | 184 | 67 | 185 | 45 |
| 186 | 22 | 187 | 45 | 188 | 51 | 189 | 42 |
| 190 | 42 | 191 | 52 | 192 | 78 | 193 | 23 |
| 194 | 43 | 195 | 31 | 196 | 49 | 197 | 33 |
| 198 | 58 | 199 | 84 | 200 | 52 | 201 | 32 |
| 202 | 21 | 203 | 26 | 204 | 28 | 205 | 46 |
| 206 | 69 | 207 | 65 | 208 | 43 | 209 | 48 |
| 210 | 48 | 211 | 44 | 212 | 55 | 213 | 41 |
| 214 | 42 | 215 | 84 | 216 | 53 | 217 | 60 |
| 218 | 53 | 219 | 40 | 220 | 52 | 221 | 45 |
| 222 | 45 | 223 | 47 | 224 | 53 | 225 | 64 |
| 226 | 45 | 227 | 11 | 228※ | 66 | 229 | 32 |
* Результаты нормы ингибирования в примерах 29, 49, 95, 96, 117, 126, 127, 182, 183 и 228 показывают норму ингибирования (%), при этом концентрация каждого соединения составляет 100 мкмоль/л.
[0220] Тест (2)
Оценка анальгезирующего действия в моделях индуцируемой стрептозотоцином диабетической периферической нейропатии
Используя некоторые типичные соединения среди соединений настоящего изобретения, определили ингибирующий эффект для нейропатической боли через оценку анальгезирующего действия в крысиной модели индуцируемой стрептозотоцином (STZ) диабетической периферической нейропатии.
Животную модель заболевания получали посредством частично модифицированного метода Fox с соавт. (Pain 81, 307-316, 1999). Для получения животной модели диабетической периферической нейропатии 9-месячным самцам крыс Wistar интраперитонеально вводили STZ по 45 мг/кг массы тела. Анальгетический эффект оценивали псредством теста фон Фрея. Конкретно, механическую чувствительность измеряли посредством прикладывания нитей (нитей фон Фрея) к плантарной поверхности задней лапы животноего, а затем определяли порог реакции (50% порог отдергивания лапы) для механической стимуляции посредством использованием формулы на основании Chaplan с соавт. (Journal of Neuroscience Methods 53, 55-63, 1994).
В предварительном исследовании уже было подтверждено, что пороги реакции задних лап животных заметно уменьшались на 21-й день или позже после введения STZ, поэтому оценка анальгетического эффекта с использованием тестируемых соединений проводилась в любой день между 21 днем и на 30 днем после введения STZ. За один и два дня до оценки тестируемых соединений измеряли пороги реакции, чтобы получить их среднее значение, а среднее значение использовали в качестве референсного значения, полученного до введения тестируемых соединений.
Для того, чтобы уменьшить варьирование средних значений между тестируемыми группами и измеренными значениями в каждой группе, животных разделили на 4-5 групп.
В оценочном тестировании тестируемых соединений после введения каждого тестируемого соединения измеряли пороги реакций. За один час перед измерением порогов реакций вводили каждое тестируемое соединение по 3 мг/кг массы тела. Сила анальгезирующего действия каждого тестируемого соединения выражена в виде диапазона ширины (g) порогов реакций, которую получают по формуле расчета (порог реакции, полученный после введения тестируемого соединения)-(порог реакции, полученный перед введением тестируемого соединения).
[0221] Результат:
Как показано в следующей таблице, диапазоны ширины порогов реакций в каждом соединении настоящего изобретения составляли 1,3-6,5 g. Каждое количество в [ ] показывает диапазоны ширины в группах введения растворителя для каждого теста.
[Таблица 14]
| Пример | диапазон ширины (g) | Пример | диапазон ширины (g) |
| 1 | 2,8 [1,8] | 123 | 1,3 [0] |
| 20 | 2,9 [0,9] | 148 | 3,7 [0,4] |
| 28 | 6 [1,9] | 179 | 6,5 [1,4] |
| 59 | 5,1 [0,9] | 181 | 2,5 [1,4] |
| 94 | 4,9 [0,7] | 205 | 1,6 [0,6] |
| 101 | 1,4 [0] | 229 | 3,9 [0,6] |
| 118 | 3,4 [0,4] |
Результат выше показал, что соединения настоящего изобретения демонстрируют хорошее анальгезирующее действие, когда соединения вводят перорально в крысиные модели диабетической периферической нейропатии.
Промышленная Применимость
[0222] Соединения настоящего изобретения можно использовать в качестве лекарства, пригодного для лечения заболевания, поражающего Nav 1,7, например, нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии и рассеянного склероза. Таким образом, соединения настоящего изобретения могут быть весьма полезными лекарственными средствами.
Claims (175)
1. Соединение формулы (I)
или его фармацевтически приемлемая соль, при этом
R1a и R1d представляют собой водород;
R1b и R1c представляют собой независимо водород, галоген, циано, C1-4 алкил, C1-4 алкокси, C1-4 алкиламино (при этом каждый алкильный фрагмент алкила, алкокси и алкиламино может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C3-7 циклоалкил, C3-7 циклоалкокси, C3-7 циклоалкиламино (при этом каждый циклоалкильный фрагмент циклоалкила, циклоалкокси и циклоалкиламино может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси (при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C1-4 алкилтио, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей), при условии, что по меньшей мере один из R1a, R1b, R1c и R1d представляет собой указанный выше C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси,
R2 и R3 представляют собой независимо водород, C1-6 алкил, который может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-10 циклоалкил,
R4 представляет собой водород, C1-6 алкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, или C3-7 циклоалкил, который может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей,
m составляет 1, 2 или 3,
L представляет собой CR7R8 при условии, что, когда m составляет 2 или 3, каждые CR7R8 являются независимо одинаковыми или разными,
R7 и R8 представляют собой независимо водород, гидроксил, C1-4 алкил, C1-4 алкокси (при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), C3-7 циклоалкил или C3-7 циклоалкокси (при этом каждый циклоалкильный фрагмент циклоалкила и циклоалкокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей), или
в R2, R3 и -OR4, R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (II) с -OR4
в формуле (II),
e и f составляют независимо 1, 2 или 3,
R4, как определено выше,
V представляет собой одинарную связь или атом кислорода,
R5a, R5b, R5c и R5d представляют собой водород, или
в R2, R3, -OR4 и CR7R8 в L, R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IV) с R3, -OR4 и R8
в формуле (IV),
m1 составляет 0 или 1,
m2 составляет 0 или 1 и j составляет 1, 2, 3 или 4, когда m1 составляет 1, или
m2 составляет 0, 1 или 2 и j составляет 1, 2, 3 или 4, когда m1 составляет 0,
R3, R4, R8 и L, как определено выше,
R9a, R9b, R9c и R9d представляют собой водород, или
R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (III) с R2
в формуле (III),
h составляет 1, 2, 3 или 4,
R2, как определено выше,
R6a, R6b и R6c представляют собой водород,
при условии, что все из R2, R3 и -OR4 не объединены вместе с образованием кольца,
Группа A заместителей представляет собой независимо галоген, гидроксил, C1-4 алкокси, C3-7 циклоалкил или C3-7 циклоалкокси, и
Группа B заместителей представляет собой независимо галоген, гидроксил, C1-4 алкил, C1-4 алкокси, C3-7 циклоалкил или C3-7 циклоалкокси,
где "гетероарил" представляет собой 5- или 6-членный моноциклический гетероарил, имеющий одинаковые или разные и один или более гетероатомов, выбранных из атомов азота, серы и кислорода;
"гетероарилокси" представляет собой пиридилокси, имидазолилокси или фурилокси;
"гетероциклил" представляет собой оксетанил, азетидинил, пиранил, тетрагидрофуранил, пирролидинил, пиразолидинил, имидазолидинил, пиперидинил, морфолинил, тиоморфолинил, диохотиоморфолинил, гексаметиленеиминил, оксазолидинил, тиазолидинил, имидазолидинил, оксоимидазолидинил, диоксоимидазолидинил, охо-оксазолидинил, диохо-оксазолидинил, диохотиазолидинил, тетрагидропиран или тетрагидропиридинил; и
"гетеробициклил" представляет собой дигидроиндолил, дигидроизоиндолил, дигидропуринил, дигидротиазолопиримидинил, дигидробензодиоксанил, изоиндолинил, индазолил, пирролопиридинил, тетрагидрохинолинил, декагидрохинолинил, тетрагидроизохинолинил, декагидроизохинолинил, тетрагидронафтиридинил или тетрагидропиридо-азепинил;
при условии, что следующие соединения исключены:
6-[6-хлор-2-(морфолин-4-ил)пиримидин-4-ил]-1-(2-метоксиэтил)-1H-бензимидазол,
2-[5-(3,5-диметил-1,2-оксазол-4-ил)-1H-бензимидазол-1-ил]этанол,
2-{5-[5-(тетрагидрофуран-3-ил)-4H-1,2,4-триазол-3-ил]-1H-бензимидазол-1-ил}этанол,
2-{5-[3-(2-метоксиэтил)-1-(2,2,2-трифторэтил)-1H-1,2,4-триазол-5-ил]-1H-бензимидазол-1-ил}этанол,
2-{5-[3-метил-1-(1-метилпиперидин-4-ил)-1H-1,2,4-триазол-5-ил]-1H-бензимидазол-1-ил}этанол,
2-бутил-6-[1-(2-гидроксиэтил)-1H-бензимидазол-6-ил]-3,4-дигидропирроло[1,2-a]пиразин-1(2H)-он,
6-[1-(2-гидроксиэтил)-1H-бензимидазол-6-ил]-2-(3-метилбутил)-3,4-дигидропирроло[1,2-a]пиразин-1(2H)-он,
2-{5-[1-(2-гидроксиэтил)-1H-бензимидазол-5-ил]-1H-1,2,4-триазол-1-ил}этанол,
6-(2-хлорфенил)-1-(2-гидроксиэтил)-1H-бензимидазол-7-карбонитрил,
2-хлор-6-{7-фтор-1-[(1S,3S)-3-метоксициклогексил]-1H-бензимидазол-5-ил}-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин и
2-{5-[2-(тетрагидрофуран-3-ил)-1H-имидазол-1-ил]-1H-бензимидазол-1-ил}этанол.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, при этом
R1a и R1d представляют собой водород;
R1b и R1c представляют собой независимо водород, галоген, циано, C1-4 алкил, C1-4 алкокси (при этом каждый алкильный фрагмент алкила и алкокси может быть независимо замещен одинаковыми или разными и 1-3 галогенами), C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси (при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкил, необязательно замещенный 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей).
3. Соединение по п. 1 или 2 или его фармацевтически приемлемая соль, при этом
R1a и R1d представляют собой водород;
R1b и R1c представляют собой независимо водород, C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, и C1-4 алкил, необязательно замещенный 1-3 заместителями, независимо выбранными из группы A заместителей.
4. Соединение по любому одному из пп. 1-3 или его фармацевтически приемлемая соль, при этом
R2 и R3 представляют собой независимо водород или C1-6 алкил, который может быть независимо замещен 1-5 заместителями, независимо выбранными из группы, состоящей из циано, галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, при условии, что и R2 и R3 не являются водородом, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIa) с -OR4
в формуле (IIa),
e и f составляют независимо 1 или 2,
R4 и V определены в п. 1, и
R5a, R5b, R5c и R5d представляют собой водород или
в R2, R3, -OR4 и CR7R8 в L, R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IVa) с R3, -OR4 и R8
в формуле (IVa),
m1 составляет 0,
m2 составляет 1 или 2,
j составляет 1, 2 или 3,
R3, как определено выше,
R4, R8 и L определены в п. 1, а
R9a, R9b, R9c и R9d представляют собой водород.
5. Соединение по любому одному из пп. 1-4 или его фармацевтически приемлемая соль, при этом
R2 и R3 представляют собой независимо C1-6 алкил, необязательно замещенный одинаковыми или разными и 1-5 галогенами, или
R2 и R3 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIb) с -OR4
в формуле (IIb),
e и f составляют независимо 1 или 2,
R4 и V определены в п. 1, и
R5a, R5b, R5c и R5d представляют собой водород или
в R2, R3, -OR4 и CR7R8 в L,
R2 и R7 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IVa) с R3, -OR4 и R8
в формуле (IVa),
m1 составляет 0,
m2 составляет 1 или 2,
j составляет 1, 2 или 3,
R4 представляет собой водород,
R8 и L определены в п. 1, а
R9a, R9b, R9c и R9d представляют собой водород.
6. Соединение по любому одному из пп. 1-5 или его фармацевтически приемлемая соль, при этом
R2 и R3 представляют собой независимо водород или C1-6 алкил, необязательно замещенный одинаковыми или разными и 1-5 галогенами, и R2 и R3 не объединены вместе с атомом углерода, с которым они соединены с образованием кольца.
7. Соединение по любому одному из пп. 1-3 и 6 или его фармацевтически приемлемая соль, при этом
R4 представляет собой водород, C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами, или C3-7 циклоалкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, или
R3 и -OR4 могут быть объединены вместе с атомом углерода, с которым они соединены с образованием следующей группы формулы (IIIa) с R2
в формуле (IIIa),
h составляет 1, 2 или 3,
R2 по п. 1,
R6a, R6b и R6c представляют собой водород.
8. Соединение по любому одному из пп. 1-7 или его фармацевтически приемлемая соль, при этом
R4 представляет собой водород, C1-4 алкил, необязательно замещенный одинаковыми или разными и 1-3 галогенами, или C3-7 циклоалкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила и C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и R3 и -OR4 не объединены вместе с атомом углерода, с которым они соединены с образованием кольца.
9. Соединение по любому одному из пп. 1-8 или его фармацевтически приемлемая соль, при этом R4 представляет собой водород.
10. Соединение по любому одному из пп. 1-9 или его фармацевтически приемлемая соль, при этом
R7 и R8 представляют собой независимо водород или C1-4 алкил, который может быть замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C3-7 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, C3-7 циклоалкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и 3-7-членного неароматического гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы B заместителей, и
m составляет 1 или 2.
11. Соединение по любому одному из пп. 1-10 или его фармацевтически приемлемая соль, при этом R7 и R8 представляют собой водород, а m составляет 1.
12. Соединение по любому одному из пп. 1-11 или его фармацевтически приемлемая соль, при этом
R1b или R1c представляет собой C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
13. Соединение по любому одному из пп. 1-12 или его фармацевтически приемлемая соль, при этом
R1b представляет собой C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
14. Соединение по любому одному из пп. 1-12 или его фармацевтически приемлемая соль, при этом
R1c представляет собой C6-10 арил, C6-10 арилокси, 5-12-членный гетероарил или 5-12-членный гетероарилокси, при этом каждый арильный фрагмент арила и арилокси и каждый гетероарильный фрагмент гетероарила и гетероарилокси может быть независимо замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-4 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, C1-4 алкокси, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей, и C1-4 алкилсульфонила, необязательно замещенного 1-3 заместителями, независимо выбранными из группы A заместителей.
15. Соединение по п. 1 или его фармацевтически приемлемая соль, которое выбирают из следующих соединений:
1-[6-(4-фторфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
6-(4-фторфенокси)-1-(тетрагидрофуран-2-илметил)-1H-бензимидазол,
1-(тетрагидрофуран-2-илметил)-6-[4-(трифторметил)фенил]-1H-бензимидазол,
2-метил-1-{6-[4-(трифторметил)фенил]-1H-бензимидазол-1-ил}пропан-2-ол,
1-[2-(циклопентилокси)этил]-6-[4-(трифторметил)фенил]-1H-бензимидазол,
2-метил-1-{6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол-1-ил}пропан-2-ол,
1-[2-(циклопентилокси)этил]-6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол,
2-метил-1-[6-(4-метилфенокси)-1H-бензимидазол-1-ил]пропан-2-ол,
2-метил-1-{6-[4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
1-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
2-метил-1-{6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
2-метил-1-{6-[(6-метилпиридин-3-ил)окси]-1H-бензимидазол-1-ил}пропан-2-ол,
2-метил-1-(6-{[6-(трифторметил)пиридин-3-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
2-метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
2-метил-1-(5-{[5-(трифторметил)пиразин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
2-метил-1-(5-{[5-(трифторметил)пиримидин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
1-(5-{[3-фтор-5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)-2-метилпропан-2-ол,
1-{5-[(5-хлор-3-фторпиридин-2-ил)окси]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
3-[(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)метил]оксетан-3-ол,
1-[(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)метил]циклобутанoл,
2-метил-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол,
2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
3-({6-[4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
3-({6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
4-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилбутан-2-ол,
3-{[6-(2-хлор-4-фторфенокси)-1H-бензимидазол-1-ил]метил}оксетан-3-ол,
цис-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)циклогексанол,
1-{6-[2-фтор-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
1-[6-(4-хлор-2-фторфенил)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
3-({6-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
4-{6-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилбутан-2-ол,
1-{5-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
2-метил-1-{5-[4-(трифторметокси)фенил]-1H-бензимидазол-1-ил}пропан-2-ол,
1-{5-[2-фтор-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
3-({5-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}метил)оксетан-3-ол, и
(3S)-2-метил-3-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол.
16. Соединение по п. 1 или его фармацевтически приемлемая соль, которое выбирают из следующих соединений:
1-[6-(4-фторфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
2-метил-1-{6-[4-(трифторметил)фенил]-1H-бензимидазол-1-ил}пропан-2-ол,
2-метил-1-{6-[5-(трифторметил)пиридин-2-ил]-1H-бензимидазол-1-ил}пропан-2-ол,
2-метил-1-{6-[4-(трифторметил)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
1-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилпропан-2-ол,
2-метил-1-{6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}пропан-2-ол,
2-метил-1-{6-[(6-метилпиридин-3-ил)окси]-1H-бензимидазол-1-ил}пропан-2-ол,
2-метил-1-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
2-метил-1-(5-{[5-(трифторметил)пиразин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
1-(5-{[3-фтор-5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)-2-метилпропан-2-ол,
2-метил-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол,
2-метил-1-(6-{[5-(2,2,2-трифторэтил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)пропан-2-ол,
3-({6-[4-(трифторметокси)фенокси]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
4-[6-(4-хлорфенокси)-1H-бензимидазол-1-ил]-2-метилбутан-2-ол,
цис-4-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)циклогексанол,
1-{6-[2-фтор-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}-2-метилпропан-2-ол,
3-({6-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}метил)оксетан-3-ол,
3-({5-[2-метокси-4-(трифторметил)фенил]-1H-бензимидазол-1-ил}метил)оксетан-3-ол, и
(3S)-2-метил-3-(6-{[5-(трифторметил)пиридин-2-ил]окси}-1H-бензимидазол-1-ил)бутан-2-ол.
17. Лекарственное средство для лечения заболевания, вовлекающего Nav 1,7 (SCN9A), содержащее соединение по любому одному из пп. 1-16 или его фармацевтически приемлемую соль в качестве активного ингредиента.
18. Лекарственное средство для лечения заболевания, вовлекающего Nav 1,7 (SCN9A), выбранного из нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии и рассеянного склероза, которое содержит соединение по любому одному из пп. 1-16 или его фармацевтически приемлемую соль в качестве активного ингредиента.
19. Применение соединения по любому одному из пп. 1-16 или его фармацевтически приемлемая соль при производстве лекарства для лечения заболевания, вовлекающего Nav 1,7 (SCN9A), выбранного из нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии и рассеянного склероза.
20. Способ лечения заболевания, вовлекающего Nav 1,7 (SCN9A), выбранного из нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии мелких волокон, эритромелалгии, пароксизмального чрезмерного болевого расстройства, дизурии и рассеянного склероза, который включает введение терапевтически эффективного количества соединения по любому одному из пп. 1-16 или его фармацевтически приемлемой соли нуждающемуся в них млекопитающему.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015-179663 | 2015-09-11 | ||
| JP2015179663 | 2015-09-11 | ||
| PCT/JP2016/076645 WO2017043636A1 (ja) | 2015-09-11 | 2016-09-09 | 新規ベンズイミダゾール化合物およびその医薬用途 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2018105683A RU2018105683A (ru) | 2019-10-14 |
| RU2018105683A3 RU2018105683A3 (ru) | 2019-12-26 |
| RU2775673C2 true RU2775673C2 (ru) | 2022-07-06 |
Family
ID=
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040010141A1 (en) * | 2002-04-26 | 2004-01-15 | Pfizer Inc. | N-substituted-heteroaryloxy-aryl-spiro-pyrimidine-2,4,6-trione metalloproteinase inhibitors |
| US20050272765A1 (en) * | 2004-06-04 | 2005-12-08 | Jun Feng | Dipeptidyl peptidase inhibitors |
| RU2010118481A (ru) * | 2007-10-11 | 2011-11-20 | Вертекс Фармасьютикалз Инкорпорейтед (Us) | Амиды, применимые в качестве ингибиторов потенциалзависимых натриевых каналов |
| US20130274243A1 (en) * | 2012-02-03 | 2013-10-17 | Pfizer Limited | Chemical Compounds |
| US20130296281A1 (en) * | 2010-06-16 | 2013-11-07 | Purdue Pharma L.P. | Aryl Substituted Indoles and Their Use as Blockers of Sodium Channels |
| US20140275011A1 (en) * | 2013-03-13 | 2014-09-18 | Abbvie Inc. | Pyridine cdk9 kinase inhibitors |
| WO2015008861A1 (ja) * | 2013-07-19 | 2015-01-22 | 大日本住友製薬株式会社 | 新規イミダゾピリジン化合物 |
| US20150133500A1 (en) * | 2013-11-08 | 2015-05-14 | Purdue Pharma L.P. | Benzimidazole derivatives and use thereof |
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040010141A1 (en) * | 2002-04-26 | 2004-01-15 | Pfizer Inc. | N-substituted-heteroaryloxy-aryl-spiro-pyrimidine-2,4,6-trione metalloproteinase inhibitors |
| US20050272765A1 (en) * | 2004-06-04 | 2005-12-08 | Jun Feng | Dipeptidyl peptidase inhibitors |
| RU2010118481A (ru) * | 2007-10-11 | 2011-11-20 | Вертекс Фармасьютикалз Инкорпорейтед (Us) | Амиды, применимые в качестве ингибиторов потенциалзависимых натриевых каналов |
| US20130296281A1 (en) * | 2010-06-16 | 2013-11-07 | Purdue Pharma L.P. | Aryl Substituted Indoles and Their Use as Blockers of Sodium Channels |
| US20130274243A1 (en) * | 2012-02-03 | 2013-10-17 | Pfizer Limited | Chemical Compounds |
| US20140275011A1 (en) * | 2013-03-13 | 2014-09-18 | Abbvie Inc. | Pyridine cdk9 kinase inhibitors |
| WO2015008861A1 (ja) * | 2013-07-19 | 2015-01-22 | 大日本住友製薬株式会社 | 新規イミダゾピリジン化合物 |
| US20150133500A1 (en) * | 2013-11-08 | 2015-05-14 | Purdue Pharma L.P. | Benzimidazole derivatives and use thereof |
Non-Patent Citations (1)
| Title |
|---|
| HAY D.A. et al. Discovery and Optimization of Small-Molecule Ligands for the CBP/p300 Bromodomains, J. Am. Chem. Soc., 2014, v. 136, no. 26, p. 9308-9319. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3348547B1 (en) | Benzimidazole derivatives as nav 1.7 (sodium channel, voltage-gated, type ix, alpha subunit (scn9a)) inhibitors for treating pain, dysuria and multiple sclerosis | |
| RU2775673C2 (ru) | Новое соединение бензимидазола и его медицинское применение | |
| JP7165501B2 (ja) | 新規ベンズイミダゾール化合物からなる医薬 | |
| KR102614535B1 (ko) | 중수소화 벤즈이미다졸 화합물 및 그의 의약 용도 | |
| KR102606737B1 (ko) | 신규 벤즈이미다졸론 화합물 및 그의 의약 용도 | |
| RU2468009C2 (ru) | Ингибитор связывания s1p1 | |
| EP1156047B1 (en) | 6-substituted-7- heteroquinoxaline carboxylic acid derivatives and addition salts thereof and processes for the preparation of both | |
| RU2804319C2 (ru) | Дейтеризованное бензимидазольное соединение и его медицинское применение | |
| HK1251225B (en) | Benzimidazole derivatives as nav 1.7 (sodium channel, voltage-gated, type ix, alpha subunit (scn9a)) inhibitors for treating pain, dysuria and multiple sclerosis | |
| HK40019705A (en) | Deuterated benzimidazole compound and medicinal use thereof | |
| HK40019697A (en) | Novel benzimidazolone compound and pharmaceutical use thereof |