RU2730497C1 - 2,4,5-три(метоксифенил) цис-имидазолин и способ их получения - Google Patents
2,4,5-три(метоксифенил) цис-имидазолин и способ их получения Download PDFInfo
- Publication number
- RU2730497C1 RU2730497C1 RU2019124301A RU2019124301A RU2730497C1 RU 2730497 C1 RU2730497 C1 RU 2730497C1 RU 2019124301 A RU2019124301 A RU 2019124301A RU 2019124301 A RU2019124301 A RU 2019124301A RU 2730497 C1 RU2730497 C1 RU 2730497C1
- Authority
- RU
- Russia
- Prior art keywords
- dimethoxyphenyl
- ethoxyphenyl
- cis
- methoxyphenyl
- imidazoline
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/04—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D233/20—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D233/22—Radicals substituted by oxygen atoms
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
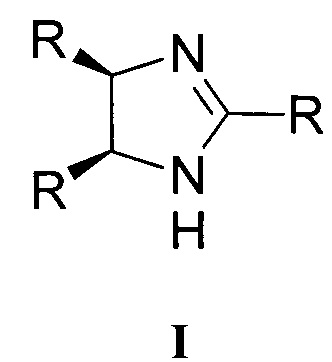
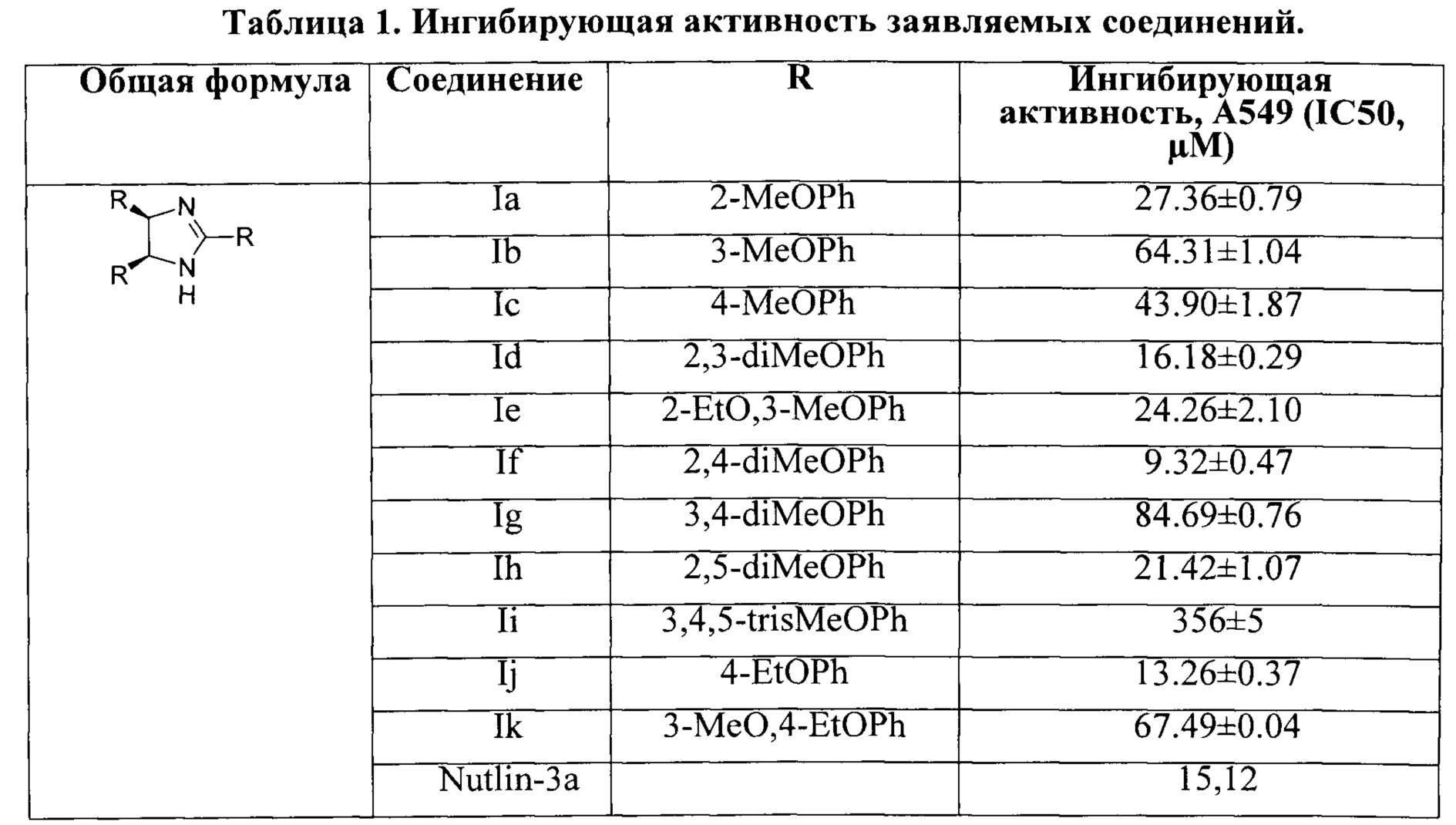
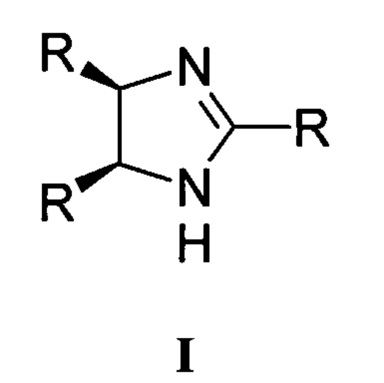
Изобретение относится к производным цис-имидазолина общей формулы I, в которой R=2-метоксифенил, 3-метоксифенил, 4-этоксифенил, 2,3-диметоксифенил, 3,4-диметоксифенил, 2,5-диметоксифенил, 2,4-диметоксифенил, 3,4,5-триметоксифенил, 3-метокси-4-этоксифенил или 3-метокси-2-этоксифенил. Изобретение также относится к активному компоненту и к способу получения соединения общей формулы I. Технический результат: получены новые производные цис-имидазолина общей формулы I, обладающие ингибирующим действием в отношении роста клеток опухолей немелкоклеточного рака лёгкого. 3 н. и 3 з.п. ф-лы, 1 табл., 11 пр.
Description
Область техники
Изобретение относится к области органической и медицинской химии, фармацевтики и медицины, в частности онкологии, конкретно к новым производным 2,4,5-трис(метоксиарил)-цис-имидазолинов обладающих антипролиферативными свойствами. Изобретение может быть использовано для лечения ряда онкологических заболеваний, связанных с пролиферацией опухолевых клеток, в частности немелкоклеточного рака легкого, колоректального рака, и других злокачественных новообразований.
Уровень техники
В настоящее время лечение онкологических заболеваний, связанных с пролиферацией опухолевых клеток, в частности немелкоклеточного рака легкого, колоректального рака, и других злокачественных новообразований представляет собой серьезную проблему, поскольку известные химиотерапевтические агенты, применяемые с этой целью, отличаются высокой острой токсичностью, их использование приводит к сужению терапевтического индекса и сопряжено с различными побочными эффектами в отношении здоровых клеток.
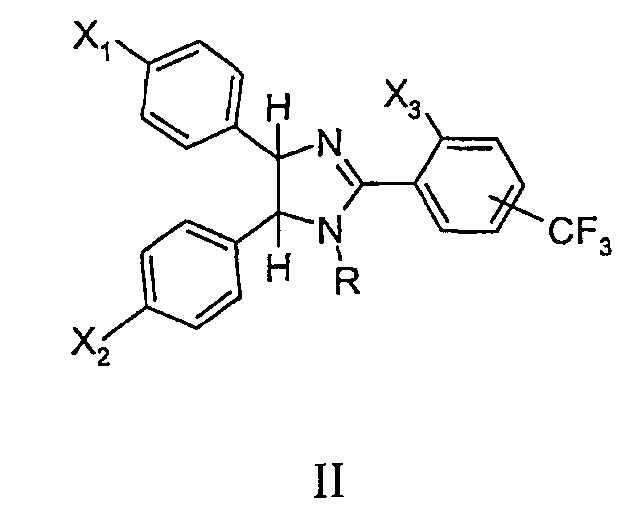
Известны соединения цис-имидазолинов общей формулы II (WO 2005/003097, 13.01.2005), обладающие антипролиферативной активностью, основанной на ингибировании MDM2-p53 взаимодействия, а также способ их получения. Способ заключается в последовательном проведении нескольких реакций с выделением промежуточных продуктов, в частности получение 1,2-бис(4-хлорфенил)этан-1,2 диамина, 4,5-бис(4-хлорфенил)-2-(2-изопропокси-4-метоксифенил)-4,5-дигидро-1Н-имидазола их структурных аналогов с различными заместителями при атоме азота в имидазолиновом ядре. Однако данный способ получения соединений является трудоемким и высокозатратным, промежуточные вещества требуют дополнительных очисток (Zhuang С, Miao Z, Zhu L, et al. Discovery, synthesis, and biological evaluation oforally active pyrrolidone derivatives as novel inhibitors of p53-MDM2 protein-pro-tein interaction, J Med Chem., 2012).
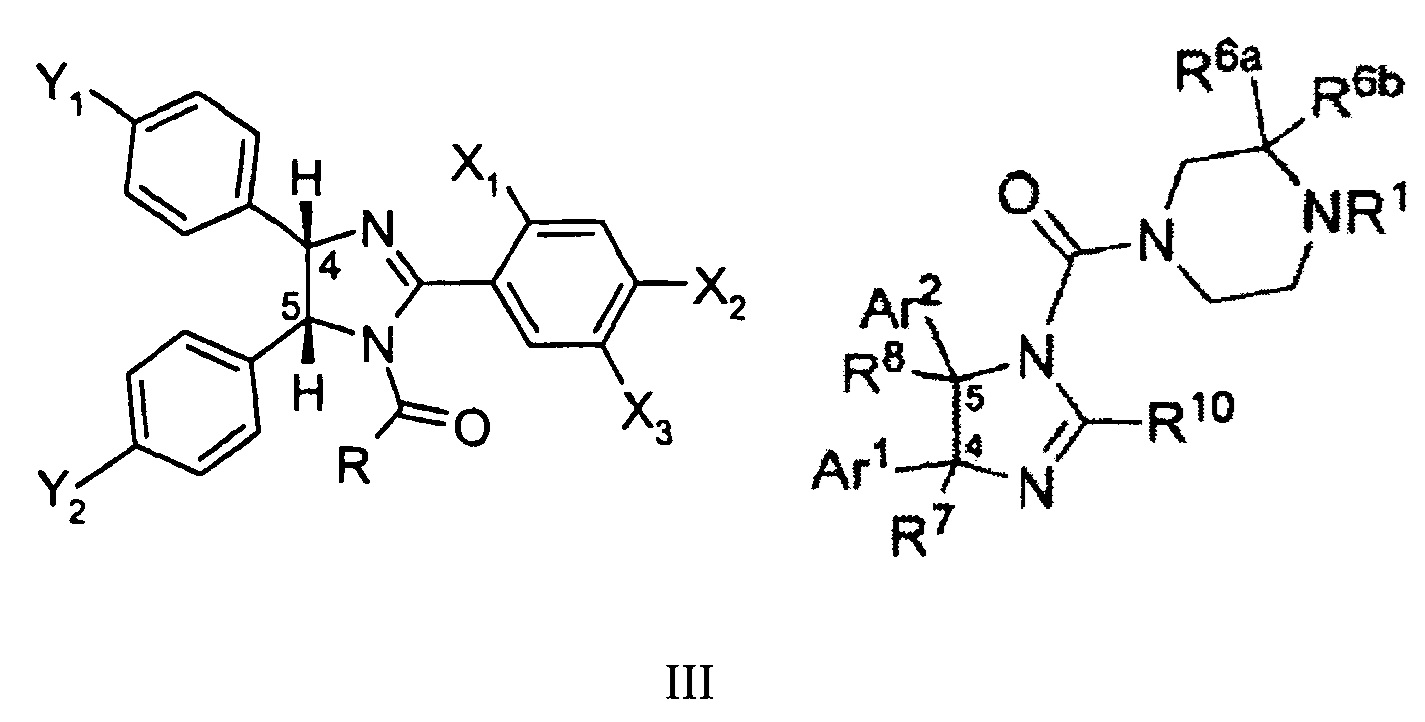
Известны и другие структурные аналоги предлагаемых соединений, а именно соединения цис-имидазолинов общей формулы III (WO 2005/110996) и IV (WO 2009/047161), антипролиферативное действие которых основано также на ингибировании MDM2-p53 взаимодействия. Способ получения заключается в получении диамина - 1,2-бис(4-хлорфенил)этан-1,2 диамин, с последующим получением из него имидазолина. Однако, известные способы многостадийны (3-4 стадии синтеза) и время, затраченное на синтез составляет не менее 2 суток.
Технической проблемой является сложность и многостадийность способа получения цис-имидазолиновых структур, обладающих антипролиферативными свойствами.
Раскрытие изобретения
Техническая проблема решается новыми соединениями общей формулы I, где R = 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 4-этоксифенил, 2,3-диметоксифенил, 3,4-диметоксифенил, 2,5-диметоксифенил, 2,4-диметоксифенил, 3,4,5-триметоксифенил, 3-метокси-4-этоксифенил, 3-метокси-2-этоксифенил.
Техническая проблема решается также активным компонентом, представляющим собой заявляемое соединение, обладающим антипролиферативными свойствами.
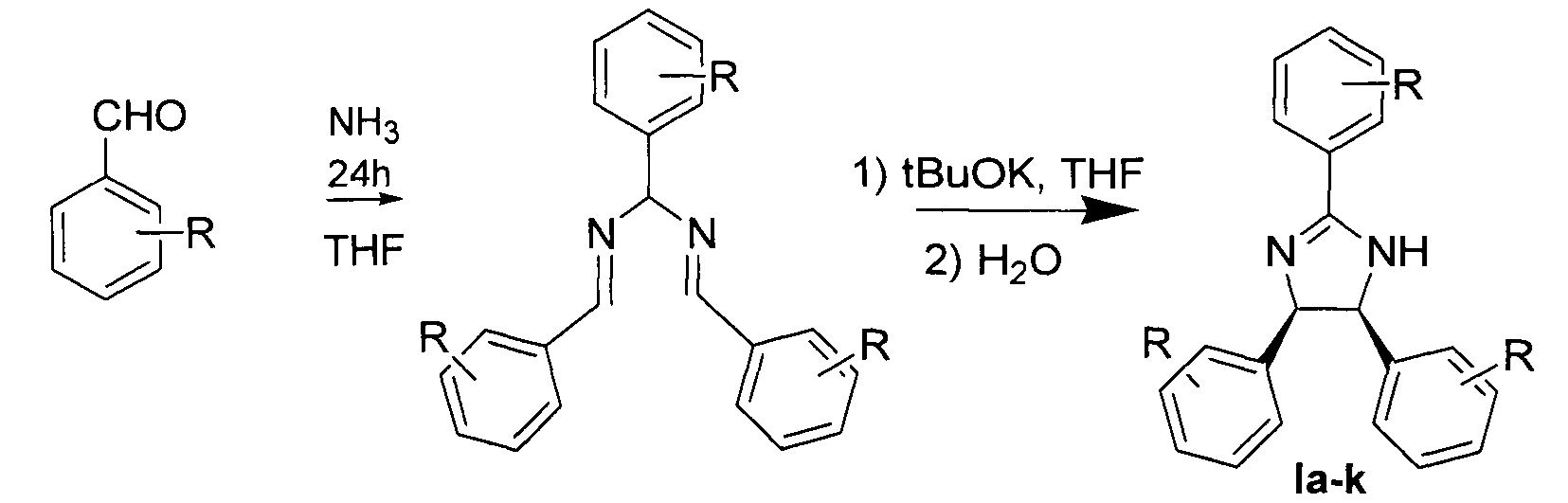
Также техническая проблема решается способом получения заявляемых
соединений формулы, который представляет собой двухстадийный синтез без выделения промежуточного продукта. На первой стадии проводят смешение исходных соединений в качестве которых использовали соответствующий алкоксибензальдегид и насыщенный аммиаком растворитель, взятый массовом соотношении 1:10-1:100. По прошествии не менее 12 часов в реакционную смесь добавляли органическое основание, растворимое в используемом органическом растворителе в массовом соотношении исходный альдегид : органическое основание 1:0,1-1:3 (вторая стадия), после исчезновения интенсивной окраски в реакционную смесь добавляли воду для остановки реакции. Предпочтительно добавляют воду в массовом соотношении реакционная смесь : вода 1:0,1-1:10. Продут экстрагировали, органическую вытяжку сушили над гигроскопичной неорганической солью, растворитель удаляли на вакууме. Производные цис-имидазолина при необходимости очищали от примесей исходных веществ на силикагеле для хроматографии, в качестве элюента использовали смесь этилацетата с гексаном в объемном отношении 1:1 (Daniil R. Bazanov, et al., Bioorganic & Medicinal Chemistry Letters, https://doi.org/10.1016/j.bmcl.2019.06.007).
Техническим результатом заявляемой группы изобретений является разработка одностадийного способа получения цис-имидазолиновых структур с сохранением цитотоксичности в микромолярном диапазоне за время не превышающее 24 часов.
Данные соединения позволяют расшить арсенал средств, обладающих антипролиферативным действием.
Осуществление изобретения.
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°C; выпаривание растворителя осуществляли с использованием роторного испарителя, при пониженном давлении при температуре бани примерно 50°С; контроль за ходом реакции осуществляли при помощи тонкослойной хроматографии (ТСХ), и время реакции указано только для иллюстрации; структуру и чистоту всех выделенных соединений подтверждали, по меньшей мере, одним из следующих методов: ТСХ (пластины для ТСХ с предварительно нанесенным силикагелем 60 F254 Merck), масс-спектрометрия или ядерный магнитный резонанс (ЯМР).
Для получения заявляемых соединений использовали следующие коммерческие реагенты и растворители: тетрагидрофуран, сульфат натрия (осушитель), силикагель для колоночной хроматографии, этилацетат, гексан, газообразный аммиак, соответствующие альдегиды (Sigma Aldrich).
Выход продукта приведен только для иллюстрации. Колоночную флэш-хроматографию осуществляли, используя Merck силикагель 60 (230-400 меш ASTM). Масс-спектры высокого разрешения (HRMS) положительных ионов зарегистрирован на спектрометре Jeol GCMate II при энергии ионизации 70 eV. Спектры ЯМР регистрировали на приборах Bruker Avance-400 (рабочая частота 400.1 и 100.6 МГц для 1Н и 13С, соответственно) и Agilent 400-MR (рабочая частота 400.0 и 100.6 МГц для 1Н и 13С, соответственно), используя дейтерированный хлороформ (99,8% D) или метанол (99,8% D) или вода (99,9% D) в качестве растворителя, если не указано иное, относительно тетраметилсилана (TMS) в качестве внутреннего стандарта, миллионных долях (м.д.).
Структура заявляемых соединений доказана данными спектроскопии ЯМР (1H и 13С), а индивидуальность - данными масс спектрометрии высокого разрешения.
Ниже представлено более подробное описание заявляемого изобретения. Настоящее изобретение может подвергаться различным изменениям и модификациям, понятным специалисту на основе прочтения данного описания. Такие изменения не ограничивают объем притязаний. Например, могут изменяться растворители, насыщенные аммиаком (тетрагидрофуран, диоксан, диэтиловый эфир, хлористый метилен), органические основания (третбутилат калия, третбутилат натрия, этилат калия, этилат натрия, гидрид натрия или гидрид калия), экстрагирующие агенты (этилацетат, диэтиловый эфир, хлороформ, хлористый метилен), гигроскопические неорганические соли для осушивания (безводный сульфат натрия, хлорид кальция и др.).
Пример 1. Цис-2,4,5-трис(2-метоксифенил)имидазолин (Ia).
Из 1,0 грамма (7,4 ммоль) 2-метоксибензальдегида растворяли в 10 мл насыщенного аммиаком тетрагидрофурана. Реакционную смесь оставляли перемешиваться на 12 часов при комнатной температуре. Затем в реакционную смесь добавляли третбутилат калия 0,1 грамма, после исчезновения интенсивной окраски в реакционную смесь добавляли 3 мл воды. Продукт экстрагировали этилацетатом, органический слой сушили над безводным сульфатом натрия, растворитель удаляли в вакууме. Очистку продукта проводили на хроматографической колонке, в качестве элюента использовали смесь этилацетата с гексаном в равных объемных отношениях. Время синтеза составило 18 часов.
Было получено 0,6 грамм желтого масла (63%); 1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ 3,63 (с, 6Н); 3,93 (с, 3Н); 5,87 (с, 2Н); 6,56 (д, J=8,1 Гц, 2Н); 6,65 (т, J=7.5 Гц, 2Н); 6.98-7.12 (м. 6Н); 7,47 (дд, J=1,8 Гц, J=7,8 Гц, 1Н); 8.37 (дд, J=1,6 Гц, J=7,7 Гц, 1Н); 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 54,92; 55,77; 62,69; 109,05; 111,41; 119,46; 121,28; 127,55; 128,45; 131,71; 132,08; 156,58; 157,75; 163,44. HRMS (ESI): m/z вычислено для C24H24N2O3 388.1787, найдено: 389.1867 [М+Н]+.
Пример 2. Цис-2,4,5-трис(3-метоксифенил)имидазолин (Ib).
Получение соединения проводили аналогично примеру 1, только в качестве растворителя использовали 100 мл насыщенного аммиаком диоксана, 1 грамм этилата калия, для остановки реакции использовали 10 мл воды, а для осушки органического слоя безводный сульфатом натрия.
Из 1,0 грамма (7,4 ммоль) 3-метоксибензальдегида получено 0,65 грамм желтого масла (68%); 1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ 3,60 (с, 6Н); 3,88 (с, 3Н); 5,41 (с, 2Н); 6,49 (с, 2Н); 6,59 (м, 4Н); 6,98 (т, J=7,9 Гц, 2Н); 7,08 (дд, J=7,5 Гц, J=2,5 Гц, 1H); 7,38 (т, J=8,1 Гц, 1Н); 7,48 (д, J=7,6 Гц, 1H); 7,58 (м, 1H). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 55,10; 55,53; 112,12; 112,81; 113,03; 117,61; 119,37; 120,05; 128,61; 129,66; 131,36; 140,54; 159,13; 159,82; 164,49. HRMS (ESI): m/z вычислено для C24H24N2O3 388.1787, найдено 389.1852 [М+Н]+.
Пример 3. Цис-2,4,5-трис(4-метоксифенил)имидазолин (Ic).
Получение соединения проводили аналогично примеру 1, только в качестве растворителя использовали 50 мл насыщенного аммиаком хлороформа, 1 грамм гидрида натрия и 100 мл воды для остановки реакции.
Из 1,0 грамма (7,4 ммоль) 4-метоксибензальдегида получено 0,9 грамм белого твердого вещества (95%); 1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ 3,68 (с, 6Н); 3,87 (с, 3Н); 5.32 (с, 2Н); 6,59 (д, J=8,6 Гц, 4Н); 6,86 (д, J=8,7 Гц, 4Н); 6,97 (д, J=8.7 Гц, 2Н); 7,91 (д, J=8,7 Гц, 2Н). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 55,11; 55,43; 69,95; 113,08; 113,94; 122,13; 128,57; 128,99; 131,15; 158,36; 161,93; 164,00.
Пример 4. Цис-2,4,5-трис(2,3-диметоксифенил)имидазолин (Id).
Получение соединения проводили аналогично примеру 1, только в качестве растворителя использовали 50 мл насыщенного аммиаком диэтилового эфира, 2,5 грамма этилат натрия и 200 мл воды для остановки реакции.
Из 2,0 грамм (12 ммоль) 2,3-диметоксибензальдегида получено 1,2 грамма желтого масла (67%); 1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ 3,73 (с, 6Н); 3,74 (с, 3Н); 3,81 (с, 3Н); 3,91 (с, 6Н); 5.79 (д, J=10,4 Гц, 1H); 5,90 (д, J=10,4 Гц, 1Н); 6,51 (с, 1Н); 6,63 (д, J=7,2 Гц, 2Н); 6,74-6,79 (м, 2Н); 7,04 (д, J=7,0 Гц, 1H); 7,15 (дд, J=7,9 Гц, J=15,9 Гц, 2Н); 7,89 (д, J=7,8 Гц, 1H). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 55,81; 55,98; 59,34; 60,39; 60,73; 61,54; 66,77; 111,26; 111,46; 112,12; 114,47; 120,50; 122,13; 122,55; 122,81; 124,33; 133,23; 146,81; 148,07; 151,98; 152,89; 163,37. HRMS (ESI): m/z вычислено для C27H30N2O6 478.2104, найдено (М-Н): 477.2010 [М-Н]+.
Пример 5. Цис-2,4,5-трис(3-метокси-2-этоксифенил)имидазолин (Ie).
Получение соединения проводили аналогично примеру 1.
Из 1,0 грамма (5,6 ммоль) 3-метокси-2-этоксибензальдегида получено 0,8 грамм желтого масла (83%); 1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ 1,27 (т, J=7,1 Гц, 3Н); 1,41 (т, J=7,1 Гц, 3Н); 3,71 (с, 6Н); 3,89 (с, 3Н); 4,00 (кв, J=13,0 Гц, 4Н); 4,12 (кв, J=13,6 Гц, 2Н); 5,87 (кв, 2Н); 6,62 (дд, J=1,4 Гц, J=7,6 Гц, 4Н); 6,75 (т, J=7,8 Гц, 2Н); 6,85 (д, J=7,6 Гц, 2Н); 7,03 (дд, J=l,5 Гц, J=8,1 Гц, 1H); 7,15 (т, J=8,1 Гц, 1H); 7,88 (дд, J=1,5 Гц, J=7,9 Гц, 1Н). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 15,48; 15,87; 55,78; 68,62; 70,05; 111,25; 114,41; 122,53; 122,65; 124,20; 133,31; 146,05; 146,98; 152,12; 152,98; 163,60. HRMS (ESI): m/z вычислено для C30H34N2O6 520.2573, найдено: 519.2478 [М-Н]+.
Пример 6. Цис-2,4,5-трис(2,4-диметоксифенил)имидазолин (If).
Получение соединения проводили аналогично примеру 1.
Из 3,0 граммов (18,1 ммоль) 2,4-диметоксибензальдегида получено 2,2 грамма желтого масла (76%); 1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ 3,60 (с, 6Н); 3,70 (с, 6Н); 3,88 (с, 3Н); 3,89 (с, 3Н); 5,69 (с, 2Н); 6,15 (д, J=2,3 Гц, 2Н); 6,20 (дд, J=8,5 Гц, J=2,3 Гц, 2Н); 6,53 (д, J=2,2 Гц, 1H); 6,64 (дд, J=8,7 Гц, J=2,3 Гц, 1Н); 6,94 (д, J=8,5 Гц, 2Н); 8,39 (д, J=8,7 Гц, 1Н). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 54,98; 55,22; 55,58; 55,77; 61,96; 97,26; 98,73; 103,20; 105,47; 120,65; 128,88; 133,19; 157,53; 159,49; 162,96; 163,12. HRMS (ESI): m/z вычислено для C27H30N2O6 478.2104, найдено: 479.2166 [М+Н]+.
Пример 7. Цис-2,4,5-трис(3,4-диметоксифенил)имидазолин (Ig).
Получение соединения проводили аналогично примеру 3.
Из 2,0 граммов (12,0 ммоль) 3,4-диметоксибензальдегида получен 1,3 грамма желтого масла (67%); 1H ЯМР-спектр (CDCl3, 400,13 МГц), δ 3,77 (с, 3Н); 3,78 (с, 3Н); 3,85 (с, 6Н); 3,88 (с, 6Н); 6,74 (д, J=8,0 Гц, 1H); 6,79 (дд, J=1,7 Гц, J=8,2 Гц, 2Н); 6,85 (д, J=1,7 Гц, 1H); 6,90 (д, J=8,2 Гц, 2Н); 7,32 (д, J=1.8 Гц, 2Н); 7,38 (дд, J=1,8 Гц, J=8,2 Гц, 2Н). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 55,91; 56,10; 67,87; 108,86; 110,36; 119,36; 123,87; 126,77; 129,19; 130,06; 135,03; 149,22; 149,53; 151,62; 154,41; 160,24. HRMS (ESI): m/z вычислено для C27H30N2O6 478.2104, найдено: 479.2166 [М+Н]+.
Пример 8. Цис-2,4,5-трис(2,5-диметоксифенил)имидазолин (Ih).
Получение соединения проводили аналогично примеру 2.
Из 2,0 граммов (12,0 ммоль) 2,5-диметоксибензальдегида получено 1,8 грамма желтого порошка (90%); 1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ 3,55 (с, 6Н); 3,58 (с, 6Н); 3,85 (с, 3Н); 3,90 (с, 3Н); 5,76 (с, 1H); 5,88 (с, 1Н); 6,50 (д, J=8,7 Гц, 2Н); 6,55 (дд, J=2,5 Гц, J=9,0 Гц, 2Н); 6,67 (д, J=15,2 Гц, 2Н); 6,96 (д, J=9,1 Гц, 1H); 7,03 (дд, J=3,2 Гц, J=8,9 Гц, 1H); 7,87 (дд, J=3,0 Гц, 1H). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 55,56; 55,70; 56,04; 56,32; 110,23; 112,75; 112,95; 114,80; 118,80; 129,31; 151,10; 152,09; 152,89; 153,78; 163,60. HRMS (ESI): m/z вычислено для C27H30N2O6 478.2104, найдено: 479.2163 [М+Н]+.
Пример 9. Цис-2,4,5-трис(3,4,5-триметоксифенил)имидазолин (Ii).
Получение соединения проводили аналогично примеру 1.
Из 2,0 граммов (10,2 ммоль) 3,4,5-триметоксибензальдегида получено 1,6 грамма желтого порошка (73%); 1H ЯМР-спектр (CDCl3, 400,13 МГц), δ 3,63 (с, 12Н); 3,69 (с, 6Н); 3,91 (с, 9Н); 5,44 (с, 1H); 5,54 (с, 1Н); 6,12 (с, 4Н); 7,21 (с, 2Н). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 56,02; 56,38; 60,76; 60,98; 104,49; 105,21; 125,25; 134,54; 152,59; 153,34; 164,55. HRMS (ESI): m/z вычислено для C30H36N2O9 568.2421, найдено: 569.2484 [М+Н]+.
Пример 10. Цис-2,4,5-трис(4-этоксифенил)имидазолин (Ij).
Получение соединения проводили аналогично примеру 3.
Из 2,0 граммов (13,3 ммоль) 4-этоксибензальдегида получено 1,6 грамма желтого масла (76%); 1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ 1,33 (т, J=6.9 Гц, 6Н); 1,36 (т, J=6,9 Гц, 3Н); 3,88 (кв, J=7,0 Гц, 4Н); 4,10 (кв, J=6,9 Гц, 2Н); 5,23 (с, 2Н); 6,56 (с, J=8,7 Гц, 4Н); 6,77 (д, J=8,7 Гц, 4Н); 6,97 (д, J=8,7 Гц, 2Н); 8,03 (д, J=8,7 Гц, 2Н). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 14,28; 27,53; 29,89; 35,45; 62,71; 32,82; 65,55; 113,44; 114,50; 115,37; 127,05; 128,04; 130,87; 157,82; 162,95; 164,26; 179,87. HRMS (ESI): m/z вычислено для C27H30N2O3 430.2256, найдено: 431.2320 [М+Н]+.
Пример 11. Цис-2,4,5-трис(3-метокси-4-этоксифенил)имидазолин (Ik).
Получение соединения проводили аналогично примеру 1.
Из 1,0 грамма (13,3 ммоль) 3-метокси-4-этоксибензальдегида получено 0,7 грамма желтого масла (73%); 1H ЯМР-спектр (CDCl3, 400,13 МГц), δ 1,28 (t, J=6,3 Гц, 3Н); 1,4 (t, J=6,2 Гц, 6Н); 3,45 (s, 6Н); 3,80 (s, 3Н); 3,85 (q, J=13,8 Гц, 4Н); 4,04 (q, J=13,4 Гц, 2Н); 5,12 (s, 2Н); 6,22 (s, 2Н); 6,47 (dd, J=7,7 Гц, J=20,8 Гц, 4Н); 6,76 (d, J=7,9 Гц, 1Н); 7,33 (d, J=7,5 Гц, 2Н); 7,56 (s, 1Н). 13С ЯМР-спектр (CDCl3, 100,61 МГц) δ 14,65; 30,79; 55,62; 56,01; 64,10; 64,28; 110,55; 111,46; 111,80; 119,68; 120,02; 122,50; 131,77; 147,05; 148,56; 149,11; 150,70. HRMS (ESI): m/z вычислено для C30H36N2O6 520.2573, найдено: 521.2634 [M+H]+.
Исследование антипролиферативной активности заявляемых соединений проводили на серии клеток немелкоклеточного рака легкого (А549) с помощью стандартного МТТ-теста с (3- (4,5-диметилтиазол-2-ил)-2,5-дифенил тетразолий бромидом. Результаты биологических испытаний представлены в Таблице 1.
Исследование антипролиферативной активности заявляемых соединений показало наличие ингибирующего действия в отношении роста клеток опухолей немелкоклеточного рака легкого (А549), для соединения If механизм действия дополнительно изучен для клеток колоректального рака (RKO).
Вестерн-блот анализ свидетельствует о том, что соединения 1с и If вызывают повышение уровня белка р53, что свидетельствует о схожем механизме действия полученных соединений с их литературными аналогами. Так, для соединения If зафиксировано повышение концентрации белка р53 в 3,5 раза по сравнению с контролем.
Сравнимые значения цитотоксичности с известным аналогом Nutlin-3a, [Zhuang С, Miao Z, Zhu L, et al. Discovery, synthesis, and biological evaluation oforally active pyrrolidone derivatives as novel inhibitors of p53-MDM2 protein-pro-tein interaction, J Med Chem., 2012] a также данные вестерн-блот анализа по активации белка р53 свидетельствуют о потенциальной возможности их использования для лечения онкологических заболеваний, связанных с пролиферацией опухолевых клеток.
Определение антипролиферативных свойств.
Антипролиферативные свойства заявляемых соединений были определены по МТТ-тесту [Mather J.P., Roberts Р.Е. Introduction to cell and tissue culture. Theory and technique. New York: Plenum Press, 1998, 175-194]. Культуры клеток человека A549 (ATCC®CCL-185™ выращивали в среде DMEM (НЛП ПанЭко), а клеток MCF7 (АТСС® НТВ-22™) - в среде ЕМЕМ (НЛП ПанЭко). В ростовую среду добавляли 10% эмбриональной телячьей сыворотки (HyClone®, Thermo Scientific), 2 ммоль L-глутамина (НЛП ПанЭко), 1% гентамицина (ОАО Биохимик) в качестве антибиотика и инкубировали при 37°С в атмосфере 5% CO2 и 95% воздуха. Клетки сеяли в 96-луночный планшет (CELLTREAT™ в количестве 1×104 клеток/200 мкл и культивировали при 37°С во влажной атмосфере, содержащей 5% CO2. После 24 ч инкубации к культурам клеток добавляли растворы тестируемых соединений различных концентраций (от 100 до 0,0012 мкмоль/л) и далее клетки культивировали в тех же условиях в течение 72 ч. Для каждой концентрации эксперименты были выполнены в трех повторностях. Все соединения растворяли в ДМСО (PANREAC QUIMICA S.L.U). Конечная концентрация ДМСО в лунке не превышала 0,1% и не была токсична для клеток. В контрольные лунки добавляли растворитель в количестве 0,1%). После инкубации в каждую лунку добавляли 20 мкл раствора 5 мг МТТ [бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия] (SigmaAldrich) в 1 мл ДМСО и дополнительно инкубировали в течение 2 ч. Далее из планшетов удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм, за вычетом измеренного фонового поглощения при 620 нм. Значение концентрации, вызывающее 50%-ное ингибирование роста популяции клеток (IC50), оценивали на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0. Результаты определения концентраций заявляемых соединений, вызывающих 50%-ное ингибирование роста популяции клеток, приведены в таблице, представленной выше.
Вестерн-блот анализ
После культивирования клеток в необходимых условиях, указанных в описании эксперимента, клетки отделяли от поверхности чашек Петри с помощью 0,15% раствора трипсина или скребком и переносили в кондиционированную среду. Затем клетки центрифугировали (1000 rcf, 5 мин, +4°C), отделяли надосадочную жидкость и промывали холодным раствором PBS (ПанЭко). Процедуру центрифугирования повторяли и вновь удаляли надосадочную жидкость. Образовавшийся клеточный осадок ресуспендировали в 20-100 μ1 RIPA-буфера и инкубировали на льду в течение 20 минут. После центрифугирования (13200 rcf, 15 мин, +4°С) часть супернатанта была взята для определения количества белка в лизатах с помощью набора Pierce ВСА Protein Assay Kit (Thermo Scientific). Другую часть супернатанта использовали для Вестерн-блот анализа. Объем клеточного лизата с содержанием белка 20-40 мкг смешивали с 4-5 мкл 5Х Лэммли буфера и водой (в количестве, необходимом для получения конечного объема пробы 20-25 мкл). Полученные пробы прогревали при 95°С в течение 5 мин. Затем образцы разделяли в ПААГ геле (4% - концентрирующий, 12% - разделяющий, в качестве буфера для проведения гель-электрофореза использовали IX электродный буфер) и переносили на нитроцеллюлозную мембрану (Bio-Rad) с помощью приборов Trans-Blot TurboTransfer System (Bio-Rad) или камер для переноса Mini Trans-Blot (Bio-Rad). В качестве буфера для переноса использовали соответствующий IX буфер. Дальнейшие процедуры выполняли в условиях перемешивания на качающемся шейкере (ELMI S-4). Для определения загрузки геля при помощи реагента Ponceau S мембраны помещали в соответствующий раствор на 1 минуту, затем дважды отмывали в растворе TBS (по 5 минут). Мембраны блокировали в течение 40 минут в 5% растворе обезжиренного молока, разведенного в TBS. При покраске антителами на фосфорилированные формы белков для блокировки использовали 2,5% раствор BSA (Amresco) в TBS. Далее мембрану четырежды отмывали в растворе TBS и инкубировали с первичными антителами, разведенными в соответствующем буфере, на протяжении 18±6 часов при температуре +4оС. После трех серий промывок в TBST мембрану инкубировали со вторичными антителами, разведенными в 2,5% растворе обезжиренного молока (или 1,25% растворе BSA) на протяжении 1 часа, затем трижды промывали в растворе TBST. Мембраны проявляли с помощью реагентов ECL (Promega) или SuperSignal West Dura Extended Duration Substrate (Thermo Scientific) на приборе Molecular Imager ChemiDoc (Bio-Rad). В случае необходимости покраски другими антителами мембраны инкубировали в Restore Western Blot Stripping Buffer (Thermo Scientific) в течение 5-15 минут, после чего отмывали трижды раствором TBS, повторно блокировали мембрану, отмывали ее и заливали первичными антителами. Денситометрический анализ проводили с использованием ChemiDoc MP.
Таким образом, за время, не превышающее 24 часа, были синтезированы новые производные цис-имидазолинов, обладающие цитотоксичностью в микромолярном диапазоне. Также синтезированные производные цис-имидазолинов, обладают умеренной растворимостью в физиологических средах.
Claims (8)
1. Производные цис-имидазолина общей формулы I
где R=2-метоксифенил, 3-метоксифенил, 4-этоксифенил, 2,3-диметоксифенил, 3,4-диметоксифенил, 2,5-диметоксифенил, 2,4-диметоксифенил, 3,4,5-триметоксифенил, 3-метокси-4-этоксифенил или 3-метокси-2-этоксифенил.
2. Активный компонент, характеризующийся тем, что представляет собой соединение по п. 1, обладающее ингибирующим действием в отношении роста клеток опухолей немелкоклеточного рака легкого.
3. Способ получения соединения общей формулы I по п. 1, характеризующийся тем, что к соответствующему альдегиду при комнатной температуре добавляют насыщенный аммиаком тетрагидрофуран, диоксан, диэтиловый эфир, хлороформ в массовом соотношении 1:10-1:100, по прошествии не менее 12 часов к реакционной смеси добавляют органическое основание в массовом соотношении исходный альдегид: основание 1:0,1-1:3, реакцию ведут до исчезновения интенсивной окраски, затем к реакционной смеси добавляют воду для остановки реакции в массовом отношении 1:0,1-1:10, полученный продукт экстрагируют, органический слой сушат над гигроскопичной неорганической солью, растворитель удаляют в вакууме.
4. Способ по п. 3, характеризующийся тем, что в качестве гигроскопичной неорганической соли используют безводный сульфат натрия или хлорид кальция.
5. Способ по п. 3, характеризующийся тем, что дополнительно полученный продукт очищают на силикагеле смесью этилацетат:гексан 1:1.
6. Способ по п. 3, характеризующийся тем, что в качестве органического основания используют третбутилат калия, третбутилат натрия, этилат калия, этилат натрия, гидрид натрия или гидрид калия.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2019124301A RU2730497C1 (ru) | 2019-07-31 | 2019-07-31 | 2,4,5-три(метоксифенил) цис-имидазолин и способ их получения |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2019124301A RU2730497C1 (ru) | 2019-07-31 | 2019-07-31 | 2,4,5-три(метоксифенил) цис-имидазолин и способ их получения |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2730497C1 true RU2730497C1 (ru) | 2020-08-24 |
Family
ID=72237933
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2019124301A RU2730497C1 (ru) | 2019-07-31 | 2019-07-31 | 2,4,5-три(метоксифенил) цис-имидазолин и способ их получения |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2730497C1 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2809688C1 (ru) * | 2022-10-03 | 2023-12-14 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Московский государственный университет имени М.В. Ломоносова" (МГУ) | Новые азотзамещенные 2,4,5-три(метоксифенил) цис-имидазолины, способ их получения и применения |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5182268A (en) * | 1989-11-22 | 1993-01-26 | Marion Merrell Dow, Inc. | Pharmaceutical composition comprising daunorubicin potentiated with 2,4,5-tri (4-methoxyphenyl)-4,5-dihydroimidazole |
| JP2003321457A (ja) * | 2002-04-26 | 2003-11-11 | Aisin Seiki Co Ltd | イミダゾリン誘導体の製造方法及びジイミン誘導体の製造方法 |
-
2019
- 2019-07-31 RU RU2019124301A patent/RU2730497C1/ru active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5182268A (en) * | 1989-11-22 | 1993-01-26 | Marion Merrell Dow, Inc. | Pharmaceutical composition comprising daunorubicin potentiated with 2,4,5-tri (4-methoxyphenyl)-4,5-dihydroimidazole |
| JP2003321457A (ja) * | 2002-04-26 | 2003-11-11 | Aisin Seiki Co Ltd | イミダゾリン誘導体の製造方法及びジイミン誘導体の製造方法 |
Non-Patent Citations (2)
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2809688C1 (ru) * | 2022-10-03 | 2023-12-14 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Московский государственный университет имени М.В. Ломоносова" (МГУ) | Новые азотзамещенные 2,4,5-три(метоксифенил) цис-имидазолины, способ их получения и применения |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN113105425B (zh) | 一种抗炎化合物、其制备方法和抗炎用途 | |
| RU2662805C2 (ru) | Соли дасатиниба в кристаллической форме | |
| RU2129546C1 (ru) | 6,9-бис(аминозамещенные)-бензо(g)изохинолин-5,10-дионы, способ их получения, фармацевтическая композиция на их основе и способ ингибирования опухолей у млекопитающих | |
| CA2116621C (en) | Novel anticancer agents | |
| KR100588803B1 (ko) | 암세포주에 항암활성을 지닌 인디루빈 유도체 | |
| Cheng et al. | Synthesis of oleanolic acid dimers as inhibitors of glycogen phosphorylase | |
| WO2018209961A1 (zh) | 烷氧端基寡peg修饰的氨基嘧啶衍生物及抗肿瘤应用 | |
| CN110981881B (zh) | 白屈菜碱一氧化氮供体衍生物及其制备方法和用途 | |
| RU2730497C1 (ru) | 2,4,5-три(метоксифенил) цис-имидазолин и способ их получения | |
| ES2939493T3 (es) | Inhibidor de la indoleamina-2,3-dioxigenasa, procedimiento de preparación del mismo y uso del mismo | |
| CN116217582A (zh) | 一种鹤氏唐松草碱衍生物及应用 | |
| CN113979850B (zh) | 一种二萜衍生物及其制备方法、药物组合物和应用 | |
| FI75173C (fi) | Foerfarande foer framstaellning av nya cytostatiskt verkande antracyklinderivat. | |
| FI87789C (fi) | Foerfarande foer framstaellning av nya terapeutiskt anvaendbara epipodofyllotoxinglukosidderivat innehaollande nitrogen | |
| CN118221585B (zh) | (E)-8-氯-6-(2-氟苯基)-1-对甲基-4-(对甲基)-1,2,3,4-四氢苯并[b]氮杂辛环 | |
| CN109438437B (zh) | 一类含噻唑环的抗癌化合物 | |
| CN110981882A (zh) | 一类白屈菜碱一氧化氮供体衍生物及其制备方法和用途 | |
| SU843753A3 (ru) | Способ получени димерных индолдигидроиндолдионовых соединений | |
| US4460599A (en) | Mitomycin analogs | |
| CN113717138A (zh) | 一类氮芥类色原酮衍生物与应用 | |
| CN108299429B (zh) | 一类八氢苯并萘啶化合物及其制备方法和应用 | |
| CN116102608B (zh) | 一种豆甾醇三氮唑衍生物及其制备方法与应用 | |
| RU2839138C1 (ru) | Азопроизводные аминофенолов, обладающие способностью ингибировать образование конечных продуктов гликирования | |
| RU2039733C1 (ru) | Производные 2-(3,4-дигидроксифенил)-этиламина, проявляющие иммунотропную активность и обладающие способностью тормозить репликацию вируса | |
| US5374739A (en) | Mitomycin analogs |