RU2657797C2 - Фармацевтическая композиция, содержащая никотиновую кислоту и/или никотинамид, и/или триптофан, для положительного воздействия на кишечную микробиоту - Google Patents
Фармацевтическая композиция, содержащая никотиновую кислоту и/или никотинамид, и/или триптофан, для положительного воздействия на кишечную микробиоту Download PDFInfo
- Publication number
- RU2657797C2 RU2657797C2 RU2014148239A RU2014148239A RU2657797C2 RU 2657797 C2 RU2657797 C2 RU 2657797C2 RU 2014148239 A RU2014148239 A RU 2014148239A RU 2014148239 A RU2014148239 A RU 2014148239A RU 2657797 C2 RU2657797 C2 RU 2657797C2
- Authority
- RU
- Russia
- Prior art keywords
- pharmaceutical composition
- microbiota
- composition according
- intestinal microbiota
- positive effect
- Prior art date
Links
- 244000005709 gut microbiome Species 0.000 title claims abstract description 53
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 title claims abstract description 51
- 239000008194 pharmaceutical composition Substances 0.000 title claims abstract description 40
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 title claims abstract description 39
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 title claims abstract description 37
- 229960003512 nicotinic acid Drugs 0.000 title claims abstract description 36
- DFPAKSUCGFBDDF-UHFFFAOYSA-N nicotinic acid amide Natural products NC(=O)C1=CC=CN=C1 DFPAKSUCGFBDDF-UHFFFAOYSA-N 0.000 title claims description 237
- 235000005152 nicotinamide Nutrition 0.000 title claims description 122
- 239000011570 nicotinamide Substances 0.000 title claims description 122
- 229960003966 nicotinamide Drugs 0.000 title claims description 105
- 229960004799 tryptophan Drugs 0.000 claims abstract description 35
- 239000011664 nicotinic acid Substances 0.000 claims abstract description 19
- 235000001968 nicotinic acid Nutrition 0.000 claims abstract description 18
- 210000000813 small intestine Anatomy 0.000 claims abstract description 15
- 210000002429 large intestine Anatomy 0.000 claims abstract description 9
- DFPAKSUCGFBDDF-ZQBYOMGUSA-N [14c]-nicotinamide Chemical compound N[14C](=O)C1=CC=CN=C1 DFPAKSUCGFBDDF-ZQBYOMGUSA-N 0.000 claims abstract description 6
- 239000013543 active substance Substances 0.000 claims description 38
- 238000013270 controlled release Methods 0.000 claims description 37
- 239000000203 mixture Substances 0.000 claims description 36
- 238000011282 treatment Methods 0.000 claims description 34
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 33
- 201000010099 disease Diseases 0.000 claims description 31
- 210000001072 colon Anatomy 0.000 claims description 30
- 241000736262 Microbiota Species 0.000 claims description 20
- 230000004054 inflammatory process Effects 0.000 claims description 20
- 206010061218 Inflammation Diseases 0.000 claims description 19
- 230000007423 decrease Effects 0.000 claims description 19
- 210000000936 intestine Anatomy 0.000 claims description 19
- 230000008092 positive effect Effects 0.000 claims description 18
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 16
- 210000003405 ileum Anatomy 0.000 claims description 15
- 230000003111 delayed effect Effects 0.000 claims description 14
- 230000002265 prevention Effects 0.000 claims description 14
- 230000009286 beneficial effect Effects 0.000 claims description 13
- 208000011231 Crohn disease Diseases 0.000 claims description 11
- 241000894006 Bacteria Species 0.000 claims description 10
- 230000003993 interaction Effects 0.000 claims description 10
- 230000008859 change Effects 0.000 claims description 9
- 208000027866 inflammatory disease Diseases 0.000 claims description 9
- 206010009900 Colitis ulcerative Diseases 0.000 claims description 8
- 206010009944 Colon cancer Diseases 0.000 claims description 8
- 201000006704 Ulcerative Colitis Diseases 0.000 claims description 8
- 244000052616 bacterial pathogen Species 0.000 claims description 8
- 239000002552 dosage form Substances 0.000 claims description 7
- 230000036541 health Effects 0.000 claims description 7
- 108010016626 Dipeptides Proteins 0.000 claims description 6
- 230000001771 impaired effect Effects 0.000 claims description 6
- 239000004480 active ingredient Substances 0.000 claims description 5
- 238000002560 therapeutic procedure Methods 0.000 claims description 5
- 230000006806 disease prevention Effects 0.000 claims description 4
- 230000036961 partial effect Effects 0.000 claims description 4
- 231100000915 pathological change Toxicity 0.000 claims description 4
- 230000036285 pathological change Effects 0.000 claims description 4
- 238000011321 prophylaxis Methods 0.000 claims description 3
- 208000009056 telangiectasis Diseases 0.000 claims description 3
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 claims description 2
- 206010062696 Spider vein Diseases 0.000 claims description 2
- 229960001138 acetylsalicylic acid Drugs 0.000 claims description 2
- 239000005557 antagonist Substances 0.000 claims description 2
- 210000000056 organ Anatomy 0.000 claims description 2
- BHMBVRSPMRCCGG-OUTUXVNYSA-N prostaglandin D2 Chemical compound CCCCC[C@H](O)\C=C\[C@@H]1[C@@H](C\C=C/CCCC(O)=O)[C@@H](O)CC1=O BHMBVRSPMRCCGG-OUTUXVNYSA-N 0.000 claims description 2
- BHMBVRSPMRCCGG-UHFFFAOYSA-N prostaglandine D2 Natural products CCCCCC(O)C=CC1C(CC=CCCCC(O)=O)C(O)CC1=O BHMBVRSPMRCCGG-UHFFFAOYSA-N 0.000 claims description 2
- 210000000664 rectum Anatomy 0.000 claims 1
- 239000003814 drug Substances 0.000 abstract description 17
- 150000001875 compounds Chemical class 0.000 abstract description 11
- 230000000694 effects Effects 0.000 abstract description 10
- 239000000126 substance Substances 0.000 abstract description 10
- 239000008187 granular material Substances 0.000 description 49
- 235000013305 food Nutrition 0.000 description 43
- 241000699670 Mus sp. Species 0.000 description 35
- KBOPZPXVLCULAV-UHFFFAOYSA-N mesalamine Chemical compound NC1=CC=C(O)C(C(O)=O)=C1 KBOPZPXVLCULAV-UHFFFAOYSA-N 0.000 description 32
- 229960004963 mesalazine Drugs 0.000 description 31
- 206010009887 colitis Diseases 0.000 description 30
- TVZRAEYQIKYCPH-UHFFFAOYSA-N 3-(trimethylsilyl)propane-1-sulfonic acid Chemical compound C[Si](C)(C)CCCS(O)(=O)=O TVZRAEYQIKYCPH-UHFFFAOYSA-N 0.000 description 26
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 22
- 241001465754 Metazoa Species 0.000 description 16
- 125000002707 L-tryptophyl group Chemical group [H]C1=C([H])C([H])=C2C(C([C@](N([H])[H])(C(=O)[*])[H])([H])[H])=C([H])N([H])C2=C1[H] 0.000 description 15
- 239000003826 tablet Substances 0.000 description 14
- 230000000968 intestinal effect Effects 0.000 description 13
- 238000000034 method Methods 0.000 description 13
- 239000008188 pellet Substances 0.000 description 13
- 102100035765 Angiotensin-converting enzyme 2 Human genes 0.000 description 12
- 108090000975 Angiotensin-converting enzyme 2 Proteins 0.000 description 12
- 230000037396 body weight Effects 0.000 description 11
- 229940079593 drug Drugs 0.000 description 11
- 208000024891 symptom Diseases 0.000 description 9
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 8
- 230000002354 daily effect Effects 0.000 description 8
- 238000011161 development Methods 0.000 description 8
- 229960000633 dextran sulfate Drugs 0.000 description 8
- 239000011734 sodium Substances 0.000 description 8
- 229910052708 sodium Inorganic materials 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- 241000282412 Homo Species 0.000 description 7
- 102000003896 Myeloperoxidases Human genes 0.000 description 7
- 108090000235 Myeloperoxidases Proteins 0.000 description 7
- 230000002550 fecal effect Effects 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 241000792859 Enema Species 0.000 description 6
- 229920003134 Eudragit® polymer Polymers 0.000 description 6
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 6
- 208000002141 Pellagra Diseases 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 239000007920 enema Substances 0.000 description 6
- 230000002068 genetic effect Effects 0.000 description 6
- 210000004347 intestinal mucosa Anatomy 0.000 description 6
- 239000008185 minitablet Substances 0.000 description 6
- 235000016709 nutrition Nutrition 0.000 description 6
- 230000035764 nutrition Effects 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 239000008223 sterile water Substances 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 5
- -1 N-formyl kinurenine Chemical compound 0.000 description 5
- XJLXINKUBYWONI-NNYOXOHSSA-O NADP(+) Chemical compound NC(=O)C1=CC=C[N+]([C@H]2[C@@H]([C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](OP(O)(O)=O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 XJLXINKUBYWONI-NNYOXOHSSA-O 0.000 description 5
- 206010029400 Nicotinic acid deficiency Diseases 0.000 description 5
- 208000025865 Ulcer Diseases 0.000 description 5
- 230000003110 anti-inflammatory effect Effects 0.000 description 5
- 230000007812 deficiency Effects 0.000 description 5
- 230000009266 disease activity Effects 0.000 description 5
- 239000003651 drinking water Substances 0.000 description 5
- 235000020188 drinking water Nutrition 0.000 description 5
- 244000005700 microbiome Species 0.000 description 5
- 210000004877 mucosa Anatomy 0.000 description 5
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 108010078791 Carrier Proteins Proteins 0.000 description 4
- 206010012735 Diarrhoea Diseases 0.000 description 4
- BAWFJGJZGIEFAR-NNYOXOHSSA-N NAD zwitterion Chemical compound NC(=O)C1=CC=C[N+]([C@H]2[C@@H]([C@H](O)[C@@H](COP([O-])(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 BAWFJGJZGIEFAR-NNYOXOHSSA-N 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 230000002950 deficient Effects 0.000 description 4
- 229940079360 enema for constipation Drugs 0.000 description 4
- 230000003203 everyday effect Effects 0.000 description 4
- 210000001035 gastrointestinal tract Anatomy 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 229920000609 methyl cellulose Polymers 0.000 description 4
- 239000001923 methylcellulose Substances 0.000 description 4
- 235000010981 methylcellulose Nutrition 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 238000012552 review Methods 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 239000000829 suppository Substances 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 238000012384 transportation and delivery Methods 0.000 description 4
- 230000036269 ulceration Effects 0.000 description 4
- 102000044503 Antimicrobial Peptides Human genes 0.000 description 3
- 108700042778 Antimicrobial Peptides Proteins 0.000 description 3
- 241000692822 Bacteroidales Species 0.000 description 3
- 241000282472 Canis lupus familiaris Species 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- 206010020751 Hypersensitivity Diseases 0.000 description 3
- 108010007622 LDL Lipoproteins Proteins 0.000 description 3
- 102000007330 LDL Lipoproteins Human genes 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 208000008589 Obesity Diseases 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 3
- 230000007815 allergy Effects 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 208000006673 asthma Diseases 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 239000000306 component Substances 0.000 description 3
- 239000008202 granule composition Substances 0.000 description 3
- 230000002757 inflammatory effect Effects 0.000 description 3
- 230000002147 killing effect Effects 0.000 description 3
- 230000002906 microbiologic effect Effects 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 229950006238 nadide Drugs 0.000 description 3
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 3
- 235000020824 obesity Nutrition 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 3
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 3
- 229940068968 polysorbate 80 Drugs 0.000 description 3
- 229920000053 polysorbate 80 Polymers 0.000 description 3
- 235000018291 probiotics Nutrition 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 238000005507 spraying Methods 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- 238000011269 treatment regimen Methods 0.000 description 3
- WBQJTPDOGLYTBE-VIFPVBQESA-N 1-nitroso-L-tryptophan Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CN(N=O)C2=C1 WBQJTPDOGLYTBE-VIFPVBQESA-N 0.000 description 2
- 108091093088 Amplicon Proteins 0.000 description 2
- 206010003210 Arteriosclerosis Diseases 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 208000012657 Atopic disease Diseases 0.000 description 2
- 241000605059 Bacteroidetes Species 0.000 description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 2
- 241000193163 Clostridioides difficile Species 0.000 description 2
- 206010012438 Dermatitis atopic Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 239000001856 Ethyl cellulose Substances 0.000 description 2
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 2
- 241000192125 Firmicutes Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 108010010234 HDL Lipoproteins Proteins 0.000 description 2
- 102000015779 HDL Lipoproteins Human genes 0.000 description 2
- 241000186660 Lactobacillus Species 0.000 description 2
- 240000006024 Lactobacillus plantarum Species 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 241001267970 Paraprevotella Species 0.000 description 2
- 229930003537 Vitamin B3 Natural products 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 208000011775 arteriosclerosis disease Diseases 0.000 description 2
- 201000008937 atopic dermatitis Diseases 0.000 description 2
- 208000010668 atopic eczema Diseases 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 208000029078 coronary artery disease Diseases 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 235000019700 dicalcium phosphate Nutrition 0.000 description 2
- 229940095079 dicalcium phosphate anhydrous Drugs 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 229940095399 enema Drugs 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 230000003628 erosive effect Effects 0.000 description 2
- 235000019325 ethyl cellulose Nutrition 0.000 description 2
- 229920001249 ethyl cellulose Polymers 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 2
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 2
- 210000003714 granulocyte Anatomy 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 210000004969 inflammatory cell Anatomy 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 210000002490 intestinal epithelial cell Anatomy 0.000 description 2
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 208000030159 metabolic disease Diseases 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 230000000051 modifying effect Effects 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 229920000191 poly(N-vinyl pyrrolidone) Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 235000013406 prebiotics Nutrition 0.000 description 2
- 239000006041 probiotic Substances 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 235000021391 short chain fatty acids Nutrition 0.000 description 2
- 150000004666 short chain fatty acids Chemical class 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 230000009469 supplementation Effects 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 241000344485 unclassified Bacteroidales Species 0.000 description 2
- 235000019160 vitamin B3 Nutrition 0.000 description 2
- 239000011708 vitamin B3 Substances 0.000 description 2
- 230000004580 weight loss Effects 0.000 description 2
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 description 1
- 108020004465 16S ribosomal RNA Proteins 0.000 description 1
- WJXSWCUQABXPFS-UHFFFAOYSA-N 3-hydroxyanthranilic acid Chemical compound NC1=C(O)C=CC=C1C(O)=O WJXSWCUQABXPFS-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 206010027654 Allergic conditions Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 208000000412 Avitaminosis Diseases 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 108020000946 Bacterial DNA Proteins 0.000 description 1
- 241000606125 Bacteroides Species 0.000 description 1
- 241000186000 Bifidobacterium Species 0.000 description 1
- 241000186012 Bifidobacterium breve Species 0.000 description 1
- 241001608472 Bifidobacterium longum Species 0.000 description 1
- 241000186015 Bifidobacterium longum subsp. infantis Species 0.000 description 1
- 241001135254 Bisgaard taxa Species 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 241000605716 Desulfovibrio Species 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- 208000004232 Enteritis Diseases 0.000 description 1
- 241000588921 Enterobacteriaceae Species 0.000 description 1
- 206010058838 Enterocolitis infectious Diseases 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241001608234 Faecalibacterium Species 0.000 description 1
- 241000605980 Faecalibacterium prausnitzii Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000605909 Fusobacterium Species 0.000 description 1
- 208000034826 Genetic Predisposition to Disease Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 206010021135 Hypovitaminosis Diseases 0.000 description 1
- 240000001046 Lactobacillus acidophilus Species 0.000 description 1
- 235000013956 Lactobacillus acidophilus Nutrition 0.000 description 1
- 244000199866 Lactobacillus casei Species 0.000 description 1
- 241000186605 Lactobacillus paracasei Species 0.000 description 1
- 235000013965 Lactobacillus plantarum Nutrition 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-M Methacrylate Chemical compound CC(=C)C([O-])=O CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 101100330194 Mus musculus Cyren gene Proteins 0.000 description 1
- 102000012106 Neutral Amino Acid Transport Systems Human genes 0.000 description 1
- 108010036505 Neutral Amino Acid Transport Systems Proteins 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 229920003081 Povidone K 30 Polymers 0.000 description 1
- 241000605861 Prevotella Species 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000192031 Ruminococcus Species 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 101150054399 ace2 gene Proteins 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 201000009961 allergic asthma Diseases 0.000 description 1
- 102000018568 alpha-Defensin Human genes 0.000 description 1
- 108050007802 alpha-defensin Proteins 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 229940004120 bifidobacterium infantis Drugs 0.000 description 1
- 229940009291 bifidobacterium longum Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000008993 bowel inflammation Effects 0.000 description 1
- 150000001720 carbohydrates Chemical group 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 239000008199 coating composition Substances 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 235000021316 daily nutritional intake Nutrition 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000004815 dispersion polymer Substances 0.000 description 1
- 239000012738 dissolution medium Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 208000007784 diverticulitis Diseases 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 210000000750 endocrine system Anatomy 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000007888 film coating Substances 0.000 description 1
- 238000009501 film coating Methods 0.000 description 1
- 238000005243 fluidization Methods 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- 235000011389 fruit/vegetable juice Nutrition 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 210000004051 gastric juice Anatomy 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 108010084389 glycyltryptophan Proteins 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000037189 immune system physiology Effects 0.000 description 1
- 208000027139 infectious colitis Diseases 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 230000000622 irritating effect Effects 0.000 description 1
- 238000009533 lab test Methods 0.000 description 1
- 229940039696 lactobacillus Drugs 0.000 description 1
- 229940039695 lactobacillus acidophilus Drugs 0.000 description 1
- 229940072205 lactobacillus plantarum Drugs 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 108010022197 lipoprotein cholesterol Proteins 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 102000006240 membrane receptors Human genes 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000003448 neutrophilic effect Effects 0.000 description 1
- 229940101270 nicotinamide adenine dinucleotide (nad) Drugs 0.000 description 1
- 229960002715 nicotine Drugs 0.000 description 1
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 229940072223 pentasa Drugs 0.000 description 1
- 239000005426 pharmaceutical component Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 230000002974 pharmacogenomic effect Effects 0.000 description 1
- 239000008196 pharmacological composition Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000009290 primary effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 238000012175 pyrosequencing Methods 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- GJAWHXHKYYXBSV-UHFFFAOYSA-N quinolinic acid Chemical compound OC(=O)C1=CC=CN=C1C(O)=O GJAWHXHKYYXBSV-UHFFFAOYSA-N 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000007814 response to vitamin B3 Effects 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 230000001502 supplementing effect Effects 0.000 description 1
- 238000013269 sustained drug release Methods 0.000 description 1
- 235000019722 synbiotics Nutrition 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 238000012385 systemic delivery Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000000304 virulence factor Substances 0.000 description 1
- 230000007923 virulence factor Effects 0.000 description 1
- 208000030401 vitamin deficiency disease Diseases 0.000 description 1
- 229920003169 water-soluble polymer Polymers 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
- A61K31/405—Indole-alkanecarboxylic acids; Derivatives thereof, e.g. tryptophan, indomethacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/455—Nicotinic acids, e.g. niacin; Derivatives thereof, e.g. esters, amides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/05—Dipeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0031—Rectum, anus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/284—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5036—Polysaccharides, e.g. gums, alginate; Cyclodextrin
- A61K9/5042—Cellulose; Cellulose derivatives, e.g. phthalate or acetate succinate esters of hydroxypropyl methylcellulose
- A61K9/5047—Cellulose ethers containing no ester groups, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Diabetes (AREA)
- Pulmonology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Dermatology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Emergency Medicine (AREA)
- Endocrinology (AREA)
- Urology & Nephrology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Группа изобретений относится к медицине. Описана фармацевтическая композиция, содержащая никотиновую кислоту, никотинамид, триптофан или родственные соединения для положительного воздействия на кишечную микробиоту. Фармацевтическая композиция частично или полностью высвобождается в тонком кишечнике или толстом кишечнике для положительного воздействия на кишечную микрофлору. 3 н. и 17 з.п. ф-лы, 7 ил., 3 табл., 6 пр.
Description
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новой фармацевтической композиции, содержащей никотиновую кислоту и/или никотинамид, и/или триптофан, для положительного воздействия на кишечную микробиоту, где данная фармацевтическая композиция специфично высвобождается (например, селективно высвобождается) в тонком кишечнике и/или толстом кишечнике.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Многие воспалительные заболевания стенки кишечника вызваны или подвергаются влиянию изменений кишечной микробиоты и/или ухудшенного взаимодействия между кишечной микробиотой и кишечником. Такие кишечные воспаления, например, воспалительные заболевания кишечника (IBD), такие как болезнь Крона или язвенный колит, встречаются у людей, а также и у других млекопитающих (например, хронический идиопатический колит у собак). Эти заболевания основаны на сложных иммунологических процессах, которые не полностью понятны. Однако ухудшенные взаимодействия кишечной микробиоты и ее изменения также могут быть этиологическими факторами при целом ряде других заболеваний. Примеры включают атопические заболевания, такие как атопическая экзема, аллергические состояния или астму (см., например, Bisgaard etal. 2011, J. Allergy Clin. Immunol. 128:646; lebba et al. 2011, Dig. Dis. 29:531; Abrahamsson et al. 2012, J. Allergy Clin. Immunol. 129:434; Candela et al. 2012, BMC Microbiol. 12:95; Olszak et al. 2012, Science 336:489), a также метаболические заболевания с воспалительным компонентом, такие как артериосклероз с возникающими в результате коронарными заболеваниями сердца, ожирение или диабет (Ott ef al. 2006, Circulation 113:929; Koren et al. 2011, PNAS 108 Suppl 1:4592; для обзора см. Caesar et al. 2010, J. Intern. Med. 268:320; и Vrise et al. 2010, Diabetologia 53:606).
Несмотря на то, что известна связь между кишечной микробиотой и разными заболеваниями, не было понятно как воздействовать на микробиоту так, чтобы положительно повлиять на ассоциированные заболевания.
Никотиновую кислоту (ниацин, витамин В3), никотинамид (амид никотиновой кислоты) и/или L-триптофан в течение десятилетий использовали для терапии заболеваний, связанных с недостаточностью ниацина (например, пеллагры). Известно, что пеллагра может сопровождаться воспалением кишечника, интенсивность которого уменьшается после введения ниацина, где терапевтическим принципом является устранение недостаточности витамина, вызывающей воспаление кишечника (Segal et al. 1986, Int. J. Colorectal Dis. 1:238; и Clayton et al. 1991, Eur. J. Pediatr. 150:498).
Также известно, что никотиновая кислота имеет улучшающий здоровье эффект на холестериновые липопротеины в крови (отношение HDL (липопротеин высокой плотности) / LDL (липопротеин низкой плотности) и размер везикул LDL; Wahlberg et al. 1990, J. Intern. Med. 228:151; Seed et al. 1993, Atherosclerosis 101:61; Elam et al. 2000, JAMA 284:1263; McKenney et al. 2001, Am. J. Cardiol. 88:270).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предложение новых форм лечения для терапии и/или профилактики заболеваний человека и животных, ассоциированных с изменениями кишечной микробиоты и/или ухудшенным взаимодействием между кишечной микробиотой и кишечником.
Согласно данному изобретению вышеупомянутая проблема решается посредством фармацевтической композиции, которая содержит никотиновую кислоту, никотинамид, триптофан или другое описанное здесь соединение, которая, как считается, оказывает положительное влияние на кишечную микробиоту. В предпочтительных воплощениях никотиновую кислоту и/или никотинамид, и/или триптофан вводят для местного воздействия на слизистую кишечника и кишечную микробиоту. Например, активное вещество готовят для селективного введения в терминальный отдел подвздошной кишки или толстую кишку, где находится кишечная микробиота, которую необходимо модифицировать. В настоящем изобретении также рассматриваются другие активные вещества, которые превращаются в организме животного (например, в организме человека) в никотиновую кислоту и/или никотинамид, и/или триптофан.
Соответственно, предложены фармацевтические композиции, которые содержат никотиновую кислоту (ниацин, витамин В3) и/или никотинамид, и/или триптофан. Эти три вещества, индивидуально или в комбинации (комбинации двух или трех) друг с другом, оказывают противовоспалительное и/или положительное влияние на микробиоту в тонком кишечике и/или толстом кишечнике. Эта композиция подходит для перорального введения с контролируемым и/или отсроченным высвобождением активного ингредиента для специфичной локальной или местной эффективности в терминальном отделе подвздошной кишки и/или в толстой кишке. Примеры состояний, которые лечат, включают терапию или профилактику воспалительных заболеваний тонкого кишечника, воспалительных заболеваний толстого кишечника, профилактику карциномы толстой кишки и терапию или профилактику других заболеваний, которые возникают в результате изменений кишечной микробиоты и/или ухудшенного взаимодействия между кишечной микробиотой и кишечником. Данная композиция также подходит для (нео)ректального введения в толстую кишку или илеоанальный карман для локальной и/или местной терапии воспалительных заболеваний толстого кишечника или паучита.
Изобретение также включает способы лечения одного или более чем одного из описанных здесь заболеваний и состояний с использованием описанной здесь фармацевтической композиции. Кроме того, согласно изобретению предложено применение описанной здесь фармацевтической композиции для изготовления лекарственного средства для лечения одного или более чем одного из описанных здесь заболеваний и состояний.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
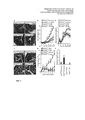
На Фиг. 1 показано предупреждение интенсификации колита, индуцированного DSS (декстрансульфат натрия), у мышей, дефицитных по АСЕ2 (ангиотензин-превращающий фермент 2), посредством никотинамида или триптофана. Верхний ряд: гистопатология толстой кишки (гематоксилин-эозиновое окрашивание в сутки 10 после введения DSS; шкала масштаба: 100 мкм (а)), потеря массы в процентах (б) и бальная оценка диареи (в) у стимулированных DSS нормальных в отношении АСЕ2 (АСЕ2+/y) и дефицитных по АСЕ2 (АСЕ2-/y) мышей, которым давали носитель или никотинамид (NAM) в питьевой воде. Введение NAM начиналось за 3 суток до введения DSS. Нижний ряд: гистопатология толстой кишки (гематоксилин-эозиновое окрашивание в сутки 7 после стимуляции DSS; планка: 100 мкм (г)), потеря массы в процентах (д) и повреждение крипт толстой кишки (е) у стимулированных DSS нормальных в отношении АСЕ2 (АСЕ2+/y) и дефицитных по АСЕ2 (АСЕ2-/y) мышей, которые получали нормальное питание (контроль) или триптофан-дипептидное питание (Trp+).
Все значения представляют собой средние значения со стандартной ошибкой для 3-10 мышей на группу.
*: P меньше 0,05; ** или ##: P меньше 0,01.
На Фиг. 2 показано развитие индекса активности болезни Крона (CDAI) у трех пациентов с недели (нед.) 0 до недели 4 при введении никотинамида (2 раза по 600 мг ежесуточно).
На Фиг. 3 показаны гистологические бальные оценки слизистой толстой кишки мышей, стимулированных декстрансульфатом натрия (DSS) для развития колита, и которых лечили либо никотинамидом (NAM), вводимым через зонд в воде, либо композицией минитаблетки NAM с контролируемым высвобождением, подмешанной в корм, либо 5-аминосалициловой кислотой, вводимой через зонд в виде суспензии в 0,5% метилцеллюлозе.
На Фиг. 4 показаны данные по индексу активности заболевания (DAI) у мышей, стимулированных декстрансульфатом натрия (DSS) для развития колита, которых лечили (1) никотинамидом (NAM), вводимым через зонд в воде, или (2) контрольными гранулами, смешанными с пищей, или (3) композицией гранул NAM с контролируемым высвобождением, смешанной с пищей, в трех дозах, или (4) композицией гранул 5-аминосалициловой кислоты (гранулы 5-ASA) с контролируемым высвобождением, смешанной с кормом. *, p меньше 0,05 по сравнению с контрольными гранулами; **, p меньше 0,01 по сравнению с контрольными гранулами; ***, p меньше 0,001 по сравнению с контрольными гранулами; ###, р меньше 0,001 по сравнению с такой же дозой NAM в воде.
На Фиг. 5 показано содержание миелопероксидазы (МРО) гомогенатов ткани толстой кишки от мышей, стимулированных декстрансульфатом натрия (DSS) для развития колита, и которых лечили (1) никотинамидом (NAM), вводимым через зонд в воде, или (2) контрольными гранулами, смешанными с пищей, или (3) композицией гранул NAM с контролируемым высвобождением, смешанной с кормом, в трех дозах, или (4) композицией гранул 5-аминосалициловой кислоты (гранулы 5-ASA) с контролируемым высвобождением, смешанной с кормом. *, p меньше 0,05 по сравнению с контрольными гранулами; ***, p меньше 0,001 по сравнению с контрольными гранулами.
На Фиг. 6 показано относительное количество основных типов бактерий Bacteroidetes и Firmicutes в образцах кала 5-8 мышей на группу до и после 12 суток питания с отсутствием триптофана, никотиновой кислоты или никотинамида (корм, не содержащий Trp/Nia/NAM). Корм, не содержащий Trp/Nia/NAM, включал: 1) контрольные гранулы без NAM или 5-аминосалициловой кислоты (5-ASA), (2) композицию гранул NAM с контролируемым высвобождением, смешанную с питанием, в трех дозах или (3) композицию гранул 5-аминосалициловой кислоты (5-ASA) с контролируемым высвобождением, смешанную с кормом.
На Фиг. 7 показаны процентные анализы сходства (SIMPER) состава микробиоты в образцах кала 5-8 мышей на группу до и после 12 суток питания с отсутствием триптофана, никотиновой кислоты или никотинамида (корм, не содержащий Trp/Nia/NAM). Корм, не содержащий Trp/Nia/NAM, включал: 1) контрольные гранулы без NAM или 5-аминосалициловой кислоты (5-ASA) или (2) композицию гранул NAM с контролируемым высвобождением, смешанную с кормом, в трех дозах или (3) композицию гранул 5-аминосалициловой кислоты (5-ASA) с контролируемым высвобождением, смешанную с кормом. Размножение неклассифицируемых Bacteroidales и представителей рода Paraprevotella Bacteroidales визуализируется заштрихованными частями столбиков.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Сутью изобретения является фармацевтическая композиция, содержащая одно, два или более чем два активных вещества, выбранных из никотиновой кислоты, никотинамида, триптофана, соединения, которое превращается в организме животного (например, в организме человека) в никотиновую кислоту, никотинамид или триптофан, никоти нам идаден и нди нуклеотида (NAD), никотинамидадениндинуклеотидфосфата (NADP), промежуточного соединения в биосинтезе NAD или NADP и дипептида триптофана, для положительного воздействия на кишечную микробиоту, где указанная фармацевтическая композиция предназначена для отсроченного высвобождения так, что она высвобождается (например, частично высвобождается, селективно высвобождается) в нижнем отделе тонкого кишечника, в толстой кишке или в обеих.
Авторы изобретения обнаружили, что никотиновая кислота и/или никотинамид, и/или триптофан проявляют противовоспалительный эффект путем воздействия на кишечную микробиоту (совокупность всех микроорганизмов в кишечнике, в частности, бактерий) таким образом, что они изменяют картину секреции противомикробных пептидов в кишечнике. Кишечная микробиота, измененная после введения фармацевтической композиции по изобретению, имеет меньший эффект, стимулирующий воспаление, или является противовоспалительной, таким образом, вызывая и/или поддерживая явное ослабление симптомов IBD (воспалительные заболевания кишечника), таких как болезнь Крона или язвенный колит, у человека или у других животных (например, хронический идиопатический колит у собак). Кроме того, здесь было впервые продемонстрировано, что фармацевтические композиции, которые высвобождают по меньшей мере часть их активного вещества в пораженной области желудочно-кишечного тракта, имеют значительно лучшую эффективность, чем фармацевтическая композиция, которая в значительной степени абсорбируется до достижения пораженной области.
Таким образом, выражение «положительно воздействующий на кишечную микробиоту» в том виде, как она здесь используется, относится к вызову изменения кишечной микробиоты, которое имеет положительное воздействие на состояние здоровья, особенно на одно или более чем одно из описанных здесь заболеваний и состояний. Например, положительные воздействия ассоциированы с уменьшением числа патогенных бактерий, уменьшением отношения патогенных бактерий к полезным бактериям, увеличением разнообразия микробиоты, уменьшением уровня воспаления, которое микробиота индуцирует в кишечнике, и частичным или полным обращением патологических изменений в энтеротипе микробиоты (например, энтеротипы, ассоциированные с Bacteroides, Prevotella и Ruminococcus). Бактерии, обычно считающиеся патогенными при воспалительных заболеваниях кишечника, включают, например, Enterobacteriaceae (например, Escherichia coli) с инвазивными свойствами или факторами вирулентности, сульфид-продуцирующие Desulfovibrio spp. и Fusobacterium spp. с инвазивными свойствами. Бактерии, обычно считающиеся полезными, включают виды родов Lactobacillus, Bifidobacterium и Faecalibacterium, такие как L. casei, L. plantarum и F. prausnitzii. Для недавнего обзора микробиоты кишечника при воспалительных заболеваниях кишечника см. Manichanh et al. 2012, Nat. Rev. Gastroenterol. Hepatol. 9:599.
В статье Hashimoto et al. (Nature 2012, 487:477), опубликованной после даты приоритета данной заявки, и содержание которой включено сюда посредством ссылки, приведено дополнительное доказательство, касающееся описанного здесь изобретения. Hashimoto et al. показали, что неправильное поглощение триптофана у мышей приводит к значительно повышенной тяжести колита, индуцированного раздражающим веществом - декстрансульфатом натрия (DSS). Добавка в пищу триптофана или никотинамида предотвращала это усиление колита. Hashimoto et al. продемонстрировали, что повышенная чувствительность к тяжелому колиту была обусловлена измененным микробиомом кишечника, который, при трансплантации другим мышам, также увеличивал тяжесть колита у реципиентов. Обнаружили, что вредное изменение микробиома кишечника обусловлено значительно пониженным количеством определенных противомикробных пептидов (AMP), особенно альфа-дефенсинов, экспрессия которых в эпителиальных клетках терминального отдела подвздошной кишки контролировалась, главным образом, сигнализацией mTOR, индуцированной триптофаном или никотинамидом.
Поскольку хроническое воспаление кишечника сильно увеличивает риск развития карциномы толстой кишки (для обзора см., например, Ullman & Itzkowitz 2011, Gastroenterology 140:1807), применение композиции по изобретению также является профилактикой карциномы толстой кишки в случае хронического или рецидивирующего воспаления кишечника.
Было показано, что терапевтическое вмешательство путем установления или восстановления нормальной микробиоты кишечника или посредством дополнения полезных бактерий является эффективным в разнообразных моделях заболеваний и при соответствующих заболеваниях человека. Например, Olszak et al. (Science 2012, 336:489) недавно продемонстрировали, что патологическое накопление инвариантных естественных Т-киллеров в пораженных заболеванием органах безмикробных мышиных моделей IBD или астмы может быть предотвращено колонизацией новорожденных мышей нормальной микробиотой. Исследования продемонстрировали благоприятные эффекты определенных пре-, про- или синбиотиков при разных заболеваниях. Например, лактобациллы могут снижать уровни холестерина в крови при ожирении, но данный механизм все еще не полностью ясен (см. обзор Caesar et al. 2010, J. Intern. Med. 268:320). При воспалительных заболеваниях кишечника в ограниченном числе клинических исследований были успешно использованы некоторые пробиотики, подобные VSL#3 (смесь Bifidobacterium breve, Bifidobacterium longum, Bifidobacterium infantis, Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus paracasei, Lactobacillus delbrueckii ssp. bulgaricus и Streptococcus thermophilus). По-видимому, дополнение по меньшей мере несколькими штаммами бактерий обычно является необходимым для обеспечения значимой терапевтической пользы. Недавним примером очевидной эффективности комплексного бактериального вмешательства является успешное применение трансплантации кала против Clostridium difficile (van Nood etal. 2013, New Engl. J. Med. 368:407).
Поскольку патологические изменения кишечной микробиоты также могут быть причиной множества других заболеваний, возникающих из-за атопических расстройств, а также метаболических заболеваний с воспалительным компонентом, терапия и/или профилактика таких заболеваний также находится в пределах объема данного изобретения. В частности, следующие заболевания являются примерами таких показаний:
- заболевания кожи: аллергия, атопическая экзема, псориаз;
- заболевания легкого: муковисцидоз, астма, ХОБЛ (хроническая обструктивная болезнь легких);
- заболевания сосудов: коронарная болезнь сердца, артериосклероз, атеросклероз;
- заболевания эндокринной системы: диабет, ожирение.
Изобретательское, специфичное, местное применение никотиновой кислоты и/или никотинамида, и/или триптофана (и родственных активных веществ) для местного влияния на слизистую кишечника и кишечную микробиоту, кишечные воспаления и прямая терапия слизистой кишечника возникают в результате описанного здесь понимания ранее неизвестной и неожиданной роли данных соединений. Это применение значительно отличается от традиционных применений активных веществ, где данные вещества поглощаются, и предполагается, что они действуют системно. Вследствие их нового противовоспалительного эффекта и/или их эффекта, модифицирующего кишечную микробиоту, никотиновая кислота и/или никотинамид, и/или триптофан (и другие описанные здесь соединения) являются, таким образом, подходящими в качестве активных веществ для лечения воспалительных заболеваний тонкого кишечника и/или толстого кишечника. Конкретные состояния включают лечение кишечных воспалений, профилактику карциномы толстой кишки и терапию или профилактику других заболеваний, которые возникают в результате изменений кишечной микробиоты и/или ухудшенного взаимодействия между кишечной микробиотой и кишечником. Предпочтительно, эти активные вещества используются в фармакологической композиции, которая защищает максимально возможное количество активного вещества от абсорбирования организмом в верхнем отделе тонкого кишечника и скорее осуществляет высвобождение (например, контролируемое высвобождение и/или отсроченное высвобождение) в терминальном отделе подвздошной кишки или в толстой кишке, где находится кишечная микробиота, подлежащая модификации (например, активное вещество селективно высвобождается в терминальном отделе подвздошной кишки и/или в толстой кишке).
В частности, описанные здесь активные вещества, таким образом, подходят для использования в лекарственных средствах с местным высвобождением (например, контролируемым или отсроченным высвобождением) для терапии болезни Крона, язвенного колита, паучита, других хронических заболеваний толстого кишечника или воспалений толстого кишечника, воспаления в отключенной кишке, инфекционного энтерита, диареи, ассоциированной с приемом антибиотиков, такой как диарея, ассоциированная с С. difficile, инфекционного колита, дивертикулита и воспалений, которые формируются под воздействием облучения, антибиотиков, химиотерапевтических агентов, фармацевтических продуктов или химических соединений, а также для профилактики карциномы толстой кишки и для терапии или профилактики других заболеваний, которые возникают в результате изменений кишечной микробиоты и/или ухудшенного взаимодействия между кишечной микробиотой и кишечником.
Заявленные вещества одинаково пригодны для терапии или профилактики заболеваний с аналогичным генезисом и у человека, и у других млекопитающих, в частности у домашних и полезных животных. Примерами таких животных являются, без объективного ограничения, собаки, кошки, лошади, верблюды или коровы.
Активные вещества, т.е. никотиновая кислота и/или никотинамид, и/или триптофан, могут быть использованы в любой форме, доступной на рынке, например, произведенные Merck KgaA. Триптофан можно использовать в виде одиночной аминокислоты или дипептида, например, в виде дипептида Gly-Trp.
Помимо никотиновой кислоты, никотинамида и триптофана в описанном здесь изобретении могут быть использованы другие родственные соединения в качестве активных веществ. Например, подходящими являются соединения, которые превращаются в организме человека или животного в один из этих агентов (например, посредством гидролиза, метаболизма), такие как сложные эфиры никотиновой кислоты. Кроме того, можно использовать промежуточные соединения в синтезе никотинамидадениндинуклеотида (NAD) или NAD фосфата (NADP), такие как N-формилкинуренин, L-кинуренин, 3-гидрокси-L-кинуренин, 3-гидроксиантранилат, 2-амино-3-карбоксимуконата полуальдегид, хинолинат и бета-никотинат D-рибонуклеотида. Другие примеры включают NAD и NADP.
Фармацевтические композиции, которые содержат никотиновую кислоту и/или никотинамид, и/или триптофан (или одно из других описанных выше веществ), можно вводить перорально с замедленным высвобождением активного вещества или также посредством ректального способа применения (например, клизмы или суппозитории). Местом доставки активного вещества для ингибирования воспалительного процесса предпочтительно являются нижние части тонкого кишечника и/или толстая кишка, и оно, таким образом, фундаментально отличается от способов применения, которое, например, для терапии пеллагры, преследует цель максимального поглощения и метаболизма в организме и, таким образом, достижения системного эффекта. Кроме того, способ введения согласно изобретению и дозировка согласно изобретению минимизируют вероятность проявления побочных эффектов, например, как описано в связи с системным введением никотиновой кислоты.
Термин «нижний отдел тонкого кишечника» в том виде, как он здесь используется, относится ко второй половине тонкого кишечника, и «терминальный отдел подвздошной кишки» представляет собой вторую половину подвздошной кишки.
В данном отношении настоящее изобретение также включает комбинированные препараты, такие как комбинации никотиновой кислоты и/или никотинамида с ацетилсалициловой кислотой и/или антагонистами простагландина D2, такими как ларопипрант, которые уменьшают типичные для никотиновой кислоты побочные эффекты. Состав и дозировка таких комбинаций известна специалисту в данной области. Кроме того, применение никотинамида вместо никотиновой кислоты, который является предпочтительным согласно данному изобретению, минимизирует вероятность проявления побочных эффектов.
Для того чтобы получать вводимые перорально композиции активного вещества, оказывающего противовоспалительный и/или модифицирующий эффект на кишечную микробиоту в терминальном отделе подвздошной кишки и/или в толстой кишке, преимущественным и инновационным, таким образом, является применение способов контролируемого и/или отсроченного высвобождения. В отличие от традиционных (в некоторых случаях также с отсрочкой) способов высвобождения для оптимального добавления, например, в случае пеллагры, в определенных воплощениях настоящего изобретения частично или по существу избегается поглощение в желудке и в верхних частях тонкого кишечника.
Для того чтобы лечить болезнь Крона или язвенный колит, подходят пероральный и/или ректальный способы (например, в виде клизмы) применения. Для того чтобы лечить паучит в случае язвенного колита, предпочтительным является ректальное применение (например, в виде клизмы). Оно также может быть поддержано пероральным введением описанных выше пероральных композиций, например, препаратов с отсроченным высвобождением. Для симптоматической терапии любой другой формы колита могут быть выбраны и пероральное, и ректальное применения для терапевтической модификации кишечной микробиоты. Пероральное применение является предпочтительным для профилактики карциномы толстой кишки, в частности, в случае язвенного колита, и для терапии и/или профилактики других заболеваний, которые частично или по существу возникают в результате изменений кишечной микробиоты и/или ухудшенного взаимодействия между кишечной микробиотой и кишечником.
Для перорального введения особенно подходят особые лекарственные формы, которые контролируют и/или откладывают высвобождение активного вещества благодаря специальным галенам (так называемые формы с контролируемым высвобождением, медленным высвобождением или отсроченным высвобождением). Такие лекарственные формы могут представлять собой простые таблетки и также покрытые таблетки, например, пленочные таблетки или драже. Таблетки обычно являются круглыми или двояковыпуклыми. Также являются возможными таблетки продолговатой формы, которые позволяют делить таблетку. Кроме того, возможными являются гранулы, сфероиды, пеллеты или микрокапсулы, которыми заполняют пакетики или капсулы, когда это целесообразно.
Термин «отсроченное высвобождение» предпочтительно относится к фармацевтической композиции, которая высвобождает активные ингредиенты после периода задержки. В определенных воплощениях задержка является достаточной для того, чтобы по меньшей мере часть активных веществ в композиции высвободилась в нижнем отделе тонкого кишечника (например, в терминальном отделе подвздошной кишки) и/или в толстой кишке.
Термин «контролируемое высвобождение» предпочтительно относится к фармацевтической композиции или ее компоненту, который высвобождает или доставляет один или более чем один активный ингредиент на протяжении длительного периода времени. В определенных воплощениях данный период времени является достаточным для того, чтобы по меньшей мере часть активных веществ в композиции высвободилась в нижнем отделе тонкого кишечника (например в терминальном отделе подвздошной кишки) и/или в толстой кишке.
Задержка преимущественно достигается, например, посредством покрытий, устойчивых к желудочному соку и растворяющихся в зависимости от рН, посредством технологий на основе микроцеллюлозных или мультиматриц (ММХ), посредством применения матриц на основе разных носителей или комбинации этих методик. Примеры включают пленочные покрытия, которые содержат акриловые и/или метакрилатные полимеры в разных смесях для контролируемого и/или отсроченного высвобождения. Например, активное(-ые) вещество(-а) может содержаться в традиционной матрице из микрокристаллической целлюлозы или желатина, или матрице, приготовленной с использованием технологии ММХ, которая покрыта веществом, которое обеспечивает отсроченное высвобождение активного вещества. Предпочтительным является введение активного вещества в капсулы большого объема (например, из желатина, имеющие объем 0,68 мл), которые покрывают посредством известных способов. Подходящими покрытиями являются нерастворимые в воде воска и полимеры, такие как полиметакрилаты (например, номенклатура продукции с торговым наименованием Eudragit®, в частности Eudragit® S и Eudragit® L, Evonik Industries AG, Эссен, Германия), и нерастворимые в воде целлюлозы (например, метилцеллюлоза, этилцеллюлоза). Когда это целесообразно, в веществе покрытия также могут содержаться водорастворимые полимеры (например, поливинилпирролидон), водорастворимые целлюлозы (например, гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза), полисорбат 80, полиэтиленгликоль (PEG), лактоза или маннит.
Например, комбинация соединений Eudragit® S и L (например, Eudragit® L/S 100) осуществляет контролируемое высвобождение активных веществ согласно изобретению при рН больше 6,4, что имеет место в терминальном отделе подвздошной кишки. Также допустимы другие применения препаратов Eudragit® и их смесей (соединения L, S и R) для упаковки активного вещества и, следовательно, может достигаться местное применение в выбранных частях всего желудочно-кишечного тракта посредством контролируемого высвобождения при определенных значениях рН.
Фармацевтическая композиция также может содержать другие вещества фармацевтических эксципиентов, такие как связующие вещества, наполнители, глиданты, смазки и агенты, регулирующие текучесть. Эти соединения согласно изобретению могут быть приготовлены, когда это целесообразно, совместно с другими активными веществами и с эксципиентами, традиционными в фармацевтических композициях, например, с тальком, аравийской камедью, лактозой, крахмалом, стеаратом магния, маслом какао, водными и неводными носителями, липидными компонентами животного или растительного происхождения, производными парафина, гликолями (в частности, полиэтиленгликолем), разными пастификаторами, диспергирующими агентами, эмульгаторами и/или консервантами.
Для получения клизм или суппозиториев для ректального применения, препараты активного вещества можно растворять в подходящем растворителе и дополнительно перерабатывать в клизмы или суппозитории согласно известным фармацевтическим способам.
Содержание активного вещества в конечной лекарственной форме составляет 1-3000 мг, предпочтительно 100-1000 мг, в случае перорального введения; клизмы и/или суппозитории могут содержать количество активного вещества от 10 мг до 5000 мг. В зависимости от интенсивности и тяжести воспалительного заболевания, лекарственные формы вводятся один раз или несколько раз в сутки или согласно другой схеме дозировке, которая должна быть выбрана лечащим врачом.
Термины «лечение», «лечить» и «проведение лечения» в том виде, как они здесь используются, относятся к обращению, уменьшению интенсивности, откладыванию начала или ингибированию развития заболевания или расстройства, или одного или более чем одного его симптома, как здесь описано. В некоторых воплощениях лечение можно вводить после развития одного или более чем одного симптома. В других воплощениях лечение можно назначать в отсутствие симптомов. Например, лечение можно назначать чувствительному индивиду до начала симптомов (например, в свете истории симптомов и/или в свете генетических или других факторов чувствительности). Лечение также можно продолжать после устранения симптомов, например, для предупреждения или откладывания их рецидива.
Термины «профилактика» и «предупреждать» в том виде, как они здесь используются, относятся к задержке начала или к уменьшению вероятности развития заболевания или расстройства, или одного или более чем одного его симптома по сравнению с не подвергавшейся лечению контрольной популяцией.
Другим описанным здесь аспектом изобретения является эффективное применение заявленных лекарственных средств на основе генетических и/или микробиологических данных и специфических потребностей индивидов, подлежащих лечению. Новое понимание генетической предрасположенности индивидов ко всем типам заболеваний (в частности, также к заболеваниям, при которых ухудшается взаимодействие между кишечной микробиотой и кишечником) и фармакогенетики указывает на то, что доказательная персонализированная медицина, включающая генетические анализы релевантных генов риска и также генов, которые кодируют, например, рецепторы клеточной поверхности, белки-транспортеры, ферменты метаболизма или белки трансдукции сигнала, которые взаимодействуют с лекарственным средством и/или с его метаболитами, и/или с его работающими позднее эффекторами, может давать информацию и улучшения в отношении типа применения, способа применения, времени применения, дозы и/или схемы дозировки описанных здесь лекарственных средств. Индивиды, которые могут получать пользу от данного персонализированного лечения включают индивидов с пониженным сывороточным триптофаном, измененной экспрессией В°АТ1 (например, в эпителиальных клетках кишечника) и полиморфизмами В°АТ1. Это аналогичным образом применимо к анализам кишечной микробиоты, особенно когда образец кала указывает на изменение микробиоты. Настоящее изобретение, таким образом, также включает применение подходящих способов на основе генетических и/или микробиологичеких анализов для идентификации индивидов, особенно чувствительных к лекарственным средствам согласно изобретению, и/или для адаптации применения лекарственных средств согласно изобретению к индивидуальным обстоятельствам. Это также прямо включает применение разных веществ (никотиновая кислота и/или никотинамид, и/или триптофан) в разных способах введения, в зависимости от генетических и микробиологических характеристик индивида. Для этих целей можно использовать лабораторные анализы и/или подходящие наборы для анализов и также способы измерения, устройства и/или наборы для применения лечащим врачом, пользователем и/или пациентом, например, для отбора образцов кала или для анализа подходящих параметров в крови, моче или других жидкостях организма.
ПРИМЕРЫ
Существуют различные возможности полезного развития и дальнейшего развития идей настоящего изобретения. С этой целью делается ссылка на приведенные ниже примеры, которые репрезентативно описывают изобретение.
Пример 1:
Новые данные и открытия, не опубликованные на время подачи приоритетной заявки, позднее опубликованные Hashimoto et al. (Nature 2012, 487:477), поддерживают идеи настоящего изобретения и вкратце описаны здесь с целью иллюстрации: известно, что экспрессия транспортера нейтральных аминокислот В°АТ1 (который транспортирует триптофан) на поверхности эпителиальных клеток кишечника связана с присутствием ангиотензин-превращающего фермента 2 (Kowalczuk et al. 2008, FASEB J. 22:2880; Camargo et al. 2009, Gastroenterology 136:872). Дефектный ACE2 приводит к заболеванию, связанному с аминокислотной недостаточностью (так называемая болезнь Хартнапа), картина заболевания которого аналогична пеллагре, и которое можно лечить путем усиленной подачи триптофана и никотинамида. Мышиная модель теперь продемонстрировала, что мыши без функционирующего АСЕ2 (генотип: Асе2-/y) страдали от существенно более сильных искусственно индуцированных кишечных воспалений, чем мыши с нормальным генотипом (Асе2+/y), когда им давали вещество декстрансульфат натрия (DSS). Достаточно интересно то, что можно было уменьшать данный эффект до значения, характерного для генетически нормальных мышей, путем профилактического и постоянного введения никотинамида (NAM) или путем скармливания дипептидов триптофана (которые поглощаются посредством транспортера, отличного от В°АТ1, который здесь не доступен). Сопровождающие данные обобщены на Фиг. 1 и поддерживают настоящее изобретение относительно содержания открытий и формулы изобретения для применения у человека и животного с точки зрения мышиной модели.
Пример 2:
Для анализа изменения кишечной микробиоты при подаче никотинамида, геномную ДНК выделяют из образцов кала согласно предшествующему уровню техники и подвергают количественному измерению, и вариабельную область гена бактериальной 16S рРНК амплифицируют, где ампликоны получают при использовании подходящих маркеров с целью идентификации. После высокопроизводительного пиросеквенирования ампликонов все полученные последовательности подвергают контролю качества и анализируют многоэтапным сравнением последовательности с рекомендованными базами последовательностей бактериальных ДНК. Выявляют корреляции и оценивают различия полученных репрезентативных профилей кишечной микробиоты в образцах кала обработанных и необработанных индивидов при сопоставлении с наблюдаемыми и измеренными симптомами заболевания и релевантными генетическими факторами индивидов.
На Фиг. 2 показано развитие индекса активности болезни Крона (CDAI), т.е. активности заболевания, рассчитанной согласно признанному стандарту на основе различных параметров заболевания от трех пациентов, которые страдали от болезни Крона, и которых лечили приготовленным традиционным способом никотинамидом в высокой дозе в течение 4 недель (2×600 мг ежесуточно). Значение CDAI меньше 150 эквивалентно ремиссии. Все три пациента, страдающих от болезни Крона, демонстрировали явный ответ на введение никотинамида, причем у двух из них ремиссия достигалась в пределах периода терапии.
Лежащий в основе механизм и полезный эффект никотинамида, описанный Hashimoto et al. 2012 (Nature 487:477) для модели мышиного колита (см. Пример 1), соответствуют клиническому улучшению у пациентов-людей с болезнью Крона в ответ на добавление никотинамида, наблюдаемому в этом примере.
Пример 3:
Неожиданно оказалось, что, хотя экспрессия АСЕ2 в слизистой кишечника пациентов, страдающих от болезни Крона и язвенного колита, и не отличается значимо от значений у здоровых индивидов (данные не показаны), экспрессия В°АТ1 в воспаленных частях слизистой снижалась очень сильно и статистически значимо (значение P меньше 0,05) (см. Таблицу 1). Кроме того, контрольные образцы от пациентов, страдающих от кишечных воспалений разного генезиса (так называемые контроли специфичности заболевании), не демонстрировали значимых отклонений от госпитализированных нормальных людей (HN). Это свидетельствует против заболевания, связанного с общей, неспецифичной недостаточностью или недостаточностью аминокислот, и в пользу специфичных эффектов никотиновой кислоты, никотинамида и/или триптофана (и родственных соединений) в лечении IBD, которые вновь наблюдали в настоящем изобретении.
Недостаточность транспортера триптофана, наблюдаемая у пациентов с IBD, наблюдаемая в этом примере, соответствует ситуации у мышей с усугубившимся колитом из-за недостаточности транспортера триптофана (Hashimoto et al. 2012, Nature 487:477; см. Пример 1).
Пример 4:
Для того чтобы охарактеризовать преимущество композиций с контролируемым высвобождением для направленной доставки никотинамида к эпителию кишечника, провели исследование для подтверждения концепции в модели колита, индуцированного декстрансульфатом натрия (DSS), у мышей. Индуцированный DSS колит представляет собой стандартизированную модель колита для оценки эффективности лекарственного средства-кандидата для воспалительных заболеваний кишечника человека. В качестве контрольного лечения, обычно эффективного при колите, индуцированном DSS, использовали 5-аминосалициловую кислоту (5-ASA). 5-ASA является почти нерастворимой при физиологическом рН и поэтому ее вводили в виде суспензии в 0,5%-й метилцеллюлозе.
Из-за видоспецифичных различий в желудочно-кишечном тракте в показателях длины, времени прохождения и рН среды, композиции с контролируемым высвобождением адаптировали для организма, который подлежал лечению. На основе параметров мышиного желудочно-кишечного тракта (Koopman et al. 1978, Lab. Anim. 12:223; McConnell et al. 2008, J. Pharm. Pharmacol. 60:63) получали специфичную для мышей композицию для исследования для подтверждения концепции у мышей.
Получали минитаблетки с контролируемым высвобождением с использованием порошка, состоящего из смеси 99% NAM и 1% стеарата магния (оба от Caelo, Hilden, Германия) в качестве смазки. После смешивания порошок характеризовали в показателях сыпучести порошка (угол естественного откоса; меньше 35°) и распределения по размеру (лазерная дифракция; главная фракция частиц: 100-200 мкм) для обеспечения хорошей сыпучести порошка. Затем получали минитаблетки на ротационном прессе и покрывали пленкой из нерастворимого в воде полимера Kollidon SR 30 D (BASF, Ludwigshafen, Германия) для контроля высвобождения NAM посредством диффузии NAM через пленку. Композиция для покрытия была следующей: Kollicoat SR 20 D (49,9%), глицерина моностеарат 60 (0,743%), пропиленгликоль (0,743%), красный железооксидный краситель (0,4%), полисорбат 80 (0,314%) и вода для доведения до 100%.
Моностеарат глицерина 60 (Caelo) нагревали с половиной объема воды до 80°С и эмульгировали с Ultraturrax (IKA, Staufen, Германия). Затем добавляли красный железооксидный краситель (Caelo) и диспергировали в течение еще 5 мин (первая емкость). Дисперсии полисорбата 80 (Caelo), пропиленгликоля (Caelo) и полимера объединяли во второй емкости и перемешивали с использованием магнитной мешалки. Холодную (меньше 30°С) эмульсию из первой емкости объединяли с дисперсией полимера из второй емкости, и добавляли остальную воду. Дисперсию перемешивали в течение 1 ч перед фильтрованием (меньше 500 мкм). Минитаблетки покрывали в аппарате псевдоожижения (Mycrolab, Hüttlin, Schopfheim, Германия) при размере партии 50 г со скоростью подачи жидкости примерно 1 мл/мин и давлением распыления 70 кПа. Перед распылением таблетки предварительно нагревали потоком в объеме 8 м3 при 45°С. Во время распыления объемный ток увеличивали до 16 м3 при 45°С. Наблюдали температуру продукта примерно 38°С. После распыления таблетки ожижали с использованием 16 м3 в течение еще 10 мин при 45°С для отверждения. На последнем этапе процесса нагревание выключали, и слой таблеток охлаждали до менее 30°С для того, чтобы избежать слипания. Таблетки покрывали с использованием 6,2 плюс/минус 0,04 мг/см2. Высвобождение лекарственного средства определяли на приборе с лопастями (DT6, Erweka, Heusenstamm, Германия) согласно Европейской Фармакопее при 50 об./мин. Фосфатный буфер (рН 4) использовали в качестве среды для растворения, так как у мышей ожидается слабокислый желудочно-кишечный сок примерно с этим значением рН (McConnell et al. 2008, J. Pharm. Pharmacol. 60: 63-70). Концентрацию лекарственного средства определяли посредством поглощения в УФ (ультрафиолетовая область спектра) при 262 нм. Непокрытые таблетки демонстрировали мгновенное высвобождение лекарственного средства из-за крошечного размера таблеток и высокой водорастворимости никотинамида. С использованием покрытия Kollidon SR высвобождение лекарственного средства было оптимизировано для покрытия целевых площадей в тонком кишечнике мышей (лаг-период по меньшей мере 15 мин, постоянное высвобождение лекарственного средства в течение 3 ч). Минитаблетки гомогенно смешивали с пищевым порошком, не содержащим триптофан/ниацин, при использовании минимального количества стерильной воды формировались пеллеты приблизительно 2 см длины и 1 см диаметра, их замораживали в аликвотах для однократного применения при -20°С для хранения и оттаивали каждые сутки для кормления мышей.
Самцов мышей C57B L/6J (не содержащих специфических патогенов; Taconic Europe, Ry, Дания) отбирали в испытательный комплекс в возрасте 6-7 недель и акклиматизировали в течение 2-х недель. Кормом на протяжении фазы акклиматизации служил Altromin 1324, произведенный Altromin (Lage, Германия). После 2-х недель акклиматизации корм заменяли на сделанный на заказ корм без триптофана или никотиновой кислоты, или никотинамида (корм, не содержащий Trp/Nia/NAM), который был изготовлен Ssniff (Soest, Германия). В сутки смены корма начинали схему лечения, как определено ниже. И корм, не содержащий Trp/Nia/NAM, и обработку вводили до умерщвления мышей. После 12 суток получения корма, не содержащего Trp/Nia/NAM, мышей стимулировали 1,5% DSS (MP Biomedicals, Illkirch, Франция) в питьевой воде в течение 4-х суток и затем умерщвляли.
Схему обработки осуществляли с использованием четырех групп по 10 мышей в каждой, которых обрабатывали следующим образом:
Группа 1: ежесуточное пероральное зондовое введение 0,25 мл носителя (стерильная вода).
Группа 2: ежесуточное пероральное зондовое введение 0,25 мл раствора никотинамида (Кат. №4488; Caelo) в стерильной воде (6 мг/мл; конечная доза: примерно 60 мг/кг массы тела).
Группа 3: минитаблетки NAM с контролируемым высвобождением, гомогенно диспергированные в корме (конечная доза: примерно 60 мг/кг массы тела на основе потребления пищи 2,5 г на мышь в сутки).
Группа 4: ежесуточное пероральное зондовое введение 0,25 мл 5-аминосалициловой кислоты (5-ASA; Кат. № А3537, Sigma-Aldrich, Brondby, Дания), суспендированной в 0,5% метил целлюлозе (Кат. № М7140, Sigma-Aldrich) в концентрации 15 мг/мл (конечная доза: примерно 150 мг/кг массы тела).
Готовили свежие растворы доз из тех же исходных растворов каждые сутки непосредственно перед введением.
Непосредственно перед изменением питания, перед индукцией колита DSS и перед умерщвлением у каждого животного отбирали свежие образцы кала, эквивалентные двум фекальным комкам, для анализов микробиома. Образцы кала немедленно мгновенно замораживали в жидком азоте и хранили при -80°С. Мгновенное замораживание проводили для сохранения соотношений между разными бактериями с разными ростовыми характеристиками при условиях окружающей среды.
Непосредственно после умерщвления животных толстую кишку промывали 0,9%-м физиологическим раствором, и подготавливали образцы по типу «швейцарского рулета» (Moolenbeek and Ruitenberg 1981: Lab. Anim. 15: 57). Вкратце, очищенную толстую кишку продольно вскрывали, связывали так, чтобы ворсинки смотрели наружу, и образующуюся трубку фиксировали в формальдегиде и заливали в парафин согласно стандартным методикам. Препарат по типу «швейцарского рулета» обеспечивает продольную и количественную гистологическую оценку всей слизистой толстой кишки на том же самом предметном стекле со срезом. Срезы окрашивали гематоксилин-эозином согласно стандартным методикам. Образцы оценивались двумя независимыми исследователями вслепую, и им давали бальную оценку согласно следующей системе, основанной на трех параметрах:
Тяжесть воспаления: 0, редкие воспалительные клетки в собственной пластинке; 1, повышенное число гранулоцитов в собственной пластинке, отек под слизистой; 2, скопление воспалительных клеток, распространяющихся в подслизистый слой; 3, пронизывающее стенку распространение воспалительного инфильтрата.
Повреждение крипт: 0, интактные крипты; 1, потеря базальной трети; 2, потеря базальных двух третей; 3, потеря всей крипты; 4, изменение поверхности эпителия с эрозией; 5, конфлюентная эрозия.
Изъязвление: 0, отсутствие язв; 1, 1 или 2 очага изъязвлений; 2, 3 или 4 очага изъязвлений; 3, конфлюентное или обширное изъязвление.
Максимальная гистологическая бальная оценка составляла 3 плюс 5 плюс 3 равно 11.
Гистологическая оценка вслепую всей слизистой толстой кишки была выбрана в качестве грубого ожидаемого результата терапевтического эффекта заявленных композиций NAM.
Гистологические бальные оценки четырех групп показаны на Фиг. 3 и выражены в виде средних значений и стандартных отклонений. Использовали лишь оптимальным образом законсервированные и приготовленные образцы и срезы толстой кишки (число животных в следующем тексте представлено в скобках). Бальные оценки были следующими:
группа 1 (водный контроль): 6,25 плюс/минус 1,39 (n равно 8);
группа 2 (NAM в воде): 5,14 плюс/минус 1,07 (n равно 7);
группа 3 (таблетки NAM с контролируемым высвобождением): 3,38 плюс/минус 0,92 (n равно 8);
группа 4 (5-ASA): 6,50 плюс/минус 1,60 (n равно 8).
В то время как NAM в питьевой воде индуцировал лишь тенденцию к уменьшению бальной оценки гистологического воспаления по сравнению с водным контролем (p равно 0,1), наблюдали высокозначимое различие как между таблетками NAM с контролируемым высвобождением и группой водного контроля (p меньше 0,001), так и, что важно, между NAM в воде и NAM с контролируемым высвобождением (p меньше 0,01). Интересно, что контрольное лечение 5-ASA (которая снижает интенсивность нормального индуцированного DSS колита и широко используется для терапии воспалительных заболеваний кишечника у человека) не могло уменьшить интенсивность индуцированного DSS колита в отсутствие триптофана или ниацина (Фиг. 3). Данные открытия поддерживают идею настоящего изобретения о том, что благоприятные воздействия NAM на кишечную микробиоту и на колит не оптимально используются при системной доставке посредством перорального зондового питания, но, вместо этого, оптимально используются посредством композиций с контролируемым высвобождением в кишечнике, и что первичный эффект NAM оказывает на местное окружение в кишечнике.
Пример 5:
Для того чтобы далее охарактеризовать композиции с контролируемым высвобождением для направленной доставки никотинамида к кишечному эпителию, провели второе исследование для подтверждения концепции на модели индуцированного декстрансульфатом натрия (DSS) колита у мышей. В этом втором и большем исследовании для подтверждения концепции композицию гранул NAM с контролируемым высвобождением тестировали в трех разных дозах. В качестве контрольного лечения, обычно эффективного при индуцированном DSS колите, использовали гранулы с контролируемым высвобождением, содержащие 5-аминосалициловую кислоту (гранулы 5-ASA; PENTASA, Ferring Pharmaceuticals, Saint-Prex, Швейцария).
Композиция NAM с контролируемым высвобождением представляет собой гранулят из 25% никотинамида, 70% двухосновного фосфата кальция и 5% повидона К30. Средний размер частиц составлял 234 мкм. Гранулят затем покрывали пленкой с этилцеллюлозой 7, с достижением 30%-го увеличения массы и среднего размера частиц 640 мкм. Фильтрование удаляло частицы с размером меньше, чем 355 мкм. В контрольных гранулах NAM был заменен эквивалентным количеством двухосновного фосфата кальция.
Самцов мышей C57B L/6J (не содержащих специфических патогенов, Charles River Laboratories, Saint-Germain-sur-l'Arbresle, Франция) забирали в испытательный комплекс в возрасте больше 12 недель и акклиматизировали в течение 1,5 месяцев для того, чтобы обогатить и стабилизировать их микробиоту. Кормом на протяжении фазы акклиматизации был корм А4, произведенный SAFE (Scientific Animal Food and Engineering, Augy, Франция). После акклиматизации корм заменяли сделанным на заказ кормом без триптофана или никотиновой кислоты, или никотинамида (корм, не содержащий Trp/Nia/NAM), который был изготовлен Ssniff (Soest, Германия). Корм, не содержащий Trp/Nia/NAM, поставляли в виде порошка, который использовали для получения пищевых пеллетов либо без гранул, либо с контрольными гранулами без NAM или 5-ASA, либо с гранулами NAM, либо с гранулами 5-ASA. Гранулы равномерно распределяли в корме. Формировали пищевые пеллеты приблизительно 2 см длины и 1 см диаметра с использованием минимального количества стерильной воды, замораживали в аликвотах для однократного применения при -20°С для хранения и оттаивали каждые сутки для кормления мышей. Содержание гранул пищевых пеллетов было определено следующим образом с расчетом на основе массы тела 30 г и ежесуточного потребления пищи 3 г.
Гранулы 5-ASA (целевая доза 5-ASA: 150 мг/кг массы тела; содержание 5-ASA: 52%): 4,5 мг 5-ASA требовалось на 3 г пищи; 8,65 мг гранул требовалось на 3 г пищи; 2,88 г гранул добавляли на кг пищи. Фиксированные дозы для других гранул рассчитывали аналогичным образом.
Гранулы NAM (целевые дозы NAM: 30, 60 или 120 мг/кг массы тела; содержание NAM: 19,1%): для 30 мг/кг NAM, 1,57 г гранул на кг пищи; для 60 мг/кг NAM, 3,14 г гранул на кг пищи; для 120 мг/кг NAM, 6,28 г гранул на кг пищи.
Контрольные гранулы добавляли в пищу в том же самом соотношении, что и гранулы NAM в дозовой группе 120 мг/кг, т.е. 6,28 г гранул на кг пищи.
В сутки, в которые корм сменили на корм, не содержащий Trp/Nia/NAM, с гранулами или без них, начинали схему лечения с пероральным зондовым кормлением для групп 1 и 2, как определено ниже. И корм, не содержащий Trp/Nia/NAM, с гранулами или без них, и лечение посредством зондового кормления вводили до умерщвления мышей. После 12 суток кормления кормом, не содержащим Trp/Nia/NAM, мышей стимулировали 1,5% DSS (TDB Consultancy, Упсала, Швеция) в питьевой воде в течение пяти суток и умерщвляли после еще двух суток, на протяжении которых им давали нормальную питьевую воду.
Данную схему лечения осуществляли с использованием семи групп по 10 мышей в каждой, которых лечили следующим образом:
Группа 1: ежесуточное пероральное зондовое кормление 0,1 мл носителя (стерильная вода).
Группа 2: ежесуточное пероральное зондовое кормление 0,1 мл раствора NAM (Sigma-Aldrich, Brondby, Дания) в стерильной воде (18 мг/мл; конечная доза: примерно 60 мг/кг массы тела).
Группа 3: контрольные гранулы в корме (содержание гранул, соответствующее группе 6).
Группа 4: гранулы NAM в корме (конечная доза: 30 мг/кг массы тела).
Группа 5: гранулы NAM в корме (конечная доза: 60 мг/кг массы тела).
Группа 6: гранулы NAM в корме (конечная доза: 120 мг/кг массы тела).
Группа 7: гранулы 5-ASA в корме (конечная доза: 150 мг/кг массы тела).
Каждые сутки получали свежие растворы доз из тех же самых исходных растворов непосредственно перед введением.
Непосредственно перед сменой корма, перед индукцией колита DSS и перед умерщвлением у каждого животного отбирали свежие образцы кала, эквивалентные двум фекальным комкам, для анализов микробиома. Образцы кала немедленно мгновенно замораживали в жидком азоте и хранили при -80°С. Мгновенное замораживание проводили для сохранения соотношений между разными бактериями с разными ростовыми характеристиками при условиях окружающей среды.
С начала стимуляции DSS мышей ежесуточно отслеживали на их общее состояние здоровья и релевантные параметры для индекса активности заболевания (DAI), а именно диарею и видимую кровь в кале. После умерщвления осуществляли макроскопическую бальную оценку воспаления толстой кишки. DAI, который имеет теоретический максимум 9, рассчитывали согласно Melgar et al. 2005 (Am J. Physiol. Gastrointest. Liver Physiol. 288:G1328). Данные no DAI, обобщенные в Таблице 2 и на Фиг. 4, показывают, что, аналогично данным Примера 4, NAM в воде демонстрировал лишь незначимую тенденцию к улучшению в этой экспериментальной ситуации, тогда как композиция NAM с контролируемым высвобождением (гранулы NAM) вызывала высокозначимое и дозозависимое уменьшение DAI. Важно то, что группа, которую лечили гранулами NAM, получающая 60 мг/кг NAM, имела значимо меньший DAI, чем группа, получающая 60 мг/кг NAM в воде (Таблица 2).
Гранулы 5-ASA демонстрировали незначимую тенденцию в отношении терапевтической эффективности.
Количество миелопероксидазы (МРО), фермента, содержащегося в гранулах полиморфоядерных нейтрофильных гранулоцитов, является количественным тканевым маркером рекрутинга нейтрофилов и позволяет опосредованно количественно оценивать острое воспаление толстой кишки, опосредованное нейтрофилами, при колите, индуцированном DSS.
Для анализа содержания МРО в мышиной ткани толстой кишки репрезентативные образцы ткани толстой кишки анализировали с использованием набора ELISA (твердофазный иммуноферментный анализ) для МРО мыши от Hycult (Кат. № НК210; Hycult Biotech; CliniSciences, Нантер, Франция) согласно рекомендациям изготовителя.
В то время как NAM в воде демонстрировал лишь незначимую тенденцию к уменьшению уровня МРО, значимое снижение уровней МРО наблюдали в группах мышей, которые получали гранулы NAM в дозах 60 и 120 мг/кг, вновь указывая на значимый терапевтический эффект NAM только при введении в виде композиции с контролируемым высвобождением (Таблица 3, Фиг. 5).
Пример 6:
Поскольку результаты обоих исследований на животных, описанных в Примерах 4 и 5, свидетельствовали о значимой терапевтической эффективности композиций NAM с контролируемым высвобождением, кишечный микробном мышей из исследования, описанного в Примере 5, анализировали с использованием точно таких же методологии и оборудования (филогения на основе 16S рДНК и секвенирование 454 меток), как описано Hashimoto et al. 2012 (Nature 487:477). Из пяти групп, которые получали гранулы с контролируемым высвобождением (группы 3-7), слепым способом выбирали восемь животных перед проведением анализа параметров заболевания, описанных в Примере 5. Сравнивали образцы кала от всех этих мышей перед вмешательством в кормление (нормальная, не способствующая развитию колита флора в качестве контрольной точки) и после 12 суток питания, не содержащего Trp/Nia/NAM (непосредственно до стимуляции DSS, см. Пример 5).
На Фиг. 6 показано, что 12 суток питания, не содержащего Trp/Nia/NAM, приводило к кардинальному переключению преобладающей филы от Bacteroidetes до Firmicutes. Это могло быть частично и дозозависимо предотвращено гранулами NAM с контролируемым высвобождением. Гранулы 5-ASA с контролируемым высвобождением демонстрировали тенденцию в том же направлении (Фиг. 6). Кроме того, более подробные процентные анализы сходства (SIMPER) бактериальных групп показали то, что контролируемое высвобождение NAM индуцировало размножение неклассифицируемых Bacteroidales и рода Paraprevotella (Фиг. 7; заштрихованные части колонок).
Полезные симбионты из порядка Bacteroidales принадлежат к преимущественно представленным в кишечнике млекопитающих родам и являются важными для переваривания пищи, поскольку они гидролизуют пищевые полисахариды и превращают их в короткоцепочечные жирные кислоты (SCFA), которые могут использоваться хозяином. Большинство геномов, гомологичных геномам, обнаруженным в группе Bacteroidales, размножающихся при обработке гранулами NAM с контролируемым высвобождением, принадлежало к таким продуцентам SCFA. Особенно релевантно то, что превалирование данных полезных симбионтов и образующихся в результате уровней кишечных SCFA снижается при человеческих воспалительных заболеваниях кишечника (Frank et al. 2007, Proc. Natl. Acad. Sci. USA 104:13780). Было показано, что размножение такой микробиоты посредством пре- или пробиотиков, а также увеличение уровня их SCFA продуктов является терапевтически эффективным при колите грызунов, индуцированном DSS (Osman et al. 2006, ВМС Gastroenterol. 28; 6:31; Maslowski et al. 2009, Nature 461:1282). Кроме того, было показано, что Bacteroidales секретируют иммуномодулирующие углеводные структуры (полисахарид А), которые могут подавлять воспалительные ответы (Mazmanian et al. 2008, Nature 453:620).
В заключение, NAM с контролируемым высвобождением в кишечнике приводит к дозозависимому увеличению количества полезной микробиоты и уменьшает колит.
Приведенные выше примеры служат для объяснения изобретения, но не предназначены для того, чтобы ограничивать его объем.
Claims (23)
1. Фармацевтическая композиция, содержащая активное вещество, выбранное из никотиновой кислоты, никотинамида, триптофана, сложных эфиров никотиновой кислоты, дипептида триптофана или их комбинации, для положительного воздействия на кишечную микробиоту, где указанная фармацевтическая композиция селективно высвобождает активное вещество для местного воздействия в терминальном отделе подвздошной кишки, толстой кишке или в обеих, достигаемого посредством перорального введения указанной композиции, приготовленной с контролируемым высвобождением активного вещества, или посредством ректального введения указанной композиции, где положительное воздействие на кишечную микробиоту относится к вызову изменения кишечной микробиоты, которое имеет положительное воздействие на состояние здоровья, где положительное воздействие на состояние здоровья ассоциировано с уменьшением числа патогенных бактерий, уменьшением отношения патогенных бактерий к полезным бактериям, увеличением разнообразия микробиоты, уменьшением уровня воспаления, которое микробиота индуцирует в кишечнике, и частичным или полным обращением патологических изменений в энтеротипе микробиоты.
2. Фармацевтическая композиция, содержащая активное вещество, выбранное из никотиновой кислоты, никотинамида, дипептида триптофана или их комбинации, для положительного воздействия на кишечную микробиоту, где указанная фармацевтическая композиция селективно высвобождает активное вещество для местного воздействия в терминальном отделе подвздошной кишки, толстой кишке или в обеих, достигаемого посредством перорального введения указанной композиции, приготовленной с контролируемым высвобождением активного вещества, или посредством ректального введения указанной композиции, где положительное воздействие на кишечную микробиоту относится к вызову изменения кишечной микробиоты, которое имеет положительное воздействие на состояние здоровья, где положительное воздействие на состояние здоровья ассоциировано с уменьшением числа патогенных бактерий, уменьшением отношения патогенных бактерий к полезным бактериям, увеличением разнообразия микробиоты, уменьшением уровня воспаления, которое микробиота индуцирует в кишечнике, и частичным или полным обращением патологических изменений в энтеротипе микробиоты.
3. Фармацевтическая композиция по п. 1 или 2 для перорального введения, в частности приготовленная для перорального введения, с отсроченным высвобождением активных ингредиентов для специфичной местной эффективности в терминальном отделе подвздошной кишки и/или в толстой кишке.
4. Фармацевтическая композиция по п. 1 или 2, приготовленная для перорального введения, с контролируемым высвобождением активных ингредиентов для специфичной местной эффективности в терминальном отделе подвздошной кишки и/или в толстой кишке.
5. Фармацевтическая композиция по п. 1 или 2, содержащая никотинамид.
6. Фармацевтическая композиция по п. 1 или 2 для перорального введения с отсроченным высвобождением активного вещества для терапии или профилактики воспалительных заболеваний тонкого кишечника и/или заболеваний толстого кишечника, и/или для профилактики карциномы толстой кишки, и/или для терапии или профилактики заболеваний, которые возникают из-за изменений кишечной микробиоты и/или ухудшенного взаимодействия между кишечной микробиотой и кишечником.
7. Фармацевтическая композиция по п. 1 или 2 для нео(ректального) введения в толстую кишку или илеоанальный карман для терапии воспалительных заболеваний толстого кишечника или паучита.
8. Фармацевтическая композиция по п. 7, приготовленная для нео(ректального) введения в толстую кишку или илеоанальный карман.
9. Фармацевтическая композиция по п. 8 для применения в терапии или профилактике воспалительных заболеваний толстого кишечника или паучита.
10. Фармацевтическая композиция по п. 6, характеризующаяся тем, что она приготовлена для перорального введения с содержанием активного вещества 1-3000 мг на конечную лекарственную форму.
11. Фармацевтическая композиция по п. 10, характеризующаяся тем, что она приготовлена для перорального введения с содержанием активного вещества 100-1000 мг на конечную лекарственную форму.
12. Фармацевтическая композиция по п. 7, характеризующаяся тем, что она приготовлена для ректального введения для локальной терапии воспалений в прямой кишке или илеоанальном кармане.
13. Фармацевтическая композиция по любому из пп. 8, 9 и 12, характеризующаяся тем, что она приготовлена для ректального применения с содержанием активного вещества 10-5000 мг на конечную лекарственную форму.
14. Фармацевтическая композиция по п. 1 или 2, характеризующаяся тем, что ацетилсалициловая кислота и/или антагонисты простагландина D2 содержатся дополнительно к никотиновой кислоте и/или никотинамиду.
15. Фармацевтическая композиция по п. 1 или 2
(а) для применения в терапии или профилактике воспалительного заболевания кишечника,
(б) для применения в профилактике карциномы толстой кишки или
(в) для применения в терапии или профилактике заболеваний органов тела, которые возникают в результате изменений кишечной микробиоты и/или ухудшенного взаимодействия между кишечной микробиотой и кишечником.
16. Фармацевтическая композиция по п. 15 для применения в терапии или профилактике воспалительного заболевания кишечника.
17. Фармацевтическая композиция по п. 16, где воспалительное заболевание кишечника представляет собой язвенный колит или болезнь Крона.
18. Фармацевтическая композиция по п. 1 или 2, содержащая дипептид триптофана.
19. Фармацевтическая композиция по п. 1 или 2 для применения в положительном воздействии на кишечную микробиоту.
20. Применение фармацевтической композиции по п. 1 или 2 для положительного воздействия на кишечную микробиоту, где положительное воздействие на кишечную микробиоту относится к вызову изменения кишечной микробиоты, которое имеет положительное воздействие на состояние здоровья, где положительное воздействие на состояние здоровья ассоциировано с уменьшением числа патогенных бактерий, уменьшением отношения патогенных бактерий к полезным бактериям, увеличением разнообразия микробиоты, уменьшением уровня воспаления, которое микробиота индуцирует в кишечнике, и частичным или полным обращением патологических изменений в энтеротипе микробиоты.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102012011890 | 2012-06-15 | ||
| DE102012011890.2 | 2012-06-15 | ||
| PCT/EP2013/062363 WO2013186355A1 (en) | 2012-06-15 | 2013-06-14 | A pharmaceutical composition containing nicotinic acid and/or nicotinamide and/or tryptophan for positively influencing the intestinal microbiota |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2014148239A RU2014148239A (ru) | 2016-08-10 |
| RU2657797C2 true RU2657797C2 (ru) | 2018-06-15 |
Family
ID=47002494
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014148239A RU2657797C2 (ru) | 2012-06-15 | 2013-06-14 | Фармацевтическая композиция, содержащая никотиновую кислоту и/или никотинамид, и/или триптофан, для положительного воздействия на кишечную микробиоту |
Country Status (32)
| Country | Link |
|---|---|
| US (2) | US10426765B2 (ru) |
| EP (2) | EP3831379A1 (ru) |
| JP (3) | JP6855165B2 (ru) |
| KR (2) | KR20150021071A (ru) |
| CN (2) | CN104363907A (ru) |
| AR (1) | AR091465A1 (ru) |
| AU (1) | AU2013276451B2 (ru) |
| BR (1) | BR112014030835B1 (ru) |
| CA (1) | CA2876540C (ru) |
| CY (1) | CY1123999T1 (ru) |
| DK (1) | DK2861229T3 (ru) |
| ES (1) | ES2859758T3 (ru) |
| HR (1) | HRP20210090T1 (ru) |
| HU (1) | HUE053359T2 (ru) |
| IL (1) | IL236205B (ru) |
| IN (1) | IN2014DN10260A (ru) |
| JO (1) | JO3578B1 (ru) |
| LT (1) | LT2861229T (ru) |
| MX (1) | MX370795B (ru) |
| NZ (1) | NZ702297A (ru) |
| PH (1) | PH12014502744A1 (ru) |
| PL (1) | PL2861229T3 (ru) |
| PT (1) | PT2861229T (ru) |
| RS (1) | RS61288B1 (ru) |
| RU (1) | RU2657797C2 (ru) |
| SA (1) | SA113340643B1 (ru) |
| SG (1) | SG11201408251SA (ru) |
| SI (1) | SI2861229T1 (ru) |
| SM (1) | SMT202100248T1 (ru) |
| TW (1) | TWI624260B (ru) |
| WO (1) | WO2013186355A1 (ru) |
| ZA (1) | ZA201408922B (ru) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10426765B2 (en) | 2012-06-15 | 2019-10-01 | Conaris Research Institute Ag | Pharmaceutical composition containing nicotinic acid and/or nicotinamide and/or tryptophan for positively influencing the intestinal microbiota |
| WO2014194407A1 (en) * | 2013-06-05 | 2014-12-11 | The University Of British Columbia | Anti-fibrogenic compounds, methods and uses thereof |
| EP3007680B1 (en) | 2013-06-14 | 2020-02-19 | CONARIS research institute AG | Extended release nicotinamide formulation |
| EP2884282A1 (en) | 2013-12-13 | 2015-06-17 | CONARIS research institute AG | Use of tryptophan as a biomarker for patient selection, dosing and therapy monitoring for pharmaceutical compositions targeting the intestinal microbiota in diseases featuring tryptophan deficiency |
| HK1223840A1 (zh) | 2013-12-13 | 2017-08-11 | Conaris Research Institute Ag | 用於有益地影響腸道微生物叢和/或治療胃腸道炎症的含有煙醯胺和5-氨基水楊酸的組合的藥物組合物 |
| WO2015086843A2 (en) * | 2013-12-13 | 2015-06-18 | Conaris Research Institute Ag | A pharmaceutical composition containing nicotinic acid and/or nicotinamide for beneficially influencing blood lipid levels by modifying the intestinal microbiota |
| WO2015124637A1 (en) * | 2014-02-18 | 2015-08-27 | Conaris Research Institute Ag | Methods and compositions for intestinal microenvironment transfer |
| CN113908074A (zh) * | 2014-05-12 | 2022-01-11 | 联合利华知识产权控股有限公司 | 用于诱导抗微生物肽生成的烟酰胺 |
| CN105287561A (zh) * | 2015-11-25 | 2016-02-03 | 上海交通大学医学院附属瑞金医院 | 一种治疗溃疡性结肠炎的药物组合物 |
| NZ787127A (en) * | 2016-04-14 | 2025-03-28 | Chromadex Inc | Use of nicotinamide riboside, nicotinic acid riboside, nicotinamide mononucleotide, and nicotinoyl compound derivatives in infant formula |
| CN109310642B (zh) | 2016-04-19 | 2021-07-20 | 费灵有限公司 | 美沙拉嗪的口服药物组合物 |
| CA3021066C (en) | 2016-04-19 | 2024-04-09 | Ferring B.V. | Oral pharmaceutical compositions of nicotinamide |
| CN109718234A (zh) * | 2017-10-31 | 2019-05-07 | 中国农业大学 | L-色氨酸在缓解肠道炎症反应和屏障功能紊乱中的应用 |
| CN108935981A (zh) * | 2018-06-05 | 2018-12-07 | 西北农林科技大学 | 围产期奶山羊添加烟酰胺对羔羊糖脂代谢的影响及其机制 |
| CN113438896B (zh) * | 2019-02-12 | 2024-10-29 | 田中惠 | 婴幼儿食品或饮料、用于改善婴幼儿肠道环境的方法和用于增强婴幼儿免疫力的方法 |
| WO2020196651A1 (ja) * | 2019-03-28 | 2020-10-01 | 国立大学法人東北大学 | がんの予防又は治療剤 |
| CN113398130A (zh) * | 2020-03-16 | 2021-09-17 | 广州市妇女儿童医疗中心(广州市妇幼保健院、广州市儿童医院、广州市妇婴医院、广州市妇幼保健计划生育服务中心) | 烟酰胺用于预防和治疗胃肠道功能紊乱的用途 |
| JP2023550994A (ja) * | 2020-11-27 | 2023-12-06 | コナリス リサーチ インスティテュート アクチェンゲゼルシャフト | Covid-19及びその他のウイルス感染症の患者の症状の消散までの時間を低減するためのニコチンアミド、ニコチンアミド前駆体及びニコチンアミド代謝体並びにそれらの組成物 |
| TW202308605A (zh) * | 2021-07-19 | 2023-03-01 | 日商明治控股股份有限公司 | 用於炎症性腸疾病之預防或改善之組合物、以及用於腸內細菌叢調節之組合物 |
| EP4499059A1 (en) * | 2022-03-30 | 2025-02-05 | CONARIS research institute AG | Composition comprising nicotinamide, nicotinamide precursors, nicotinamide metabolites or combinations thereof for preventing or reducing one or more post-acute symptoms of infectious diseases |
| KR102789810B1 (ko) | 2023-02-06 | 2025-03-31 | 한림대학교 산학협력단 | 아토피 피부염 진단용 바이오마커 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997028801A1 (en) * | 1996-02-09 | 1997-08-14 | Mayo Foundation For Medical Education And Research | Colonic delivery of nicotine to treat inflammatory bowel disease |
| WO1998002148A2 (en) * | 1996-07-16 | 1998-01-22 | John Rhodes | Pharmaceutical composition |
| WO2009131537A1 (en) * | 2008-04-25 | 2009-10-29 | Karolinska Institutet Innovations Ab | New therapy of treatment of the irritable bowel syndrome. |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6129930A (en) | 1993-09-20 | 2000-10-10 | Bova; David J. | Methods and sustained release nicotinic acid compositions for treating hyperlipidemia at night |
| DE19524928A1 (de) * | 1995-07-08 | 1997-01-09 | Basf Ag | Verfahren zur Rektifikation von Gemischen hochsiedender luft- und/oder temperaturempfindlicher Substanzen, die eine hohe Trennleistung erfordern, im Feinvakuum, sowie für dieses Verfahren geeignete Kolonnen |
| US5736532A (en) * | 1996-02-14 | 1998-04-07 | Furda; Ivan | Multifunctional fat absorption and blood cholesterol reducing formulation comprising chitosan |
| CN1338946A (zh) * | 1998-12-23 | 2002-03-06 | G·D·瑟尔有限公司 | 用于心血管适应症的回肠胆汁酸转运抑制剂和烟酸类衍生物的联合形式 |
| US6713057B1 (en) | 1999-02-24 | 2004-03-30 | The Johns Hopkins University | Compositions and methods for modulating serum cholesterol |
| GB0015242D0 (en) | 2000-06-22 | 2000-08-16 | Nycomed Amersham Plc | Stabiliser for radiopharmaceuticals |
| WO2002011725A1 (fr) | 2000-08-08 | 2002-02-14 | Shionogi & Co., Ltd. | Inhibiteurs de production de cytokine inflammatoire |
| US20040185097A1 (en) | 2003-01-31 | 2004-09-23 | Glenmark Pharmaceuticals Ltd. | Controlled release modifying complex and pharmaceutical compositions thereof |
| WO2005072113A2 (en) | 2004-01-20 | 2005-08-11 | Harty Richard F | Compositions and methods of treatment for inflammatory diseases |
| US20060264409A1 (en) | 2004-01-20 | 2006-11-23 | Harty Richard F | Compositions and methods of treatment for inflammatory diseases |
| EP1751096A4 (en) | 2004-05-27 | 2009-01-07 | Antibe Therapeutics Inc | 4- OR 5- AMINOSALICYLIC ACID SALT |
| ES2401185T3 (es) * | 2004-09-27 | 2013-04-17 | Sigmoid Pharma Limited | Formulaciones de microcápsulas que comprenden dos ingredientes farmacéuticamente activos |
| WO2007004613A1 (ja) * | 2005-07-01 | 2007-01-11 | Ajinomoto Co., Inc. | 炎症性腸疾患治療薬及びTNF-α産生抑制剤 |
| DK2026651T3 (da) * | 2006-03-08 | 2013-07-08 | Cortria Corp | Kombinationsterapi med ikke-selektive COX-inhibitorer til forebyggelse af COX-relaterede maveskader |
| ITMI20061932A1 (it) | 2006-10-09 | 2008-04-10 | Carlo Ghisalberti | Complessi a trasferimento di carica per uso medicale |
| EP1935422A1 (en) * | 2006-12-20 | 2008-06-25 | PEJO Iserlohn Heilmittel-und Diät-GmbH & Co.KG | Pharmaceutical composition comprising nicotinamide or nicotinic acid |
| US20090104171A1 (en) * | 2007-10-19 | 2009-04-23 | Pardee Joel D | Metabolic Enhancement Therapy |
| JP2011521915A (ja) * | 2008-05-20 | 2011-07-28 | セレニス セラピューティクス エス.エー. | ナイアシン及びnsaid併用療法 |
| JP2011521977A (ja) * | 2008-06-02 | 2011-07-28 | ドクター・レディーズ・ラボラトリーズ・リミテッド | 調節放出性ナイアシン処方物 |
| AU2009298139B2 (en) | 2008-10-03 | 2015-02-19 | Dr. Falk Pharma Gmbh | Compositions and methods for the treatment of bowel diseases with granulated mesalamine |
| JP2011121889A (ja) | 2009-12-09 | 2011-06-23 | En Otsuka Pharmaceutical Co Ltd | 炎症性腸疾患用アミノ酸組成物 |
| JP2012102054A (ja) * | 2010-11-11 | 2012-05-31 | Kyodo Milk Industry Co Ltd | 腸内ポリアミン増強剤 |
| WO2012090224A1 (en) | 2010-12-29 | 2012-07-05 | Nutracryst Therapeutics Private Limited | Novel cocrystals / molecular salts of mesalamine to be used as improved anti-inflammatory drug |
| US10426765B2 (en) | 2012-06-15 | 2019-10-01 | Conaris Research Institute Ag | Pharmaceutical composition containing nicotinic acid and/or nicotinamide and/or tryptophan for positively influencing the intestinal microbiota |
| EP3007680B1 (en) | 2013-06-14 | 2020-02-19 | CONARIS research institute AG | Extended release nicotinamide formulation |
| CA3021066C (en) | 2016-04-19 | 2024-04-09 | Ferring B.V. | Oral pharmaceutical compositions of nicotinamide |
| JP2023550994A (ja) * | 2020-11-27 | 2023-12-06 | コナリス リサーチ インスティテュート アクチェンゲゼルシャフト | Covid-19及びその他のウイルス感染症の患者の症状の消散までの時間を低減するためのニコチンアミド、ニコチンアミド前駆体及びニコチンアミド代謝体並びにそれらの組成物 |
-
2013
- 2013-06-14 US US14/407,780 patent/US10426765B2/en active Active
- 2013-06-14 DK DK13728758.7T patent/DK2861229T3/da active
- 2013-06-14 SG SG11201408251SA patent/SG11201408251SA/en unknown
- 2013-06-14 IN IN10260DEN2014 patent/IN2014DN10260A/en unknown
- 2013-06-14 KR KR20147036089A patent/KR20150021071A/ko not_active Ceased
- 2013-06-14 SI SI201331842T patent/SI2861229T1/sl unknown
- 2013-06-14 PL PL13728758T patent/PL2861229T3/pl unknown
- 2013-06-14 RS RS20201595A patent/RS61288B1/sr unknown
- 2013-06-14 EP EP20214819.3A patent/EP3831379A1/en active Pending
- 2013-06-14 SM SM20210248T patent/SMT202100248T1/it unknown
- 2013-06-14 RU RU2014148239A patent/RU2657797C2/ru active
- 2013-06-14 PT PT137287587T patent/PT2861229T/pt unknown
- 2013-06-14 CA CA2876540A patent/CA2876540C/en active Active
- 2013-06-14 HU HUE13728758A patent/HUE053359T2/hu unknown
- 2013-06-14 KR KR1020207002601A patent/KR102211832B1/ko active Active
- 2013-06-14 AU AU2013276451A patent/AU2013276451B2/en active Active
- 2013-06-14 LT LTEP13728758.7T patent/LT2861229T/lt unknown
- 2013-06-14 BR BR112014030835-7A patent/BR112014030835B1/pt active IP Right Grant
- 2013-06-14 HR HRP20210090TT patent/HRP20210090T1/hr unknown
- 2013-06-14 MX MX2014015217A patent/MX370795B/es active IP Right Grant
- 2013-06-14 ES ES13728758T patent/ES2859758T3/es active Active
- 2013-06-14 WO PCT/EP2013/062363 patent/WO2013186355A1/en active Application Filing
- 2013-06-14 EP EP13728758.7A patent/EP2861229B1/en active Active
- 2013-06-14 CN CN201380031622.4A patent/CN104363907A/zh active Pending
- 2013-06-14 NZ NZ702297A patent/NZ702297A/en unknown
- 2013-06-14 JP JP2015516627A patent/JP6855165B2/ja active Active
- 2013-06-14 CN CN201810359182.XA patent/CN108273064A/zh active Pending
- 2013-06-15 SA SA113340643A patent/SA113340643B1/ar unknown
- 2013-06-16 JO JOP/2013/0182A patent/JO3578B1/ar active
- 2013-06-17 TW TW102121395A patent/TWI624260B/zh active
- 2013-06-17 AR ARP130102127 patent/AR091465A1/es unknown
-
2014
- 2014-12-04 ZA ZA2014/08922A patent/ZA201408922B/en unknown
- 2014-12-05 PH PH12014502744A patent/PH12014502744A1/en unknown
- 2014-12-11 IL IL236205A patent/IL236205B/en active IP Right Grant
-
2018
- 2018-12-13 JP JP2018233038A patent/JP2019069972A/ja active Pending
-
2019
- 2019-09-16 US US16/572,494 patent/US20200009124A1/en active Pending
-
2021
- 2021-03-02 CY CY20211100172T patent/CY1123999T1/el unknown
- 2021-10-15 JP JP2021169322A patent/JP2022017332A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997028801A1 (en) * | 1996-02-09 | 1997-08-14 | Mayo Foundation For Medical Education And Research | Colonic delivery of nicotine to treat inflammatory bowel disease |
| WO1998002148A2 (en) * | 1996-07-16 | 1998-01-22 | John Rhodes | Pharmaceutical composition |
| WO2009131537A1 (en) * | 2008-04-25 | 2009-10-29 | Karolinska Institutet Innovations Ab | New therapy of treatment of the irritable bowel syndrome. |
Non-Patent Citations (2)
| Title |
|---|
| Bülbüller N1 et al, The effect of L-tryptophan on hemorrhagic shock induced bacterial translocation, J Surg Res. 2005 Feb;123(2):194-9 (реферат) [найдено 2017.11.08]. Найдено из Интернет: URL: https://www.ncbi.nlm.nih.gov/pubmed/15680378. * |
| Bülbüller N1 et al, The effect of L-tryptophan on hemorrhagic shock induced bacterial translocation, J Surg Res. 2005 Feb;123(2):194-9 () [найдено 2017.11.08]. Найдено из Интернет: URL: https://www.ncbi.nlm.nih.gov/pubmed/15680378. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2657797C2 (ru) | Фармацевтическая композиция, содержащая никотиновую кислоту и/или никотинамид, и/или триптофан, для положительного воздействия на кишечную микробиоту | |
| JP6895752B2 (ja) | ニコチン酸および/またはニコチンアミドを含む、腸内微生物叢を改変することにより血中脂質レベルに有益に影響を及ぼすための医薬組成物 | |
| JP6554468B6 (ja) | ニコチンアミドと5−アミノサリチル酸との組合せを含有する、腸内微生物叢に有益な影響を及ぼすため、かつ/または胃腸の炎症を処置するための医薬組成物 | |
| US20210275513A1 (en) | Shellac microcapsule formulations and compositions for topical intestinal delivery of vitamin b3 | |
| HK40045364A (en) | A composition containing nicotinic acid and/or nicotinamide and/or tryptophan for positively influencing the intestinal microbiota | |
| EP2884282A1 (en) | Use of tryptophan as a biomarker for patient selection, dosing and therapy monitoring for pharmaceutical compositions targeting the intestinal microbiota in diseases featuring tryptophan deficiency | |
| HK1204972B (en) | A pharmaceutical composition containing nicotinic acid and/or nicotinamide and/or tryptophan for positively influencing the intestinal microbiota |