RU2336089C2 - Средство для лечения и способ лечения периодонтальных заболеваний и заболеваний пульпы - Google Patents
Средство для лечения и способ лечения периодонтальных заболеваний и заболеваний пульпы Download PDFInfo
- Publication number
- RU2336089C2 RU2336089C2 RU2006111465/15A RU2006111465A RU2336089C2 RU 2336089 C2 RU2336089 C2 RU 2336089C2 RU 2006111465/15 A RU2006111465/15 A RU 2006111465/15A RU 2006111465 A RU2006111465 A RU 2006111465A RU 2336089 C2 RU2336089 C2 RU 2336089C2
- Authority
- RU
- Russia
- Prior art keywords
- cells
- bdnf
- mrna
- level
- expression
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/185—Nerve growth factor [NGF]; Brain derived neurotrophic factor [BDNF]; Ciliary neurotrophic factor [CNTF]; Glial derived neurotrophic factor [GDNF]; Neurotrophins, e.g. NT-3
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S530/00—Chemistry: natural resins or derivatives; peptides or proteins; lignins or reaction products thereof
- Y10S530/81—Carrier - bound or immobilized peptides or proteins and the preparation thereof, e.g. biological cell or cell fragment as carrier
- Y10S530/812—Peptides or proteins is immobilized on, or in, an organic carrier
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Physical Education & Sports Medicine (AREA)
- Gastroenterology & Hepatology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Psychology (AREA)
- Zoology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Rheumatology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pain & Pain Management (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Materials For Medical Uses (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Изобретение относится к медицине, а именно к стоматологии. Изобретение заключается в создании средства и способа лечения периодонтальных заболеваний и заболеваний пульпы, а также к получению трансплантата для регенерации периодонтальной ткани, содержащего в качестве активного вещества нейротрофические факторы. Изобретение обеспечивает более эффективную эндодонтическую терапию. 5 н. и 18 з.п. ф-лы, 29 ил.
Description
УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к средству для лечения и способу лечения периодонтальных заболеваний и заболеваний пульпы, к трансплантату для регенерации периодонтальной ткани и к способу регенерации периодонтальной ткани.
ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Периодонтальная ткань, состоящая из десны, альвеолярной кости, периодонтальной связки (периодонтальной мембраны), цемента, зубной пульпы и т.д., необходима для вертикального положения зубов и поддержания их функций, таких как жевание и смыкание челюстей, а ее повреждение или разрушение приводит к потере зубов. Например, полагают, что периодонтальным заболеванием страдают приблизительно 30 миллионов человек в Японии; по мере развития заболевания все в большей степени происходит повреждение или разрушение периодонтальной ткани, что приводит к потере зубов. Лечение поврежденной или разрушенной периодонтальной ткани, включающей в себя зубную пульпу, пытались осуществлять различными способами, в том числе лекарственными средствами и оперативным вмешательством, но ни одно из лекарственных средств и способов лечения не является достаточно эффективным для регенерации поврежденной или разрушенной периодонтальной ткани, включающей в себя зубную пульпу.
Нейротрофические факторы включают в себя нейротрофический фактор головного мозга (BDNF), фактор роста нервов (NGF), нейротрофин-3 (NT-3) и нейротрофин-4/5 (NT-4/5), и они вовлечены в дифференцировку, выживание, регенерацию и функциональное поддержание нейронов. BDNF и NT-4/5 связываются с высокоаффинным рецептором TrkB (тропомиозин-киназный рецептор B), NGF с TrkA, а NT-3 с TrkC.
BDNF, NGF и NT-3 представляют собой присутствующие преимущественно в головном мозге нейротрофические факторы, а эффективность BDNF и NGF была показана в экспериментах над животными с такими моделями различных заболеваний, как модель двигательной нейропатии, модель болезни Паркинсона и модель болезни Альцгеймера. В частности, предполагают, что BDNF может быть эффективным терапевтическим средством при лечении двигательных и периферических заболеваний нервной системы, таких как латеральный амиотрофический склероз (ALS) и периферические нейропатии при диабете и терапии химиотерапевтическими средствами, и при заболеваниях, поражающих центральную нервную систему, таких как болезнь Альцгеймера, болезнь Паркинсона и заболевания сетчатки.
Предполагают, что эти нейротрофические факторы играют важную роль не только в центральной нервной системе, но также и в периферической нервной системе. Сообщалось, что экспрессия BDNF, NGF, NT-3, TrkC и TrkA возрастает в процессе заживления сломанных ребер у мыши (K. Asaumi et al., Bone, Vol. 26, No. 6, 625-633, 2000) и что BDNF, NGF и NT-3 усиливают пролиферацию клеток периодонтальной связки мыши (Y. Tsuboi et al., J Dent Res 80(3):881-886, 2001). Однако подробных сообщений о действии этих нейротрофических факторов в периодонтальной ткани и ткани пульпы не было.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение средства для лечения и разработка способа лечения периодонтальных заболеваний и заболеваний пульпы, получение трансплантата для регенерации периодонтальной ткани и разработка способа регенерации периодонтальной ткани.
Для решения указанных выше задач авторами настоящего изобретения было осуществлено тщательное исследование и обнаружено, что нейротрофические факторы усиливают пролиферацию клеток периодонтальной связки человека, экспрессию мРНК белков костной ткани и регенерацию периодонтальной ткани на моделях повреждения в участках зон разделения корней зуба у собак. На основании данных исследований было выполнено настоящее изобретение.
Таким образом, настоящее изобретение относится к лекарственному средству для лечения периодонтальных заболеваний, содержащему в качестве активного вещества нейротрофический фактор.
Предпочтительно лекарственное средство по настоящему изобретению регенерирует периодонтальную ткань.
Предпочтительно лекарственное средство по настоящему изобретению регенерирует цемент, периодонтальную связку, альвеолярную кость или зубную пульпу.
Предпочтительно лекарственное средство по настоящему изобретению предотвращает верхушечное прорастание эпителия десны вдоль поверхности корней зубов.
Предпочтительно лекарственное средство по настоящему изобретению усиливает продукцию восстановленного дентина в полости пульпы. Также лекарственное средство предпочтительно усиливает присоединение восстановленного дентина к внутренним поверхностям полости пульпы.
Предпочтительно в составе лекарственного средства по настоящему изобретению нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5.
В соответствии с еще одним аспектом настоящее изобретение относится к трансплантату для регенерации периодонтальной ткани, содержащему нейротрофический фактор.
Предпочтительно трансплантат по настоящему изобретению регенерирует периодонтальную ткань.
Предпочтительно трансплантат по настоящему изобретению регенерирует цемент, периодонтальную связку, альвеолярную кость или зубную пульпу.
Предпочтительно трансплантат по настоящему изобретению предотвращает верхушечное прорастание эпителия десны вдоль поверхности корней зубов.
Предпочтительно трансплантат по настоящему изобретению усиливает продукцию восстановленного дентина в полости пульпы. Также трансплантат предпочтительно способствует присоединению восстановленного дентина к внутренним поверхностям полости пульпы.
Предпочтительно в составе трансплантата по настоящему изобретению нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5.
В соответствии с еще одним аспектом настоящее изобретение относится к способу регенерации периодонтальной ткани, предусматривающему применение нейротрофического фактора.
Предпочтительно способ регенерации по настоящему изобретению регенерирует периодонтальную ткань.
Предпочтительно способ регенерации по настоящему изобретению регенерирует цемент, периодонтальную связку, альвеолярную кость или зубную пульпу.
Предпочтительно способ регенерации по настоящему изобретению предотвращает верхушечное прорастание эпителия десны вдоль поверхности корней зубов.
Предпочтительно в способе регенерации по настоящему изобретению нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5.
В соответствии с другим аспектом настоящее изобретение относится к способу лечения периодонтального заболевания, предусматривающему введение терапевтически эффективного количества нейротрофического фактора индивидууму, страдающему или подверженному воздействию заболевания.
Предпочтительно способ лечения по настоящему изобретению направлен на регенерацию периодонтальной ткани.
Предпочтительно способ лечения по настоящему изобретению направлен на регенерацию цемента, периодонтальной связки, альвеолярной кости или зубной пульпы.
Предпочтительно благодаря способу лечения по настоящему изобретению предотвращается верхушечное прорастание эпителия десны вдоль поверхности корней зубов.
Предпочтительно способ лечения по настоящему изобретению усиливает продукцию восстановленного дентина в полости пульпы. Также способ предпочтительно усиливает присоединение восстановленного дентина к внутренним поверхностям полости пульпы.
Предпочтительно в способе лечения по настоящему изобретению нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5.
В соответствии с другим аспектом настоящее изобретение относится к применению нейротрофического фактора для получения лекарственного средства для применения при лечении периодонтальных заболеваний.
Предпочтительно лекарственное средство регенерирует периодонтальную ткань, в частности цемент, периодонтальную связку, альвеолярную кость или зубную пульпу. Предпочтительно лекарственное средство предотвращает верхушечное прорастание эпителия десны вдоль поверхности корней зубов. Предпочтительно лекарственное средство усиливает продукцию восстановленного дентина в полости пульпы. Также лекарственное средство предпочтительно усиливает присоединение восстановленного дентина к внутренним поверхностям полости пульпы. Предпочтительно нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5.
В соответствии с еще одним аспектом настоящее изобретение относится к средству, усиливающему морфогенез восстановленного дентина, содержащему в качестве активного вещества нейротрофический фактор. Предпочтительно нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5. Предпочтительно восстановленный дентин присоединяется к внутренним поверхностям полости пульпы.
В соответствии с другим аспектом настоящее изобретение относится к способу лечения заболевания пульпы, предусматривающему введение терапевтически эффективного количества нейротрофического фактора индивидууму, страдающему или подверженному воздействию заболевания, для усиления морфогенеза восстановленного дентина. Предпочтительно нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5. Предпочтительно восстановленный дентин присоединяется к внутренним поверхностям полости пульпы.
В соответствии с еще одним аспектом настоящее изобретение относится к применению нейротрофического фактора для получения лекарственного средства для усиления морфогенеза восстановленного дентина. Предпочтительно нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5. Предпочтительно восстановленный дентин присоединяется к внутренним поверхностям полости пульпы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
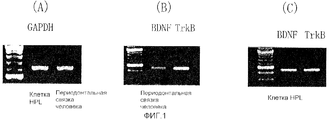
На фигуре 1 представлен набор электрофореграмм, на которых показана экспрессия мРНК BDNF и TrkB в клетках HPL и периодонтальной связке человека; на крайней левой дорожке каждой электрофореграммы показан маркер; на (A) показана экспрессия мРНК (613 п.о.) глицеральдегид-3-фосфатдегидрогеназы (GAPDH) в периодонтальной связке человека и клетках HPL; на (B) показана экспрессия мРНК (438 п.о.) BDNF и мРНК (434 п.о.) TrkB в периодонтальной связке человека; на (C) показана экспрессия мРНК для BDNF и TrkB в клетках HPL.
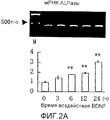
На фигуре 2A посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК (381 п.о.) ALPазы в клетках HPL; все клетки HPL обрабатывали BDNF с конечной концентрацией 50 нг/мл; на крайней левой дорожке электрофореграммы показан маркер; вертикальная ось графика представляет относительный уровень экспрессии мРНК для каждого времени воздействия, с принятым в качестве единицы уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось графика представляет время воздействия BDNF; каждая из вертикальных линий на столбцах графика отражает диапазон среднего ± стандартного отклонения; ** означает статистически значимое различие при p<0,01 (в t-тесте).
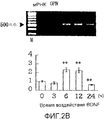
На фигуре 2B посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК (532 п.о.) OPN в клетках HPL; все клетки HPL обрабатывали BDNF в конечной концентрации 50 нг/мл; на крайней левой дорожке электрофореграммы показан маркер; вертикальная ось графика представляет относительный уровень экспрессии мРНК для каждого времени воздействия, с принятым в качестве единицы уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось графика представляет время воздействия BDNF; каждая из вертикальных линий на столбцах графика отражает диапазон среднего ± стандартного отклонения; ** означает статистически значимое различие при p<0,01 (в t-тесте).
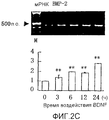
На фигуре 2C посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК (440 п.о.) BMP-2 в клетках HPL; все клетки HPL обрабатывали BDNF с конечной концентрацией 50 нг/мл; на крайней левой дорожке электрофореграммы показан маркер; вертикальная ось графика представляет относительный уровень экспрессии мРНК для каждого времени воздействия, с принятым в качестве единицы уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось графика представляет время воздействия BDNF; каждая из вертикальных линий на столбцах графика отражает диапазон среднего ± стандартного отклонения; ** означает статистически значимое различие при p<0,01 (в t-тесте).
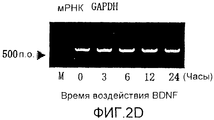
На фигуре 2D представлена электрофореграмма, на которой показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК GAPDH в клетках HPL; все клетки HPL обрабатывали BDNF с конечной концентрацией 50 нг/мл; на крайней левой дорожке электрофореграммы показан маркер.
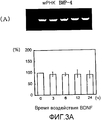
На фигуре 3A посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК (339 п.о.) BMP-4 в клетках HPL; все клетки HPL обрабатывали BDNF с конечной концентрацией 50 нг/мл; на крайней левой дорожке электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия, с принятым в качестве 100 уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось графика представляет время воздействия BDNF; каждая из вертикальных линий на столбцах графика отражает диапазон среднего ± стандартного отклонения.
На фигуре 3B посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК (736 п.о.) OPG в клетках HPL; все клетки HPL обрабатывали BDNF с конечной концентрацией 50 нг/мл; на крайней левой дорожке электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия, с принятым в качестве 100 уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось графика представляет время воздействия BDNF; каждая из вертикальных линий на столбцах графика отражает диапазон среднего ± стандартного отклонения.
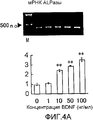
На фигуре 4A посредством электрофореграммы и гистограммы показана взаимосвязь между дозой, в которой вводили BDNF в клетки HPL, и уровнем, на котором экспрессировалась мРНК ALPазы; BDNF в соответствующих концентрациях позволяли воздействовать на клетки HPL в течение 24 часов; на крайней левой дорожке электрофореграммы показан маркер; вертикальная ось графика представляет относительный уровень экспрессии мРНК при каждой дозе BDNF, с принятым в качестве единицы уровнем экспрессии мРНК для нулевой дозы; горизонтальная ось графика представляет концентрацию BDNF (нг/мл); каждая из вертикальных линий на столбцах графика отражает диапазон среднего ± стандартного отклонения; ** означает статистически значимое различие при p<0,01 (в t-тесте).
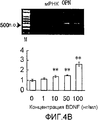
На фигуре 4B посредством электрофореграммы и гистограммы показана взаимосвязь между дозой, в которой вводили BDNF в клетки HPL, и уровнем, на котором экспрессировалась мРНК OPN; BDNF в соответствующих концентрациях позволяли воздействовать на клетки HPL в течение 12 часов; на крайней левой дорожке электрофореграммы показан маркер; вертикальная ось графика представляет относительный уровень экспрессии мРНК при каждой дозе BDNF, с принятым в качестве единицы уровнем экспрессии мРНК для нулевой дозы; горизонтальная ось графика представляет концентрацию BDNF (нг/мл); каждая из вертикальных линий на столбцах графика отражает диапазон среднего ± стандартного отклонения; ** означает статистически значимое различие при p<0,01 (в t-тесте).
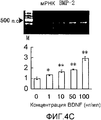
На фигуре 4C посредством электрофореграммы и гистограммы показана взаимосвязь между дозой, в которой вводили BDNF в клетки HPL, и уровнем, на котором экспрессировалась мРНК BMP-2; BDNF в соответствующих концентрациях позволяли воздействовать на клетки HPL в течение 24 часов; на крайней левой дорожке электрофореграммы показан маркер; вертикальная ось графика представляет относительный уровень экспрессии мРНК при каждой дозе BDNF, с принятым в качестве единицы уровнем экспрессии мРНК для нулевой дозы; горизонтальная ось графика представляет концентрацию BDNF (нг/мл); каждая из вертикальных линий на столбцах графика отражает диапазон среднего ± стандартного отклонения; * и ** означают статистически значимые различия при p<0,05 и p<0,01 соответственно (в t-тесте).
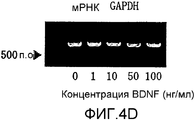
На фигуре 4D представлена электрофореграмма, на которой показана взаимосвязь между дозой, в которой вводили BDNF в клетки HPL, и уровнем, на котором экспрессировалась мРНК (613 п.о.) GAPDH.
На фигуре 5(A) представлена гистограмма, на которой показана взаимосвязь между дозой, в которой BDNF вводили в клетки HPL, и уровнем, на котором секретировался OPN; BDNF в соответствующих концентрациях позволяли воздействовать на клетки HPL в течение 12 часов; вертикальная ось представляет уровень секреции OPN (нг/мл), а горизонтальная ось представляет концентрацию BDNF (нг/мл); на фигуре 5(B) представлена гистограмма, на которой показана взаимосвязь между дозой, в которой BDNF вводили в клетки HPL, и уровнем, на котором секретировался BMP-2; BDNF в соответствующих концентрациях позволяли воздействовать на клетки HPL в течение 24 часов; вертикальная ось представляет уровень секреции BMP-2 (пг/мл), а горизонтальная ось представляет концентрацию BDNF (нг/мл); на фигуре 5(C) представлена гистограмма, на которой показана взаимосвязь между временем воздействия BDNF и уровнем, на котором секретировался BMP-2 в клетках HPL; клетки обрабатывали BDNF с конечной концентрацией 50 нг/мл; вертикальная ось представляет уровень секреции BMP-2 (пг/мл), а горизонтальная ось представляет время воздействия BDNF; каждая из вертикальных линий на столбцах графиков (A)-(C) отражает диапазон среднего ± стандартного отклонения; ** означает статистически значимое различие при p<0,01 (в t-тесте).
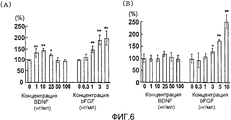
На фигуре 6 посредством гистограммы показана взаимосвязь между дозой, в которой вводили BDNF, и способностью клеток HPL и HGK синтезировать ДНК; BDNF в соответствующих концентрациях позволяли воздействовать на клетки HPL и HGK в течение 24 часов; вертикальная ось каждого графика представляет относительную способность синтезировать ДНК при каждой дозе BDNF или bFGF, с принятой в качестве 100 способностью синтезировать ДНК в отсутствие BDNF или bFGF (т.е. при нулевой концентрации BDNF или bFGF); горизонтальная ось представляет концентрацию BDNF или bFGF (нг/мл); каждая из вертикальных линий на столбцах графиков отражает диапазон среднего ± стандартного отклонения; * и ** означают статистически значимые различия при p<0,05 и p<0,01 соответственно (в t-тесте); (A) отражает способность синтезировать ДНК в клетках HPL, а (B) отражает способность синтезировать ДНК в HGK.
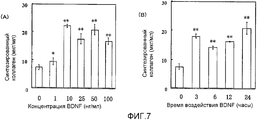
На фигуре 7 (A) представлена гистограмма, на которой показана взаимосвязь между дозой, в которой BDNF вводили в клетки HPL, и уровнем, на котором синтезировался коллаген I типа; BDNF в соответствующих концентрациях позволяли воздействовать на клетки HPL в течение 24 часов; вертикальная ось представляет уровень (мкг/мл), на котором синтезировался коллаген I типа, а горизонтальная ось представляет концентрацию BDNF (нг/мл); на фигуре 7(B) представлена гистограмма, на которой показана взаимосвязь между временем воздействия BDNF и уровнем, на котором синтезировался коллаген I типа; клетки обрабатывали BDNF с конечной концентрацией 50 нг/мл; вертикальная ось представляет уровень (мкг/мл), на котором синтезировался коллаген I типа, а горизонтальная ось представляет время воздействия BDNF; каждая из вертикальных линий на столбцах графиков (A) и (B) отражает диапазон среднего ± стандартного отклонения; * и ** означают статистически значимые различия при p<0,05 и p<0,01 соответственно (в t-тесте).
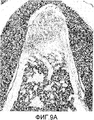
На фигуре 8 посредством гистограммы показана взаимосвязь между дозой, в которой BDNF вводили в собаку с моделью повреждения зоны разделения корней зуба III класса, и регенерацией цемента и альвеолярной кости; вертикальная ось представляет процент регенерации цемента или кости, а горизонтальная ось представляет концентрацию BDNF (мкг/мл); каждая из вертикальных линий на столбцах графиков отражает диапазон среднего ± стандартного отклонения; * и ** означают статистически значимые различия при p<0,05 и p<0,01 соответственно (в t-тесте); (A) отражает взаимосвязь с процентом регенерации цемента, а (B) отражает взаимосвязь с процентом регенерации кости.
На фигуре 9A представлено полученное в примере 2 посредством оптической микроскопии (×20) изображение окрашенного гематоксилин-эозином образца кости с повреждением в зоне разделения корней зуба, заполненным TERUPLUGR в отсутствие BDNF (контроль).
На фигуре 9B представлено полученное в примере 2 посредством микроскопии (×20) изображение заполненного содержащим BDNF (5 мкг/мл) трансплантатом повреждения кости в зоне разделения корней зуба.
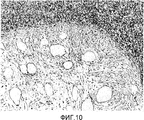
На фигуре 10 представлено частично увеличенное изображение (×200) области непосредственно под зоной разделения корней зуба, представленной на фигуре 9B; в этой области и почти во всех частях поверхности корней зубов, подвергавшейся воздействию, регенерировал цемент с внедренными в него коллагеновыми волокнами и не происходило прорастание эпителия.
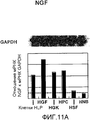
На фигуре 11A посредством радиоактивной полосы и гистограммы показан уровень, на котором экспрессировалась мРНК NGF в клетках HPL; вертикальная ось графика представляет уровень экспрессии мРНК NGF по отношению к уровню экспрессии мРНК GAPDH; на графике HGF обозначает фибробласты десны, HPC - клетки пульпы, HSF - фибробласты кожи человека и HNB - клетки нейробластомы человека.
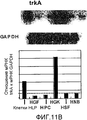
На фигуре 11B посредством радиоактивной полосы и гистограммы показан уровень, на котором экспрессировалась мРНК TrkA в клетках HPL; вертикальная ось графика представляет уровень экспрессии мРНК TrkA по отношению к уровню экспрессии мРНК GAPDH; на графике HGF обозначает фибробласты десны, HPC - клетки пульпы, HSF - фибробласты кожи человека и HNB - клетки нейробластомы человека.
На фигуре 12 посредством гистограммы показано влияние NGF на уровень экспрессии мРНК OPN в клетках HPL; на (A) представлен график, отражающий результаты измерения влияния NGF с течением времени; вертикальная ось графика представляет относительный уровень экспрессии мРНК OPN для каждого времени воздействия NGF, с принятым в качестве единицы уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось графика представляет время воздействия NGF; все клетки обрабатывали NGF с конечной концентрацией 100 нг/мл; на (B) представлен график, отражающий результаты измерения эффекта дозы; вертикальная ось графика представляет относительный уровень экспрессии мРНК OPN при каждой концентрации NGF, с принятым в качестве единицы уровнем экспрессии мРНК при нулевой концентрации; горизонтальная ось графика представляет концентрацию NGF (нг/мл); во всех случаях время воздействия NGF составляло 24 часа.
На фигуре 13 посредством гистограммы показано влияние NGF на уровень экспрессии мРНК ALPазы в клетках HPL; на (A) представлен график, отражающий результаты измерения влияния NGF с течением времени; вертикальная ось графика представляет относительный уровень экспрессии мРНК ALPазы для каждого времени воздействия NGF, с принятым в качестве единицы уровнем экспрессии мРНК ALPазы для нулевого времени воздействия; горизонтальная ось графика представляет время воздействия NGF; на (B) представлен график, отражающий результаты измерения эффекта дозы; вертикальная ось графика представляет относительный уровень экспрессии мРНК ALPазы при каждой концентрации NGF, с принятым в качестве единицы уровнем экспрессии мРНК ALPазы при нулевой концентрации; горизонтальная ось графика представляет концентрацию NGF (нг/мл).
На фигуре 14 посредством гистограммы показано влияние NGF на уровень экспрессии мРНК BMP-2 в клетках HPL; на (A) представлен график, отражающий результаты измерения влияния NGF с течением времени; вертикальная ось графика представляет относительный уровень экспрессии мРНК BMP-2 для каждого времени воздействия NGF, с принятым в качестве единицы уровнем экспрессии мРНК BMP-2 для нулевого времени воздействия; горизонтальная ось графика представляет время воздействия NGF; на (B) представлен график, отражающий результаты измерения эффекта дозы; вертикальная ось графика представляет относительный уровень экспрессии мРНК BMP-2 при каждой концентрации NGF, с принятым в качестве единицы уровнем экспрессии мРНК BMP-2 при нулевой концентрации; горизонтальная ось графика представляет концентрацию NGF (нг/мл).
На фигуре 15 посредством гистограммы показана взаимосвязь между дозой, в которой вводили NGF, и способностью клеток HPL и HGK синтезировать ДНК; NGF в соответствующих концентрациях вводили в клетки HPL и HGK в течение 24 часов; вертикальная ось каждого графика представляет относительную способность синтезировать ДНК при каждой дозе NGF, с принятой в качестве 100 способностью синтезировать ДНК при нулевой концентрации NGF; горизонтальная ось представляет концентрацию NGF (нг/мл); (A) отражает способность синтезировать ДНК в клетках HPL, а (B) отражает способность синтезировать ДНК в HGK.
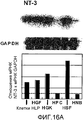
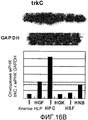
На фигуре 16A посредством радиоактивной полосы и гистограммы показан уровень экспрессии мРНК NT-3 в клетках HPL; вертикальная ось графика представляет относительный уровень экспрессии мРНК NT-3, с принятым в качестве единицы уровнем экспрессии мРНК GAPDH; на графике HGF обозначает фибробласты десны, HPC - клетки пульпы, HSF - фибробласты кожи человека и HNB - клетки нейробластомы человека.
На фигуре 16B посредством радиоактивной полосы и гистограммы показан уровень экспрессии мРНК TrkC в клетках HPL; вертикальная ось графика представляет относительный уровень экспрессии мРНК TrkC, с принятым в качестве единицы уровнем экспрессии мРНК GAPDH; на графике HGF обозначает фибробласты десны, HPC - клетки пульпы, HSF - фибробласты кожи человека и HNB - клетки нейробластомы человека.
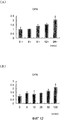
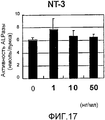
На фигуре 17 представлена гистограмма, отражающая взаимосвязь между дозой, в которой вводили NT-3, и активностью ALPазы в клетках HPL; вертикальная ось графика представляет активность ALPазы (нмоль/лунка), а горизонтальная ось графика представляет концентрацию NT-3 (нг/мл).
На фигуре 18 представлена гистограмма, отражающая взаимосвязь между дозой, в которой вводили NT-3, и способностью синтезировать ДНК в клетках HPL; вертикальная ось графика представляет сравнение, посредством поглощения, способности клеток HPL синтезировать ДНК при различных концентрациях NT-3; а горизонтальная ось графика представляет концентрацию NT-3 (нг/мл).
На фигуре 19A посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NT-4/5 и уровнями, на которых экспрессировались мРНК OPN и OCN в клетках HPL; конечную концентрацию NT-4/5 доводили до 50 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось каждого графика представляет относительный уровень экспрессии мРНК для времени воздействия, с принятым в качестве 100 уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось каждого графика представляет время воздействия NT-4/5; вертикальные линии на столбцах каждого графика отражают диапазон среднего ± стандартного отклонения; в каждом графике * и ** означают p<0,05 и p<0,01, соответственно (статистический анализ посредством t-теста).
На фигуре 19B посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NT-4/5 и уровнями, на которых экспрессировались мРНК BMP-2 и BMP-7 в клетках HPL; конечную концентрацию NT-4/5 доводили до 50 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось каждого графика представляет относительный уровень экспрессии мРНК для каждого времени воздействия, с принятым в качестве 100 уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось каждого графика представляет время воздействия NT-4/5; вертикальные линии на столбцах каждого графика отражают диапазон среднего ± стандартного отклонения; в каждом графике * и ** означают p<0,05 и p<0,01, соответственно (статистический анализ посредством t-теста).
На фигуре 19C посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NT-4/5 и уровнем, на котором экспрессировалась мРНК ALPазы в клетках HPL; также на фигуре посредством электрофореграммы показана взаимосвязь между временем воздействия NT-4/5 и уровнем экспрессии GAPDH; конечную концентрацию NT-4/5 доводили до 50 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет относительный уровень экспрессии мРНК для каждого времени воздействия, с принятым в качестве 100 уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось каждого графика представляет время воздействия NT-4/5; вертикальные линии на столбцах графика отражают диапазон среднего ± стандартного отклонения; * означает p<0,05 (статистический анализ посредством t-теста).
На фигуре 20 представлен набор графиков, отражающих результаты измерения эффекта дозы NGF на экспрессию мРНК для различных белков костной ткани (ALPазы, BMP-2, DSPP, OPN и OCN) в клетках HP; время воздействия NGF составляло 24 часа; вертикальная ось каждого графика представляет относительный уровень экспрессии мРНК при каждой концентрации NGF, с принятым в качестве единицы уровнем экспрессии мРНК при нулевой концентрации; горизонтальная ось представляет концентрацию NGF (нг/мл); вертикальные линии на столбцах каждого графика отражают диапазон среднего ± стандартного отклонения.
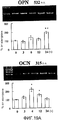
На фигуре 21 представлен набор графиков, отражающих результаты измерения эффекта дозы BDNF на экспрессию мРНК для различных белков костной ткани (ALPазы, BMP-2, DSPP, коллагена I типа, OPN и OCN) в клетках HP; вертикальная ось каждого графика представляет относительный уровень экспрессии мРНК при каждой концентрации BDNF, с принятым в качестве единицы уровнем экспрессии мРНК при нулевой концентрации; горизонтальная ось представляет концентрацию BDNF (нг/мл); вертикальные линии на столбцах каждого графика отражают диапазон среднего ± стандартного отклонения.
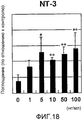
На фигуре 22 представлен набор графиков, отражающих результаты измерения эффекта дозы NT-3 на экспрессию мРНК для различных белков костной ткани (ALPазы, BMP-2, DSPP, OPN и OCN) в клетках HP; вертикальная ось каждого графика представляет относительный уровень экспрессии мРНК при каждой концентрации NT-3, с принятым в качестве единицы уровнем экспрессии мРНК при нулевой концентрации; горизонтальная ось представляет концентрацию NT-3 (нг/мл); вертикальные линии на столбцах каждого графика отражают диапазон среднего ± стандартного отклонения.
На фигуре 23 представлен набор графиков, отражающих результаты измерения эффекта дозы NT-4/5 на экспрессию мРНК для различных белков костной ткани (ALPазы, BMP-2, DSPP, коллагена I типа, OPN и OCN) в клетках HP; вертикальная ось каждого графика представляет относительный уровень экспрессии мРНК при каждой концентрации NT-4/5, с принятым в качестве единицы уровнем экспрессии мРНК при нулевой концентрации; горизонтальная ось представляет концентрацию NT-4/5 (нг/мл); вертикальные линии на столбцах каждого графика отражают диапазон среднего ± стандартного отклонения.
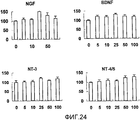
На фигуре 24 представлен набор гистограмм, отражающих взаимосвязь между дозой, в которой вводили различные нейротрофические факторы (NGF, BDNF, NT-3 и NT-4/5), и способностью клеток HP синтезировать ДНК; нейротрофическим факторам в соответствующих концентрациях позволяли воздействовать на клетки HP в течение 24 часов; вертикальная ось каждого графика представляет относительное поглощение при каждой дозе нейротрофического фактора, с принятым в качестве 100 поглощением в отсутствие нейротрофического фактора (т.е. при нулевой концентрации нейротрофического фактора); горизонтальная ось представляет концентрацию каждого нейротрофического фактора (нг/мл); вертикальные линии на столбцах каждого графика отражают диапазон среднего ± стандартного отклонения.
На фигуре 25A посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NGF и уровнем экспрессии мРНК ALPазы в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH в качестве контроля; все клетки HMS обрабатывали NGF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NGF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NGF.
На фигуре 25B посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NGF и уровнем экспрессии мРНК OCN в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NGF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NGF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NGF.
На фигуре 25C посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NGF и уровнем экспрессии мРНК OPN в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NGF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NGF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NGF.
На фигуре 25D посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NGF и уровнем экспрессии мРНК BSP в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NGF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NGF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NGF.
На фигуре 25E посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NGF и уровнем экспрессии мРНК коллагена I типа в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NGF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NGF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NGF.
На фигуре 26A посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК ALPазы в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали BDNF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия BDNF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия BDNF.
На фигуре 26B посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК OCN в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали BDNF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия BDNF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия BDNF.
На фигуре 26C посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК OPN в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали BDNF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия BDNF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия BDNF.
На фигуре 26D посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК BSP в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали BDNF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия BDNF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия BDNF.
На фигуре 26E посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия BDNF и уровнем экспрессии мРНК коллагена I типа в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали BDNF в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия BDNF, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия BDNF.
На фигуре 27A посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NT-3 и уровнем экспрессии мРНК ALPазы в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NT-3 в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NT-3, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NT-3.
На фигуре 27B посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NT-3 и уровнем экспрессии мРНК OCN в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NT-3 в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NT-3, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NT-3.
На фигуре 27C посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NT-3 и уровнем экспрессии мРНК OPN в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NT-3 в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NT-3, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NT-3.
На фигуре 27D посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NT-3 и уровнем экспрессии мРНК BSP в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NT-3 в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NT-3, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NT-3.
На фигуре 27E посредством электрофореграммы и гистограммы показана взаимосвязь между временем воздействия NT-3 и уровнем экспрессии мРНК коллагена I типа в клетках HMS; также на фигуре представлена электрофореграмма, отражающая взаимосвязь с уровнем экспрессии мРНК GAPDH; все клетки HMS обрабатывали NT-3 в конечной концентрации 100 нг/мл; на крайней левой дорожке каждой электрофореграммы показан маркер; вертикальная ось графика представляет выраженный в процентах уровень экспрессии мРНК для каждого времени воздействия NT-3, с принятым в качестве 100% уровнем экспрессии мРНК для нулевого времени воздействия; горизонтальная ось представляет время воздействия NT-3.
На фигуре 28 представлена гистограмма, отражающая влияние аскорбиновой кислоты (Aa), NGF, BDNF и NT-3 на пролиферацию клеток HMS; вертикальная ось графика представляет процент поглощения в каждой тестируемой группе по отношению к контрольной группе; вертикальные линии на столбцах графика отражают диапазон среднего ± стандартного отклонения; * и ** означают p<0,05 и p<0,01 соответственно (статистический анализ посредством t-теста).
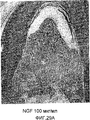
На фигуре 29A представлено полученное в примере 8 посредством оптической микроскопии (×20) изображение повреждения кости в зоне разделения корней зуба, где повреждение заполняли содержащим NGF (100 мкг/мл) трансплантатом.
На фигуре 29B представлено полученное в примере 8 посредством микроскопии (×20) изображение повреждения кости в зоне разделения корней зуба, где повреждение заполняли содержащим NT-3 (100 мкг/мл) трансплантатом.
НАИЛУЧШИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
На следующих страницах описаны более конкретные варианты осуществления настоящего изобретения и способы осуществления изобретения.
Использующийся здесь термин "периодонтальная ткань" обозначает ткань, включающую в себя десну, альвеолярную кость, периодонтальную связку (периодонтальную мембрану) и цемент.
"Десна" обозначает мягкую ткань, покрывающую поверхность шейки корня и часть альвеолярной кости; десна состоит из эпителия десны и собственной пластинки десны.
"Периодонтальная связка" обозначает известную также и в качестве периодонтальной мембраны соединительную ткань, связывающую альвеолярную кость и цемент.
"Альвеолярную кость" подразделяют на альвеолярную кость, в узком значении относящуюся к компактной кости альвеолярной стенки, окружающей корень зуба, и на внешнюю поддерживающую альвеолярную кость, состоящую из губчатой и компактной костей.
"Цемент" представляет собой твердую ткань самого внешнего слоя корня зуба, и его подразделяют на клеточный цемент, содержащий цементоциты, и бесклеточный цемент, не имеющий цементоцитов.
"Пульпа зуба" представляет собой ткань, контролирующую жизненно важные реакции зубов и формирующую дентин по мере реакции на физиологические или патологические стимулы. Пульпа состоит из клеток пульпы, нервных волокон, внеклеточного матрикса, кровеносных сосудов и т.д.
"Регенерация" обозначает воссоздание и воспроизводство погибших тканей, разрушенных тканей и поврежденных тканей; "регенерация периодонтальной ткани" обозначает восстановление периодонтальной ткани до исходного состояния и соответствующего функционирования.
"Восстановление" обозначает заживление поврежденной ткани, как, например, в случае, когда структура и функции поврежденной области еще полностью не восстановились; а "восстановление периодонтальной ткани" включает в себя формирование эпителиального прикрепления к поверхности корня зуба.
"Предотвращение верхушечного прорастания эпителия десны вдоль поверхности корней зубов" обозначает предотвращение роста эпителиальных клеток десны по направлению к верхушке корня вдоль поверхности корня зуба.
"Трансплантат для регенерации периодонтальной ткани" представляет собой вещество, усиливающее регенерацию периодонтальной ткани. Для того чтобы вызвать воздействие таких нейротрофических факторов, как BDNF, в установленной концентрации на данный in vivo участок (например, область альвеолярной кости с недостающим участком), необходим определенный каркас. Для обеспечения трансплантата по настоящему изобретению использующееся в качестве такого каркаса вещество применяют вместе с нейротрофическим фактором, таким как BDNF.
"Периодонтальные заболевания" обозначают затрагивающие периодонтальную ткань воспалительные заболевания, вызываемые локализованными бактериями и тому подобное.
"Восстановленный дентин" обозначает дентин, образованный в результате внешних стимулов.
"Заболевания пульпы" обозначают воспалительные заболевания, регрессивную метаплазию и т.д. пульпы зуба.
Настоящее изобретение может использоваться для лечения теплокровных животных, таких как человек, и особенно предпочтительно для лечения собственно человека.
Применяемые в настоящем изобретении нейротрофические факторы, такие как BDNF, NGF, NT-3 и NT-4/5, могут быть получены искусственно путем рекомбинации генов или химическим синтезом; альтернативно, они могут быть природными белками.
Предпочтительно лекарственное средство для лечения периодонтальных заболеваний по настоящему изобретению применяют местно, в форме лекарственного средства для наружного применения. При желании, лекарственное средство может быть наполнено в шприц или тому подобное и введено путем инъекции в периодонтальный карман. Также можно вводить лекарственное средство в область части периодонтальной ткани, удаленной в ходе периодонтальной операции. В этом случае для обеспечения продолжительного воздействия в установленной концентрации, лекарственное средство по настоящему изобретению также предпочтительно использовать вместе с абсорбирующим веществом, таким как пленка или губка и тому подобное. Предпочтительно лекарственное средство вводят после удаления инфицированной периодонтальной ткани. Также лекарственное средство по настоящему изобретению можно вводить местно в форме инъекции. Например, лекарственное средство можно вводить путем инъекции в десну периодонтального кармана или путем инъекции в полость в периодонтальной мембране рядом с альвеолярным гребнем. Также его можно вводить путем инъекции рядом с верхушкой корня.
Предпочтительно средство, усиливающее морфогенез восстановленного дентина, по настоящему изобретению применяют местно в форме лекарственного средства для наружного применения. Например, средство, усиливающее морфогенез восстановленного дентина, можно применять для вскрытия пульпы в форме жидкости, крема, пасты или в другой форме; альтернативно, его можно применять для удаления коронковой пульпы или полного удаления пульпы. При желании, можно применять тонколистовой материал или губку, пропитанные активным веществом, для получения временной пломбы на определенный период. Альтернативно, в случае пересадки зуба, выпавшего вследствие травмы или по другой причине, усиливающее средство можно наносить на верхушку корня или подобное этому.
Лекарственное средство для лечения периодонтальных заболеваний и средство, усиливающее морфогенез восстановленного дентина, по настоящему изобретению могут находиться в разнообразных лекарственных формах, включающих в себя лекарственные формы для наружного применения, такие как крем, мазь и лосьон, которые получают общепринятыми фармацевтическими способами составления рецептур, используя фармацевтически приемлемые носители или разбавители; также в их составе могут быть растворы для инъекций на основе водных растворителей. Также лекарственное средство и средство, усиливающее морфогенез восстановленного дентина, могут находиться в форме порошка, а непосредственно перед применением эти средства растворяют в солюбилизирующей жидкости, такой как очищенная вода.
Лекарственное средство для лечения периодонтальных заболеваний и средство, усиливающее морфогенез восстановленного дентина, по настоящему изобретению можно вводить в дозах, различающихся в зависимости от возраста индивидуума, его пола, тяжести заболевания и других факторов; как правило, при местном применении доза находится в диапазоне предпочтительно от 1×10-12 г до 1×10-3 г, более предпочтительно от 1×10-11 г до 1×10-7 г, более предпочтительно от 1×10-10 г до 1×10-8 г, вычисленном для нейротрофического фактора на зуб. В целом, дозы для местного введения путем инъекции могут быть меньше, чем дозы, используемые для наружного применения.
Предпочтительно трансплантат по настоящему изобретению содержит от 1×10-12 г до 1×10-3 г, более предпочтительно от 1×10-11 г до 1×10-8 г, более предпочтительно от 1×10-10 г до 1×10-9 г нейротрофических факторов в дозе, которую следует наносить на одно повреждение в зоне разделения корней зуба.
Лекарственное средство для лечения периодонтального заболевания, средство, усиливающее морфогенез восстановленного дентина, и трансплантат по настоящему изобретению можно применять в сочетании с другими лекарственными средствами при условии, что их эффективность не снижается. BDNF, NGF, NT-3 и NT-4/5 можно применять в сочетании друг с другом. Также их можно применять в сочетании с мезенхимальными стволовыми клетками (MSC) костного мозга, клетками периодонтальной связки, фибробластами десны, клетками эндотелия сосудов и т.д. Также их можно сочетать с препаратами гидроксида кальция, противобактериальными средствами и т.д.
Веществом, которое в трансплантате по настоящему изобретению объединяют с нейротрофическим фактором, может быть любое вещество, не вызывающее повреждение живого организма и способное удерживать нейротрофический фактор в участке, в который его ввели; предпочтительные примеры представляют собой пористый пленочный материал и губку. Более предпочтительны биологически деградирующие белковые вещества (коллаген, желатин, альбумин и богатая тромбоцитами плазма (PRP)) и абсорбирующиеся тканью вещества (полигликолевая кислота (PGA), полимолочная кислота (PLA), сополимер молочной и гликолевой кислот (PLGA), гиалуроновая кислота (HA) и трикальцийфосфат (TCP)), поскольку впоследствии нет необходимости в их удалении. Примеры включают в себя TERUPLUGR (торговое название TERUMO CORPORATION), мембрану GC (торговое название GC Co., Ltd.) и Osferion (торговое название OLYMPUS CORPORATION).
ПРИМЕРЫ
Более подробно настоящее изобретение описано посредством нижеприведенных примеров.
(Пример 1)
Исследование воздействия BDNF на клетки периодонтальной связки человека (клетки HPL) и кератиноциты десны человека (HGK).
(1) Используемые клетки
(i) Клетки периодонтальной связки человека (клетки HPL)
Клетки HPL выделяли из периодонтальной связки здорового премоляра человека, который для удобства удаляли в ходе ортодонтического лечения. Для предотвращения попадания клеток из других соединительных тканей вокруг периодонтальной связки отделяли скальпелем здоровую периодонтальную связку посередине корня удаленного премолярного зуба человека, за исключением поверхности шейки корня и верхушки корня, и измельчали. Измельченную ткань переносили на чашку Петри для культивирования клеток, диаметром 60 мм, (CORNING, NY) и культивировали при 37°С в атмосфере с 5% CO2. Культуральная среда представляла собой модифицированную по способу Дульбекко среду Игла (DMEM, NISSUI PHARMACEUTICAL CO., LTD., Tokyo), дополненную 10% FBS (GIBCO, Buffalo, NY), пенициллином (100 ед/мл; MEIJI SEIKA KAISHA, LTD., Tokyo), стрептомицином (100 мкг/мл; MEIJI SEIKA KAISHA, LTD., Tokyo) и амфотерицином В (1 мкг/мл; GIBCO); здесь и далее эта культуральная среда обозначена "средой A". В следующем эксперименте использовали клетки HPL в культуре после 4-8 пассажей.
(ii) Кератиноциты десны человека (HGK)
Десну получали у пациентов после их согласия на основе информации о необходимости выполнять эксперименты, применяя культивируемые клетки человека, и о цели использования десны. Пациенты страдали перикоронитом зубов мудрости, а когда вызывающие заболевание зубы мудрости были удалены, из избыточного лоскута десны получали образцы десны. Для выделения HGK полученные образцы десны в течение 24 часов при 4°C обрабатывали PBS(-) Дульбекко (PBS(-) из NISSUI PHARMACEUTICAL CO., LTD.), дополненным 0,01% этилендиаминтетрауксусной кислотой (EDTA) и 0,025% трипсином. Первичное культивирование проводили на среде MCDB 153 (Sigma), дополненной бычьим инсулином (10 мкг/мл; Sigma, St. Louis, MO, USA), трансферрином человека (5 мкг/мл; Sigma), 2-меркаптоэтанолом (10 мкМ), 2-аминоэтанолом (10 мкМ), селенитом натрия (10 мкМ), экстрактом бычьего гипофиза (50 мкг/мл), пенициллином (100 ед./мл), стрептомицином (100 мкг/мл) и амфотерицином В (50 нг/мл); здесь и далее эту культуральную среду обозначают "средой C". Культивирование проводили в покрытой бычьим коллагеном I типа чашке Петри, диаметром 60 мм, (SUMILON CELTITE C-l из SUMITOMO BAKELIGHT COMPANY LIMITED, Tokyo) при 37°C в газовой фазе 5% CO2. Для последующего эксперимента использовали клетки HGK в культуре после 3-4 пассажей.
(2) Экспрессия BDNF и его рецептора в клетках HPL
Экспрессию мРНК для BDNF и TrkB в клетках HPL и периодонтальной связке человека исследовали посредством PCR с обратной транскрипцией, применяя набор синтеза 1-й цепи кДНК для RT-PCR (Roche, Indianapolis).
Полученные в указанном выше (1)(i) клетки HPL снимали в период времени, когда они достигали определенной степени смыкания монослоя; затем клетки растворяли в ISOGEN (Nippon Gene, Tokyo) и после добавления хлороформа центрифугировали; для выделения тотальной РНК к полученной водной фазе добавляли изопропанол.
Полученную в указанном выше (1) (i) периодонтальную связку человека гомогенизировали в ISOGEN и после добавления хлороформа центрифугировали; для выделения тотальной РНК к полученной водной фазе добавляли изопропанол.
Порции (1 мкг каждая) очищенной тотальной РНК подвергали обратной транскрипции, используя олиго (dT) праймеры; полученную кДНК амплифицировали посредством 30 циклов PCR и проводили электрофорез в 1,5% агарозном геле. В качестве контроля применяли глицеральдегид-3-фосфатдегидрогеназу (GAPDH).
Результаты представлены на фигуре 1. Контроль представлял собой глицеральдегид-3-фосфатдегидрогеназу (GAPDH). Как видно из электрофореграмм, в периодонтальной связке человека экспрессировались мРНК BDNF и TrkB, и было подтверждено, что мРНК BDNF и TrkB также экспрессировались в клетках HPL, культивируемых после выделения из периодонтальной связки человека.
(3) Обработка клеток BDNF
(i) клетки HPL
Полученные в указанном выше (1)(i) клетки HPL культивировали в течение 13 суток при 37°C в газовой фазе 5% CO2, в покрытых бычьим коллагеном I типа чашках Петри, диаметром 60 мм (SUMILON CELTITE C-1), при плотности 3,5×105 клеток на чашку Петри, применяя среду A, дополненную 50 мкг/мл L-аскорбиновой кислотой. Использовавшуюся в этом культивировании культуральную среду обозначают "средой B". Среду меняли один раз каждые двое суток. На 0, 3, 6, 12 и 24 час перед окончанием культивирования на 14 сутки клетки дважды промывали DMEM и заменяли среду на бессывороточную культуральную среду, содержащую BDNF (рекомбинантный BDNF человека, R&D System, Minneapolis, USA) в конечной концентрации 0, 1, 10, 50 или 100 нг/мл (среда представляла собой DMEM, дополненную пенициллином (100 ед./мл), стрептомицином (100 мкг/мл), амфотерицином В (1 мкг/мл; GIBCO) и L-аскорбиновой кислотой (50 мкг/мл)). Эту культуральную среду обозначают "средой D".
(ii) HGK
Полученные в указанном выше (1)(ii) HGK высевали на покрытый бычьим коллагеном I типа 96-луночный планшет (SUMILON CELTITE C-l Plate 96F из SUMITOMO BAKELIGHT COMPANY LIMITED) при плотности 2×103 клеток/лунка и культивировали при 37°C в 5% CO2 газе, используя среду C. Среду меняли один раз каждые двое суток. На 4 или 5 сутки, на стадии клеточной пролиферации, клетки на планшете дважды промывали средой MCDB 153 и заменяли среду на культуральную среду, содержащую BDNF в конечной концентрации 0, 1, 10, 25, 50 или 100 нг/мл (среда имела тот же состав, что и среда C, за исключением того, что она не содержала экстракт бычьего гипофиза). Клетки культивировали в течение 24 часов.
Экспрессия белков костной ткани в клетках HPL
(i) Экспрессия мРНК
Клетки HPL обрабатывали BDNF в конечной концентрации 0, 1, 10, 50 или 100 нг/мл посредством такой же процедуры, какая описана выше в (3)(i), и из обработанных таким образом клеток HPL выделяли, применяя ISOGEN, и очищали тотальную РНК. Экспрессию мРНК для щелочной фосфатазы (ALPазы), белка костного морфогенеза-2 (BMP-2), белка костного морфогенеза-4 (BMP-4), остеопонтина (OPN) и остеопротегерина (OPG) анализировали количественно посредством наблюдения за процессом образования продуктов PCR в реальном времени, применяя ABI PRISM 7700 (Applied Biosystems, Tokyo) (способ PCR в реальном времени). В качестве контроля использовали GAPDH.
Результаты измерения влияния BDNF с течением времени на экспрессию мРНК для соответствующих белков костной ткани представлены на фигурах 2A-2C, 3А и 3B, а результаты измерения эффекта дозы BDNF представлены на фигурах 4A-4C. В каждом графике * и ** означают p<0,05 и p<0,01 соответственно (статистический анализ посредством t-теста).
Как видно из этих фигур, BDNF не влиял на экспрессию мРНК для OPG и BMP-4, но повышал уровень экспрессии мРНК для ALPазы, BMP-2 и OPN, как зависящим от дозы, так и зависящим от времени образом.
(ii) Экспрессия белков
Полученные в указанном выше (1)(i) клетки HPL высевали на покрытый бычьим коллагеном I типа 48-луночный планшет (SUMILON CELTITE C-1 Plate 48F из SUMITOMO BAKELITE COMPANY LIMITED) при плотности 1×104 клеток/лунка и культивировали в течение 13 суток, используя среду B. Среду меняли один раз каждые двое суток. За двадцать четыре часа перед окончанием культивирования на 14 сутки клетки на планшете дважды промывали DMEM и заменяли среду на бессывороточную среду D, содержащую BDNF в конечной концентрации 0, 1, 10, 25, 50 или 100 нг/мл. После окончания культивирования снимали супернатант и посредством ELISA измеряли в супернатанте количество секретированных OPN и BMP-2. Для измерения секретированного OPN применяли набор сэндвич-ELISA (IBL, Gunma), а для измерения секретированного BMP-2 применяли набор сэндвич-ELISA (R&D System).
На фигуре 5 представлены результаты измерения влияния с течением времени и эффекта дозы BDNF на секрецию OPN и BMP-2 в клетках HPL. В каждом графике * и ** означают p<0,05 и p<0,01 соответственно (статистический анализ посредством t-теста). Как видно из фигуры 5, BDNF усиливал секрецию OPN и BMP-2 в клетках HPL.
(5) Пролиферация клеток HPL и HGK
Влияние BDNF на способность клеток HPL и HGK синтезировать ДНК измеряли посредством ELISA, применяя систему пролиферации клеток ELISA, версия 2 (Amersham Pharmacia Biotech).
Полученные в указанном выше (1)(i) клетки HPL высевали на покрытый бычьим коллагеном I типа 96-луночный планшет (SUMILON CELTITE C-1 Plate 96F) при плотности 5×103 клеток/лунка и культивировали в течение 10 суток, используя среду B. Клетки дважды промывали DMEM и культивировали в течение 24 часов на среде B (дополненной 0,3% FBS вместо 10% FBS); затем среду заменяли на среду, полученную добавлением к той же среде BDNF в конечной концентрации 0, 1, 10, 25, 50 или 100 нг/мл; клетки дополнительно культивировали в течение 24 часов. За два часа перед окончанием культивирования (т.е. через 22 часа после добавления BDNF) в каждую лунку добавляли бромдезоксиуридин (BrdU) в концентрации 10 нг/мл таким образом, что он включался в клетки. Культивирование проводили при 37°C в газовой фазе 5% CO2.
Полученные в указанном выше (1)(ii) HGK культивировали и обрабатывали BDNF посредством тех же процедур, как в указанном выше (3)(ii). За два часа перед окончанием культивирования (т.е. через 22 часа после добавления BDNF) в каждую лунку добавляли бромдезоксиуридин (BrdU) в концентрации 10 нг/мл таким образом, что он включался в клетки.
После окончания культивирования клетки HPL и HGK фиксировали, а затем проводили блокирование; на клетки в течение 2 часов при комнатной температуре позволяли воздействовать меченному пероксидазой антителу к BrdU и для измерения поглощения на длине волны 450 нм посредством абсорбциометра (MICRO PLATE READER, TOSOH) добавляли субстрат TMB (3,3',5,5'-тетраметилбензидин). В качестве контроля клетки, на которые в течение 24 часов позволяли воздействовать основному фактору роста фибробластов (bFGF) в конечной концентрации 0, 0,3, 1, 3, 5 и 10 нг/мл, обрабатывали тем же способом, как и для измерения их способности синтезировать ДНК.
Результаты представлены на фигуре 6; на (A) представлена гистограмма, отражающая воздействие на клетки HPL, а на (B) представлена гистограмма, отражающая воздействие на клетки HGK. В каждом графике * и ** означают p<0,05 и p<0,01 соответственно (статистический анализ посредством t-теста).
Как видно из фигуры 6, BDNF усиливал способность клеток HPL синтезировать ДНК, но не влиял на способность HGK синтезировать ДНК.
(6) Синтез коллагена клетками HPL
Полученные в указанном выше (1)(i) клетки HPL высевали на покрытый бычьим коллагеном I типа 48-луночный планшет и культивировали в течение 13 суток, используя среду B. Среду меняли один раз каждые двое суток. На 0, 3, 6, 12 и 24 час перед окончанием культивирования на 14 сутки клетки на планшете дважды промывали DMEM и заменяли среду на бессывороточную среду D, содержащую BDNF в конечной концентрации 0, 1, 10, 25, 50 или 100 нг/мл.
Количество, в котором клетки HPL синтезировали коллаген, измеряли посредством ELISA, применяя набор C-пептида проколлагена I типа (PIP) EIA (TAKARA). Количество синтезированного коллагена в супернатанте культуры клеток HPL определяли измерением поглощения на длине волны 450 нм посредством абсорбциометра (MICRO PLATE READER), применяя специфичное к C-концевому пропептиду проколлагена I типа (PIP) моноклональное антитело (меченное пероксидазой).
Результаты представлены на фигуре 7; (A) отражает результаты измерения эффекта дозы BDNF на синтез коллагена I типа, а (B) отражает результаты измерения влияния с течением времени. Как видно из фигуры 7, BDNF увеличивал количество коллагена I типа, синтезированного клетками HPL.
(Пример 2)
Исследовали воздействие BDNF на собак породы бигль, использовавшихся в качестве модели повреждения зоны разделения корней зуба III класса.
Для получения трансплантатов TERUPLUGR (торговое название TERUMO CORPORATION), диаметром 8 мм × 5 мм, пропитывали 25 мкл каждого из растворов BDNF (в стерильном физиологическом растворе) в концентрациях 5, 25 и 50 мкг/мл.
Семи сукам породы бигль (возраст 12-20 месяцев, масса 10-14 кг), пока они находились под седативным эффектом внутримышечной инъекции DOMITOR (MEIJI SEIKA KAISHA, LTD.), проводили ручным скалером удаление зубного камня и выравнивание поверхности корней зубов. Затем с частотой один раз каждые двое суток полость рта каждого животного очищали и промывали жидкостью для полоскания рта ISOJIN (торговое название MEIJI SEIKA KAISHA, LTD.), содержащей в качестве активного вещества повидон-йод; для достижения у каждого животного клинически здоровой периодонтальной ткани эту практику продолжали в течение месяца.
Собакам породы бигль проводили общее обезболивание внутривенной инъекцией обезболивающего средства, содержащего пентобарбитал, а для десен щечной поверхности нижней челюсти с правой и левой сторон применяли местное инфильтративное обезболивание; между дистальной частью первого премоляра и срединной частью первого моляра рассекали десневую борозду и отделяли десну, образуя слизисто-надкостничный лоскут. Затем для получения повреждений кости в зоне разделения корней зуба III класса (в соответствии с классификацией Lindhe & Nyman) шаровидным буром и полуклинообразным долотом удаляли с правой и левой сторон альвеолярные кости в области зон разделения корней второго, третьего и четвертого премоляров. Размер каждого повреждения кости был таким, что оно распространялось от области под необработанной зоной разделения корней зуба до приблизительно 4 мм по направлению к верхушке корня.
Остаток цемента на подвергавшейся воздействию поверхности корней зубов удаляли ручным скалером и для вымывания продуктов разрушения внутреннюю поверхность каждого повреждения кости в зоне разделения корней зуба тщательно промывали физиологическим раствором с последующим заполнением трансплантатом TERUPLUGR диаметром 8 мм × 5 мм на участок. Для получения контроля такое же повреждение кости заполняли трансплантатом TERUPLUGR диаметром 8 мм × 5 мм, не содержавшим BDNF, а пропитанным только 25 мкл стерильного физиологического раствора.
Через шесть недель после операции в условиях общего обезболивания посредством внутривенной инъекции содержащего пентобарбитал обезболивающего средства животным систематически проводили перфузию 4% параформальдегидом. После перфузии препарировали нижнюю челюсть каждого животного и целиком удаляли обработанные зубы и периодонтальную ткань. Полученный образец фиксировали 4% параформальдегидом, декальцифицировали посредством 10% EDTA с последующей дегидратацией набором спиртов повышающейся концентрации и заливали парафином в соответствии с обычной практикой. Из этого образца получали серийные срезы (приблизительно 5 мкм толщиной) в срединно-дистальной плоскости через щечно-язычное протяжение зуба и окрашивали их гематоксилином и эозином (H&E).
Среди полученных таким образом образцов ткани выбирали образцы, которые срезали в срединно-дистальной плоскости через щечно-язычное протяжение зуба и которые срезали рядом с серединой корня, и проводили исследование и измерение ткани, применяя оптический микроскоп (ECLIPSE E600, NIKON). Процент регенерации кости выражали как отношение (в процентах) площади регенерировавшей альвеолярной кости к площади подвергавшегося воздействию повреждения в зоне разделения корней зуба. Процент регенерации цемента выражали как отношение (в процентах) длины регенерировавшего цемента к длине подвергавшейся воздействию поверхности корня зуба.
Результаты представлены на фигурах 8, 9A, 9B и 10. Фигура 8 (A) отражает результаты измерения влияния BDNF на регенерацию цемента; фигура 8 (B) отражает результаты измерения влияния BDNF на регенерацию альвеолярной кости. На фигуре 9A представлен окрашенный гематоксилин-эозином образец повреждения кости в зоне разделения корней зуба, который не обрабатывали BDNF (контроль), а на фигуре 9B представлено полученное оптической микроскопией изображение (×20) повреждения кости в зоне разделения корней зуба, которое обрабатывали BDNF (заполняли трансплантатом, содержащим BDNF (5 мкг/мл)). На фигуре 10 представлено частично увеличенное изображение (×200) области непосредственно под зоной разделения корней зуба, представленной на фигуре 9B.
Как видно из фигуры 8, в случае обработки BDNF в модели повреждения зоны разделения корней зуба III класса на собаке наблюдали заметную регенерацию цемента и альвеолярной кости.
В представленном на фигуре 9A контрольном образце наблюдали некоторый уровень регенерации цемента, альвеолярной кости и периодонтальной связки, но она распространялась только от нижней части повреждения кости до приблизительно половины расстояния по направлению к коронке. В поврежденной области непосредственно под зоной разделения корней зуба заметной регенерации цемента и альвеолярной кости не было, но в этом месте наблюдали прорастание эпителия; эта область была практически заполнена соединительной тканью, в основном состоящей из фибробластов, коллагеновых волокон и кровеносных сосудов.
В представленном на фигурах 9B и 10 образце повреждения кости в зоне разделения корней зуба, которое обрабатывали BDNF, цемент регенерировал практически во всех частях подвергавшейся воздействию поверхности корня зуба, а заметного прорастания эпителия не наблюдали. Кроме того, между регенерировавшим цементом и регенерировавшей альвеолярной костью наблюдали сохраняющую определенную ширину периодонтальную связку.
(Пример 3)
Исследовали воздействие NGF на клетки HPL и HGK
(1) Экспрессия NGF и его рецептора в клетках HPL
Тотальную РНК из клеток HPL выделяли и очищали посредством таких же процедур, как описанные выше в примере 1(2). Экспрессию мРНК для NGF и TrkA измеряли посредством нозерн-блоттинга, использовав в качестве образца полученную тотальную РНК. В качестве контроля использовали GAPDH.
Результаты представлены на фигурах 11A и 11B. Фигура 11A отражает экспрессию мРНК для NGF, а фигура 11B отражает экспрессию мРНК для TrkA. Как видно из фигур, было подтверждено, что мРНК NGF и мРНК TrkA экспрессировались в клетках HPL.
(2) Экспрессия белков костной ткани в клетках HPL
Исследовали воздействие NGF на экспрессию мРНК для белков костной ткани в клетках HPL.
Клетки HPL обрабатывали посредством таких же процедур, как в примере 1(4)(i), за исключением замены BDNF на NGF (рекомбинантный NGF человека, R&D System, Minneapolis, USA) в конечных концентрациях 0, 5, 10, 25, 50 и 100 нг/мл. Уровни, на которых обработанные NGF клетки HPL экспрессировали мРНК для ALPазы, BMP-2 и OPN, измеряли тем же способом, как в примере 1(4)(i).
На фигурах 12, 13 и 14 представлены результаты измерения влияния с течением времени и эффекта дозы NGF на экспрессию мРНК для OPN, ALPазы и BMP-2 соответственно. В каждом графике * и ** означают p<0,05 и p<0,01 соответственно. Проверку выполняли, применяя t-тест.
Как видно из фигур 12, 13 и 14, NGF повышал экспрессию мРНК для ALPазы, BMP-2 и OPN как зависящим от дозы, так и зависящим от времени образом.
(3) Пролиферация клеток HPL и HGK
Измеряли влияние NGF на способность клеток HPL и HGK синтезировать ДНК.
Клетки HPL и HGK обрабатывали тем же способом, как в примере 1(5), за исключением замены BDNF на NGF в конечных концентрациях 0, 5, 10, 25, 50 и 100 нг/мл. Способность обработанных NGF клеток HPL и HGK синтезировать ДНК измеряли тем же способом, как в примере 1(5).
Результаты представлены на фигуре 15. Во всех случаях время воздействия NGF составляло 24 часа. (A) отражает влияние на клетки HPL, а (B) отражает влияние на HGK. В каждом графике * и ** означают p<0,05 и p<0,01 соответственно. Проверку выполняли, применяя t-тест.
Как видно из фигуры 15, NGF повышал способность клеток HPL синтезировать ДНК, но снижал способность HGK синтезировать ДНК.
(Пример 4)
Исследовали воздействие NT-3 на клетки HPL и HGK.
(1) Экспрессия NT-3 и его рецептора в клетках HPL
Тотальную РНК из клеток HPL выделяли и очищали посредством таких же процедур, как описанные выше в примере 1(2). Экспрессию мРНК для NT-3 и TrkC измеряли посредством нозерн-блоттинга, использовав в качестве образца полученную тотальную РНК. В качестве контроля использовали GAPDH.
Результаты представлены на фигурах 16A и 16B. Фигура 16A отражает экспрессию мРНК для NT-3, а фигура 16B отражает экспрессию мРНК для TrkC. Как видно из фигур, было подтверждено, что мРНК NT-3 и мРНК TrkC экспрессировались в клетках HPL.
(2) Экспрессия белков костной ткани в клетках HPL
Исследовали влияние NT-3 на активность ALPазы в клетках HPL.
Клетки HPL обрабатывали посредством такой же процедуры, как в примере 1(3)(i), за исключением замены BDNF на NT-3 (рекомбинантный NT-3 человека, R&D System, Minneapolis, USA) в конечных концентрациях 0, 1, 10 и 50 нг/мл, и проводили количественный анализ активности их ALPазы в соответствии со способом Бессея-Лаури. Указывая более конкретно, для получения образца обработанные NT-3 клетки HPL трижды промывали фосфатным буфером и после добавления 10 мМ буфера Tris-HCl клетки в условиях охлаждения льдом подвергали воздействию ультразвука. Активность ALPазы в образце измеряли с помощью набора для измерения ALPазы (Wako Pure Chemical Industries, Ltd.), используя в качестве субстрата п-нитрофенилфосфат.
На фигуре 17 представлены результаты измерения эффекта дозы NT-3 на активность ALPазы. Во всех случаях время воздействия NT-3 составляло 24 часа. Как видно из фигуры, NT-3 не оказывал значительного влияния на активность ALPазы.
(3) Пролиферация клеток HPL
Выделенные тем же способом, как в примере 1(1), клетки HPL обрабатывали таким же способом, как в примере 1(5), за исключением замены BDNF на NT-3 в конечных концентрациях 0, 1, 5, 10, 50 и 100 нг/мл. Их способность синтезировать ДНК измеряли тем же способом, как в примере 1(5).
Результаты представлены на фигуре 18. Во всех случаях время воздействия NT-3 составляло 24 часа. В графике * и ** означают p<0,05 и p<0,01 соответственно. Проверку выполняли, применяя t-тест. Как видно из фигуры, NT-3 повышал способность клеток HPL синтезировать ДНК.
(Пример 5)
Исследовали экспрессию мРНК для белков костной ткани в клетках периодонтальной связки человека (клетки HPL) при воздействии NT-4/5.
(1) Обработка клеток HPL NT-4/5
Полученные в указанном выше примере 1(1)(i) клетки HPL в течение 13 суток культивировали в газовой фазе 5% CO2 при 37°C в покрытых бычьим коллагеном I типа чашках Петри, диаметром 60 мм (SUMILON CELTITE C-1), при плотности 3,5×105 клеток на чашку Петри, используя среду B (50 мкг/мл). Среду меняли один раз каждые двое суток. На 0, 3, 6, 12 и 24 час перед окончанием культивирования на 14 сутки клетки дважды промывали DMEM и заменяли среду на среду D, содержащую NT-4/5 (R&D) в конечной концентрации 50 нг/мл.
(2) Экспрессия мРНК в клетках HPL
Клетки HPL обрабатывали NT-4/5 в конечной концентрации 50 нг/мл посредством такой же процедуры, как описанная выше в (3)(i), и из обработанных таким образом клеток HPL выделяли, применяя ISOGEN, и очищали тотальную РНК. Экспрессию мРНК для ALPазы, BMP-2, OPN, остеокальцина (OCN), BMP-7, BMP-4 и OPG анализировали количественно посредством наблюдения за процессом образования продуктов PCR в реальном времени, применяя ABI PRISM 7700 (Applied Biosystems, Tokyo) (способ PCR в реальном времени). В качестве контроля использовали GAPDH.
Результаты измерения влияния NT-4/5 с течением времени на экспрессию мРНК для соответствующих белков костной ткани представлены на фигурах 19A, 19B и 19C. В каждом графике * и ** означают p<0,05 и p<0,01 соответственно (статистический анализ посредством t-теста). Как видно из этих фигур, NT-4/5 усиливал экспрессию мРНК для OPN, BMP-2, ALPазы, OCN и BMP-7 в клетках HPL, но не влиял на экспрессию мРНК для BMP-4 и OPG (данные не представлены).
(Пример 6)
Исследовали воздействие NGF, BDNF, NT-3 и NT-4/5 на клетки пульпы человека (клетки HP).
(1) Используемые клетки
Измельчали здоровую пульпу зуба, для удобства полученную в ходе удаления пульпы зуба. Измельченную ткань переносили на чашку Петри для культивирования клеток, диаметром 60 мм (CORNING, NY), и культивировали на среде A при 37°С в газовой фазе 5% CO2. Для последующего эксперимента использовали клетки HP в культуре после 4-8 пассажей.
(2) Обработка клеток NGF, BDNF, NT-3 и NT-4/5
К среде D добавляли NGF, BDNF, NT-3 или NT-4/5 в конечных концентрациях 0, 5, 10, 25, 50 и 100 нг/мл для получения культуральных сред, содержащих эти нейротрофические факторы в указанных концентрациях. Полученные в указанном выше (1) клетки HP в течение 13 суток культивировали в газовой фазе 5% CO2 при 37°C в покрытых бычьим коллагеном I типа чашках Петри, диаметром 60 мм (SUMILON CELTITE C-1), при плотности 3,5×105 клеток на чашку Петри, используя среду B. Среду меняли один раз каждые двое суток. За 24 часа перед окончанием культивирования на 14 сутки клетки дважды промывали DMEM и заменяли среду на одну из содержащих нейротрофические факторы культуральных сред.
(3) Экспрессия мРНК в клетках HP
Из указанных выше в (1) клеток HP, в течение 24 часов обрабатывавшихся NGF, BDNF, NT-3 или NT-4/5 в указанных концентрациях, выделяли, применяя ISOGEN, и очищали тотальную РНК. Экспрессию мРНК для ALPазы, BMP-2, сиалофосфопротеина дентина (DSPP), коллагена I типа, OPN и OCN анализировали количественно посредством наблюдения за процессом образования продуктов PCR в реальном времени, применяя ABI PRISM 7700 (Applied Biosystems, Tokyo) (способ PCR в реальном времени). В качестве контроля использовали GAPDH.
Результаты измерения эффекта дозы NGF, BDNF, NT-3 и NT-4/5 на экспрессию мРНК для соответствующих белков костной ткани представлены на фигурах 20, 21, 22 и 23 соответственно. Как видно из этих фигур, NGF, BDNF, NT-3 и NT-4/5 повышали экспрессию мРНК для ALPазы, BMP-2, DSPP, OPN и OCN в клетках HP. Также BDNF и NT-4/5 повышали экспрессию мРНК для коллагена I типа.
(4) Пролиферация клеток HP
Влияние NGF, BDNF, NT-3 и NT-4/5 на способность клеток HP синтезировать ДНК измеряли посредством ELISA, применяя систему пролиферации клеток ELISA, версия 2 (Amersham Pharmacia Biotech).
К среде B, дополненной 0,3% FBS вместо 10% FBS, добавляли каждый из NGF, BDNF, NT-3 и NT-4/5 в конечных концентрациях 0, 5, 10, 25, 50 и 100 нг/мл для получения культуральных сред, содержащих эти нейротрофические факторы.
Полученные в указанном выше (1) клетки HP высевали на покрытый бычьим коллагеном I типа 96-луночный планшет (SUMILON CELTITE C-1 Plate 96F) при плотности 5×103 клеток/лунка и культивировали в течение 10 суток, используя среду B. Клетки дважды промывали DMEM и культивировали в течение 24 часов на среде B, за исключением того, что ее дополняли 0,3% FBS вместо 10% FBS; затем среду заменяли на одну из культуральных сред, содержащих указанные выше нейротрофические факторы, и дополнительно продолжали культивирование в течение 24 часов. За два часа перед окончанием культивирования (т.е. через 22 часа после добавления нейротрофических факторов) в каждую лунку добавляли бромдезоксиуридин (BrdU) в концентрации 10 нг/мл таким образом, что он включался в клетки. Культивирование проводили при 37°C в газовой фазе 5% CO2.
После окончания культивирования клетки HP фиксировали, а затем проводили блокирование; на клетки в течение 2 часов при комнатной температуре позволяли воздействовать меченному пероксидазой антителу к BrdU и для измерения поглощения на длине волны 450 нм посредством абсорбциометра (MICRO PLATE READER, TOSOH) добавляли субстрат TMB (3,3',5,5'-тетраметилбензидин).
Результаты представлены на фигуре 24, из которой видно, что NGF, BDNF, NT-3 и NT-4/5 повышали способность клеток HP синтезировать ДНК.
(Пример 7)
Исследовали воздействие NGF, BDNF, NT-3 и аскорбиновой кислоты на мезенхимальные стволовые клетки человека (клетки HMS).
(1) Используемые клетки
Клетки HMS выделяли в соответствии со способом Tsutsumi et al. (S. Tsutsumi: BBRC, 26, 288(2), 2001). Конкретно, дававшим полное информированное согласие на эксперимент пациентам для аспирации костного мозга проводили пункцию нижней челюсти при удалении зуба мудрости. Костный мозг сразу же смешивали с модифицированной по способу Дульбекко средой Игла (DMEM, Sigma, USA), дополненной гепарин натрием (200 ед./мл, Sigma, USA), и смесь центрифугировали (150 г, 5 мин). После центрифугирования удаляли супернатант и полученный компонент клетки суспендировали в DMEM, содержащей 10% эмбриональную телячью сыворотку (FCS, Biological Industries, Israel), 100 единиц/мл пенициллина (MEIJI SEIKA KAISHA, LTD., Tokyo), 100 мкг/мл стрептомицина (MEIJI SEIKA KAISHA, LTD., Tokyo) и 1 мкг/мл амфотерицина В (GIBCO, USA), и суспензию высевали на чашки Петри для культивирования клеток, диаметром 100 мм (Corning, USA), таким образом, что количество костного мозга составляло 200-500 мкл/чашка, а среды - 10 мл/чашка. Культивирование проводили при 37°C в газовой фазе 5% CO2. В дальнейшем среду меняли каждые четверо суток. Для диспергирования клеток непосредственно перед достижением пролиферирующими клетками определенной степени смыкания монослоя применяли забуференный фосфатом физиологический раствор (PBS, NISSUI PHARMACEUTICAL CO., LTD., Tokyo), содержащий 0,05% трипсин (Difco, USA), 0,02% EDTA (KATAYAMA CHEMICAL INDUSTRIES Co., Ltd., Osaka), 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина. Диспергированные таким образом клетки суспендировали в DMEM, дополненной 20% FCS, 10% диметилсульфоксидом (DMSO, KATAYAMA CHEMICAL INDUSTRIES Co., Ltd., Osaka), 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина; плотность суспендированных клеток составляла 1,0×106 клеток/мл; суспензию распределяли порциями 1 мл по пробиркам для сыворотки (SUMITOMO BAKELITE COMPANY LIMITED, Tokyo), перед хранением в жидком азоте охлаждали в течение 2 часов при -20°C, затем в течение ночи при -80°C.
(2) Экспрессия мРНК для белков костной ткани в клетках HMS
(i) Обработка клеток NGF, BDNF и NT-3
Полученные в указанном выше (1) клетки HMS суспендировали в 10% FCS, содержащей DMEM (дополненную 100 единиц/мл пенициллина (MEIJI SEIKA KAISHA, LTD., Tokyo), 100 мкг/мл стрептомицина (MEIJI SEIKA KAISHA, LTD., Tokyo) и 1 мкг/мл амфотерицина В (GIBCO, USA)), и суспензию высевали на 6-луночный планшет для культивирования клеток при плотности 1,0×105 клеток/лунка. Клетки культивировали в течение недели и непосредственно перед достижением ими определенной степени смыкания монослоя среду заменяли на не содержащую FCS DMEM (дополненную 100 единиц/мл пенициллина (MEIJI SEIKA KAISHA, LTD., Tokyo), 100 мкг/мл стрептомицина (MEIJI SEIKA KAISHA, LTD., Tokyo) и 1 мкг/мл амфотерицина В (GIBCO, USA)) и позволяли воздействовать одному из NGF, BDNF и NT-3 в концентрации 100 нг/мл в течение 12 или 24 часов. После окончания культивирования выделяли тотальную РНК, применяя ISOGEN (торговое название).
(ii) Экспрессия мРНК
Проводили PCR, используя специфичные к ALPазе, OCN, OPN, костному сиалопротеину (BSP) и коллагену I типа праймеры. PCR включала в себя денатурацию в течение 2 минут при 94°C, 30 циклов 94°C × 15 секунд, отжига в течение 30 секунд и 72°C × 50 секунд (но 35 циклов в случае BSP), с последующим удлинением в течение 7 минут при 72°C. Полученные продукты PCR подвергали электрофорезу в 2% агарозном геле, содержащем 0,002% бромид этидия. Плотность полос после электрофореза измеряли, применяя программное обеспечение NIH image.
Результаты представлены на фигурах 25A-25E, 26A-26E и 27A-27E. Как видно из фигур, NGF не оказывал заметного влияния на экспрессию в клетках HMS мРНК для любого из ALPазы, OCN, OPN, BSP и коллагена I типа. BDNF значительно усиливал экспрессию мРНК для ALPазы, OPN, BSP и BMP-2, усиливая в то же время в некоторой степени экспрессию гена OCN. NT-3 усиливал экспрессию мРНК для ALPазы и коллагена I типа.
(3) Влияние аскорбиновой кислоты, NGF, BDNF и NT-3 на пролиферацию клеток HMS
Полученные в указанном выше (1) клетки HMS суспендировали в содержащей 10% FCS DMEM (продукт NISSUI PHARMACEUTICAL CO., LTD.; дополненной 100 единиц/мл пенициллина (MEIJI SEIKA KAISHA, LTD., Tokyo), 100 мкг/мл стрептомицина (MEIJI SEIKA KAISHA, LTD., Tokyo) и 1 мкг/мл амфотерицина В (GIBCO, USA)) и суспензию высевали на 96-луночный планшет для культивирования клеток (Corning, USA) при плотности 5,0×103 клеток/лунка. В тестируемых группах через 24 часа после начала культивирования к культуральной среде добавляли отдельно 50 мкг/мл аскорбиновой кислоты (Sigma, USA) или 100 нг/мл NGF (FUNAKOSHI, Tokyo), или 100 нг/мл BDNF (FUNAKOSHI, Tokyo), или 100 нг/мл NT-3 (FUNAKOSHI, Tokyo) и продолжали культивирование в течение еще 7 дней. Замену среды проводили на 4 сутки. Контрольную группу культивировали на содержащей 10% FCS DMEM (продукт NISSUI PHARMACEUTICAL CO., LTD.; дополненной 100 единиц/мл пенициллина (MEIJI SEIKA KAISHA, LTD., Tokyo), 100 мкг/мл стрептомицина (MEIJI SEIKA KAISHA, LTD., Tokyo) и 1 мкг/мл амфотерицина B (GIBCO, USA)). Через 7 суток культивирования среды полностью заменяли на содержащую 10% FCS DMEM (дополненную 100 единиц/мл пенициллина (MEIJI SEIKA KAISHA, LTD., Tokyo), 100 мкг/мл стрептомицина (MEIJI SEIKA KAISHA, LTD., Tokyo) и 1 мкг/мл амфотерицина В (GIBCO, USA)) и подсчитывали число жизнеспособных клеток измерением поглощения на длине волны 490 нм, применяя CellTiter 96 (торговое название) набор AQueous One Solution для анализа пролиферации клеток (Promega, USA).
Результаты представлены на фигуре 28. Вертикальная ось графика представляет процент поглощения в тестируемых группах по сравнению с контрольной группой. В графике * и ** означают p<0,05 и p<0,01 соответственно (статистический анализ посредством t-теста). Как видно из фигуры, клетки HMS, культивируемые на среде, дополненной одним из аскорбиновой кислоты, NGF, BDNF и NT-3, проявляли значительно более высокую тенденцию к пролиферации по сравнению с контролем. В частности, усиливающее пролиферацию воздействие аскорбиновой кислоты, BDNF и NT-3 было сильнее, чем таковое NGF.
(Пример 8)
Исследовали воздействие NGF и NT-3 на модели повреждения зоны разделения корней зуба III класса на собаках породы бигль.
Эксперименты проводили, как в примере 2, за исключением того, что в качестве трансплантатов использовали TERUPLUGR, диаметром 8 мм × 5 мм, пропитанный 25 мкл раствора NGF (в стерильном физиологическом растворе) в концентрации 100 мкг/мл вместо растворов BDNF (в стерильном физиологическом растворе) в концентрациях 5, 25 и 50 мкг/мл, а также TERUPLUGR такого же размера, пропитанный 25 мкл раствора NT-3 (в стерильном физиологическом растворе) в концентрации 100 мкг/мл. Среди полученных (и окрашенных гематоксилин-эозином) образцов ткани выбирали и исследовали под оптическим микроскопом (ECLIPSE E600, NIKON) образцы, которые срезали в срединно-дистальной плоскости через щечно-язычное протяжение зуба и которые срезали рядом с серединой корня.
На фигуре 29A представлено полученное оптической микроскопией изображение заполненного содержащим NGF трансплантатом повреждения кости в зоне разделения корней зуба, а на фигуре 29B представлено полученное оптической микроскопией изображение (×20) заполненного содержащим NT-3 трансплантатом повреждения кости в зоне разделения корней зуба. Как видно из микрофотографий, регенерированную кость на моделях повреждения зоны разделения корней зуба на собаках наблюдали в ответ на введение NGF или NT-3.
ПРОИЗВОДСТВЕННАЯ ОБЛАСТЬ ПРИМЕНЕНИЯ
Средство для лечения периодонтальных заболеваний, средство, усиливающее морфогенез восстановленного дентина, способ лечения, трансплантат для регенерации периодонтальной ткани и способ регенерации периодонтальной ткани по настоящему изобретению потенциально способны стать эффективными в лечении периодонтальных заболеваний и эндодонтической терапии.
Claims (23)
1. Лекарственное средство для регенерации периодонтальной ткани, содержащее в качестве активного вещества нейротрофический фактор, где нейротрофический фактор выбран из группы, состоящей из мозгового нейротрофического фактора, фактора роста нервов, нейротрофина-3 или нейротрофина-4/5.
2. Лекарственное средство по п.1, регенерирующее цемент.
3. Лекарственное средство по п.1, регенерирующее периодонтальную связку.
4. Лекарственное средство по п.1, регенерирующее альвеолярную кость.
5. Лекарственное средство по п.1, предотвращающее верхушечное прорастание эпителия десны вдоль поверхности корней зубов.
6. Лекарственное средство по п.1, регенерирующее пульпу зуба.
7. Лекарственное средство по п.1, усиливающее продукцию восстановленного дентина в полости пульпы.
8. Трансплантат для регенерации периодонтальной ткани, содержащий нейротрофический фактор, объединенный с каркасным веществом, где нейротрофический фактор выбран из группы, состоящей из мозгового нейротрофического фактора, фактора роста нервов, нейротрофина-3 или нейротрофина-4/5 и где трансплантат содержит указанный нейротрофический фактор в количестве от 1·10-12 до 1·10-3 г в дозе, которую следует наносить на одно повреждение в зоне разделения корней зубов.
9. Трансплантат по п.8, применяемый для регенерации цемента.
10. Трансплантат по п.8, применяемый для регенерации периодонтальной связки.
11. Трансплантат по п.8, применяемый для регенерации альвеолярной кости.
12. Трансплантат по п.8, применяемый для предотвращения верхушечного прорастания эпителия десны вдоль поверхности корней зубов.
13. Трансплантат по п.8, применяемый для регенерации пульпы зуба.
14. Трансплантат по п.8, применяемый для усиления продукции восстановленного дентина в полости пульпы.
15. Способ регенерации периодонтальной ткани, предусматривающий применение нейротрофического фактора, выбранного из группы, состоящей из мозгового нейротрофического фактора, фактора роста нервов, нейротрофина-3 или нейротрофина-4/5.
16. Способ регенерации по п.15, регенерирующий цемент.
17. Способ регенерации по п.15, регенерирующий периодонтальную связку.
18. Способ регенерации по п.15, регенерирующий альвеолярную кость.
19. Способ регенерации по п.15, предотвращающий верхушечное прорастание эпителия десны вдоль поверхности корней зубов.
20. Способ регенерации по п.15, регенерирующий пульпу зуба.
21. Способ регенерации по п.15, усиливающий продукцию восстановленного дентина в полости пульпы.
22. Средство, усиливающее морфогенез восстановленного дентина, которое содержит в качестве активного вещества нейротрофический фактор, где нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5.
23. Способ регенерации периодонтальной ткани, предусматривающий применение терапевтически эффективного количества нейротрофического фактора индивидууму, страдающему или подверженному воздействию заболевания, для усиления морфогенеза восстановленного дентина, где нейротрофический фактор представляет собой мозговой нейротрофический фактор, фактор роста нервов, нейротрофин-3 или нейротрофин-4/5.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003316719 | 2003-09-09 | ||
| JP2003-316719 | 2003-09-09 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2006111465A RU2006111465A (ru) | 2007-10-27 |
| RU2336089C2 true RU2336089C2 (ru) | 2008-10-20 |
Family
ID=34308464
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2006111465/15A RU2336089C2 (ru) | 2003-09-09 | 2004-09-08 | Средство для лечения и способ лечения периодонтальных заболеваний и заболеваний пульпы |
Country Status (8)
| Country | Link |
|---|---|
| US (3) | US8158752B2 (ru) |
| EP (3) | EP2460529B1 (ru) |
| JP (2) | JP4589233B2 (ru) |
| CN (3) | CN102600455B (ru) |
| AU (1) | AU2004271843B2 (ru) |
| RU (1) | RU2336089C2 (ru) |
| TW (1) | TW200513264A (ru) |
| WO (1) | WO2005025605A1 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2523559C2 (ru) * | 2009-01-28 | 2014-07-20 | Орган Текнолоджиз, Инк. | Способ создания зуба |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8113837B2 (en) | 2007-11-26 | 2012-02-14 | Peter John Zegarelli | Oral appliance for delivering a medicament |
| US8470303B2 (en) * | 2010-02-02 | 2013-06-25 | James C. Richards | Automated method and system for introducing molecular iodine into drinking water |
| RU2449760C1 (ru) * | 2011-01-12 | 2012-05-10 | Светлана Минифаритовна Алетдинова | Способ лечения хронических верхушечных периодонтитов |
| US20190247173A1 (en) | 2018-02-13 | 2019-08-15 | Peter John Zegarelli | Methods of making an oral appliance |
| US11273022B2 (en) | 2018-02-13 | 2022-03-15 | Emanate Biomedical, Inc. | Oral appliance in a blockchain system |
| WO2019183201A1 (en) * | 2018-03-20 | 2019-09-26 | University Of Pittsburgh - Of The Commonwealth System Of Higher Education | Regeneration of vital tooth pulp |
| CN112220966A (zh) * | 2020-11-23 | 2021-01-15 | 北京大学口腔医学院 | 一种注射剂、注射剂的制备方法及其在牙髓再生中的应用 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5229500A (en) * | 1989-08-30 | 1993-07-20 | Regeneron Pharmaceuticals, Inc. | Brain derived neurotrophic factor |
| US5372503A (en) * | 1993-04-27 | 1994-12-13 | Dental Marketing Specialists, Inc. | Method for installation of a dental implant |
| CA2187355C (en) * | 1994-04-08 | 2009-10-13 | Richard L. Dunn | An adjunctive polymer system for use with medical device |
| BR9608344A (pt) * | 1995-06-06 | 1999-01-05 | Osteogenics Inc | Formulações de hidroxiapatita biocompatível e usos das mesmas |
-
2004
- 2004-09-08 WO PCT/JP2004/013023 patent/WO2005025605A1/ja active Application Filing
- 2004-09-08 US US10/571,069 patent/US8158752B2/en not_active Expired - Fee Related
- 2004-09-08 JP JP2005513867A patent/JP4589233B2/ja not_active Expired - Fee Related
- 2004-09-08 CN CN201210032750.8A patent/CN102600455B/zh not_active Expired - Fee Related
- 2004-09-08 CN CN201210032026.5A patent/CN102526706B/zh not_active Expired - Fee Related
- 2004-09-08 RU RU2006111465/15A patent/RU2336089C2/ru active
- 2004-09-08 CN CN2004800311946A patent/CN1871024B/zh not_active Expired - Fee Related
- 2004-09-08 EP EP12157314.1A patent/EP2460529B1/en not_active Expired - Lifetime
- 2004-09-08 EP EP12157313.3A patent/EP2460528B1/en not_active Expired - Lifetime
- 2004-09-08 EP EP04787706.3A patent/EP1671641B1/en not_active Expired - Lifetime
- 2004-09-08 AU AU2004271843A patent/AU2004271843B2/en not_active Ceased
- 2004-09-09 TW TW093127310A patent/TW200513264A/zh unknown
-
2010
- 2010-06-24 JP JP2010143538A patent/JP5313209B2/ja not_active Expired - Fee Related
-
2012
- 2012-03-05 US US13/412,503 patent/US8513191B2/en not_active Expired - Lifetime
- 2012-03-16 US US13/422,363 patent/US9089606B2/en not_active Expired - Fee Related
Non-Patent Citations (1)
| Title |
|---|
| Y.Tsuboi et. all. Mitogenic effects of neutrophins on a periodontal ligament cell line. J. Dent. Res. 2001 Mar; 80(3):881-6. Kurihara H et. all. Neurotrophins in cultured cells from periodontal tissues. J. Periodontol. 2003 Jan; 74(1):76-84. Harada F. The involvement of brain-derived neurotrophic factor (BDNF) in the regeneration of periodontal Ruffini endings following transection of the inferior alveolar nerve. Arch. Histol. Cytol. 2003 May; 66(2):183-94. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2523559C2 (ru) * | 2009-01-28 | 2014-07-20 | Орган Текнолоджиз, Инк. | Способ создания зуба |
Also Published As
| Publication number | Publication date |
|---|---|
| US20120214738A1 (en) | 2012-08-23 |
| TW200513264A (en) | 2005-04-16 |
| CN102600455A (zh) | 2012-07-25 |
| EP2460529A1 (en) | 2012-06-06 |
| EP2460528A1 (en) | 2012-06-06 |
| CN102526706A (zh) | 2012-07-04 |
| JPWO2005025605A1 (ja) | 2007-11-08 |
| US8513191B2 (en) | 2013-08-20 |
| RU2006111465A (ru) | 2007-10-27 |
| JP5313209B2 (ja) | 2013-10-09 |
| US20120165255A1 (en) | 2012-06-28 |
| CN102526706B (zh) | 2014-07-30 |
| EP2460528B1 (en) | 2014-03-19 |
| CN102600455B (zh) | 2015-04-15 |
| US9089606B2 (en) | 2015-07-28 |
| EP2460529B1 (en) | 2014-08-20 |
| AU2004271843A1 (en) | 2005-03-24 |
| EP1671641A4 (en) | 2009-08-19 |
| CN1871024B (zh) | 2012-03-28 |
| EP1671641A1 (en) | 2006-06-21 |
| JP2010215661A (ja) | 2010-09-30 |
| CN1871024A (zh) | 2006-11-29 |
| US20070071693A1 (en) | 2007-03-29 |
| WO2005025605A1 (ja) | 2005-03-24 |
| US8158752B2 (en) | 2012-04-17 |
| JP4589233B2 (ja) | 2010-12-01 |
| AU2004271843B2 (en) | 2010-04-08 |
| EP1671641B1 (en) | 2013-11-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8513191B2 (en) | Therapeutic agent and therapeutic method for periodontal diseases and pulpal diseases | |
| Andreasen et al. | Textbook and color atlas of traumatic injuries to the teeth | |
| Wikesjö et al. | Significance of early healing events on periodontal repair: a review | |
| Piemontese et al. | Treatment of periodontal intrabony defects with demineralized freeze‐dried bone allograft in combination with platelet‐rich plasma: A comparative clinical trial | |
| Six et al. | Differential repair responses in the coronal and radicular areas of the exposed rat molar pulp induced by recombinant human bone morphogenetic protein 7 (osteogenic protein 1) | |
| Stavropoulos et al. | Growth and differentiation factors for periodontal regeneration: a review on factors with clinical testing | |
| EP1716864A1 (en) | Neural regeneration using home bone morphogenetic proteins | |
| Eppley et al. | Free bone graft reconstruction of irradiated facial tissue: experimental effects of basic fibroblast growth factor stimulation | |
| KR20070007082A (ko) | 내피 전구체 세포의 자극, 기관 재생, 및 말단 기관 손상의진행 완화를 위한 저용량 에리스로포이에틴의 용도 | |
| EP1736173B1 (en) | Damaged tissue therapeutic agent and therapeutic method | |
| EP1952821B1 (en) | Therapeutic agent for dentin-dental pulp complex regeneration | |
| Chuang et al. | Effect of sodium lauryl sulfate (SLS) on primary human gingival fibroblasts in an in vitro wound healing model | |
| JP7212144B2 (ja) | 非細胞性根管充填材および非細胞性歯組織再生促進キット | |
| Hsu et al. | Differential effects of parathyroid hormone, parathyroid hormone-related protein, and abaloparatide on collagen 1 expression by mouse cementoblasts and mouse tooth root density | |
| JPH10139684A (ja) | 歯周組織再生促進薬および促進用歯科材料 | |
| AU2003200309B2 (en) | Pharmaceutical Composition for Preventing or Treating Ischaemic Diseases | |
| Alharbi et al. | Unlocking the Potential of Cellular Guidance in Endodontics: Advancing the Process of Pulp Regeneration and Beyond | |
| Aminah | The influence of anisotropic tissue expander on nestin and TrKB expression in rat Cranio-Facial region/Aminah Jalil | |
| Jalil | The Influence of Anisotropic Tissue Expander on Nestin and Trkb Expression in Rat Cranio-facial Region. | |
| Graul | Becaplermin | |
| Trombelli et al. | Effect of Topical Application of a Fibrin-Fibronectin Sealing System on Healing Response Following Periodontal Surgical Procedures |